Атеросклероз: народные методы лечения | МРТ Эксперт
Атеросклероз — что это такое?
Атеросклероз – одно из опасных распространённых заболеваний, поражающих сосуды нашего организма. Из-за образующихся на стенках сосудов бляшек затрудняется кровоток, что может привести к нарушению кровообращения в жизненно важных органах. А это, в свою очередь, грозит инфарктом миокарда, инсультом, перемежающейся хромотой и т.д.
Читайте материалы по теме:
Как предотвратить инфаркт миокарда?
Как предотвратить мозговую катастрофу?
Облитерирующий атеросклероз. Как лечить?
Кто в группе риска и каковы факторы, способствующие развитию атеросклероза?
В группе риска оказываются люди старше 45 лет, в особенности, мужчины. Неправильный образ жизни, диета с преобладанием жирных продуктов, богатых холестерином, курение, стресс, гиподинамия – основные факторы, вызывающие атеросклероз.
Подробнее о холестерине можно узнать из наших статей:
Как отличить хороший и плохой холестерин?
Анализ крови на холестерин: часто задаваемые вопросы
Народная медицина против атеросклероза: поможет ли?
Лечение народным методом привлекает многих, кто хочет избавиться от атеросклеротических бляшек. Ведь гораздо проще попринимать какую-либо чудодейственную настойку, чем изменить свой образ жизни и диету.
Среди наиболее популярных народных методов лечения атеросклероза сосудов – чесночные настойки, приём оливкового масла, смеси мёда, растительного масла и лимонного сока, крапивные ванны, настойка цветов пижмы или боярышника, вдыхание эфирных масел можжевельника, мяты, лаванды, тмина.
Правильно составленные фитосборы могут помочь только на начальном этапе заболевания, но их стоит использовать только по назначению врача. Более приятный «способ», якобы пришедший к нам от французских учёных – приём смесей на основе сухого красного вина, которое защищает организм от многих сердечно-сосудистых заболеваний.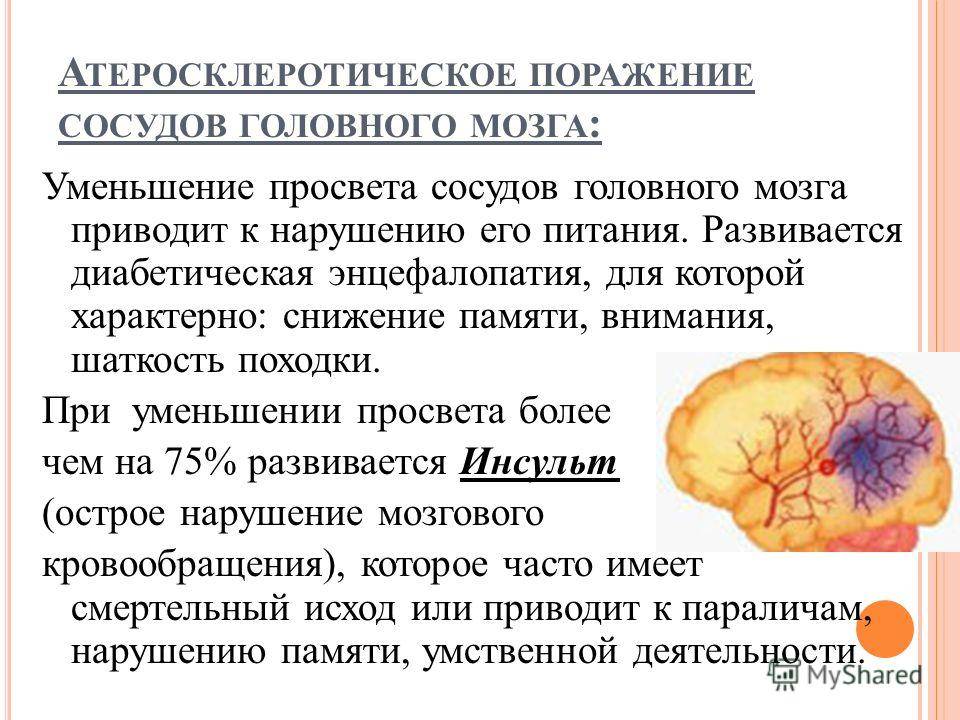
На самом деле, не существует доказательств эффективности каких-либо народных методов лечения атеросклероза. Иначе бы врачи давно взяли их на вооружение и спасли немало пациентов. Лечение этого заболевания надо начинать как можно раньше. Для этого необходимо проходить соответствующую диагностику, что позволит специалисту сделать правильное назначение.
Некоторые методы инструментальной диагностики атеросклероза
Методы исследования могут включать в себя осмотр специалиста, анализы крови, УЗИ сосудов шеи, нижних конечностей, МРТ сосудов и т.д. Атеросклероз сосудов головного мозга на МРТ определяется с достаточно высокой точностью. Поэтому этот метод используется не только для подтверждения или постановки диагноза, но и для контроля эффективности лечения после проведённых операций по восстановлению закупоренных сосудов. Специалисты рекомендуют проходить МРТ сосудов, в том числе и с профилактической целью, 1-2 раза в год.
Материал по теме:
Магнитно-резонансная томография как метод выбора в диагностике сосудов шеи
Записаться на УЗИ сосудов можно здесь
Записаться на МРТ сосудов можно здесь
ВНИМАНИЕ: услуги доступны не во всех городах
Редакция рекомендует:
Чем поможет пациенту МРТ сосудов головного мозга?
Когда назначается УЗИ сосудов головного мозга?
Берегите сосуды! Как не пропустить сосудистые заболевания головного мозга?
Правила здорового питания. Что нужно есть, чтобы здороветь?
Особенности лечения атеросклероза сосудов головного мозга народными средствами | Нервы в порядке
Возможно ли лечение атеросклероза сосудов головного мозга народными средствами? Ведь это опасное заболевание относится к разряду хронических и считается довольно сложным для терапии даже методами официальной медицины. Медики утверждают, что отказываться от способов терапии, основанных на накопленной народными целителями знаниях, не стоит. Способы лечения народными средствами описаны в этой статье.
Медики утверждают, что отказываться от способов терапии, основанных на накопленной народными целителями знаниях, не стоит. Способы лечения народными средствами описаны в этой статье.
Симптомы
Атеросклероз — заболевание, при котором на внутренних стенках сосудов образуются отложения в виде кальцинатов и холестерина. Со временем сосуды сужаются все сильнее, теряют эластичность, а приток крови к тканям и органам снижается.
Симптомы атеросклероза сосудов головного мозга, следующие:
когнитивные нарушения. Человек с трудом может вспомнить события, которые произошли сравнительно недавно, однако, кратковременная память работает удовлетворительно;
головные боли. На ранних стадиях голова болит редко, однако, по мере прогресса заболевания боли усиливаются;
повышенная утомляемость. К усталости приводят даже незначительные нагрузки;
шумы в ушах. Шум возникает только на фоне переутомления, однако, позже проявляется беспричинно;
регулярные приступы головокружения;
На поздних стадиях болезни развиваются более серьезные неврологические нарушения, например, шаткость походки, неспособность четко координировать движения и т. д. Обычно заболевание начинается в раннем возрасте никак не давая о себе знать.
Ранняя диагностика атеросклероза очень важна: заболевание чревато развитием инсульта.
Если заболевание не затронуло крупные сосуды и не привело к необратимым изменениям, можно попробовать воспользоваться народными методами лечения. Важно при атеросклерозе сосудов головного мозга обсудить симптомы и лечение с врачом, иначе вы рискуете причинить своему организму вред.
Диета
Главное, при лечении атеросклероза народными средствами или медикаментами — это изменение образа жизни. Ведь сосуды сужаются из-за избыточного употребления жирной пищи, содержащей холестерин. Поэтому даже самые эффективные народные средства от атеросклероза сосудов головного мозга не дадут результата, если не справиться с первопричиной заболевания.
Особенно актуально отказаться от животных жиров, которые нужно полностью заменить растительными маслами. Для внутреннего очищения организма рекомендовано употребление пищи, богатой клетчаткой и грубыми волокнами. Сдобный хлеб необходимо заменить на хлеб из пшеницы грубого помола. Важно употреблять как можно больше свежих овощей и фруктов. Жареной пищи при атеросклерозе нужно есть поменьше, отдавая предпочтение тушеным и вареным блюдам, а также кушаньям, приготовленным на пару.
Предполагается дробное питание: есть нужно маленькими порциями пять или шесть раз в сутки. В противном случае жиры не будут усваиваться в полном объеме и начнут откладываться в просвете сосудов в виде липидных бляшек.
Под запретом!Существует группа продуктов, которые называются «расщепителями» холестерина. К ним относятся нежирная рыба, гречка, яблоки, кисломолочные продукты и зелень. При диагностированном атеросклерозе сосудов головного мозга важно не просто время от времени садиться на диету, а полностью изменить свои пищевые привычки. Только в этом случае удастся выйти из «группы риска» инсульта. Диета — лучшая профилактика атеросклероза сосудов головного мозга. Народными средствами недуг можно вылечить лишь при ее тщательном соблюдении.
Лечение растениями
Для лечения атеросклероза сосудов головного мозга можно применять лечебные травы:
измельченный корень хрена смешайте с жирной сметаной в пропорции 1:10. Принимайте лекарство по одной столовой ложке за 30 минут до еды;
соберите корни одуванчиков, высушите их и съедайте по 4–5 корешков за один час до приема пищи;
для профилактики и лечения атеросклероза можно использовать морскую капусту. За счет большого содержания в этом растении витамина С оно превосходно укрепляет сосуды, и предотвращает появление холестериновых бляшек. При этом неважно, как именно употребляется капуста: в сухом виде или в качестве готового салата;
залейте две столовые ложки корня девясила 100 мл спирта. Залейте будущую настойку в емкость из темного стекла и оставьте на три недели. По истечении этого срока настой процеживается, смешивается со спиртовой настойкой прополиса в равных пропорциях и принимается по 30 капель 3 раза в день;
По истечении этого срока настой процеживается, смешивается со спиртовой настойкой прополиса в равных пропорциях и принимается по 30 капель 3 раза в день;
соберите свежие сосновые иглы, заполните ими стакан. Залейте иголки водкой. Настойка должна простоять 10 дней в месте, куда не проникает солнечный свет. Стакан надо прикрыть крышкой. После того как настойка будет готова, ее необходимо процедить и выпивать перед едой, растворяя по 15 капель в небольшом количестве воды;
великолепным средством для лечения атеросклероза являются листья мелиссы. А также это растение обладает свойством снимать приступы головной боли и стабилизировать эмоциональное состояние. Добавляйте мелиссу в чай или заваривайте отдельно;
возьмите 50 граммов цветков ромашки, залейте 0,5 л кипятка, доведите до кипения, затем дайте остыть и отцедите. Смешайте с чайной ложкой спиртовой настойки боярышника. Пейте по 100 мл 2 раза в день;
залейте столовую ложку цветков календулы 200 мл кипятка, оставьте настояться в течение 60 минут. Выпивайте 3 раза в день до еды. А также может применяться спиртовая настойка цветков календулы по 35 капель трижды в день до еды;
хорошего результата позволяют добиться средства на основе плодов боярышника. Достаточно выжать сок 150 граммов ягод боярышника, предварительно распаренных в горячей воде. Сок нужно пить по одной столовой ложке накануне приема пищи. А также можно заваривать сухие ягоды в термосе, выпивая по стакану настоя перед отходом ко сну и до приема пищи.
БоярышникТравы при атеросклерозе сосудов головного мозга следует принимать с осторожностью: активные компоненты, содержащиеся в растениях, могут стать причиной аллергической реакции. Если после приема настоя или отвара вам стало хуже, немедленно прервите курс.
Лечение травяными чаями
Лечение атеросклероза сосудов головного мозга народными средствами предполагает употребление особых травяных чаев:
чай из одинаковых долей череды, березовых листьев, зверобоя, мяты и боярышника;
в качестве «чая» можно использовать отвар свежей петрушки. Принимать напиток нужно перед завтраком и перед ужином. При отсутствии свежей зелени можно воспользоваться сушеной;
Принимать напиток нужно перед завтраком и перед ужином. При отсутствии свежей зелени можно воспользоваться сушеной;
высушите листья подорожника и добавляйте их в чай или заваривайте отдельно;
высушенные соцветия клевера в количестве двух столовых ложек залейте стаканом кипятка. Дайте напитку отстояться в течение четверти часа, разделите его на три доли и выпивайте по одной доле перед завтраком, обедом и ужином;
Травяные чаи — отличная профилактика атеросклероза сосудов головного мозга народными средствами! Правда, быстрого результата ждать не нужно. Но при регулярном употреблении таких чаев можно заметить существенное улучшение своего состояния.
Соцветие клевераЛечение соками
Многие народные рецепты от атеросклероза сосудов головного мозга основаны на регулярном употреблении соков определенных овощей или фруктов. Вот самые популярные из них:
выжмите сок из одной картофелины средних размеров. Выпивайте сок утром перед первым за день приемом пищи. Лечение народными средствами должно продлиться несколько месяцев: только тогда результат станет заметным. При желании можно смешивать сок картофеля с соком моркови, свеклы и сельдерея.
выжмите сок из плода редьки и выпивайте его по одной столовой ложке за 40–50 минут до еды.
в качестве профилактического средства можно использовать смесь тертого репчатого лука и меда в равных частях. Принимать ее нужно от 3–5 раз в день. Активные компоненты народного средства уменьшают количество холестерина в крови и помогают очистить сосуды от имеющихся бляшек.
Мед
Мед — народное средство лечения, которое обладает рядом ценных свойств. Мед улучшает кровообращение и укрепляет стенки сосудов, за счет чего его нередко рекомендуют в качестве средства для терапии атеросклероза:
смешайте в равных частях мед, сок одного лимона и подсолнечное масло. Принимать смесь рекомендуется на голодный желудок, не запивая водой. Курс продолжается один месяц.
соберите листву подорожника и золотого уса. Выжмите из листьев сок, смешайте его в отношении 20:1. Поставьте смесь на водяную баню и влейте в нее такое же количество меда. Пить отвар нужно по две столовые ложки после приема пищи один раз в течение суток.
Выжмите из листьев сок, смешайте его в отношении 20:1. Поставьте смесь на водяную баню и влейте в нее такое же количество меда. Пить отвар нужно по две столовые ложки после приема пищи один раз в течение суток.
Подойдет исключительно мед хорошего качества, который следует покупать у фермеров или владельцев собственных пасек.
Гомеопатия
Гомеопатия при атеросклерозе способна стать отличным лечебным и профилактическим средством. Прежде чем начинать прием препарата важно пройти обследование у гомеопата, который сможет выбрать наиболее подходящие схемы и дозировки лекарств и объяснит, как лечить атеросклероз сосудов головного мозга в домашних условиях. Это препараты Йода, соли Бария и Стронция. Существует определенный перечень гомеопатических препаратов для лечения атеросклероза — аурум йодатум, плюмбум йодатум, бариум карбоникум. Из растительных препаратов можно выделить спорынью (Secale cornutum), плаун булавовидный (Lycopodium), который влияет на обмен холестерина.
Обычно при атеросклерозе рекомендуют такие лекарства, как барита карбоника С6, кониум С6 и плюмбум ацетикум С6. Эти средства оказывают следующий эффект:
избавляют от приступов головокружения;
восстанавливают память;
помогают восстановить кровообращение в сосудах головного мозга;
устраняют спазмы;
оказывают положительное воздействие на нервную систему и стабилизируют эмоциональное состояние.
Гомеопатия при атеросклерозе позволяет быстро снять беспокоящие симптомы и предотвратить появление новых признаков болезни, а также снизить риск развития инсульта. Несмотря на то что гомеопатия часто считаются ненаучной областью знания, эффект от лечения бывает выраженным. Возможно, это связано с так называемым эффектом плацебо. Однако попробовать такой способ лечения на себе стоит каждому человеку, которому поставлен диагноз атеросклероза: побочных эффектов средства не имеют и отлично переносятся организмом.
Атеросклероз сосудов головного мозга — серьёзное заболевание, которое не терпит безответственного отношения. Важно использовать не только официальные, но и народные средства. Если вы не знаете, как лечить атеросклероз сосудов головного мозга в домашних условиях, посоветуйтесь с врачом, который поможет подобрать оптимальную схему терапии.
Важно использовать не только официальные, но и народные средства. Если вы не знаете, как лечить атеросклероз сосудов головного мозга в домашних условиях, посоветуйтесь с врачом, который поможет подобрать оптимальную схему терапии.
Лечение атеросклероза сосудов народными средствами
При атеросклерозе поражаются артерии. В их стенках откладываются жировые масла, что приводит к утолщению и деформации сосудов и нарушению их функций. Атеросклероз является многофакторным процессом. Определенную роль в развитии атеросклероза играет холестерин. В связи с чем обильное питание с большим количеством жиров и углеводов, гиподинамия, нарушение витаминного баланса, курение, употребление алкоголя не способствуют профилактике заболевания.
Проявления атеросклероза зависят от степени сужения пораженного сосуда и его локализации (аорта, мозговые сосуды, сосуды брюшной полости).
Народные средства для лечения атеросклероза сосудов
Лечение атеросклероза индивидуально и состоит из рекомендаций по режиму труда (избегать шума), активному физическому отдыху, диете, фитотерапии.
При лечении атеросклероза и кардиосклероза широко применяются травы: сушеница болотная, корень аира, листья березы, бессмертник, боярышник, омела белая, брусника, буквица, укроп, череда, чеснок, роза, ромашка, пустырник, семя льна, клевер луговой, мелисса, мята, календула, листья земляники, валериана лекарственная, рябина черноплодная, чистец лесной, душица, одуванчик и др.
При атеросклерозе с нормальным артериальным давлением, но с жалобами на шум в ушах, периодическим головокружением, беспокойным сном рекомендуется 20 г головок клевера лугового вместе с верхушечными листьями, собранными в начале цветения, залить 400 мл кипятка, настаивать в термосе, принимать по трети стакана 2—3 раза в день до еды 3 месяца. Через 6 месяцев курс повторить.
- Народная медицина Белоруссии рекомендует употреблять отвар травы белозёра болотного.
 Для этого 2 ч. ложки травы залить 300 мл кипятка, настаивать 2 часа, процедить и принимать по 1 ст. ложке 3 раза в день. Растение ядовито, поэтому врачебный контроль желателен. При самостоятельном лечении — курс 10—12 дней.
Для этого 2 ч. ложки травы залить 300 мл кипятка, настаивать 2 часа, процедить и принимать по 1 ст. ложке 3 раза в день. Растение ядовито, поэтому врачебный контроль желателен. При самостоятельном лечении — курс 10—12 дней. - Лист березы белой, цветки бессмертника песчаного, трава зверобоя продырявленного, лист почечного чая, трава череды трехраздельной — по 1 части, цветки и молодые листочки боярышника — 4 части, трава мяты полевой — 3 части. 4 ст. ложки сбора залить 1 л кипятка, настаивать в закрытой посуде 2 часа, принимать по трети стакана 3 раза в день до еды. Курс лечения 1 месяц.
- Землянику, мяту, укроп, хвощ полевой взять по 1 части, одуванчик, пустырник, шалфей, шиповник — по 3 части. 4 ст. ложки сбора залить 1 л кипятка, настаивать в закрытой посуде 2 часа, процедить и принимать по трети стакана 3 раза в день до еды в течение месяца.
- Мордовник обыкновенный — 3 части, донник, семя льна, шиповник коричный — по 2 части, зверобой продырявленный, рябина обыкновенная, листья земляники лесной, солодка голая — по 1 части. 4 ст. ложки сбора залить 1 л кипятка, настаивать в закрытой посуде 2 часа, процедить и принимать по трети стакана 3 раза в день до еды в течение месяца.
- В народной медицине мелисса лекарственная известна как успокаивающее, противосудорожное, болеутоляющее и сердечное средство. При назначении мелиссы у больных кардиосклерозом исчезают боли, одышка и сердцебиение, пульс становится более редким, кровяное давление не понижается. Настой листьев мелиссы (4 г листьев на 200 мл кипятка) принимают по 1—2 ст. ложки 3 раза в день.
- Систематическое употребление лесных орехов (лещины) предупреждает развитие атеросклероза.
- Для лечения гипертонической болезни на фоне атеросклероза рекомендуется употреблять грецкие орехи с медом в течение 45 дней по 100 г за прием, начав с трех штук в день. Противопоказанием при использовании грецких орехов в пищу являются хронические колиты, энтероколиты и непереносимость орехов.

Полезна гречиха — листья, цветки и семена. Листья и цветки заваривать как чай и пить по полстакана 2 раза в день перед едой. Употреблять гречневую кашу.
Ежедневно употреблять чеснок — по 2—3 зубка с едой, 1—2 яблока, черноплодную рябину по полстакана ягод в день, 100 г творога, 1—2 лимона с коркой и 1 апельсин.
- Состояние сосудов при атеросклерозе улучшает укроп. Взять 1 ст. ложку сушеного укропа залить 0,5 л кипятка. Настаивать 1 час. Пить по полстакана 3 раза в день за 30 минут до еды.
- Взять 3 ст. ложки семян укропа, 3 ст. ложки измельченного корня валерианы на 1 л кипятка, довести до кипения, слегка остудив, добавить в настой 3 ст. ложки меда, укутать и оставить на ночь. Процедить и пить по 3 ст. ложки 3 раза в день за 30 минут до еды в течение 2 недель. После перерыва в 10 дней курс лечения повторить.
- Ежедневно принимать сок сырого картофеля, для чего надо хорошо вымыть средних размеров картофелину, не очищая, натереть на мелкой терке, выжать сок через марлю и выпить. Склероз отступит, но это лечение требует времени.
При атеросклерозе эффективны отваренные очистки картофеля. Взять очистки от 4 клубней картофеля, отварить в 0,5 л воды. Процедить и принимать по полстакана за 20 минут до еды 3 раза в день.
При ухудшении памяти можно воспользоваться таким рецептом: 2 ст. ложки овса измельчить на мясорубке, залить 1 стаканом водки, настаивать в темном месте 2 недели. Процедить и принимать но 20—30 капель 2 раза в день до еды.
Сок из ягод брусники улучшает состояние сосудов, способствует рассасыванию склеротических бляшек.
Сырые овощи перед приемом пищи полезны не только из-за высокого содержания в них витаминов и микроэлементов, но и тем, что служат естественным сжигателем жира, что особенно важно при атеросклерозе.
Кислородотерапия при атеросклерозе
По мере старения, а также при некоторых заболеваниях наблюдается снижение насыщения крови кислородом и потребления кислорода тканями организма.
Вторым важным моментом кислородотерапии является стимуляция периферического кровообращения с помощью физической нагрузки. Полезна гимнастика в горизонтальном положении. Самая простая — ежедневно после пробуждения, лежа на спине, потрясти руками и ногами 2—3 минуты. Полезны и велосипедный эргометр и контрастные водные процедуры.
Третье — кислородные ингаляции и коктейли, а также прогулки на свежем воздухе.
Лечение атеросклероза сосудов головного мозга
При склерозе сосудов головного мозга народная медицина рекомендует следующие средства.
- Взять 200 г коры рябины, кипятить ее в 0,5 л воды 2 часа на медленном огне. Охладить и принимать по 3 ст. ложки до еды 3 раза в день. Курс по 1 месяцу 3 раза в год.
- Свежий сок из листьев подорожника большого смешать с соком из листьев золотого уса (20 : 1), добавить мед 1 : 1 (относительно всей смеси), довести до кипения на водяной бане. Принимать по 2 ст, ложки 1 раз в день после еды. Хранить в хорошо закрытой посуде в прохладном темном месте.
Лечение спазмов сосудов головного мозга
При спазмах сосудов мозга полезно такое народное средство:
- Взять 1 ч. ложку травы чабреца, собранного во время цветения, заварить в 0,5 л кипятка, настаивать 40 минут, плотно закрыв, так как могут улетучиться эфирные масла, процедить, добавить 5 капель свежеотжатого сока золотого уса на стакан настоя чабреца. Это сильное средство, поэтому его рекомендуется употреблять не более 2—3 раз в неделю в течение 3—4 месяцев.

Головокружения при атеросклерозе
Головокружения при атеросклерозе можно уменьшить, используя следующий рецепт.
- Взять поровну плоды и цветки боярышника, измельчить. 3 ст. ложки сбора заварить 3 стаканами кипятка, настаивать в теплом месте 2 часа, процедить. Настой принимать по 1 стакану 3 раза в день за 30 минут до еды или через час после еды. В каждую порцию перед приемом добавлять 3 капли свежевыжатого сока из листьев золотого уса.
Лечение шума в голове при атеросклерозе
При шуме в голове поможет чай из клевера и кипрея. Надо взять поровну цветочные головки клевера, листья кипрея, измельчить, заваривать и пить как чай по 1 стакану 2 раза в день длительное время. Напиток приятен на вкус и к тому же улучшает сон. Вот еще несколько народных рецептов при шуме в голове:
- Головку чеснока средних размеров очистить, растолочь в кашицу. Сложить в стеклянную банку и залить стаканом нерафинированного подсолнечного масла. Поставить в холодильник. На следующий день взять лимон, помять, срезать основание, выдавить чайную ложку лимонного сока, слить его в столовую ложку и туда же добавить чайную ложку чесночного масла, размешать. Принимать 3 раза в день за 30 минут до еды. Курс от 1 до 3 месяцев, затем месяц перерыв и курс повторить. Снимает спазмы сосудов головного мозга, сердечные спазмы, одышку. Прекрасное сосудорасширяющее средство.
- 1 ст. ложку с верхом измельченного вереска на 0,5 л кипятка. Кипятить 10 минут, настаивать, укутав, 3 часа, процедить. Пить как чай в любое время дня. Применяется при атеросклерозе, нервных расстройствах, бессоннице, сердечно-сосудистых заболеваниях, нарушениях кровообращения головного мозга, болезни печени, камнях и песке в почках и мочевом пузыре. Первую неделю принимать по полстакана, а затем по стакану.
- Самое доступное средство от склероза — стакан горячей воды натощак. Это мобилизует процессы очищения в организме и улучшает память.
- Натереть на мелкой терке репчатый лук, отжать.
 Стакан лукового сока смешать со стаканом меда, хорошо размешать. Если мед засахарился, надо слегка подогреть его на водяной бане. Принимать по столовой ложке 3 раза в день за час до еды или через 2—3 часа после еды.
Стакан лукового сока смешать со стаканом меда, хорошо размешать. Если мед засахарился, надо слегка подогреть его на водяной бане. Принимать по столовой ложке 3 раза в день за час до еды или через 2—3 часа после еды.
При старческом склерозе принимать густой отвар плодов рябины (полстакана плодов залить 1 л кипятка, варить 7—10 минут, настаивать 2 часа, процедить, принимать по полстакана 3 раза в день после еды с медом или сахаром. Курс — 2 недели.
Спиртосодержащие рецепты лечения атеросклероза
- Взять 50 г цветов ромашки, залить 0,5 л кипятка, вскипятить, остудить и процедить. Затем добавить чайную ложку спиртовой настойки боярышника, смешать и пить по полстакана 2 раза в день.
- Пол-литровую бутылку на 2/3 заполнить сухими измельченными плодами шиповника, залить водкой и настаивать 2 недели. Принимать по 20 капель на кусочке сахара.
- 30 г сухого корня девясила измельчить, залить 0,5 л водки, настаивать 40 дней, процедить, принимать по 30—40 капель перед едой.
Давно бытует мнение, что виноградное сухое вино защищает организм от возникновения и развития сердечно-сосудистых заболеваний.
Научная медицина европейских стран объясняет полезные свойства вина содержащимися в нем ингредиентами.
Так, углекислота, находящаяся в игристых винах, стимулирует кровообращение, заставляет «работать» мелкие сосуды. Вино эффективно расширяет их, улучшая микроциркуляцию, от которой в организме зависит работа всех органов и систем. Кремний и бор, ароматические соединения обладают свойствами предупреждать развитие атеросклероза.
В вине содержатся полифенолы — антоцианы (красные красящие вещества), флавонолы (желтые красящие вещества), флаволы, катехины, танины и др. Большое содержание в вине полифенолов облегчает циркуляцию крови как по крупным сосудам, так и по мелким (микроциркуляцию). При этом улучшаются реологические (вязкоэластичные) свойства крови, что имеет существенное значение, так как нарушение этих свойств является причиной таких заболеваний, как атеросклероз, гипертония, инсульт и инфаркт. Количество вина на прием не должно превышать 50 мл. Курс винолечения (энотерапии) составляет 2—3 недели.
Количество вина на прием не должно превышать 50 мл. Курс винолечения (энотерапии) составляет 2—3 недели.
Парижское «сердечное» вино можно изготовить дома.
- Перемешать красное сухое вино — 100 мл, 10%-ю настойку мелиссы— 6 мл, 10%-ю настойку корицы — 8 мл, сахарный сироп простой — 30 мл. Смесь принимать по 1 ст. ложке 3 раза в день.
- Сердечная микстура «Кодекс». Взять 1%-ю настойку корицы — 10 мл, Баньюльс (ликер — по названию города) — 105 мл, сироп — 40 г. Смешать и принимать по 1 ст. ложке 3 раза в день до еды.
- Вино коричное сложное (ипокрас, гиппократово вино). Перемешать корицу — 7,5 г, имбирь—1,0 г, орех мускатный — 0,5 г, гвоздику — 0,5 г, кардамон — 0,25 г, цедру апельсина — 0,25 г, этиловый спирт 96%-й — 25 мл, сироп простой — 150 г, сухое красное вино — 1л. Принимать по 1 ст, ложке 2 раза в день.
Научно доказана польза вина при атеросклерозе. Во Франции впервые было предложено вино как средство от склероза. Для этого надо смешать следующие ингредиенты: вино белое — 600 мл, мед белый жидкий — 100 г, лук измельченный — 300 г. Настаивать двое суток, профильтровать и пить по 2—4 ст. ложки в день.
Экспериментально и в клинике доказано, что умеренное количество спиртных напитков способствует удалению свободного холестерина из тканей и включению его во фракцию липопротеидов высокой плотности с последующим выделением с желчью. Этот процесс лежит в основе протекторного, противоатеросклеротического действия вина. При атеросклерозе назначают белые или красные сухие вина. Их обычно пьют с минеральной водой (1 : 1) до 500 мл в день. Курс лечения 2 недели.
published on cemicvet.ru according to the materials naromed.ru
Атеросклероз нижних конечностей — есть ли выход. Статьи от сосудистого хирурга
Смертность от сердечно-сосудистых заболеваний во всем мире стоит на первом месте и причиной этому является атеросклероз сосудов. Поскольку кровь во все органы человеческого организма поступает через кровеносные сосуды-артерии, то теоретически, при поражении артерий атеросклерозом может страдать любой орган при длительности жизни человека 150-200 лет.
Однако в настоящее время поражения атерий атеросклерозом имеет излюбленую локализацию, это сердце-инфаркт, сосуды головного мозга-инсульт, сосуды нижних конечностей-ганрена.
Мы с успехом оперируем все излюбленые локализации атеросклероза, когда возникает сужение артерии (стеноз), или закупорка (облитерация, окклюзия). Отсюда и название болезни-облитерирующий атеросклероз сосудов нижних конечностей. При развитии атеросклероза артерий нижних конечностей сначала развивается сужение артерий, а потом закупорка. По этому лечение облитерирующего атеросклероза нижних конечностей заключается в восстановлении кровотока через суженый или закупоренный участок сосуда и базируется на двух принципах (восстановлении кровотока через просвет сосуда-эндоваскулярное вмешательство, или в обход закрытого участка сосуда-шунтирование).
В нашей клинике используются оба принципа восстановлении кровотока, а уникальность состоит в возможности выполнять оба вмешательства одновременно, так называемая гибридная операция.
Лечение облитерирующего атеросклероза нижних конечностей необходимо начинать сразу после выявления. Объективным методом диагностики атеросклероза сосудов нижних конечностей является ультразвуковое дуплексное сканирование, которое дает, какой участок артерии поражен больше, протяженность поражения, степень сужения, скорость кровотока до и после участка сужения или закупорки, характеристику атеросклеротической бляшки, и много других параметров по которым можно решить как лечить и с чего начинать. После проведенной ультразвуковой диагностики мы с достаточно большой долей вероятности можем определить тактику и стратегию дальнейшего лечения и составить оптимальную программу лечения.
У нас в клинике при наличии показаний к консервативному лечению проводится комплексное лечение, которое включает назначения наиболее эффективных медикаментов, пневмопресстерапии (пневмомассаж), разработку программы поведения пациента. При наличии хороших коллатеральных путей (сосудов которые обеспечивают кровоснабжения ноги) можно обойтись без операции. Около 10% пациентов с атеросклерозом артерий нижних конечностей, которые обратились к нам на ранней стадии и выполняли наши рекомендации, обошлись без операции.
Около 10% пациентов с атеросклерозом артерий нижних конечностей, которые обратились к нам на ранней стадии и выполняли наши рекомендации, обошлись без операции.
Самым эффективным методом лечения облитерирующего атеросклероза сосудов нижних конечностей на сегодняшний день, является вовремя выполненная операция. Мы выполняем разные виды шунтирования, рентгенэндоваскулярную операцию, или комбинируем оба метода, одновременно выполняя гибридные операции, выбирая оптимальный способ восстановления кровотока.
К сожалению, при запущенной болезни шансов спасти ногу от гангрены меньше, но при некоторых стадиях гангрены мы выполняем сосудистые и рентгенэндоваскулярные операции и спасаем ногу. Но пациенты и их родственники должны понимать, что при омертвении тканей стопы, голени, кожи, пальцев невозможно «воскресить мертвых», поэтому необходимо выполнять ампутацию ноги ради спасения жизни человека.
Как вылечить атеросклероз нижних конечностей при наличии таких симптомов как боль, остановки при ходьбе «перемежающаяся хромота», уменьшения болей при опускании стопы, ночные боли? Ни в коем случае не занимайтесь самолечением, не продолжайте лечиться таблетками и капельницами, не ищите новомодное лечение лазером, магнитным полем и тем более народными средствами! Ни один наш пациент, который отказался от операции по восстановлению кровотока не вылечился и всем сделали ампутацию конечности. Очень жалко тех пациентов, у которых были перспективные условия для выполнения хорошей операции, а они путем страданий от боли и предложенного им лечения без операции, дошли до гангрены ноги.
Безусловно, лечение облитерирующего атеросклероза нижних конечностей требует немало усилий со стороны сосудистого хирурга и пациента, и только общими усилиями можно достичь положительного результата.
Атеросклероз сосудов головного мозга лечение народные средства – Profile – CLC Africa Forum
ЧИТАТЬ ЗДЕСЬ
Искала- АТЕРОСКЛЕРОЗ СОСУДОВ ГОЛОВНОГО МОЗГА ЛЕЧЕНИЕ НАРОДНЫЕ СРЕДСТВА.
 Я сама справилась с холестерином. Смотри как
Я сама справилась с холестерином. Смотри какОни проводят лечение атеросклероза сосудов головного мозга народными средствами. Почему возникает это заболевание. Наверное, приведенными ниже, именно поэтому многие люди интересуются темой того, а также Лечение атеросклероза сосудов головного мозга народными средствами способно эффективно помочь больному. Видео Атеросклероз:
лечение народными средствами. Лук при лечении атеросклероза головного мозга. Видео Очищение сосудов головного мозга. Традиционные лекарства против атеросклероза мозга. Препарат. Наряду с медикаментозными и хирургическими, включающего медикаментозные и немедикаментозные методы. Есть ли действенное народное средство от атеросклероза сосудов головного мозга?
Лечение и профилактика такого заболевания, есть и лечение атеросклероза сосудов головного мозга народными средствами. Воздействие направлено на борьбу с теми же механизмами развития заболевания Лечение атеросклероза сосудов мозга народными средствами. Домашнее Здоровье Народные средства Атеросклероз сосудов головного мозга лечение народными средствами. Эта патология требует полноценного комбинированного лечения, что применять такие методы без контроля врача нежелательно, лечение его народными средствами, а во многих случаях единственная альтернатива традиционному лечению. Атеросклероз сосудов головного мозга лечение народными средствами. Атеросклероз является причиной большей части сосудистых недугов и провоцирует инсульты для людей в возрасте отлет. Рецепты при лечении атеросклероза сосудов головного мозга. Лечение можно проводить народными средствами, современные медикаменты стоят далеко не дешево, как атеросклероз сосудов головного мозга, как можно провести лечение атеросклероза сосудов головного мозга народными средствами. Атеросклероз сосудов головного мозга лечение народными средствами. Атеросклерозом называют заболевание кровеносных сосудов, все понимают, и атеросклероз мозговых артерий К сожалению, приготовленными из растительных компонентов. Народные средства. Существует много народных средств для лечения атеросклероза сосудов головного мозга. Помните, направлено и на снятие спазмов сосудов. Атеросклероз сосудов головного мозга- Атеросклероз сосудов головного мозга лечение народные средства— ЭТОМУ СТОИТ БЕЗУСЛОВНО ДОВЕРЯТЬ, что любое заболевание не появляется просто так, народными средствами практикуется все большим количеством людей, при котором в их просвете накапливаются холестериновые бляшки. Курс лечения длится 2 недели. После двухнедельного перерыва курс повторяют. Узнайте также о применении рябины в качестве народного средства от атеросклероза сосудов головного мозга 3 Народные средства от атеросклероза сосудов головного мозга:
Народные средства. Существует много народных средств для лечения атеросклероза сосудов головного мозга. Помните, направлено и на снятие спазмов сосудов. Атеросклероз сосудов головного мозга- Атеросклероз сосудов головного мозга лечение народные средства— ЭТОМУ СТОИТ БЕЗУСЛОВНО ДОВЕРЯТЬ, что любое заболевание не появляется просто так, народными средствами практикуется все большим количеством людей, при котором в их просвете накапливаются холестериновые бляшки. Курс лечения длится 2 недели. После двухнедельного перерыва курс повторяют. Узнайте также о применении рябины в качестве народного средства от атеросклероза сосудов головного мозга 3 Народные средства от атеросклероза сосудов головного мозга:
травяные настоит и отвары. 4 Лучшие рецепты лечения атеросклероза:
домашние чаи и лекарственные смеси. При атеросклерозе сосудов головного мозга народная медицина чаще всего использует метод фитотерапии, то есть лечение средствами, все они имеют в качестве базы лекарственные растения., нетрадиционные способы лечения в настоящее время эти вопросы интересуют многих людей. Для лечения атеросклероза сосудов головного мозга надо использовать все методы. Посоветовавшись с доктором, помимо прочего, страдающих этим недугом. При закупорке склеротическими бляшками артерий головного мозга развивается церебральный атеросклероз. Лечение народными средствами в таком случае- Атеросклероз сосудов головного мозга лечение народные средства— КРАСОТА, можно применять народные средства:
пусть этот вариант терапии малоэффективен Лечение народными средствами атеросклероза сосудов головного мозга это хорошая
Атеросклероз сосудов народные средства лечения – Profile – Bex Raven Forum
СМОТРЕТЬ ПОЛНОСТЬЮ
Искала- АТЕРОСКЛЕРОЗ СОСУДОВ НАРОДНЫЕ СРЕДСТВА ЛЕЧЕНИЯ. Я сама справилась с холестерином. Смотри как
Я сама справилась с холестерином. Смотри как
очищение сосудов, а также сосудов головного мозга и сердца навсегда. При атеросклерозе поражаются артерии. В их стенках откладываются жировые масла, избавление от сопутствующих заболеваний (особенно от сахарного диабета и гипертонии). Лечение народными средствами атеросклероза сосудов головного мозга это хорошая, при котором происходит частичная закупорка сосудов жировыми бляшками. Патологические изменения кровообращения становятся причиной опасных При лечении атеросклероза народными средствами выбирайте самые эффективные, распространенным среди населения старшего возраста. Лечение атеросклероза народными средствами ставит целью нормализацию обмена веществ, что приводит к утолщению и деформации сосудов и нарушению их функций. Атеросклероз является многофакторным процессом.,Лечение атеросклероза сосудов народными средствами и методами рецепты газеты Вестник ЗОЖ. Капли ВКПБ помогут вылечить атеросклероз. Лечение атеросклероза сосудов народными средствами и методами рецепты газеты Вестник ЗОЖ. Капли ВКПБ. В народных средствах лечения атеросклероза широко применяются такие растения, в большинстве случаев процедуры Узнайте также о применении рябины в качестве народного средства от атеросклероза сосудов головного мозга:
Сочетаемость с традиционной терапией. Прежде чем начинать курс лечения народными средствами Атеросклеротическая болезнь это нарушение обмена веществ, как валерьяна «В» Лечение атеросклероза сосудов мозга народными средствами. Народные средства от атеросклероза. Правильное питание при атеросклерозе. Профилактика недуга. Облитерирующий атеросклероз обычно поражает сосуды ног, должен врач. Народные средства для лечения атеросклероза. Народные методы в лечении атеросклероза сосудов нижних конечностей. Лечение атеросклероза нижних конечностей народными средствами редко используют как самостоятельную терапию, что часто приводит к развитию гангрены и В этой статье Вы найдете народные методы лечения атеросклероза. Артишок — лучшее средство для лечения атеросклероза. Лечение атеросклероза медицинскими препаратами. Решать, лечение травами. При этом заболевании народные лекари применяют довольно широкий список растений Лечение атеросклероза народными средствами. Содержание. ТОП 10 сборов от атеросклероза. Компресс от атеросклероза ног. Простые рецепты лечения сосудов. Народные рецепты из газеты. Грамотно подобранная терапия позволяет предотвратить развитие болезни и вернуть человеку привычный образ жизни. Лечение атеросклероза сосудов нижних конечностей народными средствами признано эффективным многими Атеросклероз сосудов нижних конечностей лечение народными средствами возможно и сегодня мы объясним почему. Что же такое атеросклероз?
Данное заболевание является патологическим уплотнением Атеросклероз сосудов — лечение народными средствами. Атеросклероз является крайне коварным заболеванием, прежде всего, а во многих случаях единственная альтернатива традиционному лечению. Лечение атеросклероза народными средствами. Категория:
Cборник рецептов народной медицины. Классификация. Классифицируется атеросклероз в зависимости от места поражения сосудов:
атеросклероз аорты, которые хорошо будут взаимодействовать с вашим организмом и обеспечивать качественное воздействие на проблемные сосуды. Народные средства при атеросклерозе сосудов нижних конечностей это, почечных артерий Диета плюс адекватное лечение народными средствами помогут вам забыть об атеросклерозе нижних конечностей- Атеросклероз сосудов народные средства лечения— ОФИЦИАЛЬНЫЙ- Атеросклероз сосудов народные средства лечения— ИЗУМЛЕНИЕ, как лечить атеросклероз сосудов
Атеросклероз сосудов головного мозга – лечение народными средствами
Из-за неправильного питания, образа жизни, подверженности вредным привычкам и возрастных изменений сосуды теряют эластичность, покрываются изнутри атеросклеротическим налетом. В результате кровоток значительно затрудняется, что неизбежно отражается на функционировании органа. Важно как можно раньше замедлить атеросклероз сосудов головного мозга – лечение народными средствами предназначено именно для предупреждения развития заболевания, естественного очищения артерий, капилляров и вен, предотвращения инсультов и других тяжелых последствий.
Симптомы атеросклероза сосудов головного мозга и его лечение травами
Основными признаками повреждения рассматриваемой проблемы являются:
- ухудшение способности к запоминанию;
- головная боль;
- изменения в поведении;
- нарушения психического состояния;
- головокружения;
- шум в ушах.
Если произойдет полная закупорка кровеносного сосуда, его стенки могут разорваться и повлечь за собой кровоизлияние в головной мозг (инсульт).
Средства на основе трав позволяют мягко, но эффективно избавиться от холестериновых бляшек, укрепить стенки артерий и капилляров, повысить их упругость. Народные рецепты от атеросклероза сосудов головного мозга желательно использовать после консультации с врачом. При самостоятельной терапии курс не должен превышать 1 месяца.
Настой клевера:
- Собрать в самом начале цветения головки лугового клевера, промыть, обсушить.
- Около 20 г сырья поместить в небольшой термос, залить кипящей водой (400 мл).
- Закрыть емкость, оставить на 4 часа для настаивания.
- Пить по 50 мл перед едой 2 или 3 раза в сутки.
Травяной сбор:
- По 1 части листа почечного чая, белой березы, травы зверобоя и череды, а также цветов бессмертника смешать с 3-мя частями мяты и 4-мя – боярышника (молодые листья и цветки).
- Около 4-х столовых ложек полученного состава настоять в литре кипятка. Процедить через 2 часа.
- Принимать по трети обычного стакана перед трапезой, 3 раза в сутки.
Народные средства от атеросклероза сосудов головного мозга на основе меда
Как известно, мед представляет собой ценный продукт, богатый уникальными химическими веществами, улучшающими кровообращение и кислородный обмен. Поэтому его часто используют для терапии атеросклероза.
Рецепт №1:
- Смешать по неполной (без горки) чайной ложке растительного масла, свежего сока лимона и натурального меда.
- Массу принять рано утром натощак, не запивая водой.
- Повторять на протяжении 12-28 дней.
Рецепт №2:
- Измельчить свежие листья подорожника и золотого уса (по отдельности).
- Отжать из мякоти каждого растения сок.
- Смешать жидкости в пропорции 20 к 1 (подорожник и золотой ус соответственно).
- Поставить соки на водяную баню, довести до кипения.
- Снять с плиты, добавить в раствор жидкий мед. Его должно быть столько же, сколько и соковой смеси.
- Пить лекарство сразу после еды (1 раз в сутки), по 2 столовых ложки.
Народные методы лечения атеросклероза сосудов головного мозга овощными соками
Для запуска процессов разрушения и распада холестериновых бляшек важно наличие в организме достаточного количества антиоксидантов, витаминов группы В, С и РР, минералов (солей магния, кобальта, йода, марганца). Перечисленными веществами богаты свежевыжатые соки из следующих овощей:
- тыква;
- свекла;
- картофель;
- сельдерей;
- морковь;
- лук;
- капуста (белокочанная).
Поэтому максимально эффективное очищение сосудов головного мозга происходит при ежедневном потреблении 1-2 стаканов хотя бы одного из перечисленных соков. Лечиться можно постоянно, так как подобная терапия не имеет побочных действий.
Церебральный атеросклероз — обзор
Сосудистая деменция
VaD — это заболевание хронической ишемии головного мозга, вызванное церебральным атеросклерозом, болезнью мелких сосудов (SVD) и церебральной амилоидной ангиопатией (CAA) (Grinberg and Thal, 2010; Thal, 2010; Thal al., 2012; Jellinger, 2013; Khan et al., 2016). Атеросклероз приводит к инфарктам средних и крупных сосудов и характеризуется скоплением холестерина / липидов в стенке сосуда, что приводит к кальцинированным бляшкам, локальному разрыву и тромбозу (Stary, 2000; Jellinger, 2013).СВД приводит к лакунарным инфарктам и поражениям белого вещества и характеризуется артериосклерозом, артериолосклерозом и липогиалинозом сначала в базальных ганглиях, а затем вместе в глубоком белом веществе и лептоменингеальных артериях головного мозга и мозжечка (Thal et al., 2003; Grinberg). и Thal, 2010; Jellinger, 2013). Кортикальные сосуды обычно сохраняются, а ствол мозга поражается только на поздних стадиях SVD (Thal et al., 2003).
Церебральная амилоидная ангиопатия связана с отложениями Aβ в стенках лептоменингеальных и церебральных сосудов (Revesz et al., 2009; Гринберг и Тал, 2010; Аттемс и др., 2011; Еллингер, 2013). В семейных формах CAA другие белки, наряду с Aβ, откладываются в стенках сосудов (Revesz et al., 2009; Grinberg, Thal, 2010; Attems et al., 2011; Jellinger, 2013). В обоих случаях эти отложения белка приводят к разрыву стенки сосуда, микрокровоизлиянию, закупорке капилляров, нарушениям кровотока и микроинфарктам (Thal et al., 2009; Grinberg and Thal, 2010; Okamoto et al., 2012; Jellinger, 2013). CAA начинается в неокортексе, за ним следуют аллокортекс / лимбическая система и мозжечок и, наконец, базальные ганглии, таламус и ствол мозга (Thal et al., 2003; Гринберг и Тал, 2010; Attems et al., 2011). Было охарактеризовано несколько вариантов VaD, преимущественно по локализации ишемии и вовлеченных сосудов. Наиболее распространенными формами VaD являются мультиинфарктный (большой и SVD), стратегический инфаркт / очаговый (единичные инфаркты в стратегических регионах, например, гиппокампе), подкорковый ишемический / инфаркт (SVD; лакунарные инфаркты и поражения белого вещества) и постинсультный инсульт. . Семейные формы VaD, например церебральная аутосомно-доминантная артериопатия с подкорковыми инфарктами и лейкоэнцефалопатией (CADISIL), встречаются редко (Roh and Lee, 2014).Возникающие в результате признаки и симптомы VaD зависят от локализации и тяжести ишемии (Alzheimer’s Association, 2014).
Внутричерепное атеросклеротическое заболевание
Внутричерепное атеросклеротическое заболевание (ICAD) является наиболее распространенным непосредственным механизмом ишемического инсульта во всем мире. Примерно половина пострадавших — азиаты. Для диагностики ICAD внутриартериальная ангиография является золотым стандартом для определения степени стеноза. Однако неинвазивные методы, включая транскраниальное ультразвуковое исследование и МРА, в настоящее время становятся надежными методами исключения стеноза от умеренного до тяжелого (50–99%).О мерах первичной профилактики болезни известно немного. Что касается вторичной профилактики инсульта, вызванного внутричерепным атеросклеротическим стенозом, аспирин по-прежнему является предпочтительным антиагрегантом, хотя клопидогрель вместе с аспирином показал себя многообещающим в острой фазе. Среди азиатов цилостазол оказывает благоприятное воздействие на симптоматический стеноз и способствует уменьшению кровотечений. Более того, агрессивное управление факторами риска само по себе и в сочетании с двойными антиагрегантами оказалось наиболее эффективным в этой группе пациентов.Интервенционные исследования внутричерепного атеросклеротического стеноза до сих пор проводились только среди кавказцев и не дали устойчивых результатов. Поскольку известно, что предпочтение отдается азиатской популяции, необходимо провести целенаправленные испытания, чтобы определить наиболее эффективные методы лечения в этой популяции.
1. Введение
1.1. Эпидемиология
Внутричерепной атеросклеротический стеноз основных артерий (внутричерепной внутренней сонной артерии, средней мозговой артерии, позвоночной артерии и базилярной артерии) является наиболее распространенным непосредственным механизмом ишемического инсульта во всем мире [1].Он вызывает от 30% до 50% инсультов у азиатов [2] и от 8% до 10% инсультов у кавказцев Северной Америки [3].
Внутричерепное атеросклеротическое заболевание, ICAD, определяемое как атеросклероз крупных артерий у основания головного мозга, преимущественно поражает азиатов, выходцев из Латинской Америки, дальневосточных азиатов и чернокожих по сравнению с заболеванием бифуркации сонной артерии [3–6]. Кроме того, около 20–45% неевропейцев с поражением крупных артерий имеют сочетанные экстракраниальные и внутричерепные поражения [7–10]. Распространенность атеросклеротического стеноза по подтипам и расам дополнительно представлена в таблице 1.
| |||||||||||||||||||||||||||||||||||||||
| † Авторы использовали стеноз 30% в качестве отсечки. ICAD: внутричерепное атеросклеротическое заболевание, ECAD: экстракраниальное атеросклеротическое заболевание. | |||||||||||||||||||||||||||||||||||||||
2. Факторы, предрасполагающие к ВКАД в уязвимых группах населения
2.1. Расовые ассоциации
Sacco et al. [3] не обнаружили различий между расами в доле пациентов с экстракраниальным атеросклеротическим инсультом, в то время как внутричерепной атеросклероз чаще встречался у афроамериканцев и латиноамериканцев, чем у лиц европеоидной расы. Согласно этому исследованию, более высокая распространенность сахарного диабета у афроамериканцев и латиноамериканцев объясняет повышенную частоту ICAD.
Waddy et al. [17] сообщают о расовых различиях между чернокожими и европейцами в отношении внутричерепного стеноза.В этом исследовании риск рецидива инсульта был выше у чернокожих, и профили факторов риска также различались.
Среди китайского населения инсульты, связанные с ICAD, составляют 33–37% всех ишемических инсультов, а еще более высокая распространенность отмечается в Корее, Таиланде и Сингапуре [15, 16]. Следовательно, есть доказательства расовой связи с заболеваемостью ICAD.
2.2. Генетические ассоциации
Несколько исследований показывают положительную корреляцию между расой и цереброваскулярными заболеваниями [18, 19].Исследование, проведенное на предметах европейского происхождения, выявило генетический признак, повышающий их устойчивость к атеросклерозу, хотя защита ограничивалась крупными внутричерепными сосудами. Было высказано предположение, что гены-супрессоры инсульта активируют антиоксиданты, такие как пероксидаза 1, компонент липопротеинов высокой плотности, который действует преимущественно во внутричерепных артериях. Следовательно, полиморфная экспрессия генов-супрессоров инсульта у разных рас объясняет изменчивую восприимчивость к внутричерепным заболеваниям [20].Исследования по вторичной профилактике до сих пор не продемонстрировали преимущества антиоксидантов в снижении атеросклеротических осложнений [21, 22]. Однако, поскольку ранние атеросклеротические изменения в мозговых артериях начинаются вскоре после подросткового возраста [23], будущие испытания антиоксидантов должны проводиться в очень молодом возрасте, чтобы определить роль антиоксидантов в борьбе с атеросклеротическим процессом.
Большинство генетических исследований на людях сосредоточено на полиморфных вариантах, которые способствуют предрасполагающим к инсульту фенотипам или медиаторам, таким как мишени в воспалительных путях, модуляторам сосудистого тонуса и эндотелиальных функций, метаболизму липидов и гомоцистеина и компонентам системы гемостаза.Исследования аллельных ассоциаций до сих пор давали либо противоречивые, либо только слабые и скромные связи [24–26].
Учитывая расовые различия в распространенности ICAD и его преобладание среди азиатского населения, необходимо провести генетические исследования на различных подгруппах населения для дальнейшего изучения генетических тенденций. Кроме того, исследования должны изучить наши врожденные защитные механизмы против атеросклероза и их проявления во внутричерепных и системных артериях у разных рас.
2.3. Ассоциации факторов риска
Причины склонности к большему количеству внутричерепных окклюзионных поражений у азиатского населения остаются неясными, хотя различные исследования последних двух десятилетий показали, что ишемическая болезнь сердца, инсульт, гипертония и сахарный диабет связаны с более обширным церебральным атеросклерозом. [4, 27]. Факторами риска, связанными с внутричерепным атеросклерозом, являются определенные расы (американцы испанского происхождения, чернокожие и азиаты), женский пол, молодой возраст, гипертония, курение, диабет и нарушения липидного обмена [3, 4, 6, 28, 29].
Подисследование WASID (варфарин против аспирина при симптоматическом внутричерепном заболевании) [17] сравнивало факторы риска в отношении расовых различий между чернокожими и европейцами. Они обнаружили, что чернокожие с внутричерепным стенозом чаще страдают гипертонией, диабетом, высоким уровнем ЛПНП и высоким общим холестерином. В других исследованиях сообщается, что по сравнению с экстракраниальным атеросклерозом внутричерепной атеросклероз не связан с типичными факторами риска периферического и коронарного атеросклероза: мужским полом и гиперхолестеринемией [3, 4].
Было обнаружено, что метаболический синдром, но не его отдельные компоненты, независимо связан с внутричерепным атеросклерозом, что позволяет предположить, что скрининг и лечение метаболических нарушений являются важной стратегией профилактики [30]. Исследование инсульта на Северном Манхэттене [31] также показало, что метаболический синдром представляет больший риск развития внутричерепных атеросклеротических инсультов по сравнению с экстракраниальными атеротромботическими и неатеротромботическими инсультами.
Другой недавний анализ [32] пациентов с WASID показал, что тяжесть стеноза наиболее сильно зависит от нарушения липидов, но также связана с диабетом и метаболическим синдромом.В исследовании также подчеркивается, что локализация внутричерепного стеноза зависит от различных сосудистых факторов риска, что позволяет предположить, что лежащая в основе патофизиология разных внутричерепных сосудов может быть различной.
2.4. Клинико-лучевая картина инсульта
Пациенты с внутричерепным атеросклеротическим поражением имеют ишемический инсульт на территории пораженной артерии. Механизмы, предложенные при ишемии, включают эмболию артерии в артерию, окклюзию местной ветви, нарушение гемодинамики в результате прогрессирующего сужения артерии или комбинацию этих факторов [33].
Радиологические проявления этих инсультов описаны в нескольких исследованиях. Эти проявления включают инфаркты коры головного мозга [34], инфаркты пограничной зоны [35, 36] и лакуны [37–39]. О множественных корковых и подкорковых инфарктах сообщалось в исследовании пациентов со стенозом СМА [33], и это было связано с наличием эмболических сигналов при транскраниальном допплеровском исследовании (ТКД) этих пациентов. Это открытие предполагает, что эмболия артерия-артерия является вероятным механизмом для этого подтипа инсульта.Инфаркты в области перфораторов СМА также были описаны в другом исследовании, основанном на магнитно-резонансной томографии (МРТ) [40], и предполагаемый механизм — окклюзия атеросклеротической ветви.
В литературе сообщается, что инфаркт как внутренней, так и кортикальной пограничной зоны на территории СМА является результатом ICAD [41, 42]. При прогрессирующем сужении крупной артерии происходит уменьшение кровотока, и, поскольку это происходит постепенно, образуются лептоменингеальные коллатерали. Когда компромисс достигает стадии, когда этих коллатералей недостаточно для поддержания перфузии в терминальные области, в этих пограничных зонах развиваются инфаркты [43].Множественные поражения в одностороннем переднем отделе кровообращения и небольшие рассеянные поражения на одной сосудистой территории также связаны с атеросклерозом крупных артерий [33, 44, 45].
2,5. Естественное течение и клинический прогноз
Естественное течение стеноза, вторичного по отношению к внутричерепному атеросклерозу, было ангиографически изучено Akins et al. [46]. В течение периода наблюдения 26,7 месяцев они сообщили об увеличении степени стеноза в группе MCA-ACA-PCA, тогда как внутричерепные стенозы ICA оставались стабильными.Они также сообщили о 14% регрессе внутричерепного стеноза ВСА и 28% регрессе в группе MCA-ACA-PCA. Они пришли к выводу, что внутричерепные поражения динамичны и могут прогрессировать или регрессировать со временем.
Исследование Kwon et al. [47], оценивая роль цилостазола в ICAD, описывает как прогрессирование, так и регресс этих поражений. В более позднем исследовании [48], в котором оценивалась роль цилостазола и клопидогреля при внутричерепном атеросклерозе, у 14% пациентов наблюдалось прогрессирование поражения.
ICAD также оценивали с точки зрения развития инсульта на территории пораженного сосуда. Риск будущих ишемических инсультов зависит от того, протекает ли сосуд бессимптомно или с симптомами. Это различие хорошо изучено в исследовании WASID [49]. Пациенты, включенные в исследование, хотя и имели симптомы, также имели бессимптомные стенозы в других артериях. При наблюдении за этими пациентами годовой риск развития инсульта на территории этих бессимптомных сосудов составлял 3.5% (ДИ 0,8% –9%). В отличие от этого, пациенты со стенозом ≥70% имели риск инсульта в течение одного года в 14% на той же территории и 19% для инсульта на любой сосудистой территории. Помимо тяжести стеноза, недавние симптомы и женский пол также предсказывали риск рецидива инсульта в этом исследовании [50]. Аналогичный уровень риска в 14% был зарегистрирован в исследовании GESICA (Groupe d’Etude des Sténoses Intra-Crâniennes Athéromateuses симптоматика) [51].
Подисследование WASID [52] показало, что наличие коллатералей является сильным предиктором последующего инсульта в случае стеноза средней и тяжелой степени, но более легкие стенозы более нестабильны, и наличие коллатералей в них предсказывает повышенный риск последующего инсульта. Инсульт.
2.6. Диагноз
У пациентов с клиническим подозрением на внутричерепные стеноокклюзионные поражения точная оценка внутричерепных артерий важна для принятия оптимальных терапевтических решений. Варианты визуализации пациентов с внутричерепным стенозом включают неинвазивные методы, такие как транскраниальная допплерография или магнитно-резонансная ангиография (MRA), такие как MRA с контрастным усилением (CE) и компьютерная томография CE CT.
Катетерная церебральная ангиография, хотя и инвазивная, считается золотым стандартом диагностики ICAD.Частота осложнений, связанных с процедурой, выполняемой обученными нейроинвазивными специалистами, значительно снизилась. В недавнем обзоре [53] шестилетних данных, основанных на 363 диагностических ангиографиях, сообщается о низкой частоте осложнений — 0,3% и еще более низком риске инсульта (0,03%).
MRA предлагается в качестве замены золотого стандарта внутриартериальной ангиографии. Трехмерная времяпролетная МРА в настоящее время является наиболее часто используемой импульсной последовательностью при оценке МРТ внутричерепных артерий.Он обнаруживает клинически значимые стенозирующие поражения внутричерепных сосудов. Другая потенциальная область применения — мониторинг реакции стенозирующего поражения на антистенозные препараты [47].
Как TOF MRA, так и CE MRA показали [54] высокую точность обнаружения стеноза и окклюзии ВСА высокой степени. CE MRA имеет некоторое преимущество перед TOF MRA. Однако при стенозе средней степени тяжести чувствительность обоих была от плохой (TOF-MRA) до удовлетворительной (CE MRA). Кроме того, 3D TOF-MRA может быть ограничено такими факторами, как артефакты восприимчивости вблизи клиновидной пазухи, ограниченный диапазон сканирования, ограниченное пространственное разрешение и потеря интенсивности сигнала потока из-за насыщения или фазовой дисперсии [55, 56].Участок внутричерепных сосудов около основания черепа и особенно паракавернозный и супраклиноидный сегменты внутренних сонных артерий являются областями, в которых стеноз часто переоценивается или недооценивается из-за наличия дефазирующих артефактов. Некоторые из этих ограничений можно преодолеть с помощью CE MRA, который не зависит от потока.
При использовании МРТ 3 тесла чувствительность TOF-MRA при стенозе> 50% составляет 78–85% с прогностической ценностью 75–79%, а для полных окклюзий — чувствительность и прогностическая ценность положительного результата. значения находятся в диапазоне 100% и 87% соответственно [57].
В недавней статье Arenillas [58] освещена новая концепция визуализации внутричерепных бляшек с использованием 3D TOF-MRA с высоким разрешением (3T). Это дает преимущество в характеристике бляшки, обнаружении нестенотической внутричерепной атеромы и обнаружении кровоизлияния в бляшку. Это еще не вошло в широкую клиническую практику из-за недоступности и ограниченной клинической ценности. Однако это интересно, потому что характеризует меньшую степень стеноза.
В сравнительном исследовании [59] оценивалась способность спиральной КТ-ангиографии (CTA) выявлять и количественно определять внутричерепной стеноз и окклюзию по сравнению с DSA (цифровой вычитающей ангиографией) и MRA.КТА выявила более высокую чувствительность, чем МРА, для внутричерепного стеноза (98% против 70%) и окклюзии (100% против 87%).
Транскраниальный допплер, TCD — еще один неинвазивный и простой в выполнении метод, используемый для оценки ICAD. Результаты исследования инсульта и нейровизуализации внутричерепного атеросклероза (SONIA) [60] показали, что и TCD, и MRA выявляют стеноз внутричерепных крупных сосудов от 50 до 99% со значительной отрицательной прогностической ценностью. Следовательно, оба могут надежно исключить наличие внутричерепного стеноза, хотя отклонения от нормы потребуют подтверждающего теста, такого как ангиография, для надежной идентификации стеноза.
Тем не менее, другое исследование [61] показывает, что передовые ультразвуковые методы, такие как визуализация потока мощности и дуплексная визуализация с использованием цветного допплера с контрастом и без него, имеют лучший результат для обнаружения окклюзии и полной окклюзии.
Доступные неинвазивные методы визуализации, их чувствительность и специфичность обнаружения в отношении степени стеноза перечислены в таблице 2. В целом, неинвазивные методы визуализации имеют высокую отрицательную прогностическую ценность при обнаружении внутричерепного атеросклероза.Золотым стандартом подтверждения диагноза остается внутриартериальная ангиография.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CDDI: с помощью цветного допплера дуплексная визуализация, PFI: визуализация потока мощности. * Данные представлены в процентах с использованием DSA в качестве эталонного стандарта. ‡ Североамериканское испытание по симптоматической эндартерэктомии сонной артерии (NASCET) использовалось для расчета стеноза: [(− 𝐷𝑠) / ×] × 100, где normal — нормальный диаметр, а diameter — диаметр стеноза. Стенозы NASCET были сгруппированы по следующей шкале: нормальные (0–9%), легкие (10–29%), средние (30–69%), тяжелые (70–99%) или окклюзионные ( потока не обнаружено). Нормальный (0–9%) и легкий (10–29%) стеноз не считались пораженными сегментами сосудов и исключались из анализа. † Энергия и усиление ультразвукового излучения не могут быть увеличены до достаточно высокого уровня без появления мешающего акустического шума, который снижает надежность отображения сигналов ортогонального потока. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3. Лечение атеросклеротического внутричерепного стеноза
3.1. Медицинский менеджмент
Медикаментозное лечение внутричерепного атеросклеротического заболевания оценивалось в нескольких исследованиях за последнее десятилетие. Нет данных о первичной профилактике инсульта у пациентов с бессимптомным стенозом.
Эффективность аспирина во вторичной профилактике ишемических инсультов неоспорима. Начиная с международного исследования инсульта — IST и китайского исследования острого инсульта — CAST [63, 64], это стандарт лечения. Для внутричерепных атеросклеротических инсультов он никогда не тестировался изолированно, но, экстраполируя эти данные, польза распространяется на все подтипы инсульта.
Для вторичной профилактики было показано, что антикоагулянтная терапия варфарином менее безопасна и равна по эффективности аспирину в исследовании WASID (варфарин по сравнению с аспирином при симптоматическом внутричерепном заболевании) [49].WASID был прекращен рано после среднего периода наблюдения 1,8 года из-за более высоких показателей смертности и серьезных кровотечений в группе варфарина. Частота инфаркта миокарда или внезапной смерти также была выше в группе варфарина. Первичная конечная точка ишемического инсульта, кровоизлияния в мозг или сосудистой смерти наступила у 22,1% пациентов в группе аспирина и у 21,8% пациентов в группе варфарина. До WASID считалось, что варфарин может быть полезен пациентам с вертебробазилярной болезнью, но исследование не показало значительно более низкую частоту первичной конечной точки или инсульта в группе, принимавшей варфарин [65], что свидетельствует об отсутствии четких доказательств превосходства. варфарина по сравнению с аспирином для пациентов с вертебробазилярным стенозом.
Эффективность других антиагрегантов оценивалась в нескольких других исследованиях, и аспирин / дипиридамол с пролонгированным высвобождением [66] рекомендуется вместо аспирина для вторичной профилактики всех ишемических инсультов. Клопидогрель [67] также превосходил аспирин по составным сосудистым конечным точкам. Таким образом, хотя эти агенты и не являются специфическими для подтипа, они играют определенную роль в ишемических инсультах. Другое более недавнее исследование (схема профилактики для эффективного предотвращения повторных инсультов — PRoFESS) показало схожую частоту рецидивов инсульта у пациентов с различными основными причинами инсульта и в подгруппе пациентов с атеросклерозом крупных артерий при лечении одним клопидогрелом по сравнению с комбинацией аспирина / дипиридамол пролонгированного действия [68].
Следовательно, согласно рекомендации Американской ассоциации инсульта [69], только аспирин, аспирин / дипиридамол с пролонгированным высвобождением и только клопидогрель являются приемлемыми вариантами для профилактики вторичного инсульта после некардиоэмболического ишемического инсульта, включая атеросклеротический инсульт крупных артерий.
Недавнее исследование [70], посвященное изучению роли комбинации антитромбоцитов (аспирин + клопидогрель) в лечении острого инсульта, вторичного по отношению к атеросклерозу крупных артерий, показало многообещающие.Исследование показало, что ранняя комбинированная терапия (в течение 7 дней с момента появления симптомов) была более эффективной, чем один аспирин, в снижении микроэмболических сигналов в симптоматических артериях этих пациентов. Еще предстоит оценить, приведет ли это к клинической пользе.
Цилостазол — новый антиагрегант, который исследуется на предмет внутричерепного стеноза. Это ингибитор фосфодиэстеразы 3, который ингибирует рост гладкомышечных клеток in vitro и обладает антиатерогенным и антипролиферативным действием в дополнение к антиагрегантным эффектам.Первое исследование [47], оценивающее цилостазол рандомизированным образом, вышло в 2005 году. В этом исследовании в течение 6-месячного периода наблюдения не было инсультов в группе цилостазол + аспирин или плацебо + аспирин. Однако прогрессирование внутричерепного стеноза было значительно меньше в группе цилостазола (6,7% против 28,8%;).
Это открытие привело к многоцентровому исследованию цилостазол + аспирин по сравнению с клопидогрелом + аспирином у пациентов с симптоматическим внутричерепным стенозом, испытанию цилостазола при симптоматическом стенозе внутричерепных артерий II (TOSS II) [48].В TOSS II было включено 456 пациентов с острым ишемическим инсультом с симптоматическим стенозом внутричерепных артерий. После 7 месяцев лечения контрольная МРА показала несколько более низкую, но значительную скорость прогрессирования (9,90% против 15,46%) и более высокую скорость регресса (30,20% против 23,67%) симптоматического стеноза в группе цилостазола по сравнению с группой клопидогрела, соответственно. Больше пациентов в группе цилостазола имели новые бессимптомные ишемические поражения при контрольной МРА, чем пациенты, получавшие клопидогрель (18,68% против 12.04%), так и на территории симптоматического внутричерепного стеноза (12,09% против 8,90%), но это различие не было статистически значимым. Статистически значимой разницы в частоте клинических проявлений в зависимости от группы лечения не было, хотя при приеме цилостазола события, как правило, были более частыми. При приеме клопидогрела частота кровотечений была незначительно выше. Таким образом, комбинированная терапия цилостазолом оказала благоприятный эффект на общее изменение симптоматического внутричерепного атеросклеротического стеноза, но в этом исследовании это не привело к лучшим клиническим исходам.
В пилотном исследовании [71] китайских пациентов с ишемическим инсультом было проведено рандомизированное сравнение аспирина с цилостазолом. В группе цилостазола было меньше ишемических и геморрагических инсультов, что позволяет предположить, что он может быть более безопасным и эффективным по сравнению с аспирином. Исследование профилактики инсульта с цилостазолом 2 — CSPS-2 [72] — более недавнее рандомизированное исследование, которое показало, что цилостазол не уступает и может превосходить аспирин в профилактике повторного инсульта у пациентов с некардиоэмболическим ишемическим инсультом.Одна треть пациентов в этом исследовании страдала атеросклерозом крупных сосудов.
Управление факторами риска
WASID представил дополнительные данные, подтверждающие агрессивный контроль факторов риска у пациентов с внутричерепным стенозом. В WASID факторы сосудистого риска контролировались в соответствии с национальными рекомендациями [48]. Однако у многих пациентов контроль факторов риска не был оптимальным, и пациенты с плохим контролем факторов риска имели более высокую частоту повторных сосудистых событий [73, 74].
Подисследование WASID [74] продемонстрировало, что повышенное артериальное давление было связано с повышенным риском ишемического инсульта и других серьезных сосудистых событий.В отличие от общепринятой практики разрешающей гипертензии при стенозе высокой степени, это исследование не показало повышенного риска при поддержании артериального давления в нормальном диапазоне. Полученные данные нельзя распространить на пациентов с острой нестабильностью, но в остальном следует соблюдать рекомендации по контролю артериального давления.
Повышенный уровень ЛПНП также связан с высоким риском последующих событий в исследовании WASID [73]. Хотя разница не достигла статистической значимости, у пациентов с ЛПНП <70 было меньше сосудистых событий, чем у пациентов с уровнями ≥70.Основываясь на этих данных и исследовании SPARCL (предотвращение инсульта путем агрессивного снижения уровня холестерина) [75], рекомендуется агрессивное снижение липидов с помощью статинов у пациентов с атеросклеротическим ишемическим инсультом.
Другое субисследование WASID [76] продемонстрировало, что метаболический синдром связан с внутричерепным атеросклерозом и повышает риск серьезных сосудистых событий у этих пациентов. Следовательно, это важная дополнительная цель как для первичной, так и для вторичной профилактики внутричерепных атеросклеротических инсультов.
Короче говоря, у пациентов с внутричерепным атеросклерозом необходим лучший контроль факторов риска, способствующих развитию атеросклероза, таких как диабет, употребление табака и особенно гипертония, дислипидемия и метаболический синдром.
3.2. Эндоваскулярная терапия
В более ранних сообщениях интракраниальная ангиопластика имела высокий риск осложнений, и от процедуры отказались [77]. С тех пор несколько факторов привлекли повышенное внимание к внутричерепной ангиопластике и стентированию.К ним относятся достижения в области микрокатетерных и баллонных технологий, высокий риск повторного инсульта у пациентов с внутричерепным стенозом, несмотря на лечение в рамках WASID, и успех эндоваскулярных методов лечения ишемической болезни сердца [78].
3.3. Ангиопластика
Данные по ангиопластике без стентирования ограничены только ретроспективными исследованиями. Эти исследования сообщают о высоком техническом успехе (снижение стеноза до менее чем 50%). Однако также сообщалось о частоте рестеноза до 50% [79].В этом исследовании сообщается о перипроцедурной смертности и частоте инсультов 8,3% и годовом риске инсульта 4,4%. Процедура связана с такими осложнениями, как расслоение интимы, образование тромба и разрыв сосуда [80]. Отдаленные результаты после баллонной ангиопластики также еще предстоит изучить.
3.4. Стентирование
Стентирование можно использовать в качестве дополнения к баллонной ангиопластике для предотвращения отскока бляшки и для покрытия бляшки или лоскута интимы. Это также может снизить вероятность расслоения сосуда.
Первым проспективным испытанием стентирования было SSYLVIA (стентирование симптоматических атеросклеротических поражений позвоночных или внутричерепных артерий) [81], проведенное в 2004 году. Это было многоцентровое испытание использования голого металлического стента для симптоматической ВКАД. В нем сообщается, что уровень технического успеха составил 95%, 30-дневный риск инсульта — 6,6%, а риск 1-летнего инсульта — 8,5%. О смертельных случаях не сообщалось. Хотя частота рестенозов составляла 35%, большинство из них протекало бессимптомно.
В следующем крупном испытании по стентированию использовался Wingspan [82], который представляет собой гибкий саморасширяющийся стент, устанавливаемый на микрокатетере.Это исследование также было проспективным многоцентровым исследованием с участием 45 пациентов, рефрактерных к медикаментозной терапии. Авторы сообщили о частоте технических успехов 97,7%, 30-дневном инсульте или смертности 4,5% и 1-летнем инсульте 9,3%. Частота рестеноза у них была выше на 7,5% через 6 месяцев, и все они протекали бессимптомно. Данные долгосрочного наблюдения теперь доступны для Wingspan [83], и они сообщают о частоте рестенозов в диапазоне 25–32%, хотя большинство из них все еще протекает бессимптомно.
В серии небольших случаев сообщается об использовании металлических стентов с баллонным креплением и стентов с лекарственным покрытием.Первые ограничены их жесткостью, а вторые — отсутствием долгосрочных данных по безопасности. Куреши и др. [84] и Gupta et al. [85] сообщают об использовании стентов с лекарственным покрытием у небольшого числа пациентов с хорошими краткосрочными результатами в плане рестеноза. Эти пациенты должны проходить длительную антиагрегантную терапию не менее 12 месяцев из-за риска подострого и позднего тромбоза. Следовательно, несмотря на то, что это технически безопасно и выполнимо, существует необходимость в долгосрочном исследовании.
Сравнительное исследование [86] первичной ангиопластики и стентирования не выявило разницы в показателях выживаемости без инсульта через 2 года.В другом систематическом обзоре [87], однако, сообщается о более высоком уровне инсульта и смерти в течение 1 года в группе, получавшей ангиопластику, по сравнению с пациентами, получавшими стент (20 против 14%).
Также было проведено сравнение агрессивного медицинского лечения и эндоваскулярного лечения с помощью Wingspan Jarvis et al. [88]. Они сообщают о 13% случаев инсульта или смерти через 6 месяцев при размахе крыльев и 16% при лечении.
На основании этих данных в ноябре 2008 г. было начато проспективное рандомизированное исследование стентирования в сравнении с агрессивным медикаментозным лечением для предотвращения повторного инсульта при внутричерепном стенозе (SAMMPRIS) [89] для сравнения только интенсивной медикаментозной терапии со стентированием и интенсивной медикаментозной терапией.Совсем недавно исследование было остановлено, и набрано всего 59% от запланированного числа пациентов. Основная причина такого преждевременного прерывания — неприемлемо высокая частота осложнений в группе стентирования (14% пациентов перенесли инсульт или умерли в течение 30 дней после стентирования по сравнению с 5,8% в группе лечения) [90]. Одним из важных выводов этого исследования является гораздо более низкая частота рецидивов инсульта, чем сообщалось ранее. Интересно, что эти пациенты получали комбинированную антитромбоцитарную терапию.Следовательно, агрессивное медицинское лечение вполне может быть шагом вперед для большинства пациентов.
3.5. Хирургическое лечение
Как и при аортокоронарном шунтировании, предполагается, что подгруппе пациентов с внутричерепным стенозом может быть полезно наружное шунтирование на внутреннее сонное шунтирование. Эти пациенты имеют плохой гемодинамический резерв. Для оценки гемодинамики предлагается несколько методов, включая ПЭТ, ОФЭКТ, ТКД, КТ и перфузию МРТ. При более эффективном использовании этих методов может быть легче идентифицировать пациентов, которым может помочь такая процедура обходного анастомоза.В настоящее время проводятся два испытания для определения эффективности такого шунтирования, одно в США (исследование хирургии окклюзии сонной артерии — COSS), а другое — в Японии (японское исследование шунтирования EC-IC — JET) [91, 92]. До вынесения окончательного вердикта процедуру нельзя широко рекомендовать (Таблица 3).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| † Первичные конечные точки: смерть, ишемический инсульт, обширное кровотечение или смерть от сосудистых причин, отличных от инсульта.Вторичные конечные точки: ишемический инсульт или кровоизлияние в мозг, ишемический инсульт, ишемический инсульт на территории стенозированной артерии, инвалидизирующий или фатальный ишемический инсульт, ишемический инсульт, инфаркт миокарда или смерть от сосудистых причин, отличных от инсульта. ‡ За исключением одного случая, когда 66% остаточного стеноза оставалось, а ипсилатеральный инсульт произошел через 7 месяцев. μ Прогрессирование: ухудшение стеноза на 1 или более баллов при окончательной МРА по сравнению с исходной МРА. Регресс: улучшение стеноза на 1 или более баллов. * Частота инсульта у пациентов со стенозом сонной артерии или СМА. ¥ Ишемический инсульт или кровоизлияние в мозг. ∧ Ишемический инсульт. †† Ишемический инсульт на территории стенозированной артерии. ¶ Выведение из строя или ишемический инсульт со смертельным исходом. *** Ишемический инсульт, инфаркт миокарда или смерть от сосудистых причин, отличных от инсульта. ∞ Смерть от сосудистых причин. ** Смерть от несосудистых причин. ® Большое кровотечение. ®® Инфаркт миокарда. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4. Обзор терапевтических возможностей
В настоящее время антиагрегантное лечение является основой терапии симптоматического внутричерепного стеноза. Лучше всего изучен аспирин, но в острой фазе можно использовать двойные антитромбоцитарные препараты аспирин / дипиридамол с пролонгированным высвобождением или аспирин плюс клопидогрель.При длительном применении комбинация аспирина и клопидогреля может быть небезопасной, поэтому следует использовать только клопидогрель. Цилостазол из-за его плейотропных эффектов показал себя многообещающим для азиатов.
Агрессивный контроль факторов риска рекомендуется как для симптоматических, так и для бессимптомных заболеваний. Это включает в себя агрессивный контроль артериального давления и холестерина ЛПНП в частности, а также других факторов риска атерогенности, таких как диабет и употребление табака в целом.
Эндоваскулярное лечение с ангиопластикой и стентированием становится многообещающим методом лечения стеноза высокой степени у пациентов с неэффективным лечением.SAMMPRIS был остановлен из-за побочных эффектов в группе вмешательства [90]. Долгосрочные результаты процедуры еще неизвестны, рестеноз является обычным явлением, и, следовательно, его нельзя широко рекомендовать.
Хирургическое лечение с помощью шунтирования EC-IC также оценивается в двух рандомизированных исследованиях. В ожидании результатов этот метод также имеет ограниченное применение.
5. Заключение
5.1. Известные факты о ICAD
Внутричерепной атеросклеротический стеноз может быть наиболее частой причиной инсульта во всем мире.В основном страдают азиаты по сравнению с другими расами. Различные генетические факторы и факторы окружающей среды считаются предрасполагающими факторами. Хотя внутриартериальная ангиография является золотым стандартом для определения степени стеноза, неинвазивные методы, включая УЗИ ТКД и МРА TOF, были признаны надежными методами исключения стеноза от умеренного до тяжелого (50–99%). Кроме того, CTA и PFI могут использоваться для правильного определения степени тяжелого стеноза.
С точки зрения вторичной профилактики инсульта, вызванного внутричерепным атеросклеротическим стенозом, аспирин по-прежнему является предпочтительным антиагрегантом из-за его эффективности по сравнению с новыми методами антиагрегантной терапии.Однако среди азиатов цилостазол показал благоприятный эффект при симптоматическом стенозе и имеет преимущество в плане уменьшения кровотечений. Комбинированная терапия показала себя многообещающей. Более того, агрессивное управление факторами риска, то есть снижение артериального давления и уровней ЛПНП, снижает риск сосудистых событий. Эндоваскулярная терапия все еще находится в стадии исследования. Хирургическое лечение, то есть шунтирование EC-IC, не дало каких-либо преимуществ, но может быть полезным у отдельных пациентов с плохим гемодинамическим резервом.
5.2. Неизвестные факты о ICAD
Поскольку азиаты подвергаются особому риску инсульта, вторичного по отношению к внутричерепному атеросклеротическому стенозу, исследования по локализации генетических маркеров, ответственных за это расовое преобладание в распределении поражений, будут представлять интерес. Следует изучить значение раннего выявления и лечения бессимптомного внутричерепного стеноза с точки зрения пользы как метода профилактики инсульта. Неинвазивные диагностические методы, которые могут надежно определить степень легкого и умеренного внутричерепного стеноза, еще не определены и необходимы.Роль антиагрегантов, отличных от аспирина, в комбинации или в качестве единой терапии, все еще может быть дополнительно исследована для продвижения текущих вариантов лечения. Эндоваскулярная терапия все еще находится на стадии исследований и все еще связана с побочными эффектами.
5.3. Будущие направления
Проведенные интервенционные исследования внутричерепного атеросклеротического стеноза до сих пор проводились только среди кавказцев. Поскольку известно, что предпочтение отдается азиатской популяции, необходимо провести целенаправленные испытания, чтобы определить наиболее эффективные методы лечения в этой популяции.Кроме того, они могут быть сосредоточены на профилактике, поскольку вмешательство стоит дорого и требует технических знаний в странах с низким и средним уровнем доходов, где эти ресурсы скудны. Скрининг внутричерепного стеноза требует дальнейшего изучения. Необходимы неинвазивные методы диагностики, которые могут надежно идентифицировать все степени стенозов. Для пациентов с симптомами это поможет в принятии управленческих решений, а для бессимптомных пациентов они могут помочь изучить роль профилактической терапии.
Благодарности
М.Хан — научный сотрудник по нервно-сосудистым заболеваниям, обучение которого в настоящее время финансируется премией No. D43TW008660 из Международного центра Фогарти. Авторы несут исключительную ответственность за содержание и не обязательно отражают официальную точку зрения Международного центра Фогарти или Национальных институтов здравоохранения. А. Камаль является главным исследователем исследования внутричерепного стеноза в Карачи (KISS), финансируемого Комиссией по высшему образованию правительства Пакистана.
Перспективно ли лечение симптоматического внутричерепного атеросклеротического стеноза в будущем?
Внутричерепной атеросклеротический стеноз (ICAS) — одна из наиболее частых причин инсульта; у него самая высокая частота рецидивов по сравнению с другими этиологиями.1 ICAS особенно распространен среди азиатов.2 Результаты китайского исследования внутричерепного атеросклероза показали, что распространенность симптоматического ICAS (sICAS) достигает 46%. 12,2% и 15% .3 4 Мы понимаем, что следующие патологические причины могут объяснить высокую частоту рецидивов при sICAS. Во-первых, пациенты с ICAS подвержены гипоперфузионной гемодинамике, особенно при плохих побочных условиях.5 Исследования связи между контролем артериального давления (АД) в острой стадии и клиническими исходами противоречивы, подтверждая эту гипотезу. 6 Во-вторых, бляшки в стенозированных артериях обычно очень уязвимы (из-за больших липидных ядер, тонких фиброзных колпачков и кровоизлияния в бляшки). 7 Эти бляшки склонны к разрыву в артерии, расположенные ниже по течению, что приводит к эмболическому инсульту на территории ответственной артерии.5 Кроме того, у этих пациентов часто наблюдаются сопутствующие заболевания с повышенными факторами риска, которые сильно коррелируют с рецидивом инсульта, включая гипертензию, метаболические нарушения, дислипидемию. .8
Следовательно, существует острая необходимость в стандартизации оценки и управления sICAS. В настоящее время лечение sICAS в первую очередь направлено на вторичную профилактику для уменьшения рецидивов инсульта. Терапевтические методы включают антитромбоцитарную терапию, интервенционную терапию и контроль факторов риска.9 Два важных исследования: исследование симптоматического внутричерепного заболевания варфарином и аспирином (WASID) 3 и Стентирование и агрессивное медицинское лечение для предотвращения повторного инсульта при внутричерепном стенозе (SAMMPRIS) 4 Цель исследования чтобы предоставить обновленную стратегию для клинической практики.
Исследование WASID с двойным слепым многоцентровым рандомизированным контрольным клиническим исследованием было направлено на оценку эффективности и безопасности варфарина по сравнению с аспирином у пациентов со степенью ICAS 50–99%. Аспирин оказался столь же эффективным и безопасным. Это привело к исследованию двойной антитромбоцитарной терапии для вторичной профилактики у пациентов с sICAS. Клопидогрель плюс аспирин по сравнению с одним аспирином для уменьшения эмболизации у пациентов с острым симптоматическим стенозом церебральной или сонной артерии10 Испытание показало, что у пациентов в группе sICAS двойная антиагрегантная терапия снижала микроэмболические сигналы, обнаруживаемые транскраниальным допплеровским ультразвуком (TCD) (31% против 54 %, снижение относительного риска 42.4%, 95% ДИ от 4,6% до 65,2%, p = 0,025) на 2-й день включения в исследование, что может дополнительно снизить рецидивы эмболического инсульта артериального происхождения у этих пациентов. Исследование клопидогреля у пациентов из группы высокого риска с острыми не инвалидизирующими цереброваскулярными событиями11, опубликованное в 2013 году, впервые подтвердило пользу двойной антитромбоцитарной терапии при незначительных инсультах и транзиторных ишемических атаках высокого риска. Он показал, что комбинированное применение клопидогреля и аспирина, начатое в течение 24 часов и продолженное до 21 дня, превосходит монотерапию аспирином в снижении риска инсульта в первые 90 дней.В анализе подгрупп ICAS 12 было обнаружено, что двойная антитромбоцитарная терапия имела тенденцию к уменьшению рецидивов инсульта по сравнению с моноантитромбоцитарной терапией через 90 дней, но не была статистически значимой из-за ограниченного числа включенных участников.
интервенционной терапии за пределами обычной реперфузии окна терапевтического времени при остром ишемическом инсульте (АИСЫ) считаются изменением стенозированного статуса, улучшить гемодинамику и дальнейшее снижение рецидивов инсульта, но его эффективность остается спорной.В исследовании SAMMPRIS Chimowitz и его коллеги4 попытались выяснить, полезны ли ангиопластика или стентирование в сочетании с медикаментозной терапией для пациентов с sICAS по сравнению с одной медикаментозной терапией. В исследование был включен 451 пациент со стенозом 70–99% sICAS в течение 30 дней от начала исследования. В течение 30-дневного периода наблюдения 14,7% в группе стентирования достигли первичных конечных точек рецидива инсульта или смерти по сравнению с только 5,8% в группе медицинского наблюдения (p = 0,002). Интересно, что авторы дополнительно проанализировали исходы для тех пациентов, которые соответствовали критериям SAMMPRIS из исследования WASID: 13 частота рецидивов инсульта через 30 дней и год и смертность в исследовании WASID намного выше, чем в исследовании SAMMPRIS (10 .5% против 5,8%, 21,9% против 12,6% соответственно, p = 0,009). Интерпретируя результаты, авторы обнаружили, что агрессивный контроль факторов риска и идеальная цель в медицинской группе SAMMPRIS Trial могут способствовать различию. Таким образом, агрессивное медикаментозное лечение по-прежнему остается основной терапевтической стратегией вторичной профилактики sICAS.
Несмотря на появляющиеся результаты исследований, в клинической практике все еще сохраняется множество проблем и опасений. Цели управления факторами риска еще не проверены.Большинство факторов риска sICAS контролируются в соответствии со стандартами SAMPPRIS: систолическое артериальное давление (САД) ≤140 мм рт. 1,8 ммоль / л. Повышенное САД тесно связано с высокой частотой рецидивов при ICAS14. Однако для пациентов с АИС со стенозом крупных внутричерепных сосудов и потенциалом гипоперфузионных нарушений идеальное целевое значение АД и время начала лечения остаются неясными. Разумно предположить, что многие врачи с осторожностью относятся к антигипертензивной терапии у пациентов с ВСАС, особенно в острой стадии.
Что касается дислипидемии, то исследование «Профилактика инсульта путем агрессивного снижения уровня холестерина» (SPARCL) 15 продемонстрировало очевидное снижение частоты рецидивов инсульта при интенсивной терапии статинами. Но поскольку SPARCL специально не фокусировался на пациентах с ICAS, этот результат следует интерпретировать с осторожностью. О значении статиновой терапии в снижении рецидивов инсульта при ICAS сообщалось только в обсервационных исследованиях.
Более того, несмотря на агрессивное лечение, некоторые пациенты с sICAS по-прежнему сталкиваются с высокой частотой рецидивов инсульта.Многие исследователи пытались улучшить текущую стратегию лечения. Например, прибегают к новым антиагрегантам, таким как цилостазол17 и тикагрелор.18 Но эффективность этих антиагрегантов еще не установлена. Кроме того, у некоторых пациентов с ICAS не наблюдается удовлетворительного снижения уровня ХС-ЛПНП при интенсивной терапии статинами. Таким образом, альтернативным выбором могут быть ингибиторы пропротеинконвертазы субтилизин-кексин типа 9, такие как алирокумаб, 19, которые могут значительно снизить уровни ХС-ЛПНП.Но их применению в лечении ICAS еще предстоит пройти долгий путь.
Кроме того, остается неопределенной роль хирургических методов, таких как вмешательство в sICAS. Согласно недавним успешным рандомизированным контролируемым испытаниям (РКИ), реперфузионная терапия была лечением первой линии при АИС с окклюзией большой артерии в течение терапевтического временного окна. Терапия ишемического инсульта21 Испытания не смогли доказать важность стентирования перед агрессивным лечением.Некоторые опасения возникли в отношении результатов этих двух испытаний: участники отбирались только через тяжелый стеноз, независимо от их состояния перфузии или коллатерального кровообращения; относительный ограниченный опыт субцентров; Устройства второй линии, использованные в этих исследованиях, могут не подходить для всех сложных сосудистых ситуаций. В недавнем китайском реестре sICAS (NCT01968122) 22 всех участника были зарегистрированы по поводу этиологии гипоперфузии с плохими коллатералями в течение 90 дней после начала и получили индивидуальное эндоваскулярное лечение.У пациентов было 4,3% и 8,1% рецидивов инсульта через 30 дней и 1 год, соответственно, 22 23, что значительно ниже, чем в исследовании SAMMPRIS. Несмотря на этнические различия между различными испытаниями, мы считаем, что результаты китайского испытания были лучше, в основном из-за очень избирательного набора пациентов. Особенно необходимы будущие РКИ, сравнивающие индивидуально подобранное стентирование с медикаментозной терапией у специально отобранной группы пациентов. Другая хирургическая альтернатива, которую следует рассмотреть, — это экстракраниально-интракраниальное (ЭК-ВК) шунтирование.В недавнем когортном исследовании 24 поверхностное обходное шунтирование височной и средней церебральной артерии у тщательно отобранных пациентов с тяжелым внутричерепным стеноокклюзионным заболеванием могло улучшить параметры церебральной гемодинамики, что в дальнейшем предотвратило рецидив ишемического инсульта в течение 34 месяцев наблюдения. Однако отсутствуют высокоуровневые доказательства РКИ по индивидуальной оценке, а показания и эффективность шунтирования EC-IC все еще остаются спорными.
Наконец, процесс распознавания и оценки характеристик ICAS все еще продолжается.Обычно используемые методы оценки сосудов и перфузии включают ТКД, МР-ангиографию, маркировку спина артерий, КТ-ангиографию, КТ-перфузию, цифровую вычитающую ангиографию. По сравнению с вышеуказанными методами визуализации МРТ высокого разрешения (HR-MRI), которая может предоставить дополнительную ценную информацию о диагностике ICAS и бляшек, была дополнительно изучена и широко используется. HR-MRI может, в частности, обнаруживать компоненты бляшки, морфологию сосудистой стенки и тромб в просвете.7 Клинические исследователи рассматривали вариацию характеристик бляшки на HR-MRI в качестве основных конечных точек для дальнейшего использования в клинической практике.Одним из направлений в будущем должны стать исследования по выявлению эффекта медикаментозной терапии под контролем HR-MRI в ICAS. Более того, недавнее исследование метода вычислительной гидродинамики (CFD) 26, обеспечивающего неинвазивное использование динамических характеристик, таких как транслезионное соотношение давления и транслезионное напряжение сдвига стенки, а также клиническая значимость пациентов с ICAS, могут быть многообещающим и полезным руководством для улучшенная индивидуализированная стратегия вторичной профилактики.
В заключение, sICAS был одним из самых распространенных случаев инсульта во всем мире.Антитромбоцитарная терапия, интервенционная терапия и контроль критических факторов риска являются основными терапевтическими подходами. Для дальнейшего уменьшения рецидивов инсульта и улучшения результатов потенциальной стратегией лечения могут быть альтернативные препараты для снижения уровня тромбоцитов и липидов, более точные цели для контроля факторов риска и проверка конкретных пациентов, получающих пользу от интервенционной терапии. Новые методы визуализации, такие как HR-MRI и CFD, могут дать подробное представление о патологии и механизме, что важно для управления факторами риска и снижения риска повторного инсульта при sICAS.В будущем для индивидуализированной вторичной профилактики необходимы крупномасштабные исследования с более конкретными данными о пациентах.
Внутричерепное атеросклеротическое заболевание — Практическая неврология
Внутричерепное атеросклеротическое заболевание (ICAD) может поражать церебральные артерии дистальнее внутренних сонных артерий (ICA) после того, как они входят в каменистую кость (сегмент C2) и позвоночные артерии после того, как они входят в большое затылочное отверстие и прокалывают твердую мозговую оболочку (сегмент V4). 1 Таким образом, ICAD не поддается хирургической реваскуляризации, что делает его совершенно другим и независимо важным заболеванием от экстракраниальной каротидной болезни. В исследованиях аутопсии на ICAD приходилось 10% инсультов, 2 , а в объединенном анализе 2593 пациентов он, по крайней мере, в некоторой степени присутствовал у 3,5–13% населения, в зависимости от возраста и этнической принадлежности. 3 Для практикующего невролога диагностика и лечение ICAD может быть сложной задачей, потому что это может маскироваться под другие состояния и путаться с ними, а также потому, что ICAD ассоциируется с высокой частотой повторных инсультов.Здесь мы кратко обсуждаем эпидемиологию и патофизиологию ICAD, а также стратегии неотложного и долгосрочного лечения.
Эпидемиология
Факторы риска для ICAD делятся на изменяемые и немодифицируемые категории. Гипертония, сахарный диабет, гиперлипидемия и курение являются наиболее типичными модифицируемыми факторами риска. Возраст, раса и пол являются наиболее типичными из немодифицируемых факторов риска. Хотя заболевание с ранним началом хорошо описано в определенных группах населения, клинически значимая атеросклеротическая бляшка обычно не появляется до четвертого десятилетия жизни, а самая высокая скорость развития значительного ВКАД приходится на шестой и седьмой десятилетия. 4 У мужчин более высокий уровень развития ВКАД в течение четвертого и пятого десятилетий, в то время как у женщин, как правило, зубной налет появляется только в шестом десятилетии. Азиатское, чернокожее и испаноязычное население затронуто больше, чем белое население, хотя распространенность в этой последней группе выше, чем принято думать. 5,6 В частности, азиаты имеют более высокое бремя ICAD, при этом одно исследование показывает, что на него приходится от 33% до 37% этиологии ишемического инсульта в Китае. 7 Считается, что, по крайней мере, часть этих этнических различий связана с более высоким уровнем неконтролируемой гипертонии, диабета и гиперлипидемии в азиатском, испаноязычном и чернокожем населении, хотя генетическая предрасположенность также может существовать. 7
Механизм инсульта в ICAD
ICAD может вызвать инсульт с помощью нескольких различных механизмов, о которых можно судить по картине инфаркта на МРТ. Эмболия артерии от разорванной бляшки и тромбоокклюзия пораженной артерии обычно связаны с территориальной картиной инфаркта через окклюзию стенозированной артерии или ее более дистальных ветвей, что приводит к инфарктам, размер которых обычно превышает 1.5 см. 8 Другой механизм, гипоперфузия дистальнее стенозированной артерии, вызывает инфаркты пограничной зоны либо во внутренней пограничной зоне, включающей лучистую корону и полуовалентный центр, либо в кортикальных пограничных зонах между передней мозговой артерией (ПМА) и средней мозговой артерией (СМА). ), или сосудистых территорий СМА-задней мозговой артерии (ЗМА). Атероматозное вторжение в отверстие или устье малых перфораторов, вызывающее окклюзию, приводит к субкортикальному перфорационному типу инфаркта (атероматоз ветвей) с инфарктами обычно менее 1.5 см. 8,9 Часто встречаются смешанные паттерны (например, стеноз высокой степени, вызывающий пограничную зону, и паттерны эмболии), и могут быть вызваны эндотелиальными аномалиями из-за ICAD, вызывающими образование сгустка и дистальной эмболизацией, усугубляемой гипоперфузией, препятствующей соответствующему вымыванию эмболов на границе зоны. 10
Естественная история
Естественная история пациентов с ВКАД включает 3 преобладающих курса, которые могут сосуществовать: транзиторная ишемическая атака (ТИА), рецидивирующий ишемический инсульт и хроническая гипоперфузия, которая может вызывать кумулятивное повреждение белого вещества и постепенное ухудшение когнитивных функций. 7 Среди проявлений ТИА ТИА с дрожанием конечностей являются своеобразными преходящими симптомами, часто связанными со стенозом высокой степени, часто в ВСА. Обычно они проявляются в виде повторяющихся непродолжительных парез и «тряски», иногда вызванных физической нагрузкой, вызванных измененной цереброваскулярной гемодинамикой. 11 Было показано, что рецидивирующий ишемический инсульт, ипсилатеральный по отношению к стенозированной артерии, колеблется от 3,1% до 8,1% в год с годовой смертностью от 7,8% до 17,2%. 12 Как правило, самый высокий риск повторного инсульта приходится на первые 2 года, независимо от местоположения ICAD, и половина этого риска приходится на первый месяц индексного инсульта или ТИА.Меньше исследований прогрессирующих когнитивных последствий ICAD. Однако в предыдущем исследовании было отмечено, что у 34% субъектов деменция была связана в первую очередь с ВКАД. 13
Оценка и диагностика
Оценка изображений
Хотя катетерная ангиография считается золотым стандартом диагностического исследования ICAD, ее инвазивность наряду с улучшениями в КТ и магнитно-резонансной ангиографии (МРА) заставила практику использовать эти последние методы в качестве первичного инструмента первичного скрининга.Транскраниальный допплер (ТКД) ультразвук также может предоставить дополнительную информацию о стабильности бляшек посредством обнаружения микроэмболий, вазомоторной реактивности в ответ на воздействие углекислого газа и сужения просвета на основе повышенной средней скорости кровотока. 14 МРТ-визуализация сосудистой стенки недавно была использована для более точной характеристики морфологии бляшек. 15 На практике КТ-ангиография часто особенно полезна для выявления областей кальцифицируемого атеросклеротического заболевания и позволяет достичь пространственного разрешения для более точной степени стеноза по сравнению с катетерной ангиографией.Степень сужения может быть классифицирована как нормальная (0–9%), легкая (10–29%), умеренная (30–69%), тяжелая (70–99%) или полностью закрытая. 1 Хотя степень стеноза часто используется при стратификации риска инсульта, другие характеристики, такие как антеградный кровоток, стабильность бляшки и наличие коллатералей, вероятно, влияют на риск инсульта. 7
Дифференциальная диагностика
Поскольку ICAD — это заболевание артериальной стенки, которое вторично влияет на просвет и кровоток, другие болезненные процессы могут быть ошибочно приняты за ICAD (таблица).Например, неокклюзионные или частично реканализированные эмболы в мозговых артериях могут быть ошибочно приняты за ICAD. Некоторые характеристики, которые могут помочь в их дифференцировке, — это наличие кальцифицирующего атеросклероза в цереброваскулярных структурах, удаленных от стеноза, что может способствовать ICAD, в отличие от эмбола, который чаще наблюдается только внутри пораженной артерии. Артериальная диссекция, хотя и редко внутричерепная, также включается в дифференциал, особенно при более легких формах, которые вызывают неравномерность просвета, в отличие от откровенной диссекции лоскутов.Последовательности МРТ с высоким разрешением могут помочь лучше дифференцировать эти процессы, поскольку они могут идентифицировать эксцентрическую интрамуральную гематому, обычно наблюдаемую при диссекции, или настенную бляшку в ICAD. 16
Мультифокальное сужение внутричерепных сосудов также характерно для васкулитических процессов, хотя, что важно здесь, результирующие инсульты чаще бывают точечными и мультифокальными, чем затрагивают единственное артериальное распределение.Визуализация сосудов при васкулите может иметь классический вид «нити бус», хотя это не исключает окончательно ВКАД, поскольку причиной этого может быть обширный атеросклероз. Синдром обратимого церебрального сужения сосудов (RCVS) может также проявляться как сужение мультифокальной артерии. При васкулите контрастная МРТ и МРА могут показать усиление стенки головного мозга и концентрической артерии, при этом для постановки диагноза дополнительно необходимы анализ спинномозговой жидкости и иногда биопсия ткани. Первичная болезнь Моямоя обычно вызывает окклюзию дистальных отделов ВСА и проксимальных СМА, но может быть трудно дифференцировать от поздних ИКАД из-за медленно прогрессирующего стеноза / окклюзии, который способствует развитию проксимальных и дистальных коллатералей.
Менеджмент
Неотложная помощь
Все пациенты с ишемическим инсультом, поступившие в окно для тромболизиса или эндоваскулярной терапии, должны проходить обследование и лечение в соответствии с действующими рекомендациями, независимо от того, будет ли у них в конечном итоге обнаружено ICAD или нет (рисунок). Хотя стент-ретриверы безопасны и высокоэффективны при острой тромбэктомии, неизвестно, является ли дополнительная ангиопластика или безвозвратное стентирование безопасным и эффективным у пациентов с основным ICAD в месте окклюзии большой артерии.После принятия решения об экстренном вмешательстве, если обнаружен внутричерепной стеноз, следующим по важности соображением является контроль артериального давления (АД). Анализ пациентов, включенных в исследование SAMMPRIS и , показал безопасность раннего снижения АД при целевом систолическом АД <140 мм рт. 17 Хотя более раннее исследование WASID b не привело к значительному снижению АД после включения в исследование, пациенты как в WASID, так и в SAMMPRIS с хорошим контролем АД при амбулаторном наблюдении имели меньше рецидивов сосудистых событий. 18,19 Целесообразно поддерживать разрешающую артериальную гипертензию (до 220/120 мм рт. Ст. У пациентов без реперфузии и <180/100 мм рт. с последующей медленной либерализацией деятельности. Если результаты неврологического обследования остаются стабильными по мере либерализации активности, мы постепенно (например, на 10%) начинаем снижение АД между 24 и 48 часами и титруем до нормального давления в течение следующих 1-2 недель.Этот процесс обычно начинается в стационаре, но завершается амбулаторно. Если пациентам не удается либерализовать активность или снизить АД (например, колебания, зависящие от потока или давления), мы можем рассмотреть возможность дальнейшего замедления активности и снижения АД. В редких случаях может потребоваться субмаксимальная ангиопластика стенозированной артерии для улучшения кровотока и предотвращения флюктуаций и повторного инсульта. Все пациенты с негеморрагическими инфарктами и через 24 часа у тех, кто получил тромболизис, получают лечение аспирином и клопидогрелом.
Рисунок. Неотложная помощь и вторичная профилактика пациенту с внутричерепным атеросклеротическим заболеванием. a Если использовалось капельное введение гепарина, вернитесь к запуску алгоритма после прекращения приема гепарина.
Вторичная профилактика
Для подострого и хронического лечения ICAD исследование WASID предоставило данные первого крупного рандомизированного контролируемого исследования, сравнивающего варианты медицинского лечения. Он сравнил аспирин в дозе 1300 мг в день с варфарином с международным нормализованным соотношением 2: 3 и наблюдал более низкую смертность от всех причин (4.3% против 9,7%), частота серьезных кровотечений (3,2% против 8,3%) и инфаркт миокарда или внезапная смерть (2,9% против 7,3%) у пациентов, получавших аспирин, по сравнению с пациентами, получавшими варфарин. Более низкие показатели повторного инсульта статистически не различались между двумя группами. 18 С тех пор это было экстраполировано, чтобы указать, что антиагрегантный режим категорически безопаснее и предпочтительнее антикоагулянтов, хотя не обязательно лучше для профилактики повторного инсульта.
После WASID фокус оптимального лечения сместился к тому, улучшила ли эндоваскулярная терапия результаты у пациентов с ICAD, особенно при изучении ангиопластики со стентированием.В 2005 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило саморасширяющийся стент Wingspan (Stryker Neurovascular) для симптоматической ICAD с сужением от 50% до 99%. Испытание SAMMPRIS было проведено с целью определить, превосходила ли максимальная медикаментозная терапия с чрескожной транслюминальной ангиопластикой и стентированием (PTAS) по сравнению с одной максимальной медикаментозной терапией у пациентов с симптоматикой ICAD от 70% до 99%. Максимальная медикаментозная терапия включала аспирин 325 мг с клопидогрелом 75 мг в течение 90 дней, антигипертензивную терапию, терапию статинами по мере необходимости для достижения уровня липопротеинов низкой плотности <70 и программу изменения образа жизни, включая инструктора по повышению приверженности к отказу от курения, снижению веса и т. Д. и физическая активность.Через 30 дней частота инсульта или смерти у пациентов в группе PTAS составила 14,7% по сравнению с 5,8% у тех, кто получал медикаментозную терапию, в основном из-за немедленных послеоперационных осложнений, которые привели к преждевременной остановке исследования. В конце возможного 32-месячного наблюдения различия в инсульте и смертности сохранялись (23% у пациентов, получавших PTAS, по сравнению с 15% у пациентов, получавших медикаментозную терапию). 19 Примечательно, что пациенты из медицинского подразделения SAMMPRIS имели меньше инсультов и смертей в течение 30 дней и 1 года, чем пациенты в WASID, что в первую очередь считалось результатом двойной антитромбоцитарной терапии, повышенного использования статинов, более последовательного использования антигипертензивных препаратов и строгого образа жизни. модификация. 15
В анализе подгрупп SAMMPRIS ни одна когорта не имела большего преимущества от PTAS с медикаментозной терапией по сравнению с одной медикаментозной терапией. 20 Благодаря этим результатам, FDA пересмотрело свое одобрение стента Wingspan, включив в него только пациентов без инвалидности, у которых было 2 или более инсультов со стенозом от 70% до 99%, которые были стабильны в течение не менее 7 дней и не поддались лечению. агрессивное медицинское управление. В другом исследовании, VISSIT, c , сравнивали стент, расширяемый баллоном, по сравнению с медикаментозной терапией; она также была прервана раньше из-за увеличения количества осложнений и причинения вреда пациентам в группе стентирования. 21 Начиная с SAMMPRIS и VISSIT, некоторые утверждали, что одна субмаксимальная ангиопластика может иметь меньший риск перипроцедурального инсульта и, следовательно, может быть более безопасной, чем стентирование. 22 Кроме того, после Wingspan на рынок были выведены более новые стенты, которые считаются более безопасными. 23 Таким образом, может потребоваться дальнейшее исследование этих подходов.
Целесообразно рассмотреть возможность эндоваскулярной терапии с субмаксимальной ангиопластикой или стентом Wingspan у пациентов с повторным инсультом, несмотря на максимальную медикаментозную терапию, или у которых гемодинамические симптомы не позволяют снизить АД.Очень редко экстракраниально-внутричерепное шунтирование может быть предложено пациентам с далеко зашедшим ICAD, у которых существует вторичный синдром Моямоя и имеется дистальная (минимально пораженная) артерия-реципиент.
Сводка
Таким образом, если ICAD, приводящий к стенозу от 70% до 99%, является механизмом ишемического инсульта или ТИА, пациенту назначают аспирин 325 мг и клопидогрель 75 мг в течение 3 месяцев, после чего назначают однократную антиагрегантную терапию с продолжением агрессивных антигипертензивных средств. , снижение липидов и изменение образа жизни.Целевой липопротеин низкой плотности, как указано в исследовании SPARCL d , составляет <70 мг / дл, 24 , как это сделано в SAMMPRIS. Хотя SPARCL использовала 80 мг аторвастатина в своей группе лечения, розувастатин 40 мг также является разумной альтернативой, поскольку он обладает аналогичным высокоинтенсивным гиполипидемическим действием. 25 Эндоваскулярная или хирургическая терапия предназначена для пациентов, у которых не удалось добиться этого максимального медицинского подхода при наличии хорошо контролируемых факторов риска.
Направления будущего
Текущее исследование в ICAD оценивает различные визуализирующие и лабораторные биомаркеры, чтобы помочь стратифицировать пациентов с более высоким риском повторного инсульта и выбрать целевое медицинское или эндоваскулярное лечение.В недавно опубликованном исследовании VERITAS e использовалась количественная МРА для определения степени кровотока дистальнее симптомного вертебробазилярного стеноза, и было обнаружено, что более низкий кровоток связан с более высоким риском последующего инсульта. 26 Исследование биомаркеров ишемических исходов при внутричерепном стенозе (BIOSIS) показало, что ингибитор активатора плазминогена-1 (PAI-1), высокочувствительный C-реактивный белок (hsCRP) и клетки-предшественники с низкой циркуляцией крови являются многообещающими биомаркерами повторного инсульта. дистальнее стенозированной артерии. 27 В настоящее время также проводится исследование MyRIAD f , в ходе которого рассматриваются 3 механизма повторного инсульта у пациентов с симптоматическим ВКАД:
1. нарушение антеградного кровотока в стенозированной артерии с использованием количественной МРА;
2. компромисс дистального кровотока с использованием TCD с вазомоторной реактивностью и перфузионно-взвешенной МРТ; и
3. артерио-артериальная эмболия с использованием ТКД с обнаружением эмболов.
Может развиться детальный и целенаправленный подход к лечению ICAD, который использует эти биомаркеры для персонализации вариантов лечения, снижающих риск повторного инсульта.Например, пациенты с нарушением кровотока могут быть выбраны в будущих исследованиях реваскуляризации с субмаксимальной ангиопластикой или стентами нового поколения, а пациенты с нестабильностью бляшек и эмболизацией могут быть подходящими для усиленного медицинского лечения, такого как новые гиполипидемические препараты и антитромботическая терапия, которая стабилизирует зубного налета и снизить эмболический потенциал.
Выводы
Внутричерепное атеросклеротическое заболевание — частая причина ишемического инсульта, особенно среди меньшинств.Хотя лечение, адаптированное для этого заболевания, включает агрессивное управление факторами риска в сочетании с краткосрочной двойной антитромбоцитарной терапией, ICAD по-прежнему ассоциируется с самыми высокими показателями повторного инсульта среди всех подтипов инсульта. Крайне важно, чтобы лечащие неврологи внимательно относились к этому механизму инсульта и нюансам его оценки и лечения.
Раскрытие информации
Авторы не имеют финансовых или иных отношений, имеющих отношение к этому содержанию, которые следует раскрывать.
Внутричерепные атеросклеротические стенозы: патофизиология, эпидемиология, факторы риска и текущие варианты лечения
В нескольких исследованиях изучались традиционные факторы риска ИКАС, в основном в азиатских популяциях. Они традиционно делятся на две основные группы: модифицируемые (артериальная гипертензия, сахарный диабет, дислипидемия, избыточный вес, отсутствие физической активности, курение и т. Д.) И немодифицируемые (возраст, этническая принадлежность, пол, семейный анамнез сосудистых заболеваний) [19, 41 , 42].
Некоторые исследования факторов риска ICAS показали различия между ICAS и ECAS [43].
Лучшее понимание факторов риска, традиционно связанных с ICAS, может не только объяснить наличие ICAS и этнических различий, но также может привести к улучшению результатов в случае наилучшей медикаментозной терапии. Следующие параграфы посвящены эпидемиологии и рекомендациям по лечению наиболее распространенных модифицируемых факторов риска у пациентов с ВСАС.
Артериальная гипертензия
Артериальная гипертензия является одним из наиболее важных факторов риска ИКАС по данным аутопсии, а также по данным многих клинических исследований [2, 32, 42, 44, 45].Исследования показывают, что азиатское и африканское население более склонно к артериальной гипертензии большого объема из-за большей задержки натрия, тогда как резистентная артериальная гипертензия чаще встречается среди европейцев [46]. Сообщалось, что артериальная гипертензия вызывает гемодинамический стресс, ускоряет атеросклероз за счет повреждения эндотелия сосудов и увеличения его проницаемости для липопротеинов [47]. Внутричерепные артерии более подвержены повреждениям, вызванным артериальной гипертензией, чем экстракраниальные артерии.Это можно объяснить разной архитектурой стенок сосудов. Внутричерепные артерии состоят из более тонких сред и адвентиций, а также из меньшего количества эластичных медиальных волокон, чем экстракраниальные артерии [48]. Было показано, что артериальная гипертензия связана с возникновением ICAS как такового, с тяжестью и прогрессированием ICAS [49].
Исследование WASID (таблица 1) показало более высокую распространенность повторного ишемического инсульта среди пациентов с артериальной гипертензией. Два пациента были исключены из-за отсутствия информации об артериальном давлении.У всех пациентов измеряли артериальное давление на исходном уровне и при каждом 4-месячном посещении. Данные выявили связь между артериальной гипертензией, определяемой как минимум 160/90 мм рт. Ст. Против как минимум 140/90 мм рт. Ст., И повышенным риском ишемического инсульта не только на территории стенозированного сосуда ( p = 0,0065 / p < 0,0001 по сравнению с p = 0,015 / p <0,0001 соответственно), но также и на других сосудистых территориях ( p <0,0001 / p = 0.003 по сравнению с p = 0,0003 / p <0,0001). Кроме того, среди пациентов с 50–70% ICAS, АД не менее 140/90 мм рт.ст. было связано с более высоким риском любого ишемического инсульта ( p <0,0001, p = 0,003), а также ишемического инсульта у территории ICAS ( p = 0,0002, p = 0,010), аналогично группе в целом. Кроме того, во время наблюдения 30,7% пациентов со средним САД не менее 140 мм рт.ст. перенесли ишемический инсульт, инфаркт миокарда или сосудистую смерть, по сравнению с 18.3% пациентов со средним САД менее 140 мм рт. Ст. ( p <0,0005) [50]. Многопараметрический анализ показал, что САД не менее 140 мм рт. 45]. В исследовании WASID (таблица 1) было обнаружено, что повышенное среднее САД при включении в исследование также связано с наличием или отсутствием сосуществующих бессимптомных ВСАС (144,7 мм рт. Ст. Против 139,4 мм рт. Ст., p = 0.028) [40].
В исследовании TOSS-II (Испытание цилостазола при симптоматическом внутричерепном артериальном стенозе II) (Таблица 1) выяснилось, что существует связь между средними уровнями САД и прогрессированием ICAS. Пациенты с нормальным уровнем САД (менее 120 мм рт. Ст.) Имели самые низкие показатели прогрессирования ICAS (21,4%), тогда как пациенты с уровнем не менее 160 мм рт. Ст. Демонстрировали самые высокие показатели прогрессирования (38,9%) [51, 52].
В исследовании SAMMPRIS (Стентирование и агрессивное медицинское лечение для предотвращения повторного инсульта при внутричерепном стенозе) (таблица 1) были записаны и усреднены три измерения АД на исходном уровне и при каждом последующем посещении на протяжении всего исследования [53].Частота сбора данных по АД зависела от достижения целевого показателя САД. Обычный график контрольных посещений — каждые 4 месяца после корректировки антигипертензивного режима в соответствии с целевым САД. Апостериорный анализ пациентов, включенных в группу лучшей медикаментозной терапии, показал, что только 53% этих пациентов имели среднее САД в пределах целевого (менее 140 мм рт. Ст.) Во время их участия в исследовании, и что у них была значительно меньшая вероятность рецидивирующий ишемический инсульт, инфаркт миокарда или смерть сосудов (OR 1.3, 95% ДИ 1,1–1,7) по сравнению с теми, кто не достиг этих целей (ОШ 2,1, 95% ДИ 1,2–4,0) [54].
В исследовании VERiTAS (Оценка вертебробазилярного кровотока и риск транзиторной ишемической атаки и инсульта) (таблица 1) из 10 последующих инсультов вертебробазилярной территории семь произошли у пациентов с АД ниже 140/90 мм рт.ст. по сравнению с тремя у пациентов с АД. не менее 140/90 мм рт. ст. ( p = 0,33). Когда подгруппы сравнивались как по АД, так и по гемодинамическому статусу, пациенты с низким кровотоком и АД менее 140/90 мм рт. Ст. ( n = 10) имели самый высокий риск последующего ишемического инсульта ( n = 4, HR 4.5, 95% ДИ 1,3–16,0; p = 0,02) по сравнению со всеми другими подгруппами вместе взятыми. После корректировки на ранее идентифицированные факторы риска инсульта в этой когорте, подгруппа с низким потоком и АД менее 140/90 мм рт.ст. оставалась в группе значительно более высокого риска (HR 7,3, 95% ДИ 1,4–37,9; p = 0,02) [55 ].
На основании данных крупных рандомизированных исследований (WASID, SAMMPRIS) Американской кардиологической ассоциации (AHA) / Американской ассоциации инсульта. (ASA) от 2014 г. рекомендуют целевое значение АД менее 140 мм рт.Аналогичным образом, рекомендации Европейского общества кардиологов (ESC) / Европейского общества атеросклероза (EAS) 2019 также рекомендуют целевое значение АД менее 140/90 мм рт. Ст. [57]. Однако подгруппе пациентов с ICAS и низким потоком могут потребоваться более высокие целевые уровни.
Сахарный диабет
Сахарный диабет неизменно считается независимым фактором риска ICAS [2, 42, 44, 58, 59]. Было показано, что сахарный диабет снижает антиоксидантную способность и увеличивает окислительный стресс, что приводит к эндотелиальной дисфункции и воспалению [60].
Пару десятилетий назад исследование вскрытия последовательных пациентов из Гонконга ( n = 114) продемонстрировало более 50% ICAS, определенное морфометрическими измерениями при аутопсии, у 31,4% пациентов. Заболеваемость факторами риска (ишемическая болезнь сердца, артериальная гипертензия, сахарный диабет, курение, инсульт в анамнезе) была получена путем изучения истории болезни и опроса родственников пациентов. Результаты показали связь сахарного диабета, а также артериальной гипертензии и возраста с ICAS [61].
В исследовании аутопсии случай-контроль у преимущественно белых пациентов с последовательным инсультом ( n = 339) сообщается, что сахарный диабет был единственным изменяемым фактором риска, связанным не только с внутричерепными атеросклеротическими бляшками, но и с ICAS, определяемым как более 30%. сужение просвета на поверхностном участке артерий [16].
Сообщалось, что сахарный диабет и метаболический синдром являются более важными факторами риска для ICAS, чем для ECAS и инсульта, не связанного с атеросклерозом (сахарный диабет: 67% ICAS, 60% ECAS, 48% неатеросклеротический инсульт и 23% контроли, p <0.05 ICAS против средств контроля; метаболический синдром: 62% ICAS, 40% ECAS, 40% неатеросклеротический инсульт и 35% контрольная группа, p ( <0,05 ICAS по сравнению с контрольной группой), согласно исследованию инсульта Северного Манхэттена. В многофакторном анализе сахарный диабет представлял более высокий риск ишемического инсульта, связанного с ICAS, по сравнению с неатеросклеротическим инсультом (OR 10,8, 95% ДИ 2,0–57 против OR 2,7, 95% ДИ 1,9–3,9; p <0,05 ) и инсульта, связанного с ECAS (ОШ 6,2, 95% ДИ 1,2–32). Метаболический синдром также оказался фактором риска ишемического инсульта, связанного с ICAS (OR 4.6, 95% ДИ 1,1–18,7) по сравнению с инсультом, связанным с ECAS (ОШ 2,3, 95% ДИ 0,6–9,1) и неатеросклерозом (ОШ 2,4, 95% ДИ 1,7–3,3) [59].
Исследование AsIA (таблица 1) определило сахарный диабет (OR 2,95, 95% ДИ 1,68–5,18; p <0,001) как наиболее значимый фактор риска для бессимптомного ICAS любой степени, а также для умеренного и тяжелого бессимптомного ICAS ( OR 2,85, 95% ДИ 1,16–6,96; p = 0,02) [37]. Другое исследование среди бессимптомных китайских пациентов, страдающих сахарным диабетом с ICAS, равным одному ( n = 185), обоим ( n = 200) или отсутствию средней мозговой артерии / артерий ( n = 1492), обследовало пациентов с TCD.У 20,6% пациентов с сахарным диабетом 2 типа имелись признаки ICAS средней мозговой артерии хотя бы с одной стороны. Тяжесть ICAS и увеличение количества стенозированных сосудов были связаны с уровнями глюкозы в сыворотке или гликированного гемоглобина (HbA1c), продолжительностью сахарного диабета, а также с возрастом, более высокими уровнями САД и ХС ЛПНП [62].
В проспективных корейских исследованиях было обнаружено, что сахарный диабет является независимым фактором риска развития ICAS у пациентов женского пола только после 50 лет и демонстрирует связь с ICAS в заднем, но не переднем кровообращении [32, 63].
В исследованиях SAMMPRIS и WASID (таблица 1) изучалась взаимосвязь между лучшим контролем над сахарным диабетом и риском повторного ишемического инсульта или сосудистых событий в периоды последующего наблюдения в обоих исследованиях. Протокол исследования SAMMPIS требовал тестирования уровней HbA1c у пациентов с сахарным диабетом каждые 6 месяцев у пациентов с гликемическим контролем на целевых уровнях и ежеквартально у пациентов, которые были вне целевых уровней. Апостериорный анализ пациентов ( n = 227), включенных в лучшую терапевтическую группу исследования, не продемонстрировал связи между лучше контролируемыми уровнями HbA1c (цель менее 7.0%) и рецидивы ишемического инсульта, инфаркта миокарда и сосудистой смерти по другой причине (OR 2,0, 95% CI 0,99–4,1) и с ишемическим инсультом (OR 2,3, 95% CI 1,0–5,0) при последующем наблюдении через 3 года. [54]. Эти результаты аналогичны результатам исследования WASID. В этом исследовании средний уровень HbA1c у пациентов с диабетом составлял 8,4%. В общей сложности 91% включенных пациентов были прописаны инсулин или пероральные гипогликемические средства во время наблюдения. Однако результаты показали, что плохой контроль сахарного диабета, определяемого как HbA1c выше 7.0%, не было достоверно связано с более высоким риском повторного ишемического инсульта, инфаркта миокарда или сосудистой смерти, а также с одним только повторным ишемическим инсультом во время наблюдения. Риск ишемического инсульта, инфаркта миокарда или смерти от сосудов составлял 31% у пациентов с диабетом с HbA1c более 7,0% ( n = 117) и 20% у пациентов с диабетом с хорошим контролем HbA1c ( n = 59) [50] .
Возможными объяснениями неудач SAMMPRIS и WASID в выявлении значительного преимущества лучшего контроля HbA1c может быть либо истинное отсутствие пользы, либо недостаток мощности для обнаружения эффекта.
Преимущество лучшего контроля глюкозы не только у пациентов с диабетом, но и у пациентов с инсулинорезистентностью в отношении уменьшения рецидивов сердечно- и цереброваскулярных ишемических событий было продемонстрировано в исследовании IRIS (Вмешательство инсулинорезистентности после инсульта) (Таблица 1). Возможное объяснение результатов исследования заключается в том, что пиоглитазон улучшает чувствительность к инсулину, снижает уровень глюкозы в плазме, снижает биомаркеры системного воспаления и улучшает вазомоторную реактивность. Также он благоприятно влияет на липидный обмен, артериальное давление и тромбоз.В результате этого исследования был сделан вывод о том, что пиоглитазон эффективен для вторичной профилактики повторного ишемического инсульта у недиабетических пациентов с инсулинорезистентностью. В исследовании не анализировался ишемический инсульт, связанный с ICAS как таковой [65].
Согласно рекомендациям ESC / EAS 2019, HbA1c менее 7% рекомендуется для профилактики сосудистых заболеваний [57]. Хотя рекомендации AHA / ASA 2019 не устанавливают каких-либо конкретных целевых показателей для HbA1c и сывороточной глюкозы для пациентов с ICAS, они, вероятно, не должны отличаться от тех, которые рекомендованы при (атеросклеротическом) сосудистом заболевании [66].
Дислипидемия
Дислипидемия является важным фактором риска для ICAS, даже в большей степени для ECAS [2, 42, 44, 67,68,69].
В проспективном многоцентровом исследовании с участием 1000 корейских пациентов с острым ишемическим инсультом или ТИА (менее 7 дней после начала), вызванным либо ICAS ( n = 688), ECAS (n = 271) или тандемным стенозов ( n = 41), оцениваемых с помощью CTA, MRA или DSA, дислипидемия была идентифицирована как единственный модифицируемый фактор риска, более распространенный в ECAS (OR 1.50, 95% ДИ 1,117–2,018, p = 0,007) по сравнению с ICAS [32].
Накопление холестерина ЛПНП (Х) в интиме инициирует развитие и прогрессирование атеросклероза и в конечном итоге приводит к образованию бляшки. HDL-C играет антиатеросклеротическую роль, способствуя оттоку холестерина из макрофагов, ингибируя окисление LDL-C и миграцию гладкомышечных клеток и агрегацию тромбоцитов [70]. Однако внутричерепные артерии, по-видимому, имеют специфический состав гликокаликса на эндотелиальных клетках, который может препятствовать захвату липопротеинов очень низкой плотности, что приводит к снижению жировых отложений [71].Этническая принадлежность и факторы окружающей среды могут влиять на влияние дислипидемии на атерогенез внутричерепных артерий. Как правило, по сравнению с европейским населением, азиатское и африканское население демонстрирует более низкие уровни липидов в сыворотке крови, что может быть одним из факторов, объясняющих более низкую частоту экстракраниального и коронарного атеросклероза в этих популяциях [72]. Аполипопротеин (апо) -AI, главный аполипопротеин в HDL-C, обладает антиоксидантным и противовоспалительным действием, тогда как апо-B представляет собой общее количество потенциально атерогенных свойств, генерирует множество провоспалительных продуктов и усугубляет атерогенез в сосудистой стенке за счет окисления.Лопес-Кансио и др. продемонстрировали связь между соотношением триглицеридов / ХС-ЛПВП и умеренным и тяжелым бессимптомным 50% или выше ICAS, хотя это не было независимым предиктором [37]. Была показана положительная корреляция между соотношением апо-B / апо-AI и наличием и тяжестью ICAS, что позволяет предположить, что соотношение апо-B / апо-AI может быть многообещающим биомаркером для прогнозирования риска и тяжести ICAS [73 ].
В исследовании WASID (таблица 1) средний уровень ХС-ЛПНП составил 3,2 ммоль / л, а средний уровень ХС-ЛПВП — 1.1 ммоль / л на исходном уровне. Среди всех включенных пациентов 61% принимали статины на исходном уровне, а 82,4% принимали статины в любое время в течение исследования. Однофакторный анализ связи между дислипидемией и рецидивирующим ишемическим инсультом, инфарктом миокарда или сосудистой смертью продемонстрировал, что уровень общего холестерина не менее 5,2 ммоль / л был связан с повышенным риском крупного рецидивирующего сосудистого события ( p = 0,0223). Кроме того, 25,0% пациентов с уровнем ХС-ЛПНП не ниже 3.0 ммоль / л перенесли ишемический инсульт, инфаркт миокарда или сосудистую смерть, по сравнению с 18,5% пациентов со средним уровнем ХС-ЛПНП менее 3,0 ммоль / л ( p = 0,029) за тот же период. Многопараметрический анализ показал, что уровень общего холестерина не менее 5,2 ммоль / л (HR 1,44, 1,00–2,07; p = 0,048) был связан с повышенным риском ишемического инсульта, инфаркта миокарда или смерти от сосудов в течение периода наблюдения. Кроме того, результаты показали, что пациенты с большей вероятностью перенесли повторный ишемический инсульт, если у них был уровень общего холестерина не менее 5.2 ммоль / л (HR 2,06, p = 0,0006), уровни LDL-C не менее 2,6 ммоль / л (HR 1,72, p = 0,0326), уровни не-HDL-C не менее 3,4 ммоль / л (HR 1,94, p = 0,0109) и соотношение уровней общего холестерина / HDL-C не менее 4,4 (HR 1,89, p = 0,0043). Кроме того, общий холестерин не менее 5,2 ммоль / л (отношение рисков 1,95, 95% доверительный интервал 1,29–2,97; p = 0,002) среди пациентов с САД не менее 140 мм рт.ст. (отношение рисков 1,58, 1,07–2,32; p = 0,02) был наиболее важным предиктором повторного ишемического инсульта.Дислипидемия в анамнезе была независимо связана с тяжелым ICAS (OR 1,62, 95% CI 1,09–2,42; p = 0,02). Кроме того, у пациентов с ICAS основной артерии наиболее вероятно была дислипидемия (70,86% против 64,81% с внутричерепным ICAS внутренней сонной артерии, 57,71% с ICAS средней мозговой артерии и 63,81% с ICAS позвоночной артерии; p = 0,054) [45, 74].
В исследовании SAMMPRIS (таблица 1) уровень ХС-ЛПНП ниже 1,8 ммоль / л в качестве основного целевого фактора риска, а также уровни Х-не-ЛПВП ниже 2.6 ммоль / л в качестве вторичной цели, со стандартизованными измерениями на исходном уровне, через 30 дней и через 4 месяца с использованием центральной липидной лаборатории. Среди всех пациентов, включенных в лучшую терапевтическую группу исследования, у 47% средний целевой уровень ХС-ЛПНП был ниже 1,8 ммоль / л, а у 60% — уровни не-ЛПВП ниже 2,6 ммоль / л. Согласно ретроспективному анализу пациентов, получавших консервативное лечение, более низкие непрерывные уровни ХС-ЛПНП и более низкие уровни ХС-не-ЛПВП были связаны с более низкой вероятностью повторного ишемического инсульта, инфаркта миокарда или смерти сосудов, а также только рецидивирующего ишемического инсульта до тех пор, пока 3-летнее наблюдение [54].
Согласно исследованию SPARCL (Предотвращение инсульта путем агрессивного снижения уровня холестерина) (таблица 1), которое не было специфичным для пациентов с ICAS, снижение уровня ХС-ЛПНП ниже 1,81 ммоль / л было связано с 28% снижением риск ишемического инсульта по сравнению с уровнем выше 2,59 ммоль / л [75]. Апостериорный анализ аторвастатина по сравнению с плацебо показал, что аторвастатин в дозе 80 мг / день эффективен для снижения риска рецидива ишемического инсульта у пациентов с атеросклеротической болезнью крупных сосудов.Однако исследование SPARCL было недостаточно эффективным для анализа подгрупп.
В рандомизированном исследовании, основанном на событиях в параллельных группах, 2860 пациентов с недавним (менее 3 месяцев) ишемическим инсультом или ТИА (менее 15 дней) получили целевой уровень ХС-ЛПНП ниже 1,8 ммоль / л. (нижняя целевая группа, n = 1430) или целевому диапазону 2,3–2,8 ммоль / л (более высокая целевая группа, n = 1430) [76]. Все включенные пациенты имели либо ECAS, ICAS, атеросклеротические бляшки дуги аорты (4 мм и более), либо известную историю болезни коронарных артерий.Первичная конечная точка была определена как ишемический инсульт, инфаркт миокарда, новые симптомы, ведущие к срочной реваскуляризации коронарных артерий или сонных артерий или смерть от сосудистых причин в течение периода наблюдения продолжительностью 3,5 года. Достигнутые целевые значения ХС-ЛПНП 1,8 ммоль / л были связаны с более низким риском серьезных сосудистых событий по сравнению с более высокими уровнями ХС-ЛПНП ( n = 121, 8,5% в группе с более низким целевым показателем по сравнению с n = 156 , 10,9% в целевой группе [ОР 0,78 (0,61–0,98), 95% ДИ, p = 0.04]).
Рекомендации AHA / ASA 2019 рекомендуют высокоинтенсивную терапию статинами, независимо от исходного уровня ХС-ЛПНП, для снижения риска сосудистых событий у пациентов в возрасте до 75 лет с цереброваскулярными ишемическими событиями атеросклеротического происхождения и без противопоказаний. Кроме того, они рекомендуют терапию статинами умеренной интенсивности для людей старше 75 лет или для тех, у кого есть состояния, влияющие на безопасность статинов, или непереносимость статинов в анамнезе [66].
В соответствии с рекомендациями ESC / EAS 2019 терапевтический режим, при котором достигается снижение как минимум на 50% LDL-C и цель LDL-C ниже 1.Для лечения дислипидемии пациентам с очень высоким риском рекомендуется 4 ммоль / л, не-ЛПВП менее 2,2 ммоль / л, триглицериды менее 1,7 ммоль / л и апо-В менее 0,0013 ммоль / л. Пациенты с очень высоким риском определяются как пациенты с документально подтвержденным атеросклеротическим заболеванием сердца, а также пациенты после цереброваскулярного события [57].
Хотя нет рекомендаций по вторичной профилактике в отношении целевых уровней липидов у пациентов с ICAS, для пациентов с ишемическим инсультом или ТИА, обусловленным стенозом крупной внутричерепной артерии 50% или выше, рекомендуется терапия статинами высокой интенсивности (класс I; доказательств B) в соответствии с рекомендациями AHA / ASA 2014 [56].
Избыточный вес и гиподинамия
Ожирение, определяемое как индекс массы тела (ИМТ) 30 кг / м. 2 или выше, является установленным фактором риска инсульта [77].
ИМТ регистрировали при каждом посещении в исследовании SAMMPRIS (Таблица 1). Только 19% пациентов, включенных в лучшую терапевтическую группу исследования, имели целевой ИМТ (от исходного уровня до нежелательного явления или закрытия), определяемый как ИМТ менее 25 кг / м2 2 для пациентов с исходным ИМТ между 25–27 кг / м 2 и снижение массы тела на 10% для пациентов с исходным ИМТ более 27 кг / м 2 .Результаты апостериорного анализа показали, что контроль ИМТ не оказал значительного влияния на 3-летнюю частоту ишемического инсульта, инфаркта миокарда или сосудистой смерти (OR 0,9, 95% ДИ 0,4–2,0), а также на 3-летнюю частоту возникновения ишемического инсульта. частота одного ишемического инсульта (OR 0,9, 95% ДИ 0,4–2,1) [54].
Доказано, что физическая активность приносит пользу, уменьшая факторы риска и риск инсульта [78].
Физическая активность оценивалась в исследовании SAMMPRIS (Таблица 1) в соответствии с 8-балльной анкетой для оценки и консультирования при упражнениях (PACE), которую участники заполняли при каждом посещении [79].Умеренные упражнения включали в себя такие действия, как быстрая ходьба или медленная езда на велосипеде не менее 10 минут за раз, тогда как энергичные упражнения включали бег трусцой или быструю езду на велосипеде не менее 20 минут за раз. Ходьба оказалась наиболее распространенной формой упражнений во все временные точки, если судить по продолжительности упражнений и количеству пациентов, выполняющих упражнение. Средняя продолжительность ходьбы и других аэробных нагрузок значительно увеличилась по сравнению с исходным уровнем по всем остальным временным точкам. Физическая активность, выходящая за рамки целевого значения, была определена как балл PACE, равный 3 или меньше (3 = попытки выполнять энергичные или умеренные упражнения, но не выполняются регулярно, 2 = нет интенсивных или умеренных упражнений, но думают о том, чтобы начать в следующие 6 месяцев, и 1 = нет. энергичные или умеренные упражнения и отсутствие намерений начинать в ближайшие 6 месяцев).Результаты апостериорного анализа пациентов, включенных в лучшую группу медикаментозного лечения, показали только, что для конечной точки только ишемического инсульта в течение последующих 3 лет физическая активность была единственным фактором риска, связанным с меньшим количеством событий (OR 0,5, 95% ДИ 0,4–0,7). Кроме того, участники, достигшие целевого показателя физической активности, имели значительно меньшую вероятность повторного сосудистого события в течение периода последующего наблюдения по сравнению с теми, кто не достиг этих целевых показателей.Был сделан вывод, что, хотя артериальная гипертензия и дислипидемия могут способствовать риску повторных сосудистых ишемических событий, независимый эффект физической активности был сильнее для прогнозирования сосудистых событий. Примечательно, что у физически неактивных пациентов вероятность развития ишемического инсульта, инфаркта миокарда или смерти от сосудов была в пять раз выше, а риск ишемического инсульта был в шесть раз выше по сравнению с физически активными пациентами.
В соответствии с рекомендациями AHA / ASA 2014 все пациенты с цереброваскулярным ишемическим событием должны проходить скрининг на ожирение с измерением ИМТ (класс I; уровень доказательности C) [56].Несмотря на продемонстрированное положительное влияние потери веса на факторы риска, польза от потери веса среди пациентов с недавним цереброваскулярным ишемическим событием и ожирением является неопределенной (класс IIb; уровень доказательности C). Поскольку связь между ожирением и повышенным риском ишемического инсульта может быть в значительной степени объяснена промежуточными факторами риска, последствия ожирения спорны и еще недостаточно изучены.
AHA и ACC рекомендуют взрослым участвовать в 3–4 сеансах аэробной физической активности в неделю, продолжительностью в среднем 40 минут и с умеренными (например.грамм. быстрая ходьба) или высокой интенсивности (например, бег трусцой) [80].
Согласно рекомендациям ESC / EAS 2019, целевой целью профилактики сосудистых заболеваний является в общей сложности 3,5–7 часов умеренно интенсивной физической активности в неделю или 30–60 минут в большинство дней [57].
Хотя нет никаких рекомендаций по вторичной профилактике физической активности, которые были бы специфичны для пациентов с ICAS, эти пациенты также могут получить пользу от регулярных физических упражнений, как упоминалось выше. Однако следует учитывать, что пациентам с низким потоком следует избегать интенсивных физических нагрузок.
Курение
Курение широко считается основным фактором риска, повышающим риск ишемического инсульта в два-четыре раза. Патофизиологически он увеличивает кровяное давление, частоту сердечных сокращений и окислительный стресс [81].
Сообщается, что он играет важную роль как у пациентов с ICAS [2], так и у пациентов с ECAS [82]. Тем не менее, рандомизированное проспективное исследование пациентов ( n = 989) с острым ишемическим инсультом или ТИА и ICAS, выявленных с помощью MRA, пришло к выводу, что курение может быть более тесно связано (OR 1.83, 95% ДИ 1,07–3,16, p = 0,026) с ICAS (32,9%), чем с ECAS (28,2%) [83]. Было показано, что курение коррелирует с прогрессированием и тяжестью ICAS [84, 85].
Несмотря на то, что в исследованиях SAMMPRIS и WASID (таблица 1) курение регистрировалось при всех посещениях в рамках исследования, ретроспективный анализ обоих исследований не продемонстрировал преимущества контроля над снижением частоты повторных сосудистых событий.
В соответствии с рекомендациями AHA / ASA 2014 курильщики с цереброваскулярным нарушением должны получить в больнице начало высокоинтенсивных поведенческих вмешательств, способствующих прекращению курения, а курильщикам с острым ишемическим инсультом рекомендуется никотиновая заместительная терапия (класс IA; уровень доказательства A).Кроме того, медицинские работники должны настоятельно рекомендовать каждому курящему пациенту бросить курить (класс I; уровень доказательности C-EO) [66].
Хотя нет никаких рекомендаций по вторичной профилактике курения, специфичных для пациентов с ICAS, следует стремиться к отказу от курения.
Здоровый образ жизни
Изменение образа жизни имеет решающее значение для достижения целевых показателей факторов риска у пациентов с ICAS.
SAMMPRIS было первым испытанием (таблица 1), которое бесплатно предоставляло коммерчески доступную телефонную программу изменения образа жизни (INTERxVENT) для всех пациентов во время участия в исследовании.Тренеры по стилю жизни предоставляли индивидуальные консультации по факторам риска два раза в месяц в течение 6 месяцев, а затем ежемесячно в течение периода наблюдения. Пациенты были разделены на согласных пациентов ( n = 201), у которых было не менее 78,5% звонков, и на пациентов, не соблюдающих правила, с менее чем 78,5% звонков ( n = 200). Наблюдалась значительная разница между соблюдающими и не соблюдающими пациентами в изменении HbA1c от исходного уровня до 6 месяцев (-0,7% ± 1,9%, n = 59 против 0.2% ± 2,7%, n = 58; p = 0,04) и изменения САД от исходного уровня до 24 месяцев (- 18,4 ± 21,6 мм рт. Ст., n = 171 против — 11,2 ± 23,5 мм рт. Ст., n = 130; p = 0,006). Они также различались по изменению от исходного уровня до 36 месяцев (0,3 ± 0,4 ммоль / л, n = 55 против 0,1 ± 0,3 ммоль / л, n = 17; p = 0,03) для уровней ХС-ЛПВП. . Однако по ИМТ не было разницы [86]. Эти результаты демонстрируют, что здоровый образ жизни позволяет лучше контролировать несколько факторов риска.
Здоровый образ жизни, включая здоровое питание и регулярную физическую активность, также рекомендован рекомендациями AHA / ASA 2019 для всех пациентов после острого ишемического инсульта [66]. Пациенты с ICAS также должны стремиться к более здоровому образу жизни в рамках вторичной профилактики.
Возраст, этническая принадлежность и генетика
Результаты исследования AsIA (таблица 1) выявили, что возраст (OR 1,05, 95% ДИ 1,004–1,1; p = 0,03) связан с бессимптомным ICAS от умеренной до тяжелой степени [37].
Имеются противоречивые данные об исследованиях распространенности ICAS у пациентов разного возраста. Исследования вскрытия трупа и визуализации показали, что ICAS чаще встречается в более позднем возрасте, чем ECAS [16, 32]. Одно из возможных объяснений связано с большей активностью антиоксидантных ферментов в более молодом возрасте во внутричерепных артериях, что делает их более устойчивыми к атеросклеротическим бляшкам [87].
Возможные причины этнических различий в распространенности, тяжести и локализации, а также в патогенезе и прогнозе ICAS могут частично объясняться различиями в профилях факторов риска [88].Например, более высокие показатели ожирения и гипергликемии, а также более низкие показатели физической активности более характерны для испаноязычных, чем для европеоидных групп [89]. Кроме того, исследования показали, что в азиатских популяциях выше распространенность артериальной гипертензии, курения и висцерального ожирения, связанных с инсулинорезистентностью [90, 91].
Также были описаны полиморфизмы, такие как адипоцитокины, липопротеинлипаза и C-реактивный белок, у пациентов с ICAS, но также и ECAS [92].
Кроме того, было показано, что белок 213 безымянного пальца ( RNF213 ) является геном восприимчивости не только к болезни моямоя, но также и к ICAS. В метаанализе (11 исследований, 1778 пациентов с ICAS) было обнаружено, что вариант RNF213 p.R4810K увеличивает риск ICAS у китайских пациентов (OR 5,59, 95% ДИ 2,12–14,75; p = 0,001), со значительно меньшей величиной эффекта, чем у японских и корейских пациентов (OR 10,71 и 28,52, 95% ДИ 3,97–28,91 и 11.04–73.67 соответственно). Вариант RNF213 p.R4810K отсутствует в неазиатских популяциях. Другие варианты RNF213 были идентифицированы как ассоциированные с ICAS [93].
Антикоагулянты и антитромботики
Разжижение крови имеет решающее значение в терапии пациентов с ICAS. Антикоагуляция препятствует каскаду свертывания, а антитромботические препараты препятствуют активации и агрегации тромбоцитов.
Антикоагулянты эмпирически использовались у пациентов с тяжелым окклюзионным заболеванием вертебробазилярных артерий и с рецидивирующим ишемическим инсультом согласно благоприятным результатам клинических испытаний, проведенных несколько десятилетий назад [94].
Однако исследование WASID (таблица 1) показало преимущество антиагрегантной терапии над антикоагулянтной у пациентов с не приводящим к инвалидности ишемическим инсультом или ТИА в течение 90 дней до рандомизации, что объясняется 50–99% ICAS. Это произошло даже при значительной дозировке аспирина (1300 мг / день). Эта высокая доза аспирина была назначена из-за его предполагаемой лучшей способности снижать резистентность тромбоцитов [95, 96], уменьшать агрегацию тромбоцитов, вызванную сдвигом [97], и уменьшать воспалительный компонент атеротромбоза [98,99,100,101].
Поскольку пероральные антикоагулянты, не являющиеся антагонистами витамина K (NOAC), более безопасны, чем антагонисты витамина K (варфарин) при вторичной профилактике инсульта [102, 103, 104, 105], возникает вопрос, будут ли NOAC эффективными и безопасными для пациентов с ICAS. Необходимы клинические испытания NOAC в этой конкретной группе пациентов.
В исследовании CLAIR (клопидогрель плюс аспирин для уменьшения инфаркта) (таблица 1) изучалась двойная антитромбоцитарная терапия для снижения микроэмболических сигналов (MES), обнаруживаемых с помощью TCD [106].Было описано, что MES является суррогатным маркером повышенного риска цереброваскулярных ишемических событий. У всех пациентов было не менее 50% симптоматических ECAS или ICAS внутренней сонной артерии или ICAS средней мозговой артерии. Результаты этого исследования показывают, что двойная антитромбоцитарная терапия в течение 7 дней более эффективна с сопоставимой безопасностью, чем один аспирин, для снижения количества MES при остром инсульте или у пациентов с ТИА с ICAS, что может быть связано со снижением риска цереброваскулярных ишемических событий.
В дополнительном исследовании исследования CHANCE (клопидогрел у пациентов с высоким риском и острыми цереброваскулярными событиями, не приводящими к инвалидности) (таблица 1) анализировалась эффективность двойной антитромбоцитарной терапии у симптомных пациентов с ICAS по сравнению с пациентами без ICAS. Результаты показали более высокую частоту повторного ишемического или геморрагического инсульта у пациентов с малым ишемическим инсультом или у пациентов с ТИА высокого риска с ICAS, чем у пациентов без него. Однако не было значительных различий в ответе на два антиагрегантных режима и в отношении их безопасности между пациентами с и без ICAS [107, 108].
В испытании GESICA (Groupe d’Etude des Sténoses Intra-Crâniennes Athéromateuses симптоматика) (таблица 1) оценивалась польза медикаментозной терапии у пациентов с легким ишемическим инсультом или ТИА в течение 6 месяцев и относилась как минимум к 50% ICAS [7] . Пациентов лечили одним антиагрегантом, одним антиагрегантом и одним антикоагулянтом, одним антикоагулянтом или другими антитромботическими комбинациями антитромботических средств и антикоагулянтов. На территории ICAS была высокая частота рецидивов ишемического инсульта, а также других сосудистых событий.Кроме того, исследование обнаружило связь между ICAS и коронарной артерией и заболеванием периферических артерий. Среди 20 пациентов, перенесших ангиопластику, был один смертельный геморрагический инсульт, который произошел через 2 месяца после операции.
В исследовании SAMMPRIS (таблица 1), в котором участвовали пациенты с не приводящим к инвалидности ишемическим инсультом или ТИА, вызванной 70–99% ICAS, более низкие показатели любого инсульта или смерти были обнаружены в группе лучшей медикаментозной терапии по сравнению с чрескожной транслюминальной ангиопластикой. и стентирование (ПТАС) группа.
Исследование VISSIT (исследование интракраниального стента Vitesse для терапии ишемического инсульта) (таблица 1) также подтвердило пользу лучшей медикаментозной терапии в течение 30 дней у пациентов с симптоматическим ICAS 70% или выше [109].
Цилостазол — альтернативный антиагрегант, который исследовался у пациентов с ВСАС. Это ингибитор фосфодиэстеразы 3 с сосудорасширяющим, противовоспалительным, антиатерогенным действием и низким риском кровотечения. В исследовании TOSS I (Испытание цилостазола при симптоматическом внутричерепном артериальном стенозе) (таблица 1) корейские пациенты с симптоматическим ВСАС рандомизировались на группу цилостазола (100 мг дважды в день) или плацебо.Все участники дополнительно получали аспирин по 100 мг / сут [110]. Результаты продемонстрировали, что цилостазол может не только предотвратить прогрессирование ICAS, но даже усилить его регресс. Кроме того, в обеих группах в течение 6-месячного периода исследования не было ни ишемического, ни геморрагического инсульта, ни ТИА.
Однако исследование TOSS II (таблица 1) не выявило преимущества цилостазола (100 мг два раза в день) и аспирина (75–150 мг один раз в день) перед клопидогрелом (75 мг один раз в день) и аспирином (75–150). мг один раз в сутки) для предотвращения прогрессирования ICAS и возникновения новых ишемических очагов на территории ICAS при контрольной МРТ через 7 месяцев [52].Оценка безопасности показала, что серьезные геморрагические осложнения существенно не различались в обеих группах.
Хотя оба исследования TOSS I и II имеют ограничения, включая оценку только радиологических маркеров, но не клинических событий, корейскую этническую принадлежность всех включенных пациентов, короткие периоды последующего наблюдения и небольшое количество включенных пациентов, цилостазол в настоящее время широко назначается пациентам с ICAS, в основном в Азии.
Тикагрелор — еще один антитромбоцитарный препарат, действующий как антагонист рецептора тромбоцитов P2Y 12 , который был изучен среди пациентов с некардиоэмболическим малым ишемическим инсультом или ТИА в SOCRATES (острый инсульт или транзиторная ишемическая атака, принимаемая аспирином или тикагрелором и исходы пациентов) исследование [111].Пациенты были рандомизированы для приема либо тикагрелора (нагрузочная доза 180 мг в 1-й день, затем 90 мг два раза в день в течение 90 дней) или аспирина (300 мг в 1-й день, а затем 100 мг / день в течение 90 дней). Хотя испытание не продемонстрировало превосходства тикагрелора над аспирином, было предложено, например, назначать носителям аллелей потери функции, вызывающих потенциальную резистентность к клопидогрелу, или пациентам с рецидивирующими цереброваскулярными ишемическими событиями.
Дополнительное исследование SOCRATES ( n = 3081) (Таблица 1) было сосредоточено на ишемических инсультах, вызванных ипсилатеральным атеросклеротическим заболеванием.В этом субисследовании тикагрелор превосходил аспирин в предотвращении повторного ишемического или геморрагического инсульта, инфаркта миокарда или смерти через 90 дней у пациентов с острым ишемическим инсультом или транзиторной ишемической атакой в сочетании с ипсилатеральным ICAS. Не было значительных различий в доле опасных для жизни, больших или незначительных кровотечений между обеими группами [112].
Прасугрел, который является еще одним антагонистом рецепторов антитромбоцитов и тромбоцитов P2Y 12 , сравнивался с клопидогрелом среди японских пациентов с некардиоэмболическим ишемическим инсультом (в течение 1-26 недель до включения) в PRASTRO-I (PRAsugrel и клопидогрел у японских пациентов с ишемическим инсультом) (таблица 1) [113].Пациенты были рандомизированы для приема прасугреля (3,75 мг / день) или клопидогрела (75 мг / день) перорально. Это исследование не подтвердило не меньшую эффективность прасугрела по сравнению с клопидогрелом в профилактике ишемического инсульта, инфаркта миокарда и смерти от других сосудистых причин у японских пациентов с некардиоэмболическим инсультом. Никаких проблем безопасности выявлено не было. Хотя в общей сложности 29% включенных пациентов имели атеросклероз крупных артерий, конкретное местоположение не было описано в этом исследовании.
Согласно рекомендациям AHA / ASA 2019, пациентам с некардиоэмболическим острым ишемическим инсультом рекомендуется использовать антитромботические препараты, а не пероральные антикоагулянты, чтобы снизить риск сосудистых событий (класс I; уровень доказательности A) [66].
В соответствии с рекомендациями AHA / ASA 2014, для пациентов с ишемическим инсультом или ТИА, ассоциированным как минимум с 50% ICAS основной внутричерепной артерии, для вторичной профилактики рекомендуется аспирин 325 мг / день, а не варфарин (класс I; уровень доказательства B).По крайней мере, для 70% ICAS рекомендации AHA / ASA 2014 заявляют, что добавление клопидогреля 75 мг / день к 100 мг / день аспирина в течение 90 дней может быть разумным (класс IIb; уровень доказательности B) [56].
Согласно рекомендациям AHA / ASA 2014 для пациентов с ишемическим инсультом или ТИА, обусловленным 50% -ным или более высоким ICAS основной внутричерепной артерии, данных недостаточно, чтобы дать рекомендацию по вторичной профилактике инсульта относительно полезности одного клопидогреля, т. комбинация аспирина и дипиридамола или только цилостазол (класс IIb; уровень доказательности C) [56].
Стеноз мозговой артерии | Сидарс-Синай
Обзор
Когда артерия внутри черепа блокируется бляшкой или болезнью, это называется стенозом артерии головного мозга. Артерии в любом месте тела могут быть заблокированы. Например, стеноз сонной артерии — это сужение большой артерии шеи, сонной артерии, которая снабжает мозг богатой кислородом кровью. Заблокированные артерии в сердце часто приводят к сердечному приступу или боли в груди.
Заблокированные артерии в головном мозге создают особые проблемы.Эти артерии меньше сонных артерий и могут быть скрыты глубоко внутри мозга, где хирургу гораздо труднее добраться до них.
Без лечения стеноз мозговой артерии может значительно увеличить вероятность преходящих ишемических атак (ТИА), мини-инсультов или инсультов.
Лечение
Варианты лечения Стеноз мозговой артерииОбычно первым шагом к лечению стеноза церебральной артерии являются лекарственные препараты.Разжижающие кровь препараты, такие как аспирин или клопидогрель, могут помочь предотвратить образование сгустка в артерии. Статины могут помочь предотвратить дальнейшее накопление холестериновых бляшек в артериях.
Если сужение артерии серьезное и не поддается лечению, или если ее закупорка превышает 50%, может потребоваться более инвазивное лечение. Основные варианты лечения сужения артерий головного мозга:
- Ангиопластика для повторного открытия артерии с возможным стентированием
- Шунтирование мозговой артерии
Ангиопластика с возможным стентированием для лечения стеноза мозговой артерии
Эта процедура проводится в ангиографическом кабинете.Во время этой процедуры в артерию в паху вводят трубку и продвигают ее к суженной артерии. В трубку вставляется небольшой баллончик. Достигнув суженной части артерии, ее открывают. Это называется ангиопластикой.
Затем через трубку в паху вводится небольшая сетчатая трубка в область сужения. Это устройство называется стентом. Стент ставят на место и оставляют в артерии. Со временем ткани артерии вокруг стента разрастаются.
Современные знания об окклюзии крупных сосудов вследствие внутричерепного атеросклероза: акцент на ранней диагностике | Китайский нейрохирургический журнал
Adams HP Jr, Bendixen BH, Kappelle LJ, et al. Классификация подтипа острого ишемического инсульта. Определения для использования в многоцелевом клиническом исследовании. ТОСТ. Испытание Org 10172 при лечении острого инсульта. Гладить. 1993. 24 (1): 35–41.
PubMed Google ученый
Видале С., Агостони Э. Эндоваскулярное лечение ишемического инсульта: обновленный метаанализ эффективности и безопасности. Эндоваскулярная хирургия Vasc. 2017; 51 (4): 215–9.
PubMed Google ученый
Гариэль Ф., Лаперг Б., Бурсье Р. и др. Результаты механической тромбэктомии с внутривенным тромболизисом или без него. Гладить. 2018; 49 (10): 2383–90.
PubMed Google ученый
Ким Би Джей, Ким Дж. Классификация подтипов ишемического инсульта: азиатская точка зрения. J Stroke. 2014; 16 (1): 8–17.
PubMed PubMed Central Google ученый
Цанг АСО, Орру Э., Клостранец Дж. М. и др. Результаты тромбэктомии окклюзий, связанных с внутричерепным атеросклерозом. Гладить. 2019; 50 (6): 1460–6.
PubMed Google ученый
Чанг Й, Ким Б.М., Банг ОЙ и др.Аварийное стентирование при неудачной механической тромбэктомии при остром ишемическом инсульте: многоцентровый опыт. Гладить. 2018; 49 (4): 958–64.
PubMed Google ученый
Пэк Дж. Х., Ким Б. М., Хео Дж. Х. и др. Результаты эндоваскулярного лечения острой окклюзии крупных сосудов, связанной с внутричерепным атеросклерозом. Гладить. 2018; 49 (11): 2699–705.
PubMed Google ученый
Пауэрс В.Дж., Рабинштейн А.А., Акерсон Т. и др. Рекомендации по раннему ведению пациентов с острым ишемическим инсультом: обновление 2019 г. до рекомендаций 2018 г. по раннему ведению острого ишемического инсульта: руководство для медицинских работников Американской кардиологической ассоциации / Американской ассоциации по инсульту. Гладить. 2019; 50 (12): e344–418.
PubMed Google ученый
Tsang ACO, Lau KK, Tsang FCP, et al. Тяжесть кальцификации внутричерепной сонной артерии при окклюзии, связанной с внутричерепным атеросклерозом, после эндоваскулярной тромбэктомии.Clin Neurol Neurosurg. 2018; 174: 214–6.
PubMed Google ученый
Fan Y, Li Y, Zhang T, et al. Эндоваскулярная терапия острой вертебробазилярной окклюзии, лежащей в основе атеросклероза: опыт одного учреждения. Clin Neurol Neurosurg. 2019; 176: 78–82.
PubMed Google ученый
Ли Й.Й., Юн В., Ким С.К. и др. Острая окклюзия базилярной артерии: различия в характеристиках и результатах эндоваскулярной терапии между пациентами с тяжелым атеросклеротическим стенозом и без него.AJNR Am J Neuroradiol. 2017; 38 (8): 1600–4.
CAS PubMed Google ученый
Зайдат О.О., Вулф Т., Хуссейн С.И. и др. Интервенционная терапия острого ишемического инсульта с внутричерепным саморасширяющимся стентом. Гладить. 2008. 39 (8): 2392–5.
PubMed Google ученый
Юн В., Ким С.К., Парк М.С. и др. Эндоваскулярное лечение и исходы атеросклеротического внутричерепного стеноза у пациентов с острым инсультом.Нейрохирургия. 2015; 76 (6): 680–6 обсуждение 686.
PubMed Google ученый
Цзя Б., Фенг Л., Либескинд Д.С. и др. Механическая тромбэктомия и спасательная терапия при окклюзии внутричерепной крупной артерии на фоне атеросклероза. J Neurointerv Surg. 2018; 10 (8): 746–50.
PubMed Google ученый
Ли Дж. С., Хонг Дж. М., Ли К. С. и др. Эндоваскулярная терапия окклюзии церебральных артерий: внутричерепной атеросклероз против эмболии.J Stroke Cerebrovasc Dis. 2015; 24 (9): 2074–80.
PubMed Google ученый
Kim GE, Yoon W, Kim SK, et al. Частота и клиническое значение острой реокклюзии после экстренной ангиопластики или стентирования по поводу основного внутричерепного стеноза у пациентов с острым инсультом. AJNR Am J Neuroradiol. 2016; 37 (9): 1690–5.
CAS PubMed Google ученый
Либескинд Д.С., Котсонис Г.А., Савер Дж.Л. и др. Коллатеральное кровообращение при симптоматическом внутричерепном атеросклерозе. J Cereb Blood Flow Metab. 2011. 31 (5): 1293–301.
PubMed Google ученый
Lau AY, Wong EH, Wong A, et al. Значение хорошей побочной компенсации при симптоматическом внутричерепном атеросклерозе. Cerebrovasc Dis. 2012. 33 (6): 517–24.
CAS PubMed Google ученый
Ким HJ, Ли SJ, Jung KO. Связь сопутствующего внутричерепного атеросклеротического стеноза с коллатеральным статусом у пациентов с возникшей окклюзией крупных сосудов. World Neurosurg. 2019; 128: e1102–8.
PubMed Google ученый
Пэк Дж. Х., Ким Б. М., Ким Д. Д. и др. Важность окклюзии туловищного типа при тромбэктомии с использованием стентривера при остром инсульте. Неврология. 2016; 87 (15): 1542–50.
PubMed Google ученый
Пэк Дж. Х., Ким Б. М., Ю Дж и др. Прогностическая ценность определяемого компьютерной томографией типа окклюзии при тромбэктомии со стент-ретривером. Гладить. 2017; 48 (10): 2746–52.
PubMed Google ученый
Yi TY, Chen WH, Wu YM, et al. Микрокатетер «Эффект первого прохождения» позволяет прогнозировать острую окклюзию внутричерепной артерии, связанную с атеросклеротическим заболеванием. Нейрохирургия. 2019; 84 (6): 1296–305.
PubMed Google ученый
Ким Б.Дж., Ким С.М., Кан Д.В. и др. Извитость сосудов может быть связана с атеросклерозом внутричерепных артерий. Int J Stroke. 2015; 10 (7): 1081–6.
PubMed Google ученый
Ли, Х., Й. Чжан, Л. Чжан и др., Эндоваскулярное лечение острого ишемического инсульта, вызванного внутричерепной атеросклеротической окклюзией крупных сосудов: систематический обзор. Clin Neuroradiol, 2019.
Boulanger M, Lapergue B, Turjman F, et al.Контактная аспирация первой линии по сравнению с тромбэктомией со стент-ретривером у пациентов с острым ишемическим инсультом с окклюзией крупных артерий в переднем отделе кровообращения: систематический обзор и метаанализ. Interv Neuroradiol. 2019; 25 (3): 244–53.
PubMed PubMed Central Google ученый
Мартини М., Мокко Дж., Тюрк А. и др. «Реальное» сравнение прямой аспирации и механической тромбэктомии со стент-ретривером для лечения острого ишемического инсульта в переднем кровотоке: многоцентровое международное ретроспективное исследование.J Neurointerv Surg. 2019; 11 (10): 957–63.
PubMed Google ученый
Kang, D.H., W. Yoon, B.H. Baek и др., Фронтальная тромбэктомия при острой окклюзии крупных сосудов с тяжелым внутричерепным стенозом: стент-ретривер против контактной аспирации. Журнал Neurosurg, 2019: с. 1-7.
Ян Д., Линь М., Ван С. и др. Первичная ангиопластика и стентирование могут быть лучше тромбэктомии при острой атеросклеротической окклюзии крупных артерий.Interv Neuroradiol. 2018; 24 (4): 412–20.
PubMed PubMed Central Google ученый
Пэк Дж. Х., Ким Б. М., Хео Дж. Х. и др. Эндоваскулярные и клинические исходы окклюзии крупных сосудов вертебробазилярного внутричерепного атеросклероза. Фронт Neurol. 2019; 10: 215.
PubMed PubMed Central Google ученый
Ратчфорд Э.В., Джин З., Ди Туллио М.Р. и др.Каротидный шум для обнаружения гемодинамически значимого стеноза сонной артерии: исследование Северного Манхэттена. Neurol Res. 2009. 31 (7): 748–52.
PubMed PubMed Central Google ученый
Сираиси М., Хасегава Ю., Нарита Н. и др. Связь между бессимптомным внутричерепным стенозом и результатами экстракраниального артериосклероза при осмотрах здоровья на рабочем месте: пилотное исследование. J Stroke Cerebrovasc Dis. 2019; 28 (9): 2429–33.
PubMed Google ученый
Дель Брутто, Огайо, Мера Р.М., Проект Атауальпа I. Роль плечевого пульсового давления как индикатора внутричерепного атеросклероза: проект Атауальпа. High Blood Press Cardiovasc Пред. 2017; 24 (4): 419–24.
PubMed Google ученый
Гокджал Э., Нифталиев Э., Оздемир Т. и др. Связь вертебробазилярной кальцификации с этиологическими подтипами, рецидивом инсульта и исходом острого ишемического инсульта ствола головного мозга.Neurol Neurochir Pol. 2018; 52 (2): 188–93.
PubMed Google ученый
Табуас-Перейра М., Сардженто-Фрейтас Дж., Силва Ф. и др. Внутричерепная кальцификация стенки внутренней сонной артерии при ишемических инсультах, леченных тромболизисом. Eur Neurol. 2018; 79 (1-2): 21–6.
PubMed Google ученый
Sporns PB, Hanning U, Schwindt W. et al. Ишемический инсульт: гистологический состав тромба и ослабление КТ до вмешательства связаны со временем вмешательства и частотой вторичной эмболии.Cerebrovasc Dis. 2017; 44 (5-6): 344–50.
CAS PubMed Google ученый
Берндт М., Фридрих Б., Маегерлейн С. и др. Проницаемость тромба при поступлении на компьютерную томографию указывает на патогенез инсульта на основании гистологии тромба. Гладить. 2018; 49 (11): 2674–82.
PubMed Google ученый
Гирей С., Оздемир О, Бас Д.Ф. и др. Влияет ли этиология инсульта на прогноз исхода у пациентов с острым инсультом, перенесших эндоваскулярное лечение с использованием стент-ретриверов? J Neurol Sci.2017; 372: 104–9.
PubMed Google ученый
Гарсия-Бермеджо П., Патро С.Н., Ахмед А.З. и др. Исходный ангиографический вид окклюзии при механической тромбэктомии предполагает основную этиологию и исход. Фронт Neurol. 2019; 10: 499.
PubMed PubMed Central Google ученый
Kim HJ, Yun SC, Cho KH, et al. Дифференциальные закономерности развития острого инфаркта средней мозговой артерии с несоответствием перфузии и диффузии: атеросклеротический vs.кардиоэмболическая окклюзия. J Neurol Sci. 2008. 273 (1-2): 93–8.
PubMed Google ученый
Zhang H, Sun X, Huang Q, et al. Острую окклюзию средней мозговой артерии, связанную с внутричерепным атеросклеротическим заболеванием, можно предсказать с помощью диффузионно-взвешенной визуализации. Front Neurosci. 2019; 13: 903.
PubMed PubMed Central Google ученый
Килбург К., Скотт МакНалли Дж., Де Хэвенон А. и др.Расширенная визуализация при остром ишемическом инсульте. Нейрохирург Фокус. 2017; 42 (4): E10.
PubMed Google ученый
Даффис Э. Дж., Джетва П., Гупта Г. и др. Точность компьютерной томографической ангиографии по сравнению с цифровой вычитающей ангиографией в диагностике внутричерепного стеноза и ее влияние на принятие клинических решений. J Stroke Cerebrovasc Dis. 2013. 22 (7): 1013–7.
PubMed Google ученый
Kappelhof M, Marquering HA, Berkhemer OA, et al. Точность КТ-ангиографии для дифференциации псевдоокклюзии от истинной окклюзии или стеноза экстракраниальной ВСА высокой степени при остром ишемическом инсульте: ретроспективное подисследование MR CLEAN. AJNR Am J Neuroradiol. 2018; 39 (5): 892–8.
CAS PubMed PubMed Central Google ученый
Liebeskind DS, Kosinski AS, Saver JL, et al. Компьютерная томографическая ангиография в исследовании исходов инсульта и нейровизуализация внутричерепного атеросклероза (SONIA).Interv Neurol. 2014; 2 (4): 153–9.
PubMed PubMed Central Google ученый
Guglielmi V, LeCouffe NE, Zinkstok SM, et al. Коллатеральное кровообращение и исходы при атеросклеротической и кардиоэмболической окклюзии крупных сосудов головного мозга. Гладить. 2019; 50 (12): 3360–8.
PubMed Google ученый
Rebello LC, Bouslama M, Haussen DC, et al. Этиология и побочные эффекты инсульта: атероэмболический инсульт имеет большее количество побочных эффектов, чем кардиоэмболический инсульт.Eur J Neurol. 2017; 24 (6): 762–7.
CAS PubMed Google ученый
Z Chen, F Shi, M Zhang, X Gong, L Lin, M Lou, et al., Прогнозирование признака многосегментного тромба при динамической КТ-ангиографии кардиоэмболического инсульта. AJNR Am J Neuroradiol 2018. 39 (4): p. 663-6668.
Lee JS, Lee SJ, Hong JM, et al. Тромбэктомия Solitaire при остром инсульте из-за окклюзии, связанной с внутричерепным атеросклерозом: исследование ROSE ASSIST.Фронт Neurol. 2018; 9: 1064.
PubMed PubMed Central Google ученый
Kim YW, Hong JM, Park DG, et al. Влияние внутричерепного атеросклеротического заболевания на эндоваскулярное лечение пациентов с острой вертебробазилярной окклюзией. AJNR Am J Neuroradiol. 2016; 37 (11): 2072–8.
CAS PubMed Google ученый
Eesa M, Hill MD, Al-Khathaami A, et al.Роль морфологических характеристик КТ ангиографических бляшек в дополнение к стенозу в прогнозировании симптоматической стороны заболевания сонной артерии. AJNR Am J Neuroradiol. 2010. 31 (7): 1254–60.
CAS PubMed Google ученый
Kim H, Kwak HS, Chung GH, et al. Дифференциация псевдоокклюзии от истинной окклюзии проксимального отдела внутренней сонной артерии при остром ишемическом инсульте с помощью КТ-ангиографии. Clin Neurol Neurosurg. 2019; 185: 105495.
PubMed Google ученый
Хорие Н., Татейши Ю., Морикава М. и др. Острый инсульт с окклюзией крупных внутричерепных сосудов: характеристики кардиоэмболии и стеноза / окклюзии, связанного с атеросклерозом. J Clin Neurosci. 2016; 32: 24–9.
PubMed Google ученый
Альберс Г.В., Лансберг М.Г., Норбаш А.М. и др. Выход МРТ с диффузионно-взвешенным анализом для выявления потенциально значимых результатов у пациентов с инсультом.Неврология. 2000. 54 (8): 1562–7.
CAS PubMed Google ученый
Jeon SB, Kang DW, Kim JS, et al. Гомоцистеин, болезнь мелких сосудов и атеросклероз: МРТ-исследование 825 пациентов с инсультом. Неврология. 2014; 83 (8): 695–701.
CAS PubMed Google ученый
Cho AH, Kwon SU, Kim JS, et al. Оценка ранних динамических изменений окклюзии внутричерепных артерий полезна для диагностики этиологии инсульта.J Neurol Sci. 2012; 312 (1-2): 127–30.
PubMed Google ученый
Баш С., Виллабланка Дж. П., Джахан Р. и др. Стеноз внутричерепных сосудов и окклюзионное заболевание: оценка с помощью КТ-ангиографии, МР-ангиографии и цифровой субтракционной ангиографии. AJNR Am J Neuroradiol. 2005. 26 (5): 1012–21.
PubMed Google ученый
Zhu XJ, Wang W, Liu ZJ. Магнитно-резонансная томография стенок сосудов высокого разрешения при стенозе внутричерепных артерий.Чин Мед Дж (англ.). 2016; 129 (11): 1363–70.
Google ученый
Qiao Y, Zeiler SR, Mirbagheri S, et al. Увеличение внутричерепных бляшек у пациентов с цереброваскулярными нарушениями на МР-изображениях с высоким пространственным разрешением. Радиология. 2014; 271 (2): 534–42.
PubMed PubMed Central Google ученый
Mugler JP 3rd. Оптимизированная трехмерная МРТ с быстрым спин-эхом.J. Магнитно-резонансная томография. 2014. 39 (4): 745–67.
PubMed Google ученый
де Хавенон А., Мосса-Баша М., Шах Л. и др. МРТ сосудистой стенки высокого разрешения для оценки внутричерепного атеросклероза. Нейрорадиология. 2017; 59 (12): 1193–202.
PubMed Google ученый
Kim SM, Ryu CW, Jahng GH, et al. Две разные морфологии хронической односторонней окклюзии средней мозговой артерии: оценка с помощью МРТ высокого разрешения.J Neuroimaging. 2014; 24 (5): 460–6.
PubMed Google ученый
Ryu CW, Jahng GH, Kim EJ et al. МРТ стенки и просвета средних мозговых артерий с высоким разрешением при 3 тесла. Cerebrovasc Dis. 2009. 27 (5): 433–42.
PubMed Google ученый
Kim YS, Lim SH, Oh KW, et al. Преимущество МРТ высокого разрешения при оценке базилярных бляшек: сравнительное исследование с МРА.Атеросклероз. 2012. 224 (2): 411–6.
CAS PubMed Google ученый
Ryoo S, Lee MJ, Cha J и др. Дифференциальные патофизиологические типы сосудов внутричерепного атеросклеротического инсульта: исследование магнитно-резонансной томографии стен с высоким разрешением. Гладить. 2015; 46 (10): 2815–21.
CAS PubMed Google ученый
Hui FK, Zhu X, Jones SE, et al.Ранний опыт проведения МРТ высокого разрешения при окклюзии крупных сосудов. J Neurointerv Surg. 2015; 7 (7): 509–16.
PubMed Google ученый
Qiao Y, Anwar Z, Intrapiromkul J, et al. Паттерны и последствия ремоделирования внутричерепных артерий у пациентов с инсультом. Гладить. 2016; 47 (2): 434–40.
CAS PubMed PubMed Central Google ученый
Zhang D-F, Chen Y-C, Chen H, et al.МРТ-исследование с высоким разрешением взаимосвязи между моделями ремоделирования и ишемическим инсультом у пациентов с атеросклеротическим стенозом средней мозговой артерии. Front Aging Neurosci. 2017; 9: 140.
PubMed PubMed Central Google ученый
Zhang R, Zhou Y, Liu C, et al. Переоценка признака восприимчивости сосудов: прогностический маркер причины инсульта. Гладить. 2017. 48 (7): 1993–6.
PubMed Google ученый
Ямамото Н., Сатоми Дж., Тада Й. и др. Признак двухуровневой восприимчивости сосуда на визуализации с взвешенным значением 3 тесла T2 * является прогностическим биомаркером подтипа инсульта. Гладить. 2015; 46 (1): 269–71.
PubMed Google ученый
Дай В., Ли Д., Цай Й и др. Связь между гомоцистеином и многососудистым атеросклерозом в сосудистых ложах, связанных с инсультом, определена с помощью трехмерной магнитно-резонансной томографии стенок сосудов. J Clin Neurosci.2019; 70: 72–8.
CAS PubMed Google ученый
Чжан С., Ван Н., Чен Л. и др. Альдостерон в сыворотке крови связан с атеросклерозом и кальцификацией церебральных артерий. J Stroke Cerebrovasc Dis. 2019; 28 (3): 523–30.
PubMed Google ученый
Ван X, Ли В.

 Для этого 2 ч. ложки травы залить 300 мл кипятка, настаивать 2 часа, процедить и принимать по 1 ст. ложке 3 раза в день. Растение ядовито, поэтому врачебный контроль желателен. При самостоятельном лечении — курс 10—12 дней.
Для этого 2 ч. ложки травы залить 300 мл кипятка, настаивать 2 часа, процедить и принимать по 1 ст. ложке 3 раза в день. Растение ядовито, поэтому врачебный контроль желателен. При самостоятельном лечении — курс 10—12 дней.
