ИДЦ — Иркутский диагностический центр
Витамин В-12 (количественный тест)(сыворотка крови)
Описание услуги
Код услуги:
2Ж6075
Готовность результатов:
через 2 рабочих дня, после 17:00
Витамин В12 (кобаламин) поступает в организм с животной пищей. Всасывание витамина В12 требует присутствия внутреннего фактора, секретируемого желудком. У больных, перенесших гастрэктомию, могут развиться симптомы недостаточности витамина В12. Он необходим для нормального кроветворения. Его дефицит ведет к нарушению синтеза ДНК и РНК. Этот тест полезен для правильной диагностики макроцитарных и мегалобластических анемий. Большая часть витамина В12 связана с белком транскобаламином (альфа-глобулин). После внутреннего введения уровень свободного витамина В12 значительно повышается. Недостаток витамина В12 может также привести к развитию серьёзных неврологических нарушений.
Уровень циркулирующего В12 обычно является хорошим показателем его содержания в тканях. То есть при дефиците витамина В12 его уровень в сыворотке и плазме будет низким, а при отсутствии дефицита – нормальным или повышенным. Исключения из этого правила случаются в тех случаях, когда уровень белков-носителей витамина В12 выходит за пределы нормы. Так, низкие значения циркулирующего витамина В12 при отсутствии дефицита В12 могут отмечаться при низком уровне транскобаламина I (физиологически неактивный транспортный белок).

Для сдачи биоматериала (кровь из вены) обратиться в регистратуру клинико-диагностической лаборатории на 2 этаже. Перед сдачей анализов рекомендуется воздержаться от приема пищи в течение не менее 3 часов. Можно пить воду без газа.
Анализ крови на биохимию
Биохимический анализ крови – это метод лабораторной диагностики, позволяющий оценить работу многих внутренних органов: почек, печени, поджелудочной железы и других. Кроме того, это исследование показывает весь спектр микроэлементов вашего организма, безошибочно определяя, каких ему в данный момент не хватает.
Татьяна Веселова, врач-терапевт, к. м. н.
Стандартный биохимический анализ крови включает в себя определение большого числа показателей. Какие параметры будут исследоваться в этом анализе, зависит от заболевания и определяются лечащим врачом. Попробуем расшифровать некоторые из них. Приводя нормы (референсные значения) для отдельных показателей, напомним, что в различных лабораториях они могут несколько отличаться.
Общий белок
Определение общего белка в сыворотке крови используется для диагностики заболеваний печени, почек, онкологических заболеваний, нарушений питания.
Норма содержания общего белка крови – 64–83 г/л.
Повышенное содержание белка бывает при острых и хронических инфекционных заболеваниях, онкологической патологии, болезнях крови, обезвоживании. Снижение уровня белка чаще всего вызывают заболевания печени, почек, кишечника, голодание и некоторые другие.
Альбумины и глобулины
Изменение соотношения отдельных белковых фракций (альбумины и глобулины) в крови зачастую дают врачу более значимую информацию, нежели просто знание уровня общего белка.
Нормы:
альбумин
40–60%
глобулины, общее количество
40–60%
γ-глобулины
15–20%
α-1 глобулины
1–8%
α-2 глобулины
1–8%
β-глобулины
10–12%
По соотношению отдельных фракций можно судить о множестве состояний и нарушений. Например, падение уровня альбумина может говорить о болезнях печени, почек или кишечника. Обычно этот показатель снижен при сахарном диабете, тяжелой аллергии, ожогах, воспалительных процессах. В норме он понижен у кормящих матерей и курильщиков. Повышенный показатель альбумина – сигнал о нарушениях иммунной системы или обмена веществ. Точную оценку, почему произошел сдвиг в соотношении белков, может дать только врач, назначивший анализ.
Например, падение уровня альбумина может говорить о болезнях печени, почек или кишечника. Обычно этот показатель снижен при сахарном диабете, тяжелой аллергии, ожогах, воспалительных процессах. В норме он понижен у кормящих матерей и курильщиков. Повышенный показатель альбумина – сигнал о нарушениях иммунной системы или обмена веществ. Точную оценку, почему произошел сдвиг в соотношении белков, может дать только врач, назначивший анализ.
СРБ
C-реактивный белок (СРБ) – показатель, который быстрее других реагирует на – повреждение тканей.
Норма СРБ: – менее 0,5 мг/л.
При воспалительных процессах инфекционной природы (бронхит, ангина и т. д.) и системном воспалении (системная красная волчанка, ревматизм), а также при опухолях его содержание увеличивается. С помощью этого показателя можно определить тяжесть болезни и эффективность лечения.
РФ
Ревматоидный фактор (РФ) – показатель ревматоидного артрита (обнаруживается у 75 –80%больных). Показаниями для назначения этого анализа являются ревматоидный артрит, острые воспалительные процессы, системные заболевания, гепатит, саркоидоз.
РФ определяют двумя способами, для качественного анализа норма – «отрицательно», для количественного анализа – менее 14МЕ/мл.
Трансферрин, ферритин,ЖСС
Эти показатели исследуются для углубленной диагностики анемии, определения связи анемии с нарушенным поступлением или обменом железа в организме. Трансферрин – белок в плазме крови, основной переносчик железа. Ферритин – основной показатель запасов железа в организме. Железосвязывающая способность сыворотки крови (ЖСС) – показатель, характеризующий способность сыворотки крови к связыванию железа.
Нормы:
трансферрин
2,0–4,0 г/л
ферритин для мужчин
20–250 мкг/л
ферритин для женщин
10–120 мкг/л
ЖСС
30–85 мкмоль/л
На основании величины и соотношения этих показателей врач делает заключение о природе заболевания и методах лечения.
Гликозилированный гемоглобин
В соответствии с рекомендациями Всемирной организации здравоохранения (ВОЗ) это самый эффективный и необходимый показатель в диагностике сахарного диабета. Больным сахарным диабетом рекомендуется сдавать биохимический анализ крови на гликозилированный гемоглобин не реже 1 раза в квартал.
Норма гликозилированного гемоглобина
для мужчин –135–160 г/л,
для женщин 120–140 г/л.
Глюкоза
Это основной показатель углеводного обмена.
Норма глюкозы в крови – 3,8–5,83 ммоль/л,
с 60 лет уровень глюкозы в норме возрастает до 6,38 ммоль/л.
Увеличение содержания глюкозы наблюдается при сахарном диабете. Повышение этого показателя может быть в первые часы инсульта, инфаркта, при травмах, инфекциях, панкреатите, а также на фоне сильного стресса и курения. Понижение уровня глюкозы крови сопровождает некоторые эндокринные заболевания, нарушение функции печени.
Билирубин
Билирубин – продукт распада гемоглобина. Он входит в состав желчи. Анализ билирубина назначается, чтобы оценить работу печени и желчного пузыря. Билирубин существует в двух формах – прямой и непрямой. Вместе эти формы образуют общий билирубин.
Нормы:
общий билирубин
3,4–17,1 мкмоль/л
прямой билирубин
0–3,4 мкмоль/л
Если происходит повышение билирубина в крови, то это зачастую сопровождается пожелтением кожи и белков глаз (желтуха), что является признаком неблагополучия в организме. Чаще всего к повышению уровня билирубина приводит дефицит витамина В12, заболевания печени и желчного пузыря.
Мочевина и креатинин
Это продукты расщепления белков. Они образуются в печени и выводятся из организма почками.
Нормы:
мочевина
2,5–6,4 ммоль/л
креатинин для женщин
53–97 мкмоль/л
креатинин для мужчин
62–115 мкмоль/л
Повышение уровня мочевины обнаруживается при заболевании почек и мочевыводящих путей, сердечной недостаточности, шоковых состояниях, а также после большой физической нагрузки и на фоне приема гормональных препаратов. Подъем уровня креатинина наблюдается не только при патологии почек, но и при поражении мышц.
Подъем уровня креатинина наблюдается не только при патологии почек, но и при поражении мышц.
Наиболее частыми причинами снижения мочевины и креатинина в анализе крови являются: голодание, вегетарианская диета, снижение мышечной массы, первая половина беременности, прием кортикостероидов.
Мочевая кислота
Мочевая кислота отвечает за выведение из организма избытка азота. Она синтезируется в печени и выводится почками. Если работа почек нарушена, то она накапливается в организме и приводит к повреждению различных органов.
Норма мочевой кислоты
для женщин
145–400 мкмоль/л
для мужчин
210–450 мкмоль/л
Повышение уровня мочевой кислоты происходит в первую очередь при подагре, а также при острых инфекциях, почечнокаменной болезни, сахарном диабете.
АЛТ и АСТ
Аланинаминотрансфераза (АЛТ или АлАТ) и аспартатаминотрансфераза (АСТ или АсАТ) – это ферменты печени, участвующие в белковом обмене. Они содержатся в большом количестве в печени, почках, в сердечной мышце и скелетной мускулатуре.
Нормы:
АЛТ
до 30 ед./л
АСТ
до 41 ед./л
Степень повышения этих показателей в совокупности с другими отклонениями дает врачу информацию о целом ряде возможных проблем в организме.
Альфа-амилаза (диастаза)
Она вырабатывается в слюнных железах и поджелудочной железе, а панкреатическая амилаза – только в поджелудочной железе. Обе они участвуют в переваривании углеводов.
Нормы:
альфа-амилаза
28–100 ед/л
амилаза панкреатическая
0–50 ед./л
Эти показатели, как правило, повышаются при заболеваниях поджелудочной железы, сахарном диабете, почечной недостаточности. Снижение уровня амилазы в крови может свидетельствовать о гепатите и эндокринных нарушениях.
Снижение уровня амилазы в крови может свидетельствовать о гепатите и эндокринных нарушениях.
Минеральный обмен
Также биохимический анализ крови позволяет исследовать состояние минерального обмена. Наиболее часто исследуются железо, калий, натрий, кальций, магний, хлор, витамин В12.
Нормы:
железо
9–30 мкмоль/л
калий
3,5–5,5 ммоль/л
натрий
136–145 ммоль/л
кальций
2,15–2,50 ммоль/л
магний
0,65–1,05 ммоль/л
хлор
98–107 ммоль/л
витамин В12
180–900 пг/мл
Изменение уровня этих веществ является вспомогательным показателем для оценки множества патологических состояний.
Результаты анализа
Получив результат биохимического анализа крови, легко сравнить показатели своего анализа с нормой. Отклонение от нормы – это сигнал о том, что произошли нарушения в деятельности организма.
Правильно оценить результаты анализа и поставить диагноз может только опытный врач.
Альфа-2-макроглобулин как главный цитокин-связывающий белок плазмы крови Текст научной статьи по специальности «Фундаментальная медицина»
Медицинская иммунология Cifirmnui
1999, Т. 1, № 5, стр 5-12 UUJUpbl
& 1999. СПб РО РААКИ
АЛЬФА-2-МАКРОГЛОБУЛИН КАК ГЛАВНЫЙ ЦИТОКИН-СВЯЗЫВАЮЩИЙ БЕЛОК ПЛАЗМЫ КРОВИ
Дорофейков В.В., Фрейдлин Т.С., Щербак И.Г.
Санкт-Петербургский Государственный медицинский университет имели академика И.
Резюме. Лльфа-2-макроглобулин (МГ) — высокомолекулярный белок крови, обнаруживаемый и сыворотке и других нпесосудистых жидкостях и концентрации 2-4 мг/мл в зависимости от пола и возраста. Ключевая физиологическая роль МГ подтверждается тем, что не было описано пи одного случая отсутствия гена этого протеина. МГ является уникальным эндогенным ингибитором протешш, который, взаимодействуя с энзимами, лишает их протеипазпон активности, по сохраняет их способность гидролизовать пептиды. Взаимодействие между МГ и протеиназами приводит к копформациоппым изменениям молекулы ингибитора, которые проявляются в увеличении его электрофоретической подвижности и экспозиции особого гидрофобного ре-цептор-связывающего участка. Это приводит к быстрому удалению МГ из сосудистого русла за счет поглощения гсиатоцитами, макрофагами и фибробластами. Недавно было покачано, ч то различные формы МГ связывают такие цитокппы как IL-1, 2, 6, 8, TNF-a PDGF, FGF, NGF, TGF и др. Важнейшие механизмы и функциональное значение трех типов взаимодействия МГ с цптокнпами обобщены.
Ключевые слова: и-2-макрогпабулин, цитокины, факторы роста
HUMAN ALPHA-2-MACROGLOBULIN AS A MAIN CYTOKINE-BINDING PLASMA PROTEIN.
Abstract. Alpha-2-inacroglobulin (MG) is a highly conserved major blood protein found at a concentration of 2-4 mg/ml in serum and extravascular fluid depending on age and sex. No recorded cases of MG gene deletion have been demonstrated to date, suggesting a key physiological importance. MG is a unique endogenous proteinase inhibitor that thoroughly abolishes proteinase activity while saving its peptidase one. Proteinase-MG interaction results in important changes in MG molecule.
2-глобулиповой фракции плазмы крови, был открыт в масса 720 к Л а), МГ состоит из четырех полипептид-
пачале 60-х годов как ингибитор илазмипа и трипсина пых цепей, образующих две иден тичные субъедипи-
и со временем занял центральное место среди всех эп- цы. Каждая из них содержит участок, подходящий для
догеппых ингибиторов иротеолитических ферментов атаки большинством известных протешш. Согласно
15,15,37,61). Уникальность этого белка заключается в теории А. Баррегга [13J, в результате гидролиза одной
способности связывать протеипазы всех четырех пзве- из пептидных связей в этом «приманочном» участке
стпых классов, а также в особом механизме взаимо- (bait region) в молекуле МГ открывается особая «ло-
действия с эт ими ферментами. Являясь наиболее вы- вушка», куда «пропаливается» нротеиназа.
сокомолекулярпым эндогенным ингибитором и одним «в плену», фермент не теряет полностью спою способность гидролизовать пептидные связи. Однако, суб-
Адрес для переписки: стратная специфичность протеипазы сужается. Фер-197022 Санкт-Петербург, ул. Л. Толстого 6/8, мент сохршшег способность гад[Юлизош1Ть относительная биохимии Санкт-Петербургского П() иебольшие молекулЫ( а большинство крупных бел-Государственного медицинского университета ,
имени академика МЛ. Павлова. ™ субстратов становятся для пего недоступными.
тел 238-70-10 факс 234-01-25 Биологическая роль этого феномена остается не впол-
Е-таИ: [email protected] !1е МС1ЮИ’
Одним из существенных моментов в функционировании МГ является наличие в каждой из субъе-диництак называемой тиолэфирной петли, образованной радикалами цистеина и глутамата. Такой участок встречается крайне редко в молекулах белков и обнаружен также в СЗ- и С4-комнопентах комплемента, которые поэтому были отнесены к семейству макро-глобулинов. При гидролизе тиолэфирной связи, например, под действием первичных аминов, упомянутая выше «ловушка» закрывается и МГ теряет способность связывать протеипазы [1,42]. Если МГ взаимодействует с нротеиназой, то тиолэфирпые связи гидролизуюгся и ингибитор утрачивает способность связывать дополнительное количество фермента. Элск-трофоретическ;ш подвижность МГ с гидролизовапны-ми тиолэфириыми связями несколько выше, чем у па-тпвнога, поэтому они получили иа;5вапие соответственно F (fast)- и S (Б1о\у)-форм [14J. В отечественной и иностранной литературе F-форму МГ часто называют также активированным макроглобулипом, что, по нашему мнению, является не вполне удачным. Дело в том, что МГ в F-форме уже выполнил свою функцию как ингибитор протеипаз, время его существования в кровеносном русле измеряется секундами, в то время как S-i|x)pMa является функционально активной [27,38]. В последние годы было показано, что F-формы МГ связываются с LRP-реценторамн па поверхности ге-патоцитов и всех клеток моноцитарпо-макрофагаль-ного ряда, а затем поглощаются внутрь клеток [9,10,31,41,45,62J.
В последние годы было показано, что F-формы МГ связываются с LRP-реценторамн па поверхности ге-патоцитов и всех клеток моноцитарпо-макрофагаль-ного ряда, а затем поглощаются внутрь клеток [9,10,31,41,45,62J.
В работах начала 90-х годов показана возможность взаимодействия различных форм МГ с биологически активными белково-пептидными молекулами, в том числе с инсулином, соматотронпым гормоном гипофиза и рядом цитокипов [20,23,46,47]. Данные приведены в таблице 1
Т. Matsuda и соапт. (1989) идентифицировали МГ «как связывающий белок для IL-6» [53]. Цитокин молекулярной массой 26 кДа, обработанный J125, инкубировали в течение трех часов с сывороткой и подвергали электрофорезу в ПААГ. Авторадиофафия показала образование дополнительной полосы, соответствовавшей по подвижности МГ. Затем аналогичные эксперименты провели с очищенными препаратами МГ. Чем выше была концентрация МГ, тем больше с ним связывалось IL-6. Было показано, что МГ в концепт-рации 2.5 мг/мл (близкой к физиологической) не препятствовал взаимодействию IL-6 с его рецепторами. При добавлении к очищенному гель-фильтрацией комплексу МГ-11,-6таких малоспецифичпых протеипаз как трипсин или катепсин G IL-6 гораздо лучше сохранялся, чем в отсутствие МГ. На основании этих экспериментальных данных был сделан вывод о роли МГ как главного бедка плазмы, способного комплексиро-вать с IL-6, транспортировать его и защищать от разрушения.
Таблица 1 .ВЗАИМОДЕЙСТВИЕ a-2-МАКРОГЛОБУЛИНА С ЦИТОКИНАМИ И БИОЛОГИЧЕСКИ АКТИВНЫМИ ПЕГЩЦАМИ.
Цитокин Форма МГ, связывающая цитокины Характер связи Биологическая активность цитокинов в составе комплексов с МГ Ссылки
TGF-ßl S.F Ковалентная Модулируется 29,30, 44,50, 55,68
TGF-ß2 S. юкусировапия, а также препарат ре-комбииаптного IL-1, меченный J125. С помощью электрофореза в ПААГ (5% ‘Г) выявлено отсутствие связывания между цитокином и плазменными белками. После обработки плазмы метиламином часть IL-1 сорбировалась на высокомолекулярном протеине, который и оказался быстрой формой МГ. В эксперимеп-
юкусировапия, а также препарат ре-комбииаптного IL-1, меченный J125. С помощью электрофореза в ПААГ (5% ‘Г) выявлено отсутствие связывания между цитокином и плазменными белками. После обработки плазмы метиламином часть IL-1 сорбировалась на высокомолекулярном протеине, который и оказался быстрой формой МГ. В эксперимеп-
тах с очищенным МГ показан пекошшептпый характер взаимодействия с IL-1 , а также возможность сорбции цитокипа на МГ, щхдаарительно подвергнутом обработке трипсином. В присутствии 2,5 мМ Zn ста нзаи-модействия между IL-1 и МГ заметно увеличивалась, хотя наличие этого катиона не было абсолютно необходимым. Изучая IL-подобную биологическую активность комплексов МГ-IL-l (J125), полученных гель-хроматог-рафией, авторы отмстили сохранение части такой активности в тимоцит-костимулирующем бпотесге.
Похожую работу выполнили А. Пашотич и Т. Ганз (1991 год) с главным пептидом из группы де<|>епзшюв человек;! (HNP-1). Радиография этого пептида, состоящего из 34 аминокислотных остатков, со свежей плазмой крови (срок хранения 3 суток) не показала связывания дефензипа пи с одним белком плазмы. В то же время после инкубации HNP-1 со «старой» плазмой (срок хранения 4 педели) обнаружили связывание пептида с про-теш юм, молекуляр! 1ая масса которого превышала 500 кДа Было показало, что им является Е-с|юрма МГ [56J.
Аналогичные методические приемы использовали Wollcnberg и соавт., опубликовавшие в 1991 г. статью о взаимодействии МГ, полученного хроматографией па Zn-сефарозе, с TNF-oc [69]. Важной особепностыо этой работы были эксперименты на животных (мышах), в которых было показало, что радиоактивно меченный TNF-a, предварительно комплексироваппый с F-формами МГ, быстро выводится из кровотока, несмотря па то, что МГ-рецепторы были предварительно блокированы инъекцией МГ, связанного с трипсином. Также был показан пекопалептпый характер взаимодействия между F-формами МГ и TNF-a. Это позволило авторам выдвинуть предположение о транспортной роли МГ для TNF-a.
Это позволило авторам выдвинуть предположение о транспортной роли МГ для TNF-a.
В дальнейшем было показано, что комплектованный с трипсином или катепсииом В МГ разрушает этот цитокин, в то время как ингибитор, связанный с плазмином или подвергнутый модификации метиламином, сорбирует TNF [2]. Интересные данные были получены J. Bonner о взаимодействии МГ и PDGF [18,19]. В плазме крови около 70% этого фактора роста связывалось с МГ пековалептно, а 30% — за счет дисульфидных связей. При снижении рН с 7.5 до 4.0 около половины фактора освобождалось с сохранением биолошческой активности.
Разнообразие процесса комплексообразования между цитокинами и МГ проявляется в различии форм МГ, с которыми предпочтительно связываются цитокипы. TNF-a имеет сходство с TGF-р, с TGF-P2, связываясь преимущественно с МГ-штазмином в присутствии на-тивного МГ. Подобным образом, МГ, обработанный метиламином, связывает значительно большие количества TNF-a, TGF-(3(,TGF-P2, IL-фи IL-2, чем нативпый МГ. Эти факты позволили авторам сделать предположение о том, что F-форма МГ является своеобразным «сборщиком» или «мусорщиком» для этих цитокипов, так как
их комплексы с М Г быстро уда’шклся из крови посредством Зешисимого от МГ-рецептора механизма клиренса [24,31,33]. Например, обработанный метиламином МГ в комплексе с TGF-ßl или TNF-a удаляются из системной циркуляции (Т1/2 3-4 мин) преимущественно МГ-рецепторами печени [44,55]. В пользу этого щэедполо-жеция говорят факты, о замедлении выведения этих комплексов из системной циркуляции мышей при 20-крат-иом избытке МГ-трипсипа, блокирующем свободные МГ-рецепторы [24,69].
Однако некоторые цитокипы, например, ГЬ-6 преимущественно связываются с нативным МГ. Ингибитор способен помимо цнтокинов образовывать комплексы и с другими биологачески активными полинеп-гидами. Так, F-форма МГ способна пековалептно связываться с дефензипами [56] и эозинофильным катионным белком [57].
Так, F-форма МГ способна пековалептно связываться с дефензипами [56] и эозинофильным катионным белком [57].
Совсем недавно была показана возможность связывания иативного МГ с ключевым энзимом катаболизма лшшдов — липопротеинлипазой [66]. Vivella L и соавторы при изучении взаимодействия лилонроте-иплипазы с плазменными липопротеинами обнаружили белок, пековалептно связывающий энзим. Протеин, оказавшийся a-2-макро глобул ином, сорбиров;и1 ди-поиротеишшпазу (гликопротеин с молекулярной массой 110 кДа), что подтвердили результаты электрофореза и гель-хроматофафии, с сохранением ее функциональной активности. В то же время преип-кубация липопротеиплипазы с гепарином существенно снижала силу и скорость взаимодействия энзима с МГ. Было показано, что гепарип-связывающий сайт липопротеиплипазы оказывается в ловушке МГ, хотя комплексировапие энзима с МГ не препятствует его взаимодействию с антителами в ELISA. Авторы не смогли высказать предположений о биологической роли такого взаимодействия, хотя сам факт не вызывает никаких сомнений, а специфичность такого взаимодействия была подтверждена контрольными экспериментами с другими белками.
Механизмы связывания белково-нентидных молекул с МГ изучены недостаточно [7,23]. В большинстве известных нам работ установлен только сам факт взаимодействия и определен ковалептпый или пековалеит-ный характер связывания. Так, дефензины, PDGF и инсулин ковалептпо связывают МГ, что доказывается стабильностью вновь образованных комплексов при электрофорезе в iюлиакрилам идиом геле в денатурирующих условиях. Комплексы F-формы МГ с EGF и IL-1 диссоциируют при обработке их додецилсульфатом иа-трия только в присутствии дитнотрейола. Предварительная обработка иодацетамином, который необратимо модифицирует свободные тиоловые группы, значительно уменьшает связывание этих цитокипов с МГ. Эта факты говорят в пользу ковалептпого механизма связывания некоторых цитокипов с МГ, скорее всего по механизму тиол-дисульфидиого обмена [29,46,64].
Сходным образом осуществляется связывание Ml’с инсулином. Ни пативный, ни подвершутый обработке иротеипазами или метиламином МГ не взаимодейсшу-ет с инсулином [28]. Однако, при добавлении к инкубационной смеси, содержицей пативный МГ с инсулином, некоторою количества протеииаз (например, трипсина) происходит ковалеитпое связывание МГ с этим гормоном. Максимально 1 моль МГ связывает 4 моля панкреатического инсулина свиньи за счег образования евшей между у-глутаматом (тиолэфирпой петли МГ) и остатками лизина А или В цепей инсулина.
Напротив, TGF-P, и Р2, IL-2, IL-6 и TNF-a образуют с МГ иековалентные комплексы, что приводит к диссоциации более 95% образованных комплексов в присутствии додецилсульфата натрия [20,21,22,53,30]. Более того, иековалентные связи в данных случаях не очень прочные, и комплексы МГ-цитокип могут распадаться при электрофорезе в ПААГ или при гель-фильтрации. Механизмы пековалептиого связывания цитокинов с различными формами МГ остаются недостаточно изученными [2,68]. В одной из последних работ в этой области D. Webb и соав.(1998) изучали взаимодействие цельной молекулы МГ и пяти ее основных фрагментов, полученных геппоипжеперпым способом, с TGF-p и (3. Было показано, что обе формы цнтокина сорбировались на белке FP-3 (Fusion protein 3), который содержит аминокислотную последовательность 614-797 макроглобулипа. Этот участок соответствует «приманочной» зоне МГ и не содержит тиол-эфираой петли и участка, ответственного за связывание со специфическим МГ-рецентором. Добавление FP-3 к пативному TGF-P приводило к нейтрализации биологической активности этого ростового фактора [68]. Ранее было показано, что пековалентпое взаимодействие МГ с TGF-P вначале обратимо, а затем может становиться ковалентиым также в результате тиол-дисульфидпого обмена [44,55,67].
Последствия взаимодействия МГи цитокинов мо-гут быть различными. Это в первую очередь относится к специфической биологической активности вновь образующихся комплексов. Биологическая активность некоторых цитокинов снижается при связывании с МГ, например, 1L-1Ph PDGF [21,43,58]. Исследователи считают, что механизм такого снижения активности PDGF заключается в невозможности взаимодействия пептида с его специфическим клеточным рецептором. Интересно, что МГ, модифицированный метиламином, инкубированный с PDGF, усиливал пролиферацию фиб-робластов и их хемотаксис, в то время как МГ, комп-лексировапный с плазмипом, влиял прямо противоположным образом.
Это в первую очередь относится к специфической биологической активности вновь образующихся комплексов. Биологическая активность некоторых цитокинов снижается при связывании с МГ, например, 1L-1Ph PDGF [21,43,58]. Исследователи считают, что механизм такого снижения активности PDGF заключается в невозможности взаимодействия пептида с его специфическим клеточным рецептором. Интересно, что МГ, модифицированный метиламином, инкубированный с PDGF, усиливал пролиферацию фиб-робластов и их хемотаксис, в то время как МГ, комп-лексировапный с плазмипом, влиял прямо противоположным образом.
В случае с TGF-P экспериментальные результаты иеодназначиы, так как биологическая активность TGF-pl о присутствии МГ изменялась по разному в зависимости or условий. В человеческой сыворотке комплексы Mr-TGF-Pt не проявляли биологической активнос-
ти [55]. Напротив, МГ не препятствовал биологическому действия ТСР-Р, на две клеточные линии [30].МГ препятствовал митозипгабировапию крысиных гепатоцитов и легочных эпителиальных клеток [50,51] под действием ТСР-Р2 гораздо сильнее, чем под действием ТСР-РГ Эти данные показывают, что различные формы ТСР-р мо-1ут по-разному взаимодействовать с МГ.
Одной из причин подавления специфической биологической активности цитокинов в составе их комплексов с МГ может быть невозможность взаимодействия цитокинов, находящихся внутри комплекса, со специфическими рецепторами для них па поверхности клеток-мишеней [8,46].
Процесс взаимодействия Р-форм МГ с цитокина-ми не всегда приводит к комплексообразованшо. Показало, что МГ, комплексированный с трипсином, способен разрушать 1Ь-2 и ТОТ [2,22]. По всей вероятности, в этом случае 1Ь-2 является субстратом достаточно низкой молекулярной массы и имеет доступ к активному центру трипсина, находящемуся в «ловушке» МГ.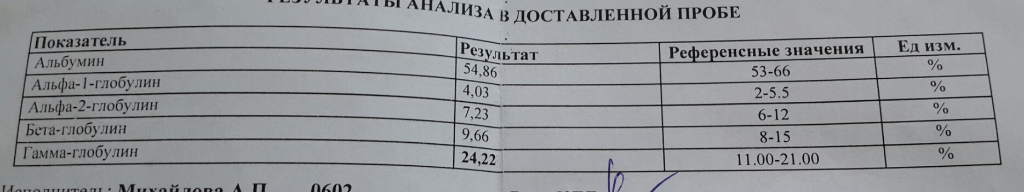
Процесс комилексообразоваиия между МГ и цито-кипами можно рассматривать с различных точек зрения, так как он затрагивает много аспектов функционирования цитокинов. Способность иативпого МГ служить белком-носителем и пОотектором по отношению к прот45ипазам для 1Ь-6, возможно, траст важную роль при развитии острофазового ответа, способствуя формированию положительной обратной связи между синтезом 1Ь-6 и синтезом белков острой фазы гепатоци-тами [53,25 ]. Связывание ЮТ-а и И.-1 Р-формами МГ приводит к элиминации вновь образованных комплексов МГ-цитокин путем рецептор-опосредованного эндоцитоза, что также способствует синтезу осгро-фазных белков, так как ни ШР-а, ни 1Ь-1 не стимулируют синтеза острофазовых белков клетками печени, по способны ингибировать стимулирующее действие 1Ь-6 на этот процесс.
Элиминация ЮТ-а, 1Ь-1, 1Ь-2 из крови и лимфы Р-формами МГ при острофазовом ответе может приводить к недостатку этих цитокинов при формировании специфического иммунного ответа во время и последействия стрессорпого воздействия па организм. Им-мупосунрессорпые эффекты тяжелой механической травмы, ожогов, отравлений и выраженного стресса описаны и литературе [7,52,63]. Также показан переход иммунной системы со специфического па эволю-циопно более низкий иеснецифический уровень функционирования, не требующий сложных межклеточных взаимодействий, опосредуемых иммупоцитокипа-ми. Одним из наиболее важных факторов, обуславливающих эти эффекты, может служить непосредственное разрушение иммуноцитокипов нротеипа-зами и комплексами МГ-протеиназа, а также рецептор-опосредованный эндоцитоз комплексов Р-формы МГ с иммупоцитокииами.
Данные о сохранении функциональной активности иммуноцптокипои н составе комплексов МГ-цитокнн сгавят вопрос об ш нормативности и корректности исследования уровня иммуноцптокипов в сыворотке крови при помощи иммуноферментпого анализа, ‘пи< гс;и< «с)ндш!ч»-метод, при котором цитокип должен одновременно взаимодействовать с двумя анти телами к его различным антигенным детерминантам, не позволяет выявить в тестируемых образцах комплексы МГ-цито-кпп, которые могут вносить свой вклад в общую биологическую активность тестируемого цитокипа. Поэтому исследования содержания в сыворотке крови любого цитокипа должны дубли[х>ваться биотестом, особенно у пациентов с выраженным острофазпым ответом, когда в крови одновременно возрастают уровни как МГ, так и нротеиназ, что приводит к возрастанию уровня Р-форм МГ и его комплексов с цитокииами.
Поэтому исследования содержания в сыворотке крови любого цитокипа должны дубли[х>ваться биотестом, особенно у пациентов с выраженным острофазпым ответом, когда в крови одновременно возрастают уровни как МГ, так и нротеиназ, что приводит к возрастанию уровня Р-форм МГ и его комплексов с цитокииами.
С другой столпы, есть признаки того, что при поведении бпоапализов специфические нейтрализующие антисывороткн миут не распознават ь цитокины в комплексе с МГ. Так как иммунологические апачизы на многие цитокины поводятся в присутствии сывороток, возможное влияние МГ и растворимых цитокиио-вых рецепторов должно учитываться [24,39]. В части случаев отрицательные результаты некоторых бпоапализов могут определяться присутствием в культураль-ной с[х%де МГ и иротеолитических ферментов, и в этом контексте следует, вероятно, особенно учитывать, что сыворотка плода коровы содержит высокий у[ювепь МГ.
Очевидно, что комнлексообразовапие должно оказывать глубокое воздействие па циркуляцию, биологическую активность, стабильность и клиренс цитокинов. Ос! ювываясь только 11а известных даыпых, важ1 юегть феномена комнлексообразовапия сложно оценить, гак как он зависит от последовательности молекулярных и клеточных взаимодействий. Д;оке простейшая модель щх)-цесса включает в себя следующие этапы:
1. Переход М Г из медленной формы в быструю при взаимодействии с протеипазамн или другим белково-нептидным материалом, например, некоторыми иммунными комплексами.
2. Формирование комплекса между МГ и цитокииами.
3. Взаимодействие комплекса с цитокиповыми рецепторами па поверхности клеток-мишеией пли со специфическими рецепторами для Е-формы МГ па макрофагах, гепатоцитах или фибробластах.
Терапевтическое значение взаимодействия МГс цитокииами, главным образом, определяется скоростью, с которой цитокины выводятся из циркуляции. В самом деле, это особенно важно, если главной функцией М Г является выведе! Iие цитокинов из циркуляции, так как проведенные исследования показывают, что это достаточно быстрый процесс [27,40,41,45].
В самом деле, это особенно важно, если главной функцией М Г является выведе! Iие цитокинов из циркуляции, так как проведенные исследования показывают, что это достаточно быстрый процесс [27,40,41,45].
Конкретные результаты комнлексообразовапия в значительной степени зависят от концентрации МГ и дру-
гих сывороточных иш-ибиторов протетш, щютеоли-тических <1>ермептов, а также количественного и качественного состава л нм(|х)[хтикулярпых клеток н мик-[хюкруженин. Следует заметить, что существует большое количество нормальных и патологических состояний, при которых уровень МГ резко повышен. К ним можно отнести высокий уровень МГ в процессе развития плода, у детей и безменных. Значительное повышение уровня МГ наблюдается при диабете, атонических дерматитах, нефритах и друшх заболеваниях [5,61].
Можно предположит ь, что процесс взаимодействия иммуноцптокипов с Р-({юрмами МГ можно использовать с терапевтической целыо при избыточном уровне какого-либо цитокипа н крови. С этой целыо можно вводить пациенту переведенный в Р-(|юрму МГ, тем самым стимулируя комплексообразование между МГ и цитокииами и рецептор-опосредованный эпдоцитоз комплексов МГ-цитокии, что приведет к снижению избыточного уровня цитокипа, например, TNF при септическом шоке [17,26]. Другой подход к элиминации цитокинов разработай с использованием препаратов МГ из крови человека, иммобилизованных па сорбентах, через которые пропускают кровь больных [3,4]. По нашему мнению, использование этих методов более перспективно, чем применение мопоклональпых антител против TNF [25,26,36,52,63].
Аиализ результатов пашей работы [ 1,2,6,7,34] и последних данных других лабораторий [46,48,59,67,681 позволяет сформулировать несколько обобщающих положений, описывающих результаты взаимодействия МГ и цитокинов:
Нативный МГ способен к нековалептному связыванию небольшого числа пептидов, поступающих в кровеносное русло (IL-6, TGF-ß2). Выполняя транспортную функцию, оп защищает их от действия малоспеци-фичпых протеи паз. Таким же образом МГ взаимодействует и с некоторыми протеинами, например, ключевым ферментом катаболизма лииидов лииопротеиплипазой. Можно предполжить, что комилексировапне цитокинов с пативным МГ in vivo может усиливать их биологическое действие за счет: во-первых, — предохранения их от разрушения малоспецифичпыми иротеииазами и, во- вторых, за счет уменьшения почечной фильтрации (клиренса) свободных пептидов. В клеточных культурах нативный МГ, вероятно, не оказывает существенного влияния на цитокииовую активность.
Выполняя транспортную функцию, оп защищает их от действия малоспеци-фичпых протеи паз. Таким же образом МГ взаимодействует и с некоторыми протеинами, например, ключевым ферментом катаболизма лииидов лииопротеиплипазой. Можно предполжить, что комилексировапне цитокинов с пативным МГ in vivo может усиливать их биологическое действие за счет: во-первых, — предохранения их от разрушения малоспецифичпыми иротеииазами и, во- вторых, за счет уменьшения почечной фильтрации (клиренса) свободных пептидов. В клеточных культурах нативный МГ, вероятно, не оказывает существенного влияния на цитокииовую активность.
Известно, что плазменные и тканевые трапеглута-миназы (в том числе фактор XI11 системы свертывания крови) ускоряют включение первичных аминов в белковые субстраты за счет образования изопентидпых связей [24,29]. Именно эти энзимы катализируют инкорпорацию первичных аминов и пептидных молекул внутрь МГ. Именно в момент образования F-формы МГ способен ковалептпо связывать некоторые ростовые факторы и инсулин с утратой их биологической активности. Такие комплексы должны быстро выводится из
У
кровотока за счет связывания с LRP-рецепторами плазматических мембран шпатоцитов и других клеток. Можно предположить, что но такому же механизму происходит взаимодействие некоторой части других белко-во-нептидпых молекул с МГ в кровеносном русле, где постоянно происходит активация протеолитических каскадных сисгем, а следовательно, и азаимодейсгвие протеиназ с S-формой МГ и его переход в F-(j>opMy. Этим можно объяснить данные некоторых авторов (J. Bonner и др.) о «частично» ковалеитпом характере взаимодействия МГ с некоторыми пептидными молекулами, а также данные о «некотором снижении» биологической активности цитокинов в составе комплексов с МГ [18,19,55]. Возможно, цитокины, способные комп-лексироваться с S-формой МГ, предпочтительней бу-дуг связываться ковалентпо с ингибитором в момент разрыва тиолэфирпой петли под действием протеиназ, чем другие молекулы. Это предположение, однако, требует тщательной проверки. В то же время не вызывает сомнения, что судьба ковалентпо связанных с МГ пептидных молекул предрешена: вместе с белком-носителем (МГ) они будут захвачены внутрь лизосом гепато-цитов или макрофагов и в результате тотального проте-олиза превратятся в набор аминокислот для дальнейшего строительства белковых молекул.
Это предположение, однако, требует тщательной проверки. В то же время не вызывает сомнения, что судьба ковалентпо связанных с МГ пептидных молекул предрешена: вместе с белком-носителем (МГ) они будут захвачены внутрь лизосом гепато-цитов или макрофагов и в результате тотального проте-олиза превратятся в набор аминокислот для дальнейшего строительства белковых молекул.
Наибольшее количество цитокинов, по-видимому, способны к нековалептному взаимодействию с F-фор-мой МГ. Однако механизмы таких взаимодействий существенно различаются, а влияние комнлексообразо-вания на биологическую активность цитокинов однозначно определить не представляется возможным как в связи с широтой спектра действия цитокинов, так и в связи с возможностью МГ взаимодействовать с про-теипазами разного спектра действия. В контексте полученных нами данных по взаимодействию TNF-a с различными формами МГ можно сформулировать следующее положение: биологическое действие таких сложных надмолекулярных комплексов, по-видимому, определяется как: специфичностью протеиназы, комп-лексировапной с молекулой МГ, так и физико-химическими и биологическими свойствами самого пептида и его рецепторов. Так, в подтверждение этого тезиса было показано, что МГ, модифицированный метиламином, усиливал PDGF-зависимый клеточный рост, в то время как МГ-плазмип ипгибировал PDGF-зави-симую пролиферацию фибробластов [18,19,43,58]. Другим обстоятельством, которое необходимо учитывать при оценке влияния МГ па биологическое действие пептидов , является наличие или отсутствие экспрессии LRP-реценторов на клетках-мишенях цитокинов. Бивалентные по отношению к TNF-a молекулы МГ, модифицированные метиламином, усиливают цитоток-сическое дейсгвие этого цитокина па фибробласты [2, 34]. Одним из возможных механизмов этого феномена может служить «сшивание» стимулированных TNF-рецепторов на поверхности клеток-мишеней.
Список литературы
1. Боголюбова Г.М., Сапковский А.А., Щербак И.Г. Способ инактивации альфа-2-макроглобулипа. / / Лаб. Дело. — 1988. — N11. — С.13-15.
Боголюбова Г.М., Сапковский А.А., Щербак И.Г. Способ инактивации альфа-2-макроглобулипа. / / Лаб. Дело. — 1988. — N11. — С.13-15.
2. Бондарев Н.Э., Дорофейков В.В., Фрейдлин Т.С., Фрейдлин И.С., Щербак И.Г. Цитотоксическая активность комплексов, образующихся при азаимодей-ствии туморнекротизирующего фактора а с a-2-мак-роглобулином. // Бюллетень экспериментальной биологии и медицины,- 1996. — т.121. — N6.- С.673-676.
3. Бондарев И.Э., Дорофейков В.В., Фрейдлин Т.С., Фрейдлин И.С., Щербак И.Г., Цыбулькип Э.К., Жебруп А.Б., Кузнецов С.И. // Офиц. бюллетень (Изобретения) комитета РФ по патентам и товарным знакам. — 1998. — N36 Патент RU N 2123860.
4. Бондарев И.Э., Дорофейков В.В., Фрейд-липТ.С., Фрейдлин И.С., Щербак И.Г., Цыбулькип Э.К., Жебрун А.Б., Кузнецов С.И. // Офиц. бюллетень (Изобретения) комитет РФ по патентам и товарным знакам. — 1998. — N16 Патент RU N 2112553.
5. Веремеенко К.Н., Голобородько О.ГГ., Кизим А.И. Протеолиз в норме и при патологии. // Киев. -Здоровья. — 1988. — 200с.
6. Галебская Л.В., Щербак И.Г., Бельтюков ПЛ., Дорофейков В.В. Структура и свойства внеклеточных белковых регуляторов иротеолитической фазы активации системы комплемента. // Биохимия. — 1995. -т.60(5). — С.668-677.
7. Цыбулькип Э.К, Бондарев И.Э., Фрейдлин И.С., Дорсх])ейков В.В., Жебрун А.В., Кузнецов С.И., Резник Л.В., Фрейдлин Т.С., Ще{)бак И.Г. Новые стратегические подходы к лечению септического шока. // Международные медицинские обзоры. — 1994. — N5. — С.351-355.
8. Aclerda D., Endelmann Н., Mayor Y., Brakebusch С., Wallach D. Stabilization of the bioactivity of tumor necrosis factor by its soluble receptor. // J. Exp.Med. -1992. — Vol.175. — P. 323.
// J. Exp.Med. -1992. — Vol.175. — P. 323.
9. Albert S.J., Jensen K. Alpha-2-macroglobulin-pro-teinase complexes, plasminogen activator inhibitor type-1-plasminogen activator complexes, and receptor-associated protein bind to region of the alpha-2-macroglobulin receptor containing a claster of 8 complement-type repeats. //Journal of Biological Chemistry. — 1993. — Vol. 268, N 18. — P.13691-13697.
10. Ashcom J.D., Tiller S.E., Dickerson K., Gravens J.L., Argraves W.S, Strickland D.K. The human alpha-2-macroglobulin receptor: identification of a 420-kD cell surface glycoprotein specific for the activated conformation of alpha-2-macroglobulin. //J. Cell. Biol. — 1990. — Vol.110. — P.1041-1048.
11. Ashkenazi A., Masters S.A., Copon D.J., Chamow S.M., Figari I.S., Pennica D„ Goeddel D.V., Palladino M.A., Smith D.H.. Protection against endotoxic shock by tumor necrosis factor receptor immunoadhesin. // Proc.Natl.Acad.Sci. USA. -1991. — Vol. 88. — P. 10535.
¡999, T.l.NeS
Альфа-2-макрогяобулин и цитокины
12. Balldin G„ Laurell C.B., Ohlsson K. Increased ca-talxilism of a-2-macroglobulius after intravenous infusion of trypsin-a-1-antitrypsin complexes in dogs. // Hopjx’-Sey-ler’s Z. Physiol. Chem. — 1978. — Vol.359, N 6. — P. 699-708.
13. Barrett A.J., Starkey P.M. The interaction of a-2-inacroglobulin with proteinases. Characteristics and specificity of the reaction, and a hypothesis concerning its molecular mechanism. // Biochem. J.-1973. -Vol. 133, N 4. -P. 709-724.
14. Barret A.J., Brown M.A., Sayers C.A. The elec-troforctically «slow» and «fast» forms of the ct-2-macroglo-bulin molecule// Biochem. J.-1979.- Vol.l81.-P.401-418
J.-1979.- Vol.l81.-P.401-418
15. Barret A.J. Alpha-2-macroglobulin. // Methods Enzymol. — 1981. — Vol. 80. — P. 737 -741.
16. Bellot R., Bou A., Letoge A. Evidence for an a-2-macroglobulin with complement inhibiting activity in rat serum // Int. J. Of Experimental Pathology-1991.- Vol.72.
— P. 151-161.’
17. Beutler В., Milsark I.W., Cerami A.C. Passive immunisation against cachectin/tumor necrosis factor protects mice from lethal effect of endotoxin.// Science. -1985. — Vol. 229. — P. 869-874.
18. Bonner J.C., Hoffman M„ Brody A.B. Alpha-2-macroglobulin secreted by alveolar macrophages serves as a binding protein for a macrophage-derived homologue of platelet-derived growth factor. // Am. J. Respir.Cell Mol. Biol. — 1989. — Vol.1. — P. 171-179.
19. Bonner J.C., Hofman M„ Brody A.R. A platelet-derived growth factor homologue secreted by alveolar macrophages is complexed to an alpha-macroglobulin. // Transplant. Proc. — 1989. — Vol. 21. — P. 3704-3705.
20. Boith W„ Lugerr T.A. Identification of alpha-2-inacroglobulin ;is a cytokine binding plasma protein. Binding of interleukin 1-beta to «F» alpha-2-macroglobulin. // J.Biol. Chem. — 1989. — Vol. 264. — P. 5818-5825.
21. Borth W., Scheer В., Urbansky A., Lugerr T.A., Sottrup-Jensen L. Binding of IL-1 beta to alpha-2-macro-globulins and release by thioredoxin.//J. Immunol. — 1988.
— Vol. 145. — P. 3747-3754.
22. Borth W., Teodorescu M. Inactivation of human interleukin-2 (IL-2) by alpha-2-macroglobulin-trypsin complexes. // Immunology. — 1986. — Vol. 57. — P. 367-371.
// Immunology. — 1986. — Vol. 57. — P. 367-371.
23. Borth W. Alpha-2-macroglobulin, a multifunctional binding protein // FASEB J.-1992. — Vol.6. — P.3345-3353.
24. Borth W., Feinman R., Gonias S., Quigley J., Strickland D. Biology of a-2-macroglobulin, its receptor and related proteins //Annals of the N.Y. Acad. Of Sciences. — 1994. — Vol.737 — P.l-521.
25. Calandka Т., Glauser M. Treatment of gram-negative septic shock with human IgG-antibody to E.coli. // J.Infect.Diaseases — 1988. — Vol. 158, N 2. — P. 312-319.
26. Cirardin E., Roux-Lombard P., Grau G.E., Sut-er P., Callati H., Dayer J.M. Imbalance between tumor necrosis factor-alpha and soluble TNF receptor concen-
trations in severe meningococcaemia. // Immunology. -1992. — Vol.1. — P.20-26.
27. Cohen J. New strategies for treatment of septic shock. // News and views on infection. — 1991. -Vol. 1, N 3.
— P. 6-11.
28. Chu C„ Rubcnstcin D„ Enghild J., Pizzo S. Mechanism of insulin incorporation into a-2-macroglobulin: implications for the study of peptide and growth factor binding. // Biochemistry.-1991.- Vol. 30. — P. 1551-60.
29. Crookston KP., Gonias SL. The role of cysteine-949 in the binding of transforming growth factor-beta 1 and transforming growth factor-tata 2 to alpha 2-macro-globulin. // Biochemical & Biophysical Research Communications. — 1994. — Voi. 200(3). — P. 1578-85.
30. Danielpour D., Sporn M.B. Differential inhibition of transforming growth factor p-1 and P-2 activity by alpha-2-macroglobulin. // J. Biol. Ghem. — 1990. — Vol. 265,- P. 6973-6977.
// J. Biol. Ghem. — 1990. — Vol. 265,- P. 6973-6977.
31. Debanne M.T., Bell R., Pastan I. Uptake of pro-teinase-a-mac.roglobulin complexes by macrophages. // Biochem. Biophys. Acta. — 1975. — Vol. 411, N 2. — P. 295-304.
32. Dennis P.A., Sarsela 0., Harpel P., Rifkin D.B. Alpha-2-macroglobulin is a binding protein for basic fibroblast growth factor. //J. Biol. Chem. — 1989. — Vol.264 -P.7210-7216.
33. Dickson R.B., Willigham M.C., Pastam I. Binding and internalisation of alpha-2-macroglobulin by cultured fibroblasts. //J. Biol.Chem. — 1982. — Vol.256. — P. 3454-3459.
34. Doropheikov V.V., Freidlin T.S., Shcherbak I.G. TNF-alpha binding by alpha-2-inacroglobulin as an antiinflammatory or proinflammatory mechanism. // Intensive Care Medicine. — 1994. — Vol. 20, N 1. — P. 239.
35. Enghild J.J., Thogeresen I.B., Roche P.A., Pizzo S.V. A converved region in alpha-macroglobulin participates in binding to the mammalian alpha-macroglobulin receptor. // Biochemistry. — 1989 — Vol. 28. — P. 1406-1412.
36. Eshadari M„ Bolgos K„ Miller C„ Nquyen D.T., De Forge L.E., Remick D.G. Anti-tumor necrosis factor antibody therapy fails to prevent lethality after cecal ligation and puncture or endotoxeinia. //J. Immunol. — 1992.
— Vol. 148. — P. 2724.
37. Feidman S.R., Gonias S.I., Pizzo S.V. Model of alpha-2-macroglobulin structure and function. // Proc. Natl. Acad. Sci. USA. — 1985. — Vol. 82. — P. 5700-5704.
38. Feidman S.R., Rosenberg M.R, Ney K.A., Micha-lopoulos G.M., Pizzo S.V. Binding of alpha-2-macroglobulin to hepatocytes: mechanism of in vivo clearance. // Biochem. Biophys. Res. Commun. — 1985. — Vol. 128 — P. 795-802.
// Biochem. Biophys. Res. Commun. — 1985. — Vol. 128 — P. 795-802.
39. Fernander-Botran R. Soluble cytokine receptors: their role in immunoregulation. // FASEB J. — 1991. -Vol. 5. — P. 2567.
40. Gliemann J., Larsen T.R., Sottrup-Jensen L. Cell association and degradation of a-2-macroglobulin-trypsin complexes in hepatocytes and adipocytes. // Biochem. Biophys. Acta. — 1983. — Vol. 756, N 2. — P.230-237.
41. Hoffman M.R., Pizzo S.V., Weinberg J.B. Modulation of mouse peritoneal macrophage la and human peritoneal macrophage phage HLA-DR expression by cx-2-macroglobulin «fost» forms. // J.Immunol. -1987. — Vol. 139, N6. -P. 1885-1890.
42. Howard J.B. Reactive site in human a-2-macro-globulin: circumstantial evidence for a thiolcster. // Proc. Natl. Acad. Sci. USA. -1981. — Vol.78, N 4. — P. 2235-2239.
43. Huang J.S., Huang S.S., Deuel T.N. Specific co-valent binding of platelet-derived growth factor to human plasma alpha-2-macroglobulin. // Proc. Natl. Acad. Sci. USA. — 1984. — Vol. 81. — P. 342-346.
44. Iiuang S.S., O’Crady P., Huang J.S. Human transforming growth factor beta alpha-2-macroglobulin complex is a latent form of transforming growth factor beta. //]. Biol. Chem. — 1984. — Vol. 263. — P. 1535.
45. Imber M.J., Pizzo S.V. Clearence and binding of two electroplioretic «fast» forms of alpha-2-inacroglobu-lin. //J. Biol. Chem. — 1981. — P. 8134-8139.
46. James K. Interaction between cytokines and alpha-2-macroglobulin.// Immunol. Today. — 1990. — Vol. 11.-P. 163-166.
47. Koo P.M., Stach R. W. Interaction of nerve growth factor with murine a-2-macroglobulin. // J. Neurosci. Res. — 1989. — Vol. 23. — P. 247-261.
W. Interaction of nerve growth factor with murine a-2-macroglobulin. // J. Neurosci. Res. — 1989. — Vol. 23. — P. 247-261.
48. Krimbou L., Trcmblay M., Davignon J., Cohn J.S. Association of apolipoprotein E with alpha-2-macroglobulin in human plasma//J Lipid Res. — 1998. -39(12). — P. 2373-86.
49. La Marre J., Wollenberg G.K., Gauldie J., Hayes M.A a-2-macroglobulin and serum preferentlly counteracts the initoinhibitory effects of transforming growth factor p in rat hepatocynts.// Lab. Invest. -1990. — Vol. 62. — P. 545-551.
50. La Marre J., Wollenberg G.K., Gonias S.L., Hayers M.A. Reaction of a-2-macroglobulin with plasmin increases binding of transforming growth factor pi and P2. //Biochem. Biophys. Acta. — 1991. — Vol.1. — P. 9-14.
51. La Marre J., Ilayers M.A., Wollenberg G.K., I.Hussaini, Hall S.W., Gonias S.L. An alpha-2-macroglobulin receptor-dependent mechanism for the plasma clearance of transforming growth factor P-1 in mice. //J. Clin. Invest. -1987, — Vol. 877. — P. 39-44.
52. Lowry S. Anticytokine therapy in sepsis.// New horizon — 1993. — Vol. 1, N 1. — P. 120-126.
53. Matsuda T., Hirano T„ Nagasava S„ Kishimolj T. Identification of a-2-macroglobulin as a carrier protein for IL-6. //J. Immunol. — 1989. — Vol.142. — P. 148-152.
54. McCafferey T.A., Falcone D.J., Brayten C.F., Aqarwal LA., Welt F.G.P., Weksler B.B.’ // Transforming growth factor-p is potentiated be heparin via dissociation of the transforming groth factor-p/a-2-macroglobulin complex. //J. Cell Biol. — 1989. — Vol.109. — P. 448-452.
55. O’Connor-McCourt M., Wakefield L.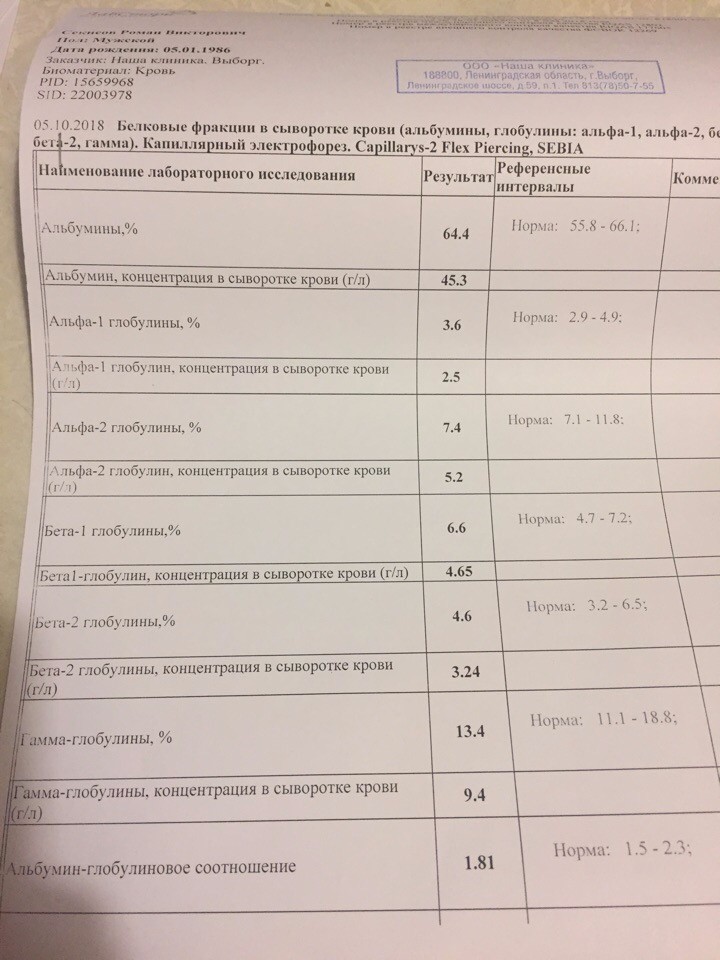 M. Latent transforming growth factor-p in serum. //]. Biol. Chev. -1987. — Vol. 262. — P. 14090-1496.
M. Latent transforming growth factor-p in serum. //]. Biol. Chev. -1987. — Vol. 262. — P. 14090-1496.
56. Panyutich A., Ganz T. Activated alpha-2-macroglobulin is principal defensing-binding protein. // Am. J. Resp. Cell Mol. Biol. — 1991. — Vol. 5. — P. 101-106.
57. Peterson C.G., Venge P. Interaction and complex formation between the eosinophil cationic protein and alpha-2-macroglobulin. // Biochem. J. — 1987. — Vol. 245. — P. 781-787.
58. Rainer E.W., Daniel F.B., Russell R. Plasma binding proteins for platelet-derived growth factor that inhibit its binding to cell-surface receptors. // Proc. Natl. Acad. Sci. USA. -1984. — Vol. 81. — P. 3424-3428.
59. Ramdin L., Perks В., Sheron N., Shute J.K. Regulation of interleukin-8 binding and function by heparin and alpha-2-macroglobulin // Clin Exp Allergy. — 1998. -Vol.28 (5).-P. 616-24.
60. Redely V.Y., Pizzo S.V., Wess S.J. Functional inactivation and structural disruption of human alpha-2-macroglobulin by neutrophils and eosinophils. //J. Biol. Chem. — 1989. — Vol. 264. — P. 13801-13809.
61. Roberts R.C. a- 2-macroglobulin. // J. Med. -1985,-Vol.16.- P.129-219
62. Rotme II., Anunde H., Rask L, Peterson PA Nerve growth factor binds to serum alpha-2-macipglobulin. // Biochem. Biophys. Res. Commun. — 1979. — Vol. 87. — P. 330-336.
63. Silva A.T., Bayston K.F., Cohen J. Prophylactic and therapeutic effects of a monoclonal antibody to tumor necrosis factor-a in experimental gram-negative shock. // Inf. Dis. -1990. — Vol. 162. -P. 421.
64. Sottrup-Jensen L Alpha-macroglobulin: structure, shape and mechanism of proteinase complex formation. / /J. Biol. Chem. — 1989. — Vol. 264. — P. 11539-11542.
/ /J. Biol. Chem. — 1989. — Vol. 264. — P. 11539-11542.
65. Van Zee K.F., Kohno Т., Fischer E., Rock C.S., Moldawer LL., Lowry S.F. Tumor necrosis factor soluble receptors circulate during experimental and clinical inflammation and can protect against excessive tumor necrosis factor-a in vitro and in vivo. // Proc. Natl. Acad. Sci. USA. — 1992. — Vol. 89. — P. 4845-4849.
66. Vilella E. Bengtsson-Olivecrona G. Stigbrand T. Jensen PE. Binding of lipoprotein lipase to alpha 2-macroglobulin// Biochemical Journal. — 1998. — Vol.300 ( Pt 2). — P. 443-8.
67. Webb D.J, Gonias S.L. Chemical modification of alpha-2-macroglobulin to generate derivatives that bind transforming growth factor-beta with increased affinity / / FEBS Lett. — 1997. — Vol.410(2-3). — P. 249-53.
68. Webb D.J., Wen J., Karns L.R., Kurilla M.G., Gonias S.L. Localization of the binding site for transforming growth factor-beta in human alpha-2-macroglobulin to a 20-kDa peptide that also contains the bait region. // J Biol Chem. — 1998. — Vol.273(21). — P. 13339-46.
69. Wollenberg G.IC, La Marre J., Rosental S., Gonias S.L., Hays M.A. Binding of tumor necrosis factor alpha to activated forms of human plasma alpha-2-macroglobulin. // Am. J. Pathol. — 1991. — Vol.138. — P. 265-271.
поступила в редакцию 11.10.99 принята к печати 29.10.99
Альфафетопротеин (S-AFP) – SYNLAB Eesti
Гликопротеин, который синтезируется в печени плода, желудочно-кишечном тракте и в желточном мешке. AFP называют еще онкофетальным антигеном, поскольку этот белок в норме синтезируется только у плода.
Наиболее высокие значения AFP в плазме у плода наблюдаются до 12-14 недели, потом происходит резкое падение содержания AFP. Динамика AFP в околоплодных водах схожа с его динамикой в плазме плода, но в 100 раз меньшей концентрации.
Динамика AFP в околоплодных водах схожа с его динамикой в плазме плода, но в 100 раз меньшей концентрации.
В крови матери повышается значение AFP до 10-32 недели, затем падает на уровень 24 недели и остается на этом уровне до рождения ребенка.
Показания:
- Один из маркеров в дородовой диагностике (см. тройной тест)
- Гепатоцеллюлярный рак печени
- Диагностика опухоли яичка – семиномы и несеминомы (эмбриональной, терато- или хориокарциномы). Определяется вместе с hCG
- Диагностика опухолей легкого
- Определение AFP нельзя рекомендовать как скрининговое исследование для диагностики онкологических заболеваний.
Метод анализа: Хемилюминисцентный метод
Референтное значение: < 5,5 IU/mL
Интерпретация результата:
Высокие значения AFP:
- Физиологически – беременность, многоплодная беременность
- Болезненные состояния плода и врожденные нарушения развития – анэнцефалия, гидроцефалия, открытая невральная трубка (в том числе spina bifida), дефект передней стенки живота (omphalocele, gastroschisis), врожденный нефроз, синдром дистресса плода, олигогидроамнион, токсемия, гипотрофия плода, гидропс плода, синдром Tернера, Патау, Меккеля, атрезия желудочно-кишечного тракта
- Заболевания у матери – цирроз печени, гепатит, некроз печени, наследственная тирозинемия
- Угрожающее прерывание беременности, преэклампсия, замершая беременность
- Опухоли – рак яичка, опухоли толстого кишечника, лимфомы, опухоли, происхо- дящие из эмбриональных тканей, опухоли почки, поджелудочной железы, печени, легких, щитовидной железы, желчных путей и желудка.
Низкие значения AFP:
- Диабет у матери
- Большой вес матери
- Хромосомальные аномалии плода (синдром Дауна, Эдвардса)
- Спонтанный аборт и внутриутробная смерть плода (fetus mortus). Низкие значения AFP после 10 недели беременности считаются прогностически неблагоприятными и могут указывать на задержку развития плода даже в том случае, если hCG в норме
- Неправильно рассчитанный срок беременности
При первичном диагнозе гепатоцеллюлярной карциномы у 90-95% пациентов повышены значения AFP (>200 IU/mL). Поэтому используется определения AFP для диагностики и мониторинга лечения этих опухолей.
Поэтому используется определения AFP для диагностики и мониторинга лечения этих опухолей.
При классификации и определении стадии рака яичка определяется одновременно с AFP также и hCG. При типе опухоли, такой как «чистая» семинома AFP не повышен и подъем значений hCG наблюдался только у 16% пациентов. Повышенные значения AFP отмечались у пациентов с диагностированным типом рака яичка – семинома вместе с метастазами рака несеминомного типа.
У 90% пациентов с раком несеминомного типа повышены значения как AFP, так и hCG – повышены. Скорость снижения опухолевого маркера – это показатель эффективности лечения. Подъем значений в течение 3-18 месяцев указывает на рецидив рака. Повышенные значения после оперативного лечения характеризуют неполное удаление опухоли или наличие метастазов. После орхидэктомии у пациента с высоким содержанием рецидивы возникают чаще, чем у пациентов с повышенным значением hCG.
При гепатите и циррозе печени значения AFP у пациентов обычно не превышают 165 IU/mL.
Биохимический анализ крови / «9 месяцев»
№ 3, март 2008 г.
За 9 месяцев беременности будущей маме приходится сдавать немалое количество анализов. Зачем это нужно и что означают их результаты?
Биохимический анализ крови позволяет оценить работу многих внутренних органов — почек, печени, поджелудочной железы и др. Кроме того, биохимический анализ крови показывает, каких микроэлементов не хватает в организме женщины. Поскольку во время беременности происходят различные изменения, связанные с обменными процессами, оценка биохимических показателей крови важна для своевременной диагностики патологических состояний, которые могут возникнуть в организме будущей мамы.
Перечислим основные показатели биохимического анализа крови.
Общий белок — показатель белкового обмена, отражающий общее содержание всех белков в сыворотке крови. Нормальная концентрация общего белка в крови — 63-83 г/л. Белки плазмы делят на группы с разными структурами и функциями, которые называются белко¬выми фракциями. Среди белковых фракций выделяют альбумины и альфа-, бета-, гамма-глобулины. Их определение и соотношение позволяет более точно оценить нарушения функций внутренних органов. Физиологическая гипопротеинемия (снижение уровня белка) может наблюдаться у беременных женщин (особенно в третьем триместре) и при лактации за счет уменьшения количества эритроцитов в плазме, связанного с увеличением общего объема плазмы. Небольшое снижение общего белка (55-65 г/л) во время беременности не является патологией. Повышение концентрации белка в сыворотке крови наблюдается вследствие патологии — обезвоживания и сгущения крови при потерях жидкости.
Нормальная концентрация общего белка в крови — 63-83 г/л. Белки плазмы делят на группы с разными структурами и функциями, которые называются белко¬выми фракциями. Среди белковых фракций выделяют альбумины и альфа-, бета-, гамма-глобулины. Их определение и соотношение позволяет более точно оценить нарушения функций внутренних органов. Физиологическая гипопротеинемия (снижение уровня белка) может наблюдаться у беременных женщин (особенно в третьем триместре) и при лактации за счет уменьшения количества эритроцитов в плазме, связанного с увеличением общего объема плазмы. Небольшое снижение общего белка (55-65 г/л) во время беременности не является патологией. Повышение концентрации белка в сыворотке крови наблюдается вследствие патологии — обезвоживания и сгущения крови при потерях жидкости.
Липиды (жиры) — в крови присутствуют 4 основные группы липидов: холестерин (холестерол), три-глицериды, фосфолипиды, жирные кислоты. Холестерол является важнейшим показателем липидного обмена, служит структурным компонентом клеточных мембран, участвует в синтезе половых гормонов, желчных кислот, витамина D. Выделяют фракции холестерола липопротеидов низкой плотности (ЛПНП), холестерола липопротеидов высокой плотности (ЛПВП) и некоторые другие, различающиеся по составу и функциям. Содержание холестерина в крови в значительной степени зависит от возраста. Нормальный уровень холестерина в крови молодой женщины -3.15-5.8 ммоль/л. Во время беременности наблюдается физиологическое увеличение уровня общего холестерина (до 6,0-6,2), которое обусловлено повышенным формированием эндогенного (вырабатываемого в печени) холестерина, необходимого для построения сосудистого русла плаценты и плода. Повышение уровня холестерина в крови считается фактором, предрасполагающим к развитию атеросклероза — образованию специфических бляшек в сосудах.
Углеводы являются основным источником энергии для организма.
Глюкоза — это источник энергии и компонент жизнедеятельности любой клетки организма. Нормальная концентрация глюкозы в крови у взрослых — 3.9-5.8 ммоль/л. У здоровых беременных женщин уровень глюкозы может быть немного снижен (до 3.5-4,0 ммоль/л), поскольку растущий плод потребляет все большее количество глюкозы.
Нормальная концентрация глюкозы в крови у взрослых — 3.9-5.8 ммоль/л. У здоровых беременных женщин уровень глюкозы может быть немного снижен (до 3.5-4,0 ммоль/л), поскольку растущий плод потребляет все большее количество глюкозы.
Во время беременности повышенная потребность организма в инсулине (гормоне поджелудочной железы, регулирующем углеводный обмен) превышает функциональную способность клеток поджелудочной железы, вырабатывающих инсулин. Это может привести к его недостаточной секреции для поддержания нормального уровня глюкозы в крови. В этот период у некоторых беременных относительная недостаточность инсулина может вызвать развитие гестационного диабета (диабета беременных), об этом свидетельствует повышение глюкозы крови. Поэтому всем будущим мамам в сроки между 24-й и 28-й неделей рекомендуется проведение исследования глюкозы крови. Этот анализ проводится дополнительно, без исследования других показателей биохимического анализа.
В организме во всех биохимических реакциях в качестве катализаторов участвуют специфические белки, которые называются ферментами. В каждой реакции участвует свой специфический фермент, поэтому их количество исчисляется сотнями. При этом диагностическое значение имеют всего несколько десятков ферментов.
Аланинаминотрансфераза (АЛТ) — в норме у женщин содержится до 32 ЕД/л. Наиболее высокая активность АЛТ выявляется в печени и почках. Уровень АЛТ повышается при повреждении клеток печени, почек вирусами или химическими веществами.
Аспартатаминотрансфераза (ACT) — в норме у женщин содержится до 30 ЕД/л. ACT содержится в тканях сердца, печени, нервной ткани и почек; соответственно, определяется с целью выявления патологии этих органов. При нормальном течении беременности показатели АЛТ и ACT не меняются. Небольшое повышение трансаминаз наблюдается при гестозах легкой и средней степени тяжести. Многократное повышение активности АЛТ (до 100 МЕ/л) и ACT (до 160 МЕ/л) наблюдается при гестозах тяжелой степени. Такой результат свидетельствует о том, что печень не справляется с нагрузкой.
Многократное повышение активности АЛТ (до 100 МЕ/л) и ACT (до 160 МЕ/л) наблюдается при гестозах тяжелой степени. Такой результат свидетельствует о том, что печень не справляется с нагрузкой.
Фосфатаза щелочная присутствует практически во всех тканях организма. Самая высокая активность ЩФ обнаруживается в клетках костной ткани, печени, почек, слизистой кишечника и плаценте. Повышение активности ЩФ крови связано, в основном, с заболеваниями костей и патологией печени. У беременных, особенно в третьем триместре, также имеет место физиологическое повышение активности этого фермента, дополнительным источником щелочной фосфатазы в этом случае является плацента. Нормальные значения ЩФ у взрослых — до 150 ЕД/л. У беременных этот показатель может повышаться до 240 ЕД/л.
Амилаза панкреатическая синтезируется клетками поджелудочной железы. В норме у взрослых ее содержится до 50 ЕД/л. Уровень панкреатической амилазы крови возрастает при патологии поджелудочной железы.
Пигменты представляют собой окрашенные органические вещества. Диагностическое значение имеют желчные пигменты (билирубин и уробилиноген) и порфирины (красные пигменты).
Билирубин — это желчный пигмент, который образуется в результате распада гемоглобина — пигмента красных кровяных клеток, к которому присоединяется кислород. При распаде гемоглобина первоначально образуется свободный билирубин, который транспортируется из селезенки в печень в комплексе с альбумином. Затем в печени свободный билирубин связывается со специальной кислотой (глюкуроновой), в результате чего образуется прямой, менее токсичный билирубин, который активно выделяется в желчные протоки и выводится с желчью. Он является одним из основных компонентов желчи. Билирубин содержится в сыворотке крови в виде двух фракций: прямого (связанного) и непрямого (свободного) билирубина, вместе составляющих общий билирубин крови. Нормальный уровень общего билирубина, в том числе и во время беременности, — 3,4-17,2 мкмоль/л. При повышении концентрации билирубина в крови (при ускоренном распаде эритроцитов, патологии печени или желчевыводящих путей) появляется желтуха. Это связано с тем, что при гипербилирубинемии билирубин накапливается в глазном яблоке и коже.
Азотистые вещества — это конечные продукты распада белков и нуклеиновых кислот — мочевина, креатинин, креатин, аммиак, мочевая кислота. Но в биохимии крови определяют в основном мочевину и креатинин.
Мочевина — определение уровня мочевины сыворотки крови, наряду с креатинином, используется для оценки выделительной функции почек. Нормальная концентрация мочевины в крови — 2,5-6,3 ммоль/л. Повышение концентрации мочевины в крови наблюдается при различных заболеваниях почек.
Креатинин — нормальные значения креатинина у женщин — 53-97 мкмоль/л. Увеличение креатинина в сыворотке крови говорит об уменьшении уровня почечной фильтрации (снижении функции почек). Концентрация креатинина крови у беременных женщин физиологически снижена (на 40%) вследствие увеличения объема крови, повышения почечного плазмотока и фильтрации, особенно во втором и третьем триместрах беременности. Для беременных нормальный уровень креатинина — 35-70 мкмоль/л.
Микроэлементы — это химические вещества, содержание которых в организме колеблется от нескольких микрограммов до нескольких нанограммов. Но, несмотря на такое незначительное количество, они играют существенную роль во всех биохимических процессах организма.
Железо — жизненно важный микроэлемент, участвующий в транспорте кислорода. Нормальный уровень железа у женщин — 8,95-30,4 мкмоль/л. Железо входит в состав гемоглобина эритроцитов, миоглобина мыщц и некоторых ферментов. При дефиците железа развивается железодефицитная анемия — самая частая патология беременности, наблюдающаяся преимущественно во втором или третьем триместре вследствие недостаточного удовлетворения повышенной потребности организма матери и плода в веществах, необходимых для кроветворения. Однако при нормальном уровне гемоглобина возможно низкое содержание железа, что является показателем скрытой железодефицитной анемии — вот почему важно контролировать уровень железа в биохимическом анализе крови во время беременности. Наибольшие потери железа происходят при кровотечениях.
Натрий — важнейший компонент внеклеточного пространства, с которым связана регуляция распределения воды в организме. Нормальная концентрация натрия — 136-145 ммоль/л. Натрий участвует в механизмах возбуждения нервных и мышечных клеток. Снижение его уровня в плазме вызывает общую слабость, может привести к развитию различных неврологических нарушений. Увеличение концентрации натрия в крови наблюдается при ограничении приема воды, рвоте, например при токсикозе первой половины беременности или диарее (жидком стуле) без возмещения потери жидкости.
Калий — основной внутриклеточный микроэлемент. Нормальный уровень калия у взрослых — 3.5-5,5 ммоль/л. Гиперкалиемия наблюдается при почечной недостаточности, передозировке лекарственных средств. При снижении уровня калия, которое может быть при диарее, рвоте, развиваются нарушения ритма сердца, мышечная слабость, снижение тонуса мыщц.
Кальций — основной компонент костной ткани. Нормальная концентрация кальция у молодых женщин — 2,20-2,55 ммоль/л. Кальций в организме выполняет множество функций: участвует в процессах мышечного сокращения, секреции гормонов, регуляции активности многих ферментов, процессе свертывания крови. Дефицит кальция наблюдается при беременности, что объясняется потребностью ребенка в строительном материале для костей, При снижении кальция в анализе необходимо восполнять его содержание с помощью лекарственных препаратов.
Фосфор — основная его часть находится в костной ткани в виде солей кальция, остальная часть -преимущественно в мягких тканях. Нормальная концентрация фосфора для будущей мамы — 1.0-1,40 ммоль/л. Повышение его содержания в крови наблюдается при передозировке витамина D. Снижении функции паращитовидных желез, почечной недостаточности.
Биохимический состав крови исследуется дважды за беременность: в самом начале беременности, при постановке беременной на учет и в 30 недель беременности, если не требуется чаще. Кровь на биохимический анализ берут из вены утром натощак. С момента последнего приема пищи должно пройти не менее 12 часов.
Мы привели перечень необходимых, наиболее часто проводимых исследований, но в каждом случае набор исследуемых позиций определяет врач. Исходя из необходимости, в каждом конкретном случае количество показателей может быть сокращено или увеличено.
Нона Овсепян, врач Независимой лаборатории ИНВИТРО
гамма глобулины повышены — 25 рекомендаций на Babyblog.ru
Репродуктивные гормоны и маркеры ФПКФолликуло-стимулирующий гормон, лютеинизирующий гормон
ФСГ и ЛГ секретируются гонадотропными клетками передней доли гипофиза. Гонадотропины ФСГ и ЛГ, хориогонадотропин ХГ и тиротропин ТТГ являются гликопротеинами, молекулы которых состоят из двух ковалентно связанных субъединиц, а и ß . а-субъединицы ФСГ, ЛГ, ТТГ и ХГ идентичны, а ß-субъединицы специфичны для каждого гормона и определяют их биологическую активность. Небольшое количество свободных субъединиц могут циркулировать в крови, однако возможность любого из биологических эффектов реализуется лишь при условии ассоциации а-цепи с ß-цепью. Секреция ФСГ и ЛГ гонадотропными клетками передней доли гипофиза контролируется следующими факторами:
а) Гонадотропин-рилизинг гормон ( Gn — RH ), известным также как ЛГ-рилизинг гормоном ( LH — RH ), или как люлиберин. LH — RH является декапептидом, секретируемым гипоталамусом. LH — RH и его синтетические химические аналоги широко используются в терапевтических и диагностических целях (LH-RH-тест). LH — RH секретируется в портальную венозную систему гипофиза, где он стимулирует образование и пульсирующую секрецию ЛГ и, в меньшей степени, ФСГ.
б) стероидными гормонами, вырабатываемыми половыми железами. Именно эстрогены и гестагены контролируют секрецию гонадотропина по принципу положительной или отрицательной обратной
в) ингибином (гликопротеином, синтезируемым клетками Сертолли в процессе сперматогенеза и специфически ингибирующим секрецию ФСГ).Эффект гонадотропинов реализуется через специфические рецепторы на поверхности клеточной мембраны. В этом процессе участвует важный межклеточный медиатор циклический аденозин монофосфат (цАМФ, сАМР).
Гонадотропины выводятся из организма с мочой. Так как их биологическая активность и иммунологические свойства в значительной мере остаются неизменными, концентрация этих гормонов в моче здоровых людей соответствует их концентрации в периферической крови.
Функции гонадотропинов у детей
У детей препубертатного периода уровни гонадотропинов и половых стероидов очень низкие. Во время пубертатного периода чувствительность гипофиза к LH — RH возрастает, в результате чего увеличивается секреция гонадотропинов, секреция половых стероидов и развиваются вторичные половые признаки.
Функции гонадотропинов у мужчин
У мужчин ЛГ стимулирует синтез тестостерона в клетках Лейдига, ФСГ стимулирует сперматогенез, синтез ингибина и андроген-связывающего белка в семенных канальцах, а также превращение тестостерона в 17- ß-эстрадиол в клетках сертоли. И тестостерон, и эстрогены оказывают ингибирующий эффект на секрецию гонадотропина посредством гипоталамического подавления L Н- RH.
Функции гонадотропинов у женщин
а) У женщин детородного периода секреция гонадотропинов является наиболее важным условием поддержания менструального цикла. В последние несколько дней предыдущего цикла снижение концентрации стероидных гормонов повышает секрецию ФСГ, что стимулирует рост нескольких граафовых пузырьков. Один из фолликулов развивается более интенсивно, остальные — атрофируются. Растущий созревающий фолликул продуцирует повышающиеся количества эстрогенов, которые оказывают мягкий ингибирующий эффект на секрецию ФСГ. В конце фолликулярной фазы секреция эстрогенов резко возрастает и достигает максимума непосредственно перед овуляцией. Обратная связь концентраций гормонов из отрицательной становится положительной, что выражает ся в овуляторных пиках уровней ЛГ и ФСГ. Овуляция, завершающаяся разрывом фолликула и превращением его в желтое тело, приводит также к падению уровней гонадотропинов и эстрогенов на фоне повышающегося уровня прогестерона. Лютеинизация гранулезных клеток наступает при вторичном подъеме концентрации эстрогенов параллельно с возрастанием уровня прогестерона до максимума в середине лютеиновой фазы. Желтое тело рассасывается, и уровень стероидных гормонов падает к концу цикла, что приводит к отмене ингибирования секреции LH — RH гипоталамусом. Секреция гонадотропинов возрастает и начинается новый цикл.б) В перименопаузе циклическая активность яичников снижается вплоть до полного угасания. Циклы в перименопаузе часто бывают ановуляторными и характеризуются значительной флюктуацией уровней стероидных и гипофизарных гормонов. В последствии все примордиальные фолликулы перестают реагировать на гонадотропную стимуляцию под воздействием стероидных гормонов.
в) В менопаузе исчезает отрицательная обратная связь и уровни гонадотропинов, в частности, ФСГ, значительно повышаются по сравнению с детородным периодом.
Рис.1. Динамика концентраций гонадотронпинов (ГТ), эстрадиола (Е2) и прогестерона (Пр) в крови на протяжении менструального цикла и при наступлении беременности.
Патология женщины детородного периода
Если исключается возможность гиперпролактинемии, определение ФСГ представляет собой первую часть исследований нарушений менструального цикла. Рекомендуется проводить одно временное определение ФСГ, ЛГ и пролактина в первой пробе крови. Повышенные уровни ФСГ обычно являются индикатором необратимой недостаточности функции яичников (за исключением очень редкого синдрома резистентности яичников). Пониженная или нормальная концентрация ФСГ при пониженной концентрации ЛГ имеет место при нарушении функции гипофиза или гипоталамуса. Если секреция эстрогенов понижена (при отрицательном анализе на прогестерон), овуляцию можно индуцировать гонадотропинами (Прегонал) или пульсирующим введением LH — RH . Если секреция эстрогенов в норме, лечение нужно начать с кломифена. Незначительное повышение концентрации ЛГ при нормальной концентрации ФСГ может наблюдаться при синдроме поликистозных яичников (РСО, синдром Штейна-Левенталя). Возникновение синдрома связано с гиперсекрецией андрогенов и замедленным синтезом эстрогенов яичниками, что компенсируется их ускоренным синтезом в периферии. Таким образом, уровень эстрогенов в сыворотке крови остается в норме. Довольно часто в этом случае наблюдается незначительная гиперпролактинемия.
У женщин с анорексией уровень гонадотропинов понижен. При стимуляции LH — RH наблюдается повышение содержания ФСГ, уровень ЛГ остается неизменным или незначительно возрастает.
Девочки пубертатного периода
При замедленном половом развитии диагностика проводится по схеме, приведенной для случаев недостаточности яичников. При повышенном уровне ФСГ необходимо провести полное эндокринологическое и генетическое обследование.
В случаях преждевременного созревания концентрация гонадотропинов часто бывает повышен ной по сравнению с нормальными для данного возраста уровнями. Диагностический тест с LH — RH часто приводит к резкому повышению секреции ЛГ.
У женщин в менопаузе пониженное содержание гонадотропинов наблюдается при проведении заместительной терапии ( HRT ) или у пациенток с эстроген-продуцирующими опухолями. Низкие уровни гонадотропинов также обнаруживаются при гипофизарной недостаточности.
Мужчины
Определение ФСГ проводят в случае подозрения на недостаточность половых желез в результате обнаружения азооспермии или олигоспермии. Высокий уровень ФСГ указывает на первичную тестикулярную недостаточность.
Показания к проведению исследований:Женщины детородного периода:
• Нарушения менструального цикла и аменорея
• Бесплодие
• Недостаточность яичников
• Синдром поликистоза яичников
• Анорексия
• Гипофизарная недостаточность
Девочки пубертатного периода:
• Гипофизарная недостаточность
• Преждевременное половое созревание
• Замедленное половое созревание
• Недостаточность яичников
• Анорексия
Женщины в менопаузе:
• Гипофизарная недостаточность
• Метроррагия
• Гормональная заместительная терапия ( HRT )
Мужчины:
• Гипофизарная недостаточность
• Азооспермия, олигоспермия
Подготовка проб для анализа и содержание гонадотропинов в норме.Уровни гонадотропинов не имеют циркадного ритма. Пульсирующий характер секреции с интервалами в 1-2 часа особенно характерен для ЛГ, поэтому результаты единичных анализов следует считать приблизительными. Образцы сыворотки или плазмы крови после образования сгустков и/или отделения эритроцитов стабильны в течение времени, достаточного для пересылки образцов по почте. Замороженные образцы можно хранить в течение длительного периода времени.
Не рекомендуется использовать гемолизированные, липемические или иктерические образцы, так как это может оказать влияние на результаты анализа. Снижение уровня гормонов может наблюдаться при приеме оральных контрацептивов, фенотиазинов, эстрогенов.
Современные иммуноанализы ЛГ и ФСГ основаны на использовании моноклональных антител, которые не имеют перекрестной реакции с ХГ.
ФСГ, (мМЕ/л)
ЛГ, (мМЕ/л)
Мужчины
0,7-1,1
0,8-7,6
Женщины
Фолликулярная фаза
2,8 — 11,3
1,1-11,6
Овулятрный пик
5,8-21
17-77
Лютеиновая фаза
1,2-9,0
0-14,7
Постменопауза
21,7-153
11,3-40
Препубертатные дети
<1
<1
Биологический материал :
• сыворотка крови
• гепаринизированная плазма крови
ПролактинПролактин человека — полипептид с молекулярной массой около 23 000 Да. В циркулирующей крови он находится в мономерной форме или в форме полимеров с различной биологической активностью. Количественное соотношение этих форм меняется при различных физиологических состояниях. По своей структуре пролактин имеет высокую степень подобия с гормоном роста и плацентарным лактогеном, возможно из-за их общего эволюционного происхождения. Биологический период полу-жизни пролактина около 15-20 мин. О способе выведения его из организма до настоящего времени известно немного.
Физиологические функции пролактина
Пролактин секретируется лактотропными клетками передней доли гипофиза Его секрецию гипотапамусом контролирует сложная система, в которой преобладает ингибирование (в результате перерезания ножки гипофиза секреция пролактина увеличивается). Дофамин — наиболее важное эндогенное соединение, ингибирующее секрецию пролактина, которое, возможно, идентично так называемому пролактин-ингибирующему фактору (PIF). Адреналин, норадреналин, ацетилхолин, соматостатин и простагландины не оказывают такого сильного влияния на секрецию пролактина.
Тиреолиберин (TRH) стимулирует секрецию пролактина, но не является физиологическим триггерным фактором. Другими эндогенными стимуляторами секреции пролактина являются: гамма -амино масляная кислота ( GAВA ), серотонин и мелатонин.
На секрецию пролактина влияет также уровень эстрогенов. Высокие уровни эстрогенов стимулируют секрецию пролактина посредством ингибирования синтеза дофамина, а низкие их уровни, вероятно, ингибируют секрецию пролактина посредством увеличения чувствительности гипофиза к дофамину.Основной физиологической функцией пролактина является запуск и поддержание процесса лактации.
Во время беременности секреция пролактина постоянно возрастает в результате ускоренного синтеза эстрогенов в фето-плацентарной системе. Эстрогены и пролактин подготавливают молочную железу к лактации, воздействуя на процесс дифференциации альвеол и протоков.
Уровень пролактина повышен в амниотической жидкости и оболочках плода. Возможно, пролактин играет важную роль в формировании легочной ткани эмбриона. Новорожденные имеют относительно высокий уровень пролактина, который снижается в течение нескольких первых месяцев жизни, пока не достигнет уровня, характерного для детского возраста.
Если женщина не кормит грудью, уровень пролактина после родов приходит в норму в течение 4 недель. У кормящих женщин уровень пролактина снижается медленнее, так как кормление стимулирует его секрецию.
Существует теория, что физиологический уровень пролактина необходим для нормального функционирования репродуктивной системы у обоих полов. Однако физиологическая роль пролактина у мужчин пока не доказана.
Патология: Гиперпролактинемия ослабляет функцию гонад обоих полов. У женщин она вызывает нарушения менструального цикла вследствие недостаточности лютеиновой фазы, олигоменорею, аменорею, которая может сочетаться с галактореей. У мужчин она сопровождается потерей либидо или импотенцией. Механизм этого не совсем ясен, но, возможно, он сходен с ингибированием циклической функции яичников у кормящих грудью женщин.Наиболее распространенные причины гиперпролактиемии следующие:
• секретирующие пролактин опухоли гипофиза, так называемые пролактиномы.
• расположенные над турецким седлом опухоли гипофиза, тормозящие выработку и транспорт дофамина.
• повреждения ножки гипофиза, приводящие к такому же эффекту.
• эктопический синтез пролактина
Кроме того повышение уровня пролактина может быть при:
• первичном гипотиреозе
• поликистозе яичников
• почечной недостаточности
Однако уровень пролактина не является единственным фактором, ответственным за возникновение клинических проявлений гиперпролактинемии. Изменение соотношения форм пролактина с различной биологической активностью или изменение количества рецепторов к пролактину могут также быть причиной возникновения данного заболевания. Именно поэтому в литературе описаны отдельные случаи нормального менструального цикла и беременности при наличии выраженной гиперпролактинемии, а с другой стороны, у бесплодных женщин с нормальным уровнем пролактина отмечен хороший терапевтический эффект при применении препаратов, подавляющих секрецию пролактина. Отдельным клиническим случаем является так называемая «латентная гиперпролактинемия», которая подтверждается в тесте стимуляции метоклопрамидом.
Если гиперпролактинемия подтверждается при анализе нескольких проб крови и исключена фармакологическая причина повышения уровня пролактина, необходимо провести тщательную проверку на наличие опухолей гипофиза ( RTG обследование турецкого седла, СТ области седла проверка угла зрения, тесты на стимуляцию и подавление и т.п.). Вероятность наличия опухоли тем выше, чем выше уровень пролактина.
Рис.2. Содержание пролактина в сыворотке крови здоровых женщин и пациенток с гиперпролактинемией.
Определение уровня пролактина является важным моментом для оценки эффективности проведенного оперативного или консервативного лечения у пациентов с опухолями гипофиза. Лечение таких больных должно всегда проводится под наблюдением эндокринолога.
Показания к проведению исследований:Женщины детородного периода:
• Нарушения менструального цикла и аменорея
• Бесплодие
• Нарушения лактации
• Галакторрея
• Синдром гиперфункции гипофиза
• Недостаточность гипофиза
• Заместительная терапия после удаления опухоли гипофиза
Мужчины:
• Тестикуляная недостаточность
• Азооспермия, олигоспермия
• Галакторрея
• Синдром гиперфункции гипофиза
• Недостаточность гипофиза
• Заместительная терапия после удаления опухоли гипофиза
Подготовка проб для анализа и содержание пролактина в нормеИнформация, приведенная выше для гонадотропинов, справедлива и по отношению к пролактину. Однако, пролактин имеет довольно выраженный циркадный ритм с максимальным выбросом гормона во время ночного сна. Поэтому кровь для анализа берут утром, не ранее, чем через 3 часа после пробуждения.
Рис.3. Суточный ритм секреции пролактина (индивидуальные графики).
Кроме того, уровень пролактина может повышаться в результате физического или эмоционального стресса, воздействий на молочные железы или операций на грудной клетке, после пребывания в сауне, а также после принятия спиртных напитков. Секрецию пролактина стимулирует ряд лекарственных препаратов: фенотиазиды, трициклические антидепрессанты, метилдофа, галоперидол, хлорпромазин, резерпин, циметидин и другие.
Концентрация пролактина выражается в нг/мл. Для перевода концентрации в мкМЕ/мл необходимо использовать следующее соотношение: 1 нг/мл = 30,3 мкМЕ/мл
Пролактин
нг/мл
мкМЕ/л
Мужчины
2,5-17
53-360
Женщины
Фолликулярная фаза
4,5- 33
98-784
Середина цикла
6,3-49
134-975
Лютеиновая фаза
4,9- 40
104-848
Биологический материал:
• сыворотка крови
• гепаринизированная плазма крови
ß- Эстрадиол (Е2)17 ß-Эстрадиол — наиболее активный эстроген в периферической крови, секретируемый, в основном, яичниками, а также в меньшем количестве плацентой, надпочечниками и яичками. С точки зрения биосинтеза эстрадиол представляет собой производное холестерина, а его непосредственными пред шественниками являются андростендион и тестостерон. Более 98 % эстрадиола циркулирует в связанном с белками сыворотки крови состоянии, в основном с ГСПГ . Только небольшая часть эстрадиола находится в свободной форме и является носителем гормональной биологической активности. Эстрадиол быстро трансформируется в эстрон с меньшей биологической активностью, а затем в сульфат эстрона. Образование в организме сульфатов и глюкуронидов снижает эффективность метаболизма производных эстрадиола.
Физиологические функции эстрадиола у женщин
Наиболее значительное воздействие эстрогены оказывают на эндометрий, слизистую влагалища и шейку матки. Они также влияют на развитие молочных желез и тормозят выработку гонадотропинов как у мужчин, так и у женщин Биологический эффект эстрогенов осуществляется путем связывания с цитоплазматическими рецепторами эстрогенов в клетках тканей-мишеней.
Половое созревание
Эстрогены играют ключевую роль в формировании и развитии женских половых органов, а также вторичных половых признаков. Они также ускоряют рост трубчатых костей в длину, а затем, воз действуя на эпифиз, вызывают остановку дальнейшего роста.
Детородный период
Эстрадиол поступающий в периферическое кровообращение, почти исключительно секретируется яичниками. Под воздействием ЛГ в поверхностных клетках фоликулов происходит синтез предшественников андрогенов, андростендиона и тестостерона, из которых в гранулезных клетках, стимулированных ФСГ, образуются эстрогены. Изменение уровней эстрадиола в нормальном менструальном цикле описано в разделе, посвященном гонадотропинам.
Менопауза
В менопаузе синтез эстрогенов затухает, и их уровень в сыворотке крови снижается до очень низких значений.
Физиологические функции эстрадиола у мужчин
У мужчин часть эстрогенов синтезируется яичками, а другая часть образуется в периферических тканях путем ароматизации тестикулярных и надпочечниковых андрогенов. У мужчин в возрасте до 50 лет 20 % эстрадиола секретируется яичками, 60 % образуется в процессе ароматизации тесто стерона, а остальные 20 % — при восстановлении эстрона. В возрасте между 50 и 60 годами доля эстрадиола, синтезируемая яичками, относительно возрастает вследствие резкого снижения секреции андрогенов корой надпочечников.
Патология:Девочки пубертатного периода и женщины детородного возраста:
• Гиперэстрогенемия
• Феминизация у детей
• Гормонсекретирующие опухоли яичника
• Гиперплазия надпочечников
• Гипоэстрогенемия
• Гипоганадизм
• Центральная анорексия (за счет снижения уровня гонадотропинов и нарушения синтеза эстрогенов)
• Прием гормональных контрацептивов
Женщины в менопаузе:
Гиперсекреция эстрогенов (т.е. менопаузальная метроррагия) может быть вызвана двумя причинами:
• повышенным периферическим синтезом
• секрецией эстрогенов опухолевыми тканями.
Мужчины:
Гиперсекреция эстрогенов :
• повышенная периферическая ароматазная активность,
• изменения в метаболизме эстрогенов, возникшие из за нарушений функции печени (напр., по причине алкоголизма)
• эстрогенсекретирующие опухоли (в том числе тестикулярные).
Кроме того, гиперэстрогенемия может наблюдаться при гипертиреозе. Показания к проведению исследований:Девочки пубертатного периода:
• Замедленное половое созревание
• Ментальная анорексия
• Овариальная недостаточность
Женщины детородного периода:
• Овариальная недостаточность
• Нарушения менструального цикла
• Бесплодие
• Контроль за процессом индуцированной овуляции
• Мониторинг при экстракорпоральном оплодотворении
• Предупреждение синдрома гиперстимуляции
• Поликистоз яичников
• Гипофизарная недостаточность
Женщины в менопаузе:
• Гипофизарная недостаточность
• При назначении гормональной заместительной терапии ( HRT ) и во время ее мониторинга
• Менопаузальная метроррагия
• Опухоли яичников и надпочечников
Мониторинг терапии тамоксифеном (уровень эстрадиола может служить индикатором эстрогенного статуса и помочь в оценке содержания рецепторов к прогестерону в опухолевых тканях).
Мужчины:
• Опухоли
• Азооспермия, олигоспермия
• Заболевания печени
Уровни эстрадиола в нормеКонцентрации эстрадиола выражаются в пг/мл или пмоль/л. Для перевода пг/мл в пмоль/л необходимо использовать следующее соотношение: 1 пг/мл = 0,0037 пмоль/л. Нужно иметь в виду, что на фоне приема пероральных контрацептивов показатели эстрадиола могут быть занижены.
Эстрадиол
пг/мл
пмоль/л
Мужчины
<56
<206
Женщины
Фолликулярная фазф
0 –160
0-587
Предовуляторная фаза
34 – 400
124-1468
Лютеиновая фаза
27 – 246
101-905
Менопауза
<30
<110
Препубертатные дети старше 5 лет
<30
<110
Биологический материал:• Сыворотка крови
• Гепаринизированная плазма крови
Прогестерон Прогестерон — природный гестаген, принадлежащий к группе С21 -стероидов. У небеременных женщин основное количество прогестерона синтезируется яичниками и, в меньшей степени, корой надпочечников. Около 97 % прогестерона находится в связанном состоянии с альбумином и другими транспортными белками: тироксинсвязывающим глобулином и кортикостероидсвязывающим глобулином. Период биологической полужизни прогестерона очень короткий. На 2/3 он метаболизируется в печени и выводится с мочой в виде сульфата или глюкуронида прегнадиола. Некоторые из 5 ß-восстановленных метаболитов прогестерона вызывают повышение базальной температуры тела во время лютеиновой фазы. Физиологическая функция прогестеронаУровень секретируемого яичниками прогестерона остается низким во время фолликулярной фазы. Под воздействием структурных и биохимических изменений в фолликуле, достигающих пика
при овуляции, лютеинизация гранулезных клеток завершается разрывом фолликула и образованием желтого тела. Это приводит к значительному увеличению синтеза прогестерона, уровень которого достигает максимума примерно за 7 дней до начала менструации. Биологическая роль прогестерона заключается в подготовке стимулированного эстрогенами эндометрия к имплантации оплодотворенной яйцеклетки.
Синтез прогестерона желтым телом возрастает при воздействии ЛГ и хорионического гонадотропина (ХГ). Только что образовавшееся желтое тело содержит наибольшее количество рецепторов, специфичных к ХГ. После имплантации яйцеклетки ХГ стимулирует синтез прогестерона желтым телом беременности до появления плаценты на 8 неделе развития плода. На этом этапе прогестерон начинает синтезироваться плацентой и его главной функцией становится снижение сократительной способности матки для сохранения беременности.
Патология:- Повышение концентрации прогестерона: • Врожденная гиперплазия надпочечников, обусловленная дефицитом 21- ß-, 17- ß- и 11- ß-монооксигенов • Хорионэпителиома яичника • Липидоклеточная опухоль яичника
- Снижение концентрации: • Угроза выкидыша • Синдром галактореи-аминореи • Прием гормональных контрацептивов
• Овариальная недостаточность
• Нарушения менструального цикла и аменорея
• Карцинома молочной железы (параллельно с определением рецепторов прогестерона)
Уровни прогестерона в нормеВлияние на результаты анализа связывающих белков устраняется использованием соответству ющих блокирующих агентов. Результаты выражаются в нмоль/л и нг/мл (1 нг/мл = 0,3145 нмоль/л).
Прогестерон
(нг/мл)
(нмоль/л)
Мужчины (20 — 70 лет)
0 – 0,75
0 – 2,4
Женщины
Фолликулярная фаза
0 — 1,13
0 -3,6
Овуляторный пик
0,48- 1,72
1,52 – 5,36
Лютеиновая фаза
0,95 — 21
3,02 –66,8
Менопауза
0 — 1
0 – 3,18
Биологический материал:• сыворотка крови
• гепаринизированная плазма крови
ТестостеронТестостерон является наиболее важным андрогенным и природным анаболическим гормоном мужчин и женщин. Его предшественниками являются дельта-5-прегненолон и прогестерон; важными промежуточными продуктами являются дегидроэпиандростерон и андростендион. У мужчин он синтез ируется преимущественно в семенниках клетками Лейдига; у женщин — корой надпочечников и яичниками, а также в результате периферического метаболизма.
97- 98 % тестостерона циркулирует в крови в связанном состоянии. Основными связывающими белками являются ГСПГ и альбумин. Только свободный тесто стерон (около 2 % у мужчин и 1 % у женщин) обладает биологической активностью.
Физиологическая функция тестостеронаНормальная секреция тестостерона необходима для поддержания функции воспроизведения у мужчин. Тестостерон контролирует сперматогенез, функцию простаты и потенцию. У обоих полов тестостерон стимулирует либидо, влияет на рост волос и голос.
Секрецию тестостерона клетками Лейдига стимулирует ЛГ. По принципу обратной связи тестостерон, а также образующийся из него эстрадиол, модулируют секрецию гонадотропинов гипофизом. Андрогенный компонент оказывает воздействие только на ЛГ, а эстрогенный — на ФСГ, поэтому нарушения функции семенников влекут за собой повышение уровня гонадотропинов в сыворотке крови. Синтез ФСГ подавляется ингибином семенных канальцев.
У женщин тестостерон секретируют яичники и кора надпочечников. Около половины тестостерона непосредственно секретируется стромой яичников, другая половина образуется в результате периферического метаболизма. Секреция тестостерона надпочечниками резко снижается у обоих полов после 50-60 лет. Патология:Маленькие дети и дети пубертатного периода
Мужчины:
• Недостаток андрогенов может вызвать замедленное половое созревание, бесплодие и импотенцию.
• Низкий уровень тестостерона в сочетании с высоким уровнем гонадотропинов указывает на первичную тестикулярную недостаточность. Однако в некоторых случаях (например; при синдроме Клайнфельтера) уровень тестостерона может быть в норме.
• Низкий уровень тестостерона в сочетании с низким или нормальным уровнем ЛГ указывает на вторичную тестикулярную недостаточность. В этом случае проводят тест стимуляции LH — RH . Пациенту назначают гонадотропины, кломифен или пульсирующее введение LH — RH . Мониторинг проводится с помощью измерения уровня тестостерона и исследования эякулята.
Женщины:
а) повышенные уровни тестостерона и DHEAS указывают на избыток андрогенов надпочечникового происхождения. В качестве дополнительного исследования проводят определение циркадного цикла кортизола, тест на подавление дексаметазоном и тест на стимуляцию АСТН.
б) повышенный уровень тестостерона при нормальном или слегка повышенном уровне DHEAS указывает на избыток андрогенов овариального происхождения. У женщин с поликистозом яичников уровень тестостерона часто незначительно повышен; повышаются также уровни ЛГ, андростендиона и эстрона в сыворотке крови. Диагностический тест с LH — RH обычно приводит к повышению уровня ЛГ, но не ФСГ. При очень высокой концентрации тестостерона необходимо исключить наличие опухоли яичника, продуцирующей андрогены.в) нормальные уровни тестостерона и DHEAS при клинически выраженном гиперандрогенизме указывают на повышение содержания свободного тестостерона вследствие снижения связы вающей емкости ГСПГ.
В случае тестикулярной феминизации пациенты имеют женский фенотип, слабый рост волос на лобке, хорошо развитые яички, расположенные либо в брюшной полости, либо в паху, и XY кариотип. Уровень тестостерона при этом соответствует нормальному мужскому уровню. Причиной заболевания является отсутствие рецепторов андрогенов в тканях-мишенях.
Показания к проведению исследований:Пубертатный период:
• Тестикулярные нарушения у мальчиков
• Овариальные нарушения у девочек
• Нарушения деятельности надпочечников у обоих полов
• Замедленное половое созревание
Мужчины:
• Тестикулярная недостаточность
• Наблюдение за ходом лечения тестикулярной недостаточности
• Бесплодие
• Импотенция
• Гинекомастия
Женщины:
• Гирсутизм
• Тестикулярная феминизация
• Опухоли яичника, продуцирующие тестостерон
• Поликистоз яичников
• Нарушения менструального цикла
• Аменорея
• Бесплодие
Уровни тестостерона в норме
Изменяющийся уровень тестостерона объясняется эпизодической секрецией ЛГ. У женщин отмечен циркадный ритм тестостерона, что объясняется значительным вкладом надпочечников в синтез андрогенов. Поэтому уровень тестостерона у женщин достигает своего максимума в ранние утренние часы.
Повышение концентрации тестостерона может наблюдаться при приеме барбитуратов, кломифена, эстрогенов, пероральных контрацептивов. У мужчин причинами низкого уровня тестостерона могут быть длительный алкоголизм, стресс и физическое истощение.
Уровень тестостерона приводится в нмоль/л (1 нг/мл = 3,47 нмоль/л).
нг/мл
нмоль/л
Мужчины
2,9 – 15,1
9,9 – 52,4
Женщины
0,65 – 1,19
2,3 – 4,1
Примечание:
С возрастом уровень тестостерона постепенно снижается.
Биологический материал:• сыворотка крови
• плазма крови.
Глобулин, связывающий половые гормоны (ГСПГ)ГСПГ связывает циркулирующие в крови половые гормоны (тестостерон и эстрогены), переводя их в не активную фракцию. ГСПГ синтезируется в печени. Его уровень повышается под действием эстрогенов и тиреоидных гормонов, при беременности, неврогенной анорексии, циррозе печени. Снижение уровня ГСПГ наблюдается при гипотиреозе, гиперандрогенемии, ожирении, заболеваниях печени, ведущих к снижению синтетической способности.
Так как половые гормоны, связанные с ГСПГ выбывают из активного пула, снижение его уровня у женщин приводит к явлениям гиперандрогении без повышения уровня общих андрогенов. У мужчин повышение уровня ГСПГ приводит к клинике гипоандрогении при нормальном уровне общего тестостерона.
Содержание ГСПГ в норме
нмоль/л
Мужчины
13-71
Женщины
18-114
Дегидроэпиандростерон сульфат ( DHEAS ) DHEAS является надпочечниковым андрогеном, относящимся к группе 17-кетостероидов. DHEAS образуется из сульфата холестерола. Основное количество DHEAS катаболизируется организмом и только 10 % его выделяется с мочой. Ежесуточно в кровяное русло выделяется 10 — 20 мг DHEAS (35 — 70 моль) у мужчин и 3,5 — 10 мг (12 — 35 моль) у женщин. Секреция DHEAS не имеет циркадного ритма, для этого стероида нет также специфических стероидсвязывающих сывороточных белков, поэтому концентрация DHEAS не зависит от изменения содержания этих белков в сыворотке крови. Однако DHEAS способен связываться с альбумином сыворотки крови человека.
Помимо DHEAS в крови циркулирует DHEA (дегидроэпиандростерон) DHEA синтезируется в основном корой надпочечников и, частично, половыми железами. Он образуется в 4 раза медленнее, чем DHEAS , у мужчин и в 2 раза медленнее у женщин. Скорость его метаболизма значительно выше, поэтому концентрация циркулирующего DHEA может быть в 1 000 раз ниже, чем DHEAS . Высокая концентрация в крови, длинный период полу-жизни и высокая стабильность делают DHEAS отличным индикатором андрогенсекретирующей функции надпочечников.
Повышенный уровень тестостерона у женщин может иметь надпочечниковое или овариальное происхождение. Результаты определения DHEAS позволяют выявить причину гиперандрогении.
Патология:• Значительное повышенная концентрация DHEAS (наблюдается только при гиперандрогении надпочечникового происхождения):
• андрогенсекретирующих опухолях надпоче-чников,
• двусторонней врожденной гиперплазии надпочечников с гиперандрокортицизмом (дефект 21-гидроксилазы и 11- ß-гидроксилазы)
• гирсутизме надпочечникового происхождения
• синдром Кушинга
• эктопический синтез АКТГ.
• Умеренное повышение может быть при поликистозе яичников.
• Снижение наблюдается при недостаточности коры надпочечников
Показания к проведению исследований:• Опухоли надпочечников
• Дифференциальная диагностика овариальных нарушений
• Остеопороз
• Задержка полового развития
Содержание DHEAS в норме
мкг/дл
мкмоль/л
Мужчины
80 – 560
2,2 – 15,2
Женщины
35 – 430
0,9 – 11,7
Биологический материал:• Кровь
• Гепаринизированная плазма крови
17-гидрокси-прогестерон 17-гидроксипрогестерон – это промежуточный продукт синтеза стероидов в корковом слое надпочечников и гонадах. Основное клиническое значение определения 17ОН-прогестерона состоит в выявлении дефицита 21-гидроксилазы (фермента, под действием которого 17ОН-прогестерон превращается в11-дезоксикортизол в каскаде стероидогенеза).Дефицит 21-гидроксилазы является самой распространенной формой (90% случаев) врожденной гиперплозии коры надпочечников (ВГКН, адрено-генитальный синдром). Нарушение синтеза 11-дезоксикортизола приводит к дефициту кортизола и альдостерона, повышению уровня АКТГ, гиперплазии коры надпочечников и усилению секреции надпочечниковых андрогенов. Дефицит альдостерона приводит к формированию синдрома потери соли, который проявляется кризами у 75% новорожденных с ВГКН, в более старшем возрасте кризы могут провоцироваться интеркурентными заболеваниями. Избыточная продукция андрогенов, особенно андростендиона, вызывает вирилизацию, которая служит характерным признаком этой формы ВГКН. У девочек вирилизация начинается еще во внутриутробном периоде и к моменту рождения может достигнуть разной степени от клиторомегалии до полного сращения губно-мошоночных складок и формирования уретры, открывающейся в тело полового члена. После рождения у мальчиков и девочек наблюдается увеличение полового члена/ клитора, угри, ускоренный рост, раннее оволосение лобка. Рост детей 3-10 лет опережает сверстников, в 11-12 лет происходит закрытие эпифизарных зон, поэтому нелеченные дети остаются низкорослыми. Характерны нарушение полового развития и бесплодие, однако, лечение может обеспечить нормальное формирование вторичных половых признаков и фертильность. Особое внимание следует обратить на женщин с невыраженными проявлениями ВГКН, которые обращаются к гинекологам-эндокринологам с жалобами на нарушение менструального цикла, гирсутизм и бесплодие.
Содержание 17ОН-прогестерона в норме:
нг/мл
новорожденные
5-30 дней
0,7-2,5
31-60 дней
мальчики
0,8-5,0
девочки
0,5-2,3
дети
3-14 лет
0,7-1,7
мужчины
0,5-2,1
женщины
фоликулиновая фаза
0,1-0,8
овуляция
0,3-1,4
лютеиновая фаза
0,6-2,3
постменопауза
0,13-0,5
беременные 3 триместр2,0-12,0
Биологический материал:• Кровь
• Гепаринизированная плазма крови
Антитела к спермеОколо 15% всех семейных пар, желающих иметь детей, страдают бесплодием. Предполагают, что у 10 из 100 бесплодных пар бесплодие имеет иммунологические причины. Одной из таких причин может быть выработка специфических антител к поверхностным белкам сперматозоидов, которые влияют на подвижность и функции мужских половых клеток. Метод иммуноферментного определения антител к сперме может быть использован для проведения скрининговых обследований по выявлению бесплодия, обусловленного иммунологическими механизамами. В случае бесплодия неясной этиологии рекомендуется проводить исследование на наличие антител к сперме обоим супругам. Показано, что тесты на выявление антител к сперме могут так же применяться для контроля за проводимой терапией. Пограничная концентрация антиспермальных антител в сыворотке 75 Е/мл. Пробы с концентрацией превышающей 75 Е/мл считаются положительными.
Хорионический гонадотропин (ХГЧ)Хорионический гонадотропин — наиболее важный из гестационных гормонов. ХГЧ продуцируется клетками синцитиотрофобласта плаценты и некоторыми опухолями.
Подобно гипофизарным гонадотропинам, ХГЧ является гликопротеином с молекулярной массой 40 кДа, который состоит из двух субъединиц. ß-субъединица ХГ содержит значительную часть аминокислотной последовательности ß-субъединицы ЛГ, а также 30 аминокислот на С-конце молекулы. В результате такой молекулярной гомологии возможность иммунохимической дифференциации ХГЧ и ЛГ зависит от способности антител определять небольшую часть молекулы ХГЧ, структурно отличающуюся от ЛГ. Использование моноклональных антител или специально обработанных поликлональных антител в ряде случаев делает возможным разрабатывать методы определения ХГЧ с пренебрежимо малой перекрестной реакцией с ЛГ, ФСГ и ТТГ.
Физиологические функции ХГЧОпределяемые количества ХГЧ появляются в крови матери уже на 8-9 день после оплодотворения яйцеклетки. Во время первого триместра беременности уровень ХГЧ быстро возрастает, удваиваясь каждые 2-3 дня. Концентрация ХГЧ достигает своего максимума на 8-10 неделе беременности, после чего несколько снижается и остается постоянной в течение второй половины беременности. Быстрое возрастание концентрации ХГЧ в периферической крови и моче делает определение ХГЧ идеальным видом анализа для быстрой диагностики беременности. Физиологическая роль ХГЧ в ранние сроки беременности состоит в стимуляции синтеза прогестерона желтым телом. Считается также, что ХГЧ стимулирует синтез тестостерона половыми железами плода мужского пола, а также оказывает воздействие на кору надпочечников эмбриона.
При удалении матки, после родов или аборта ХГЧ детектируется в течение более длительного периода, чем это следует из периода его полу-жизни. Уровень ХГЧ возвращается в норму в течение 2-3 недель после хирургического вмешательства; если уровень ХГЧ не снижается, это указывает на неполное удаление матки или эктопическую беременность. Высокий уровень ХГЧ после миниаборта указывает на продолжающуюся беременность.
Патология:Беременные женщины:
При внематочной беременности уровень ХГЧ в сыворотке крови и моче значительно ниже, чем при нормальной беременности в соответствующие сроки, либо его уровень повышается медленнее. Однако в случае имплантации эмбриона в достаточно благоприятном месте, уровень ХГЧ может повышаться, до значений, характерных для нормальной беременности. Таким образом, определение ХГЧ можно проводить в целях диагностики внематочной беременности. В случае положительного анализа на ХГЧ проводят дальнейшие исследования, в том числе эхографию, для дифференциации маточной и внематочной, физиологической и патологической беременности.
Пониженная концентрация гормона наблюдается при угрожающем или несостоявшемся выкидыше. Для подтверждения диагноза рекомендуется проводить повторные измерения уровня ХГЧ в динамике и ультразвуковое обследование.В последние годы при повышенном уровне ХГЧ проводят определение альфа-фетопротеина (АФП) и других независимых маркеров для пренатальной диагностики синдрома Дауна. Кроме того, при повышении уровня ХГЧ необходимо исключать внутриматочную инфекцию.
При пузырном заносе (хорионаденоме) происходят изменения в хориальных ворсинах. Возрастает активность клеток синцитиотрофобласта, что влечет за собой гиперсекрецию ХГЧ. Если в случае нормальной беременности уровень ХГЧ снижается после 10 недели беременности, то при хорионаденоме он продолжает возрастать и может достигнуть миллиона МЕ/л. Оптимальная диагностическая информация достигается при использовании ультразвуковой эхографии.
Повышенные уровни у больных со злокачественными заболеваниями
• опухоли трофобласта или терминального происхождения
• рак яичек
• рак яичников
• хорионкарцинома
• пузырный занос
• рак желудка
• рак печени
• рак тонкой кишки
• рак толстой кишки
• рак почек
• мелкоклеточный бронхогенный рак легких (эктопическая секреция)
• рак яичников
• рак молочных желез (эктопическая секреция)
• рак матки
Женщины:
Злокачественные опухоли трофобласта. Злокачественные новообразования возникают у 5-10 % пациенток с хорионаденомой. Поэтому после удаления хорионаденомы необходимо проводить регулярное обследование пациенток до тех пор, пока уровень ХГЧ не перестанет детектироваться. В течение, как минимум, полугода анализ ХГЧ должен проводиться ежемесячно, в течение 2 последующих лет анализ проводят через более длительные промежутки времени. Определение ХГЧ при лечении пролиферирующих опухолей и хориокарцином цитостатическими агентами позволяет оценить эффективность терапии. Три отрицательных анализа с интервалами в три недели свидетельствуют о ремиссии. В дальнейшем мониторинг проводится, как в случаях беременности с пузырным заносом. Определение а-субъединицы ХГЧ имеет прогностическое значение, так как увеличение ее уровня свидетельствует об ухудшении состояния больной.
Мужчины:
Уровень ХГЧ определяют в случае злокачественных новообразований (например, тератом и других тестикулярных опухолей). Хотя уровень ХГЧ не всегда повышается до минимально детектируемого, или повышается только уровень свободных субъединиц, анализ ХГЧ позволяет оценить эффективность проводимой терапии.
Показания к проведению исследований:Беременные женщины:
• Детекция беременности
• Внематочная беременность
• Диагностика угрожающего выкидыша
• Пузырный занос (хорионаденома)
• Злокачественные опухоли трофобласта
• Диагностика врожденных злокачественных опухолей плода
• Хромосомные аберрации плода
Мужчины и небеременные женщины:
• Тестикулярные опухоли
• Тератомы и тератобластомы
Содержание ХГЧ в норме
( МЕ/л )
Мужчины
0-2,5
Небеременные женщины
0-5,3
Беременность:Гестационный возраст (недели)
Медиана (интервал значений)
2-3
300 (150-600)
3-4
700 (360-1400)
4-5
14000. (9000 –21000)
5-6
80000 (40000 –120000.)
6-7
155000 (130000 –200000)
7-8
185000 (150000 –220000)
9
175000 (140000 –210000)
10
170000 (135000 – 205000)
11
140000 (120000 –160000)
12
115000 (100000 -130000)13
100000 (90000 – 110000)
14 90000 (80000 – 100000) 15 31700 (15900-63400) 16 27100 (13500-54100) 17 23100 (11000-46200) 18 21600 (10800-43200) 19 18200 (9100 – 36400) 20 16400 (8200-32800) 21 14600 (7300-29200) 22 12500 (6300-23000) 23 11000 (5500 – 22000) >24 7000 (3500 – 14000) Биологический материал:• сыворотка крови
• гепаринизированная плазма крови
• моча
• амниотическая жидкость.
Альфафетопротеин (АФП )
АФП является специфическим фетальным а-глобулином с молекулярной массой 65-70 кДа. Первоначально АФП вырабатывается желтым телом. Начиная с 13 недели беременности, когда его уровень достигает максимума в сыворотке крови плода (3 мг/мл), он начинает синтезироваться печенью плода, и его уровень постепенно снижается до 0,08 мг/мл к моменту родов. В течение первого года жизни уровень АФП снижается до очень низких значений, характерных для взрослого человека.
Диагностическое значение АФП во время беременности
Во время физиологической беременности уровень АФП в амниотической жидкости снижается, а в материнской сыворотке, напротив, возрастает. Увеличение уровня АФП всегда служит показателем наличия серьезных нарушений.
Возможность определять дефекты незаращения нервной трубки плода (расщелину позвоночника, анэнцефалию) на базе повышенного уровня АФП в амниотической жидкости, полученной при отхождении околоплодных вод на 15-20 месяце, была показана в 1970г. Затем повышенный уровень АФП в амниотической жидкости стали связывать с наличием других аномалий развития плода.
Диагностика врожденных аномалий по уровню АФП в материнской сыворотке (MC АФП) основывается на тех же принципах. Так как физиологический уровень АФП зависит от срока беременности, результаты анализа МС АФП наиболее часто оценивают по отношению к среднему значению уровня АФП, характерному для данного срока Повышение уровня МС АФП в 2,5 и более раз выше нормы наблюдается при серьезных патологических состояниях, угрожающем выкидыше или гибели плода.
Понижение уровня АФП по сравнению с уровнем нормально развивающейся беременности может свидетельствовать о риске рождения ребенка с трисомией по 21 хромосоме. Однако, поскольку уровень АФП при патологической беременности (при трисомии) составляет лишь 0,7 от его уровня при физиологической беременности, рекомендуется анализ АФП комбинировать с определением других независимых маркеров, например, ХГЧ или его субъединиц, свободного эстирола и др.
Некоторые авторы советуют использовать анализ МС АФП в качестве дополнительного анализа при осложненной беременности.
Патология:Повышенные уровни у больных со злокачественными опухолевыми заболеваниями:
• первичный рак печени (за исключением анапластической формы, при которой АФП — отрицательный)
• метастазы злокачественных опухолей в печень(при бронхогенной карциноме, раке молочной железы и раке прямой и сигмовидной кишки).
• опухоли терминального происхождения
• рак яичника
• рак яичка
• рак желудка
• рак толстой кишки
• рак поджелудочной железы
• рак молочной железы
• бронхиальные опухоли
Повышенные уровни при заболеваниях доброкачественной этиологии :
• цирроз печени
• острый вирусный гепатит
• хронический гепатит
• хроническая почечная недостаточность
Показания к проведению анализа:Беременные женщины :
• Контроль за ходом 1-ого триместра беременности
• Угроза выкидыша
• Диагностика врожденных пороков развития
• Диагностика хромосомных аберраций
Пациенты с опухолями :
• Гепатоцеллюлярная карцинома
• Злокачественные опухоли желчного пузыря, желчных путей и поджелудочной железы
• Тестикулярные опухоли
• Тератомы, тератобластомы
• Опухоли, имеющие эмбриональное происхождение
Содержание АФП в нормеРезультаты обычно выражаются в МЕ/мл (1 МЕ/мл = 1,21 нг).
МЕ/мл
нг/мл
Вне беременности
0,5 – 5,5
0,6 – 6,66
Во время беременности:
Гестационный возраст (недели)
Медиана (интервал), МЕ/мл
14
21,7 (10,9-21,8)
15
25,0 (12,5-50)
16
28,8 (14,4-57,6)
17
33,1 (16,5-66,2)
18
38,0 (19-76)
19
43,8 (21,9-87,6)
20
50,4 (25,2-100,8)
21
57,9 (28,9-115,8)
22
66,2 (33,1- 132,4)
23
90,0 (45-180)
Биологический материал:• сыворотка
• гепаринизированная плазма
• амниотическая жидкость
• кистозная жидкость
• асцитическая жидкость
Неконъюгированный эстриолЭстриол является стероидным гормоном, синтезируемым плацентой. На первой стадии синтеза, которая происходит в эмбрионе, холестерин, образующийся de novo, либо поступающий из крови матери, превращается в прегненолон, который сульфатируется корой надпочечников плода в дегидроэпиандростеронсульфат. Гидроксилирование этого соединения по 16 а-положению и отщепление сульфата сульфатазами плаценты приводит к образованию эстриола. Поскольку в образовании эстриола принимают участие как плод, так и плацента, измерение уровня эстриола может служить идеальным показателем функции фето-плацентарной системы.
Физиологические функции эстриола В материнской крови только небольшая часть эстриола циркулирует в свободном состоянии, основное его количество составляет глюкуронид а-сульфата Во время беременности уровень эстриола постепенно возрастает до 40 недели. Пониженный уровень эстриола или его резкое снижение свидетельствует о патологическом состоянии плода. Определение уровней общего или свободного эстриола используют для мониторинга беременности. Уровень свободного эстриола быстрее отражает ухудшение состояния плода. ПатологияОпределение эстриола используют для наблюдения за состоянием фетоплацентарной системы , а также для диагностики
Уровень неконъюгированного эстриола снижается при :
• осложненном течении беременности (поздний гестоз, анемия, пиелонефрит, хронические заболевания ЖКТ, патология надпочечников у беременной), сопровождающемся нарушением плацентарного кровообращения и возникновением плацентарной недостаточности, развитием гипоксии и ацидоза у плода
• внутриутробной гипотрофии плода
• алкогольном синдроме плода
• внутриутробном инфицировании плода
• некоторых видах наследственной патологии (врожденной гипоплазии надпочечников, синдроме Дауна, анэнцефалии и др.)
• нарушения сульфатазной активности плаценты (редкое врожденное заболевание, связанное с Х-хромосомой). Отсутствие этого фермента блокирует синтез эстриола из предшественников, что отражается в очень низком уровне эстриола при беременности без каких-либо других признаков неблагополучия плода. Такие беременности часто заканчиваются хирургическим вмешательством в процесс родов, причем рождаются исключительно младенцы мужского пола с признаками ихтиоза, появляющегося вскоре после рождения.
• применении кортикостероидов (например, для стимуляции созревания легочной ткани плода)
• применении некоторых антибиотиков.
Уровень неконъюгированного эстриола повышается при:
• почечной недостаточности.
Показания к проведению исследований:Беременные женщины :
• Мониторинг состояния плода в третьем триместре беременности
• Диагностика хромосомных аберраций
Уровни неконъюгированного эстриола в нормеГестационный возраст (недели)
Медиана, нмоль/л
Интервал, нмоль/л
6-7
1,19
0,98-1,38
8-9
1,63
1,37-1,89
10-12
4,03
2,3-5,77
13-14
7,72
5,74-9,68
15-16
10,0
5,4-21,0
17-18
12,0
6,6-25,0
19-20
14,93
10,76-19,1
21-22
24,48
19,34-29,62
23-24
28,33
22,11-34,54
25-26
30,80
23,40-38,19
27-28
32,55
24,39-40,71
29-30
35,38
28,09-42,67
31-32
45,63
35,01-56,26
33-34
43,0
39,08-46,93
35-36
51,68
44,77-53,59
37-38
63,68
54,90-72,47
39-40
65,07
57,61-72,53
Трофабластический ß — гликопротеин (ТБГ)ТБГ синтезируется клетками трофобласта и является специфическим маркером беременности. В низких концентрациях (0,2-5,0 нг/мл) он определяется в крови здоровых небеременных женщин. Уже со 2 недели его уровень существенно возрастает, что позволяет использовать этот тест для ранней диагностики беременности. При нормальном течении беременности уровень ТБГ прогрессивно возрастает до 20-24 недели, затем стабилизируется и резко падает накануне родов. В послеродовом периоде содержание ТБГ через 30 – 40 часов уменьшается вдвое, а к 16 дню достигает уровня здоровых небеременных женщин. Одним из физиологических эффектов является его иммуносупрессивное действие, что необходимо для нормального развития беременности.
Патология:Снижение:
• Менее 500нг/мл при сроке 3-5 недель:
• Внематочная беременность
• Функциональная недостаточность трофобласта
• Резкое снижение в более поздние сроки указывает на угрозу спонтанного преждевременного прерывания беременности (при падении в 6 раз в 100% случаев, а в 2-4 раза в 33,3% случаев)
• Уменьшение концентрации ТБГ в ходе лечения угрожающего выкидыша говорит о неэффективности терапии
• Медленное увеличение содержания ТБГ по мере развития беременности или стабилизации его показателей указывает на вероятность позднего выкидыша или преждевременных родов
• Снижение ТБГ наблюдается при наличии у плода трисомий
Повышение:
• Многоплодная беременность
• Сахарный диабет
• Резус-конфликтная беременность (уровень ТБГ увеличивается пропорционально тяжести гемолитической болезни плода)
• Перенашивание
• Онкологические заболевания (мониторинг течения и эффективности терапии):
• Рак матки
• Рак яичников
• Хорионкарцинома (ТБГ/ХГЧ = 0,1 – 1,0)
• Инвазивный занос (ТБГ/ХГЧ = 1,2 – 4,5)
• Пузырный занос (ТБГ/ХГЧ = 6,0 – 12,0)
• Анэнцефалия плода (наряду с исследованием АФП, ХГЧ и неконьюгированного эстриола).
Содержание ТБГ в норме
Гестационный возраст (недели)
ТБГ, нг/мл
2-3
50-150
3-4
150-300
4-5
300-500
5-6
500-1500
6-7
1500-3000
7-8
3000-5000
9
8000 — 10000
10
10000 — 13000
11
13000 — 17000
12
15000 – 18000
13
17000 – 20000
14
19000 – 24000
15
20000 –25000
16
22000 – 28000
17
25000 – 30000
18
30000 – 35000
19
32000 – 37000
20
33000 — 38000
21
35000 — 40000
22
37000 – 42000
23
40000 – 45000
24
45000 – 55000
25
55000 – 100000
26
100000 -200000
27
200000 –300000
28
300000 –400000
29 –40
400000 –500000
Биологический материал:• Кровь
• Сыворота крови
ПАПП-А (РАРР-А) Белок РАРР-А (pregnancy associated plazma protein A) впервые был обнаружен в сыворотке крови беременных с помощью метода иммунодиффузии в 1974г. РАРР-А вырабатывается у беременных женщин трофобластом, у небеременных — клетками гранулезы, слизистой обочлочкой маточных труб и эндометрием, а у мужчин — клетками Лейдига. Молекулярная масса РАРР-А 200 кД. В сыворотке крови беременных РАРР-А находится в комплексе с проформой основного протеина эозинофилов, что позволяет ему разрывать мембрану цистосом и оказывать повреждающее воздействие на ткани. Подобный эффект вероятно необходим в процессах нидации плодного яйца и развития трофобласта. РАРР-А принимает участие в регуляции кровотока в межворсинчатом пространстве за счет ингибирования гемолиза, индуцированного системой комплимента, угнетает активность плазмина и имеет аффинитет к гепарину. РАРР-А in vitro до-зозависимо ингибирует пролиферативную активность лимфоцитов, индуцированную лейкинами или аллогенными клетками, поэтому он входит в группу белков-иммуносупрессоров.
Рост сывороточной концентрации РАРР-А при беременности зависит от массы плацентарных клеток. Прогностическая ценность по диагностике плацентарной недостаточности (ПН) у РАРР-А ниже, чем у трофобластического ?1-гликопротеина (ТБГ). При ПН уровень РАРР-А снижается, а при начавшемся самопроизвольном выкидыше, сопровождающемся деструкцией клеток синцитиотрофобласта — повышается.
Особый интерес исследования РАРР-А представляют для диагностики синдромов хромосомных трисомий плода по 21 (синдром Дауна), 18 (синдром Эдвардса), 13 (синдром Патау) хромосомам в I триместре беременности. Исследования показали, что уровень РАРР-А в сыворотке крови при названных синдромах снижается в сроке 9-13 недель менее 0,5 Мом. Для синдрома Дауна снижение РАРР-А выявлено в 65%, для синдромов Эдвардса и Патау до 70% случаев, при ложноположительных результатах 5%. Обнаружено снижение РАРР-А менее 0,5 Мом при синдроме Корнелии де Ланге.
Рекомендуется проводить определение РАРР-А оптимально с 9 до 11 недель (по последней менструации), за 7-10 дней до УЗИ эмбриона с измерением толщины его воротникового пространства (ТВП).Содержание РАРР-А в сыворотке крови при беременности в норме:
Недели беременности по последней менструации
Медиана (Мом), ug/ml
Допустимые значения
0,5 Мом, ug/ml
2 Мом, ug/ml
8
2600
1300
5200
9
4200
2100
8400
10
7560
3780
15120
11
11000
5500
22000
12
15060
7530
30120
13
17000
8500
34000
14
21510
10750
43020
Коэффициенты пересчета единиц измерения:
1 mIU/ml = 450 ug/ml
1 ug/ml=2220 mIU/ml
Аллергокомпонент f76 — Альфа-лактальбумин nBos d 4, IgE (ImmunoCAP): исследования в лаборатории KDLmed
Количественное определение в крови специфических иммуноглобулинов класса E к
одному из главных аллергенов коровьего молока – сывороточному белку альфа-лактальбумину.
Синонимы русские
Специфические иммуноглобулины класса Е к ?-лактальбумину коровьего молока.
Синонимы английские
ImmunoCAPf76 (Cow’sMilk, Alfa-lactalbumin, nBosd 4), IgE; Cow’sMilkAlfa-lactalbumin (nBosd 4),IgEAbinSerum; ?-LactalbuminnBosd4, IgE.
Метод исследования
Реакция иммунофлюоресценции на трехмерной пористой твердой фазе, ИФЛ (ImmunoCAP).
Единицы измерения
kU/l (килоединица на литр).
Какой биоматериал можно использовать для исследования?
Венозную или капиллярную кровь.
Общая информация об исследовании
Аллерген – это вещество, вызывающее аллергическую реакцию. При атопических заболеваниях аллергены стимулируют образование антител класса IgE и являются причинными факторами развития клинических симптомов аллергических заболеваний. Выявление в крови специфических иммуноглобулинов Е к определенному аллергену подтверждает его роль в развитии аллергической реакции I типа (реагиновой), а значит, позволяет определить возможного «виновника» аллергии и назначить соответствующие лечебные и профилактические мероприятия.
Однако в состав аллергенного вещества входит не один, а несколько белковых структур, которые могут выступать аллергенами. Одни являются «мажорными» — главными аллергенами, другие «минорными» – второстепенными. Это позволяет дифференцировать истинную и перекрестную аллергию.
Пищевая аллергия – вызванная приемом пищи реакция, в основе которой лежат иммунные механизмы. Её нередко можно спутать с пищевой непереносимостью, связанной с другими причинами (особенностями приготовления пищи, составом продукта, метаболическими нарушениями, заболеваниями ЖКТ). Необоснованное исключение неаллергенных для человека пищевых продуктов или, наоборот, их употребление при наличии аллергии может оказывать негативное воздействие на организм.
Пищевая аллергия чаще наблюдается у детей первых лет жизни, преимущественно до 3х-летнего возраста. Одним из наиболее распространенных пищевых аллергенов является молоко. У детей, сенсибилизированных к коровьему молоку, аллергия может проявляться не только кожными симптомами, но и поражением пищеварительного тракта, ринитом, обострением астмы, анафилактическими реакциями. Гиперчувствительность к коровьему молоку не всегда исчезает в детстве и может сохраняться на многие годы во взрослом возрасте или на всю жизнь.
В коровьем молоке содержится около 40 белков, которые могут выступать аллергенами. С учетом физико-химических свойств их разделяют на казеины (80% белков молока) и сывороточные белки (20%). Сыворотка содержит преимущественно глобулярные белки, бета-лактоглобулин и альфа-лактальбумин, и в меньшем количестве бычий сывороточный протеин, лактоферрин, иммуноглобулины. Альфа-лактальбумины и бета-глобулины синтезируются в молочных железах, а бычий сывороточный протеин, лактоферрин и иммуноглобулины проникают из крови.
Антительный ответ на белки молока очень варьирует у различных людей, поэтому не существует конкретного аллергена, который мог бы считаться главным фактором аллергенности коровьего молока. В большинстве случаев IgE-антитела одновременно выявляются сразу к нескольким белкам молока, мажорными среди которых считаются казеин (Bosd 8), бета-лактоглобулин (Bosd 5) и альфа-лактальбумин (Bosd 4).
Альфа-лактальбумин – мономерный глобулярный кальций-связывающий белок весом 14,2 кДа, который составляет 25% сывороточных протеинов и около 5% всех белков молока. В секреторных клетках молочной железы он выступает регулятором синтеза лактозы. Структура коровьего альфа-лактальбумина на 72% соответствует человеческому, обладает антибактериальными и иммуностимулирующими свойствами, что делает его очень важным компонентом детского питания. Существуют специальные смеси для детского питания, в которых концентрация альфа-лактальбумина увеличена, а бета-лактоглобулина снижена.
Аллергенность белка зависит от его конформационной структуры, а перекрестная реактивность с альфа-лактальбуминами молока других видов животных возможна, но недостаточно изучена. IgE-антитела к бета-лактоглобулинами и альфа-лактальбуминам в 10% случаев имеют перекрестную реактивность.
Целью данного исследования является определение специфических IgE к нативному (полученному из натурального сырья) аллергену коровьего молока – альфа-лактальбумину (nBos d 4) методом ImmunoCAP. Аллергодиагностика технологией ImmunoCAP характеризуется высокой точностью и специфичностью, что достигается обнаружением в очень малом количестве крови пациента низких концентраций IgE-антител. Исследование основано на иммунофлюоресцентном методе, что позволяет увеличить чувствительность в несколько раз по сравнению с другими диагностическими методами. Во всем мире до 80% определений специфических иммуноглобулинов IgE выполняется данным методом. Всемирная Организация Здравоохранения и Всемирная Организация Аллергологов признают диагностику с использованием ImmunoCAP как «золотой стандарт», так как эта методика доказала свою точность и стабильность результатов в независимых исследованиях.
Для чего используется исследование?
- Диагностика аллергии на сывороточные белки коровьего молока;
- подбор гидролизированных смесей для питания детей раннего возраста.
Когда назначается исследование?
- При сенсибилизации к коровьему молоку;
- при подборе гидролизированных смесей для детей раннего возраста;
- при обследовании детей с атопическим дерматитом, крапивницей, ангиоотеками, бронхиальной астмой, аллергическим ринитом/конъюнктивитом, желудочно-кишечными расстройствами, анафилактическим шоком и другими проявлениями аллергических заболеваний.
Что означают результаты?
Референсные значения: отрицательно.
Причины положительного результата:
- сенсибилизация к одному из главных («мажорных») аллергенов коровьего молока – альфа-лактальбумину.
Причины отрицательного результата:
- отсутствие сенсибилизации к данному аллергену;
- длительное ограничение или исключение контакта с аллергеном.
Важные замечания
Выполнение данного исследования безопасно для пациента по сравнению с кожными тестами (invivo), так как исключает контакт пациента с аллергеном. Прием антигистаминных препаратов и возрастные особенности не влияют на качество и точность исследования.
Также рекомендуется
[02-029] Клинический анализ крови с лейкоцитарной формулой и СОЭ
[08-017] Суммарные иммуноглобулины E (IgE) в сыворотке
[21-673] Аллергочип ImmunoCAP
[40-443] Аллергологическое обследование при экземе
[21-713] Аллергокомпонент f77 — Бета-лактоглобулин nBos d 5, IgE (ImmunoCAP)
[21-712] Аллергокомпонент e204 — Бычий сывороточный альбумин nBos d6, IgE (ImmunoCAP)
определение специфических иммуноглобулинов класса E к прочим аллергенам
Кто назначает исследование?
Аллерголог, гастроэнтеролог, педиатр, дерматолог, пульмонолог, оториноларинголог, терапевт, врач общей практики.
Литература
- Monaci L, Tregoat V, van Hengel AJ, Elke Anklam. Milk allergens, their characteristics and their detection in food: A review. Eur Food Research Tech 2006;223(2):149-79
- Wal JM. Bovine milk allergenicity. Ann Allergy Asthma Immunol 2004;93(5 Suppl 3):S2-11
- Lien EL. Infant formulas with increased concentrations of alpha-lactalbumin. Am J Clin Nutr 2003;77(6):1555S-8S
- Permyakov EA, Berliner LJ. Alpha-Lactalbumin: structure and function. FEBS Lett 2000;473(3):269-74
- Baroglio C, Giuffrida MG, Cantisani A, Napolitano L, Bertino E, Fabris C, Conti A. Evidence for a common epitope between bovine alpha-lactalbumin and beta-lactoglobulin. Biol Chem 1998;379(12):1453-6
Alpha 1 Globulin — обзор
Основные белки в плазме крови
Альбумин — самый распространенный белок плазмы, присутствующий в концентрациях приблизительно 3,5–4,0 г / дл. Альбумин — глобулярный белок с массой 69 кДа, состоящий из полипептидной цепи из 585 аминокислот. Его изоэлектрическая точка 4,7 объясняет его электроотрицательный заряд при pH 8,6. Присутствие многочисленных реактивных групп в альбумине наделяет эту молекулу способностью связывать широкий спектр веществ, что позволяет ей функционировать в качестве носителя для многих соединений (жирных кислот, желчных пигментов, стероидов, гормонов и лекарств).Из-за своей относительно низкой массы и высокой концентрации альбумин составляет примерно 80% от общего коллоидного осмотического давления плазмы (стр. 695).
Концентрация альбумина в плазме снижается во многих состояниях, при которых снижен его синтез (белковая недостаточность или печеночная недостаточность) или при аномальном выведении белка (заболевание почек).
Глобулины. Фракция глобулина плазмы представляет собой сложную смесь белков. Это конъюгированные белки двух основных типов: гликопротеины и липопротеины, которые связаны либо с углеводами, либо с липидами, соответственно.Будут упомянуты только некоторые из основных компонентов глобулина.
Гликопротеины. К этим типам глобулинов относятся следующие:
α 1 глобулины . Они включают:
α 1 -антипротеиназа или α 1 -антитрипсин — гликопротеин с массой 50 кДа и общим содержанием углеводов 12%.Это один из основных ингибиторов сериновых протеаз плазмы, защищающий ткани (особенно легкие) от действия протеаз, высвобождаемых полиморфно-ядерными гранулоцитами. Дефицит этого белка является причиной некоторых случаев эмфиземы легких. Курение способствует окислению метионинового остатка α 1 -антипротеиназы, который инактивирует его. Это причина того, что курильщики с низким уровнем этого гликопротеина предрасположены к протеолитическому разрушению легочной ткани и образованию эмфиземы легких и хронической обструктивной болезни легких (POCD).
Оросомукоид . Также называемый α 1 кислотный гликопротеин, имеет высокую долю углеводов. Концентрация этого белка увеличивается во время воспалительных процессов вместе с С-реактивным белком (так называемым, потому что он реагирует с пневмококковым полисахаридом С).
Протромбин . Это предшественник тромбина, фермента, катализирующего превращение фибриногена в фибрин, заключительный этап свертывания крови (Глава 31).
Транскортин . Это белок, отвечающий за транспорт кортизола, гормона, вырабатываемого корой надпочечников.
α 2 глобулинов. Включите следующее:
Церулоплазмин . Это белок с массой 151 кДа, который содержит шесть атомов меди на молекулу и имеет интенсивный синий цвет. Он функционирует как переносчик меди и является ферментом, проявляющим ферроксидазную активность.При болезни Вильсона, аутосомно-рецессивном генетическом заболевании, уровни церулоплазмина в плазме снижаются. Медь накапливается в головном мозге и печени, вызывая неврологические симптомы и заболевания печени.
Гаптоглобин — это белок, который связывается с гемоглобином. Hb обычно циркулирует в плазме в небольших количествах из-за его высвобождения в результате гемолиза эритроцитов. Эта белок-белковая ассоциация предотвращает вывод свободного циркулирующего гемоглобина с мочой (свободный гемоглобин в плазме может проходить через почечный фильтр).
α 2 макроглобулин представляет собой гомотетрамер массой 720 кДа, который транспортирует 10% всего цинка, присутствующего в плазме, и действует как ингибитор протеазы.
Эритропоэтин — это гормон, вырабатываемый почками и контролирующий выработку красных кровяных телец (стр. 629).
β-глобулинов. К ним относятся следующие:
Трансферрин . Этот белок связывает два атома железа и служит переносчиком железа в плазме.В случае дефицита железа или при нормальной беременности уровень трансферрина значительно повышается. Он снижается при злокачественной анемии, хронических инфекциях и печеночной недостаточности.
β 2 микроглобулин . Это небольшой белок массой 11,7 кДа, обнаруженный в клеточных мембранах. Он является частью главного комплекса гистосовместимости (MHC) класса I (стр. 766).
Если электрофорез проводится в плазме крови вместо сыворотки, можно наблюдать присутствие другого белка, который мигрирует между β- и γ-глобулинами⋅ Это фибриноген , гликопротеин, который участвует в заключительной стадии коагуляции.Фибриноген составляет 4-6% от общего белка плазмы; его концентрация составляет 0,35 г / дл. Он имеет массу 340 кДа и форму с преобладанием продольной оси. Другие структурные данные для этого белка будут рассмотрены в главе 31. Фибриноген синтезируется в печени; Таким образом, у пациентов с тяжелой печеночной недостаточностью уровень фибриногена в плазме снижается. Описаны наследственные заболевания, при которых фибриноген либо снижен, либо отсутствует, фибриногенопения и афибриногенемия соответственно.
гамма-глобулинов или иммуноглобулинов. Эти гликопротеины представляют собой антитела . Антитела образуются у человека, когда в организм попадают чужеродные вещества или антигены. Это могут быть патогенные агенты (такие как бактерии, вирусы и грибки) или макромолекулы, отличные от тех, которые получают индивидуум (гетерологичные белки). Эти экзогенные для организма агенты вызывают специфический ответ, называемый иммунной реакцией (см. Главу 30). Во время иммунной реакции организм вырабатывает серию антител, способных специфически связываться с вторгающимся антигеном.Это вызовет осаждение и разрушение (лизис) инородной частицы. После заражения вирусными или бактериальными патогенами или после вакцинации определенным антигеном большинство людей поддерживают уровни антител против чужеродных агентов в течение различных периодов времени. Это, известное как иммунизация, помогает защитить человека от последующих повторных инфекций. Антитела относятся к гамма-глобулиновой фракции белков плазмы крови и обычно называются иммуноглобулинами (Ig).
Исследования с использованием ультрацентрифугирования, электрофореза, иммунохимических и других методов подтвердили существование различных типов иммуноглобулинов, обозначенных буквами G, A, M, D и E.
Иммуноглобулин G (IgG) включает примерно 75% иммуноглобулинов циркулирует в плазме крови. Их молекулярная масса составляет 150 кДа, а скорость оседания составляет 7S; по этой причине их называют 7S γIgG (обозначение S относится к единицам Сведберга, что связано со скоростью осаждения вещества после ультрацентрифугирования).Содержание углеводов иммуноглобулина G составляет 3% от общей массы молекулы. Существует четыре подкласса этого гликопротеина, обозначенных IgG 1 , IgG 2 , IgG 3 и IgG 4 .
Иммуноглобулин A (IgA) составляет 12–15% иммуноглобулинов плазмы. Они имеют массу от 150 до 380 кДа, скорость осаждения от 7S до 11S и содержание углеводов примерно 12% от их общей массы.Были идентифицированы два подкласса: IgA 1 и IgA 2 .
Иммуноглобулин M (IgM) — самая большая молекула из этого семейства белков с массой около 1000 кДа и скоростью оседания 19S или более. Их также называют макроглобулинами, и они составляют 8% от общего количества γ-глобулинов; около 12% его веса составляют углеводы.
Иммуноглобулин D (IgD) составляет примерно 1% от общего содержания Ig. Их масса составляет 180 кДа, и 13% от их веса приходится на углеводы.
Иммуноглобулин E (IgE) имеет массу около 180 кДа и представляет собой антитело, обнаруживаемое в самых низких концентрациях в плазме, составляющее менее 0,3% от общего количества иммуноглобулинов.
Структура, функция и генетический контроль иммуноглобулинов будут рассмотрены в главе 30.
Циркулирующие антитела от человека, который приобрел иммунитет к определенному инфекционному заболеванию, могут быть переданы другому человеку с помощью парентеральной инъекции. Этот «пассивный» перенос иммуноглобулина обеспечивает реципиенту временную защиту от инфекции и является основой для превентивного использования гамма-глобулина в качестве агента против риска инфекционных заболеваний.
Выявлены генетические дефекты, при которых отсутствует или снижена способность синтезировать иммуноглобулины (агаммаглобулинемия или гипогаммаглобулинемия соответственно). Эти состояния имеют серьезный прогноз, поскольку естественная защита пациента от инфекции снижена или отсутствует.
При миеломе, злокачественном опухолевом процессе, наблюдается заметное повышение уровня иммуноглобулинов. Все Ig, секретируемые миеломой, относятся к одному классу, и все они будут иметь одинаковую антигенную специфичность.
Липопротеины. Это глобулярные белки, которые связаны с липидами. Поскольку липиды представляют собой гидрофобные вещества, которые не могут свободно диспергироваться в плазме, им необходимо связываться с белками, чтобы переноситься в плазме. В липопротеинах неполярные липиды (триацилглицерины и сложные эфиры холестерина) расположены внутри частицы, окружены фосфолипидами, свободным холестерином и белками, причем их гидрофобные части ориентированы к неполярному ядру, а их гидрофильные области обращены к внешней стороне частицы.Такое расположение поддерживает стабильность липидов в водной среде. Идентифицировано несколько типов липопротеинов плазмы, и все они различаются по содержанию липидов и белков, плотности и электрофоретической подвижности (стр. 326).
Поскольку липиды имеют низкую плотность, удельная плотность липопротеинов ниже по мере увеличения содержания липидов. Это свойство позволяет разделять различные липопротеины плазмы с помощью ультрацентрифугирования. При помещении в раствор NaCl плотностью 1.063, подвергнутые центрифугированию, липопротеины имеют тенденцию плавать или локализоваться в верхних слоях среды. Тенденция к плавучести в среде известной плотности выражается в единицах флотации Сведберга (Sf). Это свойство можно использовать как инструмент для оценки содержания липидов в молекуле. Таким образом, чем больше значение Sf, тем ниже плотность данного липопротеина (таблица 3.3).
Таблица 3.3. Липопротеины плазмы крови человека
| Фракция | Плотность | Sf | Подвижность | Состав | |||||
|---|---|---|---|---|---|---|---|---|---|
| % | % | % Всего липидов | % Всего липидов | Всего липидов | Фосфолипиды | Холестерин | |||
| Хиломикроны | & lt; 0.96 | & gt; 400 | Происхождение | 1 | 99 | 88 | 8 | 4 | |
| Липопротеины очень низкой плотности (ЛПОНП) | 0,96–1,006 20242 | 7 | 93 | 56 | 20 | 23 | |||
| Липопротеины низкой плотности (ЛПНП) | 1.019–1.063 | 2–20 | Бета | 13–2927 | 43–58 | ||||
| Липопротеины высокой плотности (ЛПВП) | 1.063–1.210 | 0–2 | Alpha | 33–57 | 43–67 | 13–16 | 45 | 35–41 | |
В зависимости от плотности четыре группы липопротеинов плазмы могут быть признанным:
- 1.
Хиломикроны , с наименьшей плотностью: 0,96.
- 2.
Липопротеины очень низкой плотности s (ЛПОНП) с удельным весом от 0,96 до 1.006.
- 3.
Липопротеин низкой плотности (ЛПНП), имеющий плотность от 1,019 до 1 л. 063.
- 4.
Липопротеины высокой плотности (ЛПВП), с плотностью от 1,063 до 1,210.
Эта классификация, предложенная Fredrickson и соавторами, получила широкое распространение и используется в клиниках.
Липопротеины также можно разделить с помощью электрофореза, и существует тесная корреляция между фракциями, полученными с помощью электрофореза, и фракциями, различимыми на основе их плотности.ЛПВП мигрируют как α-глобулины и обозначаются как α-липопротеины. ЛПНП обладают подвижностью β-глобулинов и называются β-липопротеинами. ЛПОНП движутся впереди β-глобулинов и называются пре-β-глобулинами. Хиломикроны не мигрируют в электрическом поле.
Состав разных липопротеидов заметно различается. Те, у кого более высокий удельный вес, имеют относительно более высокое содержание белка (Таблица 3.3). Например, в ЛПОНП содержится 7% белка, а в ЛПВП содержится от 33% до 57% белка.Хиломикроны — это частицы диаметром около 0,5 мкм, которые в основном переносят триацилглицерины из кишечника в лимфатическую систему и содержат очень мало белка (почти 1%). Белки образуют тонкую пленку на поверхности хиломикронов.
Относительное содержание липидов каждого типа липопротеинов показано в таблице 3.3. Липопротеины пре-β (ЛПОНП) особенно богаты триацилглицеринами, в то время как β-липопротеины (ЛПНП) в первую очередь отвечают за транспорт холестерина. Повышение ЛПНП — частая находка в случаях гиперхолестеринемии.
Белковая или апопротеиновая часть липопротеинов обычно неоднородна. Существует несколько классов аполипопротеинов, обозначаемых буквами A, B, C, D и E, и все они обычно называются апо A, апо B и т. Д. (Стр. 327). Также известны несколько подтипов аполипопротеинов. Таким образом, для апо A описаны три вида (A-I, A-II и A-IV). Апо AI является основным компонентом белка ЛПВП и обнаруживается в качестве второстепенного компонента в хиломикронах и ЛПОНП. Апо AI является активатором лецитин-холестерин-ацилтрансферазы (ЛХАТ) в плазме (см. Стр.330). Апо A-II является вторым по распространенности апопротеином и составляет почти 20% ЛПВП. Апо A-IV связан с хиломикронами и синтезируется в слизистой оболочке кишечника.
Апо B представляет собой аполипопротеин, присутствующий в ЛПНП, ЛПОНП и хиломикронах. Он представлен двумя подтипами, апо B-100 и апо B-48. Апо B-100 является самым крупным подтипом и состоит из полипептидной цепи из более чем 4500 аминокислот, синтезируемых в печени. Это самый распространенный белок фракций ЛПНП и ЛПОНП. Апо B-100 распознается рецепторами ЛПНП различных типов клеток по всему телу, что помогает в поглощении холестерина клетками.ЛПНП обычно называют «плохим холестерином». Апо B-48, который имеет ту же последовательность, что и N-концевая половина апо B-100, обнаруживается в хиломикронах и синтезируется в кишечнике.
Apo C представляет собой апопротеин с наименьшей массой и представлен тремя подтипами, названными C-I, C-II и C-III. Апо C-II является активатором липопротеинлипазы, который гидролизует триацилглицерины хиломикронов и ЛПОНП.
Апо D содержится в ЛПВП и отвечает за обмен эфиров холестерина и триацилглицеринов между липопротеинами ЛПВП и ЛПОНП.
Апо E является второстепенным компонентом хиломикронов, ЛПОНП и ЛПВП. Это гликопротеин с четырьмя подтипами, названными E-I – E-IV. Они играют важную роль в катаболизме холестерина и участвуют в опосредованном рецептором распознавании и поглощении липопротеинов клетками.
β-липопротеины с молекулярной массой около 1300 кДа являются одними из крупнейших белков плазмы. Альфа-липопротеины (ЛПВП) намного меньше, их масса составляет 200 кДа.
Синтез белков плазмы. Печень — главный орган, участвующий в производстве альбумина, фибриногена, протромбина и большинства α- и β-глобулинов. Печень взрослого мужчины синтезирует примерно 20 г белков плазмы в сутки. Γ-глобулины образуются в плазматических клетках, происходящих из B-лимфоцитов (Глава 30).
Синтез белков плазмы очень активен, так как они быстро разрушаются и заменяются. Средний период полувыведения белков плазмы (время, в течение которого обновляется половина белков) составляет примерно 10 дней.
Поскольку печень играет важную роль в синтезе белков плазмы, любая серьезная неисправность печени приводит к изменению белкового состава плазмы. Такие изменения известны как диспротеинемии. Электрофорез белков — отличный метод выявления изменений относительного содержания различных белков плазмы. Снижение фракции альбумина (гипоальбуминемия) является типичным признаком печеночной недостаточности.
Синтез белков плазмы, как и любого другого белка, требует ввода необходимых аминокислот, обеспечиваемых нормальной диетой.Существует прямая зависимость между количеством и качеством белков, поступающих с пищей, и синтезом белков плазмы. Дефицит белка приводит к снижению белков плазмы, особенно альбумина, и дефициту синтеза антител. Это объясняет измененную защиту от инфекций, которую имеют недоедающие люди.
Общие функции белков плазмы. Общая важная роль белков плазмы — поддержание объема внеклеточной жидкости тела (см.696). Кроме того, белки плазмы обладают буферным действием. При нормальном pH крови буферная способность белков зависит от присутствия в молекуле остатков гистидина. Это зависит от способности имидазольного азота в гистидине принимать протоны (p K a 6.0).
Тест на глобулины: высокий и низкий уровни + нормальный диапазон
Глобулины переносят питательные вещества и борются с инфекциями; как высокий, так и низкий уровень могут означать проблемы. Тест на глобулин также известен как «гамма-пробел».Узнайте больше о том, что означают результаты здесь.
Что такое тест на глобулин?Глобулины — это группа белков, которые помогают транспортировать питательные вещества и бороться с инфекциями.
Белки глобулина включают белки-носители, ферменты, антитела (иммуноглобулины) и другие белки. Большинство глобулинов вырабатывается печенью, они помогают транспортировать питательные вещества и бороться с инфекциями [1].
Существует четыре типа глобулинов: альфа-1, альфа-2, бета и гамма. Для измерения глобулинов можно использовать два типа тестов на глобулины: тест на общий белок и тест на электрофорез сывороточного белка.
Тест на общий белок измеряет альфа-1, альфа-2, бета-глобулин и другой белок печени, называемый альбумином. Низкий уровень белка может сигнализировать о заболевании печени или почек.
Электрофорез сывороточного белка измеряет гамма-глобулин и другие белки в крови. Врачи могут использовать этот тест для диагностики нарушений иммунной системы и других состояний.
Уровни глобулина также могут помочь вашему врачу диагностировать воспалительное заболевание, аутоиммунное заболевание или инфекцию. Это связано с тем, что гамма-глобулины содержат антитела, повышенная выработка которых может сигнализировать об этих заболеваниях.Высокие глобулины могут также указывать на определенные типы рака, такие как множественная миелома [2].
Однако аномальные результаты также могут быть результатом приема определенных лекарств, обезвоживания или других факторов.
Кроме того, только результатов этого теста недостаточно для постановки диагноза. Ваш врач оценит ваши результаты с учетом вашего общего состояния здоровья и других лабораторных показателей.
Нормальный диапазон глобулиновУровни глобулина определяются путем вычитания альбумина из общего белка , также известного как « гамма-интервал .”
Нормальный диапазон глобулина составляет около 2,0–3,9 г / дл или 20–39 г / л. Некоторая вариативность между лабораториями возникает из-за различий в оборудовании, методах и используемых химикатах.
Глобулин в нормальном диапазоне обычно подразумевает нормальный баланс белков-носителей, ферментов и антител, которые необходимы для многих биологических процессов. Это также, вероятно, означает отсутствие вирусной инфекции, воспалительного или иммунного нарушения [2].
Однако важно помнить, что нормальный тест не означает отсутствие определенного заболевания.Ваш врач интерпретирует ваши результаты вместе с вашей историей болезни и результатами других анализов.
Высокий уровень глобулина ПричиныОбсуждаемые здесь состояния обычно связаны с высоким уровнем глобулина, но этого единственного симптома недостаточно для постановки диагноза. Поработайте со своим врачом, чтобы выяснить, какое основное заболевание может вызывать высокий уровень глобулина, и разработать соответствующий план по улучшению вашего здоровья.
Высокий уровень глобулина обычно вызывается:
- Вирусными и бактериальными инфекциями [3, 4, 1]
- Обезвоживанием [2, 5]
- Болезнь тяжелых цепей [6]
- Воспалительные или иммунные нарушения [1]
- Раковые заболевания, такие как лимфома Ходжкина или множественная миелома [7, 8, 9, 1]
- Некоторые препараты, такие как амиодарон (кордарон, некстерон), используются для лечения и предотвращения нерегулярного сердцебиения [10, 1]
Симптомы зависят от основная причина.
Влияние на здоровьеВ настоящее время исследования показывают, что высокий уровень глобулина (гамма-разрыв) связан с повышенным риском заболеваний и смерти .
Обзор, проведенный с участием более 12 тысяч человек, выявил повышенный риск смерти от всех причин у людей с гамма-разрывом выше 3,1 г / дл. Точно так же гамма-разрыв более 3,1 г / дл может предсказать смерть в исследовании 870 человек в возрасте старше 90 лет [11, 12].
В обсервационном исследовании с участием 27 000 здоровых людей было обнаружено, что низкое соотношение альбумина к глобулину (аналогичное высокому гамма-разрыву) было связано с повышенным уровнем заболеваемости раком и смертностью [13].
Почему высокий разрыв глобулина / гамма связан с плохим здоровьем? Один из возможных ответов состоит в том, что повышенная продукция иммуноглобулинов связана с воспалением ; воспалительные факторы, такие как с-реактивный белок и ИЛ-6, например, повышают уровень иммуноглобулинов [12].
Воспаление также увеличивается с возрастом, что может объяснить, почему пожилые люди с более высоким гамма-интервалом умирают с большей вероятностью, чем люди с более низким гамма-интервалом. Это также предполагает, что глобулин / гамма-промежуток может использоваться в качестве маркера воспаления [12].
Факторы, снижающие уровень глобулина 1) Лечить основное заболеваниеСамое важное — работать с вашим врачом для лечения любых основных состояний, вызывающих ваш высокий уровень глобулина.
Дополнительные стратегии, приведенные ниже, — это еще кое-что, что вы можете попробовать, если вы и ваш врач сочтете, что они могут быть целесообразными.
2) УпражнениеДелайте упражнения чаще. Как аэробные, так и силовые упражнения могут помочь значительно снизить уровень глобулина у людей [14].
У мужчин и женщин большее количество дней в неделю аэробных или силовых упражнений было значительно связано с более низким уровнем глобулина [14].
Вам также может потребоваться прекратить прием протеиновых добавок, так как они могут вызывать повышение уровня протеина и глобулинов [15].
3) ГидратацияПейте больше воды, чтобы предотвратить обезвоживание [2, 16].
Согласно ограниченным исследованиям, цинк может помочь предотвратить обезвоживание, вызванное диареей [17].
Электролиты также могут помочь при обезвоживании, вызванном диареей [18].
Ограничить употребление алкоголя; алкоголь может усугубить обезвоживание [19].
4) Снижение стрессаПостарайтесь уменьшить стресс, поскольку острый стресс может увеличить уровень определенных типов глобулинов [20].
Рекомендуемые тесты, если у вас высокий уровень глобулинаАльбумин, общий белок сыворотки, натрий (Na), хлорид (Cl), кортизол, креатинин, азот мочевины крови (BUN), аланинаминотрансфераза (AST), аспартатаминотрансфераза (ALT) ), общий билирубин, щелочная фосфатаза (ЩФ), кальций, сывороточный гастрин, IgA, IgM, IgG, HCT (гематокрит), HGB (гемоглобин)
Низкий уровень глобулинаОбсуждаемые здесь состояния обычно связаны с низким уровнем глобулина. , но одного этого симптома недостаточно для постановки диагноза.Поработайте со своим врачом, чтобы выяснить, какое основное заболевание может быть причиной низкого уровня глобулина, и разработать соответствующий план по улучшению вашего здоровья.
Низкий уровень глобулина может быть вызван:
- Заболеванием почек (нефротический синдром), которое может вызывать потерю белка [2, 1]
- Заболевание печени [21, 22, 1]
- Врожденный (врожденный) иммунодефицит, который снижает выработку глобулина [2]
- Недоедание или недостаток питательных веществ в рационе, что снижает выработку глобулина [2]
- Акромегалия, заболевание, вызванное избытком гормона роста [23]
- Рак легкого [24]
- Окислительный стресс у женщин с гипертонией, вызванной беременностью (ограниченные данные) [25]
- Отек из-за скопления жидкости (отек) [26]
- Восприимчивость к инфекционным заболеваниям [2]
- Симптомы заболевания печени, которые включают пожелтение кожи и белков глаз (желтуху), тошноту, рвоту, усталость и скопление жидкости [2, 27]
Симптомы зависят от основной причины.
Факторы, повышающие уровень глобулинаСамое важное — работать с вашим врачом, чтобы лечить любые основные состояния, вызывающие ваш низкий уровень глобулина. Приведенные ниже дополнительные стратегии — это еще кое-что, что вы можете попробовать, если вы и ваш врач решите, что они могут быть подходящими.
Диета с достаточным количеством питательных веществ предотвратит недоедание и предотвратит слишком низкий уровень белка. Употребление нежирного белка, такого как рыба и индейка, может помочь улучшить общий уровень белка [2].
Также может быть полезно увеличить потребление продуктов, которые помогают детоксикации печени и почек. К ним относятся спаржа, свекла, капуста, брокколи, чеснок и лук [28].
Пробиотические добавки ( Lactobacillus plantarum и Bacillus polyfermenticus ) также могут способствовать увеличению глобулинов, особенно иммуноглобулинов, согласно ограниченным исследованиям [29, 30].
Рекомендуемые анализы при низком уровне глобулинаАльбумин, общий белок сыворотки, натрий (Na), хлорид (Cl), кортизол, креатинин, азот мочевины крови (BUN), аланинаминотрансфераза (AST), аспартатаминотрансфераза (ALT) ), общий билирубин, щелочная фосфатаза (ЩФ), кальций, сывороточный гастрин, IgA, IgM, IgG, HCT (гематокрит), HGB (гемоглобин)
Электрофорез общего белка | Колледж ветеринарной медицины Корнельского университета
Эта процедура разделяет белки сыворотки и биологических жидкостей (например,грамм. перитонеальная жидкость, моча) на составляющие альбумин и глобулины. Электрофорез показан для определения основного характера гиперглобулинемии или при подозрении на множественную миелому у пациента. Типы иммуноглобулинов, вызывающие гиперглобулинемию, могут предоставить полезную диагностическую информацию. Это менее полезно для оценки иммунодефицитов; индивидуальное количественное определение иммуноглобулинов дает больше информации при этих расстройствах. В настоящее время в Корнельском университете мы используем капиллярный электрофорез для электрофореза белков.Это очень чувствительный метод, который разделяет белки на несколько фракций, которые зависят от вида. Для простоты отчетности мы приводим результаты не для отдельных фракций, а для объединенных фракций, например альбумин, a1, a2, общий a, b1, b2, общий b и g. Мы также предоставляем пояснительные комментарии к нашим электрофореграммам.
Компоненты для электрофореза
Электрофореграмма разделяет белковую фракцию сыворотки или плазмы на составляющие компоненты, включая альбумин и глобулины.Существует три фракции глобулина: альфа, бета и гамма.
Общий белок
Это измеряется на Modular P с использованием биуретового метода (сыворотка, плазма, биологические жидкости) или турбидометрии (спинномозговая жидкость, моча). Общая концентрация белка необходима для получения абсолютных значений (а не только процентов) белковых компонентов.
Альбумин
Альбумин является первым пиком на электрофореграмме и обычно представляет собой высокий тонкий пик. Концентрация альбумина у ELP обычно ниже, чем у Modular P.
Альфа (а) глобулины
Они мигрируют вместе с альбумином и синтезируются в печени. Они включают белки-реагенты острой фазы, макроглобулин α-2 и гаптоглобулин. У большинства видов а-глобулины можно разделить на два основных компонента, а1 и а2, хотя у некоторых видов или отдельных животных присутствуют дополнительные подразделения.
Бета (b) глобулины
Они мигрируют между g- и a-глобулинами. Обычно они вырабатываются в печени и включают фибриноген (плазма), трансферрин и компоненты комплемента.Подобно α-глобулинам, β-глобулины можно разделить на два основных компонента (b1 и b2) у большинства видов, хотя очевидны и другие подразделения (например, собаки обычно имеют b1a и b1b).
Гамма (г) глобулины
Он включает иммуноглобулины, IgG, IgA и IgM и является самым дальним от альбумина пиком. В действительности IgA и IgM часто мигрируют в позднюю b- (b2-область) или раннюю g-область. Форма g-пика предоставляет диагностическую информацию. Широкий пик указывает на поликлональную гаммопатию (см. Панель B ниже), которая обычно возникает из-за антигенной стимуляции и не является специфической для заболевания.Высокий острый пик в g-области или поздней b-области совместим с моноклональной гаммопатией. Моноклональные пики обычно возникают из-за опухолевых заболеваний, например множественная миелома, В-клеточная лимфома или В-клеточный хронический лимфоцитарный лейкоз. В редких случаях воспалительные или инфекционные заболевания могут проявляться узким гамма-пиком, который трудно отличить от истинной неопластической моноклональной гаммаопатии. Это более правильно назвать «ограниченной олигоклональной» гаммопатией, и о ней сообщалось при различных заболеваниях, таких как Ehrlichia, Leishmania, FIV, FIP и других заболеваниях.
Различные модели электрофореграммы в сыворотке
Панель A: Нормальная электрофореграмма в агарозном геле у собаки. Самый высокий пик слева — это альбумин, за ним следует a1 (2 пика), a2 (2 пика), b1 (2 пика b1a и b1b), b2 и g (последний плоский пик).
Панель B: Сыворотка кошки, инфицированной вирусом инфекционного перитонита кошек (FIPV). Наблюдается увеличение α-2-глобулинов (стрелка), что указывает на острую фазу реакции реагентов и поликлональную гаммопатию (стрелка). Эти результаты типичны, но не специфичны для инфекции FIPV (их можно увидеть при других воспалительных состояниях).
Панель C: Сыворотка собаки с множественной миеломой. В g-области есть высокий узкий пик, указывающий на моноклональную гаммапатию (стрелка). Концентрация альбумина также снижается (по сравнению с нормальной собакой на панели A).
Электрофорез сывороточного протеина
Сыворотка является предпочтительным образцом для электрофореза. Фибриноген (в гепаринизированных образцах) дает моноклональный пик в b-области, что влияет на интерпретацию в образцах плазмы. Мы установили собственные эталонные интервалы для собак, кошек, лошадей, крупного рогатого скота и альпак.Поэтому ненормальные результаты у этих видов будут отмечены. Кроме того, мы всегда предоставляем сам снимок электрофореграммы, а не только письменный отчет.
Электрофорез белков жидкости организма
Электрофорез можно проводить с жидкостями организма, такими как перитонеальная жидкость. Обычно это делается у кошек с выделениями из брюшной полости для подтверждения диагноза инфицирования вирусом инфекционного перитонита кошек. При этом заболевании в брюшной полости может развиваться экссудативный выпот.Электрофоретические характеристики жидкости аналогичны результатам сыворотки, поскольку выпот вызван васкулитом. Поэтому сыворотку и жидкость следует сдавать на электрофорез одновременно. Оба обычно показывают увеличение альфа-глобулинов (острофазовый ответ) и поликлональную гаммопатию (широкое увеличение гамма-глобулинов). Повышение уровня g-глобулинов в жидкости указывает на инфекцию FIPV (см. Изображение ниже). Электрофорез также может быть проведен на образцах спинномозговой жидкости, однако обычно это не делается, поскольку требуются большие объемы спинномозговой жидкости.Белка в спинномозговой жидкости обычно слишком мало для работы с ELP без концентрации. Для проведения электрофореза нам необходимо минимум 600 мг / дл белка. Для концентрирования спинномозговой жидкости требуется от 5 до 10 мл жидкости, которую невозможно получить у многих животных.
Электрофорез белков мочи
Электрофореграммы сыворотки и мочи кошки с множественной миеломой. Моноклональный пик наблюдается в g-области сыворотки. Аналогичный моноклональный пик с низким содержанием альбумина наблюдается в моче. Это подтверждает протеинурию Бенс-Джонса.Моноклональным белком был IgG.Электрофорез можно проводить в моче, но, как и в спинномозговой жидкости, для этого требуется концентрирование, поскольку содержание белка в моче обычно довольно низкое (для проведения электрофореза нам требуется минимум 600 мг / дл белка). К счастью, у большинства животных мы можем получить достаточное количество мочи (минимум 10 мл) для проведения электрофореза. Электрофорез мочи — предпочтительный метод для идентификации белков Бенс-Джонса у пациентов с подозрением на множественную миелому.Это всегда следует делать вместе с сывороткой, чтобы результаты можно было сравнивать напрямую. Другие люди выполняли электрофорез мочи, чтобы отличить гемоглобинурию от миоглобинурии (однако различие субъективно и чревато осложнениями), а также чтобы понять механизмы протеинурии.
Интерпретация концентрации белка требует исследовательской работы
Q Как интерпретировать концентрации белка в сыворотке крови у собак и кошек?
A Изменения концентрации сывороточного белка обычно наблюдаются при большом количестве заболеваний у собак и кошек.Ключевыми типами белков, присутствующих в сыворотке крови, являются альбумин и глобулины. Альбумин — наименьший из этих белков, вырабатываемый только печенью, и концентрация молекул альбумина в крови больше, чем концентрация молекул глобулина.
В результате на альбумин приходится около 80 процентов онкотического давления крови. Это онкотическое давление предотвращает попадание воды из крови в ткани. Альбумин также является важным белком-носителем. Глобулины — это гетерогенная группа белков, больших, но различающихся по размеру.Глобулины включают различные типы молекул антител, другие белки, активные в иммунной системе (например, комплемент), факторы свертывания крови, множество различных ферментов и множество белков-носителей. Глобулины обычно классифицируются как альфа, бета или гамма в зависимости от их электрофоретической подвижности.
Как повышенные, так и пониженные концентрации общего белка обычно обнаруживаются у собак и кошек. Снижение или увеличение является результатом изменений концентрации сывороточного альбумина и / или глобулина.В плазме повышенная концентрация фибриногена, глобулина, иногда может приводить к повышению концентрации белка. Интерпретация измененных концентраций белка зависит от определения того, какие основные белковые составляющие сыворотки или плазмы (например, альбумин, глобулин и, в плазме, фибриноген) являются аномальными. Снижение или повышение концентрации альбумина или глобулина не всегда приводит к обнаруживаемым изменениям концентрации общего белка. Таким образом, при интерпретации изменений следует оценивать концентрации альбумина и глобулина, а также общие концентрации белка.
Здесь кратко описаны причины снижения или повышения концентрации общего белка, альбумина, глобулина и фибриногена.
Выясните причину
- Гипоальбуминемия с гипоглобулинемией: Сопутствующая гипоальбуминемия и гипоглобулинемия могут быть результатом гипергидратации (чрезмерной инфузионной терапии или чрезмерного потребления воды) или пропорциональной потери обеих этих белковых фракций. Последние возникают при следующих нарушениях потери белка:
- Кровопотеря приводит к пропорциональной потере всех компонентов крови.Следовательно, альбумин и глобулин теряются в концентрациях, равных их концентрациям в крови.
- Энтеропатия с потерей белка возникает в результате различных поражений кишечника, включая воспалительные инфильтраты в собственной пластинке и подслизистой оболочке, а также блокировку лимфатического дренажа, ведущую к расширению лимфатических сосудов (лимфангиэктазии). Независимо от основной причины и альбумин, и глобулин просачиваются из стенки кишечника в просвет кишечника, а затем перевариваются или выводятся. При некоторых типах энтеропатий с потерей белка сопутствующий иммунный ответ приводит к увеличению, а не снижению концентрации глобулина в сыворотке.Это происходит у басенджи и китайских шарпейских собак, но также может встречаться и у других пород собак.
- Тяжелое экссудативное заболевание кожи.
- Сильные ожоги.
- Эффузивная болезнь.
- Гипоальбуминемия с нормальной или повышенной концентрацией глобулина: Снижение концентрации альбумина, которое не сопровождается снижением концентрации глобулина, может быть вызвано либо снижением продукции, либо повышенной потерей альбумина. Если одновременно повышается концентрация глобулина, снижение концентрации альбумина может не привести к снижению общей концентрации белка.
Снижение выработки альбумина может происходить при указанных здесь заболеваниях.
- Печеночная недостаточность: Печень является единственным местом производства альбумина. Из-за резервной способности печени большинство типов повреждений печени не приводят к снижению выработки альбумина. Если теряется более 80 процентов функциональной массы печени, может произойти снижение выработки альбумина.
- Желудочно-кишечные паразиты могут вызывать гипоальбуминемию. Если паразиты поглощают значительное количество питательных веществ, в том числе аминокислот, животное лишается аминокислот, необходимых для производства альбумина.Если желудочно-кишечные паразиты прикрепляются к стенке желудка или кишечника и поглощают кровь хозяина, альбумин и глобулин теряются.
- Мальабсорбция кишечника. Снижение продукции альбумина может произойти, если кишечная мальабсорбция приводит к недостаточному всасыванию аминокислот.
- Внешнесекреторная недостаточность поджелудочной железы. Неадекватное переваривание пищевых белков может быть результатом внешнесекреторной недостаточности поджелудочной железы.
Повышенная потеря альбумина может происходить при следующих нарушениях потери белка:
1) Гломерулярная болезнь.Поскольку молекулы альбумина меньше, чем молекулы глобулина, они легче проникают через поврежденные мембраны клубочков (суммарный отрицательный заряд молекул альбумина по сравнению с молекулами глобулина также играет роль в этой избирательной утечке). Тяжелое заболевание клубочков может привести к гипоальбуминемии с нормальной или повышенной концентрацией глобулина в сыворотке. Концентрация белка в моче и соотношение белок / креатинин в моче должны быть увеличены при гломерулярной болезни.
2) Заболевания, ранее перечисленные как возможные причины снижения альбумина и глобулина.Хотя при этих заболеваниях обычно происходит потеря как альбумина, так и глобулина, одновременный иммунный ответ может вызывать повышенную продукцию глобулинов и приводить к нормальным или повышенным концентрациям глобулинов. Эти заболевания также следует учитывать при обнаружении гипоальбуминемии и нормальных или повышенных концентраций глобулинов.
- Гипоглобулинемия с нормальной или повышенной концентрацией альбумина: Гипоглобулинемия при отсутствии гипоальбуминемии обычно является результатом снижения концентрации бета- или гамма-глобулина.Снижение концентрации альфа-глобулина само по себе не приводит к снижению общей концентрации глобулина. Снижение концентрации бета- или гамма-глобулина при отсутствии гипоальбуминемии почти всегда является результатом снижения концентрации иммуноглобулина. Такое снижение может происходить при следующих нарушениях:
- Отказ пассивного переноса. Проглатывание молозива и абсорбция иммуноглобулинов из молозива называется пассивным переносом. Поскольку большинство животных рождаются с минимальными концентрациями иммуноглобулинов, этот процесс играет важную роль в передаче устойчивости к инфекции в неонатальном периоде.Неспособность проглотить молозиво и / или абсорбировать иммуноглобулины из молозива называется отказом от пассивного переноса и хорошо документирована у домашних животных.
- Унаследованный или приобретенный иммунодефицит. Иммунодефицит с участием В-лимфоцитов и / или плазматических клеток может привести к низким концентрациям иммуноглобулинов и, в некоторых случаях, низким концентрациям общих глобулинов. У щенков наблюдается иммунодефицит, приводящий к низким концентрациям глобулина (комбинированный иммунодефицит и избирательный дефицит IgA).
Какой у вас вопрос? Â Присылайте свои педиатрические / гериатрические вопросы по адресу: Pediatric / Geriatric Protocol, DVM Newsmagazine, 7500 Old Oak Blvd., Cleveland, OH 44130. Доктор Хоскинс ответит на ваши вопросы в следующих столбцах.
Влияние гормональных контрацептивов и беременность на структуру белков сыворотки
Адлеркрейц, Х., Эйсало, А., Хейно, А., Луукайнен, Т., Пентиля, И., Саукконен, Х .: Исследования влияния пероральный контрацептив и его компоненты влияют на функцию печени, сывороточные белки, медь, церулоплазмин и гамма-глутамилпептидазу у женщин в постменопаузе.Сканд. J. Gastroent. 18 , 273 (1968).
Google ученый
Аурелл, М., Крамер, К., Рыбо, Г.: Липиды и липопротеины сыворотки при длительном применении оральных контрацептивов. Ланцет 1966 I , 293.
Google ученый
Бокнер, В., Роман, В .: Влияние уральских контрацептивов на связывающую способность белков сыворотки. Med.J. Aust. 2 , 1187 (1967).
Google ученый
Борглин Н.Е., Найман М .: Влияние эстрогенов на уровень гаптоглобина в крови. Сканд. J. Clin. Лаборатория. Вкладывать деньги. 13 , 107 (1961).
Google ученый
Bottermann, P., Dieterle, P., Hochheuser, W., Horn, K., Kopetz, K., Schleypen, K., Schwarz, K., Scriba, PC: Zur Frage der endokrinen Nebenwirkungen der Ovulationshemmer .Жевать. мед. Wschr. 13 , 685 (1967).
Google ученый
Brody, S., Kerstell, J., Nilsson, L., Svanborg, A .: Влияние некоторых ингибиторов овуляции на различные фракции липидов плазмы. Acta med. сканд. 183 , 1–7 (1968).
Google ученый
Бертон, Дж. Л .: Влияние оральных контрацептивов на гемоглобин, объем упакованных клеток, сывороточное железо и общую железосвязывающую способность у здоровых женщин.Ланцет 1967 I , 978.
Google ученый
Carruthers, M.E., Hobbs, C.B., Warren, L.R .: Повышенный уровень меди и церулоплазмина в сыворотке крови у субъектов, принимающих оральные контрацептивы. J. Clin. Дорожка. 19 , 498 (1966).
Google ученый
Доу, Р.П., Меллингер, Г.Т., Сваим, В.Р., Сил, США: Влияние дозировки эстрогена на белки сыворотки: продольное исследование.J. Clin. Endocr. 27, , 1081 (1967).
Google ученый
Фишер Д.А., Одди Т.Х., Эпперсон Д.: Норэтинодрелместранол и функция щитовидной железы. J. Clin. Endocr. 26 , 878 (1966).
Google ученый
Florsheim, W.H., Faircloth, M.A .: Влияние пероральных ингибиторов овуляции на связанный с белками сыворотки йод и тироксин-связывающие белки. Proc.Soc. опыт Биол. Med. 117 , 56 (1964).
Google ученый
Foldenauer, A., Boehm, P .: Medikamentöse Beeinflussung des Jodstoffwechsels der Schilddrüse und ihrer klinischen Funktionsdiagnostik. Dtsch. Med. Wschr. 27, , 1454 (1970).
Google ученый
Gleichmann, W: инаугурационная диссертация, 1972 г.
Goolden, A.W.G., Gartside, J.M., Sanderson, C .: Состояние щитовидной железы во время беременности и у женщин, принимающих оральные контрацептивы. Ланцет 1967 I , 12.
Google ученый
Halsted, J.A., Hackley, B.M., Smith, J.C .: Плазменный цинк и медь во время беременности и после пероральных контрацептивов. Ланцет 1968 II , 278.
Google ученый
Heinen, G .: Die Differenzierte Anwendung von Kombinations- und Sequentialpräparaten in der гормональные овуляции.Der prakt. Arzt 12 , 1159 (1970).
Google ученый
Хенгер П.Э., Россинг Н .: Метаболизм альбумина и оральная контрацепция. Clin. Sci. 36, , 41 (1969).
Google ученый
Хорн, C.H.W., Хоуи, П.В., Вейр, Р.Дж., Гуди, Р.Б .: Влияние комбинированных пероральных контрацептивов эстроген-прогестаген на сывороточные уровни альфа-2-макроглобулина, трансферрина, альбумина и IgH.Ланцет 1970 I , 49.
Google ученый
Kaffarnik, H., Gassel, W.-D., Lehnert, H., Schneider, J., Zöfel, P., Meyer-Bertenrath, J.G., Karsznia, R .: Befunde verschiedener Blutwerte unter Ovulationshemmern. Жевать. мед. Wschr. 113, , 757 (1971).
Google ученый
Каппа, А .: Биологическое действие некоторых природных стероидов на печень.New Engl. J. Med. 278, , 378 (1968).
Google ученый
Laurell, C.-B., Skanse, B .: Эстрогены и оросомукоид плазмы. J. Clin. Endocr. 23 , 214 (1963).
Google ученый
Лаурелл, С.-Б., Кулландер, С., Торелл, Дж .: Влияние введения комбинированного эстроген-прогестинового контрацептива на уровень отдельных белков плазмы.Сканд. J. Clin. Лаборатория. Вкладывать деньги. 21, , 337 (1968).
Google ученый
Лаурелл, С.-Б., Кулландер, С., Торелл, Дж .: Белки плазмы после непрерывного перорального приема прогестагена, хлормадионола ацетата, в качестве контрацептива. Scand J. Clin. Лаборатория. Вкладывать деньги. 24 , 387 (1969).
Google ученый
Лаурелл, С.-Б., Кулландер, С., Торелл, Дж .: Изменения белков плазмы, вызванные последовательным приемом стероидных противозачаточных таблеток.Clin. чим. Acta 25 , 294 (1969).
Google ученый
Мэйси Дж. Г .: Метаболические и биохимические изменения при нормальной беременности. J. Amer. мед. Жопа. 168, , 2265 (1958).
Google ученый
Mancini, G., Carbonera, A., Heremans, J.F .: Иммунохимическое количественное определение антигенов с помощью однократной радиальной иммунодиффузии. Иммунохимия 2 , 235 (1965).
Google ученый
Mondorf, W., Kollmar, M., Halberstadt, E., Frey, I .: Untersuchungen über das Verhalten des Coeruloplasmins unter oralen Ovulationshemmern. Клин. Wschr. 46 , 958 (1968).
Google ученый
Müller, H.E., Müller v. Voigt, I .: Quantitativ Immunologische Serumproteinbestimmungen bei verschiedenen Krankheitszuständen. Dtsch.мед. Wschr. 93 , 216 (1968).
Google ученый
Müller, H., Beckmann, A., Kluthe, R .: Serumproteinveränderungen nach Gestagenapplikation. Верх. dtsch. Ges. гостиница. Med. 77, , 577 (1971).
Google ученый
Муса, Б.У., Сил, США, Доу, Р.П .: Повышение уровня определенных белков плазмы у человека после введения эстрогена: зависимость от дозы.J. Clin. Endocr. 25 , 1163 (1965).
Google ученый
Муса, Б.У., Доу, Р.П., Сил, США: изменения сывороточного белка, вызываемые у женщин синтетическими эстрогенами. J. Clin. Endocr. 27, , 1463 (1967).
Google ученый
Никлис, В., Коммерелл, Б., Рапп, В .: Улучшенное количественное различие сывороточного протеина с уменьшенным размером гельдиффузии на Oudin im Rahmen einer Hepatitis-Nachuntersuchung.Верх. dtsch. Ges. гостиница. Med. 74 , 608 (1968).
Google ученый
Oudin, J .: Метод иммунохимического анализа для специальной обработки в чистой среде. C.R. Acad. Sci. 222 , 115 (1946).
Google ученый
Пилгерам, Л.О., Пикарт, Л.Р .: Снижение уровня альбумина плазмы с помощью стероидной терапии. Proc. Soc. опыт Биол. Med. 114, , 758 (1963).
Google ученый
Poidevin, L.O.S .: предварительный отчет об изменениях аминокислот и сывороточного белка на протяжении всей беременности. Med. J. Austr. I , 105 (1954).
Google ученый
Prellwitz, W., Hammar, C.-H., Dudeck, J .: Haptoglobin und Coeruloplasmin bei Krankheiten der Leber und der Gallenwege. Dtsch. мед. Wschr. 93 , 1277 (1968).
Google ученый
Ребоуд П., Гроулад Дж., Гросламберт П., Коломб М .: Влияние нормальной беременности и послеродового состояния на белки и липиды плазмы. Амер. J. Obstet. Gynec. 86, , 820 (1963).
Google ученый
Робертсон Г.С.: изменения сывороточного белка и холинэстеразы в связи с приемом противозачаточных таблеток. Ланцет 1967 I , 232.
Google ученый
Русс, Э.М., Раймунт, Дж .: Влияние эстрогенов на общую сыворотку меди и церулоплазмина. Proc. Soc. опыт Биол. Med. 92 , 465 (1956).
Google ученый
Шульце, H.E., Heremans, J.F .: Молекулярная биология белков человека. Vol. 1 , 354. Амстердам: Elsevier 1966.
Google ученый
Тайлер, Э.Т .: Восьмилетний опыт оральной контрацепции и анализ низких доз норэтистерона. Брит. мед. J. 1964 II , 843.
Google ученый
Visscher, R.D .: T 3 -I 131 связывающая способность белков сыворотки. Амер. J. Obstet. Gynec. 86, , 829 (1963).
Google ученый
Weiss, M., Horsch, A., Rapp, W .: Geldiffusion nach Oudin zur Quantitativen Erfassung von Serumproteinen.Ärztl. Лаборатория. 17 , 245 (1971).
Google ученый
Weiss, W.A .: Normalwerte spezifischer Serumproteine im Kindes- und Erwachsenenalter (Oudin-Technik für Albumin, Transferrin, гамма-глобулин). Клин. Wschr. 43 , 273 (1965).
Google ученый
Wilbert, L., Hillmer, T., Hunstein, P., Kaboth, U., Creutzfeld, W .: Einfluß oraler Ovulationshemmer auf klinisch-chemische Normalwerte.Dtsch. мед. Wschr. 94 , 844 (1969).
Google ученый
Виникофф, Д .: Оральные контрацептивы и функциональные тесты щитовидной железы. Med. J. Austr. 2 , 13 (1968).
Google ученый
Винн В., Доар Дж. У. Х., Миллс Г. Л .: Некоторые эффекты оральных контрацептивов на уровни липидов и липопротеинов в сыворотке. Ланцет 1966 II , 720.
Google ученый
% PDF-1.5 % 1 0 объект > / OCGs [8 0 R] >> / Страницы 2 0 R / Тип / Каталог >> эндобдж 28 0 объект > / Шрифт >>> / Поля [] >> эндобдж 32 0 объект > поток 2021-03-18T03: 18: 23-07: 002006-09-08T16: 20: 10 + 08: 002021-03-18T03: 18: 23-07: 00uuid: f9b53017-d418-4def-a214-68bf5ae11868uuid: f7d7ba1d- 1dd1-11b2-0a00-aa0068edc1ffapplication / pdf конечный поток эндобдж 2 0 obj > эндобдж 23 0 объект > / Resources> / Font> / T1_1> / T1_2> / T1_3> / T1_4 36 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Page >> эндобдж 18 0 объект > / Ресурсы> / Шрифт> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5 36 0 R >> / ProcSet [/ PDF / Text / ImageB] / Свойства> / XObject >>> / Type / Page >> эндобдж 13 0 объект > / Resources> / Font> / T1_1> / T1_2> / T1_3> / T1_4 36 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Page >> эндобдж 5 0 obj > / Ресурсы> / Шрифт> / T1_1> / T1_2 36 0 R >> / ProcSet [/ PDF / Text / ImageB] / Свойства> / XObject >>> / Type / Page >> эндобдж 33 0 объект > / ProcSet [/ PDF / Text / ImageC] / XObject >>> / Type / Page >> эндобдж 43 0 объект [50 0 R 51 0 R 52 0 R 53 0 R 54 0 R] эндобдж 44 0 объект > поток q 540.0594177 0 0 68.6011963 35.9702911 675.3988037 см / Im0 Do Q BT / T1_0 1 Тс 10 0 0 10 85,56995 576,99985 тм (1972; 32: 426-429.) Tj / T1_1 1 Тс -5.55699 0 Тд (Рак Res \ 240) Tj / T1_0 1 Тс 0 1 ТД (\ 240) Tj 0 1.00001 TD (Сёдзи Суга и Зюн Тамура) Tj / T1_2 1 Тс 0 1 ТД (\ 240) Tj / T1_3 1 Тс 18 0 0 18 402,49 109 616,99997 тм (-Глобулиновые фракции) Tj / T1_4 1 Тс -0,631 0 Тд (а) Tj / T1_3 1 Тс -20.06295 0 Тд (Рак желудка с особым упором на) Tj Т * (Анализ изменений сывороточного протеина у пациентов с продвинутой стадией) Tj ET 30 522 552 35 рэ 0 0 мес. S BT / T1_0 1 Тс 11 0 0 11 120.94202 529,99997 тм (\ 240) Tj / T1_3 1 Тс -7,55696 1 тд (Обновленная версия) Tj ET BT / T1_2 1 Тс 10 0 0 10 141 521,99994 тм (\ 240) Tj / T1_0 1 Тс 22.06695 1 тд () Tj 0 0 1 рг -22.06695 0 Тд (http://cancerres.aacrjournals.org/content/32/2/426)Tj 0 г 0 1.00001 TD (См. Самую последнюю версию этой статьи по адресу:) Tj ET BT / T1_2 1 Тс 10 0 0 10 30 501,99997 тм (\ 240) Tj 0 1 ТД (\ 240) Tj ET BT / T1_2 1 Тс 10 0 0 10 30 481,99997 тм (\ 240) Tj Т * (\ 240) Tj ET BT / T1_2 1 Тс 10 0 0 10 30 461,99997 тм (\ 240) Tj Т * (\ 240) Tj ET 30 347 552 115 рэ 0 0 мес. S BT / T1_0 1 Тс 11 0 0 11 120.94202 429,99997 тм (\ 240) Tj / T1_3 1 Тс -5.66901 1 тд (Оповещения по электронной почте) Tj ET BT / T1_0 1 Тс 10 0 0 10 295,4996 442 тм (относится к этой статье или журналу.) Tj 0 0 1 рг -15.44996 0 Тд (Зарегистрируйтесь, чтобы получать бесплатные уведомления по электронной почте) Tj ET BT 0 г / T1_0 1 Тс 11 0 0 11 120.94202 396.99994 тм (\ 240) Tj / T1_3 1 Тс -6.38997 1 тд (Подписки) Tj 0,556 1,00001 тд (Отпечатки и) Tj ET BT / T1_0 1 Тс 10 0 0 10 141 399,99994 тм (\ 240) Tj 13.46496 1 тд (.) Tj 0 0 1 рг -6.85098 0 Тд ([email protected]) Tj 0 г -6.61398 0 Тд (Отделение) Tj 0 1.00001 TD (Чтобы заказать перепечатку статьи или подписаться на журнал, свяжитесь с нами \ t Публикации AACR) Tj ET BT / T1_0 1 Тс 11 0 0 11 120,94 202 374,99997 тм (\ 240) Tj / T1_3 1 Тс -5.66901 1 тд (Разрешения) Tj ET BT / T1_0 1 Тс 10 0 0 10 141 346,99988 тм (\ 240) Tj 0 1 ТД (Сайт Rightlink.) Tj 0 1.00001 TD (Нажмите «Запросить разрешения», чтобы перейти на страницу защиты авторских прав \ Центр Рэнсиса \ (CCC \)) Tj 22.06695 1 тд (.) Tj 0 0 1 рг -22.06695 0 Тд (http://cancerres.aacrjournals.org/content/32/2/426)Tj 0 г 0 1 ТД (Чтобы запросить разрешение на повторное использование всей или части этой статьи, используйте это li \ nk) Tj ET BT / T1_0 1 Тс 9 0 0 9 252.\ q
Уровни сывороточного белка, альбумина, глобулина и соотношение A / G у ВИЧ-положительных пациентов
Патил Р., Рагхуванши У. Сывороточный белок, альбумин, уровни глобулина и соотношение A / G у ВИЧ-положительных пациентов. Biomed Pharmacol J 2009; 2 (2)
Рукопись получена: 18 июля 2009 г.
Рукопись принята: 19 августа 2009 г.
Опубликована онлайн: 17-11-2015
Как Citeclose | История публикаций Закрыть Просмотры: (Посещений 14,040, сегодня 5) Загрузки в формате PDF: 786
Ранджит Патилу * и Уплабди Рагхуванши 2
¹Кафедра медицинской биохимии, д.Медицинский колледж Улхаса Патила, Джалгаон (Индия). ²Махараштский университет медицинских наук, Нашик, Медицинский колледж Б.Дж., Пуна (Индия).
Аннотация
Оценка общего белка сыворотки и уровня сывороточного альбумина позволяет оценить состояние питания пациента. Недоедание — важное осложнение ВИЧ-инфекции. Оппортунистические инфекции не только вызывают изменение метаболизма в организме, но также связаны с уменьшением перорального приема, что, по-видимому, является наиболее важным фактором, определяющим потерю веса.В настоящем исследовании делается попытка оценить следующее: — 1. Белковый статус у ВИЧ-положительных пациентов. 2. Если это полезно как прогностический инструмент. Исследование демонстрирует значительное увеличение (p <0,01) общего белка сыворотки крови в группе больных с болезнью по сравнению с контрольной группой. Средний уровень общего белка в сыворотке у ВИЧ-положительных пациентов составлял 7,43 ± 0,43 г / м% (контрольная группа = 7,07 ± 0,22 г / м%). Уровни сывороточного альбумина (среднее = 2,67 ± 0,34 г / м%) были снижены в группе с болезнью по сравнению с контролем (4,45 ± 0,26 г / м%), что оказалось статистически высоко значимым (p <0.001). Уровни глобулина в сыворотке (среднее = 4,76 ± 0,41 г / м%) были увеличены у ВИЧ-положительных пациентов по сравнению с контрольной группой (2,6 ± 0,29 г / м%). Это увеличение было статистически значимым (p <0,001). Среднее соотношение A: G в сыворотке крови в контрольной группе составило 1,7 ± 0,26, тогда как у ВИЧ-положительных пациентов оно было обратным (0,56 ± 0,1), что было статистически высоко значимым (p <0,001), согласно настоящему исследованию. Уровень сывороточного альбумина (<3 г / м%) может использоваться как прогностический индикатор.
Ключевые слова
Общий белок; альбумин; глобулин; Соотношение A: G; и ВИЧ / СПИД
Загрузите эту статью как:| Скопируйте следующее, чтобы процитировать эту статью: Patil R, Raghuwanshi U. Сывороточный белок, альбумин, уровни глобулина и соотношение A / G у ВИЧ-положительных пациентов. Biomed Pharmacol J 2009; 2 (2) |
| Скопируйте следующее, чтобы процитировать этот URL: Patil R, Raghuwanshi U.Белок сыворотки, альбумин, уровни глобулина и соотношение A / G у ВИЧ-положительных пациентов. Biomed Pharmacol J 2009; 2 (2). Доступно по ссылке: http://biomedpharmajournal.org/?p=822 |
Введение
СПИД — разрушительное заболевание, вызываемое ВИЧ, которое делает хозяина крайне иммуно-некомпетентным. Диарея — частый признак СПИДа. Многие пациенты со СПИДом, у которых развивается диарея, имеют некоторую степень атрофии ворсинок тощей кишки, а более 70% имеют некоторые признаки мальабсорбции.При СПИДе диарея часто связана со снижением уровня сывороточного альбумина (<10 г / л), вероятно, из-за гиперкатаболизма, хотя могут вносить вклад и другие факторы, включая мальабсорбцию и энтеропатию с потерей белка, на что указывает повышение уровня альфа-1-антитрипсина в фекалиях.
У больных СПИДом часто наблюдается сильная потеря веса. Синдром истощения, вызванного ВИЧ, определяется как потеря веса более чем на 10% от исходного уровня без какой-либо другой причины в течение 30 или более дней — диарея или слабость с лихорадкой. При потере веса из-за недоедания жировая ткань предпочтительно истощается, а мышечный белок сохраняется.В отличие от острой инфекции, травмы, ожога, как правило, наблюдается катаболизм белков и отрицательный азотистый баланс. Хотя оценка общего белка сыворотки имеет ограниченное диагностическое значение по сравнению с альбумином из-за компенсаторного увеличения других белков сыворотки (глобулинов) во время инфекций, ее значение для оценки пациентов с некоторыми клиническими состояниями, такими как недоедание, злокачественные новообразования, заболевания почек и печени. Нельзя игнорировать иммунные нарушения [Gray CH, etal (1985)].
Материалы и методы
Клинический материал — Настоящая работа по «изучению сывороточного белка, альбумина, глобулина и соотношения A: G у ВИЧ-положительных пациентов» была проведена на 40 ВИЧ-положительных пациентах, госпитализированных в медицинские отделения Государственного медицинского колледжа, Аурангабад, Махараштра. . В исследование было включено 40 здоровых и отрицательных контрольных случаев jHIV. Средний возраст больных (27 мужчин и 13 женщин) и контрольных случаев (28 мужчин и 12 женщин) составлял примерно 35 лет.
Критерии включения — включены ВИЧ-положительные пациенты.
Критерии исключения. Были исключены пациенты, страдающие диабетом, почечными заболеваниями, а также пациенты с лихорадкой и рвотой.
Методы
Образцы сыворотки были собраны в отделении микробиологии после того, как они были подтверждены как ВИЧ-положительные с помощью рекомбигенного теста ELISA и быстрого теста на агглютинацию латекса капилляров. Образцы крови здоровых людей были собраны в OPD, обработаны для тестирования на ВИЧ в Отделении микробиологии, и после подтверждения отрицательности ВИЧ образцы были проанализированы биохимически.Все образцы крови были собраны в простые луковицы. Биохимические исследования проводили на полностью автоматическом анализаторе Erba Superstat 919, за исключением сывороточного глобулина и соотношения A: G, которое рассчитывалось математически. Все значения были рассчитаны в граммах%. Данные были статистически проанализированы с использованием t-критерия. В следующей таблице показан использованный метод с нормальными значениями всех протестированных биохимических параметров.
| S.No: | Биохимический параметр | Метод | Длина волны (нм) | Формула | Нормальное значение (г%) |
| 1. | Общий белок | Биуретовый метод | 546 | A (T) * Концентрация S (6 гм%) A (S) | 6 — 8,3 |
| 2. | Альбумин сыворотки | BCG (Bromo Cresol Green) Ферментативный метод (Doumas et al) | 659 | A (T) * Концентрация S (6 г%) A (S) | 3,2 — 5,3 |
| 3. | Сывороточный глобулин | (общий белок сыворотки) — (альбумин сыворотки) | 1,8 — 3,6 | ||
| 4. | A: G | сывороточный альбумин / сывороточный глобулин | 1,5: 1-2: 1 |
Результаты и обсуждение
Таблица 1: Средний возраст в контрольной и болезненной группах —
| S.No: | Группа | Средний возраст (лет) |
| 1. | Контроль | 35,17 |
| 2. | ВИЧ-инфицированных | 34,65 |
Средний возраст контрольной группы, включая группу с болезнью, был рассчитан как 35,17 года (от 22 до 53 лет) и 34,65 года (от 22 до 55 лет).
Таблица 2: Дифференциация по полу в группе патологий и контрольной группе —
| S.No: | Группа | №: мужчин | №: женщин |
| 1. | Контроль | 28 | 12 |
| 2. | ВИЧ-положительный | 27 | 13 |
В приведенной выше таблице показана дифференциация по полу в группе патологического теста и контрольной группе
Таблица 3: Среднее ± SD в контрольной и болезненной группах —
| S. №: | Биохимический Параметр | Макс-Мин диапазон [Контроль] | Макс.-Мин. Диапазон [Morbid] | Среднее ± стандартное отклонение (грамм%) | |
| Контрольная группа | Morbid Group | ||||
| 1. | Общий белок | 7,5-6,7 | 8,3-6,9 | 7,07 ± 0,22 | 7,43 ± 0,43 |
| 2. | Альбумин | 5,0-4,0 | 3,2–2,4 | 4,45 ± 0,26 | 2,67 ± 0,34 |
| 3. | Глобулин | 3,3–2,1 | 5,6–3,9 | 2,6 ± 0,29 | 4,76 ± 0,41 |
| 4. | Соотношение A: G | 2,3–1,2 | 0.7-0,3 | 1,7 ± 0,26 | 0,56 ± 0,1 |
Таким образом, из вышеприведенной таблицы видно —
Средний уровень общего белка в сыворотке крови в контрольной группе составлял 7,07 ± 0,22 г / м%, который повышался до 7,43 ± 0,43 г / м% у ВИЧ-положительных пациентов; Статистический анализ показал достоверную (p <0,01) взаимосвязь между контрольной и болезненной группами.
Средний уровень сывороточного альбумина в контрольной группе составлял 4,45 ± 0,26 г%, который, как было обнаружено, снизился до 2.67 ± 0,34 г% у ВИЧ-положительных пациентов, и снижение было статистически значимым (p <0,001).
Средний уровень глобулина в сыворотке крови в контрольной группе составлял 2,6 ± 0,29 г / м%, который повышался до 4,76 ± 0,42 у ВИЧ-положительных пациентов. Было обнаружено, что это статистически значимое значение (p <0,001).
Среднее соотношение A: G в сыворотке крови в контрольной группе составляло 1,7 ± 0,26, тогда как у ВИЧ-положительных пациентов оно было обратным; значения 0,56 ± 0,1 (р <0,001).
Приведенные выше данные статистического анализа показали следующие значения p —
.Таблица 4: Статистический анализ между контрольной группой и болезненной группой —
| С.Номер: | Биохимический Параметр | p-значение | Проверка значимости [t-тест] |
| 1. | Общий белок | р <0,01 | Значительное |
| 2. | Альбумин | р <0,001 | Очень важно |
| 3. | Глобулин | р <0.001 | Очень важно |
| 4. | Соотношение A: G | р <0,001 | Очень важно |
Согласно настоящему исследованию средний уровень общего белка в сыворотке крови в контрольной группе составлял 7,07 ± 0,22 г / м%, который повышался до 7,43 ± 0,43 г / м% у ВИЧ-положительных пациентов (p <0,01). Ульрих Р. и др. (1989) продемонстрировали, что среднее значение общего сывороточного белка у ВИЧ-положительных пациентов составляло 73 г / л, тогда как для сывороточного альбумина оно составляло 38 г / л. (19)
Средний уровень сывороточного альбумина в контрольной группе в настоящем исследовании составлял 4,45 ± 0,26 г / м%, который, как было обнаружено, снизился до 2,67 ± 0,34 г% у ВИЧ-положительных пациентов, и это снижение было статистически значимым (р <0,001). О гипоальбуминемии сообщили Schniedermann D et al (1987) (3,2 г%), Dworkin B. и др. (1987) (3,0 г%), Dworkin B и др. (1985) (среднее значение = 3,3 г / дл) и Keithley J.K. и др. (1989). (16, 5, 4, 11) Guenter P. et al (1993) наблюдали, что уровни сывороточного альбумина и потеря веса связаны с количеством CD4.Они заявили, что относительный риск для субъектов с низким уровнем сывороточного альбумина (<3,5 г / дл) был в 3,6 раза выше (p <0,021), чем для субъектов с нормальным уровнем сывороточного альбумина (> 3,5 г / дл) и количеством CD4. (10) Fernandez p etal (1995) оценили, что уровни сывороточного альбумина <30 г / л связаны с плохим прогнозом. (7) Scuttman U et al (1995) наблюдали снижение уровня сывороточного альбумина у 14%, преимущественно на более поздних стадиях заболевания.Они заявили, что 14 из 32 пациентов умерли, а выжившие имели значительно более высокие начальные уровни сывороточного альбумина по сравнению с не выжившими. (17) Gerard L. et al (1996) пришли к выводу, что факторы, способствующие более высокой смертности, включают тип оппортунистической инфекции, вес, количество CD4-клеток и уровень сывороточного альбумина. (8) Wilcox C. M. et al (1996) заявили, что в исследовании 71 ВИЧ-положительного пациента смерть была тесно связана со снижением концентрации сывороточного альбумина. (20) Colin J. F. etal (1999) заявили, что у ВИЧ-положительных пациентов уровень сывороточного альбумина был ниже (p = 0,0009). (3) Джоэл Э. Галлант (2004) объяснил, что низкий уровень альбумина обычно наблюдается на поздних стадиях заболевания ВИЧ и отражает плохой статус питания. Однако повышенное содержание общего белка и фракции глобулинов может наблюдаться у здоровых ВИЧ-инфицированных людей. Вероятно, это отражает генерализованную поликлональную гаммопатию с повышенной выработкой антител, которая является попыткой иммунной системы компенсировать клеточный иммунодефицит.
Средний уровень глобулина в сыворотке крови в контрольной группе составлял 2,6 ± 0,29 г%, который повышался до 4,76 ± 0,42 у ВИЧ-положительных пациентов (p <0,001). Увеличение анионной щели может быть связано с повышенным уровнем IgG (гиперглобулинемия).
Гиперглобулинемия у пациентов с ВИЧ была продемонстрирована исследованиями Slucher B. et al (1993), Quensel A et al (1994), Miguez-Burban M.J. et al (1995) (p = 0,003) и Moja P et al (1997). (18, 15, 13, 14) Гиперглобулинемия, наблюдаемая у ВИЧ-положительных пациентов, может быть связана с повышенным уровнем IgA и IgG при этом заболевании.
Ball S.G. (1994) заявил, что диарея СПИДа часто связана с пониженным уровнем сывороточного альбумина, в тяжелых случаях до 10 г / л, вероятно, из-за гиперкатаболизма, хотя другие факторы могут способствовать, включая мальабсорбцию и энтеропатию с потерей белка. Он также заявляет, что поликлональной гиперглобулинемии может быть достаточно для повышения общего белка обычно примерно на 10-15 г / л. (1)
Хот В.В. (1999) пришли к выводу, что у ВИЧ-положительных алкоголиков и ВИЧ-положительных неалкоголиков были повышены общие уровни сывороточного белка и сывороточного глобулина; уровни сывороточного альбумина и соотношение A: G были снижены в вышеуказанных группах, но различия не были статистически значимыми (p <0.05). Она заявила, что общие уровни белков сыворотки (p <0,001) и уровни глобулина в сыворотке (p <0,001) у ВИЧ-положительных неалкоголиков были выше, чем у ВИЧ-отрицательных неалкоголиков. Уровни сывороточного альбумина были значительно ниже у ВИЧ-положительных неалкоголиков по сравнению с ВИЧ-отрицательными неалкоголиками (p <0,001). Когда ВИЧ-положительных алкоголиков сравнивали с ВИЧ-отрицательными неалкоголиками, общий уровень белка у ВИЧ-положительных алкоголиков был повышен (p <0,001), тогда как уровни сывороточного альбумина были снижены у ВИЧ-положительных алкоголиков (p <0.05). Уровни глобулина в сыворотке были повышены у ВИЧ-инфицированных алкоголиков (p <0,001). (12) Настоящее исследование демонстрирует, что среднее соотношение A: G в сыворотке составляет 1,7 ± 0,26 (контроль), тогда как в группе с болезнью было обнаружено обратное; значения 0,56 ± 0,1 (р <0,001). Хотя оценка общего белка сыворотки имеет ограниченное диагностическое значение по сравнению с альбумином из-за компенсаторного увеличения других белков сыворотки (глобулинов) во время инфекций, ее значение для оценки пациентов с некоторыми клиническими состояниями, такими как недоедание, злокачественные новообразования, заболевания почек и печени. и иммунные нарушения нельзя игнорировать [Gray CH, et al (1985)].Снижение общего белка в сыворотке крови при ВИЧ-инфекции было связано либо с увеличением потерь и / или катаболизма, либо в результате снижения потребления и / или всасывания из-за язв во рту, глотке и / или пищеводе, усталости, депрессии и побочных эффектов. лекарств (Macallan DC) (1999). (6)
Guardia J. A. и др. (1997) пришли к выводу, что у ВИЧ-положительных пациентов уровень сывороточного альбумина в среднем составлял 2,3 г%. Среднее значение сывороточного глобулина у ВИЧ-инфицированных было 3.1 г%. Они пришли к выводу, что глобулины играют важную роль в поддержании онкотического давления при низком уровне альбумина. (9) Cirasino L. et al (1996) продемонстрировали у пациентов, у которых выживаемость была значительно снижена для тех групп, в которых в начале периода наблюдения количество лимфоцитов CD4 <240 / куб. Мм, сывороточный альбумин <4,13 г / дл. (p = 0,04) и сывороточный IgA> 2,5 г / дл (p = 0,043). (2)
Резюме и выводы
Хотя уровни сывороточного альбумина были снижены у ВИЧ-инфицированных пациентов, уровни сывороточного глобулина были увеличены, в результате чего общий уровень сывороточного белка оставался, по-видимому, в пределах нормы.Глобулин сыворотки был повышен выше верхней границы нормы у всех ВИЧ-инфицированных пациентов. Было обнаружено, что у ВИЧ-положительных пациентов соотношение A: G было обратным. Глобулины играют важную роль в поддержании онкотического давления при низком уровне альбумина у этих пациентов. У ВИЧ-положительных пациентов с уровнем сывороточного альбумина ниже 3 г / м% прогноз обычно плохой; следовательно, уровень сывороточного альбумина можно использовать как прогностический индикатор. Эти пониженные уровни альбумина могут отражать плохой статус питания, катаболическое состояние хронического заболевания, о чем свидетельствует значительная потеря веса.
Список литературы
- Болл С.Г. Химическая патология СПИДа. Ann Clin Biochem 1994. 31: 401-09.
- Чиразино Л., Кароли А., Имбриани М. и др. Прогностическое значение некоторых лабораторных показателей в группе потребителей инъекционных наркотиков на ранних стадиях ВИЧ-инфекции. Недавний Prog Med 1996. 86 (1): 16-22.
- Colin JH et al. Влияние ВИЧ-инфекции на хронический гепатит В у гомосексуальных мужчин. Гепатология 1999. 29 (4): 1306-10.
- Dworkin B, Wormser GP, Rosenthal WS et al.Желудочно-кишечные проявления СПИДа: обзор 22 случаев. Am Journal Gastroenterol 1985. 80 (10): 774 — 80.
- Дворкин Б.М., Шталь Р.Э., GiardianaA и др. Печень при СПИДе — Акцент на пациентов, злоупотребляющих наркотиками внутривенно. Am J Gastroenterol 1987. 82 (3): 231-40.
- Э. Угвуджа и Н. Эз: Сравнительное исследование сывороточных электролитов, общего белка, кальция и фосфата среди пациентов с диабетом и ВИЧ / СПИДом в Абакалики, Юго-Восток, Нигерия. Интернет-журнал лабораторной медицины 2007.Том 2, номер 1.
- Фернандес П., Торрес А., Миро Дж. М. и др. Факторы прогноза, влияющие на исход пневмонии, вызванной Pneumocystis carnii, у пациентов со СПИДом. Thorax 1995. 50 (6): 668-71.
- Gerard L, Flandre P, Raguin G et al. Ожидаемая продолжительность жизни госпитализированных больных СПИДом — прогностические факторы при поступлении. J Паллиативная помощь 1996 Весна 12 (1): 26-30.
- Guardia JA, Butcher OC, Bourgoignie JS и др. Онкотическое давление и образование отеков у гипоальбуминемических ВИЧ-инфицированных пациентов с протеинурией.Am J Kid Disease 1997. 30 (6): 822-28.
- Guenter P, Murahainen N, Simons G et al. Взаимосвязь между статусом питания, прогрессированием заболевания и выживаемостью при ВИЧ-инфекции. J. AIDS 1993. 6 (10): 1130-38.
- Keithley JK, Zella JM, Szeluga DJ et al. Изменения в питании людей с ВИЧ-инфекцией. Изображения J Nurs Sch 1992. 24 (3): 183-89.
- Хот В.В. (1999), диссертация, Медицинский колледж GS, Мумбаи, Индия. Изучение некоторых функциональных тестов печени у ВИЧ-положительных алкоголиков.
- Miguez — Burbano MJ, Shor Posner G, Fletcher MA et al. Уровни иммуноглобулина Е в связи с заболеванием ВИЧ, путем заражения и уровнями витамина Е. Allergy 1995. 50 (2): 157-61.
- Moja P, JalilA, Quensel A et al. Гуморальный иммунный ответ внутри организма при ВИЧ-1-инфекции. Clin Express Immunol 1997. 110 (3): 341-48.
- Quensel CM, Moja P, Lucht F. et al. Есть ли IgA слизистой оболочки кишечника в сыворотке ВИЧ-инфицированных пациентов? Gut 1994. 35 (6): 803-08.
- Schneiderman JD, Areneson DM, Cello JP et al.Заболевания печени у больных СПИДом. Гепатология 1987. 7 (5): 925-30.
- Scuttman U, Ockenga J, Selberg O et al. Частота и прогностическое значение недоедания и истощения у ВИЧ-инфицированных амбулаторных пациентов. J. AIDS and Human Retrovirol 1995. 8 (3): 239-246.
- Slucher B, LevinsonSS et al. ВИЧ и анионный разрыв. Ann Clin Lab Science 1993. 23 (4): 249-55.
- Ulrich R, Zeitz M, Heise W et al. Структура и функция тонкого кишечника у пациентов, инфицированных ВИЧ — данные о ВИЧ-индуцированной энтеропатии.Ann Int Med 1989. 111: 15-21.
- Wilcox CM, Rabeneck L, Friedman S. AGA, Технический обзор. Недоедание и кахексия, хроническая диарея и гепатобилиарные заболевания у пациентов с ВИЧ. Gastroenterol 1996.
