Анализы на Лактатдегидрогеназа (ЛДГ), цены в лаборатории KDL
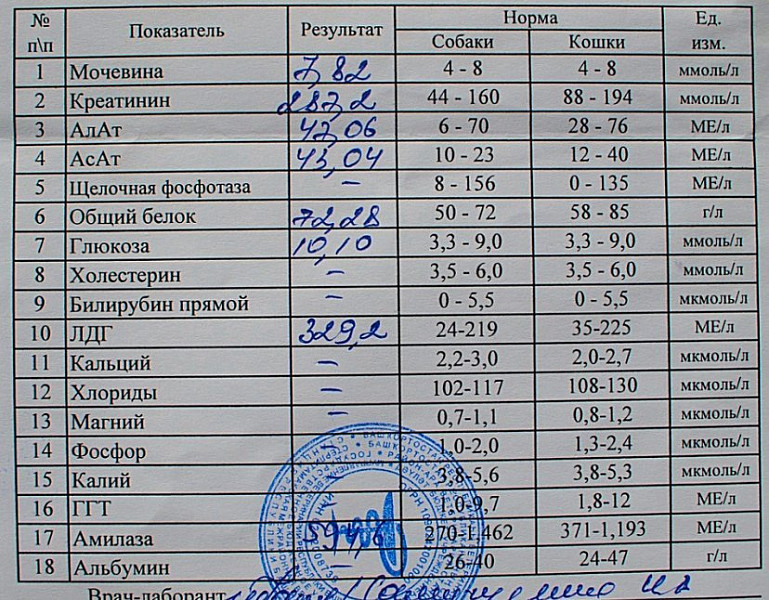
Лактатдегидрогеназа (ЛДГ) – внутриклеточный фермент, участвующий в метаболизме глюкозы. Содержит цинк, продуцируется всеми клетками организма. Наибольшая активность фермента наблюдается в мышцах, сердце, печени, почках и клетках крови — эритроцитах.
Существует 5 типов ЛДГ, от преобладания той или иной разновидности фермента зависит способ метаболизма глюкозы в тканях – аэробный (до углекислого газа и воды) или анаэробный (до молочной кислоты). Например, в миокарде преобладает ЛДГ-1, в почках и клетках крови – ЛДГ-2, в большинстве внутренних органов ЛДГ-3 и 4, в мышцах, плаценте, печени – ЛДГ-5. Все формы фермента присутствуют в крови, где они определяются в составе суммарного показателя – общей лактатдегидрогеназы.
Концентрация ЛДГ в крови повышается при заболеваниях, для которых характерно повреждение тканей организма. Анализ крови на ЛДГ не является специфичным, однако в совокупности с другими тестами он помогает диагностировать различные патологические состояния: инфаркт легкого, гемолитическую анемию и т.
В каких случаях обычно назначают исследование?
Анализ крови на лактатдегидрогеназу назначается при:
- дифференциальной диагностике загрудинных болей (инфаркт миокарда, стенокардия, инфаркт легкого) вместе с анализом на тропонин I;
- при подозрении на гемолиз;
- диагностике поражений мышц;
- комплексном профилактическом обследовании пациента.
Что именно определяется в процессе анализа?
В процессе анализа измеряется концентрация ЛДГ в сыворотке крови пациента при помощи колориметрического метода.
Что означают результаты теста?
У детей референсные значения меняются в зависимости от возраста. Верхняя граница нормы уровня ЛДГ у мужчин несколько выше, чем у женщин. Так же повышенная активность ЛДГ может выявляться у новорожденных, беременных и у пациентов после интенсивных физических нагрузок (в частности,у спортсменов). При выявлении любых отклонений требуются дополнительные исследования и консультация врача.
Сроки выполнения теста.
Результат исследования можно получить на следующий день после сдачи анализа.
Как подготовиться к анализу?
Следует придерживаться общих правил подготовки к взятию крови из вены. Кровь можно сдавать не ранее, чем через 3 часа после приема пищи в течение дня, или утром натощак. Чистую воду можно пить в обычном режиме. Накануне исключить избыточные физические, эмоциональные нагрузки и прием алкоголя.
№AN24LDH, ЛДГ (лактатдегидрогеназа): показатели, норма
Лактатдегидрогеназа содержится в цитоплазме большинства клеток и катализирует обратимое превращение L-лактата в пируват.
ЛДГ ‒ это тетрамер, состоящий из четырех субъединиц двух типов: H (сердечный) и M (мышечный), которые образуют пять молекулярных форм – ЛДГ1 (Н4), ЛДГ2 (h4M1), ЛДГ3 (h3M2), ЛДГ4 (h2M3) и ЛДГ5 (М4). Каждый изофермент присутствует в ограниченном числе тканей и, следовательно, определение изоферментов является более специфичным, чем определение общей сывороточной активности ЛДГ.
Существует заметная разница в периодах полураспада пяти изоферментов. Скорость полувыведения ЛДГ из плазмы крови варьирует для каждого изофермента: для ЛДГ 1 (Н4) она самая продолжительная, а для ЛДГ 5 (M4) самая короткая и у собак составляет в среднем 3,3 часа, у свиней 40 часов, у овец 50 часов. Некоторые изоформы ЛДГ могут образовывать комплексы с препаратами, например, стрептокиназой.
Мышцы, печень и разрушающиеся эритроциты, как правило, являются источниками высокой активности ЛДГ в сыворотке. После повреждения тканей сывороточная активность ЛДГ достигает пика через 24-48 часов и возвращается к норме в течение 7-10 дней. Для выявления повреждения мышечной ткани уровень ЛДГ в крови является менее информативным показателем, чем КФК и АСТ, поскольку ЛДГ не обладает тканевой специфичностью, и на ее сывороточную активность существенно влияет даже незначительный гемолиз. В совокупности исследование сывороточной активности ЛДГ может помочь в дифференциальной диагностике патологического процесса.
ПРЕАНАЛИТИКА
Для получения более точных результатов животные перед исследованием должны находиться на голодной диете не менее 12 часов. Образец стабилен 1 неделю при температуре хранения +2°С…+8°С; сохраняет стабильность 1 месяц при замораживании -17ºС…-23ºС.
При выраженном гемолизе уровень ЛДГ повышается.
ИНТЕРПРЕТАЦИЯ
Результаты исследования содержат информацию исключительно для врачей. Диагноз ставится на основании комплексной оценки различных показателей, дополнительных сведений и зависит от методов диагностики.
Единицы измерения в лаборатории VET UNION: Ед/л.
Референсные значения:
Собаки: 20-350 Ед/л.
Кошки: 40-350 Ед/л.
Лошади: 102-340 Ед/л.
Хорьки: 241-460 Ед/л.
Кролик:34-129 Ед/л.
Тукан:200-400 Ед/л.
Повышение уровня:
Состояния или заболевания, приводящие к гемолизу.
Повреждения скелетной мускулатуры.
Гепатоцелюллярные повреждения.
Инфаркт миокарда.
Неопластические процессы.
Острый панкреатит.
Нефрит.
Лептоспироз.
Инфекционный перитонит кошек.
Понижение уровня:
Не имеет клинической значимости.
Что могут сказать о сердце анализы.
Что такое анализы? Анализы – это подтверждение или исключение того или иного заболевания, о котором сложилось мнение после клинического осмотра пациента. При их помощи врач узнает, что именно мешает вашему организму нормально жить и работать, каково состояние отдельных его органов и систем.
Итак, о чем же говорят эти самые анализы, если появились боли в области сердца. Важное значение в диагностике заболеваний, связанных с повреждением миокарда, имеет определение ферментов, содержащихся внутри клеток. И в зависимости от того какие и сколько клеток гибнет, будут изменяться и их значения.
Показатели биохимического анализа крови:
АЛТ (аланинаминотрансфераза): до 68Е/л, при оценке уровня данного фермента, стоит учитывать, что он содержится не только в миокарде, но в большей степени, в печени, поэтому АСТ и АЛТ всегда определяют вместе, что помогает в разграничении поражения сердца и печени.
АСТ (аспартатаминотрансфераза): до 45Е/л, данный фермент в большом количестве содержится в миокарде, и его повышение, в большинстве случаев, говорит о повреждении кардиомиоцитов – мышечных клеток сердца; повышение АСТ в сыворотке крови наблюдается при инфаркте миокарда (95-98%) случаев уже через 6-12 часов от начала заболевания. Максимальное возрастание отмечается на 2-4 сутки, и на 5-7 сутки уровень фермента приходит к норме. Имеется четкая зависимость между цифрами АСТ и величиной очага некроза сердечной мышцы. Поэтому при величине некроза менее 5мм диаметром, возможно сохранение уровня этого фермента в пределах нормы, что тоже надо учитывать.
ЛДГ (лактатдегидрогеназа) и составляющие этот показатель фракции: до 250Ед/л, считается специфическим маркером при ОИМ, возрастание активности изофермента ЛДГ1 и ЛДГ2 даже при нормальных показателях общей активности ЛДГ свидетельствует о наличии мелких некрозов в сердечной мышце. При ОИМ ее уровень возрастает быстро на 2-4 сутки, и нормализуется только на 2 –3 неделе. Уровень ЛДГ позволяет получить ценную информацию о ИМ на всем протяжении заболевания. Другие фракции ЛДГ3 и ЛДГ4 – ферменты легочной ткани, ЛДГ5 – печени.
При ОИМ ее уровень возрастает быстро на 2-4 сутки, и нормализуется только на 2 –3 неделе. Уровень ЛДГ позволяет получить ценную информацию о ИМ на всем протяжении заболевания. Другие фракции ЛДГ3 и ЛДГ4 – ферменты легочной ткани, ЛДГ5 – печени.
КФК (креатинфосфокиназа) и составляющие этот фермент фракции: до 190 Ед/л, креатинфософокиназа – считается специфическим маркером (особенно повышение более чем в 10 раз) при остром инфаркте миокарда. Повышается в остром периоде (в первые 4-8 часов от начала заболевания), намного опережая активность выше перечисленных ферментов и является маркером ранней диагностики ОИМ, особенно изофермент КФК-МВ. Через 8-14 час величина КФК может достигать максимального значения, а нормализация может наступить через 3-4 суток. Также значение КФК может повышаться при миокардитах;
тропонин-тест: до 0,4 мкг/л. Тропонин является специфическим сократительным белком, входящим в структуру сердечной мышцы и мышц скелета. Этот тест является диагностическим маркером при подозрении на острое повреждение клеток миокарда, является одним из ключевых результатов при постановке диагноза «острый инфаркт миокарда»;
миоглобин: 12-92 мкг/л.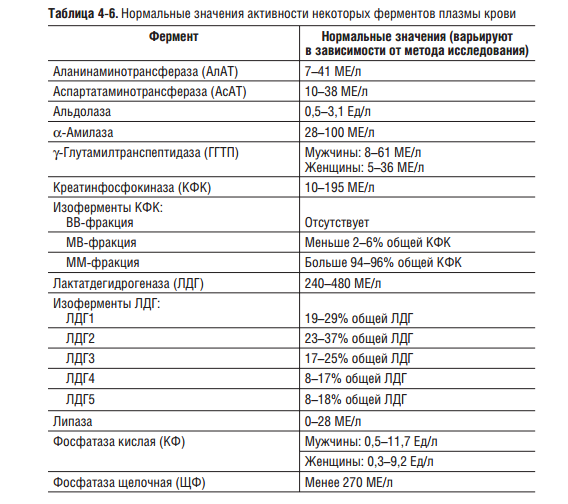 Белок мышечной ткани, участвующий в процессе дыхания клетки. В случае появления его в крови, расценивается как продукт распада мышечной ткани сердца или скелета, при соответствующей клинике, может указывать на омертвение (некроз) очага мышечной ткани сердца, поэтому тоже считается специфическим маркером этой патологии.
Белок мышечной ткани, участвующий в процессе дыхания клетки. В случае появления его в крови, расценивается как продукт распада мышечной ткани сердца или скелета, при соответствующей клинике, может указывать на омертвение (некроз) очага мышечной ткани сердца, поэтому тоже считается специфическим маркером этой патологии.
Показатели АЛТ, АСТ, КФК, КФК-МВ, ЛДГ, миоглобина и тропонинового теста тесно корелируют с размерами очага некроза в сердечной мышце, и поэтому имеют не только диагностическое, но и прогностическое значение.
Кислая фосфатаза: 67-167 нмоль/(с·л), повышается в активности у больных с тяжелыми, осложненными ИМ, преимущественно трансмуральными;
С-реактивный белок (СРБ): до 0,5 мг/л, его обнаружение свидетельствует о наличии в организме патологического процесса, в частности воспалительного или некротического. Он относится к белкам так называемой «острой фазы». Резко положительная реакция на СРБ указывает на тяжесть течения воспалительного процесса.
сиаловые кислоты: 2,0-2,36ммоль/л, содержание сиаловых кислот может увеличивается при эндокардите, ИМ;
элктролиты, главным образом представлены ионами К+(норма 3,6 – 5,2 ммоль/л), Na+(норма 135 – 145 ммоль/л), Cl-(норма 100 – 106 ммоль/л), Ca2+ (норма 2,15-2,5 ммоль/л). Повышенное количество калия в сыворотке может сопровождаться клинически нарушением ритма сердечной деятельности, что подтверждается при выполнении ЭКГ. Может развиться атриовентрикулярные блокада проводящей системы сердца, развиться синдром преждевременного возбуждения желудочков, мерцание желудочков, и такое грозное нарушение, как остановке сердца. Поэтому больным с нарушениями ритма сердца необходимо контролировать содержание в организме ионов К+. С другой стороны, снижение калия в крови также может привести к неблагоприятным последствиям у этих пациентов – гипорефлексии миокарда. Снижение уровня ионов натрия может сопровождаться развитием недостаточности сердечно-сосудистой системы, поскольку соотношение ионов К+ и Na+, как регуляторов процессов в клетке, находится в постоянном взаимодействии и уменьшение одно, приводит к увеличению другого иона. Гиперхлоремия наблюдается у пациентов с заболеванием почек, и может также привести к развитию сердечно-сосудистой недостаточности;
Гиперхлоремия наблюдается у пациентов с заболеванием почек, и может также привести к развитию сердечно-сосудистой недостаточности;
липидный спектр, ассоциируется у простого человека со словом «холестерин». В данном случае определяются вещества (липопротеиды различной плотности, триглицериды), которые участвуют в обмене холестерина (ХС) (норма в крови – 3,1 – 5,2 ммоль/л). Кроме значения общего холестерина, важным показателем является коэффициент атерогенности (норма до 4), который показывает соотношение «хороших» и плохих» липидов, участвующих в обмене жиров и холестерина, и угрозу развития или прогрессирования атеросклероза и всеми вытекающими последствиями. Увеличение фракций липопротеидов и триглицеридов может быть как физиологическим состоянием (алиментарного характера), так и патологическим состоянием. Повышение липидов свойственно распространенному атеросклерозу, ожирению сопровождающего и обуславливающего артериальную гипертензию. А вернее будет сказать, что это нарушение работы внутренних органов и промежуточных звеньев обмена липидов и триглицеридов, выраженное в повышение показателя атерогенности, обуславливает отложение холестерина в сосудах различного диаметра, отложению «запасного жира», что и ведет к вышеперечисленным болезням. Поэтому при распространенном атеросклерозе, в этом анализе крови, можно увидеть повышенные значения ß-липопротеидов и общего холестерина. Вместе с тем, можно увидеть снижение концентрации фосфолипидов. Но и при этом необходимо учитывать то, что имеются возрастные колебания жиров в крови.
Поэтому при распространенном атеросклерозе, в этом анализе крови, можно увидеть повышенные значения ß-липопротеидов и общего холестерина. Вместе с тем, можно увидеть снижение концентрации фосфолипидов. Но и при этом необходимо учитывать то, что имеются возрастные колебания жиров в крови.
коагулограмма – анализ, по которому можно посмотреть «вязкость» крови, или другими словами, существует ли угроза образования тромбов, что может привести к образованию тромбов с различной локализацией, что в свою очередь может осложниться тромбоэмболией легочной артерии, при которой отмечается мгновенная смерть. Либо наоборот посмотреть, насколько высока вероятность кровотечения и сможет ли оно самостоятельно остановится, после операции, например, по протезировании клапана сердца.
Любой анализ или исследования дают врачу дополнительную информацию, помогающую точнее поставить диагноз, определить стадию заболевания, назначить лечение. Контролировать, течение болезни, эффективность назначенного лечения, а также обеспечивать безопасность терапии также помогают анализы. Но иногда требуется дополнительные исследования, подтверждающие или дополняющие результаты прошлых анализов.
Но иногда требуется дополнительные исследования, подтверждающие или дополняющие результаты прошлых анализов.
Федорова Любовь Алексеевна – врач первой категории, терапевт, кардиолог медицинского центра «Тет-а-тет».
Анадиз на ЛДГ
Что такое лактатдегидрогеназа (ЛДГ, 1-ый изофермент ЛДГ, ЛДГ-1, альфа-гидроксибутират дегидрогеназа, изофермент лактатдегидрогеназы-1, Alpha-HBDH)?
Это фермент, который участвует в процессе окисления глюкозы и образовании молочной кислоты. Лактат (соль молочной кислоты) образуется в клетках в процессе дыхания. Лактатдегидрогеназа содержится почти во всех органах и тканях человека, особенно много его в мышцах.
При полноценном снабжении кислородом лактат в крови не накапливается, а разрушается до нейтральных продуктов и выводится. В условиях гипоксии (недостатка кислорода) накапливается, вызывает чувство мышечной усталости, нарушает процесс тканевого дыхания.
Показания к назначению исследования:
- инфаркт миокарда;
- болезни печени;
- анемии гемолитические;
- опухолевые заболевания.
Когда уровень лактатдегидрогеназы повышен?
- Заболеваниях печени (вирусный и токсический гепатит, желтуха, цирроз печени).
- Инфаркте миокарда и инфаркте легкого.
- Заболеваниях кровеносной системы (анемия, острый лейкоз).
- Травмах скелетных мышц, атрофии.
- Острый панкреатит.
- Заболеваниях почек (гломерулонефрит, пиелонефрит).
- Злокачественные опухоли различных органов.
- Гипоксия (недостаточное снабжение кислородом тканей: кровотечение, сердечная недостаточность, дыхательная недостаточность, анемия).
-
Беременность.

- У новорожденных.
- После физической нагрузки.
- После приема алкоголя и некоторых лекарственных веществ (кофеина, инсулина, аспирина, анестетиков и других).
Строго натощак. Необходимо воздержаться от приема пищи в течение 8-12 часов.
Лактатдегидрогеназа (S-LDH) – SYNLAB Eesti
Лактатдегидрогеназа – внутриклеточный энзим, который находится в цитоплазме всех клеток организма, больше всего в сердечной и скелетных мышцах, эритроцитах, почечной и печеночной тканях, меньше – в легких, гладких мышцах и мозге. Внутриклеточно активность энзима примерно в 500 раз больше, чем в сыворотке крови.
LDH является неспецифичным показателем тканевого повреждения – активность его в крови увеличена при всех состояниях, сопровождающихся увеличением проницаемости клеточной мембраны.
Показания:
Подкрепляющее исследование при диагностике поражения сердца, печени, эритропоэза, почек, скелетных мышц, мозга и диагностике легочных заболеваний.
Метод анализа: Фотометрия
Референтные значения:
| <1 мес | 135-630 U/L |
| 1-12 мес | 135-375 U/L |
| 1-4 л | 135-305 U/L |
| 5-11 л | 120-245 U/L |
| >12 л | 120-246 U/L |
Интерпретация результата:
Высокие значения LDH:
- Гематологические заболевания: мегалобластические и гемолитические анемии, острые лейкемии, лимфомы, хронические миело¬пролиферативные заболевания
- Инфаркт сердечной мышцы: от начала инфаркта LDH увеличивается в течение 10-12, максимально за 48-72 часа, умеренно увеличенная активность сохраняется до 10-14 дней
- Заболевания печени (гепатиты, некрозы), поражение легких (эмболия легких, саркоидоз), злокачественные опухоли, заболевания почек и мышц
- Физиологическое увеличение активности LDH: последний триместр беременности
- NB! Возникший при взятии крови гемолиз и предшествующая анализу сильная физическая нагрузка могут привести к ложно-положительным результатам.
 Также важно учитывать, что у одного и того же человека может быть несколько причин подъема LDH.
Также важно учитывать, что у одного и того же человека может быть несколько причин подъема LDH.
Сдать анализ на ЛДГ, лактатдегидрогеназу
Метод определения Лактат =>пируват (IFCC).
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Онлайн-регистрацияСинонимы: Лактатдегидрогеназа; L-лактат; НАД+Оксидоредуктаза; Дегидрогеназа молочной кислоты.
Lactate dehydrogenase, Total; Lactic dehydrogenase; LDH; LD.
Краткая характеристика определяемого аналита ЛДГ (Лактатдегидрогеназа)
Гликолитический фермент, участвующий в конечных этапах превращения глюкозы (катализ взаимопревращения пирувата и лактата).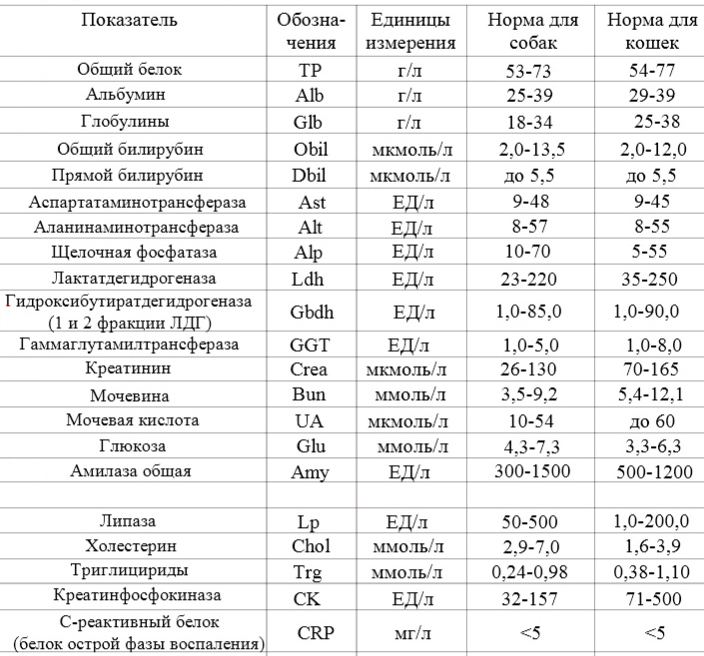
Цинксодержащий фермент, локализующийся в основном в цитоплазме и обнаруживающийся практически во всех органах и тканях человека. Наибольшая активность отмечается в почках, печени, сердце, скелетных мышцах, поджелудочной железе, клетках крови. В эритроцитах её уровень в 100 раз выше, чем в сыворотке. У детей активность фермента выше, чем у взрослых, с возрастом активность ЛДГ сыворотки плавно снижается.
С какой целью определяют уровень ЛДГ в сыворотке крови
Оценка уровня ЛДГ в сыворотке крови помогает выявить состояния, сопровождающиеся повреждением клеток и тканей.
Что может повлиять на показатели активности фермента ЛДГ
Показатели активности ЛДГ зависят от метода исследования. Повышенная активность ЛДГ в физиологических условиях наблюдается у беременных, новорожденных, после интенсивных физических нагрузок. Активность фермента у женщин несколько ниже, чем у мужчин.
Мониторинг течения инфаркта миокарда. Рост активности ЛДГ наблюдается на 12-24 часу после инфаркта; максимальная активность отмечается через 24-48 часов. Повышенная активность фермента держится вплоть до 10 суток. Активность ЛДГ зависит от размеров очага поражения миокарда, а динамика ее снижения в процессе выздоровления – от интенсивности восстановительных процессов в сердечной мышце. Определение активности ЛДГ позволяет дифференцировать истинный инфаркт миокарда и клинически сходные с ним приступы стенокардии: при инфаркте суммарная активность ЛДГ возрастает и в результате ее значение в несколько раз превышает нормальный уровень, в то же время даже при тяжелых приступах стенокардии уровень активности ЛДГ соответствует норме. Снижение активности фермента в постинфарктном периоде происходит в 2 раза медленнее, чем нормализация таких маркеров поражения миокарда, как креатинкиназа и АСТ, что особенно ценно для поздней диагностики поражения.
Повышенная активность фермента держится вплоть до 10 суток. Активность ЛДГ зависит от размеров очага поражения миокарда, а динамика ее снижения в процессе выздоровления – от интенсивности восстановительных процессов в сердечной мышце. Определение активности ЛДГ позволяет дифференцировать истинный инфаркт миокарда и клинически сходные с ним приступы стенокардии: при инфаркте суммарная активность ЛДГ возрастает и в результате ее значение в несколько раз превышает нормальный уровень, в то же время даже при тяжелых приступах стенокардии уровень активности ЛДГ соответствует норме. Снижение активности фермента в постинфарктном периоде происходит в 2 раза медленнее, чем нормализация таких маркеров поражения миокарда, как креатинкиназа и АСТ, что особенно ценно для поздней диагностики поражения.
Лактатдегидрогеназа (ЛДГ) общая: исследования в лаборатории KDLmed
Лактатдегидрогеназа (ЛДГ) общая – внутриклеточный гликолитический фермент, который участвует в обратимом превращении лактата в пируват и содержится в большинстве тканей организма.
Синонимы русские
Дегидрогеназа молочной кислоты.
Синонимы английские
Lactate dehydrogenase, Total, Lactic dehydrogenase, LDH, LD.
Метод исследования
УФ кинетический тест.
Единицы измерения
Ед/л (единица на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов до анализа.
- Исключить физическое и эмоциональное перенапряжение за 30 минут до исследования.
- Не курить в течение 30 минут до сдачи крови.
Общая информация об исследовании
Лактатдегидрогеназа (ЛДГ) – цинксодержащий внутриклеточный фермент, который катализирует окисление молочной кислоты в пируват и содержится практически во всех клетках организма. ЛДГ наиболее активна в скелетной мускулатуре, сердечной мышце, почках, печени и эритроцитах.
ЛДГ наиболее активна в скелетной мускулатуре, сердечной мышце, почках, печени и эритроцитах.
Существует пять разных форм (изоферментов) ЛДГ, которые отличаются молекулярной структурой и расположением в организме. От того, какая из пяти преобладает, зависит основной способ окисления глюкозы – аэробный (до CO2 и H2O) или анаэробный (до молочной кислоты). Подобное различие обусловлено разной степенью родства того или иного изофермента и пировиноградной кислоты. Для миокарда и мозговой ткани основной является ЛДГ-1, для эритроцитов, тромбоцитов, почечной ткани — ЛДГ-1 и ЛДГ-2. В лёгких, селезёнке, щитовидной и поджелудочной железах, надпочечниках, лимфоцитах преобладает ЛДГ-3. ЛДГ-4 находится во всех тканях с ЛДГ-3, а также в гранулоцитах, плаценте и мужских половых клетках, в которых содержится и ЛДГ-5. Изоферментная активность в скелетных мышцах (в порядке убывания): ЛДГ-5, ЛДГ-4, ЛДГ-3. Для печени наиболее характерен изофермент ЛДГ-5, меньшая активность у ЛДГ-4. В норме в сыворотке крови все фракции фермента определяются с небольшой активностью в составе суммарного показателя – общей ЛДГ. Их активность в крови распределяется следующим образом: ЛДГ-2 > ЛДГ-1 > ЛДГ-3 > ЛДГ-4 > ЛДГ-5.
В норме в сыворотке крови все фракции фермента определяются с небольшой активностью в составе суммарного показателя – общей ЛДГ. Их активность в крови распределяется следующим образом: ЛДГ-2 > ЛДГ-1 > ЛДГ-3 > ЛДГ-4 > ЛДГ-5.
При заболеваниях, сопровождающихся повреждением тканей и разрушением клеток, активность ЛДГ в крови повышается. В связи с этим она является важным маркером тканевой деструкции. Несмотря на то что увеличение активности фермента не указывает на какую-то определённую болезнь, его определение в комплексе с другими лабораторными анализами помогает в диагностике инфаркта лёгкого, мышечной дистрофии и гемолитической анемии. Повышенная активность ЛДГ может выявляться у новорождённых, беременных и после интенсивных физических нагрузок.
Ранее совместные анализы на ЛДГ, аспартатаминотрансферазу и креатинкиназу широко использовались в диагностике инфаркта миокарда. Сейчас для этой цели определяют уровень тропонина как более специфического маркера повреждения сердечной мышцы.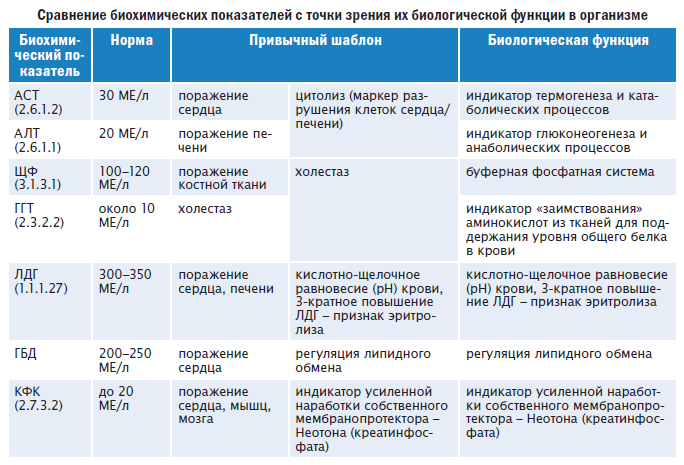 Но исследование активности ЛДГ остается вспомогательным анализом при дифференциальной диагностике болевого синдрома в грудной клетке. У больных стенокардией активность фермента не изменяется, но при инфаркте миокарда начинает возрастать через 8-10 часов с максимумом в первые 24-48 часов после сердечного приступа и возвращается к норме через 10-12 дней. Повышение ЛДГ при нормальной активности АСТ через 1-2 дня после боли в грудной клетке указывает на инфаркт лёгкого.
Но исследование активности ЛДГ остается вспомогательным анализом при дифференциальной диагностике болевого синдрома в грудной клетке. У больных стенокардией активность фермента не изменяется, но при инфаркте миокарда начинает возрастать через 8-10 часов с максимумом в первые 24-48 часов после сердечного приступа и возвращается к норме через 10-12 дней. Повышение ЛДГ при нормальной активности АСТ через 1-2 дня после боли в грудной клетке указывает на инфаркт лёгкого.
При дифференциальной диагностике миопатий данный анализ помогает уточнить патофизиологические механизмы заболевания. Так, при нарушении мышечной функции, связанной с нейрогенными заболеваниями, ЛДГ не повышается, но при повреждении мышц из-за эндокринных и метаболических патологий активность ЛДГ увеличивается.
Активность ЛДГ в крови может возрастать вследствие многих злокачественных новообразований, при эффективном лечении она снижается, что иногда применяют для динамического наблюдения за онкологическими больными.
Для чего используется исследование?
- Для диагностики острого или хронического повреждения тканей при комплексном обследовании пациента.
- Для дифференциальной диагностики заболеваний при резкой боли в грудной клетке (инфаркт миокарда, стенокардия, инфаркт лёгкого).
- Чтобы выявлять заболевания, сопровождающиеся гемолизом эритроцитов.
- В целях наблюдения за течением онкологических заболеваний при терапии.
- Для исследования патологий печени и почек.
- Для диагностики поражений мышечной ткани.
Когда назначается исследование?
- При подозрении на острое или хроническое повреждение ткани и клеток в организме.
- При комплексном профилактическом обследовании пациента.
- При наблюдении за течением некоторых хронических заболеваний (мышечной дистрофии, гемолитических анемий, заболеваний печени, почек), онкологической патологии.
Что означают результаты?
Референсные значения
Возраст, пол | Референсные значения | |
1 — 3 года | ||
3 — 6 лет | ||
6 — 12 лет | ||
12 — 17 лет | ||
> 17 лет | женский | 135 — 214 Ед/л |
мужской | 135 — 225 Ед/л | |
Причины повышения активности лактатдегидрогеназы общей:
- инфаркт миокарда,
- лёгочная эмболия и инфаркт лёгкого,
- заболевания крови, сопровождающиеся гемолизом (гемолитическая, пернициозная, мегалобластическая, серповидно-клеточная анемии, эритремия),
- злокачественные новообразования различных локализаций (рак яичек, рак печени, лимфома, метастазы в костную ткань и печень и т.
 д.),
д.), - лейкозы,
- патология печени (вирусные и токсические гепатиты, цирроз печени, обтурационная желтуха, алкогольная болезнь печени),
- болезни почек (инфаркт почки, гломерулонефрит, пиелонефрит),
- патология мышц (мышечная дистрофия, травма, атрофия),
- переломы костей,
- застойная сердечная недостаточность, острая коронарная недостаточность (без инфаркта), миокардит (умеренное повышение фермента),
- инфекционный мононуклеоз,
- инфаркт кишечника,
- острый панкреатит,
- инсульт,
- судорожный припадок,
- белая горячка,
- эклампсия,
- травматический шок,
- тяжёлые состояния, сопровождающиеся гипоксией, гипер- и гипотермией,
- ожоговая болезнь,
- пневмоцистная пневмония,
- преждевременная отслойка плаценты,
- гипотиреоз.
Что может влиять на результат?
К повышению результата могут приводить:
- гемолиз эритроцитов в пробе крови (в связи с высокой активностью ЛДГ в клетках крови),
- интенсивные физические нагрузки незадолго до исследования,
- наличие у пациента протезированного клапана сердца (гемолиз эритроцитов вследствие повреждения клеток створками клапана),
- применение электроимпульсной терапии незадолго до исследования,
- гемодиализ (в связи с удалением ингибиторов фермента – мочевины во время процедуры),
- большое количество тромбоцитов (тромбоцитоз),
- некоторые заболевания кожи,
- лекарственные средства, повышающие активность ЛДГ (анестетики, аспирин, вазопрессин, вальпроевая кислота, наркотики, прокаинамид, этанол, амиодарон, анаболические стероиды, верапамил, изотретиноин, каптоприл, хлорамфеникол, кодеин, дапсон, дилтиазем, интерферон-альфа, интерлейкин-2, некоторые антибактериальные и противогрибковые препараты, неспецифические противовоспалительные препараты, пеницилламин, стрептокиназа, тиопентал, фуросемид, метотрексат, сульфасалазин, симвастатин, такролимус).

Возможные причины снижения результата:
- присутствие оксалатов и мочевины, ингибирующих фермент,
- лекарственные средства, снижающие активность ЛДГ (амикацин, аскорбиновая кислота, гидроксимочевина, дофибрат, эналаприл, метронидазол, налтрексон, противосудорожные препараты, цефотаксим).
Важные замечания
- Ввиду неспецифичности данного анализа его результат должен трактоваться с учётом показателей других лабораторных исследований и клинической картины заболевания.
- В диагностике острых процессов, сопровождающихся деструкцией ткани (инфаркта, некроза), необходимо учитывать изменения активности ЛДГ в плазме в течение некоторого времени после острого эпизода болезни.
- Определение изоферментов ЛДГ помогает уточнить локализацию патологического процесса.
- Основным лабораторным маркером инфаркта миокарда является тропонин I, а не ЛДГ.
Также рекомендуется
Кто назначает исследование?
Терапевт, кардиолог, онколог, врач общей практики.
Литература
- Назаренко Г.И., Кишкун А. Клиническая оценка результатов лабораторных исследований. – М.: Медицина, 2000. — 165-166.
- Fischbach F.T., Dunning M.B. A Manual of Laboratory and Diagnostic Tests, 8th Ed. Lippincott Williams & Wilkins, 2008: 1344 p.
- Wilson D. McGraw-Hill Manual of Laboratory and Diagnostic Tests 1st Ed Normal, Illinois, 2007: 347-348 pp.
Лактатдегидрогеназа (ЛДГ) — понимание теста и ваших результатов
Источники, использованные в текущем обзоре
Лактатдегидрогеназа (LD), сыворотка. Медицинские лаборатории Мэйо. Доступно на сайте https://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/8344. Доступ 13 июня 2018 г.
Лактатдегидрогеназа (ЛД), Жидкость организма. Медицинские лаборатории Мэйо. Доступно на сайте https://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/8022.Доступ 13 июня 2018 г.
Дегидрогеназа молочной кислоты (кровь).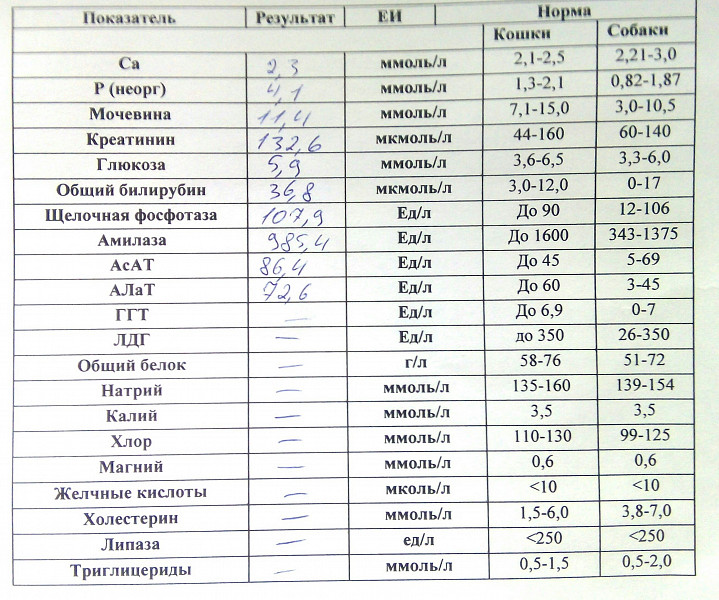 Медицинский центр Университета Рочестера. Доступно в Интернете по адресу https://www.urmc.rochester.edu/encyclopedia/content.aspx?contenttypeid=167&contentid=lactic_acid_dehydrogenase_blood. Доступ 13.06.18.
Медицинский центр Университета Рочестера. Доступно в Интернете по адресу https://www.urmc.rochester.edu/encyclopedia/content.aspx?contenttypeid=167&contentid=lactic_acid_dehydrogenase_blood. Доступ 13.06.18.
Источники, использованные в предыдущих обзорах
Томас, Клейтон Л., редактор (1997). Циклопедический медицинский словарь Табера. Компания F.A. Davis, Филадельфия, Пенсильвания [18-е издание].
Пагана, Кэтлин Д.И Пагана, Тимоти Дж. (2001). Справочник по диагностическим и лабораторным испытаниям Мосби, 5-е издание: Mosby, Inc., Сент-Луис, Миссури.
Лактатдегидрогеназа. Руководство ARUP по клиническому лабораторному тестированию [он-лайн информация]. Доступно в Интернете по адресу http://www.aruplab.com/guides/clt/tests/clt_a32b.htm#1140532.
(25 октября 2002 г., обновлено). Изоферменты ЛДГ. Информация о здоровье MedlinePlus [онлайн-информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003499. htm.
htm.
(20 ноября 2001 г., обновлено). LDH. Информация о здоровье MedlinePlus [онлайн-информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003471.htm.
Spengler, R. (14 мая 2002 г., обновлено). Что такое лактатдегидрогеназа (ЛДГ)? Больница Св. Иосифа, Библиотека здоровья, Медицинские тесты [Он-лайн информация]. Доступно в Интернете по адресу http://www.sjo.org/library/healthguide/MedicalTests/topic.asp?hwid=tv6793abc.
Мартин, Г. (9 марта 1998 г.). Устаревание тестирования лактатдегидрогеназы.Американская медицинская ассоциация, Архивы внутренней медицины, переписка редактора, Vol. 158 № 5 [Он-лайн информация]. Доступно в Интернете по адресу http://archinte.ama-assn.org/issues/v158n5/ffull/ilt0309-4.html.
Spengler, R. (14 мая 2002 г., обновлено). Исследования сердечных ферментов. WebMD [Он-лайн информация]. Доступно в Интернете по адресу http://my.webmd.com/printing/article/1675.55521.
Тест на изоферменты лактатдегидрогеназы. Hendrick Health System, Библиотека медицинской информации AccessMed [онлайн-информация].Доступно в Интернете по адресу http://www.hendrickhealth.org/healthy/00054240.html.
Hendrick Health System, Библиотека медицинской информации AccessMed [онлайн-информация].Доступно в Интернете по адресу http://www.hendrickhealth.org/healthy/00054240.html.
Тест на лактатдегидрогеназу. Hendrick Health System, Библиотека медицинской информации AccessMed [онлайн-информация]. Доступно в Интернете по адресу http://www.hendrickhealth.org/healthy/00054250.html.
Пагана, Кэтлин Д. и Пагана, Тимоти Дж. (© 2007). Справочник по диагностическим и лабораторным испытаниям Мосби, 8-е издание: Mosby, Inc., Сент-Луис, Миссури. С. 581-582.
Кларк В. и Дюфур Д. Р., редакторы (2006).Современная практика в клинической химии, AACC Press, Вашингтон, округ Колумбия. Глава 23 Лабораторная диагностика заболеваний печени, стр. 269 — 279.
Ву, А. (2006). Клиническое руководство по лабораторным испытаниям Тиц, четвертое издание. Сондерс Эльзевир, Сент-Луис, Миссури. Стр. 652.
(13 марта 2007 г., обновлено). LDH. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003471.htm. Доступно 9.07.07.
Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003471.htm. Доступно 9.07.07.
Форвик, Л.и Зиев, Д. (Обновлено 14 марта 2009 г.). Изоферменты ЛДГ. Медицинская энциклопедия MedlinePlus [Электронная информация] Доступна на сайте http://www.nlm.nih.gov/medlineplus/ency/article/003499.htm. По состоянию на октябрь 2010 г.
Форвик, Л. и Зиев, Д. (Обновлено 21 марта 2010 г.). Тест на лактатдегидрогеназу. Медицинская энциклопедия MedlinePlus [Электронная информация] Доступна на сайте http://www.nlm.nih.gov/medlineplus/ency/article/003471.htm. По состоянию на октябрь 2010 г.
Шаффер, Э. (отредактировано в июне 2009 г.).Тестирование на заболевания печени и желчевыводящих путей, лабораторные анализы. Пособие Merck для специалистов здравоохранения [Электронная информация] Доступно на сайте http://www.merck.com/mmpe/sec03/ch023/ch023b.html. По состоянию на октябрь 2010 г.
(© 1995-2010). Код единицы 8344: Лактатдегидрогеназа (ЛД), сыворотка.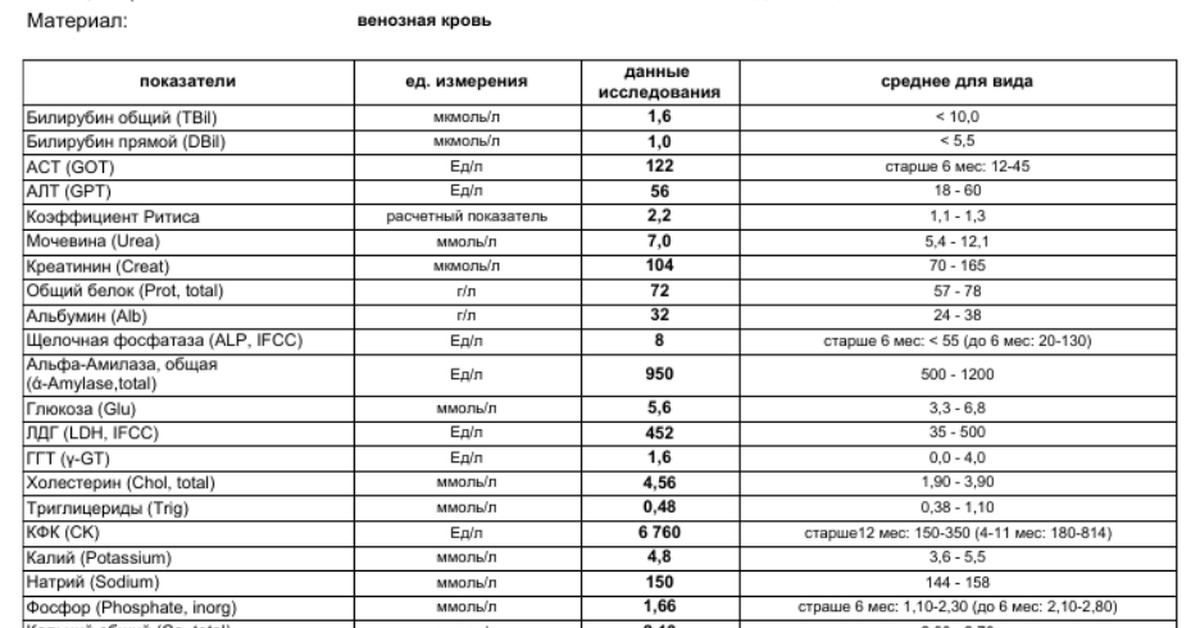 Клиника Мэйо, Медицинские лаборатории Мэйо [Информация в режиме онлайн] Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Overview/8344. По состоянию на октябрь 2010 г.
Клиника Мэйо, Медицинские лаборатории Мэйо [Информация в режиме онлайн] Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Overview/8344. По состоянию на октябрь 2010 г.
Анализ крови: лактатдегидрогеназа (ЛДГ).KidsHealth от Nemours Foundation [Информация в Интернете] Доступно в Интернете по адресу http://kidshealth.org/parent/system/medical/test_ldh.html. По состоянию на октябрь 2010 г.
Пагана, К. Д. и Пагана, Т. Дж. (© 2007). Справочник по диагностическим и лабораторным испытаниям Мосби, 8-е издание: Mosby, Inc., Сент-Луис, Миссури. С. 581-583.
Ву, А. (© 2006). Клиническое руководство Tietz по лабораторным испытаниям, 4-е издание: Saunders Elsevier, Сент-Луис, Миссури. С. 648-651.
Тиц Учебник клинической химии и молекулярной диагностики.Burtis CA, Ashwood ER, Bruns DE, ред. Сент-Луис: Эльзевьер Сондерс; 2006, стр. 601-602.
Национальный институт рака. Онкомаркеры. Доступно в Интернете по адресу http://www. cancer.gov/cancertopics/factsheet/Detection/tumor-markers. По состоянию на октябрь 2013 г.
cancer.gov/cancertopics/factsheet/Detection/tumor-markers. По состоянию на октябрь 2013 г.
Американское онкологическое общество. Специфические онкомаркеры. Доступно в Интернете по адресу http://www.cancer.org/treatment/understandingyourdiagnosis/examsandtestdescriptions/tumormarkers/tumor-markers-specific-markers. По состоянию на октябрь 2013 г.
KidsHealth.Анализ крови: лактатдегидрогеназа (ЛДГ). Доступно в Интернете по адресу http://kidshealth.org/parent/system/medical/test_ldh.html. По состоянию на октябрь 2013 г.
Национальный институт рака. Лечение рака яичек (PDQ®). Доступно в Интернете по адресу http://www.cancer.gov/cancertopics/pdq/treatment/testicular/HealthProfessional/page1#Section_562. По состоянию на октябрь 2013 г.
Герстен, Т. (Обновлено 8 февраля 2012 г.). Тест на лактатдегидрогеназу. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http: // www.nlm.nih.gov/medlineplus/ency/article/003471. htm. По состоянию на июль 2014 г.
htm. По состоянию на июль 2014 г.
(© 1995–2014) Лактатдегидрогеназа (LD), сыворотка. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Overview/8344. По состоянию на июль 2014 г.
Дагдейл, Д. (Обновлено 26 января 2013 г.). Изоферменты ЛДГ. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003499.htm. По состоянию на июль 2014 г.
Гарднер Т. и Берк Б. (Обновлено 3 сентября 2013 г.). Острый панкреатит. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/181364-overview. По состоянию на июль 2014 г.
(обновлено 3 июня 2013 г.). Острый перикардит. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/156951-overview. По состоянию на июль 2014 г.
Dowshen, S. (проверено в марте 2011 г.). Анализ крови: лактатдегидрогеназа (ЛДГ).KidsHealth от Nemours [Он-лайн информация]. Доступно в Интернете по адресу http://kidshealth.org/parent/system/medical/test_ldh.html. По состоянию на июль 2014 г.
(проверено в марте 2011 г.). Анализ крови: лактатдегидрогеназа (ЛДГ).KidsHealth от Nemours [Он-лайн информация]. Доступно в Интернете по адресу http://kidshealth.org/parent/system/medical/test_ldh.html. По состоянию на июль 2014 г.
Пагана, К. Д. и Пагана, Т. Дж. (© 2011). Справочник по диагностическим и лабораторным испытаниям Мосби, 10-е издание: Mosby, Inc., Сент-Луис, Миссури. С. 603-605.
Кларк У., редактор (© 2011). Современная практика клинической химии, 2-е издание: AACC Press, Вашингтон, округ Колумбия. Стр. 313.
Макферсон Р. и Пинкус М. (© 2011).Клиническая диагностика и лечение Генри с помощью лабораторных методов 22-е издание: Elsevier Saunders, Филадельфия, Пенсильвания. С. 292-294.
Strimel, W. (Обновлено 27 апреля 2014 г.). Выпот в перикарде. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/157325-overview. По состоянию на июль 2014 г.
Рубин Дж. (Обновлено 18 ноября 2013 г. ). Плевральный выпот. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/299959-overview.По состоянию на июль 2014 г.
). Плевральный выпот. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/299959-overview.По состоянию на июль 2014 г.
Тест на лактатдегидрогеназу (ЛДГ): цель, процедура, риски, результаты
Тест на лактатдегидрогеназу (ЛДГ) выявляет признаки повреждения тканей организма.
ЛДГ — это фермент, который содержится почти в каждой клетке вашего тела, включая кровь, мышцы, мозг, почки и поджелудочную железу.
Фермент превращает сахар в энергию. Тест на ЛДГ измеряет количество ЛДГ в крови или других жидкостях организма.
При повреждении или разрушении клеток этот фермент попадает в жидкую часть крови.Врачи называют это «сывороткой» или «плазмой». ЛДГ также может выделяться в другие жидкости организма, включая спинномозговую жидкость, которая окружает головной и спинной мозг.
Зачем мне нужен тест LDH?
Ваш врач может назначить его по любому количеству причин, например:
- Чтобы определить, есть ли у вас повреждение тканей, и если да, то сколько
- Для мониторинга тяжелых инфекций или состояний, таких как гемолитическая или мегалобластная анемия, заболевание почек, и заболевание печени
- Чтобы помочь оценить некоторые виды рака или ваше лечение рака
В зависимости от вашего состояния вы можете регулярно проходить тесты на ЛДГ.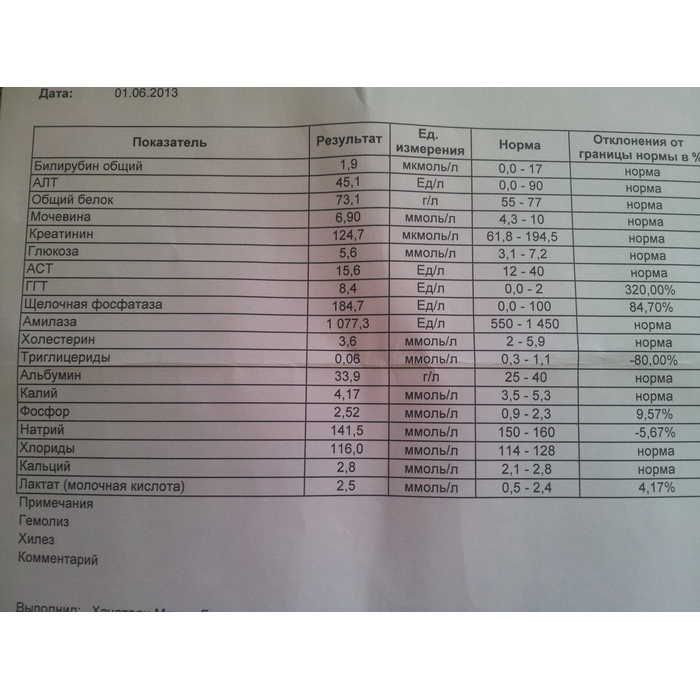
Вы можете пройти тест на ЛДГ биологических жидкостей, чтобы:
- Определить причину скопления жидкости. Это может быть связано с множеством причин, например с травмой или воспалением. (Это также может быть вызвано дисбалансом давления в кровеносных сосудах и количеством белка в крови.)
- Помогите определить, есть ли у вас бактериальный или вирусный менингит.
Что происходит во время теста?
Кровь берется через иглу, введенную в вену на руке.
Для исследования спинномозговой жидкости на ЛДГ вам понадобится люмбальная пункция (также называемая спинномозговой пункцией). Вам в поясницу вставят тонкую иглу.
Перед каждым тестом вы должны сообщить своему врачу обо всех лекарствах, добавках, травах, витаминах и обо всем, что вы принимаете.
Каковы риски или побочные эффекты?
Для анализа крови на ЛДГ они включают:
- Кровотечение
- Ушиб
- Инфекция
- Болезненность в месте взятия крови
Если вам сделали люмбальную пункцию, у вас могут возникнуть следующие побочные эффекты:
Что означают результаты?
Более высокий уровень ЛДГ в крови может быть признаком повреждения тканей или заболевания. Уровень ЛДГ в крови также может сообщить врачу, если ваше заболевание ухудшается или помогает ли ваше лечение.
Уровень ЛДГ в крови также может сообщить врачу, если ваше заболевание ухудшается или помогает ли ваше лечение.
Продолжение
Нормальные уровни ЛДГ в крови могут варьироваться в зависимости от лаборатории, но обычно колеблются от 140 единиц на литр (ЕД / л) до 280 Ед / л для взрослых и, как правило, выше для детей и подростков.
Продолжение
В спинномозговой жидкости нормальные уровни составляют:
- 70 Ед / л или ниже для новорожденных
- 40 Ед / л или ниже для взрослых
Более высокий уровень ЛДГ в спинномозговой жидкости может означать наличие инфекции или воспаление в центральной нервной системе.Это также может означать, что у вас заболевание головного или спинного мозга, например бактериальный менингит.
Если ваш уровень ЛДГ выше, чем обычно, ваш врач может назначить дополнительные тесты, чтобы определить место повреждения. Один из них смотрит на уровни ваших изоферментов ЛДГ. Это типы ЛДГ. Существует пять различных форм, от LD-1 до LD-5.
Каждый из пяти имеет тенденцию концентрироваться в определенных тканях тела. Например, LD-1 обычно находится в сердце, эритроцитах, почках, семенниках и яичниках.
Если у вас повышен уровень ЛДГ, ваш врач может также назначить тесты на АЛТ, АСТ или ЩФ. Они могут помочь с диагностикой или определить, какие органы поражены.
Продолжение
Повышенный уровень ЛДГ в крови не всегда свидетельствует о проблеме. Это могло быть результатом физических упражнений. Уровень также может быть высоким, если с образцом крови грубо обращаются в лаборатории или храниться при неправильной температуре. Иногда виноват прием слишком большого количества витамина С. Наконец, уровень ЛДГ в крови может быть высоким, если количество тромбоцитов выше нормы.
Уровни ЛДГ в пределах нормы или ниже нормы обычно не являются проблемой.
Биохимия, лактатдегидрогеназа — StatPearls
Введение
Лактатдегидрогеназа (ЛДГ) — важный фермент анаэробного метаболического пути. Он принадлежит к классу оксидоредуктаз с номером комиссии по ферментам EC 1.1.1.27. Функция фермента — катализировать обратимое превращение лактата в пируват с восстановлением НАД + до НАДН и наоборот.[1] Фермент присутствует в различных организмах, включая растения и животных. Он повсеместно присутствует во всех тканях и служит важной контрольной точкой глюконеогенеза и метаболизма ДНК. Видовой анализ ЛДГ демонстрирует его хорошо сохранившуюся структуру с небольшими изменениями аминокислотной последовательности у разных видов [2]. Структурное сходство с небольшими аминокислотными изменениями обеспечивает логическую платформу для создания функциональных молекул, модулирующих каталитический потенциал и экспрессию фермента.В этой статье мы сосредоточим наше внимание на биохимической функции, методах тестирования и клинической значимости фермента ЛДГ.
Он принадлежит к классу оксидоредуктаз с номером комиссии по ферментам EC 1.1.1.27. Функция фермента — катализировать обратимое превращение лактата в пируват с восстановлением НАД + до НАДН и наоборот.[1] Фермент присутствует в различных организмах, включая растения и животных. Он повсеместно присутствует во всех тканях и служит важной контрольной точкой глюконеогенеза и метаболизма ДНК. Видовой анализ ЛДГ демонстрирует его хорошо сохранившуюся структуру с небольшими изменениями аминокислотной последовательности у разных видов [2]. Структурное сходство с небольшими аминокислотными изменениями обеспечивает логическую платформу для создания функциональных молекул, модулирующих каталитический потенциал и экспрессию фермента.В этой статье мы сосредоточим наше внимание на биохимической функции, методах тестирования и клинической значимости фермента ЛДГ.
Проблемы, вызывающие озабоченность
Лактатдегидрогеназа — это фермент, который присутствует почти во всех тканях организма.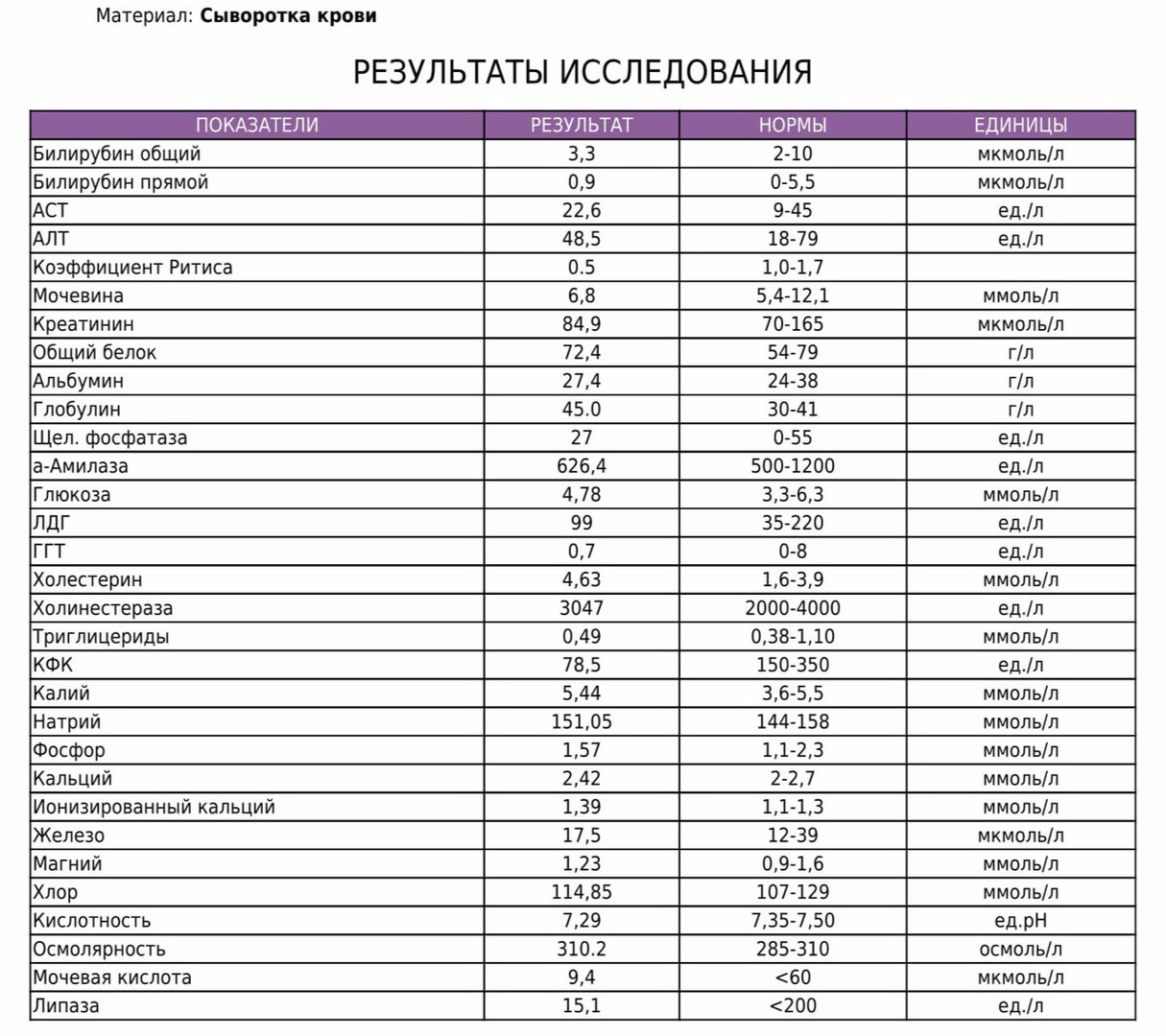 Состояния, которые могут вызвать повышение уровня ЛДГ в крови, могут включать заболевание печени, анемию, сердечный приступ, переломы костей, мышечные травмы, рак и инфекции, такие как энцефалит, менингит, энцефалит и ВИЧ. ЛДГ также является неспецифическим маркером тканевого обновления, который является нормальным метаболическим процессом.Многие виды рака вызывают общее повышение уровня ЛДГ или повышение одного из его изоферментов. Таким образом, это может быть неспецифический опухолевый маркер, не пригодный для идентификации типа рака. Поскольку ЛДГ неспецифичен и рутинные измерения изоферментов обычно недоступны в клинических лабораториях, измерения ЛДГ дают неполную информацию, и необходимы альтернативные тесты, такие как КФК для мышц, АЛТ для печени, тропонин при сердечных заболеваниях и т. Д.
Состояния, которые могут вызвать повышение уровня ЛДГ в крови, могут включать заболевание печени, анемию, сердечный приступ, переломы костей, мышечные травмы, рак и инфекции, такие как энцефалит, менингит, энцефалит и ВИЧ. ЛДГ также является неспецифическим маркером тканевого обновления, который является нормальным метаболическим процессом.Многие виды рака вызывают общее повышение уровня ЛДГ или повышение одного из его изоферментов. Таким образом, это может быть неспецифический опухолевый маркер, не пригодный для идентификации типа рака. Поскольку ЛДГ неспецифичен и рутинные измерения изоферментов обычно недоступны в клинических лабораториях, измерения ЛДГ дают неполную информацию, и необходимы альтернативные тесты, такие как КФК для мышц, АЛТ для печени, тропонин при сердечных заболеваниях и т. Д.
Кроме того, на активность ЛДГ влияет гемолиз образца крови.Поскольку эритроциты содержат собственный белок ЛДГ, гемолиз вызывает артефактное увеличение, приводящее к ложноположительным высоким результатам. Кроме того, любой клеточный некроз может привести к повышению концентрации в сыворотке, а его повсеместное распространение по тканям серьезно затрудняет его более широкое клиническое применение в качестве биомаркера.
Кроме того, любой клеточный некроз может привести к повышению концентрации в сыворотке, а его повсеместное распространение по тканям серьезно затрудняет его более широкое клиническое применение в качестве биомаркера.
Cellular
LDH — это цитоплазматический фермент, который присутствует почти во всех тканях, но в высоких концентрациях в мышцах, печени и почках. Эритроциты также содержат умеренные концентрации этого фермента.LDH имеет пять изомерных форм, собранных в тетрамеры любого из двух типов субъединиц, а именно мышечной (M) и сердечной (H). Изоформы, называемые изоферментами, называются от LDH-1 до LDH-5, каждая из которых демонстрирует дифференциальную экспрессию в различных тканях. [3] Эта дифференциальная экспрессия ЛДГ является основой его важности как клинического диагностического маркера. Изофермент LDH-1 состоит из четырех субъединиц сердца (4H) и является основным изозимом, присутствующим в ткани сердца. Изофермент ЛДГ-2 состоит из трех сердечных и одной мышечной субъединиц (3h2M) и является основным изоферментом ретикулоэндотелиальной системы и эритроцитов. Изофермент ЛДГ-3 состоит из двух сердечных и двух мышечных субъединиц (2h3M) и является основным изоферментом легких. Изофермент ЛДГ-4 имеет одну сердечную и три мышечных субъединицы (1h4M) и является основным изоферментом, присутствующим в почках. Изофермент ЛДГ-5 состоит из четырех мышечных субъединиц (4М) и имеет значительную экспрессию в печени и скелетных мышцах. [4] [5] Эти пять изоформ, хотя и катализируют одну и ту же общую реакцию, различаются по их сродству к субстрату, концентрации ингибирования, изоэлектрической точке и электрофоретической подвижности.Эти пять изоформ можно визуализировать в активном состоянии с помощью зимографии ЛДГ.
Изофермент ЛДГ-3 состоит из двух сердечных и двух мышечных субъединиц (2h3M) и является основным изоферментом легких. Изофермент ЛДГ-4 имеет одну сердечную и три мышечных субъединицы (1h4M) и является основным изоферментом, присутствующим в почках. Изофермент ЛДГ-5 состоит из четырех мышечных субъединиц (4М) и имеет значительную экспрессию в печени и скелетных мышцах. [4] [5] Эти пять изоформ, хотя и катализируют одну и ту же общую реакцию, различаются по их сродству к субстрату, концентрации ингибирования, изоэлектрической точке и электрофоретической подвижности.Эти пять изоформ можно визуализировать в активном состоянии с помощью зимографии ЛДГ.
Хотя ЛДГ является преимущественно цитоплазматическим ферментом, его митохондриальное присутствие также продемонстрировано различными исследованиями. Присутствие митохондриальной L-лактатдегидрогеназы (мл-ЛДГ) было подтверждено у дрожжей, растений и животных. [6] L-лактат, который является субстратом для мл-ЛДГ, транспортируется в митохондрии через симпортер L-лактат / H и антипортеры L-лактат / пируват и L-лактат / оксалоацетат. Впоследствии мл-ЛДГ способствует окислению L-лактата до пирувата в митохондриальном матриксе. [7] Многие раковые клетки перепрограммируют митохондриальные процессы, чтобы удовлетворить свои более высокие потребности в энергии. В раковых клетках усиливается гликолиз, и, следовательно, мл-ЛДГ может играть роль в ускорении окислительного фосфорилирования. [8]
Впоследствии мл-ЛДГ способствует окислению L-лактата до пирувата в митохондриальном матриксе. [7] Многие раковые клетки перепрограммируют митохондриальные процессы, чтобы удовлетворить свои более высокие потребности в энергии. В раковых клетках усиливается гликолиз, и, следовательно, мл-ЛДГ может играть роль в ускорении окислительного фосфорилирования. [8]
Молекулярный
Гены, кодирующие ЛДГ: LDHA , LDHB , LDHC, и LDHD . LDHA, LDHB и LDHC кодируют L-изомеры фермента, тогда как LDHD кодирует D-изомер.L-изомеры используют и продуцируют L-лактат, который является основной энантиомерной формой лактата, присутствующей у позвоночных. Ген, кодирующий форму LDHA фермента, расположен на хромосоме 11p15.4 и транскрибируется в белок из 332 аминокислот. Ген LDHB расположен на хромосоме 12p12.1 и кодирует белок из 334 аминокислот. Изоферменты ферментов лактатдегидрогеназы, от LDH-1 до LDH-5, являются продуктами трансляции двух генов LDHA и LDHB [9]. Эти два гена предоставляют инструкции по созданию субъединиц лактатдегидрогеназы-A и лактатдегидрогеназы-B фермента лактатдегидрогеназы. Существует пять различных форм ЛДГ, каждая из которых состоит из четырех субъединиц. Различные комбинации белковых продуктов субъединиц лактатдегидрогеназы-A и субъединиц лактатдегидрогеназы-B, продуцируемых разными генами) составляют различные формы фермента. [4]
Эти два гена предоставляют инструкции по созданию субъединиц лактатдегидрогеназы-A и лактатдегидрогеназы-B фермента лактатдегидрогеназы. Существует пять различных форм ЛДГ, каждая из которых состоит из четырех субъединиц. Различные комбинации белковых продуктов субъединиц лактатдегидрогеназы-A и субъединиц лактатдегидрогеназы-B, продуцируемых разными генами) составляют различные формы фермента. [4]
В систему млекопитающих еще две субъединицы, LDHC и LDHBx, также включены с образованием тетрамера LDH.Ген LDHC кодирует белок LDHC, специфичный для семенников, а ген LDHBx кодирует белок LDHBx, специфичный для пероксисомы. [10] LDHBx — это сквозная форма гена LDHB. LDHBx генерируется путем трансляции мРНК LDHB, где стоп-кодон читается как кодирующий аминокислоту. Следовательно, трансляция переходит к следующему стоп-кодону, который добавляет семь аминокислотных остатков, кодирующих сигнал пероксисомного нацеливания, к нормальному белку LDH-H, так что LDHBx импортируется в пероксисому.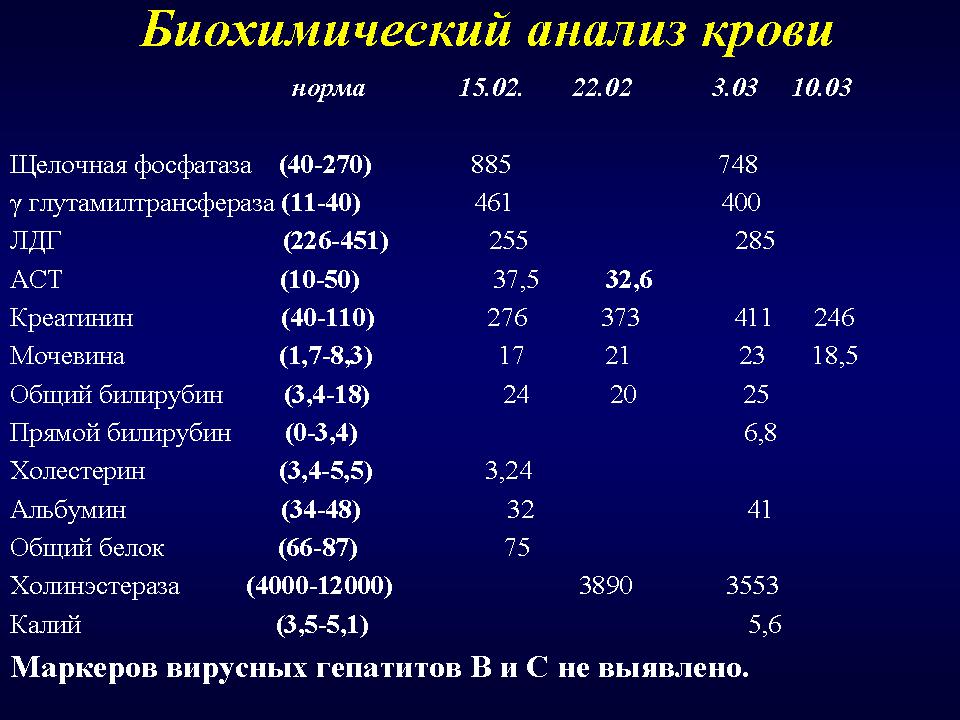 [11] Вторичная структура ЛДГ состоит из 40% альфа-спиралей и 23% бета-листов; это делает ЛДГ смешанным бета-альфа-бета с параллельными бета-слоями в качестве основного компонента структуры белка. [12]
[11] Вторичная структура ЛДГ состоит из 40% альфа-спиралей и 23% бета-листов; это делает ЛДГ смешанным бета-альфа-бета с параллельными бета-слоями в качестве основного компонента структуры белка. [12]
Активный центр фермента расположен в его субстрат-связывающем кармане и содержит каталитически важные His-193, а также Asp-168, Arg-171, Thr-246 и Arg-106. His-193 — это активные аминокислоты, присутствующие в активном центре человека, а также других видов животного мира.Все изоферменты ЛДГ структурно очень похожи; однако каждый из них обладает различными кинетическими свойствами, возникающими из-за различий в заряженных аминокислотах, фланкирующих активный сайт [2] [13].
Две разные субъединицы LDH (субъединица M и субъединица H LDH) поддерживают одинаковую структуру активного сайта и аминокислоты, которые участвуют в реакции. В третичной структуре аланин М-цепи заменен глутамином в Н-цепи. Аланин — это неполярная аминокислота с небольшой молекулярной массой, а глутамин — положительно заряженная аминокислота. Этот химический состав обеспечивает разные биохимические свойства двух субъединиц. Следовательно, субъединица H может связываться быстрее, но имеет пятикратное снижение каталитической активности по сравнению с субъединицей M. Субъединица LDHA несет чистый заряд -6 и проявляет более высокое сродство к пирувату, таким образом превращая пируват в лактат и NADH в NAD +. С другой стороны, LDHB имеет чистый заряд +1 и демонстрирует более высокое сродство к лактату, что приводит к преимущественному превращению лактата в пируват и NAD + в NADH.[4]
Этот химический состав обеспечивает разные биохимические свойства двух субъединиц. Следовательно, субъединица H может связываться быстрее, но имеет пятикратное снижение каталитической активности по сравнению с субъединицей M. Субъединица LDHA несет чистый заряд -6 и проявляет более высокое сродство к пирувату, таким образом превращая пируват в лактат и NADH в NAD +. С другой стороны, LDHB имеет чистый заряд +1 и демонстрирует более высокое сродство к лактату, что приводит к преимущественному превращению лактата в пируват и NAD + в NADH.[4]
ЛДГ необходим для поддержания гомеостаза при недостатке кислорода. Уровень кислорода в мышечных тканях быстро падает после тяжелых упражнений. Поскольку кислород обычно является конечным акцептором электронов в цепи переноса электронов (ETC), цепь останавливается вместе с АТФ-синтазой. Тем не менее, мышечные клетки продолжают функционировать, создавая АТФ через NAD +. ЛДГ производит молочную кислоту в качестве конечного продукта в результате реакции ферментации.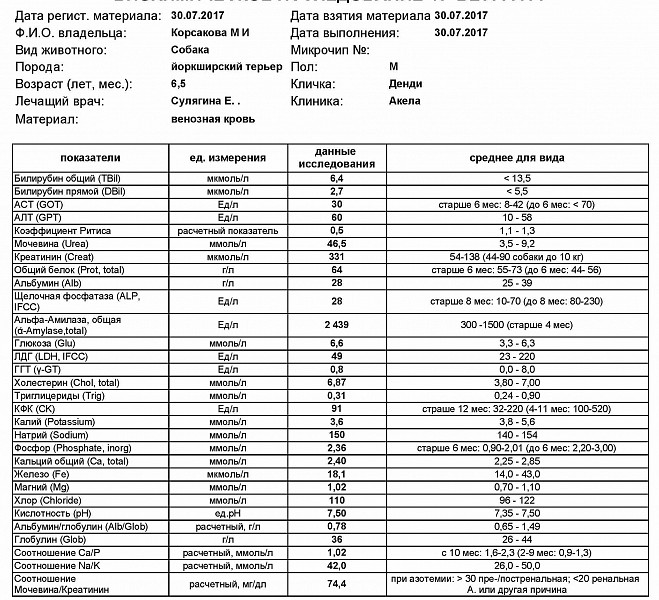 В процессе LDH удаляет электроны из NADH и производит NAD +, который направляется в путь гликолиза для создания АТФ.[1] Хотя этот процесс создает меньше АТФ по сравнению с ETC, он позволяет клетке выполнять свои физиологические и биохимические функции в отсутствие кислорода.
В процессе LDH удаляет электроны из NADH и производит NAD +, который направляется в путь гликолиза для создания АТФ.[1] Хотя этот процесс создает меньше АТФ по сравнению с ETC, он позволяет клетке выполнять свои физиологические и биохимические функции в отсутствие кислорода.
Функция
Лактатдегидрогеназа — один из ферментов, переносящих H (оксидоредуктаза), который катализирует обратимое превращение пирувата в лактат с использованием НАДН. По сути, фермент участвует в анаэробном метаболизме глюкозы, когда кислород отсутствует или в ограниченном количестве. [14]
Когда клетки подвергаются анаэробным или гипоксическим условиям, производство АТФ путем окислительного фосфорилирования нарушается.Этот процесс требует, чтобы клетки производили энергию посредством альтернативного метаболизма. Следовательно, LDH активируется в таких условиях, чтобы удовлетворить потребность в производстве энергии. Однако лактат, образующийся во время анаэробного преобразования глюкозы, заходит в тупик в метаболизме. Он не может подвергаться дальнейшему метаболизму ни в одной ткани, кроме печени. Следовательно, лактат высвобождается в кровь и транспортируется в печень, где ЛДГ выполняет обратную реакцию превращения лактата в пируват через цикл Кори. [6]
Он не может подвергаться дальнейшему метаболизму ни в одной ткани, кроме печени. Следовательно, лактат высвобождается в кровь и транспортируется в печень, где ЛДГ выполняет обратную реакцию превращения лактата в пируват через цикл Кори. [6]
Во время тренировки, когда мышцы истощают кислород, пируват превращается в молочную кислоту под действием фермента лактатдегидрогеназы.В эритроцитах пируват также не метаболизируется в дальнейшем из-за отсутствия митохондрий, но остается в цитоплазме, в конечном итоге превращаясь в лактат. В этой реакции НАДН окисляется до НАД +. Наличие высоких внутриклеточных концентраций НАД необходимо для проведения подготовительной фазы гликолиза. Чистое производство АТФ при анаэробном гликолизе составляет всего 2 АТФ на молекулу глюкозы по сравнению с окислительным фосфорилированием, которое производит 36 АТФ на молекулу глюкозы. ЛДГ может также катализировать дегидрирование 2-гидроксибутирата, но он является менее предпочтительным субстратом для ЛДГ, чем лактат. [14]
[14]
Субъединичный состав фермента ЛДГ (субъединицы H и M) варьируется в зависимости от ткани (упоминалось ранее в разделе «Клетка»). Это изменение связано с различием в скорости метаболизма, потребностях в энергии и функциях тканей, что отражается в их соотношении LDHA: LDHB. Почти 40% лактата в кровотоке высвобождается из скелетных мышц. Этот лактат дополнительно абсорбируется в основном печенью и почками, где он подвергается окислению для синтеза глюкозы.В головном мозге около 10% лактата окисляется для обеспечения 8% потребностей мозга в энергии в состоянии покоя, а оставшийся лактат выделяется в кровоток. [14] [15] Однако гиперлактатемия и физические нагрузки могут привести к поглощению лактата, который поддерживает 60% метаболизма мозга, а вклад церебрального окисления лактата составляет лишь до 33%.
В раковых клетках функция ЛДГ, в частности ЛДГА, модифицирована по сравнению с нормальными клетками. Раковые клетки используют ЛДГ для увеличения своего аэробного метаболизма (гликолиза и выработки АТФ, а также выработки лактата) даже в присутствии кислорода. Этот процесс известен как эффект Варбурга. Аномальные раковые клетки выигрывают от перехода на анаэробный метаболический фенотип, избегая создания окислительного стресса ETC. Кроме того, раковые клетки также получают доступ к промежуточным продуктам метаболизма цикла трикарбоновых кислот, вырабатываемым глюкозой и пируватом, для синтеза липидов и нуклеиновой кислоты для быстрой пролиферации клеток. [16] [17]
Этот процесс известен как эффект Варбурга. Аномальные раковые клетки выигрывают от перехода на анаэробный метаболический фенотип, избегая создания окислительного стресса ETC. Кроме того, раковые клетки также получают доступ к промежуточным продуктам метаболизма цикла трикарбоновых кислот, вырабатываемым глюкозой и пируватом, для синтеза липидов и нуклеиновой кислоты для быстрой пролиферации клеток. [16] [17]
Механизм
LDH катализирует синхронизированное взаимное преобразование пирувата в лактат и NADH в NAD + и увеличивает скорость реакции в 14 раз.Химическая реакция протекает путем переноса иона гидрида от НАДН к пирувату на его атоме углерода С2. Молекулярный механизм включает связывание НАДН с ферментами в качестве первого шага. В этом связывании участвуют многие остатки в активном сайте. Когда НАДН связывается, он способствует связыванию лактата за счет взаимодействия между кольцом НАДН и остатками ЛДГ. Перенос гидрида быстро происходит в обоих направлениях, образуя два третичных комплекса, а именно, LDH-NAD + -лактат и LDH-NADH-пируват. [18] Впоследствии пируват сначала отделяется от фермента, а затем высвобождается НАД +. Скорость диссоциации NADH и NAD + оказывается лимитирующей стадией в этой реакции, и конечное превращение пирувата в лактат, приводящее к регенерации NAD +, термодинамически благоприятно для реакции. [19]
[18] Впоследствии пируват сначала отделяется от фермента, а затем высвобождается НАД +. Скорость диссоциации NADH и NAD + оказывается лимитирующей стадией в этой реакции, и конечное превращение пирувата в лактат, приводящее к регенерации NAD +, термодинамически благоприятно для реакции. [19]
Регулирование фермента: Активность ЛДГ зависит от метаболического переключения на анаэробное дыхание. LDH регулируется тремя типами регуляторов, а именно аллостерической модуляцией, регуляцией на уровне субстрата и регуляцией транскрипции.Относительная доступность и концентрация субстратов регулируют активность ЛДГ. Фермент становится более активным во время экстремальной мышечной активности, когда увеличивается количество субстратов. Спрос на АТФ по сравнению с аэробным предложением АТФ вызывает накопление АДФ, АМФ и Pi. Гликолитический поток приводит к выработке пирувата, который превышает метаболическую способность пируватдегидрогеназы и других ферментов-челноков, которые метаболизируют пируват. Этот процесс направляет поток пирувата и НАД + через ЛДГ с последующим образованием лактата и НАДН.[20]
Этот процесс направляет поток пирувата и НАД + через ЛДГ с последующим образованием лактата и НАДН.[20]
В условиях повышенного отношения НАДН / НАД +, как это обычно бывает у пьющих людей, высокие концентрации этанола приводят к выработке высоких концентраций лактата и НАДН и, таким образом, к истощению НАД +. Эта реакция впоследствии приводит к превращению пирувата в лактат, связанному с регенерацией NAD +. Таким образом, высокое соотношение НАДН / НАД + сдвигает равновесие ЛДГ в сторону лактата. [20]
Тестирование
Анализы ЛДГ могут измерять количество ЛДГ, присутствующего в сыворотке, которая просочилась из тканей при повреждении.Каталитические свойства ЛДГ, приводящие к обратимому окислению L-лактата до пирувата, опосредованному акцептором водорода, НАД +, используются в качестве основы для измерения активности ЛДГ. Клинико-диагностические лаборатории оценивают скорость продукции НАДН, которая изменяет оптическую плотность образца, измеренную спектрофотометрически при длине волны 340 нм. Превращение пирувата в лактат или обратная реакция окисления L-лактата в пируват можно контролировать спектрофотометрически. Активность ЛДГ измеряется в различных образцах, таких как плазма, сыворотка, ткань, клетки и в культуральной среде для исследовательских целей.При использовании сыворотки и плазмы в качестве образцов требуется осторожное обращение, поскольку гемолиз может вызвать артефактное повышение уровня фермента из-за его высвобождения из разорванных эритроцитов.
Превращение пирувата в лактат или обратная реакция окисления L-лактата в пируват можно контролировать спектрофотометрически. Активность ЛДГ измеряется в различных образцах, таких как плазма, сыворотка, ткань, клетки и в культуральной среде для исследовательских целей.При использовании сыворотки и плазмы в качестве образцов требуется осторожное обращение, поскольку гемолиз может вызвать артефактное повышение уровня фермента из-за его высвобождения из разорванных эритроцитов.
Обычно нормальный диапазон ЛДГ составляет от 140 до 280 Ед / л. Однако клиническая интерпретация зависит от признаков и симптомов пациента. Сыворотка обычно имеет более высокий уровень ЛДГ по сравнению с плазмой из-за высвобождения ЛДГ во время свертывания. Активность ЛДГ также увеличивается во время физических упражнений, вырабатывая молочную кислоту в нормальных физиологических условиях.[21] На определение ЛДГ влияют лекарства и лекарства, которые могут помешать точному тестированию на ЛДГ. Присутствие высоких концентраций витамина C может привести к снижению уровня ЛДГ.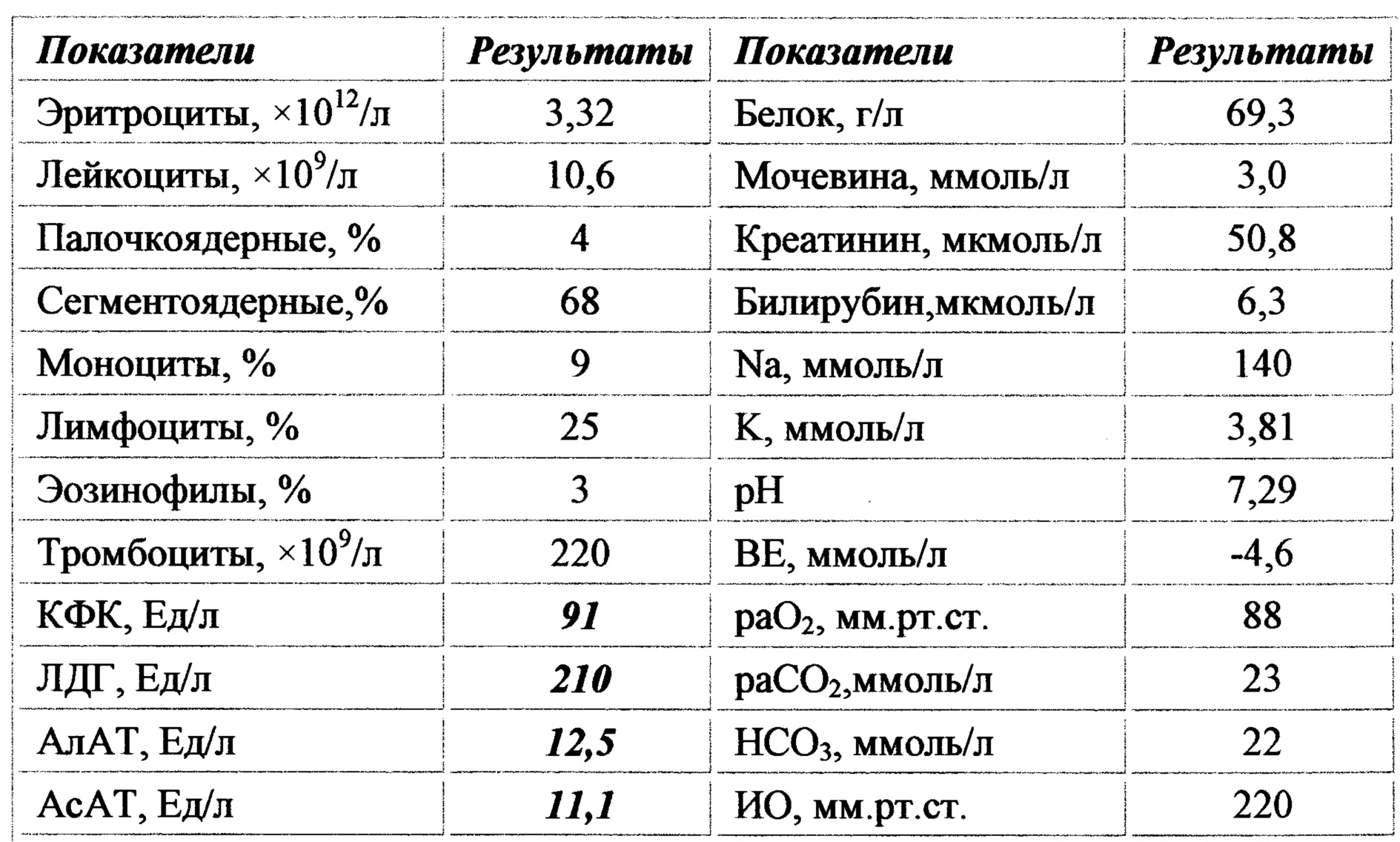 С другой стороны, присутствие анестетиков, аспирина, спиртов и некоторых наркотиков, а также прокаинамида может повысить уровень ЛДГ. Тест на ЛДГ может показать повышенную концентрацию только одного или нескольких типов изоферментов. Заболевания печени, заболевания почек, мышечные травмы, травмы, сердечный приступ, некоторые инфекционные заболевания, панкреатит, рак и анемия — вот некоторые из состояний здоровья, которые могут привести к повышению уровня ЛДГ в сыворотке.Кроме того, концентрация ЛДГ меняется с возрастом, у младенцев и детей младшего возраста нормальные уровни ЛДГ обычно намного выше, чем у детей старшего возраста и взрослых. Новорожденные имеют нормальный диапазон от 135 до 750 Ед / л (единиц / л), у детей до 12 месяцев — от 180 до 435 Ед / л, а у детей старше 18 лет — от 122 до 222 Ед / л (как указано компании Mayo Clinic Labs).
С другой стороны, присутствие анестетиков, аспирина, спиртов и некоторых наркотиков, а также прокаинамида может повысить уровень ЛДГ. Тест на ЛДГ может показать повышенную концентрацию только одного или нескольких типов изоферментов. Заболевания печени, заболевания почек, мышечные травмы, травмы, сердечный приступ, некоторые инфекционные заболевания, панкреатит, рак и анемия — вот некоторые из состояний здоровья, которые могут привести к повышению уровня ЛДГ в сыворотке.Кроме того, концентрация ЛДГ меняется с возрастом, у младенцев и детей младшего возраста нормальные уровни ЛДГ обычно намного выше, чем у детей старшего возраста и взрослых. Новорожденные имеют нормальный диапазон от 135 до 750 Ед / л (единиц / л), у детей до 12 месяцев — от 180 до 435 Ед / л, а у детей старше 18 лет — от 122 до 222 Ед / л (как указано компании Mayo Clinic Labs).
Помимо тестирования концентрации ЛДГ в образцах, тестирование изоферментов ЛДГ также помогает оценить тип, локализацию и серьезность повреждения тканей.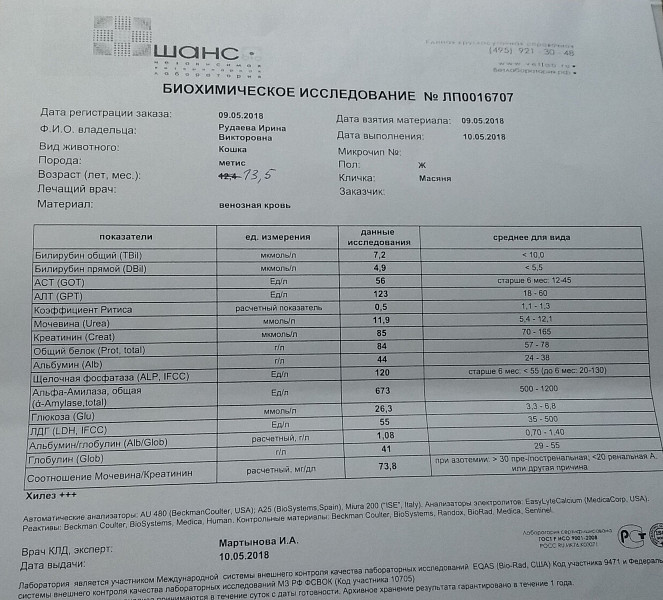 ЛДГ представляет собой тетрамерный фермент, состоящий из субъединиц H и M. Сборка ферментов происходит в определенном соотношении за счет тканеспецифического синтеза субъединиц, что обеспечивает тканевую специфичность, то есть сердечно-специфическая ЛДГ (ЛДГ-1) предпочтительно синтезирует все четыре субъединицы Н, в то время как ЛДГ печени (ЛДГ-5) состоит исключительно из всех М-субъединиц. Точно так же другие ткани синтезируют субъединицы в определенном соотношении. Тестирование изоферментов ЛДГ определяет изоферменты как ЛДГ от 1 до 5 на основании сдвига электрофоретической подвижности.Различный состав субъединиц приводит к разнице в чистых зарядах и, следовательно, к разной миграции в электрическом поле. Хорошая картина разделения изоферментов ЛДГ достигается в буфере с pH 8,6. В типичной электрофоретической картине изофермента ЛДГ ЛДГ-1 движется как быстрая полоса, за которой следуют ЛДГ-2, ЛДГ-3, ЛДГ-4 и ЛДГ-5, являющиеся самой медленной полосой. Нормальный сывороточный процент ЛДГ-1 (4H) составляет от 30,4 до 36,4%, ЛДГ-2 (3ч2М) от 30,4 до 36,4%, ЛДГ-3 (2ч3М) от 19,2 до 24,8%, ЛДГ-4 (1ч4М) от 9,6 до 15,6%, а ЛДГ-5 (4М) — 5.
ЛДГ представляет собой тетрамерный фермент, состоящий из субъединиц H и M. Сборка ферментов происходит в определенном соотношении за счет тканеспецифического синтеза субъединиц, что обеспечивает тканевую специфичность, то есть сердечно-специфическая ЛДГ (ЛДГ-1) предпочтительно синтезирует все четыре субъединицы Н, в то время как ЛДГ печени (ЛДГ-5) состоит исключительно из всех М-субъединиц. Точно так же другие ткани синтезируют субъединицы в определенном соотношении. Тестирование изоферментов ЛДГ определяет изоферменты как ЛДГ от 1 до 5 на основании сдвига электрофоретической подвижности.Различный состав субъединиц приводит к разнице в чистых зарядах и, следовательно, к разной миграции в электрическом поле. Хорошая картина разделения изоферментов ЛДГ достигается в буфере с pH 8,6. В типичной электрофоретической картине изофермента ЛДГ ЛДГ-1 движется как быстрая полоса, за которой следуют ЛДГ-2, ЛДГ-3, ЛДГ-4 и ЛДГ-5, являющиеся самой медленной полосой. Нормальный сывороточный процент ЛДГ-1 (4H) составляет от 30,4 до 36,4%, ЛДГ-2 (3ч2М) от 30,4 до 36,4%, ЛДГ-3 (2ч3М) от 19,2 до 24,8%, ЛДГ-4 (1ч4М) от 9,6 до 15,6%, а ЛДГ-5 (4М) — 5. От 5 до 12,7%.
От 5 до 12,7%.
Патофизиология
Количественная оценка ЛДГ представляет клинический интерес, поскольку концентрация изоферментов ЛДГ в сыворотке отражает тканеспецифические патологические состояния. Следовательно, ЛДГ может быть использован в качестве маркера различных повреждений тканей из-за его изоферментной формы и его повсеместного присутствия. При повреждении ткани клетки выделяют ЛДГ в кровоток. В зависимости от типа повреждения ткани уровень фермента может оставаться в кровотоке до 7 дней. Повышенный уровень ЛДГ в сыворотке крови в результате разрушения органа происходит из-за значительной гибели клеток, что приводит к потере цитоплазмы.Причинами повреждения тканей могут быть такие заболевания, как острый инфаркт миокарда, анемия, тромбоэмболия легочной артерии, гепатит, острая почечная недостаточность и др. [22] ЛДГ может использоваться в качестве удовлетворительного маркера для определения стадии заболевания (S-классификация), мониторинга прогноза или реакции на лечение, а также для оценки жидкостей организма, отличных от крови. Снижение уровней ЛДГ во время лечения указывает на лучший прогноз и / или хороший ответ на лечение при таких состояниях, как острый инфаркт миокарда или повреждение печени.При остром инфаркте миокарда изофермент ЛДГ-1 остается повышенным со второго дня до четвертого дня. Точно так же при повреждении печени повышается уровень ЛДГ-5. Значительное повышение уровня ЛДГ-5 выше, чем ЛДГ-4, является маркером гепатоцеллюлярных повреждений, таких как гепатит или цирроз.
Снижение уровней ЛДГ во время лечения указывает на лучший прогноз и / или хороший ответ на лечение при таких состояниях, как острый инфаркт миокарда или повреждение печени.При остром инфаркте миокарда изофермент ЛДГ-1 остается повышенным со второго дня до четвертого дня. Точно так же при повреждении печени повышается уровень ЛДГ-5. Значительное повышение уровня ЛДГ-5 выше, чем ЛДГ-4, является маркером гепатоцеллюлярных повреждений, таких как гепатит или цирроз.
ЛДГ увеличивается во время излияний в серозные жидкости организма, такие как перикардиальные и перитонеальные жидкости. Следовательно, он служит для характеристики излияния. В спинномозговой жидкости уровень ЛДГ увеличивается при бактериальном менингите, в то время как при вирусном менингите он остается нормальным.Отношение жидкой ЛДГ по сравнению с верхним пределом нормальной сывороточной ЛДГ (> 0,6) указывает на воспалительный процесс и, следовательно, на экссудат. [23]
Во время внутричерепного кровоизлияния наблюдается заметное повышение ЛДГ. Увеличение более чем на 40 Ед / л по сравнению с нормальным уровнем наблюдается при лимфоме центральной нервной системы, лейкемии и метастатической карциноме. Повышенные уровни более чем одного изофермента могут указывать на более чем одну причину повреждения тканей, например, в условиях, когда пневмония также может быть связана с сердечным приступом.Очень высокий уровень ЛДГ коррелирует с тяжелым заболеванием или полиорганной недостаточностью.
Увеличение более чем на 40 Ед / л по сравнению с нормальным уровнем наблюдается при лимфоме центральной нервной системы, лейкемии и метастатической карциноме. Повышенные уровни более чем одного изофермента могут указывать на более чем одну причину повреждения тканей, например, в условиях, когда пневмония также может быть связана с сердечным приступом.Очень высокий уровень ЛДГ коррелирует с тяжелым заболеванием или полиорганной недостаточностью.
ЛДГ — единственный сывороточный биомаркер, полезный для оценки метастатических меланом. [24] При злокачественных новообразованиях рост опухолевых клеток потребляет больше кислорода, чем его запасы; таким образом, гипоксия встречается довольно часто. Растущие опухоли подвергаются опосредованному ЛДГ производству энергии, чтобы удовлетворить потребность в быстром росте клеток. [25] Следовательно, ЛДГ является установленным маркером метастазов, особенно в печени. Это также важный прогностический фактор, поскольку у пациентов с высоким уровнем ЛДГ снижена выживаемость.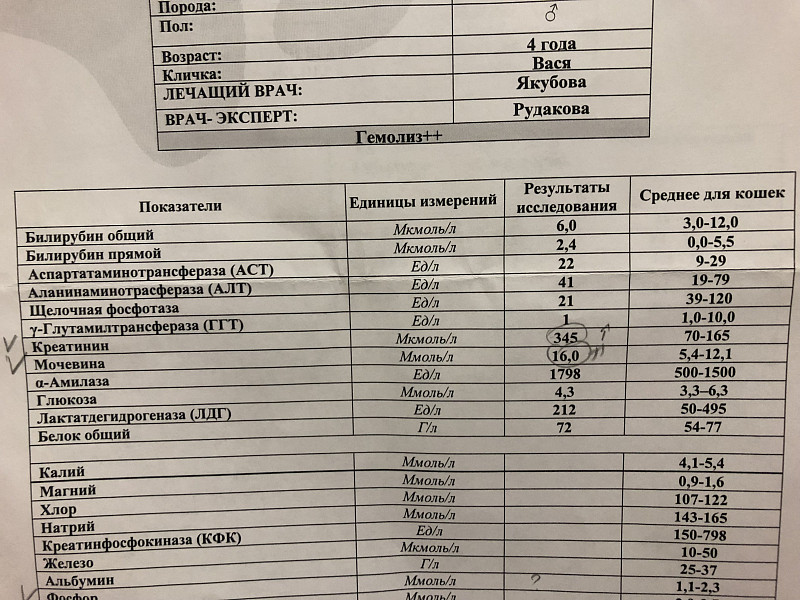 Кроме того, уровни ЛДГ служат для прогнозирования случаев метастазирования увеальной меланомы [26]. ЛДГ хорошо коррелирует с экспрессией тирозинкиназы в опухолях. [27]
Кроме того, уровни ЛДГ служат для прогнозирования случаев метастазирования увеальной меланомы [26]. ЛДГ хорошо коррелирует с экспрессией тирозинкиназы в опухолях. [27]
Этот фермент также представляет собой потенциальную терапевтическую мишень для таких заболеваний, как малярия и рак. Изоформа ЛДГ, экспрессируемая малярийным паразитом Plasmodium falciparum, является важным ферментом для выработки энергии паразитом. Поскольку у этих малярийных паразитов отсутствует цикл трикарбоновых кислот для образования АТФ, анаэробный гликолиз служит источником энергии.[28] Ингибиторы Plasmodium falciparum LDH будут направлены только на паразита и избирательно убивают паразита.
Большинство инвазивных опухолей подвергаются метаболическому переключению (эффект Варбурга) с окислительного фосфорилирования на более высокий анаэробный гликолиз. Это переключение происходит за счет активации ЛДГ-5 (также называемого ЛДГ-А), изоформы, обычно присутствующей в мышцах и печени. [22] Следовательно, ингибирование ЛДГ-5 может специфически воздействовать на место прогрессирования и инвазивности опухоли. Аналог ингибиторов ЛДГ класса N-гидроксиндола также эффективно тестируется в качестве противоопухолевых средств. [29] [30] Многие клинические испытания и трансляционные данные продемонстрировали, что нацеливание на гены LDHA или его белковый продукт LDH-5 можно использовать в качестве метаболического лечения рака. [31] [28]
Аналог ингибиторов ЛДГ класса N-гидроксиндола также эффективно тестируется в качестве противоопухолевых средств. [29] [30] Многие клинические испытания и трансляционные данные продемонстрировали, что нацеливание на гены LDHA или его белковый продукт LDH-5 можно использовать в качестве метаболического лечения рака. [31] [28]
Исследователи провели клинические испытания у пациентов с меланомой с низким уровнем ЛДГ, и лечение ипилимумабом показало более высокую эффективность, когда лечение начиналось с низкого исходного уровня ЛДГ. [32] [33] Другое испытание с использованием комбинации антисмыслового олигонуклеотида Bcl2 и дакарбазина также показало эффективность у пациентов с низким исходным уровнем ЛДГ.[34] Таким образом, общая важность ЛДГ как онкомаркера маскируется из-за его низкой чувствительности и специфичности. [35] Высокий уровень ЛПНП обычно связан с поздними стадиями рака. [36]
Дефицит фермента ЛДГ встречается очень редко, и данных о его распространенности не так много. Этот дефицит может быть результатом либо мутаций в гене LDHA, либо в гене LDHB, приводящих к дефициту белков LDH-A (белок M-субъединицы) и LDH-B (белок H-субъединицы), соответственно.[37] Мутации гена LDHA приводят к образованию аномального белка субъединицы M. Эта белковая субъединица не может связываться с другими субъединицами с образованием фермента ЛДГ.
Этот дефицит может быть результатом либо мутаций в гене LDHA, либо в гене LDHB, приводящих к дефициту белков LDH-A (белок M-субъединицы) и LDH-B (белок H-субъединицы), соответственно.[37] Мутации гена LDHA приводят к образованию аномального белка субъединицы M. Эта белковая субъединица не может связываться с другими субъединицами с образованием фермента ЛДГ.
Мутация гена LDHA в основном затрагивает скелетные мышцы, поскольку скелетный LDH имеет все М-субъединицы. Однако отсутствие функциональной субъединицы также снижает количество фермента, образующегося во всех других тканях. Эта химия приводит к неэффективному расщеплению гликогена. Следовательно, дефицит гена LDHA также называют болезнью накопления гликогена XI.Недоступность достаточной энергии, особенно мышечным клеткам, вызывает мышечную слабость и разрушение мышечной ткани (рабдомиолиз). [38] Эффект более выражен при физических нагрузках, а разрушение мышечной ткани высвобождает белок миоглобин. Этот белок перерабатывается в почках и выделяется с мочой, вызывая миоглобинурию. Высокое накопление белка миоглобина может повредить почки, что также может привести к почечной недостаточности. У некоторых пациентов с дефицитом ЛДГА возникают кожные высыпания различной степени тяжести.[39]
Высокое накопление белка миоглобина может повредить почки, что также может привести к почечной недостаточности. У некоторых пациентов с дефицитом ЛДГА возникают кожные высыпания различной степени тяжести.[39]
С другой стороны, мутации гена LDHB влияют на сердечную мышцу, прежде всего потому, что сердечная LDH состоит из всех четырех H-субъединиц. В сердечной мышце непроизвольное движение мышц подпитывается преобразованием лактата в пируват с помощью фермента ЛДГ. Такие условия приводят к снижению активности ЛДГ в сердечной мышце у пациентов с дефицитом ЛДГБ. Интересно, что у таких пациентов не наблюдается видимого фенотипа, признаков или симптомов. Мутации генов LDHA и LDHB показали свою значимость в онкогенезе.[40]
Клиническая значимость
ЛДГ служит общим индикатором острых и хронических заболеваний. Повышение активности ЛДГ в сыворотке следует изоферментным паттернам, характерным для различных заболеваний.
Повышение ЛДГ может служить прогностическим маркером прогрессирования рака при различных типах рака.
 ЛДГ также служит одним из важных диагностических маркеров кожной лимфомы. Концентрация ЛДГ-5 продемонстрирована как предиктор лучевой и химиотерапевтической реакции у онкологических больных.ЛДГ полезен при оценке пациентов с метастатическим раком. Напротив, ЛДГ-5 служит маркером радиосенсибилизации.
ЛДГ также служит одним из важных диагностических маркеров кожной лимфомы. Концентрация ЛДГ-5 продемонстрирована как предиктор лучевой и химиотерапевтической реакции у онкологических больных.ЛДГ полезен при оценке пациентов с метастатическим раком. Напротив, ЛДГ-5 служит маркером радиосенсибилизации.Ферменты могут контролировать прогрессирующие состояния, такие как мышечная дистрофия или ВИЧ-инфекция.
В спортивной медицине ЛДГ потенциально указывает на мышечный ответ на тренировку с увеличением скелетных и сердечных мышц после 3-5 часов тренировки.
Если обнаружено, что уровень ЛДГ-1 выше, чем ЛДГ-2, это указывает на инфаркт миокарда с «перевернутым» соотношением ЛДГ-1 / ЛДГ-2 больше 1.Повышение ЛДГ сохраняется примерно десять дней. Он увеличивается через 12 часов и достигает максимума через 24-48 часов. Таким образом, очень высокий уровень указывает на острый инфаркт миокарда.
Более чем 50-кратное увеличение ЛДГ-1 и ЛДГ-2 указывает на мегалобластную анемию.

Повышенный уровень ЛДГ-5 в сыворотке крови является маркером мышечной дистрофии.
Десятикратное увеличение сывороточного ЛДГ указывает на токсический гепатит с желтухой.
Повышение уровня ЛДГ-3 связано с массивным разрушением тромбоцитов, как при тромбоэмболии легочной артерии.
ЛДГ используется для оценки природы или патологического накопления плевральной, перитонеальной или перикардиальной жидкости. Сывороточный ЛДГ, по сравнению с ЛДГ серозной жидкости, помогает отличить экссудат от транссудата.
У пациентов с несеминоматозным раком яичка ЛДГ используется как маркер стадии (S-классификация).
Аномально низкие уровни ЛДГ встречаются очень редко и обычно не считаются вредными.
Дополнительное образование / Контрольные вопросы
Список литературы
- 1.
- Шуман Г., Бонора Р., Чериотти Ф., Клерк-Рено П., Ферреро К.А., Ферар Дж.
 , Франк П.Ф., Гелла Ф.Дж., Хельцель В., Йоргенсен П.Дж., Канно Т., Кесснер А., Клауке Р., Кристиансен Н., Лессинджер Дж. М., Линзингер TP, Misaki H, Panteghini M, Pauwels J, Schimmel HG, Vialle A, Weidemann G, Siekmann L. Первичные эталонные процедуры IFCC для измерения концентраций каталитической активности ферментов при 37 ° C. Часть 3. Эталонная процедура для измерения каталитическая концентрация лактатдегидрогеназы.Clin Chem Lab Med. 2002 июн; 40 (6): 643-8. [PubMed: 12211663]
, Франк П.Ф., Гелла Ф.Дж., Хельцель В., Йоргенсен П.Дж., Канно Т., Кесснер А., Клауке Р., Кристиансен Н., Лессинджер Дж. М., Линзингер TP, Misaki H, Panteghini M, Pauwels J, Schimmel HG, Vialle A, Weidemann G, Siekmann L. Первичные эталонные процедуры IFCC для измерения концентраций каталитической активности ферментов при 37 ° C. Часть 3. Эталонная процедура для измерения каталитическая концентрация лактатдегидрогеназы.Clin Chem Lab Med. 2002 июн; 40 (6): 643-8. [PubMed: 12211663] - 2.
- Холмс Р.С., Голдберг Э. Компьютерный анализ лактатдегидрогеназ млекопитающих: ЛДГ человека, мыши, опоссума и утконоса. Comput Biol Chem. 2009 Октябрь; 33 (5): 379-85. [Бесплатная статья PMC: PMC2777655] [PubMed: 19679512]
- 3.
- Drent M, Cobben NA, Henderson RF, Wouters EF, van Dieijen-Visser M. Полезность лактатдегидрогеназы и ее изоферментов в качестве индикаторов повреждения или воспаления легких .Eur Respir J. 1996 Aug; 9 (8): 1736-42. [PubMed: 8866602]
- 4.

- Прочтите JA, Winter VJ, Eszes CM, Sessions RB, Brady RL. Структурная основа измененной активности М- и Н-изоферментных форм лактатдегидрогеназы человека. Белки. 2001 мая 01; 43 (2): 175-85. [PubMed: 11276087]
- 5.
- Хан А.А., Аллемайлем К.С., Альхумайди Ф.А., Гаудер С.Дж., Рахмани А.Х. Биохимические и клинические перспективы лактатдегидрогеназы: фермента активного метаболизма. Endocr Metab — мишени для лечения иммунных расстройств.2020; 20 (6): 855-868. [PubMed: 31886754]
- 6.
- Passarella S, Schurr A. Транспорт и метаболизм l-лактата в митохондриях клеток Hep G2 — повторение цикла Кори. Фасад Онкол. 2018; 8: 120. [Бесплатная статья PMC: PMC5924780] [PubMed: 29740537]
- 7.
- Liang X, Liu L, Fu T, Zhou Q, Zhou D, Xiao L, Liu J, Kong Y, Xie H, Yi F, Lai L , Вега РБ, Келли Д.П., Смит С.Р., Ган З. Индуцируемая физическими упражнениями лактатдегидрогеназа B регулирует митохондриальную функцию в скелетных мышцах.J Biol Chem. 2016, 2 декабря; 291 (49): 25306-25318.
 [Бесплатная статья PMC: PMC5207234] [PubMed: 27738103]
[Бесплатная статья PMC: PMC5207234] [PubMed: 27738103] - 8.
- де Бари Л., Атланте А. Включая митохондриальный метаболизм L-лактата в метаболическое перепрограммирование рака. Cell Mol Life Sci. 2018 август; 75 (15): 2763-2776. [PubMed: 29728715]
- 9.
- Laughton JD, Charnay Y, Belloir B, Pellerin L, Magistretti PJ, Bouras C. Дифференциальное распределение изоформ лактатдегидрогеназы ЛДГ-1 и ЛДГ-5 изоформ ЛДГ-5 в мозге крысы.Неврология. 2000; 96 (3): 619-25. [PubMed: 10717443]
- 10.
- Markert CL, Shaklee JB, Whitt GS. Эволюция гена. Множественные гены изоферментов ЛДГ представляют собой модель эволюции структуры, функции и регуляции генов. Наука. 1975 11 июля; 189 (4197): 102-14. [PubMed: 1138367]
- 11.
- Schueren F, Lingner T, George R, Hofhuis J, Dickel C, Gärtner J, Thoms S. Пероксисомальная лактатдегидрогеназа генерируется трансляционным считыванием у млекопитающих. Элиф.2014 23 сентября; 3: e03640. [Бесплатная статья PMC: PMC4359377] [PubMed: 25247702]
- 12.

- Auerbach G, Ostendorp R, Prade L, Korndörfer I, Dams T., Huber R, Jaenicke R. Лактатдегидрогеназа из гипертермофильной кристаллической бактерии maritima thermoto структура при разрешении 2,1 A показывает стратегии внутренней стабилизации белка. Структура. 1998, 15 июня; 6 (6): 769-81. [PubMed: 9655830]
- 13.
- Ивентофф В., Россманн М.Г., Тейлор С.С., Торфф Х.Дж., Мейер Х., Кейл В., Килтц Х.Х.Структурные адаптации изоферментов лактатдегидрогеназы. Proc Natl Acad Sci U S. A. 1977 июл; 74 (7): 2677-81. [Бесплатная статья PMC: PMC431242] [PubMed: 197516]
- 14.
- Adeva-Andany M, López-Ojén M, Funcasta-Calderón R, Ameneiros-Rodríguez E, Donapetry-García C, Vila-Altesíguez M-, Rodr. Сейджас Дж. Всесторонний обзор метаболизма лактата в здоровье человека. Митохондрия. 2014 Июль; 17: 76-100. [PubMed: 24929216]
- 15.
- Овергаард М., Расмуссен П., Бом А.М., Зайферт Т., Брассард П., Заар М., Хоманн П., Эванс К.А., Нильсен Х.Б., Секер Н.
 Х.Гипоксия и физические упражнения вызывают как высвобождение лактата, так и его окисление мозгом человека. FASEB J. 2012 июл; 26 (7): 3012-20. [PubMed: 22441982]
Х.Гипоксия и физические упражнения вызывают как высвобождение лактата, так и его окисление мозгом человека. FASEB J. 2012 июл; 26 (7): 3012-20. [PubMed: 22441982] - 16.
- Liberti MV, Locasale JW. Эффект Варбурга: как он полезен для раковых клеток? Trends Biochem Sci. 2016 Март; 41 (3): 211-218. [Бесплатная статья PMC: PMC4783224] [PubMed: 26778478]
- 17.
- Аль Баваб А.К., Зихлиф М., Джаррар Й., Шараб А. Непрерывная гипоксия и метаболизм глюкозы, Влияние на экспрессию генов в линии клеток рака молочной железы Mcf7.Endocr Metab — мишени для лечения иммунных расстройств. 2020 05 мая; [PubMed: 32370732]
- 18.
- Ши Й, Пинто Б.М. Ингибиторы лактатдегидрогеназы а человека: исследование молекулярной динамики. PLoS One. 2014; 9 (1): e86365. [Бесплатная статья PMC: PMC3895040] [PubMed: 24466056]
- 19.
- Spriet LL, Howlett RA, Heigenhauser GJ. Ферментативный подход к производству лактата в скелетных мышцах человека во время упражнений.
 Медико-спортивные упражнения. 2000 апр; 32 (4): 756-63. [PubMed: 10776894]
Медико-спортивные упражнения. 2000 апр; 32 (4): 756-63. [PubMed: 10776894] - 20.
- Valvona CJ, Fillmore HL, Nunn PB, Pilkington GJ. Регуляция и функция лактатдегидрогеназы A: терапевтический потенциал при опухоли головного мозга. Brain Pathol. 2016 Янв; 26 (1): 3-17. [PubMed: 26269128]
- 21.
- Tokinoya K, Ishikura K, Yoshida Y, Ra SG, Sugasawa T., Aoyagi A, Nabekura Y, Takekoshi K, Ohmori H. Изофермент 5 LDH является показателем раннего начала болезненности мышц во время длительный бег. J Sports Med Phys Fitness. 2020 июл; 60 (7): 1020-1026. [PubMed: 32253893]
- 22.
- Фэн Y, Xiong Y, Qiao T, Li X, Jia L, Han Y. Лактатдегидрогеназа A: ключевой игрок в канцерогенезе и потенциальная мишень в терапии рака. Cancer Med. 2018 декабрь; 7 (12): 6124-6136. [Бесплатная статья PMC: PMC6308051] [PubMed: 30403008]
- 23.
- Mercer RM, Corcoran JP, Porcel JM, Rahman NM, Psallidas I. Интерпретация результатов плевральной жидкости. Clin Med (Лондон).
 2019 Май; 19 (3): 213-217. [Бесплатная статья PMC: PMC6542220] [PubMed: 31092513]
2019 Май; 19 (3): 213-217. [Бесплатная статья PMC: PMC6542220] [PubMed: 31092513] - 24.
- Юришич В., Раденкович С., Коневич Г.Фактическая роль ЛДГ как опухолевого маркера, биохимические и клинические аспекты. Adv Exp Med Biol. 2015; 867: 115-24. [PubMed: 26530363]
- 25.
- Мишра Д., Банерджи Д. Лактатдегидрогеназы как метаболические связи между опухолью и стромой в микроокружении опухоли. Раки (Базель). 29 мая 2019 г .; 11 (6) [Бесплатная статья PMC: PMC6627402] [PubMed: 31146503]
- 26.
- Галло М., Сапио Л., Спина А., Навильо Д., Калоджеро А., Навильо С. Лактодегидрогеназа и рак: ан обзор.Front Biosci (Landmark Ed). 2015, 01 июня; 20: 1234-49. [PubMed: 25961554]
- 27.
- Лю Дж, Чен Дж, Лю З., Лю С., Цай З, Ю П, Ке И, Лай Л., Хуан И, Гао Х, Чжао Л., Пеликано Х, Хуанг П, McKeehan WL, Wu CL, Wang C, Zhong W, Wang F. Аберрантная передача сигналов тирозинкиназы FGFR усиливает эффект Варбурга путем перепрограммирования экспрессии и активности изоформы LDH при раке простаты.
 Cancer Res. 2018 15 августа; 78 (16): 4459-4470. [Бесплатная статья PMC: PMC6095720] [PubMed: 298]
Cancer Res. 2018 15 августа; 78 (16): 4459-4470. [Бесплатная статья PMC: PMC6095720] [PubMed: 298] - 28.
- Granchi C, Bertini S, Macchia M, Minutolo F.Ингибиторы изоформ лактатдегидрогеназы и их терапевтические возможности. Curr Med Chem. 2010; 17 (7): 672-97. [PubMed: 20088761]
- 29.
- Di Bussolo V, Calvaresi EC, Granchi C, Del Bino L, Frau I, Lang MC, Tuccinardi T, Macchia M, Martinelli A, Hergenrother PJ, Minutolo F. Синтез и биологическая оценка не содержащих глюкозу гликоконъюгированных ингибиторов ЛДГ класса N -гидрооксиндола в качестве противораковых агентов. RSC Adv. 2015; 5 (26): 19944-19954. [Бесплатная статья PMC: PMC4497792] [PubMed: 26167277]
- 30.
- Urbańska K, Orzechowski A. Недооцененная роль LDHA и LDHB в контроле апоптоза и аутофагии в опухолевых клетках. Int J Mol Sci. 27 апреля 2019; 20 (9) [Бесплатная статья PMC: PMC6539221] [PubMed: 31035592]
- 31.
- Аугоф К., Гриневич-Янковска А.
 , Табола Р. Лактатдегидрогеназа 5: старый друг и новая надежда в мире война с раком. Cancer Lett. 2015 01 марта; 358 (1): 1-7. [PubMed: 25528630]
, Табола Р. Лактатдегидрогеназа 5: старый друг и новая надежда в мире война с раком. Cancer Lett. 2015 01 марта; 358 (1): 1-7. [PubMed: 25528630] - 32.
- Martens A, Wistuba-Hamprecht K, Geukes Foppen M, Yuan J, Postow MA, Wong P, Romano E, Khammari A, Dreno B, Capone M, Ascierto PA, Di Giacomo AM , Maio M, Schilling B, Sucker A, Schadendorf D, Hassel JC, Eigentler TK, Martus P, Wolchok JD, Blank C, Pawelec G, Garbe C, Weide B.Исходные биомаркеры периферической крови, связанные с клиническим исходом пациентов с запущенной меланомой, леченных ипилимумабом. Clin Cancer Res. 2016 15 июня; 22 (12): 2908-18. [Бесплатная статья PMC: PMC5770142] [PubMed: 26787752]
- 33.
- Weide B, Martens A, Hassel JC, Berking C, Postow MA, Bisschop K, Simeone E, Mangana J, Schilling B, Di Giacomo AM, Brenner N, Kähler K, Heinzerling L, Gutzmer R, Bender A, Gebhardt C, Romano E, Meier F, Martus P, Maio M, Blank C, Schadendorf D, Dummer R, Ascierto PA, Hospers G, Garbe C, Wolchok JD.
 Исходные биомаркеры исходов у пациентов с меланомой, получавших пембролизумаб. Clin Cancer Res. 2016 15 ноября; 22 (22): 5487-5496. [Бесплатная статья PMC: PMC5572569] [PubMed: 27185375]
Исходные биомаркеры исходов у пациентов с меланомой, получавших пембролизумаб. Clin Cancer Res. 2016 15 ноября; 22 (22): 5487-5496. [Бесплатная статья PMC: PMC5572569] [PubMed: 27185375] - 34.
- Bedikian AY, Millward M, Pehamberger H, Conry R, Gore M, Trefzer U, Pavlick AC, DeConti R, Hersh EM, Hersey P, Kirkwood JM , Халуска Ф.Г., Группа изучения меланомы Облимерсена. Антисмысловой Bcl-2 (облимерсен натрия) плюс дакарбазин у пациентов с запущенной меланомой: группа исследования меланомы облимерсена.J Clin Oncol. 2006 10 октября; 24 (29): 4738-45. [PubMed: 16966688]
- 35.
- Smylie MG. Использование иммуноонкологии при меланоме. Curr Oncol. 2020 апр; 27 (приложение 2): S51-S58. [Бесплатная статья PMC: PMC7194004] [PubMed: 32368174]
- 36.
- Яо Й, Ван Х, Ли Б. Сверхэкспрессия LDH5 связана с плохой выживаемостью у пациентов с солидными опухолями: метаанализ. Tumor Biol. 2014 июл; 35 (7): 6973-81. [PubMed: 24744144]
- 37.
- Monroe GR, van Eerde AM, Tessadori F, Duran KJ, Savelberg SMC, van Alfen JC, Terhal PA, van der Crabben SN, Lichtenbelt KD, Fuchs SA, Gerrits J, van Roosmalen MJ, van Gassen KL, van Aalderen M, Koot BG, Oostendorp M, Duran M, Visser G, de Koning TJ, Calì F, Bosco P, Geleijns K, de Sain-van der Velden MGM, Knoers NV, Bakkers J, Verhoeven -Duif NM, van Haaften G, Jans JJ.
 Выявление дефицита D-лактатдегидрогеназы у человека. Nat Commun. 2019 Апрель 01; 10 (1): 1477. [Бесплатная статья PMC: PMC6443703] [PubMed: 30931947]
Выявление дефицита D-лактатдегидрогеназы у человека. Nat Commun. 2019 Апрель 01; 10 (1): 1477. [Бесплатная статья PMC: PMC6443703] [PubMed: 30931947] - 38.
- Ли Б.Дж., Занд Л., Манек Нью-Джерси, Сяо Л.Л., Бабович-Вуксанович Д., Вилам М.Э., Цянь К. Рабдомиолиз, вызванный физиотерапией, и острое повреждение почек связано со снижением активности мышечной лактатдегидрогеназы A. Arthritis Care Res (Hoboken). 2011 декабрь; 63 (12): 1782-6. [PubMed: 22127970]
- 39.
- Лунд А.М., Кристенсен Э., Сковби Ф.[Диагностика и неотложное лечение врожденных заболеваний обмена веществ у младенцев]. Ugeskr Laeger. 2002 25 ноября; 164 (48): 5613-9. [PubMed: 12523004]
- 40.
- Валента С., Мюллер-Клизер В.Ф. Лактат: зеркало и мотор злокачественности опухоли. Семин Радиат Онкол. 2004 июл; 14 (3): 267-74. [PubMed: 15254870]
S100B и ЛДГ как ранние прогностические маркеры ответа и общей выживаемости у пациентов с меланомой, получавших лечение анти-PD-1 или комбинированными антителами анти-PD-1 плюс анти-CTLA-4
org/ScholarlyArticle»> 1.Robert, C. et al. Пембролизумаб в сравнении с ипилимумабом при запущенной меланоме. N. Engl. J. Med. 372 , 2521–2532 (2015).
CAS Статья Google ученый
Weber, J. S. et al. Ниволумаб в сравнении с химиотерапией у пациентов с меланомой на поздней стадии, у которых развилось прогрессирование после лечения анти-CTLA-4 (CheckMate 037): рандомизированное контролируемое открытое исследование фазы 3. Ланцет Онкол. 16 , 375–384 (2015).
CAS Статья Google ученый
Wolchok, J. D. et al. Общая выживаемость при применении комбинации ниволумаба и ипилимумаба при запущенной меланоме. N. Engl. J. Med. 377 , 1345–1356 (2017).
CAS Статья Google ученый
Zou, W., Wolchok, J. D. & Chen, L. PD-L1 (B7-h2) и блокада пути PD-1 для лечения рака: механизмы, биомаркеры ответа и комбинации. Sci. Пер. Мед 8 , 328rv324 (2016).
Артикул Google ученый
Eton, O. et al. Факторы прогноза выживаемости пациентов, получавших системное лечение по поводу диссеминированной меланомы. J. Clin. Онкол. 16 , 1103–1111 (1998).
CAS Статья Google ученый
Weide, B. et al. Сывороточные маркеры лактатдегидрогеназа и S100B независимо предсказывают исход заболевания у пациентов с меланомой с отдаленными метастазами. руб. J. Cancer 107 , 422–428 (2012).
руб. J. Cancer 107 , 422–428 (2012).
CAS Статья Google ученый
Balch, C.M. et al. Окончательная версия стадирования и классификации меланомы AJCC 2009 г. J. Clin. Онкол. 27 , 6199–6206 (2009).
Артикул Google ученый
Gershenwald, J. E. et al. Определение стадии меланомы: основанные на фактах изменения в восьмом издании руководства по стадированию рака Американского объединенного комитета по раку. CA Cancer J. Clin. 67 , 472–492 (2017).
Артикул Google ученый
Nosrati, A. et al. Оценка клинико-патологических факторов в ответе на PD-1: вывод и проверка шкалы прогнозов ответа на монотерапию PD-1. руб. J. Cancer 116 , 1141–1147 (2017).
et al. Оценка клинико-патологических факторов в ответе на PD-1: вывод и проверка шкалы прогнозов ответа на монотерапию PD-1. руб. J. Cancer 116 , 1141–1147 (2017).
CAS Статья Google ученый
Diem, S. et al. Лактатдегидрогеназа сыворотки как ранний маркер исхода у пациентов, получавших терапию анти-PD-1 при метастатической меланоме. руб. J. Cancer 114 , 256–261 (2016).
CAS Статья Google ученый
Gaynor, R., Irie, R., Morton, D. & Herschman, H.R. Белок S100 присутствует в культивируемых злокачественных меланомах человека. Nature 286 , 400–401 (1980).
CAS Статья Google ученый
Gaynor, R. et al. Белок S100: маркер злокачественной меланомы человека? Lancet 1 , 869–871 (1981).
CAS Статья Google ученый
Nakajima, T. et al. Иммуногистохимическая демонстрация белка S100 при злокачественной меланоме и пигментных невусах и его диагностическое применение. Рак 50 , 912–918 (1982).
CAS Статья Google ученый
Блессинг К., Сандерс Д. С. и Грант Дж. Дж. Сравнение иммуногистохимического окрашивания нового антитела мелан-А с белком S100 и HMB-45 при злокачественной меланоме и вариантах меланомы. Гистопатология 32 , 139–146 (1998).
CAS Статья Google ученый
von Schoultz, E. et al. Прогностическое значение сывороточных анализов бета-белка S-100 при злокачественной меланоме. Melanoma Res 6 , 133–137 (1996).
Артикул Google ученый
Шульц, Э. С., Дипген, Т. Л., фон ден Дриш, П. Клиническая и прогностическая значимость сывороточного белка S-100 бета при злокачественной меланоме. руб. J. Dermatol. 138 , 426–430 (1998).
CAS Статья Google ученый
Hauschild, A. et al. Прогностическая значимость обнаружения S100B в сыворотке по сравнению с обычными параметрами крови у пациентов с запущенной метастатической меланомой. Melanoma Res. 9 , 155–161 (1999).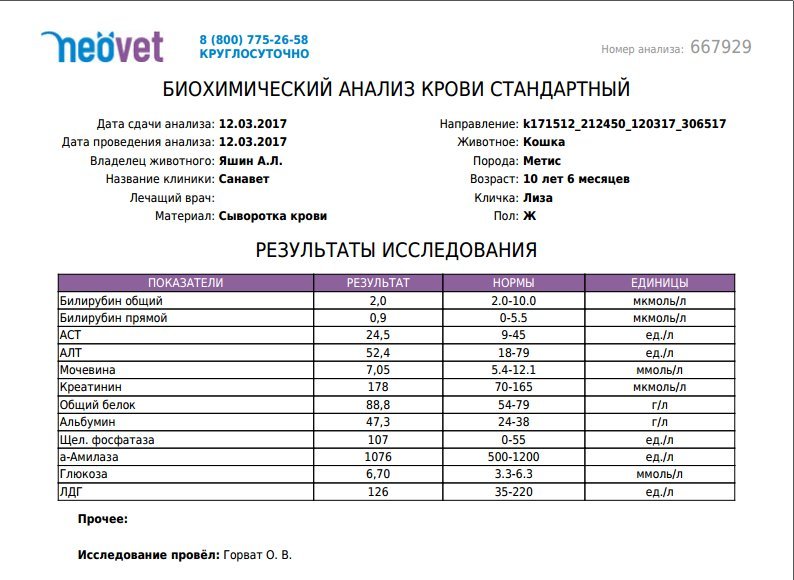
CAS Статья Google ученый
Jury, C. S., McAllister, E. J. и MacKie, R. M. Повышение уровня сывороточного белка S100 предшествует другим свидетельствам прогрессирования заболевания у пациентов со злокачественной меланомой. руб. J. Dermatol. 143 , 269–274 (2000).
CAS Статья Google ученый
Martenson, E. D. et al. Белок сыворотки S-100b как прогностический маркер злокачественной меланомы кожи. J. Clin. Онкол. 19 , 824–831 (2001).
CAS Статья Google ученый
Mocellin, S., Zavagno, G. & Nitti, D.Прогностическая ценность сыворотки S100B у пациентов с меланомой кожи: метаанализ. Int J. Cancer 123 , 2370–2376 (2008).
& Nitti, D.Прогностическая ценность сыворотки S100B у пациентов с меланомой кожи: метаанализ. Int J. Cancer 123 , 2370–2376 (2008).
CAS Статья Google ученый
Эйгентлер, Т. К., Мюленбейн, К., Фолльманн, М., Шадендорф, Д. и Гарбе, К. S3-Leitlinie diagnostik, therapie und nachsorge des melanoms — Обновление 2015/2016, Kurzversion 2.0. J. Dtsch. Дерматол. Ges. 15 , e1 – e41 (2017).
Артикул Google ученый
Felix, J. et al. Актуальность сывороточных биомаркеров, связанных с меланомой, при последующем наблюдении за иммунотерапией против CTLA-4. Int Immunopharmacol. 40 , 466–473 (2016).
CAS Статья Google ученый
Damuzzo, V. et al. Клиническое значение ассоциированных с опухолью и иммунологических параметров у пациентов с меланомой, получавших ипилимумаб. Онкоиммунология 5 , e1249559 (2016).
CAS Статья Google ученый
Gambichler T., et al. Базовые лабораторные параметры, прогнозирующие клинический исход у пациентов с меланомой, получавших ипилимумаб: одноцентровый анализ. J. Eur. Акад. Дерматол. Венереол . 32 , 972–977 (2017).
Артикул Google ученый
Eisenhauer, E.A. et al. Новые критерии оценки ответа при солидных опухолях: пересмотренное руководство RECIST (версия 1.1). Eur. J. Cancer 45 , 228–247 (2009).
CAS Статья Google ученый
Hothorn, T. & Lausen, B. О точном распределении максимально выбранной ранговой статистики. Comput. Стат. Data Anal. 43 , 121–137 (2003).
Артикул Google ученый
Манола, Дж., Аткинс, М., Ибрагим, Дж. И Кирквуд, Дж. Прогностические факторы при метастатической меланоме: объединенный анализ исследований Восточной совместной онкологической группы. J. Clin. Онкол. 18 , 3782–3793 (2000).
CAS Статья Google ученый
Deichmann, M. et al. S100-Бета, активность по ингибированию меланомы и лактатдегидрогеназа отличают прогрессирующую меланому от непрогрессивного Американского объединенного комитета по раку IV стадии. J. Clin. Онкол. 17 , 1891–1896 (1999).
J. Clin. Онкол. 17 , 1891–1896 (1999).
CAS Статья Google ученый
Weide, B. et al. Сыворотка S100B, лактатдегидрогеназа и метастазы в мозг являются прогностическими факторами у пациентов с отдаленными метастазами меланомы и системной терапии. PLoS One 8 , e81624 (2013).
Артикул Google ученый
Hodi, F. S. et al. Повышение выживаемости при применении ипилимумаба у пациентов с метастатической меланомой. N. Engl. J. Med. 363 , 711–723 (2010).
CAS Статья Google ученый

Robert, C. et al. Ипилимумаб плюс дакарбазин при ранее нелеченой метастатической меланоме. N. Engl. J. Med. 364 , 2517–2526 (2011).
CAS Статья Google ученый
Larkin, J. et al. Комбинированный ниволумаб и ипилимумаб или монотерапия при нелеченой меланоме. N. Engl. J. Med. 373 , 23–34 (2015).
Артикул Google ученый
Delyon, J. et al. Опыт повседневной практики применения ипилимумаба для лечения пациентов с метастатической меланомой: раннее увеличение количества лимфоцитов и эозинофилов связано с улучшением выживаемости. Ann. Онкол. 24 , 1697–1703 (2013).
CAS Статья Google ученый
Kelderman, S. et al. Лактатдегидрогеназа как критерий выбора лечения ипилимумабом при метастатической меланоме. Cancer Immunol. Immunother. 63 , 449–458 (2014).
CAS PubMed Google ученый
Diem, S. et al. Прогностическая оценка для пациентов с запущенной меланомой, получавших ипилимумаб. Eur. J. Cancer 51 , 2785–2791 (2015).
CAS Статья Google ученый
Ribas, A. et al. Связь пембролизумаба с опухолевым ответом и выживаемостью среди пациентов с запущенной меланомой. JAMA 315 , 1600–1609 (2016).
CAS Статья Google ученый
Valpione, S. et al. Персонализированная медицина: разработка и внешняя проверка прогностической модели для пациентов с метастатической меланомой, получавших ипилимумаб. Eur. J. Cancer 51 , 2086–2094 (2015).
CAS Статья Google ученый
Postow, M. A. et al. Сравнение ниволумаба и ипилимумаба с ипилимумабом при нелеченой меланоме. N. Engl. J. Med 372 , 2006–2017 (2015).
Артикул Google ученый
Каллахан М. К. и др. Ниволумаб плюс ипилимумаб у пациентов с меланомой на поздних стадиях: обновленные данные о выживаемости, ответе и безопасности в исследовании фазы I повышения дозы.J. Clin. Онкол. 2017 , JCO2017722850 (2017).
Afzal, MZ, Mabaera, R. & Shirai, K. Метастатическая увеальная меланома, демонстрирующая стойкий ответ на комбинированную терапию анти-CTLA-4 и анти-PD-1 после прогрессирования только на терапии анти-PD-1 . J. Immunother. Рак 6 , 13 (2018).
Артикул Google ученый
Уровень лактатдегидрогеназы в крови — обзор
A Миопатии
Повреждение мышц приводит к значительному увеличению сывороточного ЛДГ, альдолазы (ALD), GOT и, что особенно важно, CK.Хотя CK и ALD считаются специфичными для скелетных мышц, мозг и сердечная мышца также содержат заметные количества CK. В настоящее время CK считается наиболее специфичным маркером повреждения мышц, доступным для клинического использования.
Относительно небольшое повреждение мышц приводит к увеличению сывороточных CK из-за высокой специфической активности CK в мышцах. КК сыворотки крови может увеличиваться в два или три раза просто в результате внутримышечных инъекций и минимальных физических нагрузок (Anderson et al., 1976). Мышечная ишемия из-за длительной неподвижности, как во время, так и после операции, или синдром «депрессивного» коровы приводит к десятикратному увеличению сывороточного КК. У крупного рогатого скота и лошадей после транспортировки часто наблюдается повышенная активность ЦК.
КК сыворотки крови может увеличиваться в два или три раза просто в результате внутримышечных инъекций и минимальных физических нагрузок (Anderson et al., 1976). Мышечная ишемия из-за длительной неподвижности, как во время, так и после операции, или синдром «депрессивного» коровы приводит к десятикратному увеличению сывороточного КК. У крупного рогатого скота и лошадей после транспортировки часто наблюдается повышенная активность ЦК.
Активность КК в сыворотке у молодых собак вдвое выше, чем у собак в возрасте 6 месяцев и старше, а у самцов активность примерно на 50% выше, чем у самок. Однако у лошадей не наблюдалось никакой связи между возрастом и активностью ЦК (Blackmore and Elton, 1975).
Физические упражнения у лошадей приводят к различному увеличению активности ЦК в сыворотке крови.Величина увеличения коррелирует с количеством упражнений и степенью подготовки, которую лошадь получила ранее. Лошади в хорошей физической форме имеют большее количество КК в состоянии покоя и имеют меньший прирост прироста после тренировки, чем лошади в некондиционном состоянии (Андерсон, 1975). Считается, что эти различия являются результатом некоторой модификации мембраны мышечной клетки, которая позволяет ей сохранять целостность в периоды продолжительной работы. У крыс, тренируемых на беговой дорожке, активность ЦК также увеличивается в четыре-пять раз.Однако предварительная обработка крыс преднизолоном снижает увеличение только в два-три раза (Wagner and Critz, 1968). Было высказано предположение, что потеря CK из мышцы после тренировки произошла из-за того, что стероид модифицировал клеточную мембрану, и было меньше утечки содержимого цитозоля.
Считается, что эти различия являются результатом некоторой модификации мембраны мышечной клетки, которая позволяет ей сохранять целостность в периоды продолжительной работы. У крыс, тренируемых на беговой дорожке, активность ЦК также увеличивается в четыре-пять раз.Однако предварительная обработка крыс преднизолоном снижает увеличение только в два-три раза (Wagner and Critz, 1968). Было высказано предположение, что потеря CK из мышцы после тренировки произошла из-за того, что стероид модифицировал клеточную мембрану, и было меньше утечки содержимого цитозоля.
Наследственные мышечные нарушения возникают у овец, норок, собак, кур, хомяков и мышей (McGavin and Baynes, 1969; Hegreberg et al., 1975; Wentink et al., 1972; Kramer et al., 1976; Асмундсон и Джулиан, 1956; Homburger et al., 1962; Michelson et al., 1955). Когда активная мышечная дегенерация прекратится, значения КК в сыворотке вернутся к норме. Ни в одном из этих нарушений активность сывороточного фермента не имела значения для определения состояния носителя.
Стресс-синдром свиней (PSS) и злокачественная гипертермия свиней (PMH) — это два плохо определяемых, не связанных между собой заболевания, при которых на убое у свиньи бледная, мягкая экссудативная мускулатура.Эти нарушения наблюдаются у тощих пород свиней, как ландрас и пьетрен. У большого процента свиней, чувствительных к PSS, нормальная активность CK и ALD в сыворотке крови в покое. Свиньи с PMH обычно имеют почти нормальную активность CK и ALD в покое, но во время анестезии галотаном у них наблюдается гипертермия, и в течение нескольких часов после выздоровления активность CK и ALD в сыворотке в десять раз выше, чем активность до анестезии. Скрининговые тесты на CK для PSS и PMH использовались при выборе племенных свинок и хряков (Allen et al., 1970; Borgman et al., 1978; Кристиан, 1975 год; van den Hende et al., 1976; Nelson et al., 1974; Woolf et al., 1970).
Пищевые миопатии, связанные с дефицитом витамина Е, селена и серы, часто называют болезнью «белых мышц», и они наблюдались у крупного рогатого скота, собак, лошадей, свиней и кур (Blincoe and Dye, 1958; Orstadius et al. ., 1959; Owen et al., 1977; Noguchi et al., 1973; Манктелоу, 1963; Ван Влит, 1975 год; Van Vleet et al., 1975, 1977). Эти три фактора связаны с поддержанием целостности клеточной мембраны. Утечка ферментов в плазму происходит из самых разных типов клеток. Однако, поскольку мышца составляет наибольшую единичную массу клеток, профиль сывороточного фермента точно отражает повреждение мышц. Повышается активность всех общих внутриклеточных ферментов, таких как GOT и LDH, в дополнение к CK и ALD.
., 1959; Owen et al., 1977; Noguchi et al., 1973; Манктелоу, 1963; Ван Влит, 1975 год; Van Vleet et al., 1975, 1977). Эти три фактора связаны с поддержанием целостности клеточной мембраны. Утечка ферментов в плазму происходит из самых разных типов клеток. Однако, поскольку мышца составляет наибольшую единичную массу клеток, профиль сывороточного фермента точно отражает повреждение мышц. Повышается активность всех общих внутриклеточных ферментов, таких как GOT и LDH, в дополнение к CK и ALD.
При дефиците селена при болезни белых мышц наблюдается значительное снижение глутатионпероксидазы эритроцитов.Глутатионпероксидаза (ГП) — селенсодержащий фермент. Снижение активности GP в печени и эритроцитах у овец с дефицитом селена (Oh et al., 1974), крупного рогатого скота (Segall et al., 1977; Allen et al., 1975) и крыс (Hafeman et al., 1974) оказался эффективным диагностическим тестом, который по крайней мере так же чувствителен, как определение селена. Анализ GP может быть проведен на цельной крови путем точечного скрининга (Segall et al., 1977).Специфическая терапия селеном пациента с дефицитом селена приводит к нормальной активности ЦК в сыворотке в течение нескольких дней.
Анализ GP может быть проведен на цельной крови путем точечного скрининга (Segall et al., 1977).Специфическая терапия селеном пациента с дефицитом селена приводит к нормальной активности ЦК в сыворотке в течение нескольких дней.
Когда ишемия экспериментально индуцируется у собак, происходят классические изменения как изоферментов ЛДГ, так и КК, и эти закономерности являются подходящим признаком сердечной ишемии (Crawly and Sevenson, 1963; Hillis and Braunwald, 1977; Nydick et al., 1957; Ruegsegger et al., 1959; Siegel and Bing, 1956). Гербер (1968) и Хоффман (1967) сообщили об увеличении GPT, GOT и CK и изменениях, связанных с изоферментами ЛДГ у лошадей с различными формами дисфункции сердечной мышцы.
Миопатии скелетных мышц лошадей, такие как синдром связывания и миоглобинурия, также приводят к некрозу мышц и повышению уровня специфических для мышц ферментов в сыворотке крови. Патогенез этих расстройств не совсем определен, но, по-видимому, он связан с выраженным внутримышечным лактоацидозом, который возникает в результате внезапной потребности в энергии, необходимой для выполнения упражнений.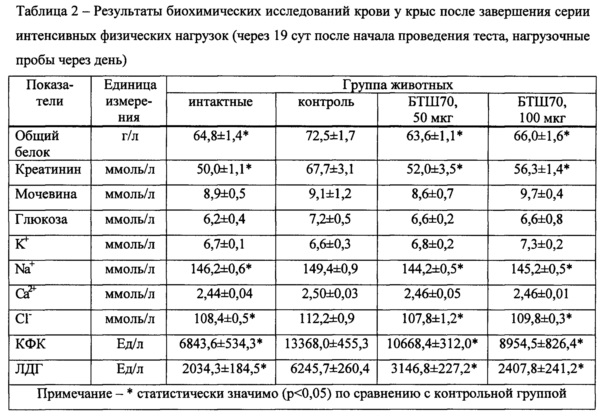 Активность CK и ALD в сыворотке резко возрастает, как и GOT и LDH. Если повреждение прекратится и повреждение не настолько велико, чтобы вызвать инфаркт другой мышцы, активность ЦК значительно снизится в течение 2 дней (Cardinet et al., 1963; Cornelius et al., 1963a; Кроули и Севенсон, 1963; Гербер, 1968). При синдроме «связывания» уровни сывороточных ферментов повышаются до появления клинических признаков. Это контрастирует с миоглобинурией, при которой увеличение происходит при появлении клинических признаков.
Активность CK и ALD в сыворотке резко возрастает, как и GOT и LDH. Если повреждение прекратится и повреждение не настолько велико, чтобы вызвать инфаркт другой мышцы, активность ЦК значительно снизится в течение 2 дней (Cardinet et al., 1963; Cornelius et al., 1963a; Кроули и Севенсон, 1963; Гербер, 1968). При синдроме «связывания» уровни сывороточных ферментов повышаются до появления клинических признаков. Это контрастирует с миоглобинурией, при которой увеличение происходит при появлении клинических признаков.
Лактатдегидрогеназа сыворотки и выживаемость после диагноза рака
Armstrong AJ, George DJ, Halabi S (2012) Лактатдегидрогеназа сыворотки прогнозирует общее улучшение выживаемости у пациентов с метастатической почечно-клеточной карциномой, леченных с ингибированием рапамицина-мишени млекопитающих. J Clin Oncol 30 : 3402–3407.
CAS Статья Google ученый
Augoff K, Hryniewicz-Jankowska A, Tabola R (2014) Лактатдегидрогеназа 5: старый друг и новая надежда в войне с раком. Cancer Lett 358 (1): 1–7.
Артикул Google ученый
Balch CM, Soong S, Atkins MB, Buzaid AC, Cascinelli N, Coit DG, Fleming ID, Gershenwald JE, Houghton A, Kirkwood JM, McMasters KM, Mihm MF, Morton DL, Reintgen DS, Ross MI, Sober A, Thompson JA, Thompson JF (2004) Основанная на фактических данных система определения стадии меланомы кожи. CA Cancer J Clin 54 : 131–149, викторина 182–184.
Артикул Google ученый
Bar J, Spencer S, Morgan S, Brooks L, Cunningham D, Robertson J, Jürgensmeier JM, Goss GD (2014) Корреляция профиля изофермента лактатдегидрогеназы с исходом у пациентов с прогрессирующим колоректальным раком, получавших химиотерапию и бевацизумаб. цедираниб: ретроспективный анализ исследования HORIZON I. Clin Colorectal Cancer 13 : 46–53.
цедираниб: ретроспективный анализ исследования HORIZON I. Clin Colorectal Cancer 13 : 46–53.
CAS Статья Google ученый
Barlow LJ, Badalato GM, McKiernan JM (2010) Сывороточные опухолевые маркеры в оценке опухолей мужских половых клеток. Нат Рев Урол 7 : 610–617.
CAS Статья Google ученый
Brown JE, Cook RJ, Lipton A, Coleman RE (2012) Лактатдегидрогеназа в сыворотке является прогностическим фактором для выживаемости пациентов с метастазами в кости от рака груди: ретроспективный анализ у пациентов, получавших бисфосфонаты. Clin Cancer Res 18 : 6348–6355.
CAS Статья Google ученый
Brown NJ, Higham SE, Perunovic B, Arafa M, Balasubramanian S, Rehman I (2013) Лактатдегидрогеназа-B подавляется метилированием промотора при высокой частоте рака груди человека. PLoS One 8 : e57697.
CAS Статья Google ученый
Danner BC, Didilis VN, Wiemeyer S, Stojanovic T, Kitz J, Emmert A, Füzesi L, Schöndube FA (2010) Долгосрочная выживаемость связана с сывороточным LDH и частично с опухолью LDH-5 при NSCLC. Anticancer Res 30 : 1347–1351.
CAS PubMed Google ученый
Dennison JB, Molina JR, Mitra S, González-Angulo AM, Balko JM, Kuba MG, Sanders ME, Pinto Ja, Gómez HL, Arteaga CL, Brown RE, Mills GB (2013) Лактатдегидрогеназа B: метаболическая маркер ответа на неоадъювантную химиотерапию при раке груди. Clin Cancer Res 19 : 3703–3713.
Clin Cancer Res 19 : 3703–3713.
CAS Статья Google ученый
Drent M, Cobben NA, Henderson RF, Wouters EF, van Dieijen-Visser M (1996) Полезность лактатдегидрогеназы и ее изоферментов в качестве индикаторов повреждения или воспаления легких. Eur Respir J 9 : 1736–1742.
CAS Статья Google ученый
Faloppi L, Scartozzi M, Bianconi M, Svegliati Baroni G, Toniutto P, Giampieri R, Del Prete M, De Minicis S, Bitetto D, Loretelli C, D’Anzeo M, Benedetti A, Cascinu S (2014) Роль сывороточных уровней ЛДГ в прогнозировании общего исхода у пациентов с ГЦК, получавших сорафениб: значение для клинического ведения. BMC Рак 14 : 110.
Артикул Google ученый
Ferreira LMR, Hebrant A, Dumont JE (2012) Метаболическое перепрограммирование опухоли. Онкоген 31 : 3999–4011.
CAS Статья Google ученый
Goldaniga M, Ferrario A, Cortelazzo S, Guffanti A, Pavone E, Ambrosetti A, Marcheselli L, Rossi F, Luminari S, Rossi A, Cro L, Federico M, Lambertenghi Deliliers G, Baldini L (2008) A многоцентровое ретроспективное клиническое исследование CD5 / CD10-негативных хронических В-клеточных лейкозов. Am J Hematol 83 : 349–354.
Артикул Google ученый
Gravis G, Boher JM, Fizazi K, Joly F, Priou F, Marino P, Latorzeff I, Delva R, Krakowski I, Laguerre B, Walz J, Rolland F, Théodore C, Deplanque G, Ferrero JM, Pouessel D, Mourey L, Beuzeboc P, Zanetta S, Habibian M, Berdah JF, Dauba J, Baciuchka M, Platini C, Linassier C, Labourey JL, Machiels JP, Kouri C, El, Ravaud A, Suc E, Eymard JC, Hasbini A, Bousquet G, Soulie M, Oudard S (2014) Прогностические факторы для выживаемости при некастрированном метастатическом раке простаты: проверка модели Гласса и разработка новой упрощенной прогностической модели.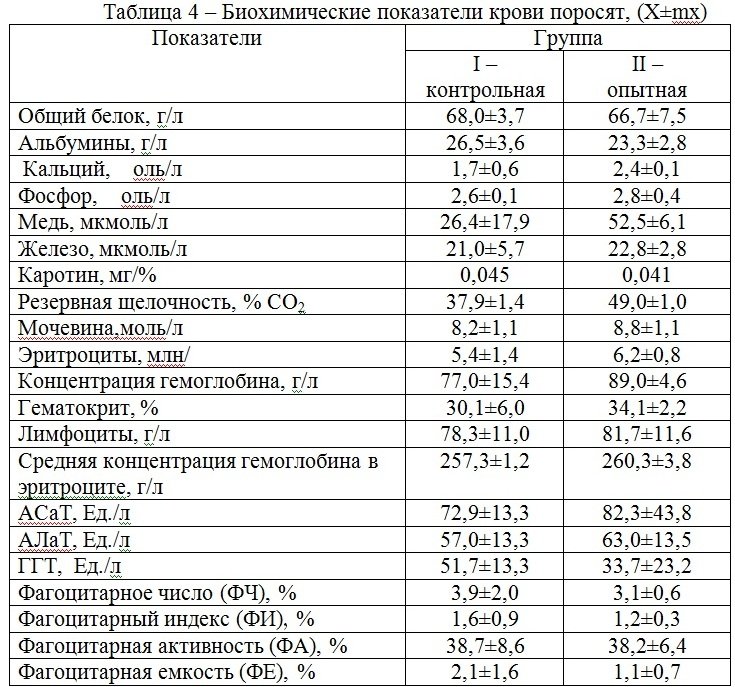 Eur Urol 68 (2): 196–204.
Eur Urol 68 (2): 196–204.
Артикул Google ученый
Ханахан Д., Вайнберг Р.А. (2011) Признаки рака: следующее поколение. Ячейка 144 : 646–674.
CAS Статья Google ученый
Hirschhaeuser F, Sattler UGa, Mueller-Klieser W (2011) Лактат: ключевой метаболический фактор в развитии рака. Cancer Res 71 : 6921–6925.
CAS Статья Google ученый
Holme I, Aastveit AH, Hammar N, Jungner I, Walldius G (2010) Воспалительные маркеры, липопротеиновые компоненты и риск серьезных сердечно-сосудистых событий у 65 005 мужчин и женщин в исследовании Apolipoprotein MOrtality RISk (AMORIS). Атеросклероз 213 : 299–305.
Атеросклероз 213 : 299–305.
CAS Статья Google ученый
Jin Y, Ye X, Shao L, Lin BC, He CX, Zhang BB, Zhang YP (2013) Лактодегидрогеназа в сыворотке надежно предсказывает выживаемость при метастатической карциноме носоглотки, леченной паллиативной химиотерапией. Eur J Cancer 49 : 1619–1626.
CAS Статья Google ученый
Kato GJ, McGowan V, Machado RF, Little JA, Taylor VIJ, Morris CR, Nichols JS, Wang X, Poljakovic M, Morris SM, Gladwin MT (2006) Лактатдегидрогеназа как биомаркер оксида азота, связанного с гемолизом резистентность, приапизм, язвы на ногах, легочная гипертензия и смерть пациентов с серповидно-клеточной анемией. Кровь 107 : 2279–2285.
CAS Статья Google ученый
Кемп М., Донован Дж., Хигэм Х., Хупер Дж. (2004) Биохимические маркеры повреждения миокарда. Br J Anaesth 93 : 63–73.
CAS Статья Google ученый
Ким Дж., Чернышев И., Семенза Г.Л., Данг К.В. (2006) Опосредованная HIF-1 экспрессия киназы пируватдегидрогеназы: метаболический переключатель, необходимый для клеточной адаптации к гипоксии. Cell Metab 3 : 177–185.
Артикул Google ученый
Leiblich A, Cross SS, Catto JWF, Phillips JT, Leung HY, Hamdy FC, Rehman I (2006) Лактатдегидрогеназа-B подавляется гиперметилированием промотора при раке простаты человека.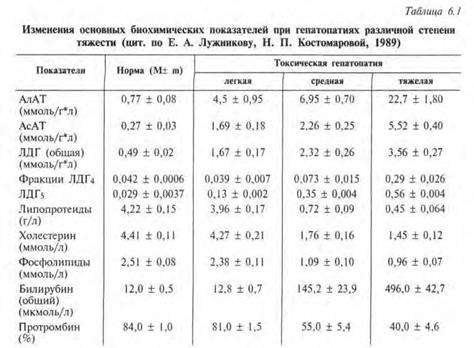 Онкоген 25 : 2953–2960.
Онкоген 25 : 2953–2960.
CAS Статья Google ученый
Lewis BC, Prescott JE, Campbell SE, Shim H, Orlowski RZ, Dang CV (2000) Индукция опухоли с помощью генов-мишеней c-Myc rcl и лактатдегидрогеназы A. Cancer Res 60 : 6178–6183.
CAS PubMed Google ученый
Maekawa M (1988) Изоферменты лактатдегидрогеназы. J Chromatogr 429 : 373–398.
CAS Статья Google ученый
Maekawa M, Taniguchi T, Ishikawa J, Sugimura H, Sugano K, Kanno T (2003) Гиперметилирование промотора при раке подавляет LDHB, устраняя изоферменты 1-4 лактатдегидрогеназы. Clin Chem 49 : 1518–1520.
Clin Chem 49 : 1518–1520.
CAS Статья Google ученый
McCleland ML, Adler AS, Deming L, Cosino E, Lee L, Blackwood EM, Solon M, Tao J, Li L, Shames D, Jackson E, Forrest WF, Firestein R (2013) Требуется лактатдегидрогеназа B. для роста KRAS-зависимых аденокарцином легких. Clin Cancer Res 19 : 773–784.
CAS Статья Google ученый
McFate T, Mohyeldin A, Lu H, Thakar J, Henriques J, Halim ND, Wu H, Schell MJ, Tsang TM, Teahan O, Zhou S, Califano Ja, Jeoung NH, Harris Ra, Verma A (2008 г. ) Активность комплекса пируватдегидрогеназы контролирует метаболический и злокачественный фенотип в раковых клетках. J Biol Chem 283 : 22700–22708.
CAS Статья Google ученый
Nagle SJ, Woo K, Schuster SJ, Nasta SD, Stadtmauer E, Mick R, Svoboda J (2013) Исходы пациентов с рецидивирующей / рефрактерной диффузной большой B-клеточной лимфомой с прогрессированием лимфомы после трансплантации аутологичных стволовых клеток в эпоха ритуксимаба. Am J Hematol 88 : 890–894.
CAS Статья Google ученый
Ostergaard L, Tietze A, Nielsen T., Drasbek KR, Mouridsen K, Jespersen SN, Horsman MR (2013) Взаимосвязь между кровотоком опухоли, ангиогенезом, гипоксией опухоли и аэробным гликолизом. Cancer Res 73 : 5618–5624.
CAS Статья Google ученый
Палмер Б.Ф., Клегг Д.Д. (2014) Зондирование кислорода и метаболический гомеостаз. Mol Cell Endocrinol 397 : 51–58.
CAS Статья Google ученый
Папандреу И., Кэрнс Ра, Фонтана Л., Лим А.Л., Денко NC (2006) HIF-1 опосредует адаптацию к гипоксии, активно подавляя потребление кислорода митохондриями. Cell Metab 3 : 187–197.
CAS Статья Google ученый
Parks SK, Chiche J, Pouysségur J (2013) Нарушение динамики протонов и энергетического метаболизма для лечения рака. Нат Рев Рак 13 : 611–623.
CAS Статья Google ученый
Petrelli F, Cabiddu M, Coinu A, Borgonovo K, Ghilardi M, Lonati V, Barni S (2015) Прогностическая роль лактатдегидрогеназы в солидных опухолях: систематический обзор и метаанализ 76 исследований. Acta Oncol 54 : 961–970.
CAS Статья Google ученый
Polee MB, Hop WCJ, Kok TC, Eskens FA, van der Burg MEL, Splinter TaW, Siersema PD, Tilanus HW, Stoter G, van der Gaast A (2003) Факторы прогноза выживаемости у пациентов с распространенным раком пищевода лечится комбинированной химиотерапией на основе цисплатина. Br J Cancer 89 : 2045–2050.
CAS Статья Google ученый
Pouysségur J, Dayan F, Mazure NM (2006) Передача сигналов гипоксии при раке и подходы к обеспечению регрессии опухоли. Природа 441 : 437–443.
Природа 441 : 437–443.
Артикул Google ученый
Savory DJ, Pryce JD (1980) Прогностическое значение активности ЛДГ при ишемической болезни сердца. Ланцет 2 : 1375–1376.
CAS Статья Google ученый
Scher HI, Jia X, de Bono JS, Fleisher M, Pienta KJ, Raghavan D, Heller G (2009) Циркулирующие опухолевые клетки как прогностические маркеры прогрессирующего, устойчивого к кастрации рака простаты: повторный анализ данных испытаний IMMC38. Ланцет Онкол 10 : 233–239.
CAS Статья Google ученый
Шнайдер Д. , Гальперин Р., Гальперин Д., Буковский И., Хадас Е. (1998) Прогнозирование выживаемости пациентов с распространенным раком яичников в соответствии с моделью риска, основанной на системе оценок. Eur J Gynaecol Oncol 19 : 547–552.
, Гальперин Р., Гальперин Д., Буковский И., Хадас Е. (1998) Прогнозирование выживаемости пациентов с распространенным раком яичников в соответствии с моделью риска, основанной на системе оценок. Eur J Gynaecol Oncol 19 : 547–552.
CAS PubMed Google ученый
Seagroves TN, Ryan HE, Lu H, Wouters BG, Knapp M, Thibault P, Laderoute K, Johnson RS (2001) Фактор транскрипции HIF-1 является необходимым медиатором эффекта Пастера в клетках млекопитающих. Mol Cell Biol 21 : 3436–3444.
CAS Статья Google ученый
Shen Y, Zelen M (2001) Чувствительность скрининга и время пребывания в клинических испытаниях по раннему обнаружению рака груди: маммография и физикальное обследование.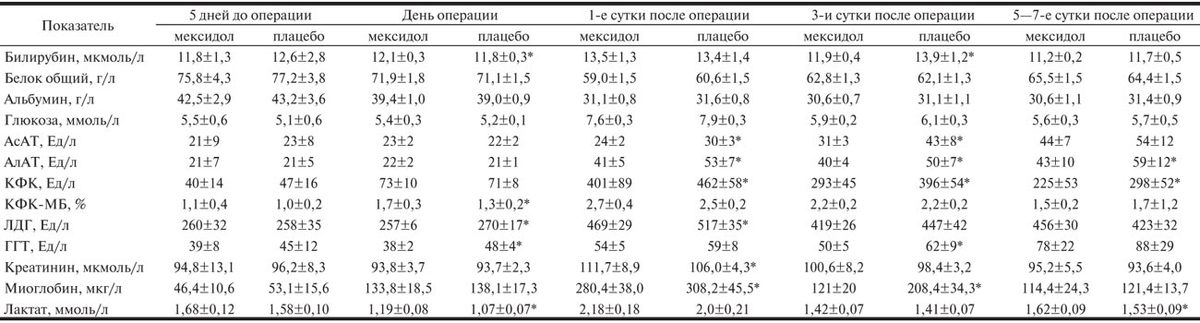 J Clin Oncol 19 : 3490–3499.
J Clin Oncol 19 : 3490–3499.
CAS Статья Google ученый
Shim H, Dolde C, Lewis BC, Wu CS, Dang G, Jungmann RA, Dalla-Favera R, Dang CV (1997) c-Myc трансактивация LDH-A: последствия для метаболизма и роста опухоли. Proc Natl Acad Sci USA 94 : 6658–6663.
CAS Статья Google ученый
Sougioultzis S, Syrios J, Xynos ID, Bovaretos N, Kosmas C, Sarantonis J, Dokou A, Tzivras D, Zografos G, Felekouras E, Papalambros E, Tsavaris N (2011) Паллиативная выживаемость при гастрэктомии и другие факторы, влияющие на общую выживаемость у пациентов с аденокарциномой желудка IV стадии, получающих химиотерапию: ретроспективный анализ. Eur J Surg Oncol 37 : 312–318.
CAS Статья Google ученый
Статистическое управление Швеции (2015 г.) http://www.scb.se/en_/ (дата обращения: 07.02.2015).
Tas F, Aykan F, Alici S, Kaytan E, Aydiner A, Topuz E (2001) Факторы прогноза при карциноме поджелудочной железы: уровни ЛДГ в сыворотке предсказывают выживаемость при метастатическом заболевании. Am J Clin Oncol 24 : 547–550.
CAS Статья Google ученый
Thorne JL, Campbell MJ (2014) Ядерные рецепторы и эффект Варбурга при раке. Int J Cancer 00 : 1–9.
CAS Google ученый
Vander Heiden MG, Cantley LC, Thompson CB (2009) Понимание эффекта Варбурга: метаболические потребности пролиферации клеток. Наука 324 : 1029–1033.
CAS Статья Google ученый
Weide B, Elsässer M, Büttner P, Pflugfelder A, Leiter U, Eigentler TK, Bauer J, Witte M, Meier F, Garbe C (2012) Сывороточные маркеры лактатдегидрогеназы и S100B независимо предсказывают исход заболевания у пациентов с меланомой с отдаленные метастазы. Br J Cancer 107 : 422–428.
CAS Статья Google ученый
Weinberg JB, Volkheimer AD, Chen Y, Beasley BE, Jiang N, Lanasa MC, Friedman D, Vaccaro G, Rehder CW, Decastro CM, Rizzieri DA, Diehl LF, Gockerman JP, Moore JO, Goodman BK, Levesque MC (2007) Клинические и молекулярные предикторы тяжести заболевания и выживаемости при хроническом лимфолейкозе. Am J Hematol 82 : 1063–1070.
Am J Hematol 82 : 1063–1070.
CAS Статья Google ученый
Wulaningsih W, Michaelsson K, Garmo H, Hammar N, Jungner I, Walldius G, Holmberg L, Van Hemelrijck M (2013a) Неорганический фосфат и риск рака в шведском исследовании AMORIS. BMC Cancer 13 : 257.
CAS Статья Google ученый
Wulaningsih W, Michaelsson K, Garmo H, Hammar N, Jungner I, Walldius G, Lambe M, Holmberg L, Van Hemelrijck M (2013b) Кальций в сыворотке и риск рака желудочно-кишечного тракта в шведском исследовании AMORIS. BMC Public Health 13 : 663.
CAS Статья Google ученый
You B, Tranchand B, Girard P, Falandry C, Ribba B, Chabaud S, Souquet PJ, Court-Fortune I, Trillet-Lenoir V, Fournel C, Tod M, Freyer G (2008) Фармакокинетика этопозида и выживание у пациентов с мелкоклеточным раком легкого: многоцентровое исследование. Рак легких 62 : 261–272.
Артикул Google ученый
Zha X, Wang F, Wang Y, He S, Jing Y, Wu X, Zhang H (2011) Лактатдегидрогеназа B имеет решающее значение для гиперактивного mTOR-опосредованного туморогенеза. Cancer Res 71 : 13–18.
CAS Статья Google ученый
Zhou Z, Sehn LH, Rademaker AW, Gordon LI, Lacasce AS, Crosby-Thompson A, Vanderplas A, Zelenetz AD, Abel GA, Rodriguez MA, Nademanee A, Kaminski MS, Czuczman MS, Millenson M, Niland J , Gascoyne RD, Connors JM, Friedberg JW, Winter JN (2014) Расширенный международный прогностический индекс (NCCN-IPI) для пациентов с диффузной крупноклеточной B-клеточной лимфомой, леченных в эру ритуксимаба. Кровь 123 : 837–842.
Кровь 123 : 837–842.
CAS Статья Google ученый
Раки | Бесплатный полнотекстовый | Ответ лактатдегидрогеназы (ЛДГ) на лечение первой линии прогнозирует выживаемость при метастатическом раке молочной железы: первые ключи к экономически эффективному и динамическому биомаркеру
1. Введение
Рак молочной железы (РМЖ) является наиболее распространенным раком среди женщин и занимает второе место причина смерти от рака [1]. Около 6% всех опухолей молочной железы имеют отдаленные метастазы на момент постановки диагноза, а у 30% пациентов с ранним РМЖ наблюдается местный или отдаленный рецидив [2].РМЖ — неоднородное заболевание, включающее отдельные подгруппы с различным прогнозом, основанным на гистологических и молекулярных особенностях [3]. В клинической практике по экспрессии рецептора эстрогена (ER), рецептора прогестерона (PR) и рецептора 2 эпидермального фактора роста человека (HER2) выделяют три основные подгруппы: люминальный рецептор или рецептор гормона положительный (HR-положительный) BC, HER2- положительный BC и тройной отрицательный рак груди (TNBC) [4]. Несмотря на новые методы лечения и улучшенные стандарты лечения, метастатический рак молочной железы (МБК) остается неизлечимым заболеванием со средней выживаемостью около 34 месяцев, даже если она значительно варьирует между подгруппами и внутри них [5].Следовательно, важно идентифицировать факторы, связанные с опухолью и пациентом, которые позволяют прогнозировать агрессивное биологическое поведение и устойчивость к лечению. Недавно было проведено несколько исследований по оценке новых циркулирующих биомаркеров в РМЖ, включая воспалительные факторы [6], экзосомы [7], циркулирующую опухолевую ДНК (цтДНК) [8] и циркулирующие опухолевые клетки (ЦОК) [9]. Однако даже обычно используемые биомаркеры (например, соотношение нейтрофилов и лимфоцитов [10], лактатдегидрогеназа (ЛДГ) [11], щелочная фосфатаза (ЩФ) [12]) предоставляют дополнительную информацию о биологии опухоли и должны быть дополнительно оценены для выявления их прогностическая значимость.ЛДГ — это широко распространенный фермент, который играет центральную роль в анаэробном гликолизе, поскольку он катализирует обратимое превращение пирувата в лактат [13].
Несмотря на новые методы лечения и улучшенные стандарты лечения, метастатический рак молочной железы (МБК) остается неизлечимым заболеванием со средней выживаемостью около 34 месяцев, даже если она значительно варьирует между подгруппами и внутри них [5].Следовательно, важно идентифицировать факторы, связанные с опухолью и пациентом, которые позволяют прогнозировать агрессивное биологическое поведение и устойчивость к лечению. Недавно было проведено несколько исследований по оценке новых циркулирующих биомаркеров в РМЖ, включая воспалительные факторы [6], экзосомы [7], циркулирующую опухолевую ДНК (цтДНК) [8] и циркулирующие опухолевые клетки (ЦОК) [9]. Однако даже обычно используемые биомаркеры (например, соотношение нейтрофилов и лимфоцитов [10], лактатдегидрогеназа (ЛДГ) [11], щелочная фосфатаза (ЩФ) [12]) предоставляют дополнительную информацию о биологии опухоли и должны быть дополнительно оценены для выявления их прогностическая значимость.ЛДГ — это широко распространенный фермент, который играет центральную роль в анаэробном гликолизе, поскольку он катализирует обратимое превращение пирувата в лактат [13]. LDH включает семейство из шести тетрамерных изоферментов [14,15], тканеспецифическая экспрессия которых регулируется как физиологическими, так и патологическими состояниями. Экспрессия гена LDHA повышается при некоторых типах рака, особенно в быстрорастущих опухолях, для поддержания гликолиза в качестве альтернативного источника энергии во время гипоксического стресса и последующего высокого уровня LDH в цитоплазматическом компартменте.Примечательно, что различные внеклеточные факторы, такие как гормоны, факторы роста и цитокины, могут регулировать экспрессию ЛДГ рецептор-зависимыми и независимыми внутриклеточными сигнальными путями (например, белок, связывающий элемент ответа цАМФ (CREB), индуцируемый гипоксией фактор-1 (HIF -1) и c-Myc) [15]. Помимо своей роли в регулировании клеточного метаболизма, ЛДГ является хорошо известным маркером повреждения тканей. Многие патологические состояния, включая рак, проявляются повышением ЛДГ из-за острой гибели или некроза клеток.Более того, высокие уровни ЛДГ в плазме влияют на прогрессирование опухоли и распространение метастазов, что отрицательно влияет на исход при различных типах рака [16,17,18,19,20,21,22,23,24,25].
LDH включает семейство из шести тетрамерных изоферментов [14,15], тканеспецифическая экспрессия которых регулируется как физиологическими, так и патологическими состояниями. Экспрессия гена LDHA повышается при некоторых типах рака, особенно в быстрорастущих опухолях, для поддержания гликолиза в качестве альтернативного источника энергии во время гипоксического стресса и последующего высокого уровня LDH в цитоплазматическом компартменте.Примечательно, что различные внеклеточные факторы, такие как гормоны, факторы роста и цитокины, могут регулировать экспрессию ЛДГ рецептор-зависимыми и независимыми внутриклеточными сигнальными путями (например, белок, связывающий элемент ответа цАМФ (CREB), индуцируемый гипоксией фактор-1 (HIF -1) и c-Myc) [15]. Помимо своей роли в регулировании клеточного метаболизма, ЛДГ является хорошо известным маркером повреждения тканей. Многие патологические состояния, включая рак, проявляются повышением ЛДГ из-за острой гибели или некроза клеток.Более того, высокие уровни ЛДГ в плазме влияют на прогрессирование опухоли и распространение метастазов, что отрицательно влияет на исход при различных типах рака [16,17,18,19,20,21,22,23,24,25]. Прогностическая роль ЛДГ в плазме. уровни исследовались и в Британской Колумбии. Первые доказательства относятся к концу 1990-х — началу 2000-х годов, когда три обширных исследования показали, что повышенные уровни ЛДГ в плазме связаны с плохим исходом у пациентов с МБК [26,27,28]. Было также доказано, что высокие уровни ЛДГ в плазме значительно связаны с повышенным риском рецидива заболевания и смерти [12,29].Примечательно, что недавний метаанализ подтвердил эти данные как для MBC, так и для раннего BC [11].
Прогностическая роль ЛДГ в плазме. уровни исследовались и в Британской Колумбии. Первые доказательства относятся к концу 1990-х — началу 2000-х годов, когда три обширных исследования показали, что повышенные уровни ЛДГ в плазме связаны с плохим исходом у пациентов с МБК [26,27,28]. Было также доказано, что высокие уровни ЛДГ в плазме значительно связаны с повышенным риском рецидива заболевания и смерти [12,29].Примечательно, что недавний метаанализ подтвердил эти данные как для MBC, так и для раннего BC [11].Тем не менее, нет данных о прогностической роли динамического ответа ЛДГ на терапию первой линии у невыбранных пациентов с MBC. Таким образом, мы провели исследовательское исследование, чтобы определить прогностическое влияние вариаций ЛДГ в плазме после 12 недель лечения первой линии как на выживаемость без прогрессирования (PFS), так и на общую выживаемость (OS) при MBC.
3. Обсуждение
Во многих исследованиях сообщалось, что повышенные уровни ЛДГ в плазме связаны с плохими исходами при различных опухолях [30].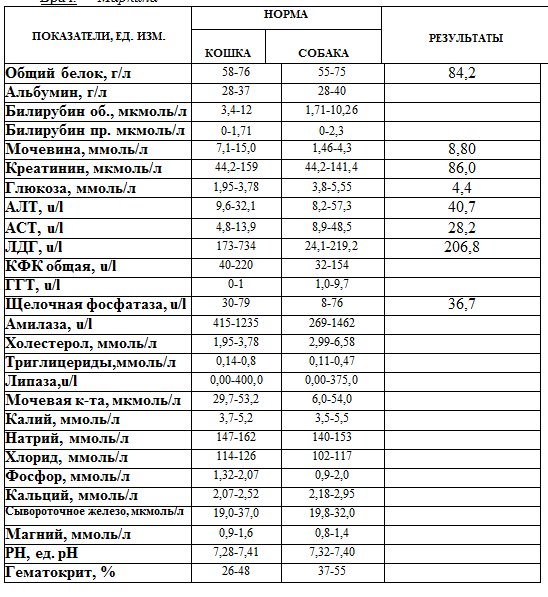 Недавний метаанализ, включающий 76 исследований, проведенных у пациентов с несколькими типами рака, подтвердил, что высокие уровни ЛДГ в плазме связаны с более короткими ВБП и ОВ [31]. Хотя прогностическая роль ЛДГ при раке хорошо известна, лежащие в основе биологические механизмы все еще неясны, и были выдвинуты некоторые возможные объяснения. Во-первых, высокие плазменные концентрации ЛДГ поддерживают анаэробный метаболизм во время роста опухоли и метастатического распространения, поддерживая энергетические потребности в условиях гипоксии [32].Во-вторых, ЛДГ оказывает воспалительное действие на микроокружение опухоли, активируя интерлейкин (IL) -23 и IL-17 и модулируя активность аргиназы I. Он ингибирует активацию CD8 + T-лимфоцитов и естественных киллеров (NK), позволяя раковым клеткам уклоняться от иммунного ответа. [33]. Более того, высокие уровни ЛДГ способствуют ангиогенезу опухоли, миграции клеток и метастатизации за счет ингибирования деградации HIF-1 альфа и увеличения продукции фактора роста эндотелия сосудов (VEGF) [34].
Недавний метаанализ, включающий 76 исследований, проведенных у пациентов с несколькими типами рака, подтвердил, что высокие уровни ЛДГ в плазме связаны с более короткими ВБП и ОВ [31]. Хотя прогностическая роль ЛДГ при раке хорошо известна, лежащие в основе биологические механизмы все еще неясны, и были выдвинуты некоторые возможные объяснения. Во-первых, высокие плазменные концентрации ЛДГ поддерживают анаэробный метаболизм во время роста опухоли и метастатического распространения, поддерживая энергетические потребности в условиях гипоксии [32].Во-вторых, ЛДГ оказывает воспалительное действие на микроокружение опухоли, активируя интерлейкин (IL) -23 и IL-17 и модулируя активность аргиназы I. Он ингибирует активацию CD8 + T-лимфоцитов и естественных киллеров (NK), позволяя раковым клеткам уклоняться от иммунного ответа. [33]. Более того, высокие уровни ЛДГ способствуют ангиогенезу опухоли, миграции клеток и метастатизации за счет ингибирования деградации HIF-1 альфа и увеличения продукции фактора роста эндотелия сосудов (VEGF) [34].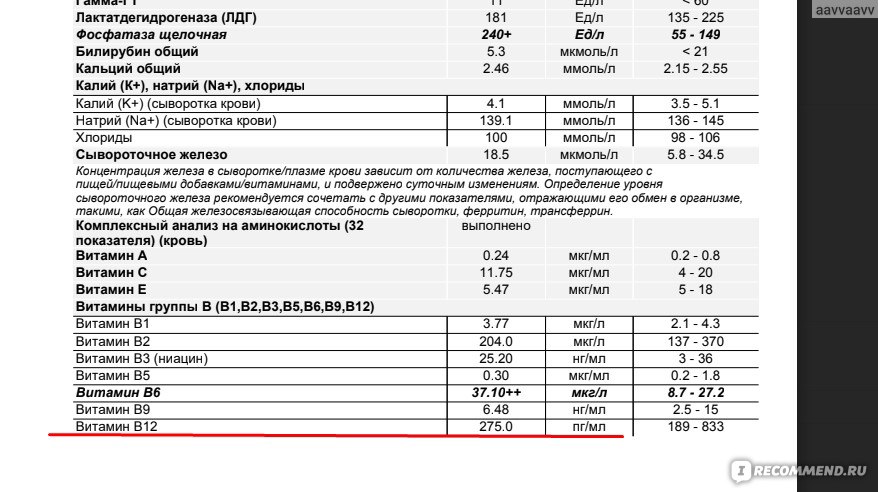 В-третьих, предварительные данные свидетельствуют о том, что повышенная экспрессия LDHA и гиперпродукция лактата также могут играть роль в устойчивости к лекарствам [35].
В-третьих, предварительные данные свидетельствуют о том, что повышенная экспрессия LDHA и гиперпродукция лактата также могут играть роль в устойчивости к лекарствам [35].В настоящем исследовании изучали прогностическое влияние уровней ЛДГ в плазме на исходы выживаемости у пациентов с МБК при лечении первой линии.
Приблизительно 31% обследованных пациентов имели высокие исходные уровни ЛДГ и около 32% имели вариацию ЛДГ во время лечения первой линии. В частности, у 15% пациентов был стабильно высокий уровень ЛДГ, а у 18% — колебания от низкого к высокому.
Результаты подтвердили, что повышенные исходные уровни ЛДГ были независимо связаны с более короткой ВБП (6.87 против 13,12 месяцев, скорректированный HR 1,51, 95% ДИ: 1,02–2,26, p = 0,039) и OS (19,23 против 46,19 месяцев, скорректированный HR 1,64, 95% ДИ: 1,05–2,55, p = 0,027). Эти данные были также подтверждены, когда уровни ЛДГ в плазме были оценены как непрерывная переменная (ВБП, ОС), поэтому наши результаты не зависели от предварительно заданного порогового значения для нормальных плазматических концентраций ЛДГ. Насколько нам известно, это первое исследование, демонстрирующее, что изменения ЛДГ во время лечения первой линии значительно влияют как на ВБП, так и на ОВ у невыбранных пациентов с МБК.В частности, пациенты с повышенным исходным уровнем ЛДГ в плазме, которые поддерживали высокие уровни ЛДГ после 12 недель лечения первой линии, испытали худшие ВБП и ОВ по сравнению с пациентами со стабильными нормальными уровнями ЛДГ даже после поправки на другие прогностические факторы (HR 2,88, 95% ДИ: 1,40–5,89, p = 0,0038 и HR 2,61, 95% ДИ 1,16–5,86, p = 0,02 для OS и PFS соответственно). Интересно, что, поскольку повышенные уровни ЛДГ в плазме могут также отражать наличие высокой опухолевой нагрузки, локализации костей, метастазов в печень и вариаций уровней ЩФ, следует отметить, что их прогностическая ценность сохранялась после включения этих ковариат в многомерную регрессионную модель Кокса.
Насколько нам известно, это первое исследование, демонстрирующее, что изменения ЛДГ во время лечения первой линии значительно влияют как на ВБП, так и на ОВ у невыбранных пациентов с МБК.В частности, пациенты с повышенным исходным уровнем ЛДГ в плазме, которые поддерживали высокие уровни ЛДГ после 12 недель лечения первой линии, испытали худшие ВБП и ОВ по сравнению с пациентами со стабильными нормальными уровнями ЛДГ даже после поправки на другие прогностические факторы (HR 2,88, 95% ДИ: 1,40–5,89, p = 0,0038 и HR 2,61, 95% ДИ 1,16–5,86, p = 0,02 для OS и PFS соответственно). Интересно, что, поскольку повышенные уровни ЛДГ в плазме могут также отражать наличие высокой опухолевой нагрузки, локализации костей, метастазов в печень и вариаций уровней ЩФ, следует отметить, что их прогностическая ценность сохранялась после включения этих ковариат в многомерную регрессионную модель Кокса.
 В соответствии с нашими выводами, недавнее исследование, проведенное у пациентов с TNBC, подтвердило, что изменения ЛДГ после двух циклов химиотерапии первой линии коррелируют с частотой объективного ответа и ВБП [36].
В соответствии с нашими выводами, недавнее исследование, проведенное у пациентов с TNBC, подтвердило, что изменения ЛДГ после двух циклов химиотерапии первой линии коррелируют с частотой объективного ответа и ВБП [36].Таким образом, LDH может прогнозировать выживаемость пациентов с MBC и обеспечивает независимую и динамическую прогностическую информацию во время лечения первой линии.Учитывая наши результаты, пациенты со стабильно высоким уровнем ЛДГ или с повышенным уровнем ЛДГ во время терапии первой линии могут чаще контролироваться на предмет прогрессирования заболевания, поскольку у них может быть более короткая ВБП. И наоборот, пациенты со стабильными нормальными уровнями ЛДГ будут испытывать длительные ВБП и ОВ. Тем не менее, поскольку эти данные проспективно не подтверждены, вариацию ЛДГ нельзя рассматривать как косвенное доказательство прогрессирования опухоли или ответа, даже если они предлагают дополнительную прогностическую информацию.
В нашем исследовании тканевая экспрессия LDH-A не проверялась. Однако его связь с плазматическим LDH может быть полезна для определения, связано ли повышение уровня LDH в плазме в первую очередь с опухолью или нет, исследуя биологическое значение и прогностическое значение их соответствия или несоответствия. Согласно предыдущим исследованиям, повышенная экспрессия тканевого LDH-A связана с повышенным Ki-67, высокой скоростью пролиферации и метастазами в ЦНС в TNBC [37].
Однако его связь с плазматическим LDH может быть полезна для определения, связано ли повышение уровня LDH в плазме в первую очередь с опухолью или нет, исследуя биологическое значение и прогностическое значение их соответствия или несоответствия. Согласно предыдущим исследованиям, повышенная экспрессия тканевого LDH-A связана с повышенным Ki-67, высокой скоростью пролиферации и метастазами в ЦНС в TNBC [37]. Основным преимуществом нашего исследования является определение динамического, простого в использовании, недорогого и воспроизводимого прогностического биомаркера у пациентов с невыбранным MBC.Однако это ретроспективное и одноцентровое исследование. Таким образом, проспективное и внешнее подтверждение является обязательным. Более того, пороговое значение LDH для нормальности, введенное в этом исследовании, может отличаться в других центрах; следовательно, его воспроизводимость должна быть подтверждена. Наконец, мы не рассматривали потенциальное взаимодействие нескольких других неопухолевых заболеваний (например, сердечной недостаточности, анемии, гипотиреоза, аутоиммунных заболеваний и заболеваний легких), которые могут влиять на уровни ЛДГ в плазме.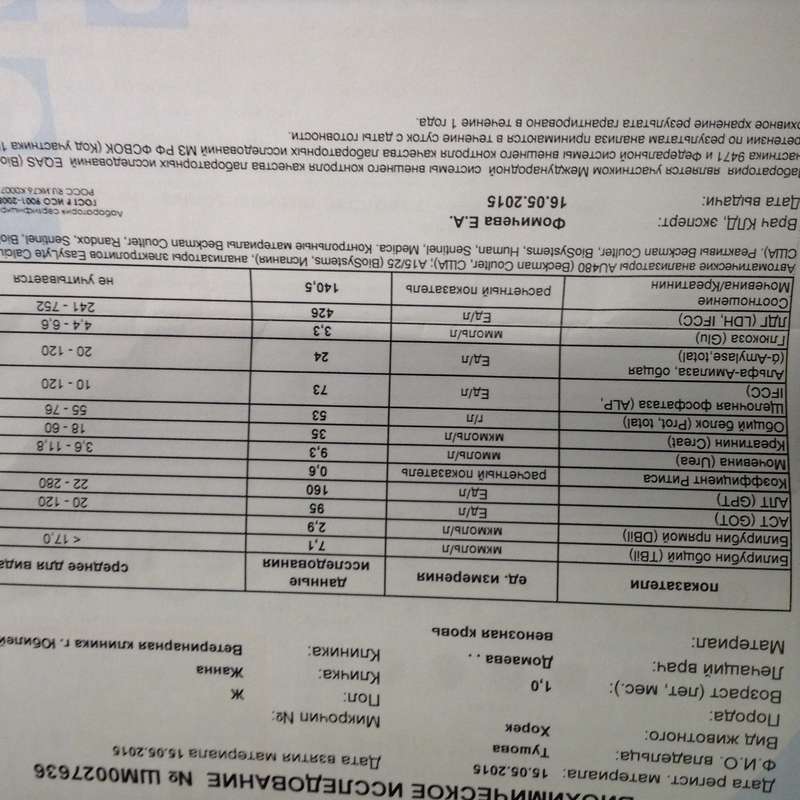


 Также важно учитывать, что у одного и того же человека может быть несколько причин подъема LDH.
Также важно учитывать, что у одного и того же человека может быть несколько причин подъема LDH.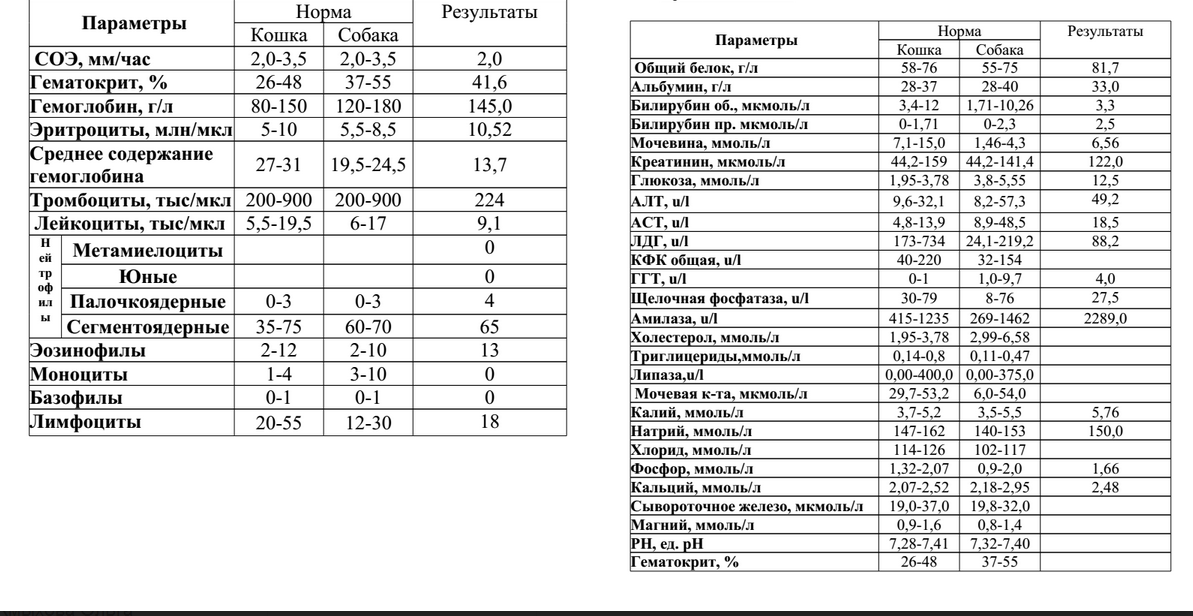 д.),
д.),
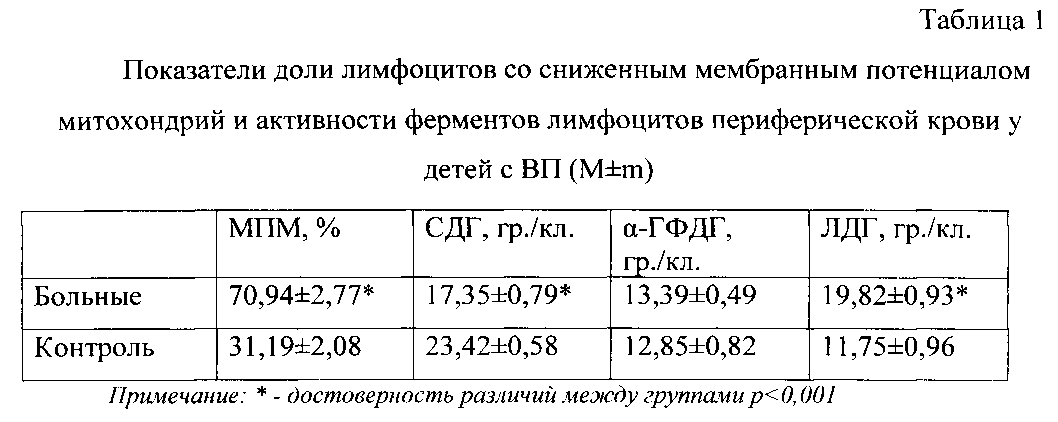 ЛДГ также служит одним из важных диагностических маркеров кожной лимфомы. Концентрация ЛДГ-5 продемонстрирована как предиктор лучевой и химиотерапевтической реакции у онкологических больных.ЛДГ полезен при оценке пациентов с метастатическим раком. Напротив, ЛДГ-5 служит маркером радиосенсибилизации.
ЛДГ также служит одним из важных диагностических маркеров кожной лимфомы. Концентрация ЛДГ-5 продемонстрирована как предиктор лучевой и химиотерапевтической реакции у онкологических больных.ЛДГ полезен при оценке пациентов с метастатическим раком. Напротив, ЛДГ-5 служит маркером радиосенсибилизации.
 , Франк П.Ф., Гелла Ф.Дж., Хельцель В., Йоргенсен П.Дж., Канно Т., Кесснер А., Клауке Р., Кристиансен Н., Лессинджер Дж. М., Линзингер TP, Misaki H, Panteghini M, Pauwels J, Schimmel HG, Vialle A, Weidemann G, Siekmann L. Первичные эталонные процедуры IFCC для измерения концентраций каталитической активности ферментов при 37 ° C. Часть 3. Эталонная процедура для измерения каталитическая концентрация лактатдегидрогеназы.Clin Chem Lab Med. 2002 июн; 40 (6): 643-8. [PubMed: 12211663]
, Франк П.Ф., Гелла Ф.Дж., Хельцель В., Йоргенсен П.Дж., Канно Т., Кесснер А., Клауке Р., Кристиансен Н., Лессинджер Дж. М., Линзингер TP, Misaki H, Panteghini M, Pauwels J, Schimmel HG, Vialle A, Weidemann G, Siekmann L. Первичные эталонные процедуры IFCC для измерения концентраций каталитической активности ферментов при 37 ° C. Часть 3. Эталонная процедура для измерения каталитическая концентрация лактатдегидрогеназы.Clin Chem Lab Med. 2002 июн; 40 (6): 643-8. [PubMed: 12211663]
 [Бесплатная статья PMC: PMC5207234] [PubMed: 27738103]
[Бесплатная статья PMC: PMC5207234] [PubMed: 27738103]
 Х.Гипоксия и физические упражнения вызывают как высвобождение лактата, так и его окисление мозгом человека. FASEB J. 2012 июл; 26 (7): 3012-20. [PubMed: 22441982]
Х.Гипоксия и физические упражнения вызывают как высвобождение лактата, так и его окисление мозгом человека. FASEB J. 2012 июл; 26 (7): 3012-20. [PubMed: 22441982] Медико-спортивные упражнения. 2000 апр; 32 (4): 756-63. [PubMed: 10776894]
Медико-спортивные упражнения. 2000 апр; 32 (4): 756-63. [PubMed: 10776894] 2019 Май; 19 (3): 213-217. [Бесплатная статья PMC: PMC6542220] [PubMed: 31092513]
2019 Май; 19 (3): 213-217. [Бесплатная статья PMC: PMC6542220] [PubMed: 31092513] Cancer Res. 2018 15 августа; 78 (16): 4459-4470. [Бесплатная статья PMC: PMC6095720] [PubMed: 298]
Cancer Res. 2018 15 августа; 78 (16): 4459-4470. [Бесплатная статья PMC: PMC6095720] [PubMed: 298] , Табола Р. Лактатдегидрогеназа 5: старый друг и новая надежда в мире война с раком. Cancer Lett. 2015 01 марта; 358 (1): 1-7. [PubMed: 25528630]
, Табола Р. Лактатдегидрогеназа 5: старый друг и новая надежда в мире война с раком. Cancer Lett. 2015 01 марта; 358 (1): 1-7. [PubMed: 25528630] Исходные биомаркеры исходов у пациентов с меланомой, получавших пембролизумаб. Clin Cancer Res. 2016 15 ноября; 22 (22): 5487-5496. [Бесплатная статья PMC: PMC5572569] [PubMed: 27185375]
Исходные биомаркеры исходов у пациентов с меланомой, получавших пембролизумаб. Clin Cancer Res. 2016 15 ноября; 22 (22): 5487-5496. [Бесплатная статья PMC: PMC5572569] [PubMed: 27185375] Выявление дефицита D-лактатдегидрогеназы у человека. Nat Commun. 2019 Апрель 01; 10 (1): 1477. [Бесплатная статья PMC: PMC6443703] [PubMed: 30931947]
Выявление дефицита D-лактатдегидрогеназы у человека. Nat Commun. 2019 Апрель 01; 10 (1): 1477. [Бесплатная статья PMC: PMC6443703] [PubMed: 30931947]