Церебральная ишемия у новорожденных: симптомы, степени, лечение, последствия
Церебральная ишемия у новорожденных – заболевание, вызванное кислородным голоданием, сопровождающееся поражением головного мозга. Без терапии оно приводит к тяжелым осложнениям. Своевременная диагностика и медицинская помощь предупреждают патологические изменения в мозге и увеличивают шансы ребенка на нормальную жизнь.Причины церебральной ишемии у новорожденных
Заболевание может развиться как на последних сроках беременности, так и в момент родов. Чаще всего кислородное голодание возникает в результате остановки дыхания в родах, гипоксии плода, тугого обвития пуповиной. Также церебральная ишемия распространена среди недоношенных детей, так как их сосудистая система до конца не сформирована.
Второе название церебральной ишемии новорожденных – гипоксически-ишемическая энцефалопатия
Другие причины болезни:
- предлежание или преждевременная отслойка плаценты, нарушение кровообращения в ней;
- стремительные или затянувшиеся роды;
- маловодие;
- удушение плода в ходе родов в результате обвития пуповиной;
- врожденные пороки развития сердечно-сосудистой системы младенца;
- нарушение целостности пуповины в момент родов;
- инфицирование при родовом процессе;
- плацентарная недостаточность;
- обильные кровотечения у младенца после появления на свет.

К факторам риска принадлежит недоношенность, рождение малыша на позднем сроке, более 42 недель, многоплодная беременность, возраст роженицы более 35 лет. На состояние сосудистой системы младенца также влияет поздний токсикоз, хронические заболевания беременной, в частности гипертония или гипохромная анемия, высокая температура у женщины во время родов, нездоровый образ жизни матери, бактериальные инфекции.
Симптомы
При церебральной ишемии мозг младенца не может функционировать нормально. На начальных этапах признаки могут быть незаметны, новорожденный не отличается от здоровых детей, хотя болезнь развивается сразу после рождения. Отклонения проявляются по мере прогрессирования патологии.
Симптомы церебральной ишемии наиболее выражены у глубоко недоношенных детей
Основные признаки:
- высокая судорожная активность;
- проявления синдрома перевозбуждения – беспокойность, плохой сон, капризность, плаксивость;
- отставание ребенка в развитии;
- проявления синдрома угнетения – снижение мышечного тонуса, вялость, ухудшение рефлексов глотания и сосания,
- может быть заметна разница в движениях рук и ног слева и справа.

В более тяжелых случаях вероятно обморочное или коматозное состояние. Среди их симптомов следует отметить отсутствие рефлексов и реакций на раздражители, нарушение пульса и дыхания, снижение давления. Малыш нуждается в экстренной помощи медиков.
Степени
Клинические проявления церебральной ишемии во многом зависят от стадии болезни:
- I степень. Это наиболее благоприятная по прогнозам стадия. Признаки болезни проявляются в первые дни жизни младенца, но исчезают в течение 3-5 суток. Это плаксивость, беспокойство, повышенный тонус мышц, вялость.
- II. Состояние ребенка тяжелое. Может быть отсутствие движений в руке и ноге с одной стороны.
- III. Самая тяжелая и неблагоприятная с точки зрения прогноза стадия. Функции дыхания нарушены, из-за чего младенец нуждается в подключении к аппарату искусственной вентиляции легких. У малыша снижается давление, замедляется пульс, возникают судороги, вероятна кома.
Признаки последней стадии заметны сразу.
Диагностика
Заболевание обнаруживается неонатологом непосредственно при осмотре новорожденного по симптомам. Врач замечает нарушение рефлексов. Для подтверждения диагноза потребуется следующее обследование:
- анализ крови – клинический, биохимический, определение уровня кислорода и углекислого газа, коагулограмма;
- нейросонография;
- при необходимости — КТ головного мозга.
По данным обследования выявляется ишемические очаги в головном мозге, нарушения в анализах крови.
Лечение
Лечебные мероприятия зависят от тяжести и времени болезни, но основная их цель остается неизменной – нормализовать мозговое кровообращение, предупредить патологические изменения.
Если у ребенка лишь незначительные признаки поражения, то медикаментозная терапия не нужна или назначаются ноотропные препараты (энцефабол и т.д.) После выписки ребенок должен наблюдаться у невролога, так как существует риск отклонений.
К лечению новорожденного может быть привлечен невропатолог, нейрохирург
На 2 и 3 стадии не обойтись без медикаментозной терапии, а иногда и хирургического вмешательства. Для лечения младенца применяются препараты таких групп:
- ноотропные — для питания клеток головного мозга;
- противосудорожные – снижают судорожную активность;
- общеукрепляющие – витаминные комплексы для поддержания нормальной работы мозга и организма;
- кардиотонические, гипертензивные – улучшают периферическое кровообращение.
Ни в коем случае нельзя подбирать препараты для лечения самостоятельно.
Если состояние малыша тяжелое, то его немедленно переводят в реанимацию. При тромбозе тромб, ставший причиной кислородного голодания, удаляется в ходе операции. После малыша ожидает длительной период реабилитации.
Последствия
 Если не остановить прогрессирование патологии, то вероятен летальный исход.
Если не остановить прогрессирование патологии, то вероятен летальный исход.К счастью, церебральная ишемия 1 степени проходит без серьезных осложнений. Ребенок может часто жаловаться на головную боль, повышенную усталость, плохую память, малышу присуща гиперактивность.
Последствия последних стадий:
- гиподинамия – снижение двигательной активности;
- головная боль;
- судороги, эпилепсия;
- ДЦП;
- отставание в умственном и физическом развитии.
Если начать лечебные мероприятия на раннем сроке, пока нет серьезных последствий, то можно нормализовать самочувствие ребенка, избежать необратимых осложнений. Период реабилитации после выздоровления младенца занимает 6-12 месяцев.
Специального лечения для восстановления поврежденных клеток мозга не существует, поэтому важно как можно раньше вывить церебральную ишемию. Состояние ребенка зависит от продолжительности кислородного голодания. Чем тяжелее гипоксия, тем печальнее прогнозы.
Смотрите далее: у ребенка кружится голова
степени, симптомы и причины, лечение и отзывы
Ишемия головного мозга возникает у младенцев по нескольким причинам. Это состояние довольно тяжелое и требует постоянного медицинского наблюдения. Малыши находятся в стационаре, для полного обследования и лечения. Возникновение заболевания происходит по причине недостаточного кровоснабжения головного мозга из-за закупорки сосудов.
Причины ишемии головного мозга у новорожденных
Узнайте больше о хронической ишемии головного мозга из нашей аналогичной статьи.
Данная болезнь у новорожденных происходит по нескольким причинам. В большинстве случаев, врачи в состоянии устранить закупорку сосудов и малыши идут на поправку.
Причины:
- В сосуде образуется тромб, который закрывает просвет и не дает крови нормально циркулировать.
 Если к головному мозгу кровь не проходит совсем, то он может умереть.
Если к головному мозгу кровь не проходит совсем, то он может умереть. - Кессонная болезнь может вызвать ишемию мозга, так как она способствует попаданию пузырьков воздуха в головной мозг.
- При переломе трубчатых костей ног и рук, в кровоток попадает жир, что способствует ишемии головного мозга.
- Различные травмы и повреждения внутренних органов ребенка, в частности, легких, влияют на попадание пузырьков воздуха в сосуды, а далее в мозг. Также это может случиться из-за неправильного внутривенного укола, когда в вену вводится воздух.
- Ядовитые вещества, появившиеся в организме малыша в результате жизнедеятельности паразитов, вызывают закупоривание сосудов. Кровь не поступает в мозг, и малыш страдает ишемией.
- Кровеносные сосуды просто сдавлены образованием, растущим в головном мозге.
- Атеросклеротические бляшки также сужают просвет сосудов или полностью его закупоривают, за счет чего кровь не поступает в головной мозг.

Если головной мозг пострадал в результате ишемии, необходимо как можно скорее возобновить его работу, иначе последствия могут быть плачевными. Сегодня существует масса лекарственных препаратов, способных быстро избавить от тромбов и очистить сосуды, но иногда требуется хирургическое вмешательство.
Ишемия головного мозга у новорожденного – что делать?
Родители младенцев должны знать, какие признаки могут означать ишемию головного мозга у ребенка и при появлении таких симптомов обязательно отвезти ребенка в больницу.
Сегодняшняя медицина способна вылечить многие болезни, все зависит от стадии. Ишемию последнее время лечат довольно эффективно, но все зависит от стадии болезни, иногда врачи бессильны.
1 степень ишемии головного мозга у новорожденных
Такая степень ишемии головного мозга самая легкая. Заметить отклонения в поведении младенца с этим диагнозом, вполне возможно. При первых подозрениях на ишемию, необходимо срочно обращаться к врачу.
Начальная стадия этой болезни означает, что головной мозг малыша снабжается кровью, но ее объема недостаточно для нормального функционирования органа. Причин возникновению такого состояния, масса. Медицинское обследование покажет полную клиническую картину, и немедленное начало лечения позволит ребенку полностью выздороветь.
Практически все дети младенческого возраста подвержены беспокойству и плачу, но если такое состояние длится долго и малыш не успокаивается лучше показать его врачу.
2 степень ишемии головного мозга у новорожденных
Эта степень тяжести ишемии головного мозга у новорожденных более опасна, симптомы выражены сильнее и тяжелее. Такое состояние малыша обусловлено очень плохим кровоснабжением головного мозга. Если вовремя не начать лечение, болезнь может прогрессировать, и мозг ребенка будет полностью поражен.
Не увидеть у своего ребенка признаков ишемии данной степени просто невозможно. Такие симптомы очень опасны и означают, что головной мозг новорожденного поврежден уже достаточно сильно.
Такие симптомы очень опасны и означают, что головной мозг новорожденного поврежден уже достаточно сильно.
3 степень ишемии головного мозга у новорожденного
Лечение малыша с такой степенью тяжести болезни, может быть долгим, а результат не всегда хорошим. Головной мозг ребенка значительно повреждается, и обратить процесс, бывает очень тяжело. Зачастую при данной степени заболевания, врачи прибегают к лечению хирургическим путем.
Симптомы и признаки
Признаки ишемии 1 степени:
- Беспокойное поведение новорожденного.
- Вялость.
- Неспокойный сон.
- Сильное возбуждение.
- Ослабевание рефлексов.
Признаки ишемии 2 степени:
- Судороги.
- Обморочные состояния.
- Частое срыгивание пищи.
- Бледность кожных покровов.
- Постоянное беспокойное поведение младенца.
Признаки ишемии 3 степени:
- Повторяющиеся обмороки.

- Сильные судороги.
- Практически полная потеря слуха и зрения.
- Рвота.
Лечение
Лечение направлено на восстановление работы кровеносной системы. С помощью препаратов врачи расширяют стенки сосудов, чтобы кровь могла свободно двигаться к головному мозгу.
1 степень
Данная степень ишемии у младенцев не требует назначения лекарственных препаратов:
- Лечение включает в себя массажи и лечебную гимнастику.
- Кроме того, ребенок во время терапии должен проживать в комфортных условиях.
- Комнату, где находится новорожденный, необходимо проветривать несколько раз в день.
- Нельзя перекармливать малыша и нарушать режим дня.
2 степень
Болезнь такой степени требует более серьезного подхода:
- Иногда врачи разрешают лечить младенца дома, но регулярно приносить ребенка на осмотры.

- Терапия включает в себя прием мочегонных и противосудорожных препаратов.
- Для нормализации деятельности сердца, ребенок принимает специальные лекарства.
- Восстановить работу нервной системы, можно с помощью ноотропов.
Если у ребенка с ишемией 2 степени были зафиксированы судороги, то физическое воздействие на него противопоказано, а в случае отсутствия таковых, дополнительный эффект терапии оказывают массажи и гимнастика.
3 степень
Большое распространение процесса ишемии может серьезно навредить младенцу. Лечение такого состояния осуществляется только в условиях стационара. Доктор назначает необходимые лекарственные препараты. Если медикаментозное лечение не приносит быстрого улучшения состояния малыша, производится хирургическое вмешательство.
Эта степень ишемии головного мозга очень тяжела. Чтобы восстановить функционирование головного мозга, нужны серьезные меры. Чем быстрее начато лечение, тем больше шанс на выздоровление.
Чем быстрее начато лечение, тем больше шанс на выздоровление.
Массажи
Массажи при ишемии мозга у новорожденных играют большую роль. На ранней стадии процесса болезни, вполне возможно, вылечить ребенка таким физическим воздействием. Действие массажа направлено на улучшение кровоснабжения всех органов и систем организма, особенно головного мозга.
Массажная терапия способна увеличить кровоток, за счет чего расширяются стенки сосудов у младенца, и головной мозг получает кровь в полном объеме. Следует учитывать, что тяжелые степени данной болезни невозможно вылечить только лишь массажем, а его применение, вообще, стоит под вопросом.
Судороги, присутствующие у больного малыша, служат противопоказанием к проведению данной процедуры. Физическое воздействие может спровоцировать появление новых приступов.
Последствия
Ранние степени ишемии головного мозга у новорожденных проходят практически без последствий для самого малыша. Такой диагноз ставится врачами достаточно часто, но тяжелые формы болезни могут сказаться на дальнейшем развитии ребенка не лучшим образом.
Такой диагноз ставится врачами достаточно часто, но тяжелые формы болезни могут сказаться на дальнейшем развитии ребенка не лучшим образом.
Одно из самых тяжелых осложнений ишемии 3 степени, является ДЦП. Лечение этого недуга довольно сложное. Полностью излечить такое заболевание невозможно. Ребенку с этим диагнозом необходимо постоянное лечение, включающее в себя лекарственные препараты, массажи и гимнастику.
Умственная отсталость – это еще одно серьезное последствие ишемии головного мозга. Дети с таким заболеванием постоянно требуют внимания и заботы родителей. Существуют различные санатории и профилактические заведения для детей с психическими отклонениями. В этих учреждениях частично восстанавливают здоровье таких детей.
Отзывы об ишемии головного мозга у новорожденных
- Моему ребенку поставили диагноз – ишемия головного мозга, сразу после рождения. Я жутко переживала, но степень тяжести оказалась первая, и мы лечились дома.
 Я возила ребенка на массажи и гимнастику, сделала все возможное, чтобы вылечить своего малыша, и мы выздоровели. Прошло уже 6 месяцев, как мы полностью здоровы.
Я возила ребенка на массажи и гимнастику, сделала все возможное, чтобы вылечить своего малыша, и мы выздоровели. Прошло уже 6 месяцев, как мы полностью здоровы. - Мне сказали врачи в роддоме, что у моей дочери ишемия. Это произошло, потому что роды прошли не очень благополучно и ребенок был травмирован. Степень болезни у нее 2. Я не знаю что делать.
- Хорошие врачи всегда помогут. Я со своим сыном лежала в больнице около месяца. Сразу после рождения ему поставили диагноз – ишемия 2 степени. Я даже не переживала, потому что знала, что все будет хорошо. Так и вышло. Мы здоровы.
- Моему мальчику поставили этот страшный диагноз – ишемия головного мозга. Ребенок только появился на свет, а уже столько страданий. Я заметила, что он ведет себя как-то не так. У него постоянно дергались ручки и ножки, он кричал и даже один раз его вырвало. Не знаю даже, что делать дальше. Степень вроде вторая.
- Я носила свою малышку на массажи.
 Нам сказали, что у нее ишемия головного мозга 1 степени. Все процедуры ей очень помогли, хотя я не замечала у нее каких-то отклонений. На плановом осмотре невролога, врач нам поставила такой диагноз.
Нам сказали, что у нее ишемия головного мозга 1 степени. Все процедуры ей очень помогли, хотя я не замечала у нее каких-то отклонений. На плановом осмотре невролога, врач нам поставила такой диагноз. - У моего сына ДЦП — это последствия тяжелой формы ишемии. Сразу после роддома мы поехали домой, но потом я стала замечать, что ребенок постоянно срыгивает и странно дергает ручками и ножками. Нам назначили пить какие-то таблетки, мы их пропили, но не помогло. На следующем приеме у врача, нам сказали, что состояние моего ребенка ухудшилось, и положили в больницу. Что только не делали врачи, чтобы спасти моего ребенка. Он жив, но последствия этой болезни ужасны.
Церебральная ишемия головного мозга у новорожденных
О чем может думать каждая мама в период беременности? Конечно, большую часть мыслей занимает ее крошечный малыш, который толкается внутри нее. Я уверена, что каждая женщина не раз представляла, каким родится малыш, на кого будет похож.
Это и есть самый правильный подход. Только светлые мысли должны посещать ваше сознание в этот период. Однако, что же делать если в первые часы после родов у ребенка диагностировали церебральную ишемию?
Главное, не впадайте в панику, правильно подобранное лечение принесет свои положительные плоды. Итак, я предлагаю разобрать сегодня, что это за болезнь, какая причина ее появления и какие симптомы вам могут помочь ее диагностировать.
Признаки и симптомы церебральной ишемии головного мозга у новорожденных
Для начала давайте попробуем разобраться в сути самого заболевания. Итак, церебральная ишемия это – заболевание, которое может возникать в результате недостатка кислорода, который необходим для развития головного мозга. В мире принято выделять две формы болезни: врожденная и хроническая. Первая упоминается, когда речь идет о детях, а вторая характерна для людей в возрасте.
Своевременное лечение дает положительные результаты. Соответственно, очень важно вовремя заметить первые признаки, которые свидетельствуют о начале развития проблемы.
Итак, давайте посмотрим, какие симптомы требуют немедленного обращения к специалисту:
- Новорожденный часто плачет без причин, легко возбудим, плохо спит, может периодически вздрагивать или появляться тремор.
- Может отмечаться пониженная активность, он плохо сосет грудь и глотает.
- Увеличен размер родничка, кроме того, внутричерепное давление также повышенно. Это происходит в результате того, что в головном мозге начинает скапливаться жидкость.
- Могут появляться судороги, периодические подергивания конечностей и головы, а также появление коматозных состояний, которые сопровождаются нарушением координации движений или потерей сознания.
- Кожные покровы новорожденных принимают мраморный оттенок.
- Могут отмечаться нарушения в работе желудочно-кишечного тракта – понос, вздутие, тошнота, рвота или запор у грудничка.
В случае, если вы отметили у новорожденного один или несколько симптомов, не стоит впадать в панику, но в то же время, это является обязательным поводом скорейшего обращения к врачу.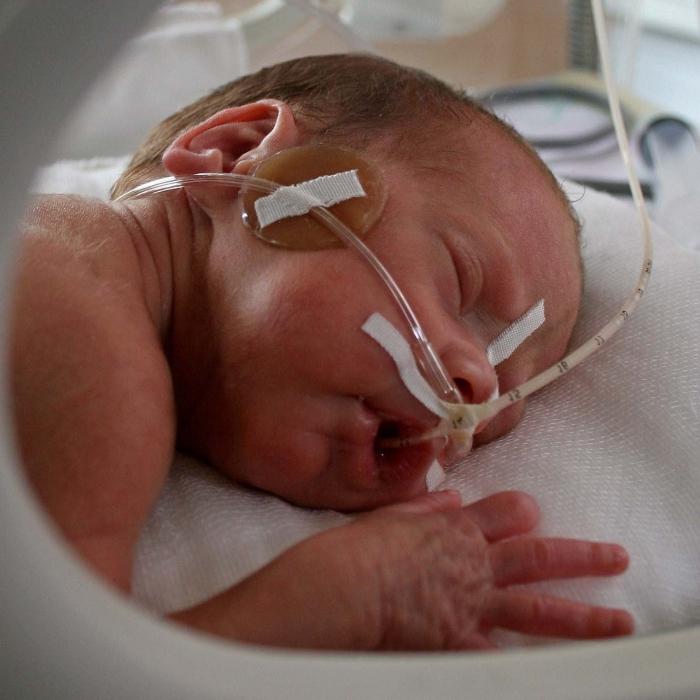 Стоит отметить, что проявление первых признаков чаще всего происходит в первые сутки или двое после рождения крохи. Поэтому, если вы видите какие-либо нарушения или его состояние вызывает у вас сомнения, обратитесь на пост дежурного врача.
Стоит отметить, что проявление первых признаков чаще всего происходит в первые сутки или двое после рождения крохи. Поэтому, если вы видите какие-либо нарушения или его состояние вызывает у вас сомнения, обратитесь на пост дежурного врача.
Как возникает церебральная ишемия
У большей половины случаев данное состояние возникает у плода еще во время внутриутробного развития. Чаще всего причиной тому является образование тромба в одном из сосудов, который идет к головному мозгу.
Кроме того, причиной может стать недоразвитость сосудов, которые питают головной мозг. Наиболее часто заболевание отмечается у детей, которые родились в результате преждевременных родов, то есть раньше планируемого срока, так как именно у них чаще всего наблюдается недоразвитие сосудистой системы. В результате вышеописанных причин в головной мозг попадает совсем небольшое количество крови, а вместе с тем и кислорода.
Несвоевременное лечение может привести к тому, что начнется поражение более крупных участков мозга, кровоизлияние или другие неприятные осложнения.
Причины
Развитие церебральной ишемии у новорожденного возможно в результате каких-либо проблем во время последнего триместра беременности или осложнений, возникших в процессе родов. Итак, вот несколько причин, которые чаще всего активизируют развитие данной болезни:
- Осложнения в процессе родоразрешения: обвитие пуповиной, длительные роды, травмы, полученные в ходе этого процесса, операция кесарево сечение, а также занесения инфекции в период родов.
- Недоношенные детки.
- Внутриутробная гипоксия плода.
- Острая плацентарная недостаточность.
- Нарушения свертываемости крови или тромбоз у плода, другие нарушения кровообращения.
- Наличие инфекционных болезней или заболеваний сердечно-сосудистой системы, дыхательной или мочеполовой, у будущей мамы в период беременности.
Факторы риска
Примерно около 15-20-й недели беременности женщине выдается обходной лист, с которым она должна обойти несколько врачей. К ним относятся: ЛОР, эндокринолог, хирург, окулист и терапевт. У всех них стоит задача вовремя диагностировать и назначить адекватное лечение. Так, после обхода всех специалистов, беременная женщина приходит к терапевту.
К ним относятся: ЛОР, эндокринолог, хирург, окулист и терапевт. У всех них стоит задача вовремя диагностировать и назначить адекватное лечение. Так, после обхода всех специалистов, беременная женщина приходит к терапевту.
Он, в свою очередь, выясняет, какие заболевания, врожденные или наследственные, могут представлять собой опасность для новорожденного. К основной группе риска развития болезни у новорожденного относят:
- Различные неврологические или сосудистые заболевания у матери, особенно, если они ей достались по наследству.
- Возраст беременной более 35 лет.
- Нарушения в работе эндокринной системы.
- Длительные, преждевременные роды.
- Многоплодная беременность.
- Гестоз.
- Несоблюдение мамой в период гестации здорового образа жизни.
- Обострение острых или хронических болезней в период вынашивания малыша.
Диагностика
Чаще всего диагностировать наличие болезни у ребенка удается в течение буквально первых нескольких часов после родов.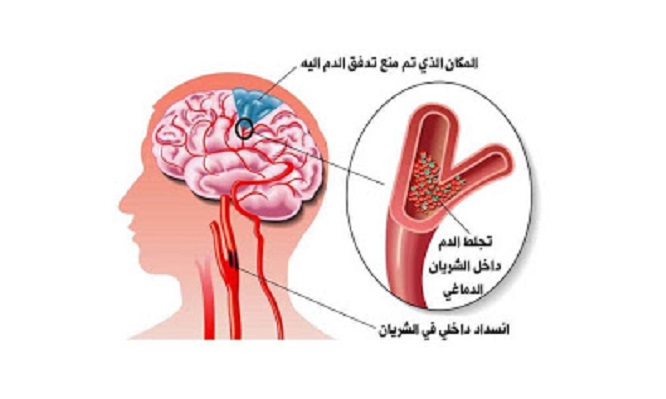 О возможном наличии патологии свидетельствует отсутствие рефлексов или наличие каких-либо отклонений при их проверке. Кроме того, свидетельствовать о заболевании может наличие отклонений в общем анализе крови. В случае положительного диагноза он показывает повышенный уровень углекислого газа.
О возможном наличии патологии свидетельствует отсутствие рефлексов или наличие каких-либо отклонений при их проверке. Кроме того, свидетельствовать о заболевании может наличие отклонений в общем анализе крови. В случае положительного диагноза он показывает повышенный уровень углекислого газа.
При диагностике болезни на более поздних стадиях может быть назначена магнитно-резонансная томография и/или электроэнцефалография. Целью данных исследований является выявления скрытых судорог и других отклонений в работе мозга.
Степени
Церебральная ишемия 1-й степени у новорожденного
Данная форма болезни – самая легкая. Она сопровождается слабым проявлением симптомов в первые 3-5 дней после рождения. В основном может наблюдаться:
- Нервное возбуждение или наоборот, угнетение.
- Усиление сухожильных рефлексов.
- Небольшой мышечный тонус.
В данном случае новорожденный находится под наблюдением врача, а все перечисленные симптомы проходят самостоятельно и не требуют медикаментозного вмешательства.
Церебральная ишемия 2-й степени у новорожденного
Чаще всего эта форма болезни проявляет себя на вторые сутки после рождения. И она считается достаточно опасной. К ее проявлениям относят:
- Выраженные остановки дыхания во сне.
- Ослабление мышечного тонуса.
- Снижение сосательных и хватательных рефлексов.
- Увеличение объемов головы за счет скопления там жидкости.
- Изменения цвета кожи.
- Нарушения координации и потеря сознания.
Симптомы церебральной ишемии могут отмечаться в течение 2-4 недель после рождения. В данном случае новорожденный постоянно находится под контролем врачей и проходит терапию. В случае необходимости может быть проведено хирургическое вмешательство с целью удаления тромба.
Церебральная ишемия 3-й степени у новорожденного
Эта форма болезни – самая тяжелая и сопровождается она следующими признаками:
- Отсутствием рефлексов.
- Возможным впадением плода в кому.

- Нарушениями ритма сердца.
- Возможны проблемы с самостоятельным дыханием.
- Резкое повышение артериального давления.
- Изредка может наблюдаться косоглазие.
В принципе для диагностики такой тяжелой формы опытному врачу требуется около 5 минут времени. В случае подтверждения диагноза ребенка отправляют в реанимацию и, в случае необходимости, подключают к аппарату искусственной вентиляции легких.
Лечение церебральной ишемии у новорожденных
Данная болезнь может пройти бесследно, если будет вовремя диагностировано и назначено правильное лечение. Нередко третья стадия может привести к летальному исходу.
Главной целью проведения всех манипуляций является восстановление кровотока в головном мозге и устранение последствий болезни. Так, при диагностировании 1-й степени достаточно будет введения в ежедневный режим новорожденного массажа для улучшения кровообращения, а также контроль за постоянным наличием достаточного объема свежего воздуха в помещении.
При диагностировании 2-й и 3-й стадии должно быть проведено комплексное лечение. Чаще всего оно включает назначение: противосудорожных препаратов, мочегонных средств, препаратов, которые разжижают кровь, сосудорасширяющие препараты, электрофорез, расслабляющий массаж. Кроме того, при необходимости может быть назначено удаление тромба путем хирургического вмешательства. В случаях нарушения со стороны дыхательной системы может быть назначена искусственная вентиляция легких.
Последствия церебральной ишемии головного мозга 2-й, 3-й степени у новорожденного
Считается, что лечить саму ишемию головного мозга намного проще на ранних стадиях, нежели справиться с ее последствиями. К наиболее частым последствиям перенесенной церебральной ишемии 2-й степени можно отнести: нарушения сна, раздражительность, головные боли, замкнутость, снижение мышечного тонуса.
Перенесенная церебральная ишемия 3-й степени имеет более серьезные последствия, например: ДЦП, аутизм, умственная отсталость, симптом Грефе и другие. Однако, расстраиваться преждевременно не стоит, так как есть определенный процент новорожденных, который переносит заболевание даже 3-й степени без последствий.
Однако, расстраиваться преждевременно не стоит, так как есть определенный процент новорожденных, который переносит заболевание даже 3-й степени без последствий.
Видео
Я предлагаю вам посмотреть краткий видеообзор такого заболевания, как церебральная ишемия. Дело в том, что болезнь может поражать как новорожденных, так и людей пожилого возраста. Узнать причины развития заболевания вы можете, посмотрев короткий видеосюжет.
К сожалению, ни подготовка к беременности, ни к родам не могут дать 100% гарантии в том, что данное заболевание не коснется вашего ребенка. Однако, не стоит впадать в панику. Ведь своевременное диагностирование заболевания и своевременное начало лечения приносит однозначный положительный результат.
Поделитесь теперь вы с нами в комментариях на сайте, была ли у вашего ребенка или у знакомых церебральная ишемия, какие методы лечения были выбраны и остались ли какие-то последствия после перенесенного заболевания?
Церебральная ишемия у новорожденных: степени, последствия, лечение
Церебральная ишемия, или ишемия головного мозга — патологическое состояние, связанное с кислородным голоданием нервных клеток.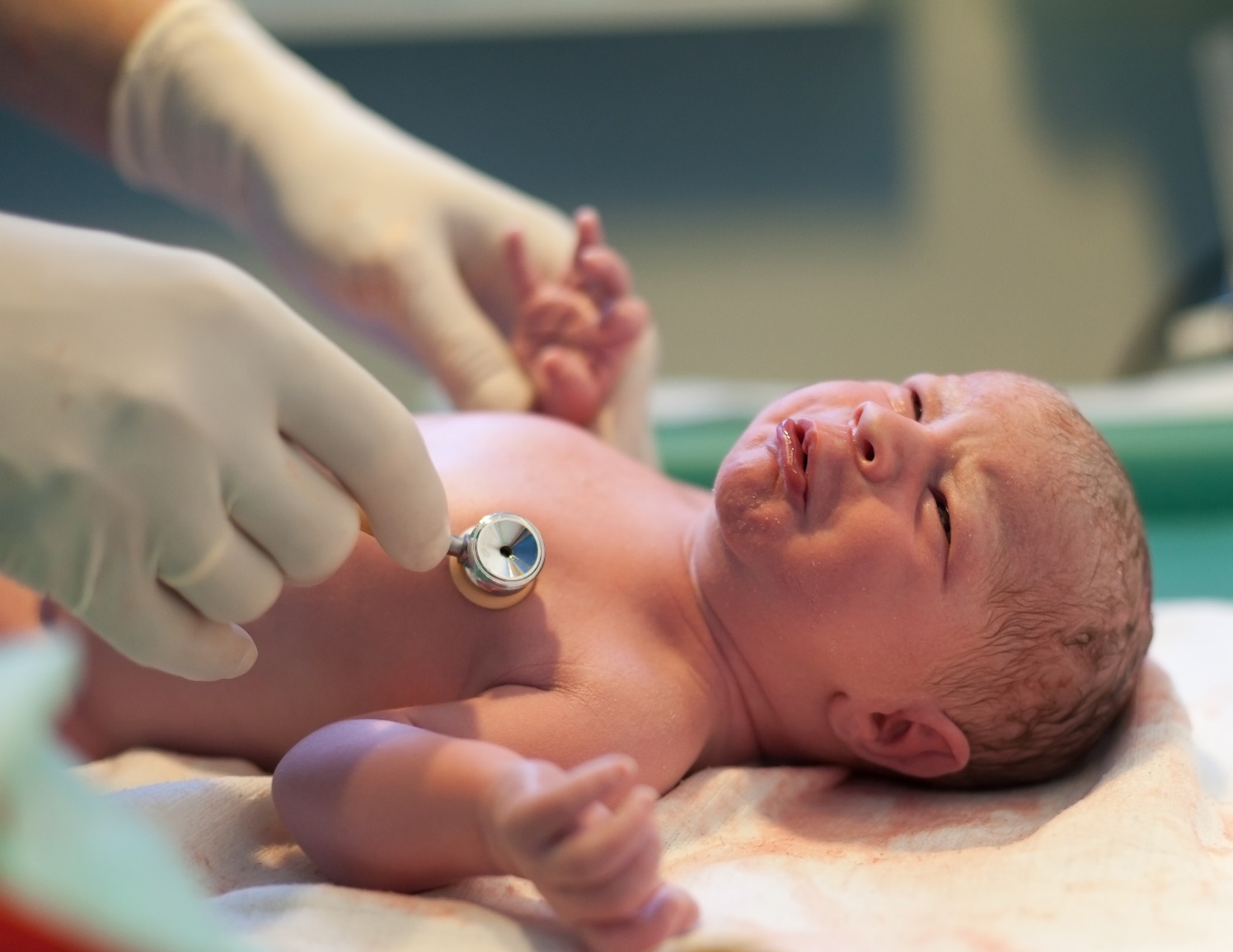 Является следствием гипоксии — снижения концентрации кислорода в крови ниже нормы.
Является следствием гипоксии — снижения концентрации кислорода в крови ниже нормы.
Ее осложнение, в виде ишемической энцефалопатии тяжелой степени – главная причина детской инвалидности и перинатальной смертности.
Причины возникновения болезни
Церебральная ишемия – это не диагноз, а синдром, входящий в состав различных заболеваний. Страдать данной патологией может абсолютно любой: от плода в утробе матери и младенца, до престарелого человека.
В зависимости от возраста, причины развития патологии могут быть разными.
У новорожденных это:
- Хронические заболевания матери, перенесенные острые респираторные заболевания во время беременности.
- Алкоголизм, табакокурение и наркотическая зависимость матери.
- Акушерская патология: обвитие пуповиной, слабость родовой деятельности, преждевременная отслойка нормально расположенной плаценты, предлежание плаценты, пережатие пуповины, преждевременные роды, стремительные роды, переношенная беременность, поздний гестоз.

- Гипертермия мамы на момент родов.
- Родовая травма позвоночника, особенно шейного отдела.
- Послеродовая патология: сепсис, профузные кровотечения.
- Пороки развития.
- Внутриутробная пневмония.
- Возраст матери младше 20 и старше 35 лет.
У детей старшего возраста и взрослых:
- Врожденные пороки развития.
- Хронические тяжелые заболевания бронхолегочной системы.
- Нейроинфекции.
- Хроническая сердечно-сосудистая недостаточность.
- Атеросклероз сосудов головного мозга и крупных артерий.
- Артериальная гипертензия.
- Сахарный диабет.
- Аномалии сосудов головного мозга (мальформации, аневризмы).
- Системные васкулиты.
- Амилоидоз.
- Заболевания крови.
Патогенез развития церебральной ишемии у взрослых и новорожденных схож, несмотря на разные причины возникновения.
Нервная клетка не имеет собственных запасов энергии, а получает их извне с током крови. Любой энергетический голод (в результате нарушения кровотока или снижения насыщаемости питательными веществами крови) ведет к ее дистрофическому повреждению, а в тяжелых случаях и к некрозу.
Степени развития и их признаки
Классификация ишемии основывается на выраженности синдрома угнетения мозговых функций. У младенцев критерии немного отличаются от детей старшего возраста и взрослых.
Это связано незрелостью самой нервной системы и особенностью неврологического осмотра новорожденных.
Новорожденные:
| Симптом | 1 степень | 2 степень | 3 степень |
| Начало развития симптомов | Первые 7 дней | Первые сутки | Сразу после рождения |
| Общее состояние | Возбуждение, частый плач, иногда наоборот сонливость | Заторможен, частые обмороки | Глубокое церебральное угнетение |
| Мышечный тонус | Повышен | Ослаблен | Снижен или отсутствует |
| Сухожильные рефлексы | Повышены | Снижены | Снижены или отсутствуют |
| Рефлексы новорожденных | В норме или незначительно ослаблены | Снижены | Значительно снижены или отсутствуют |
| Нарушение дыхания | Отсутствует | Частые эпизоды апноэ во сне | Частые апноэ, необходимость в ИВЛ |
| Патология сердечно-сосудистой системы | Отсутствует | Нарушение ритма | Различные нарушения ритма, гипотензия |
| Патология зрения | Отсутствует | Косоглазие | Косоглазие, нистагм, дискоординированное движение глаз |
| Судороги | Отсутствует | Возможны клонические | Частые, вплоть до эпистатуса |
| Гидроцефалия | Отсутствует | Возможна транзиторная | Прогрессирующая |
У взрослых и детей старшего возраста тотальная ишемия развивается постепенно, на фоне других заболеваний.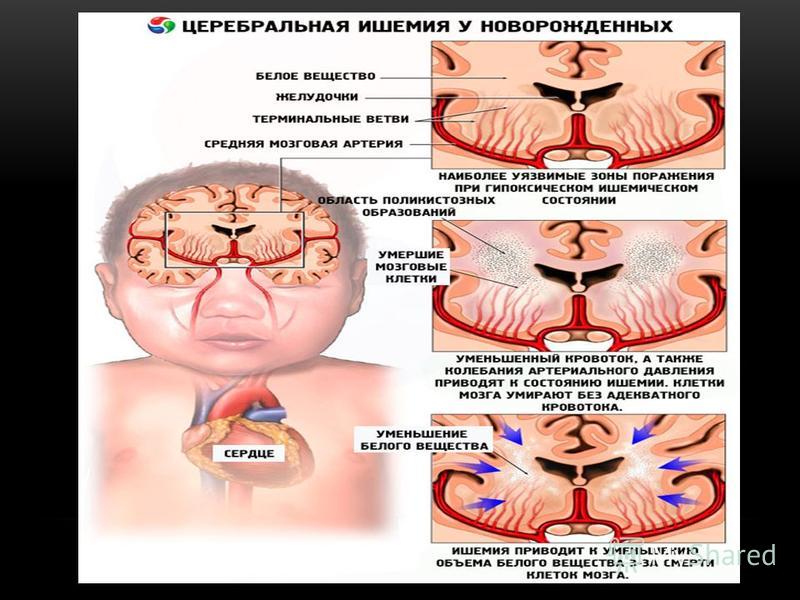
1 степень:
- Частые головные боли. У детей может проявляться перепадами настроения, постоянным плачем;
- Бессонница;
- Быстрая утомляемость;
- Ухудшение памяти, концентрации внимания, мышления;
- Начальные нарушения координации;
- Изменение походки — становится шаркающей, семенящей;
- Пожилые люди становятся нетерпимы к критике в свой адрес;
- Изменение характера;
- Появление патологических рефлексов периода новорожденности не в младенчестве.
2 степень:
- Шаткость походки, нарушения координации движений;
- Слабость в конечностях;
- Головные боли и головокружение;
- Возможны эпизоды судорог;
- Выраженные нарушения памяти, внимания;
- Эмоциональная нестабильность, апатия;
- Изменение личностных качеств;
- Часто бывает слезливость;
- Больные постепенно утрачивают повседневные и профессиональные навыки.
3 степень:
- Глубокое нарушение координации движений;
- Спастические парезы и параличи;
- Различные нарушения сознания, вплоть до комы;
- Значительное затруднение, вплоть до полной неспособности ориентации в пространстве;
- Глубокие нарушения памяти, мышления вплоть до деменции;
- Затруднение речи;
- Неконтролируемое мочеиспускание;
- Синдром Паркинсона.

Диагностика
Методы диагностики также будут различны.
Плод
Если у плода есть признаки гипоксии, то вероятнее всего будут признаки церебральной ишемии и у грудничка.
Поэтому дородовое наблюдение мамы направлено на раннее выявление гипоксического состояния ребенка и принятие мер для его коррекции:
- УЗИ плода. Определяется биофизический профиль плода и признаки задержки внутриутробного развития.
- Допплерография. Исследуется кровоток в плаценте и пупочных сосудах. Выявляются признаки повышенной резистентности сосудов плода.
- Кардиотокография. Оценивается изменение ЧСС плода в ответ на сокращение матки.
Новорожденный
При наличии признаков внутриутробной гипоксии и\или факта асфиксии во время родов наличие ишемии головного мозга не подвергается сомнению.
Но иногда клиническая картина не до конца ясна, или требуется более детальное обследование для определения степени церебрального угнетения.
Тогда используют дополнительные методы исследования:
- Нейросонография (НСГ).
 Метод достаточно прост в выполнении и информативен. Выявляет наличие структурных изменений в веществе мозга, а также отек и набухание головного мозга. НЕ является ведущим методом, поскольку часто дает ложные результаты, как положительные, так и отрицательные.
Метод достаточно прост в выполнении и информативен. Выявляет наличие структурных изменений в веществе мозга, а также отек и набухание головного мозга. НЕ является ведущим методом, поскольку часто дает ложные результаты, как положительные, так и отрицательные. - Допплерография мозгового кровообращения. Выявляет различные нарушения церебрального кровообращения. Например, увеличение кровотока за счет расширенных артерий, уменьшение его скорости в некоторых ветвях.
- КТ, МРТ. Подробная визуализация патологических изменений.
- ЭЭГ. Для определения степени повреждения нейронов, выявления судорожной готовности головного мозга, подбора адекватной противосудорожной терапии.
- Анализ ликвора (цереброспинальной жидкости) по показаниям.
- Все лабораторные исследования: общеклинические, биохимические показатели крови, коагулограмма, электролиты крови.
Дети старшего возраста и взрослые
В первую очередь всегда оцениваются жалобы, анамнез заболевания и неврологический статус.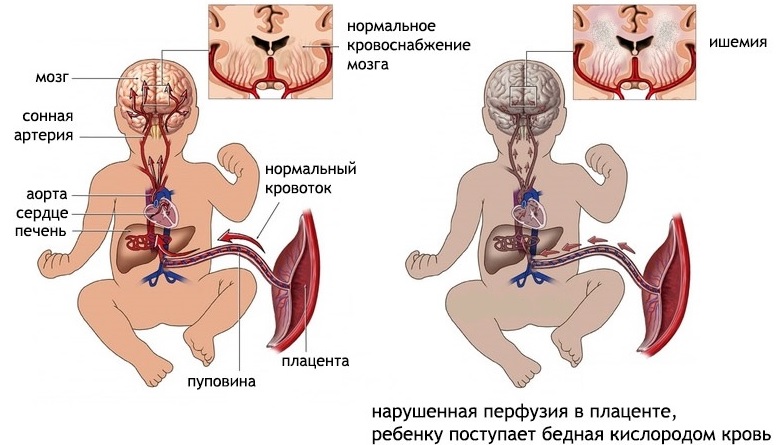
Для точной диагностики применяют инструментальные методы исследования:
- МРТ или КТ с ангиографией. Определение конкретного уровня окклюзии сосуда, признаки других сосудистых нарушений, а также очаговые изменения в веществе мозга.
- УЗДГ (ультразвуковая допплерография) и дуплексное сканирование сосудов шеи. По их состоянию можно косвенно судить о состоянии внутримозговых сосудов (степень поражения атеросклеротическими бляшками).
- Реоэнцефалография. При невозможности выполнить более точные исследования.
- ЭКГ, ЭхоКГ. Для выявление кардиогенных причин ишемии.
- ЭЭГ. Оценка активности нейронов, судорожные очаги.
- Общеклинические и биохимические показатели крови.
- Анализ ликвора (для исключения нейроинфекции).
Как происходит лечение?
Следует понимать, что полностью восстановить поврежденные структуры мозга невозможно. Современная медицина в состоянии лишь остановить прогрессирование патологии и помочь мозгу частично компенсировать нарушенные функции.
Лечение в остром периоде направлено на поддержание жизненно важных функций организма и зависит от стадии заболевания:
- ИВЛ. В тяжелых случаях самостоятельное дыхание невозможно или значительно затруднено.
- Лечение судорог. Они приводят к увеличению области судорожной активности мозга, повреждая ранее нетронутые области. В качестве терапии применяются различные противосудорожные препараты
- При тяжелых спазмах возможно назначение миорелаксантов.
- Диуретики при наличии признаков отека мозга.
- Хирургическое лечение гидроцефалии.
- Лечение расстройств сердечно-сосудистой системы. Аритмии, скачки давления, низкий сердечный выброс усугубляют состояние ребенка.
- Лечение осложнений, развившихся в остром периоде: пневмония, пролежни.
В комплексе и длительными курсами применяют ноотропы, нейропротекторы и препараты улучшающие мозговое кровообращение.
После стабилизации состояния начинается следующий восстановительный период, который порой длится всю жизнь.
В него входят:
- Массаж. При легкой степени ишемии расслабляющий массаж выполняет мама самостоятельно. При 2 и 3 стадии массаж проводится только специалистом или под его наблюдением.
- ЛФК. Обязательный компонент эффективной реабилитации. Физкультура направлена на стимулирование кровоснабжения головного мозга, разработку паралитических конечностей, а также на адаптацию ребенка к социальной жизни.
- Физиопроцедуры. Применение специальных приспособлений, типа валиков, лонгет, для сохранения в физиологичном положении спастических конечностей.
- Занятия с логопедом, различные методы психологической терапии и социальной адаптации.
Для взрослых лечение направлено на устранение причины:
- Нейропротекция. Сюда можно отнести прием статинов, антиагрегантов, жесткий контроль сахара и артериального давления.
- Применение хирургических методов лечения (стентирование, шунтирование, тромбэктомия и др.), при возможности восстановления адекватного кровоснабжения мозга.

- Отдельно стоит уделить внимание психологической помощи пожилым людям. Люди старшего возраста очень тяжело переживают собственную несостоятельность и зависимость от других. Поэтому родственникам важно вовремя обратить внимание на изменения поведения и характера близкого человека для своевременной диагностики.
Возможные осложнения
Как правило, церебральная ишемия у новорожденного 1 степени (легкая) не имеет остаточных явлений. Она характеризуется функциональными нарушениями со стороны ЦНС. Не всегда эту степень диагностируют и такие симптомы самостоятельно уходят в течение недели.
Куда тяжелее переносят гипоксию недоношенные дети, у которых даже легкая степень может привести к негативным последствиям в виде стойких неврологических нарушений: развиваются задержки умственного и физического развития, ДЦП.
2 степень (средней степень тяжести) имеет яркую симптоматику, характеризуется более значительным повреждением нервной ткани. Большей частью изменения необратимы. Без медицинской помощи, патологические изменения в мозге нарастают. Но при своевременной диагностике и адекватном лечении возможен благоприятный исход с минимальными отдаленными последствиями.
Без медицинской помощи, патологические изменения в мозге нарастают. Но при своевременной диагностике и адекватном лечении возможен благоприятный исход с минимальными отдаленными последствиями.
3 степень (самая тяжелая). Глубокие нарушения ЦНС не только необратимы, но и прогрессируют. От гипоксии страдает не только головной мозг, но и другие органы. Развивается полиорганная недостаточность. Прогноз неблагоприятный, более половины детей погибают. Выживший младенец становится инвалидом всю оставшуюся жизнь.
У взрослых церебральная ишемия имеет прогрессирующее течение приводя к развитию деменции и других психосоматических расстройств.
Автор статьи: Дмитриева Юлия (Сыч) — В 2014 году с отличием окончила Саратовский государственный медицинский университет имени В. И. Разумовского. В настоящее время работает врачом-кардиологом 8 СГКБ в 1 к/о.Церебральная ишемия 1 степени у новорожденного: лечение и последствия
Диагноз «церебральная ишемия у новорожденных», к сожалению, сегодня ставится часто. Данное заболевание представляет собой состояние, при котором клетки головного мозга недополучают нужного количества кислорода. Как правило, такой диагноз детям предварительно выставляется еще в роддоме осле проведения специального теста. Он подразумевает балльную оценку общего состояния ребенка по шкале Апгар. Данное обследование делают новорожденному сразу же после рождения. Однако окончательный диагноз с определением степени ишемии можно установить только после проведения ряда инструментальных исследований.
Данное заболевание представляет собой состояние, при котором клетки головного мозга недополучают нужного количества кислорода. Как правило, такой диагноз детям предварительно выставляется еще в роддоме осле проведения специального теста. Он подразумевает балльную оценку общего состояния ребенка по шкале Апгар. Данное обследование делают новорожденному сразу же после рождения. Однако окончательный диагноз с определением степени ишемии можно установить только после проведения ряда инструментальных исследований.
Содержание статьи
Степени заболевания
Данное заболевание имеет еще несколько названий: перинатальное гипоксически-ишемическое поражение головного мозга и гипоксически-ишемическая энцефалопатия (ГИЭ).
Ишемия мозга бывает 3 степеней. Для каждой из этих степеней характерны свои клинические проявления. При первой степени они проявляются слабо, при второй и третьей – имеют ярко выраженный характер. Церебральная ишемия 1 степени у новорожденного протекает в легкой форме и не требует госпитализации. При второй и третьей ГИЭ малышу необходимо стационарное лечение. И чем раньше оно начнется, тем меньше осложнений со здоровьем у ребенка будет наблюдаться в будущем.
При второй и третьей ГИЭ малышу необходимо стационарное лечение. И чем раньше оно начнется, тем меньше осложнений со здоровьем у ребенка будет наблюдаться в будущем.
Причины развития ГИЭ
Ишемия у новорожденного – это не самостоятельное заболевание, а следствие кислородного голодания головного мозга (гипоксии). При ее развитии в клетках мозга нарушаются процессы обмена веществ, и он подвергается различным расстройствам. Такие нарушения становятся причиной гибели нейронов, развития некроза и прочих состояний, которые негативным образом воздействуют на функциональность мозга. И чем выше степень дефицита кислорода, тем тяжелее состояние ребенка.
А причинами развития гипоксии могут являться различные факторы. Наиболее важные и часто встречаемые из них – это:
- Внутриутробная гипоксия плода. Одна из самых распространенных причин. Возникает на фоне нарушения тока крови от матери к плаценте, или наоборот.
- Асфиксия ребенка. Бывает интранатальная и постнатальная.
 В первом случае асфиксия возникает в период прохождения ребенка по родовым путям, во втором – в первые минуты после рождения.
В первом случае асфиксия возникает в период прохождения ребенка по родовым путям, во втором – в первые минуты после рождения. - Респираторный дистресс-синдром. Тяжелое состояние, при котором происходит некардиогенный (не связанный с функциональными возможностями сердца) отек легких и нарушение процесса внешнего дыхания.
- Приступы апноэ. Пик приходится на период сна и сопровождается остановкой дыхания.
- Врожденный порок сердца. При его наличии происходит нарушение тока крови к головному мозгу, что и провоцирует появление гипоксии. Наиболее часто у детей раннего возраста встречается ОАП (открытый артериальный проток).
- Нарушение системы гемодинамики. У новорожденных данное состояние становится причиной резкого падения АД, в результате чего снижается скорость церебрального кровотока.
Frontiers | Смерть клеток в развивающемся мозге после гипоксии-ишемии
Введение
Воздействие на мозг стресса или инсульта вызывает ряд адаптивных реакций, которые могут привести к восстановлению клеточного гомеостаза (Green et al. , 2014; Vanden Berghe et al., 2014). Однако, когда стресс является серьезным и / или эндогенные защитные процессы недостаточно эффективны для восстановления физиологических функций, клетка погибает. Триггеры клеточной гибели могут исходить от многих органелл, включая ядро, митохондрию, эндоплазматический ретикулум (ЭР), лизосомы, цитоскелет и / или плазматическую мембрану, в зависимости от стресса (Galluzzi et al., 2014). Существует множество альтернативных путей, ведущих к гибели клеток, таких как некроз / некроптоз, апоптоз, партанатоз и аутоз (Рисунок 1, Таблица 1), и преобладающий механизм будет зависеть от состояния метаболизма, тяжести и типа поражения, типа клеток, возраста развития. и другие факторы (Kroemer et al., 2009; Green et al., 2014; Galluzzi et al., 2015). В некоторых ситуациях, когда один путь ингибируется, гибель клеток может происходить другим путем (Jouan-Lanhouet et al., 2012), и во многих патологических ситуациях выявляются смешанные формы морфологических фенотипов (Puka-Sundvall et al.
, 2014; Vanden Berghe et al., 2014). Однако, когда стресс является серьезным и / или эндогенные защитные процессы недостаточно эффективны для восстановления физиологических функций, клетка погибает. Триггеры клеточной гибели могут исходить от многих органелл, включая ядро, митохондрию, эндоплазматический ретикулум (ЭР), лизосомы, цитоскелет и / или плазматическую мембрану, в зависимости от стресса (Galluzzi et al., 2014). Существует множество альтернативных путей, ведущих к гибели клеток, таких как некроз / некроптоз, апоптоз, партанатоз и аутоз (Рисунок 1, Таблица 1), и преобладающий механизм будет зависеть от состояния метаболизма, тяжести и типа поражения, типа клеток, возраста развития. и другие факторы (Kroemer et al., 2009; Green et al., 2014; Galluzzi et al., 2015). В некоторых ситуациях, когда один путь ингибируется, гибель клеток может происходить другим путем (Jouan-Lanhouet et al., 2012), и во многих патологических ситуациях выявляются смешанные формы морфологических фенотипов (Puka-Sundvall et al.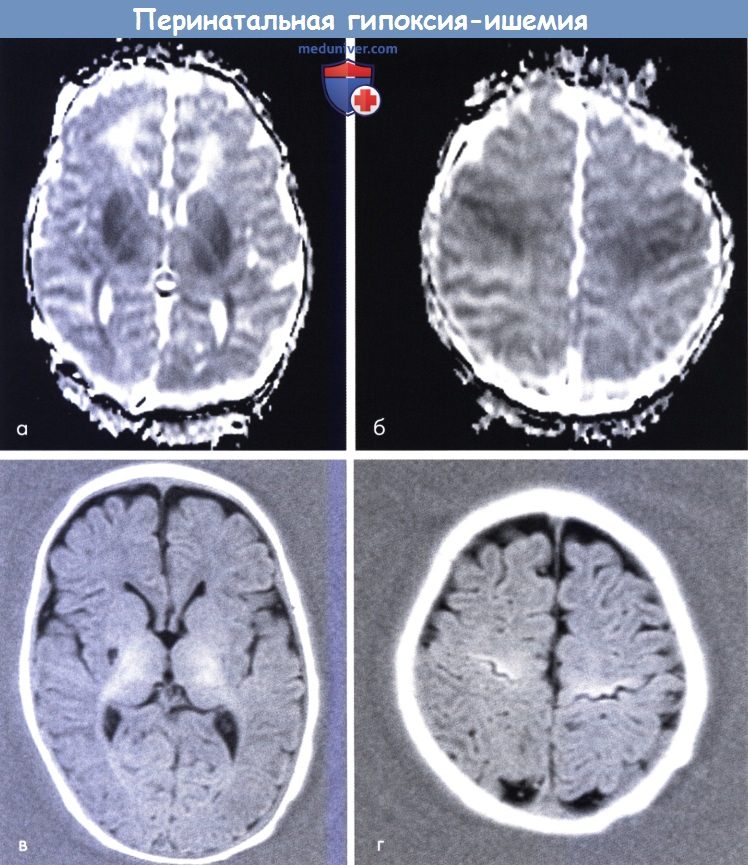 , 2000; Northington et al., 2001). Следовательно, традиционные классификации, основанные на морфологии (Таблица 1), не всегда могут давать информацию о биохимических этапах, ведущих к гибели клеток, и, следовательно, о том, какая нейропротекторная стратегия может быть успешной (Galluzzi et al., 2015). Влияние генетического и / или фармакологического вмешательства на долгосрочное функциональное восстановление клеток часто дает более важную информацию в отношении основных компонентов конкретного пути гибели клеток.
, 2000; Northington et al., 2001). Следовательно, традиционные классификации, основанные на морфологии (Таблица 1), не всегда могут давать информацию о биохимических этапах, ведущих к гибели клеток, и, следовательно, о том, какая нейропротекторная стратегия может быть успешной (Galluzzi et al., 2015). Влияние генетического и / или фармакологического вмешательства на долгосрочное функциональное восстановление клеток часто дает более важную информацию в отношении основных компонентов конкретного пути гибели клеток.
Рисунок 1 .Обзор путей гибели клеток. В ответ на легкие стрессовые стимулы активируется ряд компенсаторных механизмов, чаще всего приводящих к выживанию клеток. Умеренные и тяжелые инсульты могут вызвать регулируемую гибель клеток. В зависимости от нескольких факторов, таких как метаболическая ситуация, тип клетки, природа стрессового стимула и пораженные внутриклеточные органеллы, клетка претерпевает апоптоз (активация каспазы), некроптоз (активация MLKL), некроз (через открытие MPT pore), аутофагическая гибель клеток (аутофагия / Na + K + АТФаза) или партанатос (PARP1, AIF). Тяжелые инсульты вызывают случайную гибель клеток, которую нельзя изменить генетически или фармакологически. Однако случайная гибель клеток приводит к высвобождению факторов (DAMP), которые инициируют системные эффекты, а также воспаление и (регулируемое) вторичное повреждение головного мозга в соседних тканях.
Тяжелые инсульты вызывают случайную гибель клеток, которую нельзя изменить генетически или фармакологически. Однако случайная гибель клеток приводит к высвобождению факторов (DAMP), которые инициируют системные эффекты, а также воспаление и (регулируемое) вторичное повреждение головного мозга в соседних тканях.
Таблица 1 . Сравнение морфологических признаков гибели клеток типа I, типа II и типа III.
Смерть клеток также можно разделить на случайный и регулируемый (рисунок 1; Galluzzi et al., 2015). Случайная гибель клеток вызывается серьезным воздействием (например, тяжелой травмой, ядром ишемического инфаркта), что вызывает немедленную гибель клеток, которая не связана с конкретным молекулярным механизмом и не может быть предотвращена или модулирована (Green and Kroemer, 2005). Однако клетки, подвергающиеся выбросу продуктов случайной гибели клеток (молекулярные паттерны, связанные с повреждением; DAMP), часто оказывают прямое токсическое воздействие на окружающие клетки, которые пережили первоначальное повреждение и могут продлить первичное повреждение (Vanden Berghe et al. , 2014; Galluzzi et al., 2015). DAMP также обладают иммуногенными свойствами и способствуют воспалительной реакции, которая может вызвать повреждение и еще больше усугубить ситуацию (Zhang et al., 2010; Vanden Berghe et al., 2014). Различные вмешательства, которые ослабляют действие клеток, индуцированное DAMP, могут обеспечивать защитные эффекты (Zitvogel et al., 2010). Таким образом, даже если случайная гибель клеток не может быть направлена напрямую, ее последствия можно перехватить и в некоторой степени предотвратить травму свидетелем. Напротив, регулируемая смерть (не путать с термином запрограммированная смерть клетки, который используется как синоним апоптоза) включает в себя молекулярный аппарат клетки (рисунок 1), и ее ход действительно может модулироваться фармакологическими и генетическими средствами (Kroemer et al. al., 2009; Galluzzi et al., 2014, 2015). Регулируемая гибель клеток обычно происходит с некоторой задержкой в ситуациях, когда эндогенные защитные механизмы не могут восстановить клеточный гомеостаз.
, 2014; Galluzzi et al., 2015). DAMP также обладают иммуногенными свойствами и способствуют воспалительной реакции, которая может вызвать повреждение и еще больше усугубить ситуацию (Zhang et al., 2010; Vanden Berghe et al., 2014). Различные вмешательства, которые ослабляют действие клеток, индуцированное DAMP, могут обеспечивать защитные эффекты (Zitvogel et al., 2010). Таким образом, даже если случайная гибель клеток не может быть направлена напрямую, ее последствия можно перехватить и в некоторой степени предотвратить травму свидетелем. Напротив, регулируемая смерть (не путать с термином запрограммированная смерть клетки, который используется как синоним апоптоза) включает в себя молекулярный аппарат клетки (рисунок 1), и ее ход действительно может модулироваться фармакологическими и генетическими средствами (Kroemer et al. al., 2009; Galluzzi et al., 2014, 2015). Регулируемая гибель клеток обычно происходит с некоторой задержкой в ситуациях, когда эндогенные защитные механизмы не могут восстановить клеточный гомеостаз.
В развивающемся головном мозге повреждение клеток может быть вызвано различными воздействиями, такими как гипоксия (Schwartz et al., 2004), гипероксия (Reich et al., 2016), гипоксия-ишемия (Rice et al., 1981) , травма (Bittigau et al., 2004) и воспаление / инфекции (Strunk et al., 2014). Однако большая часть знаний о механизмах гибели клеток получена из исследований in vivo, и in vitro, на моделях гипоксии-ишемии, поэтому мы сосредоточимся в основном на этой работе.
HI приводит к начальному истощению запасов высокоэнергетических фосфатов, в частности АТФ и фосфокреатина. Эти уровни временно возвращаются к исходному уровню, но за ними следует второе, более длительное истощение запасов клеточной энергии, сопровождающееся прогрессированием повреждения мозга (Blumberg et al., 1997; Hagberg et al., 2014). Эти нарушения энергетического обмена вызывают ряд патофизиологических реакций, которые в конечном итоге приводят к гибели клеток. Предыдущие исследования показали, что HI в незрелом мозге может вызывать апоптоз (Edwards et al. , 1997; Чжу и др., 2000; Northington et al., 2001), некроптоз / некроз (Northington et al., 2011; Galluzzi et al., 2012a), а также аутофагическая гибель / аутоз клеток (Koike et al., 2008; Ginet et al., 2009; Liu и др., 2013).
, 1997; Чжу и др., 2000; Northington et al., 2001), некроптоз / некроз (Northington et al., 2011; Galluzzi et al., 2012a), а также аутофагическая гибель / аутоз клеток (Koike et al., 2008; Ginet et al., 2009; Liu и др., 2013).
Митохондрии участвуют в адаптивных и метаболических ответах на повреждение, а также в большинстве форм гибели клеток, включая апоптоз (внутренний и в некоторой степени внешний путь), регулируемый некроз (не всегда существенный), партанатоз и аутофагическую гибель клеток (Rosenberg et al. ., 1989; Ягер и др., 1996; Galluzzi et al., 2012a, b, 2015; Thornton et al., 2012; Vanden Berghe et al., 2014). Примечательно, что митохондрии играют ключевую роль в инициации и выполнении клеточной смерти также в незрелом мозге (Chavez-Valdez et al., 2012; Hagberg et al., 2014). В этом обзоре мы кратко обновим базовые знания о различных формах регулируемой гибели клеток, а затем суммируем морфологические и биохимические данные об апоптотической, некротической / некроптотической и аутотической гибели клеток в незрелом мозге, подвергающемся воздействию HI.
Апоптотическая смерть клетки
Апоптотическая клеточная машина
Апоптоз может быть вызван внутриклеточными (внутренними) и внеклеточными (внешними) стимулами (рис. 2; Kerr et al., 1972, 1994). Внутренний путь основан на проницаемости митохондриальной внешней мембраны (MOMP), что приводит к высвобождению ряда проапоптотических белков в цитозоль, включая голоцитохром c (Cyt c), фактор, индуцирующий апоптоз (AIF), вторые митохондрии. производный активатор каспаз (SMAC) и эндонуклеазы G (EndoG) (Hengartner and Horvitz, 1994; Wei et al., 2001; Ravagnan et al., 2002; Галлуцци и др., 2012а, б). Cyt c будет образовывать комплекс (апоптосомы) с дезокси-АТФ, апоптотическим фактором активации пептидазы 1 (APAF-1) и каспазой-9, что приводит к последующей активации каспазы-3 палача (Li et al., 1997; Bratton and Salvesen, 2010; Galluzzi et al., 2012a). MOMP зависит от двух порообразующих проапоптотических членов семейства B-клеточной лимфомы 2 (BCL2), Bcl-2-ассоциированного X-белка (BAX) и Bcl-2-антагониста / киллера 1 (BAK1) (Рисунок 2). Открытие поры BAX / BAK1 регулируется антиапоптотическими белками семейства BCL2, такими как сам BCL2, BCL2 подобный 1 (BCL-X L ) и лейкоз 1 миелоидных клеток (MCL1) и связывание проапоптотических членов BCL2. компонент 3 (также известный как PUMA), BCL2-подобный 11 (известный как BIM) и агонист смерти взаимодействующего домена Bh4 (BID) (Moldoveanu et al., 2014). Активность MOMP также контролируется p53, c-jun N-концевой киназой (JNK) и каспазой-2 (Galluzzi et al., 2014; Baburamani et al., 2017).
Открытие поры BAX / BAK1 регулируется антиапоптотическими белками семейства BCL2, такими как сам BCL2, BCL2 подобный 1 (BCL-X L ) и лейкоз 1 миелоидных клеток (MCL1) и связывание проапоптотических членов BCL2. компонент 3 (также известный как PUMA), BCL2-подобный 11 (известный как BIM) и агонист смерти взаимодействующего домена Bh4 (BID) (Moldoveanu et al., 2014). Активность MOMP также контролируется p53, c-jun N-концевой киназой (JNK) и каспазой-2 (Galluzzi et al., 2014; Baburamani et al., 2017).
Рисунок 2 . Апоптотические и некроптотические механизмы. Внутренний путь запускается нарушением митохондрий, связанным с переполнением глутамата, что приводит к чрезмерному внутриклеточному накоплению Ca 2+ и накоплению NO и ROS. Такие внутримитохондриальные изменения могут вызвать сдвиг в локализации проапоптотических белков, таких как цитохром C (CytC), с внутренней митохондриальной мембраны в межмембранное пространство.Кроме того, возмущение в ядре, эндоплазматическом ретикулуме или в других органеллах может увеличивать про- или антиапоптотический баланс семейства белков BCL2, JNK, активность каспазы-2 или экспрессию p53 на уровне внешней мембраны митохондрий.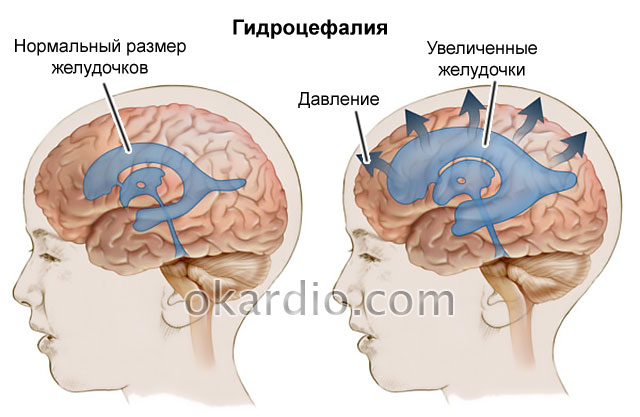 Такие изменения запускают проницаемость внешней мембраны митохондрий (MOMP) и высвобождение проапоптотических белков в цитозоль. Cyt C инициирует сборку апоптосомы, ведущую к активации каспазы-9, а затем к расщеплению каспазы-3 и ДНК-палача посредством активации ДНКазы, активируемой каспазой (CAD).Ингибиторы апоптоза (IAP) блокируют активность апоптосом и каспаз. Фактор, индуцирующий апоптоз (AIF), связывается с циклофилином А, и комплекс перемещается в ядро и запускает хроматинолиз. Повреждение мозга, включая HI, также приводит к увеличению циркулирующих лигандов рецептора смерти, таких как TNF-α, Fas, TRAIL и т. Д. В ответ на связывание лиганд-рецептор на мембране образуется комплекс I, содержащий рецептор, адаптерный белок и RIP1, который является быстро полиубихинируется (Ub) с помощью cIAP. Этот комплекс может запускать путь NFκB и реакцию на выживание.Однако деубихинирующие ферменты и Smac (который разрушает cIAP) высвобождают RIP1 и передают клетку в путь клеточной гибели. В присутствии каспаз RIP1 образует комплекс с активной каспазой-8 и FADD, запуская внешний путь апоптоза.
Такие изменения запускают проницаемость внешней мембраны митохондрий (MOMP) и высвобождение проапоптотических белков в цитозоль. Cyt C инициирует сборку апоптосомы, ведущую к активации каспазы-9, а затем к расщеплению каспазы-3 и ДНК-палача посредством активации ДНКазы, активируемой каспазой (CAD).Ингибиторы апоптоза (IAP) блокируют активность апоптосом и каспаз. Фактор, индуцирующий апоптоз (AIF), связывается с циклофилином А, и комплекс перемещается в ядро и запускает хроматинолиз. Повреждение мозга, включая HI, также приводит к увеличению циркулирующих лигандов рецептора смерти, таких как TNF-α, Fas, TRAIL и т. Д. В ответ на связывание лиганд-рецептор на мембране образуется комплекс I, содержащий рецептор, адаптерный белок и RIP1, который является быстро полиубихинируется (Ub) с помощью cIAP. Этот комплекс может запускать путь NFκB и реакцию на выживание.Однако деубихинирующие ферменты и Smac (который разрушает cIAP) высвобождают RIP1 и передают клетку в путь клеточной гибели. В присутствии каспаз RIP1 образует комплекс с активной каспазой-8 и FADD, запуская внешний путь апоптоза. Caspase-8 может напрямую запускать каспазу-3-исполнитель или расщеплять и активировать BID (формируя усеченный BID, tBID), который может запускать MOMP. Каспаза-8 также может предотвращать индукцию некроптоза, расщепляя ключевые белки. В отсутствие каспаз RIP1 взаимодействует с RIP3, который аутофосфорилирует и впоследствии рекрутирует MLKL в комплекс некросом.Фосфорилированный MLKL направляет некросому на богатые липидами области мембраны, такие как митохондриальные или плазматические мембраны, образуя поры, позволяющие приток ионов и набухание клеток.
Caspase-8 может напрямую запускать каспазу-3-исполнитель или расщеплять и активировать BID (формируя усеченный BID, tBID), который может запускать MOMP. Каспаза-8 также может предотвращать индукцию некроптоза, расщепляя ключевые белки. В отсутствие каспаз RIP1 взаимодействует с RIP3, который аутофосфорилирует и впоследствии рекрутирует MLKL в комплекс некросом.Фосфорилированный MLKL направляет некросому на богатые липидами области мембраны, такие как митохондриальные или плазматические мембраны, образуя поры, позволяющие приток ионов и набухание клеток.
В внешнем пути связывание лигандов с рецептором смерти приводит к активации каспазы-8. Приблизительно 20 пар лиганд-рецептор в настоящее время включены в суперсемейство фактора некроза опухоли лиганда рецептора смерти (TNF) (Pennica et al., 1984; Vanden Berghe et al., 2014). Эти TNF-рецепторные и подобные TNF-рецептору молекулы сходны по структуре с TNF и действуют как тримеры (как лиганды, так и рецепторы) (Pennica et al. , 1984). Из-за сходства своей структуры несколько лигандов способны связываться и индуцировать передачу сигналов через один рецептор, или один лиганд способен связывать несколько рецепторов. Некоторые из рецепторов содержат так называемый домен смерти в своем внутриклеточном домене (например, TNF-R1, DR4, DR5, Fas) и могут запускать апоптоз при активации от связывания соответствующего лиганда (например, TNF-α, TRAIL, FasL) (Holler et al., 2000). Этот внешний путь апоптоза продолжается с активацией вызывающего смерть сигнального комплекса (DISC), прилегающего к домену смерти рецептора.Активированный DISC катализирует протеолитическое расщепление и активацию прокаспазы-8 (Love, 2003; Vanden Berghe et al., 2014; Рисунок 2). Активированная каспаза-8 либо напрямую активирует каспазу-3, либо опосредует расщепление BID до усеченного BID (tBID), которое объединяет различные пути смерти в митохондриях. tBID перемещается в митохондрии, где он взаимодействует с другими проапоптотическими белками и запускает высвобождение апоптогенных факторов, что приводит к каспазозависимой и независимой от каспаз гибели клеток.
, 1984). Из-за сходства своей структуры несколько лигандов способны связываться и индуцировать передачу сигналов через один рецептор, или один лиганд способен связывать несколько рецепторов. Некоторые из рецепторов содержат так называемый домен смерти в своем внутриклеточном домене (например, TNF-R1, DR4, DR5, Fas) и могут запускать апоптоз при активации от связывания соответствующего лиганда (например, TNF-α, TRAIL, FasL) (Holler et al., 2000). Этот внешний путь апоптоза продолжается с активацией вызывающего смерть сигнального комплекса (DISC), прилегающего к домену смерти рецептора.Активированный DISC катализирует протеолитическое расщепление и активацию прокаспазы-8 (Love, 2003; Vanden Berghe et al., 2014; Рисунок 2). Активированная каспаза-8 либо напрямую активирует каспазу-3, либо опосредует расщепление BID до усеченного BID (tBID), которое объединяет различные пути смерти в митохондриях. tBID перемещается в митохондрии, где он взаимодействует с другими проапоптотическими белками и запускает высвобождение апоптогенных факторов, что приводит к каспазозависимой и независимой от каспаз гибели клеток.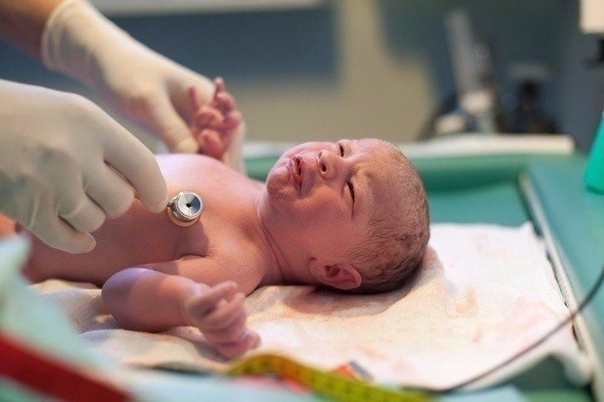 Рецепторы смерти также могут вызывать некроптоз, особенно в условиях, когда каспаза-8 неактивна (Vanden Berghe et al., 2014) (см. Ниже раздел о регулируемом некрозе).
Рецепторы смерти также могут вызывать некроптоз, особенно в условиях, когда каспаза-8 неактивна (Vanden Berghe et al., 2014) (см. Ниже раздел о регулируемом некрозе).
Апоптоз в незрелом мозге
Апоптоз имеет решающее значение для развития мозга и определяет размер и форму центральной нервной системы (Kuan et al., 2000). В некоторых регионах более половины изначально сформированных нейронов подвергаются апоптотической гибели клеток (Raff et al., 1993). Многие белки, участвующие в апоптозе, такие как каспаза-3 (Blomgren et al., 2001), APAF1 (Ota et al., 2002) и белки семейства BCL2 (Merry et al., 1994; Vekrellis et al., 1997; Soane et al., 2008) активируются во время развития мозга. У мышей, лишенных каспазы-3 (Kuida et al., 1996) или каспазы-9 (Kuida et al., 1998), наблюдается гиперпластический дезорганизованный мозг (тогда как другие органы, такие как тимус с продолжающимся апоптозом, развиваются нормально), что подтверждает концепцию, что каспазы обладают особое значение в формировании развивающегося мозга. Таким образом, в постнатальном мозге происходит заметная активация нескольких компонентов внутреннего пути из-за продолжающегося физиологического апоптоза как части развития ЦНС.
Таким образом, в постнатальном мозге происходит заметная активация нескольких компонентов внутреннего пути из-за продолжающегося физиологического апоптоза как части развития ЦНС.
Роль внутреннего пути в перинатальной травме головного мозга
Митохондрии в развивающемся головном мозге склонны к пермеабилизации в ответ на HI (Northington et al., 2001; Wang et al., 2001, 2004). Проапоптотические белки (например, Cyt C и фактор, индуцирующий апоптоз, AIF) высвобождаются из митохондрий, апоптосомные формы и расположенные ниже каспазы (особенно каспаза-3) активируются после гипоксически-ишемического инсульта (Cheng et al., 1998; Wang et al., др., 2001; Сугавара и др., 2004). Пути, зависящие от AIF (Zhu et al., 2003, 2007a, b) и каспаз, по-видимому, более сильно активируются в незрелом мозге, чем во взрослом мозге (Hu et al., 2000; Zhu et al., 2005), и митохондриальная проницаемость была предложена для обозначения точки невозврата при гипоксически-ишемическом повреждении незрелого мозга (Hagberg, 2004; Galluzzi et al. , 2009).
, 2009).
Молекулярные механизмы митохондриальной проницаемости в этих условиях до сих пор полностью не изучены. Митохондрии могут проникать через либо BAX-BAK-зависимое образование пор, либо открывая поры перехода митохондриальной проницаемости (MPT-поры) (Galluzzi et al., 2009; Расола и др., 2010). MPT-поры зависят от циклофилина D и образуются, когда как внутренние, так и внешние листочки митохондрии находятся в их ближайших точках (Rasola et al., 2010). Молекулярная идентичность MPT-поры все еще отсутствует, но недавние исследования показывают, что АТФ-синтаза является важным компонентом (Giorgio et al., 2013; Bonora and Pinton, 2014; Gerle, 2016). Проницаемость внутренней митохондриальной мембраны приводит к утечке растворенных веществ, деполяризации из-за уравновешивания протонного градиента и набуханию митохондрии из-за разрушения внешней мембраны.Гибель клеток, опосредованная MPT-порой (в отличие от BAX-опосредованной проницаемости, ниже), является преимущественно некротической (из-за дисбаланса Ca 2+ и биоэнергетической недостаточности) и способствует развитию ишемического повреждения головного мозга у взрослых из-за дефицита гена циклофилина D. Ppid и ингибиторы циклофилина D обладают нейрозащитным действием (Kuroda et al., 1999; Schinzel et al., 2005). Однако в незрелом мозге дефицит гена циклофилина D ( Ppid ) скорее усугубляет, чем уменьшает гипоксически-ишемическое повреждение, а ингибиторы циклофилина D не уменьшают повреждение (Puka-Sundvall et al., 2001; Wang et al., 2009). Вместо этого пептиды, ингибирующие BAX (Wang et al., 2009, 2010; Sun et al., 2015), и дефицит BAX (Gibson et al., 2001) существенно защищают незрелый мозг мышей, предполагая, что BAX-зависимая проницаемость внешняя мембрана (а не опосредованное циклофилином-D открытие поры MPT) имеет решающее значение для развивающегося мозга и приводит к апоптозной гибели клеток. Кроме того, исследования, которые исключают влияние BAX-опосредованной проницаемости митохондриальной мембраны (например,g., нокаут-модели BIM и BAD (Ness et al., 2006), Tat-BCL-xL (Yin et al., 2006), трансгенные мыши Bcl-xL (Parsadanian et al., 1998) демонстрируют уменьшение повреждения головного мозга.
Ppid и ингибиторы циклофилина D обладают нейрозащитным действием (Kuroda et al., 1999; Schinzel et al., 2005). Однако в незрелом мозге дефицит гена циклофилина D ( Ppid ) скорее усугубляет, чем уменьшает гипоксически-ишемическое повреждение, а ингибиторы циклофилина D не уменьшают повреждение (Puka-Sundvall et al., 2001; Wang et al., 2009). Вместо этого пептиды, ингибирующие BAX (Wang et al., 2009, 2010; Sun et al., 2015), и дефицит BAX (Gibson et al., 2001) существенно защищают незрелый мозг мышей, предполагая, что BAX-зависимая проницаемость внешняя мембрана (а не опосредованное циклофилином-D открытие поры MPT) имеет решающее значение для развивающегося мозга и приводит к апоптозной гибели клеток. Кроме того, исследования, которые исключают влияние BAX-опосредованной проницаемости митохондриальной мембраны (например,g., нокаут-модели BIM и BAD (Ness et al., 2006), Tat-BCL-xL (Yin et al., 2006), трансгенные мыши Bcl-xL (Parsadanian et al., 1998) демонстрируют уменьшение повреждения головного мозга. после неонатального ГИ). Интересно, что BCL-xL, по-видимому, в первую очередь снижает задержку апоптотической гибели клеток, а не раннюю (некротическую) потерю клеток (Dietz et al., 2007). У крыс, подвергнутых неонатальной ГИ, наблюдается пик активности каспазы-3, наблюдаемый через 24 часа после воздействия (Cheng et al., 1998), который остается повышенным в течение значительного количества дней (Wang et al., 2001). Было показано, что ингибиторы каспаз обладают нейропротективным действием на незрелых моделях гипоксии-ишемии (Cheng et al., 1998; Zhu et al., 2007a, b).
после неонатального ГИ). Интересно, что BCL-xL, по-видимому, в первую очередь снижает задержку апоптотической гибели клеток, а не раннюю (некротическую) потерю клеток (Dietz et al., 2007). У крыс, подвергнутых неонатальной ГИ, наблюдается пик активности каспазы-3, наблюдаемый через 24 часа после воздействия (Cheng et al., 1998), который остается повышенным в течение значительного количества дней (Wang et al., 2001). Было показано, что ингибиторы каспаз обладают нейропротективным действием на незрелых моделях гипоксии-ишемии (Cheng et al., 1998; Zhu et al., 2007a, b).
AIF также может перемещаться в межмембранное пространство митохондрий в ответ на окислительный стресс, индукцию поли (АДФ-рибоза) полимеразы (PARP) 1 и активацию протеаз (например, кальпаинов или катепсинов). Эта транслокация необходима для последующего перемещения AIF в ядро после MOMP (Modjtahedi et al., 2006; Krantic et al., 2007). Действительно, AIF действительно перемещается в ядро после неонатального HI (Zhu et al. , 2003), а мыши с более низкой экспрессией AIF менее уязвимы к HI, особенно в сочетании с введением ингибитора каспазы (Zhu et al., 2007b), что позволяет предположить, что высвобождение митохондриального AIF способствует повреждению головного мозга в таких ситуациях. AIF связывается с циклофилином A в цитозоле, белковый комплекс перемещается в ядро и индуцирует некаспазозависимый хроматинолиз (Zhu et al., 2007a). Этот конкретный путь гибели клеток, который зависит от PARP-1 и AIF, часто называют Parthanatos (рис.1), а не апоптозом (Fatokun et al., 2014) и проявляет морфологические признаки регулируемого некроза, а не апоптоза (Vanden Berghe et al., 2014). Было обнаружено, что белок IDUNA ингибирует этот путь во взрослом мозге (Andrabi et al., 2011), что, по-видимому, применимо также к незрелому мозгу (Yang et al., 2017). Взятые вместе, эти данные предполагают, что ВАХ-зависимый MOMP является критическим событием в отсроченном повреждении головного мозга в незрелом мозге, потому что он приводит как к активации каспазозависимой, так и независимой от каспаз гибели клеток.
, 2003), а мыши с более низкой экспрессией AIF менее уязвимы к HI, особенно в сочетании с введением ингибитора каспазы (Zhu et al., 2007b), что позволяет предположить, что высвобождение митохондриального AIF способствует повреждению головного мозга в таких ситуациях. AIF связывается с циклофилином A в цитозоле, белковый комплекс перемещается в ядро и индуцирует некаспазозависимый хроматинолиз (Zhu et al., 2007a). Этот конкретный путь гибели клеток, который зависит от PARP-1 и AIF, часто называют Parthanatos (рис.1), а не апоптозом (Fatokun et al., 2014) и проявляет морфологические признаки регулируемого некроза, а не апоптоза (Vanden Berghe et al., 2014). Было обнаружено, что белок IDUNA ингибирует этот путь во взрослом мозге (Andrabi et al., 2011), что, по-видимому, применимо также к незрелому мозгу (Yang et al., 2017). Взятые вместе, эти данные предполагают, что ВАХ-зависимый MOMP является критическим событием в отсроченном повреждении головного мозга в незрелом мозге, потому что он приводит как к активации каспазозависимой, так и независимой от каспаз гибели клеток.
Регуляторы MOMP и апоптоза Upstream
Эксайтотоксичность
Эксайтотоксичность заключается в накоплении внеклеточных возбуждающих аминокислот, таких как глутамат, что приводит к активации рецепторов NMDA и AMPA, которые, в свою очередь, вызывают приток кальция и натрия в клетку (Johnston, 2005). Последующее увеличение внутриклеточного кальция вызывает выработку NO, а также реактивных окислительных форм, которые вносят вклад в митохондриальные пертурбации и MOMP, ведущие к апоптотической гибели клеток (Рисунок 2; Hagberg et al., 2014).
р53
p53 является опухолевым супрессором, который запускает апоптоз множеством путей, включая остановку клеточного цикла и регуляцию аутофагии посредством трансактивации проапоптотических и репрессирующих антиапоптотических генов (Morrison et al., 2003; Green and Kroemer, 2009). Он очень консервативен и регулирует гибель клеток в результате широкого спектра как физиологических, так и патологических стимулов. p53 также оказывает цитоплазматическое действие на митохондриальном уровне и может способствовать BAX-зависимой митохондриальной проницаемости (Green and Kroemer, 2009).В нестрессированных нейронах экспрессия p53, как правило, низкая, что ограничивается его ассоциацией с его негативным регулятором MDM2, который функционирует как убиквитинлигаза, направляя полиубиквитинированный p53 на деградацию (Honda et al., 1997). Клеточный стресс вытесняет p53 из MDM2, и впоследствии экспрессия p53 стабилизируется посредством существенной посттрансляционной модификации (Morrison et al., 2003). Классическая роль p53 — это активатор транскрипции, и после стабилизации он накапливается в ядре, где он активирует транскрипцию проапоптотических генов, таких как PUMA, BAX и NOXA (Riley et al., 2008). Совсем недавно была описана независимая от транскрипции роль, при которой активированный p53 накапливается в цитозоле, где он секвестрируется антиапоптотическими белками BCL2, например, BCL-X L (Green and Kroemer, 2009).
p53 также оказывает цитоплазматическое действие на митохондриальном уровне и может способствовать BAX-зависимой митохондриальной проницаемости (Green and Kroemer, 2009).В нестрессированных нейронах экспрессия p53, как правило, низкая, что ограничивается его ассоциацией с его негативным регулятором MDM2, который функционирует как убиквитинлигаза, направляя полиубиквитинированный p53 на деградацию (Honda et al., 1997). Клеточный стресс вытесняет p53 из MDM2, и впоследствии экспрессия p53 стабилизируется посредством существенной посттрансляционной модификации (Morrison et al., 2003). Классическая роль p53 — это активатор транскрипции, и после стабилизации он накапливается в ядре, где он активирует транскрипцию проапоптотических генов, таких как PUMA, BAX и NOXA (Riley et al., 2008). Совсем недавно была описана независимая от транскрипции роль, при которой активированный p53 накапливается в цитозоле, где он секвестрируется антиапоптотическими белками BCL2, например, BCL-X L (Green and Kroemer, 2009). Однако повышенная экспрессия PUMA, опосредованная ядерным p53, вытесняет BCL-X L , позволяя p53 активировать BAX, способствуя его олигомеризации, проницаемости внешней мембраны митохондрий и индуцируя апоптоз (Chipuk et al., 2005; Green and Kroemer, 2009).В самом деле, p53 активируется и накапливается в ядре и митохондриях в модели in vivo на крысах HI новорожденных (Nijboer et al., 2008a, b). Как следствие, происходит активация апоптотических путей, приводящая к активации каспазы-3. Авторы идентифицировали путь с участием NFκB выше p53 и смогли снизить накопление p53 (таким образом, увеличив выживаемость нейронов) в ответ на неонатальный HI путем лечения пептидом-ингибитором NFκB (Nijboer et al., 2008a, b; Van Der Kooij et al. al., 2010). Кроме того, пифитрин-μ (ингибитор митохондриального p53; Strom et al., 2006), вводимый после неонатального HI крысам, обеспечивал значительную защиту с терапевтическим окном в 6 часов (Nijboer et al., 2011), подтверждая, что p53-BAX-зависимый путь важен при травме головного мозга HI.
Однако повышенная экспрессия PUMA, опосредованная ядерным p53, вытесняет BCL-X L , позволяя p53 активировать BAX, способствуя его олигомеризации, проницаемости внешней мембраны митохондрий и индуцируя апоптоз (Chipuk et al., 2005; Green and Kroemer, 2009).В самом деле, p53 активируется и накапливается в ядре и митохондриях в модели in vivo на крысах HI новорожденных (Nijboer et al., 2008a, b). Как следствие, происходит активация апоптотических путей, приводящая к активации каспазы-3. Авторы идентифицировали путь с участием NFκB выше p53 и смогли снизить накопление p53 (таким образом, увеличив выживаемость нейронов) в ответ на неонатальный HI путем лечения пептидом-ингибитором NFκB (Nijboer et al., 2008a, b; Van Der Kooij et al. al., 2010). Кроме того, пифитрин-μ (ингибитор митохондриального p53; Strom et al., 2006), вводимый после неонатального HI крысам, обеспечивал значительную защиту с терапевтическим окном в 6 часов (Nijboer et al., 2011), подтверждая, что p53-BAX-зависимый путь важен при травме головного мозга HI. Однако недавно мы обнаружили, что дефицит гена p53 обеспечивает только частичную защиту в задней части мозга в ответ на умеренный HI (Baburamani et al., 2017), и мы подозреваем, что защитный эффект пифитрина-μ может быть связан с факторами, независимыми от p53, такие как белки теплового шока и воспаления (Leu et al., 2009; Fleiss et al., 2015).
Однако недавно мы обнаружили, что дефицит гена p53 обеспечивает только частичную защиту в задней части мозга в ответ на умеренный HI (Baburamani et al., 2017), и мы подозреваем, что защитный эффект пифитрина-μ может быть связан с факторами, независимыми от p53, такие как белки теплового шока и воспаления (Leu et al., 2009; Fleiss et al., 2015).
c-Jun N-концевые киназы (JNK)
N-концевые киназы c-Jun (JNK) являются членами семейства митоген-активируемых протеинкиназ (MAPK) и, как таковые, активируются в ответ на стресс. В результате альтернативного сплайсинга есть три мусорных гена млекопитающих и 10 экспрессированных изоформ; однако именно JNK3 преимущественно активен в мозге (Dreskin et al., 2001). В мышиной модели, в которой экспрессия JNK3 устранена, как взрослые, так и новорожденные животные были частично защищены от инсульта HI, а у новорожденных животных уровни c-jun были снижены по сравнению с животными дикого типа (Kuan et al., 2003; Пирианов и др., 2007). Фармакологическое подавление JNK (либо с помощью TAT-JBD, либо D-JNKi) у новорожденных мышей после HI привело к уменьшению размера инфаркта, сохранению целостности митохондрий и более благоприятному поведенческому результату (Nijboer et al. , 2013). Это коррелирует с более ранним исследованием, предполагающим, что экспрессия c-Jun и его последующее фосфорилирование увеличиваются при ишемическом повреждении (Herdegen et al., 1998). Предполагается, что JNK3 действует выше проапоптотического семейства BCL2, поскольку JNK3-опосредованное увеличение экспрессии BIM и PUMA отсутствовало у мышей с нокаутом гена JNK3 (Pirianov et al., 2007). Кроме того, транскрипционный фактор Forkhead (FOXO3a), критический эффектор в активации JNK, вероятно, также участвует в проапоптотическом эффекте активации JNK, поскольку ингибирование JNK предотвращает транслокацию FOXO3a в ядро в незрелом мозге после HI (Li et al., 2015). Кроме того, активация каспазы-3 также снижалась, что позволяет предположить, что активация JNK3 в ответ на гипоксически-ишемический инсульт приводит к каспазозависимому апоптозу. Важность JNK дополнительно подтверждается недавним исследованием, показывающим, что ингибирование киназы 1, регулирующей сигнал апоптоза (ASK1), обеспечивает защиту при HI.
, 2013). Это коррелирует с более ранним исследованием, предполагающим, что экспрессия c-Jun и его последующее фосфорилирование увеличиваются при ишемическом повреждении (Herdegen et al., 1998). Предполагается, что JNK3 действует выше проапоптотического семейства BCL2, поскольку JNK3-опосредованное увеличение экспрессии BIM и PUMA отсутствовало у мышей с нокаутом гена JNK3 (Pirianov et al., 2007). Кроме того, транскрипционный фактор Forkhead (FOXO3a), критический эффектор в активации JNK, вероятно, также участвует в проапоптотическом эффекте активации JNK, поскольку ингибирование JNK предотвращает транслокацию FOXO3a в ядро в незрелом мозге после HI (Li et al., 2015). Кроме того, активация каспазы-3 также снижалась, что позволяет предположить, что активация JNK3 в ответ на гипоксически-ишемический инсульт приводит к каспазозависимому апоптозу. Важность JNK дополнительно подтверждается недавним исследованием, показывающим, что ингибирование киназы 1, регулирующей сигнал апоптоза (ASK1), обеспечивает защиту при HI.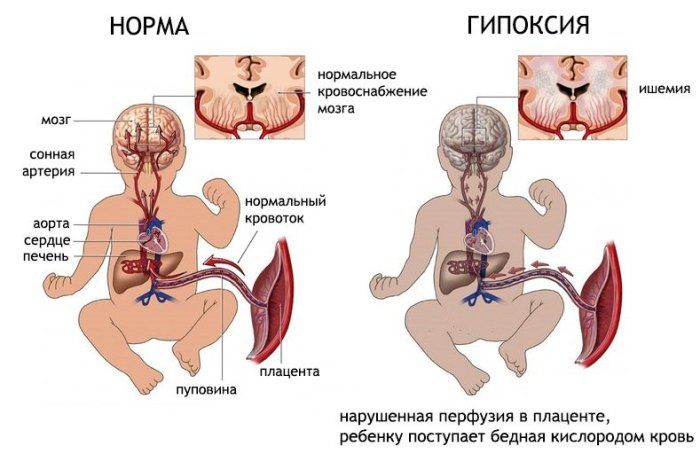 ASK1 активирует JNK и предотвращает фосфорилирование JNK, экспрессию TUNEL и активацию каспазы-3 в неонатальной модели HI (Hao et al., 2016).
ASK1 активирует JNK и предотвращает фосфорилирование JNK, экспрессию TUNEL и активацию каспазы-3 в неонатальной модели HI (Hao et al., 2016).
Каспаза-2
Caspase-2 является членом подгруппы инициаторов каспаз и регулируется в процессе развития (Kumar et al., 1994). Активация каспазы-2 зависит от ее димеризации и последующего расщепления, чему способствует взаимодействие с белком, содержащим домен смерти, индуцированным р53 (PIDD), и связанным с RIP гомологичным белком ICH-1 / CED3 с доменом смерти (RAIDD) (Duan and Диксит, 1997; Балига и др., 2004; Tinel and Tschopp, 2004) в некоторых клеточных системах. Кроме того, каспаза-2 может быть запущена повреждением ядерной ДНК, эндоплазматическим ретикулумом или стрессом Гольджи посредством механизма, не зависящего от PIDD / RAIDD (Galluzzi et al., 2014). После активации каспаза-2 способствует расщеплению BID, что приводит к транслокации BAX и высвобождению Cyt C (Lassus et al., 2002). Примечательно, что новорожденные мыши с нулевой каспазой-2 частично защищены от эксайтотоксического повреждения и повреждения HI (Carlsson et al. , 2011), в отличие от взрослых мышей с нокаутом каспазы-2 (Bergeron et al., 1998). Высокая экспрессия каспазы-2 была обнаружена у новорожденных мышей, крыс и в посмертных человеческих тканях новорожденных (Carlsson et al., 2011). Интересно, что был разработан ингибитор каспазы группы II, TRP601, который нацелен на каспазу-2 и каспазу-3. Неонатальные животные, подвергшиеся эксайтотоксичности, артериальному инсульту или HI, были значительно защищены от потери белого и серого вещества (Chauvier et al., 2011).
, 2011), в отличие от взрослых мышей с нокаутом каспазы-2 (Bergeron et al., 1998). Высокая экспрессия каспазы-2 была обнаружена у новорожденных мышей, крыс и в посмертных человеческих тканях новорожденных (Carlsson et al., 2011). Интересно, что был разработан ингибитор каспазы группы II, TRP601, который нацелен на каспазу-2 и каспазу-3. Неонатальные животные, подвергшиеся эксайтотоксичности, артериальному инсульту или HI, были значительно защищены от потери белого и серого вещества (Chauvier et al., 2011).
Циклинзависимая киназа 5 (CDK5)
Циклинзависимая киназа 5 (CDK5) принадлежит к группе серин / треониновых киназ, которые принимают участие в регуляции клеточного цикла в нормальных условиях.Однако во время патологических ситуаций p35 расщепляется кальпаинами с образованием p25, который чрезмерно активирует CDK5, что приводит к фосфорилированию и нарушению регуляции аксональных белков TAU и рецепторов глюкокортикоидов, усиливая апоптотическую гибель клеток. Ингибирование p25 / CDK5 до или после неонатального HI ослабляет активацию каспазы-3 (Tan et al. , 2015), повреждение головного мозга и улучшает неврологический исход у новорожденных крыс, что позволяет предположить, что CDK5 является еще одним потенциальным триггером апоптотической гибели клеток.
, 2015), повреждение головного мозга и улучшает неврологический исход у новорожденных крыс, что позволяет предположить, что CDK5 является еще одним потенциальным триггером апоптотической гибели клеток.
PTEN / AKT / GSK3β / foxo3a
Путь PTEN / AKT / GSK3β / foxo3a кажется критическим в индукции апоптоза в головном мозге новорожденных.Фосфатаза и гомолог тензина, удаленный на хромосоме 10 (PTEN), противодействуют передаче сигналов фосфатидилинозитол-3-киназы-AKT. Было показано, что ингибирование PTEN увеличивает pAKT, снижает транслокацию FOXO3a в ядро и подавляет BIM и апоптотическую гибель клеток в неонатальном мозге после HI (Zhao et al., 2013). Фосфорилирование Akt также подавляет активность киназы-3β гликогенсинтазы (GSK-3β), которая запускает апоптоз, зависимый от каспазы-3, и было показано, что ингибитор GSK-3β тидеглусиб снижает активацию каспаз-3 и -9, а также снижает HI. черепно-мозговая травма (Wang et al., 2016). Кроме того, нейропротекция прогестероном, инсулиноподобным фактором роста, гормоном роста и его аналогом гексарелином, по-видимому, связана с активацией Akt и ингибированием GSK3β (Gustafson et al. , 1999; Brywe et al., 2005a, b; Li et al. al., 2014) и уменьшение апоптоза, зависимого от каспазы-3.
, 1999; Brywe et al., 2005a, b; Li et al. al., 2014) и уменьшение апоптоза, зависимого от каспазы-3.
Сроки MOMP
Время митохондриальной проницаемости обсуждается, но большинство результатов исследований предполагают, что это происходит через 3–24 часа после гипоксии-ишемии, то есть начиная с латентной фазы и переходя во вторичную фазу повреждения в зависимости от тяжести повреждения, животная модель, и область мозга (Cheng et al., 1998; Нортингтон и др., 2001; Гилл и др., 2002; Wang et al., 2004; Чжу и др., 2005; Hagberg et al., 2014). Эти предлагаемые сроки также подтверждаются данными вмешательств, которые блокируют митохондриальную проницаемость, которые эффективны, если проводить их в течение 6 часов после гипоксии-ишемии (Wang et al., 2010; Chauvier et al., 2011; Nijboer et al., 2011, 2013).
Внешний путь и рецепторы смерти при перинатальной травме головного мозга
Во время воспаления, вызванного перинатальной травмой головного мозга (Hagberg et al. , 2012), активация внутренних и внешних иммунных клеток будет производить активные формы кислорода, высвобождать возбуждающие агонисты аминокислот, провоспалительные цитокины (например, IL-1β, IL-18, TNF-α), хемокины (Bona et al., 1999) и факторы некроза опухоли (например, TNF-α, TNF-β, FasL, TRAIL, TWEAK) (Taylor et al., 2005; Yepes et al., 2005; Hoffmann et al., 2009; Hagberg et al., 2015). ), которые могут способствовать гибели клеток.
, 2012), активация внутренних и внешних иммунных клеток будет производить активные формы кислорода, высвобождать возбуждающие агонисты аминокислот, провоспалительные цитокины (например, IL-1β, IL-18, TNF-α), хемокины (Bona et al., 1999) и факторы некроза опухоли (например, TNF-α, TNF-β, FasL, TRAIL, TWEAK) (Taylor et al., 2005; Yepes et al., 2005; Hoffmann et al., 2009; Hagberg et al., 2015). ), которые могут способствовать гибели клеток.
TNF-α опосредуется активацией двух рецепторов: TNFR1 с низким сродством (p55) и TNFR2 с высоким сродством (p75) (Tartaglia et al., 1991), обнаруженные как в популяциях нейронов (Dziewulska and Mossakowski, 2003; Figiel and Dzwonek, 2007), так и в популяциях глиальных клеток (Dopp et al., 1997). Хотя внеклеточные домены обоих рецепторов обладают высокой степенью гомологии, их внутриклеточные домены значительно различаются (Dembic et al., 1990; Vanden Berghe et al., 2014). Это приводит к сложным путям передачи сигналов, которые могут быть запущены и могут привести к активации антагонистических функций этих двух рецепторов (Tartaglia et al. , 1991; Marchetti et al., 2004). При активации внутриклеточная часть TNFR1, содержащая домен смерти, запускает апоптоз (Hsu et al., 1995), тогда как TNFR2 лишен этого домена — его активация запускает нейрозащиту посредством активации NFκB (Song et al., 1997). Есть несколько свидетельств, которые предполагают участие пути TNF в развитии повреждения белого вещества. У детей с церебральным параличом наблюдается повышенный уровень TNF-α в крови (Nelson et al., 1998), а TNFR1 имеет решающее значение для LPS-опосредованной сенсибилизации к недостатку кислорода / глюкозы in vitro (Markus et al., 2009). Более того, делеция кластера генов TNF устраняет LPS-опосредованную сенсибилизацию неонатального мозга к поражению HI (Kendall et al., 2011). Обработка TNF-α, по-видимому, токсична для олигодендроглиальных клеток-предшественников (OPCs) (Yu et al., 2000) и усиливает токсичность IFN-γ для этих клеток in vitro (Andrews et al., 1998). TNF также участвует в нейропротекции мозга. Было продемонстрировано, что повреждение нейронов после ишемических и эксайтотоксических поражений усиливается у мышей TNFR KO (Bruce et al.
, 1991; Marchetti et al., 2004). При активации внутриклеточная часть TNFR1, содержащая домен смерти, запускает апоптоз (Hsu et al., 1995), тогда как TNFR2 лишен этого домена — его активация запускает нейрозащиту посредством активации NFκB (Song et al., 1997). Есть несколько свидетельств, которые предполагают участие пути TNF в развитии повреждения белого вещества. У детей с церебральным параличом наблюдается повышенный уровень TNF-α в крови (Nelson et al., 1998), а TNFR1 имеет решающее значение для LPS-опосредованной сенсибилизации к недостатку кислорода / глюкозы in vitro (Markus et al., 2009). Более того, делеция кластера генов TNF устраняет LPS-опосредованную сенсибилизацию неонатального мозга к поражению HI (Kendall et al., 2011). Обработка TNF-α, по-видимому, токсична для олигодендроглиальных клеток-предшественников (OPCs) (Yu et al., 2000) и усиливает токсичность IFN-γ для этих клеток in vitro (Andrews et al., 1998). TNF также участвует в нейропротекции мозга. Было продемонстрировано, что повреждение нейронов после ишемических и эксайтотоксических поражений усиливается у мышей TNFR KO (Bruce et al. , 1996). Нейропротекторная роль TNF при церебральной ишемии по крайней мере частично приписывается активности TNFR2 (Lambertsen et al., 2009).
, 1996). Нейропротекторная роль TNF при церебральной ишемии по крайней мере частично приписывается активности TNFR2 (Lambertsen et al., 2009).
FasL способен связываться с рецептором смерти Fas, запускающим апоптоз, и с рецептором-ловушкой 3 (Pitti et al., 1998). HI активирует передачу сигналов рецептора смерти Fas в неонатальном мозге (Felderhoff-Mueser et al., 2000), а повреждение мозга HI снижается у мышей, лишенных рецепторов смерти Fas (Graham et al., 2004). Показано, что экспрессия Fas в первичных OPC выше, чем в зрелых олигодендроцитах (Andrews et al., 1998), что указывает на более высокую восприимчивость к FasL на более ранних стадиях развития.
Два TRAIL-рецептора у людей содержат домены цитоплазматической смерти (DR4 и DR5) и обладают способностью вызывать апоптотическую гибель клеток (Pan et al., 1997; Walczak et al., 1997), тогда как рецептор Decoy 1 и рецептор Decoy 2 не функционируют death домены и, таким образом, считаются действующими как рецепторы-ловушки (Marsters et al. , 1997; Sheridan et al., 1997). Сообщалось о двух мембранных рецепторах-ловушках mDcTRAILR1 и mDcTRAILR2 у мышей (Schneider et al., 2003) и только один опосредующий смерть TRAIL рецептор, который имеет самую высокую гомологию с человеческим TRAIL рецептором DR5 (Wu et al., 1999). Используя модель неонатальных мышей, мы недавно обнаружили, что экспрессия TRAIL, DR5 и mDcTRAILR2 значительно повышалась после HI (Kichev et al., 2014). Белок TRAIL экспрессируется главным образом в микроглии и астроглии, тогда как DR5 локализуется совместно с нейронами и олигодендроглиальными предшественниками in vivo . Рекомбинантный TRAIL проявлял токсичность отдельно или в сочетании с кислородной недостаточностью глюкозы и воздействием TNF-α / IFN-γ в первичных нейронах, что позволяет предположить, что повышенные уровни TRAIL после HI могут усугубить повреждение головного мозга во время фазы восстановления (Kichev et al., 2014). Это предположение подтверждается исследованиями, показывающими, что инъекция растворимого рецептора DR5 значительно снижает объем инфаркта после ишемии, по крайней мере, на моделях взрослых грызунов (Cui et al.
, 1997; Sheridan et al., 1997). Сообщалось о двух мембранных рецепторах-ловушках mDcTRAILR1 и mDcTRAILR2 у мышей (Schneider et al., 2003) и только один опосредующий смерть TRAIL рецептор, который имеет самую высокую гомологию с человеческим TRAIL рецептором DR5 (Wu et al., 1999). Используя модель неонатальных мышей, мы недавно обнаружили, что экспрессия TRAIL, DR5 и mDcTRAILR2 значительно повышалась после HI (Kichev et al., 2014). Белок TRAIL экспрессируется главным образом в микроглии и астроглии, тогда как DR5 локализуется совместно с нейронами и олигодендроглиальными предшественниками in vivo . Рекомбинантный TRAIL проявлял токсичность отдельно или в сочетании с кислородной недостаточностью глюкозы и воздействием TNF-α / IFN-γ в первичных нейронах, что позволяет предположить, что повышенные уровни TRAIL после HI могут усугубить повреждение головного мозга во время фазы восстановления (Kichev et al., 2014). Это предположение подтверждается исследованиями, показывающими, что инъекция растворимого рецептора DR5 значительно снижает объем инфаркта после ишемии, по крайней мере, на моделях взрослых грызунов (Cui et al. , 2010).
, 2010).
До сих пор был идентифицирован только один рецептор TWEAK как у людей, так и у грызунов, индуцибельный фактор роста фибробластов 14 (Fn14) (Wiley et al., 2001). Цитоплазматический хвост Fn14 не содержит домена канонической гибели, а связывание TWEAK с Fn14 может вызывать множественные пути гибели клеток в различных клеточных контекстах (Potrovita et al., 2004; Cannella et al., 2007). Внутрицеребровентрикулярная инъекция растворимого Fn14 (Yepes et al., 2005) значительно снижает объем инфаркта после ишемии на моделях взрослых грызунов, но его роль в незрелом повреждении головного мозга неизвестна.
Некроз и некроптоз
Концепция некроза как формы гибели клеток существует давно, и впервые она упоминается в 1859 году в учебнике Вирхова по клеточной патологии (Majno and Joris, 1995). Некроз определяется как быстрая, случайная или неконтролируемая гибель клеток, характеризующаяся набуханием клеток и разрывом мембраны, приводящим к воспалительной реакции (Laster et al.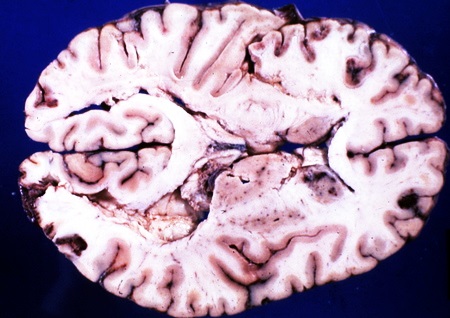 , 1988; Лу и др., 2014; Таблица 1). После инсульта начальное истощение АТФ нарушает действие транспортеров плазматической мембраны, таких как Na + , K + АТФаза, вызывая приток Na + и Cl —, сопровождаемый увеличением внутриклеточного Ca 2+ и вода (Fiers et al., 1999). Последующее увеличение внутриклеточного объема в конечном итоге приводит к коллапсу плазматической мембраны и высвобождению клеточного содержимого во внеклеточное пространство, вызывая воспалительный ответ хозяина, вызванный воздействием DAMP, таких как митохондриальная ДНК (Scaffidi et al., 2002; Zhang et al., 2010; Фигура 1).
, 1988; Лу и др., 2014; Таблица 1). После инсульта начальное истощение АТФ нарушает действие транспортеров плазматической мембраны, таких как Na + , K + АТФаза, вызывая приток Na + и Cl —, сопровождаемый увеличением внутриклеточного Ca 2+ и вода (Fiers et al., 1999). Последующее увеличение внутриклеточного объема в конечном итоге приводит к коллапсу плазматической мембраны и высвобождению клеточного содержимого во внеклеточное пространство, вызывая воспалительный ответ хозяина, вызванный воздействием DAMP, таких как митохондриальная ДНК (Scaffidi et al., 2002; Zhang et al., 2010; Фигура 1).
Однако в течение последних трех десятилетий этот взгляд на пассивный некроз был поставлен под сомнение открытием, что в ответ на лиганды, такие как цитокины семейства TNF, регулируемая гибель клеток запускалась с морфологией, напоминающей некроз (нарушение плазматической мембраны, набухание митохондрий ) (Офенгейм, Юань, 2013). Некроптоз или запрограммированный некроз (Laster et al. , 1988; Galluzzi et al., 2011, 2012c) — это форма строго регулируемой гибели клеток, которая происходит в среде, которая либо резко истощена по АТФ (Leist et al., 1997; Nicotera et al., 1998) или в которых подавляются каспазы (Vercammen et al., 1998; Cho et al., 2009; Kaiser et al., 2011).
, 1988; Galluzzi et al., 2011, 2012c) — это форма строго регулируемой гибели клеток, которая происходит в среде, которая либо резко истощена по АТФ (Leist et al., 1997; Nicotera et al., 1998) или в которых подавляются каспазы (Vercammen et al., 1998; Cho et al., 2009; Kaiser et al., 2011).
Клеточный механизм некроптоза
Как и внешний путь апоптоза, некроптоза
Инфекции мочевыводящих путей у детей: почему они возникают и как их предотвратить
1. Гинзбург CM, McCracken GH Jr. Инфекции мочевыводящих путей у детей раннего возраста. Педиатрия . 1982; 69: 409–12….
2. Wiswell TE, Смит FR, Бас JW. Снижение заболеваемости инфекциями мочевыводящих путей у обрезанных младенцев мужского пола. Педиатрия . 1985; 75: 901–3.
3. Wiswell TE,
Миллер GM,
Гельстон HM младший,
Джонс СК,
Clemmings AF.
Влияние статуса обрезания на периуретральную бактериальную флору в течение первого года жизни. Педиатр Дж. .
1988. 113: 442–6.
Педиатр Дж. .
1988. 113: 442–6.
4. Винберг Дж., Боллгрен I, Готефорс Л, Гертелиус М, Туллус К.Крайняя плоть: ошибка природы? Ланцет . 1989; 1 (8638): 598–9.
5. Боллгрен I, Винберг Дж. Периуретральная аэробная бактериальная флора здоровых мальчиков и девочек. Акта Педиатр Сканд . 1976; 65: 74–80.
6. Крафт Дж. К., Стейми Т.А. Естественное течение симптоматической рецидивирующей бактериурии у женщин. Медицина . 1977; 56: 55–60.
7. Бергстром Т, Линкольн К, Орсков Ф, Орсков I, Винберг Дж.Исследования инфекций мочевыводящих путей в младенчестве и детстве. 8. Реинфекция против рецидива при рецидивирующих инфекциях мочевыводящих путей. Оценка посредством выявления инфекционных организмов. Педиатр Дж. . 1967; 71: 13–20.
8. Кунин С.М.,
Дойчер Р.,
Paquin AJ.
Инфекция мочевыводящих путей у школьников: эпидемиологическое, клинико-лабораторное исследование. Медицина .
1964; 43: 91–130.
Медицина .
1964; 43: 91–130.
9. Марилд С, Джодал У, Мангелус Л.Истории болезни детей с острым пиелонефритом по сравнению с контрольной группой. Педиатр Инфекция Дис J . 1989; 8: 511–5.
10. Писакане А, Грациано Л, Маццарелла G, Скарпеллино Б, Зона Г. Инфекция грудного вскармливания и мочевыводящих путей. Педиатр Дж. . 1992; 120: 87–9.
11. Винберг Дж., Гертелиус-Эльман М, Моллби Р., Nord CE. Патогенез инфекции мочевыводящих путей — экспериментальные исследования устойчивости влагалища к колонизации. Педиатр Нефрол . 1993; 7: 509–14.
12. Лидефельт К.Дж., Боллгрен I, Nord CE. Изменения периуретральной микрофлоры после приема антимикробных препаратов. Арка Дис Детский . 1991; 66: 683–5.
13. Bauer SB. Невропатология нижних мочевыводящих путей. В: Келалис П.П., Кинг Л.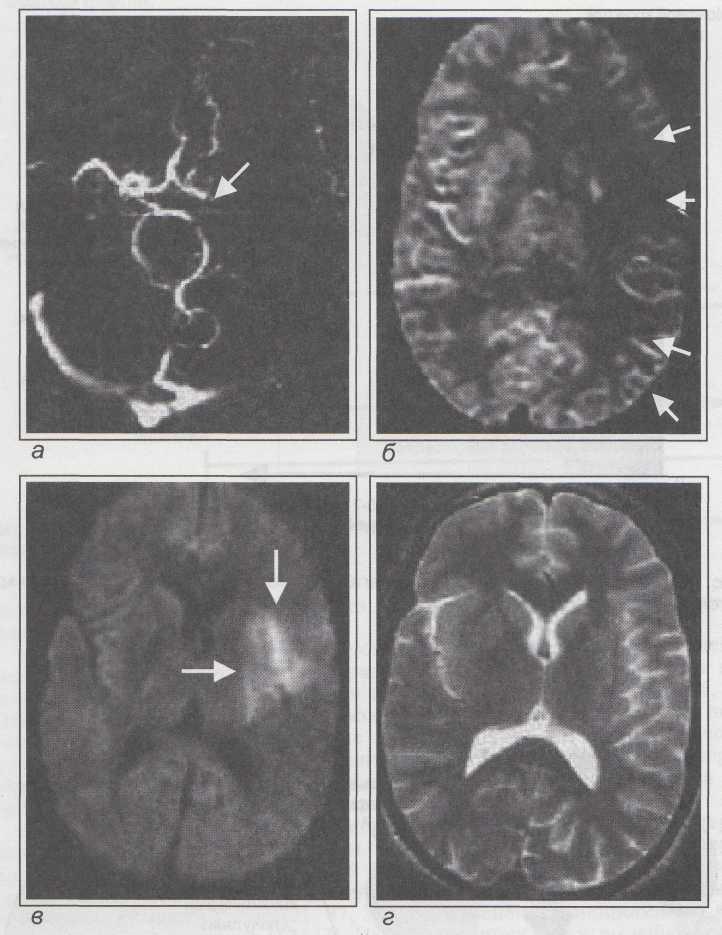 Р., Бельман А.Б., ред. Клиническая детская урология. 3-е изд. Филадельфия: Сондерс, 1992: 399–440.
Р., Бельман А.Б., ред. Клиническая детская урология. 3-е изд. Филадельфия: Сондерс, 1992: 399–440.
14. О’Реган С, Язбек С, Шик Э. Запор, нестабильность мочевого пузыря, синдром инфекции мочевыводящих путей. Клин Нефрол . 1985; 23: 152–4.
15. Лёнинг-Бауке В. Недержание мочи и инфекции мочевыводящих путей и их разрешение при лечении хронических запоров в детском возрасте. Педиатрия . 1997; 100: 228–32.
16. Винберг Дж. Какие гигиенические меры рекомендуются для предотвращения рецидивов инфекции мочевыводящих путей и какие доказательства подтверждают этот совет? Педиатр Нефрол . 1994; 8: 652.
17.Кунин СМ. Инфекции мочевыводящих путей у взрослых. В кн .: Кунин В.М., ред. Инфекция мочеиспускательного канала. 5-е изд. Балтимор: Уильямс и Уилкинс, 1997: 129–56.
18. Кунин СМ. Патогенез инфекции: микробы-захватчики. В кн .: Кунин В.М., ред. Инфекция мочеиспускательного канала. 5-е изд. Балтимор: Уильямс и Уилкинс, 1997: 280–321.
5-е изд. Балтимор: Уильямс и Уилкинс, 1997: 280–321.
19. Ericsson NO, Фон Хеденберг C, Тегер-Нильссон AC. Вульвоуретральный рефлюкс: выдумка? Дж Урол . 1973; 110: 606–8.
20.Аворн Дж, Монане М, Гурвиц JH, Глинн Р.Дж., Ходновский I, Lipsitz LA. Уменьшение бактериурии и пиурии после приема клюквенного сока. ЯМА . 1994; 271: 751–4.
21. Дик П.Т., Фельдман В. Рутинная диагностическая визуализация для инфекций мочевыводящих путей у детей: систематический обзор. Педиатр Дж. . 1996; 128: 15–22.
22. Отчет рабочей группы исследовательского отдела Королевского колледжа врачей.Рекомендации по ведению острой инфекции мочевыводящих путей в детском возрасте. Дж. Р. Колл Врачи Лондон . 1991; 25: 36–42.
23. Koff SA.
Практический подход к оценке инфекции мочевыводящих путей у детей. Педиатр Нефрол . 1991; 5: 398–400.
1991; 5: 398–400.
24. Haycock GB. Практический подход к оценке инфекции мочевыводящих путей у детей. Педиатр Нефрол . 1991; 5: 401–2.
25. Gleeson FV, Гордон И.Визуализация при инфекции мочевыводящих путей. Арка Дис Детский . 1991; 66: 1282–3.
26. Бельман А.Б. Комментарий. Педиатр Нефрол . 1997; 11: 180–81.
27. Маккензи-младший, Фаулер К., Холлман А.С., Таппин Д, Мерфи А.В., Битти TJ, и другие. Значение УЗИ у ребенка с острой инфекцией мочевыводящих путей. руб. Дж Урол . 1994; 74: 240–4.
28.Шринарасимхайя V, Алон США. Урорадиологическое обследование детей с инфекцией мочевыводящих путей: необходимы ли ультразвуковое исследование и кортикальная сцинтиграфия почек? Педиатр Дж. . 1995; 127: 373–7.
29. Старк Х.
Инфекции мочевыводящих путей у девочек: рентабельность рекомендуемых в настоящее время процедур расследования. Педиатр Нефрол .
1997; 11: 174–7.
Педиатр Нефрол .
1997; 11: 174–7.
30. Старейшина Я.С., Питерс CA, Арант Б.С. младший, Эвальт Д.Х., Хоутри CE, Гурвиц RS, и другие.Сводный отчет группы рекомендаций педиатрического пузырно-мочеточникового рефлюкса по лечению первичного пузырно-мочеточникового рефлюкса у детей. Дж Урол . 1997; 157: 1846–51.
Биологические характеристики и роль в восприимчивости к инфекциям и травмам, связанным с ишемией-реперфузией, у тяжелобольных новорожденных
Лектин, связывающий маннозу (MBL), является членом семейства коллиновых, принадлежащих к системе врожденного иммунитета. Генетические, биологические и клинические свойства MBL широко исследовались в течение последних десятилетий, хотя некоторые интересные аспекты его потенциальной клинической значимости все еще плохо изучены.Низкие циркулирующие концентрации MBL были связаны с повышенным риском инфекции и плохим неврологическим исходом у новорожденных. С другой стороны, чрезмерная и неконтролируемая воспалительная реакция кишечника новорожденного после воздействия бактерий просвета, приводящая к повышенной выработке MBL, может быть связана с началом некротического энтероколита. Цель настоящего обзора — обобщить текущие знания о генетических и биологических характеристиках MBL и его роли в восприимчивости к инфекциям и тканевым повреждениям, связанным с ишемией-реперфузией, чтобы лучше изучить его клиническую значимость в перинатальном периоде и возможные терапевтические методы лечения в будущем. Приложения.
С другой стороны, чрезмерная и неконтролируемая воспалительная реакция кишечника новорожденного после воздействия бактерий просвета, приводящая к повышенной выработке MBL, может быть связана с началом некротического энтероколита. Цель настоящего обзора — обобщить текущие знания о генетических и биологических характеристиках MBL и его роли в восприимчивости к инфекциям и тканевым повреждениям, связанным с ишемией-реперфузией, чтобы лучше изучить его клиническую значимость в перинатальном периоде и возможные терапевтические методы лечения в будущем. Приложения.
1. Введение
Лектин, связывающий маннозу (MBL), представляет собой белок врожденной иммунной системы, принадлежащий к семейству коллектинов, способный проявлять различные противомикробные свойства. Он распознает и связывает различные патогены (включая бактерии, вирусы, грибы и паразиты), обеспечивая защиту от микробной инвазии хозяина [1]. Хотя клиническое влияние дефицита MBL и его связь с широким спектром заболеваний были тщательно изучены, клиническое значение низких уровней MBL в сыворотке крови у здоровых субъектов все еще обсуждается. Изображение представляет собой мозаику, поскольку исследования показывают, что низкие или высокие уровни MBL в сыворотке крови оказывают вредное или благоприятное влияние на восприимчивость к различным заболеваниям. В раннем возрасте недостаточность MBL, по-видимому, имеет клиническое значение при наличии иммунодефицита и в тех случаях, когда иммунная система особенно уязвима [2]. Следовательно, MBL может играть решающую роль в защите первой линии в неонатальном периоде, когда материнские антитела исчезают, а собственная иммунная система ребенка является незрелой [3, 4].В тот же период жизни MBL, по-видимому, также играет роль в контактном руководстве миграцией нейронов, межнейрональном распознавании, миелинизации и ужесточении барьера эпендимных клеток [5].
Изображение представляет собой мозаику, поскольку исследования показывают, что низкие или высокие уровни MBL в сыворотке крови оказывают вредное или благоприятное влияние на восприимчивость к различным заболеваниям. В раннем возрасте недостаточность MBL, по-видимому, имеет клиническое значение при наличии иммунодефицита и в тех случаях, когда иммунная система особенно уязвима [2]. Следовательно, MBL может играть решающую роль в защите первой линии в неонатальном периоде, когда материнские антитела исчезают, а собственная иммунная система ребенка является незрелой [3, 4].В тот же период жизни MBL, по-видимому, также играет роль в контактном руководстве миграцией нейронов, межнейрональном распознавании, миелинизации и ужесточении барьера эпендимных клеток [5].
В то время как низкие уровни MBL в сыворотке были связаны с повышенным риском внутрибольничного сепсиса [6, 7] и неврологических рисков [8] у новорожденных, недавние исследования, проведенные на грызунах, подтверждают роль MBL в обострении тканевого повреждения (миокардиального , желудочно-кишечные, церебральные и почечные ткани) в ходе ишемически-реперфузионных повреждений за счет активации лектинового пути комплемента. Согласно этим данным, мы обнаружили, что генотипы MBL-2, связанные с высокими уровнями MBL в сыворотке крови, представляют собой фактор риска некротического энтероколита (НЭК) у недоношенных новорожденных [9].
Согласно этим данным, мы обнаружили, что генотипы MBL-2, связанные с высокими уровнями MBL в сыворотке крови, представляют собой фактор риска некротического энтероколита (НЭК) у недоношенных новорожденных [9].
В заключение, роль MBL, точное клиническое значение различных гаплотипов MBL и, соответственно, связанных уровней MBL в сыворотке, все еще плохо изучены и нуждаются в дальнейшем выяснении. Более того, до сих пор неясно, может ли экзогенное введение MBL оказывать защитное или, скорее, вредное воздействие на организм хозяина [10].
Целью настоящего обзора является обобщение текущих знаний о клинической роли MBL, особенно в перинатальном периоде, и рассмотрение спорных вопросов, обсуждение в конце его возможных будущих терапевтических применений.
2. MBL: белок и биологические свойства
Продукт гена MBL2 человека представляет собой полипептид 24 кДа, характеризующийся 248-аминокислотной последовательностью с четырьмя отдельными участками, богатой цистеином N-концевой областью, коллагеновой домен, короткий α -спиральный домен coiled-coil, так называемая шейная область и домен распознавания углеводов, и образует заметную глобулярную головку молекулы. Три полипептидные цепи образуют тройную спираль через коллагеновую область, стабилизированную гидрофобным взаимодействием и межцепочечными дисульфидными связями в N-концевой области, богатой цистеином. Эта тримерная форма является основной структурной субъединицей всех циркулирующих форм MBL. Более крупные молекулы могут быть получены путем олигомеризации этих гомотримерных субъединиц [11, 12] (Рисунок 1). Высокоупорядоченная олигомерная структура, расстояние и ориентация доменов распознавания углеводов определяют, какие лиганды MBL могут быть нацелены и необходимы для его функции.Через домен распознавания углеводов MBL связывается с определенными углеводами, такими как манноза или N-ацетилглюкозамин, которые подвергаются воздействию на поверхности ряда патогенов, таких как бактерии, вирусы, паразиты и грибы [13–15]. По этой причине MBL принадлежит к группе так называемых «молекул распознавания образов» [16], которые опосредуют преждевременную активацию иммунного ответа. MBL продуцируется печенью [15, 17–19] и высвобождается в сыворотке в условиях стресса [20, 21] как кальций-зависимый белок острой фазы.Сообщалось о значительном повышении циркулирующих уровней в ответ на инфекции. Во время воспалительных состояний MBL также может покидать кровоток из-за утечки из сосудов и может быть обнаружен в слизи среднего уха, в секрете верхних дыхательных путей, в воспаленной синовиальной жидкости и в нормальной жидкости амниона [22, 23]. MBL активирует макрофаги [24], усиливает фагоцитоз [25, 26] и играет роль в активации комплемента, индуцируя независимый от антител лектиновый путь [1, 13, 16, 27–31].В частности, MBL в сотрудничестве с тремя сериновыми протеазами, ассоциированными с MBL (MASP 1, 2 и 3), способен инициировать лектиновый путь активации комплемента, высвобождение цитокинов и факторов свертывания крови. Первоначально был идентифицирован единичный объект MASP и охарактеризован как протеаза, способная расщеплять белки комплемента C4, C2 и C3 [31, 32]. MASP действительно был смесью двух родственных, но различных протеаз, MASP-1 и MASP-2 [30]. Третья протеаза, MASP-3, также связана с MBL [33].Обычно считается, что MASP-2 является инициатором пути лектин-комплемент, в то время как роль других MASP все еще остается неопределенной [34]. MASP дополнительно образуют активные комплексы с фиколином-1 (M-Ficolin), Ficolin-2 (L-Ficolin) и Ficolin-3 (H-Ficolin), которые также являются защитными коллагенами [35–37].
Три полипептидные цепи образуют тройную спираль через коллагеновую область, стабилизированную гидрофобным взаимодействием и межцепочечными дисульфидными связями в N-концевой области, богатой цистеином. Эта тримерная форма является основной структурной субъединицей всех циркулирующих форм MBL. Более крупные молекулы могут быть получены путем олигомеризации этих гомотримерных субъединиц [11, 12] (Рисунок 1). Высокоупорядоченная олигомерная структура, расстояние и ориентация доменов распознавания углеводов определяют, какие лиганды MBL могут быть нацелены и необходимы для его функции.Через домен распознавания углеводов MBL связывается с определенными углеводами, такими как манноза или N-ацетилглюкозамин, которые подвергаются воздействию на поверхности ряда патогенов, таких как бактерии, вирусы, паразиты и грибы [13–15]. По этой причине MBL принадлежит к группе так называемых «молекул распознавания образов» [16], которые опосредуют преждевременную активацию иммунного ответа. MBL продуцируется печенью [15, 17–19] и высвобождается в сыворотке в условиях стресса [20, 21] как кальций-зависимый белок острой фазы.Сообщалось о значительном повышении циркулирующих уровней в ответ на инфекции. Во время воспалительных состояний MBL также может покидать кровоток из-за утечки из сосудов и может быть обнаружен в слизи среднего уха, в секрете верхних дыхательных путей, в воспаленной синовиальной жидкости и в нормальной жидкости амниона [22, 23]. MBL активирует макрофаги [24], усиливает фагоцитоз [25, 26] и играет роль в активации комплемента, индуцируя независимый от антител лектиновый путь [1, 13, 16, 27–31].В частности, MBL в сотрудничестве с тремя сериновыми протеазами, ассоциированными с MBL (MASP 1, 2 и 3), способен инициировать лектиновый путь активации комплемента, высвобождение цитокинов и факторов свертывания крови. Первоначально был идентифицирован единичный объект MASP и охарактеризован как протеаза, способная расщеплять белки комплемента C4, C2 и C3 [31, 32]. MASP действительно был смесью двух родственных, но различных протеаз, MASP-1 и MASP-2 [30]. Третья протеаза, MASP-3, также связана с MBL [33].Обычно считается, что MASP-2 является инициатором пути лектин-комплемент, в то время как роль других MASP все еще остается неопределенной [34]. MASP дополнительно образуют активные комплексы с фиколином-1 (M-Ficolin), Ficolin-2 (L-Ficolin) и Ficolin-3 (H-Ficolin), которые также являются защитными коллагенами [35–37].
В случае повреждения ткани после ишемии-реперфузии MBL быстро откладывается на клетках-мишенях и образует комплекс IgM-MBL, как только специфический аутореактивный IgM связывается с экспонированными тканевыми антигенами и запускает последующую активацию комплемента в острой фазе , усиливая расщепление C3 [38].Небольшие количества MBL также продуцируются в органах, отличных от печени, таких как мозг [39], почки [40, 41], селезенка [42], миндалины [43], тимус, тонкий кишечник [44], яички [42, 44]. ], яичников [41] и влагалища [45], предполагая, что локальная экспрессия MBL может иметь значение для местной иммунной защиты.
3. MBL: Genetics
В 1989 г. генная структура MBL и белка были идентифицированы Тейлором и Састри [48, 49]. Ген MBL человека ( MBL2) был клонирован, секвенирован и локализован в хромосоме 10q11.1 – q21. Сравнение геномной нуклеотидной последовательности MBL2 с последовательностью кДНК показало, что кодирующая белок область состоит из четырех экзонов, прерванных тремя интронами размером 600, 1350 и 800 пар оснований соответственно. Экзон 1 кодирует сигнальный пептид, богатый цистеином домен и семь копий повторяющегося мотива глицин-Xaa-Yaa, типичного для образования тройной спирали коллагеновых структур (Xaa и Yaa обозначают любую аминокислоту). Этот образец продолжается дополнительными 12 повторами глицин-Xaa-Yaa в экзоне 2.Экзон 3 кодирует область шеи, а экзон 4 — углевод-связывающий домен. Полученный белок состоит из олигомеров, каждый с тремя идентичными полипептидными цепями 32 кДа, как оценивали с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE). Печень синтезирует белок в виде структур, состоящих из трех-шести олигомеров [50] (рис. 1).
3.1. MBL2 Полиморфизмы гена
Присутствие вариантных аллелей гена MBL2 , кодирующего три различных структурных варианта полипептида MBL, сильно связано с дефицитом MBL.Пять однонуклеотидных полиморфизмов (SNP) в гене MBL2 приводят к вариациям количества или функции MBL в сыворотке. Два SNP локализованы в промоторной области в положениях -550 (вариант H / L) и -221 (вариант X / Y), а один локализован в 5′-нетранслируемой области в положении +4 (вариант P / Q) [ 51, 52] (рисунок 1). Они влияют на экспрессию гена MBL2. Гаплотипы HY, LY и LX коррелируют с высокой, средней и низкой активностью промотора, что согласуется с измерениями в сыворотке [49].Три других функциональных SNP расположены в экзоне 1, а именно в кодоне 52 (аллель D) [51], в кодоне 54 (аллель B) [2] и в кодоне 57 (аллель C) [53], и приводят к нарушение повторяющейся структуры Gly-Xaa-Yaa коллагеновой тройной спирали путем замены незаменимого остатка глицина на цистеин, аспарагиновую кислоту и глутаминовую кислоту соответственно [54]. Все три варианта предотвращают сборку субъединиц MBL в основную структуру тримера, тем самым уменьшая количество белка MBL (рис. 2).
Вариантные аллели очень часто встречаются в нормальных, здоровых популяциях, где они присутствуют у 20–50% людей, причем самые высокие частоты обнаруживаются у африканцев. Аллель B распространен у кавказцев, китайцев и эскимосов с частотами генов от 0,11 до 0,17%, в то время как аллель C присутствует почти исключительно у африканцев, где он встречается очень часто (от 0,23 до 0,29%). Аллель D присутствует как у кавказцев, так и у африканцев, хотя и с меньшей частотой (0,05% у обоих) [14].Все популяционные исследования показали значительный доминантный эффект аллелей B, C и D [51].
Уровни MBL в сыворотке определяются генетически, как описано Соренсеном, который оценил наследуемость уровней MBL в сыворотке и активности MASP-2 в элегантном исследовании взрослых близнецов, подчеркивая вклад общих генов, влияющих на оба признака. Данные этого исследования указывают на сильное генетическое влияние на сывороточные уровни MBL и на активность MASP-2 со значительной генетической корреляцией между двумя признаками.Фактически, корреляция между близнецами была выше у монозиготных, чем у дизиготных близнецов по обоим признакам, на которые, по-видимому, влияет, хотя и частично, сам
Ischemia mesenterica — Википедия
| Le informazioni riportate non sono consigli medici e potrebbero non essere точный. Я содержу только одно прекрасное иллюстративное и не состоящее из соображений состояние здоровья: легкие в авертензию. |
L ‘ ischemia mesenterica è una condizione medica causata dall’insufficiente afflusso di sangue all’intestino tenue. [1] Può manifestarsi implvvisamente (ишемия мезентерика острая) или постепенная (ишемия брыжеечной мозоли). [2] La forma acuta della malattia si Presenta spesso con dolore addominale grave импровизировано и ассоциировано с alto rischio di morte. La forma cronica si Presenta в наиболее постепенном жанре с добавлением дополнительных dopo aver mangiato, perdita di peso untaria, vomito e paura di mangiare.
Я получаю лечение от ишемии мезентериальной брыжейки, связанной с атриальным фибриллационом, сердечной недостаточностью, сердечной недостаточностью почек, тенденцией к образованию свертывания крови и предшествующего инфаркта миокарда. [1] Esistono quattro meccanismi attverso i quali si verifica uno scarso flusso sanguigno: un coagulo di sangue Proveniente da un’altra parte che viene alloggiato in un’arteria, un nuovo coagulo di sangue che si forma in un’arteria coagulo di sangue che si forma nella vena mesenterica superiore e un flusso sanguigno underfficiente a causa della bassa pressione sanguigna o spasmi di arterie. [3] [4] La malattia cronica è un fattore di rischio per la malattia acuta. [5] Лучший метод диагностики и ангиография, с компьютерной томографией (КТ), которая не используется. [2]
Терапия острой ишемии включает стент или фармакологию для удаления коагулирующего участка острой медиальной интервентистической радиологии. [2] La chirurgia a cielo aperto può anche essere utilizzata per rimuovere o bypassare l’ostruzione e strebbe essere needario rimuovere eventuali интеритини, что есть потребность смерти. [1] Se gli esiti non trattati rapidamente sono spesso scarsi. Tra le persone colieve anche in presenza di trattamento, il rischio di morte è compreso tra il 70% e il 90%. [3] В разделе «Патология хронической хирургии обхода» и «Траттаменто ди скелта». Coloro che hanno trombosi della vena Possono essere trattati con anticoagulanti come eparina e warfarin, con un intervento chirurgico usato se non migliorano. [6]
L’ischemia mesenterica acuta colpisce circa cinquecentomila persone all’anno nel mondo sviluppato. [7] L’ischemia mesenterica cronica colpisce circa uno su centomila persone. [8] La maggior parte delle persone colieve ha più di 60 anni. [3] Превосходная женщина, не имеющая себе равных, женщина, которая делает это. L’ischemia mesenterica fu descritta per la prima volta nel 1895. [2]
Sebbene non semper presenti e spesso sovrapposti, sono state descritte tre fasigressive di ischemia mesenterica: [9] [10]
- Si verifica per prima una fase iperattiva , in cui i sintomi primari sono un forte dolore addominale e il passaggio di feci sanguinolente.Самые популярные и непрогнозируемые поисковые запросы.
- Una fase paralitica può seguire se l’ischemiacontina; in questa fase, il dolore addominale diventa più diffuso, la pancia diventa più tenera al tatto e la motilità Кишечник diminuisce, causando gonfiore addominale, ulteriori feci sanguinolente e suoni Кишечник assenti all’esame.
- Infine, una fase di shock può svilupparsi quando i liquidi iniziano a fuoriuscire Attackverso il rivestimento del двоеточие даннеджиато.Ciò может вызвать шок и ацидоз метаболизма с disidratazione, bassa pressione sanguigna, battito cardiaco accelerato e confusione. Я pazienti, что progrediscono в questa fase sono spesso в condizioni critical e richiedono вылечить интенсивно.
Reperti dell’esame obiettivo [изменение | modifica wikitesto]
I sintomi dell’ischemia mesenterica Possono variare e Possono Essere Acuti (soprattutto se embolici), [11] subacuti o cronici. [12]
Le serie di casi riportano la prevalenza dei risultati clinici e forniscono la migliore stima disponibile, ma distorta, della sensibilità dei risultati clinici. [13] [14] В серии 58 пациентов с ишемией брыжейки возникает причина:
Fattori di rischio [изменение | modifica wikitesto]
In assenza di esamistrumentali adeguati per guidare la diagnosi, var fattori di rischio aiutano a sospettare questo quadro Clinico:
- L’ischemia mesenterica «dovrebbe essere sospettata quando gli Individual, в частности quelli ad alto rischio di ischemia mesenterica acuta, sviluppano dolore addominale grave e persistente che è sproporzionato rispetati ai l liluppano dolore addominale grave e persistente che è sproporzionato rispetati ai l lil. [15] , o semplicemente, dolore sproporzionato rispetto all’esame.
- Riguardo alla trombosi arteriosa mesenterica o all’embolia: «i sintomi precoci sono presenti e sono relativamente lievi nel 50% dei casi per 3-4 giorni prima di rivolgersi al medico». [16]
- Riguardo alla trombosi arteriosa mesenterica o all’embolia: «Qualsiasi paziente con un’aritmia come la fibrillazione atriale, что si lamenta di dolore addominale è altamente sospettato di avere un’embolizzazione fin nell’ai mesentericai.
- Riguardo all’ischemia кишечная, неокклюзионная: «Qualsiasi paziente che accept digitale e diuretici e che lamenta dolore addominale deve essere considerato ischemia noncclusiva fino a prova contraria».
È difficile Diagnosticare precocemente l’ischemia mesenterica. [17] Bisogna anche Differences la colite ischemica, che spesso si risolve da sola, dalla condizione piùmediatamente pericolosa per la vita di ischemia mesenterica acuta dell’intestino tenue.
Analisi del sangue [изменение | modifica wikitesto]
В серии 58 пациентов с ишемией брыжеечной кишки причина miste: [14]
- Conta dei globuli bianchi> 10,5 nel 98% (вероятность того, что соправвалутазион приходит с тестом nell’81% dei pazienti)
- Acido latticolevato al 91% (вероятное соправвалюто, приходящееся на 57% dei pazienti)
Nell’ischemia mesenterica acuta molto precoce o molto estesa, può non essere ancora presente un contexthelevato di lattian elobuli.Nell’ischemia mesenterica estesa, l’intestino può essere ischemico ma separato dal flusso sanguigno в современной истории, что и sottoprodotti dell’ischemia non siano ancora circolanti. [18]
Эндоскопия [изменение | modifica wikitesto]
Состояние использования числовых диспозитивов для достаточного количества эрозии толстой кишки. Первоначально диспозитивный базис тонометрии и насыщенный темп для равновесия и стимулирования pHi, подходящего для локального стимула жизни CO 2 .Первое устройство, одобренное Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (2004 г.), использовало визуальную визуализацию для анализа жизнеспособности капилляров. Utilizzare durante la riparazione dell’aneurisma aortico rilevato quando i livelli di ossigeno nel colour sono scesi al di sotto dei livelli sostenibili, consentendo la riparazione in tempo reale. В различных исследованиях специфичность составляет 83% на хроническую ишемию брыжейки и 90% или более высокое поражение острой толстой кишки с сенсибилизацией 71–92%.Tuttavia, questo dispositivo deve essere posizionato mediante endoscopia. [19] [20] [21]
Радиография [изменение | modifica wikitesto]
Le lastre a raggi X sono spesso normali or mostrano risultati non specific. [22]
Tomografia computerizzata [изменение | modifica wikitesto]
La tomografia computerizzata (TC) viene spesso utilizzata. [23] [24] L’accuratezza della TAC dipende dalla presenza di un’ostruzione dell’intestino tenue (SBO). [25]
In caso di SBO assente, la TC имеет сенсибилизацию 64% и специфичность 92%. В случае присутствия SBO, у TC есть сенсибилизация 83% и специфичность 93%.
I reperti durante le prime fasi dell’Ischemia mesenterica alla TAC includes:
- Мезентериальный отек [23]
- Dilatazione Кишечник
- Ispessimento delle pareti интестинали
- Мезентериальная нить [26]
- Evidenza di infarti di organi solidi adiacenti al rene o alla milza, coerenti con un fenomeno di doccia embolica cardiaca
I reperti tardivi della SBO, che indicano che l’intestino è necrotico, sono:
Ангиография [изменение | modifica wikitesto]
Poiché la causa dell’ischemia può essere dovuta all’occlusione embolica o trombotica dei vasi mesenterici o all’ischemia nonclusiva, самый лучший способ определения tra le eziologie и attverso l’uso dell’angiografia mesenterica.Sebbene abbia gravi rischi, l’angiografia предлагает возможность прямого вливания сосудорасширяющих средств в борьбе с не включенной ишемией. [27]
Il trattamento dell’ischemia mesenterica dipende dalla causa e può essere medico o chirurgico. Tuttavia, se l’intestino è diventato necrotico, l’unico trattamento è la rimozione chirurgica dei segmenti morti dell’intestino.
Nell’ischemia mesenterica non occlusiva, dove non vi è alcun blocco delle arterie che alimentano l’intestino, il trattamento è medico piuttosto che chirurgico.Le persone vengono ricoverate in ospedale per rianimazione con liquidi per via endovenosa, attento monitoraggio degli esami di labratorio e ottimizzazione della loro funzione cardiovascolare. La Decpressione della provetta NG e l’anticoagulazione dell’eparina Possono anche essere usate per limitare lo стресс кишечного и ottimizzare la perfusione, rispettivamente.
La rivascolarizzazione chirurgica rimane il trattamento di Scelta per l’ischemia mesenterica correlata a un’occlusione dei vasi che forniscono l’intestino, ma il trattamento medico trombolitico e le tecnichecenoteologiche uncololoventistic hans. [28]
Se l’ischemia — это прогнозирование на уровне кишечных сегментов, вызывающих подозрения, это необходимо для лечения кишечных инфекций. Spesso, ovviamente, i segmenti morti vengono rimossi alla prima operazione e viene pianificata un’operazione di seconda occhiata per valutare, and segmenti che sono al limit, chepossono essere salvati dopo la rivascolarizzazione. [29]
Методы проверки [изменение | modifica wikitesto]
- Chirurgica Trombectomia aperta
- Обход мезентериального канала
- Angioplastica mesenterica e стентирование ante-femorale trans-femorale
- Aprire lo стентирование angioplastico mesenterico retrogrado
- Транскатетер тромболизи [18]
La prognosi dipende dalla diagnosi tempestiva (meno di 12-24 ore e prima della necrosi) [30] e dalla causa sottostante: [31]
- trombosi venosa: mortalità al 32%
- arteriosa эмболия: mortalità al 54%
- arteriosa trombosi: mortalità al 77%
- ишемия без окклюзии: смертность 73%. Александр Нуццо и Оливье Коркос, Обратимая острая мезентериальная ишемия, в Медицинском журнале Новой Англии, вып. 375, п. 15, 13 октября 2016 г., стр. E31, DOI: 10.1056 / NEJMicm1509318, PMID 27732829.
- Инсулин стимулирует анаболическую активность
- Утероплацентарный кровоток может быть нарушен из-за диабетического сердечно-сосудистого заболевания.
- Гликозилирование материнского гемоглобина увеличивает его сродство к O 2 , тем самым сдвигая кривую диссоциации O 2 влево и уменьшая перенос кислорода к гемоглобину плода в плаценте.
- Многоводие
- Преждевременные роды
- Ограничение роста
- Повышенная частота врожденных аномалий (гипергликемия в первом триместре может быть тератогенной)
- Повышенный уровень внутриутробной смертности (в основном, из-за лактоацидоза)
- Масса тела при рождении обычно повышена (макросомия) из-за повышенного анаболизма и поглощения глюкозы клетками плода.Однако он также может быть нормальным или низким, если плод был подвержен тяжелой ишемии, вторичной по отношению к диабетическому сосудистому заболеванию матери.
- Увеличенные внутренние органы
- Пухлое полнокровное лицо (напоминает лицо пациентов, получавших кортикостероиды)
- Врожденные аномалии. Наиболее распространены пороки развития сердца (дефект межжелудочковой или предсердной перегородки, транспозиция магистральных сосудов, артериальный ствол, двойной выход правого желудочка, коарктация аорты) и пояснично-крестцовая агенезия.
- Уровень глюкозы в крови. Самая низкая точка концентрации глюкозы в крови младенца обычно достигается между 1 и 3 часами. Проверяйте всех младенцев от матерей с диабетом на уровень глюкозы в крови в возрасте около 2 часов.
- Исследования железа, включая ферритин, общая железосвязывающая способность — эритропоэз истощает запасы железа
- Электролиты — инсулин изменяют концентрацию многих, таких как калий, кальций, фосфат и магний
- Билирубин — Скрининг на гипербилирубинемию, которая может возникать из-за 1) полицитемии и 2) притупленного выброса кортизола, подавляющего метаболизм билирубина
- Общий анализ крови — Скрининг полицитемии у новорожденных с полнокровием
- Behrman: Учебник по педиатрии Нельсона, 17-е изд., Copyright © 2004 Saunders, An Imprint of Elsevier Глава 96 — Эндокринная система
- М. Б. Лэндон и С. Викерс. Наблюдение за плодом при беременности, осложненной сахарным диабетом: необходимо ли? Журнал медицины матери, плода и новорожденного, 2002; 12: 413–416
- Дж. Л. Нольд и М. К. Георгиев. Младенцы диабетических матерей. Педиатрическая клиника Северной Америки 51 (2004) 619–637
младенцев от диабетических матерей | Изучите педиатрию
Щелкните для pdf: Младенцы от матерей с диабетом
Введение
Гипогликемия развивается примерно у 25–50% младенцев от матерей с диабетом и у 15–25% младенцев от матерей с гестационным диабетом.Однако только у небольшого процента этих младенцев появляются симптомы. Нераспознанная гипогликемия у новорожденного может привести к летальному исходу, поэтому ее важно заподозрить у всех младенцев от матерей с диабетом.
Патофизиология
Нормальный гомеостаз глюкозы
а) Пренатальный
Глюкоза проникает через плаценту инсулино-независимым образом. Гормоны, контролирующие гомеостаз глюкозы, не проникают через плаценту. Плод вырабатывает собственные глюкогомеостатические гормоны.Хотя резкие изменения уровня сахара в крови не оказывают заметного влияния на секрецию инсулина или глюкагона у плода, длительное воздействие гипергликемии приводит к усилению секреции инсулина и понижению секреции глюкагона в островках Лангерганса поджелудочной железы.
б) Изменения при рождении
У любого младенца, независимо от количества глюкозы в нем до рождения, прекращение передачи материнской глюкозы привело бы к гипогликемии, если бы не было контррегуляции. Гипогликемия предотвращается за счет активации глюкогомеостатической системы на трех разных уровнях:
Гормоны
Снижение секреции инсулина — это устраняет ингибирование кетогенеза и глюконеогенеза в печени и снижает поглощение глюкозы мышечными и жировыми клетками за счет инсулинозависимого поглощения (GLUT4).
Глюкагон увеличивается в течение нескольких минут после рождения. Также повышаются уровни адреналина и гормона роста. Они действуют синергетически, стимулируя гликогенолиз и глюконеогенез в печени, а также активируют липолиз и кетогенез. Эти процессы поставляют глюкозу для поддержания уровня глюкозы в крови и поддерживают ткани, зависящие от глюкозы (то есть мозг и анаэробные ткани, такие как эритроциты, хрусталик глаза), и производят кетоновые тела для поддержания тканей, способных использовать кетоны в качестве альтернативного топлива через систему Кребса цикл (т.е. мышца, мозг).
Рецепторы
Рецепторы глюкагона повышают чувствительность, а количество рецепторов инсулина уменьшается.
Ферменты
Активируются ферменты, участвующие в производстве глюкозы (например, фосфенолпируваткарбоксикиназа), в то время как ферменты, участвующие в производстве гликогена, снижают активность (например, гликогенсинтаза).
Гомеостаз глюкозы у новорожденных от диабетических матерей
а) Пренатальный
Как объяснялось выше, длительное воздействие нерегулируемой гипергликемии приводит к адаптации плода.Поджелудочная железа плода компенсирует гипергликемию за счет увеличения количества бета-клеток, продуцирующих инсулин. Инсулин снижает уровень сахара в крови, стимулируя поглощение глюкозы миоцитами и липоцитами плода.
Далее следует компенсация плода. Экстрамедуллярный гемопоэз и гепатомегалия являются последствиями кислородного дефицита, которые объясняются следующим:
Повышенный спрос
Снижение предложения
б) Изменения при рождении
При рождении постоянный приток гипергликемической крови удаляется, в то время как гиперинсулинизм сохраняется, и возникает гипогликемия. Глюкогомеостатические механизмы не способны обратить вспять быстрое падение уровня сахара в крови.По сравнению с нормальными младенцами, младенцы от матерей с диабетом реагируют на глюкозу или белок более быстрым достижением более высокого пика инсулина. Напротив, повышение уровней уравновешивающих гормонов, глюкагона и адреналина в ответ на гипогликемию часто задерживается и уменьшается из-за преждевременного созревания надпочечников и альфа-клеток поджелудочной железы.
Клинические проявления
Характеристика беременности
Физические характеристики
Определенные системы, наиболее часто затрагиваемые
а) Центральная нервная система
Младенцы, как правило, имеют повышенный рефлекс испуга и дрожат в течение первых трех дней жизни, хотя также могут возникать гипотония, летаргия и плохое сосание. Судороги, если они возникают, вызваны гипогликемией или гипокальциемией. Механизм низкого содержания кальция следующий: у матери с диабетом 2 типа, вероятно, будет снижен уровень Mg в крови (из-за (1) экскреции в почках и (2) повышенного поглощения инсулина клетками).Низкий уровень магния у младенцев подавляет реакцию паращитовидных желез на гипокальциемию посредством высвобождения ПТГ.
б) Легочная система
Тахипноэ развивается у многих детей грудного возраста от матерей-диабетиков в течение первых двух дней жизни и может быть проявлением задержки созревания легких, гипогликемии, гипотермии, полицитемии, сердечной недостаточности, преходящего тахипноэ или отека мозга в результате родовой травмы или асфиксии. Младенцы от матерей с диабетом имеют более высокую частоту респираторного дистресс-синдрома, чем дети от матерей, не страдающих диабетом, рожденных в сопоставимом гестационном возрасте; более высокая частота, возможно, связана с антагонистическим действием инсулина на стимуляцию синтеза сурфактанта кортизолом.
c) Сердечно-сосудистая система
Кардиомегалия встречается часто (30%), а сердечная недостаточность встречается у 5–10% младенцев от матерей с диабетом. Может возникать асимметричная гипертрофия перегородки, которая проявляется как идиопатический гипертрофический субаортальный стеноз.
г) Гематологическая система
Полицитемия
Тромбоз почечной вены может возникнуть и его следует заподозрить у младенцев с опухолью в боку, гематурией и тромбоцитопенией.
д) Желудочно-кишечный тракт
Может присутствовать синдром тонкой левой толстой кишки и снижение перистальтики кишечника.Обратите внимание на признаки кишечной непроходимости, включая непереносимость кормления, рвоту и вздутие живота.
Лабораторные исследования
Лечение
дородовой
Лечение новорожденных от матерей с диабетом следует начинать до рождения путем частого пренатального обследования всех беременных женщин с явным или гестационным диабетом, оценки зрелости плода, биофизического профиля, допплеровской велосиметрии и планирования родов этих младенцев в больницах. где постоянно доступна квалифицированная акушерская и педиатрическая помощь.Контроль уровня глюкозы в периконцепции снижает риск аномалий. У матерей со значениями гемоглобина A1c менее 7% риск рождения ребенка с врожденными аномалиями не выше, чем у матерей без диабета. Для матерей со значениями от 7% до 8,5% риск составляет 5%; риск возрастает до 22% для матерей со значениями гемоглобина A1c более 10%. Точно так же контроль уровня глюкозы во время родов снижает частоту неонатальной гипогликемии. Женщины с диабетом 1 типа, которые строго контролируют уровень глюкозы во время беременности, рожают детей с массой тела при рождении и антропоморфными особенностями, аналогичными младенцам от матерей, не страдающих диабетом.Женщин с гестационным диабетом можно успешно лечить глибуридом, который может не проникать через плаценту. У этих матерей частота макросомии и неонатальной гипогликемии была аналогична таковой у матерей с гестационным диабетом, леченным инсулином.
При рождении
Макросомия подвергает ребенка диабетической матери большему риску родовой травмы из-за диспропорции головного и таза. Неудивительно, что по данным УЗИ частота родов с помощью кесарева сечения остается выше у детей от матерей с диабетом и увеличенной массой тела при рождении.В свете множества осложнений, которых следует ожидать при рождении ребенка от матери, страдающей диабетом, присутствие акушерской бригады является весьма оправданным.
Независимо от размера, все младенцы от матерей с диабетом изначально должны получать интенсивное наблюдение и уход. Младенцам без симптомов следует определять уровень глюкозы в крови между 1 и 2 часами после рождения, а затем каждый час в течение следующих 6–8 часов; если клинически хорошее и нормогликемическое, кормление грудным молоком или смесью через желудочный или пероральный прием следует начинать как можно скорее и продолжать с 3-часовыми интервалами.Если возникает вопрос о способности ребенка переносить пероральное кормление, кормление следует прекратить и ввести глюкозу путем периферической внутривенной инфузии со скоростью 4–8 мг / кг / мин или через корм для назогастрального лаважа. Гипогликемию следует лечить, даже у бессимптомных младенцев, частым кормлением и / или внутривенным вливанием глюкозы. Болюсных инъекций гипертонической глюкозы следует избегать бессимптомным младенцам, поскольку они могут вызвать дальнейшую гиперинсулинемию и потенциально повторную гипогликемию.
Кроме того, необходимо пройти полное медицинское обследование для выявления врожденных аномалий. Хотя клиническое подозрение на наличие аномалий должно быть высоким, скрининг всех младенцев от матерей с диабетом на наличие врожденных аномалий с помощью методов визуализации в настоящее время не является стандартной практикой.
См. Заявление CPS о стратегиях скрининга и ведения новорожденных из группы риска с гипогликемией для получения дополнительных сведений, выходящих за рамки данного обзора.
http://www.cps.ca/english/statements/FN/fn04-01.htm
Прогноз
Физическое развитие является нормальным, но дети с избыточным ростом могут быть предрасположены к детскому ожирению, которое может распространиться и на взрослую жизнь. Сохраняются разногласия относительно того, имеют ли эти младенцы несколько повышенный риск нарушения интеллектуального развития, не связанный с гипогликемией; Симптоматическая гипогликемия увеличивает риск, как и кетонурия у матери. Заболеваемость сахарным диабетом у младенцев от матерей с диабетом выше по сравнению с таковой среди населения в целом.
Список литературы
Благодарности
Сценарист: Элмин Стэтхэм
Под редакцией: Джефф Бишоп
Международное исследование сравнительной эффективности в отношении здоровья с помощью медицинских и инвазивных подходов (ISCHEMIA) — Полный текст
Цель исследования ISCHEMIA — определить лучшую стратегию ведения пациентов из группы высокого риска со стабильным ишемическим сердцем болезнь (SIHD).Это многоцентровое рандомизированное контролируемое исследование с 5179 рандомизированными участниками с умеренной или тяжелой ишемией при стресс-тестировании. Слепая коронарная компьютерная томографическая ангиограмма (CCTA) выполнялась большинству участников с рСКФ ≥60 мл / мин / 1,73 м2 для выявления и исключения участников либо со значительным незащищенным основным заболеванием левой руки (стеноз ≥50%), либо без обструктивной ИБС (<50 % стеноза всех крупных коронарных артерий). Из 8518 включенных участников те, у которых была недостаточная ишемия, неподходящая анатомия, продемонстрированная по CCTA или другому критерию исключения, не прошли рандомизацию.Затем подходящие участники были случайным образом распределены по стандартной инвазивной стратегии (INV) с катетеризацией сердца с последующей реваскуляризацией, если это возможно, плюс оптимальная медикаментозная терапия (OMT) или консервативная стратегия (CON) OMT, с катетеризацией сердца и реваскуляризацией, предназначенной для те, кто не справляется с ОМТ.
КОНКРЕТНЫЕ ЦЕЛИ
A. Основная цель Основная цель исследования ISCHEMIA — определить, снизит ли первоначальная инвазивная стратегия катетеризации сердца с последующей оптимальной реваскуляризацией, если это возможно, в дополнение к OMT, первичную комбинированную конечную точку сердечно-сосудистой смерти, нефатального инфаркта миокарда, реанимационная остановка сердца или госпитализация по поводу нестабильной стенокардии или сердечной недостаточности у участников с SIHD и умеренной или тяжелой ишемией в течение среднего периода наблюдения примерно 3.5 лет по сравнению с исходной консервативной стратегией только ОМТ с катетеризацией на случай неудачи ОМТ.
B. Вторичные цели Вторичные цели состоят в том, чтобы определить, улучшит ли первоначальная инвазивная стратегия по сравнению с консервативной стратегией: 1) совокупность смерти от сердечно-сосудистых заболеваний или ИМ; 2) симптомы стенокардии и качество жизни по данным опросника Сиэтлской ангины; 3) смертность от всех причин; 4) чистая клиническая польза, оцениваемая путем включения инсульта в составные первичные и вторичные конечные точки; и 5) отдельные компоненты составных конечных точек.
Состояние: Ишемическая болезнь сердца Процедура: КТ-ангиограмма коронарных артерий Процедура: Катетеризация сердца Фаза: Фаза III согласно NIH
Состояние: сердечно-сосудистые заболевания Процедура: ангиопластика, транслюминальная, чрескожная коронарная артерия, другие катетерные вмешательства Фаза: Фаза III согласно NIH
Состояние: болезни сердца Процедура: операция коронарного шунтирования Фаза: фаза III согласно NIH
СПРАВОЧНАЯ ИНФОРМАЦИЯ:
Доказательства, поддерживающие парадигму рутинной инвазивной практики для пациентов с SIHD, устарели.В испытаниях стратегии, проведенных в 1970-х годах, аортокоронарное шунтирование (АКШ) улучшило выживаемость по сравнению с отсутствием АКШ у пациентов с SIHD с анатомическими особенностями высокого риска. Актуальность этих исследований сегодня является спекулятивной, поскольку современные средства вторичной профилактики — аспирин, бета-адреноблокаторы, статины, ингибиторы АПФ и изменения образа жизни — использовались минимально, если вообще использовались. В последующих исследованиях сравнивали чрескожное коронарное вмешательство (ЧКВ) с медикаментозной терапией, поскольку ЧКВ заменило АКШ в качестве основного метода реваскуляризации при ВКВД.На сегодняшний день не показано, что ЧКВ снижает смертность или инфаркт миокарда (ИМ) по сравнению с медикаментозной терапией у пациентов с SIHD.
COURAGE и BARI 2D, два крупнейших исследования, сравнивающих коронарную реваскуляризацию с медикаментозной терапией у пациентов с SIHD, обнаружили, что среди пациентов, отобранных на основе анатомии коронарных артерий после катетеризации сердца, начальная стратегия лечения коронарной реваскуляризации (PCI, PCI или CABG, соответственно) не снижали первичные конечные точки смерти или ИМ (СМЕЛОСТЬ) или смерти (BARI 2D) по сравнению с одним ОМТ.Эти данные предполагают, но не доказывают, что рутинная катетеризация сердца, которая часто приводит к специальному ЧКВ через диагностико-терапевтический каскад, может не требоваться у пациентов с SIHD. Однако у большинства пациентов, включенных в COURAGE и BARI 2D, у которых была документально подтверждена тяжесть ишемии на исходном уровне, была только легкая или умеренная ишемия, что оставляло открытым вопрос о надлежащей роли катетеризации сердца и реваскуляризации среди пациентов из группы повышенного риска с более тяжелой ишемией.

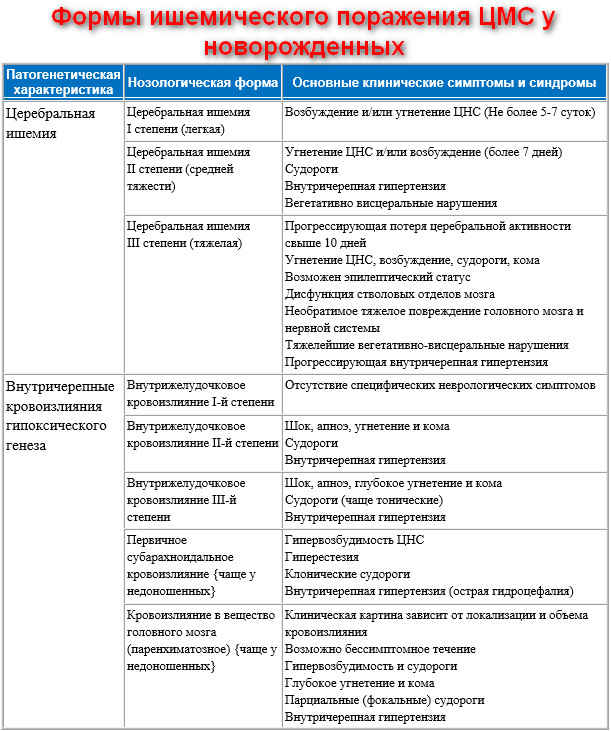

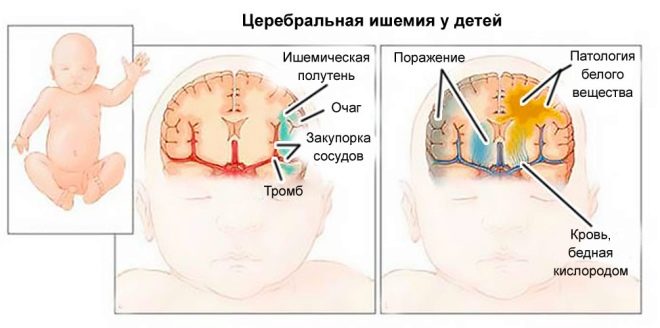 Если к головному мозгу кровь не проходит совсем, то он может умереть.
Если к головному мозгу кровь не проходит совсем, то он может умереть.

 Я возила ребенка на массажи и гимнастику, сделала все возможное, чтобы вылечить своего малыша, и мы выздоровели. Прошло уже 6 месяцев, как мы полностью здоровы.
Я возила ребенка на массажи и гимнастику, сделала все возможное, чтобы вылечить своего малыша, и мы выздоровели. Прошло уже 6 месяцев, как мы полностью здоровы. Нам сказали, что у нее ишемия головного мозга 1 степени. Все процедуры ей очень помогли, хотя я не замечала у нее каких-то отклонений. На плановом осмотре невролога, врач нам поставила такой диагноз.
Нам сказали, что у нее ишемия головного мозга 1 степени. Все процедуры ей очень помогли, хотя я не замечала у нее каких-то отклонений. На плановом осмотре невролога, врач нам поставила такой диагноз.


 Метод достаточно прост в выполнении и информативен. Выявляет наличие структурных изменений в веществе мозга, а также отек и набухание головного мозга. НЕ является ведущим методом, поскольку часто дает ложные результаты, как положительные, так и отрицательные.
Метод достаточно прост в выполнении и информативен. Выявляет наличие структурных изменений в веществе мозга, а также отек и набухание головного мозга. НЕ является ведущим методом, поскольку часто дает ложные результаты, как положительные, так и отрицательные.
 В первом случае асфиксия возникает в период прохождения ребенка по родовым путям, во втором – в первые минуты после рождения.
В первом случае асфиксия возникает в период прохождения ребенка по родовым путям, во втором – в первые минуты после рождения.