РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ ИНФЕКЦИИ HELICOBACTER PYLORI | Лапина Т.Л.
В статье подробно обсуждается вопрос эрадикации H. pylori. На основе собственного материала и международного соглашения по лечению инфекции H. pylori даются конкретные рекомендации для практических врачей. Подчеркивается необходимость единого подхода к диагностике и терапии H. pylori.
The paper discusses H.pylori eradication more specifically. Based on her own findings and the International Consensus Committee’s recommendations for treating H.pylori infection, the author provides guidelines for the practitioners. The paper underlines the need for applying a uniform approach to the diagnosis and treatment of H.pylori infection.
Т.Л. Лапина – ассистент курса “Функциональная диагностика и фармакотерапия в гастроэнтерологии”, кафедры семейной медицины факультета послевузовского профессионального образования
ММА им. И.М. Сеченова
T.L.Lapina, Assistant, Course “Functional Diagnosis and Pharmacotherapy in Gastroenterology”, Department of Family Medicine, Faculty of Postgraduate Training I.
С 1983 г., когда впервые был выделен в культуре новый вид микрооганизма – Helicobacter pylori (H. pylori), многочисленными исследованиями доказано его патогенетическое значение (табл. 1). Изучение H. pylori ведется с использованием современнейших научных методов и продвигается вперед огромными шагами. Такое «стремительное» накопление теоретических знаний в данной области, к сожалению, ведет к некоторому отставанию популяризации этой информации среди практических врачей. В итоге это оборачивается ошибками в диагностике, а главное, в выборе лечения инфекции H. pylori. К сожалению, большинство литературных источников, в которых методически правильно описывается практика эрадикационной терапии, т.е. терапии, направленной на уничтожение H. pylori, англоязычны, на русском языке опубликованы пока единичные работы.
 специальной конференцией Национального института здоровья США [1]. На конференции был достигнут консенсус по проблеме «Helicobacter pylori и язвенная болезнь»: больных язвенной болезнью с инфекцией H. pylori необходимо лечить антимикробными средствами и при обострении заболевания, и в период ремиссии, причем были рекомендованы определенные схемы терапии.
специальной конференцией Национального института здоровья США [1]. На конференции был достигнут консенсус по проблеме «Helicobacter pylori и язвенная болезнь»: больных язвенной болезнью с инфекцией H. pylori необходимо лечить антимикробными средствами и при обострении заболевания, и в период ремиссии, причем были рекомендованы определенные схемы терапии.
Таблица 1. H. pylori и патология человека
|
Патологические состояния |
Связь с инфекцией H. Pylori |
| Хронический гастрит, вызванный инфекцией H. pylori Язвенная болезнь желудка и двенадцатиперстной кишки Рак желудка MALT лимфома |
Установлена |
| Неязвенная диспепсия Болезнь Менетрие Ишемическая болезнь сердца Задержка роста детей |
|
| Гастроэзофагоеюнальная рефлюксная болезнь Гастродуоденальные изъязвления, связанные с приемом нестероидных противовоспалительных препаратов |
Спорна |
«Рекомендации по диагностике и лечению инфекции Helicobacter pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки», разработанные Российской группой по изучению H. pylori, прошли обсуждение на научной конференции, посвященной 100-летию со дня рождения В.Х. Василенко в апреле 1997 г. и на III Национальной гастроэнтерологической неделе в ноябре 1997 г. Они опубликованы в Российском журнале гастроэнтерологии, гепатологии, колопроктологии [3] и с помощью Российской гастроэнтерологической ассоциации (РГА) распространены по различным регионам России. Рекомендации предельно конкретны и призваны помочь практикующим врачам и организаторам здравоохранения.
pylori, прошли обсуждение на научной конференции, посвященной 100-летию со дня рождения В.Х. Василенко в апреле 1997 г. и на III Национальной гастроэнтерологической неделе в ноябре 1997 г. Они опубликованы в Российском журнале гастроэнтерологии, гепатологии, колопроктологии [3] и с помощью Российской гастроэнтерологической ассоциации (РГА) распространены по различным регионам России. Рекомендации предельно конкретны и призваны помочь практикующим врачам и организаторам здравоохранения.
|
Показания |
|
|
| Российская
гастроэнтерологическая ассоциация по изучению H. апрель 1997 г. |
Европейская группа по изучению H. pylori Маастрихт, сентябрь 1996 г. | |
| Язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения и в стадии ремиссии | Обязательно | |
| язвенная болезнь | безусловная | |
| МАLTома желудка | безусловная | |
| гастрит | вероятная | |
| после операции резекции жедудка по поводу рака | вероятная | |
| Желательно | ||
| функциональная диспепсия | возможная | |
| наследственность, отягощенная раком желудка, | возможная | |
| долгий прием ингибиторов протонной помпы по поводу гастроэзофагоеюнальной рефлюксной болезни | вероятная | |
| терапия нестероидными противовоспали-
тельными средствами |
возможная | |
| после операций по поводу язвенной болезни | ||
| желание пациента | вероятная | |
| Возможно | ||
| для предотвращения рака желудка | возможная | |
| бессимптомные носители | возможная | |
| экстраалиментарные заболевания(ишемическая болезнь сердца, задержка роста у детей) | возможная | |
Принципиальное значение для практики имеет разделение методики диагностики H.
2. Морфологические:
– гистологический «золотой стандарт» диагностики H. pylori: окраска бактерии в гистологических препаратах слизистой оболочки желудка по Гимзе, толуидиновым синим, Вартину – Старри, Генте;
– цитологический: окраска бактерии в мазках-отпечатках биоптатов слизистой оболочки желудка по Гимзе, Граму.

3. Дыхательный: определение в выдыхаемом больным воздухе изотопов 14С или 13С, которые выделяются в результате расщепления в желудке больного меченной мочевины под действием уреазы бактерии H. pylori.
4. Уреазный: определение уреазной активности в биоптате слизистой оболочки желудка путем помещения его в жидкую или гелеобразную среду, содержащую субстрат, буфер и индикатор.
Таблица 3. Тройная терапия на основе препаратов висмута
|
Препарат висмута |
Антибактериальные препараты |
|||
| Коллоидный субцитрат висмута или субсалицилат висмута или галлат висмута по 120 мг 4 раза в день(в пересчете на окись вимута) | + | Тетрациклин
по 500 мг 4 раза в день |
+ |
Метронидазол |
|
Продолжительность лечения – 7 дней |
||||
В «Рекомендациях» дано определение понятия «эрадикация» – это полное уничтожение бактерии H. pylori (как вегетативной, так и кокковидной форм) в желудке и двенадцатиперстной кишке человека. Эрадикационная терапия – серьезная задача для врача, и не всегда приводит к успеху. Для ведущих научных центров эрадикация H. pylori в 80% случаев является отличным показателем эффективности терапии.
pylori (как вегетативной, так и кокковидной форм) в желудке и двенадцатиперстной кишке человека. Эрадикационная терапия – серьезная задача для врача, и не всегда приводит к успеху. Для ведущих научных центров эрадикация H. pylori в 80% случаев является отличным показателем эффективности терапии.
Таблица 4. Соли висмута угнетают H. pylori in vitro
|
Соль висмута |
MIC90, нг/л |
| Висмута субцитрат |
4 – 32 |
| Висмута субсалицилат |
64 |
| Ранитидин-висмут-цитрат |
16 |
| Висмута субгаллат |
32 |
| Висмута субнитрат |
> 128 |
Применение антибактериальных лекарственных препаратов резко снижает количество H. pylori в гастродуоденальной слизистой оболочке. Поэтому сразу после окончания эрадикационного лечения даже в случае его неудачи H. pylori не обнаруживается. Ложноотрицательные результаты обусловлены тем, что H. pylori может отсутствовать в случайно взятых единичных биоптатах слизистой оболочки или находится там в таких незначительных количествах, которые не воспринимаются диагностическими методами (морфологический, уреазный). С уменьшением количества H. pylori связаны сложности его обнаружения после монотерапии висмут-содержащими препаратами, метронидазолом, любыми антибактериальными препаратами, использованными по другим показаниям (например, аугментин по поводу ангины, фурадонин по поводу цистита и др.).
pylori в гастродуоденальной слизистой оболочке. Поэтому сразу после окончания эрадикационного лечения даже в случае его неудачи H. pylori не обнаруживается. Ложноотрицательные результаты обусловлены тем, что H. pylori может отсутствовать в случайно взятых единичных биоптатах слизистой оболочки или находится там в таких незначительных количествах, которые не воспринимаются диагностическими методами (морфологический, уреазный). С уменьшением количества H. pylori связаны сложности его обнаружения после монотерапии висмут-содержащими препаратами, метронидазолом, любыми антибактериальными препаратами, использованными по другим показаниям (например, аугментин по поводу ангины, фурадонин по поводу цистита и др.).
Таблица 5. Тройная терапия на основе ингибиторов протонной помпы париетальных клеток
| Ингибиторы протонной помпы Антибактериальные препараты | ||
|
Омепразол |
+ |
Кларитромицин по 250 мг 2 раза в день + метронидазол по 400 мг 3 раза в день |
|
Или |
или |
|
|
пантопразол |
амоксициллин по 1000 мг 2 раза в день + кларитромицин 500 мг 2 раза в день |
|
|
Или |
или |
|
|
Лансопразол |
Амоксициллин по 500 мг 3 раза в день + метронидазол по 400 мг 3 разав день |
|
|
Продолжительность лечения – 7 дней |
||
Таблица 6. Квадротерапия
Квадротерапия
|
Блокаторы протонной помпы |
Препарат висмута |
Антибактериальные препараты |
||
|
Омепразол по 20 мг |
Коллоидный субцитрат висмута |
Тетрациклин по 500 мг 4 раза в день |
||
|
или |
Или |
+ |
||
|
Пантопразол по 40 мг 2 раза в день |
Субсалицилат висмута |
Метронидазол по 250 мг 4 раза в день |
||
|
или |
или |
или |
||
|
Лансопразол |
Галлат висмута по 120 мг 4 раза в день |
Тинидазол |
||
|
Продолжительность лечения – 7 дней |
||||
Важно отметить, что применение любых ингибиторов протонной помпы (омепразола, пантопразола, лансопразола) в силу особенностей адаптации H. pylori к определенным значениям рН приводит к перераспределению H. pylori по слизистой оболочке: бактерии элиминируются из антрального отдела и в большем количестве обнаруживаются в теле желудка. Считается, что мощная антисекреторная терапия приводит и к уменьшению общего количества бактерий H. pylori. Таким образом, если проводить исследование на H. pylori во время или сразу после курса терапии ингибиторами протонной помпы не исключен ложноотрицательный результат, особенно если ограничиться биоптатами из антрального отдела [4]. Известен факт ложноотрицательной диагностики H. pylori после лечения омепразолом и с помощью дыхательного теста, для которого не требуется биопсия.
pylori к определенным значениям рН приводит к перераспределению H. pylori по слизистой оболочке: бактерии элиминируются из антрального отдела и в большем количестве обнаруживаются в теле желудка. Считается, что мощная антисекреторная терапия приводит и к уменьшению общего количества бактерий H. pylori. Таким образом, если проводить исследование на H. pylori во время или сразу после курса терапии ингибиторами протонной помпы не исключен ложноотрицательный результат, особенно если ограничиться биоптатами из антрального отдела [4]. Известен факт ложноотрицательной диагностики H. pylori после лечения омепразолом и с помощью дыхательного теста, для которого не требуется биопсия.
Таблица 7. Терапия на основе ранитидин-висмут-цитрата
|
Ранитидин-висмут-цитрат |
Ранитидин-висмут-цитрат |
Ранитидин-висмут-цитрат |
|
+ |
+ |
+ |
|
тетрациклин |
кларитромицин |
Кларитромицин |
|
+ |
+ |
|
|
Метронидазол |
метронидазол |
|
|
14 дней |
14 дней |
7 дней |
Таблица 8. Принципы терапии инфекции H. pylori
Принципы терапии инфекции H. pylori
| • Использование многокомпонентных схем лечения – тройная терапия – квадротерапия • Строгое соблюдение выбранной схемы лечения – определенные лекарственные препараты – определенные дозы – определенная продолжительность терапии • Учет синергизма лекарственных препаратов |
Поэтому контроль успешности проведения антибактериального лечения требует особого подхода. Правила диагностики эрадикации по «Рекомендациям» следующие:
1. Диагностика эрадикации должна осуществляться не ранее 4 – 6 недель после окончания курса антихеликобактерной терапии, либо лечения любыми антибиотиками или антисекреторными средствами сопутствующих заболеваний.
2. Диагностика эрадикации осуществляется, как минимум, двумя из указанных диагностических методов, причем при использовании методов непосредственного обнаружения бактерии в биоптате слизистой оболочки желудка (бактериологический, морфологический, уреазный) необходимо исследование 2 биоптатов из тела желудка и 1 биоптата из антрального отдела.
Диагностика эрадикации осуществляется, как минимум, двумя из указанных диагностических методов, причем при использовании методов непосредственного обнаружения бактерии в биоптате слизистой оболочки желудка (бактериологический, морфологический, уреазный) необходимо исследование 2 биоптатов из тела желудка и 1 биоптата из антрального отдела.
3. Цитологический метод для установления эрадикации неприменим.
Особое место в диагностике инфекции H. pylori имеют иммуноферментный анализ и экспресс-тесты на основе иммунопреципитации, которые позволяют обнаруживать в сыворотке крови или в капиллярной крови пациентов антитела к H. pylori. Эти методы могут быть использованы в качестве скрининговых или в случае установленной болезни для первичной диагностики инфекции H. pylori. Понятно, что для обнаружения H. pylori после лечения серологические методы неприменимы, так как даже после эрадикации бактерии антихеликобактерные антитела продолжают циркулировать в крови.
«Рекомендации по диагностике и лечению инфекции Helicobacter pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки» устанавливают в качестве показания к эрадикационному лечению только язвенную болезнь как в стадии обострения, так и в стадии ремиссии. Значение H. pylori в патологии человека значительно шире, хотя результаты эрадикационной терапии действительно лучше изучены при этом заболевании. Маастрихтские рекомендации охватывают гораздо более широкий круг показаний для антихеликобактерного лечения, причем указывают степень важности проведения такого лечения и его научную обоснованность (табл. 2). Вероятно, по мере накопления новой информации показания к эрадикационной терапии в Российских рекомендациях будут расширены.
Значение H. pylori в патологии человека значительно шире, хотя результаты эрадикационной терапии действительно лучше изучены при этом заболевании. Маастрихтские рекомендации охватывают гораздо более широкий круг показаний для антихеликобактерного лечения, причем указывают степень важности проведения такого лечения и его научную обоснованность (табл. 2). Вероятно, по мере накопления новой информации показания к эрадикационной терапии в Российских рекомендациях будут расширены.
Особенности терапии инфекции H. pylori нашли свое отражение в определенных принципах лечения, которые сформулированы в «Рекомендациях» следующим образом:
Основой лечения является использование комбинированной (трехкомпонентной) терапии:
• способной уничтожать бактерию H. pylori, как минимум, в 80% случаев;
• не вызывающей вынужденной отмены терапии врачом, вследствие побочных эффектов (допустимо менее чем в 5% случаев) или прекращения пациентом приема лекарств по схеме, рекомендованной врачом;
• эффективной при продолжительности курса не более 7 – 14 дней.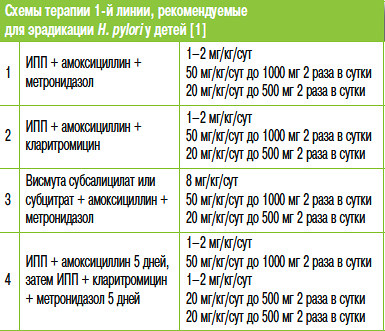
Действительно, наиболее эффективные схемы эрадикационной терапии являются трехкомпонентными. К сожалению, лечение с помощью двух лекарственных препаратов оказывается недостаточным для того, чтобы уничтожить H. pylori как минимум у 80% пролеченных пациентов. Давно не используется в клинической практике сочетание де-нола с метронидазолом, эрадикация с помощью такой схемы практически недостижима. Исследования 1995 – 1996 гг. показали, что сочетание омепразола с одним антибиотиком дает слишком большой разброс результатов эрадикации H. pylori. Так, двойная терапия омепразолом с амоксициллином результативна, по данным разных авторов, в 29 – 92% случаев. В среднем эффективность двойной терапии оценивается в пределах 50 – 70%. Эрадикация в контролируемых исследованиях наступает менее чем у 80% пролеченных, и двойной режим лечения не может быть рекомендован для практического здравоохранения. Таким образом, эрадикационные схемы стали трехкомпонентными и даже четырехкомпонентными.
Эрадикационная терапия – это терапия антибиотиками, поэтому естественными являются требования к безопасности и хорошей переносимости такого лечения. К сожалению, укороченный курс менее 7 дней, как правило, приводит к неудаче – эрадикация не наступает. Поэтому, если попытка эрадикационной терапии привела к побочным проявлениям, вынудившим прервать курс (например, аллергическая реакция), с уверенностью можно говорить о персистировании инфекции H. pylori.
К сожалению, укороченный курс менее 7 дней, как правило, приводит к неудаче – эрадикация не наступает. Поэтому, если попытка эрадикационной терапии привела к побочным проявлениям, вынудившим прервать курс (например, аллергическая реакция), с уверенностью можно говорить о персистировании инфекции H. pylori.
Рекомендуемые схемы для эрадикации H. pylori приведены в табл. 3, 5, 6, 7.
Схемы лечения на основе препаратов висмута, в первую очередь коллоидного субцитрата висмута, раньше всего стали использовать по поводу инфекции H. pylori. Препараты висмута в сочетании с тетрациклином и метронидазолом называют даже классической тройной терапией. Дело в том, что соли висмута обладают бактерицидными свойствами в отношении Н.pylori: разрушают бактериальную стенку, ингибируют ферменты бактерий (уреазу, каталазу, липазу/фосфолипазу), предотвращают адгезию Н. рylori к эпителиальным клеткам желудка. Для солей висмута определены минимальные концентрации, ингибирующие Н. рylori (MIC) (табл. 4).
4).
В настоящее время оптимальной считается схема тройной терапии с ингибитором протонной помпы (табл. 5). Благодаря своим особенностям ингибиторы протонного насоса являются незаменимыми в антихеликобактерном лечении. В начале 90-х годов рядом авторов было показано, что монотерапия омепразолом приводит к подавлению Н. pylori (при исследовании биоптатов антрального отдела сразу после курса антисекреторной терапии ингибитором протонного насоса бактерию часто не обнаруживали). Как уже было описано, использование омепразола приводит к перераспределению микроорганизма в слизистой оболочке желудка: их число в антральном отделе снижается, причем часто значительно, а в теле желудка возрастает. Механизм такого регулирующего влияния ингибиторов протонного насоса связан с мощным угнетением желудочной секреции. Синтез АТФ Н. pylori осуществляется благодаря наличию электрохимического градиента ионов водорода. Уреаза бактерии, разлагая мочевину с выделением ионов аммония, приводит к защелачиванию микроокружения бактерии, предохраняющего ее от действия соляной кислоты желудочного сока; в этих условиях синтез АТФ продолжается. Но применение ингибиторов протонного насоса приводит к повышению рН, а эффект уреазы – к суммарному повышению рН, до уровня, который несовместим с жизнедеятельностью микроорганизма. Таким образом, Н. pylori является толерантным к кислым значениям рН (благодаря уникальной уреазной активности), но неустойчивым к щелочной реакции среды «нейтрофилом». При использовании ингибиторов протонного насоса бактерии приходится переселяться в отделы желудка с более низкими значениями рН, т. е. в тело желудка из антрального отдела.
Но применение ингибиторов протонного насоса приводит к повышению рН, а эффект уреазы – к суммарному повышению рН, до уровня, который несовместим с жизнедеятельностью микроорганизма. Таким образом, Н. pylori является толерантным к кислым значениям рН (благодаря уникальной уреазной активности), но неустойчивым к щелочной реакции среды «нейтрофилом». При использовании ингибиторов протонного насоса бактерии приходится переселяться в отделы желудка с более низкими значениями рН, т. е. в тело желудка из антрального отдела.
Самые мощные из известных на сегодняшний день антисекреторных препаратов – ингибиторы протонной помпы – не только угнетают Н. pylori в антральном отделе, но и стимулируют защитные механизмы макроорганизма в отношении бактерии. Антитела к Н. pylori, секретируемые на поверхность слизистой оболочки желудка, быстро деградируют под влиянием протеолитических ферментов желудочного сока. Сдвиг рН в щелочную сторону при использовании блокаторов Н+, К+-АТФазы заметно снижает протеолитическую активность содержимого желудка и удлиняет период полужизни антител и их концентрацию. Функциональная активность нейтрофилов также зависит от pH и возрастает при его сдвиге в щелочную сторону. Ингибиторы протонного насоса обладают синергизмом с антибактериальными препаратами. Активность многих антибиотиков повышается при сдвиге значений рН из кислой среды в щелочную. Кроме того, уменьшение объема секрета повышает концентрацию антибактериальных препаратов в желудочном соке [4].
Функциональная активность нейтрофилов также зависит от pH и возрастает при его сдвиге в щелочную сторону. Ингибиторы протонного насоса обладают синергизмом с антибактериальными препаратами. Активность многих антибиотиков повышается при сдвиге значений рН из кислой среды в щелочную. Кроме того, уменьшение объема секрета повышает концентрацию антибактериальных препаратов в желудочном соке [4].
Однако антихеликобактерный эффект ингибиторов протонного насоса объясняется не только подавлением секреции. Эти препараты обладают специфической, присущей только этому классу препаратов способностью подавлять H. pylori in vitro и, вероятно, in vivo. Имеются данные, свидетельствующие о том, что они угнетают уреазу бактерии и одну из ее АТФаз. Подавление уреазной активности микроорганизма не так давно показано не только in vitro, но и в клинических экспериментах. Все производные бензимидазола – омепразол, пантопразол, лансопразол – приводят к одинаковому перераспределению бактерии в слизистой оболочке желудка и обладают сходным бактериостатическим эффектом (известны минимальные ингибирующие концентрации каждого из этих препаратов). Таким образом, антихеликобактерный эффект – это свойство ингибиторов протонного насоса как класса лекарственных препаратов.
Таким образом, антихеликобактерный эффект – это свойство ингибиторов протонного насоса как класса лекарственных препаратов.
Квадротерапию следует рассматривать как терапию резерва. Ее эффективность в отношении H. pylori оценивается как максимальная (табл. 6). Комбинацию четырех лекарственных препаратов целесобразно использовать как лечение «второй линии», после неудачи первого эрадикационного курса, или в особых случаях (например, при лечении MALTомы желудка.)
Новая формула – ранитидин-висмут-цитрат – представляет собой соединение, сочетающее лекарственную активность антисекреторного агента и бактерицидные особенности висмута. Эффект этого комбинированного препарата превосходит суммарные возможности сочетания блокатора Н2-рецепторов гистамина и соли висмута, за счет особого синергизма, присущего данной химической структуре. Особые свойства ранитидин-висмут-цитрата позволяют комбинировать его только с одним антибиотиком – кларитромицином, хотя по сути это сочетание уже трехкомпонентно (табл. 7).
7).
Значительно снижает успешность эрадикационной терапии развитие резистентности H. pylori к антибиотикам. Наиболее распространена устойчивость микроорганизма к метронидазолу, хотя описаны штаммы H. pylori, устойчивые к кларитромицину и амоксициллину. Резистентность, как правило, возникает вследствие бесконтрольного неграмотного назначения антибактериального агента. К сожалению, ситуация с метронидазолом в России может быть описана именно таким образом. По данным Л.В. Кудрявцевой, доложенным на III Российской гастроэнтерологической неделе (1997), первичная резистентность H. pylori к метронидазолу обнаруживается в 30% случаев, при повторном курсе метронидазола бактерия устойчива к нему практически в 100% случаев. Самой серьезной и наиболее частой ошибкой в назначении антибактериальных препаратов при язвенной болезни является использование метронидазола не в составе описанных схем, а в качестве дополнительного препарата вместе с блокаторами Н2-рецепторов гистамина, де-нолом или в качестве монотерапии.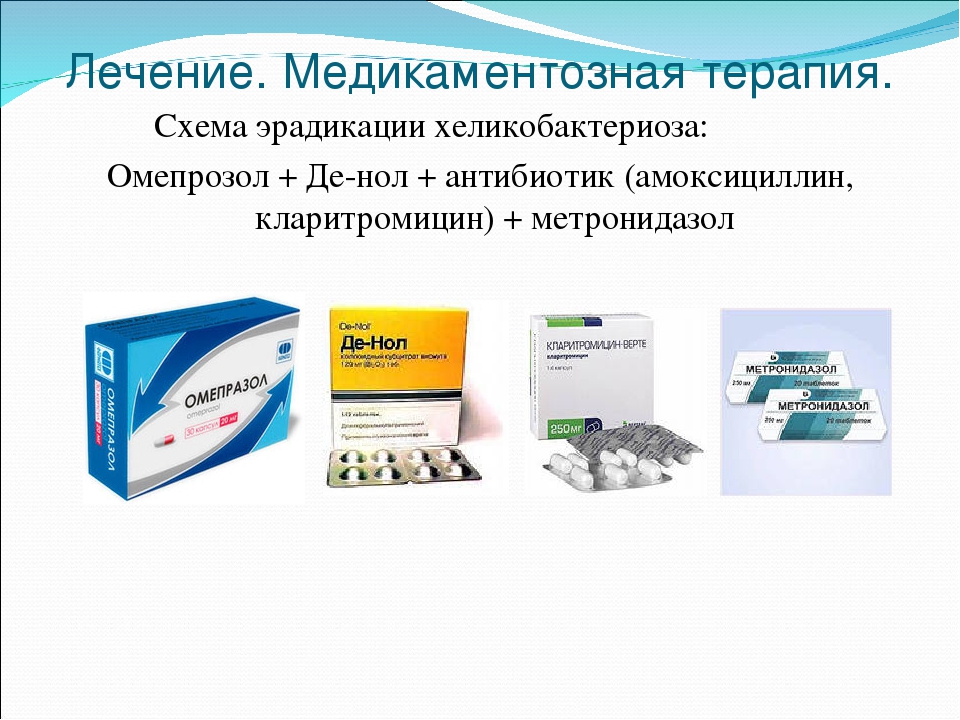
Репаративные свойства метронидазола, если они и есть, настолько слабы, что при использовании современных ингибиторов Н2-рецепторов гистамина или протонной помпы, приводящих к заживлению язвы за 2 нед, рассчитывать на них просто бессмысленно. А вот устойчивость H. pylori к метронидазолу в случае его необоснованного применения возникает неизбежно.
Именно в связи с проблемой резистентности в «Рекомендациях» выделены правила применения антихеликобактерной терапии:
1. Если использование схемы лечения не приводит к наступлению эрадикации, повторять ее не следует.
2. Если использованная схема не привела к эрадикации, это означает, что бактерия приобрела устойчивость к одному из компонентов схемы лечения (производным нитроимидазола, макролидам).
3. Если использование одной, а затем другой схемы лечения не приводит к эрадикации, то следует определять чувствительность штамма H. pylori ко всему спектру используемых антибиотиков.
4. Появление бактерии в организме больного спустя год после лечения следует расценивать как рецидив инфекции, а не реинфекцию*. При рецидиве инфекции необходимо применение более эффективной схемы лечения.
Распространенной ошибкой является уменьшение дозы антибактериальных препаратов или продолжительности лечения, произвольная замена компонентов схемы. Даже замена тетрациклина на доксициклин приводит к уменьшению эффективности лечения, замена кларитромицина на эритромицин практически сводит на нет усилия врача по эрадикации инфекции H. pylori. В большинстве случаев неадекватной является замена ингибиторов протонной помпы антагонистами Н2-рецепторов гистамина (табл. 8). К сожалению, встречается даже «поэтапное» назначение компонентов схемы: сначала неделя омепразола с метронидазолом, а затем неделя приема кларитромицина. Итог один – эрадикация не наступает, больной принимает антибиотики без всякого смысла, число резистентных штаммов H. pylori возрастает.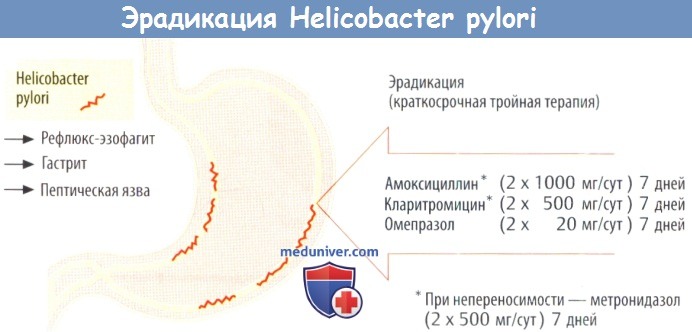
Таким образом, лишь строгое соблюдение отработанных схем терапии (вид лекарственных препаратов, их сочетание, дозы и продолжительность лечения) дает возможность добиться эрадикации H. pylori у большинства пациентов.
Литература:
1. NIH сonsensus development panel on Helicobacter pylori in peptic ulcer disease. JAMA 1994; 272:65–9.
2. Current European concepts in the management of Helicobacter pylori infection. The Maastricht Consensus Report. Gut 1997; 41(1):8–13.
3. Рекомендации по диагностике и лечению инфекции Helicobacter pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 1998; № 1.
4. Hunt R.H. The role of acid suppression in the treatment of H. pylori infection. In: Helicobacter pylori. Basic mechanisms to clinical cure. Ed. by R.H. Hunt, G.N.J. Tytgat. Kluwer academic publishers. Dordrecht, Boston, London, 1995; 584–93.
.
Базис и надстройка схем эрадикационной терапии Helicobacter pylori
Юрий Павлович Успенский, профессор, доктор медицинских наук:
– Уважаемые коллеги, следующая часть нашей гастроэнтерологической секции посвящена проблеме хеликобактериоза человека. И я с удовольствием хотел бы предоставить слово глубокоуважаемой Татьяне Львовне Лапиной с таким философичным докладом: «Базис и надстройка схем эрадикационной терапии Helicobacter pylori».
Татьяна Львовна Лапина, доцент, кандидат медицинских наук:
– Спасибо большое, Юрий Павлович. Итак, дорогие коллеги, действительно из старой философии взяты эти термины: «Базис и надстройка схем эрадикационной терапии пилорического хеликобактера». Если говорить о многообразии схем, которые применялись когда-либо и описаны в литературе для того, чтобы провести эрадикацию пилорического хеликобактера, то это многообразие схем невозможно описать. Это такое обилие различных лекарственных препаратов, самые разные комбинации, самая разная продолжительность, попытка давать двухступенчатые схемы и так далее. Но если обратиться к современным стандартным схемам, то по большому счету они известны наперечет. Вот те схемы, которые представлены в IV Маастрихтском консенсусе. В первую очередь, это стандартная тройная терапия с кларитромицином (ингибитор протонной помпы + кларитромицин + амоксициллин). Затем, конечно, нужно говорить о квадротерапии с препаратом висмута (ингибитор протонной помпы + препарат висмута + тетрациклин + метронидазол). Как резервная схема – тройная терапия с левофлоксацином (ингибитор протонной помпы + левофлоксацином + амоксициллин). И варианты применения широко известных антимикробных агентов для уничтожения пилорического хеликобактера – это кларитромицин + амоксициллин + метронидазол в составе последовательной и так называемой квадротерапии без препарата висмута, то есть сочетанной схемы эрадикации пилорического хеликобактера.
Это такое обилие различных лекарственных препаратов, самые разные комбинации, самая разная продолжительность, попытка давать двухступенчатые схемы и так далее. Но если обратиться к современным стандартным схемам, то по большому счету они известны наперечет. Вот те схемы, которые представлены в IV Маастрихтском консенсусе. В первую очередь, это стандартная тройная терапия с кларитромицином (ингибитор протонной помпы + кларитромицин + амоксициллин). Затем, конечно, нужно говорить о квадротерапии с препаратом висмута (ингибитор протонной помпы + препарат висмута + тетрациклин + метронидазол). Как резервная схема – тройная терапия с левофлоксацином (ингибитор протонной помпы + левофлоксацином + амоксициллин). И варианты применения широко известных антимикробных агентов для уничтожения пилорического хеликобактера – это кларитромицин + амоксициллин + метронидазол в составе последовательной и так называемой квадротерапии без препарата висмута, то есть сочетанной схемы эрадикации пилорического хеликобактера.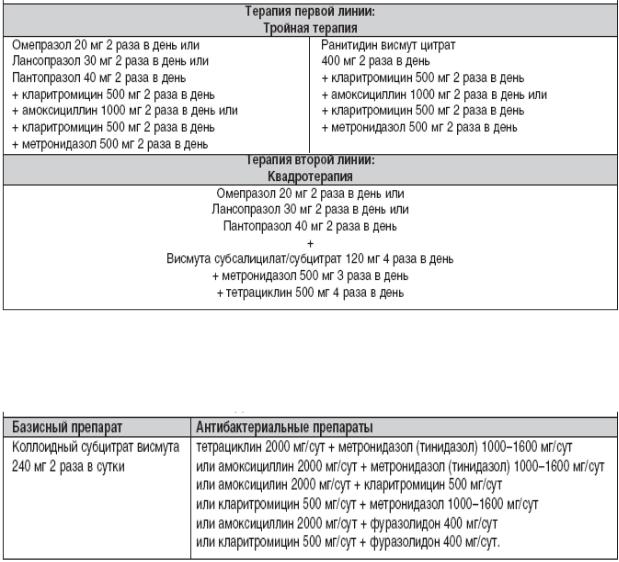
Российская Гастроэнтерологическая Ассоциация в своих рекомендациях по диагностике и лечению инфекции пилорического хеликобактера постаралась очень четко для практикующих врачей обозначить порядок обращения к этим схемам лечения. В качестве первой линии мы можем выбрать стандартную тройную терапию или квадротерапию. В случае неудачи терапии первой линии мы можем обратиться к квадротерапии с препаратом висмута. А в случае неудачи этой схемы лечения мы можем обратиться к резервному антибиотику в составе тройной терапии с «Левофлоксацином».
Так вот, вроде бы мы занимаемся лечением микробного агента. Может быть, главное в схеме эрадикационной терапии, базис – это антибактериальные препараты. Вы знаете, я бы все-таки говорила о том, что главное в схеме эрадикационной терапии, базис – это ингибиторы протонной помпы. Обратите внимание, при перечислении всех схем на первое место установлены препараты из группы ингибиторов протонной помпы. Почему ингибиторы протонной помпы имеют такое принципиальное значение для эрадикационной терапии? Все дело в том, что мы очень хорошо можем предсказать эффективность ингибиторов протонной помпы. Если обратиться к вот этой классической схеме необходимого поддержания уровня интрагастрального pH для лечения кислотозависимых заболеваний, то мы здесь видим полученный pH >3 для успешного заживления дуоденальной язвы. Напомню, это классическая работа – мета-анализ Борже. (00:04:24) Мы видим здесь пороговое значение – надо выдерживать pH>4 энтерогастрально в течение длительного достаточно периода времени, в течение суток, для того, чтобы успешно заживить эрозии при эрозивном эзофагите. Это работа Белла – тоже классический мета-анализ. Но вот самое интересное, что нас больше всего интересует сегодня, почему, собственно, мы говорим об ингибиторах протонной помпы как о базисе в схемах эрадикационной терапии – это поддержание энтерогастрального pH>5. Для того, чтобы успешно прошла эрадикация пилорического хеликобактера, для действия кислотосупрессивных препаратов установлены самые жесткие значения поддержания энтерогастрального pH. Почему?
Если обратиться к вот этой классической схеме необходимого поддержания уровня интрагастрального pH для лечения кислотозависимых заболеваний, то мы здесь видим полученный pH >3 для успешного заживления дуоденальной язвы. Напомню, это классическая работа – мета-анализ Борже. (00:04:24) Мы видим здесь пороговое значение – надо выдерживать pH>4 энтерогастрально в течение длительного достаточно периода времени, в течение суток, для того, чтобы успешно заживить эрозии при эрозивном эзофагите. Это работа Белла – тоже классический мета-анализ. Но вот самое интересное, что нас больше всего интересует сегодня, почему, собственно, мы говорим об ингибиторах протонной помпы как о базисе в схемах эрадикационной терапии – это поддержание энтерогастрального pH>5. Для того, чтобы успешно прошла эрадикация пилорического хеликобактера, для действия кислотосупрессивных препаратов установлены самые жесткие значения поддержания энтерогастрального pH. Почему?
Вернемся к классическим представлениям о пилорическом хеликобактере (Helicobacter pylori). Любая бактерия продуцирует АТФ (ATP) с помощью так называемой протон-движущей силы, то есть электрохимического градиента ионов водорода. Вот редукс-помпа (на схеме это окислительно-восстановительный насос) создает отрицательный заряд электрохимического градиента внутри клетки, что, собственно, и используется для образования АТФ (ATP). Таким образом, клетка бактериальная функционирует нормально. Подсчитано, что если пилорический хеликобактер (Helicobacter pylori) находится в среде с pH-7, то внутренняя среда бактерии имеет pH – 8 и 4. То есть градиент pH составляет 1,4 и в электрическом выражении он равен 90 милливольтам. Это очень удобное хорошее состояние для пилорического хеликобактера (Helicobacter pylori), нормальная жизнедеятельность его. Но мы понимаем, что хеликобактер живет в кислой среде желудка. Насколько она кислая под слоем слизи на поверхности эпителиальных клеток, конечно, сказать сложно, но если pH в желудке где-то порядка, например, 2-х, то может быть, в пристеночном слое слизи pH составляет порядка 4-х.
Любая бактерия продуцирует АТФ (ATP) с помощью так называемой протон-движущей силы, то есть электрохимического градиента ионов водорода. Вот редукс-помпа (на схеме это окислительно-восстановительный насос) создает отрицательный заряд электрохимического градиента внутри клетки, что, собственно, и используется для образования АТФ (ATP). Таким образом, клетка бактериальная функционирует нормально. Подсчитано, что если пилорический хеликобактер (Helicobacter pylori) находится в среде с pH-7, то внутренняя среда бактерии имеет pH – 8 и 4. То есть градиент pH составляет 1,4 и в электрическом выражении он равен 90 милливольтам. Это очень удобное хорошее состояние для пилорического хеликобактера (Helicobacter pylori), нормальная жизнедеятельность его. Но мы понимаем, что хеликобактер живет в кислой среде желудка. Насколько она кислая под слоем слизи на поверхности эпителиальных клеток, конечно, сказать сложно, но если pH в желудке где-то порядка, например, 2-х, то может быть, в пристеночном слое слизи pH составляет порядка 4-х.
Что позволяет хеликобактеру активно выживать? Фермент уреаза, который разлагает мочевину с образованием ионов аммония. Ионы аммония по сути дела предохраняют вот этот самый электрохимический градиент ионов водорода. Совершенно другая ситуация складывается, когда мы назначаем пациенту ингибиторы протонной помпы, и мы искусственно приводим к желаемым значениям pH энтерогастральным для того, чтобы у нас успешно рубцевалась дуоденальная язва, заживали эрозии при гастроэзофагеальной рефлюксной болезни или проходила эрадикация пилорического хеликобактера. Все дело в том, что пилорический хеликобактер плохо выдерживает защелачивание внешних условий среды. И это, в общем-то, очень хорошо знает любой практикующий врач, потому что он понимает, что ели он назначит даже два очень хороших антибиотика, то эрадикация, скорее всего, не получится.
Позвольте представить вам очень старое классическое исследование. Мы видим здесь две группы столбиков. Первые столбики показывают нам процент эрадикации при назначении любимых наших антибиотиков «Амоксициллина» и «Кларитромицина», но только желтый столбик без ингибиторов протонной помпы. Посмотрите, пожалуйста – никакой эрадикации, по сути дела, не наступает. А вот если мы даем три препарата на основе ингибиторов протонной помпы, то разница в проценте эрадикации просто колоссальная.
Посмотрите, пожалуйста – никакой эрадикации, по сути дела, не наступает. А вот если мы даем три препарата на основе ингибиторов протонной помпы, то разница в проценте эрадикации просто колоссальная.
То же самое касается других вариантов стандартной тройной терапии: «Кларитромицин», «Метронидазол». Мы видим, что если мы даем пациенту только «Кларитромицин» с «Метронидазолом» без ингибитора протонной помпы, то существует очень большой прирост в эффективной эрадикации, который дает нам ингибитор протонной помпы. И, естественно, если мы назначаем мототерапию с ингибитором протонной помпы, то пилорический хеликобактер пытается как-то сохранить свою стандартную хорошую жизнедеятельность. Например, в основном существовал он в антральном отделе, там, где ему было относительно кислотно и практически не очень щелочно. А когда мы назначаем ингибиторы протонной помпы, происходит транслокация пилорического хеликобактера в тело желудка. Там, где расположены железы желудка, там, где среда будет покислее и на фоне ингибиторов протонной помпы приближается к более желанным условиям pH. Для того, чтобы не допустить увеличения плацдарма хронического гастрита, в качестве одного из положения IV Маастрихтского консенсуса рекомендуется проводить эрадикационную терапию тем пациентам, которым планируется длительное лечение ингибиторами протонной помпы. Для чего? Для того, чтобы вылечить гастрит, для того, чтобы у них не было пилорического хеликобактера, для того, чтобы не допустить изменений транслокаций пилорического хеликобактера по поверхности желудка.
Для того, чтобы не допустить увеличения плацдарма хронического гастрита, в качестве одного из положения IV Маастрихтского консенсуса рекомендуется проводить эрадикационную терапию тем пациентам, которым планируется длительное лечение ингибиторами протонной помпы. Для чего? Для того, чтобы вылечить гастрит, для того, чтобы у них не было пилорического хеликобактера, для того, чтобы не допустить изменений транслокаций пилорического хеликобактера по поверхности желудка.
Итак, ингибиторы протонной помпы – действительно основа схем эрадикационной терапии, и они тем лучше работают, тем лучше они могут поддерживать энтерогастральный pH>5. Почему? Потому что именно в таких условиях пилорический хеликобактер становится особо чувствительным для действия тех антибиотиков, которые составляют надстройку схемы эрадикационной терапии. В основном мы сегодня будем в качестве примера базиса схемы эрадикационной терапии оперировать препаратом «Рабепразол». С удовольствием обращаю ваше внимание на график биоэквивалентности «Рабепразола» производства компании КРКА оригинальному препарату.
Итак, что является базисом для назначения схемы эрадикационной терапии? Конечно, способность ингибиторов протонной помпы поддерживать энтерогастральный pH в заданных пределах в течение заданного периода времени. И если мы посмотрим недавний мета-анализ, то действительно ингибиторы протонной помпы последнего поколения, в том числе «Рабепразол», с точки зрения процента среднего времени pH>4 при курсовом приеме стандартной дозы, показывают, конечно, очень и очень хороший результат.
Вернемся к схемам эрадикационной терапии. В качестве схемы первой линии лечения принята стандартная тройная схема эрадикационной терапии: ингибитор протонной помпы (ИПП) в стандартной дозе два раза в день, «Кларитромицин» (КЛА) 500 миллиграмм два раза в суки, «Амоксициллин» (АМО) 1000 миллиграмм два раза в сутки.
Возможно выбрать квадротерапию с препаратом висмута в определенных клинических ситуациях. Например, нам очень важно дать схему с максимально высокой эффективностью, например, в случае MALT-лимфомы желудка, когда мы планируем эрадикацию пилорического хеликобактера для того, чтобы достичь гистологической ремиссии опухоли. Это, конечно, комбинация ингибитора протонной помпы в стандартной дозе два раза в сутки, «Висмута трикалия дицитрата» (ВТД) 120 миллиграмм четыре раза в сутки, «Тетрациклина» (ТЕТ) и «Метронидазола» (МЕТ).
Это, конечно, комбинация ингибитора протонной помпы в стандартной дозе два раза в сутки, «Висмута трикалия дицитрата» (ВТД) 120 миллиграмм четыре раза в сутки, «Тетрациклина» (ТЕТ) и «Метронидазола» (МЕТ).
В качестве схемы, которую могут назначать гастроэнтерологи в спорных, сложных случаях Российская Гастроэнтерологическая Ассоциация рекомендует использование схемы с «Левофлоксацином». Еще раз повторюсь, конечно, это не назначение врача первичного звена здравоохранения, это все-таки назначение, которое должен делать гастроэнтеролог. Есть ли в России данные по последовательной терапии? К сожалению, не очень много данных, хотя есть единичные работы, которые говорят о том, что можно применять эту схему. Опять же, вот эта последовательная терапия достаточно сложная, которая стоит из двух этапов назначения препаратов для эрадикации пилорического хеликобактера, скорее, входит в арсенал гастроэнтеролога, чем врача первичного звена здравоохранения. Давайте посмотрим, как работает стандартная тройная терапия на основе «Рабепразола». Посмотрите, пожалуйста, доза «Рабепразола» здесь достаточно маленькая, 10 миллиграмм два раза в сутки. И, несмотря на то, что это азиатская популяция, в которой всегда сложно добиться успешной эрадикации пилорического хеликобактера, все-таки в реальной клинической практике процент эрадикации превышает 80.
Посмотрите, пожалуйста, доза «Рабепразола» здесь достаточно маленькая, 10 миллиграмм два раза в сутки. И, несмотря на то, что это азиатская популяция, в которой всегда сложно добиться успешной эрадикации пилорического хеликобактера, все-таки в реальной клинической практике процент эрадикации превышает 80.
Можно ли увеличить эффективность стандартной тройной терапии? Можно, причем работая как с базисом схемы, так и с надстройкой схемы. Например, мы можем добавить к стандартной тройной терапии препарат висмута. Я думаю, что это очень удачное дополнение к надстройке схемы. Мы можем увеличить дозу ингибитора протонной помпы, и этот дополнительный антикислотный эффект скажется на приросте эрадикации инфекции пилорического хеликобактера. Мы можем увеличить продолжительность стандартной тройной терпи. Сложно, конечно, сказать, что любой из нас получит вот такой замечательный прирост в проценте эрадикации, в зависимости от того, 7, 10 или 14 дней мы назначаем стандартную тройную терапию. Но все-таки современная тенденция, конечно, говорит о том, что чем дольше мы проводим эрадикационную терапию в рамках обозначенных сроков, тем выше процент эрадикации.
Но все-таки современная тенденция, конечно, говорит о том, что чем дольше мы проводим эрадикационную терапию в рамках обозначенных сроков, тем выше процент эрадикации.
И, конечно, хочется обратить внимание еще раз на базисные препараты в схемах эрадикационной терапии. Посмотрите, пожалуйста, 35 исследований, практически 6 тысяч больных. Мета-анализ, который изучал: есть ли преимущества более современных ингибиторов протонной помпы, «Рабепразола» и «Эзомепразола», по сравнению с более старыми, более классическими ингибиторами протонной помпы. И, видите, здесь число больных, которых необходимо пролечить – 23. Действительно есть данные о том, что схемы на основе «Рабепразола» обладают большей эффективностью. Что мне хочется показать? Мне хочется показать этот мета-анализ с точки зрения разных дозировок ингибиторов протонной помпы. Посмотрите, пожалуйста: здесь 10 миллиграмм два раза в сутки «Рабепразол» использовался. А вот этот же мета-анализ – 20 миллиграмм два раза в сутки. И мы видим, что благодаря мощному, кислотоподавляющему эффекту «Рабепразола» здесь даже доза 10 миллиграмм два раза в сутки отлично действует для эрадикации пилорического хеликобактера.
И мы видим, что благодаря мощному, кислотоподавляющему эффекту «Рабепразола» здесь даже доза 10 миллиграмм два раза в сутки отлично действует для эрадикации пилорического хеликобактера.
Я должна сказать, что когда я увидела вот этот терракотовый барельеф Римской эпохи – вы видите Геракла с дубиной, он расправляется с лернейской гидрой – мне сразу показалось, что лернейская гидра кого-то мне сильно напоминает. Мне кажется, что аналогия с пилорическим хеликобактером здесь налицо. И очень приятно сказать в заключение моей лекции, что действительно у нас есть оружие для того, чтобы победить гидру пилорического хеликобактера – это схемы эрадикационной терапии инфекции пилорического хеликобактера. Только должны мы четко соблюдать стандарты ведения пациентов с инфекцией пилорического хеликобактера.
СХЕМЫ ЭРАДИКАЦИИ ШТАММОВ HELICOBACTER PYLORI, РЕЗИСТЕНТНЫХ К МЕТРОНИДАЗОЛУ У ДЕТЕЙ | Щербаков
1. Щербаков П.Л. Поражения верхних отделов пищеварительного тракта у детей (клинико-эндоскопические исследования). Автореф. дис…. докт. мед. наук. М. 1997. 34 с.
Щербаков П.Л. Поражения верхних отделов пищеварительного тракта у детей (клинико-эндоскопические исследования). Автореф. дис…. докт. мед. наук. М. 1997. 34 с.
2. Schwarz K. Ueber penetrierende Magen und Jejunalgeschwunde. Beitr. Klin. Chir. 1910; 67: 96-128.
3. Marshall B.J., Warren J.R. Unindencifield curved bacilli in the stomach of patient with gastritis and peptic ulceration. Lancet. 1984; 1: 1311.
4. Satoh K., Kimura K., Takimoto T., Kihira K. A follow up study of atrophic gastritis and intestinal metaplasia after eradication of Helicobacter pylori. Helicobacter. 1998; 3 (4): 236-240.
5. Eradication of Helicobacter pylori normalizes elevated mucosal levels of epidermal growth factor and its receptor. Am. J. Gastroenterol. 1999; 94 (10): 2885–2889.
Am. J. Gastroenterol. 1999; 94 (10): 2885–2889.
6. Ganga-Zandzou P.S., Michaud L., Vincent P. еt al. http://www3.infotrieve.com/medline/infotrieve/results.asp?search+simplesearch+view1+nmed98-99+25+0+wAAA+(‘Helicobacter’):TANatural outcome of Helicobacter pylori infection in asymptomatic children: a two-year follow up study. Pediatrics. 1999; 104 (2): 216–221.
7. Nawaz A., Mohammed I., Ahsan K. et al. Clostridium difficult colitis associated with treatment of Helicobacter pylori infection. Am. J. Gastroenterol. 1998; 93(7): 1175–1176.
8. Sёoderlin M.K., Alasaarela E.,; Hakala M. Reactive arthritis induced by Clostridium difficult enteritis as a complication of Helicobacter pylori eradication. Clin. Rheumatol. 1999; 18 (4): 337–338.
9. http://www3.infotrieve.com/medline/infotrieve/results.asp?search+simplesearch+view1+nmed98-99+25+0+wAAA+(‘Adamsson+I’):AUAdamsson I.., Nord C.E., Lundquist P. et al. Comparative effects of omeprazole, amoxycillin plus metronidazole versus omeprazole, clarithromycin plus metronidazole on the oral, gastric and intestinal microflora in Helicobacter pylori-infected patients. J. Antimicrob. Chemother. 1999; 44 (5): 629–640.
http://www3.infotrieve.com/medline/infotrieve/results.asp?search+simplesearch+view1+nmed98-99+25+0+wAAA+(‘Adamsson+I’):AUAdamsson I.., Nord C.E., Lundquist P. et al. Comparative effects of omeprazole, amoxycillin plus metronidazole versus omeprazole, clarithromycin plus metronidazole on the oral, gastric and intestinal microflora in Helicobacter pylori-infected patients. J. Antimicrob. Chemother. 1999; 44 (5): 629–640.
10. Mahony D.E., Lim-Morrison S., Bryden L. et al. Antimicrobial activities of synthetic bismuth compounds against Clostridium difficile. Antimicrob. Agents. Chemother. 1999; 43 (3): 582–588.
11. Лыкова Е.А., Сидоренко С.В., Бондаренко В.М. и др. Антибактериальная терапия и коррекция микроэкологических нарушений при хеликобактериозе у детей. Диагностика и лечение. 1996; 12: 75–77.
12. Мазурин А.В. Болезни органов пищеварения. М.: Медицина. 1984. С. 254–333.
Мазурин А.В. Болезни органов пищеварения. М.: Медицина. 1984. С. 254–333.
13. Аруин Л.И., Григорьев П.Я., Исаков В.А., Яковенко Э.П. Хронический гастрит. Амстердам. 1993. 362 с.
14. Zala G., Wirth H.P., Bauer S. et al. Eradication of metronidazole-resistant Helicobacter pylori: is omeprazole/amoxicillin a therapeutic alternative? Schweiz. Med. Wochenschr. 1994; 124 (31–32): 1385–1390.
15. Sieber C.C.; Frei R.; Beglinger C. et al. Helicobacter pylori resistance against metronidazole in Switzerland: implications for eradication therapy? Schweiz. Med. Wochenschr. 1994; 124 (31–32): 1381–1384.
16. Hudson N., Brydon W.G., Eastwood M.A. et al. Successful Helicobacter pylori eradication incorporating a one week antibiotic regimen. Aliment. Pharmacol. Ther. 1995; 9 (1): 47.
Aliment. Pharmacol. Ther. 1995; 9 (1): 47.
17. Holton J., Vaira D., Menegatti M. The susceptibility of Helicobacter pylori to the rifamycin, rifaximin. Antimicrob. Chemother. 1995; 35 (4): 545–549.
Современные методы диагностики и лечения инфекции Helicobacter pylori. 104-я Международная осенняя сессия Национальной школы гастроэнтерологии, гепатологии РГА. Сателлитный симпозиум компании «Янссен»
Последние годы во всем мире наблюдается тенденция к снижению эффективности эрадикационной терапии, что обусловлено возрастающей резистентностью микроорганизмов к антибактериальным препаратам. В рамках 104-й Международной осенней сессии Национальной школы гастроэнтерологии, гепатологии Российской гастроэнтерологической ассоциации были затронуты проблемы эпидемиологии, диагностики и лечения инфекции Helicobacter pylori. Ведущие российские специалисты-гастроэнтерологи проанализировали современные методы эрадикационной терапии H. pylori, подчеркнув необходимость включения в нее ингибитора протонной помпы рабепразола, как фактора повышения эффективности подобной терапии.
pylori, подчеркнув необходимость включения в нее ингибитора протонной помпы рабепразола, как фактора повышения эффективности подобной терапии.
Профессор, д.м.н. А.С. Трухманов
Профессор, д.м.н. И.В. Маев
К.м.н. Т.Л. Лапина
Профессор, д.м.н. В.И. Симаненков
К.м.н. Е.В. Ледин
Перспективы эрадикационной терапии. Место муцининдуцирующих препаратов и пробиотиков в лечении пациентов с инфекцией Helicobacter pylori
Доктор медицинских наук, профессор кафедры пропедевтики внутренних болезней лечебного факультета Первого Московского государственного медицинского университета (МГМУ) им. И.М. Сеченова, секретарь профильной комиссии Минздрава России по специальности «гастроэнтерология», главный ученый секретарь Российской гастроэнтерологической ассоциации (РГА) Александр Сергеевич ТРУХМАНОВ в начале выступления отметил, что наблюдаемое сегодня снижение уровня инфицированности Helicobacter pylori в ряде стран обусловлено улучшением социально-экономических и гигиенических условий. В то же время в некоторых странах, в том числе России, уровень инфекции Н. pylori остается высоким. В связи с этим актуальной задачей российских специалистов являются снижение распространенности, совершенствование методов профилактики и повышение эффективности эрадикации Н. pylori.
В то же время в некоторых странах, в том числе России, уровень инфекции Н. pylori остается высоким. В связи с этим актуальной задачей российских специалистов являются снижение распространенности, совершенствование методов профилактики и повышение эффективности эрадикации Н. pylori.
Антибиотикорезистентность – основная причина неэффективности эрадикации Н. pylori. Согласно результатам российских исследований, средний уровень резистентности 650 штаммов Н. pylori, собранных в разных регионах России за последние десять лет, составил 8,3% к кларитромицину, 35,8% – к метронидазолу. Это говорит о том, что в большинстве регионов России уровень резистентности к кларитромицину и метронидазолу низкий1.
Исходя из положений 5-го Маастрихтского соглашения, стандартную тройную эрадикационную схему, включающую кларитромицин, не следует назначать без определения чувствительности к данному препарату, если частота устойчивости к нему в регионе превышает 15%. В районах с высокой двойной резистентностью к кларитромицину и метронидазолу предпочтительна квадротерапия с препаратами висмута. У пациентов с аллергией к препаратам пенициллинового ряда в регионах с низкой устойчивостью Н. pylori к кларитромицину в качестве первой линии показана комбинация ингибиторов протонной помпы (ИПП) с кларитромицином и метронидазолом, в регионах с высокой устойчивостью к кларитромицину – квадротерапия с препаратами висмута2.
В районах с высокой двойной резистентностью к кларитромицину и метронидазолу предпочтительна квадротерапия с препаратами висмута. У пациентов с аллергией к препаратам пенициллинового ряда в регионах с низкой устойчивостью Н. pylori к кларитромицину в качестве первой линии показана комбинация ингибиторов протонной помпы (ИПП) с кларитромицином и метронидазолом, в регионах с высокой устойчивостью к кларитромицину – квадротерапия с препаратами висмута2.
По мнению экспертов, увеличение дозы ИПП повышает эффективность тройной терапии. В странах с высокой частотой быстрых метаболизаторов ИПП (Европа и Северная Америка) предпочтительно назначение эзомепразола и рабепразола. Добавление к стандартной терапии препаратов висмута повышает частоту эрадикации у больных, резистентных к кларитромицину. Известно, что препараты висмута нарушают обменные процессы внутри бактерии за счет альтерации метаболизма железа и никеля. Нарушение обменных процессов приводит к снижению синтеза аденозинтрифосфата (АТФ), белка и компонентов мембраны Н. pylori. Как следствие, уменьшаются подвижность и адгезивные свойства Н. pylori.
pylori. Как следствие, уменьшаются подвижность и адгезивные свойства Н. pylori.
Доказано, что одним из основных факторов защиты слизистой оболочки желудка являются муцины. Это гликопротеины со специфическим аминокислотным составом, образующие защитный слой, предохраняющий эпителий желудка от повреждающего воздействия адгезивных факторов, в том числе препятствующий колонизации Н. pylori.
Муцины – основные компоненты слизи желудка, определяющие ее физико-химические свойства и обеспечивающие барьерные функции. Современные гистохимические методики позволили выделить несколько типов муцинов в слизистой оболочке желудка: MUC1 (мембраносвязанный муцин), MUC5AC и MUC6 (секретируемые муцины). MUC5AC экспрессируется преимущественно в поверхностном эпителии, а MUC6 – в желудочных железах. MUC5АС, препятствуя адгезии Н. pylori, защищает поверхностный эпителий желудка, а MUC6 характеризуется антибактериальной активностью.
Результаты метаанализа 11 исследований продемонстрировали взаимосвязь между Н. pylori и экспрессией секретируемых муцинов MUC5АС и MUC6. У Н. pylori-позитивных пациентов экспрессия муцина MUC6 была выше, чем у Н. pylori-негативных (отношение шансов (ОШ) 9,2; 95%-ный доверительный интервал (ДИ) 1,5–54,5; р = 0,014)3. В то же время экспрессия MUC5AC у Н. pylori-позитивных пациентов была достоверно ниже (ОШ 0,44; 95% ДИ 0,21–0,95; р = 0,036). Исследователи пришли к выводу, что Н. pylori играет ингибирующую роль в отношении экспрессии MUC5AC в эпителии желудка, что облегчает его колонизацию. Вместе с тем увеличение экспрессии MUC6 может способствовать подавлению колонизации Н. pylori за счет антибактериальных свойств данного муцина.
pylori и экспрессией секретируемых муцинов MUC5АС и MUC6. У Н. pylori-позитивных пациентов экспрессия муцина MUC6 была выше, чем у Н. pylori-негативных (отношение шансов (ОШ) 9,2; 95%-ный доверительный интервал (ДИ) 1,5–54,5; р = 0,014)3. В то же время экспрессия MUC5AC у Н. pylori-позитивных пациентов была достоверно ниже (ОШ 0,44; 95% ДИ 0,21–0,95; р = 0,036). Исследователи пришли к выводу, что Н. pylori играет ингибирующую роль в отношении экспрессии MUC5AC в эпителии желудка, что облегчает его колонизацию. Вместе с тем увеличение экспрессии MUC6 может способствовать подавлению колонизации Н. pylori за счет антибактериальных свойств данного муцина.
Таким образом, влияние на экспрессию указанных муцинов может повышать эффективность эрадикационной терапии3.
Применение у больных, инфицированных Н. pylori, препаратов с гастропротективными свойствами, стимулирующими секрецию муцинов, значительно повышает клиническую эффективность терапии. Так, введение оригинального рабепразола (Париет®) в схемы эрадикационной терапии способствует повышению концентрации и скорости секреции муцинов в желудочной слизи. Кроме того, Париет® обладает выраженной прямой антихеликобактерной активностью4, 5.
Так, введение оригинального рабепразола (Париет®) в схемы эрадикационной терапии способствует повышению концентрации и скорости секреции муцинов в желудочной слизи. Кроме того, Париет® обладает выраженной прямой антихеликобактерной активностью4, 5.
Профессор А.С. Трухманов коснулся темы пробиотиков, применяемых у больных с инфекцией Н. pylori. Адъювантная терапия с включением пробиотиков в стандартные схемы антихеликобактерной терапии сегодня признана многообещающим направлением оптимизации протоколов лечения. В ходе исследований показано, что добавление Saccharomyces boulardii, Bifidobacterium lactis и Bifidobacterium bifidum к стандартным схемам увеличивает эффективность эрадикации, уменьшает колонизацию слизистой оболочки желудка Н. pylori и частоту побочных эффектов, связанных с антихеликобактерной терапией6.
Механизмы антихеликобактерного действия пробиотиков подразделяют на иммунологические и неиммунологические. Иммунологическим механизмом считают модулирование иммунного ответа макроорганизма, в том числе ингибирование высвобождения интерлейкина 8 в ответ на инвазию Н. pylori. Неиммунологические механизмы – выработка веществ, ингибирующих процессы метаболизма Н. pylori, конкуренция с Н. pylori за питательные вещества, подавление адгезивных свойств Н. pylori7.
Иммунологическим механизмом считают модулирование иммунного ответа макроорганизма, в том числе ингибирование высвобождения интерлейкина 8 в ответ на инвазию Н. pylori. Неиммунологические механизмы – выработка веществ, ингибирующих процессы метаболизма Н. pylori, конкуренция с Н. pylori за питательные вещества, подавление адгезивных свойств Н. pylori7.
Важнейшим свойством пробиотиков является их способность влиять на секрецию муцинов. Стимуляция секреции слизи препятствует адгезии патогенов. Так, штамм Lactobacillus plantarum увеличивает экспрессию гена MUC2, а L. rhamnosus стимулирует экспрессию MUC3-гена с последующей внеклеточной секрецией муцина клеточными культурами. Таким образом, на фоне применения пробиотиков полная элиминация Н. pylori не достигается, но повышается эффективность эрадикации и снижается риск развития побочных эффектов при проведении хеликобактерной терапии. Ряд пробиотических штаммов, увеличивая продукцию муцина, защищает слизистую оболочку желудка от адгезии Н. pylori.
pylori.
В заключение профессор А.С. Трухманов отметил, что, назначая эрадикационную терапию, необходимо учитывать резистентность Н. pylori к антибактериальным препаратам в конкретном регионе. Для оптимизации стандартной эрадикационной терапии можно использовать либо двойную дозу ИПП, либо более эффективные препараты данной группы.
Добавление препарата висмута трикалия дицитрата к стандартной схеме эрадикации способствует повышению ее эффективности.
Существует ли проблема резистентности Н. pylori в России?
Профессор, член-корреспондент РАН, проректор по учебной работе, заведующий кафедрой пропедевтики внутренних болезней и гастроэнтерологии лечебного факультета Московского государственного медико-стоматологического университета им. А.И. Евдокимова, д.м.н., директор Департамента медицинского образования и кадровой политики в здравоохранении Минздрава России, вице-президент РГА Игорь Вениаминович МАЕВ проанализировал современные данные о распространенности резистентности Н. pylori в России. На сегодняшний день наличие Н. pylori считается важнейшим этиопатогенетическим фактором развития хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки, MALT-лимфомы, а также аденокарциномы желудка. Исходя из эпидемиологических данных, свыше 50% населения земного шара (примерно 3 млрд человек) инфицировано данным микроорганизмом. При этом в развитых странах ежегодно Н. pylori инфицируются около 0,3–0,7% населения, в развивающихся – 6–14%8.
pylori в России. На сегодняшний день наличие Н. pylori считается важнейшим этиопатогенетическим фактором развития хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки, MALT-лимфомы, а также аденокарциномы желудка. Исходя из эпидемиологических данных, свыше 50% населения земного шара (примерно 3 млрд человек) инфицировано данным микроорганизмом. При этом в развитых странах ежегодно Н. pylori инфицируются около 0,3–0,7% населения, в развивающихся – 6–14%8.
В нашей стране распространенность инфекции Н. pylori составляет около 60–95%9. Однако информация о распространенности Н. pylori на федеральном уровне отсутствует. Распространению инфекции способствуют факторы риска, такие как низкий социально-экономический статус, неблагоприятные социально-гигиенические условия. Высокий уровень заболеваемости инфекцией Н. pylori диктует необходимость применения эффективных схем эрадикации. Однако на эффективность эрадикационных схем негативно влияет резистентность Н. pylori к антибактериальным средствам. Глобальное снижение эффективности тройной терапии – ИПП, кларитромицина, амоксициллина требует поиска новых резервных схем для лечения инфекции Н. pylori.
pylori к антибактериальным средствам. Глобальное снижение эффективности тройной терапии – ИПП, кларитромицина, амоксициллина требует поиска новых резервных схем для лечения инфекции Н. pylori.
В случае резистентности к кларитромицину эффективность классической тройной схемы эрадикационной терапии уменьшается более чем на 65%10.
В основе формирования молекулярно-генетических механизмов резистентности лежат преимущественно точечные мутации, обусловливающие альтерацию механизмов действия антибиотиков. Исследования механизмов резистентности Н. pylori к кларитромицину выявили наличие точечных хромосомных мутаций в регионе, кодирующем пептидилтрансферазу (основную мишень макролидов) в домене V 23S рРНК. Наиболее часто встречающимися вариациями таких мутаций являются A2142G/C и A2143G11.
Систематический обзор исследований (2009–2014 гг.) распространенности резистентности Н. pylori к антибактериальным препаратам в разных регионах мира продемонстрировал, что в Европе и Северной Америке резистентных к кларитромицину штаммов намного больше. Высокая резистентность к метронидазолу наблюдается в Африке, Азии, тенденция к росту – в Южной и Северной Америке. Показатели распространенности резистентных к амоксициллину штаммов во всех регионах, кроме Африки и Азии, достаточно низкие. Уровень резистентности Н. pylori к тетрациклину в мире также низкий. В странах Африки резистентные штаммы встречаются значительно чаще, чем в Европе и странах Северной и Южной Америки. Постепенно в мире возрастает резистентность Н. pylori к левофлоксацину.
Высокая резистентность к метронидазолу наблюдается в Африке, Азии, тенденция к росту – в Южной и Северной Америке. Показатели распространенности резистентных к амоксициллину штаммов во всех регионах, кроме Африки и Азии, достаточно низкие. Уровень резистентности Н. pylori к тетрациклину в мире также низкий. В странах Африки резистентные штаммы встречаются значительно чаще, чем в Европе и странах Северной и Южной Америки. Постепенно в мире возрастает резистентность Н. pylori к левофлоксацину.
В Российской Федерации показатели резистентности Н. pylori к кларитромицину умеренные и варьируются в зависимости от региона (7–40%)12.
На сегодняшний день проблема лечения пациентов с Н. pylori-ассоциированными заболеваниями в России обусловлена рядом факторов, прежде всего отсутствием реальной научной базы и актуальной информации об антибиотикорезистентности микроорганизмов, систематизированных данных об эффективности эрадикационной терапии. Высокая распространенность в нашей стране инфекции Н. pylori определяет необходимость разработки программы активного мониторинга уровня антибиотикорезистентности, а также скрининга рака желудка в известных группах риска (возраст, наследственный анамнез, курение и др.) с возможной профилактикой с помощью своевременной эрадикации Н. pylori.
Высокая распространенность в нашей стране инфекции Н. pylori определяет необходимость разработки программы активного мониторинга уровня антибиотикорезистентности, а также скрининга рака желудка в известных группах риска (возраст, наследственный анамнез, курение и др.) с возможной профилактикой с помощью своевременной эрадикации Н. pylori.
Рабепразол в схемах эрадикации Н. pylori более эффективен по сравнению с другими ИПП. Метаанализ A.G. McNicholl и соавт., включавший 35 исследований, показал обоснованность концепции о необходимости антисекреторной терапии для повышения уровня эрадикации. В схемах антихеликобактерной терапии рабепразол продемонстрировал преимущества в отношении антисекреторного эффекта перед ИПП первых генераций (4,3%; ОШ 1,21; 95% ДИ 1,02–1,42)13.
Таким образом, применение оригинального рабепразола в схемах эрадикационной терапии характеризуется более быстрым наступлением антисекреторного действия и более выраженной прямой антихеликобактерной активностью по сравнению с другими ИПП. Париет® (оригинальный рабепразол) в четыре раза снижает минимальную подавляющую концентрацию антибиотиков для Н. pylori с множественной лекарственной устойчивостью14.
Париет® (оригинальный рабепразол) в четыре раза снижает минимальную подавляющую концентрацию антибиотиков для Н. pylori с множественной лекарственной устойчивостью14.
Профессор И.В. Маев подчеркнул, что Н. pylori – одна из наиболее распространенных бактериальных инфекций человека. Во всем мире наблюдается негативный тренд снижения эффективности классических схем эрадикации, коррелирующий с ростом резистентных к антибактериальным препаратам штаммов бактерий в популяции. Одним из способов преодоления такой резистентности и повышения эффективности лечения является правильный выбор ИПП. Высокоэффективным ИПП для эрадикационных схем в эпоху роста резистентности Н. pylori к антибиотикотерапии признан рабепразол.
Микробиота желудка и Н. pylori. Существует ли связь с прогрессированием патологии?
По словам доцента кафедры семейной медицины факультета послевузовского профессионального образования врачей Первого МГМУ им. И.М. Сеченова, к.м.н. Татьяны Львовны ЛАПИНОЙ, благодаря развитию современных технологий представления о микробиоте желудка за последние десятилетия значительно изменились. Ранее считалось, что кислая среда желудка обеспечивает его стерильность. Кроме того, желчный рефлюкс способствует снижению колонизации микроорганизмами. Принципиальный шаг с точки зрения современных представлений о микробиоте был сделан в 1984 г. I.R. Warren и B.I. Marshall, которые выделили микроорганизм Н. pylori из проб слизистой оболочки желудка человека и культивировали его на искусственных питательных средах. В исследованиях они опирались на данные более ранних работ, авторы которых обнаружили спиралевидные бактерии во внутриклеточных канальцах клеток желудка. С тех пор накоплен большой объем информации о роли Н. pylori в патогенезе заболеваний человека и методах их лечения. Очевидно, что микробиота желудка включает и другие микробы. Однако состав нормальной микробиоты желудка и влияние на нее Н.
И.М. Сеченова, к.м.н. Татьяны Львовны ЛАПИНОЙ, благодаря развитию современных технологий представления о микробиоте желудка за последние десятилетия значительно изменились. Ранее считалось, что кислая среда желудка обеспечивает его стерильность. Кроме того, желчный рефлюкс способствует снижению колонизации микроорганизмами. Принципиальный шаг с точки зрения современных представлений о микробиоте был сделан в 1984 г. I.R. Warren и B.I. Marshall, которые выделили микроорганизм Н. pylori из проб слизистой оболочки желудка человека и культивировали его на искусственных питательных средах. В исследованиях они опирались на данные более ранних работ, авторы которых обнаружили спиралевидные бактерии во внутриклеточных канальцах клеток желудка. С тех пор накоплен большой объем информации о роли Н. pylori в патогенезе заболеваний человека и методах их лечения. Очевидно, что микробиота желудка включает и другие микробы. Однако состав нормальной микробиоты желудка и влияние на нее Н. pylori до конца не изучены, что требует проведения дальнейших исследований.
pylori до конца не изучены, что требует проведения дальнейших исследований.
Последние годы особое внимание уделяется изучению роли инфекции Н. pylori в развитии рака желудка. Международное агентство по изучению рака (International Agency for Research on Cancer – IARC) отнесло ее к канцерогенам класса I. Эти микроорганизмы благодаря ферментативной активности (уреазной, фосфолипазной и др.) и способности вырабатывать цитотоксины проникают в межклеточные пространства, повреждают эпителиальные клетки слизистой оболочки желудка и запускают каскад иммуновоспалительных реакций.
Инфицирование Н. pylori может приводить к изменению состава микробиоты – снижению микробного разнообразия и числа анаэробов, необходимых для нормального функционирования желудочно-кишечного тракта (ЖКТ). Установлено, что у Н. pylori-негативных лиц микробиота более разнообразна, чем у Н. pylori-позитивных15.
Микробиомная теория участия различных микроорганизмов в канцерогенезе хорошо вписывается в представление о «каскаде Correa». Согласно теории о «каскаде Correa», последовательные структурные изменения слизистой оболочки желудка, возникающие при ее колонизации Н. pylori, вызывают дисплазию и рак желудка. Однако нельзя недооценивать значение других микроорганизмов в развитии патологических изменений слизистой оболочки желудка. В частности, одновременно со снижением контаминации Н. pylori происходит избыточный бактериальный рост аэробной и анаэробной флоры. Н. pylori – своего рода дирижер, который руководит работой микробиомного оркестра. Н. pylori прежде всего индуцирует развитие атрофии с повышением уровня рН, выделением аммония и бикарбоната, служащих субстратом для других бактерий, замедляет моторику желудка, обусловливает степень воспаления и объем патологических изменений желудка. Н. pylori – основной компонент микробиоты желудка, который создает и разрушает различные экологические ниши микроорганизмов в составе микробиоты.
Согласно теории о «каскаде Correa», последовательные структурные изменения слизистой оболочки желудка, возникающие при ее колонизации Н. pylori, вызывают дисплазию и рак желудка. Однако нельзя недооценивать значение других микроорганизмов в развитии патологических изменений слизистой оболочки желудка. В частности, одновременно со снижением контаминации Н. pylori происходит избыточный бактериальный рост аэробной и анаэробной флоры. Н. pylori – своего рода дирижер, который руководит работой микробиомного оркестра. Н. pylori прежде всего индуцирует развитие атрофии с повышением уровня рН, выделением аммония и бикарбоната, служащих субстратом для других бактерий, замедляет моторику желудка, обусловливает степень воспаления и объем патологических изменений желудка. Н. pylori – основной компонент микробиоты желудка, который создает и разрушает различные экологические ниши микроорганизмов в составе микробиоты.
Показано, что у трансгенных мышей, инфицированных Н. pylori и комплексом микроорганизмов различных видов, интраэпителиальная метаплазия развивается намного раньше, чем у инфицированных только Н. pylori16. Антибактериальная терапия приводит к отсрочке появления признаков метаплазии.
pylori и комплексом микроорганизмов различных видов, интраэпителиальная метаплазия развивается намного раньше, чем у инфицированных только Н. pylori16. Антибактериальная терапия приводит к отсрочке появления признаков метаплазии.
Микроорганизмы могут индуцировать воспаление, активизировать клеточную пролиферацию, разбалансировать стволовые клетки, продуцировать определенные метаболиты.
По словам Т.Л. Лапиной, необходимость проведения эрадикационной терапии Н. pylori в целях профилактики рака желудка не подвергается сомнению. Более того, следует максимально эффективно использовать препараты уже в первой линии эрадикационной терапии. Важно правильно выбрать ИПП. Доказано, что оригинальный рабепразол (Париет®) в схемах эрадикационной терапии характеризуется максимальной способностью иммобилизировать и подавлять рост бактерии Н. pylori, резистентной к кларитромицину5. Кроме того, Париет® значительно усиливает продукцию слизи в желудке. Так, Париет® 20 мг в течение семи дней увеличивает продукцию желудочной слизи на 167%. Применение в схеме эрадикационной терапии напроксена снижает продукцию слизи на 49%, но в сочетании с оригинальным рабепразолом достигается восстановление продукции слизи с ростом на 67%17.
Так, Париет® 20 мг в течение семи дней увеличивает продукцию желудочной слизи на 167%. Применение в схеме эрадикационной терапии напроксена снижает продукцию слизи на 49%, но в сочетании с оригинальным рабепразолом достигается восстановление продукции слизи с ростом на 67%17.
Специальные свойства рабепразола, такие как быстрое и мощное подавление кислотной продукции и потенцирование синтеза слизи, укрепление защитного барьера желудка, могут оказывать дополнительный синергичный эффект в ходе проведения антихеликобактерной терапии. Рабепразол может быть назначен в комбинации с различными антибактериальными препаратами, что расширяет возможности выбора оптимального режима эрадикационной терапии у пациентов с инфекцией, вызванной Н. pylori.
Каковы последствия непроведенной диагностики и несостоявшейся эрадикации Н. pylori?
Заведующий кафедрой терапии и клинической фармакологии Северо-Западного государственного медицинского университета им. И.И. Мечникова, д.м.н., профессор Владимир Ильич СИМАНЕНКОВ отметил, что Россию традиционно считают регионом с высокими показателями распространенности и смертности от рака желудка. Анализируя причины возникновения рака желудка, следует учитывать этиопатогенетическую роль Н. pylori в развитии гастродуоденальной патологии. Инфекция, вызванная Н. pylori, рассматривается как ведущий этиологический фактор в развитии рака желудка. По меньшей мере 90% случаев рака данной локализации обусловлены Н. pylori.
И.И. Мечникова, д.м.н., профессор Владимир Ильич СИМАНЕНКОВ отметил, что Россию традиционно считают регионом с высокими показателями распространенности и смертности от рака желудка. Анализируя причины возникновения рака желудка, следует учитывать этиопатогенетическую роль Н. pylori в развитии гастродуоденальной патологии. Инфекция, вызванная Н. pylori, рассматривается как ведущий этиологический фактор в развитии рака желудка. По меньшей мере 90% случаев рака данной локализации обусловлены Н. pylori.
По мнению большинства экспертов IARC, именно эрадикация Н. pylori является ключевой стратегией предотвращения рака желудка. Это подтверждают данные многочисленных исследований. Так, в многоцентровом рандомизированном исследовании GISTAR оценивали роль эрадикации Н. pylori в предупреждении рака желудка. Анализ данных 15-летних наблюдений продемонстрировал снижение смертности на 35% в группе больных, получавших эрадикационную терапию18.
Эффективные меры по снижению заболеваемости раком желудка были предприняты на государственном уровне в Японии. Еще в 2009 г. эрадикация Н. pylori была рекомендована всем инфицированным, а с 2013 г. подобная терапия входит в медицинскую страховку.
Эксперты РГА считают, что в клинической ситуации, когда проведение диагностики и лечения инфекции, вызванной Н. pylori, ставится под сомнение, дополнительным и убедительным аргументом в пользу их проведения должна стать профилактика развития рака желудка, особенно у пациентов с отягощенным наследственным анамнезом19.
Отметим, что в случае развития рака желудка в микрофлоре пораженных и непораженных отделов желудка преобладает Н. pylori. Особенно вирулентен CagA-положительный штамм Н. pylori, который увеличивает риск развития атрофии и метаплазии с последующей злокачественной трансформацией. При наличии CagA-положительных штаммов риск развития рака желудка увеличивается в 28 раз20.
Результаты когортных исследований показывают, что инфекция Н. pylori является важнейшим фактором риска развития рака желудка. Тем не менее доказательства, что при эрадикации снижается риск развития рака, до сих пор основываются на данных двух рандомизированных исследований. Результаты нескольких масштабных исследований, которые в настоящее время проводятся в Китае, Великобритании и Корее, позволят однозначно оценить эффективность эрадикации Н. pylori в контексте профилактики рака желудка.
Показаниями для эрадикации Н. pylori в свете канцерогенеза являются рак желудка у родственников первой степени родства, новообразования в желудке в анамнезе, гастрит высокого риска (тяжелый пангастрит, гастрит с преимущественным поражением тела желудка, тяжелая атрофия), длительное подавление кислотной секреции желудка, наличие факторов риска развития рака желудка со стороны внешней среды (курение, воздействие пыли, угля, кварца, цемента и/или работа в карьерах, шахтах).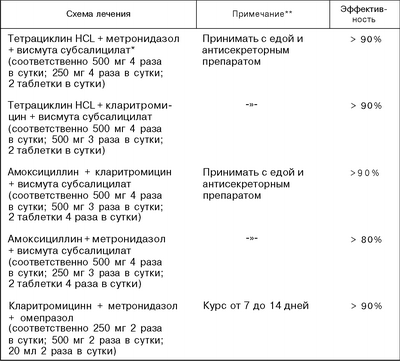
В 2015 г. состоялся Киотский консенсус, целью которого была систематизация накопленных за последние несколько лет данных об этиологии, тактике диагностики и лечении воспалительных изменений слизистой оболочки желудка и двенадцатиперстной кишки21. По мнению экспертов, бактерия Н. pylori и связанный с ней гастрит персистируют до тех пор, пока не будет проведена эрадикационная терапия или не возникнут распространенный атрофический гастрит и кишечная метаплазия. Риск развития рака желудка зависит от степени атрофии слизистой оболочки желудка и наличия кишечной метаплазии. Эрадикация Н. pylori способна снижать риск развития рака, но эффективность подобного мероприятия существенно ограничена у пациентов с атрофией и метаплазией. У пациентов с такими изменениями эрадикация Н. pylori может уменьшить выраженность гастрита, но не предотвратить прогрессию в рак. В итоге рак проявится спустя десять лет после проведения эрадикации Н. pylori. Поэтому предпочтительно проводить поисковый скрининг Н. pylori-ассоциированного гастрита в возрасте, когда новое инфицирование менее вероятно (старше 12 лет), и до развития атрофического гастрита и кишечной метаплазии.
Поэтому предпочтительно проводить поисковый скрининг Н. pylori-ассоциированного гастрита в возрасте, когда новое инфицирование менее вероятно (старше 12 лет), и до развития атрофического гастрита и кишечной метаплазии.
Эпидемиологические данные свидетельствуют о том, что эрадикация Н. pylori предотвращает прогрессию предраковых изменений. Однако после эрадикации снижается степень атрофии, но не кишечной метаплазии.
С точки зрения канцеропревенции эрадикация Н. pylori наиболее эффективна на ранних сроках заболевания. Киотский консенсус для индивидуального определения повышенного риска развития рака желудка рекомендует использовать серологические тесты (пепсиногены I, II и антитела к Н. pylori).
Эксперты предложили применять дифференцированный подход к выбору стратегий «тестируй и лечи» и «выполни эндоскопию и лечи». Для стран, к числу которых можно отнести и Россию, с уровнем инфицированности в популяции выше 20% стратегия «тестируй и лечи» оправданна с позиции экономической целесообразности. При диагностике инфекции целесообразно применять С-уреазный дыхательный тест, позволяющий минимизировать ложноположительные результаты. Эзофагогастродуоденоскопия показана пациентам с симптомами тревоги (потеря массы тела, дисфагия, желудочно-кишечное кровотечение, новообразование в брюшной полости, железодефицитная анемия).
При диагностике инфекции целесообразно применять С-уреазный дыхательный тест, позволяющий минимизировать ложноположительные результаты. Эзофагогастродуоденоскопия показана пациентам с симптомами тревоги (потеря массы тела, дисфагия, желудочно-кишечное кровотечение, новообразование в брюшной полости, железодефицитная анемия).
Приверженность пациентов лечению рассматривается как важнейший фактор успеха эрадикационной терапии Н. pylori, причем низкая комплаентность может быть причиной неудачи при чувствительных к назначению антибиотиков штаммах Н. pylori и развития антибиотикорезистентности. Комплаентность определяют такие факторы, как сложность и продолжительность многокомпонентного лечения, эффективность терапии, нежелательные явления, мотивация врача и пациента, полнота информированности больного.
Для повышения уровня приверженности пациентов лечению необходимо стремиться использовать максимально эффективные для конкретного региона схемы эрадикационной терапии. При этом нужно учитывать возможность реинфекции Н. pylori вследствие развития резистентности микроорганизмов к антибактериальным препаратам.
При этом нужно учитывать возможность реинфекции Н. pylori вследствие развития резистентности микроорганизмов к антибактериальным препаратам.
Современные схемы эрадикации Н. pylori включают использование ИПП. Наиболее обоснованный способ повышения эффективности эрадикационной терапии – модификация схемы лечения с использованием двойных доз ИПП. Эффективным базовым компонентом схемы эрадикации Н. pylori, выгодно отличающимся от других препаратов класса ИПП, является препарат Париет®. Париет® в составе тройной схемы и квадротерапии на фоне проведенной ранее неудачной эрадикации демонстрирует эффективность у 87% пациентов.
Завершая выступление, профессор В.И. Симаненков констатировал, что лечение пациентов с инфекцией, вызванной Н. pylori, предполагает проведение своевременных диагностических мероприятий и использование эффективных методов эрадикационной терапии.
Современные возможности диагностики и лечения рака желудка
Тему диагностики и лечения рака желудка продолжил заведующий отделением клинических исследований и химиотерапии ФГАУ «Лечебно-реабилитационный центр» Минздрава России, к. м.н. Евгений Витальевич ЛЕДИН. По его словам, в основе тактики лечения онкологического заболевания лежат адекватно установленные диагноз и стадия заболевания, определение плана лечения в ходе мультидисциплинарного консилиума, который не должен быть формальным. Важным компонентом схемы лечения больного раком желудка является комплексное дообследование для верификации диагноза различными диагностическими методами. Существенный вклад в уточняющую диагностику форм рака желудка вносят эндосонография, лапароскопия, исследования перитонеальных смывов и др.
м.н. Евгений Витальевич ЛЕДИН. По его словам, в основе тактики лечения онкологического заболевания лежат адекватно установленные диагноз и стадия заболевания, определение плана лечения в ходе мультидисциплинарного консилиума, который не должен быть формальным. Важным компонентом схемы лечения больного раком желудка является комплексное дообследование для верификации диагноза различными диагностическими методами. Существенный вклад в уточняющую диагностику форм рака желудка вносят эндосонография, лапароскопия, исследования перитонеальных смывов и др.
Эдоскопическое ультразвуковое исследование может быть эффективно в определении глубины опухолевой инвазии стенки желудка, слоя, из которого исходит опухоль. Диагностическая лапароскопия проводится для уточнения глубины поражения стенки желудка и показана при раке желудка стадий IB – III. Лапароскопию не проводят больным раком желудка на ранней стадии. К преимуществу диагностической лапароскопии относится возможность забора материала для морфологического исследования обнаруженных изменений и забор перитонеальных смывов для цитологического исследования на наличие свободных опухолевых клеток. Присутствие свободных опухолевых клеток в смывах рассматривается как фактор негативного прогноза, предиктор раннего перитонеального рецидива. Выявление свободных опухолевых клеток классифицируется как IV стадия заболевания (М1) и подразумевает отказ от неоправданной резекции желудка. С 2014 по 2016 г. в ФГАУ «Лечебно-реабилитационный центр» была проведена диагностическая лапароскопия 219 пациентам с забором перитонеальных смывов. Из них 57 (26%) больных имели перитонеальный канцероматоз. Анализ данных подтверждает необходимость проведения диагностической лапароскопии в предоперационном периоде для предотвращения случаев необоснованных хирургических вмешательств.
Основным методом лечения рака желудка в настоящее время является хирургический. Частота прогрессирования после радикальных операций остается неприемлемо высокой. Распространенный рак желудка не относится к опухолям, высокочувствительным к химиотерапии, токсичность большинства режимов лечения высокая. Большинство же пациентов относятся к группе пожилого или старческого возраста с сопутствующими заболеваниями.
Оптимальная схема комплексного лечения больных раком желудка предусматривает использование периоперационной химиотерапии. Иногда после нескольких курсов периоперационной химиотерапии удается достичь определенных результатов – снижения стадии заболевания, повышения резектабельности, абластики, обеспечения селекции больных. У большинства пациентов с местнораспространенным процессом лечение следует начинать не с хирургического этапа, а именно с химиотерапии.
Несмотря на достижения хирургии, профилактическая химиотерапия у большинства пациентов с развившимся раком желудка является ключевым методом лечения. К сожалению, пятилетний рубеж преодолевает только половина больных со стадией II и каждый пятый или каждый десятый – со стадией III.
Среди особенностей прогрессирования рака желудка необходимо отметить преобладание отдаленного метастазирования, причем даже у пациентов с резекцией желудка. Истинно местный рецидив заболевания встречается крайне редко – 0,3–0,5%. Преобладающей локализацией системного рецидива считаются печень и брюшина22.
Целями паллиативного лечения рака желудка являются облегчение симптомов заболевания, повышение качества жизни и увеличение продолжительности жизни больных. Наиболее эффективна цитостатическая противоопухолевая терапия. Современные методы химиотерапии позволяют в ряде случаев генерализованного опухолевого процесса увеличивать показатели средней продолжительности жизни от шести до 7–11 месяцев.
Сегодня началась новая эра таргетной терапии, которая дает надежду на лучшие результаты лечения и улучшение качества жизни больных. В мире продолжаются исследования, направленные на поиск новых эффективных средств против рака. Цель таргетной терапии – не разрушение клеток новообразования, а подавление и угнетение их активности и способности к репликации. Главная задача таргетной терапии – определить клетки опухоли, то есть мишени, на которые нужно воздействовать.
Высокие показатели заболеваемости и смертности, верификация диагноза рака желудка на поздних стадиях обусловливают необходимость совершенствования методов диагностики и лечения заболевания.
Заключение
Базисными препаратами эрадикационной терапии у пациентов с инфекцией, вызванной Н. pylori, являются ИПП. Применение оригинального ИПП Париет® в схемах эрадикационной терапии характеризуется более быстрым наступлением антисекреторного действия и более выраженной прямой антихеликобактерной активностью по сравнению с другими ИПП. Рабепразол стимулирует секрецию муцинов в слизистой оболочке желудка и пищевода, обеспечивая барьерную функцию слизистой оболочки.
Препарат Париет®, в соответствии с инструкцией, в ряде случаев назначают в комбинации с различными антибактериальными препаратами, что расширяет возможности выбора оптимального режима эрадикационной терапии Н. pylori.
Подготовила А. Горчакова
(по материалам докладов, прозвучавших в рамках 104-й Международной осенней сессии Национальной школы гастроэнтерологии, гепатологии Российской гастроэнтерологической ассоциации, Москва, 6–8 октября 2017 г.)
Клинические рекомендации Американской гастроэнтерологической ассоциации по лечению инфекции Helicobacter pylori
— Helicobacter pylori представляет собой хроническую и обычно приобретенную в детском возрасте инфекцию. Распространенность инфекции зависит от расы и страны.
— Всем пациентам с положительным тестом на активную инфекцию пилорического хеликобактера должна быть предложена эрадикационная терапия.
— У всех пациентов с активной язвенной болезнью желудка и двенадцатиперстной кишки, у лиц, у которых в анамнезе есть указание на язвенную болезнь (если не проводилась ранее эрадикационная терапия), больных с MALT-лимфомой низкой степени или указанием в анамнезе на эндоскопическую резекцию раннего рака желудка должно быть проведено исследование на выявление H. pylori. В случае положительного результата необходимо предложить пациенту лечение.
— У больных с неопределенной диспепсией, возраст которых не превышает 60 лет и у которых нет симптомов тревоги, показано неэндоскопическое тестирование на H. pylori.
— В случае проведения эндоскопического исследования пациенту с диспепсией следует производить биопсию для последующего исследования на хеликобактер.
— Пациентов с типичными симптомами гастроэзофагеальной рефлюксной болезни (ГЭРБ), у которых нет в анамнезе язвенной болезни, не следует рутинно исследовать на H. pylori. Однако, если в результате обследования инфекция обнаружена, врачу следует предложить антибактериальную терапию. При этом необходимо помнить, что эрадикация может оказать непредсказуемое влияние на течение ГЭРБ.
— У пациентов, которые получают в течение длительного времени низкую дозу аспирина, тестирование на H. pylori должно рассматриваться в качестве меры по снижению риска кровотечения.
— Больным, которые начинают длительную терапию нестероидными противовоспалительными препаратами, следует выполнить исследование на пилорический хеликобактер. В случае положительного результата необходимо проведение эрадикационной терапии. Польза от обследования и лечения пациентов, которые уже длительно получают нестероидные противовоспалительные препараты, остается невыясненной.
— Больные с железодефицитной анемией неясной этиологии должны обследоваться на наличие хеликобактерной инфекции.
— Взрослых пациентов с идиопатической тромбоцитопенией следует обследовать на H. pylori.
— В настоящее время не получено достаточного количества доказательств рутинного тестирования и лечения хеликобактерной инфекции у асимптоматичных пациентов с указанием в наследственном анамнезе на рак желудка или пациентов с лимфоцитарным гастритом, гиперпластическим полипом желудка или рвотой беременных.
— Перед назначением терапии необходимо расспросить пациента, какие антибактериальные препараты он получал ранее. Полученную информацию следует учитывать при выборе режима терапии.
— Тройная терапия с кларитромицином (кларитромицин, амоксициллин или метронидазол, ингибитор протонной помпы (ИПП)) в течение 14 дней назначается больным в регионах, где известно, что резистент-ность к кларитромицину < 15 %, и больным, которые ранее не получали макролиды.
— Висмутсодержащая квадротерапия (ИПП + висмут + тетрациклин + метронидазол) в течение 10–14 дней является терапией первой линии. Висмутсодержащая схема терапии особенно подходит для больных, которые ранее получали макролиды или у которых отмечаются аллергические реакции на антибиотики пенициллинового ряда.
— Сопутствующая терапия (ИПП + кларитромицин + амоксициллин + метронидазол) на 10–14 дней рассматривается в качестве терапии первой линии.
— Последовательная терапия (ИПП + амоксициллин на 5–7 дней, затем кларитромицин + метронидазол + ИПП на протяжении 5–7 дней) рассматривается в качестве терапии первой линии.
— Гибридная схема лечения, включающая ИПП и амоксициллин на 7 дней, затем — ИПП + амоксициллин + кларитромицин + метронидазол на протяжении 7 дней, может быть выбрана в качестве терапии первой линии.
— Тройная терапия с левофлоксацином (ИПП + амоксициллин + левофлоксацин) продолжительностью 10–14 дней предлагается как эрадикационная терапия первой линии.
— Последовательная терапия с фторхинолоном, включающая амоксициллин и ИПП в течение 5–7 дней, далее — фторхинолон + метронидазол + ИПП, может быть использована в качестве схемы первой линии.
— Основными факторами, предопределяющими эффективность эрадикации, выступают: выбор режима лечения, приверженность к лечению (большое значение имеет частота нежелательных явлений) и чувствительность штаммов H. pylori к антибиотикам.
— Антимикробная резистентность должна определяться с помощью культурального и/или молекулярного тестирования. К сожалению, данное исследование можно выполнить в небольшом количестве лабораторий.
Выбор терапии при неэффективности терапии первой линии
— У пациентов с персистирующей инфекцией H. pylori необходимо по возможности стараться избегать назначения ранее применяемых препаратов.
— Квадротерапия с висмутом или схема с лево-флоксацином являются терапией выбора. Если пациент ранее получал эрадикацию с препаратом висмута, то выбор терапии второй линии зависит от локальной антибиотикорезистентности. Также необходимо учитывать, какие антибиотики больной получал в прошлом.
— Для эрадикации можно выбрать следующие схемы:
— квадротерапия с висмутом на протяжении 14 дней;
— тройная терапия с левофлоксацином в течение 14 дней;
— сопутствующая терапия на протяжении 10–14 дней;
— рифабутинсодержащая схема (ИПП + амоксициллин + рифабутин) в течение 10 дней;
— высокодозовая двойная терапия, включающая ИПП и амоксициллин, на протяжении 14 дней.
— Тройную терапию с кларитромицином в данном случае использовать не следует.
Большинство больных, отмечающих аллергические реакции на пенициллин, не имеют истинной гиперчувствительности к препарату. После неудачи терапии первой линии такие пациенты должны быть направлены на тестирование аллергии на пенициллин, так как у подавляющего большинства амоксициллинсодержащие эрадикационные схемы могут быть безопасны.
Источник: William D. Chey, Grigorios I. Leontiadis,
Colin W. Howden et al. // Am. J. Gastroenterol. —
2017. — 112. — Р. 212-238.
Хеликобактер пилори: мифы и реальность
Helicobacter pylori (хеликобактер пилори, в дальнейшем — НР) — бактерия, которая инфицирует различные области желудка и двенадцатиперстной кишки, вызывая в слизистой оболочке изменения, приводящие к развитию гастрита, язвы, рака.
Международное агентство по изучению рака (IARC) отнесло НР к канцерогенам первой группы (определенный канцероген). НР — не единственный этиологический фактор рака желудка, но он играет причинную роль в цепи событий, ведущих к его развитию.
Следует отметить, что заболеваемость раком желудка в Беларуси достаточно высока, в Европейском регионе в 2016 г. мы занимали первое место по этому показателю, в 2017 году второе. Именно поэтому стратегия поголовного лечения этой инфекции является абсолютно оправданной, это действительно сохраняет чьи-то реальные жизни в перспективе.
Бактерия была вновь открыта в 1979 году австралийским патологом Робином Уорреном, который затем провёл дальнейшие исследования её вместе с Барри Маршаллом, начиная с 1981 года.
Уоррен и Маршалл высказали предположение, что большинство язв желудка и гастритов у человека вызываются инфицированием микроорганизмом НР, а не стрессом или острой пищей, как предполагалось ранее.
В 2005 году Робин Уоррен и Барри Маршалл были удостоены Нобелевской премии по медицине за открытие НР.
Сколько же людей в Беларуси инфицировано?
Около 80% взрослого населения Беларуси заражены НР, а в странах Западной Европы и США — 30—40%. Такой же уровень заражения НР, как в нашей стране, наблюдается в Украине и России.
В Японии, где отмечается высокая заболеваемость раком желудка, существует национальная программа по эрадикации HР (пациенты получают препараты для эрадикации бесплатно), что позволило значительно снизить не только количество носителей НР в популяции, но и заболеваемость раком желудка.
Каким образом можно заразиться НР-инфекцией?
В первую очередь, следует отметить, что заражение в основном происходит в семьях, в случаях, если инфицированы родители, инфицируются и дети. Заражение может происходить через столовые приборы и посуду, а также пустышку или бутылочку, в случае с маленькими детьми, через слюну и прочие слизистые выделения, например, при поцелуе; через предметы индивидуальной гигиены и личную косметику (губную помаду).
Поскольку носителями различных видов НР являются домашние животные (собаки, кошки) – важно соблюдение мер личной гигиены при общении с ними.
Также возможны случаи заражения через медицинское оборудование, после обследования больного.
Всегда ли нужно лечить НР-инфекцию?
Существуют определенные ситуации, в которых обязательно нужно проводить эрадикацию НР:
— Язва 12-перстной кишки и/или желудка в настоящее время или в прошлом
— Лимфома желудка
— Атрофический (аутоиммунный) гастрит
— У пациентов – родственников 1-й степени родства (мать, отец, братья, сестры) больных раком желудка
— Диспепсия (наличие жалоб, связанных с желудком)
— Желание пациента
В любом случае врач всегда должен найти общий язык с пациентом, объяснить ему, зачем назначает эрадикационную терапию, и только после этого назначать лечение.
Какие схемы лечения лучше использовать?
В 2016-2017 годах было принято несколько глобальных соглашений по диагностике и лечению НР-инфекции: это Маастрихтское соглашение, Киотский консенсус. Врачи и эксперты всего мира договорились о стратегии, выработали тактику для более успешного выявления и лечения этой инфекции.
Схемы лечения легко найти в интернете, однако самостоятельно назначать себе лечение не стоит. Лучше предварительно проконсультироваться с участковым терапевтом, который и должен назначить вам схему лечения с учетом индивидуальных особенностей (аллергия на лекарственные препараты, наличие сопутствующих заболеваний, прием антибактериальных препаратов в анамнезе).
Если раньше схема эрадикации по длительности занимала 7-10 дней, то по последним рекомендациям – продолжительность ее увеличилась до 14 дней. Это повышает вероятность успеха в лечении.
Также для улучшения переносимости эрадикационных схем и уменьшения вероятности развития побочных эффектов, таких, как антибиотик-ассоциированная диарея, рекомендуется параллельно с антибиотиками принимать препарат из группы пробиотиков (энтерол, энтерожермина и др.).
Нужно ли делать контроль после лечения и каким образом?
Последние вышедшие клинические протоколы диагностики и лечения заболеваний органов пищеварения рекомендуют проводить контроль эрадикации НР после лечения. Способы могут быть разными – это либо гастроскопия с взятием биопсии (морфологический контроль является «золотым стандартом»), либо проведение дыхательного теста, а также определение антигенов НР в кале.
В нашей стране сейчас доступны разные виды дыхательных тестов для определения наличия НР, однако наиболее надежным является С13-УДТ (С13-уреазный дыхательный тест), который проводится с помощью газоанализатора, в основном в РБ используются аппараты немецкой фирмы FAN. Определение антигенов НР в кале в Минске пока недоступно, однако в некоторых городах РБ этот анализ можно сделать.
Врач-гастроэнтеролог консультационного отделения
О.С. Полякова
РЕЗИСТЕНТНОСТЬ HELICOBACTER PYLORI К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ: СОВРЕМЕННОЕ СОСТОЯНИЕ ПРОБЛЕМЫ
В настоящее время доказан факт определенной этиологической и патогенетической роли бактерий Helicobacter pylori (НР) в развитии распространенных заболеваний — острого и хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки, образовании некоторых видов опухолей желудка (МALT-лимфомы, аденокарциномы), диспепсии неязвенной этиологии (Hant R.N., 1994).
Наличие НР в большинстве случаев при этих заболеваниях и их влияние на организм человека дали основание считать их патогенетически связанными и получили название заболеваний, ассоциированных с НР (Noach L., Tytgat G., 1994).
Так, бактерии НР выявляют у 80—100% больных с хроническим гастритом, у 70–80% — с язвой желудка, у 90–100% — с язвой двенадцатиперстной кишки, у 100% — с МALT-лимфомой, у 80–95% — с аденокарциномой желудка, у 60% — с диспепсией неязвенной этиологии (Moran P., O’Morein A.A., 1997).
Элиминация бактерий НР после проведения успешной терапии способствует полной или частичной регенерации слизистой оболочки в гастродуоденальной зоне (Axon A.T.R., 1996; Hulst R.W.M. et al., 1996; Pounder R.E., Williams M.P., 1997; Vautier G., 1997).
Общепринято, что при заболеваниях, ассоциированных с инфекцией НР, необходимо проводить антихеликобактерную терапию. В 1996–1997 гг. были предложены единые стандартные схемы антихеликобактерной терапии (Европейский Маастрихтский консенсус, Американская Интернациональная конференция фонда здоровья, Азиатский консенсус) с использованием 2 или 3 антимикробных препаратов и 1 антисекреторного (препарат висмута, антибиотики: кларитромицин, амоксициллин, тетрациклин или метронидазол и блокатор Н+/К+-АТФазы) (Consensus conference Helicobacter pylori peptic ulcer disease, 1994; The European Maastricht Consensus, 1997; Lam S.K., Talley N.J., 1998).
По усредненным данным эффективность официально рекомендованных схем лечения заболеваний органов пищеварения, ассоциированных с НР, составляет от 65 до 87%, но в большинстве случаев зависит от чувствительности НР к применяемым антибактериальным препаратам (Hant R.N., 1997; Graham D.Y., Dore M.P., 1998).
Резистентность патогенных микроорганизмов к применяемым антибактериальным препаратам является весьма актуальной проблемой. Это связано с неуклонным повышением резистентности, которая в последние годы приобрела глобальный характер (Glupczynski Y., 1998).
В полной мере это относится и к заболеваниям, ассоциированным с НР, базисное лечение которых по сути сводится к уничтожению возбудителей этой инфекции. В последние годы такое лечение становится все более сложным, поскольку количество штаммов НР, резистентных к применяемым антибактериальным препаратам неуклонно увеличивается.
Резистентные штаммы НР значительно труднее поддаются эрадикации (уничтожению), что снижает на 20–50% эффективность рекомендованных лечебных схем и делает их экономически невыгодными (Иванников И.А., 1998). Так, именно с повышением резистентности НР к антибактериальным препаратам связывают рост заболеваний и осложнений, обусловленных патологией органов гастродуоденальной зоны, а следовательно — значительное увеличение затрат на лечение, что является не только медицинской, но и социально-экономической проблемой.
Установлено, что НР резистентны к антибактериальным препаратам групп нитроимидазолов, макролидов, фторхинолонов, производных рифампицина, полусинтетических пенициллинов. Известно, что развитие первичной резистентности микроорганизмов к тем или иным антибактериальным препаратам зависит от частоты их применения у населения конкретного региона. Развитие первичной резистентности НР к этим препаратам связывают с их довольно частым применением при инфекционных и респираторных заболеваниях. Вторичная резистентность бактерий развивается вследствие проведения антихеликобактерной терапии.
Распределение антибактериальных препаратов, рекомендованных для антихеликобактерной терапии в зависимости от частоты развития к ним резистентности НР
Препараты | Максимальные показатели развития резистентности |
Часто возникает резистентность | |
| Группа нитроимидазолов: метронидазол тинидазол | 100% |
| Группа макролидов: кларитромицин | 40% |
| Группа фторхинолонов: офлоксацин норфлоксацин ципрофлоксацин | 30% |
Редко возникает резистентность | |
| Полусинтетические пенициллины: амоксициллин | 7% |
| Тетрациклины: тетрациклина гидрохлорид доксациклина гидрохлорид | 5% |
Резистентность не развивается | |
| Группа нитрофуранов: фурадонин фуразолидон | |
| Соли коллоидного висмута: висмута субцитрат висмута субгалат висмута субсалицилат | |
Таблица 2
Эффективность существующих схем антихеликобактерной терапии при разной резистентности НР к метронидазолу и кларитромицину (Tytgat G.N.J., 1998)
Первичная резистентность | Схемы терапии | Эффективность, % |
М менее 30% | О+К+А О+К+М РВЦ/ВК+К+М | 85–95 |
M более 30% K менее 15% | O+K+A РВЦ/ВК+К+А | 85–95 |
M более 30% K более 15% | О+ВК+М+Т О+ВК+М+Т | 50–95 |
Примечание. М — метронидазол, К — кларитромицин, О — омепразол, А — амоксициллин, РВЦ — ранитидин — висмут — цитрат, ВК — коллоидный висмут, Т —тетрациклин.
Наиболее высокая резистентность НР развивается к производным нитроимидазола — метронидазолу и тинидазолу. В развитых странах первичная резистентность НР к нитроимидазолам составляет 30–35%, что связано с частым применением в гинекологии и венерологии, в развивающихся странах — 50–60%, где его также применяют при часто возникающих амебиазе, лямблиозе, трихомониазе.
Так, в странах Африки, Латинской Америки, Юго-Восточной Азии первично-резистентные к нитроимидазолу штаммы НР в популяции составляют от 50 до 100% (Lee A., Megraud F., 1996).
В странах Восточной Европы с невысоким уровнем жизни (в том числе и в странах СНГ) первично-резистентные к нитроимидазолу штаммы НР составляют 20–40%; в России к метронидазолу — почти 30%, в Москве — 36% (Кудрявцева Л.В., 1998).
В странах Западной Европы, по данным Европейского многоцентрового исследования, средний уровень первичной резистентности НР к метронидазолу составляет 25,6% (European Study Group on Antibiotic Susceptibility of Helicobacter pylori, 1992).
Вторичная резистентность НР к используемым антибиотикам, как правило, обусловлена неадекватным лечением: заниженными дозами препаратов, применением неполных схем лечения (с использованием двух препаратов), несоблюдением сроков лечения и кратности приема или неправильной оценкой эффективности эрадикации. Предполагают, что механизм развития повторной резистентности НР связан с мутациями бактерий.
Повторная резистентность к нитроимидазолам в развитых странах в 1996 р. составила 50% (Megraud F. et al., 1994), а в развивающихся — 80–100%. Так, бесконтрольное использование метронидазола при лечении пациентов с язвенной болезнью привело к повышению вторичной резистентности в Гонконге с 22 в 1991 г. до 73,2% в 1995 г. (Ling T.K.W. et al., 1996). В России вторичная резистентность к метронидазолу у больных, которым проводили антихеликобактерную терапию по поводу язвенной болезни, составила 100% (Кудрявцева Л.В., 1998).
Уровень первичной резистентности НР к макролидам, например к кларитромицину, в Европе составляет 2–15%, что, вероятно, связано с частым использованием препаратов этой группы для лечения больных с респираторными инфекциями (Versalovic G. et al., 1995).
В развивающихся странах, где кларитромицин применяют нечасто, резистентность к нему значительно ниже или еще не выявлена. По данным Российской Группы по изучению НР, первичная резистентность бактерий к этому препарату не выявлена. Вторичная резистентность НР к кларитромицину в развитых странах достигает 40%, в России — пока не обнаружена (Кудрявцева Л.В., 1998).
Первичная резистентность НР к фтoрхинолонам (ципрофлоксацину, офлоксацину, норфлоксацину) составляет в среднем 1% (Меgraud F., 1995). Наряду с этим, определена довольно высокая вторичная резистентность бактерий к фторхинолонам — 30% в развитых странах. Данных о резистентности НР к препаратам этой группы в развивающихся странах нет.
Данных о первичной резистентности НР к препаратам группы рифампицина пока нет. Имеются единичные сообщения о развитии вторичной резистентности бактерий к препаратам этой группы, составляющей 5%, что, возможно, связано с довольно редким включением их в схемы антихеликобактерной терапии (Меgraud F., 1995).
В последнее время не сообщалось о выделении в странах Западной Европы штаммов НР, резистентных к полусинтетическим пенициллинам (амоксициллину), тетрациклинам, нитрофуранам.
В 1997 г. впервые сообщалось о появлении резистентных к амоксициллину штаммов НР, составивших 7% в развитых странах. Российская Группа по изучению НР в 1998 г. сообщила о выделении резистентных к амоксициллину штаммов НР, что составило 11% (Кудрявцева Л.В., 1998).
Почти полное отсутствие или низкая резистентность бактерий к кларитромицину, амоксициллину и фторхинолонам у населения развивающихся стран связана с ограниченным применением этих средств, поскольку указанные препараты не производятся промышленностью этих стран, а стоимость экспортируемых препаратов высока.
Отмечена довольно низкая резистентность (не более 5%) НР к препаратам группы тетрациклина у населения как в развитых, так и в развивающихся странах, хотя эти средства довольно часто применяются (Hant R.N., 1997).
Не определена резистентность бактерий НР к препаратам нитрофуранового ряда, а также к препаратам коллоидного висмута.
Известно, что препараты, содержащие висмут, в частности Де-нол, для лечения пациентов с язвенной болезнью применяют в течение нескольких десятилетий, однако резистентность к нему НР до сих пор не выявлена.
Распределение антибактериальных препаратов в зависимости от частоты развития резистентности к ним HР
Антибактериальные препараты, применяемые для эрадикации НР, условно можно разделить на следующие группы (табл. 1): средства, к которым резистентность НР развивается часто; редко; не возникает вовсе.
Частота резистентности НР неодинакова в разных регионах. Например, резистентность к метронидазолу в странах Европы составляет 45% — в Германии, 30% — во Франции, 80% — в Албании. Причем отмечается тенденция к неуклонному ее повышению. Так, в странах Западной Европы резистентность НР к метронидазолу возросла с 31,8 в 1991 г. до 46% в 1995 г., к кларитромицину — от 0 до 8,5% в 1997 г. (во Франции — 10%, в США — 7%) (Hant R.N., 1997).
Пути преодоления резистентности HP к антибактериальным препаратам
Для повышения эффективности эрадикации бактерий необходим дифференцированный подход к применению существующих стандартных схем антихеликобактерной терапии. Состав препаратов, входящих в схемы терапии, необходимо изменять с учетом данных о частоте выявления резистентных штаммов бактерий в разных регионах и локальной резистентности НР к каждому из применяемых препаратов.
Так, при резистентности НР к метронидазолу более 30% в популяции в схему лечения этот препарат не включают, используют кларитромицин и амоксициллин в сочетании с препаратами коллоидного висмута. При высокой резистентности к метронидазолу (более 30%) и одновременно к кларитромицину (более 15%) рекомендуют одновременное применение четырех препаратов («квадротерапия») — блокатор Н+/К+-АТФазы+препарат висмута+метронидазол+тетрациклин (табл. 2) (Передерий В.Г., 1997).
Необходимо отметить, что такая дифференцированная терапия допускает определение чувствительности и резистентности НР к назначаемым препаратам.
Наряду с существующими рекомендациями, идет постоянный поиск более эффективных схем антихеликобактерной терапии с учетом изменяющейся резистентности НР и создание новых антихеликобактерных средств, к которым не развивается резистентность.
Результаты исследования последних лет свидетельствуют, что повышение доз антибактериальных средств не преодолевает резистентность бактерий, а только приводит к увеличению частоты побочных эффектов.
В Украине пока не разработан единый подход к антихеликобактерной терапии. Нет единого стандарта для диагностики и лечения заболеваний, ассоциированных с НР, с учетом географических, этнических, социальных и экономических особенностей. Некоторые ученые продолжают пропагандировать устаревшие способы лечения, например язвенной болезни, без применения антибактериальных препаратов, многие специалисты продолжают назначать репаранты и М-холинолитики, а при хроническом гастрите типа В — антациды. Антихеликобактерную терапию, как правило, проводят с использованием метронидазола.
Все это обусловлено в значительной мере тем, что в Украине не проводят многоцентровые исследования по изучению распространенности и выявляемости НР в популяции в целом и при заболеваниях органов гастродуоденальной зоны, в частности. Нет данных о частоте выявления инфекции НР при гастрите типа В, язвенной болезни желудка и двенадцатиперстной кишки, диспепсии неязвенной этиологии; вирулентных штаммах НР и их распространенности; локальной резистентности бактерий к антибактериальным препаратам, в том числе к метронидазолу и др.; обобщенных данных о частоте неэффективной эрадикации бактерий после применения того или другого варианта терапии. Не изучена частота рецидивов инфекции НР и реинфицирования после успешного лечения.
Результаты наших исследований, проводимых в отделе гастроэнтерологии Института терапии АМН Украины (под руководством проф. О.Я. Бабак) в течение 10 лет, свидетельствуют, что частота инфицирования НР весьма высока не только среди больных с патологией органов пищеварения, но и при других заболеваниях — атеросклерозе, гипертонической болезни, вегетососудистой дистонии и достигает 83%. При обострении воспалительных заболеваний верхних отделов пищеварительного тракта частота определения НР достигает 94%. При этом выявлена высокая частота резистентности к производным нитроимидазолов — в 98% (исследования проводили только у жителей Харьковского региона).
Однако, с нашей точки зрения, вероятность формирования резистентности НР к антибактериальным препаратам может быть снижена. Этого возможно достичь путем повышения эффективности антихеликобактерной терапии.
Прежде всего необходимо исключить применение исходных нитроимидазолов в схеме тройной антихеликобактерной терапии, поскольку, очевидно, в нашей стране резистентность НР к препаратам этой группы превышает 30%.
В связи с тем что к препаратам коллоидного висмута, в частности к Де-нолу, резистентность НР не выявлена, целесообразно его включение в большинство схем антихеликобактерной терапии.
Благодаря действию Де-нола на НР (угнетение его адгезии в эпителий слизистой оболочки в гастродуоденальной зоне, нарушение метаболизма бактерий, что приводит к их гибели), и практически полному отсутствию резистентности, препарат на сегодня остается базовым, то есть основным компонентом при составлении схем антихеликобактерной терапии. Доза препарата должна составлять 240 мг при приеме 2 раза в день.
Весьма перспективно включение в схемы лечения препаратов нитрофуранового ряда — фурадонина и фуразолидона, поскольку резистентность НР к ним также до сих пор не выявлена. Опубликованы данные (Segura A.M. et al., 1997) об успешном применении фуразолидона при лечении больных с резистентными штаммами НР к метронидазолу. Применяли висмута субцитрат в дозе 240 мг 2 раза, фуразолидон — по 100 мг 4 раза, амоксициллин — по 500 мг 4 раза в сутки, курс лечения — 2 нед). Эрадикация НР достигнута в 6% случаев. Представленная схема лечения эффективна, имеет невысокую стоимость, поэтому лечение доступно для населения стран с невысоким уровнем жизни.
Перспектива усовершенствования схем антихеликобактерной терапии и повышение частоты эрадикации НР с учетом чувствительности и резистентности бактерий к препаратам, этнических, географических особенностей каждой популяции и экономических возможностей позволяет надеяться на возможность замедления повышения резистентности НР к проводимой терапии.
Ссылки
- 1. Иваницкий И.О. (1998) Проблема преодоления резистентности штаммов Helicobacter pylori. В кн.: Материалы 7-й сессии Российской Группы по изучению Helicobacter pylori, 27–28 мая 1998 г., Нижний Новгород, с. 34–36.
- 2. Кудрявцева Л.В. (1998) Опыт изучения антибиотикорезистентных российских штаммов Helicobacter pylori. В кн.: Материалы 7-й сессии Российской Группы по изучению Helicobacter pylori, 27–28 мая 1998 г., Нижний Новгород, с. 11–14.
- 3. Axon A.T.R. (1996) Eradication of Helicobacter pylori. Scand. J. Gastroenterol., 31 (214): 47–53.
- 4. European Study Group on Antibiotic Susceptibility of Helicobacter pylori. Results of a multicentre European Survey in 1991 of metronidasole resistance in Helicobacter pylori (1992) Eurор. J. Microbiol. Infect. Dis., 8, p. 181–185.
- 5. Glupczynski Y. (1998) Rasing antimicrobial resistance of Helicobacter pylori: A global problem Helicobacter pylori: Basic mechanisms to clinical cure. San Diego Marriott. Hotel & Marina, Januar 18–21, р. 43.
- 6. Graham D.Y., Dore M.P. (1998) Causes of variability of antimicrobial efficacy. Helicobacter pylori: Basic mechanisms to clinical cure. San Diego Marriott Hotel & Marina Januar 18–21, р. 45.
- 7. Hant R.N. (1997) Dyspepsia menagement in the year 2000 — a caseillustrated discussion. Europ. J. Clin. Res., 9: 99–103.
- 8. Helicobacter pylori. Basic Mechnisms to Clinical Cure (1994) Ed. R.N. Hant, GNJ Tytgat Kluwer Academic Publishers Lancaster, UK, 612 р.
- 9. Hulst R.W.M., Keller J., Rauws E.A.J., Tytgat G.N.J. (1996) Treatment of Helicobacter pylori infection: A Review of World Lierature. Helicobacter, 1(1): 6–19.
- 10. Lam S.K., Talley N.J. (1998) Helicobacter pylori consensus: Report of the 1997 Asia Pacific Consensus Conference on the menegement of Helicobacter pylori infection. J. Gastroenterol. Hepatol., 13: 1–12.
- 11. Lee A., Medraud F. (1996) Helicobacter pylori: techniques for clinical diagnosis and basic reseach., 20–21.
- 12. Ling T.K.W., Cheng A.F.B., Sung J.J.Y. et al. (1996) An increase in Helicobacter pylori straint resistant to metronidasole:
- 13. A five-year study. Helicobacter, 1: 57–61.
- 14. Medraud F., Cayla R., Lamouliatte H., Bouchard S. (1994) Darmaillac Surveillance or Helicobacter pylori resistance to macrolides and nitroimidasole compounds at a national level (abstract). Amer. J. Gastroenterol., 89: 1368.
- 15. Medraud F. (1995) Rationale for the choice of antibiotics for the eradication Helicobacter pylori. Eurор. J. Gastroenterol., 1: 49–54.
- 16. National Institute of Health (1994) Consensus conference Helicobacter pylori in peptic ulcer disease. J.A.M.A., 272: 65–69.
- 17. Noach L., Tytgat G. (1994) Helicobacter pylori infection. Aspects of pathogenesis and therapy. Amsterdam, 165 p.
- 18. Pathogenesis and Host Response in Helicobacter pylori Infection Edited by Anthony P. Moran, Colm A. O’Morain (1997) NORMED, Bad Homburg, Verl., p. 230–241.
- 19. Pounder R.E., Williams M.P. (1997) The treatment of Helicobacter pylori infection. Alimentary Pharmacology & Therapeutics. Apr, 11( 1): 35–41.
- 20. The European Helicobacter pylori Study Group (1997) Current European concepts in the management of Helicobacter pylori infection: The Maastricht Consensus Report. Gut, 41: 8–13.
- 21. Tytgat G.N.J. (1998) Treatment of Peptic Ulcer. Digestion, 59: 446–452.
- 22. Vautier G. (1997) Scott BBA one-week quadruple eradication regimen for Helicobacter pylori in routine clinical practice. Aliment Pharmacol Ther Feb, 11(1): 107–108.
- 23. Versalovic J., Kibler K., Smell S., Graham D.Y., Go M.F. (1995) Mutation in 23 S ribosomal RNA confer claritromycin resistance in Helicobacter pylori. Gut, 37(1): A67.
Фадеенко Галина Дмитріївна
Резюме. У статті на підставі багаторічного досвіду та аналізу сучасної літератури наведені причини розвитку первинної та вторинної резистентності Helicobacter pylori до антибактеріальних препаратів, що застосовуються. Висвітлені можливі шляхи подолання розвитку резистентності Helicobacter pylori до антибактеріальних препаратів, засоби знищення бактерій.
Ключові слова:Helicobacter pylori, резистентність, антигелікобактерна терапiя
Fadeуenko Galina D
Summary. Based on many years experience and analysis of modern literature the reasons of development of primary and secondary Helicobacter рylori resistance to the applied antibacterial preparations are presented. Possible ways of development overcoming of Helicobacter рylori resistance to antibacterial preparations as well as bacterias elimination are reflected.
Key words: Helicobacter pylori, resistance, antihelicobacter therapy
Инфекция H. pylori: ACG обновляет Рекомендации по лечению — Практическое руководство
Ключевые моменты практики
• Тестирование на Helicobacter pylori показано при определенных состояниях, таких как язвенная болезнь, и его следует лечить у любого пациента с положительным результатом теста.
• Пациентов следует спросить о предыдущем воздействии антибиотиков, чтобы помочь составить схему лечения и избежать неудач из-за резистентности.
• Для определения успеха лечения следует использовать дыхательный тест на мочевину, анализ фекальных антигенов или биопсию.
От редакции AFP
Инфекция Helicobacter pylori — одна из наиболее распространенных хронических бактериальных инфекций. Американский колледж гастроэнтерологии (ACG) обновил свои клинические рекомендации в ответ на значительные научные достижения в лечении этого заболевания.
Поскольку в Северной Америке (определенных в данном руководстве как Соединенные Штаты и Канада) отсутствуют рандомизированные контролируемые испытания, оценивающие современные схемы лечения, рекомендации ACG в основном основываются на данных клинических испытаний, полученных в других частях мира.Эти лечебные рекомендации основаны на ряде вопросов.
Что известно об эпидемиологии инфекции H. pylori в Северной Америке? Какие группы риска?
Инфекция H. pylori обычно возникает в детстве, хотя способы заражения неясны. Факторы риска включают низкий социально-экономический статус; увеличение количества братьев и сестер; и наличие инфицированного родителя, особенно матери. Заболеваемость и распространенность заболевания обычно выше среди лиц, родившихся за пределами Северной Америки.В Северной Америке это чаще встречается у иммигрантов и в определенных расовых группах. (в целом распространенность среди неиспаноязычных белых ниже, чем среди других групп, таких как чернокожие, латиноамериканцы, коренные американцы и коренные жители Аляски).
Каковы показания для тестирования и лечения H. pylori?
Некоторым пациентам показано обследование на H. pylori. Любой пациент с положительным результатом теста на инфекцию H. pylori должен получить лечение.
Все пациенты с активной или ранее перенесенной язвенной болезнью должны быть проверены на H.pylori, если нет документации о том, что инфекция была ранее излечена. Пациенты с лимфомой лимфоидной ткани, ассоциированной со слизистой оболочкой желудка низкой степени злокачественности, или с анамнезом эндоскопической резекции раннего рака желудка также должны быть обследованы. Тестирование у пациентов с гастроэзофагеальной рефлюксной болезнью не рекомендуется, если у пациента в анамнезе нет язвенной болезни или диспепсии. Если при обследовании пациента с гастроэзофагеальной рефлюксной болезнью обнаруживается инфекция H. pylori, следует предлагать лечение с учетом того, что симптомы гастроэзофагеальной рефлюксной болезни вряд ли улучшатся.
Основываясь на доказательствах низкого качества, ACG также рекомендует тестирование тем, кто начинает длительную терапию нестероидными противовоспалительными препаратами, пациентам с необъяснимой железодефицитной анемией и взрослым с идиопатической тромбоцитопенической пурпурой.
В идеале для диагностики инфекции H. pylori следует использовать тесты для выявления активной инфекции, такие как дыхательный тест на мочевину, тест на фекальный антиген или эндоскопическая биопсия. Однако, поскольку предварительная вероятность заражения выше у пациентов с документально подтвержденной язвенной болезнью, у этих пациентов приемлемо тестирование на антитела к иммуноглобулину G.Неэндоскопическое обследование — это вариант у пациентов моложе 60 лет с неисследованной диспепсией без красных флажков. Если у пациентов с диспепсией используется эндоскопия, следует выполнить биопсию желудка.
Недостаточно доказательств, чтобы дать рекомендации относительно тестирования и лечения бессимптомных пациентов с семейным анамнезом рака желудка или пациентов с лимфоцитарным гастритом, гиперпластическими полипами желудка или гиперемезисом беременных.
Каковы научно обоснованные стратегии лечения первой линии для врачей в Северной Америке?
H.pylori обычно лечат комбинацией антибиотиков и ингибитора протонной помпы (ИПП). Пациентов следует спросить о предыдущем приеме антибиотиков, чтобы помочь составить схему лечения. Не существует схемы со 100% излечением от инфекции H. pylori, и очень мало схем с коэффициентом излечения 90%, если таковые вообще имеются. Авторы использовали рекомендованные и предложенные термины, чтобы выразить свои предпочтения.
РЕКОМЕНДУЕТСЯ
Тройная терапия кларитромицином состоит из ИПП, кларитромицина (биаксина) и амоксициллина или метронидазола (флагил) в течение 14 дней.Эффект устойчивости H. pylori к кларитромицину хорошо задокументирован. Следует избегать применения кларитромицина в местах, где резистентность превышает 15%, а также у пациентов, ранее подвергавшихся воздействию макролидов.
Квадратная терапия висмутом состоит из ИПП, висмута, тетрациклина и нитроимидазола в течение 10–14 дней. Это может быть особенно хорошим вариантом для пациентов, подвергшихся воздействию макролидов или страдающих аллергией на пенициллин. Хотя резистентность к метронидазолу влияет на эффективность этого режима, она не так сильна, как тройная терапия кларитромицином.Четырехкратную терапию висмутом следует строго рассматривать как терапию первой линии при высокой резистентности к кларитромицину или у пациентов, ранее подвергавшихся воздействию макролидов.
Сопутствующая терапия включает ИПП, кларитромицин, амоксициллин и нитроимидазол (тинидазол [Тиндамакс] или метронидазол) в течение 10–14 дней. Эта схема является многообещающим вариантом, который, как показали международные исследования, не менее эффективен, чем тройная терапия кларитромицином с аналогичной переносимостью.Ограниченные данные показывают, что эффекты устойчивости к кларитромицину при этой схеме меньше, чем при тройной терапии кларитромицином. Продолжительность от 10 до 14 дней кажется подходящей, хотя исследования для оценки того, улучшает ли эрадикацию продление терапии до 14 дней, продолжаются.
ПРЕДЛАГАЕМЫЙ
Последовательная терапия состоит из ИПП и амоксициллина в течение пяти-семи дней, а затем ИПП, кларитромицина и нитроимидазола в течение пяти-семи дней. Хотя 10 дней последовательной терапии, по-видимому, являются жизнеспособной альтернативой 14-дневной тройной терапии кларитромицином, 10 дней последовательной терапии не превосходят 14 дней тройной терапии кларитромицином.Продление последовательной терапии до 14 дней может улучшить показатели эрадикации, но необходимы дополнительные исследования. Сложность последовательной терапии может ограничивать ее использование.
Гибридная терапия, нечто среднее между последовательной и сопутствующей терапией, состоит из ИПП и амоксициллина в течение семи дней, за которыми следуют ИПП, амоксициллин, кларитромицин и нитроимидазол в течение семи дней. Эта схема является многообещающим вариантом, который, как показали международные исследования, не менее эффективен, чем тройная терапия кларитромицином с аналогичной переносимостью.Хотя рандомизированные контролируемые испытания показали, что гибридная терапия похожа на сопутствующую терапию, сложность гибридной терапии может ограничивать ее использование.
Тройная терапия левофлоксацином состоит из ИПП, левофлоксацина (левакина) и амоксициллина в течение 10–14 дней. Левофлоксацин — это фторхинолон, обладающий антимикробной активностью in vitro в отношении грамположительных и грамотрицательных бактерий, включая H. pylori. Немногочисленные имеющиеся данные позволяют предположить, что устойчивость к фторхинолонам может быть такой же, если не выше, чем устойчивость к кларитромицину в Северной Америке.Также отсутствуют данные о влиянии устойчивости к фторхинолонам на лечение. Тройная терапия левофлоксацином в течение 10–14 дней представляется сопоставимой альтернативой тройной терапии кларитромицином. Лучшими вариантами, по-видимому, являются последовательная терапия фторхинолоном (ИПП и амоксициллин в течение пяти-семи дней, затем ИПП, фторхинолон и нитроимидазол в течение пяти-семи дней) или терапия НАГРУЗКОЙ (левофлоксацин, омепразол [Прилосек], нитазоксанид [ Алиния] и доксициклин в течение 7-10 дней).
Какие факторы предсказывают успешную ликвидацию при лечении инфекции H. pylori?
Факторы успеха могут быть связаны с факторами пациента или с инфекцией. Основными детерминантами являются выбор режима, приверженность пациента режиму приема нескольких лекарственных препаратов с частыми побочными эффектами и чувствительность штамма H. pylori к комбинации используемых антибиотиков. Количество доз в день и тяжесть побочных эффектов влияют на приверженность лечению. Перед тем, как начать лечение, врачи должны обсудить преимущества и проблемы терапии.Другие факторы пациента, такие как курение сигарет, сахарный диабет и генетика, также могут играть роль в неэффективности лечения.
Из факторов, связанных с инфекцией, чувствительность к антибиотикам оказалась наиболее важным фактором успеха лечения в клинических испытаниях и популяционных исследованиях. Устойчивость к кларитромицину, метронидазолу и левофлоксацину ограничивает их эффективность и увеличивает распространенность инфекции H. pylori. Устойчивость к амоксициллину, тетрациклину и рифабутину (микобутину) встречается редко.
Что мы знаем об устойчивости к противомикробным препаратам H. pylori в Северной Америке? Какие методы можно использовать для оценки устойчивости и когда их следует использовать?
Данных о сопротивлении немного. Необходимы дополнительные исследования для определения местных, региональных и национальных моделей устойчивости H. pylori к антибиотикам, которые помогут выбрать схему лечения.
Устойчивость можно оценить с помощью культурального или молекулярного тестирования; однако эти методы не широко доступны в Соединенных Штатах.Тестирование посредством посева сложно выполнить и занимает несколько дней. В случае успеха методы культивирования включают разбавление в агаре, дисковую диффузию и Е-тест. Молекулярные тесты, такие как полимеразная цепная реакция или гибридизация флуоресцентно меченых нуклеиновых кислот, являются более быстрой и простой альтернативой культивированию. Однако молекулярное тестирование на устойчивость к H. pylori в настоящее время не одобрено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США.
Отсутствие знаний об устойчивости к H. pylori в Соединенных Штатах резко контрастирует с другими частями мира, создавая препятствия для рекомендаций по лечению, основанных на фактических данных.
Должны ли мы тестировать на успех лечения после эрадикационной терапии H. pylori?
Поскольку эффективность эрадикационной терапии H. pylori снижается, после лечения нередко возникает хроническая инфекция. Для определения успеха лечения следует использовать дыхательный тест на мочевину, анализ фекальных антигенов или биопсию. Тестирование следует проводить как минимум через четыре недели после завершения антибактериальной терапии и после того, как лечение ИПП было прекращено на одну-две недели. Хотя рекомендация по посттестированию интуитивно понятна, научных доказательств рентабельности такого тестирования нет, за исключением сценария кровотечения из пептических язв.
В случае неудачи терапии первой линии, каковы варианты терапии спасения?
Если инфекция сохраняется после лечения, следует избегать применения тех же антибиотиков при повторном лечении пациента. Режимы четырехкратной терапии висмутом или левофлоксацина предпочтительны для пациентов, которые первоначально получали режим, содержащий кларитромицин. Схема, содержащая кларитромицин или левофлоксацин, предпочтительна для пациентов, которые первоначально получали четырехкратную терапию висмутом. При выборе терапии спасения следует учитывать данные о местной устойчивости к противомикробным препаратам и предыдущее воздействие антибиотиков на пациента.Как и терапия первой линии, рекомендации ACG по спасательной терапии основаны на эмпирическом отборе, а не на результатах культурального исследования и тестирования чувствительности к противомикробным препаратам.
Четырехкратная терапия висмутом (ИПП, висмут, тетрациклин, метронидазол) в течение 14 дней или тройная терапия левофлоксацином (ИПП, левофлоксацин, амоксициллин) в течение 14 дней являются рекомендуемыми режимами спасения. Другие предлагаемые схемы включают сопутствующую терапию (ИПП, кларитромицин, амоксициллин, нитроимидазол) в течение 10-14 дней, тройную терапию рифабутином (ИПП, амоксициллин и рифабутин) в течение 10 дней и двойную терапию высокими дозами (ИПП и амоксициллин) в течение 14 дней. .Тройная терапия кларитромицином не рекомендуется для терапии спасения.
Когда следует рассмотреть возможность проведения теста на аллергию на пенициллин у пациентов с инфекцией H. pylori?
Амоксициллин — важный компонент схем лечения H. pylori. Однако есть альтернативы, которые не включают амоксициллин, в первую очередь четырехкратная терапия висмутом. Тест на аллергию может быть рассмотрен после одного или двух неудачных попыток терапии первой линии. Чаще всего исключается истинная аллергия на пенициллин, и можно безопасно начинать терапию, содержащую амоксициллин.
Источник рекомендаций: Американский колледж гастроэнтерологии
Используется ли система оценки доказательств? Да
Описан систематический поиск литературы? Да
Руководство разработано участниками, не имеющими финансовых связей с промышленностью? №
Рекомендации, основанные на результатах, ориентированных на пациента? Да
Опубликованный источник: Am J Gastroenterol. Февраль 2017 г .; 112 (2): 212–239
Доступно по адресу: https://www.nature.com/ajg/journal/v112/n2/full/ajg2016563a.html [требуется вход в систему]
Текущее и будущее лечение инфекций Helicobacter pylori
Adv Exp Med Biol. Авторская рукопись; доступно в PMC 2020 1 января.
Опубликован в окончательной отредактированной форме:
PMCID: PMC6
4NIHMSID: NIHMS1061742
Хироши Мацумото
Отделение гастроэнтерологии, Отделение внутренней медицины, Медицинская школа города Кавасаки Префектура Окаяма, Япония
Акико Сиотани
Отделение гастроэнтерологии, Отделение внутренней медицины, Медицинская школа Кавасаки, город Курашики, префектура Окаяма, Япония
Дэвид Ю.Грэм
Майкл Э. Дебейки Медицинский центр VA и Медицинский колледж Бейлора, Хьюстон, Техас, США
Хироши Мацумото, Отделение гастроэнтерологии, Отделение внутренней медицины, Медицинская школа Кавасаки, Город Курашики, префектура Окаяма, Япония;
Окончательная отредактированная версия этой статьи издателя доступна на сайте Adv Exp Med Biol. См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Helicobacter pylori — один из наиболее распространенных патогенов человека, и, по оценкам, в настоящее время инфицировано около 50% населения мира.В настоящее время консенсус состоит в том, что, если нет веских причин, следует вылечить все инфекций H. pylori . С 1990-х годов были опубликованы и периодически обновлялись различные национальные и международные руководства по лечению заболеваний, связанных с H. pylori , в отношении показаний к лечению, диагностических процедур и предпочтительных схем лечения. Большинство руководств предоставляют сложные мета-анализы, изучающие результаты различных схем лечения, проводимых в регионах с переменными, часто высокими показателями устойчивости к антибиотикам, для которых распространенность и эффекты устойчивости часто игнорировались.Хотя успешная противомикробная терапия должна быть основана на чувствительности, повышение устойчивости к противомикробным препаратам и общая недоступность тестирования на чувствительность заставили клиницистов в основном полагаться на эмпирические схемы. Устойчивость к антибиотикам H. pylori достигла угрожающе высокого уровня во всем мире, что влияет на эффективность лечения. Рекомендации должны предусматривать режимы для инфекций с множественной устойчивостью или для тех, для которых тестирование на чувствительность недоступно или отказано.Первое правило — использовать только проверенные местные эффективные методы лечения. Из-за непереносимости пациентов, аллергии на лекарства и местного опыта у врачей должно быть как минимум два варианта терапии первой линии. Как и в случае любой противомикробной терапии, тщательный анализ предшествующего использования антибиотиков неоценим для определения наличия вероятной резистентности. Второй ключ — это информирование пациентов о потенциальных и ожидаемых побочных эффектах, а также о важности завершения курса антибиотиков. Мы также рассматриваем здесь тройную терапию, последовательную сопутствующую терапию, гибридную терапию, терапию висмутом, двойную терапию, фонопразан, современные методы лечения антибиотиками, пробиотики и вакцинацию.
Ключевые слова: Helicobacter pylori , тройная терапия, последовательная терапия, сопутствующая терапия, вонопразан
1. Введение
Helicobacter pylori — грамотрицательная спиралевидная бактерия и патоген человека. Инфекция H. pylori вызывает воспаление желудка и связанные с ним заболевания: язвенную болезнь, рак желудка, лимфому, ассоциированную со слизистой оболочкой, лимфоидную ткань (MALT) и множество других состояний, таких как дефицит витамина B12, дефицит железа и идиопатическая тромбоцитопения (Malfertheiner et al. al.2012). H. pylori — один из наиболее распространенных патогенов человека, и, по оценкам, в настоящее время инфицировано около 50% населения мира (Williams and Pounder 1999). Однако существуют существенные географические различия в распространенности инфекции, наиболее часто встречающиеся в развивающихся странах и нечастые в странах с развитой экономикой (Hunt et al. 2011). Проживание или рождение в развивающейся стране и низкий социально-экономический статус связаны с повышенным риском заражения H.pylori (Bastos et al.2013; Брюс и Маарус 2008). Люди являются основным хозяином, и передача требует контакта с инфицированным человеком либо напрямую, либо через зараженную пищу или воду. Передача обычно происходит в семье и чаще всего в детстве. Улучшение домашней гигиены и условий жизни сокращает передачу, и такие улучшения, вероятно, являются наиболее важными факторами в снижении распространенности инфекции H. pylori во всем мире (Vale and Vitor 2010).Снижение передачи среди детей привело к появлению ряда возрастных когорт с распространенностью инфекции в возрасте 20 лет, как правило, описывающей распространенность в течение всей жизни для этой возрастной когорты (Bastos et al. 2013; Fujimoto et al. 2007). Даже в Европе распространенность H. pylori колеблется от 11% в Швеции до 60% в Испании (Hunt et al. 2011; Sanchez Ceballos et al. 2007). Сообщается, что в Китае распространенность H. pylori достигает 83%, но в большинстве регионов она быстро снижается (Zhang et al.2014). В США перекрестные исследования участников Национального исследования здоровья и питания (NHANES) III и NHANES 1999–2000 показали общую серопозитивность примерно 30%, что было аналогично распространенности в Канаде (Chen and Blaser 2012 ). В Японии наблюдается постепенное и быстрое снижение распространенности H. pylori , что отражается в общем снижении с 75% в 1970-х годах до 35% к 2010 году (Kamada et al. 2015). Инфекция становится все более редкой среди японских детей с общей распространенностью <4% и падением.
1.1.
H. pylori как бактериальная инфекцияH. pylori инфекция является бактериальной инфекцией, и было показано, что ее рост и выживаемость зависят от множества противомикробных препаратов. Однако чувствительность in vitro и не позволяет надежно предсказать эффективность in vivo , а противомикробное лечение H. pylori оказалось более сложным, чем лечение других распространенных инфекций, таких как бактериальная пневмония, отчасти потому, что H.pylori находится в желудке человека. Желудок представляет собой враждебную среду, поскольку он кислый, и для того, чтобы быть эффективным, большинству антибиотиков требуется нейтральная или почти нейтральная среда. H. pylori также можно обнаружить глубоко в слизистой оболочке и даже в эпителиальных клетках желудка (Kwok et al. 2002). Этот широкий диапазон сред затрудняет доставку активных противомикробных препаратов, чтобы гарантировать уничтожение всех организмов. Другие проблемы были вызваны врачами, поскольку большинство схем было разработано с использованием подхода проб и ошибок, а не систематической стратегии.
Как и в случае со всеми противомикробными препаратами, успех лечения зависит от деталей терапии, включая: чувствительность, дозы, составы, частоту дозирования в зависимости от приема пищи, использование адъювантов, таких как антисекреторные препараты, антациды или пробиотики, а также продолжительность лечения. Некоторые из этих важных факторов были подвергнуты детальной клинической оценке, и оптимальные схемы лечения все еще остаются неизвестными. Эффективность некоторых схем также может варьироваться в зависимости от различий между хозяевами, например, полиморфизм фермента, метаболизирующего лекарственные средства, такого как цитохром P450 2C9 (CYP2C19), может сильно повлиять на эффективность (Yang and Lin 2010).
2. История лечения
H. pyloriРанние эксперименты показали, что, хотя H. pylori был восприимчивым in vitro ко многим противомикробным препаратам, только некоторые оказались полезными in vivo . Первая эффективная схема, определенная как надежно способная обеспечить уровень излечения> 90%, представляла собой тройную терапию в основном кислотно-независимыми противомикробными препаратами: висмут, метронидазол (MTZ) и тетрациклин (Graham and Lee 2015). Вскоре было обнаружено, что его эффективность заметно снижается из-за устойчивости к MTZ, и эту проблему можно частично или полностью преодолеть, увеличив дозировку MTZ до 1.5 г или больше и добавление ингибитора протонной помпы (ИПП). Эти изменения привели к появлению четырехкратной терапии, теперь обычно называемой четырехкратной терапией висмутом. При применении в течение 5-7 дней он оказался высокоэффективным при инфекциях, чувствительных к MTZ, но при наличии резистентности потребовалась 14-дневная терапия. Вторая широко используемая схема, которая будет введена, включала pH-чувствительные агенты амоксициллин (AMX) и кларитромицин (CLR), а также ИПП, вводимые два раза в день. Чтобы быть эффективными, эти чувствительные к pH антибиотики требуют размножения бактерий.Описаны эффективные схемы с использованием 200–500 мг CLR два раза в день. Как четырехкратная терапия висмутом, так и терапия CAM могут надежно обеспечить 95% или более высокий уровень излечения у восприимчивых инфекций и приверженных пациентов (Hsu et al., 2017; Macias-Garcia et al., 2018).
Благодаря удобству, переносимости и обширной маркетинговой поддержке со стороны Pharma тройная терапия CLR стала и остается одной из наиболее широко назначаемых схем лечения во всем мире. Наилучшие результаты дает 14-дневная терапия.Однако для получения маркетинговых преимуществ фармацевтические компании ввели более короткую тройную терапию CLR (7 или 10 вместо 14 дней), что, как правило, было связано со снижением показателей излечения с> 95% до между 88% и 94% соответственно. Это снижение было частично скрыто увеличением устойчивости к CLR, что быстро подрывало эффективность режима (Thung et al., 2016). В отличие от устойчивости к MTZ, устойчивость к CLR является полной или нулевой, что означает, что наличие устойчивости к CLR эффективно снижает схему приема трех препаратов до только AMX и PPI, что при введенных дозах привело к общему заметному снижению показателей излечения.Быстрый рост устойчивости к CLR был очевидным эффектом, связанным с широким использованием макролидов во всем мире для лечения респираторных инфекций. К 2000 г. частота излечения H. pylori с CLR часто составляла от 70% до 75%. Однако во многих странах этот режим был единственным одобренным, и у врачей оставалось мало вариантов. Руководства по лечению из различных групп и стран продолжали рекомендовать кратковременную тройную терапию CLR еще долгое время после того, как показатель излечения стал неприемлемо низким. В 2012 году руководство Маастрихт IV (Malfertheiner et al.2012) рекомендовал не использовать CLR, если распространенность резистентности составляла 15% или выше, но, поскольку клиницисты не имели доступа к данным о местных показателях резистентности, это не привело к снижению постоянной популярности и использования этой устаревшей схемы.
2.1. Устойчивость к антибиотикам
По крайней мере с 2000 года уровень эрадикации H. pylori снижался из-за повышения устойчивости к одному или нескольким антибиотикам (Grad et al.2012; Graham and Fischbach 2010; Malfertheiner et al.2012; Savoldi et al. 2018; Selgrad и Malfertheiner 2011). Всемирная организация здравоохранения сгруппировала данные об устойчивости к противомикробным препаратам по регионам, а среди стран Восточной Азии распространенность устойчивости к CLR высока. Устойчивость к МТЗ низкая только в Японии. Кроме того, высокая распространенность устойчивости к CLR и MTZ признана в Италии, Вьетнаме и Мексике, а также в Китае. В северной Европе обычно наблюдается низкая устойчивость к CLR также из-за ограниченного использования. Распространенность бактериальной устойчивости связана с уровнем потребления этих антибиотиков (Graham 2015; Meyer et al.2002). В ретроспективном обзоре 2017 г., проведенном в Нидерландах, сообщалось о повышении уровня устойчивости к CLR (с 9,8% до 18,1%), MTZ (20,7–23,2%) и AMX (6,3–10%) в течение 10 лет (Ruiter et al., 2017). Первые системные обзоры первичной устойчивости к антибиотикам в Азиатско-Тихоокеанском регионе сообщили о средних показателях устойчивости 17% для CLR, 18% для левофлоксацина и 44% для MTZ. В разных странах наблюдалась значительная неоднородность показателей устойчивости (Kuo et al., 2017). Средняя общая распространенность устойчивости к MTZ составляет 44% (95% доверительный интервал 39–48), варьируясь от 10% в Японии до 84% в Бангладеш и 88% в Непале.
Устойчивость к AMX обычно составляет менее 1% (Megraud 2004), и в целом значительного изменения устойчивости не наблюдалось (Kobayashi et al. 2007). Куо с соавторами (2017) сообщили о средней общей распространенности устойчивости к левофлоксацину 18% (95% ДИ 15–22), от 2% до 3% (Бутан и Малайзия) до 66% в Бангладеш. Анализ подгрупп по периоду сбора показал, что общая резистентность к левофлоксацину увеличилась с 2% (95% ДИ 0–13) до 2000 г. до 27% (95% ДИ 21–34) в течение 2011–2015 гг. При значительной межгрупповой неоднородности.По данным с 2006 по 2015 год, общая распространенность левофлоксацина (21%) была выше, чем в Европе и Латинской Америке. Устойчивость к левофлоксацину со временем увеличивалась во всех включенных странах, по которым были доступны данные. Кроме того, устойчивость к хинолонам находится в диапазоне 20% в Европе, 15% в Америке и 10% в Азии и быстро растет (Liang et al. 2014).
Поскольку устойчивость к левофлоксацину и CLR возросла во всем мире, так что существует лишь несколько областей, где схемы, основанные на CLR или левофлоксацине, все еще эффективны при использовании в качестве эмпирической терапии, и стратегии лечения необходимо будет адаптировать к моделям устойчивости в каждой стране. по странам или регионам (Kuo et al.2017).
2.1.1. Другие виды тройной терапии
Как отмечалось выше, недавний высококачественный метаанализ предполагает, что эффективность как тройной терапии с ИПП, так и AMX плюс CLR или MTZ в настоящее время низкая и клинически неприемлема при назначении в течение 7 дней (70% против 77%) или 14 дней (80% против 84%) (Puig et al., 2016). Из-за увеличения резистентности к CLR левофлоксацин, хинолон широкого спектра действия, был заменен на CLR в тройной терапии. В первоначальных испытаниях использовались 7- и 10-дневные схемы лечения, и они не достигли даже 90% успеха лечения.Впоследствии было обнаружено, что 14-дневный курс лечения оказался весьма успешным и надежным, позволяя достичь уровня эрадикации более 90% в регионах, где местная резистентность к левофлоксацину низкая (Savoldi et al. 2018). Использование хинолонов во всем мире заметно увеличилось, так что фторхинолоны присоединились к CLR и больше не считаются приемлемыми для эмпирической терапии, за исключением нескольких областей, где резистентность все еще остается низкой. Среди хинолонов четвертого поколения (моксифлоксацин, ситафлоксацин и гемифлоксацин) успешным оказался только ситафлоксацин, поскольку он остается эффективным при более высокой минимальной ингибирующей концентрации (МИК), чем другие фторхинолоны (An et al.2018). Таким образом, в регионах, где доступен ситафлоксацин, это единственный хинолон, рекомендованный для эмпирической терапии.
2.1.2. Последовательно-сопутствующие гибридные методы лечения
Существует ряд эмпирически разработанных 4 схем приема лекарств с использованием AMX, CLR, MTZ и PPI. Они названы в зависимости от того, как вводятся лекарства (например, последовательно или все вместе). Все они имеют общие черты: обеспечивают наилучшую скорость излечения при назначении в течение 14 дней и становятся неэффективными из-за наличия двойного CLR и MTZ (Graham et al.2014). Все они функционируют так, как если бы один проводил тройную терапию CLR и тройную терапию MTZ одновременно (то есть MTZ убьет CLR-устойчивые штаммы, а CLR убьет MNZ-устойчивые штаммы, например, что только присутствие штаммов с двойной устойчивостью будет вызвать сбой этого режима). Поскольку одновременный прием всех 4 препаратов всегда дает результаты, эквивалентные или превосходящие результаты других версий, его рекомендуется использовать по сравнению с другими комбинациями с использованием тех же препаратов (например, последовательная терапия). Все эти схемы возникли как эмпирические методы лечения в ответ на неудачную тройную терапию CLR и отсутствие данных о чувствительности.В настоящее время признано, что каждый пролеченный пациент получает один ненужный антибиотик (либо CLR, либо MTZ, а при неудачах — два ненужных антибиотика). Этот режим был рекомендован Маастрихтским V, Американским колледжем гастроэнтерологии и консенсусными конференциями в Торонто без их признания или понимания того, что каждый миллион процедур также будет включать примерно 15 тонн ненужного CLR или MTZ (который на самом деле является потенциальным канцерогеном для человека) (Chey et al 2017; Fallone et al.2016; Malfertheiner et al.2012). Это чрезвычайно высокая цена за неспособность обеспечить программы антимикробного надзора за инфекцией H. pylori (Graham and Shiotani 2008).
2.1.3. Терапия висмутом
Хотя тройная терапия висмутом и впоследствии четырехкратная терапия были введены в начале истории H. pylori , они так и не стали популярными. Проблемы включали внутреннюю сложность, большое количество таблеток, прием четыре раза в день, побочные эффекты, отсутствие поддержки со стороны фармацевтических компаний и, что важно, резко негативные оценки ключевых лидеров общественного мнения, работающих с тройной терапией CLR, которая была более простой и переносимой.Комбинация высоких доз MTZ и высоких доз тетрациклина была связана с высокой частотой побочных эффектов, таких как боль в животе, тошнота и рвота, которые часто приводили к плохому соблюдению режима лечения. Запатентованная капсула «три в одном» (Pylera), содержащая субцитрат висмута, калий, МТЗ и тетрациклин, в США оказалась не лучше. Однако его появление в Европе совпало с потерей поддержки тройной терапии со стороны крупных фармацевтических компаний, что потребовало от ключевых лидеров общественного мнения пересмотреть свои предыдущие возражения, и теперь они сочли Pylera весьма приемлемой.К сожалению, несмотря на то, что все текущие руководящие принципы лечения H. pylori рекомендуют 14-дневную четырехкратную терапию висмутом, в настоящее время Pylera выпускается по 10-дневной схеме. Результирующее снижение показателей излечения от инфекций, устойчивых к MTZ, вероятно, является причиной того, что показатели излечения в Европе очень неоднородны, поскольку они представляют собой объединение группы с очень высокими показателями излечения (то есть для восприимчивых инфекций было достаточно 7 дней) и более низких показателей излечения в с МТЗ-устойчивыми инфекциями.В действительности, 14-дневная тройная терапия MTZ или 7-дневная четырехкратная терапия висмутом были бы лучше переносимыми вариантами для людей с инфекциями, чувствительными к MTZ. Патент на формулу Pylera истекает в декабре 2018 года, и мы надеемся, что другие производители предложат другую упаковку, подходящую для использования различной продолжительности терапии. Другой вариант — прописать дженерики, но их часто трудно получить из-за трудностей с поставкой и доступностью как висмута или тетрациклина в Европе, так и тетрациклина в США.
2.2. Альтернативная четырехкомпонентная терапия висмутом
Висмутсодержащая четырехкомпонентная терапия рекомендована действующими европейскими, американскими, канадскими и китайскими руководящими принципами (Chey et al., 2017; Fallone et al., 2016; Liu et al., 2018; Malfertheiner et al., 2017). Висмут является аддитивным, добавляя 20-25% к результату других компонентов четырехкратного режима (Graham et al. 2018). В Китае были разработаны различные высокоэффективные четырехкомпонентные препараты висмута, которые эффективны, несмотря на резистентность к MTZ.Большинство используют ИПП дважды в день, висмут 220 мг два раза в день, вместе с тетрациклином 500 мг четыре раза в день и либо AMX 1 г три раза в день, либо MTZ 400 или 500 мг четыре раза в день в течение 14 дней (Chen et al. др. 2018; Доре и др. 2016; Чжан и др. 2015). В качестве альтернативы, AMX 1 г три раза в день использовался для замены тетрациклина в областях, где тетрациклин трудно получить. Эти схемы оказались хорошо переносимыми и оказались весьма успешными для четверной терапии.
2.3. Двойная терапия
Двойная терапия AMX и PPI изучается с 1989 года и в некоторых случаях доказала свою высокую эффективность (Unge et al.1989; обзор Dore et al. 1998). Группа, в которой он кажется наиболее эффективным, — это люди с низкой секрецией кислоты (например, со значительным гастритом тела). Режим, одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA): 60 мг лансопразола три раза в день и AMPC 1 г три раза в день в течение 14 дней с показателем излечения от 60% до 70% (Dore et al. 1998; Laine et al. 1998; Унге и др. 1989). Некоторые недавние исследования на Тайване оказались успешными, тогда как другие исследования в Китае — нет (Graham et al.2017; Ян и др. 2015; Ян и др. 2011). Основным препятствием, которое необходимо преодолеть, по-видимому, является трудность получения и поддержания внутрижелудочного pH на уровне 6 или выше. Это практически невозможно с традиционными ИПП, за исключением наличия значительного воспаления тела (Graham and Tansel 2018). Тем не менее, этого можно добиться с помощью новейшего типа ИПП, блокатора калий-конкурентной кислоты (P-CAB), хотя дозу, частоту и продолжительность приема еще предстоит установить (Graham and Dore 2018).Ранние исследования показывают, что это станет возможным при 14-дневной терапии и 1 мг AMX три раза в день или 500-750 мг четыре раза в день.
AMX считается зависимым от времени антибиотиком, который быстро всасывается в плазму, но выводится через 6-8 часов после приема (Barbhaiya et al. 1979). Дозировка 500-750 мг за 6 часов по сравнению с 1000 мг два раза в день с большей вероятностью будет поддерживать более высокую концентрацию AMX в плазме. Бактерицидный эффект AMX против H. pylori также зависит от pH, поскольку AMX более стабилен при более высоком внутрижелудочном pH (Furuta et al.2007). Более того, H. pylori реплицируется, когда внутрижелудочный pH увеличивается до более чем 6, и, таким образом, становится восприимчивым к AMX. Напротив, бактерии переходят в нерепликативное, но жизнеспособное состояние, когда pH меньше 6 (Scott et al. 1998). Более высокая доза ИПП увеличивает антимикробную эффективность за счет поддержания высокого уровня pH, а также улучшает стабильность и биодоступность AMX в желудочном соке (Erah et al. 1997).
Kwack и соавторы (2016) сообщили о высоких дозах ИПП, лиапразола (80 мг в день) и AMX 3000 мг в день в течение 14 дней в качестве терапии первой линии, и показатель излечения составил 79.3%. Мета-анализ двойной терапии в качестве спасательной терапии для H. pylori по сравнению с другими методами спасения показал, что показатели эрадикации были почти такими же, 81,3% против 81,5% (Gao et al., 2016). Частота комплаентности и побочных эффектов также была такой же, как и у других, поэтому в некоторых руководствах этот режим рекомендуется в качестве спасательного лечения.
2.3.1. Vonoprazan
Как отмечалось выше, vonoprazan — это новый P-CAB. На ингибирующий эффект (pKa 9,4) в значительной степени не влияет pH окружающей среды, и он накапливается в париетальных клетках как в условиях секретирования, так и в условиях покоя (Hori et al.2011). ИПП требует 3 или более дней для достижения полной антисекреторной эффективности, тогда как фонопразан, по сути, достигает полной эффективности в первый день. Вонопразан в настоящее время одобрен в Японии для эрадикации первой линии H. pylori с помощью тройной терапии, содержащей CLR, и для терапии второй линии с помощью MTZ и AMX (Murakami et al., 2016). В основном исследовании при CLR-чувствительных инфекциях и лансопразол, и вонопразан, содержащие тройную терапию CLR, вылечили почти 100% из H.pylori (Мураками и др., 2013). Напротив, для штаммов, устойчивых к CLR, полученные в результате двойные терапии (фонопразан или лансопразол плюс AMX) заметно отличались: лансопразол-AMX излечивал 40% и фонопразан-AMX излечивал 80% (Murakami et al., 2016). Таким образом, в сравнительном исследовании при наличии резистентности к CLR тройная терапия, содержащая фонопразан, «окажется» лучше тройной терапии лансопразолом (Jung et al., 2017). Однако с точки зрения злоупотребления противомикробными препаратами, поскольку 80% тех, кто получал CLR, были бы излечены, если бы CLR не применялся, этот режим использует около 3000 кг ненужного CLR на миллион пролеченных случаев.Ясно, что японское правительство должно переосмыслить использование фонопразана в тройной терапии CLR. ()
Таблица 1
Лекарственное средство, обычно используемое для искоренения H. pylori a
| Амоксициллин | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Висмут (субцитрат субсалицилата) | макролициндаМетронидазол / тинидазол | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тетрациклин HCl | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фторхинолоны (левофлоксацин) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рифабутин | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лечение | Лекарства, дозировки и продолжительность | |||
|---|---|---|---|---|
| Чувствительность | аллергия на лекарство тройная терапия (чувствительна к кларитромицину) | Амоксициллин (1 г) и кларитромицин (500 мг) плюс ИПП, все принимаемые дважды в день в течение 14 дней (эквивалент 40 мг омепразола на дозу) | ||
| Тройная терапия метронидазолом (чувствительность к метронидазолу) | Амоксициллин (1 г) и метронидазол или тинидазол (500 мг) плюс ИПП, все вводимые дважды в день в течение 14 дней (эквивалент 40 мг омепразола на дозу) | |||
| Тройная терапия фторхинолоном (чувствительна к фторхинолонам) | Фторхинолон (эорохинолон) .грамм. левофлоксацин 500 мг один раз в сутки), плюс ИПП и амоксициллин 1 г два раза в день в течение 14 дней (эквивалент 40 мг омепразола на дозу) | |||
| На основе чувствительности | Аллергия на пенициллин | |||
| Кларитромицин (500 мг) и метронидазол или тинидазол (500 мг) плюс ИПП (эквивалент 40 мг омепразола на дозу) все вводятся дважды в день в течение 14 дней | ||||
| Устойчив к кларитромицину и / или метронидазолу | четырехкратная терапия (см. тестирование чувствительности недоступно ) | |||
| эмпирическая терапия | тестирование чувствительности недоступно | |||
| четырехкратная терапия висмутом после двухразового приема пищи или тетрациклиновой кислоты 2 раза в день | субцитрацит 4 раза в день или 2 таблетки висмута субцитрацизма гидрохлорид (500 мг) 4 раза в день во время еды и перед сном плюс метронидазол (400 или 500 мг) 4 раза в день во время еды и ИПП 2 раза в день в течение 14 дней. | |||
| Готовая четырехкратная терапия висмутом | PYLERA в течение 14 дней; добавить PPI b.i.d. (Эквивалент 20-40 мг омепразола два раза в день) | |||
| Новая четырехкратная терапия висмутом (амоксициллин заменяет тетрациклин) | Висмут 2 таблетки 2 или 4 раза в день после еды плюс метронидазол (400 или 500 мг) четыре раза в день во время еды и амоксициллин по 1 г три раза в день вместе с ИПП (эквивалент 40 мг омепразола или более два раза в день) в течение 14 дней. | |||
| Новая четырехкратная терапия висмутом (амоксициллин заменяет метронидазол) | Висмут 2 таблетки 2 или 4 раза в день после еды плюс 500 мг тетрациклина HCl 4 раза в день во время еды и амоксициллин 1 г 3 раза в день вместе с ИПП (омепразол 40 мг эквивалент или более два раза в день) в течение 14 дней. | |||
| Четырехкратная терапия фуразолидоном | Терапия фуразолидоном достигается путем замены метронидазола в четырехкратной терапии висмута на фуразолидон 100 мг три раза в день | |||
| Эмпирические вероятные эффективные схемы | тройной R 150 мг один или два раза в день), амоксициллин (1 г три раза в день и омепразол 40 мг (или эквивалентный ИПП) каждые 8 часов в течение 14 дней. | |||
| Рифабутин-висмутовая терапия | Добавить субцитрат или субсалицилат висмута по 2 таблетки два раза в день к вышеуказанной терапии | |||
| Экспериментальные схемы | ||||
| Двойная терапия вонопразан-амоксициллин | Вонопразан, конкурентный калий блокатор кислоты: 20 мг два раза в день плюс 500-750 мг амоксициллина каждые 6 часов в течение 14 дней. | |||
| Устаревшие схемы | Последовательная, гибридная, сопутствующая терапия, эмпирическое использование тройной терапии |
Был опубликован ряд недавних крупных консенсусных конференций (Chey et al., 2017; El-Serag al.2018; Fallone et al.2016; Liu et al.2018; Mahachai et al.2018; Malfertheiner et al.2017; Sugano et al.2015). Киотский консенсус включал обозначение гастрита H. pylori как инфекционное заболевание с рекомендациями лечения для всех H.pylori инфицированных субъектов. Это было первым, кто систематизировал очевидную смену парадигмы, призывающую к тому, чтобы лечение больше не предназначалось для пациентов с клиническими проявлениями инфекции. За этим последовал Хьюстонский консенсус по диагностике инфекции H. pylori , который обновил показания для рассмотрения диагностического тестирования (El-Serag et al.2018). Все недавние консенсусные конференции признали проблему увеличения резистентности и неэффективности обычно назначаемых схем.Однако большинство из них не затрагивает такие вопросы, как рациональное использование антибиотиков, контроль противомикробных препаратов, критическая роль тестирования на чувствительность и предоставление обновленных региональных, местных или конкретных данных о восприимчивости для конкретных пациентов. Скорее, в большинстве руководств содержится сложный мета-анализ, изучающий результаты различных схем, проводимых в регионах с переменными, часто высокими показателями устойчивости, для которых распространенность и эффекты устойчивости часто игнорировались (Graham et al., 2017). Этот подход привел к сравнению несравнимых групп, которые не получали оптимальные схемы, а получали схемы, включающие один или несколько противомикробных препаратов, устойчивость к которым была индуцирована H.pylori (Chey et al., 2017; Fallone et al., 2016). Многие сравниваемые схемы оказались очень успешными для лечения приверженных пациенту с восприимчивыми инфекциями, что привело к неприемлемо низким показателям излечения без объяснения причин. В целом, за исключением рекомендации больше не использовать определенные комбинации, большинство выводов имеют ограниченную ценность, поскольку они сформулированы с целью предоставления актуальных рекомендаций.
4. Современный подход к терапии
В некоторых странах существуют ограничения, по которым анти- H.pylori можно использовать. Эти ограничения включают правительственные ограничения на то, какие режимы одобрены для возмещения расходов, и ограничения могут включать лекарства, дозы и продолжительность лечения. В некоторых регионах некоторые обычно рекомендуемые противомикробные и антисекреторные препараты не одобрены для использования (например, висмут, фуразолидон, ситафлоксацин и фонопразан) или дозы могут быть ограничены, что ограничивает диапазон доступных методов лечения. Утвержденные лекарства также могут быть недоступны из-за нехватки или высокой местной стоимости (например,г., тетрациклин в США). Наконец, одобренные схемы могут отличаться от ранее рекомендованных схем. Например, четырехкратный препарат висмута, Pylera, расфасован для 10-дневной терапии, несмотря на рекомендацию, что при наличии устойчивости к MTZ его можно назначать в течение 14 дней. Ни одно из этих ограничений не согласуется с принципами рационального использования противомикробных препаратов, которые включают содействие использованию оптимальных режимов приема лекарств, включая лекарства, дозирование, продолжительность терапии и пути введения, а также принятие мер для обеспечения устойчивого доступа к эффективной терапии ( я.е., чтобы предотвратить развитие резистентности) (Dyar et al., 2017).
5. Рекомендуемые методы лечения
Рациональная противомикробная терапия всегда основана на чувствительности, и регулирующие и государственные органы должны поощряться к созданию программ надзора за резистентностью H. pylori для предоставления обновленных региональных и местных отчетов о распространенности резистентности и руководств по лечению врачам для лучшего лечения своих пациентов. Регулирующие агенты должны одобрять только высокоэффективные методы лечения, которые должны включать данные о эффектах резистентности.Регионам с разными типами восприимчивости к противомикробным препаратам, возможно, потребуется продвигать разные стратегии.
Общая стратегия заключается в использовании терапии на основе чувствительности. Порядок рекомендуемой терапии чувствительных инфекций основан на использовании CLR, во-первых, потому что он имеет самые низкие значения MIC и обычно хорошо переносится. Левофлоксацин используется последним из-за растущих опасений относительно побочных эффектов, отраженных в предупреждениях о черном ящике. В рекомендациях должны быть указаны схемы лечения мультирезистентных инфекций или тех, в которых тестирование на чувствительность недоступно или отказано.
Первое правило — использовать только проверенные местные эффективные методы лечения (то есть те, которые надежно обеспечивают уровень излечения ≥90%, предпочтительно ≥95% для пациентов, соблюдающих терапию). Этот подход основан на противомикробных препаратах, резистентность к которым либо редка (AMX, висмут, тетрациклин, фуразолидон, рифабутин), либо преодолима (MTZ) (). Из-за непереносимости пациентом, аллергии на лекарства и местного опыта у клинициста должно быть как минимум два варианта терапии первой линии. Как и в случае любой противомикробной терапии, тщательный анализ предшествующего использования антибиотиков неоценим для определения наличия вероятной резистентности.Например, предварительное использование макролида или хинолона повышает вероятность устойчивости к кларитромицину и левофлоксацину. Второй ключ — это информирование пациентов о потенциальных и ожидаемых побочных эффектах, а также о важности завершения курса антибиотиков.
Стратегия внедрения в практику терапии на основе чувствительности против H. pylori
В первую очередь следует использовать наиболее переносимые и наиболее эффективные схемы лечения. Для инфекций с множественной лекарственной устойчивостью или в случаях, когда терапия должна быть выбрана эмпирически, следует выбирать только схемы, которые доказали свою высокую эффективность, с упором на использование лекарств, резистентность к которым является редкой
5.1. Подход после неудачного лечения
Лечение будет неудачным. Одна из наиболее частых причин неэффективности лечения — это неправильный прием лекарств. Проблема может заключаться в том, что врач не дает адекватных инструкций (для пациентов или из-за невыносимых побочных эффектов. При правильно подобранном лечении и обучении пациентов неудачи лечения должны быть редкими (например, <5%). Другой вариант неудачи - это наличие необычной устойчивости, такой как AMX.Например, если область представляет собой область с редкой устойчивостью к CLR и тройная терапия CLR является предпочтительным первым выбором и проводится эмпирически, неудача предполагает, что у пациента уже была устойчивость к CLR.Там, где это возможно, лучший подход к выбору терапии второго выбора - это провести тестирование на чувствительность. Если он недоступен, второй вариант будет использовать другой режим. Например, если пациенту была назначена традиционная четырехкратная терапия висмутом с висмутом, МТЗ, тетрациклином и ИПП, можно было заменить МТЗ на AMX 1 г три раза в день. Два отказа требуют тестирования на восприимчивость.
5.1.1. Вакцинация
Усилия по разработке эффективной вакцины против H.pylori появился в начале 1990-х годов (Del Giudice et al. 2009; Salama et al. 2013, см. также главу 15 этой книги). Результаты показали, что защита от инфекции H pylori может быть достигнута как профилактически, так и терапевтически на животных моделях. Однако все предыдущие испытания вакцины-кандидата H pylori были на начальной стадии, и о реальной эффективности не сообщалось (Corthesy et al. 2005; Del Giudice et al. 2009; Malfertheiner et al. 2008). Пероральная рекомбинантная вакцина H pylori , использующая субъединицу B уреазы, слитую с субъединицей B термолабильного энтеротоксина, была разработана Третьим военно-медицинским университетом и Chongqing Kang Wei Biotechnology в Китае.Вакцина была оценена в фазе 1 и фазе 2 клинических испытаний на предмет предварительной безопасности, иммуногенности и оптимальной дозы (не опубликовано). Цзэн с соавторами (2015) сообщили, что пероральное введение вакцины H. pylori обеспечивает хорошую защиту от инфекции у детей в возрасте 6–15 лет в течение 1 года после вакцинации. Хотя предыдущее исследование защитной способности вакцины показало слабое предупреждение об эффективности, общая защита сохранялась до 3 лет. Другие недавние испытания потерпели неудачу (Zeng et al.2015). Например, Malfertheiner et al. (2018) сообщили о внутримышечной иммунизации вакциной, состоящей из трех рекомбинантных антигенов H. pylori — вакуолизирующего цитотоксин A (VacA), цитотоксин-ассоциированного антигена (CagA) и предотвращенной инфекции нейтрофил-активирующего белка (NAP) на животных моделях хорошо переносился и обладал высокой иммуногенностью у здоровых взрослых. Однако по сравнению с плацебо вакцина не обеспечивала дополнительной защиты от инфекции H pylori после заражения CagA-положительным штаммом, несмотря на усиление системных гуморальных ответов на H.pylori антигенов. Очевидно, что эффективная вакцинация необходима для решения проблемы очень высокой распространенности инфекции H. pylori в развивающихся странах.
6. Выводы
В прошлом году было проведено несколько исследований по оценке новых вариантов лечения H. pylori . Debraekeleer и Remaut (2018) сообщили о будущих перспективах потенциальных методов эрадикационной терапии H. pylori . Уреаза H. pylori в течение многих лет находилась в центре внимания при разработке лечебных или лечебных добавок более узкого спектра, и было обнаружено несколько потенциально ингибиторов in vitro.Тем не менее многие страдают отсутствием конкретики. Единственный продаваемый на рынке ингибитор бактериальной уреазы, ацетогидроксамовая кислота (литстат), одобрен только как орфанный препарат для использования при струвите, вызывающем хроническую инфекцию мочевыводящих путей, вызванную патогенами, способствующими расщеплению уреаспирации. Он не рекомендуется для эрадикации H. pylori из-за его многочисленных и частых побочных эффектов. Два одобренных и продаваемых муколитических агента, эрдостеин и N-ацетилцистеин (NAC), предложили повысить эффективность эрадикации H. pylori в клинических испытаниях при применении в сочетании с тройной терапией (Yoon et al.2016). Тем не менее, они не получили широкого распространения из-за требуемых высоких доз, повышенной стоимости лечения, дополнительного дискомфорта пациента и повышенного риска кровотечения из пептических язв, связанных с муколитическими агентами.
Было обнаружено, что производное интерволина (противоопухолевое), AS-1934, обладает избирательной активностью против H. pylori , в том числе против устойчивых к антибиотикам штаммов, без какого-либо воздействия на кишечные бактерии (Ohishi et al. 2018). Было проведено неисчислимое количество исследований in vitro, агентов, ингибирующих H.pylori и некоторые исследования на животных, но почти не исследования на людях. Jeong с соавторами (2018) сообщили об эффективности схем лечения на основе гибрида смектита, интеркалированного гентамицином, на мышиной модели. Kouitcheu Mabeku et al. (2017) сообщили, что Bryophyllum pinnatum, лекарственное растение с антиоксидантными и противомикробными свойствами, может подавлять рост H. pylori , а также защищает слизистую оболочку желудка от активных форм кислорода. Группа из Ирана показала, что стандартная тройная терапия куркумином (экстракт куркумы) увеличила H.pylori и снижение показателей эндоскопического воспаления (Judaki et al.2017). Исследование, проведенное группой египтян, показало высокий уровень эрадикации с помощью нитазоксанида, который является очень дорогим противоинфекционным препаратом против простейших и анаэробных бактерий, а также против H. pylori . Когда MTZ был заменен нитазоксанидом в тройной терапии, зарегистрированные показатели эрадикации составили 94,6% по сравнению с 60,6% (Shehata et al.2017).
Будущее, вероятно, будет включать в себя двойную терапию нового поколения ИПП плюс AMX.Как отмечалось выше, этот режим исследуется с 1989 г. (Unge et al. 1989) с переменным успехом (обзор Dore et al. 2016). Ключи к созданию этого режима, по-видимому, включают дозировку AMPC и способность надежно поддерживать высокий внутрижелудочный pH. Введение нового класса PPI, P-CAB, предполагает, что это возможно (Dore et al., 2016; Graham and Dore, 2018). Детали терапии с точки зрения доз и продолжительности еще предстоит проработать.
Благодарности
Dr.Шиотани получил грант на исследования и оплату лекций от Такеда.
Pharmaceutical Co. Ltd. и Otsuka Pharmaceutical Co., Ltd. Доктор Грэм частично участвует в исследовательской службе Департамента по делам ветеранов и получает грант DK56338 Службы общественного здравоохранения, который финансирует Центр болезней органов пищеварения Техасского медицинского центра.
Информация для авторов
Хироши Мацумото, Отделение гастроэнтерологии, Отделение внутренней медицины, Медицинская школа Кавасаки, город Курашики, префектура Окаяма, Япония.
Акико Сиотани, отделение гастроэнтерологии, отделение внутренней медицины, медицинская школа Кавасаки, город Курашики, префектура Окаяма, Япония.
Дэвид Ю. Грэм, Медицинский центр Майкла Э. Дебейки, штат Вирджиния, и медицинский колледж Бейлора, Хьюстон, Техас, США.
Ссылки
- An Y, Wang Y, Wu S, Wang YH, Qian X, Li Z, Fu YJ, Xie Y (2018) Хинолоны четвертого поколения в лечении инфекции Helicobacter pylori : метаанализ . Мир Дж Гастроэнтерол 24: 3302–3312.10.3748 / wjg.v24.i29.3302 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Барбхайя Р., Тонкий Р.Н., Тернер П., Уодсворт Дж. (1979) Клинические фармакологические исследования амоксициллина: эффект пробенецида. Бр Дж Венер Дис 55: 211–213 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Бастос Дж., Пелетейро Б., Баррос Р., Алвес Л., Северо М., де Фатима П. М., Пинто Х., Карвалью С., Мариньо А., Гимарайнш Дж. Т., Azevedo A, La Vecchia C, Barros H, Lunet N (2013) Социально-демографические детерминанты распространенности и заболеваемости инфекцией Helicobacter pylori у взрослых португальцев.Хеликобактер 18: 413–422. 10.1111 / hel.12061 [PubMed] [CrossRef] [Google Scholar]
- Брюс М.Г., Маарус Х.И. (2008) Эпидемиология инфекции Helicobacter pylori . Хеликобактер 13 (Дополнение 1): 1–6. 10.1111 / j.1523-5378.2008.00631.x [PubMed] [CrossRef] [Google Scholar]
- Chen Y, Blaser MJ (2012) Связь между колонизацией желудочного кишечника Helicobacter pylori и уровнями гликированного гемоглобина. J заразить Дис 205: 1195–1202. 10.1093 / infdis / jis106 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Chen MJ, Chen CC, Chen YN, Chen CC, Fang YJ, Lin JT, Wu MS, Liou JM, Taiwan Gastrointestinal Disease and Консорциум Helicobacter (2018) Систематический обзор с метаанализом: сопутствующая терапия vs.тройная терапия для лечения первой линии инфекции Helicobacter pylori . Am J Gastroenterol. 10.1038 / s41395-018-0217-2 [PubMed] [CrossRef] [Google Scholar]
- Chey WD, Leontiadis GI, Howden CW, Moss SF (2017) Клиническое руководство ACG: лечение инфекции Helicobacter pylori . Am J Gastroenterol 112: 212–239. 10.1038 / ajg.2016.563 [PubMed] [CrossRef] [Google Scholar]
- Corthesy B, Boris S, Isler P, Grangette C, Mercenier A (2005) Пероральная иммунизация мышей молочнокислыми бактериями, продуцирующими субъединицу B уреазы Helicobacter pylori частично защищает от заражения Helicobacter felis.J заразить Дис 192: 1441–1449. 10.1086 / 444425 [PubMed] [CrossRef] [Google Scholar]
- Debraekeleer A, Remaut H (2018) Перспективы потенциальных методов уничтожения Helicobacter pylori . Будущий микробиол 13: 671–687. 10.2217 / fmb-2017-0115 [PubMed] [CrossRef] [Google Scholar]
- Del Giudice G, Malfertheiner P, Rappuoli R (2009) Разработка вакцин против Helicobacter pylori . Экспертные ревакцины 8: 1037–1049. 10.1586 / erv.09.62 [PubMed] [CrossRef] [Google Scholar]
- Dore MP, Piana A, Carta M, Atzei A, Are BM, Mura I, Massarelli G, Maida A, Sepulveda AR, Graham DY, Realdi G ( 1998 г.) Устойчивость к амоксициллину является одной из причин неэффективности лечения амоксициллин-омепразолом инфекции Helicobacter pylori .Алимент Фармакол Тер 12: 635–639 [PubMed] [Google Scholar]
- Dore MP, Lu H, Graham DY (2016) Роль висмута в улучшении эрадикации Helicobacter pylori с помощью тройной терапии кишечника. 10.1136 / gutjnl-2015-311019 [PubMed] [CrossRef] [Google Scholar]
- Дьяр О.Дж., Хаттнер Б., Скоутен Дж., Пульчини С. (2017) Что такое рациональное использование противомикробных препаратов? Clin Microbiol Инфекция 23: 793–798. 10.1016 / j.cmi.2017.08.026 [PubMed] [CrossRef] [Google Scholar]
- Эль-Сераг HB, Kao JY, Kanwal F, Gilger M, LoVecchio F, Moss SF, Crowe S, Elfant A, Haas T, Hapke RJ, Graham DY (2018) Хьюстонская консенсусная конференция по тестированию на инфекцию Helicobacter pylori в США.Clin Gastroenterol Hepatol. 10.1016 / j.cgh.2018.03.013 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Erah PO, Goddard AF, Barrett DA, Shaw PN, Spiller RC (1997) Стабильность амоксициллина, кларитромицина и метронидазол в желудочном соке: актуальность для лечения инфекции Helicobacter pylori . J Antimicrob Chemother 39: 5–12 [PubMed] [Google Scholar]
- Fallone CA, Chiba N, van Zanten SV, Fischbach L, Gisbert JP, Hunt RH, Jones NL, Render C, Leontiadis GI, Moayyedi P, Marshall JK (2016) Торонтский консенсус по лечению инфекции Helicobacter pylori у взрослых.Гастроэнтерология 151: 51–69.e14. 10.1053 / j.gastro.2016.04.006 [PubMed] [CrossRef] [Google Scholar]
- Fujimoto Y, Furusyo N, Toyoda K, Takeoka H, Sawayama Y, Hayashi J (2007) Внутрисемейная передача Helicobacter pylori среди население эндемичных районов Японии. Хеликобактер 12: 170–176. 10.1111 / j.1523-5378.2007.00488.x [PubMed] [CrossRef] [Google Scholar]
- Furuta T, Shirai N, Kodaira M, Sugimoto M, Nogaki A, Kuriyama S, Iwaizumi M, Yamade M, Terakawa I, Ohshi K, Ishizaki T, Hishida A (2007) Индивидуальный подход на основе фармакогеномики по сравнению со стандартным терапевтическим режимом для искоренения H.pylori . Clin Pharmacol Ther 81: 521–528. 10.1038 / sj.clpt.6100043 [PubMed] [CrossRef] [Google Scholar]
- Gao CP, Zhou Z, Wang JZ, Han SX, Li LP, Lu H (2016) Эффективность и безопасность двойной терапии высокими дозами для Спасательная терапия Helicobacter pylori : систематический обзор и метаанализ. J Dig Dis 17: 811–819. 10.1111 / 1751-2980.12432 [PubMed] [CrossRef] [Google Scholar]
- Grad YH, Lipsitch M, Aiello AE (2012) Светские тенденции распространенности серотипа Helicobacter pylori среди взрослых в США: доказательства устойчивых расовых / этнических различий .Am J Epidemiol 175: 54–59. 10.1093 / aje / kwr288 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Graham DY (2015) Обновление Helicobacter pylori : рак желудка, надежная терапия и возможные преимущества. Гастроэнтерология 148: 719–731.e713. 10.1053 / j.gastro.2015.01.040 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Graham DY, Dore MP (2018) Обновленная информация об использовании фонопразана: конкурентного блокатора кислоты. Гастроэнтерология 154: 462–466. 10.1053 / j.gastro.2018.01.018 [PubMed] [CrossRef] [Google Scholar]
- Graham DY, Fischbach L (2010) Лечение Helicobacter pylori в эпоху растущей устойчивости к антибиотикам. Кишечник 59: 1143–1153. 10.1136 / gut.2009.192757 [PubMed] [CrossRef] [Google Scholar]
- Graham DY, Lee SY (2015) Как эффективно использовать четырехкратную терапию висмутом: хорошее, плохое и уродливое. Гастроэнтерол Clin N Am 44: 537–563. 10.1016 / j.gtc.2015.05.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Graham DY, Shiotani A (2008) Новые концепции устойчивости в лечении инфекций, вызванных Helicobacter pylori .Нат Клин Прак Гастроэнтерол Гепатол 5: 321–331. 10.1038 / ncpgasthep1138 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Graham DY, Tansel A (2018) Взаимозаменяемое использование ингибиторов протонной помпы на основе относительной эффективности. Клин Гастроэнтерол Гепатол 16: 800–808.e807. 10.1016 / j.cgh.2017.09.033. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Graham DY, Lee YC, Wu MS (2014) Терапия Rational Helicobacter pylori : доказательная медицина, а не доказательная медицина.Клин Гастроэнтерол Гепатол 12: 177–186.e173 ;. обсуждение e112 – e173. 10.1016 / j.cgh.2013.05.028 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Graham DY, Lu H, Shiotani A (2017) Отказ оптимизированной терапии амоксициллином с двойным ингибитором протонной помпы: что теперь? Саудовская Дж. Гастроэнтерол 23: 265–267. 10.4103 / sjg.SJG_292_17 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Graham DY, Dore MP, Lu H (2018) Понимание рекомендаций по лечению висмутовой и невисмутовой четверкой Helicobacter pylori эрадикационной терапии.Expert Rev Anti-Infect Ther 16: 679–687. 10.1080 / 14787210.2018.1511427 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Hori Y, Matsukawa J, Takeuchi T, Nishida H, Kajino M, Inatomi N (2011) Исследование, сравнивающее антисекреторный эффект TAK -438, новый блокатор кислоты, конкурирующий с калием, с лансопразолом для животных. J Pharmacol Exp Ther 337: 797–804. 10.1124 / jpet.111.179556 [PubMed] [CrossRef] [Google Scholar]
- Hsu PI, Tsai FW, Kao SS, Hsu WH, Cheng JS, Peng NJ, Tsai KW, Hu HM, Wang YK, Chuah SK, Chen A, Wu DC (2017) Десятидневная четырехкратная терапия, включающая ингибитор протонной помпы, висмут, тетрациклин и левофлоксацин, более эффективна, чем стандартная тройная терапия левофлоксацином при лечении второй линии инфекции Helicobacter pylori : рандомизированное контролируемое исследование.Am J Gastroenterol 112: 1374–1381. 10.1038 / ajg.2017.195 [PubMed] [CrossRef] [Google Scholar]
- Hunt RH, Xiao SD, Megraud F, Leon-Barua R, Bazzoli F, van der Merwe S, Vaz Coelho LG, Fock M, Fedail S, Cohen H, Malfertheiner P, Vakli N, Hamid S, Goh KL, Wong BC, Krabshuis J, Le Mair A, World Gastroenterology Organization (2011) Helicobacter pylori в развивающихся странах. Глобальное руководство всемирной гастроэнтерологической организации. J Gastrointestin Liver Dis: JGLD 20: 299–304 [PubMed] [Google Scholar]
- Jeong SJ, Kim JH, Jung DH, Lee KH, Park SY, Song Y, Kang IM, Song YG (2018) Смектит, интеркалированный гентамицином, как новый терапевтический вариант для Ликвидация Helicobacter pylori .J Antimicrob Chemother 73: 1324–1329. 10.1093 / jac / dky011 [PubMed] [CrossRef] [Google Scholar]
- Judaki A, Rahmani A, Feizi J, Asadollahi K, Hafezi Ahmadi MR (2017) Куркумин в сочетании с режимами тройной терапии снижает окислительный стресс и гистопатологические изменения при хронических заболеваниях. ассоциированный с гастритом Инфекция Helicobacter pylori Arquivos de Gastroenterologia 54: 177–182 doi: 10.1590 / s0004-2803.201700000-18 [PubMed] [CrossRef] [Google Scholar]
- Jung YS, Kim EH, Park CH (2017) Систематический обзор с метаанализом: эффективность использования фонопразана тройная терапия по эрадикации Helicobacter pylori .Алимент Фармакол Тер 46: 106–114. 10.1111 / apt.14130 [PubMed] [CrossRef] [Google Scholar]
- Jung JH, Cho IK, Lee CH, Song GG, Lim JH (2018) Клинические результаты стандартной тройной терапии плюс пробиотики или сопутствующей терапии для Helicobacter pylori Инфекционное заболевание. Кишечник печень 12: 165–172. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Kamada T и другие. (2015) Тенденции развития инфекции Helicobacter pylori и атрофического гастрита за 40 лет в Японии. Helicobacter, 20: 192–198.10.1111 / hel.12193 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Kobayashi I и другие. (2007) Изменение эпидемиологии чувствительности к противомикробным препаратам штаммов Helicobacter pylori в Японии в период с 2002 по 2005 годы. J Clin Microbiol 45: 4006–4010. 10.1128 / jcm.00740-07 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Kouitcheu Mabeku LB, Eyoum Bille B, Tchouangueu TF, Nguepi E, Leundji H (2017) Лечение заражения Helicobacter pylori мышей с Bryophyllum pinnatum, лекарственным растением с антиоксидантными и антимикробными свойствами, снижает бактериальную нагрузку.Фарм Биол 55: 603–610. 10.1080 / 13880209.2016.1266668 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Kuo YT, Liou JM, EL-Omar, Wu JY, Leow AHR, Goh KL, Das R, Lu H, Lin JT, Tu YK, Yamaoka Y, Wu MS (2017) Первичная устойчивость к антибиотикам в Helicobacter pylori в Азиатско-Тихоокеанском регионе: систематический обзор и метаанализ Lancet Gastroenterol Hepatol 2: 707–715 doi: 10.1016 / s2468-1253 (17) 30219-4 [PubMed] [CrossRef] [Google Scholar]
- Kwack W, Lim Y, Lim C, Graham DY (2016) Высокая доза илапразола / амоксициллина как схема первого ряда для инфекции Helicobacter pylori в Корее.Гастроэнтерол Рес Прак 2016: 1648047. 10.1155 / 2016/1648047 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Kwok T, Backert S, Schwarz H, Berger J, Meyer TF (2002) Конкретное введение Helicobacter pylori в культивируемый эпителиальный слой желудка ячеек через механизм, похожий на молнию. Заразить иммунную 70: 2108–2120 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Laine L, Suchower L, Frantz J, Connors A, Neil G (1998) Дважды в день, 10-дневная тройная терапия с омепразолом, амоксициллином, и кларитромицин для эрадикации Helicobacter pylori при язвенной болезни двенадцатиперстной кишки: результаты трех многоцентровых двойных слепых исследований в США.Am J Gastroenterol 93: 2106–2112. 10.1111 / j.1572-0241.1998.00602.x [PubMed] [CrossRef] [Google Scholar]
- Lau CS, Ward A, Chamberlain RS (2016) Пробиотики повышают эффективность стандартной тройной терапии при уничтожении Helicobacter pylori : метаанализ. Устойчивость к инфекционным препаратам 9: 275–289. 10.2147 / idr.s117886 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Liang CM, Cheng JW, Kuo CM, Chang KC, Wu KL, Tai WC, Chiu KW, Chiou SS, Lin MT, Hu TH, Chuah SK (2014) Ликвидация второй линии анти- Helicobacter pylori , содержащей левофлоксацин, в реальной практике Тайваня.Биомед Дж 37: 326–330. 10.4103 / 2319-4170.125650 [PubMed] [CrossRef] [Google Scholar]
- Лю WZ, Xie Y, Lu H, Cheng H, Zeng ZR, Zhou LY, Chen Y, Wang JB, Du YQ, Lu NH (2018) Пятый Китайский национальный консенсусный отчет по управлению инфекцией Helicobacter pylori . Хеликобактер 23: e12475. 10.1111 / hel.12475 [PubMed] [CrossRef] [Google Scholar]
- Масиас-Гарсия Ф, Бастон-Рей I, де ла Иглесиа-Гарсия Д., Кальвино-Суарес С., Ньето-Гарсия Л., Домингес-Муньос Дж. Э. (2018 ) Висмутсодержащая четырехкратная терапия по сравнению с сопутствующей четырехкратной терапией в качестве лечения первой линии для инфекции Helicobacter pylori в области высокой устойчивости к кларитромицину: проспективное, поперечное, сравнительное, открытое исследование.Хеликобактер: e12546. 10.1111 / hel.12546 [PubMed] [CrossRef] [Google Scholar]
- Mahachai V, Vilachone RK, Pittayanon R, Rottayanon R, Rojborwonwitaya J, Leelaksolovong S, Mannerattanaporn M, Chotivitayatarakornsa P, Treeprakorsa Mairiang P, Rani A, Leow A, Mya SM, Lee YC, Vannarath S, Rasachak B, Chakravuth O, Aung MM, Ang TL, Sollano JD, Trong Quach D, Sansak I, Wiwattanachang O, Hamosomburana P, Syam AF, Yamaoka Y, Fock KM, Goh KL, Sugano K, Graham DY (2018) Helicobacter pylori Управление в АСЕАН: Бангкокский консенсусный отчет.J Гастроэнтерол Гепатол 33: 37–56. 10.1111 / jgh.13911 [PubMed] [CrossRef] [Google Scholar]
- Malfertheiner P, Schultze V, Rosenkranz B, Kaufmann SH, Ulrichs T, Novicki D, Norelli F, Contorni M, Peppoloni S, Berti D, Tornese D, Ganju J, Palla E, Rappuoli R, Scharschmidt BF, Del Giudice G (2008) Безопасность и иммуногенность внутримышечной вакцины Helicobacter pylori у неинфицированных добровольцев: исследование фазы I. Гастроэнтерология 135: 787–795. 10.1053 / j.gastro.2008.05.054 [PubMed] [CrossRef] [Google Scholar]
- Malfertheiner P, Megrad F, O’Morain CA, Atherton J, Axon AT, Bazzoli F, Gensini GF, Gisbert JP, Graham DY, Rokkas T, El-Omar EM, Kuipers EJ (2012) Управление инфекцией Helicobacter pylori — Маастрихтский IV / Флорентийский консенсусный отчет.Кишечник 61: 646–664. 10.1136 / gutjnl-2012-302084 [PubMed] [CrossRef] [Google Scholar]
- Malfertheiner P, Megraud F, O’Morain CA, Gisbert JP, Kuiper EJ, Kuiper A, Axon AT, Bazzoli F, Gasbarini A, Atherton J , Graham DY, Hunt R, Moayyedi P, Rokkas T, Rugge M, Selgrad M, Suerbaum S, Sugano K, El-Omar EM (2017) Управление инфекцией Helicobacter pylori — отчет Маастрихтского V / Флорентийского консенсуса. Кишечник 66: 6–30. 10.1136 / gutjnl-2016-312288 [PubMed] [CrossRef] [Google Scholar]
- Malfertheiner P, Selgrad M, Wex T, Romi B, Borgogni E, Spensieri F, Zedda L, Ruggiero P, Pancotto L, Censini S, Palla E, Kansesa-Thasan N, Scharschmidt B, Rappuoli R, Graham DY, Schiavetti F, Del Giudice G (2018) Эффективность, иммуногенность и безопасность парентеральной вакцины против Helicobacter pylori у здоровых добровольцев, зараженных cag-положительным штаммом : рандомизированное плацебо-контролируемое исследование 1/2 фазы.Ланцет Гастроэнтерол Гепатол 3: 698–707. 10.1016 / s2468-1253 (18) 30125-0 [PubMed] [CrossRef] [Google Scholar]
- McFarland LV, Evans CT, Goldstein EJC (2018) Штамм-специфичность и специфичность эффективности пробиотиков к болезням: систематический обзор и мета -анализ. Front Med 5: 124 10.3389 / fmed.2018.00124 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Megraud F (2004) H pylori Устойчивость к антибиотикам: распространенность, важность и успехи в тестировании. Кишечник 53: 1374–1384.10.1136 / gut.2003.022111 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Meyer JM, Silliman NP, Wang W, Siepman NY, Sugg JE, Morris D, Zhang J, Bhattacharyya H, King EC, Hopkins RJ (2002) Факторы риска устойчивости к противомикробным препаратам Helicobacter pylori в США: наблюдение за исследованием H. pylori партнерства по устойчивости к противомикробным препаратам (SHARP), 1993–1999. Энн Интерн Мед 136: 13–24 [PubMed] [Google Scholar]
- Мураками К., Фурута Т., Андо Т., Накадзима Т., Инуи И., Осима Т., Томита Т., Мабе К., Сасаки М., Суганума Т., Номура Х., Сато К., Хори С, Иноуэ С, Томокане Т, Кудо М, Инаба Т, Таке С, Окуса Т, Ямамото С, Мизуно С, Камошида Т, Амаги К., Ивамото Дж, Мива Х, Кодама М, Окимото Т, Като М, Асака М (2013) Многоцентровое рандомизированное контролируемое исследование по разработке стандартной схемы третьей линии для эрадикации Helicobacter pylori в Японии.J Гастроэнтерол 48: 1128–1135. 10.1007 / s00535-012-0731-8 [PubMed] [CrossRef] [Google Scholar]
- Murakami K, Sakurai Y, Shiino M, Funao N, Nishimura A, Asaka M (2016) Vonoprazan, новый блокатор кислоты, конкурирующий с калием , как компонент тройной терапии первой и второй линии для эрадикации Helicobacter pylori : рандомизированное двойное слепое исследование фазы III. Кишечник. 10.1136 / gutjnl-2015-311304 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Oh B, Kim BS, Kim JW, Kim JS, Koh SJ, Kim BG, Lee KL, Chun J (2016) Влияние пробиотиков на микробиоту кишечника во время эрадикации Helicobacter pylori : рандомизированное контролируемое исследование.Хеликобактер 21: 165–174. 10.1111 / hel.12270 [PubMed] [CrossRef] [Google Scholar]
- Охиши Т., Масуда Т., Абэ Х., Хаяси К., Адачи Х., Охба С.И., Игараси М., Ватанабе Т., Мимуро Х., Амалия Е., Инаока Д.К., Mochizuki K, Kita K, Shibasaki M, Kawada M (2018) Монотерапия новым производным интервенолина, AS-1934, является эффективным средством лечения инфекции Helicobacter pylori . Helicobacter. 10.1111 / hel.12470 [PubMed] [CrossRef] [Google Scholar]
- Puig I, Baylina M, Sánchez-Delgado J, López-Gongora S, Suarez D, García-Iglesias P, Muñoz N, Gisbert JP, Dacoll C, Cohen H, Calvet X (2016) Систематический обзор и метаанализ: тройная терапия, сочетающая ингибитор протонной помпы, амоксициллин и метронидазол для лечения первой линии Helicobacter pylori .J AntimicrobChemother 71: 2740–53. [PubMed] [Google Scholar]
- Ruiter R, Wunderink HF, Veenendaal RA, Visser LG, de Boer MGJ (2017) Устойчивость к Helicobacter pylori в Нидерландах: растущая проблема? Neth J Med 75: 394–398 [PubMed] [Google Scholar]
- Салама Н.Р., Хартунг М.Л., Мюллер А. (2013) Жизнь в желудке человека: стратегии сохранения бактериального патогена Helicobacter pylori . Нат Рев Микробиол 11: 385–399. 10.1038 / nrmicro3016 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Санчес Себальос Ф, Таксонера Самсо С, Гарсия Алонсо С, Альба Лопес С, Сайнс де Лос Террерос Солер Л, Диас-Рубио М (2007) Распространенность инфекции Helicobacter pylori среди здорового населения Мадрида (Испания).Revista espanola de enfermedades digestivas: официальный орган испанского общества патологии дигестива 99: 497–501 [PubMed] [Google Scholar]
- Savoldi A, Carrara E, Graham DY, Conti M, Tacconelli E (2018) Распространенность устойчивости к антибиотикам у Helicobacter pylori : систематический обзор и метаанализ в мире Регионы организации здравоохранения. Гастроэнтерология. 10.1053 / j.gastro.2018.07.007 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Скотт Д., Уикс Д., Мельчерс К., Сакс Г. (1998) Жизнь и смерть Helicobacter pylori .Кишечник 43 (Приложение 1): S56 – S60 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Selgrad M, Malfertheiner P (2011) Лечение Helicobacter pylori . Курр Опин Гастроэнтерол 27: 565–570. 10.1097 / MOG.0b013e32834bb818 [PubMed] [CrossRef] [Google Scholar]
- Shafaghi A, Pourkazemi A, Khosravani M, Fakhrie Asl S, Amir Maafi A, Atrkar Roshan Z, Abaspour Rahimabad J (2016) Эффект пребиотика и пребиотика J (2016) добавка на переносимость и эффективность эрадикационной четырехкратной терапии Helicobacter pylori : рандомизированное проспективное двойное слепое контролируемое исследование.Ближний Восток Дж Диг Дис 8: 179–188. 10.15171 / mejdd.2016.30 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Shehata MA, Talaat R, Soliman S, Elmesseri H, Soliman S, Abd-Elsalam S (2017) Рандомизированное контролируемое исследование романа Терапевтический режим, содержащий тройной нитазоксанид (NTZ), по сравнению с традиционным режимом для искоренения инфекции Helicobacter pylori . Хеликобактер 22 10.1111 / hel.12395 [PubMed] [CrossRef] [Google Scholar]
- Sugano K, Tack J, Kuiper EJ, Graham DY, EL-Omar EM, Miura S, Haruma K, Asaka M, Uemura N, Malfertheiner P (2015) ) Киотский глобальный консенсусный отчет по гастриту Helicobacter pylori .Кишечник 64: 1353–1367. 10.1136 / gutjnl-2015-309252 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Thung I, Aramin H, Vavinskaya V, Gupta S, Park JY, Crowe SE, Valasek MA (2016) Обзорная статья; глобальное появление хеликобактер пилори , устойчивый к антибиотикам. Pharmacol Ther 43: 514–533. 10.1111 / apt.13497 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Unge P, Gad A, Gnarpe H, Olsson J (1989) Улучшает ли омепразол антимикробную терапию, направленную на желудочный Campylobacter pylori у пациентов при антральном гастрите? Пилотное исследование скандинавского языка.J Gastroenterol Suppl 167: 49–54 [PubMed] [Google Scholar]
- Vale FF, Vitor JM (2010) Путь передачи Helicobacter pylori : играет ли пища роль в сельских и городских районах? Пищевой микробиол Int J 138: 1–12. 10.1016 / j.ijfoodmicro.2010.01.016 [PubMed] [CrossRef] [Google Scholar]
- Wen J, Peng P, Chen P, Zeng L, Pan Q, Wei W, He J (2017) Пробиотики в трехкратном 14-дневном приеме терапия для азиатских педиатрических пациентов с инфекцией Helicobacter pylori : сетевой метаанализ.Oncotarget 8: 96409–96418. 10.18632 / oncotarget.21633 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Член парламента Уильямса, Pounder RE (1999) Helicobacter pylori : от доброкачественного к злокачественному. Am J Gastroenterol 94: S11 – S16 [PubMed] [Google Scholar]
- Yang JC, Lin CJ (2010) Генотипы CYP2C19 в фармакокинетике / фармакодинамике терапии инфекции Helicobacter pylori на основе ингибитора протонной помпы. Мнение экспертов: Drug Metab Toxicol 6: 29–41. 10.1517/174252506251 [PubMed] [CrossRef] [Google Scholar]
- Yang JC, Wang HL, Chern HD, Shun CT, Lin BR, Lin CJ, Wang TH (2011) Роль дозировки омепразола и генотип цитохрома P450 2C19 у пациентов, получающих Двойная терапия омепразолом-амоксициллином для эрадикации Helicobacter pylori . Фармакотерапия 31: 227–238. 10.1592 / phco.31.3.227 [PubMed] [CrossRef] [Google Scholar]
- Ян Дж. К., Лин Си Джей, Ван Х. Л., Чен Дж. Д., Као Дж. Й., Шун К. Т., Лу К. В., Лин Б. Р., Ши М. Дж., Чанг М. К., Чанг YT, Wei SC, Lin LC, Yeh WC, Kuo JS, Tung CC, Leong YL, Wand TH, Wong JM (2015) Двойная высокодозная терапия превосходит стандартную терапию первой линии или терапию спасения при инфекции Helicobacter pylori .Клин Гастроэнтерол Гепатол 13: 895–905.e895. 10.1016 / j.cgh.2014.10.036 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Yoon H, Lee DH, Jang ES, Kim J, Shin CM, Park YS, Hwang JH, Kim JW, Jeong SH, Kim N (2016) Влияние N-ацетилцистеина на последовательную терапию первой линии для инфекции Helicobacter pylori : рандомизированное контролируемое пилотное исследование. Кишечник печень 10: 520–525. 10.5009 / gnl15048 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Zeng M, Mao XH, Li JX, Tong WD, Wang B, Zhang YJ, Guo G, Zhao ZJ, Li L, Wu DL, Lu DS, Tan ZM, Liang HY, Wu C, Li DH, Luo P, Zeng H, Zhang WJ, Zhang JY, Guo BT, Zhu FC, Zou QC (2015) Эффективность, безопасность и иммуногенность перорального рекомбинантного хеликобактера pylori у детей в Китае: рандомизированное двойное слепое плацебо-контролируемое исследование фазы 3.Ланцет 386: 1457–1464. 10.1016 / s0140-6736 (15) 60310-5 [PubMed] [CrossRef] [Google Scholar]
- Zhang J, Jin HC, Zhu AK, Ying RC, Wei W, Zhang FJ (2014) Прогностическое значение уровней хемерина в плазме в пациенты с раком желудка. Пептиды 61: 7–11. 10.1016 / j.peptides.2014.08.007 [PubMed] [CrossRef] [Google Scholar]
- Zhang YX, Zhou LY, Song ZQ, Zhang JZ, He LH, Ding Y (2015) Первичная устойчивость к антибиотикам штаммов Helicobacter pylori изолированы от пациентов с диспепсическими симптомами в Пекине: проспективное серийное исследование.Мир Дж Гастроэнтерол 21: 2786–2792. 10.3748 / wjg.v21.i9.2786 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Обновленная информация о борьбе с инфекцией Helicobacter pylori
Резюме
Цель обзора
Нашей целью было предоставить обновленная информация о методах и показаниях для тестирования и выбора лечения с упором на новые методы.
Последние данные
Повышение устойчивости к антибиотикам снижает эффективность лечения.Тестирование на устойчивость к антибиотикам не является широко доступным в Северной Америке, где недостаточно данных о резистентности и восприимчивости. Четырехкратные схемы (на основе висмута или сопутствующие / не на основе висмута) рекомендованы в качестве первой линии. Комбинированный препарат на основе рифабутина, недавно одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, очень эффективен и должен упростить лечение. Калий-конкурентный блокатор кислоты фонопразан оценивается как часть схем двойной или тройной комбинации.Молекулярные генотипические тесты на устойчивость к антибиотикам и эффективная вакцина H. pylori все еще находятся в стадии разработки.
Резюме
Невозможность тестирования на устойчивость к антибиотикам делает выбор лечения эмпирическим. Однако устойчивость к рифабутину и амоксициллину остается редкостью. Эффективное ведение по-прежнему включает соответствующее диагностическое тестирование на активную инфекцию, использование эффективного режима и тестирование после лечения.
Ключевые слова: H.pylori , Антибиотики, устойчивость к антибиотикам, кларитромицин, рифабутин, вонопразан
Введение
Helicobacter pylori ( H. pylori ) Инфекция является одной из наиболее распространенных хронических бактериальных инфекций у людей, поражающих примерно 4,4 миллиарда человек во всем мире, с распространенность от 28 до 84% в разных популяциях [1, 2]. Заболеваемость и распространенность инфекции H. pylori выше среди людей, родившихся за пределами Северной Америки, по сравнению с людьми, родившимися здесь.Однако распространенность высока в определенных сообществах Северной Америки и зависит от социально-экономического статуса и расы / этнической принадлежности [3–6]. В целом, распространенность среди белых неиспаноязычных стран ниже по сравнению с другими группами, такими как афроамериканцы, латиноамериканцы, коренные американцы, коренные жители Аляски и американцы корейского или китайского происхождения [7, 8].
Инфекция H. pylori участвует в патогенезе гастрита, язвы желудка и двенадцатиперстной кишки, рака желудка и лимфомы, связанной со слизистой оболочкой желудка, лимфоидной ткани (MALT) [9–12]; его ликвидация рекомендуется при лечении и / или профилактике этих состояний [13, 14].Лечение также рекомендовано пациентам с неисследованной диспепсией при отсутствии признаков тревоги и пациентам с функциональной диспепсией. Важно отметить, что всем пациентам с положительным результатом теста на активную инфекцию следует предлагать лечение [3, 15, 16]. Однако лечение H. pylori было сложным и потребовало 10 или 14 дней приема многократных ежедневных доз трех или четырех различных лекарств. Кроме того, эффективность многих схем снизилась из-за повышения устойчивости к антибиотикам [17–21], что составляет H.pylori сложно искоренить. Всемирная организация здравоохранения включила H. pylori в число 12 видов бактерий, требующих высокоприоритетных будущих стратегий для разработки новых антибиотиков — в основном из-за высоких показателей устойчивости к кларитромицину [22]. Для решения этой глобальной проблемы экспертные группы в США [3], Канаде [9] и Европе [12 •] выпустили руководство по лечению инфекции H. pylori . Однако скудность данных об устойчивости к антибиотикам среди H.pylori из Северной Америки остается основной областью неудовлетворенных клинических потребностей, что побуждает к согласованным усилиям по созданию регистров эпиднадзора за паттернами устойчивости и показателями успешности для определения эффективного лечения [23]. Аналогичным образом, тестирование на чувствительность к противомикробным препаратам для H. pylori , выполненное на образцах биопсии желудка, обычно не доступно в большинстве медицинских центров Северной Америки и требует эндоскопии верхних отделов желудочно-кишечного тракта; молекулярные методы выявления генетических мутаций, ответственных за устойчивость к антибиотикам, в настоящее время не одобрены [3, 24].В этом обзоре мы обсуждаем важную роль H. pylori при раке желудка, лечение инфекции H. pylori , уделяя особое внимание диагностическому тестированию, включая культивирование и чувствительность, молекулярным методам тестирования устойчивости и новым методам лечения. в настоящее время в разработке или недавно были утверждены.
Инфекция H. pylori — потенциально изменяемый фактор риска рака желудкаH. pylori — признанный канцероген желудка, на который во всем мире приходится до 89% некардиальных раковых заболеваний [25].В 2018 году H. pylori стали причиной примерно 810 000 новых случаев некардиальной аденокарциномы желудка во всем мире, что делает ее ведущей причиной рака, вызываемого инфекцией, перед вирусами папилломы человека высокого риска и вирусами гепатита B и C [26] . По оценкам Американского онкологического общества, в 2020 году в США будет 27 600 новых случаев рака желудка и 11 010 случаев смерти [27 ••]. Следует отметить, что бремя аденокарциномы желудка в США превышает бремя обоих типов рака пищевода вместе взятых [27] (рис.). Важно отметить, что накапливаются данные о том, что ликвидация инфекции H. pylori у бессимптомных лиц снижает риск рака желудка.
Бремя аденокарциномы желудка в США.
Ретроспективное исследование 371 813 ветеранов США с инфекцией H. pylori обнаружило значительное снижение риска рака желудка среди тех, у кого была подтвержденная эрадикация [28]. Кроме того, Ford et al. обновили свой предыдущий систематический обзор и метаанализ рандомизированных испытаний, в которых изучалось влияние H.pylori у бессимптомных лиц и риск рака желудка [14]. В их число вошли шесть исследований, проведенных в странах Восточной Азии и одно — в Южной Америке. Они обнаружили умеренные доказательства преимущества эрадикационной терапии H. pylori в снижении как заболеваемости, так и смертности от рака желудка; они были уменьшены на 46% и 39% соответственно. Они также подтвердили ранее отмеченное преимущество эрадикации H. pylori у пациентов, перенесших эндоскопическую резекцию ранней неоплазии желудка; лечение снизило риск дальнейшего рака желудка на 51% [14 ••].Аналогичным образом, более ранний систематический обзор и метаанализ шести рандомизированных исследований и восьми когортных исследований Lee et al. обнаружили, что эрадикация H. pylori снижает риск рака желудка и может быть наиболее жизнеспособной стратегией для первичной профилактики рака желудка у бессимптомных инфицированных лиц [29]. Рандомизированное плацебо-контролируемое исследование Choi et al. в Южной Корее показали, что эрадикация H. pylori также снижает риск рака желудка у лиц, у которых был родственник первой степени родства с раком желудка [30 ••].
Тестирование на H. pyloriВ странах с высоким уровнем заболеваемости раком желудка, таких как Япония, Корея, Китай и Тайвань, популяционный скрининг H. pylori либо начался, либо находится на рассмотрении [10, 31–33 ]. В Северной Америке, где распространенность ниже, чем в Азии [1, 2], в настоящее время нет никаких оснований для проведения популяционного скрининга. Тем не менее, существуют определенные установленные показания для тестирования H. pylori с последующим лечением, включая активную язвенную болезнь (ЯБ), прошлую историю ЯБ (если излечение инфекции не было документально подтверждено), желудочно-кишечную метаплазию, которая случайно обнаруживается при эндоскопия, MALT-лимфома желудка, эндоскопическая резекция раннего рака желудка в анамнезе, а также у пациентов с неисследованной или функциональной диспепсией [3, 15, 34].Имеются также данные, связывающие H. pylori с необъяснимой железодефицитной анемией, идиопатической тромбоцитопенической пурпурой и дефицитом витамина B 12 . В этих условиях следует искать и ликвидировать инфекцию H. pylori после проведения других подходящих обследований [12, 35].
H. pylori можно обнаружить неинвазивно с помощью серологического исследования, дыхательного теста с мочевиной (UBT) или теста на фекальный антиген. Хотя серологические тесты широко доступны, они больше не рекомендуются из-за их низкой прогностической ценности среди групп с низкой распространенностью, таких как США.Кроме того, серологические тесты могут оставаться положительными после успешной эрадикации [12, 36]. Однако, согласно рекомендациям Американского колледжа гастроэнтерологии (ACG) 2017 года по лечению H. pylori , допустимо использовать серологические тесты у пациентов с задокументированным анамнезом ЯБ (при условии, что они еще не лечились от инфекции). . В большинстве других обстоятельств предпочтительны тесты, выявляющие активную инфекцию [3 •]. Несмотря на такие рекомендации, предыдущие исследования показали, что серологический анализ H.pylori в США [37, 38]. Однако тест на UBT и фекальный антиген более чувствителен и специфичен, выявляет только активную инфекцию и одобрен как для первоначального диагноза, так и для подтверждения эрадикации после лечения [3, 31]. Если показана эндоскопия, биопсия желудка может быть взята до или после лечения, чтобы определить статус H. pylori с помощью гистологического исследования и / или анализа уреазы на основе биопсии. Все тесты для подтверждения эрадикации следует проводить после прекращения приема ингибиторов протонной помпы (ИПП) в течение не менее 2 недель и антибиотиков и висмутсодержащих соединений в течение 4 недель, чтобы избежать ложноотрицательных результатов.Антагонисты или антациды рецепторов гистамина H 2 могут использоваться без влияния на точность теста UBT или фекального антигена [31].
Инвазивные методы исследования H. pylori основаны на эндоскопии для получения биоптатов для определения активности уреазы, гистопатологии или посева. Из-за топографических различий в плотности H. pylori в желудке важно получить биопсию как из тела желудка, так и из антрального отдела [39], особенно когда эндоскопия должна быть выполнена пациенту, который недавно принимал лечение ИПП. .Биопсийные уреазные тесты широко используются, поскольку они просты, дешевы, легки в выполнении и точны для пациентов, не получающих ИПП. Однако они подвержены предвзятости между наблюдателями, могут давать двусмысленные результаты и должны интерпретироваться в контексте дотестовой вероятности и распространенности инфекции H. pylori в популяции [36, 40]. Чувствительность теста на уреазу также может снижаться из-за наличия крови в желудке [41]. Гистопатологическое исследование H. pylori обеспечивает дополнительную оценку слизистой оболочки желудка, например, наличие хронического активного гастрита (наличие воспаления слизистой оболочки, особенно полиморфно-ядерных лейкоцитов) или атрофии желудка, кишечной метаплазии или дисплазии.Чувствительность гистологии для обнаружения H. pylori может быть улучшена с помощью иммуногистохимии, особенно когда наблюдается хронический активный гастрит, состояние, которое почти патогномонично для инфекции H. pylori , но бактерии не обнаруживаются сразу [42]. Посев образцов биопсии желудка имеет 100% специфичность и позволяет проводить тестирование устойчивости к противомикробным препаратам. Однако посев H. pylori требует строгих условий транспортировки, занимает несколько дней и может быть трудным для выполнения даже в опытных руках.Его успех еще больше осложняется недавним использованием ИПП или антибиотиков. К сожалению, поэтому такое тестирование не является широко доступным в США [3, 42].
Культура и тестирование чувствительности — отсутствие данных о местной резистентности и восприимчивости
В отличие от обычного лечения бактериальной инфекции, когда выбор противомикробного препарата определяется восприимчивостью организма in vitro и / или данными местной резистентности, лечение Инфекция H. pylori все еще носит эмпирический характер.В связи с увеличением количества неудач лечения, трудностями в искоренении H. pylori и некоторыми данными, свидетельствующими о том, что культуральная терапия связана с более высокими показателями эрадикации [43, 44], эксперты призвали к более широкому тестированию устойчивости к антибиотикам. Маастрихтские руководящие принципы рекомендуют тестирование резистентности к кларитромицину в регионах с высокой резистентностью перед назначением тройной терапии кларитромицином или после неэффективности терапии второй линии [12, 31]. Тестирование на чувствительность к антибиотикам может быть выполнено путем посева или молекулярного определения устойчивости генотипа, оба из которых требуют биопсии желудка — основного фактора, препятствующего широкому распространению этой стратегии.Выполнение эндоскопии с единственной целью получения биопсии также делает этот подход менее рентабельным. Несмотря на эти проблемы, некоторые эксперты рекомендуют перенести тестирование на чувствительность к антибиотикам на более раннюю фазу, чем ожидание двух неудачных попыток лечения, в основном из-за повышения устойчивости к левофлоксацину, составляющей многих схем второго ряда [23].
Хотя в руководствах по лечению настоятельно рекомендуется использовать местные образцы восприимчивости и резистентности для выбора терапии H. pylori , такие данные отсутствуют во многих частях мира [23].Недостаток таких данных в США был препятствием для выработки убедительных рекомендаций по лечению, основанных на фактических данных, в руководстве ACG от 2017 г. по лечению H. pylori [3 •]. В США только две публикации за последние 20 лет, включающие менее 500 штаммов H. pylori , описали характеристики устойчивости [45, 46]. В Европе реестр регистрирует в реальном времени данные о типах резистентности H. pylori ; это может быть использовано для разработки будущих рекомендаций по лечению [47].Раздавались призывы к созданию аналогичных регистров по всей Северной Америке для предоставления данных о местной восприимчивости в целях повышения показателей эрадикации путем рекомендации основанных на фактических данных схем первого ряда и схем спасения [23, 31]. Это повлечет за собой повсеместную доступность культур стула или биопсии желудка, а также тестов на чувствительность или молекулярного генотипического анализа.
Молекулярное тестирование на
H. pyloriКак и другие инфекционные агенты, H. pylori может приобретать устойчивость к различным антибиотикам.Следовательно, тестирование на чувствительность должно быть важным инструментом для эффективного лечения. H. pylori приобретает устойчивость в результате генотипической мутации [42]. К H. pylori можно применить традиционные фенотипические методы культивирования и тестирования чувствительности. Однако молекулярные методы, такие как полимеразная цепная реакция или флуоресцентная гибридизация in situ для выявления точечных мутаций, ответственных за устойчивость, предлагают более простые и быстрые методы обнаружения устойчивости и соответствующего выбора лечения.Молекулярное тестирование может выявить резистентность к кларитромицину и левофлоксацину, вызванную точечными мутациями, но не подходит для выявления резистентности к метронидазолу, которая может быть обусловлена множественными механизмами [24, 42]. Молекулярные тесты могут быть выполнены на биоптатах желудка, полученных при эндоскопии. Молекулярное тестирование стула перед лечением, которое устраняет необходимость в эндоскопии, должно обеспечить более универсальный переход от эмпирической терапии к терапии с резистентностью, но требует дальнейшего развития. В то время как H.pylori почти всегда чувствительны к амоксициллину, тетрациклину и рифабутину, схемы, содержащие кларитромицин или фторхинолоны, становятся все более неэффективными для многих популяций из-за увеличения показателей устойчивости [17, 23]. Тестирование индивидуальной восприимчивости перед терапией первой линии является привлекательным терапевтическим подходом, но потребует повсеместной доступности молекулярных тестов в образцах стула. Однако в настоящее время валидированные молекулярные тесты биопсии желудка или образцов стула не широко доступны, и такие тесты все еще находятся в стадии разработки [48, 49].
Лечение с упором на первичную терапию и терапию спасения
Все руководящие принципы лечения согласны с тем, что лучший подход к лечению инфекции H. pylori — добиться успеха с первой попытки, тем самым избегая повторного лечения и снижая затраты, беспокойство, и дальнейшее продвижение устойчивых штаммов [23]. Поскольку данные о чувствительности к антибиотикам обычно недоступны, эмпирическая терапия первой линии должна основываться на некоторых знаниях о предыдущем воздействии антибиотиков на пациента и истории аллергии на пенициллин, а также на некотором понимании уровней местной резистентности.В рекомендациях ACG от 2017 г. рекомендована четырехкомпонентная терапия на основе висмута (BQT), сопутствующая / не связанная с висмутом четырехкомпонентная терапия и тройная терапия на основе кларитромицина (таблица) [3 •]. Однако тройную терапию на основе кларитромицина следует использовать только для пациентов, которые ранее не подвергались воздействию макролидов и которые приехали из регионов, где уровень местной резистентности к кларитромицину, как известно, составляет менее 15%. Это существенно ограничивает применимость тройной терапии на основе кларитромицина.В руководстве ACG также предлагалось использовать без висмута последовательную и гибридную четырехкомпонентную терапию в качестве схем первого ряда с оговорками, что их сложность может привести к плохой комплаентности пациентов и низким предпочтениям врачей, и что они не были подтверждены в Северной Америке. В США BQT, вероятно, является лучшим эмпирическим выбором. Его эффективность не связана с возможной устойчивостью к кларитромицину и, поскольку он не содержит амоксициллин, не вызывает опасений по поводу возможной аллергии на пенициллин.В недавнем ретроспективном исследовании, проведенном в Род-Айленде, уровень эрадикации составил 87% [50 •] — при условии, что он включал тетрациклин; Показатели эрадикации были ниже среди пациентов, получавших доксициклин вместо тетрациклина. Промежуточный анализ данных Европейского реестра по лечению H. pylori показал, что добавление висмута к 14-дневной стандартной тройной терапии на основе кларитромицина привело к эрадикации более чем у 90% пациентов [51 •]. Это может быть альтернативная терапия первой линии в регионах с умеренной устойчивостью к кларитромицину, но где нет данных о чувствительности.Висмут обладает синергическим действием с некоторыми антибиотиками, которое не зависит от резистентности к кларитромицину и метронидазолу.
Таблица 1
Американский колледж гастроэнтерологии рекомендовал терапию первой линии для лечения инфекции Helicobacter pylori . Взято из Chey et al. [3]
| Схема | Лекарства (дозы) | Частота дозирования | Продолжительность (дни) | Утверждение FDA | ||
|---|---|---|---|---|---|---|
| Кларитромицин тройной | двойная доза PPI (стандартная или двойная) мг) Амоксициллин (1 г) или метронидазол (500 мг 3 раза в сутки) | BID | 14 | Да a | ||
| Четверка висмута | PPI (стандартная доза) PPI (стандартная доза) 9000 300 мг) или субсалицилат (300 мг) Тетрациклин (500 мг) Метронидазол (250–500 мг) | BID QID QID QID (250) (TID) до | 10–14 | № b | ||
| Сопутствующий | ИПП (стандартная доза) Кларитромицин (500 мг) Амоксициллин (1 г) Нитро мидазол (500 мг) c | BID | 10–14 | № | ||
| Последовательный | ИПП (стандартная доза) + амоксициллин (1 г) ИПП, кларитромицин + нитромицин (500 мг) c | BID BID | 5–7 5–7 | № | ||
| Гибрид | PPI (стандартная доза) ИПП, амоксициллин, кларитромицин (500 мг), нитроимидазол (500 мг) c | BID BID | 7 7 | 91 Le 91 Le (стандартная доза)BID QD BID | 10–14 | Нет |
ИПП (стандартная или двойная доза) + амоксициллин (1 г) ИПП, амоксициллин, левофлоксацин (500 мг QD), нитроимидазол (500 мг) c | BID03 BID03 BID 5–7 5–7 | № | ||||
| НАГРУЗКА | Левофлоксацин (250 мг) ИПП (двойная доза) Нитазоксанид (500 мг) 10026 мг QDQD BID QD | 7–10 | № |
У пациентов, которые не прошли терапию первой линии, BQT или тройная терапия на основе левофлоксацина являются вариантами второй линии, которые позволяют избежать повторного лечения. использование кларитромицина; Тройную терапию на основе левофлоксацина следует использовать только в качестве второй линии, если левофлоксацин не применялся в первой линии.Однако амоксициллин и тетрациклин можно использовать повторно из-за сохраняющейся низкой устойчивости к этим агентам. Метронидазол, обладающий синергическим действием с висмутом, также можно использовать повторно [23], если пациенты могут его переносить.
Предполагаемая аллергия на пенициллины (включая амоксициллин) может быть препятствием для эффективного лечения инфекции H. pylori . В то время как до 20% взрослого населения в целом могут считать себя «аллергиками» на пенициллин, более 90% могут безопасно получать амоксициллин после соответствующего отрицательного кожного теста [52 •].Таким образом, в руководстве ACG от 2017 года рекомендовано пройти тестирование на аллергию у пациентов, которые не прошли терапию первой линии и которые сообщили об аллергии на пенициллин в анамнезе.
После нескольких неудачных попыток ликвидации требуется выбор режима спасения. Маастрихтские руководящие принципы рекомендуют посев с тестированием на чувствительность после неэффективности лечения второй линии. Если такое тестирование недоступно, можно попробовать BQT или — если фторхинолон изначально не использовался — режим на основе левофлоксацина.Как двойная терапия высокими дозами (амоксициллин и ИПП), так и схемы на основе рифабутина [53, 54] рассматривались во всех основных руководствах, но с разной силой их рекомендаций (таблица) [3, 9, 12, 23].
Таблица 2
Лечение Helicobacter pylori пациентов с предыдущими неудачными попытками. Основано на рекомендациях Американского колледжа гастроэнтерологии (ACG), Toronto Consensus и Maastricht V / Florence Report. Воспроизведено с разрешения Fallone et al.[23]
| Схема | ACG | Торонто a | Маастрихт / Флоренция | |
|---|---|---|---|---|
| Висмутовая четырехкомпонентная терапия | 9102||||
| Терапия левофлоксацином b | Рекомендуемый выбор | Рекомендуемый выбор | Рекомендуемый выбор | |
| Тройная терапия ИПП на основе кларитромицина | Не рекомендуется | Не рекомендуется | не рекомендуется | Область резистентности к кларитромицину |
| Сопутствующая четырехкомпонентная терапия без висмута | Рекомендуется, если предыдущее четырехкратное лечение висмутом не помогло | Недостаточно доказательств для комментариев зона резистентности | ||
| Двойная терапия с высокими дозами | Рекомендуемая | Многообещающие, но недостаточные доказательства для рекомендации | Рассмотреть, есть ли высокая частота двойной резистентности к кларитромицину / метронидазолу | |
| Терапия рифабутином | Предлагается ограниченная | лечение 3 или более раз | Рассмотрите возможность неудачной терапии на основе кларитромицина и четырехкратной терапии висмутом из области высокой резистентности к фторхинолонам (т. е. неудачное лечение 2 или более раз) |
Последние разработки в
H.pylori лечениеВ связи с отсутствием доступа к надежным тестам на чувствительность к противомикробным препаратам и исходя из вышеизложенных соображений, BQT является надежным эмпирическим выбором для лечения инфекции H. pylori . Аналогичным образом, исследование, проведенное в Китае, показало, что BQT столь же эффективен, как и таргетная терапия на основе тестирования чувствительности [55]. Систематический обзор и метаанализ Янга и др. показали, что как BQT, так и двойная терапия высокими дозами достигают одинаковых показателей эрадикации и приверженности лечению, причем последнее вызывает меньше побочных эффектов [56].Другие области развития связаны с многообещающими результатами двойных режимов с высокими дозами и режимов на основе рифабутина.
Обоснование двойной терапии высокими дозами ИПП и амоксициллина состоит в том, что H. pylori очень редко бывает устойчивым к амоксициллину, бактерицидное действие которого на H. pylori усиливается при высоком pH желудочного сока [57]. Лечение высокими дозами ИПП и, по крайней мере, 3 г / день амоксициллина в течение 14 дней обеспечило уровень эрадикации 70–89% у пациентов с одним или несколькими предшествующими неудачами лечения [3, 58].
Еще одним событием является одобрение в 2019 г. Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) комбинированного препарата (Talicia®; RedHill Biopharma, Роли, Северная Каролина), содержащего омепразол, рифабутин и амоксициллин [59 •]. Это первая и единственная одобренная FDA терапия H. pylori на основе рифабутина. Потенциально это может улучшить соблюдение пациентом режима лечения из-за его относительной простоты. В испытании ERADICATE Hp2 эта комбинация успешно уничтожила H.pylori у 84% пациентов по сравнению с 58%, которые получали те же дозы омепразола и амоксициллина, но без рифабутина. Рекомендуемая доза для этого продукта составляет четыре капсулы три раза в день в течение 14 дней; общие суточные дозы составляют 120 мг омепразола, 150 мг рифабутина и 3 г. амоксициллина. Это должно обеспечить более упрощенную схему лечения, включающую 12 идентичных капсул одного комбинированного продукта, а не несколько лекарств в переменных дозах. Миелотоксичность, которая является редким осложнением лечения рифабутином, в основном ограничивается дозами, превышающими 600 мг в день, и / или длительным применением [54].Таким образом, это не должно быть проблемой для Talicia®, учитывая, что общая доза рифабутина будет составлять 150 мг в день в течение 14 дней. Более того, разработка агентов узкого спектра действия против мишеней, специфичных для H. pylori , остается областью активных исследований и предоставляет широкие возможности, поскольку были секвенированы многочисленные геномы H. pylori с потенциально новыми мишенями для разработки лекарств [23 , 60]. Разработка новых, более эффективных методов лечения инфекции H. pylori не была основным направлением деятельности фармацевтической промышленности в последние годы.Это отражает тот факт, что инфекция наиболее распространена в более бедных, менее развитых странах и что эффективное лечение обязательно будет краткосрочным и будет назначаться только один раз без возможности повторного назначения или более длительного использования [61]. Однако с появлением этих более простых подходов это может наконец измениться.
Подавление кислоты с помощью калий-конкурентных блокаторов кислоты
Вонопразан, первый в своем классе и наиболее широко изученный калий-конкурентный блокатор кислоты (P-CAB), имеет более быстрое начало действия, более длительный срок действия и более глубокий кислотный подавление, чем ИПП [62].В клинических испытаниях в Японии исследователи заменили им ИПП. Это, как правило, приводит к повышению уровня эрадикации на 10–20% при использовании в тройной терапии на основе кларитромицина [63]. Двойная терапия фонопразаном и амоксициллином также дала многообещающие результаты. Furuta et al. Сообщили о 92,9% степени эрадикации при приеме вонопразана 20 мг два раза в день и амоксициллина 500 мг три раза в день по сравнению с 91,9% для вонопразана 20 мг два раза в день , кларитромицина 200 мг два раза в день и амоксициллина 750 мг два раза в день , причем обе схемы назначались в течение 7 дней [64].Аналогичным образом в многоцентровом рандомизированном исследовании Suzuki et al. сообщили о показателях эрадикации при использовании двойных (вонопразан 20 мг + амоксициллин 750 мг два раза в день, два раза в день) и тройных (фонопразан 20 мг + амоксициллин 750 мг + кларитромицин 200 мг два раза в день, ) схемах 84,5% и 89,2% соответственно [65]. Более сильная и продолжительная степень подавления кислотности с помощью вонопразана повышает эффективность амоксициллина и может устранить необходимость в кларитромицине [23, 66]. Фаза 3 клинических испытаний двойных и тройных схем на основе фонопразана для H.pylori инфекция продолжалась в США и Европе. Однако на момент написания (март 2020 г.) это было временно приостановлено в связи с пандемией Covid-19, хотя впоследствии было возобновлено. Другие P-CAB в настоящее время доступны в некоторых азиатских странах, но не используются рутинно в схемах эрадикации H. pylori [67]. Внутри класса P-CAB есть тонкие различия в отношении фармакодинамики [68], как это было продемонстрировано для ИПП.
Роль пробиотиков в
H.pylori managementМетаанализ испытаний пробиотиков, содержащих один или несколько микробных штаммов, не дал мало доказательств их пользы в улучшении показателей эрадикации H. pylori . Включенные испытания, как правило, были низкого качества и имели высокий риск систематической ошибки из-за отсутствия слепого анализа и использования плохо определенных комбинаций и концентраций пробиотических штаммов [69, 70]. Несмотря на эти ограничения, некоторые мультиштаммовые пробиотики могут улучшить показатели эрадикации [62, 63] и могут помочь уменьшить побочные эффекты и, таким образом, улучшить соблюдение режима лечения [69, 70].Пробиотики могут предложить значительный потенциал в этом отношении; однако необходимы дальнейшие исследования, чтобы выяснить их влияние на продолжающиеся усилия по ликвидации H. pylori .
Разработка вакцины
H. pyloriРазработка эффективной вакцины H. pylori , которая позволит обойти текущую проблему снижения уровня эрадиации и повышения устойчивости к антибиотикам, будет привлекательной стратегией управления. Хотя усилия по разработке такой вакцины не имели большого успеха за последние три десятилетия [23, 71], недавнее крупное испытание фазы 3, проведенное в Китае с использованием пероральной вакцины, содержащей рекомбинантную уреазу B, обеспечило> 70% защиты от естественного вируса H.pylori [72]. Это знаменательное исследование возобновило интерес к разработке безопасной и эффективной вакцины H. pylori в качестве столь необходимой профилактической альтернативы использованию сложных схем лечения антибиотиками для лечения установленной инфекции.
Выводы
Снижение уровня эрадикации H. pylori из-за роста устойчивости к антибиотикам во всем мире является серьезной проблемой глобального общественного здравоохранения. Инфекция H. pylori является потенциально изменяемым фактором риска рака желудка. Инфекция H. pylori также остается единственной наиболее частой причиной ЯБ, которая, в свою очередь, является единственной наиболее частой причиной кровотечения из верхних отделов желудочно-кишечного тракта. Последнее руководство США по лечению указывает, что 14-дневный курс BQT будет наиболее надежной эмпирической терапией первой линии. Однако это имеет множество ограничений, включая сложность и частую недоступность генерического тетрациклина. Альтернативой является сопутствующая четырехкратная терапия без висмута. Однако в отсутствие тестирования чувствительности к антибиотикам это обязательно приводит к неправильному использованию отдельных антибиотиков (т.например, кларитромицин или метронидазол), к которым штамм H. pylori уже может быть устойчивым, и ненужное добавление метронидазола при лечении чувствительных к кларитромицину штаммов. Это свидетельствует о плохом использовании антибиотиков. Недавнее одобрение комбинированного режима омепразола, рифабутина и амоксициллина, вероятно, окажет большое влияние на лечение. Хотя схемы на основе рифабутина не рекомендовались для использования в качестве первой линии в руководстве ACG 2017 г., этот документ был подготовлен до появления результатов клинического исследования в США [59].
Тестирование на устойчивость к антибиотикам — если таковое возможно — все же следует рассматривать после неудачной попытки эрадикации двумя разными схемами. Все пациенты должны пройти тестирование после лечения, чтобы подтвердить эрадикацию с помощью UBT, теста на фекальный антиген или гистологии (если эндоскопия выполняется по другому показанию) после прекращения приема висмута и антибиотиков в течение 4 недель и ИПП в течение как минимум 2 недель. Возможное включение фонопразана или других P-CAB в схемы эрадикации представляет большой интерес.Исследования, проведенные в Японии и других странах Азии, дали многообещающие результаты. Теперь, когда исследование фазы 3 в США и Европе возобновлено, его результаты будут представлять большой интерес.
Поскольку тесты на предрасположенность к лечению (включая молекулярные тесты и тесты стула) вряд ли будут широко доступны в ближайшее время, скоординированные усилия по получению местных и региональных данных о резистентности и восприимчивости лягут в основу эффективного управления при одновременном соблюдении принципов рационального использования антибиотиков.При отсутствии тестирования устойчивости традиционными или молекулярными методами эрадикационная терапия H. pylori должна основываться, когда это возможно, на региональных или популяционных данных о чувствительности к антибиотикам, а также на знании личных историй болезни отдельных пациентов и их наличии. истинной аллергии на пенициллин.
Появление более простых 14-дневных схем лечения и комбинированных препаратов должно улучшить практику и упростить существующие громоздкие схемы лечения.Такие усилия по улучшению соблюдения пациентом режима лечения должны привести к более высокому уровню эрадикации. Между тем, эффективное лечение включает соответствующее диагностическое тестирование, отказ от неэффективных схем лечения и рутинное подтверждение эрадикации после лечения.
Как управлять устойчивостью к противомикробным препаратам?
Авторские права © Автор (ы) 2019. Опубликовано Baishideng Publishing Group Inc. Все права защищены.Разработка лечения Helicobacter pylori : как управлять устойчивостью к противомикробным препаратам?
Шо Судзуки, Мицуру Эсаки, Чика Кусано, Хисатомо Икехара, Такудзи Готода
Sho Suzuki, Mitsuru Esaki, Chika Kusano, Hisatomo Ikehara, Takuji Gotoda, Отделение гастроэнтерологии и гепатологии, Медицинский факультет, Медицинская школа Университета Нихон, Токио 1018309, Япония
Вклад авторов : Все авторы в равной степени внесли свой вклад в концепцию и дизайн исследования, обзор и анализ литературы, составление и критический пересмотр и редактирование, а также утверждение окончательной версии.
Заявление о конфликте интересов : Gotoda T получил гонорар от AstraZeneca K.K., Daiichi Sankyo Company Limited, EA Pharma Co., Ltd. и Takeda Pharmaceutical Company Limited.
Открытый доступ : Эта статья представляет собой статью в открытом доступе, которая была выбрана штатным редактором и полностью рецензирована внешними рецензентами. Он распространяется в соответствии с лицензией Creative Commons Attribution Non-Commercial (CC BY-NC 4.0), которая позволяет другим распространять, ремикшировать, адаптировать, использовать эту работу в некоммерческих целях и лицензировать свои производные работы на других условиях, при условии, что оригинальная работа правильно цитируется и используется в некоммерческих целях.См .: http://creativecommons.org/licenses/by-nc/4.0/
Автор, ответственный за переписку : Шо Судзуки, доктор медицинских наук, доктор, научный сотрудник отделения гастроэнтерологии и гепатологии медицинского факультета школы Нихонского университета of Medicine, 1-6 Kanda-Surugadai, Chiyoda-ku, Tokyo 1018309, Japan. [email protected]
Телефон : + 81-3-32931711 Факс: + 81-3-32931711
Поступило: 6 февраля 2019 г.
Началась экспертная оценка : 6 февраля 2019 г.
Первое решение : 14 марта 2019 г.
Доработано: 18 марта 2019 г.
Принято: 24 марта 2019 г.
Статья в прессе : 25 марта 2019 г.
Опубликована онлайн: 28 апреля 2019 г.
ВВЕДЕНИЕ
Helicobacter pylori ( H.pylori ), одна из наиболее распространенных бактериальных инфекций, поражает примерно 50% населения мира [1]. Инфекция H. pylori является основной причиной гастрита, язв желудка и двенадцатиперстной кишки, лимфоидной ткани слизистой оболочки и рака желудка [2]. Эрадикационная терапия H. pylori , как было доказано, улучшает воспаление желудка, способствует заживлению язв и снижает заболеваемость раком желудка [3,4]. Кроме того, для обнаружения и искоренения H.pylori у пациентов с симптомами диспепсии, но с низким риском рака желудка [5].
Эрадикационная терапия H. pylori становится все более сложной задачей из-за повышения устойчивости к противомикробным препаратам. Ранее для искоренения H. pylori была рекомендована 7-дневная стандартная тройная терапия, состоящая из ингибитора протонной помпы (PPI), амоксициллина (AMPC) и кларитромицина (CAM) [6]. Тем не менее, произошло значительное снижение скорости эрадикации, достигнутой с помощью этого режима, из-за повышения устойчивости к противомикробным препаратам H.pylori . Устойчивость H. pylori достигла угрожающего уровня во всем мире, что сильно влияет на эффективность лечения. Всемирная организация здравоохранения (ВОЗ) недавно опубликовала свой первый в истории список устойчивых к противомикробным препаратам «приоритетных патогенов», который представляет собой каталог из 12 семейств бактерий, представляющих наибольшую угрозу для здоровья человека. Они указали три приоритетных статуса: критический, высокий и средний: устойчивый к САМ H. pylori классифицирован как высокоприоритетная бактерия того же уровня, что и устойчивый к ванкомицину Enterococcus faecium и устойчивый к метициллину Staphylococcus aureus .Кроме того, устойчивость к метронидазолу (MNZ) и фторхинолонам, которые в основном используются в качестве терапии спасения [7], в последнее время также возросла до более чем 15% во многих регионах мира [8,9]. Таким образом, простого предотвращения CAM при эрадикационной терапии H. pylori недостаточно для предотвращения и снижения устойчивости к противомикробным препаратам H. pylori . Фактически, недавнее исследование влияния введенной правительством ограничительной политики в отношении антибиотиков на уровень устойчивости H.pylori на Тайване, указывает на повышение устойчивости к левофлоксацину после ограничения приема макролидов [10].
ПОСЛЕДНИЙ СТАНДАРТ H. PYLORI ТЕРАПИИ И ПРОБЛЕМЫ АНТИМИКРОБНОЙ РЕЗИСТЕНТНОСТИ
Ожидается, что схемы лечения позволят преодолеть растущее распространение резистентных штаммов H. pylori и достичь уровня эрадикации> 90%. Уровни эрадикации для схем лечения первого ряда H. pylori , опубликованные в метаанализе и в исследовании уровней эрадикации двойной терапии на основе фонопразана, показаны в таблице 1.Недавно международные руководства рекомендовали висмутсодержащую четырехкомпонентную терапию (BQT) или сопутствующую четырехкомпонентную терапию (CQT) без висмута в качестве лечения первой линии для H. pylori в областях с высокой устойчивостью к CAM и / или MNZ [5 , 11,12]. И BQT, и CQT содержат PPI и два-три вида антибиотиков, включая AMPC, CAM, MNZ, нитроимидазол и тетрациклин, с более длительной продолжительностью лечения, составляющей 10–14 дней. Сообщается, что приемлемые уровни эрадикации> 90% были достигнуты при использовании обоих режимов.Хотя BQT и CQT обеспечивают приемлемую скорость эрадикации H. pylori , они имеют много ограничений, таких как сложный протокол, высокая стоимость, побочные эффекты и плохое соблюдение пациентом режима лечения из-за нескольких комбинаций лекарств [13]. Кроме того, эти схемы не должны способствовать устойчивости к противомикробным препаратам H. pylori ; более того, они могут способствовать развитию устойчивости в будущем из-за использования нескольких антибиотиков в течение длительного времени. Тревожные глобальные показатели устойчивости к H. pylori у пациентов, ранее не получавших лечения, могут быть коррелированы с растущим и неконтролируемым использованием антибиотиков, которые обычно используются для H.pylori эмпирической терапии и в терапии других распространенных инфекций в общей популяции [14]. Увеличение использования антибиотиков во всем мире привело к устойчивости к противомикробным препаратам у многих бактерий, включая H. pylori , что привело к снижению показателей успешности лечения H. pylori . Эти схемы также можно улучшить, чтобы оптимизировать использование антибиотиков для предотвращения устойчивости к противомикробным препаратам.
Таблица 1 Схемы лечения для препаратов первой линии Helicobacter pylori и показатели успешной ликвидации.| Схемы лечения | PPI | Антибиотики | Продолжительность лечения | Частота эрадикации | TC 125 мг четыре раза в день ; MNZ 125 мг четыре раза в день | 10 дней | 90% [35] |
| Сопутствующая четырехкратная терапия | Эзомепразол 20-40 мг два раза в день ; Лансопразол 30 мг два раза в день ; Омепразол 20-40 мг два раза в день ; Пантопразол 40 мг два раза в день ; Рабепразол 10-20 мг два раза в день | AMPC 750 мг-1 г два раза в день ; КАМ 200-500 мг два раза в день ; MNZ или TNZ 250-500 мг два раза в день | 5-14 дней | 83% [36] |
| Стандартная тройная терапия | Эзомепразол 40 мг два раза в день ; Лансопразол 30 мг два раза в день ; Пантопразол 40 мг два раза в день ; Рабепразол 10-20 мг два раза в день | AMPC 500 мг-1 г два раза в день ; CAM 200-500 мг два раза в день | 7 дней [37]; 14 d [38] | 73% [37]; 81% [38] |
| Двойная терапия высокими дозами | Эзомепразол 20 мг 4 раза в день ; Омепразол 40 мг 4 раза в день ; Рабепразол 10-20 мг 4 раза в день | AMPC 750 мг 4 раза в день | 14 дней | 86% [39] |
| Тройная терапия на основе вонопразана | фонопразан 20 мг 2 раза в день ПК ; CAM 200-400 мг два раза в день | 7 дней | 88% [37] | |
| Двойная терапия на основе вонопразана | вонопразан 20 мг два раза в день | AMPC 500 мг три раза в день | 7 дней | 91 32]
ВОЗ запустила Глобальный план действий по устойчивости к противомикробным препаратам, чтобы как можно дольше обеспечить непрерывность возможности лечения и профилактики инфекционных заболеваний с помощью эффективных и безопасных лекарственных средств, которые имеют гарантированное качество, используются ответственно и доступны для населения. всем кому они нужны.В этом документе перечислены пять целей, а четвертая цель — «оптимизировать использование противомикробных препаратов для защиты здоровья человека и животных». Они заявляют, что «степень сокращения глобального потребления антибиотиков человеком, потребления антибиотиков, используемых в производстве продуктов питания, и использования медицинских и ветеринарных противомикробных агентов для других целей, помимо здоровья человека и животных» является потенциальной мерой эффективности для оптимизации использование противомикробных препаратов для лечения людей и животных.Таким образом, повышение устойчивости к САМ и наличие множественной устойчивости к различным семействам антибиотиков должны быть решены путем соответствующего использования антибиотиков в лечении H. pylori . Тестирование на чувствительность к противомикробным препаратам — лучший способ оптимизировать и сократить количество антибиотиков для лечения эрадикации H. pylori , а также для лечения других распространенных инфекций. Рекомендуется тестирование на чувствительность к противомикробным препаратам, чтобы можно было адаптировать эрадикационную терапию, представленную в международных руководствах [5], для обеспечения успешной ликвидации [15,16].Однако тестирование на чувствительность к противомикробным препаратам не является рутинной клинической практикой из-за инвазивности процедуры эндоскопии, трудоемкости, доступности лабораторных помещений для культивирования и соображений стоимости [17]; Разрабатываются неинвазивные методы [18].
ПЕРСПЕКТИВЫ НОВЫХ СТРАТЕГИЙ ПО ОБЕСПЕЧЕНИЮ ЭРАДИКАЦИИ H. PYLORI И ПРЕДУПРЕЖДЕНИЯ АНТИМИКРОБНОЙ РЕЗИСТЕНТНОСТИ
Новая стратегия, которая могла бы обеспечить достаточные темпы эрадикации, а также уменьшить количество антибиотиков, необходима для предотвращения будущей устойчивости к противомикробным препаратам ЧАС.pylori . Двойная терапия с AMPC и PPI может быть возможным решением, потому что этот режим представляет собой терапию с одним антибиотиком, и хорошо известно, что H. pylori вряд ли устойчив к AMPC. В настоящее время уровень устойчивости H. pylori к AMPC остается низким (0-5%) [19,20]. Двойная терапия, включающая ИПП и АМРС, была впервые представлена в 1990-х годах в качестве схемы первой линии для лечения инфекции H. pylori [21]. Поскольку двойная терапия ИПП и АМПК в стандартных дозах не приводила к удовлетворительным результатам лечения [22,23], впоследствии ее использовали в качестве лечебного средства.Недавно Yang и др. [24] сообщили, что двойная терапия высокими дозами, состоящая из AMPC и рабепразола, достигла уровня эрадикации 95,3% при терапии первой линии и 89,3% при терапии экстренной помощи. Однако этот метод требовал высокой частоты и высоких доз AMPC и PPI в течение более длительного времени (, например, ., рабепразол 20 мг и амоксициллин 750 мг 4 раза в день в течение 14 дней) для достижения приемлемой скорости эрадикации> 90. %, что привело к высокой стоимости, нежелательным побочным эффектам и плохому соблюдению пациентом режима лечения.
Одна интересная возможность — заменить обычные ИПП на вонопразан для использования в двойной терапии. Двойная терапия на основе вонопразана может быть альтернативной схемой лечения для эрадикации H. pylori , которая может обеспечить достаточную скорость эрадикации H. pylori и минимизировать устойчивость к противомикробным препаратам. Ключом к успешному режиму двойной терапии является нейтральная среда, генерируемая ИПП, подходящая для роста бактерий; это приводит к тому, что спящий H. pylori входит в репликативное состояние и составляет H.pylori , чувствительный к AMPC. Вонопразан — новый конкурентный блокатор кислоты, связанный с калием, который оказывает сильное и продолжительное действие на ингибирование секреции кислоты [25,26]. Кроме того, на фармакокинетические свойства вонопразана не влияют полиморфизмы CYP2C19 [27,28]. Сообщается, что семь дней стандартной тройной терапии, содержащей вонопразан, обеспечили примерно 90% -ную степень эрадикации, связанную с эффективным ингибированием кислоты желудочного сока и поддержанием высокого рН желудочного сока, и имели высокий профиль безопасности независимо от возраста [29–31].Насколько нам известно, существует только одно исследование двойной терапии фонопразаном и AMPC; это исследование показало, что схема, состоящая из вонопразана 20 мг два раза в день и AMPC 500 мг три раза в день в течение семи дней, обеспечивала достаточный уровень эрадикации 93,8% инфекции H. pylori [32]. Эта семидневная двойная терапия на основе фонопразана может иметь дополнительные преимущества с точки зрения соблюдения режима лечения и медицинских затрат, поскольку используется меньше агентов и продолжительность терапии короче, чем у других недавних стандартных схем лечения (таких как BQT, CQT, и последовательные терапии).Двойная терапия на основе вонопразана может быть недавним прорывом, который может обеспечить удовлетворительную скорость эрадикации при использовании минимального количества антибиотиков и короткой продолжительности лечения. Кроме того, уменьшение количества антибиотиков может предотвратить изменения и дисбиоз в составе микробиоты кишечника, которые вызваны антибиотиками, используемыми в эрадикационной терапии H. pylori [33]. Хотя двойная терапия на основе вонопразана потенциально имеет эти преимущества, она также имеет несколько ограничений для применения в клинических условиях.Во-первых, вонопразан доступен в нескольких странах. Вонопразан был разработан и запущен в Японии в 2015 году. Однако теперь он доступен в нескольких азиатских странах, включая Филиппины, Сингапур и Таиланд, и был одобрен в других регионах, включая Южную Америку (такие страны, как Аргентина и Перу). Таким образом, вонопразан может стать доступным и может быть использован для эрадикационной терапии H. pylori во всем мире в ближайшем будущем. Во-вторых, этот режим нельзя использовать у пациентов с аллергией на пенициллин, и, следовательно, у этих пациентов следует проводить тестирование на чувствительность к противомикробным препаратам, чтобы оптимизировать H.pylori эрадикационная терапия. Хотя традиционный тест на чувствительность к противомикробным препаратам является инвазивным из-за необходимости эндоскопии и биопсии, как упоминалось выше, недавно был разработан неинвазивный молекулярный тест с использованием образца фекалий [34]. Этот метод включает выделение ДНК H. pylori из стула и обнаружение точечных мутаций, обеспечивающих устойчивость к противомикробным препаратам, с помощью полимеразной цепной реакции. Этот метод следует рассматривать для тестирования чувствительности к антимикробным препаратам у пациентов с аллергией на пенициллин до H.pylori эрадикационная терапия. Наконец, есть немного данных и исследований относительно этой схемы. Необходимо провести дальнейшие исследования, чтобы доказать его эффективность и безопасность.
ЗАКЛЮЧЕНИЕ
В этом обзоре мы очерчиваем актуальную глобальную проблему устойчивости к противомикробным препаратам H. pylori и предлагаем наши перспективы подхода к решению этой проблемы. Лечение H. pylori становится все более сложной задачей из-за растущей устойчивости к противомикробным препаратам не только к САМ, но также к MNZ и фторхинолонам.Таким образом, существует необходимость в разработке новых методов эрадикационной терапии H. pylori , которые обеспечивают приемлемую скорость эрадикации, лучший профиль безопасности и переносимости и хорошее соблюдение пациентом режима лечения, предотвращая при этом повышение устойчивости к противомикробным препаратам H. Одна интересная возможность — использование вонопразана в двойной терапии с AMPC, уровень эрадикации которого, как было показано, превышает 90%. Для проверки и подтверждения этого вывода в будущем необходимо провести крупномасштабные рандомизированные контрольные испытания.
Источник рукописи: Приглашенная рукопись
Тип специальности: Гастроэнтерология и гепатология
Страна происхождения: Япония
Классификация отчета экспертной оценки
Оценка A (отлично): 0
Оценка B (очень хорошо): 0
Оценка C (хорошо): C, C
Оценка D (удовлетворительно): 0
Оценка E (плохо): 0
P-рецензент: Bang CS, Ierardi E S-редактор: Ma RY L-редактор: A E- Редактор: Song H
Спасательная терапия по схеме рифабутина при резистентной инфекции Helicobacter pylori с двойными лекарственно-устойчивыми штаммами | BMC Gastroenterology
Возможные причины неудач эрадикационной терапии включают резистентность к антибиотикам, курение, высокую бактериальную нагрузку до лечения, бактериальный генотип, плохую комплаентность пациента и полиморфизм метаболизма ИПП.С увеличением распространенности устойчивости к противомикробным препаратам скорость эрадикации H. pylori снизилась. В консенсусном отчете Маастрихт IV / Флоренции рекомендуется проводить культуральные исследования и тестирование на чувствительность к противомикробным препаратам после одного или двух неудачных попыток лечения разными антибиотиками [3]. Между тем, согласно консенсусному отчету Маастрихт V / Флоренции, после первой неудачи, если проводится эндоскопия, рекомендуется посев и стандартный тест на чувствительность к противомикробным препаратам для адаптации лечения [11].
Распространенность штаммов H. pylori , устойчивых к более чем одному антибиотику, составила 15% в США и 8,9% в Европе [12]. Согласно исследованию Liou et al. [13], вторичная резистентность к кларитромицину, левофлоксацину и метронидазолу составила 92,5, 70,1 и 87,7%, соответственно, у пациентов, получавших эти антибиотики в ходе предшествующей терапии на Тайване.
При выборе терапии спасения следует избегать ранее применявшихся антибиотиков.Использование режима спасения для пациентов с персистирующей инфекцией H. pylori становится все более распространенным сценарием, но остается проблемой для клиницистов, поскольку доступно лишь несколько антибиотиков. В настоящее время стандартного режима спасения все еще нет. Наши данные показали, что 10-дневная тройная терапия на основе рифабутина хорошо переносилась и дала приемлемый уровень эрадикации H. pylori для пациентов, инфицированных штаммами с двойной лекарственной устойчивостью к кларитромицину и левофлоксацину.
Рифабутин ингибирует бета-субъединицу ДНК-зависимой РНК-полимеразы H. pylori , которая кодируется геном rpoB . Тройная терапия на основе рифабутина применялась в качестве экстренного лечения. Низкий уровень устойчивости (0,24%) к рифабутину отмечен у штаммов H. pylori , выделенных от 414 японских пациентов. Единственный обнаруженный устойчивый к рифабутину штамм показал точечную мутацию в гене rpoB и был изолирован от пациента, который в анамнезе лечился рифампицином от туберкулеза легких.Средний показатель устойчивости к рифабутину H. pylori (рассчитанный на основе 11 исследований, включающих 2982 пациента) составил 1,3% (95% доверительный интервал [ДИ], 0,9–1,7%) [14]. Соответствующие показатели излечения для терапии рифабутином второй линии (223 пациента), третьей линии (342 пациента) и четвертой / пятой линии (95 пациентов) составили 79% (95% ДИ, 67-92%), 66%. (95% ДИ, 55–77%) и 70% (95% ДИ, 60–79%) соответственно [14].
Клинические рекомендации Американского колледжа гастроэнтерологии предлагают тройную схему лечения на основе рифабутина, состоящую из ИПП, амоксициллина и рифабутина в течение 10 дней в качестве рекомендуемой схемы спасения, но у нее очень низкое качество доказательств для продолжительности [15].Однако идеальная продолжительность лечения по схеме рифабутина остается неясной. Van Zanten et al. Сообщают, что ИПП дважды в день, амоксициллин 1 г два раза в день и рифабутин 300 мг один раз в день в течение 1 недели были прописаны 16 пациентам для неотложной терапии, и показатель успеха составил 63% [16]. В некоторых отчетах 7-дневный курс был столь же эффективен, как и 10-14-дневные схемы, в то время как другие обнаружили, что такая более короткая продолжительность резко снижает эффективность с точки зрения показателей эрадикации. Похоже, что высокие дозы ИПП играют определенную роль.Предыдущее исследование, проведенное в Корее, показало, что более высокая скорость эрадикации была достигнута, когда двойные дозы (лансопразол 60 мг два раза в день) вводились вместо стандартных доз (лансопразол 30 мг два раза в день) с той же комбинацией рифабутин-амоксициллин (намерение лечить, 96,3%). против 78,1%. p = 0,51) [17].
Недавнее исследование Fiorini et al. [18] сообщили, что эффективность 12-дневной тройной терапии на основе рифабутина (с эзомепразолом 40 мг 2 раза в день, амоксициллин 1 г 2 раза в день и рифабутин 150 мг 1 раз в день) для пациентов, инфицированных штаммами с множественной лекарственной устойчивостью (кларитромицин, метронидазол и левофлоксацин). ) было 82.9% (95% ДИ, 78,3–87,5) при анализе намерения лечить и 88,7% (95% ДИ, 84,7–92,7) при анализе по протоколу. Средняя частота побочных эффектов составила 22% (19–25%). Долгосрочное проспективное исследование в большой когорте с участием 302 пациентов с трудностями в лечении показало, что рифабутин в дозе 150 мг, амоксициллин 1 г и стандартная доза ингибитора протонной помпы дважды в день в течение 14 дней позволили достичь скорости эрадикации у 72,7% (на один- протокол) и 71,5% (намерение лечить) соответственно. Однофакторный анализ показал, что пол, этническое происхождение, курение и семейный анамнез желудочных заболеваний не были прогностическими факторами ответа [19].За исключением комбинации с амоксициллином и ИПП, сообщалось, что четырехкратная комбинация с рифабутином, висмутом, миноциклином и рабепразолом достигла 77,7% степени эрадикации, но в исследование был включен только 21 пациент [20]. Эффективность лечения рифабутином суммирована в таблице 1.
Таблица 1 Сводка результатов тройной терапии на основе рифабутина при инфекции H. pyloriОдним из важных факторов, вызывающих обеспокоенность при лечении рифабутином, были побочные эффекты миелотоксичности. Более низкие дозы и / или более короткая продолжительность снизят вероятность миелотоксичности.В настоящем исследовании мы использовали рифабутин 150 мг 2 раза в день, амоксициллин 1 г 2 раза в день и эзомепразол 40 мг 2 раза в день в течение 10 дней, при этом нейтропении не наблюдалось.
Наше исследование имеет некоторые ограничения. Во-первых, это было одноцентровое исследование, и размер выборки был небольшим. Примерно у 5–10% пациентов не удалось ликвидировать инфекцию H. pylori после широко применяемой терапии на основе кларитромицина и левофлоксацина. Однако в недавней литературе основное внимание уделяется эрадикации H. pylori с помощью тройной терапии на основе рифабутина (таблица), количество случаев варьировалось от 16 до 302, и размер нашей выборки мог быть приемлемым.Во-вторых, в нашем исследовании отсутствует рандомизация по разным режимам спасения. Например, гораздо более полезным будет более крупное многоцентровое исследование, сравнивающее это лечение с терапией висмутом квадриком. В-третьих, есть некоторая озабоченность по поводу широкого использования рифабутина для ликвидации H. pylori . Рифабутин использовался в качестве антимикобактериального препарата, и показания к нему следует подбирать очень тщательно, чтобы избежать дальнейшего развития резистентности. Наконец, необходимо долгосрочное наблюдение за теми пациентами, которым не удалось принять препарат H.pylori .
Эффективность двух различных доз левофлоксацина в лечении инфекции Helicobacter pylori: проспективное одноцентровое рандомизированное клиническое исследование
Дизайн исследования
Это было проспективное рандомизированное контролируемое одноцентровое клиническое исследование. Это исследование было проведено в Шестой дочерней больнице Медицинского университета Гуанчжоу (Народная больница Цинюань) в период с апреля по сентябрь 2017 г. Пациенты с диспепсией, направленные на верхнюю эндоскопию с диагнозом хронический гастрит с диспепсией или атрофией / эрозией слизистой оболочки, имели право на включение у них был H.pylori , были в возрасте 20–60 лет и никогда ранее не получали лечения от инфекции H. pylori . Пациенты, которые соответствовали одному из следующих критериев, были исключены из исследования: пациенты, принимавшие какие-либо лекарства, которые могли повлиять на результаты исследования, такие как антибиотики, соли висмута, ИПП или блокаторы гистаминовых 2-рецепторов, в течение предыдущих 4 недель; пациенты с язвенной болезнью, злокачественными новообразованиями желудочно-кишечного тракта, перенесенными операциями на желудке или пищеводе или тяжелыми сопутствующими заболеваниями; пациенты с аллергией на какой-либо из исследуемых препаратов в анамнезе; беременные или кормящие пациентки; и пациенты, которые не могли дать информированное согласие сами или отказались участвовать в исследовании.Это исследование было одобрено институциональным наблюдательным советом Шестой дочерней больницы Медицинского университета Гуанчжоу. Перед началом процедуры исследования каждый пациент предоставил письменное информированное согласие. Дизайн и процедуры исследования были выполнены в соответствии с принципами Хельсинкской декларации. Это исследование было зарегистрировано в Китайском регистре клинических испытаний 13.01.2017 (регистрационный номер клинического исследования: ChiCTR-IPD-17010408).
Вмешательство
Подходящие пациенты были случайным образом разделены на две группы эрадикации с компьютерным случайным порядком в соотношении 1: 1, чтобы принять одну из следующих четырехкратных схем, содержащих амоксициллин, в течение 14 дней.Группа А получала эзомепразол 20 мг 2 раза / сут за 30 мин до еды, амоксициллин 1000 мг 2 раза / сут через 30 мин после еды, коллоидный пектин висмута 200 мг 2 раза / сут через 30 мин после еды и левофлоксацин 500 мг 1 раз / сут через 30 мин после еды. Группа Б получала эзомепразол 20 мг 2 раза / сут за 30 мин до еды, амоксициллин 1000 мг 2 раза / сут через 30 мин после еды, коллоидный пектин висмута 200 мг 2 раза / сут через 30 мин после еды и левофлоксацин 200 мг 2 раза / сут через 30 мин после еды.
Медицинский персонал отделения гастроэнтерологии подробно объяснил всем включенным пациентам схему лечения и возможные побочные эффекты перед началом терапии.Их также попросили записывать симптомы побочных эффектов во время лечения. Пациентам давали устные и письменные инструкции о важности регулярного приема лекарств и советовали не прекращать прием лекарств в случае легких или умеренных побочных эффектов. Пациентам рекомендовалось вызвать врачей, если побочные эффекты были серьезными. Пациентов просили вернуться в течение 3 дней после эрадикации H. pylori для оценки терапевтического соответствия и определения частоты побочных эффектов.
Обнаружение H. pylori
Пациенты прошли 13 дыхательных тестов на C-мочевину (UBTs; UCBT Kit, Atom High Tech, Пекин, Китай) через 8 недель после уничтожения H. pylori для оценки терапевтического результата. Другие препараты, которые могли повлиять на результаты, были запрещены во время исследования. Антибиотики, соли висмута, ИПП и блокаторы рецепторов гистамина-2 были отменены как минимум на 4 недели до проведения 13 C – UBT. Пациентам было рекомендовано ничего не принимать внутрь за 2 часа до процедуры 13 C-UBT.Базовый образец выдыхаемого воздуха получали путем продувания через одноразовую пластиковую соломинку в контейнер емкостью 20 мл, а затем капсулу, содержащую 75 мг 13 C-мочевины, давали пациентам со 100 мл воды. Другой образец дыхания был собран через 30 минут. Базовые и 30-минутные образцы дыхания анализировали с помощью масс-спектрометра. Тест считался положительным, если разница между исходным образцом и 30-минутным образцом превышала 4,0 единицы.
Безопасность и соответствие
Побочные реакции на лекарства и соблюдение режима приема лекарств были оценены научным персоналом.Нежелательные реакции на лекарства оценивались с помощью открытых вопросов в самоотчетах пациентов и при физикальных обследованиях. Неблагоприятные лекарственные реакции были классифицированы как легкие (не мешающие распорядку дня), умеренные (влияющие на распорядок дня), тяжелые (существенно влияющие на распорядок дня и прекращение приема лекарств) и серьезные (госпитализация, инвалидность, требующая вмешательства для предотвращения необратимого повреждения или смерти). . Учитывались также лечебные препараты, которые пациенты не принимали. Комплаентность считалась низкой, если принималось менее 80% лечебных препаратов.
Сбор данных
Были собраны демографические и клинические данные. Первичной конечной точкой исследования была степень эрадикации H. pylori . Вторичными конечными точками были частота побочных реакций на лекарства и соблюдение каждого режима. Оценивались профиль безопасности (частота нежелательных реакций) и комплаентность (прием препаратов). Инфекция H. pylori определялась по разнице между исходным и 30-минутным образцами, превышающей 6.0 шт. Инфекция H. pylori считалась искорененной, если результат однократного теста 13 C-UBT был отрицательным.
Статистический анализ
Размер нашей выборки (N = 390) был запланирован перед исследованием, исходя из ранее сообщенной степени эрадикации при использовании четырехкомпонентной схемы приема амоксициллина, составляющей приблизительно 90%. Расчеты основывались на предположениях a = 0,05 и 1 – β = 0,80 и ожидаемой разнице между группами 10% или больше, что считалось минимальной клинически значимой разницей.Проценты использовались для описания категориальных переменных, а средние (стандартное отклонение) или медианы (диапазон) использовались для описания непрерывных переменных. Для категориальных переменных ассоциации между 2 группами оценивались с помощью критерия хи-квадрат (при необходимости применяя поправку Фишера), а для непрерывных переменных использовался t-критерий для двух выборок или U-критерий Манна-Уитни. Все статистические анализы были выполнены с использованием программного обеспечения IBM SPSS 18.0. Все тесты проводились с параметром a-level, установленным на 0.05 (двусторонний).
Лечение после неудачи: проблема «нереагирующих»
Сводка
Хотя наиболее эффективные в настоящее время схемы лечения излечивают около 90% инфекций, 10% пациентов остаются положительными на Helicobacter pylori . Несколько факторов способствуют неэффективности лечения. К ним относятся соблюдение пациентом режима лечения, устойчивость бактерий к антибиотикам и проблемы, связанные с лечением. Неэффективность лечения приводит к развитию устойчивости бактерий к метронидазолу и кларитромицину.Повторное лечение может быть предпринято после рассмотрения нескольких различных стратегий: повторение той же схемы с полными дозами лекарств и более продолжительной продолжительностью лечения, или выбор других схем, чтобы избежать ранее использованного антибиотика, или переход на четырехкратный прием ингибитора протонной помпы (ИПП). терапия или тройная терапия на основе ранитидина цитрата висмута (RBC). В принципе, желательны полные дозы и более длительное лечение. Поскольку повторное лечение всегда затруднено, выбор наилучшей доступной схемы лечения первой линии по-прежнему остается лучшим «спасательным» лечением.
Прошло более 12 лет с тех пор, как было опубликовано первое рандомизированное плацебо-контролируемое клиническое испытание по искоренению инфекции H pylori .1 Лечение для искоренения инфекции эволюционировало от отдельных агентов к множественным комбинированным методам лечения, состоящим из антисекреторного агента и одного или другие антибиотики. 2 3 Лечение, достигающее уровня эрадикации более 80% на основе намерения лечить, было рекомендовано большинством консенсусных конференций и авторитетных источников.4-7 В настоящее время они включают тройную терапию на основе висмута, тройную терапию, включающую ИПП и два антибиотика, четырехкратную терапию или недавние комбинации с эритроцитами и двумя антибиотиками. Хотя эти комбинированные методы лечения очень эффективны для искоренения инфекции H pylori у большинства пациентов, у значительной части пациентов эти методы лечения неэффективны по целому ряду различных причин, таких как бактериальная резистентность, плохая комплаентность или факторы, связанные с лечением. 9 Повторное лечение этих пациентов, не ответивших на лечение, остается сложной проблемой, поскольку некоторым пациентам может потребоваться более двух попыток для искоренения инфекции.В этой статье представлен обзор текущей литературы о возможных причинах неэффективности лечения H pylori , обсуждается несколько подходов к повторному лечению и даются предложения для будущих исследований.
Насколько серьезна проблема неудачного лечения?
Чтобы ответить на этот вопрос, нам необходимо оценить эффективность наиболее рекомендуемых в настоящее время схем лечения. В комплексном мета-анализе с участием 294 лечебных групп и 15 971 пациента мы обнаружили, что наиболее эффективными схемами лечения, о которых сообщалось до 1997 г., была семидневная тройная терапия, состоящая из ИПП, кларитромицина (C) по 500 мг два раза в день и амоксциллина (A). или метронидазол (M), или четырехкратная терапия с ИПП и висмутом (B), метронидазолом (M) и тетрациклином (T).10 Эти схемы обеспечивают общий уровень эрадикации не менее 90% за счет анализа намерения лечить. Однако между исследованиями этих схем лечения существует большая разница в эффективности, с 95% доверительным интервалом (ДИ) от 81% до 100%. Это означает, что до 19% пациентов не получат этого лечения и останутся положительными на H pylori (таблица 1). В недавнем обзоре тройной терапии на основе эритроцитов Pipkin и др. Показали, что совокупная скорость эрадикации для семидневных эритроцитов, кларитромицина и метронидазола составляла 89% (95% ДИ 87-91%) по анализу намерения лечения и 82%. (95% ДИ от 79 до 85%) для эритроцитов, кларитромицина и амоксициллина соответственно.11 Это говорит о том, что до 21% пациентов не получат тройную терапию на основе эритроцитов и потребуют повторного лечения инфекции.
Таблица 1Эрадикация H. pylori: объединенные показатели успеха и неудач с наиболее часто используемыми схемами
Факторы, приводящие к неэффективности лечения
ФАКТОРЫ, СВЯЗАННЫЕ С ПАЦИЕНТОМ
Плохое соответствие
Плохое соблюдение режима лечения считается основным фактором неэффективности лечения. В пошаговом регрессионном анализе факторов, влияющих на эффективность тройной терапии на основе висмута, Graham и др. показали, что комплаентность пациента была наиболее важным фактором, предсказывающим успех лечения.9 Показатель излечения H pylori составил 96% для пациентов, которые принимали более 60% прописанных лекарств, и только 69% для тех, кто принимал меньше (p = 0,001). В недавнем исследовании неэффективности лечения инфекции H pylori в амбулаторных условиях 30 инфицированных H pylori пациентов получали лансопразол (L) 30 мг два раза в день, амоксициллин 1000 мг два раза в день и кларитромицин 500 мг два раза в день для семь дней12. Соответствие пациенту оценивалось с помощью контейнеров системы мониторинга событий приема лекарств (МЭМС), которые содержали скрытое электронное устройство, регистрирующее время открытия.Общий уровень эрадикации составил 63%. У пациентов, которые принимали более 60% предписанных лекарств, показатель излечения составил 72% (18/25), тогда как уровень эрадикации был только 20% (1/5) у тех, кто принимал менее 60% прописанных таблеток. (p = 0,028) .12 Эти результаты подтверждают, что соблюдение пациентом режима лечения играет важную роль в успехе эрадикационного лечения H. pylori . Однако значительная часть неудач лечения в этом исследовании не может быть объяснена плохой комплаентностью, поскольку уровень эрадикации составил только 72% у пациентов, которые принимали более 60% прописанных лекарств.
Бактериальная устойчивость
Устойчивость бактерий к метронидазолу или кларитромицину является важным фактором, приводящим к неэффективности лечения. Существует хорошая корреляция между резистентностью бактерий к кларитромицину и неэффективностью его эрадикации; однако клиническая значимость устойчивости H pylori к нитроимидазолам, обнаруженной in vitro, является спорной. Некоторые исследования показывают, что тройная терапия, состоящая из ИПП, кларитромицина и нитроимидазола, эффективна для искоренения инфекции H pylori у пациентов, у которых есть штаммы, устойчивые к метронидазолу13-15; другие показывают, что эффективность значительно снижается при наличии резистентности к метронидазолу.16-19 На эти различия могли повлиять несколько факторов, в том числе различные методы, используемые для диагностики устойчивости к метронидазолу, 20 21 различное пороговое значение для определения минимальных ингибирующих концентраций, 22 23 и, вероятно, в разных местах, где были взяты образцы биопсии.24 У пациентов, у которых есть штаммы, устойчивые к метронидазолу, скорость эрадикации примерно на 30% ниже, чем у пациентов, инфицированных штаммами, чувствительными к метронидазолу, при лечении висмутом, метронидазолом и тройной терапией тетрациклином или амоксициллином .8 Хотя ИПП может частично преодолеть влияние устойчивости к метронидазолу на эрадикацию H pylori 25, уровень эрадикации, достигаемый с помощью PAM у пациентов, инфицированных штаммами, устойчивыми к метронидазолу, примерно на 30% ниже, чем у тех, кто инфицирован чувствительными к метронидазолу штаммами. 23 26 год 27 Аналогичная разница также наблюдается, когда пациенты получают комбинацию PMC.8 28 год
Распространенность устойчивости H pylori к кларитромицину, как правило, намного ниже, чем к метронидазолу во всем мире.8 Однако устойчивость H pylori к кларитромицину оказывает значительное влияние на эффективность лечения схем, содержащих этот препарат. Наличие первичной бактериальной резистентности к кларитромицину почти на 100% свидетельствует о неэффективности лечения при двойной терапии, состоящей из омепразола и кларитромицина.29 Следовательно, двойная терапия не должна использоваться. В исследованиях с комбинациями PAC, вводимыми в течение 10–14 дней, уровни эрадикации H pylori варьировались от 83% до 98% у пациентов, инфицированных штаммами, чувствительными к кларитромицину, тогда как только 25-50% инфекций были ликвидированы у тех, кто имел штаммы, устойчивые к кларитромицин.8
Вторичная резистентность бактерий к метронидазолу или кларитромицину значительно возрастает у пациентов, которые не прошли предыдущую эрадикационную терапию. Бакли и др. сообщили, что из 87 пациентов, получавших семидневную ЧМК (омепразол 20 мг один раз в день), 31 пациент (35,6%) был инфицирован штаммами, устойчивыми к метронидазолу, а трое (3,4%) были инфицированы штаммами, устойчивыми к оба антибиотика.16 Вторичная резистентность бактерий к кларитромицину развилась у семи (58.3%) из 12 пациентов со штаммами, резистентными к метронидазолу, которые не прошли курс лечения.16 В другом исследовании резистентность к метронидазолу была обнаружена у 28% пациентов (7/25) до лечения эрадикацией, но увеличилась до 66,7% (12/18) после безуспешного лечения. со схемами, содержащими метронидазол.30 Резистентные к кларитромицину штаммы также увеличились с 32% до лечения до 70,6% после безуспешного лечения.30 Это предполагает, что предыдущая неудача лечения является значительным фактором, способствующим приобретенной устойчивости бактерий как к метронидазолу, так и к кларитромицину.
Штаммы H. pylori
Результаты недавних исследований также показывают, что статус бактериальных штаммов cagA – также является фактором риска неудачи лечения. В многоцентровом исследовании Marais et al показали, что эрадикация H. pylori была достигнута у 87% пациентов (54/62), инфицированных штаммами cagA + , при лечении семидневной тройной терапией на основе ИПП по сравнению с 69. % (47/68) из тех, у кого штаммы cagA — .31 Это наблюдение может объяснить, по крайней мере частично, разницу в уровнях эрадикации H pylori , которые сообщаются между пациентами с язвенной болезнью (PUD) и пациентами с неязвенной диспепсией (NUD), когда пациенты получают лечение те же схемы.32 Вирулентные штаммы инфекции H pylori более распространены у пациентов с ЯБ, чем у пациентов с ЯБ.33 Это могло способствовать более высокому уровню эрадикации, достигнутому у пациентов с ЯБ по сравнению с НУД в некоторых исследованиях.34 35 Однако, как обсуждалось ранее, комплаентность пациента играет важную роль в определении успеха лечения. По сравнению с пациентами с ЯБ, пациенты с ЯБ могут хуже переносить эрадикационную терапию из-за рефрактерности и разнообразного характера симптомов. Действительно, когда пациенты комплаентны более 90%, эрадикация может быть достигнута более чем у 90% пациентов с НУД, получавших ИПП, кларитромицин и амоксициллин или нитроимидазол (36). 37
ФАКТОРЫ, СВЯЗАННЫЕ С ЛЕЧЕНИЕМ
Составляющие схемы
Компоненты схемы лечения также играют важную роль в эрадикации H pylori , например, какие лекарства выбраны, количество и дозы лекарств, используемых в комбинации, частота дозирования и продолжительность лечения.Тройная терапия на основе ИПП значительно более эффективна для эрадикации H pylori , чем двойная терапия, состоящая из двух антибиотиков или ИПП плюс антибиотик. 28 ИПП, вводимые два раза в день, значительно более эффективны, чем один раз в день в сочетании с кларитромицином и амоксициллином или нитроимидазолом.11 38 Тройная терапия на основе ИПП может ликвидировать больше инфекций H. pylori при назначении в течение 10–14 дней, чем в течение семи дней. 39 Следовательно, хорошая комбинированная терапия должна включать полные дозы лекарств, оптимальную частоту дозирования и адекватную продолжительность лечения.
Стратегии оказания неотложной помощи после аварии
В ведении пациентов с неэффективным лечением можно предпринять несколько шагов. К ним относятся определение статуса устойчивости бактерий к метронидазолу и / или кларитромицину (или, что менее вероятно, к амоксициллину), и соблюдение пациентом предыдущей схемы лечения. Эта информация полезна для выбора надлежащей терапии спасения в отношении того, следует ли проводить повторное лечение с использованием полных доз лекарств и в течение более длительного периода с той же комбинацией или с различными комбинациями, чтобы избежать применения ранее использовавшегося антибиотика при подозрении на устойчивость бактерий к антибиотику.
Ricci и др. сообщили об исследовании 123 инфицированных H. pylori пациентов, получавших ИПП 20 мг два раза в день, амоксициллин 1 г два раза в день и кларитромицин 250 мг два раза в день в течение семи дней40. H pylori эрадикация была достигнута у 85% из 123 пациентов. Пятнадцать пациентов не прошли терапию и остались положительными на H pylori через четыре недели после лечения. Эти пациенты прошли второй курс эрадикационного лечения полной дозой кларитромицина 500 мг два раза в день и 10-дневный курс лечения.Инфекция H pylori была излечена у 67% (6/9) обследуемых пациентов.40 Этот результат позволяет предположить, что повторное лечение инфекции H pylori той же комбинацией все еще является выбором, когда статус устойчивости бактерий к антибиотикам не является приемлемым. известен. Однако необходимо использовать полные дозы и более длительную продолжительность лечения. Если пациентов лечат одной и той же комбинацией и в течение одной и той же продолжительности лечения, обычно сообщается о низком уровне эрадикации (41).
Поскольку приобретенная резистентность бактерий к метронидазолу или кларитромицину возникает в основном в результате неудачного предыдущего лечения, в терапии неотложной помощи обычно следует избегать применения этих антибиотиков и использовать различные комбинации для достижения высокой степени эрадикации.Тройная терапия на основе ИПП, как правило, очень эффективна для пациентов, у которых двойная терапия на основе ИПП оказалась неэффективной. 43 В случае неэффективности тройной терапии на основе ИПП, такой как семидневный омепразол (O), амоксициллин (A) и метронидазол (M), повторное лечение семидневным омепразолом 20 мг два раза в день, амоксициллином 1 г два раза в день и кларитромицином (C) 500 мг два раза в день оказались очень эффективными с вероятностью успеха 85% .44 При наличии устойчивости к метронидазолу и / или кларитромицину в рандомизированном контролируемом исследовании Houben et al. al , 41 неэффективен в отношении терапевтической неудачи по сравнению с семидневной четырехкратной терапией, состоящей из висмута (B), метронидазола (M), тетрациклина (T) и омепразола.Эрадикация H pylori была достигнута у 100% (11/11) пациентов, получавших OBMT, включая восемь пациентов, инфицированных устойчивыми к метронидазолу и / или кларитромицину штаммами H pylori , тогда как вероятность успеха составила только 25% (2 / 8) у пациентов, получавших OMC. Ни один из пациентов, инфицированных штаммами, устойчивыми к метронидазолу и / или кларитромицину, не ответил на OMC.41
Более свежие данные показывают, что тройная терапия на основе эритроцитов может преодолеть влияние резистентных к метронидазолу и кларитромицину штаммов на лечение эрадикационной терапии H pylori .В исследовании, опубликованном Wouden et al , 111 пациентов, инфицированных H pylori , лечились эритроцитами по 400 мг два раза в день, кларитромицином по 500 мг два раза в день и метронидазолом по 500 мг два раза в день в течение семи дней. Общий показатель успеха составил 96% при анализе намерения лечить. Инфекция была излечена у 95% (20/21) пациентов, у которых были штаммы, устойчивые к метронидазолу, и у 100% (4/4) пациентов, инфицированных штаммами, устойчивыми к кларитромицину, или штаммами, устойчивыми к метронидазолу, и штаммами, устойчивыми к кларитромицину.45 Поскольку количество пациентов, включенных в это исследование, было небольшим, эти многообещающие результаты необходимо подтвердить в будущих исследованиях. В одном недавнем анекдотическом сообщении также было высказано предположение, что фуразолидон можно использовать для замены кларитромицина или метронидазола в тройной терапии на основе ИПП для лечения H. pylori .46 В этом небольшом исследовании с участием 12 пациентов, инфицированных чувствительными к метронидазолу и чувствительными к кларитромицину штаммами H. pylori. , Graham и др. сообщили, что тройная терапия, состоящая из фуразолидона 100 мг три раза в день, омепразола 20 мг четыре раза в день и метронидазола 500 мг три раза в день или кларитромицина 500 мг три раза в день в течение 14 дней, успешно искоренила все инфекции.46 Этот многообещающий результат также нуждается в подтверждении в более крупных рандомизированных исследованиях.
Рекомендации крупных консенсусных конференций
Рекомендации по повторному лечению инфекции H pylori были сделаны на нескольких крупных консенсусных конференциях по всему миру.4-7 Европейская исследовательская группа Helicobacter pylori рекомендовала, чтобы в случае неэффективности лечения после рассмотрения предыдущее лечение или чувствительность к микробам, или и то, и другое.Четырехкратная терапия на основе ИПП может использоваться в случае неэффективности тройной терапии.6 В Азиатско-Тихоокеанском консенсусе предлагается, чтобы после неудачи лечения комбинацией кларитромицина и амоксициллина на основе РСА или эритроцитов можно было повторить тот же режим. После одной неудачи лечения схемой, содержащей метронидазол, лечение можно повторить, заменив метронидазол амоксициллином. Группа также рекомендовала семидневную четырехкратную терапию на основе ИПП в качестве дополнительной терапии.7 В Соединенных Штатах продолжительность лечения больше, чем рекомендованная в Европе, Азиатско-Тихоокеанском регионе и Канаде. 4 Согласованное совещание в США рекомендует двухнедельный курс лечения. 4 Увеличенная продолжительность лечения важна для управления лечением. неудача, которая может увеличить вероятность успеха повторного лечения40.
Какая стратегия «спасения» лучше всего?
Поскольку предыдущая неудача лечения приводит к развитию вторичной резистентности бактерий как к метронидазолу, так и к кларитромицину30, а эффективность повторного лечения также значительно снижается из-за количества предыдущих курсов лечения, 47 понятно, что чем выше вероятность успеха с лечением первой линии, тем ниже будет неудача лечения.Таким образом, выбор наилучшей доступной схемы лечения первой линии следует рассматривать как лучший подход к «спасительному» лечению. В регионах, где распространенность резистентности к метронидазолу среди населения в целом высока, следует использовать семидневную тройную терапию, включая ИПП в рекомендуемых дозах, кларитромицин 500 мг два раза в день и амоксициллин 1 г два раза в день, если бактериальная чувствительность неизвестна. . В случае резистентности к кларитромицину следует рассмотреть семидневную четырехкратную терапию на основе ИПП или четырнадцатидневную четырехкратную терапию на основе антагонистов рецепторов H 2 .5Антагонист рецепторов PPI и H 2 следует вводить в рекомендуемых дозах. Коллоидный салицилат висмута назначается по 120 мг четыре раза в день, метронидазол по 250 мг четыре раза в день и тетрациклин по 500 мг четыре раза в день.5 RBC 400 мг два раза в день с кларитромицином 500 мг два раза в день и амоксициллином 1 г два раза в день в течение семи дней также можно рассматривать как альтернативную схему лечения первой линии.
Заключение
В заключение, информации о неэффективности лечения инфекции H pylori в современной литературе мало.Многие отчеты публикуются только в абстрактной форме и ограничены небольшим количеством пациентов и дизайном исследования. Однако даже при нынешних наиболее эффективных схемах лечения около 10% пациентов не получат результата при различных видах лечения и останутся положительными на H. Каковы основные преимущества детского массажа для здоровья и развития ребенка. Какие виды детского массажа наиболее эффективны для разных возрастов. Как […] Почему грудничок часто требует грудь. Какие причины заставляют ребенка постоянно висеть на груди. Как определить, достаточно ли малышу молока. Что […] Как витаминно-минеральный комплекс Алфавит помогает укрепить иммунитет. Какие компоненты входят в состав Алфавита. Для кого предназначен Алфавит в сезон простуд. […]Похожие записи
Детский массаж в Минске: польза, виды, техники и рекомендации специалистов
Почему ребенок постоянно просит грудь: причины и решения
Алфавит для иммунитета: укрепление защитных сил организма в сезон простуд

 pylori,
pylori,