Перинатальные поражения ЦНС — ПроМедицина Уфа
Диагноз «перинатальное поражение ЦНС» объединяет большую группу различных по причине и происхождению поражений головного и спинного мозга, возникающих во время беременности, родов и в первые дни жизни малыша.
От 5 до 55% детей первого года жизни получают такой диагноз, поскольку в это число иногда включают детей с лёгкими преходящими нарушениями со стороны нервной системы. Тяжёлые формы перинатальных поражений ЦНС наблюдаются у 1,5–10% доношенных и у 60–70% недоношенных детей.
Тяжёлые перинатальные поражения мозга (в том числе внутричерепные кровоизлияния, тяжёлая ишемия мозга) представляют реальную угрозу для жизни и здоровья ребёнка, даже при своевременно оказанной высококвалифицированной медицинской помощи в условиях перинатального центра. Среднетяжёлые и лёгкие формы поражения мозга непосредственной угрозы для жизни не представляют, но они могут быть причиной нарушений психики и развития двигательной активности у ребёнка.
Причины
Основная причина перинатального поражения ЦНС у плода и новорождённого — гипоксия (кислородная недостаточность), возникающая под влиянием различных факторов. Неблагоприятные условия для развития плода в утробе матери могут быть заложены задолго до наступления беременности вследствие различных заболеваний у девочки-подростка, будущей матери. Инфекционные и неинфекционные заболевания, гормональные нарушения, вредные привычки, производственные вредности во время беременности вызывают усиление гипоксии будущего ребёнка. Предшествующие аборты приводят к нарушению кровотока между матерью и плодом и, следовательно, к внутриутробной гипоксии.
Важную роль в развитии перинатальных поражений ЦНС играют инфекции, передающиеся половым путём (хламидиоз, герпес, сифилис).
Причиной острой асфиксии в родах могут быть различные нарушения нормального течения родов, стремительные или затяжные роды, неправильное положение петель пуповины. Механическая травма ребёнка реже приводит к перинатальному повреждению ЦНС (особенно головного мозга).
Симптомы
При легких повреждениях ЦНС у новорожденных наиболее часто отмечается синдром повышенной нервно-рефлекторной возбудимости, который проявляется вздрагиванием, повышением или понижением мышечного тонуса, усилением рефлексов, тремором (дрожанием) подбородка и конечностей, беспокойным поверхностным сном, частым «беспричинным» плачем.
При поражении ЦНС средней степени тяжести в первые дни жизни дети чаще имеют угнетение ЦНС в виде снижения двигательной активности и снижения мышечного тонуса, ослабления рефлексов новорожденных, в том числе рефлексов сосания и глотания. К концу 1-го месяца жизни угнетение ЦНС постепенно исчезает, а у некоторых детей сменяется повышенным возбуждением.
При средней степени поражения ЦНС наблюдаются нарушения в работе внутренних органов и систем в виде неравномерной окраски кожи (мраморность кожи) вследствие несовершенства регуляции тонуса сосудов, нарушений ритма дыхания и сердечных сокращений, дисфункции желудочно-кишечного тракта в виде неустойчивого стула, запоров, частых срыгиваний, метеоризма. Реже может отмечаться судорожный синдром,при котором наблюдаются приступообразные подергивания конечностей и головы, эпизоды вздрагиваний и другие проявления судорог.
Реже может отмечаться судорожный синдром,при котором наблюдаются приступообразные подергивания конечностей и головы, эпизоды вздрагиваний и другие проявления судорог.
Длительно сохраняющиеся нарушения тонуса мышц нередко приводят к появлению у детей задержки психомоторного развития. При задержке моторного развития ребенок позднее начинает держать голову, сидеть, ползать, ходить. Бедность мимики, позднее появление улыбки, сниженный интерес к игрушкам и предметам окружающей среды, а также слабый монотонный крик, задержка появления гуления и лепета должны насторожить родителей в плане задержки психического развития у малыша.
К годовалому возрасту у большинства детей проявления перинатальных поражений ЦНС постепенно исчезают либо сохраняются их незначительные проявления. К частым последствиям перинатальных поражений относят:задержку психического, моторного или речевого развития;цереброастенический синдром (он проявляется перепадами настроения, двигательным беспокойством, тревожным беспокойным сном, метеозависимостью), синдром гиперактивности с дефицитом внимания.
Наиболее неблагоприятными исходами являются эпилепсия, гидроцефалия, детский церебральный паралич, свидетельствующие о тяжелых перинатальных повреждениях ЦНС.
Диагностика
Диагноз основывается на данных врачебного осмотра, анамнестических данных и подтверждается инструментальными исследованиями. Большое значение имеет ультразвуковое исследование (УЗИ) мозга с оценкой состояния его сосудов (допплерографией). При необходимости используют рентгенологическое исследование черепа, позвоночника, компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ).
Лечение
В остром периоде тяжёлых перинатальных поражений мозга лечение проводят в отделении реанимации и интенсивной терапии новорождённых. В первую очередь устраняют нарушения в работе дыхательной, сердечно-сосудистой системы и нарушения обмена веществ, ликвидируют судороги (при необходимости проводят искусственную вентиляцию лёгких, внутривенные вливания, парентеральное питание). Далее новорождённых переводят в специальное отделение, где продолжают индивидуальное лечение в зависимости от характера и тяжести поражения мозга: применяют противосудорожные препараты, при развивающейся гидроцефалии — дегидратационные, а также средства, стимулирующие рост капилляров и улучшающие питание повреждённых тканей мозга. Эти же препараты по назначению невролога можно применять на протяжении первого года жизни повторными курсами.
Эти же препараты по назначению невролога можно применять на протяжении первого года жизни повторными курсами.
При среднетяжёлых и особенно лёгких поражениях ЦНС используют в основном нелекарственную терапию.
В восстановительном периоде (с конца первого года жизни) решающее значение имеют нелекарственные методы реабилитации: лечебный массаж и гимнастика, упражнения в воде, физиотерапия, педагогические методики музыкотерапии (оздоровление и лечение организма с помощью музыки).
Гипоксически-ишемическое поражение: Причины развития, диагностика
Гипоксически-ишемическое поражение (ГИП) ЦНС – это комплекс изменений в организме ребенка, возникающий вследствие недостаточного снабжения кислородом органов и тканей. Гипоксия на ранних сроках (6-11 недель) может привести к аномалиям развития структур головного мозга плода, а на поздних стадиях – к задержке внутриутробного развития, поражению ЦНС и снижению адаптационных возможностей малыша после рождения.
Основные причины развития ГИП ЦНС:
— анемия у мамы (снижение количества гемоглобина, при котором снижается доставка кислорода и питательных веществ к тканям организма малыша)
— любые хронические заболевания и пороки: врожденные пороки сердца, легких других органов, заболевания почек, наличие сахарного диабета, которые способствуют нарушению кровообращения
— осложнения беременности и родов (гестоз, угроза преждевременных родов, патология плаценты и пуповины, недонашивание и перенашивание беременности, многоплодная беременность, многоводие и маловодие, различные аномалии родовой деятельности)
— заболевания плода (гемолитическая болезнь новорожденных, внутриутробное инфицирование, кровотечения)
Ощутимые признаки гипоксии плода преимущественно выражаются в изменении его двигательной активности (внезапное усиление, учащение сердцебиения и движений (шевеления) плода при острой или урежение и ослабление их же при хронической гипоксии). При выявлении диагноза внутриутробная гипоксия плода, будущей маме необходимо проведение процедур по выявлению причин с последующим комплексным лечением их источника с возможной госпитализацией в стационар, соблюдением постельного или домашнего режима и режима дня.
Диагностика:
Необходимо проведение ультразвукового исследования плода, применение кардиотокографии (запись сердечной деятельности плода) и доплерометрии (исследование кровотока сосудов матки и пуповины плода) с той частотой, которой назначит лечащий врач. Также применяются аускультация (выслушивание) сердцебиения плода стетоскопом.
Следует отметить, что не каждая беременность протекает на фоне вышеперечисленных заболеваний, осложняя внутриутробную гипоксию плода. Чтобы не допустить возможного появления гипоксии, особое внимание уделяется ее профилактике: длительные прогулки на свежем воздухе, обязательные дозированные физические нагрузки (гимнастика, зарядка, упражнения для беременных и дыхательные упражнения, плавание, йога). Возможно применение гипербарической оксигенации (ГБО) по назначению лечащего врача. Необходимо помнить, что лечение должно быть назначено гинекологом, быть комплексным и учитывать индивидуальный подход к каждой будущей маме.
Ранние симптомы, с которыми следует обратиться к детскому неврологу— вялое сосание груди, поперхивание при кормлении, вытекание молока через носик малыша
— слабый крик ребенка, гнусавый или осиплый голос
— частые срыгивания и недостаточная прибавка в весе
— снижение двигательной активности ребенка, сонливость, вялость или выраженное беспокойство
— дрожание подбородка, верхних и/или нижних конечностей, частые вздрагивания
— трудности при засыпании, частые пробуждения во сне
— запрокидывание головы
— замедление или быстрое увеличение окружности головы
— низкий (дряблые мышцы) или высокий тонус мышц конечностей и туловища
— уменьшение активности движений руки или ноги с какой-либо стороны, ограничение разведения бедер или наличие позы «лягушки» с выраженным разведением бедер, необычная поза ребенка
— косоглазие, кривошея
— рождение ребенка путем кесарева сечения, в тазовом предлежании, с аномалием родовой деятельности или с применением акушерских щипцов, выдавливанием, с обвитием пуповины вокруг шеи
— недоношенность ребенка
— наличие судорог при родах или в послеродовом периоде
Бывают случаи, когда при рождении у малыша имеются минимальные нарушения, но спустя годы, под влиянием тех или иных нагрузок – физических, умственных, эмоциональных – неврологические нарушения проявляются с различной степенью выраженности. Это, так называемые, поздние проявления родового травматизма. Среди них:
Это, так называемые, поздние проявления родового травматизма. Среди них:
— снижение мышечного тонуса (гибкость), которая так часто является дополнительным плюсом при занятиях спортом. Нередко таких детей с радостью принимают в секции спортивной и художественной гимнастики, в хореографические кружки. Но большинство из них не выносят тех физических нагрузок, которые имеют место быть в данных секциях.
— снижение остроты зрения, наличие асимметрии надплечий, углов лопаток, искривления позвоночника, сутулости – признаков возможной родовой травмы шейного отдела позвоночника
-возникновение головных болей, головокружения
При наличии вышеперечисленных жалоб не откладывайте визит к детскому неврологу! Специалист назначит определенные обследования, курс лечения и обязательно поможет Вам!
Гипоксическая ишемическая энцефалопатия: патофизиология и экспериментальное лечение
1. Schiariti V, Klassen AF, Hoube JS, et al. Перинатальные характеристики и взгляд родителей на состояние здоровья выпускников ОРИТ, рожденных в срок. Дж. Перинатол. 2008; 28: 368–376. [PubMed] [Google Scholar]
Дж. Перинатол. 2008; 28: 368–376. [PubMed] [Google Scholar]
2. Graham EM, Ruis KA, Hartman AL, et al. Систематический обзор роли интранатальной гипоксии-ишемии в этиологии неонатальной энцефалопатии. Am J Obstet Gynecol. 2008; 199: 587–595. [PubMed] [Академия Google]
3. Kurinczuk JJ, White-Koning M, Badawi N. Эпидемиология неонатальной энцефалопатии и гипоксически-ишемической энцефалопатии. Ранний Хам Дев. 2010; 86: 329–338. [PubMed] [Google Scholar]
4. Long M, Brandon DH. Индуцированная гипотермия у новорожденных с гипоксически-ишемической энцефалопатией. Журнал акушерства и гинекологии неонатального ухода. 2007; 36: 293–298. [PubMed] [Google Scholar]
5. Pierrat V, Haouari N, Liska A, et al. Распространенность, причины и исход энцефалопатии новорожденных в возрасте 2 лет: популяционное исследование. Архивы болезней в детстве: издание для новорожденных плода. 2005;90: F257–261. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Gluckman PD, Wyatt JS, Azzopardi D, et al. Селективное охлаждение головы с легкой системной гипотермией после неонатальной энцефалопатии: многоцентровое рандомизированное исследование. Ланцет. 2005; 365: 663–670. [PubMed] [Google Scholar]
Селективное охлаждение головы с легкой системной гипотермией после неонатальной энцефалопатии: многоцентровое рандомизированное исследование. Ланцет. 2005; 365: 663–670. [PubMed] [Google Scholar]
7. Hoehn T, Hansmann G, Buhrer C, et al. Терапевтическая гипотермия у новорожденных. Обзор текущих клинических данных, рекомендации ILCOR и предложения по внедрению в отделениях интенсивной терапии новорожденных. Реанимация. 2008;78:7–12. [PubMed] [Академия Google]
8. Окереафор А., Оллсоп Дж., Коунселл С.Дж. и соавт. Паттерны повреждения головного мозга у новорожденных, подвергшихся перинатальным дозорным событиям. Педиатрия. 2008; 121:906–914. [PubMed] [Google Scholar]
9. Кумар С., Патерсон-Браун С. Акушерские аспекты гипоксически-ишемической энцефалопатии. Ранний Хам Дев. 2010; 86: 339–344. [PubMed] [Google Scholar]
10. Шанкаран С. Энцефалопатия новорожденных: лечение гипотермией. J Нейротравма. 2009; 26: 437–443. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Ваннуччи Р.С., Перлман Дж.М. Вмешательства при перинатальной гипоксически-ишемической энцефалопатии. Педиатрия. 1997; 100:1004–1014. [PubMed] [Google Scholar]
Ваннуччи Р.С., Перлман Дж.М. Вмешательства при перинатальной гипоксически-ишемической энцефалопатии. Педиатрия. 1997; 100:1004–1014. [PubMed] [Google Scholar]
12. Мадан А., Хамрик С.Е., Ферриеро Д. Травма центральной нервной системы и нейропротекция. В: Tauesch H, Ballard R, Gleason C, редакторы. Болезни Эйвери у новорожденных. Филадельфия: Эльзевир Сондерс; 2005. стр. 965–992. [Google Scholar]
13. Американский колледж акушеров и гинекологов и Американская академия педиатрии. Неонатальная энцефалопатия и детский церебральный паралич. Определение патогенеза и патофизиологии. Библиотека Конгресса; 2003. [Google Академия]
14. де Врис Л.С., Коуэн FM. Развитие понимания гипоксически-ишемической энцефалопатии у доношенных детей. Семин Педиатр Нейрол. 2009; 16: 216–225. [PubMed] [Google Scholar]
15. Коттен С.М., Шанкаран С. Гипотермия при гипоксически-ишемической энцефалопатии. Экспертный обзор акушерства и гинекологии. 2010;5:227–239. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Sarnat HB, Sarnat MS. Неонатальная энцефалопатия после дистресса плода. Клиническое и электроэнцефалографическое исследование. Арх Нейрол. 1976;33:696–705. [PubMed] [Google Scholar]
Sarnat HB, Sarnat MS. Неонатальная энцефалопатия после дистресса плода. Клиническое и электроэнцефалографическое исследование. Арх Нейрол. 1976;33:696–705. [PubMed] [Google Scholar]
17. Шалак Л., Перлман Дж. М. Гипоксически-ишемическое поражение головного мозга в терминах инфантильно-современных представлений. Ранний Хам Дев. 2004; 80: 125–141. [PubMed] [Google Scholar]
18. Hanrahan JD, Sargentoni J, Azzopardi D, et al. Мозговой метаболизм в течение 18 часов после асфиксии при рождении: исследование протонной магнитно-резонансной спектроскопии. Педиатр Рез. 1996; 39: 584–590. [PubMed] [Google Scholar]
19. Вольпе Дж. Неврология новорожденных. 5. Филадельфия: Сондерс; 2008. [Google Академия]
20. Johnston MV, Ishida A, Ishida WN, et al. Пластичность и травмы в развивающемся мозге. Мозг Дев. 2009; 31:1–10. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Фатеми А., Уилсон М.А., Джонстон М.В. Гипоксически-ишемическая энцефалопатия у доношенных детей. Клин Перинатол. 2009; 36: 835–858. vii. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Клин Перинатол. 2009; 36: 835–858. vii. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Шир Д., Батлер Дж., Льюис Р. Хоул, Анатомия и физиология человека. Нью-Йорк: Макгроу-Хилл; 2009. [Google Scholar]
23. Alvarez-Diaz A, Hilario E, de Cerio FG, et al. Гипоксически-ишемическое повреждение в незрелом мозге — ключевые сосудистые и клеточные игроки. Неонатология. 2007;92: 227–235. [PubMed] [Google Scholar]
24. Sahni R, Sanocka UM. Гипотермия при гипоксически-ишемической энцефалопатии. Клин Перинатол. 2008; 35: 717–734. ви. [PubMed] [Google Scholar]
25. Ивата О., Ивата С., Торнтон Дж. С. и соавт. Длительность «терапевтического временного окна» уменьшается с увеличением тяжести церебральной гипоксии-ишемии в условиях нормотермии и отсроченной гипотермии у новорожденных поросят. Мозг Res. 2007; 1154: 173–180. [PubMed] [Google Scholar]
26. Laptook AR. Применение лечебной гипотермии у доношенных детей с гипоксически-ишемической энцефалопатией. Педиатр Клин Норт Ам. 2009 г.;56:601–616. Оглавление. [PubMed] [Google Scholar]
Педиатр Клин Норт Ам. 2009 г.;56:601–616. Оглавление. [PubMed] [Google Scholar]
27. Lorek A, Takei Y, Cady EB, et al. Отсроченная («вторичная») церебральная энергетическая недостаточность после острой гипоксии-ишемии у новорожденного поросенка: непрерывные 48-часовые исследования методом магнитно-резонансной спектроскопии фосфора. Педиатр Рез. 1994; 36: 699–706. [PubMed] [Google Scholar]
28. Ferriero DM. Неонатальная травма головного мозга. N Engl J Med. 2004; 351:1985–1995. [PubMed] [Google Scholar]
29. Buonocore G, Perrone S, Bracci R. Свободные радикалы и повреждение головного мозга у новорожденных. Биол Неонат. 2001;79: 180–186. [PubMed] [Google Scholar]
30. Кумар В., Аббас А., Фаусто Н. Роббинс и Котран: патологическая основа болезни. 7. Филадельфия: Эльзевир Сондерс; 2005. [Google Scholar]
31. Buonocore G, Groenendaal F. Антиоксидантные стратегии. Семинары по фетальной и неонатальной медицине. 2007; 12: 287–295. [PubMed] [Google Scholar]
32. Johnston MV, Trescher WH, Ishida A, et al. Нейробиология гипоксически-ишемического повреждения в развивающемся мозге. Педиатр Рез. 2001; 49: 735–741. [PubMed] [Академия Google]
Johnston MV, Trescher WH, Ishida A, et al. Нейробиология гипоксически-ишемического повреждения в развивающемся мозге. Педиатр Рез. 2001; 49: 735–741. [PubMed] [Академия Google]
33. Палмер С., Робертс Р.Л., Янг П.И. Время истощения нейтрофилов влияет на долгосрочную нейропротекцию при гипоксически-ишемическом повреждении головного мозга у новорожденных крыс. Педиатр Рез. 2004; 55: 549–556. [PubMed] [Google Scholar]
34. Чжао П., Зуо З. Предварительное кондиционирование изофлураном индуцирует нейропротекцию, которая зависит от синтазы оксида азота у новорожденных крыс. Анестезиология. 2004; 101: 695–703. [PubMed] [Google Scholar]
35. McAuliffe JJ, Loepke AW, Miles L, et al. Десфлуран, изофлуран и севофлуран обеспечивают ограниченную нейропротекцию против неонатальной гипоксии-ишемии в парадигме отсроченного прекондиционирования. Анестезиология. 2009 г.;111:533–546. [PubMed] [Google Scholar]
36. Zhao P, Peng L, Li L, et al. Прекондиционирование изофлураном улучшает долгосрочный неврологический исход после гипоксически-ишемического повреждения головного мозга у новорожденных крыс.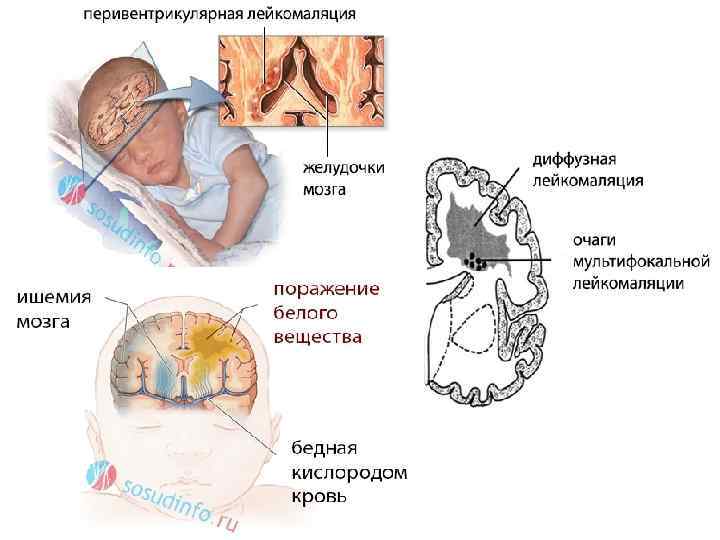 Анестезиология. 2007; 107: 963–970. [PubMed] [Google Scholar]
Анестезиология. 2007; 107: 963–970. [PubMed] [Google Scholar]
37. Yin W, Signore AP, Iwai M, et al. Прекондиционирование подавляет воспаление при гипоксической ишемии новорожденных посредством активации Akt. Инсульт. 2007; 38:1017–1024. [PubMed] [Google Scholar]
38. Линь Х.И., Ву К.Л., Хуан К.С. Путь Akt-эндотелиальной синтазы оксида азота в гипоксически-ишемической толерантности, индуцированной липополисахаридным прекондиционированием, в мозге новорожденных крыс. Инсульт. 2010;41:1543–1551. [PubMed] [Академия Google]
39. Вольпе Ж. Перинатальная травма головного мозга: от патогенеза к нейропротекции. Обзоры исследований умственной отсталости и нарушений развития. 2001; 7: 56–64. [PubMed] [Google Scholar]
40. Рока А., Аззопарди Д. Терапевтическая гипотермия при неонатальной гипоксически-ишемической энцефалопатии. Ранний Хам Дев. 2010; 86: 361–367. [PubMed] [Google Scholar]
41. Gunn AJ, Gunn TR, de Haan HH, et al. Драматическое спасение нейронов с длительным селективным охлаждением головы после ишемии у эмбрионов ягнят. Джей Клин Инвест. 1997;99:248–256. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джей Клин Инвест. 1997;99:248–256. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Shah PS. Семинары по фетальной и неонатальной медицине. 2010. Гипотермия: систематический обзор и метаанализ клинических испытаний. [PubMed] [Google Scholar]
43. Eicher DJ, Wagner CL, Katikaneni LP, et al. Умеренная гипотермия при неонатальной энцефалопатии: результаты эффективности. Педиатр Нейрол. 2005; 32:11–17. [PubMed] [Google Scholar]
44. Gunn AJ, Gluckman PD, Gunn TR. Селективное охлаждение головы у новорожденных после перинатальной асфиксии: исследование безопасности. Педиатрия. 1998;102:885–892. [PubMed] [Google Scholar]
45. Shankaran S, Pappas A, Laptook AR, et al. Результаты безопасности и эффективности в многоцентровом рандомизированном контролируемом исследовании гипотермии всего тела при неонатальной гипоксически-ишемической энцефалопатии. Педиатрия. 2008; 122:e791–798. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Edwards AD, Brocklehurst P, Gunn AJ, et al. Неврологические исходы в возрасте 18 месяцев после умеренной гипотермии по поводу перинатальной гипоксически-ишемической энцефалопатии: синтез и метаанализ данных испытаний. БМЖ. 2010;340:c363. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Неврологические исходы в возрасте 18 месяцев после умеренной гипотермии по поводу перинатальной гипоксически-ишемической энцефалопатии: синтез и метаанализ данных испытаний. БМЖ. 2010;340:c363. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Келен Д., Робертсон, Нью-Джерси. Экспериментальные методы лечения гипоксически-ишемической энцефалопатии. Ранний Хам Дев. 2010; 86: 369–377. [PubMed] [Google Scholar]
48. Хокенберри М., Уилсон Д., редакторы. Сестринский уход за младенцами и детьми Вонга. 8. Сент-Луис: Мосби; 2007. [Google Scholar]
49. Sugawa M, Sakurai Y, Ishikawa-Ieda Y, et al. Влияние эритропоэтина на развитие глиальных клеток; созревание олигодендроцитов и пролиферация астроцитов. Нейроси Рес. 2002; 44: 391–403. [PubMed] [Академия Google]
50. Spandou E, Papoutsopoulou S, Soubasi V, et al. Гипоксия-ишемия влияет на эритропоэтин и характер экспрессии рецепторов эритропоэтина в мозге новорожденных крыс. Мозг Res. 2004; 1021: 167–172. [PubMed] [Google Scholar]
51. Nagai A, Nakagawa E, Choi HB, et al. Эритропоэтин и рецепторы эритропоэтина в нейронах ЦНС человека, астроцитах, микроглии и олигодендроцитах, выращенных в культуре. J Neuropathol Exp Neurol. 2001; 60: 386–392. [PubMed] [Google Scholar]
Nagai A, Nakagawa E, Choi HB, et al. Эритропоэтин и рецепторы эритропоэтина в нейронах ЦНС человека, астроцитах, микроглии и олигодендроцитах, выращенных в культуре. J Neuropathol Exp Neurol. 2001; 60: 386–392. [PubMed] [Google Scholar]
52. Tabata M, Tarumoto T, Ohmine K, et al. Стимуляция GATA-2 как механизм подавления пероксида водорода при индуцированной гипоксией экспрессии гена эритропоэтина. J Cell Physiol. 2001; 186: 260–267. [PubMed] [Академия Google]
53. Siren AL, Knerlich F, Poser W, et al. Эритропоэтин и рецептор эритропоэтина в ишемическом/гипоксическом мозге человека. Акта Нейропатол. 2001; 101: 271–276. [PubMed] [Google Scholar]
54. Wang CH, Liang CL, Huang LT, et al. Однократная внутривенная инъекция голой плазмидной ДНК, кодирующей эритропоэтин, обеспечивает нейропротекцию у крыс с гипоксией-ишемией. Biochem Biophys Res Commun. 2004; 314:1064–1071. [PubMed] [Google Scholar]
55. van der Kooij MA, Groenendaal F, Kavelaars A, et al. Комбинация дефероксамина и эритропоэтина: терапия повреждения головного мозга, вызванного гипоксией-ишемией, у новорожденных крыс? Нейроски Летт.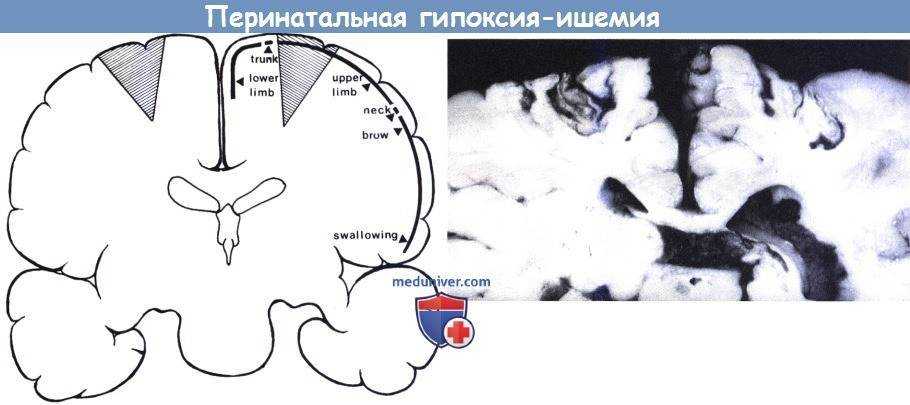 2009 г.;451:109–113. [PubMed] [Google Scholar]
2009 г.;451:109–113. [PubMed] [Google Scholar]
56. Gunnarson E, Song Y, Kowalewski JM, et al. Модуляция эритропоэтином водопроницаемости астроцитов как компонент нейропротекции. Proc Natl Acad Sci U S A. 2009;106:1602–1607. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Spandou E, Papadopoulou Z, Soubasi V, et al. Эритропоэтин предотвращает долговременный сенсомоторный дефицит и повреждение головного мозга после неонатальной гипоксии-ишемии у крыс. Мозг Res. 2005; 1045: 22–30. [PubMed] [Академия Google]
58. Zhu C, Kang W, Xu F, et al. Эритропоэтин улучшил неврологические исходы у новорожденных с гипоксически-ишемической энцефалопатией. Педиатрия. 2009; 124:e218–226. [PubMed] [Google Scholar]
59. Elmahdy H, El-Mashad AR, El-Bahrawy H, et al. Рекомбинантный эритропоэтин человека при асфиксии новорожденных: пилотное испытание. Педиатрия. 2010;125:e1135–1142. [PubMed] [Google Scholar]
60. Lee OK, Kuo TK, Chen WM, et al. Выделение мультипотентных мезенхимальных стволовых клеток из пуповинной крови. Кровь. 2004;103:1669–1675. [PubMed] [Google Scholar]
Кровь. 2004;103:1669–1675. [PubMed] [Google Scholar]
61. Bompais H, Chagraoui J, Canron X, et al. Эндотелиальные клетки человека, полученные из циркулирующих предшественников, проявляют специфические функциональные свойства по сравнению со зрелыми эндотелиальными клетками стенки сосуда. Кровь. 2004; 103: 2577–2584. [PubMed] [Google Scholar]
62. Pimentel-Coelho PM, Magalhaes ES, Lopes LM, et al. Трансплантация пуповинной крови человека в модели гипоксически-ишемического повреждения головного мозга у новорожденных крыс: функциональный результат, связанный с нейропротекцией в стриатуме. Стволовые клетки и развитие. 2010;19: 351–358. [PubMed] [Google Scholar]
63. van Velthoven CT, Kavelaars A, van Bel F, et al. Назальное введение стволовых клеток: многообещающий новый способ лечения неонатального ишемического повреждения головного мозга. Педиатр Рез. 2010;68:419–422. [PubMed] [Google Scholar]
64. van Velthoven CT, Kavelaars A, van Bel F, et al. Лечение мезенхимальными стволовыми клетками после неонатального гипоксически-ишемического повреждения головного мозга улучшает поведенческие исходы и вызывает регенерацию нейронов и олигодендроцитов. Мозг Behav Immun. 2010; 24:387–39.3. [PubMed] [Google Scholar]
Мозг Behav Immun. 2010; 24:387–39.3. [PubMed] [Google Scholar]
65. Коттен CM. Аутологичные клетки пуповинной крови для гипоксически-ишемической энцефалопатии. 2009. Национальные институты здоровья; 22 февраля 2009 г. [Google Scholar]
66. Schubert S, Brandl U, Brodhun M, et al. Нейропротекторные эффекты топирамата после гипоксии-ишемии у новорожденных поросят. Мозг Res. 2005; 1058: 129–136. [PubMed] [Google Scholar]
67. Barks JD, Liu YQ, Shangguan Y, et al. Фенобарбитал усиливает гипотермическую нейропротекцию. Педиатр Рез. 2010;67:532–537. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Filippi L, Poggi C, la Marca G, et al. Пероральный топирамат у новорожденных с гипоксически-ишемической энцефалопатией, получавших гипотермию: исследование безопасности. J Педиатр. 2010; 157:361–366. [PubMed] [Google Scholar]
69. Franks NP, Dickinson R, de Sousa SL, et al. Как ксенон вызывает анестезию? Природа. 1998; 396:324. [PubMed] [Google Scholar]
70. Banks P, Franks NP, Dickinson R. Конкурентное ингибирование в глициновом участке рецептора N-метил-D-аспартата опосредует ксеноновую нейропротекцию против гипоксии-ишемии. Анестезиология. 2010; 112: 614–622. [PubMed] [Академия Google]
Banks P, Franks NP, Dickinson R. Конкурентное ингибирование в глициновом участке рецептора N-метил-D-аспартата опосредует ксеноновую нейропротекцию против гипоксии-ишемии. Анестезиология. 2010; 112: 614–622. [PubMed] [Академия Google]
71. Dinse A, Fohr KJ, Georgieff M, et al. Ксенон снижает глутамат-, АМРА- и каинат-индуцированные мембранные токи в корковых нейронах. Бр Джей Анаст. 2005; 94: 479–485. [PubMed] [Google Scholar]
72. Dingley J, Tooley J, Porter H, et al. Ксенон обеспечивает кратковременную нейропротекцию у новорожденных крыс при введении после гипоксии-ишемии. Инсульт. 2006; 37: 501–506. [PubMed] [Google Scholar]
73. Hobbs C, Thoresen M, Tucker A, et al. Ксенон и гипотермия аддитивно сочетаются, обеспечивая долгосрочную функциональную и гистопатологическую нейропротекцию после неонатальной гипоксии/ишемии. Инсульт. 2008;39: 1307–1313. [PubMed] [Google Scholar]
74. Thoresen M, Hobbs CE, Wood T, et al. Охлаждение в сочетании с немедленной или отсроченной ингаляцией ксенона обеспечивает эквивалентную долговременную нейропротекцию после неонатальной гипоксии-ишемии. J Cereb Blood Flow Metab. 2009; 29: 707–714. [PubMed] [Google Scholar]
J Cereb Blood Flow Metab. 2009; 29: 707–714. [PubMed] [Google Scholar]
75. Chakkarapani E, Thoresen M, Hobbs CE, et al. Система доставки неонатального ксенона с замкнутым контуром: техническое и практическое технико-экономическое обоснование нейропротекции у новорожденных свиней. Анест Анальг. 2009 г.;109:451–460. [PubMed] [Google Scholar]
76. Berman DR, Mozurkewich E, Liu Y, et al. Предварительная обработка докозагексаеновой кислотой обеспечивает нейропротекцию на крысиной модели перинатальной церебральной гипоксии-ишемии. Am J Obstet Gynecol. 2009; 200:305, e301–306. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Suganuma H, Arai Y, Kitamura Y, et al. Диета матери, обогащенная докозагексаеновой кислотой, предотвращает повреждение головного мозга новорожденных. Невропатология. 2010;30:597–605. [PubMed] [Google Scholar]
78. Zhang W, Hu X, Yang W, et al. Добавка полиненасыщенных жирных кислот омега-3 обеспечивает долгосрочную нейропротекцию от неонатального гипоксически-ишемического повреждения головного мозга за счет противовоспалительного действия. Инсульт. 2010;41:2341–2347. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Инсульт. 2010;41:2341–2347. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Martinez-Orgado J, Fernandez-Frutos B, Gonzalez R, et al. Нейропротекция агонистом каннабиноидов WIN-55212 в модели острой тяжелой асфиксии у новорожденных крыс in vivo. Мозг Res Мол Мозг Res. 2003; 114: 132–139. [PubMed] [Google Scholar]
80. Castillo A, Tolon MR, Fernandez-Ruiz J, et al. Нейропротекторный эффект каннабидиола в модели in vitro гипоксически-ишемического повреждения головного мозга новорожденных у мышей опосредуется рецепторами CB(2) и аденозина. Нейробиол Дис. 2010; 37: 434–440. [PubMed] [Академия Google]
81. Fernandez-Lopez D, Pazos MR, Tolon RM, et al. Агонист каннабиноидов WIN55212 уменьшает повреждение головного мозга в модели гипоксически-ишемической энцефалопатии in vivo у новорожденных крыс. Педиатр Рез. 2007; 62: 255–260. [PubMed] [Google Scholar]
Гипоксически-ишемическая энцефалопатия (ГИЭ) | UF Health, University of Florida Health
Определение
Гипоксия относится к уменьшению снабжения кислородом органов, включая мозг. Ишемия относится к недостаточному кровоснабжению органов. Энцефалопатия — это термин, используемый для описания любой формы генерализованной дисфункции головного мозга. Гипоксически-ишемическая энцефалопатия (или ГИЭ) — это неспецифический термин для обозначения дисфункции головного мозга, вызванной недостатком притока крови и кислорода к мозгу. Иногда ГИЭ также называют родовой асфиксией, но этот термин относится только к очень строгим критериям новорожденных с черепно-мозговой травмой.
Ишемия относится к недостаточному кровоснабжению органов. Энцефалопатия — это термин, используемый для описания любой формы генерализованной дисфункции головного мозга. Гипоксически-ишемическая энцефалопатия (или ГИЭ) — это неспецифический термин для обозначения дисфункции головного мозга, вызванной недостатком притока крови и кислорода к мозгу. Иногда ГИЭ также называют родовой асфиксией, но этот термин относится только к очень строгим критериям новорожденных с черепно-мозговой травмой.
Альтернативные названия
ГИЭ
Причины, заболеваемость и факторы риска
Как и когда возникает ГИЭ?
Существует множество проблем во время беременности, родов, родов и после родов, которые могут вызвать ГИЭ. Однако во многих случаях причина ГИЭ неизвестна.
Возможные проблемы во время беременности
Преэклампсия, диабет матери с сосудистыми заболеваниями, врожденные инфекции плода, злоупотребление наркотиками и алкоголем, тяжелая анемия плода, пороки сердца, пороки развития легких, проблемы с притоком крови к плаценте.
Проблемы во время родов и родоразрешения
Аварии пуповины, разрыв плаценты или матки, чрезмерное кровотечение из плаценты, неправильное положение плода, затяжные поздние периоды родов, очень низкое кровяное давление у матери (вызванное лекарствами, кровотечение, анестезия.)
Проблемы после родов
Тяжелая недоношенность, тяжелое заболевание легких или сердца, серьезные инфекции (особенно менингит или сепсис), травма головного мозга или черепа, врожденные пороки развития головного мозга, очень низкое кровяное давление у ребенка.
Насколько распространена ГИЭ?
Что касается доношенных детей, ГИЭ встречается примерно у 3-20 на 1000 живорождений. У недоношенных детей ГИЭ встречается у 60% живорожденных.
Типы
- Легкая форма ГИЭ : Менее 5% этих младенцев будут иметь серьезную инвалидность.
- Умеренная ГИЭ: От 25% до 75% этих младенцев будут иметь серьезную инвалидность или потенциально умрут в раннем возрасте.

- Тяжелая ГИЭ: 75% или более таких младенцев будут иметь серьезную инвалидность или могут умереть в раннем возрасте.
Признаки и симптомы
Перед родами
- Измерения движений плода и/или вариабельности сердечного ритма до рождения.
- Наличие мекония (первый стул ребенка) в амниотической жидкости. Это плохой предиктор повышенного риска ГИЭ, но может указывать на то, что плод находился в дистрессе до рождения.
Клиническая оценка
Анализы, лечение
Лабораторная оценка
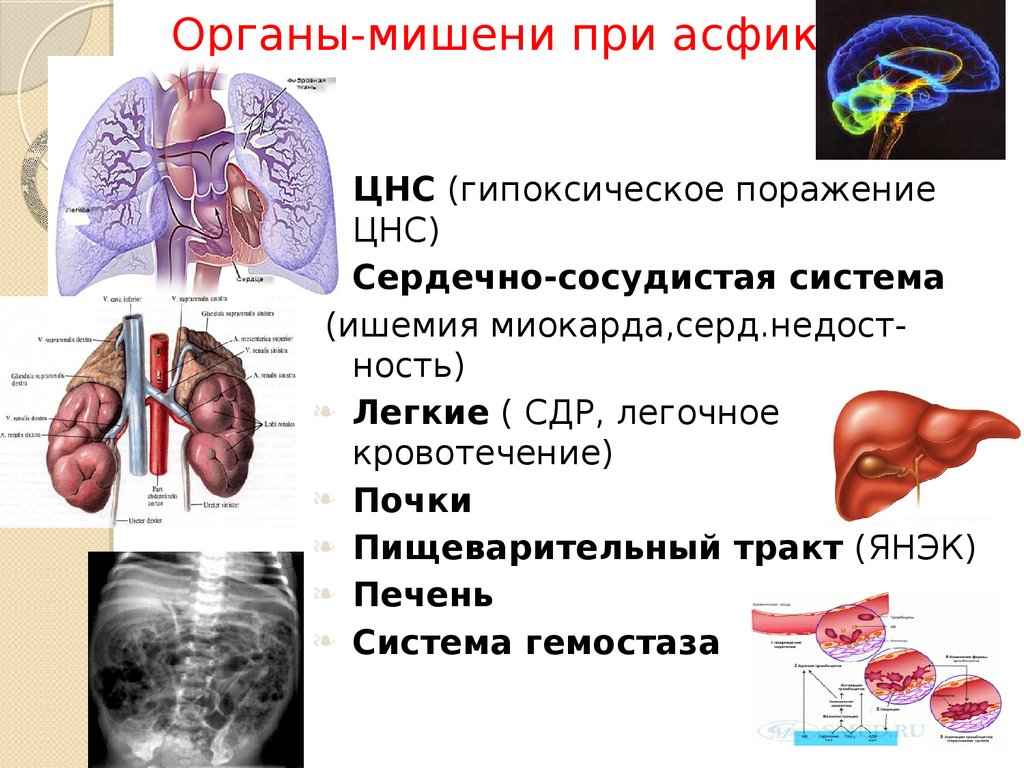
Анализы крови позволяют оценить признаки повреждения других органов, вызванного ГИЭ. Это связано с тем, что снижение кровотока и кислорода может повлиять на все органы, а не только на мозг. Почки, печень, сердце и легкие являются наиболее распространенными органами, поражаемыми при ГИЭ. Образцы пуповинной крови могут показать повышенное накопление кислоты. Это может быть признаком того, что ребенок был в бедственном положении до рождения.
Рентгенологическое обследование
Визуализация головного мозга с использованием УЗИ, КТ (компьютерной томографии) и МРТ (магнитно-резонансной томографии) может использоваться для оценки основного порока развития головного мозга и поиска признаков повреждения головного мозга. В настоящее время МРТ является наиболее чувствительным способом поиска повреждений головного мозга, но младенец может быть слишком болен для транспортировки на МРТ или может не переносить длительное время сканирования (примерно 45 минут).
Как лечить ГИЭ?
К сожалению, окончательного лечения детей с ГИЭ не существует. Большинство методов лечения направлены на поддержку пораженных органов младенца, включая:
- Поддержка сердца и артериального давления
- Поддержание функции почек и печени
- Искусственная вентиляция легких может потребоваться, если младенец не может полностью дышать самостоятельно
- Если у ребенка судороги, их необходимо контролировать с помощью лекарств
В настоящее время единственной терапией, специфичной для головного мозга, которая, как было доказано, снижает риск долгосрочных нарушений развития нервной системы, является гипотермия мозга или всего тела (охлаждение температуры тела младенца примерно до 33,5 градусов Цельсия или 92 градуса по Фаренгейту) в течение 3 дней.

