Специализированное научно-практическое издания для ветеринарных врачей и студентов ветеринарных ВУЗов.
Авторы: Азарова М. С., Герасимов А. С., Ветеринарная клиника имени Айвэна Филлмора, Санкт-Петербург.Введение
Портосистемные шунты – аномалии сосудов брюшной полости, при которых часть крови или вся кровь из системы воротной вены, минуя печень, попадает в основное кровеносное русло.У здорового животного воротная вена отводит кровь от желудка, тонкой и толстой кишок (исключая каудальный отдел прямой кишки) и селезенки в печень (фото 1). В печени эта кровь, содержащая продукты распада белков, подвергается детоксикации.
У животного с портосистемным шунтом кровь из воротной вены сбрасывается в общее венозное русло, не пройдя детоксикацию в печени. Продукты расщепления белков и питательных веществ, попадающие из желудочно-кишечного тракта в общее кровеносное русло, обуславливают развитие клинической картины.
НВ – непарная вена, КПВ – каудальная полая вена, ВВ – воротная вена, ПВ – пупочная вена
Клинические признаки
К общим клиническим проявлениям относят потерю веса, отставание в росте, плохое качество шерсти, понижение температуры тела, слюнотечение, рвоту.Помимо этого, может развиться гепатоэнцефалопатия, поражающая практически все отделы головного мозга, что проявляется вялостью, угнетением, нарушением координации, судорожными приступами, в тяжелых случаях может развиться кома. Выраженность гепатоэнцефалопатии зависит от содержания белка в пище. При переходе на низкобелковую диету состояние пациентов улучшается.
Классификация
Портосистемные шунты могут быть врожденными или приобретенными. Врожденные шунты рассматривают как сохранившиеся после рождения эмбриональные анастомозы (фото 2), являющиеся нормой для плода на той или иной стадии внутриутробного развития. Предполагается, что шунт при этом может развиться из нормального для эмбриона анастомоза, существовавшего у плода, но запустевшего до или после рождения.
Предполагается, что шунт при этом может развиться из нормального для эмбриона анастомоза, существовавшего у плода, но запустевшего до или после рождения.Если сосуд, шунтирующий печеночный кровоток, расположен внутри печени, его называют внутрипеченочным (фото 3), если за пределами печени – внепеченочным (фото 4).
Шунты могут быть одиночными, двойными и множественными.
Помимо открытого венозного протока и портокавального шунта, то есть анастомоза между воротной веной и каудальной полой веной, встречаются и другие топологические варианты шунтов. Шунты могут брать начало от воротной, селезеночной или желудочной вены, а сбрасывать кровь – в каудальную полую, непарную или диафрагмальную вену.
НВ – непарная вена, КПВ – каудальная полая вена, ВВ – воротная вена, ПВ – пупочная вена.
Породные предрасположенности
Внепеченочные портосистемные шунты чаще встречаются у чистопородных собак мелких пород: чихуахуа, лхасских апсо, ши-тцу, мальтийских болонок, различных мелких терьеров, миниатюрных шнауцеров и такс.
Среди кошек наиболее часто портосистемные шунты встречаются у гималайской, домашней короткошерстной, персидской и сиамской пород. Как правило, у кошек выявляют внепеченочные шунты.
Лабораторные исследования
Биохимический анализ крови:- Гипоальбуминемия и пониженное содержание в крови общего белка.
- Низкая концентрация азота мочевины в крови.
- Низкие уровни холестерина и глюкозы в крови.
- Повышенная концентрация печеночных ферментов.
- Увеличение уровня аммиака в крови в периоды между приемами корма.
- Резкое повышение в сыворотке желчных кислот (тест проводится до и после кормления).
- У 72% собак выявляют микроцитоз с сопутствующей анемией или без нее.
- Может наблюдаться лейкоцитоз.

- Снижается плотность мочи.
- Могут быть признаки цистита.
- Наличие уратов в моче у молодого животного является показанием для проведения дальнейших исследований.
- Позволяет выявить причины, приведшие к образованию приобретенных шунтов, микроваскулярную дисплазию и другие патологии, которые не всегда удается обнаружить другими методами.
Визуальная диагностика
Клинические признаки и лабораторные исследования позволяют предположить наличие шунта. Подтвердить диагноз и оценить топологию сосудов помогают методы визуальной диагностики.Ультразвуковое исследование
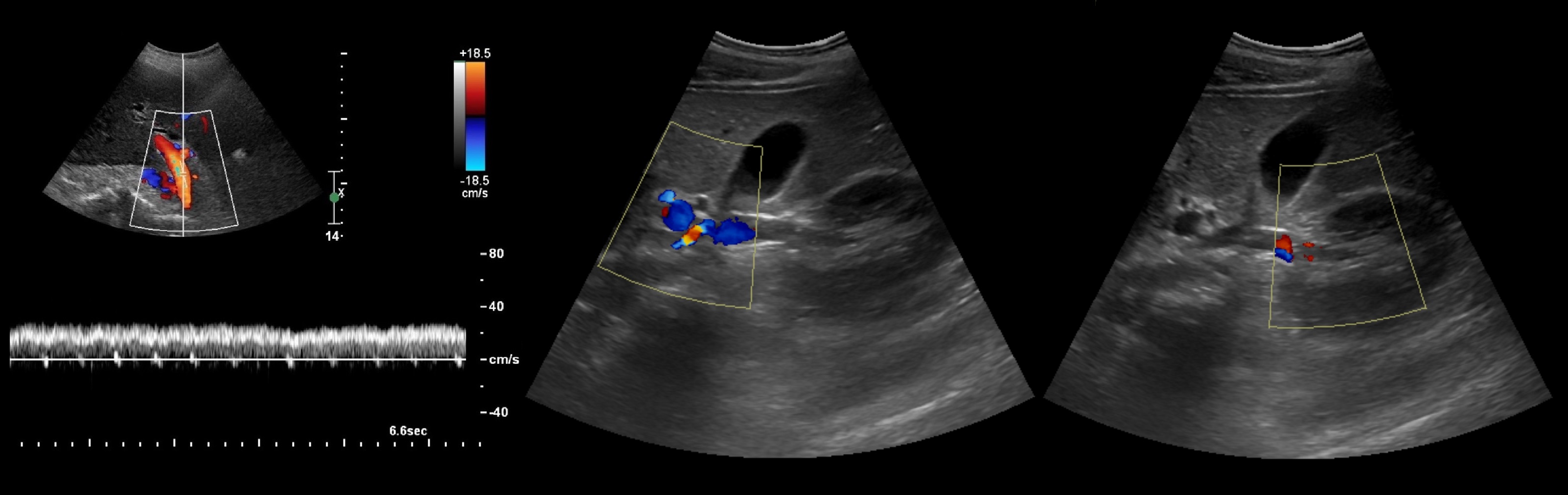
Внутрипеченочные шунты визуализируются проще (фото 5), внепеченочные – сложнее. Допплерография позволяет обнаружить турбулентные потоки в полой и воротной венах, которые обычно возникают в области шунта.
Допплерография позволяет обнаружить турбулентные потоки в полой и воротной венах, которые обычно возникают в области шунта.
Вероятность выявления портосистемных шунтов у животных с помощью ультразвукового сканирования варьируется в широких пределах и во многом определяется уровнем подготовки и опытом проводящего исследование специалиста.
КПВ – каудальная полая вена
Рентгенографические исследования
На обзорных рентгенограммах брюшной полости выявляют уменьшение размеров тени печени. Для визуализации границ желудка перед рентгенографией животному выпаивают водную взвесь сульфата бария. На обзорных рентгенограммах можно обнаружить тени рентгеноконтрастных камней в почках и мочевом пузыре. Кристаллы урата аммония не рентгеноконтрастны, но нередко при портосистемных шунтах образуются камни более сложного состава, являющиеся рентгеноконтрастными.
Для визуализации сосудов применяют ангиографию – введение рентгеноконтрастного препарата в кровеносные сосуды.
рентгеноконтрастного вещества в брыжеечную вену – норма.
Избирательное контрастирование воротной вены называют портографией. Существует несколько способов введения контрастного препарата в воротную вену.
Портография с введением рентгеноконтрастного вещества в брыжеечную вену в настоящий момент является «золотым стандартом» в диагностике портосистемных шунтов. Это инвазивный метод. Животному под общим наркозом делают лапаротомию, катетеризируют брыжеечную вену, выводят магистраль от катетера за пределы брюшной полости. Далее через магистраль вводят рентгеноконтрастный препарат, который по брыжеечной вене попадает в воротную вену, и сразу же делают серию рентгенограмм (фото 6).
ВВ – воротная вена.
КПВ – каудальная полая вена, ВВ – воротная вена.
Портография с введением рентгеноконтрастного вещества в паренхиму селезенки – менее инвазивный метод. Пункция селезенки проводится без лапаротомии, через брюшную стенку под контролем УЗИ. В паренхиму селезенки вводится рентгеноконтрастный препарат, который поступает в селезеночную вену, а из нее – в воротную вену. Делается серия рентгенограмм. Этот путь введения позволяет визуализировать те шунты, которые берут начало от селезеночной вены и от воротной вены после впадения в нее селезеночной вены.
При портографии с введением рентгеноконтрастного препарата в краниальную брыжеечную артерию не нужна лапаротомия, но требуется катетеризация бедренной артерии, по которой катетер под рентгенографическим контролем продвигается по брюшной аорте до краниальной брыжеечной артерии. Вводится контрастный препарат, который по брыжеечной артерии уходит в капилляры кишечника, а оттуда – в вены брыжейки и воротную вену.
Неселективная ангиография воротной вены неприменима при рентгенографии потому, что из-за большого количества близко расположенных в брюшной полости сосудов и контрастирования введенным препаратом петель кишечника и паренхиматозных органов невозможно интерпретировать полученное изображение.
Сцинтиграфия
Метод функциональной визуализации, заключающийся в том, что исследуемому животному вводят (ректально или внутриселезеночно) радиоактивный препарат, который попадает в воротную вену, а оттуда в печень (у здорового животного) или венозный кровоток (при наличии шунта). После введения препарата отслеживают сроки его накопления в печени и сердце. У здоровых животных печень накапливает препарат быстрее, чем сердце. Для регистрации излучения применяют гамма-камеры.
Для регистрации излучения применяют гамма-камеры.Исследование неинвазивное (в случае с ректальным введением препарата), но оно позволяет только оценить, какая часть крови, поступающая от кишечника, идет в обход печени. То есть можно подтвердить наличие шунта, но не визуализировать его.
КТ-ангиография
КТ-ангиография (КТА) – метод получения изображения сосудов при помощи компьютерного томографа. Преимуществом КТ-ангиографии является то, что этот метод позволяет визуализировать сосуды брюшной полости, в том числе и воротную вену, не прибегая к селективному контрастированию. Компьютерная томография, в отличие от рентгенографии, дает возможность работать с изображениями срезов и трехмерными моделями, и для нее сложная сосудистая анатомия брюшной полости помехой не является (фото 8).При неселективной КТ-ангиографии рентгеноконтрастный препарат вводится в периферическую вену грудной конечности, откуда попадает в сердце, проходит малый круг кровообращения, возвращается в сердце и попадает в аорту.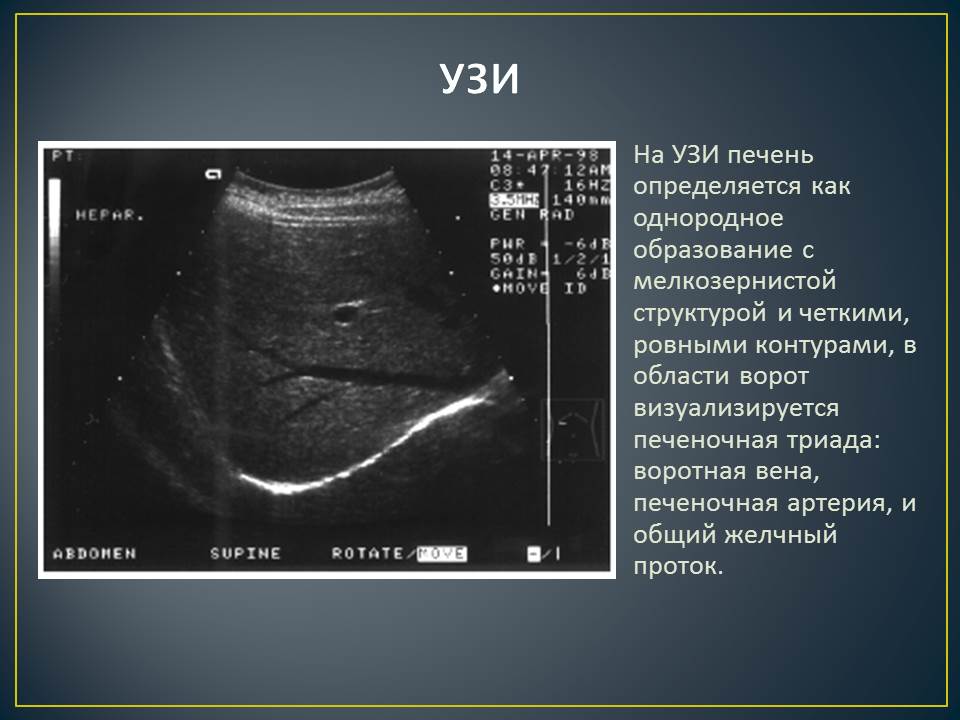 Из нисходящей аорты кровь с контрастным веществом попадает в сосуды селезенки и кишечника, а оттуда – в воротную вену. Прохождение контрастного препарата по сосудам – это динамический процесс. Обычно делается несколько серий сканирования в разные фазы прохождения контраста.
Из нисходящей аорты кровь с контрастным веществом попадает в сосуды селезенки и кишечника, а оттуда – в воротную вену. Прохождение контрастного препарата по сосудам – это динамический процесс. Обычно делается несколько серий сканирования в разные фазы прохождения контраста.
Для хорошей визуализации шунта необходимо, чтобы сканирование зоны интереса произошло во время нахождения максимального количества контрастного препарата в системе воротной вены. Время появления контрастного препарата в воротной вене зависит от скорости кровотока, которая может сильно отличаться у разных животных. На практике применяют два способа, позволяющих получить качественные изображения: измерение времени появления контраста в воротной вене по предварительной серии и болюс-трекер.
А – брюшная аорта, ВВ – часть воротной вены от кишечника до шунта, КПВ – каудальная полая вена, Ш – шунт, СВ – селезеночная вена.
Для измерения времени появления контраста в воротной вене перед предварительной серией сканирования вводят небольшое количество контрастного препарата, в момент начала введения препарата начинают сканирование одного и того же среза, расположение которого выбирают так, чтобы на нем были хорошо различимы нисходящая аорта, каудальная полая и воротная вены.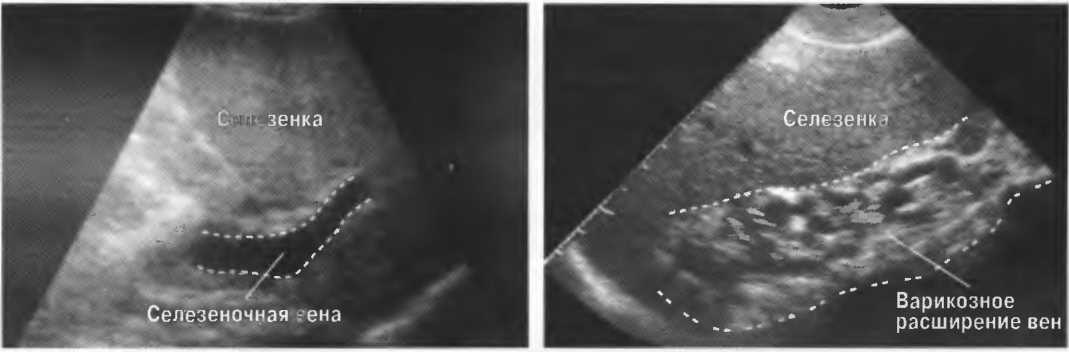 Сканирование этого среза продолжается 1-2 минуты с периодичностью 1 раз в 0,5-2 секунды. По полученным изображениям определяют временной промежуток между внутривенным введением препарата и его появлением в воротной вене. На основании этого планируют и проводят серию с введением полной дозы контрастного препарата.
Сканирование этого среза продолжается 1-2 минуты с периодичностью 1 раз в 0,5-2 секунды. По полученным изображениям определяют временной промежуток между внутривенным введением препарата и его появлением в воротной вене. На основании этого планируют и проводят серию с введением полной дозы контрастного препарата.
При методике «болюс-трекер», никаких предварительных серий не требуется, сразу вводится полная доза препарата, а используемый протокол исследования состоит из отслеживающей серии и серий спирального сканирования. Во время отслеживающей серии с периодичностью 1 раз в 1-2 секунды сканируется один и тот же срез, по которому сразу же автоматически определяется рентгеновская плотность крови в просвете выбранного сосуда. Как только плотность превысит указанный порог (то есть в сосуде появится достаточное количество рентгеноконтрастного препарата), начинается спиральное сканирование зоны интереса. Последующие серии начинаются через заданное время после начала первой серии. Как правило, делается несколько серий сканирования в разные сосудистые фазы.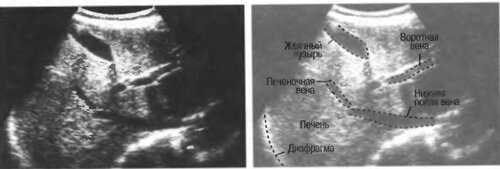 Визуализируются крупные артерии и вены брюшной полости.
Визуализируются крупные артерии и вены брюшной полости.
КТ-ангиография позволяет не только обнаружить шунт, но и всесторонне описать его топографию: исследовать, между какими сосудами происходит сброс крови, описать локализацию шунта, оценить его размеры, выявить наличие множественных шунтов, оценить перфузию печени.
МРТ-ангиография
Магнитно-резонансная ангиография (МРА) – метод получения изображения сосудов при помощи магнитно-резонансного томографа. Метод позволяет оценивать как анатомические, так и функциональные особенности кровотока. МРА основана на отличии сигнала подвижной ткани (крови) от окружающих неподвижных тканей, что позволяет получать изображения сосудов без использования каких-либо рентгеноконтрастных средств. Для получения более четкого изображения при МР-ангиографии могут быть использованы рентгеноконтрастные препараты (на основе солей гадолиния), вводимые в периферическую вену.Лечение и прогноз
Консервативное лечение направлено на уменьшение количества токсинов, поступающих из желудка и кишечника в воротную вену. Заключается в подборе корма, энтеросорбентов и назначении процедур, направленных на восстановление водного, глюкозного и электролитного баланса организма. Предполагает также профилактику печеночной энцефалопатии.
Заключается в подборе корма, энтеросорбентов и назначении процедур, направленных на восстановление водного, глюкозного и электролитного баланса организма. Предполагает также профилактику печеночной энцефалопатии.Хирургическое лечение заключается в частичном или полном, одномоментном или постепенном лигировании патологического сосуда. Для внепеченочных шунтов используют амероидные констрикторы и целлофановые лигатуры, для внутрипеченочных шунтов применяют эмболизацию внутрисосудистыми спиралями.
Литература:1. А. Гоф, А. Томас. Породная предрасположенность к заболеваниям у собак и кошек. М., «Аквариум», 2005.
2. К. Пратчке. Портосистемные шунты у собак: обзор подходов к диагностике и лечению. Veterinary Focus, 2010, 20.3
3. Дж. Д. Бонагура, Р. Кирк. Современный курс ветеринарной медицины Кирка. М., «Аквариум», 2005.
4. D. E. Thrall et al. Textbook of Veterinary Diagnostic Radiology, Sixth Edition. Elsevier, 2013.
5. T. Schwarz, J.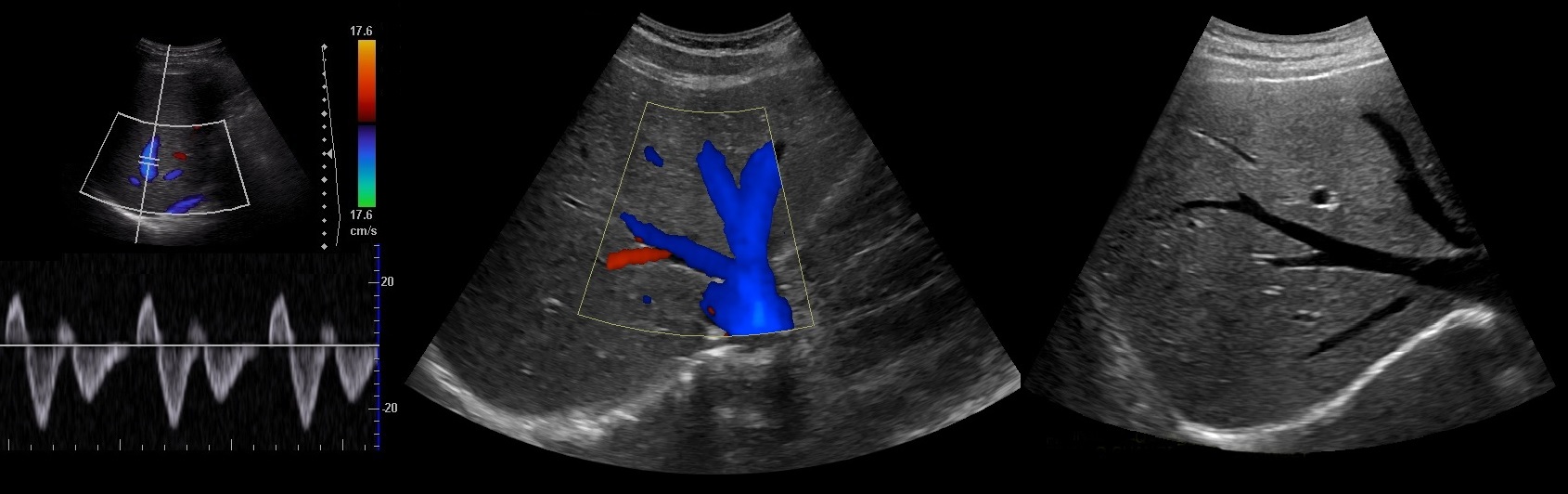 Saunders. Veterinary Computed Tomography. Wiley-Blackwell, 2011.
Saunders. Veterinary Computed Tomography. Wiley-Blackwell, 2011.
6. A. Bruehschwein et al. Contrast-enhanced magnetic resonance angiography for diagnosis of portosystemic shunts in 10 dogs. Vet RadiolUltrasound 2010, 51.
7. N. C. Nelson, L. L. Nelson. Anatomy of extrahepatic portosystemic shunts in dogs as determined by computed tomography angiography. Vet Radiol Ultrasound 2011, 52.
8. S. E. Kim et al. Comparison of computed tomographic angiography and ultrasonography for the detection and characterization of portosystemic shunts in dogs. Vet Radiol Ultrasound. 2013, 54.
9. A. Zwingenberger. CT diagnosis of portosystemic shunts. Vet Clin North Am Small Anim Pract. 2009, 39.
10. G. Bertolini et al. Three-dimensional multislice helical computed tomography techniques for canine extra-hepatic portosystemic shunt assessment. Vet Radiol Ultrasound. 2006, 47.
Лучевая диагностика болезней органов брюшной полости
В.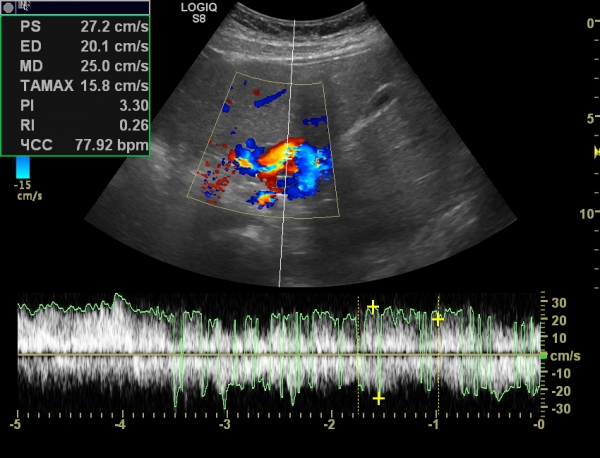 Е. Синицын
Е. Синицын
МЕТОДЫ ДИАГНОСТИКИ
Современная лучевая диагностика болезней органов брюшной полости совершенно не похожа на рентгенологию пищеварительного канала 40-70-х годов ХХ века. На протяжении десятилетий для исследований этой анатомической зоны использовались лишь обзорные снимки, контрастирование барием желудка и кишки и холецистография. Возможности оценки печени, поджелудочной железы и желчных протоков, внеорганных опухолей были ограниченными и основывались, в основном, на косвенных признаках. По мере развития эндоскопии частота использования рентгеновских методов для исследований пищевода, желудка и толстой кишки стала уменьшаться. С другой стороны, рентгеноскопия и рентгенография органов пищеварительного канала остаются важнейшими методами комплексного исследования этих органов. Такие методы, как пероральная или внутривенная холецистография, а также диагностический ретроперитонеум, практически вышли из употребления.
Неизбежный технический прогресс техники, изменения в организации медицины и быстрое накопление научных данных неузнаваемо изменили абдоминальную радиологию. В первую очередь, это касается исследования паренхиматозных органов брюшной полости, где ведущую роль на сегодняшний день занимают ультразвуковое исследование (УЗИ), компьютерная томография (КТ) и реже – магнитно-резонансная томография (МРТ).
В первую очередь, это касается исследования паренхиматозных органов брюшной полости, где ведущую роль на сегодняшний день занимают ультразвуковое исследование (УЗИ), компьютерная томография (КТ) и реже – магнитно-резонансная томография (МРТ).
УЗИ стал основным, стандартным методом исследования всех паренхиматозных органов брюшной полости. Фазированные датчики и ложные микропроцессорные системы предоставили возможность существенно улучшить качество изображений и уменьшить выраженность артефактов. Цветовое доплеровское исследование является стандартным методом изучения сосудов органов брюшной полости и исследования васкуляризации выявленных патологических образований и структур. Появились методики трехмерного УЗИ. Применение эндоскопических датчиков для внутриполостных исследований существенно расширяет возможности этого метода в сложных случаях. Исследуются контрастные средства для УЗИ, предназначенные для изучения перфузии и выявления очаговых поражений печени.
Другой базовый метод исследований органов брюшной полости – КТ – также претерпел огромные изменения. До 1989 г. она была «шаговой» – стол перемещался ступенями, соответственно толщине среза, что ограничивало ее временное и пространственное разрешение и, соответственно, диагностическую информативность.
После появления спиральной КТ (СКТ) в 1989 г. метод стал объемным. При СКТ постоянно включенная рентгеновская трубка вращается вокруг непрерывно движущегося стола. Соответственно этому существенно возросло пространственное и временное разрешение метода, уменьшился риск пропустить мелкие патологические очаги. Метод стал стандартизованным. Следующим шагом (1999 г.) стало появление мультиспиральной КТ (МСКТ). Системы МСКТ первого поколения могли выполнять одновременно 4 среза толщиной от 0,5 мм за один оборот трубки (длительность его удалось сократить до 0,5 с). В настоящее время основной парк МСКТ составляют приборы с 16-64 рядами детекторов, у которых время оборота трубки составляет всего 320-350 мс, а толщина среза – 0,5 с. В 2008 г. появились приборы с 256 и 320 рядами детекторов. В настоящее время все новые системы КТ являются мультиспиральными. Благодаря техническому прогрессу, КТ стала применяться в областях, ранее недоступных для нее. Появилась КТ-ангиография, метод стал использоваться для визуализации полых органов. Были созданы методики КТ-колонографии и гастрографии. Было доказано, что диагностическая эффективность КТ-колоноскопии сопоставимо с таковой традиционной фиброволоконной колоноскопии. Учитывая быстроту выполнения и необременительность КТ-колонографии пациентов, обсуждается целесообразность применения этого метода для скрининга рака толстой кишки.
В 2008 г. появились приборы с 256 и 320 рядами детекторов. В настоящее время все новые системы КТ являются мультиспиральными. Благодаря техническому прогрессу, КТ стала применяться в областях, ранее недоступных для нее. Появилась КТ-ангиография, метод стал использоваться для визуализации полых органов. Были созданы методики КТ-колонографии и гастрографии. Было доказано, что диагностическая эффективность КТ-колоноскопии сопоставимо с таковой традиционной фиброволоконной колоноскопии. Учитывая быстроту выполнения и необременительность КТ-колонографии пациентов, обсуждается целесообразность применения этого метода для скрининга рака толстой кишки.
Однако наиболее распространенным является применение КТ для диагностики и дифференциальной диагностики очаговых поражений печени и поджелудочной железы. Стандартным является выполнение КТ с болюсным введением 100-140 мл контрастного средства. Многофазное исследование в различные фазы контрастирования (из которых важнейшими являются артериальная и портально-венозная) позволяет выявлять и характеризовать очаговые поражения печени и поджелудочной железы, планировать лечение и оценивать его результаты. С помощью МСКТ можно с высокой точностью визуализировать артерии и вены органов брюшной полости, а также желчные протоки.
С помощью МСКТ можно с высокой точностью визуализировать артерии и вены органов брюшной полости, а также желчные протоки.
Благодаря быстроте и надежности МСКТ все чаще используется при обследовании пациентов с диагнозом «острый живот» (выявление перфорации полых органов, кровотечений, кишечной непроходимости, мезентериальной ишемии, острого аппанедицита, панкреатита, холецистита и другой патологии).
МРТ реже используется в исследованиях органов брюшной полости, чем УЗИ и МСКТ, – в первую очередь, по экономическим соображениям. Тем не менее, при правильно выбранных показаниях она дает важную диагностическую информацию. Одной из важнейших областей применения МРТ являются исследования печени. Благодаря мультипараметрическому характеру МР-изображений, возможности получения серий срезов с варьирующими параметрами, подчеркивающих контрастность по параметрам магнитной релаксации (Т1, Т2), подавлению сигнала от жира, хорошей визуализации артерий и вен без контрастирования, МРТ стала важнейшим методом выявления очаговых поражений печени. Методика МР-холангиографии позволяет видеть вне- и внутрипеченочные желчные протоки неинвазивно, не прибегая к искусственному контрастированию. Эта методика основывается на усилении сигнала от неподвижной жидкости (желчь) и подавлению сигнала от плотных тканей и крови. При раздутии очищенных от внутрикишечного содержимого петель толстой кишки воздухом или специальными жидкостями возможно выполнение методики МР-энтерографии или колонографии. Использование контрастных препаратов на основе гадолиния («Магневист», «Гадовист», «Омнискан», «Оптимарк» и пр.) еще более расширяет возможности метода. Относительно недавно появился новый класс контрастных средств для МРТ – гепатотропные (орган-специфические) агенты, такие как «Примовист», «Тесласкан» и ряд других. Эти препараты обладают двойным механизмом действия, позволяя характеризовать как васкуляризацию, так и клеточный состав изучаемых внутрипеченочных структур.
Методика МР-холангиографии позволяет видеть вне- и внутрипеченочные желчные протоки неинвазивно, не прибегая к искусственному контрастированию. Эта методика основывается на усилении сигнала от неподвижной жидкости (желчь) и подавлению сигнала от плотных тканей и крови. При раздутии очищенных от внутрикишечного содержимого петель толстой кишки воздухом или специальными жидкостями возможно выполнение методики МР-энтерографии или колонографии. Использование контрастных препаратов на основе гадолиния («Магневист», «Гадовист», «Омнискан», «Оптимарк» и пр.) еще более расширяет возможности метода. Относительно недавно появился новый класс контрастных средств для МРТ – гепатотропные (орган-специфические) агенты, такие как «Примовист», «Тесласкан» и ряд других. Эти препараты обладают двойным механизмом действия, позволяя характеризовать как васкуляризацию, так и клеточный состав изучаемых внутрипеченочных структур.
УЗИ, МСКТ и МРТ используются, как уже говорилось, и для изучения структур пищеварительного канала. В качестве примера следует упомянуть эндоскопическое УЗИ (исследования прямой кишки, пищевода, головки поджелудочной железы), КТ- и МРТ-колонографию, гастро- и энтерографию.
Область использования радионуклидных методов в абдоминальной радиологии существенно сократилась. Они утратили свое значение в качестве методик изучения анатомии внутренних органов. Основная роль радионуклидных методов (в первую очередь – позитрон-эмиссионной томографии /ПЭТ/) в абдоминальной радиологии – стадирование опухолей, выявление метастатических поражений (прежде всего – печени). Реже радионуклидные методы применяют для выявления скрытых (оккультных) кровотечений из ЖКТ и изучения функции печени.
Ангиографические методы, в связи с развитием УЗИ, МСКТ и МРТ, в значительной степени утратили свое диагностическое значение. Сейчас они преимущественно используются для планирования и проведения интервенционных вмешательств на полых и паренхиматозных органах (стентирование, остановка кровотечений, хемоэмболизация и пр.).
Основные области использования лучевых методов диагностики болезней органов брюшной полости представлены в таблице 1.
Таблица 1. Методы исследования органов брюшной полости
| Исследуемый орган | Метод | Цель исследования |
|---|---|---|
| Органы брюшной полости |
Обзорный снимок брюшной полости | Обследование пациентов с «острым животом», диагностика кишечной непроходимости, перфорации полых органов, выявление рентгенопозитивных конкрементов |
| Пищевод | Рентгенография/рентгеноскопия пищевода | Выявление грыж пищеводного отверстия диафрагмы, дивертикулов, стриктур, обтураций, варикозного расширения вен, опухолей, инородных тел |
| Желудок и 12-перстная кишка | Рентгенография/рентгеноскопия по обычной методике Рентгенография/рентгеноскопия двойным контрастированием |
Диагностика язв, опухолей, стриктур, обтураций, синдрома нарушенного всасывания, контроль результатов операции |
| 12-перстная кишка | Релаксационная дуоденография | Диагностика опухолей головки поджелудочной железы, Фатерова соска, болезней 12-перстной кишки |
| Тонкая кишка | Пассаж бария (пероральное контрастирование) Энтероклизма (чреззондовое введение контрастного вещества) |
Диагностика проходимости кишки, выявление причин стриктур, обструкции, опухолей, воспалительных заболеваний |
| Толстая кишка | Ирриогоскопия (ретроградное контрастирование) Двойное контрастирование КТ-колоноскопия МР-колоноскопия Эндоскопическое УЗИ |
Диагностика опухолей, воспалительных заболеваний, дивертикулов, выявление причин кишечной непроходимости |
| Желчный пузырь и протоки |
Ретроградная панкреатохолангиография Прямая (пункционная) холангиография УЗИ, КТ, МРТ МР-холангиография |
Оценка состояния внепеченочных и внутрипеченочных желчных протоков (конкременты, стриктуры, опухоли), диагностика опухолей головки поджелудочной железы, Фатерова соска, воспалительных и опухолевых заболеваний |
| Печень | УЗИ КТ МРТ ПЭТ |
Диагностика и дифференциальная диагностика очаговых поражений печени, диффузных болезней, травм |
| Поджелудочная железа | УЗИ Эндоскопическое УЗИ КТ МРТ |
Воспалительные заболевания, конкременты, опухоли, травмы, аномалии развития |
ЧАСТНАЯ ПАТОЛОГИЯ
Пищевод
Для исследования пищевода традиционно используется рентгенологическое исследование с барием (рис.1). Процесс прохождения глотков бариевой взвеси (или специального бариевого препарата) регистрируют с помощью флюороскопии в реальном масштабе времени. Частое показание к рентгенологическому исследованию пищевода – диагностика желудочно-пищеводного рефлюкса. Он проявляется обратным забросом бариевой взвеси из желудка в пищевод при исследовании в горизонтальном положении или в положении Тренделенбурга. В случае обструкции пищевода инородным телом рентгенологическое исследование позволяет немедленно установить его уровень и выраженность. С помощью этого метода хорошо видны участки расширения и сужения пищевода при доброкачественных стриктурах (рубцовых, ахалазии). Для ахалазии характерно расширение проксимальной части пищевода и сужение его дистального отдела в форме «клюва». При опухолях пищевода (доброкачественных и злокачественных) виден дефект наполнения пищевода. Характерным признаком злокачественных образований (рака) является изъязвление слизистой и изменение ее рентгенологического рисунка, ригидность стенок пищевода, неровные контуры опухоли (рис.2). Различные виды патологии пищевода (грыжи пищеводного отверстия диафрагмы, опухоли, расширения) хорошо выявляются с помощью КТ или МРТ. КТ позволяет хорошо выявлять распространение опухолей за пределы пищевода. Для детальной оценки стенок пищевода иногда используют эндоскопическое УЗИ.
У пациентов с циррозом печени рентгенографию пищевода назначают для обнаружения варикозно-расширенных вен. С целью уточнения нарушения моторики пищевода иногда назначается манометрия нижнего пищеводного сфинктера с измерением силы и длительности перистальтических сокращений.
Желудок и 12-перстная кишка
Как уже говорилось, из-за более высокой информативности эндоскопические методы несколько потеснили рентгенологические при диагностике болезней желудка и 12-перстной кишки. В то же время существенно, что рентгеноскопия желудка дает цельную картину об анатомии и функции исследуемых органов (рис.3). Это особенно важно при выявлении диффузно растущих опухолей, оценке степени рубцовых поражений стенок, нарушений эвакуации содержимого. По этой причине рентгеноскопия и рентгенография желудка и 12-перстной кишки входят в большинство стандартных схем обследования пациентов с болезнями этих органов.
При диагностике гастритов данные рентгенографии неспецифичны и лишь в случае гипертрофического или склерозирующего (ригидного) гастрита можно увидеть грубые изменения рисунка слизистой (гипертрофия или сглаживание, ригидность стенок).
Классическим показанием к рентгенологическому исследованию желудка является диагностика язв желудка и 12-перстной кишки. Язвы желудка чаще всего локализуются на малой кривизне, а 12-перстной кишки – в области ее луковицы. Однако возможна любая локализация язв. Наиболее надежными рентгенологическими симптомами язв являются симптомы «ниши» и «кратера», локальные изменения рисунка слизистой, отек и ригидность стенки в месте локализации язвы (рис.4, рис.5). Рентгенография хорошо выявляет последствия язвенной болезни – участки рубцовой деформации желудка и 12-перстной кишки. Иногда язвы могут осложняться пенетрацией в окружающие органы (поджелудочную железу, печеночно-дуоденальную связку, сальник, печень и желчные пути), а также в брюшную полость. В этом случае при обзорной рентгенографии или при выполнении снимка на правом боку (латерография) выявляется свободный воздух в брюшной полости, указывающий на перфорацию полого органа. Следует заметить, что при подозрении на перфорацию одного из органов пищеварительного канала противопоказан прием бария. Для контрастирования органов пищеварительного канала в этом случае используют водорастворимые йодсодержащие контрастные вещества. Диагностика перфораций и сопутствующих им осложнений возможна также с помощью УЗИ и КТ.
Рентгенография и рентгеноскопия остаются важными методами диагностики доброкачественных и злокачественных опухолей желудка. Их дифференциальная диагностика основывается на анализе контуров опухоли, характера изменений складок желудка и локальной ригидности его стенок (рис.6). Во всех случаях при выявлении опухоли при рентгенологическом исследовании желудка и 12-перстной кишки назначается эндоскопия с биопсией. В настоящее время все чаще и чаще опухоли желудка впервые выявляют при проведении КТ органов брюшной полости (рис.7) (чаще всего как случайную находку), после чего пациентов направляют на специализированное исследование. УЗИ и МСКТ широко используются для оценки локальной инвазии злокачественных опухолей (прорастание стенки желудка и окружающих структур) и выявления локальных и удаленных метастазов.
Тонкая кишка
Как уже упоминалось, для исследований тонкой кишки используют оценку пассажа по ней бариевой взвеси или водорастворимого контрастного средства, а также чреззондовую энтерографию. В последнее время большое внимание привлекли такие методики, как КТ- или МР-энтерография, при которых возможно построение трехмерных изображений органа и построение изображений просвета кишки в эндоскопическом режиме. Опухоли тонкой кишки, по сравнению с выше- и нижележащими отделами пищеварительного канала, встречаются редко. При лучевом исследовании этого органа частым показанием к исследованию является диагностика тонкокишечной непроходимости и выяснение ее причины, выявление локальных воспалительных поражений (чаще всего – терминального отдела при болезни Крона), обследование пациентов с синдромом «острого живота». При подозрении на острую тонкокишечную непроходимость выполняют обзорный снимок брюшной полости (рис.9), еще более информативным в выявлении обструкции и диагностике ее причины назначают КТ или УЗИ. Использование МР- или КТ-энтерографии при болезни Крона позволяет получить информацию, зачастую недоступную для эндоскопического исследования. Так, эти методы дают возможность видеть не только утолщенные, изъязвленные участки стенки подвздошной кишки, но и инфильтрацию окружающей клетчатки, локальное расширение сосудов брыжейки, увеличение региональных лимфатических узлов.
Толстая кишка
Ирригоскопия по-прежнему является одним из важнейших методов исследования всех отделов толстой кишки. Она дополняет данные колоноскопии и позволяет получить более полную информацию о состоянии органа (рис.10). Одно из самых частых показаний к ирригоскопии – диагностика рака толстой кишки, полипов и дивертикулов. При ирригоскопии рак толстой кишки виден как дефект наполнения с четкой границей между неизмененной слизистой оболочкой и опухолью; выявляются признаки ригидности кишечной стенки. Нередко участок опухолевого поражения вызывает циркулярное сужение просвета кишки (симптом «яблочного огрызка»). Рентгенологические проявления рака толстой кишки зависят от гистологической формы опухоли, локализации и степени ее распространения. МСКТ и в особенности методика КТ-колонографии могут служить альтернативой ирригоскопии в скрининге и диагностике рака толстой кишки. КТ позволяет лучше видеть изменения кишечной стенки и стадировать заболевание (рис.12). Для диагностики ранних стадий рака прямой и сигмовидной кишки стало применяться и трансректальное УЗИ.
Помимо злокачественных опухолей, рентгенологические исследования толстой кишки позволяют выявить воспалительные заболевания толстой кишки (дивертикулит (рис.13), язвенный или гранулематозный колит), врожденные аномалии развития (болезнь Гиршпрунга, мегаколон), нарушения мезентериального кровообращения.
Обзорный снимок брюшной полости, УЗИ и КТ позволяют выяснить причину острого живота и кишечной непроходимости. Одной из самых частых причин синдрома «острого живота» при локализации боли в правом нижнем квадранте является аппендицит. КТ и УЗИ (рис.14) обеспечивают визуализацию воспаленного и увеличенного червеобразного отростка, своевременную диагностику осложнений (развитие инфильтратов, абсцедирования, перфорации). Эти два метода незаменимы и для диагностики других причин «острого живота» (обструкция мочеточника камнем, острый панкреатит, острый холецистит, панкреатит, перфорация полого органа и другой патологии).
Та же тенденция прослеживается и в диагностике кишечной непроходимости. Чаще всего встречается механическая кишечная непроходимость, вызванная опухолями, спайками, инвагинациями, грыжами, желчными и каловыми камнями. При развитии кишечной непроходимости развивается пневматоз кишечника, по мере ее прогрессирования в петли кишечника жидкостью. Уровни жидкости со скоплениями газа над ними в расширенных петлях кишки («чаши Клойбера») являются классическим симптомом кишечной непроходимости. При тонкокишечной непроходимости вертикальные размеры «чаш Клойбера» преобладают над горизонтальными, видны характерные полулунные складки слизистой петель кишки; при толстокишечной горизонтальные размеры уровней жидкости превалируют над вертикальными, видны гаустры. КТ и УЗИ лучше выявляют кишечную непроходимость на ранних стадиях ее развития нежели обзорный снимок, кроме того, обычно с их помощью удается установить и ее причину (рис.15).
Печень
Как уже упоминалось выше, лучевая диагностика заболеваний печени сегодня в основном основывается на использовании УЗИ, КТ и МРТ, реже – ПЭТ.
Применение методов лучевой диагностики при основных болезнях печени зависит от характеристик самого заболевания и возможностей метода.
При диффузных заболевания печени лучевые методы диагностики играют вспомогательную роль. Они используются для дифференциального диагноза (исключение опухолевых поражений), оценки размеров и структуры органа, динамического наблюдения.
Так, при гепатитах (вирусных, токсических, алкогольных) данные методов лучевой диагностики неспецифичны. Печень может быть увеличена или уменьшена в размерах, могут встречаться признаки неоднородности структуры печени при УЗИ. Может определяться диффузное увеличение органа.
Диагностика жировой инфильтрации печени с помощью лучевых методов вполне надежна. Как правило, области жировой инфильтрации чередуются с участками нормальной паренхимы печени. Жировая инфильтрация не приводит к нарушению архитектоники сосудов печени или масс-эффекту. Картина жировой инфильтрации может претерпевать быструю динамику, что имеет важное дифференциально-диагностическое и прогностическое значение. При УЗИ жировая дистрофия печени хорошо видна. Она выглядит как диффузные изменения печени с пониженной эхогенностью, перемежающиеся с участками неизмененной ткани. При КТ отмечается значительное снижение плотности паренхимы органа (до 20-30 единиц Хаунсфилда) (рис.16). Из-за понижения ее плотности пораженные сегменты становятся отчетливо видимыми на фоне неизмененных участков печеночной ткани и сосудов печени. В норме плотность печени несколько выше, чем плотность селезенки. Поэтому при жировой инфильтрации снижение плотности ткани печени видно даже без помощи денситометрии. МРТ редко применяется для подтверждения диагноза, т.к. УЗИ и КТ вполне достаточно для этой цели. Однако если у этих больных проводится МРТ, то применяют специальные программы исследования (импульсные последовательности с подавлением сигнала от жировой ткани).
При диагностике цирроза печени информативность методов лучевой диагностики существенно выше. Выделяют макроузловую, микроузловую и смешанную формы цирроза печени. При микроузловом циррозе печень уменьшена в размерах и значительно уплотнена, регенеративная активность выражена незначительно. При макроузловом циррозе выявляются множественных узлы регенерации, некоторые из них мультилобулярные, с перегородками. Основными критериями диагностики цирроза являются уменьшение размеров печени (на начальных этапах заболевания печень может быть увеличена в размерах), выявление множественных узлов регенерации, наличие признаков портальной гипертензии, спленомегалии, асцита. Наиболее информативными для диагностики являются КТ, УЗИ и МРТ (рис.17). Оценка характера кровотока в портальной вене и печеночных венах с помощью УЗ-допплерографии может оказывать помощь в оценке степени нарушения венозного кровотока в органе. Иногда возникает необходимость в дифференциальной диагностике очагов печеночно-клеточного рака и узлов регенерации при циррозе. В сложных для диагностики случаях прибегают к пункционной биопсии. Она может выполняться под контролем УЗИ или КТ, что повышает точность забора материала и уменьшает риск осложнений.
При ряде заболеваний печени, связанных с метаболическими нарушениями, лучевые методы диагностики позволяют выявить специфические симптомы, облегчающие их диагностику. В качестве примера можно привести болезнь Коновалова-Вильсона и гемохроматоз.
Гепатоцеребральная дистрофия (болезнь Коновалова-Вильсона) обусловлена нарушениями обмена меди, которая откладывается в печени, почках, головном мозге. При обследованиях печени обнаруживают явления гепатита или цирроза различной степени выраженности. Однако самым важным является характерное увеличение плотности паренхимы печени при КТ (или повышение интенсивности сигнала при МРТ). Это связано с повышенным содержанием в органе ионов меди. При гемохроматозе (первичном или вторичном) происходит повышенное накопление железа в клетках ретикуло-эндотелиальной системы. Соответственно этому меняется характер изображения печени на компьютерных томограммах (повышение плотности) и изменение сигнала при МРТ (низкая интенсивность сигнала от паренхимы печени как на Т1, так и на Т2-взвешенных изображениях – рис.18). Последнее объясняется особенностями магнитных свойств оксидов железа в клетках ретикуло-эндотелиальной системы.
Исключительно важным является диагностика и дифференциальная диагностика объемных образований печени. К ним относятся простые кисты печени, паразитарные болезни, абсцессы, эхинококкоз и альвеококкоз, метастазы органных опухолей и первичные опухоли печени.
Простые кисты печени встречаются достаточно часто. На ультразвуковых и томо- графических изображениях они имеют различные размеры, тонкие стенки, однородное содержимое с характеристиками, характерными для жидкости, по плотности близкой к воде. Внутри кист отсутствуют сосуды. Содержимое простых кист не усиливается при введении контрастного препарата. Кисты печени встречаются у 20-40% пациентов с поликистозом почек.
Все методы лучевой диагностики – УЗИ, КТ, МРТ – позволяют с высокой точностью выявлять кисты печени (рис.19).
Абсцессы печени могут иметь различное происхождение. Чаще всего встречаются микробные (кишечная палочка, стрептококк, анаэробная инфекция) и паразитарные (амебные) абсцессы печени.
Инфекционные абсцессы могут возникать после травм печени, хирургических вмешательств, при холангите, сепсисе, флебите портальной вены. При допплеровском ультразвуковом исследовании видна повышенная васкуляризация капсулы, отсутствие сигнала от кровотока внутри полости абсцесса. При УЗИ абсцесс печени проявляется как округлая структура с плотной, неровной капсулой, имеющая толстые стенки и неровную внутреннюю поверхность. Внутри лоцируется плотное жидкое содержимое, возможно наличие газа. Для амебных абсцессов характерна толстая капсула с множественным внутренними перегородками, отсутствие скоплений газа в абсцессе, нередки множественные поражения. Схожая картина получается при использовании КТ и МРТ. В сомнительных случаях прибегают к внутривенному контрастированию. Повышение контрастности капсулы абсцесса и выявление пузырьков газа в его полости позволяет поставить правильный диагноз (рис.20).
С помощью методов лучевой диагностики (чаще всего КТ и УЗИ) выполняют различные виды манипуляций для лечения абсцессов, такие как пункция и дренирование.
Печень, селезенка и легкие являются основными органами диссеминации личинок эхинококка и альвеококка. Поражения других органов (почки, мог, сердце и пр.) встречаются гораздо реже. Первоначально, после заражения, кисты имеют небольшой размер (2-3 мм), и выявление их бывает крайне затруднительным. По мере их роста диагноз облегчается. Для всех методов наиболее характерными признаками эхинококкоза являются наличие в печени кист различного размера с четкими, тонкими и ровными стенками. Диагноз эхинококкоза облегчается при обнаружении внутри или снаружи образования дочерних кист (рис.21). При эхинококкозе в 30% случаев стенки кисты кальцинированы. В случае гибели паразита часто наблюдается частичное или полное отслоение внутренней оболочки, которая становится хорошо видимой внутри кистозной полости. При альвеококкозе кисты множественные, контуры их нечеткие из-за инфильтративного роста с воспалительными и некротическими реакциями по периферии кист. Плотность внутри кисты выше, чем при эхинококкозе. Поэтому образование может напоминать растущую опухоль.
К очаговым поражениям печени относятся доброкачественные и злокачественные опухоли печени и метастазы органных опухолей в печень.
Среди доброкачественных опухолей наиболее часто встречаются гемангиомы, фокальная узловая гиперплазия и аденома печени.
Гемангиома – наиболее часто встречающаяся доброкачественная опухоль печени. Она встречается у 1-5% взрослого населения. В подавляющем большинстве случаев гемангиомы обнаруживают случайно при УЗИ или томографии печени. Очень редко гигантские (>10 см) гемангиомы могут сопровождаться клинической симптоматикой из-за сдавления окружающих структур, тромбоза, геморрагий. При УЗИ гемангиома выглядит как округлое образование с множественными сигналами внутри опухоли от мелких сосудов. На КТ-изображениях гемангиомы в типичных случаях выглядят как округлые образования с низкой плотностью и четкими контурами. При выявлении образования, похожего на гемангиому, обязательно проводить внутривенное контрастирование. Характерным для гемангиом является центропетальная (от периферии к центру) последовательность заполнения гемангиомы контрастным препаратом (рис.22).
При МРТ, из-за длительного времени релаксации на Т2-взвешенных изображениях, характерно очень яркое изображение опухоли на фоне темной паренхимы печени. При динамическом контрастном МР-исследовании с гадолинием характер заполнения опухоли контрастом тот же, что и при КТ. Большие гемангиомы могут иметь нетипичный вид – протяженные центральные зоны, плохо, или не накапливающие контрастный препарат (рубцы, участки гиалиноза). В редких случаях для диагностик гемангиом используют сцинтиграфию печени с меченными эритроцитами или ангиографию.
Фокальная узловая гиперплазия – редкая доброкачественная опухоль печени, обычно встречающаяся у молодых женщин (до 75% случаев). Она состоит из гепатоцитов, купферовских клеток и желчных протоков. В ее центральной части обычно располагается рубец, от которого расходятся перегородки (септы). Она может быть множественной. На изображениях эта опухоль характеризуется отсутствием капсулы, гомогенностью структуры и гиперваскулярностью. Без контрастного усиления опухоль обычно имеет такие же характеристики сигнала, что и паренхима печени. Большая опухоль может вызывать нарушение хода сосудов печени. Эта опухоль гиперваскулярна, поэтому она хорошо выявляется при динамической КТ или МРТ с контрастным усилением в артериальную фазу (рис.23). Обычно хорошо виден гипоинтенсивный центральный рубец, который в отстроченную фазу накапливает контрастный препарат, в то время как паренхима опухоли становится мало отличимой от нормальной печени.
Аденома – редкая доброкачественная опухоль печени, состоящая из гепатоцитов. Кровоснабжается она одной или несколькими дополнительными веточками почечной артерии. При выполнении УЗИ, КТ или МРТ выглядит как объемное образование, нередко окруженное тонкой псевдокапсулой (зоной фиброза). В ткани опухоли могут выявляться участки кровоизлияний, центральный рубец отсутствует. При проведении КТ и МРТ с контрастным усилением аденома контрастируется преимущественно в артериальную фазу. При этом отмечается негомогенное повышение плотности. Иногда аденому трудно дифференцировать от гепатоцеллюлярного рака.
Злокачественные опухоли печени делятся на первичные и вторичные (метастазы). Из злокачественных опухолей часто встречается гепатома (гепатоцеллюлярный рак), реже – холангиокарцинома (холангиоклеточный рак).
Гепатоцеллюлярный рак (гепатома) – наиболее часто встречающаяся первичная опухоль печени. Риск развития гепатомы повышен у пациентов с циррозом печени, гепатитами В и С, гемохроматозом. Выделяют узловую (солитарную), многоузловую и диффузную формы заболевания. Характерна инвазия опухоли в портальную и печеночные вены (до 30% случаев). Гепатома может метастазировать в другие органы (легкие, кости, лимфатические узлы).
Изображения гепатомы, получаемые при лучевых методах диагностики, достаточно разнообразны. Для опухоли характерна негомогенность внутреннего строения, внутриопухолевые перегородки, может выявляться центральный рубец, некротические или кистозные участки, капсула, наличие дочерних узлов. Опухоль может проникать в сосуды, иметь включения кальция и сопровождаться асцитом. Гепатомы, как правило, характеризуются повышенной васкуляризацией и наличием артерио-венозных шунтов. По этой причине при выполнении УЗ-допплерографии, ангиографии или КТ и МРТ с контрастированием они лучше всего видны в артериальную фазу (рис.24).
При диагностике гепатом лучевые методы позволяют определить размеры и расположение опухоли и выявить наличие локальных внутрипеченочных метастазов, инвазии в вены печени. Эти данные очень важны для выбора метода лечения и определения прогноза.
Холангиоклеточный рак (холангиокарцинома) – злокачественная опухоль, растущая из внутрипеченочных желчных протоков. При УЗИ или КТ может иметь вид гиподенсного (гипоинтенсивного при МРТ) очага или мультифокального образования с инфильтративным ростом по ходу желчных протоков (рис.25). Наиболее яркое проявление заболевания – выраженное расширение внутрипеченочных желчных протоков выше места их обструкции опухолью и контрастирование ткани самого образования. КТ, МРТ и особенно МР-холангиография облегчают диагностику опухолевого поражения желчных протоков. Холангиокарцинома, поражающая область слияния внутрипеченочных желчных протоков и вызывающая их обструкцию, получила название опухоли Клацкина. Заболевание следует дифференцировать со случаями доброкачественного врожденного кистозного расширения желчных протоков (болезнь Кароли).
Среди всех очаговых поражений печени важное значение придается выявлению метастазов злокачественных опухолей в печень. Выявление даже единичного небольшого по размеру метастаза в печень меняет стадию процесса и, соответственно, выбор лечебной тактики и прогноз заболевания. Все методы современной лучевой диагностики позволяют визуализировать метастазы в печень. Их чувствительность и специфичность колеблются в пределах 75-90% и зависят от характеристик самого метода, методики исследования, гистологического строения, васкуляризации и размеров очагов. Чаще всего в качестве начального метода исследования назначают УЗИ. В сложных ситуациях диагностический алгоритм расширяется. Выполняют КТ с многофазным контрастированием и/или МРТ (также с контрастированием).
Метастазы в печень обнаруживают примерно у 30-40% пациентов, умерших от злокачественных заболеваний. Чаще всего источником метастатического поражения печени являются опухоли кишечника и желудка, поджелудочной железы, рак легкого и молочной железы. В печень метастазируют и опухоли других органов.
При УЗИ и томографии метастазы в печень видны как множественные мягкотканые очаги (симптом «монеток») (рис.26). В зависимости от гистологии первичного очага, они могут быть гиперваскулярными или гиповаскулярными (чаще всего). От вакуляризации во многом зависит вид метастатических очагов на томограммах и изменение их плотности (интенсивности при МРТ) во время контрастирования. Иногда встречаются метастазы с кальцинатами или с выраженным кистозным компонентом. В сомнительных случаях помощь в диагностике метастатических поражений может оказать ПЭТ или ПЭТ/КТ с 18-ФДГ.
Лучевые методы важны для диагностики портальной гипертензии. Синдром портальной гипертензии встречается при целом ряде заболеваний: тромбозе и компрессии портальной вены и ее ветвей, циррозе печени, холангите, застойной сердечной недостаточности и других заболеваниях. Поэтому при исследовании органов брюшной полости в обязательном порядке положено изучить и описать состояние сосудов печени и селезенки. Портальную гипертензию диагностируют на основании расширения воротной вены, выявления варикозного расширения коллатеральных вен, спленомегалии, асцита. При диагностике тромбоза воротной вены или синдрома Бадда-Киари (тромбоз печеночных вен) большую роль играют КТ или МРТ, выполненные в ангиографическом режиме. Методом УЗ-допплерографии можно определить скорость и направления кровотока в воротной и селезеночной венах.
Заболевания селезенки встречаются значительно реже, чем болезни печени. Диагностика осуществляется с помощью УЗИ и КТ, реже методом МРТ. В селезенке могут встречаться доброкачественные опухоли: гамартомы и гемангиомы. Из злокачественных опухолей чаще всего диагностируются метастазы и поражение селезенки лимфопролиферативными заболеваниями (лимфогранулематоз, лимфомы). Первичные злокачественные опухоли селезенки очень редки. Принципы диагностики поражений селезенки такие же, как и печени.
Травмы селезенки ведут к образованию гематом и разрыву органа. Точная информация о состоянии селезенки влияет на выбор тактики лечения. Диагностика при этом, как правило, проводится в срочном порядке. Поэтому на первый план выходят УЗ- и КТ-исследования. И при УЗИ, и при КТ можно быстро получить исчерпывающую информацию. Инфаркты селезенки эмбологенного происхождения в острой стадии хорошо выявляются при КТ или МРТ с контрастным усилением. В хронической стадии в местах инфарктов КТ можно выявлять кальцинаты.
Поджелудочная железа
Заболевания поджелудочной железы являются частыми показаниями к направлению пациента на лучевое исследование.
Острый панкреатит в начальной стадии своего развития проявляется увеличением органа, диффузным изменением структуры железы из-за ее отека. По мере прогрессирования заболевания появляются перипанкреатические скопления жидкости, инфильтрация окружающей жировой клетчатки. Важно выявление некротических очагов в железе при тяжелом течении заболевания. Для обнаружения очагов панкреонекроза требуется проведение КТ с контрастным усилением (рис.27). В отдаленном периоде с помощью методов лучевой диагностики могут выявляться псевдокисты, кальцинаты, аневризмы артерий (чаще всего – ветвей селезеночной артерии). Панкреатит головки поджелудочной железы, приводящий к обструкции холедоха, иногда приходится дифференцировать с опухолью. Для этой цели прибегают к выполнению КТ или МРТ с контрастированием.
На хронический панкреатит указывает атрофия железы (иногда в сочетании с участками локальной гипертрофии), жировая дистрофия, фиброз или кальциноз ее паренхимы (рис.28), камни в панкреатическом протоке и его расширение.
Наиболее серьезные требования к методам лучевой диагностики предъявляются при подозрении на опухоль поджелудочной железы. К основным типам опухолей железы относятся рак железы (аденокарцинома и цистаденокарцинома), эндокринные опухоли, лимфома и метастазы.
Рак поджелудочной железы – самая частая злокачественная опухоль органа. Более половины случаев заболевания возникают в головке поджелудочной железы. В этой связи первыми признаками заболевания является желтуха. При диагностике приходится проводить дифференциацию между опухолью, отечной формой панкреатита и некальцинированным конкрементом желчного протока. Опухоли тела и хвоста железы долгое время не проявляются и поэтому часто диагностируются, достигнув большого размера (4-5 см).
Диагноз опухоли поджелудочной железы по данным УЗИ, КТ или МРТ преимущественно основывается на выявлении локального утолщения железы и очагового изменения характеристик сигнала в месте поражения. При уточнении причины желтухи и выявлении изменений в головке железы большую помощь оказывает эндоскопическое УЗИ и ретроградная панкреатохолангиография. Для уточнения диагноза часто выполняется Кт с динамическим контрастированием с тонкими срезами. Опухоль обычно выявляется в виде гиподенсного образования на фоне лучше контрастированной паренхимы железы (рис.29). МРТ с использованием болюсного усиления гадолинием увеличивает чувствительность и специфичность метода в выявлении образований.
Для определения возможности выполнения резекции опухоли необходимо выявить распространенность опухоли. Методика КТ-ангиографии позволяет определить наличие инвазии опухоли в верхнебрыжеечную артерию и вену, чревный ствол или воротную вену или в прилежащие к железе органы (желудок, кишечник, сальник).
Большие трудности в диагностике представляют кистозные опухоли поджелудочной железы (цистаденокарцинома). Это злокачественная кистозного строения опухоль, содержащая муцин. Опухоль обычно локализуется в теле или хвосте поджелудочной железы. При УЗИ, КТ или МРТ опухоль выглядит как гиповаскулярная структура, ее перегородки и узлы накапливают контрастный препарат. Схожим образом может выглядеть доброкачественная опухоль – цистаденома или же многокамерная псевдокиста.
Относительно редко в поджелудочной железе встречаются эндокринные опухоли (инсулиномы, гастриномы, випомы, соматостиномы, глюкагеномы и нефункционирующие опухоли). В большинстве случаев эти опухоли являются гиперваскулярными, поэтому они хорошо видны в артериальную фазу контрастирования при выполнении КТ или МРТ (рис.30). Селективная ангиография также позволяет выявить патологические сосуды опухоли. Большое значение для диагноза имеют признаки гормональной активности опухоли (гипогликемия в случае инсулиномы, синдром Золлингера-Эллисона при гастриномах и пр.). Метастазы в печень опухолей APUD системы также обычно бывают гиперваскулярными.
Желчный пузырь и желчные протоки
Частым показанием к лучевому исследованию является подозрение на желчекаменную болезнь и холециститы (калькулезный и безкалькулезный).
Ведущим методом диагностики заболеваний желчного пузыря и желчевыводящих путей является УЗИ. С помощью этого метода можно видеть конкременты в полости желчного пузыря и симптом «акустической тени» за конкрементом (рис.31). Конкременты в желчном пузыре и протоках хорошо видны при КТ (рис.32), а также при МР-холангиографии (как дефекты наполнения на фоне яркого сигнала от желчи). На современных мультиспиральных компьютерных томографах удается визуализировать даже «рентгенонегативные» (холестериновые) конкременты в пузыре, так как они обычно отличаются по плотности от желчи.
Для диагностики острого и хронического холецистита предпочтение отдают УЗИ. С его помощью можно выявить утолщение и инфильтрацию стенок пузыря (рис.33), расширение его полости, неоднородность желчи. При осложненном холецистите (абсцедирование или гангренозные изменения пузыря) можно выявить скопления газа и гноя. Часто выявляется скопление экссудата в ложе пузыря.
Применение ультразвукового исследования также предпочтительно при подозрении на холангиты. С помощью метода визуализируют расширение внутрипеченочных желчных протоков, перипротоковую инфильтрацию паренхимы печени, изменение плотности желчи внутри протоков. При хронических холангитах характерно выявление чередующихся участков сужения (стриктур) и расширения желчных протоков, фибротических и воспалительных изменений по их периферии, которые можно диагностировать с помощью РХПГ, МР-холангиографии или УЗИ. Могут выявляться камни во внутрипеченочных желчных протоках. При осложненных холангитах УЗИ, КТ и МРТ используют для диагностики таких осложнений заболевания, как внутрипеченочные абсцессы.
Лимфатические узлы и внеорганные опухоли
В забрюшинном пространстве расположены лимфатические протоки и несколько групп лимфатических узлов. Выявление их поражения при злокачественных заболеваниях имеет важное диагностическое значение. Даже при условно нормальных размерах узлов их количественное увеличение должно восприниматься с настороженностью. Чаще всего причиной увеличения забрюшинных лимфатических узлов являются метастазы злокачественных опухолей органов брюшной полости или таза. При лимфомах (лимфогранулематоз, неходжкинские лимфомы) пораженные лимфатические узлы отличаются от пораженных метастатическим процессом. Они сливаются в полициклические массы, которые могут вызывать смещение внутренних органов, обструкцию мочеточников, сосудов. Мезентериальная, забрюшинная или тазовая лимфоаденопатия могут быть проявлением СПИДа.
Выраженное увеличение лимфатических узлов может быть обнаружено при выполнении УЗИ. Однако оптимальным методом оценки всех групп лимфатических узлов брюшной полости является КТ. В сомнительных случаях прибегают к радионуклидным методам диагностики (ПЭТ).
В брюшной полости могут быть расположены внеорганные опухоли. Эти опухоли долгое время могут не проявлять себя клинически и обнаруживаться при диспансеризации либо при обследовании по другому поводу. В зависимости от гистологического типа (липомы, липосаркомы, мезотелиомы, тератомы и т.д.) они могут иметь различную плотность и отношение к контрастному веществу.
ЗАКЛЮЧЕНИЕ
Несмотря на прогресс лучевой диагностики, до сих пор нет единого универсального метода диагностики болезней органов брюшной полости. Их выбор и методика выполнения исследования во многом зависят от характера предполагаемого заболевания, остроты процесса и ведущего клинического синдрома. Тем не менее, очевидно, что продолжает увеличиваться роль УЗИ и КТ. Эти методики все чаще используются в острых, неотложных ситуациях, а также начали применяться и для обследования полых органов (кишка, желудок). МРТ и ПЭТ имеют большое значение в диагностике и дифференциальной диагностике опухолей печени.
Воротная вена печени — норма по УЗИ и другие методы диагностики
Воротная вена (ворота печени) представляет собой своеобразный сосудистый ствол, который собирает кровь из различных органов ЖКТ и поставляет ее в печень. В данной статье содержится подробная информация о воротной вене.
Что такое воротная вена
Воротная вена – крупный сосуд, куда подается кровь из непарных органов, в число которых входит селезенка и ЖКТ. После этого жидкость транспортируется в печень. Здесь кровь проходит фильтрацию, освобождаясь от вредных примесей, после чего передается в общий кровяной поток. На воротную вену врач обращает внимание при проведении УЗИ печени. Увеличение габаритов сосуда может указывать на повышенное давление внутри ствола, которое спровоцировано нарушением кровотока в соответствующих сосудах. Такое состояние обычно возникает на фоне патологий печени в хронической форме. Установлена определенная норма по УЗИ воротной вены этого внутреннего органа. Отклонение от референсных значений происходит по патологическим причинам.
Система сосуда
Печень – это внутренний орган с двумя системами кровообращения. Первая ничем не отличается от системы любых других систем организма.
Вторая более интересна. В нее входит воротная вена – крупный сосуд, образующийся при соединении брыжеечных и селезеночных сосудов. Сюда транспортируется кровь из всех непарных органов. Воротная вена выходит через печень, где расположены сосуды более крупных габаритов. Она также соединяет печень и селезенку.
Система воротной вены находится во взаимодействии с сосудами других органов. Это означает, что патологические состояния ствола отрицательно скажутся на всем организме, поскольку загрязненная кровь будет поставляться к другим системам. По этой причине важно регулярно проходить обследования, которые позволяют оценивать состояние сосуда, и своевременно проводить терапию заболеваний.
Вероятные патологии
Выделяют несколько патологических состояний с участием воротной вены.
Тромбоз
Это формирование внутри сосуда сгустков крови, из-за которого затрудняется циркуляция крови. Из-за такой патологии увеличивается артериальное давление. Заболевание относится к смертельно опасным, поскольку может привести к летальному исходу. Тромбы в самой большой вене печени развивается по следующим причинам:
- Онкологические патологии в злокачественной форме;
- Цирроз;
- Заболевания желчного пузыря, поджелудочной железы и ЖКТ, в число которых входит панкреатит, язвенный колит и холецистит;
- Патологии, появление которых спровоцировали инфекции;
- Слишком быстрая свертываемость крови;
- Травмы внутренних органов.
Тромбоз воротной вены характеризуется возникновением следующих симптомов:
- Болевой синдром в животе, локализующийся с правой стороны;
- тошнота с рвотными позывами;
- Расстройства ЖКТ;
- Увеличение габаритов селезенки.
Если патология приобретает хронический характер, то возникает угроза возникновения внутренних кровотечений, в полости живота накапливается лишняя жидкость, увеличиваются габариты вен селезенки.
Тромбоз диагностируют с помощью следующих исследований:
- УЗИ. Помогает обнаружить тромб и локализация образования. Эндоскопическое исследование выявляется даже небольшой сгусток крови.
- МРТ. Помогает определить причины возникновения сгустков крови, и обнаружить осложнения.
Кавернома
Кавернозная трансформация воротной вены – врожденный порок развития или конечный результат послеродового тромбоза с последующей реканализацией и образованием новых сосудов. Внешне напоминает опухоль. Кавернома может быть диагностирована у взрослых и детей.
Портальная гипертензия
Это устойчивое повышение давления в воротной вене. В результате патологии нарушается циркуляция крови в сосудах и нарушается кровоснабжение вены. Это может привести к возникновению тромбов в кровяном русле и тяжелым заболеваниям соответствующего внутреннего органа.
Устойчивое повышенное венозное давление в воротном сосуде возникает по следующим причинам:
- Наличие тромбов в стволе;
- Различные виды гепатита;
- Цирроз;
- Нарушение метаболизма, в результате чего происходит травмирование мягких тканей печени;
- Патологии сердца, в частности, порок этого органа.
Характерная симптоматика:
- Отсутствие аппетита;
- Резкое похудение;
- Болевой синдром в животе с местом локализации в правом подреберье;
- Эпидермис меняет оттенок на желтый цвет;
- Проблемы с пищеварением.
Для диагностики патологии врач назначает УЗИ. Исследование показывает увеличение габаритов печени и селезенки, а также состояние просвета соответствующих сосудов.
Пилефлебит
Это гнойное воспаление воротной вены. Такое патологическое состояние обычно возникает на фоне аппендицита. Если своевременно не оказать медицинскую помощь пациенту, то произойдет некротизация печени, которая приведет к летальному исходу.
Такая патология характеризуется следующей симптоматикой:
- Лихорадка;
- Озноб;
- Повышенная потливость;
- Сильная боль в правом боку ближе к ребрам;
- Тошнота с рвотными позывами;
- Расстройство стула.
Если воспаление сопровождается гнойным процессом, увеличивается давление в сосудах. Это может привести к венозному кровоизлиянию из пищеварительных органов. Если при этом инфекции проникнут в печень, это приведет к возникновению желтухи.
Воспалительный процесс в воротной печени помогают обнаружить следующие исследования:
- Анализ крови на уровень лейкоцитов и СОЭ;
- УЗИ;
- МРТ.
Диагностические методы
Основной метод, который помогает диагностировать патологии воротной вены печени – ультразвук. Его назначают пациентам, независимо от возраста. Исследование помогает:
- Обнаружить изменения структуры вены;
- Правильно диагностировать патологии;
- Определить методы терапии.
Для определения состояния воротной вены также назначают такие исследования:
- МРТ. При проведении исследования можно оценить состояние печени и лимфоузлов. По МРТ также можно определить патологии печени.
- Ангиография. Это рентгенологическое исследование сосудов контрастным способом. Оно помогает диагностировать тромбоз.
- Исследование крови. Показывает концентрацию лейкоцитом, АЛТ, АСТ и билирубина. По состоянию этих показателей можно сделать заключение о состоянии печени и желчного пузыря.
Референсные значения по УЗИ
Референсные значения воротной вены по УЗИ будут различными для взрослых и детей.
Референсные значения УЗИ у взрослых
Воротная вена печени имеет следующую норму по УЗИ:
- ствол вены образуется при соединении трех сосудов, тянущихся от органов брюшной полости;
- стенки сосуда ровные, никаких искривлений не наблюдается;
- циркуляция крови нормальная, сгустков нет;
- референсные значения размера ствола – 13 мм, просвет – 15 мм говорит о портальной гипертензии;
- ветви ствола в печени отходят под прямым углом или перпендикулярно;
- сосуды, которые соединяют воротный и нижний ствол на УЗИ не видны, если отсутствует патологическое состояние вены.
Референсные значения УЗИ у детей
Чтобы оценить состояние воротной вены у детей, ориентируются на габариты ствола. Для каждого возраста характерны свои референсные значения диаметра сосуда, которые приведены в таблице ниже.
Таблица 1. Норма воротной вены по УЗИ у детей:
| Возраст ребенка | Диаметр вены, мм |
| 12 месяцев – 2 года | 2,8-5,8 |
| 3-4 года | 3,4-7,0 |
| 5-6 лет | 4,2-7,5 |
| 7-8 лет | 4,4-8,6 |
| 9-10 лет | 4,8-9,5 |
| 11-12 лет | 5,0-10,1 |
| 13-14 лет | 5,5-10,2 |
| 15-16 лет | 5,4-10,8 |
Норма воротной печени по УЗИ для детей также будет следующей:
- Отсутствие недоразвития;
- Нет резкого суживания;
- Отсутствие крупных сосудов, соединяющих с нижним или верхним полым стволом.
Если исследование показывает отклонения от этих норм, назначают срочное хирургическое вмешательство.
Терапия заболеваний
Терапия воротной вены печени зависит от патологии:
- При тромбозе назначают прием антикоагулянтов;
- Для снятия воспаления и остановки гнойного процесса выписывают антибиотики;
- Для терапии венозного расширения назначается зондирование и консервативная терапия.
Метод лечения может выбрать только врач. Самостоятельные мероприятия провоцируют возникновение осложнений.
Воротная вена печени – это крупный сосуд, который собирает кровь из непарных органов и поставляет в печень. Если развивается патология ствола, это негативно сказывается на состоянии всех систем организма. Чтобы не возникли нежелательные последствия, важно следить за состоянием этого сосуда и проводить своевременную терапию при обнаружении отклонений.
© 2018 – 2019, MedPechen.ru. Все права защищены.
Page not found | Східноєвропейський журнал внутрішньої та сімейної медицини
Журнал орієнтований на лікаря-практика і його потреби. Журнал грунтується на клінічній доказовій базі, алгоритмах діагностики, лікування та профілактики, призводить максимальну кількість корисного ілюстративного матеріалу, на сайті журналу наводяться відео лекції та тестові завдання, що дають можливість фахівцеві в режимі он-лайн перевірити і підвищити свої знання.
Особливість нашого журналу — практично-орієнтований підхід, а також впровадження дистанційних форм навчання у повсякденну діяльність лікаря.
Статті публікуються українською, російською та англій- ською мовами. Приймаються в першу чергу оглядові статті з актуальних проблем внутрішньої та сімейної медицини, які можуть бути використані для дистанційної освіти лікарів та підвищення їх післядипломної освіти.
Автор (або колектив авторів) усвідомлює, що несе первісну відповідальність за новизну і достовірність результатів наукового дослідження, що передбачає дотримання таких принципів: •автори статті повинні надавати достовірні результати проведених досліджень. Завідомо помилкові або сфальсифіковані затвердження неприйнятні.
На сайті журналу постійно оновлюються клінічні протоколи та рекомендації щодо внутрішній медицині. Оформіть передплату на оновлення на сайті заповнивши форму, наведену вище і Ви завжди будете отримувати електронну розсилку з оновленнями.
Ми завжди відкриті для діалогу і співпраці. Ми будемо дуже вдячні за поради та рекомендації, які Ви можете надсилати нам. Ми дуже сподіваємося, що це видання отримає підтримку як у лікарів, так і у працівників системи післядипломної освіти. Ми вдячні всім, хто співпрацює з нашим виданням, і всім читачам за інтерес до основних проблем сучасної медицини!
Засновником журналу є Харківська обласна організація «Асоціація лікарів загальної практики — сімейної медицини». Харківська медична академія післядипломної освіти: Кафедра терапії, ревматології та клінічної фармакології. Харківський національний медичний університет: кафедра внутрішньої медицини №3. Для кореспонденції: [email protected]
Анатомия Печени — 24Radiology.ru
Первым, кто додумался поделить печень на восемь, функционально независимых сегментов был французский хирург — Claude Couinaud.
Классификации Couinaud.
По классификации Couinaud печень делится на восемь независимых сегментов. Каждый сегмент имеет свой собственный сосудистых приток, отток и желчный проток. В центре каждого сегмента есть ветви воротной вены, печеночной артерии и желчного протока. На периферии каждого сегмента вены, собирающиеся в печеночную вену.
- Правая печеночная вена делит правую долю печени на передний и задний сегмент.
- Средняя печеночная вена делит печень на правую и левую доли. Эта плоскость проходит от нижней полой вены до ямки желчного пузыря.
- Серповидный связка отделяет левую долю с медиальной стороны — сегмент IV и с латеральной сторон — сегмент, II и III.
- Воротная вена делит печень на верхние и нижние сегменты. Левая и правая воротная вена делится на верхние и нижние ветви, устремляясь в центр каждого сегмента. Изображение представлено ниже.
На рисунке изображено печеночные сегменты, фронтальный вид.
- На нормальной фронтальной проекции VI и VII сегментов не видно, поскольку они расположены более кзади.
- Правая граница печени формируется из сегментов V и VIII.
- Хотя сегмент IV является часть левой доли, он расположен правее.
Couinaud решил разделить печень в функциональном плане на левую и правую печень по проекции средней печеночной вены (линия Кэнтли).
Линия Кэнтли проходит от середины ямки желчного пузыря кпереди до нижней полой вены кзади. Изображение представлено ниже.
Нумерация сегментов.
Есть восемь сегментов печени. Сегмент IV — иногда делится на сегмент iva и ivb в соответствии Bismuth. Нумерация сегментов по часовой стрелке. Сегмент I (хвостатой доле) расположена кзади. Он не виден на фронтальной проекции. Изображение представлено ниже.
Аксиальная анатомия.
Аксиальное изображение верхних сегментов печени, которые разделены правой и средней печеночной веной и серповидной связкой. Изображение представлено ниже.
Это поперечные изображения на уровне левой воротной вены.
На этом уровне левой воротной вены делит левую долю в верхних отделах (II и IVa) и нижних сегментов (III и IV в).
Левая воротная вена находится на более высоком уровне, чем в правая воротная вена. Изображение представлено ниже.
Аксиальное изображение на уровне правой воротной вены. На данном срезе воротная вена делит правую долю на верхние сегменты ((VII и VIII) и нижние сегменты (V и VI).
Уровень правой воротной вены ниже уровня левой воротной вены. Изображение представлено ниже.
Аксиальное изображение на уровне селезеночной вены, которая находится ниже уровня правой воротной вены, видна только в низко лежащих сегментах. Изображение представлено ниже.
Как разделить печень на сегменты при аксиальных кт изображениях.
- Левая доля: латеральный (II или III) vs медиальный сегмент (IVa/b)
- Экстраполировать (провести воображаемую) линию вдоль серповидной связки до места слияния левой и средней печеночной вены в нижнюю полую вену (IVC).
- Левая против правой доли — IVA/B vs V/VIII
- Экстраполировать линию от ямки желчного пузыря кверху вдоль средней печеночной вены к НПВ (красная линия).
- Правой доли: передний(V/VIII) vs задний сегмент (VI/VII)
- Экстраполировать линию вдоль правой печеночной вены к НПВ книзу до латерального края печени (зеленая линия).
Для более точного понимания КТ-анатомии печени ниже представлено видео.
Хвостатая доля.
Расположена сзади. Анатомическое отличие заключается ее в том, что венозный отток из доли идет чаще отдельно непосредственно в нижнюю полую вену. Также к доле кровь поставляется как от правой, так и от левой ветви воротной вены.
Этот КТ пациента с циррозом печени с атрофией правой доли, с нормальным объемом левой доли и компенсаторной гипертрофией хвостатой доле. Изображение представлено ниже.
Немного о хирургии печени
- На первом схеме представлена правосторонняя гепатэктомия (сегмент V и VI, VII и VIII (сегмент± I)).
- Расширенная правая лобэктомия (трисегментэктомия). Сегменты IV, V и VI, VII и VIII (сегмент± I).
- Левосторонняя гепатэктомия (сегмент II, III и IV (сегмент± I)).
- Расширенная левосторонняя гепатэктомия (трисегментэктомия) (сегмент II, III, IV, V и VII (сегмент± I)).
Многие хирурги используют расширенная гепатэктомия вместо трисегментэктомия.
На следующей схеме представлены:
- Правая задняя сегментэктомия — сегмент VI и VII
- Правая передняя сегментэктомия — сегмент V и VIII
- Левая медиальная сегментэктомия — сегмент IV
- Левая боковая сегментэктомия — сегмент II и III
Ниже представлена еще одна иллюстрация функциональной сегментарной анатомии печени.
- Portal venous and segmental anatomy of the right hemiliver: observations based on three-dimensional spiral CT renderingsMS van Leeuwen, J Noordzij, MA Fernandez, A Hennipman, MA Feldberg and EH Dillon
Department of Radiology, University Hospital Utrecht, The Netherlands - Planning of liver surgery using three dimensional imaging techniques.van Leeuwen MS, Noordzij J, Hennipman A, Feldberg MA.
Department of Radiology and Surgery, University Hospital Utrecht, The Netherlands. - Clinical and anatomical basis for the classification of the structural parts of liverSaulius Rutkauskas et al.
Clinic of Radiology, Institute of Anatomy, Clinic of Surgery, Kaunas University of Medicine, Lithuania - Division of the Left Hemiliver in Man—Segments, Sectors, or Sectionsby Anna C. Botero and Steven M. StrasbergLiver Transplantation and Surgery, Vol 4, No 3 (May), 1998: pp 226-231
- Liver Resection Guidelines
- http://radiologyassistant.nl/en/p4375bb8dc241d/anatom
Самые волнующие вопросы мам! Ответы! новости
Мы собрали самые волнующие вопросы мам, и обратились к профессиональной команде детских специалистов!
Отвечают высококвалифированные доктора клиники «Здоровая семья».
Ответы на вопросы мам
Вопросы к педиатру, к иммунологу-аллергологу, к неонатологу , неврологу
…к педиатру:
Яргина Ольга Анатольевна
Педиатр, гастроэнтеролог
Врач высшей категории, кандидат медицинских наук
Стаж работы: 18 лет
— После года у ребёнка стала замечать странную реакцию на температуру.
Когда заболеет, то очень влажный, лоб холодный, а измеряю температуру 37,5. А лоб прямо ледяной. Опасно ли это и что это вообще. Ребенку 1,5 года
О.А.: Существует два типа лихорадки. Так называемая «белая» и «красная» лихорадка. Они отличаются как раз цветом кожных покровов. При первом типе кожа бледная и холодная, при втором красная и горячая. Связано это с особенностью сосудов расширяться или спазмироваться в ответ на поднятие температуры. Причем белый тип встречается реже и сбивается такая температура тяжелее. При «белом» типе лихорадке к жаропонижающему средству есть смысл добавить спазмолитик (например но-шпу), что позволит снять спазм сосудов и легче сбить температуру.
— Дочке 2,5 года. С первого года мается запорами. Начались месяцев с 5, постоянные газоотводные трубочки. Сейчас периодически проходим курсы дюфалака или хилак форте. На время становится лучше, потом опять возвращаются. Какает раз в три дня, и то частенько после свечи или микролакс. Кал очень толстый, твёрдый бывает, процесс болезненный. Ест и овощи и фрукты и кисломолочку, супы. Но воды пьёт маловато, максимум пол-литра в день, ест очень маленькими порциями. У гастроэнтеррлога на учете не состоит пока, один раз ходили платно. Ещё у нее атопический дерматит, и запоры похоже, сказываются на ухудшении состоянии кожи.
О.А.: Вам совместно с гастроэнтерологом надо провести анализ рациона питания, составить примерное меню ребенка. Провести обследование.
— Моему сыну 2 года, рост 81см, вес 10кг. За год прибавил 1 кг и 7см из них за последние полгода 300 гр и 2см. Меня это очень беспокоит, ребенок очень маленький. Ест хорошо, все, что положено по возрасту, аппетит хороший, но вот не растет и все. В 2 года пойдем на профосмотр конечно, посоветуйте к кому обратиться, что обследовать? Вес при рождении 3300, рост 51см. Да и старшая дочь тоже худющая в 7,5 лет рост 125 см и вес 20,5 кг, но она ест плохо и избирательно. К какому врачу обратиться? Спасибо!
О.А.: Вес и рост ребенка оценивают по центильным таблицам. Это процентное отношение колебаний антропометрических данных для данного возраста и пола. Проще говоря, какой самый частый вес и рост у детей в этом возрасте и насколько он может отклоняться, являясь при этом нормой.
Ваш сын по этим самым таблицам попадает в первый коридор. Это нижняя граница нормы. Т.к. аппетит у него хороший, то можно предположить, что в дальнейшем он может резко вырасти. Но для полной уверенности Вам лучше обратиться к эндокринологу и сделать анализы на гормоны, и провести обследование у гастроэнтеролога
А Ваша дочь попадает по своим параметрам в 3-й коридор, который является самой серединой нормы. Счастья и здоровья Вам и вашим детям!
— Ребенку 1,8. Периодически чувствую запах аммиака изо рта. Появляется и исчезает без видимых причин. От чего это может быть? Какие анализы сдать? К какому врачу обратиться?
О.А.: Очень важный момент — запах появляется натощак, или в течение дня? В большинстве случав это связано с заболеваниями ротовой полости. Но может быть симптомом и более «опасных» заболеваний, таких как сахарный диабет или заболевания почек. Также этот симптом проявляется при принятии некоторых лекарственных средств и витаминов. В вашем случае надо обратиться к опытному педиатру и ЛОР врачу.
— Расскажите о вреде и пользе сахара и соли для детей? Какой тактики придерживаться, чтобы ребенок не стал сладкоежкой и обжорой?
О.А.: Всегда важен принцип разумного подхода к питанию детей. Нельзя ребенка безосновательно лишать того или иного продукта. Вреден ли сахар? Это один из мифов. Сам по себе сахар ни вреден, ни полезен. Организму для полноценной работы необходима глюкоза. Но стоит помнить, что глюкоза и сахар-рафинад не всегда тождественны. Глюкозу (плюс полезные микроэлементы) можно получать из меда, фруктов, сухофруктов. А избыток чистого сахара с пустыми калориями все-таки вреден – он замедляет метаболизм, ухудшает пищеварение, замедляя выработку желудочного сока и может провоцировать аллергию и кожные высыпания с воспалениями.
Соль также называют хлорид натрия (NaCl). Он состоит из 40% натрия и 60% хлорида. Соль является самым главным диетическим источником натрия, а слова «соль» и «натрий» часто используются как взаимозаменяемые. Некоторые виды такой пищевой добавки могут включать некоторый объем цинка, кальция, железа и калия.
Минералы в соли выступают в качестве важных электролитов в организме. Они помогают организму регулировать баланс жидкости. Некоторое количество натрия естественным образом содержится в большинстве продуктов питания. Целесообразно использовать в питании йодированную соль.
Но высокий уровень потребления соли вызывает целый ряд проблем со здоровьем.
Рациональное меню для вашего ребенка всегда поможет составить грамотный врач — педиатр, основываясь на возрасте малыша, его физической активности, т. к. количественное и качественное питание детей отличается от потребностей взрослых.
Правильно построенное питание имеет большое значение для нормального физического и нервно-психического развития детей, повышает трудоспособность и успеваемость, выносливость, устойчивость к неблагоприятным влияниям внешней среды, к инфекционным и другим заболеваниям.
Недостаток или избыток пищи нередко служит причиной заболеваний желудочно-кишечного тракта, нарушения обмена веществ, излишнего нарастания массы тела, вплоть до развития ожирения, или, наоборот, приводит к исхуданию и т. д. Дефекты в питании детей не всегда сразу отражаются на здоровье. Чаще они проявляются позже, в процессе жизнедеятельности, при неблагоприятных внешних условиях, заболеваниях, повышенной учебной нагрузке в школе, а иногда и в более зрелые годы.
— Ребенок принимает по назначению уролога канефрон, нитроксалин, нейромидин курсами. Но почти каждый день принимает какой-нибудь препарат. Какой диеты придерживаться, чтобы не нагружать ЖКТ? По утрам у ребенка неприятный запах изо рта. Ребенку 2 года.
О.А.: Какой диагноз у вашего ребенка? Кроме неприятного запаха изо рта по утрам что-то беспокоит?
— Вопрос гастроэнтерологу. Ребёнку 3 года, мучают запоры (стул ежедневно, но сухой, камушками), проходили лечение, анализы все в норме (кал, узи желудка, кровь), ничего не изменилось. Ребёнок каждый день свежие огурцы или морковку, фрукты, сухофрукты, пьет чистую воду 200-300 мл (без учёта компота, чая), кисломолочку даю только свежую (сегодняшнюю), мучными изделиями не злоупотребляем. Не знаю, что еще предпринять, врачи не помогли нам.
О.А.: В вашем случае надо провести детальный анализ рациона питания, составить индивидуальное меню. Исключить врожденную патологию кишечника, нарушения со стороны щитовидной железы. Также проблемы «сухого «стула могут быть обусловлены нарушением желчеотделения. Какая двигательная активность в течение дня у ребенка?
Очень важно знать, когда появились впервые проблемы с актом дефекации.
— Дочке 5 лет. 1) Год назад по УЗИ обнаружили, что увеличена печень (по размерам на 10 лет) и селезенка (по размерам на 7 лет). Врач УЗИ ничего определенного не сказал. Сказал, что может быть следствием ОРВИ. Педиатр развел руками. Меня все же мучает этот вопрос. Каковы причины этого и нужно ли лечение? Девочка крупная, если это имеет значение.
2) У дочки с рождения легкая неврология. Была лишняя жидкость в голове, гипервозбудимость. У нее очень эмоциональное поведение, любые эмоции через край. Нуждается ли это в корректировке?
3) В последние дни дочка часто зевает, говорит, что хочет спать, но спать не ложится, укладывается с трудом, но спит достаточно, плюс раздражительная стала. Может ли это быть признаком недостатка йода в организме?
О.А., А.Н.: 1. УЗИ надо провести повторно, т.к. год назад уже не информативно. И с результатами лучше обратиться к гастроэнтеррлогу.
2. Требуется ли Вашему ребёнку коррекция поведения или нет, возможно определить после более детального опроса, осмотра, наблюдения за поведением ребёнка, возможно необходима консультирование психологом.
3. Есть ли у Вашего ребёнка дефицит йода или нет, поможет определить врач–эндокринолог, после детального опроса, осмотра, а также необходимого обследования.
— 1) Сыну 7 лет, поставили диагноз Синдром Жильбера, с рождения наблюдаемся у гастроэнтеролога. С рождения повышен биллирубин. Гепатитов, паразитов, пр. инфекций у ребенка и в семье нет. Какой прогноз для качества жизни? Лечение и профилактика? Пьем урсосан.
2) СДВГ влияет на черты характера, успеваемость ребенка? Сыну 7 лет, неаккуратный, несобранный, все просьбы и наставления необходимо повторять по 3 раза. Успеваемость в школе хорошая, с прилежанием и выполнением просьб большие проблемы. Три раза в неделю занят танцами. Стоит ли повышать физ.нагрузки? Как помочь в учебе?
О.А., А.Н.: 1. Какой уровень билирубина? Понижается ли после приема урсосана?
Сдавали ли вы генетический тест? Т.к. важным в диагностике является генетический анализ крови на синдром Жильбера (при этом проводится анализ ДНК гена УДФГТ и в одном из аллелей обнаруживается мутация ТАТАА-уровень). Генетический анализ крови на болезнь Жильбера является наиболее информативным и определяющим, т.к. выявляет источник заболевания, а не косвенные признаки.
Прогноз благоприятный, при избегании провоцирующих факторов: инфекции, физические и психические нагрузки, употребление алкоголя и гепатотоксичных лекарств. Также противопоказана инсоляция, т. е. при подтверждении диагноза загорать и активно отдыхать на солнце Вашему ребенку нельзя.
2. Установлен ли диагноз: Синдром дефицита внимания и гиперактивности Вашему ребёнку специалистом? Получал ли Ваш ребёнок ранее медикаментозное лечение по поводу данного заболевания? Если да, то какое и был ли эффект? Деткам с данным диагнозом не стоит давать по 10 заданий в раз. Лучше дать одно, подождать, пока выполнит, затем следующее. Если успеваемость хорошая, значит, усидчив и диагноз маловероятен.
— Ребенок, что называется, «мелкий»: малый вес, ест мало, маленький рост, на грани с нормой. 5,5 лет. Что можно сделать, чтобы «подрастить» парня?))
О.А.: Педиатр при осмотре ребенка оценивает антропометрические данные по центильным таблицам (это процентное отношение колебаний антропометрических данных для данного возраста и пола). Проще говоря, какой самый частый вес и рост у детей в этом возрасте и насколько он может отклоняться, являясь при этом нормой. И указывает, в какой коридор попадают значения для данного ребенка. Кроме веса и роста измеряются окружности груди и головы, что дает возможность оценить гармоничность развития. Если ребенок развивается гармонично, соматически здоров, аппетит хороший, то делать ничего не нужно. Очень часто дети вытягиваются в период полового созревания.
Рекомендую обратиться для комплексной оценки состояния ребенка к врачу–педиатру и, если есть показания – к врачу эндокринологу для проведения полного обследования.
— Существуют ли на данный момент вакцины, абсолютно безопасные для здоровья ребенка?
О.А.: Как известно, за всю историю медицины с помощью вакцинопрофилактики было спасено больше жизней, чем с помощью всех других методов медицины, вместе взятых.
Отказавшись от прививок в современных условиях, мы становимся абсолютно беспомощными перед лицом множества опасных инфекций.
Непреложен факт, что история человечества — это история эпидемий. В современном мире есть альтернатива многим заболеваниям – вакцинация. Вакцины используют живые, убитые и химические (генно-инженерные).
Основная роль в составе вакцин отведена микроорганизмам, их фрагментам или продуктам их жизнедеятельности, которые и вызывают выработку иммунной защиты против соответствующей инфекции. Это «идеальная » вакцина, но «идеальных» вакцин не существует, т.к. в каждой вакцине есть дополнительные компоненты, которые добавляют из-за особенностей технологического процесса создания вакцин.
И перед использованием вакцин лучше выяснить, нет ли у ребенка непереносимости любого компонента.
Можно сдать кровь на комплексное исследование методом lmmunoCAP — сюда входит обследование на дрожжи пекарские, яйцо, триптазу (это основные дополнительные компоненты вакцин).
К каждой вакцинации ребенка надо подготовить. Желательно сдать перед вакцинацией ОАК и ОАМ. Обязателен осмотр педиатром. В день проведения любой вакцинации ребенок должен быть соматически здоров.
В некоторых случаях индивидуально назначают антигистаминные препараты, если ребенок имеет какие-то признаки аллергии или предрасположен к ней.
В любом случае вовремя и успешно проведенная вакцинация — это защита от многих инфекционных болезней.
— Врач назначил антибиотик Флемоксин ребенку, при этом ничего не сказал о препаратах для восстановления микрофлоры кишечника. Должна ли мама всегда покупать такой препарат сама, заботясь о здоровье ребенка? Или в каких-то случаях они не требуются? И если да, то какой вы бы порекомендовали, кроме Линекса, который подозрительно много рекламируют?
О.А.: Обычно все лекарственные препараты назначает врач. Если у ребенка есть проблемы с пищеварением или со стулом, то надо сообщить об этом Вашему доктору.
Микрофлора кишечника человека — это скопление разнообразных микроорганизмов, работа которых очень тесно связана друг с другом. Если под влиянием каких-то факторов (в Вашем случае — антибиотикотерапия), начинает меняться количество данных бактерий или же их качество, то это становится причиной нарушений в работе желудочно-кишечного тракта, что отображается на состоянии всего организма. Поэтому нужно как можно раньше диагностировать нарушение микрофлоры кишечника и начать ее лечение, чтобы избежать серьезных осложнений и проблем со здоровьем.
С данной проблемой можно обратиться как к педиатру, так и к гастроэнтерологу
…Вопросы к неврологу
Дронь Анастасия Николаевна
Детский невролог
Врач высшей категории, кандидат медицинских наук
Стаж работы: 9 лет
— Нам выписали Глиатилин (7лет), но он дорогой и я купила Церетон. Аналоги таблеток одинаковые, но противопоказания детям разные. Вот вопрос разница в них есть или нет? И правда ли, что побочные эффекты так сильно проявляются?
А.Н.: Оригинальный препарат (инновационный препарат, «бренд») — это впервые синтезированное и прошедшее полный цикл исследований лекарственное средство, активные ингредиенты которого защищены патентом на определенный срок. Отличительные характеристики оригинальных препаратов: высокие показатели качества, эффективности и безопасности; патентование химической формулы, методов синтеза и производства; полный спектр доклинических и клинических исследований; информативная инструкция; производство осуществляется только по правилам GMP; высокая стоимость за упаковку.
По истечении срока патентной защиты любая фармацевтическая компания может приобрести право на производство собственной версии оригинального препарата, т.е. создать дженерик.
Отличительные характеристики дженерических препаратов: — копирование оригинального препарата, т.к. фирма-патентообладатель передает неполное досье на оригинал; невысокие показатели качества, эффективности и безопасности; появление на рынке после окончания срока патентной защиты оригинального препарата; отсутствие доклинических и клинических исследований; как правило, малоинформативная инструкция; допускается в обращение на основании оценки регистрационного досье сокращенного объема и данных биоэквивалентности; производство не всегда осуществляется по правилам GMP; невысокая стоимость за упаковку.
Таким образом, церетон является дженериком (генериком) оригинального препарата глиатилин, поэтому возможно его отличие по составу, что может обусловливать возникновение различных показаний, противопоказаний, а также побочных эффектов. Возникнут ли те или иные побочные эффекты, зависит от индивидуальной непереносимости компонентов препарата, возникнут ли они у Вашего ребёнка или нет предсказать невозможно.
— Дочке уже 4 года 3 месяца, рост 97 см, вес 12 кг. Не можем даже научить считать до 10. все время путается после 5. Есть логопедические проблемы, много букв не выговаривает. Может выучить небольшое четверостишие, или два, но не больше. Пора бить тревогу?
А.Н.: К 4-5 годам у детей исчезают все «возрастные» неправильности произношения. Возможно недостаточно четкое произношение шипящих, «л» и «р» Если Вы ранее не обращались к специалистам с данной проблемой, то необходимо обратиться к неврологу, логопеду и нейропсихологу. По поводу счета до 10, то если малыш в 4 года считает только до 5 — это возрастная норма.
— Как облегчить мигрень подростку (13 лет)? Все анализы, МРТ, УЗДГ, КТ и пр. — в норме, а ребенка тошнит, иногда отправляют всю белую из школы. Дикая головная боль, иногда по три дня, не снимается ничем. Ставят ВСД и я согласна с диагнозом, но это же мучение! Неужели только терпеть?
А.Н.: Облегчение приступов мигрени (если речь и правда о ней) осуществляется ранним приемом препаратов антимигренозных препаратов, каждый из которых надо подбирать, с учетом сопутствующих заболеваний, веса ребенка. Учитывая, что визуализационные исследования и УЗДГ не изменены, вопрос о мигрени под большим сомнением, возможно, речь может идти об иной причине болевого синдрома.
Вам рекомендована очная консультация невролога, до нее рекомендовано использование переносимых ребенком анальгетиков, обязательно затемнение помещения, где находится ребенок в момент приступа.
— Дочке 1,5 года. Долго засыпает, плохо спит. По назначению невролога пропили магний, глицин, седативные травы. Ничего не помогло.
А.Н.: Необходимо уточнить, с какого возраста возникла данная проблема, с чем Вы ее связываете. Соблюдается ли ритуал отхождения ко сну и режим дня Вашего ребёнка?
— В связи с головными болями у ребенка обратились к неврологу. Та сделала УЗДГ и направила к остеопату. Остеопатия — это признанная отрасль медицины? Считала почему-то, что это что-то не официальное.
А.Н.: В 2003 году в России остеопатия была признана в качестве диагностического и лечебного метода, и Минздравом были утверждены методические рекомендации № 2003/74.
В 2013 году вступил в силу приказ «Об утверждении Номенклатуры должностей медицинских работников и фармацевтических работников» от 20.12.2012 года, в котором утверждена профессия врач-остеопат. В этом же году вышел приказ о включении приёма врача-остеопата в номенклатуру медицинских услуг.
— Ребенку 4.5 лет с эпилепсией (год после приступа) поставили первую прививку приорикс. Ребёнок был спокоен перед прививкой, но через минуту после прививки резко появилась сонливость и сильная слабость, ребенок ложился на меня и, запрокидывая голову, закрывал глаза. Потом побледнел, и ему стало жарко. Через 20 минут все нормализовалось. Что же это было и связано ли это с эпи активностью?
А.Н.: На фоне вакцинации у Вашего ребёнка отмечалась индивидуальная стрессовая реакция, которая не имеет прямой связи с эпилепсией. Получен ли допуск к проведению вакцинации малыша от иммунолога?
…Вопросы к иммунологу-аллергологу:
Солодовник Ольга ЕвгеньевнаАллерголог-иммунолог
Врач высшей категории
Стаж работы: 20 лет
— Ребенку 6 лет. С середины ноября у него сухой, навязчивый кашель. За это время было 3 обструкции. На фоне приема антигистаминных кашель становится реже, но все равно не проходит. Причем кашель только во время бодрствования, как только засыпает, кашель прекращается. Сдавали анализы на коклюш, на паразитов, хламидий, микоплазму, токсоплазму — все отрицательно. Пульманолог поставила диагноз реакция повышенной чувствительности верхних дыхательных путей, неуточненной локализации. Что может вызывать такой кашель и к какому врачу нам еще обратиться? (пульманолог ребенка выписала, а кашель опять усиливается).
О.Е.: Гиперреактивность дыхательных путей может быть, помимо исключенных уже причин, проявлением аллергического заболевания или иметь вирусиндуцированную природу. Нужна очная консультация аллерголога-иммунолога для завершения обследования и подбора терапии.
— Ребёнок 19 декабря заболел ветрянкой. 20 декабря обнаружила увеличенные затылочные и шейные лимфоузлы. Прощупывались и видно визуально на шее. Спустя месяц обратилась к педиатру с просьбой о направлении на анализы, так как лимфоузлы уменьшились, но не прошли. Прощупываются руками в виде шариков. 26 января сдали мочу и кровь развёрнутый анализ. Анализы хорошие, все показатели в норме.
Педиатр предлагает ничего не делать и ждать. А меня этот момент настораживает.
Подскажите, какие мои действия или бездействия? Ребенку год и пять.
О.Е.: Герпетическая инфекция действительно часто вызывает увеличение лимфатических узлов. Настораживает, если есть их уплотнение, болезненность кожи над узлом. Чтобы исключить сомнения, можно провести УЗ исследование лимфоузлов.
— Ребенку 3,5года. С рождения есть аллергические реакции. Точно могу сказать, что высыпания красные, сухость сильная появляются на сладкое. Понятно, что сладкое в сильном ограничении. Эозонофилы=11.Есть перегиб желчного пузыря. У ребенка плохой аппетит, ест избирательно. Из овощей только морковь сырую, огурцы свежие, реже банан и яблоко — это все + борщ.
1: С чего начать обследование: аллерголог или гастроэнтеролог? Или этих специалистов можно параллельно пройти?
2. С сентября пошел в д/сад. Начались постоянные болезни. На данный момент с 30.10.2016 пятый раз болеет отитом, между отитами сильная вирусная инфекция или грипп. Лор говорит профилактика отита = профирактика ОРВИ. В августе пропили бронхомунал, стоит пневмококовая вакцина, лечились гропроносином,18.01.17 закончили курс полиоксидония + назонекс в нос (месяц). И вот 25.01-серозный отит, прокалывали ухо.
О закаливании даже речи нет, все время болеет. Из-за этого прививку от гриппа не смогли поставить. Какую профилактику вы сможете порекомендовать? Или это идет адаптация и надо просто это пережить? Когда надо бить тревогу и куда все таки обращаться :к иммунологу или инфекционисту?
О.Е.: Лучше параллельно посетить аллерголога — иммунолога и гастроэнтеролога. Состояние ЖКТ оказывает очень большое влияние на развитие аллергического процесса.
Вам нужно провести полное иммунологическое обследование. Привитые дети не должны болеть часто и тяжело. Надо выяснять причину.
— Может ли у ребенка проявиться аллергия на один и тот же антибиотик не сразу, с раннего возраста, а по прошествии примерно пяти лет, в течение которых этот антибиотик назначался трижды? Проявляется аллергия зудом, спасаемся супрастином, антибиотик допиваем пятый день. Зуд на ногах появился через полчаса после приема первой таблетки.
О.Е.: Да, аллергическая реакция может быть не на первый прием лекарственного препарата. Поэтому, ваши симптомы могут быть проявлением лекарственной аллергии, но достоверно заочно это определить сложно.
— Дочке 4 года. С лялечного возраста проявлялась аллергия в виде шершавых красных пятен. Позднее мы с мужем самостоятельно методом наблюдения и исключения продуктов выявили, что организм реагирует на всю магазинную молочную продукцию кроме «Наша Маша», также нет реакции на фермерскую молочку. Также высыпает на антибиотик Амоксициллин. Примерно с 1,5 лет добавился ещё и не проходящий постоянный сухой кашель, около 2-3 раз в сутки, который часто перерастает в бронхиты, но до конца не лечится. Педиатр к моим замечаниям относится скептически и направление к аллергологу-иммунологу не даёт, заявляя, что нет у нас аллергии — это диатез. Запись только через педиатра. Как можно попасть к данному специалисту, бесплатно сдать анализы, чтобы в последствии пройти правильное эффективное лечение?
О.Е.: Учитывая, что у ребенка имеются не только высыпания, но и сухой кашель, а также повторные бронхиты, я бы не советовала надолго откладывать визит к аллергологу.
Объем бесплатной медицинской помощи определяется территориальной программой госгарантий. Направление к узкому специалисту в этом случае можно получить только у педиатра. Объем возможного обследования оговаривается непосредственно на консультации — он зависит от конкретной клиники
— У дочки (3,5 года) постоянный кашель, бывает, кашляет всю ночь, бывает только утром и иногда днем, смена места жительства и условий ничего не изменила — летом уезжала в деревню к бабушкам на 2 месяца на чистый воздух и овощи-фрукты с грядки, лето было жарким, кашель так и продолжался. Животных не держим, влажную уборку постоянно делаю, аллергии в виде сыпи или еще чего-то подобного никогда не наблюдали. Одно время придерживались диеты — никаких красных и желтых фруктов и овощей, без шоколада, сладостей и прочих аллергенов — помогло мало, кашель был все равно. Анализы на аллергию не сдавали. Пульмонолог выписывал монтелукаст, после него было на пару недель небольшое улучшение. Ингаляции с пульмикортом, беродуалом и прочим тоже не дают эффекта. Кашель иногда переходит в ОРЗ, потом снова просто кашель. Горло красное или не красное, насморк есть или его нет — все равно есть кашель. Уже пытались лечить «сопли, стекающие по стенке горла из носа», тоже безрезультатно или разовый эффект. Педиатр ничего посоветовать не может. Неужели это нормальное состояние ребенка?
О.Е.: Такой кашель может быть симптомом аллергического заболевания, хронической инфекции, проявлением гиперреактивности дыхательных путей. Вам нужна консультация аллерголога.
— Может ли врач выписать ребенка в дет. учреждение с кашлем? Моего ребенка выписали, но кашляет ещё, родители в садике нервничают.
О.Е.: В этом случае важна причина кашля. Если он является симптомом инфекционного заболевания — необходимо долечивание. Кашель может быть проявлением гиперреактивности дыхательных путей или аллергического заболевания. В этом случае посещение ДУ не противопоказано. В каждом конкретном случае должен решать врач.
— Ребенку 1 г 10 мес. На щечках постоянно небольшая красная сыпь… педиатр сказал, что нужно снизить потребление молочных продуктов, может быть из-за непереносимости лактозы, но по анализу проблем с этим нет. Продукты новые не даем, которые могли бы быть причиной аллергии… молока в день пьет 2-3 коробочки по 200 мл, творога съедает 50 гр. Есть ли причины для беспокойства, нужны ли дополнительные обследования?
О.Е.: В Вашем случае необходима консультация аллерголога. Подобные проявления могут быть симптомом аллергического заболевания. Необходимо составить план обследования и получить рекомендации по уходу за кожей.
…Вопросы к неонатологу:
Хохолков Евгений Вадимович
Педиатр, неонатолог
Стаж работы: 9 лет
— Добрый день, ребёнку скоро год, нет прививок, родился недоношенный, был мед. отвод, в полгода педиатр сказал, что уже можно начинать вакцинацию, но мы в это же время попали на дневной стационар по направлению невролога, там выяснилось, что у ребёнка нейтропения лёгкой степени, анемия, до настоящего времени наблюдались у гематолога, на данный момент ограничения по вакцинации от гематолога и невролога нет, кровь выровнялась. Вопрос в чем, к какому врачу обратиться для составления графика прививок, какие для этого нужны анализы, доверия к участковому педиатру нет.
ответ:
Е.В.: Начинать вакцинацию надо как можно скорее. Первым делом Вам необходимо сделать реакцию Манту. Это внутрикожная проба на туберкулез, т.к. в этом возрасте дети уже могли встречаться с микобактерией туберкулеза. Реакция оценивается через 72 часа.
В обязательном порядке сдаются Общий анализ крови и Общий анализ мочи.
Затем Вы идете к педиатру, который должен оценить реакцию Манту, интерпретировать результаты ОАК и ОАМ, провести предварительный врачебный осмотр и по составленному им индивидуальному графику вакцинации направить в прививочный кабинет.
— С 6 месяцев начали вводить прикорм — безмолочные каши. Все шло отлично, пока не начали вводить овощи — начались задержки стула. На 2-3 день даем дюфалак, на следующие сутки стул есть. Затем снова задержка. Клизмы и свечи не ставим, только дюфалак. Сейчас ребенку 7.5 месяцев, кушает каши в день 80 гр., овощей 80-120, основное питание — грудное молоко. В день пьет около 100 мл воды, сейчас вводим чернослив еще. Пробовали отменить овощи — стул наладился (каши оставили), только начинаем докармливать овощами — запор сразу. Мое питание скорректировано в связи с проблемами по здоровью после родов — не ем ничего, что могло бы спровоцировать запор у меня и соответственно у ребенка. Участковый педиатр говорит продолжать прикорм, добавлять новые продукты, с кефиром говорит лучше станет. Прописала линекс и микрозим. Правильно ли продолжать прикорм овощами и вводить новые продукты, может быть ребенок просто не готов и надо отложить прикорм? Что необходимо сделать в нашем случае, чтобы стул наладился?
Е.В.: Во-первых, продолжайте грудное вскармливание. С достаточным количеством грудного молока ребенок получает практически все необходимые вещества.
Во-вторых, нужно проводить хороший массаж живота. Для этого следует делать круговые движения по часовой стрелке или гимнастику — ножки прижимать к животу или делать движение велосипед.
В-третьих, после 6 месяцев проблему запоров можно решать с помощью добавления прикорма в виде пюре из чернослива, абрикосового, яблочного, персикового пюре, компота или отвара из сухофруктов. Начать следует с 1-2 ч. ложек, по результату определять оптимальную дозу.
Также можно увеличить питьевой режим и надо провести подробный анализ рациона питания мамы. Какие овощи вы вводили ребенку, и в каком количестве?
Из овощей можно попробовать кабачок, цветная капуста, брокколи, тыква, морковь. Если на все это возникает запор, то на некоторое время их можно отсрочить. Также нужен регулярный осмотр педиатра на предмет использования лекарственных препаратов.
— Дочке 10 мес. Довольно часто от нее (изо рта) пахнет кислым (уже в течение 4-х мес.). Педиатр наш ничего толком не говорит по этому поводу. Что это? Стоит ли волноваться?
Е.В.: Существует несколько причин, которые вызывают жалобы на неприятный запах изо рта у ребенка: это источники, которые находятся в полости рта и за его пределами. В основном, источником запаха является именно ротовая полость. Чаще всего, он исходит от спинки языка и промежутков между деснами и зубами. Каждая отшелушившаяся клетка эпителия собирает на своей поверхности не менее ста бактерий, которые выделяют продукты жизнедеятельности. Они-то и вызывают запах изо рта. Кроме того, халитоз (неприятный запах изо рта) вызывается снижением секреции и застоем слюны, дисбактериозом полости рта, нарушением кислотно-щелочного баланса из-за повышенного уровня белка в рационе, отмирания клеток слизистой оболочки.
Неприятный запах бывает связан еще с болезнями желудка и тонкого кишечника, воспалительными процессами в носоглотке, проблемами с печенью и почками.
Соблюдение правил гигиены – первое условие, которое поможет устранить неприятный запах изо рта у ребенка. Спинку языка нужно очищать специальной скобкой или щеткой с мягкой щетиной, при чистке зубов особое внимание уделять межзубным промежуткам. Если это не помогает, нужно обратиться на консультацию к гастроэнтерологу, пройти назначенное обследование и, если понадобится, лечение.
— Девочке 11 месяцев. На УЗИ обнаружили увеличение правой доли печени 87 мм. Левая 30 мм. Структура однородная, плотность обычная. Воротная вена 2.8 мм. В воротах печени лимфоузлы 3 шт. диаметр до 7.5 мм. Это серьезно? К врачу записалась. Питание скудное. Кроме смеси Нан, биолакта и творожка ничего не ест.
Е.В.: какому врачу Вы записались? Причиной гепатомегалии может являться наличие воспалительного процесса:
— вирусные гепатиты
— врожденные инфекции, передающиеся во внутриутробном периоде, от матери, по-другому их называют TORCH-инфекции
— поражение паразитами
— нарушение обменных процессов.
Учитывая увеличение лимфоузлов в воротах печени, можно думать об инфекционной причине этих симптомов.
В любом случае Вам как можно скорее надо обратиться на консультацию к гастроэнтерологу, который направит на анализы, в том числе и к врожденным инфекциям. В этом возрасте ребенок должен получать уже достаточно разнообразное питание, включающее все белки, жиры, углеводы, микроэлементы и витамины. Недостаток этих веществ в период активного роста и развития может серьезно сказаться на здоровье в будущем. Очень рекомендую не затягивать процесс, т.к. симптомы могут свидетельствовать о серьезном заболевании.
— У первого ребенка очень поздно обнаружили лактозную недостаточность (списывали всё на колики, целых 9 месяцев). Скоро у нас родится второй ребенок, хотела бы уточнить, можно ли с рождения узнать, есть ли непереносимость??? И как это лучше сделать?
Е.В.: Непереносимость лактозы — одна из важнейших педиатрических проблем.
Лактоза (молочный сахар) в больших количествах содержится в грудном молоке, молочных смесях, коровьем молоке.
Лактазная недостаточность бывает первичной (наследственной) и вторичной (на фоне общей ферментативной незрелости). Вторичную еще называют транзиторной.
Дети первого года жизни склонны к развитию дисбиотических изменений в кишечнике и формированию на этом фоне вторичной лактазной недостаточности. Ее диагностируют в основном клинически и косвенным методом обследования является кал на углеводы.
Но существует более точный метод диагностики — ПЦР (генетический тест на лактозную непереносимость). Советую сдать такой анализ всей Вашей семье. Это позволит установить, есть ли у вас в семье генетически детерминированные нарушения синтеза лактазы.
Также советую обследовать этим методом Вашего малыша, для того, чтобы безосновательно не лишать его молочных продуктов.
В медицинском центре «Здоровая семья» ведут прием авторитетные специалисты с большим опытом работы!
Наша концепция — это комплексная помощь и особый индивидуальный подход к решению проблем пациентов.
Мы предлагаем:
— 15 специальностей. Доктора для взрослых и детей
— 22 доктора высшей квалификационной категории, 3 к.м.н.
— Возможность вызова любого специалиста на дом с 8.00 до 20.00ч.
Обращаясь к профессиональной команде докторов медицинского центра «Здоровая семья» вы получите реальную помощь,диагностику и лечение, ориентированные на результат: на выздоровление и поддержание здоровья!
По настоящему персональный подход и внимание к каждому пациенту создадут атмосферу домашнего уюта и комфорт посещения!
Доктора медицинского центра «Здоровая семья» ежегодно проходят специальные курсы повышения квалификации, осваивают новейшие методики, посещают семинары, участвуют в конференциях!
С каждым пациентом мы тратим на 30% больше времени, чем в других клиниках. Cохраняя стабильно высокое качество услуг.
Опытные специалисты клиники «Здоровая семья» проконсультируют Вас по всем возникающим вопросам.
Звоните и записывайтесь по тел.: 219-30-50, 243-53-03, 300-40-50
ВНУТРИУТРОБНОЕ РАЗВИТИЕ УМБИЛИКАЛЬНО-ПОРТАЛЬНОЙ ВЕНОЗНОЙ СИСТЕМЫ: ДВУХ- И ТРЕХМЕРНОЕ УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
АВТОРЫ: Kivilevitch, L. Gindes, H. Deutsch, R. Achiron
Введение
Оценка умбиликально-портальной венозной системы (УПВС) стала важной частью дородового обследования плода. Аномалии УПВС, связанные с хромосомными и структурными аномалиями, допплеровская оценка кровотока в венозном протоке стала инструментом скрининга синдрома Дауна в первом триместре беременности. Кроме того, недавние исследования показали необходимость оценки кровотока в печени плода с внутриутробной задержкой роста.
У плода венозный кровоток в печени является уникальным, так как обеспечивается двумя эмбрионально и функционально разными системами: умбиликальной и портальной/желточной системами. От 5 до 10 недель беременности в печени образуется сеть анастомозов между пупочной и желточной системой, а также увеличивается объем плацентарного кровотока, который потом поступает к сердцу по этой печеночной системе. Интра- и экстрапортальная венозная система развивается с правой желточной вены. В умбиликальной системе правая пупочная вена регрессирует, а с левой пупочной вены развивается непосредственно портальная система. Венозный проток, который выходит из умбиликально-портальной системы, обеспечивает насыщенную кислородом кровь прямо к сердцу плода.
МетодыПроспективное исследование анатомически нормальных плодов проводилось в рамках рутинного дородового исследования среди населения с низким уровнем риска патологии. В большинстве случаев исследования были проведены во время эхографии плода в 14-16 недель и 19-24 недель или в третьем триместре беременности, как часть оценки роста плода.
Мы исключили плоды с любыми аномальными сонографическими выводами, в том числе с наличием “мягких маркеров” для анеуплоидии, в которых нормальный кариотип не установлен. Также исключили беременности, осложненные материнскими заболеваниями, которые могут повлиять на развитие плода. Исключены были и случаи с патологическим объемом амниотической жидкости, связанным или не связанным с аномальным внутриутробным ростом плода.
Ультразвуковые исследования были выполнены на Voluson 730 или Voluson E8, оснащенных трансабдоминальным 4-8 МГц или трансвагинальным 5-9 МГц датчиками с фильтром высоких частот 70 Гц.
Только в случае получения сонограмм с оптимальной визуализацией УПВС включались в исследование. Все обследования были сделаны в стандартном поперечном срезе верхней части живота (срез, который обычно используется для измерения окружности живота). На срезе мы визуализируем желудок и L-образный портальный синус (это впадение сосудов, которые берут начало с конца пупочной вены; он также был определен Mavrides и соавт., как сосудистое пространство, простирающееся от точки зарождения нижней ветви левой воротной вены до правой воротной вены (рис.1)). С этой точки зрения мы проводили исследования, визуализируя желудок в дистальной точке от датчика, чтобы определить стык портального синуса и главной портальной вены, которая проходит с левой стороны между желудком и нисходящей аортой. Связь между портальной веной и портальным синусом была сначала идентифицирована с помощью двухмерного (2D) ультразвука. После этого использовали цветной допплер с потоком высокой четкости (HDFlow) для достижения наилучшего режима визуализации, а также для проверки направления кровотока (Рис.2 а и b). 3D методика была применена только в тех случаях, когда портальный синус и портальная вена не могли быть обнаружены в одной плоскости в других режимах визуализации. Для 3D HDFlow мы использовали угол объема образца 30-35° (рис. 3). Для того чтобы оценить внутрипеченочные ветви портальной системы, мы приняли систему сегментации печени Couinaud. Использовали также продольный срез для определения нормального хода пупочной вены и венозного протока.
Рис.1. Ультразвуковые изображения нормальной внутрипеченочной пупочной вены, которая соединяется с левой и правой воротной венами. На срезе измерения окружности живота у плода на 23 неделе гестации. (а) Поперечный срез, используемый для измерения окружности живота плода. (b) Сонограмма поперечного среза в сагиттальной плоскости, обозначенной пунктирной линией.
Рис.2. На сонограмме наблюдаем место соединения основной воротной вены и бифуркацию правой и левой портальных ветвей с портального синуса у плода на 23 неделе гестации, представлены без (а) и с (b, c) потоком высокой четкости HDFlow. Изображения (а) и (b) показывают поперечный срез живота плода. Стрелка указывает на печеночную артерию. Изображение (с) соответствует сагитальному срезу главной воротной вены, указанной пунктирной линией.
Рис.3. Изображение воротной вены плода на 24 неделе гестации: нормальная внутрипеченочная анатомия сосудов показана в поперечном срезе (а). 3D HDFlow позволила визуализировать основную воротную вену и ее ветви одновременно, в то время как это было невозможно на 2D (b-d).
РезультатыВ ходе исследования мы изучили 208 плодов. Средний гестационный возраст на момент обследования составил 25,1 недель. В продольном срезе мы заметили, что ход пупочной вены в направлении вверх попадает в печень, где она соединяется с портальной системой. В левой интрасегментарной борозде печени она соединяется с левой портальной веной, которая затем идет резко вправо, создавая L-образный сегмент, известный как портальный сегмент. Главная портальная вена огибает главную борозду слева. Место слияния главной портальной вены с портальным синусом является анатомической точкой разделения между правой и левой ветвями, и расположена вниз (рис. 2 с) и вправо по основанию венозного протока. Правая портальная вена разветвляется на две основные ветви: на переднюю и заднюю ветви на некотором расстоянии от перехода главной портальной вены и портального синуса. Три ветви выходят с левой портальной вены: две слева (нижняя и верхняя ветвь) и одна справа (медиальная ветвь) (рис.3). За период исследования только в одном (0,4%) случае мы были неспособны обнаружить L-образный сегмент левой портальной вены, что указывает на отсутствие горизонтальной части левой портальной вены. В этом случае венозный проток исходит с правой портальной вены, а не из портального синуса (Рис.4).
Рис.4. Случай развития умбиликально-портальной системы у плода на 23 неделе гестации (а b). Типичная L-форма левой воротной вены не может быть идентифицирована (а) и венозный проток имеет другой ход (b, стрелка), по сравнению с обычным развитием (с, стрелка).
В месте слияния главной воротной вены и портального синуса (рис 2) мы заметили, что их угол слияния непрерывно варьирует от перпендикулярного к почти полностью параллельному направлению линий. Соответственно, классифицировали три основных типа связи между главной портальной системой и портальным синусом. Наиболее распространенный тип наблюдался у 140 (67,3%) плодов. Он представляет собой Т-форму соединения, с анастомозом “конец в бок” между главной портальной веной и портальным синусом (рис. 5). Этот тип соединения показал большой диапазон угла соединения и разное расстояние от места разветвления задней ветви правой портальной вены. Соединение колебалось от вертикальной Т-образной вставки в портальный синус, далеко от места разветвления правой ветви правой портальной вены (рис.5 а), до более острого угла соединения и более короткого расстояния от этого разветвления (рис. 5 b и 5 с), образуя крестообразную структуру, состоящую из четырех сосудов: главная портальная вена, левая портальная вена и две ветви (передняя и задняя правой портальной вены) (рис. 5 d). У 26 плодов (12,5%) наблюдали Х-образное соединение между главной портальной веной и портальным синусом (рис.6), характеризующееся образованием анастомоза “бок в бок”, который проходит почти параллельно. В некоторых случаях наблюдается разрыв между главной портальной веной и левой портальной веной, представляющий собой промежуточную форму между вторым и третьим типом соединения (классифицируется как Н-образная форма) и наблюдается у 30 (14,4%) плодов. В этом типе соединения между главной портальной веной и задней правой портальной веной были отделены от правой портальной вены малыми сосудами (Рис.7). Также мы наблюдали разное расстояние между сосудами. В самом крайнем случае связь между сосудами не могла быть визуализирована вместе в одной плоскости в серошкальном режиме. Только в 3D с использованием HDFlow техники можно было продемонстрировать тонкий сосуд, который их соединял (Рис.7с). В нашей серии классификация типа соединения между главной портальной веной и портальным синусом не была возможной в 12 (5,6%) случаях, что объясняется, главным образом, промежуточной морфологией. Восемь из них были между типами T и X, а четыре были между типами X и H.
Рис. 5. Варианты анастомоза главной воротной вены и портального синуса конец в сторону у плода на 24 неделе гестации. (а) Т-образный анастомоз. (b) было отмечено разное расстояние от места разветвления задней ветви правой портальной вены; в некоторых случаях левая воротная вена и правая воротная вена разветвлялась непосредственно от главной портальной вены в виде трезубца (с). (d) Более острый угол соединения является промежуточной формой между типами анастомозов “конец в бок” и “бок в бок”.
Рис.6. Варианты анастомоза главной воротной вены и портального синуса “бок в бок” у плода на 24 неделе гестации: X-образный анастомоз. На сонограмме (а) и (b) представлено соединение с разным расстоянием между комплексом “главная портальная вена/задняя ветвь” правой портальной вены и комплексом “левая воротная вена/передняя ветвь” правой воротной вены. Показан почти полный разрыв между собой, что представляет промежуточную форму между формами X и Н. (с) Трехмерная визуализация с высоким качеством реконструкции потока изображения 3D HDFlow.
Рис. 7. Случай Н-образного анастомоза главной воротной вены и портального синуса у плода на 24 неделе гестации. Главная портальная вена и задняя ветвь правой воротной вены отделены от левой воротной вены и передней ветви правой портальной вены небольшими сосудами, соединяющими их между собой (а и b). (с) изображение представляет собой случай, в котором комплексы “главная портальная вена/передняя ветвь” правой портальной вены и “главная портальная вена/задняя ветвь” правой воротной вены были столь отдалены друг от друга, что они могли быть визуализированы только с помощью режима 3D HDFlow.
Вывод
В данном исследовании мы изучали связь между главной портальной веной и портальным синусом. Умбиликально-портальная венозная система представляет собой комплекс сосудов, питающих печень, а также сердце плода.
Мы решили принять анатомическую номенклатуру, предложенную Mavrides и др., использовать термин “портальный синус” для L-образной пупочной части левой портальной вены. Основной причиной этого была наша способность, используя 2D и 3D HDF, визуализировать с легкостью нижнюю ветвь левой портальной вены в качестве ориентира начала портального синуса. Кроме того, эта методика позволила нам визуализировать одновременно главную портальную вену и ее ветви, что не удалось в режиме 2D (рис. 3 b-d).
Важной особенностью нашего исследования является тот факт, что мы были в состоянии точно описать различные анатомические связи между главной портальной веной и портальным синусом у большого количества плодов во время беременности. Знание этих анатомических вариантов имеет важное значение в диагностике аномалий портальной венозной системы, таких как полная и частичная агенезия воротной вены.
Дуплексное допплеровское ультразвуковое исследование системы воротной вены: новая новая методика оценки давления в воротной вене
Бош Дж., Пискуэта П., Феу Ф., Фернандес М., Гарсия-Паган Дж. К.. Патофизиология портальной гипертензии. Гастроэнтерол Clin North Am . 1992; 21: 1–14.
CAS PubMed Google Scholar
Лангер Д.А., Шах В.Х. Оксид азота и портальная гипертензия: взаимодействие вазореактивности и ангиогенеза. Дж Гепатол . 2006; 44: 209–216.
Артикул CAS PubMed Google Scholar
D ’Amico G, Garcia-Tsao G. Диагностика портальной гипертензии: как и когда. В: deFranchis R, ed. Портальная гипертензия. Труды Третьего международного консенсусного семинара Бавено по определениям, методологии и терапевтическим стратегиям . Оксфорд (Великобритания): Blackwell Science; 2001: 36–64.
Брайон А., Калес П., Валла Д. и др.Влияние степени печеночной недостаточности на внутреннюю гемодинамику и реакцию на пропаранол у пациентов с циррозом печени. Кишечник . 1986; 27: 1204–1209.
Артикул CAS PubMed Google Scholar
Picchiotti R, Mingazzini P, Scucchi L, et al. Корреляция между синусоидальным давлением и морфологией печени при циррозе. Дж Гепатол . 1994; 20: 364–369.
Артикул CAS PubMed Google Scholar
Gluud C, Henriksen J, Nielsen G. Прогнозные показатели у мужчин с алкогольным циррозом печени. Гепатология . 1988. 8: 222–227.
Артикул CAS PubMed Google Scholar
Меркель С., Болоньези М., Беллон С. и др. Прогностическая ценность катетеризации печеночной вены у пациентов с циррозом и варикозным расширением вен пищевода. Гастроэнтерология . 1992; 102: 973–979.
CAS PubMed Google Scholar
Viallet A, Marleau D, Huet M и др. Гемодинамическая оценка пациентов с внутрипеченочной портальной гипертензией: взаимосвязь между кровотечением из варикозно расширенных вен и порто-печеночным градиентом. Гастроэнтерология . 1975; 69: 1297–1300.
CAS PubMed Google Scholar
Ригау Дж., Бош Дж., Бордас Дж. М. и др. Эндоскопическое измерение портального давления при циррозе: корреляция с портальным давлением и кровотечением из варикозно расширенных вен. Гастроэнтерология . 1989; 96: 873–880.
CAS PubMed Google Scholar
Blei AT. Портальная гипертензия и ее осложнения. Curr Opin Gastroenterol . 2007. 23: 275–282.
Артикул PubMed Google Scholar
Гроссман Р.Дж., Бош Дж., Грейс Н. и др. Гемодинамические события в проспективном рандомизированном исследовании пропаранолола по сравнению с плацебо в профилактике первого кровотечения из варикозно расширенных вен. Гастроэнтерология . 1990; 99: 1401–1407.
Google Scholar
Feu F, García-Pagán JC, Bosch J, et al. Связь между ответом портального давления на фармакотерапию и риском повторного кровотечения из варикозно расширенных вен у пациентов с циррозом печени. Ланцет . 1995; 346: 1056–1059.
Артикул CAS PubMed Google Scholar
Pomier-Layrarques G, Kusielewicz D, Willems B, et al.Пресинусоидальная портальная гипертензия при неалкогольном циррозе печени. Гепатология . 1985; 5: 415–418.
Артикул Google Scholar
Myers JD, Taylor WJ. Окклюзионная катетеризация печеночных вен при исследовании нормальной печени, цирроза печени и нецирротической портальной гипертензии. Тираж . 1956; 13: 368–380.
CAS PubMed Google Scholar
Grosszmann RJ, Wongcharatrawee S. Градиент венозного давления в печени: все, что стоит делать, следует делать правильно. Гепатология . 2004. 39: 280–282.
Артикул Google Scholar
Wongcharatrawee S, Groszmann RJ. Диагностика портальной гипертензии. Baillieres Best Pract Res Clin Gastroenterol . 2000. 14: 881–894.
Артикул CAS PubMed Google Scholar
Перелло А., Эскорсел А., Брю С. и др. Клиновидное венозное давление в печени адекватно отражает давление в воротной вене при циррозе, связанном с вирусом гепатита С. Гепатология . 1999; 30: 1393–1397.
Артикул CAS PubMed Google Scholar
Grosszmann RJ, Glickman M, Blei AT, et al. Клиновидное и свободное печеночное венозное давление, измеренное с помощью баллонного катетера. Гастроэнтерология . 1979; 76: 253–258.
Google Scholar
Парих С. Градиент венозного давления в печени: стоит еще раз взглянуть? Dig Dis Sci . 2009. 54: 1178–1183.
Артикул PubMed Google Scholar
Штейнлауф А.Ф., Гарсия-Цао Г., Закко М.Ф., Дики К., Гупта Т., Гроссцманн Р.Дж. Седативный эффект мидазолама низкой дозой: вариант для пациентов, которым проводятся серийные измерения печеночного венозного давления. Гепатология . 1999; 29: 1070–1073.
Артикул CAS PubMed Google Scholar
Миллер В.Е., Берляндия ЛЛ. Импульсная допплеровская дуплексная сонография и КТ тромбоза воротной вены. Ам Дж. Рентгенол . 1985; 145: 73–76.
CAS Google Scholar
Sabba C, Merkel C, Zoli M, et al. Вариабельность между наблюдателями и межоборудованием эходоплеровского исследования воротной вены: эффект совместной программы обучения. Гепатология . 1995; 21: 428–433.
CAS PubMed Google Scholar
Zulke C, Matejovic M, Trager K, Radermacher P. Подтверждение измерения потока в воротной вене с помощью допплеровской сонографии с цветным потоком на модели септического шока у свиньи. Intensive Care Med . 2005; 31: 1288–1291.
Артикул PubMed Google Scholar
Chow PK, Yu WK, Ng TH, et al. Влияние допплеровского и портального давления на трансабдоминальное дуплексное ультразвуковое допплеровское измерение портального кровотока: модель свиней для экспериментальных исследований. J Surg Res . 2000. 89: 66–73.
Артикул CAS PubMed Google Scholar
Тесслер Ф.Н., Геринг Б.Дж., Гомес А.С. и др. Диагностика тромбоза воротной вены: значение цветной допплеровской визуализации. AJR Am J Roentgenol . 1991; 157: 293–296.
CAS PubMed Google Scholar
Хосоки Т., Арисава Дж., Марукава Т. и др. Портальный кровоток при застойной сердечной недостаточности: данные импульсной дуплексной сонографии. Радиология . 1990; 174: 733–736.
CAS PubMed Google Scholar
Baik SK, Kim JW, Kim HS, et al. Недавнее кровотечение из варикозно расширенных вен: ультразвуковая допплеровская кривая печеночной вены для оценки тяжести портальной гипертензии и ответа на вазоактивные препараты. Радиология . 2006; 240: 574–580.
Артикул PubMed Google Scholar
Ким М.Ю., Байк С.К., Парк Д.Х. и др.Индекс затухания допплеровской кривой печеночной вены для оценки тяжести портальной гипертензии и ответа на пропранолол при циррозе печени: проспективное нерандомизированное исследование. Печень Инт . 2007. 27: 1103–1110.
Артикул PubMed Google Scholar
Nelson RC, Lovett KE, Chezmar JL, et al. Сравнение импульсной допплерографии и ангиографии у пациентов с портальной гипертензией. AJR Am J Roentgenol .1987. 149: 77–81.
CAS PubMed Google Scholar
Гайани С., Болонди Л., Ли Басси С., Санти В., Зирони Г., Барбара Л. Влияние еды на портальную гемодинамику у здоровых людей и пациентов с хроническим заболеванием печени. Гепатология . 1989; 9: 815–819.
Артикул CAS PubMed Google Scholar
Subramanyam BR, Balthazar EJ, Madamba MR, Raghavendra BN, Horii SC, Lefleur RS.Сонография портосистемных венозных коллатералей при портальной гипертензии. Радиология . 1983; 146: 161–166.
CAS PubMed Google Scholar
Гибсон Р.Н., Гибсон П.Р., Донлан Д.Д., Клуни Д.А. Идентификация открытой околопупочной вены с помощью допплерографии: важность в диагностике портальной гипертензии. AJR Am J Roentgenol . 1989; 153: 513–516.
CAS PubMed Google Scholar
Золи М., Иервезе Т., Меркель С. и др. Прогностическое значение портальной гемодинамики у пациентов с компенсированным циррозом печени. Дж Гепатол . 1993; 17: 56–61.
Артикул CAS PubMed Google Scholar
Мориясу Ф., Нишида О, Бан Н. и др. «Индекс заложенности» воротной вены. AJR Am J Roentgenol . 1986; 146: 735–739.
CAS PubMed Google Scholar
Фернандес-Муньос Д., Карамело С., Сантос Дж.С., Бланшар А, Эрнандо Л., Лопес-Новоа Ю.М. Системные и внутренние гемодинамические нарушения у крыс в сознании с экспериментальным циррозом печени без асцита. Am J Physiol . 1985; 249: G316 – G320.
CAS PubMed Google Scholar
Ивао Ю., Ким Ю.И., Какетани К., Накашима К., Окада К., Кобаяши М. Гетерогенность ядерной ДНК по стволовой линии при гепатоцеллюлярной карциноме. Гепатогастроэнтерология . 1993; 40: 491–495.
CAS PubMed Google Scholar
Додд GDIII, Мемель Д.С., Зайко А.Б., Барон Р.Л., Сантагуида Л.А. Стеноз и тромбоз печеночной артерии у реципиентов трансплантата: допплеровская диагностика с указанием резистивного индекса и времени систолического ускорения. Радиология . 1994; 192: 657–661.
PubMed Google Scholar
Bolognesi M, Sacerdoti D, Merkel C, Bombonato G, Enzo E, Gatta A. Влияние хронической терапии надололом на портальную гемодинамику и на индексы внутреннего импеданса с использованием допплерографии: сравнение острых и хронических эффектов. Дж Гепатол . 1997. 26: 305–311.
Артикул CAS PubMed Google Scholar
Берциготти А., Касадей А., Магалотти Д. и др. Реноваскулярный импеданс коррелирует с портальным давлением у пациентов с циррозом печени. Радиология . 2006; 240: 581–586.
Артикул PubMed Google Scholar
Тасу Дж. П., Роше Л., Пелетье Г. и др. Градиенты печеночного венозного давления, измеренные с помощью дуплексного ультразвука. Клин Радиол . 2002; 57: 746–752.
Артикул PubMed Google Scholar
Самонакис Д.Н., Триантос С.К., Тальхеймер У и др. Иммуносупрессия и возраст донора в зависимости от тяжести рецидива ВГС после трансплантации печени. Трансплантация печени . 2005; 11: 386–395.
Артикул PubMed Google Scholar
Zironi G, Gaiani S, Fenyves D, Rigamonti A, Bolondi L, Barbara L. Значение измерения средней скорости портального кровотока с помощью допплеровской флоуметрии в диагностике портальной гипертензии. Дж Гепатол . 1992; 16: 298–303.
Артикул CAS PubMed Google Scholar
Zhang L, Duan YY, Li JM, Yin JK. Гемодинамические особенности ультразвуковой допплерографии у пациентов с портальной гипертензией: прямое интраоперационное измерение портального давления в системе воротной вены. J Ультразвук Med . 2007; 26: 1689–1696.
PubMed Google Scholar
Vizzutti F, Arena U, Rega L, et al. Эффективность ультразвуковой допплерографии в прогнозировании тяжелой портальной гипертензии при хроническом заболевании печени, связанном с вирусом гепатита С. Печень Инт . 2007. 27: 1379–1388.
CAS PubMed Google Scholar
Choi YJ, Baik SK, Park DH, et al. Сравнение ультразвуковой допплерографии и градиента венозного давления в печени при оценке портальной гипертензии при циррозе печени. Дж Гастроэнтерол Гепатол . 2003. 18: 424–429.
Артикул PubMed Google Scholar
Jeong PH, Baik SK, Choi YJ, et al.Сравнение ультразвуковой допплерографии и градиента венозного давления в печени при оценке портальной гипертензии при циррозе печени. Тэхан Кан Хакхо Чи . 2002; 8: 264–270.
PubMed Google Scholar
Таурель П., Блан П., Даузат М. и др. Допплеровское исследование мезентериального, печеночного и портального кровообращения при алкогольном циррозе: взаимосвязь между количественными измерениями Доплера и тяжестью портальной гипертензии и печеночной недостаточности. Гепатология . 1998. 28: 932–936.
Артикул CAS PubMed Google Scholar
Merkel C, Sacerdoti D, Bolognesi M, Bombonato G, Gatta A. Допплерография и катетеризация печеночной вены при портальной гипертензии: оценка согласованности в оценке тяжести и реакции на лечение. Дж Гепатол . 1998. 28: 622–630.
Артикул CAS PubMed Google Scholar
Bolognesi M, Sacerdoti D, Merkel C, Bombonato G, Gatta A. Неинвазивная оценка степени тяжести портальной гипертензии у пациентов с циррозом печени с помощью эхо-цветной допплерографии. Ультразвук Med Biol . 2001; 27: 901–907.
Артикул CAS PubMed Google Scholar
D’Amico G, Pagliaro L, Bosch J. Лечение портальной гипертензии: метааналитический обзор. Гепатология . 1995. 22: 332–354.
PubMed Google Scholar
Gournay J, Masliah C, Martin T, Perrin D, Galmiche JP. Изосорбид мононитрат и пропранолол по сравнению с одним пропранололом для предотвращения повторного кровотечения из варикозно расширенных вен. Гепатология . 2000; 31: 1239–1245.
Артикул CAS PubMed Google Scholar
Lo GH, Lai KH, Cheng JS и др. Эндоскопическая перевязка варикозно расширенных вен плюс надолол и сукральфат в сравнении с перевязкой только для профилактики повторного кровотечения из варикозно расширенных вен: проспективное рандомизированное исследование. Гепатология . 2000. 32: 461–465.
Артикул CAS PubMed Google Scholar
Bosch J, Garcia-Pagan JC. Профилактика повторного кровотечения из варикозно расширенных вен. Ланцет . 2003; 361: 952–954.
Артикул PubMed Google Scholar
D’Amico G, Garcia-Pagan JC, Luca A, Bosch J. Снижение градиента давления в венах печени и предотвращение кровотечения из варикозно расширенных вен при циррозе: систематический обзор. Гастроэнтерология . 2006; 131: 1611–1624.
Артикул PubMed Google Scholar
Абрачинскас Д.Р., Оокубо Р., Грейс Н.Д. и др. Пропранолол для профилактики первого кровотечения из варикозно расширенных вен пищевода: обязательство на всю жизнь? Гепатология . 2001; 34: 1096–1102.
Артикул CAS PubMed Google Scholar
Ripoll C, Groszmann RJ, Garcia-Tsao G, Bosch J, Grace N, Burroughs A, Planas R, et al.Градиент печеночного венозного давления позволяет прогнозировать развитие гепатоцеллюлярной карциномы независимо от тяжести цирроза. Дж Гепатол . 2009.
Asselah T, Bieche I, Sabbagh A, Bedossa P, Moreau R, Valla D, Vidaud M, et al. Экспрессия генов и инфекция вирусом гепатита С. Кишечник . 2009. 58: 846–858.
Артикул CAS PubMed Google Scholar
Schepke M, Raab P, Hoppe A, Schiedermaier P, Brensing KA, Sauerbruch T.Сравнение скорости воротной вены и градиента венозного давления в печени при оценке острого ответа воротной гемодинамики на пропранолол у пациентов с циррозом. Ам Дж. Гастроэнтерол . 2000; 95: 2905–2909.
Артикул CAS PubMed Google Scholar
Castano G, Viudez P, Carlevaro O, et al. Оценка реакции на пропранолол при катетеризации и ультразвуковой допплерографии у пациентов с циррозом печени. Acta Gastroenterol Latinoam . 1998. 28: 291–297.
CAS PubMed Google Scholar
Лука А., Гарсия-Паган Дж. К., Феу Ф и др. Неинвазивное измерение бедренного кровотока и реакции портального давления на пропранолол у пациентов с циррозом печени. Гепатология . 1995; 21: 83–88.
CAS PubMed Google Scholar
Cioni G, Turrini F, Tincani E, et al.Профилактика первого эпизода кровотечения из варикозно расширенных вен: роль дуплексного ультразвукового допплеровского измерения острого ответа на бета-адреноблокаторы. J Ультразвук Med . 1999; 18: 633–638.
CAS PubMed Google Scholar
Берзиготти А., Ринальди М.Ф., Магалотти Д. и др. Первичная профилактика надололом у пациентов с циррозом печени: доплеровские модели внутренней гемодинамики у пациентов с хорошим и плохим ответом. Дж Гепатол .2006. 44: 310–316.
Артикул CAS PubMed Google Scholar
Merkel C, Sacerdoti D, Bolognesi M, et al. Гемодинамическая оценка добавления изосорбид-5-мононитрата к надололу у пациентов с циррозом печени с недостаточным ответом на только бета-блокатор. Гепатология . 1997; 26: 34–39.
CAS PubMed Google Scholar
Портальная гипертензия — это часто встречающееся клиническое состояние с множественными причинами и несколькими визгами.Ультразвук — это точный неинвазивный метод оценки этиологии, тяжести и осложнений. Я рассмотрю роль ультразвукового исследования при портальной гипертензии. Будут обсуждены ультразвуковые характеристики, помогающие определить этиологию заболевания, а также критерии, позволяющие оценить тяжесть заболевания и его осложнения. Ключевые слова: Портальная гипертензия, УЗИ
Портальная гипертензия — распространенный клинический синдром, характеризующийся повышением давления в воротной вене. Его по-разному определяют как давление заклинивания в печеночной вене или давление в прямой воротной вене более чем на 5 мм рт. Ст. Выше, чем давление в нижней полой вене, давление в селезеночной вене более 15 мм рт. . Однако фактические прямые измерения портального давления достигаются лишь у небольшого количества пациентов.Следовательно, неинвазивные методы визуализации и, в частности, ультразвук, играют решающую роль в диагностике и лечении портальной гипертензии. Ультразвуковая оценка должна преследовать три цели, а именно:
Поставить диагноз Были получены множественные результаты по шкале серого и допплеровские результаты. предложены в качестве маркеров основной портальной гипертензии, а их достоинства и ограничения обсуждаются ниже. Портальная вена (PV) Традиционно увеличение воротной вены считалось признаком портальной гипертензии. Однако исследования показали, что пороговые диаметры ЛВ более 13 или 15 мм имеют чувствительность для диагностики портальной гипертензии только 40 и 12,5% соответственно. [1], [2] Фактически, ангиографически было отмечено, что диаметр портальная вена не увеличивается с градиентом порто-печеночного венозного давления и может даже снижаться в зависимости от тяжести гипертензии.[3] Кроме того, с развитием обратного кровотока в воротной вене (гепатофугальный кровоток) и / или портосистемных шунтов калибр воротной вены будет уменьшаться. Хотя абсолютный размер воротной вены не может быть надежным индикатором портальной гипертензии, ее относительное изменение размера с дыханием является более чувствительным, хотя и довольно редко оцениваемым выводом. Увеличение диаметра ЛВ менее чем на 20% при глубоком вдохе указывает на портальную гипертензию с чувствительностью 80% и специфичностью 100%.[4] Обычно портальная кровь течет в сторону печени, гепатопетальный кровоток, [Рисунок — 1] a на протяжении всей систолы и диастолы с лишь незначительным наложением фазности дыхания и периодичности сердца. В большинстве случаев портальной гипертензии поток все еще гепатопетальный, но спектральный допплер может демонстрировать потерю фазичности дыхания и более выраженную сердечную периодичность, которая может прогрессировать до отсутствия конечного диастолического потока, артериализированного потока или двунаправленного потока «туда-сюда». В редких случаях при увеличении рубцевания и фиброза паренхимы печени путем наименьшего сопротивления притоку печеночной артерии становится воротная вена, что приводит к обратному току в воротной вене.Исследования показали, что у пациентов с портальной гипертензией может быть гепатофугальный кровоток в один день и нормальный гепатопетальный кровоток в другой [5]. У здоровых пациентов средняя скорость потока в ЛВ составляет от 13 до 23 см / сек, но у пациентов с портальной гипертензией средняя скорость ЛВ может варьироваться в зависимости от наличия и расположения спонтанных шунтов. Скорость имеет тенденцию увеличиваться при наличии открытой околопупочной вены и снижаться при наличии спленоренальных коллатералей. «Индекс застоя» — это отношение площади поперечного сечения PV (см 2) к средней скорости потока PV (см / сек), тем самым принимая во внимание дилатацию воротной вены и снижение скорости потока, два физиологических изменения, связанных с портальной гипертензией. . У здоровых субъектов это соотношение составляет приблизительно 0,07 [6], а значение выше 0,1 предполагает диагноз портальной гипертензии с 95% чувствительностью и специфичностью [7] [Рисунок — 1]. Печеночная артерия (HA) У здоровых субъектов HA имеет прямой поток в диастолу из-за периферического сосудистого русла с низким сопротивлением, а индекс нормального сопротивления (RI) колеблется от 0.От 5 до 0,7. Хотя изменения сопротивления печеночной артерии широко не исследовались, большинство исследований продемонстрировали, что индекс сопротивления артерии увеличивается при циррозе. Этот вывод несколько усложняется наблюдением в некоторых исследованиях, что при возникновении тромбоза воротной вены индекс резистентности может фактически упасть ниже 0,5 [8]. Сами по себе изменения резистентности ГК недостаточно специфичны или чувствительны для диагностики портальной гипертензии. Печеночные вены (HV) Доплеровский сигнал нормальных печеночных вен показывает, что чистый поток направлен к правому предсердию, но скорость и направление потока сильно различаются.Эти изменения являются результатом передаваемых сердечных пульсаций и заброса крови из правого предсердия в вены во время систолы. Помимо изменений тромбоза печеночной вены, которые обсуждаются ниже, при портальной гипертензии могут наблюдаться два основных типа изменения профиля кровотока в печеночной вене, особенно когда это связано с циррозом. Первый — это региональное ускорение кровотока в результате локального сжатия регенеративными узелками. Второй — это ослабление нормальной пульсирующей картины потока, вызванной несоответствием, вызванным фиброзной тканью.В одном исследовании пациентов с циррозом нормальный профиль потока был обнаружен в 50% случаев, ослабленный профиль потока в 30% и полностью сглаженный поток в 20% [9]. Чугунные вены Увеличенные чревные вены (например, верхняя брыжеечная вена (SMV) и селезеночная вена (SV) диаметром более 1 см) указывают на портальную гипертензию. Несколько исследований показали, что диаметры SMV и SV статистически различаются у контрольных субъектов и пациентов с циррозом печени, причем измерения выдоха являются наиболее различающимися.[10] Изначально считалось, что отсутствие вариабельности калибра внутренних сосудов во время дыхания очень чувствительно (80%) и специфично для портальной гипертензии [11], и некоторые исследователи предположили, что увеличение диаметра во время вдоха менее чем или равный 10% является маркером портальной гипертензии. [12] Однако эти результаты не были подтверждены другим исследованием, в котором было обнаружено, что при отсутствии изменения калибра в зависимости от дыхания чувствительность к портальной гипертензии составляет всего 42%.[2] Обратный поток может быть обнаружен в SMV или SV при допплеровской сонографии [Рисунок — 2], однако это относительно редкая находка, наблюдаемая менее чем в 5% случаев портальной гипертензии. Хотя обратный кровоток по внутренним венам не связан с этиологией портальной гипертензии, он чаще встречается у пациентов, классифицируемых как дети B и C, чем у пациентов, классифицируемых как ребенок A [Рисунок — 2]. Спланхнические артерии Несколько исследований показали, что кровоток увеличивается, а индекс сопротивления падает в верхней брыжеечной и селезеночной артериях на фоне портальной гипертензии.После еды ИР внутренних артерий снижается у всех пациентов, но меньше у пациентов с циррозом печени. Однако среди пациентов с портальной гипертензией нет корреляции между величиной постпрандиального снижения RI и тяжестью основного заболевания [13]. Портосистемные коллатеральные сосуды Портосистемные коллатерали образуются, когда сопротивление кровотоку в портальных сосудах превышает сопротивление потоку в небольших коммуникационных каналах между портальной и системной циркуляцией.Встречаются несколько основных участков портосистемных венозных коллатералей, первые три из которых наиболее часто обнаруживаются при ультразвуковом исследовании. Гастроэзофагеальное соединение: Коллатерали в этой области проходят между коронарной и короткой желудочными венами и системными пищеводными венами. Лучше всего их визуализировать ультразвуком через левую долю печени. Эти сосуды имеют особое значение, поскольку они могут привести к опасному для жизни кровотечению из варикозно расширенных вен. Нормальная коронарная вена имеет диаметр до 6 мм и имеет гепатопетальный кровоток, тогда как у пациентов с портальной гипертензией дилатация выше этого размера наблюдается в 26% случаев, а гепатофугальный кровоток — в 78%.[14] Одна из интерпретаций этих результатов заключается в том, что расширение коронарной вены не происходит у большинства пациентов с портальной гипертензией. Параумбиликальная вена: Эта коллатераль берет начало от левой воротной вены и соединяется с верхней и нижней надчревными венами большого круга кровообращения вокруг пупка. Он проходит в реканализированной круглой связке серповидной связки [Рис. 3] в виде трубчатой структуры размером более 3 мм. Медленный поток (до 5 см / сек) в любом направлении может быть обнаружен в круглой связке здоровых людей, но поток не распространяется кпереди от поверхности печени.Гепатофугальный венозный кровоток в круглой связке со скоростью более 5 см / сек или визуализируемый кпереди от поверхности печени является высокоспецифичным (100% в одной серии) для наличия портальной гипертензии [15]. Поскольку коллатерали эпигастральных сосудов проходят глубоко в прямые мышцы, они не проявляются клинически, но легко идентифицируются с помощью цветного допплера. Спленоренальная и гастроренальная: Извилистые сосуды могут быть видны в прикорневой области селезенки и левой почки, представляющие собой коллатерали между селезеночной, коронарной и короткой желудочными венами и системными левыми надпочечниковыми или почечными венами.Их лучше всего визуализировать с помощью увеличенной селезенки в качестве ультразвукового окна. Об их существовании можно судить по асимметричному увеличению левой почечной вены, хотя это также можно увидеть при почечной артериовенозной фистуле и опухолях почек. Кишечник: Эти коллатеральные пути возникают в областях, где желудочно-кишечный тракт является забрюшинным (например, восходящая и нисходящая ободочная кишка и двенадцатиперстная кишка), и они соединяют панкреатодуоденальные, забрюшинные и сальниковые вены с почечными, диафрагмальными и поясничными венами.Легкость, с которой эти сосуды идентифицируются на УЗИ, в значительной степени зависит от количества воздуха в кишечнике во время исследования, а также от размера коллатеральных сосудов. Геморрой: Коллатерали в этой области соединяют нижние брыжеечные вены через верхние ректальные вены со средней и нижней ректальными венами большого круга кровообращения. Обычно обычная трансабдоминальная сонография не может обнаружить варикозные узлы прямой / параректальной области, но их можно увидеть с помощью трансвагинального сканирования. Gallbladder (GB): Эти варикозные узлы иногда наблюдаются при портальной гипертензии и отражают отток крови из кистозной вены к передней брюшной стенке или к прорезанию ветвей ЛВ в печени. На УЗИ они выглядят как кистозные или трубчатые участки в стенке ГБ. Цветной допплер помогает показать кровоток и отличить эти коллатерали от синусов Рокитанского-Ашоффа при гиперпластическом холецистозе. Другие менее распространенные портосистемные пути включают подвздошно-поясничную, гонадную и восходящие загрудинные вены.Стоит отметить, что практически любая вена в брюшной полости может служить потенциальным залогом системного кровообращения. Обнаружение аномальных коллатеральных сосудов, по-видимому, является одним из наиболее чувствительных (70–83%) и специфических ультразвуковых признаков для диагностики портальной гипертензии. [2] Чем тяжелее портальная гипертензия, тем больше портосистемных путей. По-видимому, нет никакой связи между расположением коллатерального пути и причиной портальной гипертензии, за исключением околопупочной вены, которая наблюдается только у пациентов с синусоидальным или постсинусоидальным подтипами портальной гипертензии.[16] На допплеровской сонографии коллатеральные сосуды демонстрируют непрерывный кровоток, аналогичный кровотоку в ЛВ. К сожалению, при ультразвуковой допплерографии коллатерали могут быть пропущены из-за ожирения или наличия газов в кишечнике. Спленомегалия Спленомегалия (> 12 см по самой длинной оси) часто наблюдается при портальной гипертензии. Обычно он бывает легкой или средней степени тяжести и может быть единственным свидетельством повышенного давления в воротной вене. И наоборот, отсутствие спленомегалии не исключает портальную гипертензию.Присутствие в паренхиме селезенки небольших эхогенных параллельных линий (называемых «отражающие каналы»), содержащих кровоток на цветном допплере, было предложено как средство дифференциации спленомегалии, вызванной портальной гипертензией, от спленомегалии, вызванной другими причинами. [17] Считается, что эти структуры отражают расширенные синусоидальные вены, в стенках которых содержится повышенное количество коллагена — процесс, который, как известно, происходит при портальной гипертензии. Это наблюдение имеет чувствительность, специфичность и точность для прогнозирования портальной гипертензии 0.85, 0,77 и 0,80 соответственно. [17] Единственное другое ультразвуковое исследование, которое могло бы предположить, что спленомегалия вызвана портальной гипертензией, — это сидеротические гамма-ганди-тела, которые присутствуют примерно в 13% случаев, а на УЗИ появляются как множественные гиперэхогенные очаги. Асцит Это неспецифическая находка, но часто наблюдается при портальной гипертензии. Установление причины Портальная гипертензия может быть результатом различных поражений гепатобилиарной системы, и их можно разделить на пре-синусоидальные (внепеченочные и внутрипеченочные), синусоидальные и постсинусоидальные подтипы.В Северной Америке и Европе 90% случаев портальной гипертензии вызваны циррозом, тогда как в Азии и Южной Америке гораздо чаще встречаются нецирротический портальный фиброз, гепато-селезеночный шистосомоз и тромбоз внепеченочной воротной вены. Хотя с помощью УЗИ не всегда можно установить точную этиологию портальной гипертензии, можно определить, является ли она предсинусоидальной, синусоидальной или постсинусоидальной. Предсинусоидальный внепеченочный Причины : Тромбоз воротной или селезеночной вены.Этот подтип следует подозревать при наличии вторичных признаков портальной гипертензии (например, спленомегалии, асцита и портосистемных коллатералей), но при ультразвуковом исследовании печень в норме. Тромбоз воротной вены: Это может наблюдаться у детей, вторичных по отношению к катетеризации пупочной вены или сепсису, и у взрослых из-за панкреатита, карциномы поджелудочной железы, травм, сепсиса, гепатоцеллюлярной карциномы, цирроза, портокавальных шунтов и состояний гиперкоагуляции. Это может произойти в любой точке по ходу вены.Сонографические находки тромбоза ЛВ включают эхогенный тромб в просвете вены [Рисунок 4], расширение калибра вены, отсутствие допплеровского сигнала и карвернозное преобразование. Острый тромб может казаться относительно безэховым, и его можно не заметить, если не будет проведен цветной допплеровский опрос. Допплерография также полезна для различения доброкачественных и злокачественных тромбов ЛВ. Оба вида тромбов могут демонстрировать непрерывный кровоток, но пульсирующий кровоток на 95% специфичен для диагностики злокачественного тромба.[18] Чувствительность составляет всего 60%, так как многие злокачественные тромбы гиповаскулярны. Другими признаками, указывающими на злокачественный тромб воротной вены, являются калибр воротной вены больше или равный 23 мм и свидетельство непрерывности тромба с внепросветной массой. [19] Кавернозная трансформация относится к развитию многочисленных червеобразных перипортальных коллатеральных сосудов в воротах печени после хронического тромбоза ЛВ. Для его развития требуется до 12 месяцев, поэтому его более вероятно увидеть при доброкачественных причинах портальной гипертензии.Поскольку причина обычно пресинусоидальная, кровоток в коллатеральных сосудах гепатопетальный, в отличие от гепатофугального кровотока, наблюдаемого при циррозе. Из-за небольшого размера сосуда его редко можно надежно визуализировать только на полутоновом изображении, но цветной допплер показывает сеть многочисленных серпигинозных мелких вен, которые на спектральной допплерографии демонстрируют гепатопетальный портальный поток. Пресинусоидальный внутрипеченочный Причины : Заболевания, поражающие портальные тракты (особенно первичный билиарный цирроз, шистосомоз, малярия, саркоид, врожденный фиброз печени и вторичный гепатотоксины, такие как поливинилхлорид и метотрексин). Первичный или вторичный билиарный цирроз: Первичный билиарный цирроз — это заболевание неизвестной причины, при котором внутрипеченочные желчные протоки постепенно разрушаются. Вторичный билиарный цирроз является следствием хронической обструкции внутрипеченочных желчных протоков. Эти два болезненных процесса чаще всего диагностируются на основании клинических, иммунологических, холангиографических и гистологических данных. Гепатоспленочный шистосомоз: Возникает в результате инфицирования Schistosoma Mansoni и встречается преимущественно в Южной Америке, на Ближнем Востоке и в Африке.Портальная гипертензия наблюдается у 5-10% инфицированных. Взрослые черви S. Mansoni живут в мелких брыжеечных венах и выделяют яйцеклетки, некоторые из которых проходят через воротную вену в печень, где вызывают интенсивную перипортальную гранулематозную и фиброзную реакцию. Этот процесс приводит к окклюзии периферической воротной вены и, в конечном итоге, к пресинусоидальной портальной гипертензии. Спленомегалия наблюдается у всех, утолщение ГБ более чем у 80% и увеличение селезенки и воротной вены более чем у половины пациентов.На УЗИ были предложены различные степени поражения печени. При заболевании 1 степени появляются гиперэхогенные полосы, сопровождающие воротную вену, которые наиболее хорошо видны в области бифуркации воротной вены и шейки ГБ. При 2 степени гиперэхогенные полосы простираются от бифуркации ворот по основным ветвям воротной вены к поверхности печени. 3-я оценка включает в себя все особенности 1-й и 2-й степени. Эта система оценок важна для прогнозирования осложнений. В одном исследовании [20] ни у одного из пациентов с заболеванием 1 степени в анамнезе не было желудочно-кишечного кровотечения, в то время как у значительной части пациентов с заболеванием 2 и 3 степени уже было кровотечение из варикозно расширенных вен пищевода.Schistosoma japonicum также может поражать печень и характеризуется выраженной перипортальной и перикапсулярной кальцификацией, которая вызывается мертвыми яйцами шистосомы. Врожденный фиброз печени: Портальная гипертензия является обычным явлением в этом состоянии, которое вызвано широкими плотными коллагеновыми фиброзными связями, окружающими в остальном нормальные дольки печени и сдавливающими корешки воротной вены. Это может быть связано с болезнью Кароли. Результаты УЗИ включают: атрофия правой доли, а также вторичные признаки портальной гипертензии. Синусоидальный Причины : Паренхиматозное заболевание печени (цирроз любой этиологии является наиболее частой причиной, составляющей более 90% случаев, в западном полушарии, но он также может быть результатом обширных метастазов в печени) . Цирроз: Характеризуется наличием паренхиматозного фиброза и регенерирующих узелков, а при ультразвуковом исследовании печень имеет грубую и неоднородную эхо-картину. Обычно наблюдается повышение эхогенности паренхимы, повышенное затухание звука, извилистость внутрипеченочных сосудов и узловатость поверхности печени.В то время как паренхиматозная неоднородность и укрупнение с изменением затухания звука неспецифичны, нодулярность поверхности является более специфическим сонографическим признаком цирроза. Это легче определить с помощью высокочастотных ультразвуковых датчиков или при наличии асцита. Помимо изменений паренхимы, морфология печени часто изменяется из-за атрофии правой доли (сегменты 5, 6, 7 и 8) и медиального сегмента левой доли (4) с гипертрофией латерального сегмента левой доли. доли (2 и 3) и хвостатой доли (1) [Рисунок — 5].Эти изменения в морфологии могут быть оценены путем вычисления размера правой доли по сравнению с размером хвостатой доли или путем измерения размера сегмента 4. Когда это последнее измерение простирается от левой стенки желчного пузыря до левой воротной вены, где он дает начало ветви сегмента 4, значение менее 30 мм является высокоспецифичным признаком цирроза печени, независимо от причины. [21] Постсинусоидальный Причины : синдром Бадда Киари, печеночная, веноокклюзионная болезнь и сердечная недостаточность Синдром Бадда-Киари Подробнее : Это относительно редкий синдром, характеризующийся венозным оттоком из печени обструкция, которая обычно возникает в результате тромбоза магистральных печеночных вен.Это часто происходит из-за состояний гиперкоагуляции, но также может быть результатом тромбоза опухоли и закупорки мембран. Ультразвук может играть решающую роль в демонстрации как прямых, так и косвенных признаков обструкции венозного оттока из печени. Прямые функции включают в себя; частичная или полная неспособность видеть печеночные вены, увеличение печеночных вен проксимальнее стеноза, внутрипросветная эхогенность, полное эхогенное замещение печеночной вены и утолщение стенок печеночной вены. Прямые признаки дуплексного допплера и цветного или энергетического допплера включают [Рисунок — 6]; отсутствие кровотока в печеночной вене, обратного потока или непрерывного потока (псевдопортальный допплеровский сигнал) перед стенозом.Косвенные признаки включают наличие внутрипеченочных коллатералей, асцита (который присутствует почти всегда) и гепатомегалию с неоднородной паренхимой из-за геморрагического инфаркта. Внутрипеченочные коллатерали представляют собой извилистые сосуды, которые лучше видны при цветном или энергетическом допплере, чем при полутоновом изображении. Они расположены преимущественно в верхних или субкапсулярных частях печени. Эмиссарные вены хвостатой доли впадают непосредственно в НПВ на более низком уровне, чем пораженные печеночные вены, и, следовательно, эта доля либо не поражена, либо увеличена (наблюдается примерно в 50% случаев).Мембранозные ткани могут быть идентифицированы как эхогенные или очаговые облитерации печеночной вены или полых просветов, и они особенно хорошо видны при допплерографии. Веноокклюзионная болезнь печени: Это серьезное раннее осложнение трансплантации костного мозга, интенсивной химиотерапии или лучевой терапии, но также может быть вторичным по отношению к токсичности алкалоидов (например, ямайского кустарного чая). Это результат закупорки множества мелких печеночных венул. Хотя он часто клинически неотличим от синдрома Бадда-Киари, допплерография демонстрирует нормальный калибр, проходимость и фазовый прямой ток в более крупных печеночных венах и НПВ.Поток в ЛВ может быть ненормальным, показывая либо сниженный, либо обратный, либо «туда-сюда» поток, а кровоток в печеночной артерии обычно демонстрирует повышенное сопротивление. Сердечная недостаточность: Это может быть результатом различных сердечных заболеваний, включая констриктивный перикардит, ишемическую болезнь сердца и перикардиальный выпот. Ультразвук может предложить диагноз застойных явлений в печени из-за сердечной недостаточности, демонстрируя выступание печеночных вен и нижней полой вены с отсутствием или уменьшением нормального коллапса НПВ во время вдоха.Также может быть видна гепатомегалия, но паренхима печени имеет нормальную эхо-текстуру. Допплеровские исследования демонстрируют усиление нормальной ретроградной волны кровотока в печеночной вене во время сокращения предсердий, и в запущенных случаях может наблюдаться связанный с ним пульсирующий антеградный и ретроградный кровоток в воротной вене. Ультразвук также может выявить асцит, плохую сократительную способность сердца, перикардиальные и плевральные выпоты. Оценка риска осложнений Двумя наиболее частыми осложнениями портальной гипертензии являются желудочно-кишечное кровотечение и печеночная энцефалопатия. Желудочно-кишечное кровотечение Чем выше индекс застойной болезни, тем выше вероятность первого кровотечения из варикозно расширенных вен. Венозный кровоток в селезенке, превышающий кровоток в воротной вене, может наблюдаться у пациентов с повышенным распространением варикозного расширения вен, которое, как правило, больше. Существует слабая, но положительная корреляция между размером коронарной вены (> 6 мм) и риском последующего кровотечения из варикозно расширенных вен. В одном исследовании сохранение кровотока в гепатопетальной коронарной вене было связано с более низким риском кровотечения из варикозно расширенных вен.[14] Ни у одного из пациентов с портальной гипертензией и гепатопетальным кровотоком в коронарной вене в анамнезе не было кровотечения из варикозно расширенных вен, тогда как у 40% пациентов с гепатофугальным кровотоком было варикозное кровотечение. [14] И наоборот, высокий гепатофугальный кровоток в открытой параумбиликальной вене, превышающий гепатопетальный кровоток в ЛВ, может защитить от варикозного расширения вен пищевода. Обнаружение варикозного расширения вен пара-пищевода увеличивает риск кровотечений из варикозно расширенных вен пищевода в будущем.
Портальная гипертензия — часто встречающееся клиническое состояние с множеством причин и несколькими последствиями.Ультразвук — это точный неинвазивный способ оценки его этиологии, тяжести и осложнений, но для максимальной точности диагностики рекомендуется систематический и тщательный подход, включающий оценку печени, селезенки, портального и печеночного кровообращения. Все радиологи, занимающиеся визуализацией брюшной полости, должны быть знакомы со спектром оттенков серого, цвета и спектрального допплера.
Источник поддержки: Нет, Конфликт интересов Нет
DOI: 10.4103 / 1319-3767.29750 Фигуры [Рисунок — 1], [Рисунок — 2], [Рисунок — 3], [Рисунок — 4], [Рисунок — 5], [Рисунок — 6] |
(PDF) Измененные модели допплеровского кровотока при циррозе, обзор
Измененные модели допплеровского кровотока при циррозе
e-ultrasonography.org Ультрасонография 2015 27 мая [Epub] 9
в данном случае для фульминантной печеночной недостаточности [34 ]. К сожалению,
не было обнаружено прогностической ценности в случае хронического цирроза печени.
Мы знаем, что существует значительная вариабельность выборки RI,
, что может способствовать отсутствию предсказуемости и ассоциации
со степенью цирроза [35]. Оценка RI в случае отторжения трансплантата печени
также имеет плохую прогностическую ценность
ухудшения отторжения по сравнению с улучшением [36].
Повышенная скорость печеночной артерии
У здоровых пациентов печеночная артерия представляет собой системную артерию с низким сопротивлением
с монофазными формами волны низкого сопротивления.Пиковая систолическая скорость
составляет около 100 см / сек. Хотя это не совсем надежный результат
, в случае портальной гипертензии или тромбоза воротной вены,
оба из них уменьшают кровоток в воротной вене в печени,
скорость и скорость артериального потока могут увеличиваться в качестве компенсации
(рис. 17) [3]. У пациентов с тромбозом воротной вены у
показано снижение показателей резистентности печеночных артерий, в
в некоторых случаях менее 0.50. Снижение скорости кровотока
в воротной вене с последующим увеличением артериального кровотока и скорости в печени вызывает снижение сосудистого индекса печени на
, который, как было показано, имеет
высокую чувствительность и специфичность в диагностике цирроза и
портальная гипертензия [37].
Сводка
Знание моделей сосудистого кровотока у пациентов с циррозом дает
бесценную информацию для пациентов с циррозом и портальной гипертензией
.
Аберрантный паттерн портального венозного кровотока имеет наибольшее влияние и ассоциативное значение с циррозом, учитывая, что
большая часть кровоснабжения поступает из портальной системы. Печеночный артериальный кровоток
и портальный венозный поток показывают корреляцию в
, несмотря на то, что они регулируются независимо. Поток
изменения паттернов на стороне портала, похоже, не развиваются в
в хронологическом порядке. Тем не менее, у пациента с циррозом печени, проходящего стандартное наблюдение за визуализацией
, радиолог находится в идеальном положении для
изменений паттернов, которые могут показать гемодинамические изменения,
, указывающие на ухудшение или улучшение функции печени.
ORCID: Pooya Iranpour: http://orcid.org/0000-0002-4436-6974; Рузбех Хушьяр:
http://orcid.org/0000-0003-4263-5533; Джун-Иль Чой: http://orcid.org/0000-0003-
0018-8712
Конфликт интересов
О потенциальных конфликтах интересов, относящихся к этой статье, не сообщалось.
Ссылки
1. Цочацис Э.А., Бош Дж., Берроуз А.К. Цирроз печени. Ланцет
2014; 383: 1749-1761.
2. Челепи Х., Раллс П.В., Радин Р., Грант Э.Сонография диффузной болезни печени
. J Ultrasound Med 2002; 21: 1023-1032.
3. Макнотон Д.А., Абу-Юсеф М.М. Допплеровское УЗИ печени
простое. Радиография 2011; 31: 161-188.
4. Абу-Юсеф М.М., Милам С.Г., Фарнер Р.М. Пульсирующий кровоток в воротной вене:
признак трикуспидальной регургитации при дуплексной допплерографии. AJR
Am J Roentgenol 1990; 155: 785-788.
5. Мори К., Йошиока Х., Итаи Й., Окамото Й., Мори Х., Такахаши Н. и др.
и др.Артериопортальные шунты у пациентов с циррозом: оценка разницы
между опухолевыми и неопухолевыми артериопортальными шунтами
на МРТ с суперпарамагнитным оксидом железа. AJR Am
Дж. Рентгенол 2000; 175: 1659-1664.
6. Бхаргава П., Вайдья С., Колокитас О., Кац Д.С., Диге М. Рис.
обзор: сосудистые шунты печени: эмбриология и визуализация
появления. Бр. Дж. Радиол 2011; 84: 1142-1152.
7. Ан-Накшабанди NA.Роль УЗИ при портальной
гипертонии. Сауди Дж. Гастроэнтерол 2006; 12: 111-117.
8. Берзиготти А., Сейджо С., Ревертер Э., Бош Дж. Портал оценки
гипертония при заболеваниях печени. Эксперт Рев Гастроэнтерол Гепатол
2013; 7: 141-155.
9. Пак М.И., Юнг С.Е., Бён Дж.Й., Ким Дж.Х., Джу Г.Э. Влияние угла потока
пучка на измерения скорости в современных ультразвуковых системах Доплера
. AJR Am J Roentgenol 2012; 198: 1139-1143.
10. Тола М., Юрдакуль М. Влияние доплеровского угла в диагностике стеноза внутренней сонной артерии
. J Ultrasound Med 2006; 25: 1187-1192.
11. Bathurst JC, Thorne CR, Hey RD. Вторичный поток и напряжение сдвига на
поворотах реки. J. Hydraul Div 1979; 105: 1277-1295.
12. Gijsen FJ, van de Vosse FN, Janssen JD. Влияние ньютоновских свойств крови, отличных от
, на поток в крупных артериях: постоянный поток
в модели бифуркации сонной артерии.Дж. Биомех 1999; 32: 601-608.
13. Morbiducci U, Ponzini R, Rizzo G, Cadioli M, Esposito A,
Montevecchi FM, et al. Механистическое понимание физиологической значимости
спирального кровотока в аорте человека: исследование in vivo.
Модель биомеха, механобиол 2011; 10: 339-355.
14. Галло Д., Стейнман Д.А., Биджари П.Б., Морбидуччи У. Спиральный поток в бифуркации сонной артерии
как суррогатный маркер воздействия нарушенного сдвига
.Дж. Биомех 2012; 45: 2398-2404.
15. Morbiducci U, Ponzini R, Grigioni M, Redaelli A. Helical flow as uid
динамическая сигнатура риска атерогенеза при аортокоронарном шунтировании: численное исследование
. Дж. Биомех 2007; 40: 519-534.
16. White SS, Zarins CK, Giddens DP, Bassiouny H, Loth F, Jones SA, et
al. Гемодинамические паттерны в двух моделях сосудистых анастомозов конец в бок
: эффекты пульсации, деления потока, числа Рейнольдса
и длины капюшона.J Biomech Eng 1993; 115: 104-111.
17. Розенталь С.Дж., Харрисон Л.А., Бакстер К.Г., Ветцель Л.Х., Кокс Г.Г., Батницкий
Печеночный портальный венозный газ: сравнение двух случаев
Контекст. Газ в воротной вене печени (HPVG) — редкая и зловещая находка. Его смертность связана с основным причинным заболеванием. При вторичной ишемии кишечника смертность превышает 50%. Отчет о болезни . Описаны два случая HPVG. В одном случае описан ВПЧ в сочетании с ишемией желудка с полным разрешением после консервативного лечения.Второй случай описывает ВПЧ в сочетании с широко распространенной внутрибрюшной ишемией, что приводит к летальному исходу. Заключение. Некоторым пациентам предлагается лечение HPVG, связанного с ишемией желудка, с низким порогом хирургического вмешательства. HPVG, связанный с ишемией кишечника, является абсолютным показанием к хирургическому вмешательству, при котором вмешательство может изменить клиническое течение.
1. Введение
Газ в воротной вене печени — редкая и зловещая находка.Это связано с многочисленными основными патологиями брюшной полости, начиная от доброкачественных состояний, не требующих инвазивного лечения, до потенциально смертельных заболеваний, требующих незамедлительного хирургического вмешательства. При вторичной ишемии кишечника смертность превышает 50% [1]. Мы описываем два случая HPVG, связанных с внутрибрюшной ишемией.
2. Случай 1
81-летний мужчина индийского происхождения поступил в наше отделение неотложной помощи с сильной болью в животе. Боль была локализована в правом подреберье и эпигастрии, отдалась в спину, возникла внезапно и усилилась за предыдущие 12 часов.Его предыдущая история болезни включала стенокардию, гипертонию, сахарный диабет II типа, глаукому (зарегистрированную слепую) и периодические постпрандиальные боли в животе, от которых он принимал глазные капли телмисартана, бендрофлуметиазида и латанопроста. Пациент отрицал употребление алкоголя и курение. У него была лихорадка (38,3 ° C), тахикардия и тахипноэ с другими наблюдениями в пределах нормы. При осмотре у него была генерализованная боль в животе с сильной болезненностью в эпигастральной и правом подреберье.Признаков перитонизма не было, кишечные шумы в норме.
Было проведено полное серологическое исследование, которое выявило нарушение профиля печени (билирубин 31 мкмоль / л, аланинтрансаминаза 519 МЕ / л и гамма-глутамилтрансфераза 565 МЕ / л), нарушение почечного профиля (мочевина 9,5 ммоль / л, креатинин 171 мкмоль / л). L), повышенный уровень амилазы до 2197 МЕ / л и метаболический ацидоз; маркеры воспаления были слегка повышены, а другие параметры были без особенностей.
Рентгенография грудной клетки и брюшной полости без патологии.При признаках острого живота и диагностических сомнениях была проведена компьютерная томография (КТ). Из-за повышенного креатинина у пациента была проведена неконтрастная компьютерная томография. КТ выявила обширный газ в воротной вене печени. Были отмечены разветвленные структуры, заполненные воздухом внутри печени, простирающиеся к периферии, представляющие корешки воротной вены (рис. 1). Кроме того, газ был обнаружен в нескольких верхних брюшных брыжеечных венах и в задней стенке желудка, что указывает на ишемию желудка (рис. 2).Кальцинированная бляшка была отмечена в начале чревной оси, что считается причинным фактором повторяющейся постпрандиальной боли в животе пациента и текущей клинической картины (рис. 3).
После обсуждения с региональным отделением верхних отделов желудочно-кишечного тракта из-за обширных сопутствующих заболеваний пациент был признан непригодным для операции. Пациент лечился консервативно, начав лечение антибиотиками (пиперациллин с тазобактамом) и ингибитором протонной помпы (пантопразол внутривенно).Через три дня после начала лечения было отмечено клиническое улучшение, и была проведена повторная компьютерная томография брюшной полости. КТ показала значительное улучшение интервалов — внутрибрюшного газа не было (рис. 4).
Пациент прошел двухнедельный курс пиперациллина с тазобактамом. По-прежнему бессимптомно, биохимические показатели улучшились, выписан с амбулаторным наблюдением. Эндоскопия была проведена через пять недель и не показала никаких отклонений. Пациент находился под наблюдением в клинике более года, не протекая бессимптомно.
3. Случай 2
74-летняя женщина европеоидной расы поступила в наше отделение неотложной помощи с болью в животе, кровотечением из прямой кишки, диареей и рвотой. Она сообщила о трехдневной истории генерализованной боли в животе, рвоте и диарее. Утром во время презентации она заметила ярко-красное PR-кровотечение, смешанное со стулом. Она не сообщила ни о лихорадке, ни о недавних поездках. Ее предыдущая история болезни включала недостаточность поджелудочной железы, дивертикулярную болезнь, рецидивирующий ишиоректальный абсцесс, предыдущий псевдомонадный колит, перенесенную язвенную болезнь, перенесенный инфаркт миокарда, гипертензию, гиперхолестеринемию, заболевание периферических сосудов, псевдоаневризму правой бедренной кости, аортобифеморальное легочное заболевание и хроническую обструктивную болезнь.Ее лекарства включали панкрелипазу, клопидогрель, бисопролол, изосорбид мононитрат, омепразол, рамиприл и симвастатин. Пациент признался, что выкуривает 15 сигарет в день и отрицает употребление алкоголя. У нее были лихорадка, тахикардия и тахипноэ с другими наблюдениями в пределах нормы. При осмотре у нее была общая болезненность живота. Пульсирующая масса ощущалась в правом паху. Признаков перитонизма не было, кишечные шумы в норме.
Было проведено полное серологическое исследование, которое выявило нарушение почечного профиля (мочевина 33.4 ммоль / л, креатинин 225 мкмоль / л, калий 3,2 ммоль / л), нарушение профиля печени (аланинаминотрансфераза 117 МЕ / л), повышенные маркеры воспаления (лейкоциты 33,4 × 10 9 / л, С-реактивный белок 131 мг / л) и метаболический ацидоз; остальные параметры ничем не примечательны. Культуры стула вернулись без роста и были отрицательными на токсин Clostridium difficile, яйцеклетки, цисты и паразитов.
Рентгенография грудной клетки и брюшной полости без патологии. КТ выявила старую псевдоаневризму правого паха с аортобифеморальным трансплантатом, причины боли в животе и диареи у пациента не выявлены.
Пациенту был проведен короткий курс противомикробных препаратов цефуроксим и метронидазол, а также регулярное внутривенное введение жидкости с замещением калия. Она начала улучшаться как клинически, так и биохимически.
Во время лечения у пациента возник приступ боли в груди. ЭКГ и сердечные ферменты подтвердили ИМ без подъема сегмента ST с новым началом фибрилляции предсердий. Пациент проходил лечение в соответствии со стандартизированным протоколом лечения, и после прекращения сепсиса была назначена ангиограмма.
После этого случая пациентка обратилась с жалобами на боль в правом подреберье. Серологические тесты выявили резкое увеличение маркеров воспаления (лейкоцитов 34,2 × 10 9 / л, 11,8 × 10 9 / л накануне) с заметно нарушенным профилем печени (щелочная фосфатаза 604 МЕ / л, аланинаминотрансфераза 113 МЕ / л). Проведено УЗИ брюшной полости. Визуализирована печень нормальных размеров, эхогенности и контура. Допплерография показала нормальный кровоток в воротной вене. Был отмечен аденомиоматоз желчного пузыря, УЗИ брюшной полости в остальном не отличался.Рентген грудной клетки, посев крови, посев мочи и посев кала в это время не выявили патологии. Несмотря на то, что рвота была устранена, во время госпитализации у пациента продолжалась периодическая диарея. Пациенту было начато лечение антимикробным пиперациллином с тазобактамом по поводу сепсиса неизвестного происхождения. Повторный рентген грудной клетки через несколько дней подтвердил пневмонию правой нижней доли. Повторные посевы крови дали положительный результат на Citrobacter koseri, чувствительный к действующим противомикробным препаратам.Боль в животе улеглась. Однако маркеры воспаления показали минимальное улучшение текущего режима антимикробного лечения.
Выполнена КТ органов грудной клетки, живота и таза. КТ подтвердила обширную пневмонию правой нижней доли. КТ также показала новую дилатацию внутрипеченочных желчных протоков. Обструктивных поражений или камней не наблюдалось. Пациенту было назначено MRCP. Антимикробный режим был продолжен, и серологические тесты показали постепенное улучшение маркеров воспаления.
После этого у пациента начались сильные боли в животе. Боль возникла внезапно, была максимальной в эпигастральной области и с самого начала усилилась. Это было связано с рвотой, и сообщалось о свежем кровотечении PR объемом 200 мл. При осмотре обнаружена общая болезненность живота с локализованной болезненностью в эпигастральной области. Живот был жестким с защитной и отскакивающей нежностью. Звуков кишечника не слышно. Наблюдения выявили тахикардию.Артериальное давление, сатурация кислорода, частота дыхания и температура были в пределах нормы. Отмечена олигурия. Анализ газов артериальной крови показал падение гемоглобина на 1,4 г / дл с момента предыдущего серологического исследования этим утром и компенсированный метаболический ацидоз, лактат 7,1 ммоль / л. Был поставлен дифференциальный диагноз ишемической кишки или перфорации кишечника. Начато переливание крови, добавлены противомикробные препараты тейкопланин и гентамицин, внутривенно введены витамин К и пантопразол внутривенно.
Последующая экстренная компьютерная томография брюшной полости с контрастированием выявила признаки широко распространенной ишемии кишечника. Газ был обнаружен в воротной вене с обширным газом в печени, в стенке желудка и его дренажных венах, желчном пузыре, общем желчном протоке и в большинстве стенок тонкой кишки (рис. 5). Верхняя брыжеечная артерия не усилилась после контрастирования. Глютеновая ось была сильно кальцинирована на всем протяжении с минимальным усилением контраста (Рисунок 6).
В связи со степенью широко распространенной ишемии хирургическое вмешательство не проводилось и продолжалось консервативное лечение. Пациент скончался через 36 часов.
4. Обсуждение
Газ в воротной вене печени (HPVG) — редкий и зловещий радиологический признак. Впервые он был описан Вулфом и Эвансом в 1955 г. у младенцев с некротическим энтероколитом [2]. Последующий обзор случаев у взрослых в 1978 г. показал, что сопутствующая смертность составляет 75% [3]. С появлением компьютерной томографии было выявлено больше случаев HPVG.Тем не менее, это все еще редкая находка: к 2001 г. в литературе было зарегистрировано только 182 случая [4]. Расширенная визуализация выявила меньшие объемы HPVG, не обнаруживаемые на рентгеновском снимке, что позволяет раннее вмешательство и случайное обнаружение HPVG в доброкачественных состояниях. Таким образом, обзор 2001 г. показал снижение общей смертности на 39% [4]. Когда HPVG сопровождается ишемией тонкой кишки, смертность остается высокой и превышает 50% [1].
Точная патофизиология HPVG неясна, и было выдвинуто несколько гипотез.Предполагаемые факторы — это утечка выделяемого микробами газа из просвета кишечника или в абсцесс, который затем циркулирует в печень, и присутствие газообразующих организмов в портальной системе [3]. Нет четких данных, чтобы описать, как образование газа, вторичное по отношению к микробному метаболизму, приводит к HPVG [5]. Другая ведущая гипотеза — абсорбированный внутрипросветный воздух. Нарушение эпителиального барьера из-за ишемии кишечника или повышенное внутрипросветное давление может привести к попаданию просветного воздуха в капиллярные вены [1].
Диагноз HPVG может быть поставлен с помощью простого рентгеновского снимка брюшной полости, ультразвука с допплеровской визуализацией или компьютерной томографии. Рентген брюшной полости позволяет обнаружить только значительные объемы HPVG — если они есть, смертность превышает 50% [1]. Ультразвук с допплером является экономически эффективным, неинвазивным и высокочувствительным, и его можно использовать в качестве первой линии исследования [6, 7]. Ультразвук зависит от оператора и поэтому дает разные результаты, что ограничивает его использование. КТ обеспечивает высокую чувствительность к ВПЧ и позволяет выявить основную патологию [8, 9].Прогноз HPVG связан с самой патологией и не зависит от наличия HPVG [8].
HPVG связан с многочисленными основными патологиями брюшной полости, от доброкачественных состояний, не требующих инвазивного лечения, до потенциально летальных заболеваний, требующих немедленного хирургического вмешательства [4, 10–12]. Ишемия и / или инфаркт кишечника по-прежнему являются наиболее частой первопричиной и наиболее важным диагнозом, который следует исключить из-за связанной с этим высокой смертности, частота которой достигает 75–90% [3, 13].Трансмуральный некроз присутствует в 91% случаев [13]. В нашем втором случае клинические данные, предполагающие ишемию кишечника, сопровождались результатами КТ HPVG и пневматозом кишечника. В случаях с такими находками прогноз неблагоприятный [14–18]. Таким образом, HPVG, связанный с ишемией кишечника, является абсолютным показанием для хирургического вмешательства с кишечной резекцией некротизированного кишечника. В нашем втором случае ишемия кишечника была настолько обширной, что хирургическое вмешательство не изменило клинического течения.
Первый случай, который мы представили, — это пациент с HPVG из-за ишемии желудка.Ранее пациентам с острой ишемией желудка рекомендовалось выполнять частичную или полную резекцию желудка [19]. В нашем случае консервативное лечение привело к полному исчезновению симптомов и патологии с продолжением разрешения через 1 год наблюдения. Наш пациент описал в анамнезе повторяющуюся постпрандиальную боль в животе, вероятное проявление хронической ишемии желудка, вторичной по отношению к стенозу его чревной оси. Хроническая природа ишемии желудка, возможно, позволила улучшить коллатеральное кровообращение.Желудок имеет богатое кровоснабжение, состоящее из пяти основных сосудов, второстепенных сосудов и коллатерального кровоснабжения. Ранее на животных моделях было продемонстрировано, что некроз желудка потребует перевязки левой и правой желудочных артерий, левой и правой желудочно-сальниковых артерий и более 80% коллатералей [20]. Исследования на трупах показали, что для полного наполнения сосудов стенки желудка требуется только один большой открытый сосуд [21]. Предыдущие авторы аналогичным образом сообщали о полном исчезновении ишемии желудка у пациента после консервативного лечения [22].Это предполагает, что у пациентов с ишемией желудка, у которых нет признаков перитонизма или гемодинамических нарушений, может применяться подход «наблюдай и жди». При отсутствии улучшения или клинического ухудшения следует выбрать низкий порог хирургического вмешательства.
В заключение, мы сообщили о двух случаях HPVG. Один случай был связан только с ишемией желудка и показал полную обратимость при консервативном лечении. Второй случай был связан с широко распространенной внутрибрюшной ишемией, что привело к летальному исходу.Первый случай предполагает возможность «слежения и ожидания» лечения HPVG, связанного с ишемией желудка, у некоторых пациентов; второй случай подчеркивает высокий уровень смертности от ВПЧ, связанный с ишемией кишечника, и необходимость хирургического вмешательства, при котором вмешательство может изменить клиническое течение.
Ультразвуковая допплерография при циррозе печени: корреляция измерений печеночной артерии и воротной вены с моделью оценки терминальной стадии болезни печени в Египте | Египетский журнал радиологии и ядерной медицины
Цирроз печени — хорошо известное клиническое заболевание, которое имеет всемирное распространение без заметных различий по полу и расе, хотя и имеет несколько этиологий; это может иметь такие же долгосрочные последствия и осложнения, как портальная гипертензия и декомпенсация функции печени.Было решено, что золотым стандартом для оценки степени цирроза является гистологический анализ, полученный при биопсии печени; однако это не должно быть стандартным лечением для всех пациентов с циррозом, поскольку это инвазивная процедура, особенно у пациентов с тенденцией к геморрагии [10].
Поскольку цирроз печени продолжается, он может изменять параметры сосудов печени; таким образом, допплеровское ультразвуковое сканирование является приоритетным направлением для многих исследователей как альтернативное исследование, которое могло бы заменить такие инвазивные процедуры [10].
Как мы уже упоминали, система оценок MELD превзошла систему CTP у пациентов с хроническим заболеванием печени, особенно у тех, кто является кандидатом на трансплантацию печени, поскольку она больше основана на объективных лабораторных биомаркерах, чем система CTP; кроме того, оценка MELD не учитывает демографические факторы, такие как возраст и раса, в списке трансплантации печени; таким образом, она считалась более благоприятной системой оценки, чем CTP [1, 3, 10].
При обзоре литературы основная цель этого исследования состояла в том, чтобы оценить, существует ли корреляция между параметрами печеночного допплера, а также результатами ультразвукового исследования декомпенсации печени с клиническим статусом у пациентов с циррозом, измеренным по шкале MELD.
В свете наших результатов мы обнаружили статистически значимую корреляцию между скоростью печеночной артерии (HAV) и оценкой MELD (таблицы 1 и 2) (рис. 1a, 3 и 4), при этом 70% наших случаев показали повышенный HAV.
Рис. 3изображений США ( a — f ). a , b Изображения в градациях серого, показывающие цирротическую печень с неровной поверхностью и перипортальный фиброз (желтые стрелки). c Изображение в оттенках серого, показывающее спленомегалию (длина = 22 см). d Цветное допплеровское изображение, показывающее группу желудочно-пищеводных портосистемных коллатералей (желтые стрелки). e Спектральное доплеровское изображение, отслеживающее PVV, которое составляло 13,9 см / с (уменьшенное) [нормальное значение = 20-40 см / с]. f Спектральное доплеровское изображение, отслеживающее ВГА и HARI, где ВГА повышено = 80,9 см / с [Нормальный = 30–60 см / с], оно также показывает аномально высокий HARI = 0,73 [Нормальный = 0,60–0,68]
Рис.4изображений США ( a — f ). a — c Изображения в оттенках серого, демонстрирующие цирротическую спленомегалию печени ( a ) ( b ) (длина = 22 см) с множеством эхогенных незатененных очагов, представляющих узелки гамма-Ганди (желтая стрелка) ( связь с давней портальной гипертензией). c Отмечено небольшое количество свободного асцита (желтая стрелка). d Цветные доплеровские изображения и изображения в градациях серого, показывающие реканализированную парапупочную вену (желтые стрелки). e Спектральное допплеровское изображение, отслеживающее главную воротную вену в воротах печени, показывающее обратный гепатофугальный (от печени) поток. f Спектральное доплеровское изображение, отслеживающее HAV и HARI, где HAV повышен = 68,7 см / с, а HARI был нормальным = 0,66
Это согласуется с Park et al. исследования, в которых участвовало 264 пациента с циррозом печени и коррелировали параметры Доплера с маркерами печеночной декомпенсации и сообщали о статистически значимой корреляции между баллами HAV и MELD (ρ = 0.0001) [11, 12]; Glisic et al. имели также согласующиеся поддерживающие результаты, но с относительно меньшим размером выборки (80 пациентов и 20 контрольных), и они сообщили об увеличении ВГА у пациентов с циррозом в среднем (125,7 см / с) по сравнению с их здоровой контрольной группой (79,3 см). / с) [13]; наши результаты совпали с их результатами, где точка отсечения составляла 145 см / с (таблица 5 и рис. 2c, d).
Основанное на литературе обоснование таких результатов, в которых повышенное сопротивление синусоидального синусоида печени, в свою очередь, уменьшило бы приток воротной вены; следовательно, он активирует буферный ответ печеночной артерии (HABR; опосредован вымыванием аденозина и системой ангиотензина II) и увеличивает приток печеночной артерии в качестве компенсаторного механизма для поддержания постоянного кислорода в паренхиме печени; тем не менее, некоторые исследования документально подтвердили, что HABR сохраняется при циррозе [14, 15].
Разногласия с Азизой и др. В этом отношении присутствовало исследование, в котором участвовало 56 подходящих пациентов с циррозом и изучалась корреляция гемодинамики печени с показателем CTP, и было обнаружено, что HAV не имел значительных различий между исследуемой и контрольной группами (р = 0,06). Возможная причина противоречивых данных заключалась в том, что для сканирования контрольной и исследуемой групп использовались две разные системы США. Предварительная проверка не проводилась путем сканирования одних и тех же пациентов с использованием этих двух ультразвуковых сканеров для поиска каких-либо существенных различий в измерении изучаемых параметров.Кроме того, они использовали показатель CTP для классификации популяции пациентов, оценки их прогноза и прогнозирования их смертности. Важным недостатком шкалы CTP является то, что при ее расчете используются 2 очень субъективные переменные, а именно портосистемная энцефалопатия и тяжесть асцита. Опять же, расчет MELD основан на более объективных параметрах [16].
Скорость портального кровотока также была изученным параметром, хотя 59% наших пациентов показали значительно снижение скорости портального кровотока (<20 см / с) (среднее ± стандартное отклонение, 19.68 ± 6.49) (таблицы 1 и 2) (рис. 1б, 3, 4). Мы обнаружили, что PVV существенно не коррелировал с оценкой MELD; это согласуется со многими литературными произведениями [16,17,18,19], в которых задокументирована та же проблема; однако это противоречило Berzigotti et al. исследование, в котором сообщалось о низкой скорости потока <20 см / с в дополнение к увеличению калибра главной воротной вены (MPV), считалось диагностическим признаком портальной гипертензии [20]. Однако мы не измеряли диаметр воротной вены, и возможной причиной противоречивых данных в PVV была неоднородность пациентов с циррозом, включенных в различные исследования, а также тип гемодинамических нарушений, например, наличие гиперкинетического синдрома или портосистемные коллатерали.
Индекс сопротивления печеночной артерии (HARI) был дополнительно исследован в нашем настоящем исследовании. Мы обнаружили, что HARI не имеет достоверной корреляции с оценкой MELD, спленомегалией или асцитом (таблицы 2, 3 и 4) (рис. 1c).
Это соответствует исследованию, проведенному Iranpour et al. , , которые наблюдали специфичность и чувствительность использования порогового значения индекса резистентности печеночной артерии (ИР)> 0,77 для прогнозирования цирроза, были всего лишь 70% и 68% соответственно [15], были предоставлены дополнительные подтверждающие результаты. по другим исследованиям [7, 11, 13] .
Это противоречило Азизе и др. исследование, в котором они обнаружили, что увеличение HARI при циррозе печени было статистически значимым и помогло дифференцировать участников с циррозом (где значения HARI были выше 0,7) от участников без цирроза (значения HARI были меньше или равны 0,7). Возможное объяснение противоречивых данных заключается в том, что RI печеночной артерии может быть изменен определенными физиологическими факторами и может быть повышен вскоре после приема пищи, когда поток в воротной вене увеличивается, а затем соответствующее уменьшение артериального потока вызвано сужением сосудов.Тем не менее, состояние вазоконстрикции может привести к временному повышению RI, которое может длиться до нескольких часов [21, 22]; вот почему HARI должен быть тщательно получен с особым учетом физиологических вариаций. В нашем исследовании мы проинструктировали всех пациентов о 6-часовом голодании, чтобы избежать этой диагностической ошибки, и мы не обнаружили значимой корреляции.
При циррозе такие признаки, как спленомегалия и асцит, могут указывать на состояние декомпенсации печени, мы изобразили статистически значимую корреляцию между наличием спленомегалии, оценкой MELD и HAV; однако этой значимой корреляции не существовало ни с PVV, ни с HARI (таблица 3) (рис.2а, 3, 4). В этом отношении у нас было согласие со многими исследованиями [11, 23,24,25], но, с другой стороны, это противоречило Yadav et al. исследование [26], которое не обнаружило (из 112 пациентов) значимой корреляции между оценкой MELD и размером селезенки при циррозе печени.
Kashani et al. объяснили это несоответствие, когда размер селезенки может варьироваться между пациентами с циррозом в соответствии с их первичной этиологией заболевания, при этом пациенты, инфицированные вирусом гепатита С (ВГС), и пациенты с неалкогольным гепатитом имели значительно большие размеры органов по сравнению с пациентами с алкогольным гепатитом [27], почти все наши пациенты относятся к категории постинфекционного (гепатитного) цирроза, где спленомегалия, соответственно, была гармоничным признаком.Стоит отметить, что некоторые авторы предположили, что спленомегалия связана с плохим прогнозом у пациентов с циррозом и может использоваться в качестве индекса для неинвазивной оценки варикозного расширения вен пищевода и риска кровотечений во время радиоактивных или акустических исследований [28, 29].
Асцит является еще одним важным осложнением цирроза печени и обычно связан с плохим прогнозом (моральные нормы в течение 1 и 5 лет составляют 15% и 44% соответственно) при последующем наблюдении [30].
Настоящее исследование показало статистически значимую корреляцию между наличием асцита и оценкой MELD, а также HAV.Но с другой стороны, корреляция как с PVV, так и с HARI (таблицы 2 и 4) (рис. 2b и 4) была статистически незначимой; это соответствовало мнению Азиза и др., Парка и др. и Сомсука и др. исследования [11, 16, 30].
Тем не менее, Попов и др. оценили и сравнили изменения параметров печеночного и почечного допплера у пациентов с циррозом и не обнаружили существенных различий между параметрами печеночного допплера и наличием или отсутствием асцита [31]. Наше объяснение этого несоответствия было связано с различными стадиями цирроза печени у их пациентов, у которых могло быть предыдущее тейпирование или которые получали лечение от асцита.Но большинство наших пациентов-аскетов имели декомпенсированную терминальную стадию заболевания печени и не сообщали в анамнезе о предыдущем хирургическом вмешательстве или трансъюгулярном внутрипеченочном портосистемном шунте (TIPS) для лечения асцита.
Несмотря на то, что мы предоставили потенциально полезные данные, у нас были некоторые ограничения в этой работе, включая следующие:
Во-первых, в этом исследовании мы не коррелировали степень цирроза и не подтверждали его наличие на гистологической основе. Хотя мы согласны с тем, что гистология считается эталоном, это не было стандартным протоколом для проведения биопсии печени у всех пациентов с циррозом.Во-вторых, мы не включили нормальный контроль в наше исследование, так как считаем, что оценка MELD использовалась только для пациентов с циррозом печени и не подтверждена для использования у здоровых людей. Более того, нормальные люди не проходят регулярную проверку лабораторных тестов на MELD, чтобы обеспечить справедливое сравнение. В-третьих, наша выборка для исследования была из одного центра. Наконец, продолжительность исследования была относительно короткой (около 12 месяцев) с относительно небольшим размером выборки набранных пациентов; поэтому статистический анализ может быть не таким надежным.
Портальная эхокардиография и УЗИ гипертонии
Главный редактор: C. Майкл Гибсон, M.S., M.D. [1]; Заместитель главного редактора (ов): Эйман Гаффарпасанд, доктор медицины [2]
Обзор
Эхо-допплерография может быть полезна в диагностике портальной гипертензии. Результаты эхо-допплера, указывающие на портальную гипертензию, включают отсутствие увеличения диаметра воротной вены в ответ на прием пищи, увеличение скорости кровотока в воротной вене и уменьшение площади поперечного сечения воротной вены.Цветное допплеровское ультразвуковое исследование может помочь в диагностике портальной гипертензии. Результаты ультразвукового исследования с цветным допплером, указывающие на портальную гипертензию, включают увеличение диаметра левой желудочной вены, увеличение диаметра воротной вены и увеличение скорости кровотока в левой желудочной вене. Двухфазный и обратный кровоток в воротной вене наряду с повторной канализацией пупочной вены являются патогномоничными для портальной гипертензии.
Эхокардиография / УЗИ
|
Эхо-допплер
- Эхо-допплерография может помочь в диагностике портальной гипертензии.Результаты эхо-допплера, указывающие на портальную гипертензию, включают: [1]
Цветной допплеровский УЗИ
| Цветное допплеровское ультразвуковое исследование воротной вены — случай любезно предоставлен доктором Мауликом С. Пателем, через radiopaedia.org [2] |
УЗИ
| Ультразвуковое исследование асцита — случай любезно предоставлен доктором Маулик С. Патель, через radiopaedia.org [2] | Ультразвуковое исследование спленомегалии — случай любезно предоставлен доктором Яном Биклом с помощью рентгенопедии.org [2] |
Список литературы
- ↑ Sabbà C, Ferraioli G, Buonamico P, Berardi E, Antonica G, Taylor KJ, Albano O (1992). «Эхо-допплеровская оценка острых изменений кровотока у пациентов с портальной гипертензией: скорость кровотока как надежный параметр». Дж. Гепатол . 15 (3): 356–60. PMID 1447502.
- ↑ 2,0 2,1 2,2 Radiopaedia.org. Из дела <"https: // Radiopaedia.org / cases / 29199 "> rID: 29199
- ↑ Инь XY, Лу, доктор медицины, Хуан Дж. Ф., Се XY, Лян Л. Дж. (2001). «Цветовая доплеровская оценка профиля скорости портальной гемодинамики у пациентов с циррозом и портальной гипертензией: корреляция с кровотечением из варикозно расширенных вен пищевода». J Clin Ультразвук . 29 (1): 7–13. PMID 11180179.
- ↑ 4,0 4,1 «Портальная гипертензия | Справочная статья по радиологии | Radiopaedia.org».
- ↑ Ли Ф.Х., Хао Дж., Ся Дж. Г., Ли Х.Л., Фанг Х. (2005).«Гемодинамический анализ варикозно расширенных вен пищевода у пациентов с циррозом печени с использованием цветного допплеровского ультразвука». Мир Дж. Гастроэнтерол . 11 (29): 4560–5. PMC 4398708. PMID 16052688.
Шаблон: WH Шаблон: WS]]
Визуализация врожденных портосистемных шунтов • MSPCA-Angell
Стивен Цай, DVM, DACVR
angell.org/diagnosticimaging
617-541-5139
диагностическая визуализация @ angell.org
Нормальная портальная сосудистая система транспортирует венозную кровь из желудка, кишечника, селезенки и поджелудочной железы в синусоиды печени и, в конечном итоге, в печеночные вены и каудальную полую вену. Портосистемное шунтирование (PSS) происходит, когда между воротной и системной венозными системами возникают аномальные сосудистые связи в обход печени. 1 Это может быть приобретено вторично по отношению к портальной гипертензии, возникшей в результате хронической гепатопатии (например, цирроза), или врождено из-за наличия шунтирующих сосудов плода.Визуализирующая диагностика врожденных шунтов важна, поскольку хирургическое ослабление является методом выбора у пациентов с клиническими проявлениями. 2
Портосистемные шунты могут возникать в печени или за ее пределами. Внутрипеченочный PSS чаще встречается у собак крупных пород, в то время как внепеченочный PSS чаще встречается у собак мелких или игрушечных пород. В частности, йоркширские терьеры чрезмерно представлены с внепеченочным PSS. Кошки также могут иметь как внутрипеченочный, так и внепеченочный PSS, хотя и реже, чем собаки.Пациенты с врожденным ПСС могут иметь целый спектр клинических признаков и отклонений в лабораторной работе. Они часто меньше своих однопометников, не набирают вес, могут проявлять ненормальное мышление в целом или после еды, могут иметь хронические симптомы со стороны желудочно-кишечного тракта или мочевыводящих путей. Нарушения лабораторной работы включают микроцитарную нерегенеративную анемию, гипоальбуминемию, снижение АМК, гипогликемию и гипохолестеринемию. Повышение уровня ALP и ALT также является обычным явлением. Анализ мочи может выявить кристаллурию бурата аммония. Пациентам с подозрением на ПСС обычно рекомендуется тестирование функции печени, при этом повышенные уровни желчных кислот в сыворотке крови до и после приема пищи почти на 100%. 1
Важным дифференциальным диагнозом для собак с подозрением на PSS является гипоплазия воротной вены (PVH), также известная как микрососудистая дисплазия (MVD). В этом состоянии существует прямая связь между (микроскопическими) воротными венулами и центральными печеночными венами, минуя печеночные синусоиды. 1 Клинические признаки у собак с PVH / MVD неотличимы от таковых у собак с макроскопическим PSS, и йоркширские терьеры также предрасположены. По этой причине для формирования точной клинической картины необходим точный визуальный диагноз макроскопического ПСС.
Доступно множество вариантов визуализации, при этом обычная рентгенография является единственным методом, неадекватным для постановки диагноза. Рентгенограммы брюшной полости могут показать признаки микрогепатии и реномегалии, но прямых доказательств PSS невозможно. Расширенные возможности визуализации включают брыжеечную портографию, транс-селезеночную портографию, трансколоническую портальную сцинтиграфию, транс-селезеночную портальную сцинтиграфию, ультразвуковое исследование без усиления, ультразвуковое исследование с контрастированием, КТ-ангиографию и МР-ангиографию.Три наиболее распространенных визуализирующих исследования, выполняемых в Angell для PSS, — это УЗИ, транс-селезеночная портальная сцинтиграфия и КТ-ангиография.
Рисунок 1. Поперечное ультразвуковое изображение на уровне ворот печени кошки с единичным внепеченочным PSS. Извилистый шунтирующий сосуд выходит из воротной вены (ПВ), которая составляет примерно половину диаметра каудальной полой вены (CVC).
УЗИ брюшной полости — это наиболее часто выполняемое визуализирующее исследование у пациентов с ПСС. У ультразвуковых исследований есть несколько преимуществ для диагностики PSS.Стоимость ультразвука относительно низкая или умеренная, особенно по сравнению с КТ. Ультразвуковое исследование не требует общей анестезии, хотя большинству пациентов требуется умеренная седация. Это связано с тем, что визуализируемые структуры малы и их трудно визуализировать, а небольшое движение пациента или напряжение в животе могут помешать полной оценке портальной системы. Ультразвук также не требует воздействия ионизирующего излучения. Ультразвук обычно более распространен, чем КТ, МРТ или ядерная сцинтиграфия.Основным недостатком ультразвука является переменная чувствительность (74% -100%) и высокая степень зависимости от навыков / опыта оператора. «Поиск шунта» не является рутинным компонентом УЗИ брюшной полости, и для максимального выявления PSS используется подробная методика. Типичные вторичные ультразвуковые данные у собак с PSS включают микропеченку, реномегалию и мочекаменную болезнь. В одном исследовании собак, оцениваемых на предмет потенциального PSS, наличие всех трех результатов на УЗИ было связано со 100% положительной прогностической ценностью для PSS. 3 Пациенты с внепеченочными шунтами обычно имеют небольшую воротную вену на воротах печени, что определяется путем сравнения диаметра воротной вены с хвостовой полой веной или аортой. Собаки с PSS обычно имеют отношение PV: Ao 0,8. 3
Рисунок 2 — Вид по длинной оси того же кота, что и на рисунке 1, череп слева. Цветное доплеровское изображение шунта показывает, что он пересекает диафрагму (наклонная линия, обозначенная открытой стрелкой), затем поворачивается и заканчивается на ВАХ.Это говорит о порто-диафрагмальном шунте.
Еще одно свидетельство шунта может быть получено путем инъекции взволнованного физиологического раствора в селезенку при сонографической оценке каудальной полой вены или правого предсердия. 4 Микропузырьки в физиологическом растворе являются эхогенными и могут быть видны в CVC или RA в случаях PSS. В идеале реальный аберрантный сосуд визуализируется, ответвляясь от воротной вены, обычно на уровне прикрепления селезеночной вены или правой желудочной вены (рис. 1). Цветное допплеровское исследование сосуда помогает указать, что кровь течет из воротной вены в аномальный сосуд, а не из сосуда в воротную вену, как при нормальных притоках.Визуализация обрыва шунта часто возможна, если обрывом является ЦВК (чаще всего), с отмеченным турбулентным кровотоком в ЦВК. Прерывание может не быть визуализировано, если шунт идет в неполную вену или диафрагмальную вену, хотя при неположенном шунте аберрантный сосуд часто можно увидеть, пересекая диафрагму дорсально, рядом с аортой (рис. 2). Сообщается, что внутрипеченочные шунты легче идентифицировать с помощью ультразвука (чувствительность 95–100%). Важно определить, возникает ли внутрипеченочный шунт из левого, центрального или правого отдела воротной вены, а также является ли шунт реальным аберрантным сосудом или прямым «окном», соединяющим ЛВ с ЦВК.Это важно, потому что эмболизация внутрисосудистой спиралью шунта «оконного» типа невозможна.
Рис. 3 — Составное изображение трансселезеночной портальной сцинтиграфии у собаки без PSS. Поглощение радиофармпрепарата наблюдается только в месте инъекции в селезенке (S) и в печени (L), при этом не наблюдается активности на уровне сердца (H) или остальной части тела.
Если PSS не определяется на УЗИ, следующим шагом обычно является ядерная сцинтиграфия или КТ-ангиография.Преимущества ядерной сцинтиграфии включают низкую или умеренную стоимость, а также достаточно однозначный ответ «да» или «нет». К недостаткам можно отнести не очень широкую доступность, отсутствие точной морфологической информации о шунте и необходимость изолировать пациента на 24 часа из-за радиоактивности (закон Массачусетса). Процедура требует сильной седации (обычно титрование пропофола), но обычно занимает всего 5-10 минут. Радиофармацевтический препарат (99mTc-меброфенин) вводится в селезенку под ультразвуковым контролем, и в течение нескольких минут получают динамические изображения тела.У меброфенина скорость выведения из организма при первом прохождении через печень составляет 97%, поэтому у нормальной собаки практически весь захват радиофармацевтических препаратов наблюдается только в печени, при этом системная активность практически отсутствует (рис. 3). У собак с макроскопическим шунтом радиофармпрепарат попадает в обход печени и сначала попадает в сердце, затем в легкие, затем в системный кровоток и постепенно накапливается в печени с течением времени (рис. 4). У собак с PVH / MVD поглощение сначала наблюдается в печени, но впоследствии также наблюдается в сердце, легких и большом круге кровообращения.На основании данных изображения можно рассчитать фракцию шунта, чтобы определить приблизительный процент портальной крови, проходящей в обход печени. 5
Рис. 4 — Составное изображение трансселезеночной портальной сцинтиграфии у собаки с PSS. По сравнению с рисунком 3 обратите внимание, что поглощение радиофармпрепарата определяется в месте инъекции (S), затем происходит дорсально и краниально в шунтирующем сосуде (*), минуя печень (L) и попадая в сердце (H). Обратите внимание, что раннее поглощение наблюдается в системном кровотоке и почках (K).
КТ-ангиография (КТА) по существу вытеснила брыжеечную портографию как золотой стандарт диагностики PSS у собак. Основным преимуществом является точная морфологическая информация обо всей системе воротной вены и ее связи с системной венозной и артериальной системами. Количество и расположение шунтирующих сосудов можно определить в степени, невозможной с помощью ультразвука или сцинтиграфии. К недостаткам можно отнести высокую стоимость, необходимость в общей анестезии и отсутствие повсеместной доступности высокоскоростной многосрезовой компьютерной томографии.КТА брюшной полости также включает в себя довольно высокую дозу ионизирующего излучения для пациента. КТА брюшной полости обычно начинается с неконтрастного сканирования брюшной полости для определения любых других морфологических аномалий. Если есть опасения по поводу артерио-портальной мальформации, сканирование артериальной фазы может быть получено путем сканирования пациента во время инъекции контрастного вещества с помощью инжектора. Фазовое сканирование портала обычно начинается после 30-45-секундной задержки, а постконтрастное сканирование с 3-минутной задержкой завершает исследование.При правильном выполнении КТА брюшной полости обеспечивает очень высокое качество изображений воротной и системной сосудистой сети, и исследование подвержено гораздо меньшим ошибкам интерпретации, чем при УЗИ или сцинтиграфии 6 (рис. 5).
Рисунок 5 — Дорсальная проекция максимальной интенсивности (MIP) КТ-ангиограммы у собаки с PSS. Череп находится вверху изображения, а правая сторона пациента — слева. Большой извилистый шунтирующий сосуд (*) выходит из воротной вены (ПВ), проходит каудально, влево, краниально мимо диафрагмы, затем поворачивается вправо и заканчивается на CVC.Это соответствует левому желудочно-диафрагмальному шунту. Обратите внимание на отличную визуализацию брюшной и легочной сосудистой сети.
Таким образом, портосистемные шунты являются важными врожденными дефектами у собак и кошек, которые можно точно диагностировать с помощью визуализации. Диагностическое обследование и клиническое ведение пациентов с ПСС могут быть сложными и в некоторой степени зависеть от специфики случая, а также от опыта и предпочтений основного клинициста, радиолога и хирурга, участвующих в этом случае.В Angell пациентам с ПСС чаще всего проводят УЗИ, сцинтиграфию и КТ-ангиографию.
Для получения дополнительной информации об услуге Angell Diagnostic Imaging или о наших консультационных онлайн-услугах по визуализации посетите www.angell.org/diagnosticimaging . С доктором Цай можно связаться по телефону 617-541-5139 или по электронной почте ([email protected]) .
Список литературы
- Berent AC, Tobias KM. Портосистемные сосудистые аномалии.Ветеринарная клиника North Am Small Anim Pract. 2009 1 мая; 39: 513–541.
- Гринхал С.Н., Даннинг М.Д., Маккинли Т.Дж. и др. Сравнение выживаемости собак с врожденным портосистемным шунтом после хирургического или медикаментозного лечения. J Am Vet Med Assoc. 1 июня 2010 г .; 236: 1215–1220.
- Д’Анжу М.А., Пеннинк Д.Г., Корнехо Л., Пибарот П. Ультразвуковая диагностика портосистемного шунтирования у собак и кошек. Ветеринарная радиология и ультразвук. 2004 сентябрь; 45: 424–437.
- Гомес-Очоа П., Ллабрес-Диас Ф, Руис С. и др.Использование трансселезеночной инъекции взволнованного физиологического раствора и гепаринизированной крови для ультразвуковой диагностики макроскопических портосистемных шунтов у собак. Ветеринарная радиология и ультразвук. 2011 Янв; 52: 103–106.
- Дэниел Г. Сцинтиграфическая диагностика портосистемных шунтов. Ветеринарная клиника North Am Small Anim Pract. 1 июля 2009 г.; 39: 793–810.
- Нельсон, Северная Каролина, Нельсон, LL.

