Допплер при беременности в Минске
Допплерометрия (синоним, допплерография) фето-плацентарного кровотока – это исследование состояния кровотока в системе «мать-плацента-плод», которое проводят во время ультразвукового исследования при беременности.
Результаты допплерографии позволяют судить о состоянии маточно–плацентарно–плодового кровотока и косвенно свидетельствуют о внутриутробном состоянии ребенка.
Физический эффект, применяемый в современной медицине для измерения скорости кровотока, открыл в 1842 году Христиан Иоганн Доплер, профессор математики и геометрии. Широкое распространение допплерометрия в акшерстве получила с середины 80 годов 20 века. Наиболее часто применяемые доплеровские методики при сканировании во время беременности следующие: импульсный, цветной (цветовой), энергетический допплеры.
Импульсный допплер.
Сущность эффекта Доплера сводится к тому, что при отражении ультразвуковых волн от движущихся объектов (в нашем случае такими объектами являются кровяные клетки, движущиеся по сосудам) изменяются физические свойства волны.

Цветной допплер.
Эта методика основана на применении того же частотного сдвига, только после преобразования сигналов на экране монитора появляется изображение сосудов, обычно красного и синего цвета. С помощью этой методики нельзя определить расчетные индексы, но можно охарактеризовать особенности кровотока в органе, проследить ход сосудов.
Часто цветной и импульсный допплер используются в комбинации – цветной для нахождения сосуда, импульсный для оценки скорости кровотока в нем.
При ультразвуковом исследовании во время беременности режим цветного допплера используется очень часто. Так такие опасные состояния как предлежание сосудов плаценты к шейке матки, истинный узел пуповины, многократное обвитие пуповины вокруг шеи плода, рак шейки матки можно диагностировать с помощью этой методики. Кроме этого, цветной допплер применяется при каждом исследовании сердца плода и помогает обнаружить пороки сердца.
Энергетический допплер.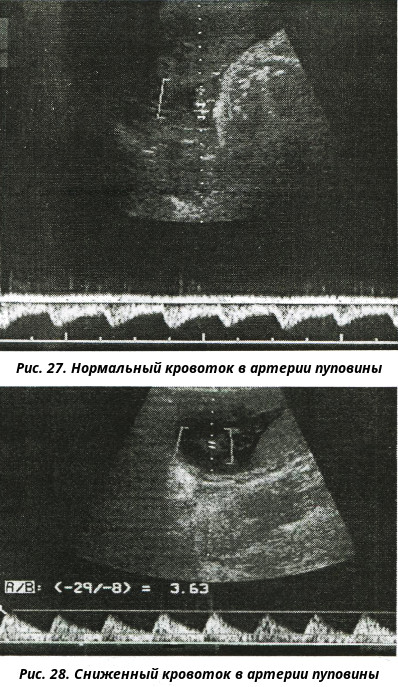
Еще одна из методик оценки кровоснабжения изучаемого объекта. Изменение амплитудных характеристик волны преображается в аппарате и на мониторе видны сосуды обычно оранжевого цвета. Эта методика в акушерстве применяется не часто.
Показания для проведения допплерометрии.
Основными показаниями для оценки кровотока в системе мать-плацента-плод являются:
1.Заболевания матери:
- гестоз, артериальная гипертензия,
- заболевания почек,
- коллагенозы,
- антифосфолипидный синдром и другие аутоиммунные состояния
- врожденные тромбофилии
- сахарный диабет
2.Заболевания плода, плаценты, пуповины:
- отставание в размерах
- маловодие,многоводие
- многоплодная беременность
- нарушение созревания плаценты
- неименная водянка, пороки развития плода, аномалии пуповины, хромосомные аномалии плода
- патологические типы КТГ
- пороки развития и подозрение на хромосомную патологию
3. Отягощённый акушерский анамнез (ЗВРП, гестоз, мертворождения при предыдущих беременностях).
Отягощённый акушерский анамнез (ЗВРП, гестоз, мертворождения при предыдущих беременностях).
Оценка кровотока в бассейне плаценты.
Оценка плацентарного кровотока включает в себя измерение индексов сопротивления в артерии пуповины и в обеих маточных артериях. Нарушение кровотока в пуповине свидетельствует о неполадках в плодовой части плаценты. Нарушение кровотока в маточных артериях говорит о сбое в работе маточной части плаценты. Необходимо знать, что нормальные показатели кровотока служат достаточно достоверным признаком нормального внутриутробного состояния плода, но полностью не исключают развития определенных осложнений; наличие нарушений кровотока в разных отделах маточно-плацентарно-плодовой системы требует строгого динамического контроля и лечения, в том числе в условиях стационара.
Оценка кровообращения плода.
Гемодинамика малыша обычно оценивается при исследовании кровотока в мозговых сосудах (средняя мозговая артерия), аорте, венозном протоке, сердце.
Классификация нарушений маточно-плацентаро-плодового кровотока.
Наиболее часто применяемая, простая и удобная классификация нарушений плацентарного кровотока изложена ниже.
1 степень
А.Нарушение маточно-плацентарного кровотока при сохранении плодово-плацентарного ( повышены индексы сопротивления в маточных артериях)
Б.Нарушение плодово-плацентарного кровотока при сохранении маточно-плацентарного (повышены индексы сопротивления в артерии пуповины)
2 степень
Одновременное нарушение маточно-плацентарного и плодово-плацентарного кровотока (повышены индексы сопротивления в артерии пуповиныи в маточных артериях)
3 степень
Критическое нарушение плодово-плацентарного кровотока (нарушение кровотока в пуповине) — отсутствует диастолический кровоток в артерии пуповины или даже появляется реверсный (обратный) кровоток.
Проведя оценку кровотока в сосудах плаценты и плода, врач делает соответствующие выводы и формулирует заключение. На основании этого заключения и результатах других методик обследования выбирается тактика ведения беременности.
На основании этого заключения и результатах других методик обследования выбирается тактика ведения беременности.
Необходимо помнить:
* Допплерометрия – это дополнительная методика, которая применяется после проведения ультразвукового исследования.
* Показания к проведению допплерометрии определяет врач. Без показаний такое исследование проводить не стоит.
* Частоту проведения допплерометрии определяет врач. Иногда требуется ежедневный контроль за состоянием кровотока мать-плод
* Нормальные результаты при допплерометрии не отменяют результатов других исследований и не гарантируют отсутствие внутриутробного страдания плода.
Способ лечения плацентарной недостаточности у беременных с вагинальными дисбиозами
Изобретение относится к медицине, а именно к разделу акушерство, и касается лечения плацентарной недостаточности. Известен способ комплексного лечение пациенток с фето-плацентарной недостаточностью проводилось на фоне традиционной, а так же современной лазерной терапии под контролем показателей УЗИ, допплеровского исследования, кардиотокографии плода (Демидов В.
Недостатком способа является отсутствие взаимосвязи предложенной схемы лечения плацентарной недостаточности в зависимости от индивидуального сочетания этиологических факторов и патогенетических механизмов развития данного осложнения.
В последние годы разработаны и продолжают совершенствоваться различные методы лечения плацентарной недостаточности, однако проблема далека от своего разрешения.
Известен способ лечения фето-плацентарной недостаточности с дисбиотическими нарушениями влагалища биологически активной добавкой (БАД), содержащей Spirulina platensis, приводящий к восстановлению нарушений в системе мать-плацента-плод, усилению процессов оксигенации в организме матери, интенсификации трофических процессов у плода, улучшению его функционального состояния.
Недостатком данного способа является, повышенная чувствительность компонентов препарата, заболевания желудочно-кишечного тракта, диарея, головная боль, головокружение. (Куркин В.А., Радзинский В.Е., Захарова К.А. «Современные аспекты химической классификации биологически активных соединений лекарственных растений // Фармация, 2002 — №2. — С. 8-16; Радзинский В.Е. «Лекарственные растения и биологически активные добавки в акушерстве и гинекологии // Под редакцией В.Е. Радзинского, 2009, с. 215.).
Также известен способ лечения плацентарной недостаточности с использованием лазерной и медикаментозной терапии, где с помощью лазерной установки генерировалось импульсное низкоинтенсивное лазерное излучение длиной волны 780 нм, средней мощностью импульсов 2,5 мВт, частотой следования импульсов от 50 до 100 Гц. Облучение производили на область проекции петель пуповины на переднюю брюшную стенку беременной женщины, продолжительностью 4-5 минут. (Тулупова М.С.«Состояние плодов, новорожденных, родившихся от матерей с фетоплацентарной недостаточностью и в зависимости от способа родоразрешения». — Дис. кандидата мед. наук; Москва, 2002 г., С. 25.)
Облучение производили на область проекции петель пуповины на переднюю брюшную стенку беременной женщины, продолжительностью 4-5 минут. (Тулупова М.С.«Состояние плодов, новорожденных, родившихся от матерей с фетоплацентарной недостаточностью и в зависимости от способа родоразрешения». — Дис. кандидата мед. наук; Москва, 2002 г., С. 25.)
Однако недостатком данного способа является необходимость знания точного места проекции петель пуповины на брюшную стенку, что является невозможным без предварительного УЗИ, отсутствия патогенетической обусловленности при назначении лазеротерапии, а так же нет дифференцированного подхода при назначении НИЛИ (низкоинтенсивное лазерное излучение).
Наиболее близким к заявленному изобретению является способ лечения плацентарной недостаточности, включающий одновременно медикаментозную и лазерную терапию. Используют контактно-стабильную методику. Длина волны составляет 0,89 мкм, импульсный режим, частота следования импульсов 80 Гц. При задержке внутриутробного развития плода на 1 неделю, нарушении маточно-плацентарного кровотока 1а степени, показателе плода 1,1-1,5 ежедневно проводят чрескожное воздействие на область локтевой вены с использованием контактно-стабильной методики, мощностью 55 Вт, продолжительностью 4 минуты, курсом 5 процедур; при задержке внутриутробного развития плода на 2 недели, нарушении маточно-плацентарного кровотока 16 степени, показателе состояния плода 1,5-2 проводят чрескожное воздействие на область локтевой вены. Мощность 60 Вт, продолжительность 5 мин, курсом 7 процедур. При задержке внутриутробного развития на 3 недели, нарушении маточно-плацентарного кровотока 2 степени, показателе плода больше 2 проводят чрескожное воздействие на переднюю брюшную стенку на область проекции плаценты. Мощность 65 Вт, продолжительность 6 минут, ежедневным курсом 10 процедур. (Патент №2456031. Способ лечения плацентарной недостаточности. Найфонова А.Н., Цаллагова Л.В., Лазарев В.В.)
Мощность 60 Вт, продолжительность 5 мин, курсом 7 процедур. При задержке внутриутробного развития на 3 недели, нарушении маточно-плацентарного кровотока 2 степени, показателе плода больше 2 проводят чрескожное воздействие на переднюю брюшную стенку на область проекции плаценты. Мощность 65 Вт, продолжительность 6 минут, ежедневным курсом 10 процедур. (Патент №2456031. Способ лечения плацентарной недостаточности. Найфонова А.Н., Цаллагова Л.В., Лазарев В.В.)
Недостатком данного способа является его недостаточная эффективность при лечении беременных с фетоплацентарной недостаточностью.
Так же в настоящее время в литературе неизвестны способы одновременного лечения беременных с фетоплацентарной недостаточностью и бактериальным вагинозом.
Цель изобретения: создание эффективного способа лечения плацентарной недостаточности у беременных с вагинальными дисбиозами. Поставленная цель достигается путем лазерного облучения, с помощью которого беременным ежедневно проводили чрескожное воздействие на локтевую вену. Также, параллельно проводилась санация влагалища раствором мирамистин 0,01% в течении 5 минут, а затем введение 1 таблетки Флуомизина на ночь курсом 6 дней.
Также, параллельно проводилась санация влагалища раствором мирамистин 0,01% в течении 5 минут, а затем введение 1 таблетки Флуомизина на ночь курсом 6 дней.
Оптимальную дозу лазерного облучения подбирали исходя из показателей УЗИ, допплерографического исследования и кардиотокографии плода. При нарушении маточно-плацентарного кровотока 1а степени, задержке внутриутробного развития плода на 1 неделю, сумме показателей по Фишер 7 баллов, ежедневно проводили чрескожное воздействие на область локтевой вены длиной волны 905 нм, частотой 1000 Гц, мощностью излучения 50 Вт, продолжительность 2 минуты, курсом 5 процедур.
При нарушении маточно-плацентарного кровотока 16, задержке внутриутробного развития на 2 недели и сумме показателей по Фишер 6-7 баллов, ежедневно проводили чрескожное облучение на область локтевой вены лазерным аппаратом длиной волны 905 нм, частотой 1000 Гц, мощностью излучения 50 Вт, продолжительность 5 минут, ежедневным курсом 7 процедур.
При нарушении маточно-плацентарного кровотока 2 степени, задержке внутриутробного развития плода на 3 недели, оценка плода по Фишер 6 баллов ежедневно проводили чрескожное облучение на переднюю брюшную стенку на область проекции плаценты. Длина волны 905 нм, частота 1000 Гц, мощность 65 Вт, продолжительность 6 минут, ежедневным курсом 10 процедур.
Длина волны 905 нм, частота 1000 Гц, мощность 65 Вт, продолжительность 6 минут, ежедневным курсом 10 процедур.
С целью коррекции вагинальных дисбиозов беременным проводилась санация влагалища раствором Мирамистин 0,01% в течении 5 минут, с последующим введением таблетки Флуомизин на ночь в течении 6 суток.
Предлагаемый метод лечения беременных с плацентарной недостаточностью на фоне вагинальных дисбиозов использовался у 110 женщин в возрасте 18-42 года, из них 60 пациенток составили основную и 50 контрольную группы. В первой основной группе традиционное лечение фетоплацентарной недостаточности дополнялось применением лазерной терапии при помощи лазерного аппарата. Пациентки контрольной группы получали стандартную терапию фетоплацентарных нарушений. Обе группы на втором этапе лечения получали «Ацилакт» по 1 свече вагинально на ночь, в течение 7 дней. Комплексное исследование эффективности различных способов лечения фетоплацентарной недостаточности у беременных с бактериальным вагинозом отображено на табл. 1.
1.
Таким образом, полученные данные показателей биофизического профиля плода свидетельствуют, что лучшие результаты достигнуты у беременных основной группы, получавших лазерную терапию.
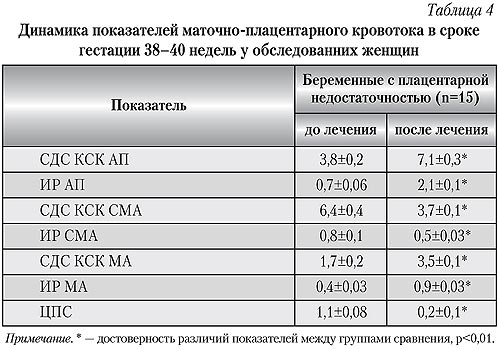
Проведенное допплерометрическое исследование фето-плацентарного комплекса выявило достоверное уменьшение показателей систолодиастолического отношения (СДО), пульсационного индекса (ПИ) и индекса резистентности (ИР) в маточных артериях и артериях пуповины, что свидетельствовало об улучшении маточно-плацентарного и плодово-плацентарного кровотока (табл. 2 и 3).
В качестве иллюстрации приводим краткие примеры.
Пример 1
Беременная Е., 28 лет
Жалобы на тянущие боли внизу живота, повышенную двигательную активность плода. Обильные выделения из влагалища, зуд, появившиеся около двух недель назад.
Анамнез: менструации с 16 лет, по 4-5 дней, через 28-30 дней, регулярные, умеренные, безболезненные.
Половая жизнь с 23 лет.
Первая беременность завершилась преждевременными родами в сроке 30 недель, гибелью плода.
Настоящая беременность II, роды предстоят первые.
Данная беременность протекала в первой половине на фоне угрозы прерывания, по поводу чего находилась на стационарном лечении в сроке 10-11 недель.
Объективно: среднего телосложения, умеренного питания. Общее состояние удовлетворительное, АД-100/70 мм рт.ст., ps 79 уд. в мин. Живот овоидной формы, увеличен за счет беременности. Матка возбудима при пальпации. Положение плода продольное, предлежит головка над входом в малый таз. Сердцебиение плода несколько приглушено, ритмичное 140 уд. в мин. Воды целы. Отеков нет. Физиологические оправления в норме. Высота стояния дна матки 32. Окружность живота 102 см.
Гинекологический статус: НПО развиты правильно, гиперемированы; оволосение по женскому типу.
В зеркалах: шейка матки синюшного цвета. Наружный зев закрыт. Выделения бели, обильные.
Наружный зев закрыт. Выделения бели, обильные.
Обследована: 17.03.15 г. Микроскопическое исследование содержимого влагалища (наличие ключевых клеток, лейкоциты до 10 ед. в поле зрения), бактериологическое исследование (дрожжеподобные грибы, гарднереллы), доплерометрия (нарушение маточно-плацентарного и плодово-плацентарного кровотока 2-й А степени), кардиотокографическое исследование (задержка внутриутробного развития плода на 2 недели, по Фишеру 6-7 баллов).
Диагноз: Беременность 33 недели. Головное предлежание. Угроза преждевременных родов. Фетоплацентарная недостаточность II ст. ЗВУР плода. ОАА (антенатальная гибель плода). Рубец на матке.
Назначено лечение:
— диета, богатая белком и витаминами;
— раствор глюкозы 40% — 10,0 с раствором аскорбиновой кислоты 5% — 5,0 в/в ежедневно №10-15;
— ацилакт свечи по 1 на ночь вагинально в течение 7 дней
— эссенциале 5,0 в/в в течение 10 дней;
— трентал 5,0 глюкоза 5%-400,0 в/в капельно ежедневно или через день №5;
— кокарбоксилаза 100 мг в/в струйно;
— актовегин 5,0 на 200,0 — 10% р-ра глюкозы в/в капельно №5;
— пирацетам 10,0 в/в, №10.
Медикаментозная терапия, включающая в себя: коррекцию фетоплацентарного нарушения, параллельно проводилась санация влагалища раствором мирамистин 0,01%, в течении 5 минут, а затем введение 1 таблетки Флуомизина на ночь курсом 6 дней.
В сочетании с чрескожным лазерным облучением на переднюю брюшную стенку на область проекции плаценты, мощностью 65 Вт, продолжительностью 6 мин, ежедневным курсом 10 процедур.
Лечение проводилось под ежедневным контролем АД и КТГ плода, а также доплерометрии.
Контроль:
Жалоб нет. Состояние удовлетворительное. Матка в нормальном тонусе. Сердцебиение плода ясное ритмичное, 140 уд. в мин.
На 10 сутки проведена микроскопия влагалищного содержимого лейкоцитов — 0.
Бактериологическое исследование дрожжевые клетки единичные, флора — палочки.
Через 2 недели произведена контрольная доплерометрия: нарушение плодово-плацентарного кровотока 16 степени.
И КТГ: признаки нарушения состояния плода (7-8 баллов по Фишеру).
Пример 2
Беременная М., 20 лет
Жалобы: на тянущие боли внизу живота, повышенный тонус матки, дискомфорт во влагалище.
Анамнез: менструации с 14 лет, по 3 дня, через 28 дней, регулярные, умеренные, безболезненные. Половая жизнь с 17 лет.
Гинекологический статус: кольпит.
Беременность первая, роды предстоящие.
В возрасте трех лет оперирована по поводу ранения органов брюшной полости.
Объективно: Общее состояние удовлетворительное, кожа и видимые слизистые чистые. АД 100/70 мм рт.ст., пульс — 78 уд. в мин. Живот продольной формы, увеличен за счет беременности. Высота стояния дна матки 36 см. Матка в нормальном тонусе. Сердцебиение плода несколько приглушено, ритмичное 140 уд. в мин. Воды целы. Отеков нет. Стул и диурез в норме. Молочные железы мягкие, безболезненные при пальпации.
В зеркалах: Наружные половые органы развиты правильно, шейка матки и стенки влагалища гиперемированы, выделения из влагалища белые. Аминотест положительный
Аминотест положительный
Обследована: Микроскопическое исследование содержимого влагалища (наличие ключевых клеток, лейкоциты 15 ед. в поле зрения), бактериологическое исследование (дрожжеподобные грибы, гарднереллы, уреаплазма), допплерометрия (нарушение маточно-плацентарного и плодово-плацентарного кровотока 1-й А степени), кардиотокографическое исследование (задержка внутриутробного развития плода на 1 недели, по Фишеру 7-8 баллов).
Диагноз: Беременность 35 недель. Головное предлежание. Угроза преждевременных родов. Плацентарное нарушение кровотока, компенсированная форма. Признаки гипоксии плода. Преждевременное созревание плаценты. ЗВУР плода II ст. Гестационный пиелонефрит, ремиссия.
Назначено лечение:
— диета, богатая белком и витаминами;
— раствор глюкозы 40% — 10,0 с раствором аскорбиновой кислоты 5% — 5,0 в/в ежедневно №10-15;
— эссенциале 5,0 в/в в течение 10 дней;
— трентал 5,0 глюкоза 5%-400,0 в/в капельно ежедневно или через день №5;
— кокарбоксилаза 100 мг в/в струйно;
— актовегин 5,0 на 200,0 — 10% р-ра глюкозы в/в капельно №5;
— ацилакт свечи по 1 на ночь вагинально в течение 7 дней
— лазерное облучение крови на область локтевой вены курсом 5 процедур по 2 минуты (мощность излучения 50 Вт, длина волны 905 нм, частота 1000 Гц).
Пример 3
Беременная З., 23 года
Жалобы: на повышенный тонус матки, повышенную активность плода.
Анамнез: менструации с 13 лет, по 3-4 дня, через 28 дней, регулярные, умеренные, безболезненные. Половая жизнь с 20 лет.
Гинекологический статус: беременность 3, роды 3. Истмико-цервикальная недостаточность. Хирургическая коррекция шейки матки.
Первая беременность (2011 г.) завершилась в 24 недели отслойкой плаценты. Преждевременные роды. Вторая беременность (2012 г.) Преждевременные роды в 28 недель. Плод (1650), умер на 13 сутки.
Беременная в сроке в 8-9 недель находилась на стационарном лечении с диагнозом «угроза прерывания беременности». В сроке 15-16 недель выполнена хирургическая коррекция шейки матки.
Из соматических заболеваний отмечает ОРВИ, ветряную оспу.
Объективно: общее состояние удовлетворительное, кожа и видимые слизистые чистые, АД 120/70 мм рт. ст., пульс — 82 уд. в мин. Молочные железы мягкие, безболезненные при пальпации.
ст., пульс — 82 уд. в мин. Молочные железы мягкие, безболезненные при пальпации.
Живот продольной формы, увеличен за счет беременности. Высота стояния дна матки 38 см. Матка в нормальном тонусе. Сердцебиение плода несколько приглушено, ритмичное 140 уд. в мин. Воды целы. Отеков нет. Стул и диурез в норме.
В зеркалах: Наружные половые органы развиты правильно, шейка матки цилиндрической формы, бледно-розовой окраски. Стенки влагалища без особенностей. Выделения молочного цвета, обильные, с «рыбным запахом». Аминотест положительный.
Обследована: Микроскопическое исследование содержимого влагалища (наличие ключевых клеток, лейкоциты 24 ед. в поле зрения), бактериологическое исследование (дрожжеподобные грибы, гарднереллы), допплерометрия (нарушение маточно-плацентарного и плодово-плацентарного кровотока 1-й В степени), кардиотокографическое исследование (задержка внутриутробного развития плода на 2 недели, по Фишеру 7 баллов).
Диагноз: Беременность 35-36 недель. Головное предлежание. Угроза преждевременных родов. Фетоплацентарная недостаточность, компенсированная форма. Признаки гипоксии плода. Истмико-цервикальная недостаточность. Хирургическая коррекция шейки матки. Анемия, осложненная беременностью. Варикозная болезнь.
Головное предлежание. Угроза преждевременных родов. Фетоплацентарная недостаточность, компенсированная форма. Признаки гипоксии плода. Истмико-цервикальная недостаточность. Хирургическая коррекция шейки матки. Анемия, осложненная беременностью. Варикозная болезнь.
Назначено лечение:
— диета, богатая белком и витаминами;
— раствор глюкозы 40% — 10,0 с раствором аскорбиновой кислоты 5% — 5,0 в/в ежедневно №10-15;
— эссенциале 5,0 в/в в течение 10 дней;
— трентал 5,0 глюкоза 5%-400,0 в/в капельно ежедневно или через день №5;
— кокарбоксилаза 100 мг в/в струйно;
— актовегин 5,0 на 200,0 — 10% р-ра глюкозы в/в капельно №5;
— пирацетам 10,0 в/в, №10;
— мальтофер 1 таблетка во время еды;
— ацилакт свечи по 1 на ночь вагинально в течение 7 дней
— лазерное облучение крови на область локтевой вены курсом 5 процедур по 2 минуты (мощность излучения 50 Вт, длина волны 905 нм, частота 1000 Гц).
28.03.2015 г. беременность завершилась срочными родами. Родился плод весом 3600 кг, ростом 52 см, оценка по Апгар 8-8 баллов.
Медико-социальная эффективность
Данный метод комплексной терапии фетоплацентарной недостаточности с применением лазерной терапии приводит к более эффективному лечению данной патологии у беременных, а также к сокращению койко-дней (7 дней). Кроме того, немаловажным фактором является снижение лекарственной нагрузки на организм беременной.
Способ лечения плацентарной недостаточности у беременных с вагинальными дисбиозами, включающий одновременное применение комплексной медикаментозной и лазерной терапии, отличающийся тем, что в течение 6 суток беременным ежедневно проводят санацию влагалища 0,01% раствором Мирамистина в течение 5 минут, с последующим введением таблетки Флуомизина на ночь, причем оптимальную дозу лазерного облучения подбирают исходя из показателей ультразвукового исследования, доплерографического исследования и кардиотокографии плода: при нарушении маточно-плацентарного кровотока 1а степени, задержке внутриутробного развития плода на 1 неделю, сумме показателей по Фишер 7 баллов ежедневно проводят чрескожное облучение на область локтевой вены длиной волны 905 нм, частотой 1000 Гц, мощностью излучения 50 Вт, продолжительностью 2 минуты, курсом 5 процедур; при нарушении маточно-плацентарного кровотока 16, задержке внутриутробного развития на 2 недели и сумме показателей по Фишер 6-7 баллов ежедневно проводят чрескожное облучение на область локтевой вены лазерным аппаратом длиной волны 905 нм, частотой 1000 Гц, мощностью излучения 50 Вт, продолжительностью 5 минут, ежедневным курсом 7 процедур; при нарушении маточно-плацентарного кровотока 2 степени, задержке внутриутробного развития плода на 3 недели, оценке плода по Фишер 6 баллов ежедневно проводят чрескожное облучение на переднюю брюшную стенку на область проекции плаценты длиной волны 905 нм, частотой 1000 Гц, мощностью 65 Вт, продолжительностью 6 минут, ежедневным курсом 10 процедур.
Сделать допплер УЗИ (допплерометрия плода) при беременности
Преимущества УЗИ исследования в Нова Клиник
Аппарат УЗИ экспертного уровня Voluson E8
Использование новейших технологий
Опытные УЗИ-специалисты
С целью наблюдения за развитием и общим состоянием плода во время беременности в определенные сроки (скрининговые) женщинам назначаются ультразвуковые исследования (УЗИ). УЗИ при беременности включает в себя подробный осмотр внутренних органов плода, исключение наличия маркеров генетических заболеваний, определение пола и веса плода. Кроме того, в исследование обязательно входит осмотр плаценты, околоплодных вод, пуповины, а также стенок матки, длины цервикального канала и, по возможности, состояния яичников женщины.
Допплеровское исследование – исследование кровотока в сосудах, которое проводится на аппарате УЗИ экспертного класса. По ощущениям женщины это исследование не отличается от обычного УЗИ.
По ощущениям женщины это исследование не отличается от обычного УЗИ.
Принцип работы УЗИ с допплером
Принцип работы допплера основан на отражении ультразвуковых волн от движущихся потоков крови. Эти сигналы улавливает и обрабатывает компьютер ультразвукового аппарата в виде цифровых значений, которые оцениваются врачом по нормативным таблицам, составленным согласно сроку беременности. На основании полученных данных специалист может дать заключение о том, как идет поток крови по сосудам (ламинарное или турбулентное течение крови), есть ли участки сужения (спазма) или, наоборот, расширения (при снижении тонуса стенок сосудов).
Для оценки состояния внутренних органов, особенно, сердца и крупных сосудов, используется дополнительно цветное допплеровское картирование (ЦДК), позволяющее исключать пороки развития сердечно-сосудистой системы, а также аномалии развития в системе кровоснабжения у плода.
При этом исследовании на мониторе ультразвукового аппарата выводится цветное изображение потока крови в кровеносном сосуде или камерах сердца плода, по которому оценивается направление тока крови, а также исключаются дефекты стенок и клапанов.
С 20-й недели беременности женщинам при наличие определенных показаний может проводится допплерометрия маточно-плацентарного и плодового кровотока для исключения нарушения кровообращения в системе мать-плацента-плод. В этот период могут быть выявлены как серьезные нарушения, требующие срочной госпитализации и лечения (а иногда, и экстренного родоразрешения), так и начальные, при которых должно назначается профилактическое лечение.
Многие пациенты интересуются, чем отличаются допплерометрия и допплерография. Нужно сказать, разницы практически нет: в первом случае оценка кровотока осуществляется врачом на основании показателей с монитора, во втором — производится их запись на бумажном носителе.
Хотите записаться на прием?
Показания для проведения допплерометрии
Показанием для исследования является высокий риск развития нарушения кровообращения в сосудах матки, плаценты, пуповины, а так же крупных сосудах плода. Целью исследования является раннее выявление гипоксии (кислородного голодания) плода у женщин с высоким риском развития различной патологии во время беременности. Допплерометрия маточно-плацентарного и плодового кровотока проводится в следующих случаях:
Целью исследования является раннее выявление гипоксии (кислородного голодания) плода у женщин с высоким риском развития различной патологии во время беременности. Допплерометрия маточно-плацентарного и плодового кровотока проводится в следующих случаях:
- беременным женщинам из групп высокого риска по развитию гестоза (токсикоза) второй половины беременности, всем беременным женщинам после после ЭКО, в возрасте старше 34 лет и юным беременным, а так же женщинам, входящим в группы риска по развитию гестационного пиелонефрита и сахарного диабета.
- беременным с различной соматической (общетерапевтической) патологией: сердечно-сосудистой системы (в том числе с артериальной гипертензией), почек, печени, щитовидной железы, дыхательной системы и т.п.;
- беременным с высоким риском развития конфликта по системе АВО и резус фактору;
- беременным женщинам с отягощенным акушерско-гинекологическом анамнезе: бесплодием, невынашиванием, антенатальной гибелью плода и т.
 д.;
д.; - при многоплодной беременности;
- при подозрении на задержку внутриутробного развития плода, а так же неудовлетворительных показателях кардиотокографии (КТГ).
- курящим, а также женщинам, употребляющим алкоголь, наркотики
- при острых акушерских ситуациях, требующих немедленного принятия решения о тактике ведения беременной женщины (например, при преэклампсия, кровянистых выделениях из половых путей во 2-й половине беременности, сильных болях в животе, подозрении на отслойку плаценты, редких шевелениях плода, преждевременном излитии околоплодных вод и т.д.)
Кроме того, при нормально протекающей беременности желательно делать допплерометрию дважды – на сроках 30 недель и 35-36 недель беременности.
Основная цель допплерометрии – оценка кровообращения в системе мать-плацента-плод при исследовании кровотока в следующих сосудах: маточных артериях (правой и левой), артериях и вене пуповины (в норме пуповина состоит из двух артерий и одной вены), а также в средней мозговой артерии плода. Кроме того, в некоторых случаях становится необходимым исследование кровотока в аорте, венозном протоке, сонных артериях плода и некоторых других сосудах.
Кроме того, в некоторых случаях становится необходимым исследование кровотока в аорте, венозном протоке, сонных артериях плода и некоторых других сосудах.
В ходе исследования компьютер аппарата выводит на экран так называемые индексы периферического сосудистого сопротивления (индекс резистентности и пульсационный индекс), скорости кровотока в сосудах и другие показатели адекватности движения крови по сосудам.
Подготовка к процедуре
Для проведения допплерометрии во время беременности специальной подготовки не требуется. Поэтому женщине нет необходимости беспокоиться о соблюдении каких бы то ни было ограничений накануне или в день процедуры. Будущей маме нужно только записаться на прием и в назначенное время подъехать в клинику.
Степени тяжести нарушения маточно-плацентарного кровотока
Для определения степени нарушения маточно-плацентарного и плодового кровотока имеется классификация, созданная под редакцией проф. М.В.Медведева, которая позволяет судить о степени тяжести нарушения кровотока. Согласно классификации выделяют три степени нарушения МППК:
М.В.Медведева, которая позволяет судить о степени тяжести нарушения кровотока. Согласно классификации выделяют три степени нарушения МППК:
- 1 степень (начальные нарушения МППК)
- 2 степень (гемодинамические нарушения, не достигающие критических значений, но требующие лекарственной коррекции)
- 3 степень (критические нарушения кровотока, свидетельствующие о внутриутробном страдании плода)
Вне зависимости от показателей маточно-плацентарного и плодово-плацентарного кровотока, необходимо также оценить плодовый кровоток. Оценка скорости кровотока и сосудистого сопротивления в средней мозговой артерии отражает наличие или отсутствие кислородного голодания плода (гипоксии), а также поможет исключить анемию у плода при развитии иммуногематологического конфликта по системе АВО или резус-фактору. При оценке плодового кровотока тоже выделяют три степени нарушений:
- 1 степень – начальные изменения, т.е.обратимые при назначении своевременного лечения
- 2 степень – признаки внутриутробной гипоксии, требующие интенсивной терапии, возможно, экстренного родоразрешения
- 3 степени – признаки тяжелой гипоксии, требующие немедленного принятия решения об экстренном родоразрешении
В настоящее время, когда беременные женщины находятся под постоянным и пристальным контролем врачей акушеров-гинекологов, критические нарушения маточно-плацентарного и плодового кровотока, благодаря мерам профилактики и выявлению изменений со стороны кровотока на начальных этапах, регистрируются очень редко. Как правило, тяжелые изменения МППК регистрируются у плодов с генетической (хромосомной, генной) патологией, что является основанием для медико-генетического консультирования.
Как правило, тяжелые изменения МППК регистрируются у плодов с генетической (хромосомной, генной) патологией, что является основанием для медико-генетического консультирования.
Следует также понимать, что женщины, входящие в группы высокого риска по различным патологиям беременности, должны сами ответственно относиться к своему здоровью, вести здоровый образ жизни и своевременно посещать своего врача. Только это дает все шансы на рождение здорового доношенного ребенка.
Стоимость допплерографии в Нова Клиник вы можете увидеть в таблице ниже или в разделе «Цены».
Остались вопросы?
Допплерометрия (УЗИ с допплером) — цены в Москве
Нарушение маточно-плацентарного кровотока 1а степени: что это такое, каковы последствия для ребенка?
Как лечить нарушение кровотока при беременности
Для лечения неполноценного движения крови в период вынашивания ребенка применяют различные препараты, способствующие повышению устойчивости мозга плода к гипоксии, улучшению микроциркуляции крови и уменьшению ее свертываемости. При необходимости врач назначает антибактериальные и антивирусные препараты, а также иммуномодуляторы.
При необходимости врач назначает антибактериальные и антивирусные препараты, а также иммуномодуляторы.
Хорошим средством, улучшающим мозговое кровообращение, работу сердца и обмен веществ у ребенка при гипоксии, является препарат Инстенон. Он применяется в комплексе с другими препаратами.
Будущей матери также приписывается применение Актовегина — препарата, способствующего повышению устойчивости тканей и головного мозга плода к гипоксии. Он также улучшает обмен веществ, стимулирует обновление клеток будущего малыша, улучшает кровообращение в сложной системе — мама-плацента-плод. В результате лечения Актовегином улучшаются показатели кровотока, и наблюдается активный рост ребенка в материнской утробе.
Известно, что при плацентарной недостаточности, как правило, наблюдается хроническое нарушение свертывания крови. В связи с этим специалисты рекомендуют применение препаратов, которые препятствуют образованию тромбов в сосудах (например, Курантила).
В случае 3-й (самой сложной) степени нарушения кровотока специалисты вызывают преждевременные роды.
Специально для — Ксения Маневич
Такой диагноз, как «Нарушение маточно-плацентарного кровотока», ставят беременным женщинам довольно часто, а вот объяснить будущей маме, что это такое, находит время не каждый гинеколог. Давайте разберемся в данной статье, чем опасно это заключение и по какой причине возникают нарушения в маточно-плацентарном кровотоке.
В организме беременной женщины существует налаженная система, которая позволяет ребенку в утробе получать все необходимые питательные вещества. Примерная схема данной системы заключается в трех составляющих: «организм матери — плацента — организм плода». Если какая-то часть данного взаимоотношения нарушается, то это приводит к осложнениям в состоянии и развитии малыша при одновременных осложнениях течения беременности.
Существует три степени нарушений:
Первая степень, когда развитие плода удовлетворительное, а нарушения не имеют опасного характера и касаются исключительно маточно-плацентарного кровотока. При отсутствии реакции со стороны специалистов и надлежащего лечения данный этап может длиться 3-4 недели в среднем и переходит на следующий 2 уровень. Делится на 2 вида:
Делится на 2 вида:
1А) Когда плодово-плацентарное кровообращение находится в норме, а нарушения замечены в маточно-плацентарном кровотоке. Синдром задержки развития плода развивается приблизительно в 90% случаев.
1Б) Характеризуется нормой маточно-плацентарного кровообращения, но осложнениями в плодово-плацентарном. Синдром задержки развития плода развивается приблизительно в 80% случаев.
Вторая степень характеризуется нарушениями движения крови по сосудам и у плода, и в маточном кровотоке. Данная степень очень быстро (иногда в течение 1 недели) может перейти к 3 степени.
Третья степень означает, что кровоснабжение плода находится на критическом уровне.
Профилактика нарушения кровотока при беременности
Каждая женщина, желающая родить ребенка, должна помнить, что будущему малышу полностью передается состояние матери. Поэтому, чтобы плод развивался без осложнений, ей необходимо составлять свой рацион из еды, содержащей максимум витаминов, микро- и макроэлементов, а также богатой необходимым количеством углеводов, белков и жиров.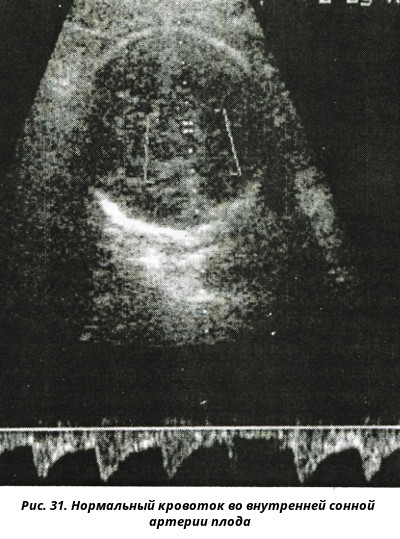 Если беременную не беспокоят отеки, то потребление жидкости должно составлять не меньше 1-1,5 л.
Если беременную не беспокоят отеки, то потребление жидкости должно составлять не меньше 1-1,5 л.
Важно контролировать изменения массы тела, так как к концу беременности прибавка в весе не должна превышать 10 кг. Существуют группы риска, нуждающиеся в применении медикаментозной профилактики, которая способствует взаимодействию систем организма плода и матери и предупреждает дисфункцию маточноплацентарного кровообращения
Существуют группы риска, нуждающиеся в применении медикаментозной профилактики, которая способствует взаимодействию систем организма плода и матери и предупреждает дисфункцию маточноплацентарного кровообращения.
Значительно уменьшить перинатальную заболеваемость и смертность поможет вовремя скорректированная методика ведения родов и медикаментозная терапия. Но высокий риск появления тяжелых неврологических осложнений все-таки не исключается.
Специально дляberemennost.net Елена Жирко
Методы диагностики
“Золотым стандартом” нарушений кровотока в системе мать-плацента-плод на сегодняшний момент в акушерстве является допплерометрическое исследование. Данный метод открывает возможности для распознавания даже самых незначительных изменений, так как обладает высокой чувствительностью и информативностью.
Данный метод открывает возможности для распознавания даже самых незначительных изменений, так как обладает высокой чувствительностью и информативностью.
Допплерометрия представляет собой разновидность ультразвукового исследования, которое основывается на использовании эффекта Допплера. Суть исследования заключается в измерении частоты ультразвуковой волны, отраженной от движущихся объектов. При исследовании кровеносных сосудов движущимися частицами являются форменные элементы крови, в частности, эритроциты, как наиболее многочисленные клетки. Регистрация полученных данных и сравнение их с нормой называется допплерографией.
Каковы преимущества допплерографии?
- Современные аппараты УЗИ дают возможность исследовать направление, скорость потока крови в маточных артериях, сосудах пуповины и даже внутриплацентарный кровоток.
- Благодаря цветному картированию можно отдельно исследовать кровоток в сосудах с разным направлением крови (артерии и вены). Направление артериальной крови на аппарате отражается красным цветом, а венозной – синим.

- Доказано, что применение этого метода при беременности не оказывает отрицательного влияния на развитие плода.
- Уникальной возможностью метода является прогнозирование развития беременности. Что это означает? Многие исследования показали, что нарушения в кровотоке маточно-плацентарной системы появляются немного раньше, чем появятся какие-либо клинические проявления страдания плода (уменьшение массы тела, изменение ритма сердца и др.). А это значит, что при своевременной диагностике нарушений кровоснабжения плода, у врача есть небольшое количество времени для принятия верного решения. Примером этому может служить обнаружение изменения кровотока, которое называется “дикротической выемкой” в 90% случаев перед развитием клинических проявлений гестоза (отеки, повышение артериального давления, появление белка в моче). Допплерография широко распространена в акушерской практике, так как открывает врачам не только возможность вовремя распознать нарушения кровотока, но и даже предупредить развитие тех, или и иных осложнений беременности.

Случай из практики
Нестандартная ситуация, произошедшая в родильном отделении, заставила врачей акушеров-гинекологов задуматься о применении допплерографии во время родов.
Женщина 25 лет без какой-либо сопутствующей патологии поступила в род. дом с регулярными схватками через каждые 3-5 минут. Роды первые, срочные.
По данным анамнеза: беременность протекала без осложнений, патологии со стороны плода не обнаружено, все протоколы УЗИ с допплерометрией в пределах нормы.
Первый период родов протекал физиологично, при полном открытии шейки матки роженица была переведена в родильный зал.
Однако, во время потуг начали происходить, на первый взгляд, необъяснимые явления: сердцебиение плода во время потуг восстанавливалось, а в перерывах между потугами значительно замедлялось. Хотя, как правило, все происходит наоборот. В связи с этим решено было выполнить УЗИ с исследованием кровотока в сосудах во время родов. Результат исследования удивил всех: в перерывах между схватками плод ручкой зажимал пуповину, в результате чего значительно нарушался кровоток. По мере нарастания гипоксии в организме ребенка, его ручки ослабевали, и он отпускал пуповину, тем временем кровоток восстанавливался. Учитывая полученную картину, было решено форсировать ведение второго периода родов с использованием вспомогательных пособий. Так, благодаря допплерометрии врачам удалось избежать серьезных осложнений.
По мере нарастания гипоксии в организме ребенка, его ручки ослабевали, и он отпускал пуповину, тем временем кровоток восстанавливался. Учитывая полученную картину, было решено форсировать ведение второго периода родов с использованием вспомогательных пособий. Так, благодаря допплерометрии врачам удалось избежать серьезных осложнений.
Вторичные методы диагностики
Помимо допплерографии существуют и другие методы исследования, которые косвенно указывают на нарушение кровотока:
- Сбор жалоб. При нарушении кровообращения плод испытывает гипоксию, что проявляется увеличением двигательной активности малыша. Обычно беременные жалуются на активное шевеление плода.
- Выслушивание сердцебиения с помощью стетоскопа также может помочь в диагностике. Замедление или ускорение ритма, выходящее за пределы физиологической нормы, также может свидетельствовать о гипоксии.
- Запись КТГ. Регистрации КТГ в течение 40-60 минут может быть достаточно для того, чтобы диагностировать признаки внутриутробной гипоксии плода.

- Некоторые ультразвуковые показатели (преждевременное старение плаценты, исследование биофизического профиля) могут зафиксировать неблагополучие состояния плода.
Лечение
При нарушении маточно-плацентарного кровотока любой выраженности показаны лечебные мероприятия. В основном это направлено на предотвращение прогрессирования патологии, тогда как нормализация гемодинамики, согласно наблюдениям, возможна только на 1б стадии. При этом стараются использовать все возможные средства для улучшения состояния плода. Конечно же, на первом месте стоят консервативные мероприятия. Хирургическое воздействие применяется только при осложнениях и по жизненным показаниям. Кроме того, большое значение отводится профилактике плацентарной недостаточности.
Медикаментозная терапия
Главное средство коррекции плацентарного кровотока – это применение медикаментов. Когда выявлены только начальные признаки нарушений, можно пройти лечение в амбулаторных условиях. Если недостаточность имеет более выраженный характер, то необходима госпитализация в стационар. Такая необходимость существует и при экстрагенитальной патологии у женщины. В основном применяют следующие препараты:
Если недостаточность имеет более выраженный характер, то необходима госпитализация в стационар. Такая необходимость существует и при экстрагенитальной патологии у женщины. В основном применяют следующие препараты:
- Спазмолитики (Но-шпа, Эуфиллин).
- Токолитики (Гинипрал, Партусистен).
- Сосудистые (Актовегин).
- Улучшающие микроциркуляцию (Трентал).
- Антиагреганты (Курантил).
- Антигипоксанты (Инстенон).
- Витамины и микроэлементы (Магне B6, аскорбиновая кислота).
- Метаболические (АТФ).
- Гепатопротекторы (Эссенциале, Хофитол).
Как правило, рекомендуют пройти два курса терапии – непосредственно после постановки диагноза и в сроке 32–34 недель. После этого решается вопрос о родоразрешении
Это особенно важно при тяжелых расстройствах кровообращения. Если нарушения зафиксированы на 1а или 1б стадии, то роды проходят естественным путем
Операция
Когда плацентарная недостаточность имеет выраженный характер, необходимо экстренное родоразрешение. В случае неэффективности консервативных мероприятий даже при легких нарушениях решение должно быть принято в течение 2 суток. В основном используют операцию кесарева сечения. Если она планируется в сроки до 32 недель беременности, то нужно исходить из состояния плода и его жизнеспособности.
В случае неэффективности консервативных мероприятий даже при легких нарушениях решение должно быть принято в течение 2 суток. В основном используют операцию кесарева сечения. Если она планируется в сроки до 32 недель беременности, то нужно исходить из состояния плода и его жизнеспособности.
Когда приходится констатировать произошедший самопроизвольный аборт, необходимо проводить выскабливание полости матки или вакуум-экстракцию плода. При замершей беременности оперативное вмешательство зависит от срока гестации и состояния женщины.
Профилактика
Чтобы избежать многих неприятных ситуаций при беременности, в том числе и плацентарной недостаточности, необходимо выполнять профилактические рекомендации. Они в основном касаются образа жизни и включают следующие принципы:
- Здоровое питание.
- Отказ от вредных привычек.
- Прогулки на открытом воздухе.
- Устранение стрессовых факторов.
- Выполнение всех рекомендаций врача.
- Своевременное лечение сопутствующих болезней.

Если бережно относиться к собственному здоровью во время беременности, то можно предотвратить нарушение кровотока в системе мать-плацента-плод. А при выявлении указанной патологии необходимо проводить своевременное лечение, что позволит сохранить ребенка.
После того как женщина узнает про свою беременность, она должна осознавать, что теперь организм принадлежит не только ей, но и ее будущему ребенку. Гормональные всплески и полная перестройка органов малого таза, довольно часто заканчивается нарушением в кровоснабжении плода. В этой статье поговорим про нарушение кровотока при беременности, чем оно чревато, какая симптоматика присуща, какую терапию можно применять и как выносить здорового ребенка.
Какие причины способны разорвать потоки крови между матерью, плацентой и плодом?
Причины нарушения системы кровообращения между материнским организмом и плодом (фетоплацентарная недостаточность) достаточно хорошо изучены. Часть факторов формируется только на фоне беременности. Другая — зависит от общего здоровья женщины.
Другая — зависит от общего здоровья женщины.
К патологии беременности относятся:
- Низкое прикрепление плаценты (акушеры говорят — предлежание, «плацентация») — нижние отделы матки отличаются более тонким мышечным слоем. Через него поступает недостаточно крови к плоду. Аналогичная ситуация развивается в случае предлежания в зоне послеоперационного рубца (например, от кесарева сечения).
- Поздний токсикоз — сопровождается поражением мелких сосудов матки, осложнение является наиболее частым нарушением кровотока.
- Анемия — низкий уровень гемоглобина вызывает компенсаторное ускорение сердцебиения, усиливается кровоток через маточные артерии с целью возмещения недостатка кислорода. Изменяется циркуляция и в маточно-плацентарном кругу.
- Несовместимость между кровью матери и плода по резусу — возникает иммунный конфликт с развитием гемолитической болезни ребенка, анемии. Такая же ситуация возможна при переливании разногруппной крови от донора.
- Нагрузка на почки в связи с токсикозом может вызвать повышение артериального давления.
 Это способствует изменению кровотока.
Это способствует изменению кровотока. - Редко выявляется патология артерий пуповины. Если имеется только одна пупочная артерия, то приток крови недостаточен для плода.
- Многоплодная беременность — плацента увеличена в размере и требует усиленного питания. Иногда кровоток переходит от одного плода к другому.
Подобные изменения называются фетотрансфузионным синдромом. Донор имеет меньшую массу тела. А у реципиента образуется повышенная нагрузка на формирующееся сердце. Проблемы возникают у обоих малышей.
Из заболеваний женщины наиболее опасны:
- Острые инфекции в период беременности — возбудители могут проникать через плацентарный барьер и разрушать сосудистую сеть.
- Пороки развития матки — наиболее значимым является «двурогая» матка. Внутри полости имеется перегородка, делящая ее на 2 части. Беременность возможна только в одной из них. Главным нарушением является не фактор сдавления (полость имеет возможность достаточно растягиваться), а отсутствие связи между маточными артериями, недостаточное развитие сети сосудов, гипоксия плаценты.

- Эндометриозы — изменения внутренней оболочки матки, возникают после воспалительных заболеваний (в том числе половых инфекций), частых абортов, диагностических выскабливаний. Одна из причин — курение и алкоголь.
- Опухоль матки — если у женщины имеется даже небольшая миома (доброкачественная опухоль), то беременность стимулирует рост узлов. Они забирают на себя часть кровоснабжения, а кровоток плода «обкрадывается». Недостаточность напрямую зависит от величины опухоли.
- Сахарный диабет — поражает стенки сосудов, часто возникает у женщины с факторами риска при беременности.
Последствия
Плацентарная недостаточность несет опасность для развития плода. Поэтому основные акушерские осложнения как раз и касаются состояния будущего ребенка. Наибольшую опасность несут выраженные нарушения кровотока, которые могут иметь как хроническое, так и острое течение. В этом контексте не упоминаются 1а и 1б степени гемодинамических нарушений, как наиболее легкие.
Отслойка плаценты
Внезапные нарушения кровотока могут провоцироваться травмами, тромбозами или эмболиями маточной артерии. Тогда возникает ситуация, когда плацента отслаивается на одном из участков. В зависимости от его расположения, патология протекает по центральному или периферическому типу. При этом появляются такие симптомы:
Тогда возникает ситуация, когда плацента отслаивается на одном из участков. В зависимости от его расположения, патология протекает по центральному или периферическому типу. При этом появляются такие симптомы:
- Боль в области отслойки.
- Локальное выпячивание стенки матки.
- Кровянистые выделения.
- Усугубление состояния плода.
Если отслойка идет по центральному типу, то внешних выделений может и вовсе не быть, однако кровь просачивается в стенку матки, из-за чего она теряет свою сократимость. Это чревато атоническим кровотечением и диссеминированным свертыванием крови (ДВС-синдромом).
Невынашивание беременности
В свою очередь, отслойка плаценты вызывает самопроизвольный аборт или преждевременные роды, что входит в понятие невынашивания беременности. Это ситуация, которой, очевидно, боятся все женщины, ведь потерять ребенка – самое страшное, что может случиться в этот период. Тогда выявляются следующие признаки:
- Боли внизу живота, в области крестца, прямой кишки.

- Кровянистые выделения различной интенсивности.
- Учащение мочеиспускания.
- Гипертонус матки.
- Постепенное раскрытие шейки матки.
Если процесс остановить на стадии угрозы, то ребенка удастся сохранить. Но когда плацента полностью отслоилась, и диагностирован аборт в ходу, что-то исправить, к сожалению, уже нельзя. В дальнейшем патология может иметь полный или неполный характер. Когда части плода или оболочки задержались в полости матки, возникает опасность инфицирования и сильного кровотечения, которое часто оканчивается геморрагическим шоком или ДВС-синдромом.
Замершая беременность
Кроме того, плод может погибнуть, оставшись в полости матки. Тогда формируется так называемая замершая беременность. Женщина и сама может отметить некоторые симптомы, которые говорят о произошедшем:
- Прекращаются движения плода.
- Не ощущается его сердцебиение.
- Живот не увеличивается в объеме.
- Периодически возникают кровянистые выделения.

- Беспокоят боли в животе.
- Повышается температура тела.
- Присоединяется инфекция.
Кровоток при беременности: норма
Терапевтическая тактика зависит от степени патологического процесса и патогенеза нарушений. Лечить медикаментозными средствами это заболевание можно только при первой степени нарушения кровообращения. Вторую степень принято считать пограничной. Если патология достигла третьей степени, показано хирургическое вмешательство. Какой метод лечения выбрать, врач решает в индивидуальном порядке.
Лечебная тактика основа на комплексном воздействии на все элементы гемодинамического процесса:
- При незначительных отклонениях от нормы используется Хофитол. При выраженных симптомах пациентке назначаются препараты с более активными действующими компонентами (Пентоксифарм, Актовегин) (см. также: Актовегин: инструкция по применению при беременности).
- При диагностировании у беременной женщины склонности к образованию тромбов применяются лекарственные средства, способные улучшить проходимость крови по кровяным сосудам (Курантил).

- Для расширения сосудов перорально используются Дротаверин или Но-Шпа, Эуфиллин применяется в виде инъекций.
- При маточном гипертонусе показано капельное введение магнезии и энтеральное применение Магне В6.
- Негативные последствия нарушения кровообращения необходимо устранять с помощью аскорбиновой кислоты, токоферола, которые обладают антиоксидантным эффектом.
Лекарственные препараты назначаются лечащим врачом. Категорически запрещено заниматься самолечением. Если выбранная лечебная тактика не способствует улучшению самочувствия, пациентке показано стационарное лечение. Такая мера позволит осуществлять постоянный врачебный контроль за состоянием будущей роженицы и плода.
При выраженных признаках патологии (2 и 3 степени МПК) прибегают к экстренному родоразрешению. В ситуациях, когда консервативная терапия не дала ожидаемого результата, включая ту, коорая проводилась при диагностированной 1 степени нарушения кровотока, решение о дальнейших действиях принимается в ближайшие 48 часов.
Многие женщины, особенно те, которые вынашивают первенца, не подозревают о существовании такого исследования, как допплерометрия. Оно заключается в ультразвуковой диагностике, которая способна оценить интенсивность кровотока в разных сосудах.
Это исследование, в основном, проводят в третьем триместре беременности. Но в некоторых случаях к нему прибегают и после двадцатой недели вынашивания ребенка. Допплерометрия считается серьезным исследованием, которое позволяет диагностировать патологию сосудов в матке и в плаценте, в мозговой и сонной артериях и аорте плода.
Существуют утвержденные нормы допплерометрии, начиная со второго триместра беременности. Это нормы индекса резистентности сосудов матки, пуповины, аорты и мозговой артерии плода. Врачи рекомендуют не пытаться расшифровывать полученные результаты самостоятельно.
Что делать для предупреждения патологии — профилактические меры
Лучшая профилактическая мера патологии гемодинамики между организмом матери и развивающимся ребенком — соблюдение принципов здорового образа жизни. От вредных привычек, которые были у женщины до зачатия, необходимо полностью отказаться.
От вредных привычек, которые были у женщины до зачатия, необходимо полностью отказаться.
Важный фактор в здоровом развитии крохи — правильное сбалансированное питание матери, употребление продуктов, богатых витаминами и минералами, а также микроэлементами, улучающими работу сердечно-сосудистой системы.
Выполнение простых гимнастических упражнений поможет поддерживать хорошее самочувствие и оптимальную работу всех систем организма будущей мамы.
Имеет значение в предотвращении патологии то, с какой скорость в процессе беременности идет прибавка в весе у женщины. Она должна соответствовать изначальному весу женщины до зачатия, строению ее тела и сроку беременности. Превышать показатели нормы не желательно.
Важнее всех профилактических мер считается своевременная постановка на учет, проведение всех плановых диагностических методик исследования для обнаружения отклонений в кровоснабжении малыша, а также вовремя скорректированная тактика наблюдения беременности и родоразрешения.
Миопия: можно ли рожать самой?
Возможность самостоятельных родов при наличии миопии часто ставится под сомнение акушерами-гинекологами. От чего же зависит метод родоразрешения? Можно ли рожать самой при зрении, например, минус 5 и 6?
Раньше считалось, что при минусовом зрении нельзя рожать самой. На сегодняшний день большинство женщин при миопии рожают сами.
Основное значение в выборе способа родоразрешения отводится состоянию сетчатки, а не величине миопии.
Миопия 1 степени, как правило, не сопровождается никакими изменениями на ретине. У таких женщин нет противопоказаний к родам естественным путем.
Если же миопия 2 степени при беременности, то, как рожать, решается после детального изучения состояния глазного дна, так как средняя степень близорукости повышает риск развития периферических дистрофий сетчатки.
Естественные роды при средней степени минусового зрения возможны в следующих случаях:
- отсутствует периферическая дистрофия на глазном дне;
- нет разрывов сетчатки;
Раньше всех женщин с миопией 3 степени кесарили. Сейчас этот подход пересмотрен. Пациенткам с высокой степенью близорукости, необходим тщательный осмотр периферии глазного дна. Естественные роды при высокой степени миопии возможны при соблюдении следующих условий:
Сейчас этот подход пересмотрен. Пациенткам с высокой степенью близорукости, необходим тщательный осмотр периферии глазного дна. Естественные роды при высокой степени миопии возможны при соблюдении следующих условий:
- нет ПХРД или ПВХРД;
- нет разрывов на сетчатке;
- нет локальной бессимптомной отслойки сетчатки.
Как же быть, если обнаружена периферическая дистрофия сетчатки?
ПХРД бывает двух видов: «опасная» и «не опасная». Степень «опасности» ПХРД определяет лазерный хирург.
Если при осмотре, выявленные изменения относятся к «не опасным» и, следовательно, лазерное лечение не требуется, то возможно родоразрешение естественным путем, желательно с укорочением потужного периода.
Обнаружение «опасной» дистрофии требует проведения ограничительной лазеркоагуляции сетчатки. Если ЛКС проведена до родов, то родоразрешают с укорочением потужного периода, если ЛКС не проведена – кесарево сечение.
Исключить потужной период в родах при миопии, то есть провести кесарево сечение, возможно в следующих случаях:
- наличие «опасной», не оперированной лазером дистрофии;
- наличие локальной бессимптомной отслойки сетчатки;
- ранее оперированная отслойка сетчатки.

Окончательное решение о способе родоразрешения выносит акушер-гинеколог на основании данных гинекологического и акушерского осмотра, консультаций специалистов, анализа данных лабораторных и инструментальных методов обследования.
Юлия Чернова, врач-офтальмолог, специально для Mirmam.pro
Виды нарушения кровотока в плаценте
Различают фетоплацентарную (между плодом и плацентой) недостаточность и маточно-плацентарную.
Фетоплацентарная гипоксия может протекать как:
- Острая недостаточность — возникает в любом периоде беременности и в ходе родовых схваток. Вызывает преждевременную отслойку плаценты, тромбозы сосудов, инфаркт в зоне плаценты, кровоизлияния. Способна вызвать смерть ребенка.
- Хроническая — встречается чаще, развивается со второго триместра, но проявляется только в третьем. Изменения плаценты носят характер преждевременного старения, на поверхности ворсин откладывается фибрин. Проницаемость резко сокращается, что провоцирует гипоксию плода.

На фоне развития хронической плацентарной недостаточности можно выделить стадии:
- компенсации — течение благоприятное, поскольку срабатывают защитные механизмы материнского организма и компенсируют малышу недостающее питание, лечение эффективно, ребенок рождается в срок, здоровым;
- субкомпенсации — материнский организм не в состоянии полностью компенсировать «убыточное» кровоснабжение плода, необходимо полноценное лечение, ребенок может родиться с осложнениями, отстает в развитии;
- декомпенсации — патология развивается бурно, компенсационных механизмов недостаточно, у плода нарушается деятельность сердца, возможна внутриутробная гибель;
- критическая стадия — отличается выраженными структурными изменениями в плаценте, что нарушает ее функции, терапия не может изменить состояние плода, гибель неизбежна.
Современные аспекты диагностики и лечения синдрома задержки роста плода uMEDp
Синдром задержки роста плода (СЗРП) является актуальной проблемой перинатологии. Эта патология оказывает влияние не только на внутриутробное состояние плода, но и на последующее развитие ребенка и становление всех функций его организма. Многочисленными исследованиями доказано, что имеется взаимосвязь между массо-ростовыми параметрами новорожденного и его дальнейшим физическим, психомоторным и неврологическим развитием не только в момент появления на свет, но и спустя много лет (1, 3, 4, 8, 11, 12).
Эта патология оказывает влияние не только на внутриутробное состояние плода, но и на последующее развитие ребенка и становление всех функций его организма. Многочисленными исследованиями доказано, что имеется взаимосвязь между массо-ростовыми параметрами новорожденного и его дальнейшим физическим, психомоторным и неврологическим развитием не только в момент появления на свет, но и спустя много лет (1, 3, 4, 8, 11, 12).
По сведениям отечественных авторов СЗРП в акушерской практике встречается у 5-17,6% пациентов, причем частота СЗРП у недоношенных детей выше и составляет 15,7-22%, так как причины и патогенетические механизмы патологических состояний, приводящих к преждевременным родам и СЗРП часто совпадают (13, 15, 18, 21).
Чаще патогенетическим аспектом в развитии СЗРП является плацентарная недостаточность – морфофункциональные изменения в фетоплацентарной системе, приводящие к нарушению плодово-плацентарной гемодинамики, транспорта кислорода и питательных веществ к плоду, изменению метаболизма и эндокринной регуляции. Учитывая тесную взаимосвязь биологических процессов, происходящих в плаценте и в организме плода, основой развития СЗРП в большинстве случаев является хроническая фетоплацентарная недостаточность (7, 9, 10, 14, 15, 19). Скрининговое исследование, проводимое в 30-34 недели беременности, позволяет обнаружить максимальное количество случаев СЗРП, обусловленных плацентарной недостаточностью. Эффективность скринингового обследования повышается при оценке нескольких обязательных компонентов: фетометрии, плацентографии и оценки околоплодных вод. Определение маточно-плодово-плацентарного кровотока с помощью допплерометрии и признаков страдания плода при КТГ дает возможность объективно оценить состояние плода, степень тяжести его внутриутробного страдания, а также компенсаторные возможности в условиях хронической гипоксии (1, 2. 5, 6, 20).
Учитывая тесную взаимосвязь биологических процессов, происходящих в плаценте и в организме плода, основой развития СЗРП в большинстве случаев является хроническая фетоплацентарная недостаточность (7, 9, 10, 14, 15, 19). Скрининговое исследование, проводимое в 30-34 недели беременности, позволяет обнаружить максимальное количество случаев СЗРП, обусловленных плацентарной недостаточностью. Эффективность скринингового обследования повышается при оценке нескольких обязательных компонентов: фетометрии, плацентографии и оценки околоплодных вод. Определение маточно-плодово-плацентарного кровотока с помощью допплерометрии и признаков страдания плода при КТГ дает возможность объективно оценить состояние плода, степень тяжести его внутриутробного страдания, а также компенсаторные возможности в условиях хронической гипоксии (1, 2. 5, 6, 20).
Наличие анатомических особенностей строения и даже аномалий развития плаценты не должны отождествляться с понятием плацентарной недостаточности, но должны явиться поводом к проведению углубленного комплексного обследования плода. Диагноз СЗРП, поставленный только на основании результатов эхографического исследования, не является полным. Отставание фетометрических данных от гестационного срока при отсутствии пороков развития может быть обусловлено конституциональными особенностями плода и не требовать специального лечения и изменения акушерской тактики. Обязательным этапом в комплексном обследовании плода после установления эхографического диагноза СЗРП является функциональное исследование и оценка компенсаторных возможностей системы «мать-плацента-плод». Для комплексной оценки состояния фетоплацентарной системы при подозрении на СЗРП во всех случаях необходимо использовать допплерографию. Допплерографическое исследование в акушерстве целесообразно проводить не ранее 16-18 недель беременности. При сроке от 18-19 до 25-26 недель допплерометрия – метод выбора, т.к. биофизический профиль плода информативен с 26 недель, а кардиотокография еще не показательна.
Диагноз СЗРП, поставленный только на основании результатов эхографического исследования, не является полным. Отставание фетометрических данных от гестационного срока при отсутствии пороков развития может быть обусловлено конституциональными особенностями плода и не требовать специального лечения и изменения акушерской тактики. Обязательным этапом в комплексном обследовании плода после установления эхографического диагноза СЗРП является функциональное исследование и оценка компенсаторных возможностей системы «мать-плацента-плод». Для комплексной оценки состояния фетоплацентарной системы при подозрении на СЗРП во всех случаях необходимо использовать допплерографию. Допплерографическое исследование в акушерстве целесообразно проводить не ранее 16-18 недель беременности. При сроке от 18-19 до 25-26 недель допплерометрия – метод выбора, т.к. биофизический профиль плода информативен с 26 недель, а кардиотокография еще не показательна.
Изменение нормальных показателей допплерометрии есть неспецифическое проявление многих патологических состояний плода, причем во многих случаях предшествующих появлению клинических симптомов, важно, что это относится и к основным патологическим состояниям при беременности – СЗРП, гипоксии плода, гестозу и др. (14, 16, 17, 19, 21).
(14, 16, 17, 19, 21).
Не все формы плацентарной недостаточности сопровождаются существенными изменениями маточно-плацентарного и плацентарно-плодового кровотока. С этим, по-видимому, связано большинство ложноотрицательных результатов. Гипердиагностика СЗРП ведет и к увеличению числа пренатальных исследований, и к необоснованной лекарственной интервенции в фетоплацентарный комплекс, а также к активизации акушерской тактики и негативному воздействию на психику пациентки.
Поэтому следует подчеркнуть необходимость комплексного учета данных трех основных взаимодополняющих методов исследования: эхографии, кардиотокографии и допплерометрии.
Диагностическая значимость допплерометрии в маточной артерии и в артериях пуповины плода достоверна только при нарушении кровотока, при патологических кривых скоростей кровотока. Однако при нарушении кровотока различной степени и несоответствии размеров плода сроку беременности (при подозрении на симметричную форму гипотрофии) этот метод может использоваться для дифференциальной диагностики со здоровым маловесным плодом. Наличие нормального кровотока при небольшом по размерам плоде в большинстве случаев будет говорить о наличии здорового маловесного плода.
Наличие нормального кровотока при небольшом по размерам плоде в большинстве случаев будет говорить о наличии здорового маловесного плода.
Цель исследования
Изучить влияние терапии Актовегином при СЗРП на состояние фетоплацентарного комплекса у беременных по данным фетометрии и допплерометрии.
Материалы и методы
Нами было проведено комплексное динамическое обследование 22 (100%) беременных женщин в сроке беременности 30-32 недели с СЗРП на базе Клинического родильного дома № 26 г. Москвы. Возраст беременных колебался от 18 до 35 лет и составил в среднем 25,6 +/- 4,2 года.
Исследования фетоплацентарной системы проводили при помощи эхографии и допплерометрии в 30-32 недели. Для коррекции метаболических изменений проводилась терапия препаратом Актовегин по 1 табл. 3 раза в день в течение 2 недель, после чего проводили контрольное исследование.
Исследования выполнены с помощью ультразвукового диагностического прибора «ALOKA SSD-5500 ProSound» (Япония). Комплексное ультразвуковое исследование включало фетометрию, плацентографию, оценку количества и качества околоплодных вод. Оценивали соответствие результатов фетометрии нормативным для данного срока беременности. Структуру плаценты расценивали как соответствующую ее нормальному состоянию в случае, если степень ее зрелости (согласно классификации Crannum P. и соавт., 1979) и толщина соответствовали сроку беременности, отсутствовали патологические включения в ее структуре, а расположение плаценты было нормальным. Определение изучаемых показателей проводили по известным методикам.
Комплексное ультразвуковое исследование включало фетометрию, плацентографию, оценку количества и качества околоплодных вод. Оценивали соответствие результатов фетометрии нормативным для данного срока беременности. Структуру плаценты расценивали как соответствующую ее нормальному состоянию в случае, если степень ее зрелости (согласно классификации Crannum P. и соавт., 1979) и толщина соответствовали сроку беременности, отсутствовали патологические включения в ее структуре, а расположение плаценты было нормальным. Определение изучаемых показателей проводили по известным методикам.
Для оценки маточно-плодово-плацентарного кровотока в артерии пуповины и маточных артериях проводилось допплерометрическое исследование. В спектре артериальных сосудов определяли общепринятый уголнезависимый показатель сосудистой резистентности: систоло-диастолическое отношение (СДО).
По возрасту и паритету беременные женщины были сопоставимы.
Результаты исследования
При интерпретации данных ультразвукового исследования мы исходили из того, что полученная информация является отражением состояния фетоплацентарной системы и ее компенсаторно-приспособительных реакций на момент исследования. Фетометрические данные, структура плаценты и объем околоплодных вод определяются как маркеры стабильности фетоплацентарной системы, т.е. отражают степень стабильности, соответствия сроку беременности в процессе формирования и развития.
Фетометрические данные, структура плаценты и объем околоплодных вод определяются как маркеры стабильности фетоплацентарной системы, т.е. отражают степень стабильности, соответствия сроку беременности в процессе формирования и развития.
Из всех обследуемых беременных женщин 22 (100%), у 18 (81,8%) пациенток имело место СЗРП асимметричной формы, а у 4 (18,2%) – симметричной формы. Причем у 19 (86,4%) отставание параметров фетометрии от нормативных для данного срока беременности составляет 2 недели, что соответствует I степени СЗРП, а у 3 (13,6%) – более 2 недель, что соответствует II степени СЗРП. Чаще выявляется СЗРП I степени – 16 (88,9%) случаев при ассиметричной форме СЗРП и 3 (75%) – при симметричной.
Из всех обследуемых беременных при комплексном обследовании эхо-признаки преждевременного созревания плаценты выявлены в 12 (54,5%) случаях. Многоводие и маловодие при этом наблюдалось практически в одинаковом количестве случаев – 3 (13,6%) и 4 (18,2%) соответственно.
При исследовании маточно-плодово-плацентарного кровотока мы получили следующие данные: в 6 (27%) случаях кровоток был не нарушен, нарушение маточно-плацентарного кровотока (IА степени) было выявлено в 5 (23%) случаях, нарушение плодово-плацентарного кровотока (IБ степени) отмечалось в 8 (36%) случаях и нарушение маточно-плодово-плацентарного кровотока II степени – в 3 (14%) случаях.
Причем при симметричной форме СЗРП патологические показатели кровотока были выявлены во всех случаях: IА степени – 1(25%), IБ степени – 2 (50%), II степени – 1 (25%). Тогда как при асимметричной форме в трети случаев – 6 (33,3%) – значения кровотока регистрировались в пределах нормы, нарушение маточно-плацентарного кровотока (IА степени) – 4 (22,2%), нарушение плодово-плацентарного кровотока (IIБ степени) – 6 (33,3%) и нарушение кровотока II степени – 2 (11,1%).
У 12 беременных определялись эхо-признаки преждевременного созревания плаценты, причем при симметричной степени СЗРП – во всех случаях: 4 (100%), а при асимметричной – 8 (44,4%). Нормальные показатели кровотока в случаях с преждевременным созреванием плаценты регистрировались у 2 (16,7%) беременных. Нарушение кровотока при преждевременном созревании плаценты наблюдалось чаще и составило 10 (83,3%) случаев, причем преимущественно отмечалось повышение резистентности маточных артерий – 6 (50%), тогда как повышение резистентности в артерии пуповины отмечалось в 2 (16,7%) случаев изолированно и в 2 (16,7%) – совместно с повышением резистентности в маточной артерии, что характеризует нарушение маточно-плодово-плацентарного кровотока II степени.
Нормальные показатели кровотока в случаях с преждевременным созреванием плаценты регистрировались у 2 (16,7%) беременных. Нарушение кровотока при преждевременном созревании плаценты наблюдалось чаще и составило 10 (83,3%) случаев, причем преимущественно отмечалось повышение резистентности маточных артерий – 6 (50%), тогда как повышение резистентности в артерии пуповины отмечалось в 2 (16,7%) случаев изолированно и в 2 (16,7%) – совместно с повышением резистентности в маточной артерии, что характеризует нарушение маточно-плодово-плацентарного кровотока II степени.
При СЗРП в результате снижения компенсаторных возможностей фетоплацентарной системы достоверно чаще встречается нарушение маточно-плодово-плацентарного кровотока, тогда как нормальный кровоток регистрировался в трети случаев. Если учитывать сочетание преждевременного созревания плаценты и СЗРП, то случаев нарушения кровотока в 5 раза больше по сравнению с нормальными показателями – 10 (83,3%) и 2 (16,7%) соответственно/
Всем беременным назначалась терапия препаратом Актовегин по 1 табл. 3 раза в день в течение 2 недель, после чего было проведено контрольное обследование с целью оценки эффективности терапии и для решения вопроса о дальнейшей тактике ведения беременных в соответствии с полученными результатами.
3 раза в день в течение 2 недель, после чего было проведено контрольное обследование с целью оценки эффективности терапии и для решения вопроса о дальнейшей тактике ведения беременных в соответствии с полученными результатами.
Терапия Актовегином была назначена в связи с тем, что этот препарат активизирует обмен веществ в плаценте, улучшает микроциркуляторные процессы в плацентарной ткани, нормализует кровообращение в плацентарных сосудах, улучшает реологические и коагуляционные свойства крови в системе «мать-плацента-плод», вследствие чего улучшаются метаболические процессы и регулируется энергообеспечение тканей.
Активное вещество Актовегина представляет собой депротеинизированный гемодериват из телячьей крови с низкомолекулярными пептидами и дериватами нуклеиновых кислот. Актовегин стимулирует клеточный метаболизм путем увеличения транспорта и накопления глюкозы и кислорода и усиления его внутриклеточной утилизации. Эти процессы приводят к ускорению метаболизма АТФ и повышению энергетических ресурсов клетки. Вторичным эффектом является улучшение микроциркуляции и кровоснабжения ишемизированных тканей. Поглощение клеткой большего количества кислорода приводит к активации процессов аэробного окисления, что увеличивает энергетический потенциал тканей. Доказано, что эффекты Актовегина наиболее выражены при гипоксическом характере повреждения тканей.
Вторичным эффектом является улучшение микроциркуляции и кровоснабжения ишемизированных тканей. Поглощение клеткой большего количества кислорода приводит к активации процессов аэробного окисления, что увеличивает энергетический потенциал тканей. Доказано, что эффекты Актовегина наиболее выражены при гипоксическом характере повреждения тканей.
Стимулируя аэробное окисление, Актовегин улучшает перфузию глюкозы в плаценте, повышает доставку кислорода, нормализует показатели гемодинамики и обладает выраженным влиянием на белковый обмен плода.
Полученные результаты при контрольном исследовании через 2 недели приема препарата свидетельствовали о терапевтическом эффекте Актовегина при лечении СЗРП. После курса лечения соответствие результатов фетометрии нормативным для данного срока беременности отмечалось у 18 (82%) беременных, причем полностью адекватный рост плода определялся в 10 (48%) случаях, а незначительное отставание параметров фетометрии в пределах одной недели – у 8 (36%) беременных. Отставание фетометрических параметров в клинически значимых значениях (более 2 недель) было отмечено в 4 (18%) случаях. Во всех случаях СЗРП при контрольном обследовании отмечена положительная динамика, но требовалось продолжение лечения более длительным курсом.
Отставание фетометрических параметров в клинически значимых значениях (более 2 недель) было отмечено в 4 (18%) случаях. Во всех случаях СЗРП при контрольном обследовании отмечена положительная динамика, но требовалось продолжение лечения более длительным курсом.
Анализ результатов допплерометрического исследования выявил значительное улучшение кровотока после курса проведенного лечения. В 15 (68%) случаях кровоток не был нарушен; нарушение маточно-плацентарного кровотока (IА степени) было выявлено в 6 (27%) случаях, нарушение плодово-плацентарного кровотока (IБ степени) отмечалось в 1 (5%) случае. Нарушение маточно-плодово-плацентарного кровотока II степени после лечения выявлено не было.
Таким образом, применение препарата Актовегин способствует уменьшению патологических изменений в плаценте и адекватному росту и развитию плода, а также улучшает общее состояние беременных.
Гемодинамические изменения в системе «мать-плацента-плод» при СЗРП универсальны, однотипны и не зависят от природы ведущего этиологического фактора.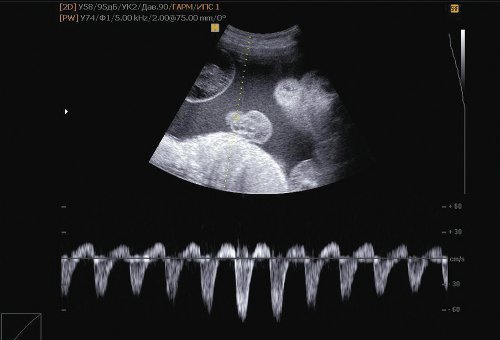 Адекватная оксигенация плода возможна только при неизмененном состоянии маточно-плодово-плацентарного кровотока. Применение Актовегина при осложненном течении беременности позволяет улучшить состояние матери и внутриматочное развитие плода, создается возможность для пролонгирования беременности и улучшения показателей перинатальной смертности и заболеваемости новорожденных.
Адекватная оксигенация плода возможна только при неизмененном состоянии маточно-плодово-плацентарного кровотока. Применение Актовегина при осложненном течении беременности позволяет улучшить состояние матери и внутриматочное развитие плода, создается возможность для пролонгирования беременности и улучшения показателей перинатальной смертности и заболеваемости новорожденных.
Целесообразно при сроке беременности 30-32 недели проводить скрининговое обследование беременных женщин с целью выявления адекватного роста плода по соответствию нормативным данным фетометрии гестационному сроку и функционального состояния плода. Фундаментальный принцип антенатальной оценки функционального состояния плода: точность диагностики с помощью различных методов тем выше, чем больше параметров биофизической активности плода принимается во внимание при его обследовании.
Комплексное обследование беременной при диагностики СЗРП:
- определить форму и степень тяжести СЗРП по данным фетометрии;
- оценить степень функциональных и структурных изменений в фетоплацентарной системе и ее адаптационно-приспособительные возможности, с помощью кардиотокографии и/или допплерометрии с учетом срока беременности;
- установить вероятные этиологические факторы и патогенетические механизмы развития СЗРП.

На основании полученных данных можно достоверно оценить прогноз и соответственно определить дальнейшую тактику ведения беременности и родов.
Плацентарная недостаточность :: ТРУДНЫЙ ПАЦИЕНТ
академик РАМН профессор В.Н. Серов
Научный центр акушерства гинекологии и перинатологии РАМН, Москва
Плацентарная недостаточность (ПН) является проявлением ряда заболеваний, нередко являющихся причиной внутриутробной гибели плода с последующим самопроизвольным выкидышем, рождением мертвого ребенка.
Наиболее показательным в отношении внутриутробной гибели плода является привычное невынашивание беременности и преждевременные роды. При привычном невынашивании плод, как правило, вначале погибает, после чего наступает выкидыш. Лишь при истмико-цервикальной недостаточности плод рождается живым. Изучение причин привычного невынашивания беременности претерпевает существенную динамику. Постоянно выясняется существенная роль аутоиммунных нарушений (антифосфолипидный синдром, анти-ХГ-синдром, наличие антител к прогестерону, фосфолипидам), гестоза, генетических аномалий.
Роль острой вирусной инфекции при беременности, как причина поражения плода и потери беременности, никем не отрицается. Однако частота острой вирусной инфекции невелика и составляет 1-1,5 %. Бактериальная инфекция, в частности хронический эндометрит, хроническая урогенитальная инфекция (пиелонефрит, кольпит), как причина ПН и внутриутробной гибели плода остается недоказанной.
Носительство вирусной инфекции, особенно герпетической, способствует образованию антифосфолипидных антител и в последующем возможному развитию антифосфолипидного синдрома.
Ранее мы изучали на большой группе (более 1200 беременных) течение беременности и родов при наличии IgG и IgM антител к герпесу, цитомегаловирусу, гепатиту А, В, С. Было отмечено, что герпетическая инфекция в 16-25 % случаев сопровождалась осложнениями со стороны плода в виде внутриутробной гибели и самопроизвольного прекращения беременности, в том числе и преждевременными родами, гипотрофией плода и мертворождениями. Аномалий развития плода также оказалось больше в 1,5 раза по сравнению с популяционными показателями.
У беременных, инфицированных вирусами различных форм гепатита, выявлено повышенное количество гестозов, преждевременных родов, слабости родовой деятельности. Однако самопроизвольных выкидышей и внутриутробной гибели плода не было. В дальнейшем мы обследовали группу женщин, ранее перенесших повторные самопроизвольные выкидыши, и обнаружили у 35 % из них наличие антител к фосфолипидам. Таким образом, можно считать причиной самопроизвольных прерываний беременности и внутриутробной гибели плода не латентную герпетическую инфекцию, а антифосфолипидный синдром.
В определенной степени можно предположить, что причинами гипотрофии плода, ПН у беременных с гестозом также являются антифосфолипидные антитела, так как преэклампсия чаще всего развивается на фоне антифосфолипидного синдрома.
Ведущими признаками определения ПН являются ультразвуковая биометрия плода, определение кровотока в сосудах плаценты и плода, определение хорионического гонадотропина и плацентарного лактогена. Наиболее ранними проявлениями, еще до заметной задержки развития плода, являются нарушения кровообращения в фетоплацентарном комплексе.
Наиболее ранними проявлениями, еще до заметной задержки развития плода, являются нарушения кровообращения в фетоплацентарном комплексе.
В клинической практике наиболее часто выделяют первичную и вторичную ПН. При первичной ПН структурные изменения обнаруживаются в строении, расположении и прикреплении плаценты и создании ворсин хориона.
Вторичная ПН развивается во II-III триместрах беременности на фоне сформировавшейся плаценты и осложненного течения беременности и характеризуется инволюционно-дистрофическими и воспалительными ее изменениями. Как первичная, так и вторичная ПН могут иметь острое и хроническое течение.
В развитии острой ПН важную роль играют нарушения маточно-плацентарного кровообращения. Острая ПН чаще развивается на фоне обширных инфарктов и преждевременной отслойки нормально расположенной плаценты, вследствие чего наступает гибель плода и прерывание беременности. Нередко обширные кровоизлияния и отслойка плаценты развиваются при катастрофическом фосфолипидном синдроме.
Хроническая ПН возникает в результате нарушения компенсаторно-приспособительных механизмов в сочетании с циркуляторными расстройствами и инволюционно-дистрофическими процессами [1-4].
В клинической практике важно различать относительную и абсолютную ПН.
При сохранении компенсаторных реакций в плаценте ее недостаточность не нуждается в лечении. В этих случаях беременность может закончиться своевременными родами здоровым ребенком. Однако возможна и внутриутробная задержка развития плода, которую следует выявить при динамическом наблюдении.
Наиболее тяжелой формой является абсолютная недостаточность плаценты, свидетельствующая об истощении ее компенсаторных механизмов. Эта форма патологии сопровождается синдромом задержки развития плода и гипоксией, вплоть до его внутриутробной гибели. Беременность у таких женщин протекает на фоне угрожающего аборта или преждевременных родов. В клинической практике наблюдаются переходные виды ПН.
Выделяют основные формы хронической недостаточности плаценты:
нарушение питательной функции (трофическая недостаточность), при которой нарушается всасывание и усвоение питательных продуктов, также синтез собственных продуктов обмена веществ плода;
дыхательную недостаточность, заключающуюся в нарушении транспорта кислорода и углекислоты.

Две формы нарушения функции плаценты могут существовать самостоятельно или сочетаться друг с другом. Они могут лежать в основе патогенеза как первичной, так и вторичной ПН.
К основным звеньям патогенеза ПН относятся нарушения маточно-плацентарного и плодово-плацентарного кровообращения, метаболизма, синтетической функции и состояния клеточных мембран плаценты. Патология маточно-плацентарного кровообращения характеризуется тремя важнейшими моментами: нарушением притока крови в межворсинчатое пространство, затруднением оттока крови из него и изменениями реологических и коагуляционных свойств крови матки.
Результаты изучения системных изменений при хронической ПН указывают на то, что к числу наиболее важных патофизиологических изменений в организме беременной относится гиповолемия и снижение перфузии органов. При этом возрастает чувствительность сосудистых элементов к циркулирующим прессорным агентам и происходит активация коагуляционного каскада, что ведет к одновременному снижению перфузии межворсинчатого пространства [1, 2, 3, 5].
Большая роль в нарушении гемодинамики плаценты принадлежит реокоагуляционным расстройствам. Известно, что изменения гемостаза, в частности гиперкоагуляция, занимает особое место в патогенезе ПН. Исходная физиологическая гиперкоагуляция крови, достигающая максимального развития к концу III триместра, обеспечивает локальный гемостаз в матке после родов. В динамике беременности в организме развивается гиперволемия и снижается периферическое сосудистое сопротивление. Эти механизмы носят адаптационно-защитный характер у здоровых беременных.
В случае же патологии, приводящей к активации системы гемостаза, они теряют свою защитную функцию и способствуют усугублению ПН [4-6]. При беременности с задержкой внутриутробного развития плода уменьшается количество проникающих в миометрий трофобластических элементов. Неполная инвазия трофобласта в спиральные артерии матери становится причиной недостаточности его перфузии и изменений секреции гуморальных факторов.
Основными направлениями для предупреждения развития и лечения ПН являются воздействия, направленные на улучшение маточно-плацентарного кровообращения и микроциркуляции, нормализацию газообмена в системе мать-плод, улучшение метаболической функции плаценты, восстановление нарушений функции клеточных мембран.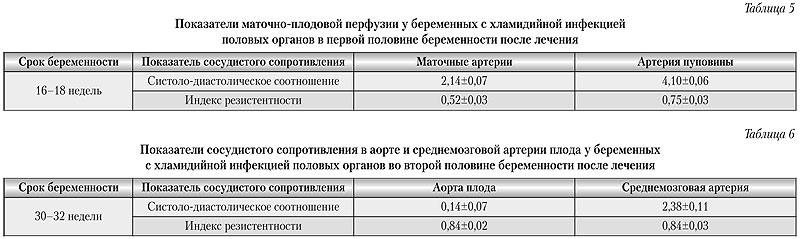 В последние годы значительно расширился арсенал лекарственных средств, назначаемых для предупреждения нарушений внутриутробного роста при ПН, сопровождающейся дефицитом кислородного снабжения плода.
В последние годы значительно расширился арсенал лекарственных средств, назначаемых для предупреждения нарушений внутриутробного роста при ПН, сопровождающейся дефицитом кислородного снабжения плода.
К числу лекарственных средств, оказывающих воздействие на сосудистый компонент маточно-плацентарного сосудистого бассейна, относятся препараты, клинический эффект которых обеспечивает снижение тонуса, амплитуды и сокращений матки, общего периферического сосудистого сопротивления, диастолического артериального давления, частоты сердечных сокращений без существенного снижения артериального давления. К данной группе препаратов относятся: фенотерол, тербуталин, Ритодрин, Гинипрал. При чрезмерной активности мускулатуры матки и острой гипоксии плода внутривенное введение -адреномиметиков способствует улучшению маточного плацентарного кровотока. Однако при гипоксии, развившейся на фоне ПН, сопровождающейся глубокими морфологическими изменениями в плаценте, эффект от применения препаратов данной группы не достигается.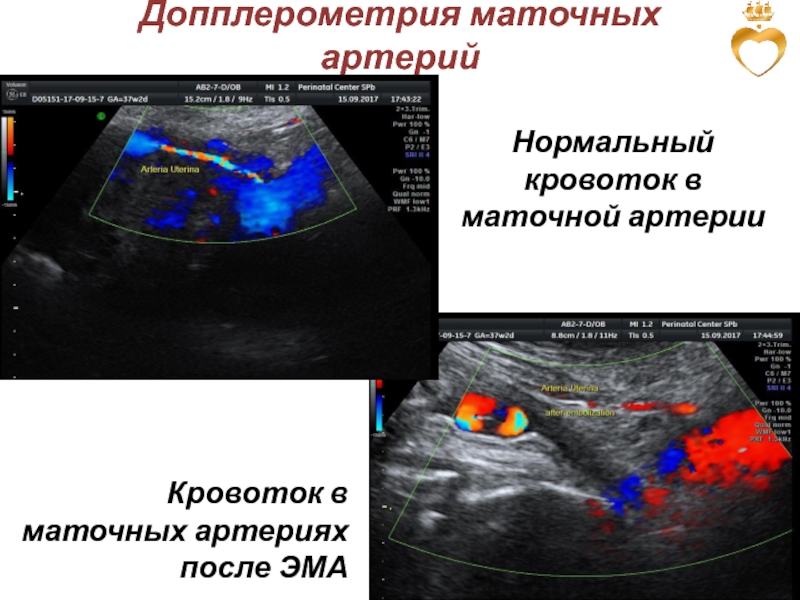 Фармакологический токолиз может оказывать благоприятное влияние на маточно-плацентарное кровообращение лишь при ПН функционального характера. Кроме того, применение данных препаратов при гиповолемии ограничено в связи с тем, что сосудорасширяющий эффект при низком систолическом артериальном давлении может способствовать снижению маточно-плацентарного кровотока. Для его улучшения используют внутривенные инфузии реополиглюкина, декстранов.
Фармакологический токолиз может оказывать благоприятное влияние на маточно-плацентарное кровообращение лишь при ПН функционального характера. Кроме того, применение данных препаратов при гиповолемии ограничено в связи с тем, что сосудорасширяющий эффект при низком систолическом артериальном давлении может способствовать снижению маточно-плацентарного кровотока. Для его улучшения используют внутривенные инфузии реополиглюкина, декстранов.
В связи с тем что в развитии хронической ПН существенное место занимают морфофункциональные изменения в плаценте в виде микротромбозов, гематом и инфарктов, мероприятия, направленные на улучшение реологических свойств крови, могут способствовать нормализации периферического кровотока, в том числе в бассейне маточно-плацентарного круга кровообращения. К ним относится применение гепарина, а в последнее время – низкомолекулярных фракций гепарина, например фраксипарина, который используется и в амбулаторных условиях.
В последние годы для лечения ПН стали применяться эфферентные методы лечения, в частности плазмаферез. Рекомендуют использовать ультрафиолетовое облучение крови, медицинский озон, лазерную терапию.
Рекомендуют использовать ультрафиолетовое облучение крови, медицинский озон, лазерную терапию.
При наступившей беременности наиболее перспективным является профилактика и лечение при ранних проявлениях ПН. Оправдано также лечение беременных с высоким риском ПН. В первую очередь, это беременные с внутриутробной инфекцией, гестозом, аутоиммунной патологией. Согласно нашим данным и сведениям литературы, эффективным методом лечения начальных проявлений у беременных с высоким риском ПН является применение антиагрегантов, в частности дипиридамола (Курантила).
Основу терапии ПН составляют мероприятия, направленные на улучшение маточно-плацентарного и фетоплацентарного кровотока. Препараты, применяемые с этой целью, расширяют сосуды, расслабляют мускулатуру матки, улучшают реологические свойства крови в системе мать-плацента-плод. Согласно последним научным данным ПН часто возникает при аутоиммунной патологии – антифосфолипидном синдроме, тромбоцитопатии. Кроме того, всегда ПН характеризуется тромбофилическим состоянием, длительно текущим ДВС-синдромом (диссеминированное внутрисосудистое свертывание крови). Особенно отчетливо тромбофилическое состояние проявляется образованием микротромбов в фетоплацентарном комплексе, нарушением микроциркуляции, гиповолемией, повышением периферического сосудистого сопротивления. Нарушения микроциркуляции, микротромбирование, ухудшение кислородной и трофической функции плаценты особенно отчетливо определяются при гестозе, внутриутробной инфекции, диабете, метаболическом синдроме, сердечно-сосудистых заболеваниях при беременности.
Особенно отчетливо тромбофилическое состояние проявляется образованием микротромбов в фетоплацентарном комплексе, нарушением микроциркуляции, гиповолемией, повышением периферического сосудистого сопротивления. Нарушения микроциркуляции, микротромбирование, ухудшение кислородной и трофической функции плаценты особенно отчетливо определяются при гестозе, внутриутробной инфекции, диабете, метаболическом синдроме, сердечно-сосудистых заболеваниях при беременности.
Следует обратить особое внимание на лечение ПН в начальных стадиях и профилактику ее при высоком риске развития ПН.
Беременные с высоким риском ПН – это больные гестозом, аутоиммунной патологией, особенно с антифосфолипидным синдромом, генетическими изменениями (мутация MTHFR C677T, мутация FV Zeiden, полиморфизм в гене ингибитора активатора плазминогена типа РАI-1, полиморфизм в гене фибриногена и др.), диабетом, метаболическим синдромом.
С целью профилактики ПН при высоком риске или начальных проявлениях вышеназванных заболеваний целесообразно в комплексе лечебных мероприятий использовать Курантил, обладающий антиагрегационными, ангиопротективными и иммуномоделирующими свойствами.
Курантил уменьшает периферическое сопротивление сосудов, расширяя артериолы и капилляры, улучшает микроциркуляцию, предупреждает артериальный тромбоз, нормализует венозный отток.
Курантил корригирует плацентарный кровоток, при гестозе предупреждает дистрофию плаценты, устраняет гипоксию плода, оказывает модулирующее действие на функциональную активность системы интерферона, повышает противовирусную резистентность.
Профилактические дозы Курантила при фетоплацентарной недостаточности составляют 25 мг 3 раза в сутки, лечебные дозы – 50 мг 3 раза в сутки.
По последним данным, учитывая роль сосудистых нарушений в патогенезе невынашивания, Курантил рекомендуется применять на ранних сроках беременности, начиная с первого триместра по 25 мг 3 раза в сутки курсами по 3-4 недели. Такие сроки необходимы, так как прием дипиридамола способствует индукции ангиогенеза сосудов плаценты.
Таким образом, ранняя диагностика НП и профилактическое лечение беременных из групп риска по развитию синдрома задержки развития плода позволяет предупредить декомпенсированные формы маточно-плацентарной дисфункции и довести беременность до благополучного исхода.
Литература
1. Афанасьева Н.В., Стрижаков А.Н. Исходы беременности и родов при фетоплацентарной недостаточности различной степени тяжести // Вопросы гинекологии, акушерства и перинатологии. 2004. Т. 3. № 2. С. 7-13.
2. Демидович Е.О., Игнатко И.В. Особенности плодового почечного кровотока при фетоплацентарной недостаточности.
3. Орджоникидзе Н.В., Клименко П.А., Дживилегова Г.Д. Новое в лечении беременных с синдромом задержки развития плода // Акушерство и гинекология. 1996. № 3. С. 32-36.
4. Федорова М.В. Плацентарная недостаточность // Акушерство и гинекология. 1997. № 6. С. 40-43.
5. Шаповаленко С.А. Комплексная диагностика и лечение плацентарной недостаточности у беременных на разных стадиях гестации // Вестник Российской ассоциации акушеров-гинекологов. 2001. № 2. С. 43-47.
возможные причины, симптомы, методы диагностики и терапия
Во время беременности женский организм начинает перестраиваться. Поэтому в этот период так важно держать под контролем состояние как женщины, так и плода.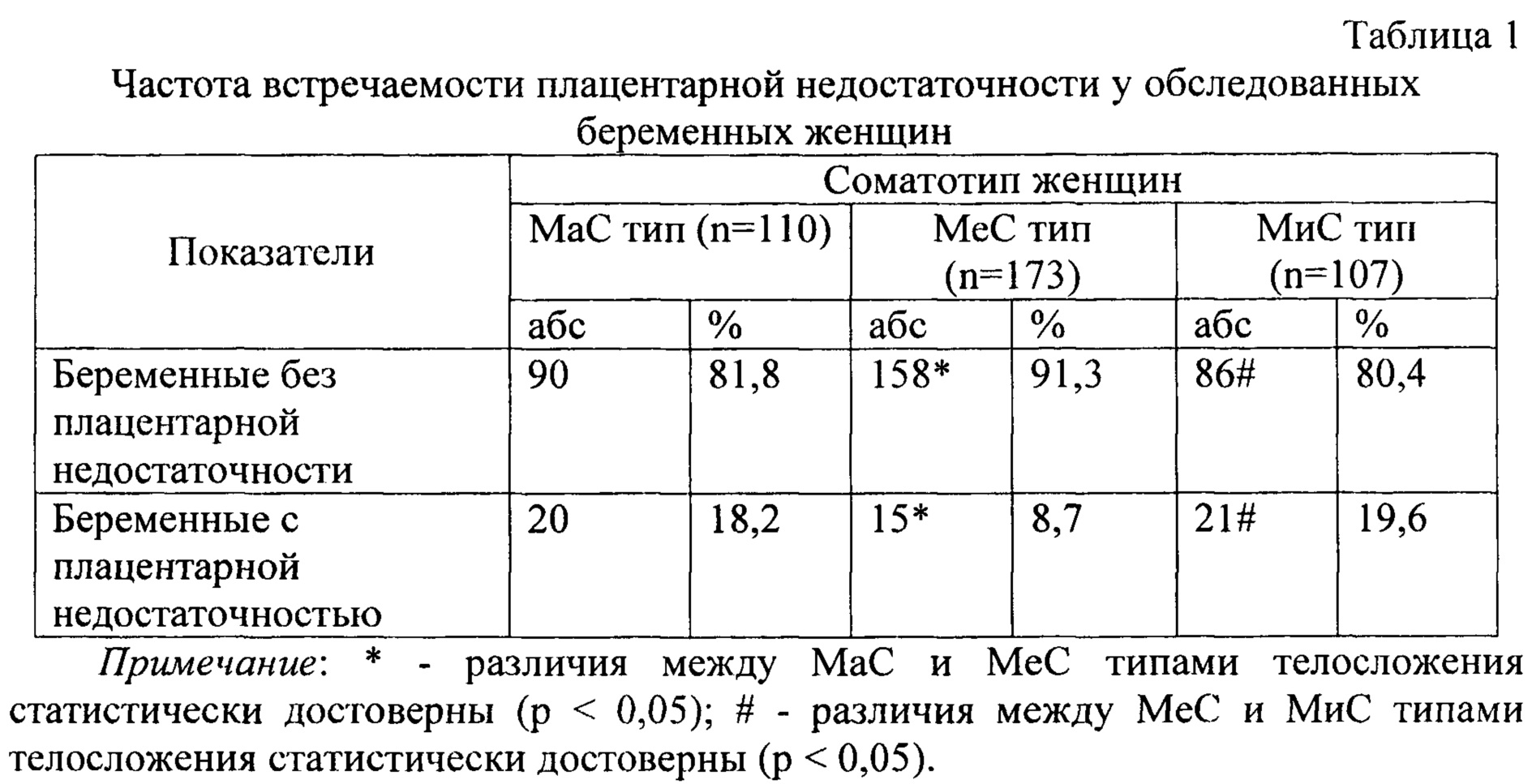 Как свидетельствует медицинская статистика, у довольно большого количества беременных женщин наблюдается нарушение кровотока. Дополнительный круг кровообращения, возникший в организме, требует постоянного контроля специалистов. Его нарушение способно привести к гибели плода, и произойти это может на любых сроках беременности. Попытаемся разобраться, почему нарушается кровоток в период беременности.
Как свидетельствует медицинская статистика, у довольно большого количества беременных женщин наблюдается нарушение кровотока. Дополнительный круг кровообращения, возникший в организме, требует постоянного контроля специалистов. Его нарушение способно привести к гибели плода, и произойти это может на любых сроках беременности. Попытаемся разобраться, почему нарушается кровоток в период беременности.
Немного теории
Всем известно, что плацента выступает в роли связующего звена между организмом женщины и плодом. В этой сложной системе выделяют два вида кровообращения – плацентарный и плодовой. Любое нарушение одного из них способно привести к достаточно печальным последствиям, в том числе и развитию разнообразных заболеваний. Тяжесть проблемы оценивает только врач.
В этом случае женщина, находящаяся на 30-й неделе беременности, должна обязательно пройти специальную ультразвуковую диагностику, на которой хорошо видны сосуды плаценты в трехмерном изображении. Если имеется какое-либо нарушение, врач обязательно увидит его, так как происходит изменение пространственного соотношения маточного и плодово-плацентарного кровообращения. Это очень опасное состояние организма, так как происходит угнетение дыхательной функции, а развитие плода приостанавливается.
Это очень опасное состояние организма, так как происходит угнетение дыхательной функции, а развитие плода приостанавливается.
Степени нарушения
Медицина выделяет три степени тяжести этой патологии. Самой легкой считается первая степень, когда недостаточное кровообращение еще не достигло своих критических значений. В этом случае гемодинамика плода находится в удовлетворительном состоянии. Выделяют нарушение маточно-плацентарного кровотока 1 А степени и недостаточное плодово-плацентарное кровообращение 1 Б степени.
Вторая степень характеризуется ухудшением кровоснабжения плода. В 50% случаев отмечается снижение максимальной скорости продвижения крови через все клапаны сердца, причем такое нарушение наблюдается и у плода, и в маточных артериях.
Довольно часто за короткий промежуток времени вторая степень переходит в третью. В этом случае кровоток практически перестает поступать к плоду, что может вызвать его гипоксию. Велика вероятность снижения диастолического кровотока в аорте, а в некоторых случаях оно может полностью исчезнуть.
Причины
Если возникло нарушение кровотока 1 степени при беременности, причины, приводящие к этому, могут быть различными. Многочисленные неблагоприятные факторы способны воздействовать на плаценту не только во время ее формирования, но и на более поздних сроках. Медицинская практика выделяет первичную и вторичную недостаточность кровообращения, из-за чего нарушается функционирование плаценты, которая выступает как транспортный, защитный, иммунный, обменный и эндокринный орган.
Таким образом, нарушение кровотока 1 А степени при беременности может возникать по следующим причинам:
- опухоль матки;
- генетические дефекты;
- последствия абортов;
- инфекционные заболевания;
- гипертоническая болезнь;
- заболевания надпочечников и щитовидной железы;
- аномалии строения;
- гормональные дисфункции;
- поздний токсикоз;
- тромбозы, атеросклероз;
- сахарный диабет.
Если своевременно не устранить эту патологию, то спустя 6 недель незначительное нарушение кровотока способно перейти в третью стадию. При обнаружении проблемы на 30-й неделе у врача еще достаточно времени для принятия соответствующих мер для восстановления нормального кровообращения.
При обнаружении проблемы на 30-й неделе у врача еще достаточно времени для принятия соответствующих мер для восстановления нормального кровообращения.
Симптомы
Любая патология характеризуется своей клинической картиной, благодаря чему врач может сделать соответствующее заключение. Недостаток гемодинамики приводит к изменению функционирования плаценты, из-за чего начинает страдать плод. К нему в ограниченном количестве начинают поступать необходимые питательные вещества и кислород, и происходит замедление выведения продуктов обмена. Начинают появляться признаки гипоксии плода, в результате чего внутриутробное его развитие приостанавливается.
Таким образом, если возникло нарушение кровотока при беременности, симптомы этого состояния проявляются следующим образом:
- учащенное сердцебиение;
- снижение или повышение двигательной активности плода;
- несоответствие объема живота конкретному сроку беременности.
Такие признаки обычно возникают при декомпенсированном виде плацентарной недостаточности. Если нарушение маточного кровотока при беременности 1 А или 1 Б степени, то эти симптомы еще не проявляются, так как гемодинамика компенсируется. Выявляется оно обычно при диагностических исследованиях.
Если нарушение маточного кровотока при беременности 1 А или 1 Б степени, то эти симптомы еще не проявляются, так как гемодинамика компенсируется. Выявляется оно обычно при диагностических исследованиях.
Диагностика
Чтобы выявить нарушение кровотока 1 А степени при беременности, необходимо пройти ряд обследований, с помощью которых устанавливают вид и степень возникших изменений, а также определяют состояние плода. В этом случае врач назначает следующие процедуры:
- анализ крови на такие гормоны, как эстрогены, хорионический гонадотропин, прогестерон;
- кардиотокография;
- ультразвуковое исследование;
- допплерометрия.
В некоторых случаях врач уже во время осмотра способен определить возникшее нарушение, ориентируясь на частоту сердечных сокращений ребенка, которые подсчитываются во время аускультации. Но самые достоверные результаты обычно получают после лабораторного и инструментального исследования.
Лечение
Нарушенный маточно-плацентарный кровоток любой степени необходимо лечить.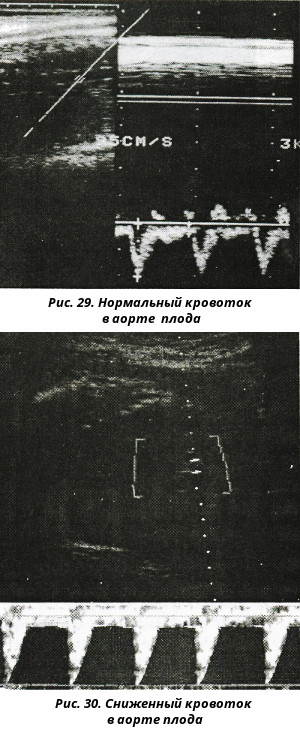 В основном лечебные мероприятия направлены на то, чтобы патология в дальнейшем не прогрессировала. Гемодинамика нормализуется только в том случае, если выявлено нарушение кровотока 1 Б степени.
В основном лечебные мероприятия направлены на то, чтобы патология в дальнейшем не прогрессировала. Гемодинамика нормализуется только в том случае, если выявлено нарушение кровотока 1 Б степени.
При беременности, протекающей с отклонениями, используются различные средства, улучшающие состояние плода. В основном применяют консервативные методы лечения. Хирургическое вмешательство возможно только в случае осложнений и по жизненно важным показаниям. При нормализации нарушения кровотока применяют комплекс мероприятий – патогенетическое, этиотропное и симптоматическое лечение.
Медикаментозное лечение
Чаще всего нарушение кровотока 1 А степени при беременности корректируется с помощью лекарственных препаратов. При выявлении первоначальных признаков нарушения лечение проводится амбулаторно. Более выраженная недостаточность кровообращения требует госпитализации в стационар.
Для лечения используют следующие препараты:
- спазмолитики – «Эуфиллин», «Но-шпа»;
- сосудистые – «Актовегин»;
- антиагреганты – «Курантил»;
- витамины и микроэлементы – «Аскорбиновая кислота», «Магне B6»;
- гепатопротекторы – «Хофитол», «Эссенциале»;
- токолитики – «Партусистен», «Гинипрал»;
- улучшающие микроциркуляцию крови – «Трентал»;
- антигипоксанты – «Инстенон»;
- метаболические – «АТФ».

Обычно для улучшения состояния проводят два курса терапии – сразу после того, как был поставлен диагноз и на сроке 32-34 недели. После этого врач решает вопрос о способе родоразрешения. Особенно важно это в том случае, если расстройство кровообращения носит тяжелый характер. При нарушении кровотока 1 степени роды осуществляются естественным путем.
Хирургическое лечение
Если нарушение кровотока носит ярко выраженный характер, проводят экстренное родоразрешение. В случае безрезультатности консервативного лечения, даже в случае легкого нарушения решение принимается в течение двух суток. Обычно проводят кесарево сечение. Если оно планируется при сроке беременности меньше 32 недель, то оценивают состояние плода и его жизнеспособность.
Профилактические меры
Чтобы избежать такого патологического состояния, как нарушение кровотока 1 А степени при беременности, следует выполнять меры профилактики. Женщина, которая ждет ребенка, должна употреблять продукты, содержащие необходимые витамины, микро- и макроэлементы, жиры, углеводы и белки. Каждый день следует употреблять не меньше 1,5 л жидкости, но только если не мучают отеки.
Также важно держать под контролем свой вес. За время беременности рекомендованная прибавка в весе не должна превышать 10 кг. Женщинам из группы риска проводят профилактику лекарственными препаратами для взаимодействия систем организма матери и плода и предотвращения крайне опасной дисфункции маточно-плацентарного кровообращения. Немаловажную роль играет и своевременно скорректированный метод ведения родов. Но следует помнить, что даже соблюдение этих мер не исключает возникновения тяжелых неврологических осложнений.
Вывод
Таким образом, важно контролировать кровотоки при беременности. Причины нарушения кровообращения могут быть различными. Главное – это следить за своим здоровьем, а своевременное выявление патологии поможет предотвратить тяжелые последствия для будущего ребенка.
Плацентарная недостаточность и ограничение роста плода
Доплер маточной артерии
Большая часть кровотока к матке обеспечивается маточными артериями. На протяжении всей беременности кровоток в матке увеличивается в 10–12 раз из-за трофобластической инвазии спиральных артерий миометрия и децидуальной оболочки, а также на 50% увеличения объема материнской крови. Форма волны Доплера маточной артерии уникальна и меняется по мере продвижения беременности. На ранних сроках беременности маточное кровообращение характеризуется высоким сопротивлением сосудов и низким кровотоком, что дает форму волны с постоянной конечной диастолической скоростью и непрерывным поступательным током крови на протяжении диастолы.По мере протекания трофобластической инвазии и модификации спиральной артерии перфузия плаценты увеличивается, и маточно-плацентарное кровообращение становится системой с высоким потоком и низким сопротивлением, дающей форму волны с большим конечным диастолическим потоком.
Когда нормальная трофобластическая инвазия и модификация спиральных артерий прерываются, увеличивается сопротивление кровотоку в маточных артериях и снижается плацентарная перфузия. Эти патологические процессы являются ключевыми особенностями развития преэклампсии и ЗВУР.
Проспективное исследование Zimmermann et al. [4] оценили полезность допплера маточной артерии, выполненного между 21 и 24 неделями, для прогнозирования последующего развития преэклампсии и ЗВУР. Они выявили 175 женщин с высоким риском развития гипертонических расстройств при беременности или ЗВУР и 172 беременных с низким риском. Устойчивые зазубрины или повышенный RI в маточных артериях или повышенный RI в маточно-плацентарных артериях были определены как патологические допплеровские признаки.
Исходя из имеющихся в настоящее время данных, недостаточно доказательств, чтобы рекомендовать допплерографию маточной артерии в качестве общего метода скрининга для всех беременностей.При выполнении в популяции с высоким риском он имеет определенную ценность для выявления беременностей, которые могут потребовать более частой оценки артериального давления.
Пупочная артерия (UA) была первым сосудом, который был исследован с помощью ультразвуковой допплерографии. Примерно к 15 неделе беременности в UA можно определить диастолический кровоток. С увеличением срока беременности конечная диастолическая скорость увеличивается вторично по отношению к снижению сопротивления плаценты. Это отражается в уменьшении S / D или PI. Поскольку сосудистое русло хориона подвергается атеросклеротическому процессу, возникает местная ишемия и некроз.Пупочная артерия демонстрирует увеличивающийся импеданс, который первоначально препятствует прямому току во время диастолы и, в конечном итоге, полностью меняет его на более позднем этапе. Эти данные были связаны с неблагоприятным перинатальным исходом. Как только выявлено изменение диастолического кровотока, следует рассмотреть возможность введения стероидов для достижения зрелости легких у недоношенного плода и родов.
Средняя мозговая артерия (СМА) — еще один сосуд, хорошо охарактеризованный с помощью Доплера, и было показано, что на него также влияет ЗВУР.СМА обычно демонстрирует низкую амплитуду диастолического кровотока, которая увеличивается при гипоксии плода как маркер церебральной вазодилатации. Чаще всего это представляет собой более позднюю стадию гипоксического процесса и обычно возникает после изменений в маточной артерии.
Dhand et al. [5] сравнили доплеровские индексы СМА с допплеровскими индексами пупочной артерии в проспективном исследовании 121 женщины, из которых 71 была женщинами высокого риска с задержкой роста плода, а 50 женщин имели здоровые плоды. Прогностическая ценность допплеровского ИП для выявления патологического исхода у плода составила 94% для СМА по сравнению с 83% для пупочной артерии.Чувствительность составила 71% для MCA по сравнению с 44% для пупочной артерии. Таким образом, авторы пришли к выводу, что доплеровские индексы MCA были лучшим предиктором исхода для плода при ЗВУР по сравнению с пупочной артерией с точки зрения чувствительности и прогностической ценности.
Последовательность аномальных событий, которые предвещают неблагоприятный перинатальный исход, начинается с отсутствия конечного диастолического потока UA. Более поздние находки включают аномальную допплеровскую пульсацию СМА (со сниженным ИП) и аномальный кровоток в венозном протоке (отсутствие или обратный кровоток во время сокращения предсердий) и обратный кровоток в МА.Эти изменения в значительной степени связаны с перинатальной смертью.
Ведение плода с аномальными показателями Доплера зависит от срока гестации. У зрелого плода от продолжения беременности мало что можно получить, а время декомпенсации у таких плодов обычно короче, поэтому рекомендуется родоразрешение. Индукция родов будет разумной для тех, у кого есть повторное отслеживание сердца плода. За незрелым плодом необходимо тщательное наблюдение.
Как только продемонстрировано отсутствие конечного диастолического кровотока в UA, биофизический профиль (BPP) и доплеровский индекс следует выполнять два раза в неделю, и рекомендуется ежедневный подсчет толчков плода.При наличии реверсирования кровотока в UA или цефализации в MCA показана госпитализация с непрерывной кислородной терапией, постельным режимом, ежедневным АДП и ежедневным допплером. Следует назначать стероиды для достижения зрелости легких плода.
Пульсирующий рисунок на DV Doppler сильно указывает на ацидемию плода и является показанием для родоразрешения. Плод с обратным конечным диастолическим потоком в UA и / или с пульсирующим DV паттерном имеет небольшой резерв и, скорее всего, не перенесет роды.
Трехмерный энергетический доплер особенно чувствителен для обнаружения низкоскоростного потока, который затем визуализируется для получения детального изображения тонких сосудистых структур. Поскольку третичные стволовые ворсинки можно визуализировать, существует возможность более раннего выявления аномальной плацентации для выявления беременностей с высоким риском преэклампсии или ЗВУР или оценки подозрения на отслойку плаценты или врастание [6].
Плацентарное кровообращение — сосудистая биология плаценты
Плацента — это уникальный сосудистый орган, который получает кровоснабжение как от материнской, так и от фетальной систем и, таким образом, имеет две отдельные кровеносные системы: (1) материнско-плацентарную ( маточно-плацентарное) кровообращение и (2) плодно-плацентарное (фетоплацентарное) кровообращение.Маточно-плацентарное кровообращение начинается с притока материнской крови в межворсинчатое пространство через децидуальные спиральные артерии. Обмен кислородом и питательными веществами происходит, когда материнская кровь обтекает терминальные ворсинки в межворсинчатом пространстве. Притекающая материнская артериальная кровь выталкивает дезоксигенированную кровь в эндометрий, а затем в маточные вены обратно в кровообращение матери. Фетально-плацентарное кровообращение позволяет пупочным артериям переносить деоксигенированную и обедненную питательными веществами кровь плода от плода к внутренним ворсинчатым сосудам плода.После обмена кислорода и питательных веществ пупочная вена переносит свежую насыщенную кислородом и богатую питательными веществами кровь, циркулирующую обратно в системный кровоток плода. В срок кровоток матери к плаценте составляет примерно 600–700 мл / мин. Подсчитано, что площадь поверхности синцитиотрофобластов составляет приблизительно 12 м 2 [1], а длина плодных капилляров полностью развитой плаценты составляет приблизительно 320 километров в срок [2,3]. Функциональная единица обмена кислорода и питательных веществ между матерью и плодом происходит в терминальных ворсинках.В плаценте не происходит смешения крови матери и плода. иллюстрирует (1) взаимоотношения матки, плаценты и плода и (2) направления кровотока от матери к плаценте, а также кровоток плода от плаценты к плоду.
Рисунок 2.1
Иллюстрация беременности человека и направления кровотока в плаценте. На правой панели показаны взаимоотношения матки, плаценты и плода во время беременности. На левой панели показаны направления кровотока от матери к плаценте и (подробнее…)
2.1. Материнско-плацентарное кровообращение
Маточно-плацентарное кровообращение полностью не налаживается до конца первого триместра. Хотя точный механизм установления маточно-плацентарного кровообращения до конца не изучен, были предложены две теории. Первая теория состоит в том, что в первом триместре эндоваскулярные трофобласты мигрируют по децидуальным спиральным артериям, вторгаются в стенки сосудов и создают путь материнской крови для перфузии межворсинчатого пространства плаценты.Эта теория подтверждается наличием эндоваскулярных трофобластов в децидуальных спиральных артериях плаценты первого триместра [4,5]. Вторая теория предполагает, что трофобласты проникают в децидуальные спиральные артерии и образуют трофобластические пробки. Эти трофобластические пробки препятствуют кровотоку матери в межворсинчатое пространство и предотвращают кровоток до конца первого триместра беременности (10–12 недель). Затем пробки ослабляются и обеспечивают непрерывный ток материнской крови в межворсинчатое пространство.Эта теория основана на наблюдениях ex vivo гистологического анализа образцов гистерэктомии плаценты первого триместра, в которых были обнаружены пробки трофобластов, частично или полностью закупоривающие или заполняющие просвет сосуда децидуальных спиральных артерий [6]. Хотя две теории расходятся относительно того, «закупоривают» ли вторгшиеся трофобласты артерии для предотвращения кровотока в межворсинчатое пространство, ясно, что генез маточно-плацентарного (материнско-плацентарного) кровотока в течение первого триместра является динамичным и прогрессирующим. процесс.
Нормальное раннее развитие плаценты приводит к трансформации спиральных артерий, которые простираются от децидуальной оболочки (слоя ткани, выстилающей матку), до мышечного слоя. В большинстве учебников приводится классическое описание кровообращения плаценты, основанное на исследованиях плаценты во втором или третьем триместре. Как показано на фиг.2, материнская кровь попадает в плаценту через базальные пластинки эндометриальных артерий (спиральные артерии), перфузирует межворсинчатые пространства и течет вокруг ворсинок, где происходит обмен кислорода и питательных веществ с кровью плода.Было подсчитано, что во время доношения имеется около 120 спиральных артериальных входов в межворсинчатое пространство [7]. Материнская кровь проходит через межворсинчатое пространство плаценты и отводится обратно через венозные отверстия в базальной пластинке, а затем возвращается в материнский системный кровоток через маточные вены. Материнско-плацентарный кровоток стимулируется материнским артериальным давлением из-за уникальной природы маточно-плацентарных сосудов с низким сопротивлением, которые способствуют значительному увеличению перфузии матки в течение беременности [7].Во время беременности объем материнской крови постепенно увеличивается с 6–8 недель беременности и достигает максимума примерно на 32–34 неделе, а затем остается относительно постоянным до срока беременности. В целом, объем материнской крови (плазмы) увеличивается до 40–50% в ближайшем будущем по сравнению с небеременным состоянием. Gowland et al. изучали перфузию материнской крови в плаценте человека от 20 недель гестации до доношения с использованием эхопланарной визуализации (EPI) [8]. Они обнаружили, что при нормальной беременности средняя скорость перфузии составляла около 176 ± 24 мл / 100 грамм / минуту.
Рис. 2.2
Схематическое изображение разреза доношенной плаценты. Верхняя панель: (1) отношение ворсинчатого хориона (C) к базальной децидуальной оболочке (D) и фетально-плацентарному кровообращению; (2) Материнская кровь течет в межворсинчатые промежутки в (подробнее …)
Ремоделирование спиральной артерии : Ремоделирование маточных артерий является ключевым событием на ранних сроках беременности, которая начинается после имплантации. Трофобласт разделяется на ворсинчатые трофобласты и вневорсинчатые трофобласты.Эти трофобласты выполняют различные функции при контакте с материнскими тканями. Ворсинки трофобласта дают начало ворсинкам хориона, основной структуре семядолей плаценты. Ворсинки хориона в основном переносят кислород и питательные вещества между плодом и матерью. Экстраворсинчатые трофобласты мигрируют в децидуальную оболочку и миометрий и проникают в сосудистую сеть матери. Экстраворсинчатые трофобласты можно разделить на интерстициальные трофобласты и эндоваскулярные трофобласты.Интерстициальные трофобласты проникают в децидуальную оболочку и окружают спиральные артерии. Эндоваскулярные трофобласты проникают в спиральные артерии. В спиральных артериях матки эндоваскулярные трофобласты пересекаются между эндотелиальными клетками, заменяя эндотелиальную выстилку и большую часть мышечно-эластической ткани в стенках сосудов, тем самым создавая плацентарную циркуляцию с высоким потоком и низким сопротивлением. «Высокий поток и низкое сопротивление» — это описание, которое обычно дается для нормальной маточно-плацентарной сосудистой сети в результате физиологического ремоделирования децидуальных спиральных артерий.иллюстрирует процесс ремоделирования спиральной артерии во время беременности.
Рисунок 2.3
Процесс ремоделирования спиральной артерии во время беременности. На ранних сроках беременности вне ворсинок обнаруживаются два типа вневорсинчатых, эндоваскулярных и интерстициальных трофобластов. Эндоваскулярные трофобласты проникают в спиральные артерии и трансформируют их (подробнее …)
Плацентарный кровоток увеличивается на протяжении всей беременности. Объем плацентарного кровотока составляет около 600–700 мл / мин (80% перфузии матки) в срок.Резкое падение давления происходит при переходе от маточных артерий к межворсинчатым промежуткам. Давление составляет около 80–100 мм рт. Ст. В маточных артериях, 70 мм рт. Ст. В спиральных артериях и только 10 мм рт. Ст. В межворсинчатом пространстве. Низкое сопротивление маточно-плацентарных сосудов и градиент артериального давления между маточными артериями и плацентарным межворсинчатым пространством позволяют материнской крови эффективно и эффективно перфузировать межворсинчатое пространство. Таким образом, кровь в межворсинчатом пространстве полностью обменивается два-три раза в минуту.Обычно спиральные артерии перпендикулярны стенке матки, а вены параллельны стенке матки. Такое расположение облегчает закрытие вен во время сокращений матки и предотвращает выдавливание материнской крови из межворсинчатого пространства.
2.2. Фетально-плацентарное кровообращение
Пуповина: Пуповина — это линия жизни, по которой плацента прикрепляется к плоду. Во время внутриутробного развития пуповина происходит от той же зиготы, что и плод.Пуповина у доношенного новорожденного человека в среднем составляет около 50–70 сантиметров (20 дюймов) в длину и около 2 сантиметров (0,75 дюйма) в диаметре. Он простирается от пупка плода до поверхности плаценты или хорионических пластинок плода. Пуповина не связана напрямую с кровеносной системой матери. Вместо этого он присоединяется к плаценте, которая передает материалы в кровь матери и из нее, не допуская прямого перемешивания. Пуповина содержит одну вену (пупочную вену) и две артерии (пупочные артерии), погруженные в желе Уортона.Пупочная вена переносит насыщенную кислородом, богатую питательными веществами кровь от плаценты к плоду, а пупочные артерии несут дезоксигенированную, обедненную питательными веществами кровь от плода к плаценте (). Любое нарушение кровотока в пуповине может стать катастрофическим для плода.
Пупочные сосуды чувствительны к различным вазоактиваторам, таким как серотонин, ангиотензин II и окситоцин. На сократительную способность гладких мышц стенок сосудов также влияют вещества, вырабатываемые соседними эндотелиальными клетками паракринным образом [9].Сосуды пуповины производят несколько сильнодействующих вазодилататоров. Например, исследование in vitro показало, что эндотелий из пупочной вены (HUVEC) производит гораздо больше простагландинов, чем эндотелий из пупочных артерий (HUAEC) [10]. Интересно отметить, что синтез и производство простациклина (PGI 2 ) и PGE 2 значительно меньше у курящих и беременных женщин с диабетом, чем у нормальных беременных [11]. И PGI 2 , и PGE 2 являются мощными вазодилататорами и ингибиторами агрегации тромбоцитов.Оксид азота (NO) и предсердный натрийуретический пептид (ANP) также присутствуют в пупочных сосудах. Giles et al. изучили корреляцию активности синтазы оксида азота (NOS) в плаценте с волновыми формами скорости кровотока в пупочной артерии при ультразвуковом допплеровском исследовании. Они обнаружили, что плаценты от женщин с аномальной формой волны скорости кровотока в пупочной артерии показали значительно более низкую среднюю активность БДУ, чем плаценты от женщин с нормальной формой волны скорости кровотока в пупочной артерии [12].
Капилляры ворсинок плаценты: На стыке пуповины и плаценты пупочные артерии разветвляются, образуя хорионические артерии, и проходят через поверхность плаценты плода в хорионической пластинке и далее разветвляются перед тем, как войти в ворсинки.Хорионические артерии легко узнать, потому что они всегда пересекают хорионические вены. Эти сосуды чувствительны к вазоактивным веществам, как упоминалось выше. Около двух третей хорионических артерий формируют сети, снабжающие семядоли в виде паттерна ветвления дисперсного типа . Остальные хорионические артерии расходятся к краю плаценты и вниз к сети. показывает материнскую и плодную поверхности плаценты; Обратите внимание на дисперсный тип ветвления сосудов плода (поверхность плода) в хорионической пластинке.
Рисунок 2.4
Материнская и плодная поверхность плаценты. Обратите внимание на характер разветвления сосудов плода (поверхность плода) в хорионической пластинке по дисперсному типу. (Из http://www.walgreens.com/marketing/library/graphics//images/en/17010.jpg). Используется с разрешения (подробнее …)
Каждая артерия пуповины обычно имеет восемь или более терминальных пластинчатых артерий хориона, которые называются стволовыми артериями от периферических стволов до цитиледонов ворсинок плода.Ветви первого порядка имеют среднюю длину 5–10 мм; диаметр артерии составляет в среднем 1,5 мм, а диаметр сопутствующей вены — около 2 мм. Эти туловищные сосуды делятся на четыре-восемь горизонтальных семядольных сосудов вторичного порядка со средним диаметром 1 мм. Горизонтальное расстояние варьируется в зависимости от размера семядоли, и по мере того, как они изгибаются к базальной пластинке, они начинают ветвиться на ворсинчатые ветви третьего порядка. В каждой семядоле около 30–60 ветвей с нулевым калибром.1–0,6 мм и длиной 15–25 мм. В ворсинах ворсинчатые ветви третьего порядка образуют обширную артериокапиллярную венозную систему, ворсинчатых капилляров , по которой кровь плода находится очень близко к материнской; но смешения материнской и плода крови не происходит. На одну плаценту приходится около 15–28 семядолей.
Ворсинчатые капилляры — это ветви пупочных сосудов, а капиллярные сети — функциональная единица обмена между матерью и плодом.Кровяное давление в артериях пуповины в среднем составляет около 50 мм рт. Ст., И кровь течет через более мелкие сосуды, которые проникают через хорионическую пластинку к капиллярам ворсинок, где артериальное кровяное давление падает до 30 мм рт. В пупочной вене давление 20 мм рт. Давление в сосудах плода и их ворсинчатых ветвях всегда больше, чем в межворсинчатом пространстве. Это защищает сосуды плода от коллапса.
Оценка кровотока плода : Ультразвуковые и доплеровские измерения кровотока позволяют визуализировать пуповину и оценить кровоток у плода.показан пример цветного ультразвукового изображения артерий и вены пуповины. Измеряя объем прямого кровотока через пупочную артерию как во время систолы, так и во время диастолы плода, можно получить общую оценку здоровья плода. В целом, чем больше прямой кровоток от плода к плаценте через пупочную артерию, тем здоровее плод. суммирует измерения и характеристики кровотока в сосудах, полученные с помощью ультразвуковых и допплеровских устройств. Средний абсолютный венозный кровоток составляет около 443 ± 92 мл / мин в нормальной пуповине между 24 и 29 неделями беременности, а снижение абсолютного венозного кровотока связано с низкой массой тела при рождении [13].Таким образом, оценка кровотока плода через пуповину с помощью ультразвуковой цветной допплерографии оказалась ценной неинвазивной процедурой для оценки благополучия плода во время беременности.
Рисунок 2.5
Цветное ультразвуковое изображение артерий и вены пуповины. Красный: вена пуповины; и синий: артерии пуповины. (с http://www.medical.siemens.com). Изображение любезно предоставлено компанией Siemens Healthcare.
ТАБЛИЦА 2.1
Список параметров измерений пуповины и характеристик кровотока в сосудах, доступный с помощью ультразвука [13].
Аномальное введение пуповины: В более чем 90% плаценты пуповина выходит на поверхность плода (хорионическую пластинку) плаценты более чем на 3 см от края, менее чем на 10% вставляется на или около края, и около 1% вставляется в плацентарные оболочки. От места прикрепления пуповины отходят артерии и вены хориональной пластинки (). Артерии всегда пересекают вены. Недавние исследования показали, что периферическое введение пуповины связано с уменьшением плотности сосудов хорионической пластинки и изменением соотношения веса плода и плаценты, что может отражать пагубное влияние на функцию плаценты и рост плода.Примеры неправильного введения пуповины включают вставки пуповины около края плаценты () или наличие дополнительной доли с соединением бархатистого сосуда (). Вставка периферического пуповины, гладкая и маргинальная, связана с увеличением частоты абортов, преждевременных родов и дискордантного роста плода. Этиология введения периферического пуповины не ясна, но это может быть результатом неправильного расположения бластоцисты при имплантации с последующей аберрантной ориентацией диска плаценты или смещением плаценты от места первоначальной имплантации, в результате чего вставка пуповины остается.Внедрение пуповины считается маркером плохой плацентации со сниженной васкуляризацией хориона и плаценты.
Рисунок 2.6
Хорионические пластинки, артерии и вены, отходят от места впадения пуповины. A: Хорионическая пластинка нормальной доношенной плаценты; B: прикрепление пуповины к краю плаценты; и C: имеется дополнительная доля с соединением бархатистого сосуда. Звездочки (подробнее …)
Трансплацентарная терапия аспирином для раннего ограничения роста плода — Полный текст
Раннее начало FGR, требующее преждевременных родов на 32 неделе беременности, осложняет 1-5% беременностей и является важной проблемой для здоровья.Более 60% детей имеют долгосрочные последствия для здоровья после родов с ранним началом ЛГР. Пренатального лечения задержки роста плода не существует. Текущее лечение FGR состоит из наблюдения за плодом для выявления ухудшения здоровья ребенка и доставки родов, когда это можно сделать безопасно. В большом количестве случаев FGR с ранним началом необходимы преждевременные роды, чтобы предотвратить ухудшение состояния плода или даже его смерть в утробе матери.
Дисфункция плаценты, приводящая к раннему началу FGR, характеризуется изменениями кровеносных сосудов плаценты, что приводит к снижению притока крови к плаценте.Артерии, которые проходят в пуповине плода (пупочные артерии), важны для обмена питательными веществами между кровообращением плода и плацентой. Многие плоды с ранним началом ЛГР имеют повышенное сопротивление кровеносных сосудов, попадающих в плаценту. Это приводит к снижению кровотока в пупочной артерии (UA). Кровоток в пупочной артерии оценивается с помощью специального ультразвукового метода, называемого допплеровским ультразвуком. Ультразвуковая допплерография пупочных артерий исследует кровоток, чтобы увидеть, есть ли признаки аномального кровотока в плаценту.Когда количество кровотока в конце каждого импульса уменьшается, это классифицируется как повышенное сопротивление кровотоку UA. Когда кровоток ненадолго приостанавливается в конце каждого импульса, это называется отсутствующей конечной диастолической скоростью (AEDV) или UA AEDV. Когда кровоток меняет направление в конце каждого импульса, это называется обратной конечной диастолической скоростью (UA REDV). У плодов с повышенным кровотоком UA плацента обычно может поставлять достаточно питательных веществ и кислорода в течение как минимум 9 недель. По истечении этого времени обычно требуется доставка.Ухудшение кровотока к UA AEDV или даже UA REDV увеличивает риск ухудшения состояния плода и преждевременных родов в течение следующих 2-6 недель. Приблизительно 80% плодов с ранним началом ЛГР прогрессируют до UA AEDV или даже UA REDV, а затем требуют родов к 32 неделе. Не существует лечения, которое могло бы остановить это прогрессирование, которое имеет решающее значение для определения того, сколько времени осталось у плода до родов.
Кровотечение при поздней беременности — Американский семейный врач
1.Чилака В.Н., Конье JC, Кларк С, Тейлор DJ. Соблюдаемая практика: является ли осмотр зеркала при поступлении необходимой процедурой в ведении всех случаев дородового кровотечения? Дж Обстет Гинекол . 2000; 20: 396–8 ….
2. Профилактика аллоиммунизации Rh D. Бюллетень практики ACOG № 4, май 1999 г. Руководство по клиническому ведению акушеров-гинекологов. Американский колледж акушерства и гинекологии. Int J Gynaecol Obstet .1999; 66: 63–70.
3. Королевский колледж акушеров и гинекологов (RCOG). Использование электронного мониторинга плода. Использование и интерпретация кардиотокографии при внутриродовом наблюдении за плодом. Доказательные клинические рекомендации № 8. Лондон: RCOG, 2001.
4. Bhide A, Префумо F, Мур Дж., Холлис Б, Тилаганатан Б. Расстояние от края плаценты до внутреннего зева в конце третьего триместра и способ родоразрешения в предлежании плаценты. БЖОГ . 2003; 110: 860–4.
5. Бхиде А, Тилаганатан Б. Последние достижения в лечении предлежания плаценты. Curr Opin Акушерский гинекол . 2004. 16: 447–51.
6. Faiz AS, Анант CV. Этиология и факторы риска предлежания плаценты: обзор и метаанализ обсервационных исследований. J Matern Fetal Neonatal Med . 2003; 13: 175–90.
7. Кларк С.Л., Кунингс П.П., Phelan JP.Предлежание / приращение плаценты и предварительное кесарево сечение. Акушерский гинекол . 1985; 66: 89–92.
8. Гладкий К, Янковиц Дж., Хансен ВФ. Отслойка плаценты. Наблюдение за акушерством и гинекологом . 2002; 57: 299–305.
9. Анант CV, Oyelese Y, Йео Л, Прадхан А, Винцилеос AM. Отслойка плаценты в США, 1979–2001 гг .: временные тенденции и потенциальные детерминанты. Am J Obstet Gynecol .2005; 192: 191–8.
10. Флеминг А.Д. Отслойка плаценты. Клиника интенсивной терапии . 1991; 7: 865–75.
11. Oyalese KO, Тернер М, Лиз С, Кэмпбелл С. Vasa previa: акушерская трагедия, которой можно избежать. Наблюдение за акушерством и гинекологом . 1999; 54: 138–45.
12. Мустафа С.А., Бризо МЛ, Карвалью MH, Ватанабэ Л., Каххале С, Зугаиб М. Трансвагинальное ультразвуковое исследование в прогнозировании предлежания плаценты при родах: продольное исследование. Ультразвуковой акушерский гинекол . 2002; 20: 356–9.
13. Смит Р.С., Лаурия MR, Комсток CH, Тредуэлл MC, Кирк JS, Ли В, и другие. Трансвагинальное ультразвуковое исследование всех плацент, расположенных низко или над внутренним зевом шейки матки. Ультразвуковой акушерский гинеколь . 1997; 9: 22–4.
14. Тимор-Тритч ИП, Юнис РА. Подтверждение безопасности трансвагинальной сонографии у пациентов с подозрением на предлежание плаценты. Акушерский гинекол . 1993. 81 (5 pt 1): 742–4.
15. Королевский колледж акушеров и гинекологов (RCOG). Предлежание плаценты и приросшая плацента: диагностика и лечение. Руководство № 27. Лондон: RCOG, 2005.
16. Cotton DB, Прочтите JA, Пол RH, Куиллиган EJ. Консервативное агрессивное лечение предлежания плаценты. Am J Obstet Gynecol . 1980; 137: 687–95.
17. Шарма А, Сури В, Гупта И.Токолитическая терапия в консервативном лечении симптоматического предлежания плаценты. Int J Gynaecol Obstet . 2004. 84: 109–13.
18. Кроули П. Профилактические кортикостероиды при преждевременных родах. Кокрановская база данных Syst Rev . 2000; (2): CD000065.
19. Neilson JP. Вмешательства при подозрении на предлежание плаценты. Кокрановская база данных Syst Rev . 2003; (2): CD001998.
20. Крыло DA, Пол RH, Миллар LK.Лечение симптоматического предлежания плаценты: рандомизированное контролируемое исследование выжидательной тактики в стационарных и амбулаторных условиях. Am J Obstet Gynecol . 1996. 175 (4 ч. 1): 806–11.
21. Кобо Э, Конде-Агудело А, Дельгадо Дж. Канаваль H, Конготе А. Цервикальный серкляж: альтернатива лечению предлежания плаценты? Am J Obstet Gynecol . 1998. 179: 122–5.
22. Даше Ю.С., Макинтайр Д.Д., Рамус Р.М., Сантос-Рамос Р, Twickler DM.Сохранение предлежания плаценты в зависимости от срока беременности при УЗИ. Акушерский гинекол . 2002. 99 (5 пт 1) 692–7.
23. Тайпале П., Хилесмаа V, Илостало П. Трансвагинальное ультразвуковое исследование на сроке 18–23 недель для прогнозирования предлежания плаценты при родах. Ультразвуковой акушерский гинеколь . 1998. 12: 422–5.
24. Беккер Р. Х., Vonk R, Mende BC, Рагош V, Энтезами М. Релевантность расположения плаценты на 20–23 неделе беременности для прогнозирования предлежания плаценты при родах: оценка 8650 случаев. Ультразвуковой акушерский гинеколь . 2001; 17: 496–501.
25. Национальный центр сотрудничества по охране здоровья женщин и детей. Дородовое наблюдение: повседневный уход за здоровой беременной женщиной. Клинические рекомендации. Лондон: RCOG, 2003.
26. Comstock CH, Любовь JJ Jr, Бронстин Р.А., Ли В, Веттрейно И.М., Хуанг Р.Р., и другие. Сонографическое определение приросшей плаценты во втором и третьем триместрах беременности. Am J Obstet Gynecol . 2004; 190: 1135–40.
27. У С, Кочергинский М, Hibbard JU. Аномальная плацентация: анализ за двадцать лет. Am J Obstet Gynecol . 2005; 192: 1458–61.
28. Комитет АКОГ по акушерской практике. Приросшая плацента. Заключение Комитета ACOG № 266, январь 2002 г. Obstet Gynecol . 2002; 99: 169–70.
29. Расмуссен С, Иргенс Л.М., Бергсьо П., Далакер К.Возникновение отслойки плаценты в Норвегии в 1967–1991 гг. Acta Obstet Gynecol Scand . 1996. 75: 222–8.
30. Анант CV, Берковиц Г.С., Савиц Д.А., Лапинский Р.Х. Отслойка плаценты и неблагоприятные перинатальные исходы. ЯМА . 1999; 282: 1646–51.
31. Witlin AG, Сибай БМ. Перинатальный и материнский исход после отслойки плаценты. Гипертоническая беременность . 2001. 20: 195–203.
32. Neilson JP. Вмешательства для лечения отслойки плаценты. Кокрановская база данных Syst Rev . 2003; (1): CD003247.
33. Knab DR. Отслойка плаценты: оценка времени и способа родоразрешения. Акушерский гинекол . 1978; 52: 625–9.
34. Glantz C, Пурнелл Л. Клиническая полезность сонографии в диагностике и лечении отслойки плаценты. J Ультразвуковая медицина . 2002; 21: 837–40.
35. Башни CV, Пиркон РА, Хеппард М. Безопасен ли токолиз при кровотечении в третьем триместре? Am J Obstet Gynecol . 1999; 180) 6 пт 1) 1572–8.
36. Каяни С.И., Walkinshaw SA, Престон С. Исход беременности при тяжелой отслойке плаценты. БЖОГ . 2003. 110: 679–83.
37. Бертон Р., Белфорт Массачусетс. Этиология и лечение кровотечения. В: Дилди Г. А., Белфорт М. А., Сааде Г. Р., Фелан Дж. П., Хэнкинс Г. Д., Кларк С. Л., ред.Акушерство интенсивной терапии. 4-е изд. Молден, Массачусетс: Blackwell Science, 2004: 298–311.
38. Альтман Д., Карроли Дж., Дулей Л., Фаррелл Б, Мудли Дж. Нейлсон Дж. и другие., для совместной группы по испытаниям сорок. Польза от сульфата магния для женщин с преэклампсией и их детей? The Magpie Trial: рандомизированное плацебо-контролируемое исследование. Ланцет . 2002; 359: 1877–90.
39. Nelle M, Зилов ЭП, Краус М, Бастерт Г, Линдеркамп О.Влияние родоразрешения по Лебойеру на вязкость крови и другие гемореологические параметры доношенных новорожденных. Am J Obstet Gynecol . 1993; 169: 189–93.
40. кв. L, Дауни В.С. мл. Melena neonatorum: синдром проглатывания крови; простой тест для дифференциации гемоглобина взрослого и плода в кровянистом стуле. J Педиатр . 1955; 47: 6–12.
41. Oyelese Y, Катанзарит V, Префумо F, Лэшли С, Шахтер М, Товбин Ю, и другие.Vasa previa: влияние пренатальной диагностики на исходы. Акушерский гинекол . 2004; 103 (5 пт 1) 937–42.
42. Ли В, Ли В.Л., Кирк JS, Слоан CT, Смит Р.С., Comstock CH. Предлежание сосудов: пренатальная диагностика, естественная эволюция и клинический исход. Акушерский гинекол . 2000. 95: 572–6.
HIV-1 Nef нарушает плацентарный барьер у крысы Модель
Abstract
Вертикальная передача ВИЧ-1 от матери к плоду известна, но молекулярный механизм, регулирующий эту передачу, полностью не охарактеризован.Плод хорошо защищен плацентой, которая не позволяет патогенам микробов проникать через плацентарный барьер. В настоящем исследовании была создана модель на крысах для наблюдения за влиянием белка Nef ВИЧ-1 на плацентарный барьер. Краситель Evans blue использовали для анализа проницаемости плацентарного барьера, и четырнадцатидневным беременным крысам Sprague Dawley внутривенно вводили 2% краситель Evans blue вместе с различными концентрациями рекомбинантного Nef. Через час животных умерщвляли и наблюдали за миграцией красителя через ассимиляцию периферической крови плодом.Интересно, что следы рекомбинантного белка Nef были обнаружены в эмбрионе, а также в околоплодных водах и амниотической мембране, а также в плаценте и матке. Наше исследование показывает, что рекомбинантный белок ВИЧ-1-Nef преодолевает плацентарный барьер и способствует миграции синего красителя Эванса к растущему плоду. Кроме того, концентрация белка Nef в крови прямо пропорциональна интенсивности миграции красителя и количеству белка Nef, обнаруженного в матке, плаценте, амниотической мембране, околоплодных водах и эмбрионе.На основании этого исследования можно сделать вывод, что белок Nef ВИЧ-1 оказывает прямое влияние на нарушение плацентарного барьера в модели, которую мы создали в этом исследовании. Наши наблюдения будут полезны для понимания молекулярных механизмов, связанных с этим нарушением плацентарного барьера Nef у людей, и могут быть полезны для определения конкретных ингибиторов Nef.
Образец цитирования: Сингх П., Агнихотри С.К., Тевари М.К., Кумар С., Сачдев М., Трипати Р.К. (2012) Nef ВИЧ-1 нарушает плацентарный барьер на модели крыс.PLoS ONE 7 (12): e51518. https://doi.org/10.1371/journal.pone.0051518
Редактор: Чен Лян, Институт медицинских исследований леди Дэвис, Канада
Поступила: 11.07.2012; Одобрена: 1 ноября 2012 г .; Опубликован: 11 декабря 2012 г.
Авторские права: © 2012 Singh et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Первый автор получил стипендию Совета научных и промышленных исследований Нью-Дели. Эта рукопись является результатом исследовательского финансирования, предоставленного Советом научных и промышленных исследований, Нью-Дели, и грантов Министерства здравоохранения и альтернативной модели животных (NWP034). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Гематоэнцефалический барьер (BBB) и плацентарный барьер (PB) — это два защитных барьера, которые защищают мозг и эмбрион соответственно от миграции белков и токсичных веществ из периферической крови. В то же время эти барьеры обеспечивают миграцию основных питательных веществ, которые полезны для развития во время органогенеза. Защитный механизм BBB сохраняется постоянно на протяжении всей жизни, когда PB активируется после имплантации эмбриона.Эти барьеры также обладают свойством действовать как изолятор, защищая мозг и плаценту от инфекционных заболеваний. Однако известно, что немногие вирусы и бактерии преодолевают эти барьеры [1], [2].
Механизм ГЭБ широко изучен [3], [4], но точный механизм, с помощью которого некоторые вещества преодолевают этот барьер, не охарактеризован. Нарушение ПБ может привести к внутриутробной передаче инфекций. Например, передача ВИЧ от матери ребенку составляет от 25 до 35% [5].Внутриутробная передача ВИЧ-1 предположительно происходит из-за множества факторов, таких как низкое количество CD4, высокая вирусная нагрузка, нейтрализующие антитела, другие факторы материнского иммунитета, генетические факторы и любые коррозионные морфологические изменения в интактной плаценте [6], [7], но точные Механизм передачи инфекции через матку еще полностью не изучен.
Плацентарная мембрана, которая существует на границе раздела матки и плаценты, отделяет кровь плода от крови матери. Он состоит из сосудистого эндотелия плода, соединительной ткани, ворсинок хориона и трофобластов, где заякоренные ворсинки прикрепляют плаценту к матке.Ворсинки хориона содержат макрофаги (клетки Хофбауэра) и сосуды плода. Трофобласт и терминальные ворсинки имеют рецепторы CD4 [8] и находятся в прямом контакте с материнской кровью.
геномный материал ВИЧ-1 был обнаружен в клетках Хафбауэра, а также в клетках трофобластов [9], [10], [11]. В то же время ВИЧ-1 был идентифицирован как на материнской, так и на плодовой частях плаценты и, как было показано, реплицируется в плаценте. Вирус может пересечь трофобластический барьер путем эндоцитоза или через поврежденную поверхность ворсинок [12].Имеются сообщения о том, что эта передача требует контакта клетки с клеткой, и предполагалось, что контакт Т-клетки с плацентой может быть ответственным за инфицирование трофобласта ВИЧ-1, и это ингибируется антителами против LFA-1 [13]. Перинатальная передача ВИЧ-1 характеризуется отбором конкретных вариантов генотипа у инфицированных младенцев, ускользающих от иммунной системы матери [14]. Также известно, что сопутствующая плацентарная инфекция может повышать риск плацентарной передачи ВИЧ-1 плоду [12].
Сообщалось, что микробные и вирусные белки играют важную роль во внутриматочной передаче инфекций. Бактериальные белки InlA и InlB из Listeria monocytogenes позволяют бактериям преодолевать плацентарный барьер и вызывают фетоплацентарный листериоз [15]. Белки ВИЧ-1; Сообщалось, что vif, vip, vpu и Nef связаны с внутриутробной передачей инфекции от матери к ребенку [16, 17, 18 и 19]. Интересно, что белок Nef, как было показано, является патогенным белком, который выполняет множество функций, ускоряет вирусный патогенез и, как предполагается, отвечает за вертикальную передачу ВИЧ-1.Сообщалось, что открытая рамка считывания Nef сохранялась как у матери, так и у ребенка с частотой 86,2%, при этом функциональные домены, важные для активности белка, сохранялись как у матери, так и у ребенка, которому он передавался [19]. Воздействие Nef на астроциты демонстрирует экспрессию провоспалительных цитокинов, включая каспазу 3, фактор комплемента 3 (C3), а также продукцию общих нитратов и активных форм кислорода. Воспалительные цитокины, нитраты и активные формы кислорода связаны с разрывом ГЭБ [20].Однако ни одно из исследований четко не продемонстрировало роль Nef в нарушении плацентарного барьера. Более того, наличие альтернативных хемокиновых рецепторов, CXCR4, экспрессируемых на трофобласте, также может играть важную роль в передаче инфекции через матку [21]. LIF, член семейства цитокинов IL-6, активируется в плаценте непередающих женщин по сравнению с передатчиками [22].
В настоящем исследовании мы создали модель на грызунах для демонстрации нарушения плацентарного барьера белком ВИЧ-1.Мы показали прямое действие Nef на нарушение плацентарного барьера, где рекомбинантный белок Nef вместе с синим красителем Эванса вводили внутривенно четырнадцатидневной беременной крысе Sprague Dawley. Системно изучали миграцию синего красителя Эванса из периферической крови к растущему эмбриону и нарушение плацентарного барьера. Присутствие периферического белка Nef в плаценте, амниотической мембране, околоплодных водах и эмбрионе было подтверждено с помощью специфичных для Nef антител в ELISA, а также иммунофлуоресцентных анализов.Эти результаты предоставляют прямые доказательства функциональной роли белка Nef в нарушении плацентарного барьера модели грызунов, и исследования могут быть полезны для корреляции механизма у других высших млекопитающих.
Результаты
Влияние Нефа на миграцию синего красителя Эванса через плаценту
В более раннем сообщении, показывающем влияние Nef на гематоэнцефалический барьер [23], наш подход был направлен на изучение влияния Nef на плацентарный барьер. Одним из возможных механизмов вертикальной передачи ВИЧ-1 от матери к ребенку является нарушение плацентарного барьера, в настоящем исследовании различные концентрации рекомбинантного белка Nef в диапазоне от 0 до 500 мкг (Таблица S1) и 500 мкг ASK. Белок-хозяин -1 вводили внутривенно четырнадцатидневным беременным крысам вместе с 2% красителя Evans blue.Животных умерщвляли через час после инъекции и проверяли на нарушение плаценты. В группе крыс, которым вводили только краситель без Неф; наблюдалось его концентрирование на стыке плаценты, и миграция красителя в амниотическую мембрану не была видна. Интересно, что крысы, которым вводили Неф, показали миграцию синего красителя Эванса через амниотическую мембрану, и интенсивность красителя снизилась на стыке (рис. 1). Кроме того, когда часть амниотической мембраны была взята у животных, которым не вводили инъекцию, а также животных, которым вводили инъекцию, наблюдался четкий визуальный эффект усиления синего цвета из-за миграции красителя (рис. 2).Амниотическая мембрана животного, которому инъецировали 500 мкг Nef, показывала сильный синий цвет, в то время как немного меньшая интенсивность синего цвета наблюдалась у животного, которому инъецировали 250 мкг Nef. В амниотической мембране животного, куда вводили только краситель без Nef, наблюдался очень голубой всплеск. У животного, которому не вводили инъекцию, был виден первоначальный розовый цвет амниотической оболочки.
Рис. 1. Миграция синего красителя Эванса в цельном эмбрионе крысы после часа инъекции рекомбинантного Nef в различной концентрации.
A: Без инъекции, B: Только краситель, C: Краситель + 250 мкг Неф, D: Краситель +500 мкг Неф.
https://doi.org/10.1371/journal.pone.0051518.g001
Рис. 2. Укоренившийся синий краситель Эванса в амниотической мембране плода крысы после часа внутривенной инъекции различных концентраций рекомбинантного Nef.
A: Без инъекции, B: Только краситель, C: Краситель + 250 мкг Неф, D: Краситель + 500 мкг Неф.
https://doi.org/10.1371/journal.pone.0051518.g002
Миграцию цвета красителя количественно оценивали путем измерения оптической плотности при 590 нМ в лизатах различных тканей плода. У животных, которым вводили 250 и 500 мкг Nef, лизаты тканей демонстрировали почти от двух до четырех раз увеличение миграции красителя, соответственно, по сравнению с животными, которым вводили белок и краситель ASK-1 без Nef (рис. 3B, C и D). Пороговый уровень Nef, необходимый для нарушения плацентарного барьера, анализировали с различными уровнями инъекции Nef (25–500 мкг белка Nef, что соответствует 10–865 нг / мл Nef в плазме; Таблица S1).Наблюдалось, что инъекция 200 мкг Nef, аналогичного ~ 500 нг / мл Nef в плазме, приводила к частичному нарушению плацентарного барьера и гематоэнцефалического барьера. Миграция красителя в присутствии Nef также наблюдалась в головном мозге по сравнению с белком ASK-1 и только крысам, которым инъецировали краситель, что указывает на нарушение конститутивного гематоэнцефалического барьера (фиг. 3A). Миграция красителя также наблюдалась в околоплодных водах крыс, которым вводили Неф (рис. 1). Наши результаты ясно показывают, что Nef участвует в проницаемости как гематоэнцефалического барьера, так и плацентарного барьера, что позволяет предположить прямую роль Nef в процессе нарушения барьеров.
Рисунок 3. Количественное определение синего красителя Эванса (OD 590), присутствующего (в течение часа) в мозге и различных изолятах ткани плода от 14-дневных беременных крыс Sprague Dawley, которым внутривенно вводили рекомбинантный белок Nef и ASK-1 и с ними.
(A) Мозг (B) Матка (C) Плацента (D) Амниотическая оболочка. Три различных столбца в каждом наборе представляют 0, 250 и 500 мкг рекомбинантного Nef и 500 мкг ASK-1, введенного внутривенно вместе с красителем Evans blue экспериментальным животным.Поскольку данные представляют собой ± SEM 3 отдельных экспериментов в двух повторностях, и изменения считались значимыми при * p≤0,05, ** p≤0,01 и *** p≤0,001.
https://doi.org/10.1371/journal.pone.0051518.g003
Миграция рекомбинантного Nef из периферической крови в ткани плода
Миграция красителя из плаценты в ткани плода указывает на перемешивание периферической крови у плода. Отток периферической крови у плода также включает миграцию белков и других компонентов, которые присутствуют исключительно в крови и обычно не пересекают плацентарный барьер.Таким образом, после прорыва плацентарного барьера периферический рекомбинантный белок Nef был идентифицирован в различных тканях плода. Белковые лизаты матки, плаценты, амниотической мембраны, околоплодных вод и эмбриона анализировали на наличие периферического рекомбинантного белка Nef с помощью ELISA с использованием Nef-специфических антител (рис. 4). Наш анализ показал наличие рекомбинантного Nef во всех тканях плода у животных, которым вводили Nef, по сравнению с контрольными животными, которым вводили не Nef, а только краситель.Концентрация Nef (оцениваемая с помощью ELISA) в тканях плода была увеличена от двух до четырех раз, когда доза инъецированного рекомбинантного Nef была увеличена с 250 мкг до 500 мкг (рис. 4). На рисунке S3 показан стандартный график для оценки концентрации Nef в неизвестных образцах. Среднее количество мигрировавшего Nef было рассчитано во всех тканях плода животных, которым вводили ряд Nef (таблица 1 и таблица S1). После нарушения ПБ; в матке наблюдалось 13,9 нг и 29.6 нг; в плаценте 10,9 нг и 24,5 нг; в амниотической оболочке 5,6 нг и 12,8 нг; в околоплодных водах 6,0 нг и 8,5 нг; и в эмбрионе 3,6 нг и 7,4 нг, соответственно, у животных, которым вводили 250 мкг и 500 мкг Nef (рис. 5). Наше исследование ясно показало, что Nef нарушает плацентарный барьер и позволяет смешивать периферическую кровь с тканями плода, в то же время количество белка Nef в крови имеет решающее значение (Таблица S1) для определения степени нарушения плацентарного барьера. Исследования, проведенные в разных группах, также показали, что Неф разрушает гематоэнцефалический барьер у мышей и крыс [24], [25], [26].
Рисунок 4. Обнаружение внутривенного рекомбинантного белка Nef, мигрировавшего (в течение часа) в мозг и различные изоляты тканей плода от 14-дневных беременных крыс Sprague Dawley, которым внутривенно вводили рекомбинантный белок Nef и без него.
(A) мозг (B) матка, (C) плацента, (D) амниотическая оболочка, (E) амниотическая жидкость и (F) плод после нарушения плацентарного барьера. Три разных столбца в каждом наборе представляют 0 мкг, 250 мкг и 500 мкг рекомбинантного Nef, введенного внутривенно вместе с красителем Evans Blue этим животным. .05, ** p≤0.01 и *** p≤0.001.
https://doi.org/10.1371/journal.pone.0051518.g004
Рисунок 5. Количественная оценка мигрировавшего рекомбинантного Nef (в течение часа) в тканях плода.
Матка, амниотическая оболочка, околоплодные воды и эмбрион самок крыс, которым внутривенно вводили 250 мкг и 500 мкг рекомбинантного белка Nef. Поскольку данные представляют собой ± SEM из 3 отдельных экспериментов в двух повторах, и изменения считались значимыми при * p≤0,05, ** p≤0.01 и *** p≤0.001.
https://doi.org/10.1371/journal.pone.0051518.g005
Мы также проанализировали влияние внутривенного Nef на гематоэнцефалический барьер у беременных крыс. Было четко замечено присутствие периферического рекомбинантного белка Nef в лизатах ткани головного мозга (фиг. 4A). Несмотря на то, что количество мигрировавшего Nef было довольно низким по сравнению с количеством введенного Nef (рис. 4 и 5), мы все же могли наблюдать его присутствие в мозге.
Локализация рекомбинантного белка Nef в тканях плода
Миграция рекомбинантного белка Nef из периферической крови в ткани плода, а также в мозг была продемонстрирована в наших экспериментах, упомянутых выше.Чтобы подтвердить миграцию следов Nef в тканях плода, эти ткани были получены и немедленно зафиксированы из набора животных, которым вводили 500 мкг белка Nef. Залитые в парафин срезы ткани использовали для отслеживания рекомбинантного белка Nef посредством иммунофлуоресценции (рис. 6). Клеточно-специфический маркер E-кадгерин также локализовался одновременно в этих тканевых срезах. Nef может четко локализоваться в тканях, подтверждая наличие закрепившегося Nef в стенке матки, плаценте, а также в амниотической мембране и растущем эмбрионе.Было обнаружено, что окрашивающие Nef клетки перекрываются с E-кадгерином, демонстрируя внутриклеточную локализацию Nef. В то же время в нескольких краевых областях плаценты Nef также оказался внеклеточным. Когда эти срезы были исследованы только вторичными антителами, сигнала не наблюдалось (рисунок S1). Это указывает на специфичность антитела, которое мы использовали в этом исследовании против Nef. У животных, которым вводили только краситель без рекомбинантного Nef (т.е. отрицательный контроль), не наблюдалось никакого сигнала (фигура S2), что дополнительно подтверждает специфичность Nef.Эти результаты предполагают, что рекомбинантный Nef участвует в нарушении плацентарного барьера и миграции к растущему эмбриону; в то же время может нести ответственность за внутриматочный перенос других компонентов, присутствующих в периферической крови.
Рисунок 6. Локализация рекомбинантного белка Nef (зеленый) и E-кадгерина (красный) в различных тканях плода посредством иммунофлуоресцентного окрашивания.
Панель состоит из набора фигур; матка, плацента, амниотическая оболочка и эмбрион. Синий цвет показывает ядерное окрашивание с помощью DAPI, тогда как перекрывающиеся изображения объединены для локализации Nef и E-кадгерина.Ткани плода выделяли от крыс через час внутривенной инъекции 500 мкг рекомбинантного белка Nef.
https://doi.org/10.1371/journal.pone.0051518.g006
Обсуждение
Согласно доступной литературе, белок Nef ВИЧ-1, как было показано, является патогенным белком и выполняет множество функций, которые отвечают за вирусный патогенез [27], а также предполагается, что он играет роль в вертикальной передаче вируса. ВИЧ-1 от матери к плоду [19].Обычно плод хорошо защищен плацентой, которая имеет барьер, не допускающий миграцию микробов. Однако в некоторых случаях этот барьер нарушается. Как нарушается этот плацентарный барьер и как ВИЧ преодолевает этот барьер, — все еще стимулирующий вопрос, на который необходимо ответить. Чтобы понять этот механизм, мы впервые разработали модель на крысах, тесно связанную с человеком, для изучения влияния белка Nef ВИЧ-1 на плацентарный барьер.
Наши результаты показывают, что дополнительный белок Nef ВИЧ-1 нарушает плацентарный барьер у 14-дневного эмбриона крысы.Доказательства, которые мы представляем в нашем исследовании, касаются миграции синего красителя Эванса у крыс, которым вводили Nef, через плацентарный барьер и локализации белка и красителя в матке, плаценте, амниотической мембране, а также околоплодных водах у крыс, получавших Nef. , в то время как такая миграция не наблюдается в наборах отрицательного контроля (рис. 1). Нарушение плацентарного барьера и гематоэнцефалического барьера вызывает смешивание периферической крови с плодом и мозгом соответственно. Известно, что материнские патогены, передающиеся с кровью, попадают в маточно-плацентарный кровоток и в межворсинчатые пространства, могут достигать плода через капилляры ворсинок.Миграция красителя (наблюдаемая в настоящем исследовании) в периферическую кровь, возможно, связана с разрывом плотных контактов эндотелиальных клеток плаценты и капилляров ворсинок. На основании наших наблюдений можно предположить, что Nef ответственен за разрыв плотных контактов эндотелиальных клеток. Исследования с участием вируса японского энцефалита показали, что нейтрофильный хемотаксический фактор (MDF), полученный из макрофагов, и цитотоксический фактор (CF), опосредованный вирусом денге, ответственны за миграцию красителя, связанного с белками плазмы, из периферической крови в мозг после нарушения гематоэнцефалического барьера [24], [25].В настоящем исследовании свободная миграция красителя в присутствии Nef из матки в эмбрион и из крови в мозг показала, что Nef действительно ответственен за нарушение плацентарного барьера, а также за повышенную проницаемость плаценты и гематоэнцефалический барьер.
Кроме того, мы также наблюдали, что рекомбинантный белок Nef ВИЧ, введенный внутривенно 14-дневным беременным крысам, обнаруживал его следы в матке, плаценте, амниотической мембране, околоплодных водах и эмбрионе. Это ясно демонстрирует, что Nef увеличивает проницаемость плаценты, возможно, за счет разрушения плотных контактов эндотелиальных клеток капилляров ворсинок и облегчает миграцию белка к эмбриону.
Ранее предполагалось, что патологические состояния плаценты ВИЧ-1 матери, например, хориоамнионит и цитотрофобластная гиперплазия могут быть причиной нарушения плацентарного барьера. Однако нет никакой связи между частотой патологических поражений плаценты и ВИЧ-1 статусом новорожденных [28]. Кроме того, было замечено, что заболеваемость хориоамниотитом увеличивается у ВИЧ-1 инфицированных женщин [29]; следовательно, должен быть другой механизм, ответственный за внутриутробную передачу ВИЧ, и наше исследование показывает, что белок Nef, возможно, является одним из факторов, ответственных за эту передачу.
HIV-1 Nef ранее был четко продемонстрирован как патогенный белок, и он демонстрирует СПИД-подобный патогенез как у C.elegans [30], так и у мышей [31]. Nef взаимодействует с более чем тридцатью различными белками-хозяевами, регулирующими уклонение от иммунитета, апоптоз, передачу сигналов, активацию Т-клеток [32], [33]. Следовательно, возможно, что Nef может взаимодействовать с белками, присутствующими в эндотелии, и приводить к проницаемости плотных контактов соединительных тканей. Более того, Nef, присутствующий в матке, плаценте, амниотической мембране, околоплодных водах и эмбрионе, может взаимодействовать с другими белками плода, тем самым усиливая неблагоприятное воздействие на плацентарный барьер.Есть свидетельства того, что Nef разрушает гематоэнцефалический барьер у мышей [23], и наше исследование также доказывает то же самое на модели крыс, предполагая, что Nef влияет на конститутивный барьер у обоих грызунов. Более того, наше исследование впервые четко проиллюстрировало нарушение плацентарного барьера через Nef.
Известно, что цитокины играют жизненно важную роль во время беременности благодаря ответу, называемому иммунным ответом типа Th3. Цитокины и хемокины, экспрессируемые на стыке плод-плацента, могут служить маркерами для понимания внутриутробного переноса ВИЧ-1.Плацента непередающей матери поддерживает сильную среду цитокинов Th3, тогда как мать от передачи ВИЧ-1 демонстрирует сильную среду цитокинов Th2 [34]. LIF, член семейства цитокинов IL-6, активируется в плаценте женщин, не передающих ВИЧ, по сравнению с переносчиками ВИЧ-1 [22]. Было замечено, что Nef индуцирует провоспалительные цитокины, продукцию нитратов и активных форм кислорода в астроцитах, которые могут быть ответственны за нарушение ГЭБ у мышей [20], [23]. Белок Nef также может вызывать разрушение BBB у крыс, предположительно посредством индукции MMP [26], но до сих пор никакие исследования не смогли продемонстрировать четкую роль Nef в нарушении PB.Однако косвенные доказательства показали, что воспалительные цитокины, экспрессируемые в плаценте, способствуют передаче ВИЧ-1 плоду. Лечение АЗТ беременных женщин, инфицированных ВИЧ-1, подавляло экспрессию мРНК TNF-α в клетках плаценты [35]. Подавление мРНК TNF-α может представлять собой механизм, посредством которого AZT может снизить риск передачи ВИЧ-1 внутриутробно, в дополнение к его прямому влиянию на репликацию ВИЧ-1. Поскольку аналогичные сигнальные молекулы действительно существуют в плаценте, можно предположить, что подобный механизм может индуцировать воспалительные цитокины, которые в конечном итоге приводят к нарушению PB.С помощью настоящего исследования была создана отличная модель для изучения молекулярных механизмов, регулирующих сигнальный путь и повышающую регуляцию воспалительных цитокинов для нарушения плацентарного барьера посредством Nef. В настоящее время мы характеризуем роль Nef в проницаемости эндотелиальных клеток плаценты.
Считается, что высокая нагрузка ВИЧ-1 является серьезной причиной передачи ВИЧ-1 от матери ребенку [6], [36]. Аналогичным образом коррелировали уровни HBV в сыворотке беременных женщин и крови плода [37].Не существует пороговых значений вирусной нагрузки или белка Nef, позволяющих различать передающих и непередающих матерей [38]. Tat и Nef представляют собой вирусные белки, экспрессирующиеся на ранних этапах после инфицирования ВИЧ-1, даже до образования провируса [39]. Основываясь на результатах нашего исследования, можно было предположить, что для преодоления плацентарного барьера необходима пороговая концентрация Nef в сыворотке (~ 500 нг / мл Nef в модели на крысах). Количественный эффект Nef на плацентарный барьер не мог быть изучен на трансгенных мышах Nef, поскольку концентрация Nef не могла регулироваться специфически [40], тогда как настоящее исследование может изучить количественный эффект Nef in vivo (рис. 5).
До сих пор не существует установленной модели внутриутробной передачи ВИЧ-1, что действительно затрудняет понимание того, как именно происходит эта передача. Наше исследование открыло новый исследовательский подход к пониманию молекулярного механизма внутриутробной передачи ВИЧ-1 через белок Nef на модели грызунов. Мы продемонстрировали, что белок Nef ВИЧ обеспечивает повышенную проницаемость плацентарного барьера у беременных крыс. Несмотря на то, что этим животным вводили острую дозу, все же очевидное нарушение плацентарного барьера, отмеченное у крыс, ясно указывает на роль Nef в повышении проницаемости плаценты и ее нарушении.Несмотря на то, что у большинства женщин, живущих с ВИЧ, отсутствуют признаки нарушения плацентарного барьера, зарегистрировано около 20–30% случаев передачи ВИЧ от матери ребенку. На основании результатов нашего исследования действительно убедительно предположить, что это может быть связано с нарушением плацентарного барьера, вызванным повышенной вирусной нагрузкой или усиленной экспрессией Nef, или и тем, и другим. Мы четко продемонстрировали пороговую концентрацию Nef, необходимую для нарушения плацентарного барьера у крыс, что можно рассматривать как острую.Однако пороговые уровни, необходимые для разрыва плаценты, могут быть разными у инфицированных беременных женщин, и результаты настоящего исследования не могут быть напрямую коррелированы с людьми. Анализ сывороточного уровня Nef у женщин и его корреляция с нарушением плацентарного барьера должен выявить роль Nef в передаче ВИЧ от матери ребенку. Модель грызунов, созданная в настоящем исследовании, безусловно, может быть использована для понимания молекулярных механизмов, участвующих в прорыве плаценты через Nef и идентификации белков плаценты, взаимодействующих с Nef.Эта модель также может быть использована для идентификации новых ингибиторов Nef, способных захватить нарушение плацентарного барьера.
Материалы и методы
Экспрессия и очистка рекомбинантного белка Nef ВИЧ-1
Nef ВИЧ-1 и ген ASK-1 человека были клонированы в векторе экспрессии T7 Pet 28a, который имеет His6-метку на С-конце. Рекомбинантный белок Nef экспрессировался в бактериальном хозяине С-41 [41]. Вкратце, для обоих белков 5 мл ночной бактериальной культуры использовали для инокуляции 1 мл среды бульона Лурия-Бертани, содержащей 0.25 мкг / мл канамицина. Культуры выращивали при 37 ° C до достижения OD 0,6 с последующей индукцией в течение 18 часов 0,8 мМ IPTG. Затем культуру собирали и осадки ресуспендировали в связывающем буфере, содержащем 25 мМ Трис [pH 8,8], 50 мМ NaCl, а также ингибитор протеаз PMSF. Ресуспендированный осадок в буфере обрабатывали ультразвуком в течение 20 минут при амплитуде 25 (10 секунд включения и 10 секунд 0ff), а затем центрифугировали при 12500 об / мин при 8 ° C в течение 30 минут и собирали супернатант. Растворимый белок, присутствующий в супернатанте, очищали с помощью Ni-аффинной хроматографии с буферами, содержащими 50 мМ Трис (pH 8.8) и 25 мМ NaCl с увеличением концентрации имидазола @ 25 мМ, 50 мМ, 75 мМ и 300 мМ в промывке №1, промывке №2, промывке №3 и в буфере для элюирования соответственно. Элюированный белок из колонки Ni-NTA дополнительно концентрировали через концентраторы (Millipore) для уменьшения объема до 2–3 мл, а затем его дополнительно очищали с помощью эксклюзионной хроматографии. Чистоту и целостность Nef и ASK-1 подтверждали с помощью SDS / PAGE и вестерн-блоттинга.
Подтверждение беременности у крыс Sprague Dawley
Взрослые самки весом около 160–180 г и самцы весом около 180–200 граммов были помещены вместе в одну клетку для спаривания во второй половине дня (16:00 — 18:00) в соотношении 3∶1.Самцы совокупляются с самками во время проэструса примерно в середине темного цикла. Успешное спаривание было подтверждено наличием вагинальной пробки у самок утром после совокупления, которое считалось 1-м днем беременности. Также осторожно собирали вагинальный мазок и готовили мазок на предметном стекле для исследования наличия сперматозоидов под световым микроскопом для подтверждения естественного спаривания, а также установленной беременности.
Анализ крови на мозговой барьер и проницаемость плацентарного барьера
Синий краситель Эванса использовали для анализа проницаемости гематоэнцефалического барьера у четырнадцатидневных беременных крыс.Брали двадцать беременных крыс Sprague Dawley и разделили их на пять групп в качестве контроля (без инъекции), по 0, 250 и 500 мкг рекомбинантного Nef и 500 мкг ASK-1 в каждой группе из четырех животных. Меньшее количество инъекций Nef также проверялось перед тем, чтобы иметь представление о пороговом значении инъекции Nef, необходимого для нарушения плацентарного барьера (Таблица S1). 2% краситель Evans Blue растворяли в нормальном физиологическом растворе 0,85% хлорида натрия и 500 мкл красителя, содержащего рекомбинантный Nef в концентрации 0, 250 и 500 мкг, и 500 мкг ASK-1 вводили внутривенно в хвостовую вену каждой группе пациентов. животные.Через 1 час всех крыс, включая тех, которым не вводили инъекцию, анестезировали и препарировали, чтобы осторожно удалить всю матку и мозг. Дальнейшие ткани плода; матку, плаценту, амниотическую оболочку и эмбрион осторожно отделяли и собирали в PBS для немедленного измерения веса этих органов. Каждую ткань плода гомогенизировали в PBS (pH 7,4), корректируя массу ткани в концентрации мг / мл. Гомогенизированную ткань центрифугировали при 10000 об / мин при 4 ° C в течение 15 минут и собирали прозрачный супернатант.Теперь определяли оптическую плотность (OD) надосадочной жидкости при 590 нм, которую рассчитывали на мг веса ткани для количественного анализа синего красителя Эванса. Поглощение синего красителя Эванса измеряли при OD 590 в головном мозге, а также тканях плода, участвующих в гематоэнцефалическом барьере и плацентарном барьере, соответственно. Абсорбцию принимали как среднее значение для четырех животных, а фактическую абсорбцию рассчитывали после нормализации фоновых значений из неинъектированного контрольного набора тканей.
ELISA
Лизаты тканей головного мозга, матки, плаценты, амниотической мембраны, а также амниотической жидкости гомогенизировали в PBS, содержащем 1% (мас. / Об.) Тритон х-100, от различных групп крыс. Гомогенат центрифугировали при 10000 об / мин в течение 15 мин и собирали прозрачный супернатант. Оценка концентрации белка для лизата производилась методом Брэдфорда (Sigma). 96-луночные планшеты (Greiner) покрывали 50 мкг общего белка из всех образцов лизата в повторах и инкубировали при 37 ° C в течение 2 часов.Супернатант отбрасывали, и лунки блокировали на 2 часа 5% BSA в PBST, а затем инкубировали с антителом против Nef (Santa-Cruze, США) при разведении 1-500 в 2% BSA в течение 2 часов. Супернатант отбрасывали и проводили пять промывок PBST по 5 минут каждая. Эти лунки дополнительно инкубировали с HRP-конъюгированными козьими антителами против ослиных (Santa Cruz) в разведении 1-10 000 в течение 2 часов, с последующими еще пятью промывками PBST в течение 5 минут каждая и проявляли с субстратом TMB (Pierce).Оптическая плотность измерялась при 450 нм.
Одновременно проводили ELISA с известными количествами рекомбинантного Nef в диапазоне от 0,25 до 25 нг, чтобы построить стандартный график (Рисунок S3). Стандартный график использовали для расчета количества рекомбинантного белка Nef в экспериментальных образцах.
Иммунофлуоресценция
Ткани плода; матку, плаценту, амниотическую оболочку и эмбрион отделяли от крыс и фиксировали в 4% параформальдегиде в течение 10-15 часов с последующей дегидратацией 70%, 80% и 90% изопропанолом последовательно в течение 1 часа каждый, а затем инкубировали в 100% растворе. изопропанол в течение 1 часа, в течение которого изопропанол меняли трижды.Затем ткани трижды обезвоживали в ксилоле в течение получаса и готовили блоки, парафинируя их в расплавленном воске в течение 4–10 часов. Теперь срезы 7 мкм были приготовлены на предметных стеклах, покрытых яичным альбумином.
Залитые парафином срезы тканей на предметных стеклах депарафинизировали ксилолом в течение 10 минут и регидратировали абсолютным спиртом, затем 90%, 70% изопропиловым спиртом в течение 5 минут каждый, а затем дистиллированной водой. После депарафинизации и регидратации блокировку срезов проводили с помощью 3% BSA (Sigma) в PBS в течение 1 часа во влажной камере при комнатной температуре.Теперь срезы инкубировали в течение ночи при 4 ° C с антителом против Nef, полученным у коз (Санта-крус), используя разведение 1∶100 вместе с антителом к E-кадгерину (Санта-крус), используя разведение 1∶100 (конъюгировано с мукой Alexa 647. ) в 1% BSA в PBS. Затем предметные стекла, содержащие срезы, промывали трижды PBST и дважды PBS в течение 5 минут. Теперь вторичное антитело козла, конъюгированное с FITC при разведении 1-250 в 1% BSA, было добавлено в срез и инкубировано в течение 4 часов в темноте при комнатной температуре с последующими тремя промываниями PBST, плюс две промывки PBS для По 5 минут каждое.Предметное стекло, содержащее срезы, инкубировали с DAPI (Sigma Aldrich USA 1 мкг / мл) в течение 20 мин при комнатной температуре после трех промывок PBS. Наконец, на предметные стекла закрепили постоянный фиксирующий и герметизирующий реагент Prolong gold (Invitrogen P36934) и исследовали с помощью флуоресцентной микроскопии.
Заявление об этике
Руководящие принципы CPCSEA / IAEC (регистрационный номер: 34/1999 от 11-3-99) строго соблюдались в течение всего курса обучения. Крысы SD, использованные в этом исследовании, были одобрены институциональным комитетом по этическому допуску IAEC, номер разрешения: IAEC / 2010/26, Центральный научно-исследовательский институт лекарственных средств, Лакхнау, штат Вашингтон, Индия.
Вспомогательная информация
Рисунок S1.
Специфичность антител Nef была подтверждена в эксперименте с параллельным иммуноокрашиванием, как определено в , фиг. 6, , при использовании вторичного антитела напрямую, без зондирования с помощью специфического антитела Nef. Панель состоит из набора фигур: матка, плацента, амниотическая оболочка и эмбрион. Синий цвет показывает ядерное окрашивание с помощью DAPI, тогда как перекрывающиеся изображения объединяются с фазовыми изображениями.Ткани плода выделяли от крыс через час внутривенной инъекции 500 мкг рекомбинантного белка Nef.
https://doi.org/10.1371/journal.pone.0051518.s001
(TIF)
Рисунок S2.
Специфичность обнаружения антител Nef была подтверждена в эксперименте с параллельным иммуноокрашиванием, как определено в Рисунок 6 , при использовании аналогичных срезов ткани из группы отрицательного контроля животных, которым вводили краситель (в течение часа) одна без Неф. Панель состоит из набора фигур: матка, плацента, околоплодные воды и эмбрион. Синий цвет показывает ядерное окрашивание с помощью DAPI, тогда как перекрывающиеся изображения объединяются с фазовыми изображениями.
https://doi.org/10.1371/journal.pone.0051518.s002
(TIF)
Благодарности
Благодарю за критическое редактирование, выполненное доктором Р. М. Сундарамом.
Вклад авторов
Эксперимент задумал и спроектировал: RKT MS. Проведены эксперименты: PS СКА.Проанализированы данные: РКТ МС. Написал статью: RKT MS. Разделение тканей и обращение с животными: SK MCT.
Ссылки
- 1. Mishra MK, Dutta K, Saheb SK, Basu A (2009) Понимание молекулярного механизма повреждения гематоэнцефалического барьера в экспериментальной модели японского энцефалита: корреляция с введением миноциклина в качестве терапевтического агента. Neuro Chem Int 55: 717–723.
- 2. Гринвуд Дж. (1991) Механизм разрушения гематоэнцефалического барьера.Нейробиология 33: 95–100.
- 3. Далласта Л.М., Писаров Л.А., Эсплен Дж.Э., Верли Ю.В., Моисей А.В. и др. (1999) Нарушение плотного соединения гематоэнцефалического барьера при энцефалите, вызванном вирусом иммунодефицита человека-1. Am J Pathol 155: 1915–1927.
- 4. Diamond MS, Klein RS (2004) Вирус Западного Нила: пересекает гематоэнцефалический барьер. Nat Med 10: 1294–1295.
- 5. Kwiek JJ, Mwapasa V, Milner DA, Alker AP, Miller WC, et al. (2006) Микротрансфузии от матери к плоду и передача ВИЧ-1 от матери ребенку в Малави.PLoS Med 3 (1): e10.
- 6. Сперлинг Р.С., Шапиро Д.Е., Кумбс Р.В., Тодд Дж.А., Герман С.А. и др. (1996) Вирусная нагрузка матери, лечение зидовудином и риск передачи вируса иммунодефицита человека 1 типа от матери к ребенку. Педиатрическая группа клинических испытаний СПИДа Протокол 076 Исследовательская группа. N Engl J Med 335: 1621–1629.
- 7. Mofenson LM, Lambert JS, Tiehm ER, Bethel J, Meyer WA и др. (1999) Факторы риска перинатальной передачи вируса иммунодефицита человека 1 типа у женщин, получавших зидовудин.Группа изучения педиатрических клинических испытаний СПИДа. Группа 185. N Engl J Med 341: 385–393.
- 8. Чандвани С., Греко М.А., Миттал К., Антуан С., Красински К. и др. (1991) Патология экспрессии вируса иммунодефицита человека в плаценте серопозитивных женщин. J Infect Dis 163 5: 1134–1138.
- 9. Lewis SH, Reynolds-Kohler C, Fox HE, Nelson JA (1990) ВИЧ-1 в трофобластических и ворсинчатых клетках Хофбауэра и гематологические предшественники у восьминедельных плодов. Ланцет 335: 565.
- 10.Багасра О., Боброски Л., Сайкумари П., Пестанер Дж. П., Сешамма Т. и др. (1995) Наличие ВИЧ-1 в плаценте ВИЧ-1 серопозитивных матерей по данным ПЦР in situ. Natl Conf Hum Retroviruses Relat Infect 2: 136.
- 11. МакГанн К.А., Коллман Р., Колсон Д.Л., Гонсалес-Скарано Ф., Коукос Г. и др. (1994) Вирус иммунодефицита человека типа 1 вызывает продуктивную инфекцию макрофагов в первичных культурах клеток плаценты. J Infect Dis 169: 746–753.
- 12. Аль-Хусайни AM (2009) Роль плаценты в вертикальной передаче вируса иммунодефицита человека.Ж. Перин 29: 331–336.
- 13. Дерриен М., Фэй А., Дольчини Дж., Чауат Дж., Дерриен М. и др. (2005) Плацентарный баланс цитокинов и хемокинов при регуляции индуцированной межклеточным контактом транслокации вируса иммунодефицита человека типа 1 через трофобластический барьер in vitro. J Virol 79: 12304–12310.
- 14. Mulder-Kampinga GA, Simonon A, Kuiken CL, Dekker J, Scherpbier HJ, et al. (1995) Сходство генов env и gag между геномными РНК вируса иммунодефицита человека типа 1 (ВИЧ-1) от матери и ребенка не связано со временем положительности РНК ВИЧ-1 у ребенка.J Virol 69: 2285–2296.
- 15. Mullard A (2008) Инфекционное заболевание: поиск ключей к плацентарному барьеру. Nat Rev Microbiol 6: 798–798.
- 16. Венкат Р.К., Ахмад Н. (2001) Низкая консервация функциональных доменов генов vif и vpr ВИЧ 1 типа у инфицированных матерей коррелирует с отсутствием вертикальной передачи. Ретровирусы AIDS Res Hum 17: 911–923.
- 17. Венкат Р.К., Хусейн М., Хороднер А., Ахмад Н. (2001) Молекулярная характеристика ВИЧ-типа 1.гены vpu от матери и ребенка после перинатальной передачи. Ретровирусы AIDS Res Hum 17: 1089–1098.
- 18. Husain M, Hahn T, Yedavalli VR, Ahmad N (2001) Характеристика последовательностей tat типа 1 ВИЧ, связанных с перинатальной передачей. Ретровирусы AIDS Res Hum 17: 765–773.
- 19. Хан Т., Рамакришнан Р., Ахмад Н. (2003) Оценка генетического разнообразия гена NEF вируса иммунодефицита человека типа 1, связанного с вертикальной передачей. J Biomed Sci 10: 436–450.
- 20. Acheampong EA, Cassandra R, Muhammad M, Alagarsamy S, Mohammad R и др. (2009) Комбинированные эффекты гипергликемических состояний и ВИЧ-1 Nef: потенциальная модель индуцированного нейропатогенеза ВИЧ. Дж. Вирол 6 10: 183.
- 21. Каварелли М., Скарлатти Г. (2010) Использование корецепторов ВИЧ-1: влияние на передачу от матери ребенку и педиатрическую инфекцию. J Transl Med 9: S1 – S10.
- 22. Паттерсон Б.К., Бехбахани Х., Кабат В.Дж., Салливан Й., О’Горман М.Р. и др.(2001) Фактор ингибирования лейкемии подавляет репликацию ВИЧ-1 и активируется в плаценте у женщин, не передающих кровь. Дж. Клин Инвест 107: 287–94.
- 23. Mordelet E, Kissa K, Cressant A, Gray F, Ozden S и др. (2004) Гистопатологические и когнитивные дефекты, вызванные Nef в головном мозге. Журнал Faseb 18: 1851–1861.
- 24. Mathur A, Khanna N, Chaturvedi UC (1992) Нарушение гематоэнцефалического барьера с помощью вирус-индуцированного цитокина во время инфицирования вирусом японского энцефалита.Int J Exp Pathol 73: 603–611.
- 25. Chaturvedi UC, Dhawan R, Khanna M, Mathur A (1991) Нарушение гематоэнцефалического барьера во время заражения мышей вирусом денге. J Gen Virol 72: 859–866.
- 26. Sporer B, Koedel U, Paul R, Kohleisen B, Erfle V и др. (2000) Белок Nef вируса иммунодефицита человека типа 1 вызывает нарушение гематоэнцефалического барьера у крыс: роль матриксной металлопротеиназы-9. Нейроиммунол 102 125–30.
- 27. Фостер Дж. Л., Гарсия СП (2008) ВИЧ-1 Nef: на распутье.Ретровирол: 5–84.
- 28. D’costa GF, Khadke K, Vishwasrao PY (2007) Патология плаценты при ВИЧ-инфекции. Индийский журнал J Pathol Microbiol 50: 515–519.
- 29. Kwon BS, Tan KB, Ni J, Oh KO, Lee ZH и др. (1997) Недавно идентифицированный член суперсемейства рецепторов фактора некроза опухоли с широким тканевым распределением и вовлечением в активацию лимфоцитов. J Biol Chem 272: 14272–14276.
- 30. Назир А., Самми С.Р., Сингх П., Трипати Р.К. (2010) Трансклеточное введение белка Nef ВИЧ-1 вызывает патогенный ответ у Caenorhabditis elegans.Plos One 5: e15312.
- 31. Hanna Z, Priceputu E, Hu C, Vincent P, Jolicoeur P (2006) Мутации Nef ВИЧ-1, отменяющие регуляцию CD4, влияют на другие функции Nef и демонстрируют снижение патогенности у трансгенных мышей. J Virol 346: 40–52.
- 32. Арольд С.Т., Баур А.С. (2001) Динамическая динамика Nef и Nef: как структура может объяснить сложную активность этого небольшого белка ВИЧ. Тенденции Biochem Sci 26: 6.
- 33. Гринуэй А.Л., Холлоуэй Г., Макфи Д.А., Эллис П., Корнолл А. и др.(2003) Контроль Nef ВИЧ-1 клеточными сигнальными молекулами: несколько стратегий, способствующих репликации вируса. J Bio Sci 28: 3.
- 34. Паттерсон Б., Бехбахани Х., Кабат В.Дж., Салливан И., Морис Р.Г. и др. (2001) Фактор ингибирования лейкемии подавляет репликацию ВИЧ-1 и активируется в плаценте у женщин, не передающих кровь. Дж. Клин Инвест 107: 287–294.
- 35. Pornprasert S, Faye A, Mary JY, Dolcini G, Leechanachai P (2006) Понижающая модуляция плацентарной экспрессии мРНК TNF-α с помощью AZT, используемого для предотвращения передачи ВИЧ-1 от матери к ребенку.Плацента 27: 989–995.
- 36. Френкель Л.М., Коулз М.К., Шапиро Д.Е., Мелвин А.Дж., Уоттс Д.Х. и др. (1997) Анализ материнского компонента схемы лечения зидовудина в группе 076 по клиническому следу СПИДа в профилактике передачи вируса иммунодефицита человека типа 1 от матери ребенку. J. Infet Dis 175: 971–974.
- 37. Бай Х, Чжан Л., Ма Л, Доу XG, Фэн Г.Х. и др. (2007) Взаимосвязь инфицирования вирусом гепатита В плацентарного барьера и внутриматочного механизма вируса гепатита В.World J Gastroenterol 13: 3625–3630.
- 38. Wu Y, Marsh JW (2001) Селективная транскрипция и модуляция активности покоящихся Т-клеток с помощью предварительно интегрированной ДНК ВИЧ. Наука 293: 1503–1506.
- 39. Cao Y, Krogstad P, Korber BT, Koup RA, Muldoon M и др. (1997) Вирусная нагрузка ВИЧ-1 у матери и вертикальная передача инфекции: Проект Ариэль по профилактике передачи ВИЧ от матери ребенку. Nat Med 3: 549–552.
- 40. Ханна З., Кей Д.Г., Ребай Н., Гимонд А., Джоти С. и др.(1998) Неф содержит основной фактор, определяющий патогенность СПИД-подобного заболевания, вызванного ВИЧ-1 у трансгенных мышей. Ячейка 95: 163–175.
- 41. Сингх П., Ядав Г. П., Гупта С., Рамачандран Р., Трипати А. К. и др. (2011) Новый переход димер-тетрамер, зафиксированный кристаллической структурой Nef ВИЧ-1. J Plos ONE 6: e26629.
Нарушение кровотока 1 А степени при беременности: возможные причины, симптомы, методы диагностики и лечение | общество
Во время беременности женский организм начинает восстанавливаться.Поэтому в этот период важно держать под контролем состояние как женщины, так и плода. Согласно медицинской татике,
Содержимое:
Во время беременности женский организм начинает восстанавливаться. Поэтому в этот период так важно держать под контролем состояние как женщины, так и плода. Согласно медицинской статистике, у довольно большого количества беременных наблюдается нарушение кровотока. Возникший в организме дополнительный круг кровообращения требует постоянного наблюдения специалистов.Его нарушение может привести к гибели плода, причем произойти это может на любом сроке беременности. Попробуем разобраться, почему нарушается кровоток при беременности.
Немного теории
Всем известно, что плацента действует как связующее звено между телом женщины и плодом. В этой сложной системе различают два типа кровообращения — плацентарный и фетальный. Любое нарушение одного из них может привести к довольно печальным последствиям, вплоть до развития различных заболеваний.Степень серьезности проблемы оценивает только врач.
В этом случае женщине, находящейся на 30 неделе беременности, необходимо обязательно пройти специальную ультразвуковую диагностику, при которой на трехмерном изображении хорошо видны плацентарные сосуды. Если есть какое-либо нарушение, врач обязательно его увидит, так как происходит изменение пространственного соотношения маточного и плодно-плацентарного кровообращения. Это очень опасное состояние организма, так как дыхательная функция подавлена, а развитие плода приостановлено.
Степень нарушения
В медицине выделяют три степени тяжести данной патологии. Первая степень считается самой легкой, когда недостаточное кровообращение еще не достигло критических значений. В этом случае гемодинамика плода находится в удовлетворительном состоянии. Выделяют нарушение маточно-плацентарного кровотока 1 А степени и недостаточное плодно-плацентарное кровообращение 1 Б степени.
Вторая степень характеризуется ухудшением кровоснабжения плода.В 50% случаев наблюдается снижение максимальной скорости кровотока по всем сердечным клапанам, причем такое нарушение наблюдается как у плода, так и в маточных артериях.
Нередко за короткий промежуток времени вторая степень переходит в третью. В этом случае кровоток к плоду практически перестает поступать, что может вызвать гипоксию. Высока вероятность снижения диастолического кровотока в аорте, а в некоторых случаях он может полностью исчезнуть.
Причины
Если при беременности наблюдается нарушение кровотока 1 степени, причины, приводящие к этому, могут быть разными.Многочисленные неблагоприятные факторы могут повлиять на плаценту не только во время ее формирования, но и в более поздний срок. В медицинской практике различают первичную и вторичную недостаточность кровообращения, при которой нарушается функционирование плаценты, выступающей в качестве транспортного, защитного, иммунного, метаболического и эндокринного органа.
Таким образом, нарушение кровотока 1 А степени при беременности может возникать по следующим причинам:
- отек матки;
- генетические дефекты;
- последствия аборта;
- инфекционные болезни;
- гипертоническая болезнь;
- болезни надпочечников и щитовидной железы;
- структурных аномалий;
- гормональные нарушения;
- поздний токсикоз;
- тромбоз, атеросклероз;
- сахарный диабет.
Если своевременно не устранить данную патологию, то через 6 недель небольшое нарушение кровотока может перейти в третью стадию. Если проблема обнаружена на 30-й неделе, у врача еще есть время принять соответствующие меры для восстановления нормального кровообращения.
Симптомы
Любая патология характеризуется своей клинической картиной, благодаря которой врач может сделать соответствующее заключение. Отсутствие гемодинамики приводит к изменению функционирования плаценты, из-за чего начинает страдать плод.К нему начинают поступать необходимые питательные вещества и кислород в ограниченном количестве, а выведение продуктов обмена замедляется. Начали появляться признаки гипоксии плода, в результате чего его внутриутробное развитие приостанавливается.
Таким образом, при нарушении кровотока при беременности симптомы этого состояния выглядят следующим образом:
- учащенное сердцебиение;
- снижение или повышение двигательной активности плода;
- несоответствие объема живота конкретному сроку беременности.
Такие признаки обычно возникают при декомпенсированной форме плацентарной недостаточности. Если нарушение маточного кровотока при беременности составляет 1 А или 1 Б степени, то эти симптомы еще не проявляются, так как гемодинамика компенсируется. Обычно выявляется при диагностических исследованиях.
Диагностика
Для выявления нарушения кровотока 1 А при беременности необходимо пройти ряд обследований, с помощью которых вид и степень произошедших изменений, а также определить состояние плод, определяются.В этом случае врач назначает следующие процедуры:
- анализ крови на такие гормоны, как эстрогены, хорионический гонадотропин, прогестерон;
- кардиотокография;
- ультразвуковая процедура;
- допплерометрия.
В некоторых случаях врач уже во время обследования может определить возникшее нарушение, ориентируясь на частоту сердечных сокращений ребенка, которые рассчитываются при аускультации. Но наиболее достоверные результаты обычно получаются после лабораторных и инструментальных исследований.
Лечение
Нарушение маточно-плацентарного кровотока любой степени требует лечения. В основном лечебные мероприятия направлены на предотвращение прогрессирования патологии в будущем. Гемодинамика нормализуется только при выявлении нарушения кровотока 1B степени.
При патологической беременности используются различные средства для улучшения состояния плода. В основном используются консервативные методы лечения. Хирургическое вмешательство возможно только при осложнениях и по жизненным показаниям.При нормализации нарушений кровотока применяется комплекс мероприятий — патогенетическое, этиотропное и симптоматическое лечение.
Медикаментозное лечение
Чаще всего нарушение кровотока 1 степени А во время беременности корректируется медикаментами. При обнаружении начальных признаков нарушения лечение проводится в амбулаторных условиях. Более тяжелая недостаточность кровообращения требует госпитализации.
Для лечения используются следующие препараты:
- спазмолитики — «Эуфиллин», «Но-шпа»;
- сосудистые — «Актовегин»;
- антиагрегантов — «Курантил»;
- витаминов и микроэлементов — «Аскорбиновая кислота», «Магне В6»;
- гепатопротекторов — «Хофитол», «Эссенциале»;
- токолитики — «Партусистен», «Гинипрал»;
- улучшение микроциркуляции крови — «Трентал»;
- антигипоксанты — «Инстенон»;
- метаболический — «АТФ».
Обычно для улучшения состояния проводят два курса терапии — сразу после постановки диагноза и на сроке 32-34 недели. После этого врач принимает решение о способе родоразрешения. Это особенно важно, если нарушение кровообращения тяжелое. При нарушении кровотока 1 степени роды проходят естественным путем.
Хирургический
При выраженном нарушении кровотока проводят экстренные роды.В случае неэффективности консервативного лечения даже при легком нарушении решение принимается в течение двух дней. Обычно делается кесарево сечение. Если он запланирован на срок гестации менее 32 недель, то оценивается состояние плода и его жизнеспособность.
Профилактические мероприятия
Во избежание такого патологического состояния, как нарушение кровотока 1 степени при беременности, следует принимать профилактические меры. Женщина, ожидающая ребенка, должна употреблять продукты, содержащие необходимые витамины, микро- и макроэлементы, жиры, углеводы. и белки.Ежедневно следует употреблять не менее 1,5 л жидкости, но только в том случае, если вы не страдаете отеками.
Также важно контролировать свой вес. Во время беременности рекомендуемая прибавка в весе не должна превышать 10 кг. Женщины из группы риска получают профилактику препаратами для взаимодействия систем организма матери с плодом и для предотвращения крайне опасной дисфункции маточно-плацентарного кровообращения. Немаловажную роль играет своевременно выверенная методика ведения родов.Но следует помнить, что даже соблюдение этих мер не исключает возникновения тяжелых неврологических осложнений.
Заключение
Таким образом, очень важно контролировать кровоток во время беременности. Причины нарушения кровообращения могут быть разными. Главное — следить за своим здоровьем, а своевременное обнаружение патологии поможет предотвратить серьезные последствия для будущего ребенка.
Кровоток матки и плаценты
Кровообращение матки чрезвычайно чувствительно к стимуляции эстрогенами, реагируя с расширением сосудов, не имеющим аналогов в других органах тела, на любые другие раздражители. 2 Во время яичникового цикла повторяющиеся паттерны UBF отражают эффект секреции эстрогена и модулирующие эффекты прогестерона. Эти циклические паттерны наиболее ярко проявляются у животных с короткими фазами преовуляторного цикла, таких как корова, свиноматка и овца, и проиллюстрированы на Рисунке 1 с периферическими уровнями эстрогена и прогестерона. 3 , 4 , 5 После зачатия у этих видов паттерны UBF аналогичны таковым у небеременных животных до тех пор, пока через 17–28 дней не произойдет перекрещивание тканей матери и плода; затем происходит окончательное и прогрессирующее увеличение UBF, которое продолжается до доношенной беременности.Поскольку эрозия эндометрия трофобластом плода происходит намного раньше после зачатия у приматов, разумно предположить, что UBF увеличивается раньше у этих видов, хотя такие реакции никогда не наблюдались. Общие закономерности общего UBF, UBF на единицу веса матки и ее содержимого, доли UBF, поставляющей плаценту, и веса плода на протяжении овечьей беременности показаны на Рисунке 2. Период между 17 и 70 днями беременности связан с наибольшим количеством беременностей. быстрые изменения UBF и PBF и соответствуют времени окончательной плацентации у этого вида.По механизмам, которые до конца не изучены, кровеносные сосуды, снабжающие плаценту, прогрессивно расширяются в течение этого времени, одновременно вызывая абсолютное увеличение общего UBF и шунтирование этой крови из неплацентарных тканей в плацентарные *. С последующим созреванием плаценты часть UBF, поставляющая плаценту и абсолютное количество PBF увеличивается, но со скоростью, более близкой к скорости роста плода; таким образом, в течение последней половины беременности UBF на единицу веса матки и ее содержимого практически не меняется.В течение этого же времени количество кислорода, извлекаемого из каждого миллилитра крови, постоянно, и поэтому количество кислорода, доставляемого на данный вес беременной матки, также остается постоянным. 6 Корреляционные исследования у женщин указывают на схожие гомеостатические паттерны от 10 до 40 недель беременности и аналогичное потребление кислорода (примерно 10 мл / кг). 7 Поскольку женщины доставляют такое же количество кислорода при более низких скоростях UBF, чем овцы (~ 150 против ~ 270 мл / кг), отсюда следует, что человеческая плацента более эффективна в этом отношении.Таким образом, для плодов аналогичного веса требуется меньше абсолютного UBF и нагрузка на сердце при беременности уменьшается.
Рис. 1. Односторонний паттерн маточного кровотока во время эстрального цикла овцы, показанный с указанными уровнями эстрогенов и прогестерона в сыворотке (адаптировано из Greiss FC, Jr, Anderson SG: Am J Obstet Gynecol 103: 629, 1969; Yuthasastrakosol P et al: J Reprod Fertil 43:57, 1975.) |
Рис. 2. Продольные модели маточного кровотока и его распределение во время беременности у овец. |
Изменения PBF достигаются за счет постоянно увеличивающейся вазодилатации кровеносных сосудов, снабжающих плаценту на протяжении всего периода беременности. Однако в любой момент второго и третьего триместров дальнейшего острого расширения сосудов не может произойти. Следовательно, чтобы поддерживать постоянную доставку кислорода во время эпизодов пониженного PBF, должна происходить повышенная экстракция кислорода (рис. 3). Судя по отчетным данным, кажется, что предел увеличения добычи — двукратный.Таким образом, PBF должен быть уменьшен более чем на 50%, прежде чем будет снижена доставка кислорода. Эти соображения предполагают, что скорость гомеостатического PBF была оптимальной до уменьшения потока. Однако мы знаем, что гомеостатические уровни могут быть неоптимальными либо подостры, как при токсемии, либо хронически, как при нефропатиях. В таких случаях коэффициент безопасности , то есть процент, на который PBF может быть снижен до того, как поставка кислорода будет нарушена, снижается. Это всегда необходимо учитывать при оценке воздействия острого раздражителя на плод.
Рис. 3. Изменения в артериовенозной экстракции кислорода маткой — (A-V) 0 2 — в ответ на снижение кровотока в матке во второй половине беременности овец. Поскольку (A-V) 02 можно удвоить, доставка 02 в матку будет поддерживаться на гомеостатическом уровне до тех пор, пока кровоток в матке не уменьшится более чем на 50%. Четкие, пунктирные и обведенные области указывают на гипотетические степени фетального резерва, определяемые как функция оптимального плацентарного кровотока, и используются для обозначения аналогичных уровней фетального резерва на последующих иллюстрациях.(По материалам Huckabee WE, Metcalfe J, Prystowsky H et al: Кровоток и потребление кислорода беременной маткой. Physiol 200: 274, 1961.) |
межворсинчатое пространство (примерно одно на семядолю плаценты) теряет свои капиллярные связи и расширяется примерно в десять раз в результате замещения стенок сосудов трофобластом. Этот процесс может распространяться до или ниже сочленения миоэндометрия, буквально превращая спиральные артериолы в спиральные артерии.Кровь, протекающая через эти модифицированные кровеносные сосуды в межворсинчатое пространство, включает PBF.
У овец в небеременном состоянии присутствуют множественные дискретные области эндометрия, называемые карункулами . Во время беременности в этих карункулах происходит переплетение тканей плода и матери, которые увеличиваются и становятся отдельными семядолями плаценты. Кровь, притекающая к этим областям, вместе составляет PBF. Хотя семядольные артериальные кровеносные сосуды значительно расширяются, они не содержат трофобластических элементов, передача от матери к плоду осуществляется через капиллярно-капиллярный интерфейс, и межворсинчатое пространство отсутствует.
Динамические реакции маточного кровообращения
Кровеносные сосуды небеременной матки реагируют так же, как и сосуды любого другого мышечного органа, за исключением их уникальной реактивности на эстрогенную стимуляцию, их реакции на местные анестетики и, возможно, их реакции к простагландинам (таблица 1). Во время беременности кровеносные сосуды, кровоснабжающие плаценту, постепенно расширяются, достигая состояния, при котором дальнейшее острое расширение может быть минимальным или отсутствовать. 24 Следовательно, стимулы, вызывающие расширение сосудов в небеременной матке, неэффективны после того, как произошла окончательная плацентация. Однако сосуды плаценты сохраняют способность сужать сосуды, как и в небеременном состоянии. Поскольку PBF составляет примерно от 80% до 90% от общего UBF при доношенной беременности, общие сосудистые реакции матки будут выглядеть так же, как и реакции сосудов плаценты. Этот момент часто неверно интерпретируют, и нужно помнить, что реакция неплацентарных сосудов одинакова, независимо от того, есть беременность или нет.
ТАБЛИЦА 1. Реакции небеременных сосудов матки *
Сужение сосудов | Сосудорасширение | ||
(дофамин, адреналин, | (изопротеренол, эпинефрин) 8 , 9 , 16 | ||
| 1 , норэпинефрин) 9 , 10 | Ацетилхолин и парасимпатомиметики 23 | ||
Симпатомиметики 11 | руб. адикинин 17 , 18 | ||
Гипоксемия (тяжелая) 12 | Цианид 19 | ||
9075 Местные анестетики | (внутриартериальное введение) 13 , 14 | (отсроченное, но пролонгированное действие) 2 | |
Никотин | Глюкозамин85 | 0 α -адренергическое посредничество) 15 | (? осмотический эффект) 21 |
Гипоксемия (легкая) 12 | |||
Ишемия 19554 77 | |||
Простагландины E 1, E 2, и I 18 , 22 | |||
9000 | 9000 Поли900 |
* Заметное расширение кровеносных сосудов, кровоснабжающих плаценту, и преимущественное распределение маточного кровотока к плаценте, облитерирующее ответ беременных; поэтому эффекты сосудорасширяющих стимулов во время беременности противоречивы.При тестировании неплацентарные сосудистые реакции аналогичны ответам небеременных.
Гемохориальная структура плаценты человека добавляет уникальный фактор к тем факторам, которые обычно контролируют кровоток в других сосудистых руслах. То есть кровь проходит по спиральным артериям, попадает в похожее на болото межворсинчатое пространство, перфузирует ворсинки плода, а затем возвращается в общую циркуляцию через множество собирающих вен в базальной пластинке. Фактически, кровь покидает нормальные сосудистые каналы и циркулирует в новом внесосудистом пространстве, трансплантированном на матку на время беременности.Поскольку межворсинчатое пространство находится внутри полости матки и плацента представляет собой гибкую структуру, давление, создаваемое сокращающимся миометрием, будет передаваться в равной степени в амниотическую полость и межворсинчатое пространство. Таким образом, фактор, не имеющий отношения к обычному сосудистому контролю, активность миометрия, может изменять давление в межворсинчатом пространстве и влиять на PBF за счет своего воздействия на перфузионное давление. Схематическое изображение кровотока к неплацентарным тканям и к одной семядоли показано на рисунке 4 вместе с формулами, относящимися к контролю каждой из них.Следует отметить, что эти формулы — всего лишь приложения закона Ома к этим индивидуальным сердечно-сосудистым ситуациям.
Рис. 4. Неплацентарное и плацентарное кровообращение и факторы, влияющие на каждую матку приматов. Связь между этими факторами и распределительным кровотоком определяется в прилагаемом уравнении. UABP — артериальное давление в матке; UVBP — артериальное давление в венозной матке; R e, внешнее сосудистое сопротивление; Ri N-PL и Ri PL, внутреннее сопротивление сосудов, вызванное реактивностью неплацентарных и плацентарных артериол, соответственно.(Из Greiss FC, Jr: MCV / Q, 8:52, 1972) |
Перфузионное давление, доставляющее кровь к неплацентарным тканям, представляет собой разницу между артериальным и венозным давлением в матке. Однако давление перфузии, доставляющее кровь в межворсинчатое пространство, представляет собой разницу между артериальным давлением матки и давлением в межворсинчатом пространстве. Последнее лучше всего определяется давлением околоплодных вод (IUP). В мышечном органе факторы сопротивления будут включать сопротивление, обусловленное реактивностью гладких мышц сосудов, или внутреннее сопротивление (R и ), и сдавливание, передаваемое кровеносным сосудам, когда они проходят через сокращающийся миометрий, или внешнее сопротивление (R e ). .Таким образом, должно быть очевидно, что сокращения матки могут влиять на PBF двумя механизмами: за счет увеличения R e и за счет снижения давления перфузии плаценты.
В клинической практике важны три основных характеристики плацентарного сосудистого контроля. К ним относятся взаимосвязь между перфузионным давлением и потоком, реакция спиральных артерий на вазоактивные стимулы и эффекты сокращений миометрия. Кроме того, следует принимать во внимание уникальные эффекты местных анестетиков.
Взаимосвязь между давлением и потоком
При наблюдении изменений в UBF, вторичных по отношению к снижению перфузионного давления во время покоя миома, можно определить прямолинейную зависимость с крутизной, равной единице (рис. 5). Это отражает широко расширенную природу сосудистой сети плаценты и указывает на то, что PBF будет уменьшаться почти в той же пропорции, что и снижение перфузионного давления. Поскольку в большинстве обстоятельств венозное давление в матке является довольно постоянным, изменения системного артериального давления (MBP) можно использовать для приблизительного определения изменений PBF.То есть можно ожидать, что снижение среднего артериального давления на 25% вызовет снижение PBF на 25%. Однако такие измерения следует проводить в положении лежа на боку, поскольку было показано, что давление беременной матки только на аорту снижает кровяное давление в области таза ниже давления, наблюдаемого в плечевой артерии.
Рис. 5. Линия регрессии давление-поток, определенная на основе объединенных пропорциональных данных для доношенных беременных овец. Поскольку зависимость является линейной, кровоток в матке будет изменяться пропорционально любому изменению перфузионного давления.(Из Greiss FC, Jr: Am J Obstet Gynecol 96:41, 1966.) |
Ответы на вазоактивные стимулы
Поскольку спиральные артерии в состоянии покоя достигают максимального расширения, сосудорасширяющие агенты или стимулы оказывают незначительное влияние или не оказывают никакого эффекта. хотя рецепторы для таких агентов присутствуют. Однако гладкие мышцы этих сосудов чрезвычайно чувствительны к сосудосуживающим агентам или стимулам, более чувствительны, чем к большинству других периферических сосудов (рис. 6). Это означает, что, хотя MPB может увеличиваться в ответ на стимуляцию периферически действующим вазопрессорным препаратом, таким как фенилэфрин, пропорциональное увеличение плацентарного сосудистого сопротивления (R i ) намного больше, чем чистый эффект — заметное снижение PBF.Такие различия в чувствительности к вазоконстрикторам следует учитывать всякий раз, когда показаны вазопрессоры. Использование препарата более центрального действия, такого как эфедрин, хотя и вызывает небольшое сужение сосудов плаценты, приведет к пропорционально большему улучшению MBP с абсолютным увеличением PBF.
Рис. 6. Исходные записи, показывающие влияние внутривенного ( A ) левартеренола (норэпинефрина) и ( B ) адреналина на кровяное давление, сердечный выброс и кровоток в матке при доношенной овечьей беременности.Пропорциональные изменения по сравнению с контрольными уровнями системной и маточной проводимости (величина, обратная сопротивлению) были заключены в скобки. Обратите внимание, что снижение маточной проводимости (увеличение сопротивления) превышает снижение системной проводимости с другими агентами. (Из Greiss FC, младший: Obstet Gynecol 21: 295, 1963. Предоставлено Harper & Row, Publishers.) |
Сокращения миометрия
Действуя двумя механизмами, описанными выше, увеличивая R e и снижая давление перфузии сокращения миометрия уменьшают PBF прямо пропорционально интенсивности и продолжительности каждого сокращения.Взаимосвязь настолько точна, что отслеживание внутриматочного давления является почти точным обратным изображением PBF (рис. 7). Увеличение частоты сокращений снижает PBF в течение данной единицы времени за счет уменьшения продолжительности диастолы миометрия, то есть того времени, когда PBF находится на гомеостатическом уровне. Кроме того, при повышении тонуса между сокращениями, как при отслойке плаценты, пропорционально снижается межсокращательный тонус. Радиоангиографические исследования на нечеловеческих приматах и женщинах показывают, что во время пика сокращений миометрия средней интенсивности PBF прекращается. 25 Таким образом, очевидно, что роды по своей природе являются стрессовыми для плода, поскольку среднее количество PBF, перфузирующее ворсинки плода за данный период времени, постепенно уменьшается по мере увеличения частоты и интенсивности сокращений матки.
Рис. 7. A. Взаимосвязь между кровотоком матки (UBF) и сокращениями матки во время спонтанных родов у макаки резус. Обратите внимание на обратную связь изображения, резкое уменьшение UBF в начале сокращений и более медленное восстановление UBF базальных уровней.UBF восстанавливал базальный уровень только при «нормальном» тонусе. В . Влияние повышенной частоты сокращений на UBF, вызванное стимуляцией окситоцином спонтанных родов, показано в A. Обратите внимание, что продолжительность фаз нормального тонуса уменьшается. Скорость UBF, достигаемая между сокращениями, зависит от интенсивности предыдущего сокращения и продолжительности фазы нормального тонуса. После сокращений 7 и 12 восстановление кровотока было неполным, поскольку последующее сокращение произошло без фазы нормального тонуса.(Из Greiss FC, Jr, Anderson SG: Clin Obstet Gynecol 11:96, 1968. Предоставлено Harper & Row, Publishers.) |
Местные анестетики
Эти препараты могут оказывать действие непосредственно на сосудистое русло, так как после случайной внутрисосудистой инъекции и косвенно, в результате паралича вегетативных нервов, поддерживающих нормальный тонус сосудов. В большинстве органов внутрисосудистые инъекции не оказывают значительного влияния на сопротивление сосудов. Однако сосуды матки и плаценты реагируют на такие стимулы значительным сужением сосудов.Кроме того, такие препараты стимулируют миометрий в различной степени (рис. 8). По отдельности или вместе эти ответы уменьшают PBF. После введения парацервикальной блокады во время родов может развиться отсроченная брадикардия плода. Лучшая гипотеза, объясняющая реакцию плода, заключается в том, что местные анестетики вводятся близко к маточным артериям и что из-за их превосходной пенетрантности они проникают через стенки артерий, вызывая их маточные эффекты, уменьшая PBF и вызывая гипоксию плода.
Рис. 8. Зависимость реакции от дозы местных анестетиков, вводимых непосредственно в маточную артерию, с проводимостью маточных сосудов и внутриматочным давлением во время вынашивания овцы. Уровни эффективных доз находятся в пределах диапазонов, наблюдаемых у плода во время брадикардии после парацервикальной блокадной анестезии (из Fishburne JI, Jr et al: Ответы сосудистой сети беременной матки на артериальные уровни местных анестетиков. Am J Obstet Gynecol 133: 753, 1979.Любезно предоставлено компанией C.V. Mosby.) |
Мы увидели, что все физиологические, патологические и ятрогенные стимулы обычно снижают СОР, и что у нас нет практических средств увеличения СБФ выше гомеостатических уровней. Следовательно, для оптимизации среды плода клиническая цель должна заключаться в предотвращении, минимизации или обращении этих побочных эффектов. Кроме того, эффекты любого динамического стимула всегда должны интерпретироваться на фоне адекватности гомеостатических уровней PBF до стимула.Теоретическое изображение этого фона, основанное, главным образом, на доставке кислорода, показано на рисунке 9 и служит для иллюстрации взаимодействия гомеостатических и динамических факторов.
Рис. 9. Гипотетическая связь между плацентарным кровотоком и состоянием плода. Из многих факторов, определяющих благополучие плода, плацентарный кровоток является наиболее изменчивым и наиболее подверженным патологическим изменениям. Значимость пагубных воздействий на плацентарный кровоток возрастает по мере снижения уровня преднапряжения кровотока.Четкие, пунктирные и обведенные области указывают на уровни резерва плода (см. Рисунок 3). (Из Greiss FC, Jr: MCV / Q, 8:52, 1972) |
Labor
Влияние родов на PBF на трех различных уровнях гомеостаза перед родами проиллюстрирован на фиг.10. Здесь показаны средние PBF на четырех уровнях активности матки и предполагается прекращение межворсинчатого пространства в течение 30 секунд при 45-секундном сокращении и 45 секунд при 60-секундном сокращении. Принимая во внимание, что плод, начинающий роды при оптимальных материнских уровнях PBF, никогда не подвергается угрозе с точки зрения доставки кислорода даже во время бурных родов, тот плод, у матери которого были неоптимальные предродовые PBF, мог выдержать обычные роды, но был бы подавлен при рождении или, возможно, родился мертворожденный, у него были бурные роды. произошел.В третьем случае должно быть очевидно, что без какого-либо фактора безопасности перед родами даже самых легких сокращений матки будет достаточно, чтобы вызвать компромисс для плода. Эта последняя категория, вероятно, описывает обстоятельства, при которых вызывается положительный стресс-тест на сокращение.
Рис. 10. Влияние сокращений матки на средний плацентарный кровоток. По мере увеличения продолжительности и частоты сокращений средний поток постепенно уменьшается. Если роды начинаются с оптимальным кровотоком, плацентарная перфузия более чем достаточна даже во время очень активных схваток ( сплошная линия ).Однако, если перфузия плаценты до родов пограничная, как при преэклампсии, даже легкие сокращения могут вызвать дистресс или смерть плода ( пунктирная линия ). Четкие, пунктирные и обведенные области указывают уровни резерва плода (см. Рисунок 3) (от Greiss FC, Jr: MCV / Q 8; 52, 1972) |
Региональная анестезия
Эпидуральная или спинальная анестезия может вызывают гипотензию у матери за счет паралича симпатических нервов, периферической вазодилатации, периферического накопления и снижения сердечного возврата крови.Поскольку сосудистая сеть плаценты обычно широко расширена, паралич симпатического нерва не повлияет на эти сосуды. Таким образом, у нас есть клинический пример эксперимента «давление-поток», и уменьшение MBP на ×% вызовет снижение PBF на ×%. Этот ответ проиллюстрирован на рисунке 11 вместе с двумя методами лечения гипотонии: вазопрессорными препаратами и восполнением объема. В то время как каждый из них восстанавливает нормотензию, их влияние на PBF радикально отличается. Как и следовало ожидать из предыдущего обсуждения, периферически действующий агент фенилэфрин не вызывал устойчивого увеличения UBF, поскольку степень индуцированной плацентарной вазоконстрикции намного превышала рост MBP.Лечение основной патофизиологии, несоответствия между емкостью и объемом сосудистой системы с одновременным восстановлением объема MBP и UBF до нормального. Однако иногда объемное восполнение неэффективно, и необходимо использовать сосудосуживающее средство. На рисунке 12 показаны более благоприятные эффекты PBF, которые могут быть получены при использовании агентов централизованного действия, и критическое различие, которое может иметь этот выбор в зависимости от количества ранее существовавших резервных PBF.
Фиг.11. Оригинальная запись, иллюстрирующая изменения, вызванные спинальной анестезией у доношенной овцы. Обратите внимание на заметное улучшение маточного кровотока от замещения объема по сравнению с вазопрессорной терапией (от Greiss FC, Jr, Crandell DL: JAMA 191: 89, 1965. Авторское право © 1965, Американская медицинская ассоциация) |
Рис. 12. Влияние гипотензии, вызванной спинальной анестезией, на перфузию плаценты. Только плоды с начальным субоптимальным плацентарным кровотоком ( пунктирная линия, ) будут затронуты выраженной гипотензией.Если требуется вазопрессорная терапия, соответствующий выбор препарата в соответствии с его механизмом действия может иметь решающее значение для выживания плода (из Greiss FC, Jr: MCV / Q, 8:52, 1972). |
Кровоизлияние
После кровотечения от 10% до 15% объема циркулирующей крови MBP обычно поддерживается в пределах нормы, главным образом за счет периферической вазоконстрикции. Сосудистая сеть плаценты будет участвовать в этом генерализованном сужении сосудов с уменьшением PBF. При дальнейшей кровопотере пределы компенсации превышаются и возникает гипотензия, добавляющая дополнительный фактор для снижения ФП.Если среднее кровяное давление снижается на 25%, то PBF будет уменьшаться на 25% только за счет механизма давление-поток плюс дополнительное снижение за счет повышенного внутреннего сопротивления сосудов. Эти предсказуемые ответы подтверждены экспериментально на фиг. 13. Как и в случае гипотензии, вызванной блокадой регионарной анестезии, терапия, направленная на основную проблему, потерю объема, улучшит MBP и PBF одновременно, а вазопрессоры следует использовать только в крайнем случае.
Фиг.13. Оригинальная запись, показывающая системные реакции и реакции матки на кровотечение у доношенной овцы. Обратите внимание, что кровоток в матке уменьшился раньше, чем артериальное давление, и что последующее уменьшение кровотока в матке было пропорционально больше, чем артериальное давление. |
Подавление родовой деятельности
β-адренергические препараты, используемые для подавления родовой деятельности за счет их расслабляющего действия на сократимость миометрия. Центральные и периферические эффекты этих агентов вызывают различную степень материнской тахикардии, периферической вазодилатации и гипотонии.Поскольку сосуды плаценты в норме широко расширены, дальнейшее расширение сосудов не может происходить, и у нас есть еще один клинический пример эксперимента по давлению-потоку, когда PBF изменяется прямо пропорционально изменениям в MBP. Пример взаимодействия миометрия и системных эффектов изоксуприна на PBF у пациентки во время активных родов показан на рисунке 14. Во время терапии изоксуприном маточные сокращения почти прекратились, а системное артериальное давление постепенно снизилось, вызывая аналогичное исходное снижение PBF ( Инжир.14А). Целесообразно прекратить прием изоксуприна, когда MBP был уменьшен вдвое, хотя частота сердечных сокращений плода оставалась нормальной. В то время как MBP и PBF все еще были на низком уровне, возникновение сильного сокращения матки еще больше уменьшило PBF, вызывая брадикардию плода (рис. 14B). На этом этапе было принято неправильное решение о правильном лечении из-за того, что не удалось распознать, что гипотензия сама по себе не вызывает стресса у плода. Скорее, это было дополнительное снижение ФП, связанное с сокращениями матки. Правильное лечение заключалось бы в том, чтобы позволить нормальным сокращениям матки постепенно возвращаться, ожидая, что к тому времени MBP и PBF вернутся к гомеостатическим уровням.Как это произошло, окситоциновая стимуляция первоначально вызвала устойчивое сокращение, которое, хотя и низкой интенсивности, было достаточным для поддержания PBF на опасном уровне, несмотря на прогрессирующее увеличение MBP. По мере развития более нормального паттерна сократительной способности миома прекращение PBF во время сокращений продолжало вызывать паттерны замедления (фиг. 14C), пока MBP и PBF не поднялись до нормальных уровней межсокращений (фиг. 14D). К счастью, у этой пациентки гомеостатический PBF был в пределах нормы, поэтому, хотя имели место эпизоды преходящей гипоксемии плода, фактор безопасности был достаточным, чтобы обеспечить нормальную выживаемость плода.
Рис. 14. A — D. Записи эффектов инфузий изоксуприна HCl и окситоцина у здоровой доношенной беременной женщины с теоретическими кривыми плацентарного кровотока, полученными на основе ожидаемых ответов. Четкие, пунктирные и обведенные области указывают на уровни резерва плода (см. Рисунок 3). (Адаптировано из Stander et al: Am J Obstet Gynecol 89: 792, 1964) |
Гипертоническое состояние
Имеется много доказательств. что токсикоз при беременности и хронические сердечно-сосудистые и почечные заболевания связаны с субоптимальными уровнями гомеостатических ФП. 26 Предположительно, механизмы, ответственные за нормальное расширение спиральных артерий, снабжающих плаценту, нарушены или подавлены во время окончательного процесса плацентации и ее последующего созревания. Это может привести к образованию спиральных артерий, способных к дальнейшему острому расширению, или к сосудам со стенками, иммобилизованными в результате атеротического процесса, так что дальнейшее расширение не может произойти. В обоих случаях можно было бы ожидать, что наклон кривой давление-поток будет уменьшаться, постепенно уменьшаясь по мере увеличения тяжести заболевания.Следовательно, снижение перфузионного давления на ×% приведет к снижению PBF менее чем на ×% (рис. 15). Теоретически возможна ауторегуляторная кривая, которая дополнительно минимизирует снижение PBF во время снижения MBP, но большинство морфологических исследований указывают на отсутствие такой сосудистой реактивности. Независимо от этих соображений, гидралазин, неспецифический релаксант гладких мышц сосудов, часто используется для контроля угрожающей жизни материнской гипертензии. Поскольку мы не можем измерить гомеостатический PBF и поскольку действие гидралазина на токсикозную сосудистую сеть плаценты в настоящее время неизвестно, разумное клиническое ведение требует, чтобы мы предполагали наименее благоприятные эффекты.Это будет снижение PBF по мере того, как MBP уменьшается в соответствии с соотношением давление-поток и отсутствием расширения сосудов спиральных артерий. Конечная точка терапии должна быть допустимым MBP 150/90 и нормальной частотой сердечных сокращений плода. Это подразумевает постоянный мониторинг плода во время терапии и постепенное снижение ОБМ для предотвращения нежелательного артериального давления и, следовательно, уровней КВФ. Несоблюдение этих принципов может вызвать компромисс для плода, как показано на Рисунке 16. У обеих пациенток наблюдалась задержка внутриутробного развития, что предполагало значительное снижение гомеостатического PBF.У обеих пациенток материнская гипертензия подвергалась достаточному чрезмерному лечению, чтобы снизить ФБК до уровней, которые вызвали тяжелое дистресс-синдром у плода и потребовали кесарева сечения. На первой иллюстрации следует отметить, что одно только снижение ОБМ негативно сказалось на состоянии плода. На второй иллюстрации MBP был снижен меньше, но дополнительное присутствие сокращений матки снизило PBF до уровней опасности для плода.
Рис. 15. Кривая внутриматочного давления-кровотока на фоне оптимального плацентарного кровотока.Показаны теоретические кривые пониженного наклона, которые могут существовать при токсикозе беременности на двух уровнях тяжести. Обратите внимание, что гомеостатический кровоток через плаценту снижается во время токсемии и что пропорционально большее снижение перфузионного давления может вызвать подобное уменьшение кровотока через плаценту. Четкие, пунктирные и обведенные области указывают уровни фетального резерва (см. Рис. 3). |
Рис. 16. Исходные записи давления околоплодных вод и частоты сердечных сокращений плода с пропорциональными изменениями систолического артериального давления и теоретическими изменениями плацентарного кровотока во время антигипертензивной терапии у двух пациентов с тяжелой токсичностью и задержкой внутриутробного развития. A. Уменьшение плацентарного кровотока, необходимое для возникновения брадикардии плода, было вызвано исключительно индуцированным снижением систолического артериального давления. B. Хотя систолическое артериальное давление было снижено менее заметно, дополнительные эффекты сокращений матки еще больше уменьшили плацентарный кровоток, что привело к дистрессу плода. Четкие, пунктирные и обведенные области указывают на уровни резерва плода (см. Рисунок 3) (адаптировано из Vink et al: Obstet Gynecol 55: 519, 1980.) |
Необычные проблемы
Врач должен постоянно справляться с человеческие ошибки.На рис. 17 показана одна такая проблема, возникающая у нормальной роженицы, которая случайно получила инъекцию метилэргоновина малеата (метергина), назначенную послеродовой пациентке. Эрготраты вызывают стойкое повышение тонуса миометрия плюс или минус наложенные ритмические паттерны сокращения. После инъекции метергина тонус межсокращательных сокращений прогрессивно повышался с обязательной обратной реакцией PBF, что приводило к брадикардии плода. Вспомнив о расслабляющем действии адреналина на миометрий от β-адренергической стимуляции, врач назначил такую терапию.Гиперсократимость матки была снижена, но сосудистая сеть плаценты ответила сужением сосудов. Чистый эффект терапии заключался в снижении частоты сердечных сокращений и сохранении брадикардии плода. Чтобы правильно управлять PBF, врач должен оценить патофизиологию каждого данного обстоятельства, а затем применить принципы контроля сосудов плаценты для оптимизации среды плода. Когда кто-то изучает эту запись, состояние плода, похоже, улучшается, и было показано только тщательное наблюдение. Если бы состояние плода ухудшалось, была бы показана специфическая терапия в виде общего анестетика, расслабляющего миометрий, такого как галотан.В этой ситуации рекомендуется использовать агонист β-адренорецепторов, такой как ритодрин, но теоретически это менее оптимальный выбор. Галотан должен быть более предсказуемым миометриальным релаксантом, и терапевтические уровни будут достигнуты быстрее без развития мешающих переменных, таких как материнская гипотензия.
Рис. 17. Исходные записи давления околоплодных вод и частоты сердечных сокращений плода с теоретическими изменениями плацентарного кровотока у женщины, случайно получившей метергин во время родов.Снижение плацентарного кровотока из-за гипертонуса миометрия вызвало перемежающуюся брадикардию плода. Терапия адреналином в двух случаях ( A и B ), хотя и уменьшала гипертонус, еще больше ухудшала плацентарный кровоток за счет увеличения плацентарного сосудистого сопротивления (данные Paul R: личные сообщения). |
Осознавая физическую подготовку и влияние факторов окружающей среды на самочувствие, акушер должен также расширить свою осведомленность о реакциях плода и матери.Поскольку влияние на PBF лишь нескольких таких стимулов было изучено, большинство комментариев в этой области должны быть умозрительными. В этой главе рассматриваются два из этих стимулов: курение сигарет и физические упражнения.
Курение сигарет увеличивает уровень никотина и угарного газа в крови. Последнее снижает способность материнской крови переносить кислород, ограничивая количество кислорода, доступного для переноса через плаценту. Никотин, стимулятор вегетативных ганглиев, по-видимому, опосредует свое действие за счет высвобождения катехоламинов, поскольку уровни адреналина и норадреналина в материнской крови повышены и поскольку прямое введение никотина в маточную артерию не вызывает изменений UBF. 15 Когда никотин вводят беременным овцам внутривенно, низкие дозы (125 мкм г / мин) не влияют на UBF, 27 , в то время как относительно высокие дозы (от 1,0 до 1,5 мг / мин) вызывают значительное снижение UBF. 15 Предположительно, при заданном пороговом уровне никотина выделяется достаточное количество катехоламинов для увеличения сопротивления сосудов плаценты и уменьшения ФВ. Следует проявлять осторожность при применении таких данных по овцам к женщинам, поскольку были измерены эффекты внутривенного никотина, а не курения per se , и поскольку такие факторы, как привыкание и толерантность к хронической стимуляции, не оценивались.Однако наблюдения за исходом беременности у курящих матерей предполагают незначительное, долгосрочное дозозависимое снижение темпов роста плода. Таким образом, разумно предположить, что курение приводит к качественному долгосрочному снижению PBF и что курение следует прекратить или уменьшить во время беременности, особенно если существуют условия высокого риска.
Влияние физических упражнений матери на UBF и плод наблюдалось только у овец. В целом, эти исследования показывают, что легкие или умеренные упражнения продолжительностью до 60 минут хорошо переносятся плодом.Когда упражнения продолжались до крайнего утомления или истощения, у матери возникал респираторный алкалоз и снижение UBF с уменьшением кислородного напряжения артериальной крови плода. В одном исследовании потребление кислорода плодом сохранялось во время снижения UBF на 28% за счет увеличения экстракции кислорода маткой на 56%. 28 В другом исследовании только с четырьмя овцами ежедневные упражнения от умеренных до тяжелых в течение 30 минут во второй половине беременности привели к ягнятам с низкой массой тела при рождении. 29
Хотя данные фрагментарны, они поддерживают довольно последовательный шаблон ответа.Сердечный выброс увеличивается во время упражнений в ответ на возрастающие метаболические потребности сокращающихся мышц. Внутреннее и, предположительно, маточное кровообращение продолжается лишь на слегка сниженном уровне до тех пор, пока эта потребность может быть адекватно удовлетворена. Если периферические потребности превышают возможности сердца, произойдет дальнейшее сужение внутренних сосудов и периферическое шунтирование. Данные показывают, что во время умеренных и тяжелых упражнений степень снижения PBF компенсируется увеличением экстракции кислорода.Во время беременности на PBF будут влиять условия до беременности, повышенная во время беременности нагрузка на сердце и степень физических нагрузок. Кроме того, влияние на плод будет определяться адекватностью гомеостатических PBF. Рекомендации относительно физических упражнений во время беременности должны учитывать все эти факторы.

 д.;
д.;



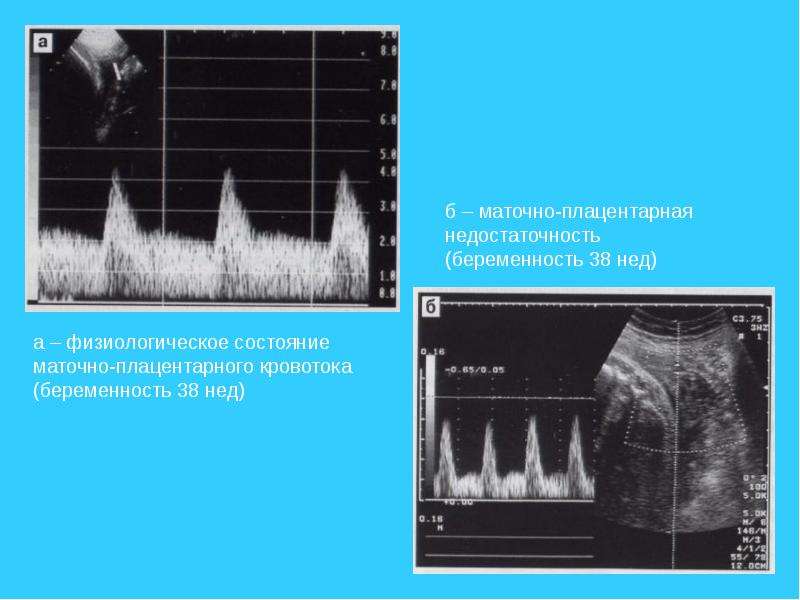 Это способствует изменению кровотока.
Это способствует изменению кровотока.