Эозинофилы в крови повышены у взрослого. О чем это говорит и что делать?
Екатерина Смольникова
Практикующий врач-эндокринолог (Стаж 10 лет). Имеет большой опыт работы в частных и государственных клиниках России.
Задать вопрос
Последнее обновление — 14 августа 2018 в 07:16
При длительном насморке или кашле в анализе крови обнаруживается, что эозинофилы повышены у взрослого человека. О чем это говорит? Скорей всего, насморк является аллергическим. Кроме этого, эозинофилия может свидетельствовать о других серьезных патологиях.
Что это такое эозинофилы?
Эозинофилы — это гранулоцитарные лейкоциты, образующиеся в клетках костного мозга. Эозинофилы поглощают иммунный комплекс во время возникновения аллергических реакций, перемешаются к очагу воспаления или к поврежденной ткани. В крови эозинофилы находятся около часа, затем переходят в ткани.
Что означают эозинофилы? Они называются так, потому что активно впитывают краситель эозин, который используются в лаборатории для диагностики. Свойства эозиновилов разнообразны. Например, они участвуют в формировании молочных желез после родов. Роль эозинофилов в организме:
Свойства эозиновилов разнообразны. Например, они участвуют в формировании молочных желез после родов. Роль эозинофилов в организме:
- Поглощение чужеродных клеток.
- Формирование противопаразитарного иммунитета.
- Поглощение и связывание гистаминов и других медиаторов воспаления.
Повышенное производство спинным мозгом эозинофилов может привести к немедленным аллергическим реакциям (анафилаксии). Таким образом, эозинофилы выполняют антиаллергенную и проаллергенную функцию. Поэтому повышение эозинофилов наблюдается во время аллергии.
Количество эозинофилов в крови меняется в течение дня. Вечером их число повышается на 16%, ночью — на 30%. Кроме того, у женщин эстрогены способствуют повышению синтеза эозинофилов, а прогестерон — снижению. Поэтому в первой половине цикла наблюдается повышенное число эозинофилов, которое постепенно снижается после овуляции.
Eos в норме, если их количество находится в пределах 0,4х109/л у взрослого и 0,7х109/л у ребенка, что составляет 1-5% от общего количества белых кровяных телец.
Причины повышения эозинофилов
Повышенное содержание эозинофилов в крови может свидетельствовать о том, что организм находится в «состоянии борьбы» с аллергенами.
Причины эозинофилии:
- Кожные заболевания: экзема, лишай, дерматит.
- Аллергическая реакция: астма, аллергический ринит, сенная лихорадка.
- Инфекционные заболевания: пневмония, туберкулез.
- Паразитарные инфекции: токсоплазмоз, хламидиоз, герпес.
- Заболевания органов ЖКТ: язва, цирроз печени.
- Аутоиммунные болезни: волчанка, ревматоидный артрит.
- Онкологические опухоли.
- Злокачественные заболевания крови: лейкоз, злокачественная анемия.
- Иммунодефицитное состояние.
- Заболевания щитовидки (гипотиреоз).
- Гипоксия.
- Дефицит магния в организме.
- Прием некоторых антибиотиков, аспирина, димедрола.
В медицине выделяют следующие степени повышения эозинофилов:
- Легкая — менее 10%.

- Средняя — повышение на 10-15%.
- Тяжелая — более 15%. Такое превышение свидетельствует о кислородном голодании тканей.
При сильном превышении показателей в организме формируются очаги воспаления, например, острый ринит, отек гортани.
Помимо крови, эозинофилы могут быть обнаружены в моче, мокроте, в жидкости, отделяемой из носоглотки. Такое явление характерно для астмы, бронхита, аллергического ринита.
Большое число эозинофилов — это не самостоятельная патология, это значит, что в организме проходит сильный воспалительный процесс, который необходимо ликвидировать. Особенно опасно повышение у детей. Это может свидетельствовать о таких серьезных патологиях, как:
- Гемолитическая болезнь.
- Злокачественное заболевание крови.
- Астма, аллергический ринит.
Симптомы повышения эозинофилов
Симптомы при повышенных эозинофилах зависят от того, что явилось первопричиной патологического состояния:
Реактивные заболевания (артрит) дают следующую симптоматику:
- анемия;
- увеличенная селезенка;
- воспаление вен, артерий;
- повышение температуры;
- суставные боли;
- потеря веса.

При паразитарных состояниях у пациента наблюдаются:
Если повышение вызвано аллергическими реакциями, то у больного присутствуют признаки аллергии:
- сыпь;
- зуд;
- отечность;
- аллергический кашель.
При заболеваниях ЖКТ, спровоцировавших повышение, симптомы следующие:
- тошнота, рвота;
- диарея;
- боли в животе;
- увеличение печени.
Легочная форма эозинофилии выражается в сухом кашле, усиливающемся ночью, снижении аппетита, потере веса.
Злокачественные болезни крови дают следующую симптоматику:
- боли в суставах;
- зуд кожных покровов;
- увеличение селезенки;
- беспричинный кашель.
Диагностика
При возникновении одного или нескольких вышеперечисленных симптомов следует пройти обследование, чтобы определить причину эозинофилии. Для этого назначают следующие анализы:
- Общий анализ мочи и крови.
 Это помогает измерить уровень эозинофилов, но поставить окончательный диагноз по этим анализам нельзя.
Это помогает измерить уровень эозинофилов, но поставить окончательный диагноз по этим анализам нельзя. - Биохимический анализ крови. Особого внимания требует количество печеночных ферментов и белков.
- Анализ кала на паразиты.
- Анализ крови на онкомаркеры. Если они увеличены, то это говорит о злокачественном процессе.
- УЗИ внутренних органов (печени, желчного пузыря, щитовидки, органов малаго таза у женщин). Это позволяет выявить патологические процессы, провоцирующие повышение эозинофилов.
- Рентген легких, бронхоскопию проводят для исключения или подтверждения пневмонии, туберкулеза, рака легких.
- С помощью УЗИ суставов, пункции диагностируют артрит.
Лечение повышенного уровня эозинофилов
Как понизить эозинофилы в крови? Поскольку эозинофилия сама по себе не является заболеванием, а лишь свидетельствует о наличии других патологий, то лечение будет зависеть от первопричины.
Медикаментозная терапия подбирается в соответствии с тяжестью основного заболевания, возраста пациента.
Обычно после устранения причины показатели нормализуются. Иногда количество эозинофилов может быть увеличено вследствие приема некоторых препаратов. Тогда следует отказаться от этих средств и все придет в норму.
Лечение паразитарной эозинофилии предполагает прием следующих препаратов:
- Антигельминтные средства: Пирантел, Мебендазол.
- Лекарства, восстанавливающие деятельность ЖКТ: Линекс, Эссенциале.
- Витамины для укрепления иммунитета.
Если причина повышения в аллергии, то пациенту назначается курс антигистаминных препаратов.
Лечение злокачественных опухолей и заболеваний крови очень сложное и длительное, курс терапии подбирает врач строго индивидуально.
Эозинофилия — это признак того, что в организме не все в порядке. Чтобы заболевания не перешли в запущенную стадию, необходимо пройти полный курс обследования. Своевременная диагностика повышает шансы на выздоровление даже при самых неблагоприятных диагнозах.
Эозинофилы в крови повышены: причины и лечение
После сдачи анализов можно заметить, что иногда эозинофилы в крови повышены, но что это значит? Увеличение эозинофилов с большой долей вероятности показывает наличии аллергии, либо глистных или бактериальных инфекций.
Функции эозинофилов в организме
Функции этой разновидности белых кровяных телецв организме разнообразны. Они принимают непосредственное участие в воспалительных процессах, участвуют в уничтожении чужеродного белка в организме, а также имеют прямое отношение к аллергии. Помимо этого, функции эозинофилов связаны с формированием органов, например, молочной железы после рождения ребенка.
Основные значимые функции эозинофилов:
Они находятся в том месте, где развивается воспалительный процесс.
Необходимы для предотвращения негативной реакции со стороны опасных веществ.
Необходимы для уничтожения клеток микроорганизмов.
Не всегда эозинофилы в крови оказывают положительное влияние, есть и отрицательное.
Нормальный уровень эозинофилов
Обычно количество эозинофилов в расшифровке общего анализа крови указывается в процентах от числа лейкоцитов. У взрослого человека эозинофилы в норме, если их количество не превышает 5% от общего числа лейкоцитов. Норма у мужчин и женщин одинаковая. В одном миллилитре крови их не должно быть больше 350.
На фоне изменения работы надпочечников количество клеток может колебаться:
Повышение эозинофилов можно наблюдать в утреннее время суток, но не более чем на 15%.
Повышенный уровень эозинофилов у взрослого в крови наблюдается в первой половине ночи, примерно на 30%.
Для того чтобы получить достоверный результат необходимо сдать анализ крови:
Сдавать кровь утром и натощак.
За несколько дней до сдачи анализов откажитесь от спиртного и сладкого.
Следует помнить, что у женщин в крови повышены эозинофилы во время менструации.
Иногда для анализа на эозинофилы берется не кровь, а секрет вырабатываемый в носоглотке. Мазок берется из каждой ноздри при помощи тампона и марли, на продолговатом предмете.
Концентрация эозинофилов при таком анализе должна быть как можно ближе к нулю.
Именно мазок на эозинофилы дает возможность ЛОР-врачу отличить аллергический насморк от инфекционного.
Повышенное содержание эозинофилов нельзя оставлять без внимания, как только были выявлены первые симптомы нужно лечить проблему.
Причины повышения эозинофилов у человека в крови
Почему норма эозинофилов в крови повышена и о чем это свидетельствует? Клетки эозинофилов не всегда приносят организму пользу. Их борьба с инфекцией может привести к развитию аллергии.
 Это заболевание имеет несколько стадий развития:
Это заболевание имеет несколько стадий развития:| Легкая степень | Эозинофилы выше нормы не более чем на 10% |
| Средняя степень | Уровень повышен на 15% |
| Тяжелая степень | Повышенное количество эозинофилов в крови на 15 и более процентов |
Причины повышения их уровня могут быть следующими:
Туберкулез
Лейкоз в острой стадии
Высокие эозинофилы могут иметь наследственный характера
Вегетососудистая дистония
Гипотиреоз
Повышенные эозинофилы у детей
В данной таблице указаны нормы процентного содержания эозинофилов в общем анализе крови у детей, в зависимости от возраста
| До 15 дней | 0,7-6 % |
| От 15 дней до 1 года | 0,5-7 % |
| От 1 года до 13 лет | 0,5-7 % |
| От 13 до 15 лет | 0,5-6 % |
Что такое эозинофилы мы выяснили, а также почему эозинофилы повышены у взрослого, но почему их уровень превышает норму у детей? В зависимости от того сколько лет малышу причины могут быть следующими:
| Новорожденных детей первых месяцев жизни | У детей до трех лет | У детей старше трех лет |
гемолитическая болезнь резус-конфликт пемфигус новорожденных стафилококкковые энтероколиты стафилококковый сепсис атопический дерматит сывороточная болезнь эозинофильный колитатопический дерматит | аллергии на лекарственные средства отек Квинке | глистные инвазии кожные аллергии аллергический ринит бронхиальная астма онкогематология скарлатина ветряная оспа |
Важно помнить! Отклонение количества эозинофилов в крови – это не самостоятельное заболевание, а всего лишь симптом, реакция на что-либо.
Катионный протеин эозинофилов
Эозинофильный катионный протеин – это белок, который есть в гранулах клеток, в момент развития воспалительных процессов он высвобождается. Концентрация в норме не должна превышать 7 мкг на один литр.
Если же показатели повышены в несколько раз, то больному ставится диагноз бронхиальная астма. При увеличении в десять раз – гельминты. Если эозинофильный катионный белок повышен и его количество 100 мкг на литр крови, это свидетельствует о развитии рака.
При получении таких результатов не нужно впадать в панику. Прежде чем будет назначено лечение, еще раз обратите внимание на симптомы и попросите сделать вам анализ повторно. В будущем необходимо исключить развитие аллергии. И помните, что поставить точный диагноз может только врач.
Прежде чем сдать анализ на eos необходимо знать обо всех требованиях его сдачи. Ведь несоблюдение какого-то пункта может отразиться на результатах.
Что делать?
Если результаты общего анализа показали, повышенный уровень эозинофилов в крови, необходимо сдать кровь на биохимический анализ, таким образом можно узнать о заболевании, которое спровоцировало это. Обратите внимание на белковой уровень ферментов, которые находятся в печени или где-то еще. В качестве дополнения при необходимости производится поиск паразитов.
Обратите внимание на белковой уровень ферментов, которые находятся в печени или где-то еще. В качестве дополнения при необходимости производится поиск паразитов.
Лечением занимается гематолог. Прежде чем будет назначена терапия, лечащим врачом должен быть поставлен точный диагноз. Добиться положительного эффекта можно только в том случае, если лечение будет комплексным: в него входят лекарственные препараты, физиопроцедуры и прочее.
показатели у детей и взрослых, повышенный уровень
Успешное лечение любого заболевания в первую очередь зависит от установления правильного диагноза. Но часто бывает так, что совершенно разные по своей природе патологии вызывают схожие изменения в анализах.
Одним из таких ярких примеров является эозинофилия в клиническом анализе крови, которая может возникать как при аллергических заболеваниях, так и при заражении глистами.
Что же делать в такой ситуации ? Для начала советуем почитать эту статью.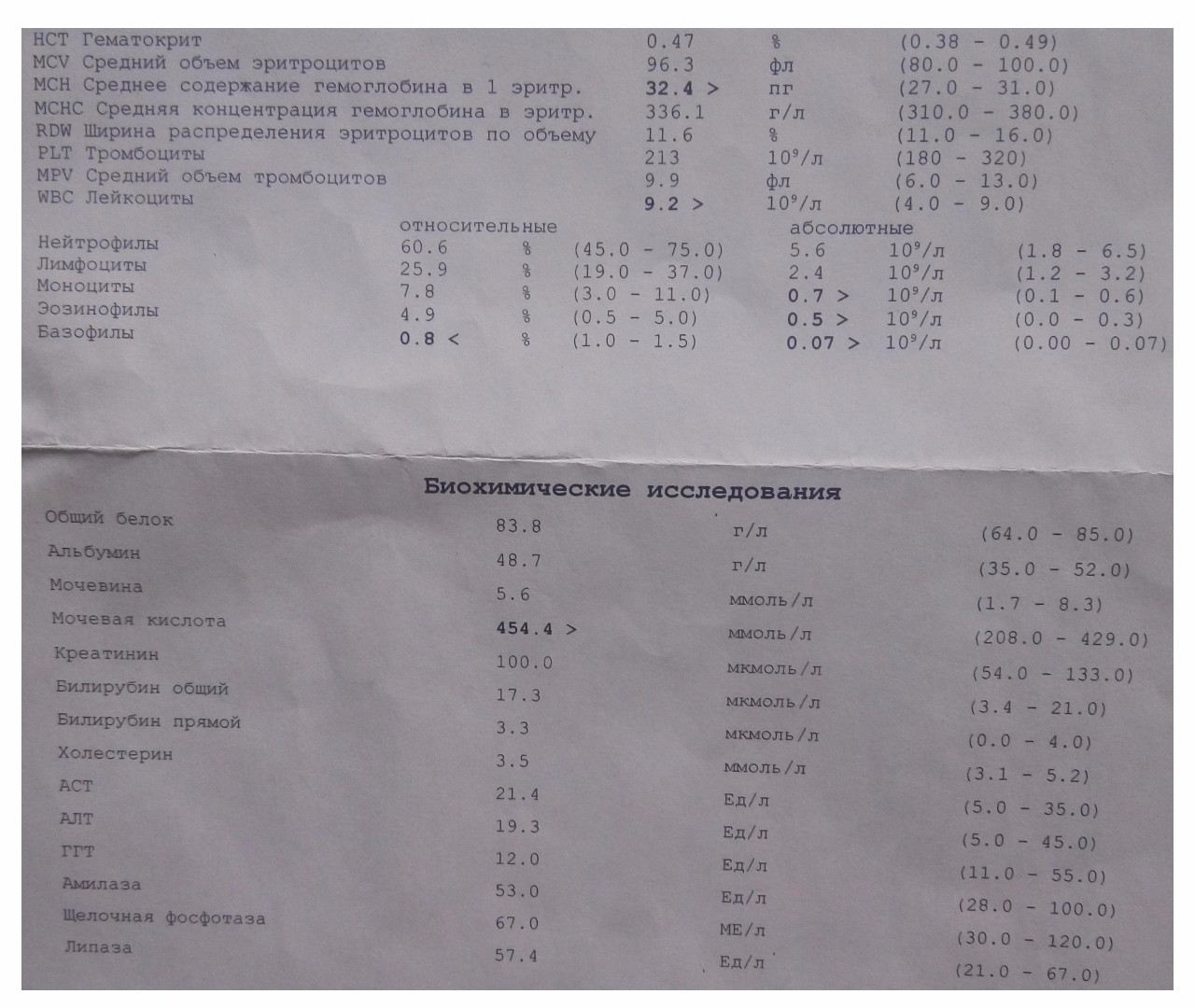 В данной статье подробно описываются методы борьбы с паразитами. Также рекомендуем обратиться к специалисту. Читать статью >>>
В данной статье подробно описываются методы борьбы с паразитами. Также рекомендуем обратиться к специалисту. Читать статью >>>
Что такое эозинофилия
Такое название носит состояние, при котором в крови резко возрастает количество эозинофилов. При этом также наблюдается инфильтрация, или пропитывание эозинофилами окружающих тканей. Эозинофилы – это подвид белых кровяных клеток, лейкоцитов.
Они отвечают за многие функции иммунитета, например, обладают способностью поглощать чужеродные клетки и частицы. Кроме того, они активно участвуют в аллергических процессах, связывая или высвобождая гистамин. То есть они могут как стимулировать аллергию, так и выполнять антиаллергическую функцию. Также эозинофилы играют важную роль в защите организма от паразитов-гельминтов, разрушая их клетки.
Соответственно, и при аллергии, и при глистной инвазии продукция этих клеток в костном мозге увеличивается – и развивается состояние, называемое эозинофилией. Но эта же двойственность функций эозинофилов может приводить и к диагностическим ошибкам.
Эозинофилы в крови
Пройти тест на наличие глистов
Когда нужно сдать анализы на глисты
На момент сдачи общего анализа крови и кала иногда обнаруживаются высокие показатели эозинофилов. Это знак, который предостерегает о риске заражения паразитами. Хотя такой показатель может привлечь внимание доктора-аллерголога.
Возможно, такая аллергия вызвана наличием паразитов в организме. Также необходимо бить тревогу при обнаружении высокого уровня гемоглобина и СОЭ.
К симптомам, подобным при паразитах в организме, принято относить:
- частые простуды;
- апатию;
- усталость;
- непроходимость кишечника;
- ломкие волосы и ногти.
Чтобы выявить точный диагноз, необходимо сдать анализы. Современная диагностика заболевания дает эффективные результаты. Нужно сдать кровь и кал на исследования, с помощью которых устанавивается отсутствие или наличие гельминтов.
По этим анализам можно определить:
- виды гельминтов;
- репродуктивность паразитов;
- число гельминтов в организме.

Необходимо добавить, что анализ (ИФА), является самым точным (он показывает достоверность результатов на 96%). Кроме того, исследование дает возможность поставить диагноз на ранней стадии и создать правильный подход к лечению паразитов.
Такие анализы носят название иммуноферментные, которые заключаются в диагностике организма человека на заражение глистами. Исследования помогают убить различные виды паразитов.
Показатели эозинофилов при гематологическом исследовании
Общий анализ крови на глисты (гемотест) позволяет определить количество эозинофилов (разновидность лейкоцитов), которые и борются с чужеродным белком. Как только в организме появляются глисты, уровень эозинофилов резко увеличивается, сигнализируя о том, что организм подвержен заражению.
Помимо всего, учитывается состояние иммунитета, симптоматика, присутствие осложнений, которые тоже влияют на показатель количества клеток.
Состояние организма, при котором прослеживается увеличение уровня эозинофилов, называется эозинофилией. Интенсивность этого состояния обладает непосредственной связью с формой симптоматики.
Количество эозинофилов в крови при заражении гельминтами возрастает. Неоспоримым признаком гельминтоза считается уровень эозинофилов больший 8%, при норме в 1–5% от общего числа лейкоцитов.
Биохимические исследования
Биохимия крови — это метод клинических исследований, который позволяет судить о состоянии большинства внутренних органов и систем организма, выявляет наличие заражений, в том числе и глистные инвазии.
При этом анализе исследуются следующие компоненты:
- глюкоза;
- билирубин общий/прямой;
- аминотрансферазы — АсАТ и АлАТ;
- щелочная фосфатаза;
- показатели общего белка;
- холестерин.
Для выявления наличия глистов назначают комплексный биохимический анализ с диагностированием всех показателей.
Эозинофилы при анализе крови на аскариды
Для избавления от паразитов наши читатели успешно используют Intoxic. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
Аскаридоз — глистная инвазия, которая вызывается аскаридой человеческой. Это достаточно распространенное заболевание, особенно среди детей. Анализ на аскариды — важный этап диагностики, своевременное проведение которой помогает предупредить развитие осложнений аскаридоза.
Аскаридоз – гельминтоз, вызываемый круглыми червями аскаридами (Ascaris lumbricoides, струнец).
Человек, в кишечнике которого паразитируют самки и самцы аскарид, является единственным источником инвазии. Взрослые аскариды обитают в тонкой кишке, где самки после оплодотворения откладывают около 200 000 яиц в сутки. Попадая с фекалиями в окружающую среду, при благоприятных условиях яйца созревают в течение 10 — 15 дней и более.
При проглатывании человеком зрелых яиц, в верхнем отделе тонкой кишки из них выходят личинки, которые проникают через стенку кишки в нижнюю полую вену, далее в сосуды печени и лёгких, откуда переходят в альвеолы и бронхи.
В лёгких они поднимаются по эпителию дыхательных путей в глотку и заглатываются в желудочно-кишечный тракт.
После повторного попадания в тонкую кишку они в течение 70 — 75 суток развиваются во взрослых паразитов, способных продуцировать яйца.
Продолжительность жизни взрослой аскариды достигает года, после чего происходит её гибель и вместе с калом она удаляется наружу. Поэтому наличие аскарид на протяжении нескольких лет у одного человека объясняется только повторными заражениями.
В клиническом течении аскаридоза выделяют две фазы — раннюю (миграционную) и позднюю (кишечную). Первая фаза совпадает с периодом миграции личинок, тогда как вторая обусловлена паразитированием гельминтов в кишечнике и возможными осложнениями.
Основными клиническими признаками аскаридоза являются симптомы поражения лёгких (сухой кашель, одышка, боли в груди), субфебрильная температура, уртикарные высыпания, зуд, недомогание, слабость, головные боли, эозинофилия до 20 — 30%, гиперлейкоцитоз.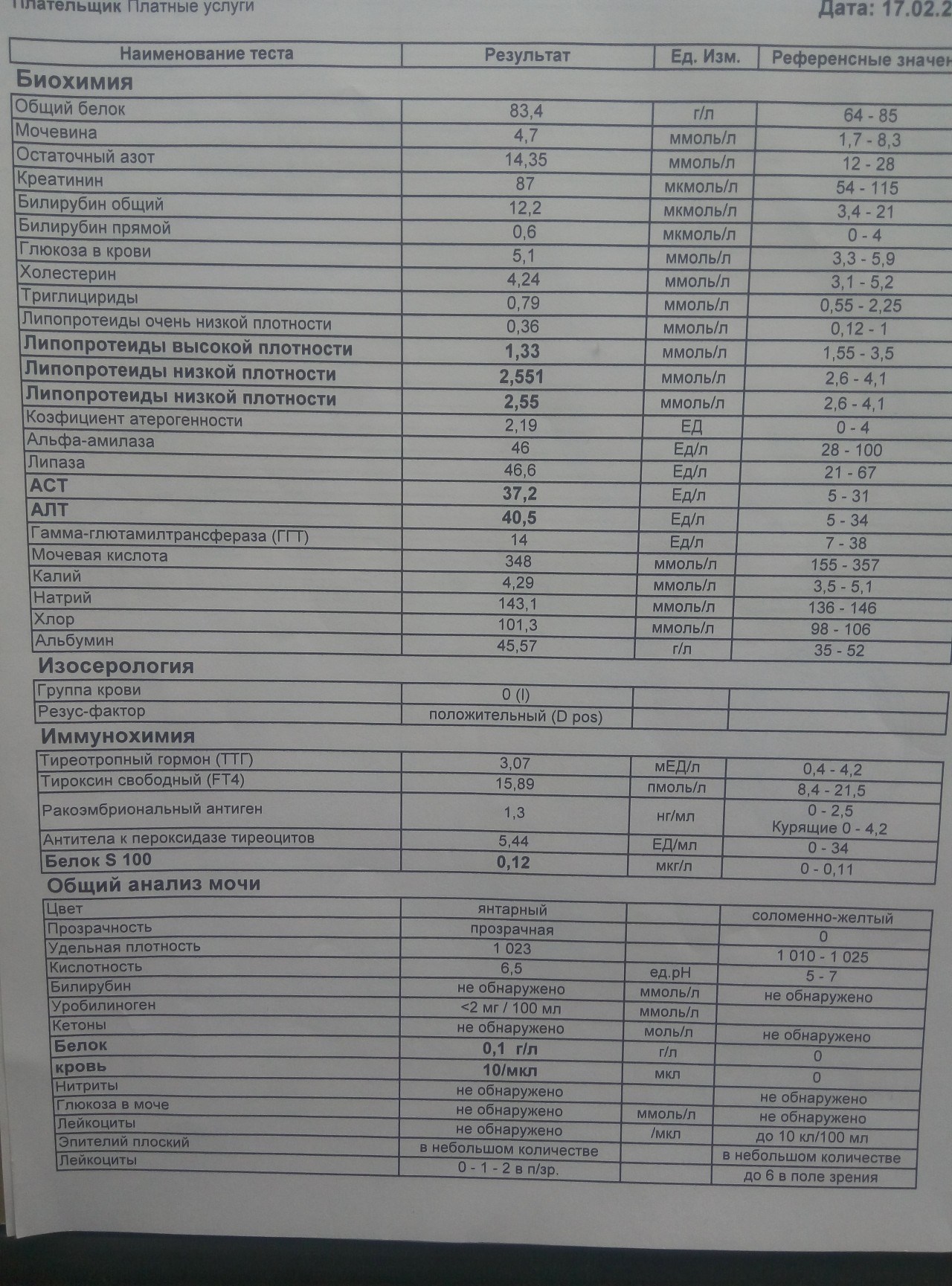
В хронической фазе аскаридоза возникают тошнота, дисфункция кишечника, боли в животе, нарушение сна. Возможные осложнения аскаридоза: панкреатит, аппендицит, кишечная непроходимость.
В заключение
Выявление повышенного количества эозинофилов в клиническом анализе крови может быть свидетельством не только аллергии или глистного поражения. Эозинофилия может развиваться и при множестве других заболеваний. Ведь клиническая практика и лабораторные исследования доказывают, что увеличение этого показателя не является специфичным ни для одной патологии.
Его выявление должно только насторожить врача, заставить его назначить пациенту дополнительные, более тщательные и узкоспециализированные обследования. Поэтому прежде чем начинать лечение от гельминтоза, аллергического или любого другого заболевания, необходимо в обязательном порядке точно определиться с причиной увеличения количества эозинофилов.
Победить паразитов можно!
Антипаразитарный комплекс® — Надежное и безопасное избавление от паразитов за 21 день!
- В состав входят только природные компоненты;
- Не вызывает побочных эффектов;
- Абсолютно безопасен;
- Защищает от паразитов печень, сердце, легкие, желудок, кожу;
- Выводит из организма продукты жизнедеятельности паразитов.

- Эффективно уничтожает большую часть видов гельминтов за 21 день.
Сейчас действует льготная программа на бесплатную упаковку. Читать мнение экспертов.
Нужна помощь специалиста?
Инютина Марина Артуровна — Врач-онколог, маммолог, хирург, лазеротерапевт. Основное направление работы — изучение паразитарной теории возникновения рака. Подбор индивидуальных схем противопаразитарного лечения. Вопросы профилактики паразитоза.Контакты:
- 89009681191 (WhatsApp, Telegram).
- Личные сообщения ВК: написать
Сертификат специалиста
Интересно знать:Список литературы
- Centers for Disease Controland Prevention. Brucellosis. Parasites. Ссылка
- Corbel M. J. Parasitic diseases // World Health Organization.
 Ссылка
Ссылка - Young E. J. Best matches for intestinal parasites // Clinical Infectious Diseases. — 1995. Vol. 21. — P. 283-290. Ссылка
- Ющук Н.Д., Венгеров Ю. А. Инфекционные болезни: учебник. — 2-е издание. — М.: Медицина, 2003. — 544 с.
- Распространенность паразитарных болезней среди населения, 2009 / Коколова Л. М., Решетников А. Д., Платонов Т. А., Верховцева Л. А.
- Гельминты домашних плотоядных Воронежской области, 2011 / Никулин П. И., Ромашов Б. В.
Статья для пациентов с диагностированной доктором болезнью. Не заменяет приём врача и не может использоваться для самодиагностики.
Лучшие истории наших читателей
Тема: Во всех бедах виноваты паразиты!
От кого: Людмила С. ([email protected])
Кому: Администрации Noparasites.ru
Не так давно мое состояние здоровья ухудшилось. Начала чувствовать постоянную усталость, появились головные боли, лень и какая-то бесконечная апатия. С ЖКТ тоже появились проблемы: вздутие, понос, боли и неприятный запах изо рта.
С ЖКТ тоже появились проблемы: вздутие, понос, боли и неприятный запах изо рта.
Думала, что это из-за тяжелой работы и надеялась, что само все пройдет. Но с каждым днем мне становилось все хуже. Врачи тоже ничего толком сказать не могли. Вроде как все в норме, но я-то чувствую, что мой организм не здоров.
Решила обратиться в частную клинику. Тут мне посоветовали на ряду с общими анализами, сдать анализ на паразитов. Так вот в одном из анализов у меня обнаружили паразитов. По словам врачей – это были глисты, которые есть у 90% людей и заражен практически каждый, в большей или меньшей степени.
Мне назначили курс противопаразитных лекарств. Но результатов мне это не дало. Через неделю мне подруга прислала ссылку на одну статью, где какой-то врач паразитолог делился реальными советами по борьбе с паразитами. Эта статья буквально спасла мою жизнь. Я выполнила все советы, что там были и через пару дней мне стало гораздо лучше!
Улучшилось пищеварение, прошли головные боли и появилась та жизненная энергия, которой мне так не хватало. Для надежности, я еще раз сдала анализы и никаких паразитов не обнаружили!
Для надежности, я еще раз сдала анализы и никаких паразитов не обнаружили!
Кто хочет почистить свой организм от паразитов, причем неважно, какие виды этих тварей в вас живут — прочитайте эту статью, уверена на 100% вам поможет! Перейти к статье>>>
Надежное и эффективное средство для борьбы с глистами. Выводит всех паразитов за 21 день.
Как Избавить свой организм от опасных для жизни паразитов, пока не поздно!
Врач паразитолог рассказывает, каке существуют эффективные методы борьбы с гельминтами.
Поиск лекрств от паразитов
Советуем почитать
причины повышения эозинофилов в крови у взрослого, диагностика и лечение
Форменные клетки крови обеспечивают разные функции и имеют собственное назначение. Формально они делятся на несколько классов.
- Тромбоциты или красные кровяные пластинки. Обеспечивают нормальную свертываемость крови, не позволяют развиваться критически опасным состояниям.
 Выступают своего рода цементом для закупорки поврежденных сосудов.
Выступают своего рода цементом для закупорки поврежденных сосудов. - Эритроциты. Красные кровяные тельца. Переносят гемоглобин. Благодаря своим функциям могут транспортировать кислород и углекислый газ. Туда-обратно. Их основная задача — газообмен и клеточное дыхание.
Остальные структуры — гранулоциты и агранулоциты. Вторые представлены лимфоцитами и моноцитами. Они обеспечивают поздний иммунный ответ. То есть вступают в бой с бактериями, вирусами и грибками несколько позже основных клеток.
Как раз гранулоциты обеспечивают первичную работу защитных сил организма.
Они представлены тремя группами структур:
- Нейтрофилы. Составляют до 70% от общей массы названных цитологических единиц. Вступают в бой самыми первыми.
- Базофилы. Клетки покрупнее. Выступают в качестве мусорщиков организма. Обеспечивают разрушение аномальных агентов, их деструкцию и переработку оставшихся веществ.
- Эозинофилы. Это небольшие клетки с маленькими ядрами, они способны к фагоцитозу, то есть, говоря условно, сбору мусора из организма.
 Но могут поглощать только относительно небольшие частицы вещества.
Но могут поглощать только относительно небольшие частицы вещества.
Эозинофилия — это состояние, при котором концентрация клеток-эозинофилов растет. Как раз о третьем типе гранулоцитов и пойдет речь. Что же следует знать о нарушении, при котором повышается количество цитологических структур?
Механизмы развития проблемы
Если говорить обобщенно, можно назвать три основных патогенетических фактора. Они, так или иначе, связаны с состоянием здоровья пациента и сказываются на нем крайне негативно.
Аллергические реакции
Развиваются в качестве ложного ответа иммунитета на мнимого патогенетического агента. На самом деле опасного вещества или микроорганизма нет, тело буквально сходит с ума и начинает атаковать здоровые клетки.
Для этого требуется большое число гранулоцитов. Тело синтезирует эозинофилы, также в меньшем количестве другие клетки.
Результатом становится аллергическая реакция, которая и приводит к эозинофилии.
Гельминтозы
Встречаются довольно часто, особенно в детские годы.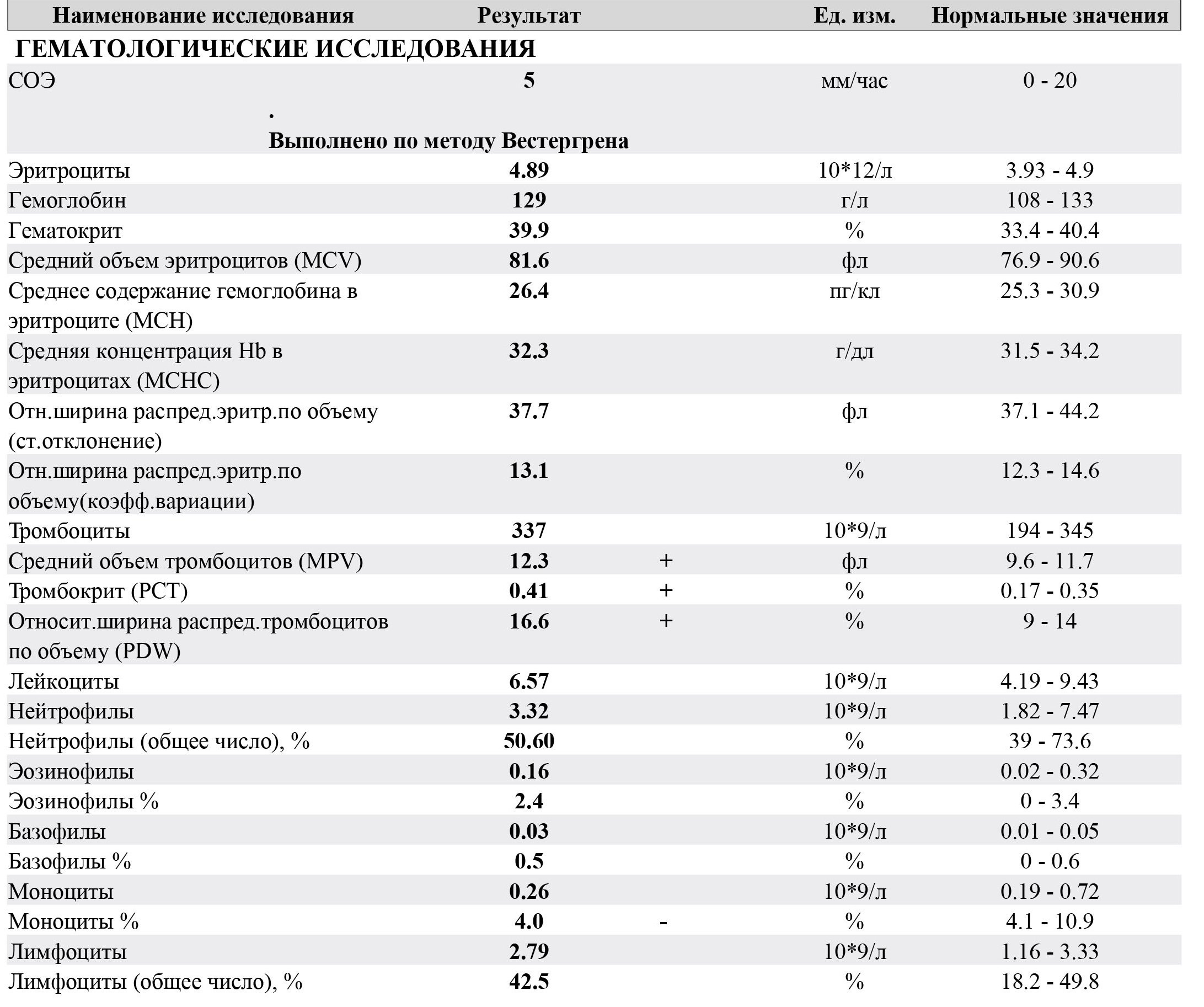 Проще говоря, речь о глистных поражениях. Когда в организме развиваются чужеродные тела, эозинофилы вступают в бой первыми.
Проще говоря, речь о глистных поражениях. Когда в организме развиваются чужеродные тела, эозинофилы вступают в бой первыми.
Это одна из основных задач названных клеток — атаковать гельминты. По концентрации можно говорить о степени поражения и тяжести патологического процесса.
Чем больше эозинофилов, тем существеннее количество глистов или же они локализованы в жизненно важных областях. Головном мозге, печени. Хотя есть исключения из названного правила.
Соматические заболевания
Множественны по своему характеру. От патологий крови до нарушений работы легких. Необходимо разбираться в ситуации отдельно.
Задача диагностики и лечение ложится на профильного специалиста. По концентрации эозинофилов в крови можно говорить о динамике патологического процесса.
Эозинофилы — это разновидность гранулоцитов. По их концентрации судят о состоянии здоровья пациента. Всего существует три механизма развития патологического процесса.
Если конкретизировать заболевания, можно назвать порядка 5-10 состояний, провоцирующих эозинофилию.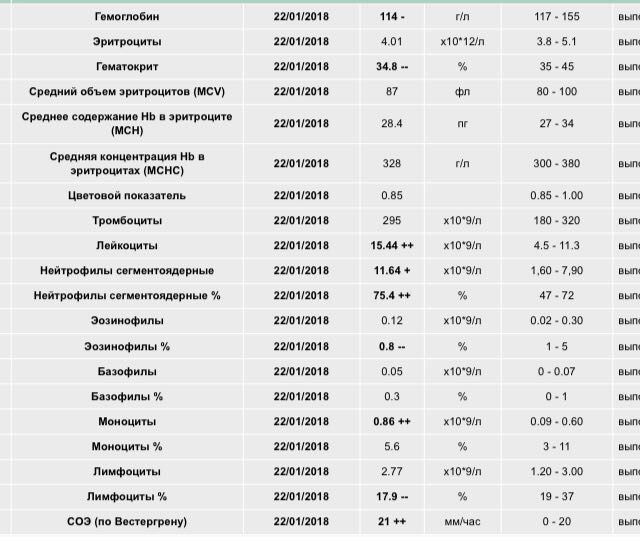
Причины, симптомы и лечение
Расстройств довольно много. Нужно рассмотреть основные.
Гельминтозы
В основном встречаются у детей. Как было сказано, это глистные поражения. Механизм в этом случае двойственный.
- С одной стороны, эозинофилы вырабатываются, чтобы бороться с инородными агентами. Они синтезируют активные формы кислорода и особые белки, которые уничтожают незваного гостя.
- С другой — продукты жизнедеятельности инородных агентов вызывают гиперсенсибилизацию организма. Тело буквально отторгает ядовитые вещества, становится слишком чувствительным. Начинается аллергия.
Концентрация эозинофилов растет в несколько раз.
По числу клеток можно говорить о степени и тяжести патологического процесса.
Что касается основных причин, то виновниками выступают описторхисы, аскариды. Реже ленточные черви.
Локализация также может провоцировать ту или иную степень поражения. Наибольших показателей эозинофилы достигают при нарушении работы головного мозга, органов зрения, печени. Хотя это и не всегда так.
Хотя это и не всегда так.
Симптоматика патологического процесса также зависит от расположения глистов. Например, при классической локализации в ЖКТ, проявления будут такими:
- Поносы.
- Запоры.
- Нарушения пищеварения.
- Быстрая потеря массы тела.
- Угревая сыпь.
- Изменение качества кожи. Состояния волос и ногтей. Это результат отравления организма.
- Боли в области живота.
- Повышенная продукция кишечного газа из-за ускоренного гниения белков.
- Увеличение температуры тела. Не всегда, но такое также возможно.
- Дискомфорт в правом боку.
- Нарушения функции печени с выраженным повышением АЛТ и АСТ, билирубина в биохимическом исследовании крови.
Это лишь часть проявлений.
Лечение этиотропное. Нужно избавиться от гельминтов. Здесь на помощь приходят специальные препараты. Празиквантел, Бильтрицид и еще десятки наименований.
Все зависит от степени тяжести инвазии, типа организма и индивидуальных особенностей клинической ситуации.
Что касается немедикаментозных методов, настоятельно рекомендуется соблюдать правильную диету. С высоким содержанием белка и углеводов.
Рацион должен быть питательным, чтобы покрыть недостаток веществ.
Аллергические реакции
Аллергия считается наиболее частой причиной эозинофилии. Это довольно логично, если учесть механизм развития нарушений. Представить его можно следующим образом:
- При реакции на аллерген организм выделяет большое количество базофилов.
- При соединении с антигенами, гранулоциты выпускают гистамин и особое вещество-медиатор. Оно как маяк манит эозинофилы и косвенно способствует выработке новых гранулоцитов.
- Результатом становится стойкое повышение количества цитологических структур в кровеносном русле.
Как правило, концентрация растет несущественно. Наблюдается легкая или, максимум, средняя степень эозинофилии. Если человек — аллергик со стажем, то вероятно нулевое или пониженное количество гранулоцитов рассматриваемого типа.
Это происходит, поскольку в результате иммунной реакции клетки гибнут. А новые синтезироваться просто не успевают.
Симптомы аллергии довольно типичны:
- Кожный зуд.
- Образование сыпи, которую хочется расчесать.
- Болевые ощущения.
- Нарушения дыхательной функции.
- Слезотечение.
- Насморк.
- Возможны отеки, все зависит от типа степени тяжести патологического процесса.
Лечение определяется конкретным заболеванием. Для коррекции самой аллергии используются антигистаминные. Первого поколения (Пипольфен, Тавегил, Супрастин, аналогичные) или же третьего (Цетрин).
Внимание:Второе поколение антигистаминных назначается гораздо реже, поскольку доказано их негативное влияние на сердце. Особенно при систематическом применении лекарств.
При поражении легких и бронхов используют дилататоры. Средства для расширения дыхательных путей. Беротек, Беродуал и аналогичные.
Обязательно нужно бороться с первичным агентом. Тем веществом, которое провоцирует аллергию. По-возможности рекомендуют избегать встречи с ним.
Тем веществом, которое провоцирует аллергию. По-возможности рекомендуют избегать встречи с ним.
Опасным веществом может быть что угодно: от какого-либо продукта до пыли, частичек слюны животных.
Заболевания дыхательной системы
Некоторые патологии легких также могут спровоцировать эозинофилию. Это довольно редкое состояние, но оно возможно.
Среди аномальных процессов:
- Осложненная пневмония. В этом случае концентрация клеток растет существенно. И чем сильнее воспаление, тем интенсивнее вторичные изменения. Постепенно, по мере восстановления все приходит в норму.
- Поражение грибками. Рода аспергилл или куда реже — кандидов. В результате организм пытается побороть инородные агенты, вырабатывая большое количество специализированных клеток-гранулоцитов. По концентрации можно опять же судить о степени тяжести патологического процесса и эффективности лечения нарушения.
- Завышенные значения эозинофилов в крови возможны при бронхитах. То же самое касается астмы.

Есть и редкие заболевания. Например, системные васкулиты, воспаления сосудов с локализацией в легких. Эти состояния идиопатические. То есть определить их причину точно невозможно. Необходима тщательна диагностика.
Лечение зависит от конкретного заболевания.
- При пневмониях, инфекционных бронхитах назначают антибиотики. Прежде проводят анализ мокроты на флору. После этого можно говорить об эффективной терапии.
Применяют противовоспалительные нестероидного происхождения. Важно назначить бронходилататоры, которые восстановят нормальное дыхание.
По-возможности принимают глюкокортикоиды, но осторожно. Они угнетают работу иммунной системы, потому возможны затяжные пневмонии. Дозировку подбирают отдельно.
- Грибковые поражения требуют применять фунгициды. Специализированные средства.
- При бронхиальной астме используют глюкокортикоиды и антигистаминные.
- Что касается васкулитов, помимо гормонов необходимы препараты группы иммуносупрессоров.
 Которые затормозят интенсивность работы защитных сил организма. Поскольку чаще всего именно иммунитет атакует сосуды.
Которые затормозят интенсивность работы защитных сил организма. Поскольку чаще всего именно иммунитет атакует сосуды.
- Вирусные и бактериальные формы лечатся антибиотиками и противовоспалительными.
Восстановление наиболее эффективно на ранних стадиях.
Патологии крови
В основном эозинофилы повышены по причине миелопролиферативных, злокачественных болезней. Лейкозов и прочих. Тут есть два основных механизма процесса.
Первый. Синтез эозинофилов, их созревание происходит в костном мозге. При заболеваниях описанного рода его ткани буквально сходят с ума и начинают вырабатывать гранулоциты с огромной скоростью. Это специфический признак.
Если человек болен лимфомой, клетки начинают вырабатывать цитокины, которые искусственно стимулируют синтез эозинофилов, тем самым достигается их чрезмерное количество, так называемая гиперэозинофилия.
Независимо от типа патологического процесса, это опасные отклонения. Необходимо как можно быстрее начинать лечение. Симптоматика определяется конкретным состоянием.
Симптоматика определяется конкретным состоянием.
В основном присутствуют такие субъективные проявления:
- Кожный зуд.
- Нарушения свертываемости крови.
- Повышение температуры тела.
- Значительная чувствительность организма к внешним факторам.
- Склонность к аллергическим реакциям.
Лечение зависит от диагноза. В основном применяют препараты группы химиотерапевтических. Метотрексат и аналогичные. Возможно лучевое лечение. Также используют глюококртикоиды в ударных дозировках.
Динамику патологического процесса отслеживают в том числе по концентрации эозинофилов. Это удобно, поскольку нет необходимости каждый раз проводить пункцию костного мозга.
К слову, процедура довольно рискованная и требует особой подготовки.
Заболевания пищеварительного тракта
Патологии желудочно-кишечных структур также могут провоцировать рост эозинофилов. Это сравнительно нечастое состояние. Наиболее распространены следующие болезни, которые вызывают такой сценарий:
- Гастрит.
 Поражение желудка.
Поражение желудка. - Колит. Воспаление слизистой оболочки кишечника.
- Прочие встречаются исключительно редко.
Почему на фоне патологий пищеварительного тракта начинается превышение содержания эозинофилов в крови точно сказать нельзя. Вопрос относится к спорным. Проводятся исследования.
Симптомы определяются конкретным патологическим процессом. Сами по себе гранулоциты, их повышение, никак не сказывается на состоянии здоровья. Это вторичное проявления.
Что касается основных признаков, имеют место:
- Боли в животе.
- Нарушение пищеварения.
- Расстройства стула. Поносы, запоры или их чередование.
- Изжога.
- Отрыжка.
- Вздутие. Повышенная продукция кишечного газа.
- Рвота и тошнота.
- Рост температуры.
- Слабость, сонливость.
- Понижение массы тела. Резкое похудение.
Необходима дифференциальная диагностика, чтобы не пропустить более опасные патологии— например, рак. Поскольку проявляется он примерно так же, а лечится — только на ранней стадии.
Терапию проводит гастроэнтеролог. Нужно бороться с первичным патологическим процессом, тогда причина повышения эозинофилов сойдет на нет сама.
Применяют препараты:
- Антациды. Средства для нормализации кислотности желудочного сока.
- Ингибиторы протонной помпы. Омез и аналогичные.
- Медикаменты для восстановления флоры кишечника. Бифидум и прочие.
- При инфекции назначат антибиотики и противовоспалительные.
- Поражения аутоиммунного характера, например, болезнь Крона, корректируются иммуносупрессорами и глюкокортикоидами.
Вопрос сложный. Нужно полное обследование.
Расстройства работы эндокринной системы
Причина нарушения очевидная. Дело в том, что гормоны коры надпочечников запускают процесс запланированной гибели клеток организма. В том числе гранулоцитов. Если глюкокортикоидов недостаточно, начинается патологическое состояние.
Среди основных диагнозов, которые провоцируют рост концентрации эозинофилов:
- Болезнь Аддисона.
 Она же недостаточность работы надпочечников.
Она же недостаточность работы надпочечников. - Ослабление функции гипофиза. Когда гормонов становится слишком мало.
Симптомы довольно типичные:
- Слабость.
- Сонливость.
- Понижение температуры тела.
- Головные боли и нарушения функции центральной нервной системы.
Это лишь часть проявлений. Лечение проводят эндокринологи. Необходимо введение искусственных глюкокортикоидов, тогда концентрация эозинофилов быстро приходит в норму.
Раковые опухоли
Многие злокачественные неоплазии умеют вырабатывать специальное вещество. Фактор, который вызывает выработку эозинофилов.
К таковым относят:
- Новообразования легких.
- Опухоли пищеварительного тракта.
- Неопластические поражения мочеотделительных структур.
Симптоматика зависит от конкретной опухоли, точной локализации патологического процесса.
Лечение онкологии специфическое:
- Удаление образования. Как можно более радикальное.

- Химиотерапия. Препаратами, которые замедляют синтез измененных клеток.
- Лучевое лечение.
Постепенно концентрация эозинофилов падает, но это довольно долгий процесс. На восстановление нормального состояния уходят месяцы.
Иммунологические проблемы
Встречаются исключительно редко. В основном речь идет о патологиях первичного типа. Не о СПИДе, а именно о врожденных расстройствах.
Аномалии сопровождаются характерными симптомами:
- Пациент часто и тяжело болеет.
- Все инфекции протекают аномально долго и в сложных формах.
Иммунодефицит отличается высокой смертностью. Лечения как такового нет.
При иммунодефиците эозинофилы в крови повышены в несколько раз, причем постоянно, состояние сохраняется годами.
Причины, не связанные с заболеваниями
Есть и естественные причины увеличения количества гранулоцитов.
Например:
- Интенсивная физическая нагрузка. Пока организм не восстановится сам.
 При систематических занятиях падение количества наблюдается постепенно.
При систематических занятиях падение количества наблюдается постепенно. - Неправильное питание.
- Недавно перенесенное заболевание.
- Повышение эозинофилов в крови у женщин происходит по причине циклических изменений. Менструация всему виной.
- Контакт с возбудителем инфекции. Даже если поражения не произошло.
- Эозинофилия у детей развивается в результате гормональных изменений, ближе к пубертату.
Вариантов довольно много. Не всегда речь идет о болезнях.
Дополнительные методы диагностики
Помимо собственно общего исследования крови, назначают вспомогательные мероприятия.
- Изучение мокроты. Чтобы выявить патологии легких и бронхов.
- Функция внешнего дыхания.
- Аллергические тесты. Стоят довольно дорого, но цена полностью покрывается информативностью.
- Рентгенография органов грудной клетки.
- Исследования крови на гормоны, биохимия.
Обычно этого достаточно. По потребности назначают МРТ или КТ.
Прогнозы
Сами по себе повышенные эозинофилы в крови у взрослых и детей не несут опасности. Это всего лишь лабораторный показатель. Отталкиваться нужно от основного патологического процесса.
Возможны ли осложнения
Как таковые — нет. По тем же самым причинам. Симптомы эозинофилии не несут опасности, это всего лишь диагностические результаты. Необходимо исследовать первичное заболевание.
Рост количества эозинофилов часто указывает на расстройства. Хотя и не всегда так. Нужна тщательная диагностика, чтобы поставить точку в вопросе.
Анализ крови повышенное содержание эозинофилов
23 января 201933275 тыс.
Эозинофилы — одна из групп лейкоцитов (белоснежных кровяных клеток). Они относятся к нейтрофильному ряду, но отличаются от нейтрофилов некими особенностями. Они немного крупнее. Ядра у их содержат наименьшее число частей (обычно 2-3).
Под микроскопом в цитоплазме этих клеток видна соответствующая обильная зернистость оранжево-розового цвета. Она состоит из огромного количества однородных гранул. Когда делают анализ крови, эозинофилы подсчитывают в мазке под микроскопом либо определяют на гематологическом анализаторе.
Повышенный уровень эозинофилов в крови у взрослого говорит о наличие ряда проблем в организме, с которыми столкнулся человек. Высокое содержание может говорить об аллергической реакции, не всегда острого типа, о разнообразных бактериальных инфекциях или о жизнедеятельности паразитов-глистов.
Это связано с тем, что эозинофилы, являются клетками, которые моментально реагируют на вышеперечисленные проблемы, и вместе с базофилами, их можно отнести к прямым маркерам на реакции гиперчувствительности в организме
Роль эозинофилов в организме
Функции эозинофилов разнообразны, некоторые из них очень похожи на функции других белых кровяных телец. Они участвуют в многочисленных воспалительных процессах, особенно связанных с аллергическими реакциями. Кроме того, у эозинофилов есть определенные физиологические роли в формировании органов (например, в развитии молочной железы после родов).
Различают следующие функции представленных клеток:
- нахождение в том месте, где имеют место воспалительные процессы;
- предотвращение негативного влияния потенциально опасных веществ;
- уничтожение клеток;
- противопаразитарная и бактерицидная активность.
Эозинофилы в крови могут оказывать не только положительное влияние, но и отрицательное. Они не дают потенциально опасным микроорганизмам попасть в организм человека, но бывают случаи, когда они связаны с патологическими изменениями. Ярким примером может стать болезнь Леффлера.
Норма
У взрослых норма эозинофилов в крови составляет 0,4х109/л, норма у детей несколько больше (до 0,7х109/л). Впрочем, относительно содержания других иммунных клеток нормальное количество эозинофилов у взрослых и детей колеблется в пределах 1–5%.
Повышенные эозинофилы в крови и других жидкостях организма могут быть обусловлены множеством факторов.
Причины повышения эозинофилов в крови
Почему эозинофилы повышены у взрослого, о чем это говорит? Эозинофилы выше нормы вызывают особое состояние организма, которое называют эозинофилией. Существуют различные степени этого недуга:
- Легкая – показатель клеток достигает 10%
- Средняя – от 10 до 15% эозинофилов
- Тяжелая форма – более 15 процентов. Данная степень заболевания может выражаться кислородным голоданием на клеточном или тканевом уровне.
В медицинской практике существует наиболее распространенная и легко запоминающаяся аббревиатура, которая помогает довольно легко запомнить наиболее известные причины развития эозинофилии.
ПОКАА – паразиты (лямблиоз, аскаридоз, описторхоз), опухоли, коллагенозы, аллергии, астма. Это топ 5 самых распространенных причин из-за которых происходит увеличение эозинофилов в крови.
В более редких случаях причиной повышения эозинофилов становятся другие болезни:
- Острый лейкоз.
- Туберкулез.
- Наследственная эозинофилия.
- Ревматическая лихорадка (ревматизм).
- Экссудативные реакции различного происхождения.
- Ваготония (раздражение блуждающего нерва), вегето-сосудистая дистония.
- Снижение функциональных способностей щитовидной железы (гипотиреоз).
Необходимо знать, что не всегда данные клетки приносят организму пользу. Борясь с инфекцией, они могут провоцировать аллергию сами. Когда число эозинофилов превышает 5% от общего количества лейкоцитов, формируется не только эозинофилия. В месте скопления данных клеток формируются воспалительные изменения тканей. По такому принципу часто у детей возникает ринит и отек гортани.
Физиологические причины
Содержание эозинофилов изменяется в зависимости от действия различных факторов:
- Самые высокие показатели данный клеток могут наблюдаться исключительно ночью, когда человек спит, а днем соответственно – самые низкие.
- Анализ выявляет вариации количества клеток у женщин на протяжении менструального цикла: в начальные этапы их число увеличивается, после овуляции постепенно снижается;
- Лечение некоторыми лекарственными средствами может повлиять на показатель: медикаменты от туберкулёза, пенициллины, аспирин, димедрол, препараты сульфаниламида и золота, комплексы с витамином В, химотрипсин, имипрамин, мисклерон, папаверин, эуфиллин, бета-блокаторы, хлорпропамид, гормональные лекарства и т.д;
- Пищевой режим: сладости или алкоголь увеличивают вероятность того, что анализ будет некорректный.
Впервые обнаруженные повышенные эозинофилы в анализе крови требуют проведения повторного исследования и изучения изменения их количества в динамике (нескольких последовательно проведённых анализов).
Повышенные эозинофилы у ребенка
В зависимости от возраста ребенка, причиной превышения нормы содержания клеток могут быть следующие факторы:
- У новорожденных детей высокая норма эозинофилов может быть вызвана резус-конфликтом, стафилококком, гемолитической болезнью, дерматитами и аллергическими реакциями на медикаменты или еду.
- В возрасте от полутора до трех лет высокие показатели эозинофилов могут быть вызваны атопическим дерматитом, аллергией на лекарства и отеком Квинке.
- У детей старше трех лет эозинофилы повышаются при наличии бронхиальной астмы или аллергического ринита, во время обострения кожной аллергии, ветрянки, скарлатины и при гельминтозе. Также повышение эозинофилов у ребенка могут вызывать злокачественные опухоли.
Повышенные эозинофилы в крови – это не самостоятельное заболевание, все усилия должны быть направлены на то, чтобы найти основную причину их повышения и, по возможности, ее ликвидировать.
Что делать?
Если общий анализ крови показал, что эозинофилы повысились, нужно обязательно дополнительно сдать биохимический анализ крови, так можно узнать о заболевании, которое привело к повышению. Обязательно нужно обратить внимание на белковый уровень ферментов, которые размещены в печени и т.д. Дополнитель
Эозинофилы повышены: патология или вариант нормы
Норма эозинофилов в крови 1 — 5
Для взрослых нормальным содержанием эозинофилов в клиническом анализе крови считается от 1 до 5% от общего числа лейкоцитов. Эозинофилы определяются методом проточной цитометрии с использование полупроводникового лазера, при этом норма у женщин такая же, как и у мужчин. Более редкие единицы измерения – число клеток в 1 мл крови. Эозинофилов должно быть от 120 до 350 в миллилитре крови.
Число этих клеток может колебаться в течение суток на фоне изменения работы надпочечников.
- В утренние вечерние часы эозинофилов на 15% больше по сравнению с нормой
- В первую половину ночи на 30% больше.
Для более достоверного результата анализа следует:
- Сдавать анализ крови в ранние утренние часы натощак.
- За два дня следует воздерживаться от алкоголя и чрезмерного употребления сладостей.
- Также эозинофилы могут повышаться во время менструаций у женщин. Начиная с момента овуляции, до конца цикла их число падает. На этом феномене основан эозинофильный тест работы яичников и определения дня овуляции. Эстрогены увеличивают созревание эозинофилов, прогестерон – снижает.
Какую функцию они выполняют в организме?
Эозинофилы в человеческом организме выполняют самые различные функции. По этой причине большинство из них схожи с функциями остальных кровяных телец. Они принимают участие во многих воспалительных процессах, а больше всего в тех, что имеют аллергическое происхождение. Помимо этого, эозинофилы обладают определённой ролью во время формирования органов.
Различают следующие функции представленных клеток:
- нахождение в том месте, где имеют место воспалительные процессы;
- предотвращение негативного влияния потенциально опасных веществ;
- уничтожение клеток;
- противопаразитарная и бактерицидная активность.
Эозинофилы в крови могут оказывать не только положительное влияние, но и отрицательное. Они не дают потенциально опасным микроорганизмам попасть в организм человека, но бывают случаи, когда они связаны с патологическими изменениями. Ярким примером может стать болезнь Леффлера.
Эозинофилы выше нормы, что это значит
Значимым повышением количества эозинофилов считается состояние, когда клеток более 700 в миллилитре (7 на 10 в 9 грамм на литр). Повышенное содержание эозинофилов носит наименование эозинофилии.
- Рост до 10% — легкая степень
- От 10 до 15% — умеренная
- Свыше 15% (больше 1500 клеток в миллилитре) – выраженная или тяжелая эозинофилия. При этом могут наблюдаться изменения во внутренних органов за счет клеточного и тканевого кислородного голодания.
Иногда при подсчете клеток возникают ошибки. Эозином прокрашиваются не только эозинофильные гранулоциты, но и зернистость в нейтрофилах, тогда нейтрофилы понижены, а эозинофилы повышены без веских к тому причин. В таком случае потребуется контрольный анализ крови.
Нормальные показатели
При интерпретации клинического анализа крови эозинофилы измеряют в процентах от общего объёма всех разновидностей лейкоцитов. Норма эозинофилов в крови не зависит от возраста пациента и его пола, поэтому у взрослого и ребёнка она будет одинаковой.
| Возраст | Норма (%) |
|---|---|
| Взрослые | 1-5 |
| Нормы у детей: | |
| 4-18 лет | 1-5 |
| 2-4 года | 1-6 |
| 1-2 года | 1-7 |
| 0-12 месяцев | 1-6 |
Таблица — Нормальные значения эозинофилов
Нормальное значение представленных клеток должно определяться на протяжении суток с учётом режима сна. В утреннее и вечернее время объём эозинофилов у детей и взрослых на 20% ниже среднесуточного. А начиная с полуночи и до середины ночи, этот показатель у детей и взрослых будет выше на 30%.
Содержание эозинофилов изменяется в зависимости от действия различных факторов:
- В ночной период эозинофилия может достигать уровня выше 30%, особенно вначале;
- Повышение показателя наблюдается в вечернее время;
- Анализ выявляет вариации количества клеток у женщин на протяжении менструального цикла: в начальные этапы их число увеличивается, после овуляции постепенно снижается;
- Лечение некоторыми лекарственными средствами может повлиять на показатель: аспирин, димедрол, медикаменты от туберкулёза, пенициллины, препараты сульфаниламида и золота, комплексы с витамином В, имипрамин, мисклерон, папаверин, эуфиллин, бета-блокаторы, химотрипсин, хлорпропамид, гормональные медпрепараты и другие;
- Пищевой режим: сладости, алкогольсодержащие напитки повышают вероятность того, что анализ будет неверный.
Впервые обнаруженные повышенные эозинофилы в анализе крови требуют проведения повторного исследования и изучения изменения их количества в динамике (нескольких последовательно проведённых анализов).
Что ведет к эозинофилии
Когда в крови повышены эозинофилы, причины кроются в аллергической готовности организма. Это происходит при:
- острых аллергических состояниях (отеке Квинке, крапивнице, сенной лихорадке)
- аллергии на лекарства, сывороточной болезни
- аллергическом рините
- кожных аллергиях (контактном дерматите, экземе, атопическом дерматите, вульгарной пузырчатке)
- гельминтозах (см. признаки глистов у человека)
- паразитарных болезнях (токсоплазмозе, хламидиозе, амебиазе)
- острых инфекциях и обострениях хронических (туберкулезе, гонорее, инфекционном мононуклеозе)
- системных патологиях (системной красной волчанке, эозинофильном фасциите, ревматоидном артрите, периартериите узелковом)
- патологии легких: бронхиальной астме, фиброзирующем альвеолите, саркоидозе, эозинофильном плеврите, гистиоцитозе, болезни Лефлера
- поражениях желудочно-кишечного тракта: эозинофильном гастрите, эозинофильном колите
- опухолях крови (лимфогранулематозе, лимфомах)
- злокачественных новообразованиях.
Далее назначается консультация аллерголога:
- При аллергическом рините берутся мазки из носа и зева на эозинофилы.
- При подозрении на бронхиальную астму выполняется спирометрия и провокационные пробы (холодовая, с беротеком).
- Аллерголог в дальнейшем проводит специфическую диагностику (определение аллергенов по стандартным сывороткам), уточняет диагноз и назначает лечение (антигистамины, гормональные препараты, сыворотки).
От глистной инвазии, паразитарных болезней и острых инфекций лечит инфекционист. Легочными проблемами займется пульмонолог.
Повышенное содержание эозинофилов
Если в общем анализе крови повышены эозинофилы, то такое состояние носит название эозинофилия. Она подразделяется на несколько степени:
- Лёгкая эозинофилия. Для неё характерно количество клеток до 10%.
- Умеренная эозинофилия. Эозинофилы содержатся в количестве 10–15%.
- Выраженная эозинофилия. Клеток более 15%.
Но это далеко не окончательные значения, так как многие гематологи до сих спорят и утверждают, что умеренная эозинофилия у детей и взрослых имеет диапазон 10–20%.
От степени эозинофилии будет зависеть выраженность патологического процесса, ведь чем она выше, тем тяжелее протекает патология.
Причины патологии
Если эозинофилы повышены, необходимо выявить причину, поскольку патология является симптомом какого-либо заболевания, а не отдельной болезнью. Увеличение числа этих клеток крови говорит об интенсивной работе иммунитета, и не всегда требует лечения.
- Паразитарные заражения;
- Аллергические реакции;
- Заболевания внутренних органов;
- Болезни крови;
- Дерматологические патологии;
- Аутоиммунные заболевания;
- Инфекции;
- Образования злокачественной природы.
Паразиты
Анализ крови выявляет эозинофилию при заражении человека гельминтозами. Причиной могут послужить следующие заболевания:
- Токсокароз;
- Описторхоз;
- Лямблиоз;
- Аскаридоз;
- Филяриоз;
- Стронгилоидоз;
- Малярия;
- Парагонимоз;
- Эхинококкоз;
- Трихинеллёз;
- Амебиаз.
Аллергия
Аллергическая реакция занимает лидирующее место в числе причин повышения эозинофилов. Состояние развивается при:
- Поллинозе;
- Отёке Квинке;
- Бронхиальной астме;
- Аллергической реакции на медикаменты;
- Сенной лихорадке;
- Сывороточной болезни;
- Рините аллергической природы;
- Крапивнице;
- Фасциите;
- Миозите и др.
| Лёгкие | ЖКТ | Сердце | Печень |
|---|---|---|---|
| альвеолит | гастрит | инфаркт миокарда | цирроз |
| плеврит | колит | врождённые пороки | |
| болезнь Леффлера | язва | ||
| саркоидоз | гастроэнтерит | ||
| гистиоцитоз | |||
| аспергиллёз | |||
| пневмония | |||
| наличие инфильтратов | |||
Заболевания крови
Повышение эозинофилов наблюдается при эритремии, миелолейкозе, лимфогранулематозе, полицитемии, пернициозной анемии, синдроме Сезари.
Практически любое заболевание кожи приводит к тому что эозинофилы повышены:
- Лишай;
- Вульгарная пузырчатка;
- Контактный или атопический дерматит;
- Пемфигус;
- Экзема;
- Грибковое заболевание.
Нередко анализ крови выявляет увеличение эозинофилов при склеродермии, СКВ (системной красной волчанке), также большое количество данных клеток образуется при отвержении трансплантата.
Инфекции
Попадание в организм инфекции всегда вызывает эозинофилию. Спровоцировать состояние может как острая фаза, так и обострение хронических заболеваний:
- Скарлатина;
- Туберкулёз;
- Гонорея;
- Мононуклеоз;
- Сифилис и др.
Различные формы злокачественных образований, в том числе лимфомы и лимфогранулематозы, вызывают увеличение клеток эозинофилов в крови. Опухоли могут локализоваться в различных органах: половые или внутренние органы, щитовидная железа, кожа, желудок и т. д., состояние ухудшается при появлении метастазов.
Аллергия вызывает повышение эозинофилов в крови
Когда в анализе крови было обнаружено повышенное содержание представленных клеток, можно утверждать о следующих патологических изменениях в организме у ребёнка и взрослого:
- Аллергия очень часто вызывает такое состояние, как эозинофилия.
- Реакция организма на определённый медикамент. Здесь может иметь место лекарственная аллергия, которую вызвали антибиотики. Но заработать такую патологию можно даже после приёма обычного аспирина. Если при сдаче анализе была обнаружена эозинофилия, нужно срочно сообщить об этом своему врачу о препаратах, которые вы употребляете.
- Нехватка магния.
- Глистные паразитарные инфекции. Эозинофилия может быть обнаружена у детей и у взрослых по причине заражения аскаридами, лямблиями.
- Болезни ЖКТ, протекающие в хронической форме. Сюда можно отнести гастриты, язвы.
- Болезни кожных покровов пополняют лишай, экзема.
- Злокачественные раковые опухоли.
- Сердечная недостаточность, цирроз, хорея. Все эти заболевания могут способствовать обнаружению повышенного содержания клеток в анализе плазмы.
Эозинофилия как у ребёнка, так и у взрослого может иметь положительную сторону. Например, при разгаре инфекционного недуга эозинофилия в лёгкой форме будет являться первым симптомом наступлении выздоровления.
Эозинофилы ниже нормы
Если абсолютное число эозинофилов в миллилитре крови падает ниже 200, состояние интерпретируется, как эозинопения.
Низкими показатели эозинофилов становятся в следующих случаях:
- При тяжелых гнойных инфекциях, в том числе, сепсисе, когда популяция лейкоцитов сдвигается в сторону юных форм (палочкоядерных и сегментоядерных), а затем лейкоцитарный ответ истощается.
- В начале воспалительных процессов, при хирургических патологиях (аппендиците, панкреатите, обострении желчнокаменной болезни).
- В первые сутки инфаркта миокарда.
- При инфекционном, болевом шоке, когда форменные элементы крови склеиваются в тиноподобные образования внутри сосудов.
- При отравлениях тяжелыми металлами (свинцом, медью, ртутью, мышьяком, висмутом, кадмием, таллием).
- При хроническом стрессе.
- На фоне патологий щитовидной железы и надпочечников.
- В развернутую стадию лейкоза эозинофилы падают до нуля.
Повышенное содержание эозинофилов
Если в клиническом анализе крови эозинофилы понижены, то такое состояние носит название эозинопения. Она указывает на истощение организма. Как правило, возникает подобное состояние у ребёнка и взрослого по причине стрессов различного происхождения:
- начальная стадия развития инфекционных заболеваний;
- состояние пациента после перенесённой операции;
- механические и термические травмы;
- сепсис.
Если эозинофилы резко понизились, то можно утверждать о наличии дизентерии, брюшного тифа или аппендицита в острой форме.
Снижение эозинофилов в крови
Объём эозинофилов у ребёнка и у взрослого может незначительно понижаться и иметь постоянный характер. Такие признаки характерны для людей с синдромом Дауна и тех, кто постоянно не высыпается.
Кроме этого, эозинопения является характерным признаком при терапии кортикостероидными гормонами. Ведь по причине выброса надпочечников наблюдается слабое производство эозинофилов утром. Также при приёме гормональных препаратов у ребёнка и взрослого может возникнуть такой побочный эффект, как сниженное производство этих клеток.
Сочетанные повышения эозинофилов
- Лимфоциты и эозинофилы бывают повышены при вирусных инфекциях у аллергиков, у пациентов с аллергодерматозами или гельминтозами. Такая же картина будет в крови у тех, кто лечится антибиотиками или сульфаниламидами. У детей эти клетки повышаются при скарлатине, наличии вируса Эпштейна-Барра. Для дифференциальной диагностики дополнительно рекомендуется сдать кровь на уровень иммуноглобулинов Е, на антитела к вирусу Эпштейна-Барра и кал на яйца глистов.
- Моноциты и эозинофилы возрастают при инфекционных процессах. Самый типичный случай у детей и взрослых – мононуклеоз. Аналогичная картина может быть при вирусных и грибковых заболеваниях, риккетсиозе, сифилисе, туберкулезе, саркоидозе.
Эозинофилы у беременных
Во время беременности эозинофилы в норме должны содержаться в количестве 0–5%. Если эта цифра увеличена в период беременности, то чаще всего это указывает на наличие аллергической реакции. Например, девушка на момент беременности съела цитрусовые перед тем, как отправиться на сдачу крови. Иногда при беременности женщина может даже не подозревать, что она страдает аллергией.
Терапевтические мероприятия
Лечение повышения уровня эозинофилов в крови
Когда причина повышенного содержания клеток ещё не определена, то кроме осмотра и сбора необходимой информации, врач может назначить следующие виды диагностики:
- рентген лёгких;
- исследование мочи и кала;
- функциональные тесты печени и почек;
- диагностика на выявление аллергена;
- серологические обследования на определение паразитарных инфекций и болезней соединительной ткани.
Лечение у детей и у взрослых можно проводить только в том случае, когда была точно выявлена причина эозинофилии. Особенно тщательно необходимо подходить к этому вопросу, когда речь идёт о беременности. Ведь в таком случае от правильно выбранной терапии будет зависеть жизнь двух людей.
Если во время терапии удалось устранить основной провоцирующий патологический процесс и аллерген, то состояние пациента нормализуется так же, как уровень представленных клеток в крови. В некоторых случаях лечение может включать приём медикаментов, которые позволяют подавить эозинофилы.
https://www.youtube.com/watch?v=1iU7p3nSuKU
Общий анализ крови – это важный вид диагностики, ведь благодаря ему удаётся определить различные патологические процессы в организме. Так, например, эозинофилы при отклонении от нормы указывают на аллергию, воспалительный процесс, заболевания кожи. Если вовремя провести мероприятия по нормализации клеток крови, то состояние пациента будет заметно улучшаться.
Высоких эозинофилов | Новое руководство по здоровью
Эозинофилы, также известные как ацидофилы, представляют собой тип лейкоцитов или белых кровяных телец, которые являются частью иммунной системы организма, которая помогает защитить от вирусных, паразитарных и бактериальных инфекций.
Белые кровяные тельца играют важную роль в защите организма от паразитов. Повышенный уровень лейкоцитов в организме может помочь определить, страдаете ли вы от болезни, потому что это означает, что ваше тело вырабатывает больше лейкоцитов, чтобы помочь бороться с инфекцией.Что означает высокий уровень эозинофилов? Что делать с высокими эозинофилами?
Высокие эозинофилы
Определение
Эозинофилия означает уровень эозинофилов выше нормы. Эозинофилы циркулируют в крови, но концентрация этих клеток может возникать в месте воспаления или инфекции. Тканевые эозинофилы могут быть обнаружены в образцах тканей во время исследовательских процедур или в образцах жидкости, такой как слизь. Эозинофилия крови обнаруживается с помощью анализа крови, часто при сдаче общего анализа крови.
Нормальное количество эозинофилов составляет менее 350 клеток на микролитр (клеток / мкл). Более 500 эозинофилов на микролитр считается эозинофилией у взрослого. Более 1500 эозинофилов на микролитр, возникающее в течение нескольких месяцев, известно как гиперэозинофильный синдром.
Симптомы
Симптомы эозинофилии, как правило, отражают основное заболевание, вызвавшее ее. Например, если вы страдаете астмой, симптомы могут включать затрудненное дыхание (одышку), хрипы или одышку, в то время как паразитарная инфекция может вызывать такие симптомы, как боль в животе, лихорадка или кожная сыпь.
Причины
Аллергические расстройства | Аллергические расстройства отмечаются наличием эозинофилов. Эти увеличения могут вызвать риноконъюнктивит или сенная лихорадка, а также астма. |
Реакции на лекарства | Любое лекарство или лекарство может вызвать реакцию, включая аллергические реакции, которые могут вызвать повышение эозинофилов в тканях или крови, где находится лекарство. |
Инфекционные болезни | Грибковые, паразитарные и другие виды инфекций обычно связаны с увеличением количества эозинофилов. |
Заболевания крови | Гематологические заболевания, такие как лимфома, лейкемия, гиперэозинофильные, опухоли, атероэмболическая болезнь или мастоцитоз, могут вызывать увеличение эозинофилов. |
Иммунологические заболевания или реакции | Синдром Оммена, синдром гипер-IgE и реакции трансплантата — вот некоторые из состояний, которые могут вызывать повышение эозинофилов. |
Эндокринные заболевания | Гипоадренализм может вызывать увеличение эозинофилов в крови, включая состояния, перечисленные ниже. |
Кожные и подкожные заболевания | Атопический дерматит, вульгарная пузырчатка, буллезный пемфигоид, поражения, вызванные лекарственными средствами, герпетиформный дерматит, ангионевротический отек, крапивница, синдром Шульмана, болезнь Кимуры, синдром Уэллса, слизистая оболочка полости рта, эозинофильные ялеры или рецидивирующий кожно-некротический васкулит может вызывать эти состояния. |
Заболевания легких | Легочные заболевания, которые, как известно, вызывают повышение эозинофилов, включают синдром Лёффлера, эозинофильную болезнь легких, аллергический бронхолегочный аспергиллез, синдром Чарджа-Стросса, эозинофильную пневмонию, плевральную эозинофилию и эозинофильную гранулему. |
Заболевания желудочно-кишечного тракта | Паразитарные инфекции, гастроэзофагеальный рефлюкс, грибковые инфекции, воспалительные заболевания кишечника, инфекции Helicobacter pylori, пищевые аллергические расстройства, белковая энтеропатия, целиакия, аллергический колит, вегетарианская пузырчатка, первичный эозинофильный эзофагит и гастроэнтерит могут вызывать повышение эозинофилов. |
Неврологические заболевания | Инфекции центральной нервной системы, мембраны субдруальной гематомы, побочные реакции, вызванные лекарственными средствами, и вентрикулоперитонеальные шунты могут вызывать эту реакцию. |
Ревматологические заболевания | Вентрикулоперитонеальные шунты, инфекции центральной нервной системы, субдуральные мембраны гематомы и побочные реакции, вызванные лекарствами, могут приводить к высокому уровню эозинофилов. |
Сердечные заболевания | Синдром Чарджа-Стросса, поражение сердца, гиперэозинофильный синдром и некоторые врожденные пороки сердца могут привести к увеличению эозинофилов в крови. |
Болезни почек | Эозинофилы, обнаруженные в моче, могут указывать на эозинофильный цистит или интерстициальный нефрит. |
Диагностика и лечение
Тесты на количество эозинофилов могут быть выполнены во время общего анализа крови или CBC.Если ваш врач подозревает, что у вас высокий уровень эозинофилов или он обнаружен во время обследования, может быть проведено дополнительное обследование, включая компьютерную томографию, биопсию тканей, рентген, серологические обследования, функциональные пробы печени, общий анализ мочи или стула.
Вы не будете лечить эозинофилию, а будете искать лечение от основного состояния, которое ее вызвало. Кортикостероиды обычно эффективны при лечении некоторых форм эозинофилии, которые не связаны со злокачественными заболеваниями. Тяжелые формы этого заболевания, поражающие жизненно важные органы, требуют для лечения более агрессивных препаратов.Это может включать антикоагулянтную терапию или введение химиотерапевтических агентов. Также может потребоваться операция, которая восстановит функцию пораженных органов.
Когда обращаться к врачу
Вы часто обнаруживаете эозинофилию, когда врач назначал анализы крови, чтобы помочь диагностировать другие симптомы, которые вы испытываете. Это часто обнаруживается случайно, а не является прямым результатом экзамена. Ваш врач может объяснить, что означают эти результаты.
Если у вас есть доказательства эозинофилии тканей или крови, ваш врач может назначить дополнительные анализы, чтобы выявить основную проблему.Если вам поставят точный диагноз, вы сможете вылечить эти состояния, и ваша эозинофилия также исчезнет.
Тем, кто страдает стойким гиперэозинофильным синдромом, вам нужно будет проконсультироваться с врачом, чтобы следить за своим здоровьем, чтобы предотвратить возможные осложнения с течением времени.
причин эозинофилии — клиника Мэйо
Эозинофилы играют в вашей иммунной системе две роли:
- Уничтожение посторонних предметов. Эозинофилы могут потреблять посторонние вещества.Например, они борются с веществами, связанными с паразитарной инфекцией, которые были отмечены как уничтоженные вашей иммунной системой.
- Регулирует воспаление. Эозинофилы способствуют развитию воспаления, которое играет полезную роль в изоляции и контроле очага заболевания. Но иногда воспаление может быть сильнее, чем необходимо, что может привести к неприятным симптомам или даже к повреждению тканей. Например, эозинофилы играют ключевую роль в симптомах астмы и аллергии, таких как сенная лихорадка.Другие нарушения иммунной системы также могут способствовать продолжающемуся (хроническому) воспалению.
Эозинофилия возникает, когда большое количество эозинофилов рекрутируется в определенное место вашего тела или когда костный мозг производит слишком много эозинофилов. Это может быть вызвано множеством факторов, включая:
- Паразитарные и грибковые заболевания
- Аллергические реакции
- Заболевания надпочечников
- Кожные заболевания
- Токсины
- Аутоиммунные расстройства
- Эндокринные расстройства
- Опухоли и состояния, которые могут привести к эозинофилии крови или тканей, включают:
- Острый миелогенный лейкоз (AML)
- Аллергия
- Аскаридоз (инфекция круглого червя)
- Астма
- Атопический дерматит (экзема)
- Синдром
- Болезнь Крона (тип воспалительного заболевания кишечника)
- Лекарственная аллергия
- Эозинофильный эзофагит
- Эозинофильный лейкоз
- Сенная лихорадка (аллергический ринит)
- Гиперфильная лихорадка Ходжкина 9019 Гиперинопатическая болезнь 9019 Гиперинопатическая болезнь Ходжкина 9019 Гиперинофильная болезнь Ходжкина фильный синдром (ГЭК), чрезвычайно высокое количество эозинофилов неизвестного происхождения
- Лимфатический филяриатоз (паразитарная инфекция)
- Рак яичников
- Паразитарная инфекция
- Первичный иммунодефицит
- Трихинеллез (инфекция круглого червя)
- Язвенный червь
- Паразитарные заболевания и аллергические реакции на лекарства — одни из наиболее частых причин эозинофилии.Гиперэозинофила, вызывающая повреждение органов, называется гиперэозинофильным синдромом. Этот синдром, как правило, имеет неизвестную причину или является результатом определенных типов рака, таких как рак костного мозга или лимфатических узлов.
Показанные здесь причины обычно связаны с этим симптомом. Проконсультируйтесь с врачом или другим медицинским работником, чтобы поставить точный диагноз.
- Определение
- Когда обращаться к врачу
- Эозинофилия.Руководство Merck Professional Version. https://www.merckmanuals.com/professional/hemology-and-oncology/eosinophilic-disorders/eosinophilia. По состоянию на 15 августа 2019 г.,
- Weller PF, et al. Биология эозинофилов и причины эозинофилии. https://www.uptodate.com/contents/search. По состоянию на 15 августа 2019 г.,
- Jameson JL, et al., Eds. Нарушения гранулоцитов и моноцитов. В: Принципы внутренней медицины Харрисона. 20-е изд. Компании Макгроу-Хилл; 2018. https: // accessmedicine.mhmedical.com. По состоянию на 15 августа 2019 г.,
- McPherson RA, et al., Eds. Лейкоцитарные нарушения. В: Клиническая диагностика и лечение Генри лабораторными методами. 23-е изд. Эльзевир; 2017. https://www.clinicalkey.com. По состоянию на 15 августа 2019 г.,
.
Эозинофилия — Консультант по терапии рака
Эозинофилия
Что нужно знать каждому врачу:
«Эозинофилия» означает повышенное абсолютное количество эозинофилов в периферической крови.И периферическая эозинофилия, и тканевая эозинофилия (инфильтрация тканей тела аномально высоким количеством эозинофилов) могут возникать как вторичные проявления широкого спектра аллергических, инфекционных и злокачественных состояний или как первичное проявление гиперэозинофильного синдрома.
Строгие определения эозинофилии незначительно различаются в разных лабораториях, но наиболее общепринятым пороговым значением является абсолютное количество эозинофилов, превышающее 500 эозинофилов на микролитр крови.Многие эксперты дополнительно классифицируют степень эозинофилии следующим образом:
Легкая эозинофилия: от 500 до 1500 эозинофилов / мкл
Умеренная эозинофилия: от 1500 до 5000 эозинофилов / мкл
Тяжелая эозинофилия: более 5000 эозинофилов / мкл
Дополнительный термин «гиперэозинофилия» был использован для обозначения абсолютного количества эозинофилов более 1500 / мкл, что включает умеренную и тяжелую эозинофилию.Напротив, термин «гиперэозинофильный синдром» обычно используется для обозначения гиперэозинофилии (обычно тяжелой), возникающей при отсутствии очевидного основного процесса.
Какие особенности презентации помогут мне определить возможные причины и следующие шаги лечения:
Острота презентации
Хотя это и неспецифично, быстро развивающаяся эозинофилия часто наблюдается при наличии аллергической реакции, агрессивной инфекции или злокачественного образования. С другой стороны, давняя эозинофилия может наблюдаться при хронических инфекциях, аутоиммунных заболеваниях и вялотекущих злокачественных новообразованиях.
Степень эозинофилии
Некоторые заболевания (особенно астма и надпочечниковая недостаточность) редко проявляются более чем легкой эозинофилией, а наличие тяжелой эозинофилии делает это менее вероятным. В противном случае, однако, степень тяжести эозинофилии редко помогает различить ее возможные причины.
Сопутствующие симптомы
Зуд — частая находка у многих пациентов с эозинофилией и может указывать на наличие аллергического процесса, паразитарной инфекции или гематологического злокачественного новообразования.Некоторые дерматологические признаки, особенно крапивница (волдыри), также часто встречаются у пациентов с эозинофилией и зудом.
Яркие конституциональные симптомы, такие как усталость, лихорадка, ночная потливость или потеря веса, хотя и неспецифические, могут сопровождать эозинофилию, вызванную хроническими инфекциями (особенно ВИЧ и кишечными паразитами), недостаточностью надпочечников, аутоиммунными заболеваниями или злокачественными новообразованиями.
Одышка или хрипы могут указывать на наличие астмы, аллергического бронхолегочного аспергиллеза (АБЛА) или синдрома Черга-Стросса.Одышка без выраженного свистящего дыхания может возникать при тероэмболической легочной эмболии.
Диарея или боль в животе могут возникать при нескольких синдромах, связанных с эозинофилией, особенно при паразитарных инфекциях.
Артралгии, миалгии, воспаление суставов, феномен Рейно, синдром Сикки или кожная сыпь на скуле могут указывать на наличие основного аутоиммунного заболевания.
Осмотр
Знаки, которые могут помочь при обследовании и лечении, включают:
Ортостатические изменения показателей жизнедеятельности (надпочечниковая недостаточность)
Свистящее дыхание (астма, АБЛА, синдром Черга-Стросса)
Болезненность живота (глистные инфекции)
Гепатоспленомегалия, лимфаденопатия (гематологические злокачественные новообразования, хронические инфекции)
Снижение периферического пульса (облитерирующий тромбангиит, атероэмболическая болезнь почек)
Воспаление суставов (ревматологическая болезнь)
Дерматография (аллергическая реакция, первичный мастоцитоз)
Падение стопы или другое свидетельство множественного мононеврита (синдром Черга-Стросса)
Какие лабораторные исследования следует заказать для постановки диагноза и как интерпретировать результаты?
Требуется лабораторных исследований:
— Гипонатриемия может указывать на недостаточность надпочечников или сокращение объема из-за диареи.- Гиперкалиемия может указывать на надпочечниковую недостаточность. — Неанионный метаболический ацидоз может указывать на надпочечниковую недостаточность. — Нарушение функции почек неспецифично, но может наблюдаться при остром интерстициальном нефрите.
— Повышение других типов лейкоцитов может указывать на инфекцию или злокачественное новообразование. — Анемия, хотя и неспецифическая, может указывать на хроническое заболевание, дефицит железа из-за злокачественного образования или инфильтративного паразита, гемолиз или инфильтрацию костного мозга или недостаточность, связанную с основным заболеванием. злокачественность.- Тромбоцитопения может сопровождать аутоиммунные заболевания, инфекцию или злокачественное новообразование. — Тромбоцитоз может быть реактивным на инфекцию или аутоиммунное заболевание, или может возникать на фоне злокачественного новообразования или миелопролиферативного заболевания.
Дополнительные лабораторные исследования должны зависеть от клинических обстоятельств и могут включать:
— Подклассы иммуноглобулинов (особенно иммуноглобулин E [IgE]). — Триптаза.
— Серология на ВИЧ +/- вирусная нагрузка. — Серология на Т-лимфотропный вирус человека (HTLV) типов I и II.- Исследование кала на яйцеклетки и паразиты. — Серология на стронгилоиды, Toxocara canis, Trichinella, Schistosoma, Echinococcus. — Серология на кокцидиомикоз, гистоплазму или аспергиллы. — Кожные пробы на реактивность к антигенам Aspergillus. чувствителен для диагностики инвазивных аспергиллезных инфекций, бесполезен при диагностике АБЛА.
— Периферическая проточная цитометрия на маркеры лейкемии или лимфомы. — Лактатдегидрогеназа (ЛДГ) (неспецифическая, но может указывать на повышенный клеточный оборот).- Исследование костного мозга на проточную цитометрию и цитогенетику.
— Антинуклеарные антитела. Однако, как подробно описано ниже, ревматологические заболевания являются редкой причиной эозинофилии, поэтому тестирование на более распространенные заболевания, такие как ревматоидный артрит или системный склероз, обычно не показано, а если положительный результат, скорее всего, является случайным.
Какие состояния могут лежать в основе эозинофилии:
Аллергические расстройства
— Полипоз носа +/- астма или чувствительность к аспирину. — Неаллергический ринит с синдромом эозинофилии (НАРЕС).
Инфекционные заболевания
— ВИЧ.- HTLV-I и -II.
— Гельминты: (анкилостомоз, Strongyloides, цистицеркоз, эхинококк, гнатостомоз) .- Филяриоз (Loa loa, онхоцеркоз, мансонеллиоз) .- двуустки (шистосомоз, Clonorchis, paragonimiasis) .- Protobazoa: Diffragilamis, примечание. другие простейшие не вызывают эозинофилию)
— АБЛА- кокцидиомикоз (первичный или диссеминированный)
Неопластические расстройства
— Гиперэозинофильные синдромы.- Мастоцитоз. — Острый эозинофильный лейкоз (FAB M4Eo).
— Острый лимфобластный лейкоз, предшественник В-клеток (обычно с t [5; 14]). — Т-предшественник острого лимфобластного лейкоза (обычно с t [8; 13]). — лимфома Ходжкина. — неходжкинская лимфома. Синдром Сезари. — Солидные опухоли (встречаются редко).
Аутоиммунное / ревматическое заболевание
Синдром эозинофилии-миалгии (связанный с загрязненным L-триптофаном)
Синдром токсического масла (связанный с приемом денатурированного рапсового масла)
Идиопатический эозинофильный синовит
Другие болезни (редко встречающиеся): ревматоидный артрит, дерматомиозит, системный склероз, синдром Шегрена
Васкулит
Первичный иммунодефицит
Надпочечниковая недостаточность
Атероэмболическая болезнь
Когда вам нужно проходить более агрессивные тесты:
Быстро увеличивающееся количество эозинофилов или явные конституциональные симптомы могут указывать на наличие агрессивного неопластического процесса, в то время как гемодинамическая нестабильность или признаки анафилаксии могут указывать на развивающуюся серьезную аллергическую реакцию.С другой стороны, давняя эозинофилия, особенно если она сопровождается некоторыми из признаков или симптомов, описанных выше, может потребовать более инвазивного или агрессивного тестирования, если причина эозинофилии неясна после основного обследования.
Некоторые из этих тестов могут включать:
— Для поиска признаков тканевой эозинофилии или инвазии тучных клеток, как это может быть при гиперэозинофильных синдромах или мастоцитозе.
Биопсия мышц, кожи или других органов
— Для поиска признаков тканевой эозинофилии или инвазии тучных клеток, как это может быть при гиперэозинофильных синдромах или мастоцитозе.
Бронхоскопия с лаважем +/- трансбронхиальная биопсия
— Для поиска эозинофилов, аспергиллов или гранулмоа, которые могут указывать на Чардж-Стросса или гранулематоз с полиангиитом.
Какие исследования изображений (если таковые имеются) будут полезны?
Не существует визуальных исследований, универсально применимых ко всем случаям эозинофилии. Локализация признаков и симптомов может потребовать проведения соответствующей визуализации, которая поможет определить источник инфекции или злокачественного новообразования.
Какие методы лечения следует начать немедленно и при каких обстоятельствах — даже если основная причина не установлена?
Соответствующая терапия почти всегда будет зависеть от выявления основной причины эозинофилии.
Пациентам с отеком губ или языка, отеком гортани или острым бронхоспазмом либо признаками гемодинамического коллапса, указывающими на анафилактическую реакцию, следует лечить стероидами и / или адреналином, в зависимости от ситуации.
Пациентов с сопутствующими инфекциями или злокачественными новообразованиями следует направлять к соответствующим узким специалистам для дополнительного диагностического обследования и лечения после постановки диагноза. Пациентам с надпочечниковой недостаточностью обычно требуется заместительная терапия кортикостероидами.
Какие другие методы лечения помогают уменьшить осложнения?
Пациентов с тяжелым зудом следует лечить симптоматически, применяя местные увлажняющие кремы или лосьоны и антигистаминные препараты первого поколения (дифенгидрамин или гидроксизин) или второго поколения (лоратидин, фексофенадин или цетиризин).
Что вы должны сказать пациенту и его семье о прогнозе?
Как и при лечении, прогноз зависит от основной причины эозинофилии.
сценария «Что если».
Поскольку эозинофилия имеет широкий дифференциальный диагноз, существует множество потенциальных моментов для принятия решения при ее выявлении и лечении. Самым важным из них является выявление состояний, неизбежно угрожающих жизни (особенно анафилаксии), и тех, которые, хотя и не возникают, требуют быстрого и решительного обследования.
Последняя группа включает молниеносную надпочечниковую недостаточность, агрессивные гематологические злокачественные новообразования и васкулиты (Churg-Strauss и гранулематоз с полиангиитом), которые могут иметь агрессивное течение, если не будут своевременно лечить.Комплексное начальное обследование, подобное описанному выше, поможет определить узких специалистов, которые будут наиболее полезны в выявлении и лечении этих состояний.
Патофизиология
Эозинофилы — терминально дифференцированные члены линии гранулоцитов. Они происходят от того же общего миелоидного предшественника, который дает начало другим гемопоэтическим клеткам, созревающим в костном мозге, включая эритроциты, тромбоциты, нейтрофилы и моноциты. У них есть более дифференцированный общий предок с базофилами.Гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), интерлейкин (IL) -3 и IL-5 важны для развития эозинофилов, причем IL-5 играет особенно важную роль в дифференцировке и активации. После дифференцировки эозинофилы мигрируют из костного мозга в периферические ткани, главным образом в кишечник, где они находятся до старения или активации; таким образом, присутствие эозинофилов в периферической крови редко при отсутствии стимулирующих факторов.
По большей части, эозинофилы неактивны синтетически и действуют, главным образом, посредством дегрануляции и высвобождения предварительно сохраненных медиаторов.Некоторые из них, такие как основной основной белок (MBP), катионный белок эозинофилов и нейротоксин, полученный из эозинофилов, являются непосредственно цитотоксичными для паразитов, в то время как другие (лейкотриены и простагландины) вызывают местные изменения, такие как расширение сосудов и повышенная проницаемость сосудов, которые помогают в развитие более стойкого иммунного ответа.
Наиболее распространенный и наиболее понятный механизм физиологической активации эозинофилов происходит через путь, опосредованный Т-хелпером (Th) 2, который важен как при аллергических, так и при атопических реакциях, а также в ответ на глистные инфекции.На этом пути антигенная стимуляция клеток Th3 приводит к продукции специфических циокинов и хемокинов, особенно IL-5. Эти продукты приводят к привлечению существующих эозинофилов к месту активации Th3 и заставляют их высвобождать свое клеточное содержимое, а также стимулируют выработку новых эозинофилов в костном мозге; тогда фактический процесс дегрануляции обычно стимулируется сшивкой поверхностных рецепторов иммуноглобулином. В то же время ответ Th3 также приводит к привлечению тучных клеток и продукции IgE.
И наоборот, некоторые причины как периферической, так и тканевой эозинофилии (в первую очередь, эзофагита и некоторых форм легочной эозинофилии) возникают без заметной продукции IgE или активации тучных клеток, что свидетельствует о существовании параллельных механизмов активации эозинофилов, независимо от пути Th3.
Патогенез гиперэозинофильных синдромов (ГЭК) и других клональных заболеваний эозинофилов отличается от этих физиологических механизмов. Наиболее изученный путь развивается в контексте наиболее распространенной генетической аномалии, лежащей в основе гиперэозинофильных синдромов, при которой интерстициальная делеция хромосомы 4q12 приводит к образованию продукта гена слияния FIP1L1-PDGFRα, конститутивно активированной тирозинкиназы, которая стимулирует выработку терминально дифференцированные эозинофилы.
Ответ этой подгруппы HES на ингибиторы тирозинкиназы, такие как иматиниб, подтверждает гипотезу о том, что эта мутация, вероятно, является причинной, хотя некоторые HES без мутации также реагируют на лекарство, что подразумевает участие других тирозинкиназ в патогенезе заболевания. У пациентов с HES, у которых отсутствуют делеции 4q12, наблюдался ряд других генетических аномалий, включая мутации в партнерах по связыванию PDGFRα и PDGFRβ, реаранжировки FGFR1 и ту же точечную мутацию V617F в JAK2, которая часто встречается в классическом bcr-abl- отрицательные миелопролиферативные нарушения.Патогенное значение многих из этих аномалий еще полностью не изучено.
Какие другие клинические проявления могут помочь мне диагностировать эозинофилию?
Это обсуждалось выше.
Какие еще дополнительные лабораторные исследования можно заказать?
Это обсуждалось выше.
Какие доказательства?
Cools, J, DeAngelo, DJ, Gotlib, J. «Тирозинкиназа, созданная слиянием генов PDGFRA и FIP1L1, в качестве терапевтической мишени иматиниба при идиопатическом гиперэозинофильном синдроме». N Engl J Med. об. 348. 2003. pp. 1201 [Основное описание транслокации FIP1L1 при гиперэозинофильном синдроме и его ответ на иматиниб.]
Golkar, L, Bernhard, JD. «Мастоцитоз». Ланцет. об. 349. 1997. pp. 1379 [Обзор мастоцитоза].
Готлиб, Дж., Коулс, Дж., Мэлоун, Дж. М.. «Гибридная тирозинкиназа FIP1L1-PDGFRalpha при гиперэозинофильном синдроме и хроническом эозинофильном лейкозе: значение для диагностики, классификации и лечения». Кровь. об. 103. 2004. pp. 2879 [Обзор, в котором открытие слитого гена PDGFRA-FIP1L1 рассматривается в контексте гиперэозинофильных синдромов.]
Каргили А., Бавбек Н., Кая А. «Эозинофилия при ревматологических заболеваниях; проспективное исследование 1000 случаев ». Rheumatol Int. об. 24. 2004. стр. 321 [Обзор эозинофилии при ревматологических заболеваниях]
Kaufman, LD, Krupp, LB. «Синдром эозинофилии-миалгии, синдром токсического масла и диффузный фасциит с эозинофилией». Curr Opin Rheumatol. об. 7. 1995. pp. 560 [Обзор необычных эозинофильных синдромов.]
Löffler, H, Gassmann, W, Haferlach, T. «AML M1 и M2 с эозинофилией и AML M4Eo: диагностические и клинические аспекты». Лимфома Leuk. об. 18 Suppl 1. 1995. pp. 61 [Обзор подтипов AML, которые могут быть связаны с эозинофилией, и важность эозинофилии как маркера подтипа M4 AML.]
Paganelli, R, Scala, E, Mazzone, AM. «Цитокины Th3-типа, гиперэозинофилия и интерлейкин-5 при ВИЧ-инфекции». Аллергия. об. 52. 1997. pp. 110 [Обсуждение иммунологических особенностей гиперэозинофилии при ВИЧ-инфекции.]
Simon, HU, Rothenberg, ME, Bochner, BS. «Уточнение определения гиперэозинофильного синдрома». J Allergy Clin Immunol. об. 126. 2010. С. 45 [Переоценка анализа гиперэозинофильного синдрома на фоне современного понимания клональности конкретных гиперэозинофильных синдромов.]
Веллер П.Ф. «Иммунобиология эозинофилов». N Engl J Med. [Обзор биологии эозинофилов.]
Веллер П.Ф., Бабли Ф.Дж. «Идиопатический гиперэозинофильный синдром». Кровь. об. 83. 1994. pp. 2759 [Описание гиперэозинофильного синдрома до открытия слияния FIP1L1-PDGFRA.]
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине». Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC.Лицензионный контент является собственностью DSM и защищен авторским правом.
Frontiers | Биология эозинофилов и их роль при астме
Введение
Три основных процесса, ответственных за клинические признаки астмы, хорошо известны: сужение бронхов, гиперсекреция слизи и воспаление дыхательных путей. Однако лежащая в основе патофизиология, ответственная за эти процессы, сложна и многогранна, включая множество типов клеток и цитокинов (1).Кроме того, активность и клиническое воздействие каждого клеточного и субклеточного компонента значительно различаются у разных людей и могут меняться со временем, а также в ответ на лекарственную терапию и влияние окружающей среды / образа жизни.
Среди этих бесчисленных клеточных взаимодействий и этой чрезвычайно разнородной группы пациентов можно идентифицировать определенные ключевые клетки, которые обычно участвуют, из которых, возможно, эозинофил является наиболее важным.
Предшественники эозинофилов образуются в костном мозге и после дифференцировки попадают в легкие (среди других участков) через кровоток (2).В то время как высокие концентрации циркулирующих эозинофилов часто измеряются у пациентов с астмой, большее клиническое значение имеет эозинофилия легочной ткани, которая также часто присутствует.
Фенотип «тяжелой эозинофильной астмы» относится к подгруппе астматических пациентов с признаками эозинофилии, которым часто требуются высокие поддерживающие дозы оральных кортикостероидов для поддержания разумного контроля над заболеванием. Общеизвестно, что неспецифические механизмы действия кортикостероидной терапии приводят к многочисленным хорошо задокументированным побочным эффектам (3), которые побудили десятилетия исследований, направленных на разработку целевых антиэозинофильных лекарственных препаратов.Чтобы понять, как лучше помочь этой группе пациентов, у которых в настоящее время есть неудовлетворенные клинические потребности, полезно понять сам эозинофил и роль, которую он играет при астме. Таргетированная антиэозинофильная терапия будет затронута, но будет рассмотрена более подробно в других обзорах в этой теме исследования.
Структура клетки эозинофилов
Эозинофилы — это гранулоциты, обычно диаметром 10–16 мкм. Они обладают сегментированными (обычно двудольными) ядрами, а их соотношение ядро: цитоплазма составляет примерно 30%.Эозинофилы окрашиваются ацидофильными красителями — особенность, отмеченная в 1879 году Полем Эрлихом, который первым описал эозинофилы и оценил их повышенное присутствие у пациентов с астмой и гельминтными инфекциями, среди других состояний (4). См. Рисунок 1 для обзора ультраструктуры эозинофилов.
Рисунок 1 . Ультраструктура эозинофилов. Схематическое изображение эозинофила, показывающее основные органеллы (черные метки) и рецепторы клеточной поверхности (синие метки). Аббревиатура: MHC-II, главный комплекс гистосовместимости-II.
Наличие крупных специфических гранул, также известных как вторичные гранулы, является характерной чертой, которая отличает эозинофилы от других гранулоцитов (нейтрофилов и базофилов). Специфические гранулы состоят из плотного кристаллического ядра и матрицы, окруженной мембраной (5). Они содержат большое количество медиаторов, способных вызывать воспаление и / или повреждение тканей, включая основные белки, цитокины, хемокины, факторы роста и ферменты. Преобладающими веществами являются белки: основной основной белок (MBP) расположен в ядре, а матрица содержит катионный белок эозинофилов (ECP), пероксидазу эозинофилов (EPO) и нейротоксин эозинофилового происхождения (EDN) (6).
Первичные гранулы имеют тенденцию быть меньше определенных гранул. Они являются основным местом расположения кристаллического белка Шарко-Лейдена (галактина-10): гексагональных бипирамидных кристаллов, которые проявляют активность лизофосфолипазы и были идентифицированы в тканях, подверженных эозинофильному воспалению (7).
Липидные тела особенно важны при рассмотрении роли эозинофилов при астме из-за их участия в производстве эйкозаноидов, включая цистеинальные лейкотриены, простагландины и тромбоксан (2).Липидные тельца являются ключевым местом этерификации арахидоновой кислоты и продукции эйкозаноидов из-за высоких концентраций соответствующих ферментов, таких как циклооксигеназы, 5-липоксигеназа и лейкотриен-C4-синтаза (5).
Тельца Гольджи, эндоплазматический ретикулум и митохондрии также присутствуют и выполняют фундаментальные функции по производству белка и аденозинтрифосфата внутри эозинофила.
Гистологический вид эозинофилов варьируется в зависимости от уровня активации.Например, большее количество везикул, таких как везикулы сомбреро эозинофилов, можно увидеть, когда клетка подвергается частичной дегрануляции (PMD), процесс, подробно описанный ниже.
Поверхностные молекулы и рецепторы эозинофилов
Различные роли эозинофилов отражены в его широком репертуаре поверхностных молекул и рецепторов, которые интегрируют эозинофилы как с врожденной, так и с адаптивной иммунной системами.
Рецепторы цитокинов и факторов роста
Гетеродимерный рецептор IL-5 считается наиболее важным рецептором цитокинов, экспрессируемым эозинофилами.Бета-субъединица идентична бета-субъединице рецепторов колониестимулирующего фактора гранулоцитов-макрофагов (GM-CSF) и IL-3 (оба из которых также присутствуют на мембранах эозинофильных клеток). Альфа-субъединица, IL-5Rα, специфична к IL-5 и была идентифицирована как терапевтическая мишень для тяжелой эозинофильной астмы и других состояний, опосредованных эозинофилами. Рецептор IL-5 также экспрессируется базофилами.
Эозинофилы также экспрессируют рецепторы для множества других цитокинов и факторов роста, включая IL-4, IL-13, IL-33, стромальный лимфопоэтин тимуса и трансформирующий фактор роста-β (TGF-β).
Рецепторы хемоаттрактантов
Хемокины — это небольшие цитокины, которые стимулируют миграцию определенных подгрупп лейкоцитов. Хемокины делятся на четыре группы, в зависимости от наличия или отсутствия одной или нескольких промежуточных аминокислот между двумя остатками цистеина (известных как CXC-, CX3C- и CC-хемокины) или наличия только одного остатка цистеина. (ХС-хемокины) (8).
CC-хемокиновый рецептор-3 (CCR3) — важный рецептор, связанный с G-белком, экспрессирующийся на мембранах эозинофильных клеток.CCR3 связывается со всеми тремя подтипами эотаксина (разновидность CC-хемокина, который функционирует как селективный хемоаттрактант эозинофилов). CCR3 также связывается с несколькими другими хемокинами, включая хемоаттрактантный белок-3 моноцитов (MCP-3) и MCP-4. Было показано, что дыхательные пути пациентов с астмой содержат большее количество клеток, экспрессирующих мРНК CCR3 и его лигандов, по сравнению с контрольными субъектами, не страдающими астмой (9). В моделях аллергического воспаления дыхательных путей на мышах антиген-индуцированная эозинофилия дыхательных путей может подавляться введением либо моноклонального антитела против CCR3 (10), либо низкомолекулярного антагониста CCR3 (11).
CCR1 — еще один ключевой рецептор хемокинов на эозинофилах, который активируется хемоаттрактантным цитокиновым лигандом-3 (CCL-3) и CCL-5 (также известный как RANTES — регулируется при активации, экспрессируются и секретируются нормальные Т-клетки).
Липидные медиаторные рецепторы
Эозинофилы обладают рецепторами на клеточной поверхности для липидных медиаторов, таких как лейкотриены, простагландины и фактор активации тромбоцитов, каждый из которых, как было показано, играет роль в патофизиологии астмы (12–14).
Рецепторы распознавания образов (PRR)
Рецепторы распознавания образов реагируют на молекулярные паттерны, ассоциированные с микробными патогенами (PAMP) или на молекулярные паттерны, связанные с повреждениями хозяина (DAMP), и регулируют иммунный ответ на эти индикаторы инфекции и / или повреждения тканей (15).
Toll-подобных рецепторов (TLR) представляют собой семейство PRR, которые экспрессируются эозинофилами, а также множеством других клеточных линий. У человека существует 10 типов TLR. TLR представляют собой трансмембранные гликопротеины, некоторые из которых расположены на поверхности клетки, а некоторые — в эндосомах. Цитоплазматический домен напоминает домен рецептора IL-1, и поэтому генерируемые внутриклеточные сигналы аналогичны (16).
Эозинофилы также экспрессируют несколько других семейств PRR, включая индуцируемые ретиноевой кислотой ген-I-подобные рецепторы, нуклеотид-связывающие домены олигомеризации (NOD-подобные) рецепторы и рецепторы конечных продуктов гликирования (RAGE) (15).
Fc рецепторы
рецепторов Fc к IgA, IgD, IgE, IgG и IgM экспрессируются на поверхности эозинофилов, облегчая взаимодействие с адаптивной иммунной системой.
Высокоаффинный рецептор FcεR1 связывает IgE и передает сигнал через внутриклеточных тирозинкиназ. На тучных клетках и базофилах, где FcεR1 экспрессируется в виде тетрамера (αβγ2), стимуляция IgE приводит к дегрануляции. Однако на эозинофилах FcεR1 обычно экспрессируется в очень малых количествах в виде тримеров (без β-цепи) и не играет роли в активации эозинофилов (17).Напротив, перекрестное связывание FcαRI и FcγRII с IgA и IgG, соответственно, запускает активацию эозинофилов (18).
Главный комплекс гистосовместимости-II (MHC-II)
Эозинофилы играют дополнительную роль в качестве антигенпрезентирующих клеток, чему способствует присутствие молекул MHC-II и костимулирующих молекул, таких как CD80 и CD86. У пациентов с аллергией, оцененных после провокации сегментарным антигеном, было обнаружено, что экспрессия HLA-DR (подтипа молекулы MHC-II) примерно в четыре раза выше в эозинофилах легких по сравнению с эозинофилами крови (19).
Рецепторы адгезии
Рецепторы адгезии, как следует из их названия, позволяют клеткам, таким как эозинофил, прилипать к внеклеточному матриксу (ЕСМ) и другим клеткам. Они также позволяют эозинофилу ощущать свое окружение и соответственно реагировать. Рецепторы адгезии делятся на четыре основные группы: интегрины, кадгерины, селектины и иммуноглобулиноподобные молекулы клеточной адгезии (Ig-CAM). Интегрины и селектины являются основными формами рецепторов адгезии, экспрессируемыми на мембранах эозинофильных клеток.
Эозинофилы экспрессируют семь типов интегринов, которые представляют собой трансмембранные гликопротеины, состоящие из α- и β-цепей (20). Примеры включают очень поздний антиген-4 (VLA-4, CD49d / CD29) и рецептор комплемента CR3 (CD11b / CD18), который иначе известен как антиген макрофага-1 (Mac-1).
Селектины представляют собой одноцепочечные трансмембранные гликопротеины с множеством доменов. Есть три семейства: E-, L- и P-селектин; последние два экспрессируются эозинофилами человека, тогда как Е-селектин присутствует на активированном эндотелии (21).
Сиглек-8
Siglec-8 представляет собой иммуноглобулиноподобный лектин сиаловой кислоты (белок, связывающий углеводы), экспрессируемый эозинофилами, тучными клетками и базофилами. Его физиологическая роль еще не идентифицирована, хотя считается, что он представляет собой потенциальную терапевтическую мишень для заболевания, опосредованного эозинофилами, из-за наблюдения, что введение антитела, нацеленного против Siglec-8, может индуцировать селективный апоптоз эозинофилов и ингибировать дегрануляцию тучных клеток ( 22).
Дифференциация, созревание, миграция, активация и дегрануляция эозинофилов
Эозинофилы развиваются из плюрипотентных клеток-предшественников гранулоцитов CD34 +.
Дифференциация и созревание происходит следующим образом:
Миелобласт → Промиелоцит → Миелоцит эозинофилов → Метамиелоцит эозинофилов → Эозинофил.Аллерген-провокация у легких астматиков приводит к повышенной экспрессии IL-5Rα на CD34 + клетках костного мозга, связанной с эозинофилией крови и мокроты (23). Дифференцировка эозинофилов обычно происходит в костном мозге. Однако предшественники эозинофилов были выделены из периферической крови субъектов с атопией в значительно более высоких концентрациях по сравнению с контрольной группой, не страдающей атопией (24).Повышенное количество предшественников эозинофилов CD34 + / IL-5Rα + также было обнаружено в биопсиях бронхов атопических астматиков по сравнению с неастматическими контрольными субъектами (как атопическими, так и неатопическими) (25). Коммитированные клетки эозинофильного клона также были идентифицированы в ткани легких на мышиной модели аллергического воспаления дыхательных путей (26). Совсем недавно было показано, что предшественники эозинофилов, выделенные из крови пациентов с тяжелой эозинофильной астмой, обладают усиленным клоногенным ответом на IL-5 in vitro по сравнению с предшественниками эозинофилов от легких астматиков, что позволяет предположить, что in situ эозинофилопоэз клинически значимая роль при тяжелой эозинофильной астме (27).
Дифференцировка эозинофилов регулируется факторами транскрипции GATA-связывающим белком 1 (GATA-1), PU.1 и семейством CCAAT-усиливающих связывающих белков (c / EBP). GATA-1 и PU.1 синергетически способствуют транскрипции MBP (28). Считается, что GATA-1 играет наиболее важную роль, поскольку нарушение гена GATA-1 у мышей приводит к появлению штамма, полностью лишенного эозинофилов (29).
Цитокины IL-3, IL-5 и GM-CSF также синергетически способствуют развитию зрелых эозинофилов (30).ИЛ-5 является наиболее эозинофил-специфичным, а также способствует высвобождению эозинофилов из костного мозга в кровоток, действуя синергетически с эотаксином (31, 32). Эозинофилы присутствуют в периферической крови в относительно небольшом количестве, обычно составляя не более 5% от общего количества лейкоцитов (33). У них относительно короткий период полураспада в крови — примерно 18 часов (34). Миграция в определенные участки тела, включая легкие и кишечник, опосредуется хемоаттрактантами эозинофилов, такими как эотаксины.Эотаксины представляют собой разновидность CC-хемокинов. Существует три известных подтипа: эотаксин-1 (CCL-11), эотаксин-2 (CCL-24) и эотаксин-3 (CCL-26). Они связываются с рецепторами CCR3 на клеточных мембранах эозинофилов и вызывают хемотаксис. 5-оксо 6, 8, 11, 14-эйкозатетраеновая кислота (5-оксо-ETE) — еще один хемоаттрактант эозинофилов.
In vitro было показано, что присутствие простагландина-D2 (PGD2) значительно усиливает хемоаттрактантные эффекты эотаксина-1 и 5-оксо-ETE на эозинофилы и, в отличие от эотаксина-1 или 5-оксо-ETE, — PGD2 сохраняет свой хемоаттрактантный эффект в присутствии крови или плазмы (35).Поэтому предполагается, что PGD2 действует как начальный хемоаттрактант, запускающий миграцию циркулирующих эозинофилов в определенные ткани, где преобладают эотаксины и 5-оксо-ETE. PGD2 высвобождается из активированных тучных клеток (36) и действует на через CRTh3 (молекула, гомологичная рецептору хемоаттрактанта, экспрессируемая на клетках T H 2).
При аллергическом воспалении и астме циркулирующие эозинофилы прикрепляются к эндотелию сосудов и катятся вдоль него, прежде чем экстравазироваться в ткань легких.Первоначальное связывание с эндотелием происходит в результате связывания рецептора адгезии эозинофильной клеточной мембраны P-селектина с лигандом-1 гликопротеина P-селектина на эндотелии (37). Связывание интегрина VLA-4 с молекулой-1 адгезии сосудистых клеток способствует активации эозинофилов и экстравазации (37). IL-13 приводит к повышенной экспрессии эозинофилами Р-селектина и усилению опосредованной Р-селектином адгезии к эндотелиальным клеткам (38).
Способность эозинофила хранить несколько предварительно сформированных цитотоксических медиаторов, готовых к быстрому высвобождению при соответствующей стимуляции, способствует гораздо более быстрой реакции на провоспалительные стимулы по сравнению с другими клетками, ответы которых зависят от активации транскрипции генов, кодирующих такие белки.
Бронхиальный эпителий вырабатывает цитокины ИЛ-25, ИЛ-33 и стромальный лимфопоэтин тимуса, известные под общим названием алармины, в ответ на раздражители, такие как аллергены, загрязнители и патогены. Эти цитокины запускают воспалительный каскад с участием, среди прочего, клеток T-helper-2 (T H 2) и врожденных лимфоидных клеток 2 типа (ILC2s), что приводит к увеличению продукции многих цитокинов, включая IL-4, IL-5, и IL-13, вызывая активацию эозинофилов (1, 39).
Высокоподвижный белок группы 1, действующий на через рецепторы TLR-2, TLR-4 и RAGE, также способствует эозинофилии, хотя о механизме его действия известно меньше (2).
Конкретное содержимое гранул может быть высвобождено посредством трех различных процессов дегрануляции. Обычный экзоцитоз влечет за собой слияние определенных гранул с клеточной мембраной эозинофилов, что приводит к высвобождению всего содержимого конкретной гранулы. Альтернативно, эозинофил можно лизировать (цитолиз), высвобождая все содержимое клетки, включая неповрежденные специфические гранулы.Эти внеклеточные гранулы могут быть обнаружены в тканях, пораженных эозинофильным заболеванием, и впоследствии могут высвобождать свое содержимое в ответ на провоспалительные стимулы (40). Однако наиболее распространенный механизм грануляции эозинофилов называется частичной дегрануляцией (PMD). В этом процессе везикулы (как круглые, так и трубчатые) высвобождаются из определенных гранул и перемещаются к клеточной мембране, чтобы вывести свое содержимое во внеклеточный домен (41). Трубчатые везикулы имеют тенденцию закручиваться в кольцевидную морфологию, что дает начало термину «везикулы сомбреро эозинофилов» (42).Везикулы с определенным содержимым могут выборочно высвобождаться в ответ на определенные цитокины, что позволяет эозинофилам поставлять определенную комбинацию цитотоксических медиаторов по мере необходимости (42, 43).
Было показано, что активация TLR на эозинофилах способствует адгезии и высвобождению определенных цитокинов и супероксидов (44). Активация TLR-2 и TLR-9 запускает дегрануляцию эозинофилов (44, 45). In vitro , было показано, что эозинофилы от субъектов с атопией продуцируют больше IL-8 и EDN в ответ на стимуляцию TLR-7 и TLR-9 по сравнению со здоровым контролем (45).
Выживанию эозинофилов способствуют IL-3, IL-5, GM-CSF и эотаксин (37). Активация TLR-7 (наиболее распространенный подтип TLR, экспрессируемый эозинофилами) также увеличивает выживаемость эозинофилов (45).
ИЛ-3, ИЛ-5 и GM-CSF
Среди цитокинов 2-го типа IL-3, IL-5 и GM-CSF особенно важны для инициации и сохранения эозинофильного воспаления дыхательных путей. Эти три цитокина тесно связаны, поскольку все гены всех трех расположены на хромосоме 5, а их рецепторы также имеют общую β-субъединицу (βc).
Моноклональные антитела против IL-5 были разработаны для лечения заболеваний, опосредованных эозинофилами, таких как эозинофильная астма. Хотя ингибирование активности IL-5 таким образом (с использованием меполизумаба) приводит к значительному истощению циркулирующих эозинофилов, влияние на эозинофилию бронхиальной ткани менее выражено, со средним снижением на 55% (46). Остаточная тканевая эозинофилия может отражать текущие эффекты, опосредованные IL-3 и GM-CSF.
В модели аллергического воспаления дыхательных путей у мышей эозинофилия легочной ткани, вызванная аллергеном, была устранена у мышей, выведенных с отсутствием общей β-субъединицы, следовательно, неспособными отвечать на IL-3, IL-5 и GM-CSF (47).В том же исследовании было обнаружено, что легочная ткань от βc-дефицитных мышей содержит меньше миелоидных дендритных клеток, а местные клетки T H 2 показали пониженную способность к пролиферации и продуцированию цитокинов типа 2 (47). Эти данные предполагают многофакторную роль общей β-субъединицы в регуляции аллергического воспаления дыхательных путей.
Роль эозинофилов в здоровье
По сравнению с той ролью, которую эозинофилы играют в заболеваниях и инфекциях, об их назначении для здоровья известно относительно мало.Однако в последние годы все большее количество гомеостатических механизмов приписывают эозинофилам или, по крайней мере, связывают с ними. Это вызвало призыв к фундаментальному изменению восприятия эозинофилов исключительно как цитотоксических эффекторных клеток (48, 49).
В здоровом состоянии эозинофилы обнаруживаются в тимусе, селезенке, лимфатических узлах и желудочно-кишечном тракте (50). Количество эозинофилов в тимусе уменьшается с возрастом (51). Эозинофилы могут играть роль в отборе Т-клеток. На мышиной модели острого отрицательного отбора, ограниченного MHC I, было продемонстрировано рекрутирование эозинофилов в кортикомедуллярную область тимуса и ассоциацию с апоптотическими тельцами (52).Эозинофилы также увеличивают способность макрофагов фагоцитировать апоптотические клетки тимуса (53).
Эозинофилы мигрируют в желудочно-кишечный тракт во время эмбрионального развития, то есть до развития какой-либо жизнеспособной кишечной флоры (54). В здоровом состоянии они присутствуют во всем желудочно-кишечном тракте, за заметным исключением пищевода. Эозинофилы способствуют иммунной защите от кишечных микроорганизмов благодаря множеству антимикробных свойств. (Антимикробные свойства эозинофилов подробно обсуждаются далее в отношении респираторных патогенов.Другие потенциальные гомеостатические роли эозинофилов в кишечнике в настоящее время четко не определены, но могут быть связаны с их способностью взаимодействовать с кишечной нейрональной системой и повышать реактивность гладких мышц ( через высвобождение MBP) (55).
В белой жировой ткани мышей была выявлена положительная корреляция между количеством эозинофилов и количеством макрофагов, экспрессирующих аргиназу-1 (56). Считается, что макрофаги, экспрессирующие аргиназу-1, способствуют гомеостазу глюкозы, хотя классификация макрофагов вызывает споры (57).В более позднем исследовании с участием более 9000 человек было обнаружено, что процент эозинофилов в периферической крови обратно пропорционален риску сахарного диабета 2 типа и инсулинорезистентности (58).
Эозинофилы также участвуют в регенерации ткани печени (59) и скелетных мышц (60). Повышенное присутствие эозинофилов в преовуляторных фолликулах яичников (61) и в эндометрии (62) вызвало предположения, что они могут играть роль в ремоделировании тканей, связанных с овуляцией и менструацией.
Эозинофилы также выполняют несколько важных иммуномодулирующих функций, обсуждаемых в следующем разделе.
Роль эозинофилов в патофизиологии астмы
Патофизиология астмы сложна, и относительный вклад различных цитокиновых сетей различается для разных пациентов. Основные характеристики включают гиперреактивность дыхательных путей (AHR), гиперсекрецию слизи, повреждение тканей и ремоделирование дыхательных путей. См. Рис. 2 для обзора роли эозинофилов в патофизиологии астмы.
Рисунок 2 . Роль эозинофилов при астме. Обзор основных стимулов эозинофильного воспаления дыхательных путей (серые прямоугольники) и способов, с помощью которых эозинофилы вызывают основные патофизиологические изменения, связанные с астмой (зеленые прямоугольники). Сокращения: MBP, основной основной белок; EPO, пероксидаза эозинофилов; ИЛ, интерлейкин; TGF-β, трансформирующий фактор роста-β; GM-CSF, гранулоцитарно-макрофагальный колониестимулирующий фактор; PGD2, простагландин-D2; 5-оксо-ETE, 5-оксо 6, 8, 11, 14-эйкозатетраеновая кислота; PAMP, молекулярные структуры, связанные с патогенами; DAMPs, молекулярные структуры, связанные с повреждением; Ig, иммуноглобулин.
Давно наблюдалось, что количество эозинофилов в периферической крови и жидкости бронхоальвеолярного лаважа (БАЛ) выше у астматиков по сравнению со здоровым контролем (63). Анализ жидкости БАЛ, полученной от пациентов с атопической астмой, выявляет повышенную экспрессию цитокинов T H 2 (64), включая IL-5, которые сильно связаны с эозинофильным воспалением (65). В целом степень эозинофилии коррелирует с тяжестью заболевания и частотой обострений (63, 66).Однако также распознаются фенотипы неэозинофильной астмы (67). Эозинофилия периферической крови может также возникать при многих других состояниях (см. Вставку 1).
Ящик 1 . Альтернативные (т.е. не астматические) причины периферической эозинофилии (68, 69).
Респираторный
Эозинофильный гранулематоз с полиангиитом (ЭГПА)
Аллергический бронхолегочный аспергиллез
Саркоидоз
Гематологические и неопластические
Миелопролиферативный гиперэозинофильный синдром
Лимфоцитарный гиперэозинофильный синдром
Некоторые лейкемии и лимфомы
Системный мастоцитоз
Солидные опухоли — аденокарциномы, плоскоклеточные карциномы, крупноклеточные карциномы легких, переходно-клеточные карциномы мочевого пузыря
Инфекционный
Паразитарная инфекция, в частности гельминты
Вирус иммунодефицита человека
Дерматологический
Экзема
Заражение чесоткой
Ятрогенный
Некоторые реакции гиперчувствительности к лекарствам
Болезнь трансплантата против хозяина
AHR и гиперсекреция слизи
Эозинофилам может быть предложено высвободить ряд различных медиаторов, способных вызывать AHR.Известно, что человеческий MBP вызывает AHR при введении приматам (70) и крысам (71). В первом исследовании введение ЭПО также вызывало AHR, в отличие от ECP и EDN (70). Данные последнего исследования предполагают, что механизм действия включает стимуляцию выработки брадикинина (71). MBP также может запускать тучные клетки и базофилы для высвобождения гистамина, мощного медиатора гиперреактивности бронхов (72, 73).
Эозинофилы являются источником нескольких цитокинов, включая IL-13, который вызывает AHR, а также способствует гиперсекреции слизи через усиленную дифференцировку бокаловидных клеток (74).IL-13 также продуцируется клетками T H 2 и ILC2. Липидные медиаторы, такие как лейкотриены, которые продуцируются липидными телами эозинофилов (и тучными клетками), также вызывают AHR и гиперсекрецию слизи (75).
Исследования с участием двух разных штаммов мышей с дефицитом эозинофилов попытались выяснить роль эозинофилов в модели овальбумина астмы, но дали, казалось бы, противоречивые результаты. В одном исследовании, проведенном Lee et al., Мыши с дефицитом эозинофилов были защищены от AHR и гиперсекреции слизи (76).Однако другое исследование, проведенное Хамблзом, показало, что дефицит эозинофилов в этом отношении не защищает (77). Было выдвинуто несколько теорий для объяснения противоречивых результатов, включая доказательства остаточных эозинофилов в легких в исследовании Хамблса и различия между основными линиями мышей (78).
С точки зрения практического применения, наличие у людей эозинофильного бронхита, состояния, характеризующегося выраженной эозинофилией дыхательных путей в отсутствие AHR, ставит под сомнение концепцию, согласно которой эозинофилы, действуя в одиночку, оказывают клинически значимое влияние на AHR.Было показано, что у пациентов с легкой степенью астмы введение моноклональных антител к IL-5 снижает эозинофилию крови и мокроты, но не влияет на AHR (79). Это может отражать клеточную избыточность патофизиологии AHR, которая включает несколько типов клеток, включая клетки T H 2, ILC2 и тучные клетки. Кроме того, текущие данные, относящиеся к AHR, специально не изучают патофизиологию обострений астмы, во время которых дегрануляция эозинофилов может способствовать ухудшению AHR.
Повреждение тканей и ремоделирование дыхательных путей
Постулат о том, что эозинофилы являются основными эффекторами повреждения легочной ткани при астме, хорошо обоснован, учитывая их склонность к высвобождению высокозаряженных основных белков, которые обладают множественными цитотоксическими эффектами. MBP токсичен для респираторных эпителиальных клеток in vitro и был идентифицирован в посмертных образцах ткани легких пациентов, умерших от астмы, в связи с повреждением эпителия (80). ECP и EDN имеют 67% гомологии аминокислотных последовательностей и, как правило, группируются вместе как связанные с эозинофилами РНКазы, хотя активность РНКаз ECP гораздо менее сильна (81).ECP связывается с клеточными мембранами и изменяет их проницаемость (82). EDN, как следует из названия, нейротоксичен. Впервые он был идентифицирован после наблюдения, что у кроликов внутримозговое введение эозинофилов приводило к разрушению мозжечковых клеток Пуркинье и неврологических признаков, названных «феноменом Гордона» (83, 84). ЭПО катализирует окисление галогенидов и тиоцианата, в результате чего образуются цитотоксические реактивные окислители (85).
Повреждение клеток запускает активацию путей восстановления, которые, если они чрезмерны, могут способствовать структурным изменениям, называемым ремоделированием дыхательных путей.Основные патологические процессы включают гиперплазию фибробластов, гладких мышц дыхательных путей (ASM) и бокаловидных клеток, отложение белков ECM и ангиогенез (86). Ремоделирование дыхательных путей связано с тяжестью астмы (87). Была выдвинута гипотеза, что ремоделирование дыхательных путей отвечает за ускоренное снижение функции легких и развитие фиксированной обструкции дыхательных путей, наблюдаемой у некоторых пациентов с астмой. Однако биопсия бронхов у детей с тяжелой астмой показала утолщение ретикулярной базальной мембраны в такой же степени, как и у взрослых астматиков (88).Кроме того, есть данные о том, что некоторые патологические особенности ремоделирования дыхательных путей могут проявиться в течение 24 часов после воздействия аллергена (89).
Эозинофилы выделяют множество факторов роста и фиброгенных медиаторов, которые способствуют ремоделированию дыхательных путей (см. Таблицу 1). Например, известно, что эозинофилы продуцируют TGF-β при болезненных состояниях, затрагивающих кожу (атопия) (90), нос (полипоз носа) (91) и кровь (идиопатический гиперэозинофильный синдром) (92). Эозинофилы являются основным источником TGF-β в биоптатах бронхов, взятых у пациентов с астмой (93), а также могут стимулировать эпителиальные клетки к выработке ряда медиаторов, включая TGF-β (94).TGF-β участвует в ремоделировании ткани посредством пролиферации фибробластов и увеличения выработки коллагена и гликозаминогликанов (95–97).
Таблица 1 . Факторы, продуцируемые эозинофилами, которые связаны с ремоделированием дыхательных путей.
Эозинофилы, выделенные от астматиков, при совместном культивировании с клетками ASM, способствуют усиленной пролиферации ASM, которая ингибируется добавлением антагониста лейкотриена монтелукаста (117). Похоже, что эозинофилы и ASM находятся во взаимной взаимосвязи, так как также известно, что клетки ASM продуцируют проэозинофильные цитокины (118).Исследования на мышах дополнительно подтверждают утверждение, что эозинофилы играют важную роль в ремоделировании дыхательных путей, поскольку мыши с дефицитом эозинофилов защищены от отложения в дыхательных путях коллагена и гладких мышц (77).
Было показано, что лечение меполизумабом моноклональным антителом против ИЛ-5 снижает эозинофилию бронхиальной ткани в сочетании со снижением TGF-β1 в образцах БАЛ и снижением проколлагена III, тенасцина и люмикана ретикулярной базальной мембраны (119).
Обострения астмы
Эозинофилия дыхательных путей — ранний признак обострений астмы.В исследовании стероидозависимых пациентов с астмой, у которых доза преднизолона постепенно снижалась до уровня ниже их поддерживающей потребности, количество эозинофилов в мокроте начало расти за 4 недели до количества эозинофилов в крови и за 6 недель до спирометрического и симптоматического ухудшения (120). Фактически, было установлено, что принятие стратегии лечения астмы, основанной на эозинофилии мокроты, а не на традиционных маркерах активности заболевания (таких как симптомы и спирометрия), снижает частоту обострений без общего увеличения средней суточной дозы кортикостероидов (121). .
Основным действием терапии против IL-5, по-видимому, является снижение частоты обострений. Назначение меполизумаба отдельным группам пациентов снизило частоту обострений примерно на 50% (122–124). Аналогичное снижение частоты обострений наблюдалось при применении реслизумаба, другого моноклонального антитела против ИЛ-5 (125). В клинических испытаниях III фазы было обнаружено, что меполизумаб оказывает умеренное сберегающее глюкокортикоиды эффект (126).
Бенрализумаб представляет собой моноклональное антитело, направленное против альфа-субъединицы рецептора IL-5 (IL-5Rα).Бенрализумаб не только блокирует взаимодействие между IL-5 и его рецептором, но и вызывает гибель эозинофильных клеток за счет антителозависимой клеточно-опосредованной цитотоксичности (127), что приводит к значительному (95%) истощению эозинофилов в дыхательных путях (128). Клинические испытания фазы III продемонстрировали снижение частоты обострений (129, 130).
Иммуномодуляция
Помимо прямого воздействия эозинофилов на патофизиологию астмы, они играют важную роль в иммуномодуляции (2).MBP, высвобождаемый из гранул, специфичных для эозинофилов, стимулирует воспалительные реакции нейтрофилов (повышенное производство супероксида и IL-8) (131) и тучных клеток (повышенное высвобождение гистамина) (72). Фактор роста нервов (также высвобождаемый из определенных гранул) также продлевает выживаемость нейтрофилов (132) и тучных клеток (133). EDN способствует активации дендритных клеток (134), которые, в свою очередь, запускают пролиферацию Т-клеток (как хелперных, так и цитотоксических) и В-клеток посредством презентации антигена .Сами эозинофилы также могут представлять антигены Т-клеткам (135, 136).
Цитокины, высвобождаемые из гранул, специфичных для эозинофилов, обладают различными иммуномодулирующими эффектами. Например, IL-4 и IL-13 моделируют пролиферацию B-клеток и продукцию IgE (137, 138), а IL-6 увеличивает выживаемость плазматических клеток (139, 140). Специфические для эозинофилов гранулы также способны выделять несколько хемокинов. . В зависимости от получаемой стимуляции, они включают CCL-17 и CCL-22, которые привлекают клетки T H 2, и CXCL-9 и CXCL-10, которые являются хемокинами T H 1 (141).Кроме того, эозинофилы экспрессируют индоламин-2,3-диоксигеназу (IDO), фермент, который катализирует выработку кинуренина, подавляя активность T H 1 и способствуя воспалительной среде 2 типа (142, 143).
См. Рисунок 3 для обзора иммуномодулирующей роли эозинофилов при астме.
Рисунок 3 . Иммуномодулирующая роль эозинофилов при астме. Эозинофилы могут влиять на другие лейкоциты как напрямую (например, на активацию В-клеток, индуцированную ИЛ-6), так и косвенно (например,g. путем усиления презентации антигена дендритными клетками). Сокращения: TGF-β, трансформирующий фактор роста-β; IgE, иммуноглобулин E; ИЛ, интерлейкин; MBP, основной основной белок; EPO, пероксидаза эозинофилов; NGF, фактор роста нервов; T H 1, Т-хелперная клетка 1 типа; T H 2, T-хелперная клетка 2 типа.
Взаимодействие между эозинофилами и респираторными патогенами
Эозинофилы традиционно считались эффекторными клетками конечной стадии, непосредственно реагирующими на инфекции, т.е.е. путем высвобождения веществ, токсичных для патогенов (в частности, гельминтов), что приводит к нежелательному вторичному эффекту повреждения тканей человека. Однако исследования, проведенные за последние 30 лет, выявили дополнительные роли, выполняемые эозинофилом, включая связи как с врожденной, так и с адаптивной иммунной системами. Эти роли включают презентацию антигена и взаимодействие с другими частями иммунной системы, такими как путь комплемента (144).
Рецепторы распознавания образов на клеточных мембранах эозинофилов позволяют им обнаруживать присутствие PAMP, таких как липополисахарид (LPS) и бета-глюканы, компоненты клеточной стенки бактерий и грибов, соответственно (144).Цистеиновые и сериновые протеазы, продуцируемые клещами и грибами, активируют эозинофилы через рецепторы, активируемые протеазой (5). TLR-7, наиболее распространенный TLR, экспрессируемый эозинофилами, активируется вирусной одноцепочечной РНК (2).
Содержимое гранул, специфичных для эозинофилов, непосредственно цитотоксично для патогенов. MBP вызывает разрушение клеточных мембран из-за своей очень основной природы (145). ECP обладает противовирусной активностью (146), а также может агглютинировать грамотрицательные бактерии, связываясь с LPS и пептидогликанами (147).EDN слабо токсичен для гельминтов по сравнению с MBP и ECP (148). Однако EDN значительно снижает инфекционность респираторно-синцитиального вируса группы B, что указывает на его роль в иммунном ответе на вирусы (149). ЭПО способствует образованию токсичных активных форм кислорода (150).
Было показано, что помимо высвобождения цитотоксических белков, эозинофилы фагоцитируют бактерии (хотя и менее эффективно, чем нейтрофилы) (151). Совсем недавно наблюдалась «катапультовидная» экструзия «ловушек», состоящих из митохондриальной ДНК и содержимого гранул эозинофилов, в ответ на грамотрицательные бактерии (152).
Эозинофилы экспрессируют рецепторы для различных белков комплемента, включая C3a и C5a, которые, как известно, способствуют привлечению, экстравазации и активации эозинофилов (153, 154). Считается, что комплемент способствует прикреплению эозинофилов к личинкам нематод и повреждению ими (155), хотя развитие вторичного иммунитета не затрагивается у мышей с дефицитом комплемента (156).
Поскольку известно, что грибы вызывают продукцию ассоциированных с T H 2 цитокинов (т.е. цитокинов 2-го типа) и эозинофилию, была выдвинута гипотеза, что субклиническая грибковая инфекция / колонизация дыхательных путей может играть роль в генезе заболевания, характеризующиеся эозинофилией.Такие заболевания включают тяжелую эозинофильную астму, а также связанные с ней состояния (например, хронический риносинусит). Одно исследование пациентов, перенесших операцию на носовых пазухах, показало, что 74% пациентов с состояниями, связанными с T H 2, имели признаки микоза поверхности дыхательных путей, по сравнению с только 16% в контрольной группе (157). Тем не менее, необходимо учитывать потенциальные мешающие факторы, такие как использование ингаляционных и / или системных кортикостероидов.
Повышенная восприимчивость к респираторным вирусным инфекциям, наблюдаемая у пациентов с астмой, связана со снижением выработки интерферонов типа I и типа III (158, 159).Эозинофилы могут способствовать этому нарушению, продуцируя TGF-β, который, как было показано, снижает способность эпителиальных клеток бронхов продуцировать интерфероны в ответ на человеческий риновирус in vitro (160).
Известно, что легкие содержат сообщества бактерий, известных как микробиом легких, во время здоровья, которые нарушаются при болезненных состояниях, включая астму (161, 162). Недавно были опубликованы данные, свидетельствующие о возможной связи между уровнем эозинофилии и структурой микробиомного сообщества при астме (163).Требуются дальнейшие специализированные исследования, изучающие предметные группы, соответствующие исходным характеристикам.
Заключение
Хотя эозинофилы были связаны с астмой с момента их первоначального открытия, наше понимание их роли в здоровье и болезнях со временем значительно изменилось. Статус эозинофила как цитотоксической эффекторной клетки, по-видимому, оправдан из-за его способности выделять мощные деструктивные основные белки, способные оказывать противомикробное действие, а также повреждать ткани хозяина.Однако его способность модулировать врожденную и адаптивную иммунные системы может быть не менее важной.
Изучение многочисленных рецепторов, экспрессируемых эозинофилами, дает некоторое представление о множестве различных взаимодействий, на которые способна эта разносторонняя клетка. Эозинофил не только рекрутируется в легкие в контексте провоспалительных цитокинов 2-го типа, но он также является промотором воспалительной среды 2-го типа, принимая на себя такие роли, как презентация антигена и цитокин-опосредованная модуляция местных лимфоцитов.
Имеются убедительные доказательства того, что эозинофилы способствуют ремоделированию дыхательных путей при астме. Существуют также механизмы, с помощью которых эозинофилы могут способствовать AHR и гиперсекреции слизи.
Разработка новых антиэозинофильных препаратов, способных селективно истощать эозинофилы, предлагает большой потенциал для изучения дополнительных вопросов, касающихся роли эозинофилов в астме и последствий их искоренения. Исследования вариаций в экспрессии генов, связанных с эозинофилами, у разных людей могут дать дополнительную информацию об относительном вкладе эозинофилов в различные фенотипы астмы и о потенциальном применении персонализированной медицины в этой области.
Авторские взносы
CM выполнил первоначальный обзор литературы и подготовил статью. AM-G предоставил критический обзор и дополнительный контент.
Заявление о конфликте интересов
CM принял участие в международной конференции Boehringer Ingelheim. AMG посещала консультационные советы Glaxo SmithKline, Novartis, Astra Zeneca, Boehringer Ingelheim и Teva. Он получал гонорары от компаний Novartis, Astra Zeneca, Vectura, Boehringer Ingelheim и Teva.Он участвовал в исследованиях, за которые его учреждение было награждено Hoffman La Roche, Glaxo SmithKline и Boehringer Ingelheim. Он участвовал в международных конференциях с Napp и Astra Zeneca, а также заключил договоры на оказание консультационных услуг с Astra Zeneca и Vectura.
Финансирование
CM — научный сотрудник, занимающийся клиническими исследованиями, должность которого финансируется благотворительным фондом Asmarley Charitable Trust через Имперский колледж Лондона . AM-G — врач-респиратор-консультант, работает в Royal Brompton and Harefield NHS Foundation Trust.
Список литературы
4. Gleich GJ. Глава 1 — Исторический обзор и перспектива роли эозинофилов в здоровье и болезнях A2 — Ли, Джеймс Дж. В: Розенберг Х. Ф., редактор. Эозинофилы в здоровье и болезнях . Бостон: Academic Press (2013). п. 1–11.
Google Scholar
6. Гембиц М.А., Линдси М.А. Фармакология эозинофила. Pharmacol Rev (1999) 51 (2): 213–340.
Google Scholar
7. Дворак А.М., Летурно Л., Логин Г.Р., Веллер П.Ф., Акерман С.Дж.Ультраструктурная локализация кристаллического белка Шарко-Лейдена (лизофосфолипаза) в отдельной популяции бескристаллоидных гранул в зрелых эозинофилах человека. Кровь (1988) 72 (1): 150–8.
PubMed Аннотация | Google Scholar
9. Инь С., Мэн К., Зейбекоглу К., Робинсон Д.С., Макфарлейн А., Хумберт М. и др. Хемотаксические хемокины эозинофилов (эотаксин, эотаксин-2, RANTES, моноцитарный хемоаттрактантный белок-3 (MCP-3) и MCP-4) и экспрессия хемокинового рецептора 3 C-C в биоптатах бронхов у атопических и неатопических (внутренних) астматиков. J Immunol (1999) 163 (11): 6321–9.
PubMed Аннотация | Google Scholar
10. Джастис Дж. П., Борчерс М. Т., Кросби Дж. Р., Хайнс Е. М., Шен Х. Х., Очкур С. И. и др. Удаление эозинофилов приводит к уменьшению аллерген-индуцированной легочной патологии. Am J Physiol Lung Cell Mol Physiol (2003) 284 (1): L169–78. DOI: 10.1152 / ajplung.00260.2002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Комай М., Танака Х., Нагао К., Ишизаки М., Кадзивара Д., Миура Т. и др.Новый антагонист CC-хемокинового рецептора 3, Ki19003, ингибирует эозинофилию дыхательных путей и субэпителиальный / перибронхиальный фиброз, вызванный повторным введением антигена у мышей. J Pharmacol Sci (2010) 112 (2): 203–13. DOI: 10.1254 / jphs.09277FP
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Такеучи О., Акира С. Рецепторы распознавания образов и воспаление. Ячейка (2010) 140 (6): 805–20. DOI: 10.1016 / j.cell.2010.01.022
CrossRef Полный текст | Google Scholar
16.Dembic Z. Функция Toll-подобных рецепторов, в базе данных Madame Curie Bioscience [Интернет] . Остин, Техас: Landes Bioscience (2000–2013).
Google Scholar
18. Muraki M, Gleich GJ, Kita H. Антиген-специфические IgG и IgA, но не IgE, активируют эффекторные функции эозинофилов в присутствии антигена. Int Arch Allergy Immunol (2011) 154 (2): 119–27. DOI: 10.1159 / 000320226
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19.Sedgwick JB, Calhoun WJ, Vrtis RF, Bates ME, McAllister PK, Busse WW. Сравнение функции эозинофилов дыхательных путей и крови после провокации антигеном in vivo. J Immunol (1992) 149 (11): 3710–8.
PubMed Аннотация | Google Scholar
20. Йоханссон М.В., Келли Э.А., Бусс В.В., Джарджур Н.Н., Мошер Д.Ф. Повышение регуляции и активация интегринов эозинофилов в крови и дыхательных путях после заражения сегментарным антигеном легких. J Immunol (2008) 180 (11): 7622–35. DOI: 10.4049 / jimmunol.180.11.7622
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Михаил С., Мезофф Э., Абернати Ф. Роль селектинов в кишечной эпителиальной миграции эозинофилов. Pediatr Res (2005) 58 (4): 644–7. DOI: 10.1203 / 01.PDR.0000180572.65751.F4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Кивамото Т., Кавасаки Н., Полсон Дж. К., Бохнер Б.С. Сиглек-8 как лекарственная мишень для лечения состояний, связанных с эозинофилами и тучными клетками. Pharmacol Ther (2012) 135 (3): 327–36. DOI: 10.1016 / j.pharmthera.2012.06.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Сехми Р., Вуд Л.Дж., Уотсон Р., Фоли Р., Хамид К., О’Бирн П.М. и др. Индуцированное аллергеном увеличение экспрессии альфа-субъединицы рецептора IL-5 на CD34 + клетках костного мозга субъектов, страдающих астмой. Новый маркер приверженности клеток-предшественников эозинофильной дифференцировке. J Clin Invest (1997) 100 (10): 2466–75.DOI: 10.1172 / JCI119789
CrossRef Полный текст | Google Scholar
24. Сехми Р., Хауи К., Сазерленд Д. Р., Шрагге В., О’Бирн П.М., Денбург Дж. А. Повышенные уровни CD34 + гемопоэтических клеток-предшественников у субъектов с атопией. Am J Respir Cell Mol Biol (1996) 15 (5): 645–55. DOI: 10.1165 / ajrcmb.15.5.8918371
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Робинсон Д.С., Дамиа Р., Зейбекоглу К., Молет С., Норт Дж., Ямада Т. и др. CD34 (+) / интерлейкин-5Ralpha матричная РНК + клетки слизистой оболочки бронхов при астме: потенциальные предшественники эозинофилов в дыхательных путях. Am J Respir Cell Mol Biol (1999) 20 (1): 9–13. DOI: 10.1165 / ajrcmb.20.1.3449
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Southam DS, Widmer N, Ellis R, Hirota JA, Inman MD, Sehmi R. Повышенное количество предшественников, коммитированных по линии эозинофилов, в легких мышей, зараженных аллергеном. J Allergy Clin Immunol (2005) 115 (1): 95–102. DOI: 10.1016 / j.jaci.2004.09.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27.Сехми Р., Смит С.Г., Кьярсгаард М., Рэдфорд К., Буле Л.П., Лемьер С. и др. Роль локальных эозинофилопоэтических процессов в развитии эозинофилии дыхательных путей при тяжелой преднизон-зависимой астме. Clin Exp Allergy (2016) 46 (6): 793–802. DOI: 10.1111 / cea.12695
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Du J, Stankiewicz MJ, Liu Y, Xi Q, Schmitz JE, Lekstrom-Himes JA, et al. Новые комбинаторные взаимодействия изоформ GATA-1, PU.1 и C / EBPepsilon регулируют транскрипцию гена, кодирующего главный основной белок эозинофильных гранул. J Biol Chem (2002) 277 (45): 43481–94. DOI: 10.1074 / jbc.M204777200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Yu C, Cantor AB, Yang H, Browne C, Wells RA, Fujiwara Y, et al. Нацеленная делеция высокоаффинного сайта связывания GATA в промоторе GATA-1 приводит к селективной потере линии эозинофилов in vivo. J Exp Med (2002) 195 (11): 1387–95. DOI: 10.1084 / jem.20020656
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31.Faccioli LH, Mokwa VF, Silva CL, Rocha GM, Araujo JI, Nahori MA и др. IL-5 направляет эозинофилы из костного мозга в кровь и ткани в модели синдрома висцеральной мигрирующей личинки на морских свинках. Медиаторы воспаления (1996) 5 (1): 24–31. DOI: 10.1155 / S096293519600004X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Палфраман Р. Т., Коллинз П. Д., Уильямс Т. Дж., Ранкин С. М.. Эотаксин вызывает быстрое высвобождение эозинофилов и их предшественников из костного мозга. Кровь (1998) 91 (7): 2240–8.
PubMed Аннотация | Google Scholar
34. Steinbach KH, Schick P, Trepel F, Raffler H, Döhrmann J, Heilgeist G, et al. Оценка кинетических параметров нейтрофильных, эозинофильных и базофильных гранулоцитов в крови человека. Blut (1979) 39 (1): 27–38. DOI: 10.1007 / BF01008072
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Шратл П., Штурм Е.М., Ройер Дж. Ф., Штурм Дж. Дж., Липпе И. Т., Пескар Б. А. и др.Иерархия хемоаттрактантов эозинофилов: роль митоген-активируемой протеинкиназы p38. Eur J Immunol (2006) 36 (9): 2401–9. DOI: 10.1002 / eji.200535672
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Льюис Р.А., Сотер Н.А., Даймонд П.Т., Остин К.Ф., Оутс Дж. А., Робертс Л.Дж. II. Образование простагландина D2 после активации тучных клеток крысы и человека анти-IgE. J. Immunol. (1982) 129 (4): 1627–31.
PubMed Аннотация | Google Scholar
38.Вольтманн Дж., Макналти, Калифорния, Дьюсон Дж., Саймон Ф.А., Уордлоу А.Дж. Интерлейкин-13 индуцирует PSGL-1 / P-селектин-зависимую адгезию эозинофилов, но не нейтрофилов, к эндотелиальным клеткам пупочной вены человека под действием потока. Кровь (2000) 95 (10): 3146–52.
PubMed Аннотация | Google Scholar
39. Фэллон П.Г., Баллантайн С.Дж., Манган Н.Е., Барлоу Дж.Л., Дасварма А., Хьюетт Д.Р. и др. Идентификация интерлейкин (ИЛ) -25-зависимой популяции клеток, которая обеспечивает ИЛ-4, ИЛ-5 и ИЛ-13 в начале изгнания гельминтов. J Exp Med (2006) 203 (4): 1105–16. DOI: 10.1084 / jem.20051615
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Невес Дж. С., Перес С. А., Спенсер Л. А., Мело Р. К., Рейнольдс Л., Гиран И. и др. Гранулы эозинофилов действуют внеклеточно как секреторные органеллы, опосредованные рецепторами. Proc Natl Acad Sci U S A (2008) 105 (47): 18478–83. DOI: 10.1073 / pnas.0804547105
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Мунис В.С., Веллер П.Ф., Невес Дж.С.Гранулы кристаллоидов эозинофилов: структура, функции и другие аспекты. J Leukoc Biol (2012) 92 (2): 281–8. DOI: 10.1189 / jlb.0212067
CrossRef Полный текст | Google Scholar
42. Мело Р.С., Спенсер Л.А., Перес С.А., Гиран И., Дворак А.М., Веллер П.Ф. Человеческие эозинофилы секретируют предварительно сформированный интерлейкин-4, хранящийся в гранулах, через отдельные везикулярные компартменты. Трафик (2005) 6 (11): 1047–57. DOI: 10.1111 / j.1600-0854.2005.00344.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43.Лейси П., Махмуди-Азер С., Баблитц Б., Хаген С.К., Веласкес Дж. Р., Ман С.Ф. и др. Быстрая мобилизация внутриклеточных RANTES в ответ на гамма-интерферон в человеческих эозинофилах. Кровь (1999) 94 (1): 23–32.
PubMed Аннотация | Google Scholar
44. Вонг С.К., Чунг П.Ф., ИП В.К., Лам С.В. Внутриклеточные сигнальные механизмы, регулирующие активацию эозинофилов, опосредованную толл-подобными рецепторами. Am J Respir Cell Mol Biol (2007) 37 (1): 85–96. DOI: 10.1165 / rcmb.2006-0457OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45.Манссон А, Карделл ЛО. Роль атопического статуса в активации 7- и TLR9-опосредованных толл-подобных рецепторов (TLR) эозинофилов человека. J Leukoc Biol (2009) 85 (4): 719–27. DOI: 10.1189 / jlb.0808494
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Флад-Пейдж PT, Мензис-Гоу А.Н., Кей А.Б., Робинсон Д.С. Роль эозинофилов остается неопределенной, поскольку анти-интерлейкин-5 лишь частично истощает их количество в дыхательных путях при астме. Am J Respir Crit Care Med (2003) 167 (2): 199–204.DOI: 10.1164 / rccm.200208-789OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Асквит К.Л., Рамшоу Х.С., Хансбро П.М., Бигли К.В., Лопес А.Ф., Фостер П.С. Общий рецептор IL-3 / IL-5 / GM-CSF играет ключевую роль в регуляции Th3-иммунитета и аллергического воспаления дыхательных путей. J Immunol (2008) 180 (2): 1199–206. DOI: 10.4049 / jimmunol.180.2.1199
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Ли Дж. Дж., Якобсен Э. А., МакГарри М. П., Шлеймер Р. П., Ли Н. А..Эозинофилы в здоровье и болезни: гипотеза LIAR. Clin Exp Allergy (2010) 40 (4): 563–75. DOI: 10.1111 / j.1365-2222.2010.03484.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Като М., Кефхарт Г.М., Талли Н.Дж., Вагнер Дж. М., Сарр М. Г., Бонно М. и др. Инфильтрация и дегрануляция эозинофилов в нормальной ткани человека. Anat Rec (1998) 252 (3): 418–25. DOI: 10.1002 / (SICI) 1097-0185 (199811) 252: 3 <418 :: AID-AR10> 3.0.CO; 2-1
CrossRef Полный текст | Google Scholar
51.Тулич МК, Слай П.Д., Эндрюс Д., Крук М., Давойн Ф., Одемуива С.О. и др. Тимические индоламин-2,3-диоксигеназа-положительные эозинофилы у детей раннего возраста: потенциальная роль в созревании наивной иммунной системы. Am J Pathol (2009) 175 (5): 2043–52. DOI: 10.2353 / ajpath.2009.0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Тросби М., Гербелин А., Плеу Дж. М., Дарден М. Эозинофилы CD11c + в тимусе мыши: регуляция развития и рекрутирование при делеции тимоцитов, ограниченной МНС класса I. J Immunol (2000) 165 (4): 1965–75. DOI: 10.4049 / jimmunol.165.4.1965
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Ким Х. Дж., Алонзо Э. С., Дороти Дж., Поллард Дж. В., Сант-Анджело Д. Б. Избирательное истощение эозинофилов или нейтрофилов у мышей влияет на эффективность клиренса апоптотических клеток в тимусе. PLoS One (2010) 5 (7): e11439. DOI: 10.1371 / journal.pone.0011439
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54.Мишра А., Хоган С.П., Ли Дж.Дж., Фостер П.С., Ротенберг М.Э. Основные сигналы, регулирующие возвращение эозинофилов в желудочно-кишечный тракт. J Clin Invest (1999) 103 (12): 1719–27. DOI: 10.1172 / JCI6560
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Якоби Д. Б., Глейх Г. Дж., Фрайер А. Д.. Главный основной белок эозинофилов человека является эндогенным аллостерическим антагонистом ингибирующего мускаринового рецептора M2. J Clin Invest (1993) 91 (4): 1314–8. DOI: 10.1172 / JCI116331
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Wu D, Molofsky AB, Liang HE, Ricardo-Gonzalez RR, Jouihan HA, Bando JK, et al. Эозинофилы поддерживают макрофаги, альтернативно активируемые жировой тканью, связанные с гомеостазом глюкозы. Наука (2011) 332 (6026): 243–7. DOI: 10.1126 / science.1201475
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Мюррей П.Дж., Аллен Дж.Э., Бисвас С.К., Фишер Е.А., Гилрой Д.В., Гёрдт С. и др.Активация и поляризация макрофагов: номенклатура и экспериментальные рекомендации. Иммунитет (2014) 41 (1): 14–20. DOI: 10.1016 / j.immuni.2014.06.008
Frontiers | Гомеостатические эозинофилы: характеристики и функции
Введение
Эозинофилы долгое время считались терминально дифференцированными цитотоксическими и деструктивными клетками, которые играют эффекторную роль в основном при глистных инфекциях и аллергических реакциях, таких как астма (1). Однако несколько недавних исследований поставили под сомнение упрощенное представление об эозинофилах как об участии исключительно в уничтожении паразитов и аллергическом воспалении.Действительно, в стабильном состоянии эозинофилы крови быстро мигрируют в желудочно-кишечный тракт, легкие, жировую ткань, тимус, матку и молочные железы, где они, как теперь известно, выполняют множество важных гомеостатических функций (2, 3). В этом мини-обзоре мы суммируем достижения в нашем понимании биологии (распространение, фенотипические и морфологические особенности, онтогенез) и функций этих гомеостатических эозинофилов (hEos).
Распространение hEos
Как у людей, так и у мышей большинство hEos обнаруживается в непищеводных частях желудочно-кишечного тракта, где они в основном располагаются в lamina propria тонкой кишки (4-7).В зависимости от библиографического источника количество hEos в желудочно-кишечном тракте мышей оценивается в 1,5-10 раз выше, чем в крови (т. Е. От 3 × 10 5 до 2 × 10 6 клеток. ) (8, 9). Легочные hEos расположены в паренхиме легких как человека, так и мышей (10). У мышей C57BL / 6 количество hEos в легких превышает 4 × 10 5 , что соответствует двукратному количеству эозинофилов, присутствующих во всем кровообращении (10). В жировой ткани мышей hEos составляет 4–5% клеток стромальной / сосудистой фракции (11).В др. Органах hEos пребывают временно (8, 12–16). У мышей количество hEos тимуса резко возрастает после рождения и достигает пика в возрасте 2 недель (15). Затем их количество значительно уменьшается, но снова возрастает через 16 недель, когда начинается инволюция тимуса (15). Во время первой фазы набора hEos концентрируются в кортико-медуллярной области тимуса, тогда как в более поздние моменты времени они более заметны в мозговом веществе (15). Примечательно, что у людей hEos, по-видимому, уже присутствует в тимусе плодов (14).У грызунов инфильтрация матки hEos совпадает с циклом течки (12, 13). Многочисленные hEos действительно наблюдаются в матке непосредственно перед течкой, во время течки и в течение 1 дня после нее, тогда как во время диэструса присутствует лишь несколько hEos (12, 13). Подавляющее большинство этих клеток находится в эндометрии, прилегающем к мышечному слою (16). У мышей hEos также является домом для молочной железы во время постнатального развития (17). ГЕО молочных желез в основном обнаруживаются вокруг растущих терминальных почек в возрасте от 3 до 8 недель (17).
Исследования in vivo на людях и мышах показали, что эозинофилы проводят в кровотоке лишь короткое время (т.е. период полураспада от 3 до 24 часов) (8, 18, 19). Напротив, hEos дольше остаются в тканях. Действительно, их период полувыведения составляет около 36 часов в легких и до 6 дней в кишечнике, тимусе и матке (8) (рисунок 1). Продолжительность жизни тканевого hEos, по-видимому, коррелирует с экспрессией CD11c. Действительно, хотя hEos кишечника, матки и тимуса экспрессируют CD11c, hEos легких и крови не экспрессируют этот маркер (8, 10) (Рисунок 1).
Рисунок 1 . Схематический обзор происхождения, интерлейкиновой (IL) -5 зависимости, фенотипа и функций гомеостатических эозинофилов (hEos) у мышей. hEos продуцируются в костном мозге из предшественника EoP независимо от IL-5. И наоборот, воспалительные эозинофилы (iEos) нуждаются в IL-5 для своей продукции. hEos равномерно характеризуются экспрессией Siglec-F, F4 / 80, CD125 и CCR3. hEos проходит через кровоток домой в ткани на исходном уровне.HEos крови имеют ядро в форме кольца и экспрессируют CD62L, тогда как iEos имеют сегментированное ядро и не экспрессируют CD62L, но экспрессируют CD101. Перемещение hEos в ткани зависит от IL-5 (темно-красный) или независимо (белый). IL-5- (in) зависимость hEos тимуса и молочной железы остается неизвестной. Тканевые hEos демонстрируют отчетливый фенотип, период полувыведения ( T 1/2 ) и гомеостатические функции. Изображенный поверхностный фенотип показывает, экспрессируют ли hEos (цветные символы) или нет (белые символы) указанные поверхностные маркеры.Если выражение маркера не определено, символ отсутствует. Была предложена функция, описанная курсивом , , но четкая демонстрация все еще отсутствует. ч, часы.
Исследования на мышах с течением времени показали, что hEos не присутствуют в легких при рождении, но постепенно увеличиваются в количестве, достигая максимальной плотности к 7 дню (10). Это наблюдение предполагает связь между колонизацией легких hEos и развитием микробиоты. Однако, как это ни парадоксально, рекрутирование hEos в желудочно-кишечный тракт, по-видимому, не зависит от бактериальной флоры.Действительно, пренатальные мыши обнаруживают hEos в кишечнике, а у мышей без микробов уровни hEos такие же, как у контрольных колонизированных мышей (5).
Базальное рекрутирование hEos в ткани в основном обеспечивается эотаксином-1 (CCL11), хемокином, продуцируемым местными клетками, такими как эпителиальные клетки, эндотелиальные клетки, фибробласты и моноциты (20–23). Соответственно, количество hEos резко снижается в желудочно-кишечном тракте, тимусе и матке мышей с дефицитом эотаксина-1 (5, 16, 24).Потеря CCR3, основного рецептора эотаксина-1 (25, 26), приводит к дефектному перемещению hEos в ткани в кишечник, но не влияет на количество hEos легких и тимуса (27), что, вероятно, связано с тем, что эотаксин -1 может действовать через альтернативные рецепторы, такие как CCR5 (28). Интерлейкин (IL) -5 и IL-13, два цитокина Т-хелперов 2 типа (Th3), также могут способствовать, хотя и в меньшей степени, чем эотаксин-1, транспортировке hEos в нормальных условиях (3, 5). IL-13 усиливает продукцию эотаксина-1 (29), тогда как IL-5 поддерживает образование эозинофилов из клеток-предшественников костного мозга, повышает их чувствительность к эотаксину-1 и поддерживает их выживание (30–32).Недавно было показано, что основным источником базальных IL-5 и IL-13 в желудочно-кишечном тракте и жировой ткани являются врожденные лимфоидные клетки 2 типа (ILC2) (29, 33). Более того, после приема пищи вазоактивный кишечный пептид стимулирует ILC2 кишечника, чтобы усилить секрецию ими IL-5 и IL-13, связывая уровни эозинофилов с метаболическим циклом (29).
Морфологические и фенотипические особенности hEos
hEos в основном охарактеризованы на мышах. Они демонстрируют большинство типичных свойств эозинофилов, включая окрашивающие в красный цвет гранулы, содержащие токсичные катионные белки (например,g., основные основные белки) и комбинированной экспрессии CCR3, Siglec-F и CD125 (т.е. субъединицы α рецептора IL-5) (8, 9, 34) (Рисунок 1). Они также могут экспрессировать CD11b (кишечник, тимус и жировая ткань), F4 / 80 (молочные железы, легкие и жировая ткань), CD69 (кишечник и тимус) и CD44 (кишечник и тимус) (6, 8, 10, 11, 15, 17, 35). Кроме того, большинство тканевых hEos имеют сегментированное ядро и экспрессируют CD11c (8, 13, 15, 16, 24, 35). Легочные hEos представляют собой исключение и скорее напоминают эозинофилы в покоящейся крови.Действительно, эозинофилы крови и легких имеют кольцевидное ядро (как и в случае hEos молочной железы), экспрессируют CD62L, отображают только промежуточные уровни Siglec-F и отрицательны по CD11c (8, 10, 17, 36 , 37) (рисунок 1). У эозинофилов мышей такие характеристики, особенно наличие кольцеобразного ядра, считаются признаком незрелости клеток (38, 39), предполагая, что легочные hEos сохраняют незрелый фенотип при распространении в легкие. Однако они подвергаются частичной дегрануляции и способны к фагоцитозу, демонстрируя свою функциональность (10).Интересно, что количество, локализация, морфологические, фенотипические и транскриптомные особенности hEos легких остаются неизменными и отличаются от таковых воспалительных эозинофилов (iEos) во время аллергического воспаления дыхательных путей (10). iEos, которые в большом количестве попадают в легкие во время аллергии дыхательных путей, действительно определяются как SiglecF hi CD62L — CD101 hi клетки с сегментированным ядром (CD101 является маркером iEos, который не экспрессируется hEos легких) (10 ). Эти наблюдения предполагают, что hEos и iEos представляют собой отдельные подмножества эозинофилов.В соответствии с этой гипотезой hEos- и iEos-подобные эозинофилы присутствуют в крови астматических мышей (10), что указывает на то, что дифференциация обеих подгрупп происходит еще до их рекрутирования в ткани. Кроме того, паренхимные hEos, обнаруженные в легких человека, не страдающего астмой (Siglec-8 + CD62L + IL-3R lo клетки), фенотипически отличаются от iEos, выделенного из мокроты пациентов с эозинофильной астмой (Siglec-8 + CD62L lo IL-3R hi клеток), что подтверждает данные, полученные на мышах (10).
Происхождение hEos
Развитие эозинофилов зависит от сложного взаимодействия нескольких факторов транскрипции, включая GATA-связывающий белок-1 (GATA-1), CCAAT / связывающий энхансер белок-α и -ε (C / EBP-α и -ε), семейство E26 фактор транскрипции PU.1 (PU.1) и X-бокс-связывающий белок-1 (1, 3, 40–42). Среди этих факторов транскрипции GATA-1 является наиболее селективным, о чем свидетельствует тот факт, что мыши ΔdblGATA, у которых генетически удален двойной палиндромный сайт связывания GATA-1 в промоторе Gata1 , в частности, отсутствуют эозинофилы, включая кровь. и тканевые hEos (7, 10, 11, 36, 43).ИЛ-5, который является наиболее специфичным цитокином для линии эозинофилов, незаменим для стабильного производства эозинофилов. Действительно, базальное количество эозинофилов в крови лишь умеренно снижено у мышей с дефицитом IL-5, которые, однако, не могут развить эозинофилию в контексте ответа Th3 (44). Интересно, что рекрутирование hEos в ткани независимо (легкие), частично (желудочно-кишечный тракт и матка) или полностью зависит (жировая ткань) от местного производства IL-5 (5, 10, 33, 44, 45) (Рисунок 1 ).Учитывая, что IL-5 увеличивает выживаемость эозинофилов после миграции в ткани, и что hEos, которые частично зависят от IL-5 (желудочно-кишечный тракт и матка), имеют более высокий период полужизни (см. Распределение hEos), чем IL-5-независимые (легкие), можно предположить, что долговечность тканевых hEos напрямую связана с их зависимостью от IL-5. Все эти наблюдения, если они применимы к людям, могут также объяснить, почему остаточные эозинофилы обнаруживаются в крови и легких пациентов, получавших анти-α-IL-5 антитела (46–48).
Функции hEos
В зависимости от типа ткани, в которую они проникают, hEos выполняет совершенно разные задачи, предполагая, что местная среда может управлять функциями hEos в соответствии со своими конкретными потребностями. Здесь мы рассмотрим тканеспецифические гомеостатические функции hEos, также обобщенные на рисунке 1.
Желудочно-кишечный тракт
hEos тонкого кишечника теперь считаются активными участниками гомеостаза кишечника, позволяя хозяину справляться с постоянным и интенсивным воздействием потенциально патогенных микроорганизмов, чужеродных и пищевых антигенов.В двух независимых исследованиях было показано, что hEos необходим для развития и поддержания плазматических клеток, продуцирующих иммуноглобулин (Ig) A (7, 35), в соответствии с функцией эозинофилов костного мозга в поддержании выживания плазматических клеток (49). Они также способствуют переключению классов на секреторный IgA, компоненты, участвующие в нейтрализации и регуляции кишечных микроорганизмов (7, 35). Кроме того, дефицит эозинофилов был связан с измененным составом микробиоты кишечника (7, 35), изменением развития пейеровских бляшек и снижением выработки слизи в тонком кишечнике (35), а также с увеличением количества клеток Th27 (50) и уменьшением количество регуляторных Т-клеток и дендритных клеток в тканях, ассоциированных с кишечником (7). In vitro , Chen и соавторы показали, что hEos тонкого кишечника способны индуцировать дифференцировку наивных Т-клеток в регуляторные Т-клетки Foxp3 + через механизмы, зависимые от IL-1β и ретиноевой кислоты (51). Совсем недавно было показано, что hEos тонкого кишечника подавляет дифференцировку in vitro клеток Th27 и продукцию IL-17, происходящую из кишечных Т-клеток, путем секретирования больших количеств антагониста рецептора IL-1 IL-1Rα (50). В целом, эти результаты согласуются с идеей, что hEos тонкого кишечника вносят вклад в гомеостаз кишечника, регулируя адаптивные гуморальные ответы IgA и ответы клеточных Т-клеток.
Жировая ткань
Эозинофилы стали центральными регуляторами метаболизма жировой ткани и метаболического здоровья. В жировых тканях hEos присутствуют вместе с альтернативно активированными макрофагами (AAM), и такие hEos продуцируют IL-4, тем самым способствуя поляризации жировых макрофагов в сторону альтернативно активированного фенотипа (11). ААМ играют решающую роль в гомеостазе глюкозы и выработке бежевого жира, который улучшает толерантность к глюкозе, реактивность инсулина и, следовательно, защищает от ожирения (11, 52, 53).В отсутствие жирового hEos количество AAM значительно снижается, а биогенез бежевого жира нарушается (11, 54). Более того, у мышей с дефицитом эозинофилов на диете с высоким содержанием жиров развивается ожирение, инсулинорезистентность и нарушение толерантности к глюкозе (11). И наоборот, мыши дикого типа, соблюдающие диету с высоким содержанием жиров, но инфицированные желудочно-кишечной нематодой Nippostrongylus brasiliensis , которая вызвала большее рекрутирование эозинофилов в жировых тканях, демонстрируют длительную улучшенную чувствительность к инсулину и толерантность к глюкозе (11).
Эта важная ось hEos / макрофагов регулируется ILC2s, которые поддерживают hEos и AAM в жировой ткани (33), и этому способствует истощение микробиоты (55) и ограничение калорийности (56).
Матка
Уже несколько десятилетий известно, что hEos инфильтрируют небеременную матку грызунов и людей циклически, с пиком во время течки (13, 57, 58), но лишь немногие исследования оценили их потенциальный вклад в физиологию матки и репродуктивным функциям. Гуон-Эванс и Поллард исследовали животных с дефицитом эотаксина, у которых было нарушено рекрутирование hEos в матку, и обнаружили задержку установления первого цикла течки вместе с первым возрастом родов у этих животных по сравнению с контрольными животными дикого типа. (16).Хотя эти наблюдения указывают на потенциальную роль hEos в подготовке матки к беременности (16), они должны быть уравновешены тем фактом, что время установления последующих циклов течки у зрелых мышей не зависит от отсутствия эозинофилов (16). . Что наиболее важно, у мышей с постоянным дефицитом эозинофилов не сообщалось о проблемах фертильности (36, 59), что свидетельствует о том, что hEos не важны для нормального воспроизводства.
Тимус
Присутствие hEos тимуса в непосредственной близости от незрелых дважды отрицательных тимоцитов и их обилие у новорожденных предполагают, что они могут вносить вклад в процесс центральной толерантности и отрицательного отбора Т-клеток (15).В поддержку этого, количество hEos тимуса быстро увеличивается и hEos кластер с апоптотическими тельцами в острой модели MHC-I-зависимого негативного отбора (15). В другом сообщении предполагается, что hEos может вносить вклад в клиренс апоптотических клеток, поскольку у мышей с дефицитом эозинофилов, подвергшихся гибели тимоцитов, вызванной облучением, нарушена их способность фагоцитировать апоптотические клетки (43). Однако окончательных доказательств гомеостатической роли эозинофилов тимуса в процессе отрицательной Т-клеточной селекции в настоящее время нет.
Молочная железа
Роль эозинофилов в регуляции постнатального развития молочных желез была предложена у мышей (17). В самом деле, устранение рекрутирования hEos в молочные железы у животных с дефицитом эотаксина приводило к уменьшению количества ветвей протокового дерева молочных желез и конечных зачатков (т.е. предшественников альвеолярных зачатков) (17). Подобный фенотип наблюдался в ткани молочной железы мышей с дефицитом IL-5 по сравнению с фенотипом от мышей дикого типа, хотя специфический вклад самого IL-5 по сравнению сIL-5-зависимые эозинофилы не оценивались в этой модели (60). Тем не менее, такие опосредованные ИЛ-5 события развития, по-видимому, имеют функциональные последствия, так как кормящие матери с дефицитом ИЛ-5 приводят к уменьшению размера помета и выживаемости отъема от груди, и этот феномен устраняется, когда детенышей с дефицитом ИЛ-5 выкармливают ИЛ-5. -достаточные плотины (60).
Легкие
Анализ микроматрицыпоказал, что легочные hEos, в отличие от iEos легких, экспрессируют несколько генов, таких как Anxa1, Nedd4, Runx3, Serpinb1a и Ldlr , которые участвуют в поддержании иммунного гомеостаза легких, и особенно в негативной регуляции. ответов клеток Th3 (10).В соответствии с этим наблюдением, мыши ΔdblGATA с дефицитом эозинофилов проявляют повышенную чувствительность к клещам домашней пыли (10), подтверждая, что легочные hEos обладают способностью предотвращать аллергию дыхательных путей, вызванную Th3. Эта иммуносупрессивная функция hEos легких связана с их уникальной способностью ингибировать созревание и, следовательно, функцию про-Th3 дендритных клеток, нагруженных аллергеном (10).
Заключение
Хотя hEos еще далеко не полностью охарактеризованы, интересно наблюдать, как быстро растет наше понимание сложности их фенотипа и функций.Тот факт, что эти клетки играют важную гомеостатическую роль на нескольких уровнях, заслуживает дальнейших исследований и имеет медицинское значение. Действительно, антиэотаксин-1 и агенты, истощающие эозинофилы, такие как гуманизированные антитела против рецептора IL-5 и молекулы анти-Siglec-8, в настоящее время разрабатываются для лечения эозинофильных расстройств, таких как аллергическая астма (9, 61–66). , и следует иметь в виду возможность того, что такие лекарства могут нарушать гомеостаз тканей, предотвращая специфическое для органа хоминг hEos или влияя на их выживание или функции.
Авторские взносы
TM, CM и FB провели обзор литературы. TM и FB написали рукопись.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарят Раджу Фареса, Седрика Франсуа и Ильхама Сбая за прекрасную секретарскую помощь.
Финансирование
Эта публикация поддержана F.R.S.-FNRS для FRFS-WELBIO (Валлония передового опыта в области наук о жизни и биотехнологии) в рамках гранта CR-2012S-01R. TM является научным сотрудником F.R.S.-FNRS и поддерживается фондом Acteria Foundation.
Список литературы
4. Като М., Кефхарт Г.М., Талли Н.Дж., Вагнер Дж.М., Сарр М.Г., Бонно М. и др. Инфильтрация и дегрануляция эозинофилов в нормальной ткани человека. Anat Rec (1998) 252 (3): 418–25.DOI: 10.1002 / (SICI) 1097-0185 (199811) 252: 3 <418 :: AID-AR10> 3.0.CO; 2-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Мишра А., Хоган С.П., Ли Дж. Дж., Фостер П.С., Ротенберг М.Э. Основные сигналы, регулирующие возвращение эозинофилов в желудочно-кишечный тракт. J Clin Invest (1999) 103 (12): 1719–27. DOI: 10.1172 / JCI6560
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Чу Д.К., Хименес-Саиз Р., Вершур С.П., Уокер Т.Д., Гончарова С., Ллоп-Гевара А. и др.Коренные кишечные эозинофилы контролируют DC, чтобы инициировать первичный иммунный ответ Th3 in vivo. J Exp Med (2014) 211 (8): 1657–72. DOI: 10.1084 / jem.20131800
CrossRef Полный текст | Google Scholar
7. Чу В.Т., Беллер А., Рауш С., Страндмарк Дж., Занкер М., Арбах О. и др. Эозинофилы способствуют образованию и поддержанию плазматических клеток, экспрессирующих иммуноглобулин-А, и способствуют иммунному гомеостазу кишечника. Иммунитет (2014) 40 (4): 582–93. DOI: 10.1016 / j.immuni.2014.02.014
CrossRef Полный текст | Google Scholar
8. Карленс Дж., Валь Б., Баллмайер М., Булфоне-Паус С., Форстер Р., Пабст О. Общие сигналы, зависимые от гамма-цепи, обеспечивают избирательное выживание эозинофилов в тонком кишечнике мышей. J Immunol (2009) 183 (9): 5600–7. DOI: 10.4049 / jimmunol.0801581
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Меснил С., Раулье С., Паулиссен Г., Сяо Х, Биррелл М.А., Пироттин Д. и др. Резидентные в легких эозинофилы представляют собой отдельную регуляторную подгруппу эозинофилов. J Clin Invest (2016) 126 (9): 3279–95. DOI: 10.1172 / JCI85664
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Wu D, Molofsky AB, Liang HE, Ricardo-Gonzalez RR, Jouihan HA, Bando JK, et al. Эозинофилы поддерживают макрофаги, альтернативно активируемые жировой тканью, связанные с гомеостазом глюкозы. Наука (2011) 332 (6026): 243–7. DOI: 10.1126 / science.1201475
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Ритёмаа Т.Распределение органов и гистохимические свойства гранулоцитов эозинофилов у крыс. Acta Pathol Microbiol Scand Suppl (1960) 50: 1–118.
Google Scholar
13. Росс Р., Клебанофф С.Дж. Эозинофильный лейкоцит. Изучение тонкой структуры изменений матки во время эстрального цикла. J Exp Med (1966) 124 (4): 653–60. DOI: 10.1084 / jem.124.4.653
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Throsby M, Herbelin A, Pleau JM, Dardenne M.CD11c + эозинофилы в тимусе мышей: регуляция развития и рекрутирование при делеции тимоцитов, ограниченной MHC классом I. J Immunol (2000) 165 (4): 1965–75. DOI: 10.4049 / jimmunol.165.4.1965
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Gouon-Evans V, Pollard JW. Эотаксин необходим для возвращения эозинофилов в строму пубертатной и циклической матки. Эндокринология (2001) 142 (10): 4515–21. DOI: 10.1210 / endo.142.10.8459
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17.Gouon-Evans V, Rothenberg ME, Pollard JW. Для постнатального развития молочной железы необходимы макрофаги и эозинофилы. Разработка (2000) 127 (11): 2269–82.
PubMed Аннотация | Google Scholar
18. Фарахи Н., Сингх Н.Р., Херд С., Луциос С., Саммерс С., Соланки С.К. и др. Использование 111-меченных индием аутологичных эозинофилов для установления кинетики человеческих эозинофилов in vivo у здоровых субъектов. Кровь (2012) 120 (19): 4068–71. DOI: 10.1182 / кровь-2012-07-443424
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19.Вен Т., Бессе Дж. А., Минглер М.К., Фулкерсон П.К., Ротенберг, ME. Система адаптивного переноса эозинофилов для прямой оценки легочного транспорта эозинофилов in vivo. Proc Natl Acad Sci U S. A (2013) 110 (15): 6067–72. DOI: 10.1073 / pnas.1220572110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Мотидзуки М., Бартельс Дж., Маллет А.И., Кристоферс Э., Шредер Дж. М.. ИЛ-4 индуцирует эотаксин: возможный механизм селективного рекрутирования эозинофилов при гельминтозной инфекции и атопии. J Immunol (1998) 160 (1): 60–8.
PubMed Аннотация | Google Scholar
21. Rothenberg ME. Эотаксин. Важный медиатор переноса эозинофилов в ткани слизистой оболочки. Am J Respir Cell Mol Biol (1999) 21 (3): 291–5. DOI: 10.1165 / ajrcmb.21.3.f160
CrossRef Полный текст | Google Scholar
22. Аренс Р., Уоддел А., Сейду Л., Бланшар С., Кэри Р., Форбс Е. и др. Кишечные макрофаги / происходящие из эпителиальных клеток CCL11 / эотаксин-1 опосредуют рекрутирование и функцию эозинофилов при язвенном колите у детей. J Immunol (2008) 181 (10): 7390–9. DOI: 10.4049 / jimmunol.181.10.7390
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Уодделл А., Аренс Р., Штайнбрехер К., Донован Б., Ротенберг М.Э., Мунитц А. и др. Эозинофильное воспаление толстой кишки при экспериментальном колите опосредуется Ly6C (высокий) CCR2 (+) воспалительным CCL11, происходящим из моноцитов / макрофагов. J Immunol (2011) 186 (10): 5993-6003. DOI: 10.4049 / jimmunol.1003844
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24.Мэтьюз А.Н., Френд Д.С., Циммерманн Н., Сарафи М.Н., Блеск А.Д., Перлман Э. и др. Эотаксин необходим для базового уровня тканевых эозинофилов. Proc Natl Acad Sci U S. A (1998) 95 (11): 6273–8. DOI: 10.1073 / pnas.95.11.6273
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Догерти Б.Л., Сицилиано С.Дж., ДеМартино Д.А., Малковиц Л., Сиротина А., Спрингер М.С. Клонирование, экспрессия и характеристика рецептора эозинофила эотаксина человека. J Exp Med (1996) 183 (5): 2349–54.DOI: 10.1084 / jem.183.5.2349
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Понат П.Д., Цинь С., Пост Т.В., Ван Дж., Ву Л., Джерард Н.П. и др. Молекулярное клонирование и характеристика рецептора эотаксина человека, избирательно экспрессируемого на эозинофилах. J Exp Med (1996) 183 (6): 2437–48. DOI: 10.1084 / jem.183.6.2437
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Хамблз А.А., Лу Б., Френд Д.С., Окинага С., Лора Дж., Аль-Гарави А. и др.Рецептор CCR3 мыши регулирует роль эозинофилов и тучных клеток в аллерген-индуцированном воспалении дыхательных путей и гиперреактивности. Proc Natl Acad Sci U S. A (2002) 99 (3): 1479–84. DOI: 10.1073 / pnas.261462598
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Огилви П., Барди Дж., Кларк-Льюис И., Баггиолини М., Угуччони М. Эотаксин является естественным антагонистом CCR2 и агонистом CCR5. Кровь (2001) 97 (7): 1920–4. DOI: 10,1182 / кровь.V97.7.1920
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Нуссбаум Дж. К., Ван Дайкен С. Дж., Фон Мольтке Дж., Ченг Л. Э., Мохапатра А., Молофски А. Б. и др. Врожденные лимфоидные клетки 2 типа контролируют гомеостаз эозинофилов. Nature (2013) 502 (7470): 245–8. DOI: 10.1038 / природа12526
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Ямагути Ю., Хаяси Ю., Сугама Ю., Миура Ю., Касахара Т., Китамура С. и др. Высокоочищенный мышиный интерлейкин 5 (ИЛ-5) стимулирует функцию эозинофилов и продлевает выживаемость in vitro.ИЛ-5 как фактор хемотаксиса эозинофилов. J Exp Med (1988) 167 (5): 1737–42. DOI: 10.1084 / jem.167.5.1737
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Клаттербак Э.Д., Херст Э.М., Сандерсон С.Дж. Интерлейкин-5 человека (IL-5) регулирует продукцию эозинофилов в культурах костного мозга человека: сравнение и взаимодействие с IL-1, IL-3, IL-6 и GMCSF. Кровь (1989) 73 (6): 1504–12.
PubMed Аннотация | Google Scholar
32.Mold AW, Matthaei KI, Young IG, Foster PS. Связь между интерлейкином-5 и эотаксином в регуляции эозинофилии крови и тканей у мышей. J Clin Invest (1997) 99 (5): 1064–71. DOI: 10.1172 / JCI119234
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Молофски А.Б., Нуссбаум Дж. К., Лян Х. Э., Ван Дайкен С. Дж., Ченг Л. Э., Мохапатра А. и др. Врожденные лимфоидные клетки типа 2 поддерживают эозинофилы висцеральной жировой ткани и, альтернативно, активированные макрофаги. J Exp Med (2013) 210 (3): 535–49.DOI: 10.1084 / jem.20121964
PubMed Аннотация | CrossRef Полный текст |
Границы | Интерлейкин-13 при астме и других эозинофильных заболеваниях
Введение
Эозинофилы — это лейкоциты костного мозга, которые присутствуют в крови в небольшом количестве во время здоровья (обычно <5% от всех белых кровяных телец) и быстро мигрируют, чтобы выбрать ткани, в которых они находятся. Однако повышенное количество эозинофилов в крови и тканях связано с множественными патологиями.Во время паразитарных инфекций и аллергических заболеваний происходит бурный эозинофилопоэз, приводящий к увеличению их количества в периферической крови. Затем эозинофилы активируются и мигрируют к месту повреждения, где они могут высвобождать медиаторы, включая цитокины, хемокины и цитотоксические гранулярные белки. В конечном итоге это приводит к изгнанию паразитов или, в случае аллергических заболеваний, к повреждению тканей (1).
Исследование моделей мышей и болезней человека показало, что повышенное количество эозинофилов связано с воспалением 2 типа и повышением уровня интерлейкина (IL) -4, -5 и -13.Действительно, эозинофильные расстройства преимущественно характеризуются воспалением 2 типа. IL-13 представляет собой плейотропный цитокин 2 типа, который, как было показано, играет важную роль в патогенезе астмы и других эозинофильных расстройств. Эффекты IL-13 в этих условиях включают индукцию метаплазии бокаловидных клеток и усиление секреции слизи, повышенную гиперреактивность дыхательных путей и, косвенно, перенос эозинофилов в место повреждения ткани посредством хемотаксиса (2).
Распространенность эозинофильных синдромов продолжает расти с появлением более тяжелых форм заболевания, не поддающихся лечению, что требует лучшего понимания лежащей в основе биологии, чтобы можно было разработать новые методы лечения.В настоящее время разрабатываются терапевтические средства против воспаления 2 типа, включая IL-4, IL-5 и IL-13, для лечения эозинофильных заболеваний. Однако из-за перекрывающейся биологии этих цитокинов было сложно определить точные роли, которые каждый играет в типе 2 / эозинофильном заболевании. Здесь мы представляем обзор литературы, описывающей роль IL-13 и текущую клиническую разработку терапевтических средств, направленных на IL-13, при астме и других эозинофильных расстройствах, таких как атопический дерматит (AD), эозинофильный эзофагит (EoE) и хронический риносинусит. (CRS) с носовыми полипами (CRSwNP).
Воспаление при эозинофильных заболеваниях
Эозинофилы развиваются из плюрипотентных предшественников в костном мозге и мигрируют в периферическую кровь после созревания. Зрелые эозинофилы имеют четко выраженные двулопастные ядра и секреторные гранулы, позволяющие легко идентифицировать их с помощью рутинной гистологии тканей с использованием окрашивания гематоксилином и эозином. Эозинофилы являются терминальными цитотоксическими эффекторными клетками и вносят уникальный вклад как в врожденный, так и в адаптивный иммунитет (3). Их период полураспада в крови составляет ~ 18 часов, и в гомеостатических условиях они быстро мигрируют в селезенку, лимфатические узлы, тимус, желудочно-кишечный тракт, матку и молочные железы, рекрутируемые хемотаксическими факторами (4).Эволюционная функция воспаления 2 типа заключается, прежде всего, в том, чтобы отвечать на инфекцию внеклеточными паразитическими организмами и контролировать ее. Заражение паразитическими червями вызывает ответ, опосредованный Th3, который необходим для успешного изгнания паразитарного бремени и защиты хозяина. Классические эффекторные механизмы Th3 используются для изгнания инфекционных организмов, включая мастоцитоз, эозинофилию, повышенное производство слизи, гиперсокращение гладких мышц и синтез IgE. В месте заражения эозинофилы дегранулируют, высвобождая цитотоксические гранулы, которые помогают убить паразита.Они также секретируют множество медиаторов, включая ИЛ-4 и ИЛ-13, чтобы способствовать дальнейшему развитию воспаления 2 типа (5, 6).
Однако присутствие эозинофилов при классических заболеваниях 2 типа, таких как астма, AD, EoE и CRSwNP, может быть патогенным. Связь между присутствием эозинофилов в тканях и патологией установлена давно, о чем свидетельствуют патологоанатомические исследования пациентов, перенесших обострения астмы со смертельным исходом (7). В случае астмы наблюдается аберрантный ответ на непаразитарные триггеры, такие как аллергены, вирусы или повреждение слизистой оболочки, что приводит к эпителиальным клеткам, продуцирующим цитокины, включая IL-25, IL-33, стромальный лимфопоэтин тимуса (TSLP) и IL. -1α.Эти так называемые алармины 2-го типа могут затем способствовать дифференцировке Т-хелперных клеток 2 (Th3), а также активации тучных клеток, макрофагов и врожденных лимфоидных клеток 2-го типа (ILC2). IL-4, IL-5 и IL-13, секретируемые этими клетками, могут впоследствии вызывать дополнительную иммунную активацию, включая эозинофильные ответы. IL-5 является основным цитокином, ответственным за эозинофилопоэз, наряду с фактором, стимулирующим колонии гранулоцитов-макрофагов (GM-CSF) и IL-3, которые также поддерживают выживание эозинофилов (8, 9).Роль IL-5 при эозинофильных заболеваниях рассматривается в другом месте этого выпуска.
Человеческий IL-13 был впервые обнаружен в 1993 году, и с тех пор было показано, что он продуцируется множеством типов клеток. Повышенная экспрессия IL-13 может вызывать многие патологические находки, связанные с заболеваниями типа 2 (10). Функции IL-13 in vivo были выяснены путем создания линии мышей, избирательно сверхэкспрессирующей IL-13, в легком через трансген , регулируемый промотором CC10, специфичным для клубных клеток (11).У этой трансгенной мыши с IL-13, специфичной для дыхательных путей, наблюдались эозинофильное воспаление легких, гипертрофия эпителиальных клеток дыхательных путей, метаплазия бокаловидных клеток, гиперсекреция слизи, субэпителиальный фиброз и гиперреактивность дыхательных путей (AHR). В модели заражения овальбумином (OVA) было обнаружено, что IL-13 необходим для поддержания AHR и гиперсекреции слизи, поскольку введение нейтрализующего антитела IL-13 приводило к ослаблению этих ответов (12). Было обнаружено, что ILC2 увеличивают in vivo в ответ на врожденные цитокины типа 2 IL-25 и IL-33 и представляют собой преобладающий ранний источник IL-13 во время инфекции Nippostrongylus brasiliensis , что обеспечивает эффективное изгнание гельминтов (13).
Интересно, что как IL-4, так и IL-13 передают сигнал через рецептор IL-4 α (IL-4Rα). IL-4Rα является компонентом комплексов IL-4R типа I (IL-4Rα и γc) и типа II (IL-4Rα и IL-13Rα1). IL-4 может передавать сигналы через рецепторные комплексы как I, так и II типа, тогда как IL-13 передает сигналы только через рецепторные комплексы типа II. IL-4 и IL-13 активируют сигнальный преобразователь киназы Janus и активатор пути транскрипции (JAK-STAT). Например, IL-13 взаимодействует с рецептором IL-13Rα1 на своей клеточной поверхности, который затем связывается с IL-4Rα, что приводит к фосфорилированию JAK1 и TYK2.Эти активированные киназы затем фосфорилируют цитоплазматический домен рецептора, создавая сайты связывания для STAT6. Молекулы STAT6, в свою очередь, фосфорилируются, после чего димеризуются и перемещаются в ядро. Там они регулируют транскрипцию генов, что в конечном итоге приводит к выработке цитокинов 2 типа, таких как IL-13, эотаксины и других медиаторов, участвующих в эозинофильном воспалении (рис. 1) (14). IL-4Rα и IL-13Rα1 экспрессируются как на гематопоэтических, так и негематопоэтических клетках, таких как макрофаги, В-клетки, фибробласты и эпителиальные клетки дыхательных путей.Считается, что эта конфигурация рецептора ответственна за тот факт, что IL-4 и IL-13 имеют перекрывающиеся функции, а также способность действовать независимо друг от друга. Например, один только ИЛ-4 участвует в инициации и потенцировании поляризации наивных Т-клеток к Т-клеткам и играет более доминирующую роль, чем ИЛ-13, в переключении класса антител на IgE (15). С другой стороны, IL-13 играет ключевую роль в фиброзе и секреции слизи (2). Эти различные функции могут быть связаны как с дифференциальной экспрессией рецепторных комплексов типа I и типа II, так и с различной пространственно-временной секрецией IL-4 и IL-13.Однако как IL-4, так и IL-13 могут способствовать воспалению, AHR и индукции хемокинов, которые управляют хемотаксисом эозинофилов крови в поврежденную ткань (16). Следует отметить, что IL-13 может также связываться с цепью IL-13Rα2, которая не содержит домена трансмембранной передачи сигналов и, таким образом, считается, что в первую очередь действует как рецептор-ловушка (17, 18).
Рисунок 1 . Передача сигналов цитокинов интерлейкина (ИЛ) -4 / ИЛ-13. IL-4 передает сигналы через рецепторные комплексы IL-4 α (IL-4Rα) / γc (тип I) и IL-4Rα / IL-13Rα1 (тип II), тогда как IL-13 передает сигналы только через IL-4Rα / Рецепторный комплекс IL-13Rα1.IL-13 может также связываться с цепью IL-13Rα2, которая, как считается, действует в первую очередь как рецептор-ловушка. И IL-4, и IL-13 активируют сигнальный преобразователь и активатор транскрипции 6 (STAT6) через киназы семейства киназ Janus (JAK), что приводит к ответам 2 типа и эозинофильному воспалению в тканях, управляемым хемокинами, факторами роста и факторами, которые позиционируют эозинофилы ткань (подробности см. в тексте). Блокирующие антитела, включая лебрикизумаб, дупилумаб и тралокинумаб, были разработаны для ингибирования передачи сигналов IL-4 и / или IL-13 при эозинофильных заболеваниях.
При эозинофильных расстройствах, таких как астма, наблюдается усиление эозинофилопоэза и последующая миграция эозинофилов в легкие из-за: (i) повышенных уровней IL-3, IL-5 и GM-CSF для стимуляции развития эозинофилов в костном мозге и выживания в крови и (ii) повышенные уровни цитокинов типа 2 (IL-4 и IL-13) для усиления продукции хемокинов, включая CCL11 (эотаксин 1), CCL24 (эотаксин 2), CCL26 (эотаксин 3), CCL13 (MCP4) и CCL5 (RANTES), которые усиливают хемотаксис перемещения эозинофилов из кровотока в дыхательные пути (19).Эти хемокины связываются с рецептором хемокинов CCR3, активируя молекулы адгезии, такие как интегрины, на поверхности эозинофилов крови. В свою очередь, это позволяет эозинофилам взаимодействовать с эндотелиальными клетками через молекулу внутриклеточной адгезии-1 (ICAM-1), молекулу адгезии сосудистых клеток-1 (VCAM-1) и периостин, что приводит к проникновению из крови в ткань дыхательных путей (20 ) (Фигура 2). Мыши с нокаутом хемокинов, такие как CCL11 — / — и CCL24 — / — , демонстрируют снижение доставки эозинофилов в дыхательные пути во время провокации аллергеном (21, 22).В модели астмы, индуцированной Aspergillus fumigatus , у мышей с нокаутом CCR3 наблюдалось снижение эозинофильного воспаления дыхательных путей наряду со сниженными уровнями цитокинов типа 2, включая IL-13 (23).
Рисунок 2 . Роль интерлейкина (IL) -13 в развитии эозинофилии при астме. При астме повреждение бронхиальных эпителиальных клеток приводит к выработке аларминов 2 типа, таких как IL-25, IL-33 и стромальный лимфопоэтин тимуса (TSLP). Эти алармины могут способствовать дифференцировке клеток Th3 и активации ILC2, что приводит к продукции IL-4, IL-5 и IL-13.IL-5 является основным цитокином, ответственным за эозинофилопоэз и выживание эозинофилов на периферии. IL-13 (и, в меньшей степени, IL-4) индуцирует секрецию хемокинов, таких как CCL11, CCL13 и CCL26, из эпителиальных клеток. Хемокины связываются с CCR3 на эозинофилах, доставляя их к месту повреждения, где они проникают в ткань легких. В легких эозинофилы дегранулируют, вызывая повреждение тканей через секрецию белков гранул эозинофилов и цитокинов, хемокинов и факторов роста (CCGfs).
Были разработаны два штамма мышей с дефицитом эозинофилов (ΔdblGATA и PHIL), однако исследования индукции аллергического воспаления дыхательных путей на этих моделях показали противоречивые результаты. OVA-стимулированные мыши ΔdblGATA (24) имели сходную гиперреактивность дыхательных путей и воспаление дыхательных путей, но снижали отложение коллагена и массу гладких мышц дыхательных путей по сравнению с мышами WT (25). Однако инфицированные OVA мыши PHIL были защищены от гиперреактивности дыхательных путей, метаплазии бокаловидных клеток и секреции слизи (26).В другом исследовании мыши ΔdblGATA были защищены от вызванного A. fumigatus аллергического воспаления дыхательных путей и имели снижение выработки цитокинов 2 типа и слизи в дыхательных путях (23). Тем не менее, есть множество предостережений при сравнении этих исследований, включая различные линии мышей, вариации в используемых моделях и различия в экспериментальных показаниях. Дальнейшие исследования необходимы, чтобы окончательно охарактеризовать взаимосвязь между IL-13 и эозинофилами на мышиных моделях аллергического заболевания.
Множественные биопрепараты и маломолекулярные терапевтические кандидаты, направленные на эозинофильное воспаление, прошли или в настоящее время оцениваются в доклинических или клинических условиях. Ряд биопрепаратов, блокирующих растворимые медиаторы воспаления и их рецепторы, связанные с эозинофильным воспалением, включая IgE, IL-4, IL-4Rα, IL-5, IL-5R, IL-13, TSLP, IL-25 и IL-33, расследуются. Было высказано предположение, что антитела против Siglec-8 ингибируют активацию эозинофилов и вызывают апоптоз эозинофилов (27).Преимущества и потенциальные ограничения различных таргетных методов лечения эозинофильных расстройств были недавно рассмотрены в другом месте (28).
Астма
Астма — одно из самых распространенных хронических заболеваний в мире. Несмотря на обширный объем исследований и большое клиническое бремя, связанное с астмой, ее сложность и неоднородность затрудняют выработку стандартизированного определения того, что составляет «болезнь». Астма обычно характеризуется воспалением дыхательных путей и респираторными симптомами в анамнезе (включая хрипы, одышку, стеснение в груди и кашель) вместе с переменным ограничением воздушного потока (29).
Исследование сложности астмы привело к идентификации множества различных клинических и молекулярных фенотипов (30). Наиболее часто описываемые клинические фенотипы включают фенотипы, определяемые степенью тяжести, частотой обострений, ответом на лечение, возрастом начала и ожирением. Современные молекулярные фенотипы включают эозинофильное, нейтрофильное и пауцигранулоцитарное воспаление 2 типа (30, 31). Эти клинические и молекулярные фенотипы не исключают друг друга, могут меняться с течением времени у отдельных пациентов и могут взаимодействовать друг с другом, что приводит к различиям в реакции на лечение астмы.
Роль эозинофилов в патофизиологии астмы
Возможно, молекулярное фенотипирование пациентов с астмой имело наибольшую ценность для разработки новых таргетных методов лечения, особенно для понимания биологии 2-го типа / эозинофильной астмы. Повышенное количество эозинофилов наблюдается в периферической крови, жидкости бронхоальвеолярного лаважа (БАЛ) и ткани бронхов у пациентов с астмой. Также сообщалось, что повышенное количество эозинофилов значительно коррелирует с тяжестью заболевания, что указывает на то, что эти клетки могут играть важную роль в патогенезе астмы (32).Было показано, что измерение эозинофилов в индуцированной мокроте является биомаркером воспаления дыхательных путей и полезным инструментом для регулировки интенсивности лечения кортикостероидами для достижения оптимального контроля астмы (33–35). Однако измерение эозинофилов мокроты не широко используется в клинических условиях, так как оно требует много времени, специальных технических знаний, а процесс сбора может вызвать некоторый дискомфорт у пациентов. Повышенное количество эозинофилов в крови коррелирует с функцией легких и оценкой симптомов астмы и, следовательно, может быть полезно как для диагностики, так и для ведения пациентов с астмой (32, 36–43).Сообщалось о статистически значимой корреляции между эозинофилами крови и эозинофилами мокроты у пациентов с астмой (44). Другое исследование позже показало, что количество эозинофилов в крови может точно предсказать эозинофилию дыхательных путей у пациентов с астмой со стойким неконтролируемым заболеванием, несмотря на лечение (45). Следовательно, эозинофилы крови могут быть хорошим суррогатным биомаркером для выявления пациентов с эозинофилией дыхательных путей. Однако Wenzel et al. описали два подтипа астмы, эозинофильную и неэозинофильную, с различными патологическими, физиологическими и клиническими характеристиками, хотя следует отметить, что эти характеристики существуют непрерывно, а не являются полностью независимыми.В их исследовании присутствие эозинофилов в биопсиях бронхов было связано со значительным увеличением тканевых лимфоцитов, тучных клеток и макрофагов, утолщением базальной мембраны и интубациями пациентов по сравнению с неэозинофильными астматиками (46). Из-за неоднородности заболевания у плохо контролируемых пациентов с астмой возникла необходимость в разработке биомаркеров, которые позволили бы идентифицировать конкретную подгруппу пациентов. Это было полезно в недавних клинических испытаниях, например, количество эозинофилов в крови коррелировало с ответом на терапию анти-IL-13 в клинических испытаниях фазы 2, в которых пациенты с более высоким уровнем эозинофилов в крови имели большее преимущество, чем пациенты с более низким уровнем (47). –50).В дополнение к количеству эозинофилов в крови существуют другие биомаркеры заболеваний типа 2, такие как сывороточный периостин и фракционный оксид азота в выдыхаемом воздухе (FeNO), которые исследуются при астме. Измерение этих биомаркеров в популяции астматиков показало, что они постоянно распределены и коррелируют друг с другом (44). Это непрерывное распределение биомаркеров и патологии дыхательных путей является важным нюансом, который следует учитывать при интерпретации клинических данных, поскольку пороговые значения определяют «высокий уровень биомаркера» по сравнению сПопуляции с «низким уровнем биомаркеров» являются произвольными и, как правило, близки к медиане непрерывно распределенных значений, а не определяют четкие различия между подгруппами (51).
IL-13 и эозинофилы при астме
Интерлейкин-13 способствует выживанию, активации и привлечению эозинофилов. In vitro культуры эозинофилов с рекомбинантным ИЛ-13 показали длительную выживаемость дозозависимым образом, что было приписано ингибированию апоптоза.Это было опосредовано аутокринным механизмом через стимуляцию или высвобождение IL-3 и GM-CSF эозинофилами. Основная функция IL-13 (и IL-4) в дыхательных путях при астме — индуцировать хемотаксис эозинофилов в месте повреждения. В ряде исследований in vitro изучали роль индуцированного IL-13 хемотаксиса и активации эозинофилов. Значительная дозозависимая хемотаксическая активность наблюдалась в эксперименте, в котором эозинофилы культивировались в верхнем отделении хемотаксических камер с рекомбинантным ИЛ-13 в нижнем отделении (52). In vitro культура эозинофилов, стимулированная IL-13, приводила к зависимой от концентрации положительной регуляции маркера активации CD69. Кроме того, добавление к этим культурам антитела против ИЛ-13 привело к ингибированию этой активации (53). IL-13 индуцирует экспрессию VCAM-1 в эндотелиальных клетках, что приводит к повышенной адгезии эозинофилов к эндотелию за счет взаимодействий VCAM-1 / интегрина α4. Это может быть потенциальным механизмом, с помощью которого IL-13 способствует остановке и экстравазации эозинофилов в астматические дыхательные пути (54).В клинических исследованиях повышенная экспрессия мРНК IL-13 в образцах мокроты и слизистой оболочке бронхов достоверно положительно коррелировала с процентным содержанием эозинофилов в просвете дыхательных путей (55, 56). При исследовании эпителиальных клеток бронхов человека от пациентов с астмой была идентифицирована сигнатура IL-13-индуцируемого гена ( POSTN, CLCA1 и SERPINB2 ), который служил суррогатным маркером воспаления дыхательных путей 2 типа. Эта сигнатура наблюдалась примерно у половины астматиков и была связана с различными особенностями астмы, включая эозинофилию дыхательных путей (56).Кроме того, было обнаружено, что эозинофилы в подслизистой оболочке бронхов экспрессируют IL-13 (57). IL-13 вырабатывается и потребляется локально в очагах воспаления, поэтому периферические уровни очень низкие, и разработка надежных анализов для измерения циркулирующего IL-13 является постоянной проблемой. Недавно мы разработали анализ для обнаружения человеческого сывороточного IL-13 с чувствительностью фемтограмм на миллилитр и отличной специфичностью (58). Используя этот анализ, мы обнаружили значительно более высокие уровни сывороточного IL-13 у пациентов с тяжелой астмой по сравнению со здоровыми добровольцами, и эти уровни сильно коррелировали с сигнатурой гена типа 2 в бронхиальном эпителии.Интересно, что у пациентов с астмой от умеренной до тяжелой степени IL-13 в сыворотке сильно коррелировал с количеством эозинофилов в крови. Также было продемонстрировано, что человеческие эозинофилы, происходящие как из периферии, так и из ткани, способны синтезировать и при стимуляции высвобождать более 35 цитокинов, хемокинов и факторов роста. IL-13 является цитокином, который содержится в большом количестве в эозинофилах, и при высвобождении может напрямую управлять воспалительными реакциями с другими иммуномодуляторами (59). Поэтому возможно, что повышенные уровни IL-13 в сыворотке отчасти могут быть следствием высвобождения эозинофилов как из дыхательных путей, так и из крови (58).
Активация IL-13 и эозинофилов при астме
Цитокины 2 типа, включая IL-13, регулируют секрецию различных хемокинов, которые могут связываться с эозинофилами через рецептор CCR3, что приводит к активации эозинофилов и миграции в легкие посредством хемотаксиса . Эозинофилы, поступающие в дыхательные пути при астме, сильно активируются и локализуются с помощью медиаторов воспаления и других иммунных клеток, которые накапливаются в месте повреждения. Хотя эозинофилы могут секретировать цитокины и другие медиаторы без дегрануляции, конечным результатом активации эозинофилов является дегрануляция.Гранулы эозинофилов человека содержат четыре катионных белка, основной основной белок (MBP), в основном присутствующий в кристаллическом ядре, пероксидазу эозинофилов (EPO / EPX), катионный белок эозинофилов (ECP) и нейротоксин эозинофильного происхождения (EDN), обогащенный в матриксе гранул. Было показано, что секреция белков гранул эозинофилов способствует уничтожению паразитов; in vitro Было обнаружено, что ECP и MBP токсичны для личинок паразитов, таких как Schistosoma mansoni и Trichinella spiralis (60).Однако они также обладают цитотоксическим действием на ткани, и предполагается, что их уровни связаны с тяжестью астмы, повреждением эпителиальных клеток бронхов и ремоделированием (61).
Наиболее часто наблюдаемыми формами дегрануляции эозинофилов в воспалительных дыхательных путях являются частичная дегрануляция и цитолитическая дегрануляция. Частичная дегрануляция — это форма экзоцитоза, при которой определенное содержимое гранул транспортируется на поверхность клетки в небольших цитоплазматических секреторных пузырьках, в то время как клетки остаются жизнеспособными (62).С другой стороны, цитолитическая дегрануляция включает хроматолиз эозинофилов и разрыв клеточной мембраны, что приводит к высвобождению интактных секреторных гранул. Бесклеточные гранулы эозинофилов могут накапливать и высвобождать свое содержимое (61). В одном исследовании были описаны гранулы эозинофилов в макрофагах дыхательных путей, которые предположительно фагоцитировали апоптозные эозинофилы. Увеличение количества макрофагов, содержащих ECP и EPO, наблюдалось с увеличением тяжести астмы (63). Помимо наиболее распространенной частичной и цитолитической дегрануляции, другой формой дегрануляции эозинофилов является создание внеклеточных ловушек (ETosis), содержащих белки гранул, в ответ на воздействие бактерий, C5a или CCL11 (64, 65).Процесс дегрануляции эозинофилов в периферической крови менее четко определен, и были противоречивые сообщения о том, способствует ли дегрануляция эозинофилов периферической крови заболеванию. Было показано, что эозинофилы крови при аллергических заболеваниях, таких как астма и AD, не проявляют морфологических признаков частичной или цитолитической дегрануляции, в то время как эозинофилы из сопоставленных биоптатов пораженной ткани демонстрировали дегрануляцию как по частям, так и посредством цитолитических процессов. Эти наблюдения предполагают, что эозинофилы существуют в состоянии покоя в кровотоке и активируются в месте патологии ткани (66).Однако небольшое исследование с участием астматиков с легкой степенью аллергии и здоровых добровольцев показало, что эозинофилы крови у пациентов с аллергией претерпевают частичную дегрануляцию в течение сезона пыльцы (67). Исследование с участием детей, сравнивающее эозинофилы крови здоровых людей, астматиков без симптомов и астматиков с обострениями, показало, что доля активированных эозинофилов в крови со значительными морфологическими изменениями была самой высокой у детей с обострениями астмы по сравнению с астматиками без симптомов и здоровыми элементы управления (68).Было также продемонстрировано, что циркулирующие уровни белков гранул эозинофилов коррелируют с некоторыми аспектами активности заболевания. Следовательно, помимо простого измерения количества эозинофилов в крови, оценка статуса активации эозинофилов может иметь клиническое применение. Действительно, сообщалось, что уровни ECP и EPX в сыворотке более точно предсказывали риск астмы, чем стандартные уровни эозинофилов в крови у пациентов с аллергическим ринитом (69).
Следует отметить, что лечение, направленное на путь IL-13, постоянно сообщало об увеличении количества эозинофилов в крови.Однако статус активации эозинофилов не охарактеризован. Чтобы решить эту проблему, мы проанализировали сывороточные уровни двух белков гранул эозинофилов, ECP и EDN, используя объединенные данные двух независимых исследований фазы 2, посвященных изучению эффективности лебрикизумаба (моноклонального антитела против IL-13) у пациентов с неконтролируемой астмой, несмотря на поддерживающую терапию препаратами. ингаляционные кортикостероиды (ICS) и второй контроллер. Все пациенты дали письменное информированное согласие на использование их образцов в исследовательских целях.Пациенты получали либо плацебо, либо лебрикизумаб (37,5, 125 или 250 мг) (47). В ходе этого исследования измеряли эозинофилы крови, FeNO и периостин сыворотки, и на каждый из этих биомаркеров наблюдали фармакодинамические (PD) эффекты. Количество эозинофилов в крови увеличивалось в ответ на лечение, и наблюдалась небольшая тенденция к дозозависимости. Уровни FeNO и периостина в сыворотке снизились после лечения, но это не зависело от дозы. Учитывая сходные эффекты PD в разных группах лечения, они были объединены для анализа статуса активации эозинофилов после лечения лебрикизумабом.Уровни ECP и EDN в сыворотке измеряли на исходном уровне и после 16 и 24 недель лечения плацебо или лебрикизумабом у подгруппы пациентов, у которых исходные характеристики сопоставимы с общей исследуемой популяцией (таблица 1). Эти ранее неопубликованные данные продемонстрировали, что на исходном уровне наблюдалась сильная положительная взаимосвязь между эозинофилами крови и сывороточными ECP и EDN, предполагая, что сывороточные ECP и EDN могут секретироваться эозинофилами крови (рис. 3). У пациентов, получавших лебрикизумаб, количество эозинофилов в крови увеличивалось после 16 и 24 недель лечения.Однако уровни ECP и EDN в сыворотке крови остались неизменными, что позволяет предположить, что, хотя лечение лебрикизумабом привело к повышению уровня эозинофилов в крови, оно не привело к активации эозинофилов в крови (рис. 4). Следует отметить, что уровни сывороточных ECP и EDN в группе плацебо значительно снизились на 16 и 24 неделе. Это снижение было неожиданным, учитывая неизменное количество эозинофилов в крови с течением времени в группе плацебо, и поэтому требует дальнейшего изучения.
Таблица 1 . Краткое изложение основных характеристик пациента на исходном уровне.
Рисунок 3 . Базовые измерения количества эозинофилов в крови положительно коррелируют с уровнями эозинофильных катионных белков (ECP) и нейротоксинов, полученных из эозинофилов (EDN). На исходном уровне была сильная положительная взаимосвязь между эозинофилами крови и ECP (A), сыворотки и EDN (B) сыворотки. (C) Уровни ECP и EDN также сильно коррелировали. Коэффициент корреляции Спирмена использовался для статистического анализа.Для всех корреляций p <0,0001; Значения rho (ρ) показаны на каждом графике.
Рисунок 4 . Лечение лебрикизумабом увеличивает количество эозинофилов в периферической крови, но уровни циркулирующих катионных белков эозинофилов (ECP) и нейротоксина, производного от эозинофилов (EDN), остаются неизменными. (A) Абсолютные уровни и изменения от исходного уровня показывают увеличение эозинофилов в крови у пациентов, получавших лебрикизумаб на 16 и 24 неделе [среднее изменение 0,12 × 10 9 / л (95% ДИ 0.08–0,16) и 0,10 × 10 9 / л (95% ДИ 0,06–0,15) соответственно, p <0,001], но не наблюдалось значительных изменений в группе плацебо. (B) Абсолютные уровни и изменения по сравнению с исходным уровнем показывают отсутствие изменений в сыворотке ECP у пациентов, получавших лебрикизумаб, но снижение у пациентов в группе плацебо через 16 и 24 недели [среднее изменение -11,59 нг / мл (95% ДИ — От 18,80 до -4,38), p = 0,018 и -8,31 нг / мл (95% ДИ от -16,71 до 0,08), p = 0,052 соответственно]. (C) Абсолютные уровни и изменения относительно исходного уровня показывают отсутствие изменений EDN в сыворотке у пациентов, получавших лебрикизумаб, но снижение у пациентов в группе плацебо через 16 и 24 недели [среднее изменение -12,25 нг / мл (95% ДИ — От 19,33 до -5,17), p = 0,0008 и -11,94 нг / мл (95% ДИ от -20,25 до -3,64), p = 0,0051, соответственно]. Графики показывают среднее значение ± стандартное отклонение, и был проведен парный тест Стьюдента t (CHG, изменение).
Хотя эти данные потенциально интересны и начинают проливать свет на связь между IL-13 и эозинофилами при астме, есть некоторые оговорки.Это был апостериорный анализ , проведенный на подгруппе пациентов из двух независимых исследований фазы 2, и поэтому потребуется дальнейшая валидация, чтобы лучше понять роль IL-13 в количестве и статусе активации эозинофилов при астме. Дальнейшие исследования также необходимы для окончательного изучения последствий, если таковые имеются, увеличения эозинофилов в крови у пациентов с астмой в ответ на терапию анти-IL-13.
Нацеливание на IL-13 при астме
Пациенты с астмой от умеренной до тяжелой степени с плохо контролируемым заболеванием представляют собой значительную неудовлетворенную медицинскую потребность.Неопровержимые доказательства роли IL-4 и IL-13 в управлении типом 2 / эозинофильной астмой привели к разработке нескольких терапевтических кандидатов, нацеленных на эти пути (рисунок 1; таблица 2). Лебрикизумаб представляет собой гуманизированное моноклональное антитело, которое связывается с растворимым IL-13 с высоким сродством и блокирует передачу сигналов через гетеродимер IL-4Rα / IL-13Rα1. Фаза 2 клинических испытаний, посвященных оценке лебрикизумаба при неконтролируемой астме средней и тяжелой степени, показала, что лечение значительно улучшило функцию легких (49) и снизило частоту обострений (47) по сравнению с плацебо.Однако в двух исследованиях фазы 3, проведенных параллельно, были получены противоречивые результаты; LAVOLTA I сообщила о значительном уменьшении обострений у пациентов, получавших лебрикизумаб, по сравнению с плацебо, но это не повторилось в LAVOLTA II. Однако улучшение функции легких, определяемое объемом форсированного выдоха за 1 секунду (ОФВ 1 ), наблюдалось в обоих исследованиях (70). Тралокинумаб, человеческое IL-13-нейтрализующее моноклональное антитело, блокирующее связывание IL-13 как с IL-13Rα1, так и с IL-13Rα2, оценивался в клинических испытаниях с участием пациентов с неконтролируемой астмой от умеренной до тяжелой степени.Исследование фазы 2, в котором изучались различные режимы дозирования тралокинумаба, показало тенденцию к улучшению функции легких после 16 недель лечения, но не изменило балл -6 по опроснику контроля астмы (ACQ) (71). Последующее исследование фазы 2b, в котором изучались двух- и четырехнедельные режимы дозирования, показало, что не было значительного снижения частоты обострений астмы, но пациенты, получавшие дозу каждые 2 недели, показали улучшение функции легких (48). В настоящее время проводятся исследования фазы 3 для оценки эффективности и безопасности тралокинумаба у взрослых и подростков с недостаточно контролируемой астмой (NCT02161757, NCT02449473 и NCT02281357).Дупилумаб, гуманизированное моноклональное антитело к IL-4Rα, которое ингибирует передачу сигналов как IL-4, так и IL-13, оценивается у пациентов с неконтролируемой астмой. Первоначальное исследование по оценке эффективности дупилумаба проводилось у пациентов с персистирующей астмой средней и тяжелой степени с повышенным уровнем эозинофилов (количество эозинофилов в крови не менее 300 клеток / мл или уровень эозинофилов в мокроте не менее 3%). В этом исследовании пациенты, получавшие фоновую терапию ICS и бета-агонистами длительного действия (LABA), были рандомизированы для получения дупилумаба или плацебо, и фоновое лечение было отменено.В этом контексте лечение дупилумабом привело к уменьшению обострений астмы и улучшению функции легких по сравнению с плацебо (50). Основное 24-недельное исследование фазы 2b у устойчивых астматиков средней и тяжелой степени тяжести на фоне ИКС, в которое включались пациенты независимо от исходного уровня эозинофилов, сообщило об улучшении функции легких и относительном снижении частоты обострений в годовом исчислении как у пациентов с высоким, так и с низким уровнем эозинофилов. Однако улучшение функции легких и абсолютное снижение частоты обострений были выше в группе с высоким содержанием эозинофилов (72).Исследования фазы 3 по оценке эффективности и безопасности дупилумаба у пациентов с персистирующей астмой (NCT02414854 и NCT02528214) продолжаются.
Таблица 2 . ИЛ-13-таргетная терапия эозинофильных заболеваний.
Хотя клинические испытания лебрикизумаба, тралокинумаба и дупилумаба, нацеленного на IL-13, имели приемлемый общий профиль безопасности, сообщалось об увеличении количества эозинофилов в крови для каждого вмешательства (48, 70, 72). Предполагается, что повышенные уровни эозинофилов в крови могут быть результатом снижения доставки эозинофилов из кровотока в дыхательные пути и / или другие ткани, где они могут проявлять свои патогенные эффекты, из-за снижения экспрессии индуцированных IL-13 хемокинов.Действительно, неопубликованные данные наших доклинических исследований, проверяющих эффективность анти-IL-13 на мышиной модели астмы, показали, что это так. Мышей C57 / B6 заражали экстрактом клеща домашней пыли, Dermatophagoides farinae , и лечили профилактически либо анти-IL-13, либо антителом изотипического контроля. Введение анти-IL-13 приводило к снижению эозинофилии в ЖБАЛ по сравнению с контролем, однако, у мышей, получавших анти-IL-13, но не в контроле, наблюдалась сопутствующая повышенная регуляция эозинофилов в крови.Динамика эозинофилов при лечении анти-IL-13 и анти-IL-5 также изучалась с использованием математической модели. Модель включала уровни эотаксина и периостина в качестве хемоаттрактантов для эозинофилов в легких. Он предсказал, что лечение анти-IL-13 приведет к уменьшению эозинофилов в легких и увеличению эозинофилов в крови, тогда как лечение анти-IL-5 приведет к снижению эозинофилов как в крови, так и в дыхательных путях (73). Следует отметить, что лечение анти-IL-5 терапией, меполизумабом, постоянно приводит к снижению уровня эозинофилов в крови.Однако в зависимости от того, из какого отдела легкого отбирается проба, наблюдалось дифференциальное снижение эозинофилов в дыхательных путях. Уровни эозинофилов в мокроте значительно снизились в ответ на лечение меполизумабом, но количество эозинофилов в тканях — нет (74, 75). Для подтверждения этих данных на животных и смоделированных прогнозов необходимы дальнейшие исследования динамики эозинофилов у людей, и несколько исследований продолжаются. Чтобы оценить влияние блокирования IL-13 на динамику эозинофилов в дыхательных путях человека, у плохо контролируемых астматиков проводятся исследования с лебрикизумабом (NCT02099656) и тралокинумабом (NCT02449473).Кроме того, влияние на воспалительные клетки в дыхательных путях после блокирования передачи сигналов IL-4 и IL-13 дупилумабом изучается у пациентов с персистирующей астмой (NCT02573233). Результаты этих исследований должны пролить свет на взаимосвязь между IL-13 и эозинофилией дыхательных путей и другими патологиями у пациентов с астмой in vivo .
Атопический дерматит
Атопический дерматит — наиболее частое рецидивирующее воспалительное заболевание кожи у детей со средней распространенностью в мире 7.9% в возрасте 6–7 лет (76). Проявления заболевания включают сухость кожи, экзематозные поражения, сильный зуд и высокий уровень сывороточного IgE. При БА нарушение функции эпидермального барьера приводит к усилению проникновения аллергенов и системной сенсибилизации IgE. У пациентов с БА наблюдается эозинофилия крови (77), эозинофильные инфильтраты в поражениях кожи (78) и отложение белков эозинофильных гранул (79).
IL-13 и эозинофилы в
нашей эрыПризнаки реакции на цитокины Th3, Th32, Th27 и Th2 связаны с кожей AD на различных стадиях заболевания.В частности, было показано, что цитокины Th3 IL-4 и IL-13 играют центральную роль в AD, модулируя эпидермальный барьер, включая подавление генов комплекса эпидермальной дифференцировки кератиноцитов (EDC) (80) и ингибирование продукции антимикробных пептидов (81 , 82). Было показано, что мРНК IL-13 положительно коррелирует с тяжестью болезни БА при острых и хронических поражениях кожи (83–85). У пациентов с БА уровень ИЛ-13 в сыворотке выше, чем у здоровых людей (58, 86). У детей с более тяжелой формой БА наблюдается более высокий процент экспрессирующих ИЛ-13 CD4 + Т-клеток в периферической крови (87). In vitro обработка нормальных эпидермальных кератиноцитов человека IL-13 привела к повышенной экспрессии ключевого хемокина для рекрутирования эозинофилов, CCL26 (88). У мышей сверхэкспрессия трансгенного IL-13 в коже индуцировала ключевые признаки AD, включая зуд, повышенный уровень IgE и эозинофильную инфильтрацию. Также наблюдались повышенные уровни хемоаттрактантов эозинофилов, таких как CCL11, в коже, что приводило к привлечению эозинофилов из крови в ткань. Это установило четкую роль IL-13 в AD (89).IL-4 и IL-13 разделяют перекрывающиеся биологические функции и патофизиологические роли при AD отчасти из-за совместного использования рецепторного комплекса IL-4Rα / IL-13Rα1 и последующей передачи сигналов через STAT6. Было обнаружено, что у мышей, конститутивно экспрессирующих активный STAT6 (Stat6VT), развивалось спонтанное AD-подобное заболевание со сниженной экспрессией гена EDC и повышенным содержанием IL-4, IL-13 и эозинофилов в пораженной коже. Дефицит IL-4 у этих мышей (IL-4 — / — Stat6VT) ослаблял развитие аллергического кожного заболевания и эозинофильного воспаления, в то время как терапевтическая блокада с помощью анти-IL-13 у мышей Stat6VT приводила к спасению гена EDC. выражение (90).Точно так же блокада IL-13 путем местной доставки антисмысловых олигонуклеотидов IL-13 снижает связанные с AD цитокины, IgE и воспалительные клетки в коже в модели эпикутанной сенсибилизации OVA (91). Как описано ранее, IL-13 также связывается с IL-13Rα2, рецептором-ловушкой, у которого отсутствует мотив внутриклеточной передачи сигналов и который может служить регулятором отрицательной обратной связи передачи сигналов IL-13. Кератиноциты пораженной кожи пациентов с БА показали повышенную экспрессию IL-13Rα2 (92). IL-13 также индуцировал экспрессию IL-13Rα2 в кератиноцитах человека STAT6-зависимым образом (93).В соответствии с его ролью в качестве рецептора-ловушки, мыши с дефицитом IL-13Rα2 показали повышенную трансэпидермальную потерю воды, воспаление кожи, периферическую эозинофилию и IgE в модели AD по сравнению с контрольными мышами (94).
Нацеливание на Ил-13 в
н.э.Учитывая сильное биологическое обоснование, различные компании продвинулись вперед с терапевтическими кандидатами, нацеленными на цитокины типа 2 при БА (Таблица 2). Дупилумаб исследовали у пациентов с умеренной и тяжелой формой БА, недостаточно контролируемых местным лечением.В двух исследованиях фазы 3 дупилумаб улучшил признаки и симптомы БА, тревожности и депрессии, а также качество жизни по сравнению с плацебо (95). Эти результаты дополнительно подтверждают гипотезу о том, что цитокины типа 2 IL-4 и IL-13 являются ключевыми факторами развития AD. Следует отметить, что эти испытания, аналогичные терапии, направленной на путь IL-13 при астме, показали повышенные уровни эозинофилов в крови у пациентов, получавших дупилумаб, по сравнению с плацебо. Биопрепараты, специально нацеленные на IL-13, завершили 2-ю фазу исследований по лечению AD.В продолжающемся исследовании лебрикизумаб оценивали у пациентов со стойкой, умеренной или тяжелой АД, неадекватно контролируемой местными кортикостероидами (TCS) (NCT02340234). Эффективность тралокинумаба оценивалась у пациентов с БА от умеренной до тяжелой на фоне ТКС (NCT02347176) и показала статистически значимое улучшение симптомов БА. Эти результаты подтверждают ключевую роль передачи сигналов IL-13 в патофизиологии БА. Однако из-за различий и ограничений в дизайне испытаний относительный вклад IL-4 vs.IL-13 и роль IL-13Rα2 при БА у человека не могут быть полностью выяснены и потребуют дальнейшего исследования.
Эозинофильный эзофагит
Эозинофильный эзофагит — хроническое воспалительное заболевание пищевода. Это одно из наиболее распространенных состояний, диагностируемых при оценке проблем с кормлением у детей, а также дисфагии и затруднения приема пищи у взрослых (96). EoE встречается во всем мире с возрастающей распространенностью, в настоящее время составляющей 0,4% в западных странах (97). Диагностика EoE была сложной задачей.Требуются два ключевых компонента: (i) клинические симптомы, включая проблемы с кормлением, рвоту и боль в животе у детей, а также дисфагию и затруднение приема пищи у подростков и взрослых, и (ii) гистологическая оценка 15 или более эозинофилов на поле высокой мощности в пищеводе. биопсия слизистой оболочки после лечения ингибиторами протонной помпы (98).
IL-13 и эозинофилы в EoE
Нарушение барьерной функции, о чем свидетельствует утолщение базального слоя слизистой оболочки, расширение межэпителиальных пространств и изменение барьерной функции эпителия, наблюдались в тканях пищевода у пациентов с EoE (99).Полагают, что результирующая повышенная проницаемость эпителия, в свою очередь, усиливает презентацию антигена и рекрутирование эозинофилов. Как экологические, так и генетические предрасположенности модулируют иммунные ответы, которые играют важную роль в патогенезе EoE. Ответы типа 2, вызванные в основном пищевыми антигенами, считаются основной причиной заболевания. В частности, IL-13 сверхэкспрессируется в биоптатах пациентов с EoE (100). Было показано, что IL-13 влияет на функцию эпителиального барьера, подавляя гены EDC, такие как филаггрин ( FLG) (101). Исследования in vitro показали, что IL-13 активирует IL-5, CCL26 и другие родственные цитокины, которые способствуют эозинофилии (101, 102). Кроме того, полногеномное ассоциативное исследование (GWAS) выявило мощный индуктор IL-13, TSLP и нижележащие гены ответа IL-13, CCL26, и кальпаин 14 ( CAPN14 ) были связаны с EoE (102–105). ). Сигнатуры транскриптома EoE, идентифицированные с помощью микроматрицы и анализа РНК-seq для дисрегулируемых генов в пищеводе пациентов с EoE, выявили значительное участие IL-13 и продемонстрировали поразительную степень совпадения с паттерном экспрессии генов, наблюдаемым в эндобронхиальных биопсиях «Th3-high». »Пациенты с астмой (106–108).Длинная некодирующая РНК BANCR индуцируется IL-13, и ее экспрессия коррелирует с уровнями эозинофилов и транскриптов, которые, как известно, участвуют в патогенезе EoE. Другая транскрипционная мишень IL-13, нейротропный рецептор тирозинкиназы типа 1 (NTRK1), была активирована в тканях пищевода EoE. Полагают, что эта повышающая регуляция вызывает повышенную чувствительность эпителиальных клеток к NGF, лиганду NTRK1, и последующую индукцию хемокина эозинофилов CCL26 (109).
Нацеливание на Ил-13 в EoE
Несколько биопрепаратов, нацеленных на IL-13, были протестированы в клинических испытаниях для лечения EoE (таблица 2).QAX576, моноклональное антитело против ИЛ-13, было протестировано на небольшой группе пациентов с устойчивым к ингибиторам протонного насоса EoE на его эффективность в снижении пикового количества эозинофилов в ткани пищевода после 8 недель лечения. Первичная конечная точка не была достигнута; тем не менее, QAX576 снизил количество эозинофилов в пищеводе на 60% по сравнению с увеличением на 23% при приеме плацебо, и наблюдалась небольшая тенденция к улучшению симптомов. Транскриптомика также была проведена на образцах биопсии, собранных на 85-й день исследования, и показала, что гены, связанные с EoE, были подавлены, включая хемоаттрактант эозинофилов CCL26, что предполагает, что IL-13 является важным фактором дифференциальной экспрессии генов, наблюдаемой в EoE.QAX576 не влиял на количество эозинофилов в крови (110). RPC4046, моноклональное антитело против IL-13, которое блокирует как IL-13Rα1, так и IL-13Rα2, в настоящее время изучается в фазе 2 исследования диапазона доз в EoE со средним количеством эозинофилов в качестве основного результата (NCT02098473). Эффективность дупилумаба также изучается в исследовании фазы 2 у пациентов с активным, умеренным и тяжелым ЭоЕ. Тем не менее, первичным результатом этого исследования является изменение баллов результатов (PRO) по шкале Straumann Dysphagia Instrument (SDI), а изменения в количестве эозинофилов будут оцениваться как одна из вторичных конечных точек (NCT02379052).
CRS с назальными полипами
Хронический риносинусит — воспалительное патологическое состояние носа и придаточных пазух носа. Пациенты с СВК характеризуются обструкцией носа, дренажом, нарушением обоняния и продолжительной лицевой болью или давлением (111). CRS подразделяется на два подтипа: CRS без носовых полипов (CRSsNP) и CRS с носовыми полипами (CRSwNP) (112). В США и Европе у большинства пациентов с CRSwNP наблюдается значительная эозинофильная инфильтрация в ткани полипа (113).
IL-13 и эозинофилы в CRSwNP
Распространенность эозинофильного CRSwNP (ECRSwNP) растет во всем мире и составляет, по оценкам, 2,1–2,7% среди взрослых (114–116). Он представляет собой трудно поддающуюся лечению или хирургическому вмешательству форму заболевания (113). ECRSwNP характеризуется воспалением 2 типа с повышенным уровнем IL-5, IL-13 и эозинофилов в ткани полипа (117). Предполагается, что клетки Th3, ILC2, тучные клетки и эозинофилы являются основными источниками цитокинов 2 типа в ECRSwNP.Считается, что, подобно астме, AD и EoE, IL-4 и IL-13 играют важную роль в патофизиологии ECRSwNP. Было показано, что IL-13 влияет на целостность эпителиального барьера придаточных пазух носа, подавляя экспрессию белков плотных контактов (118) и продукцию антимикробных пептидов (119). Экспрессия хемоаттрактантов эозинофилов, таких как CCL11, CCL24 и CCL26, повышена в ECRSwNP (120–122). In vitro , IL-4 или IL-13 в сочетании с TNF индуцировали повышенную экспрессию CCL11 в фибробластах и эпителиальных клетках дыхательных путей, полученных от этих пациентов, что свидетельствует о наличии петли положительной обратной связи между рекрутированием эозинофилов и воспалением 2 типа (123).Транскриптомный анализ данных RNA-seq, сравнивающих носовые полипы эозинофильных и не-ECRSwNP, и слизистой оболочки носа от контрольных субъектов, выявил различные профили экспрессии между этими подгруппами. Примечательно, что IL-13 и CCL26 специфически сверхэкспрессируются в ECRSwNP вместе с другими хемокинами, которые опосредуют эозинофильное воспаление (124).
Нацеливание на IL-13 в носовых полипах
В настоящее время не существует одобренных биологических методов лечения полипов носа. Дупилумаб оценивался в клинических испытаниях фазы 2 на предмет его эффективности у пациентов с хроническим синуситом и назальным полипозом, резистентным к интраназальным кортикостероидам, и показал обнадеживающие результаты (125).Пациенты, получавшие дупилумаб вместе с назальным спреем мометазона фуроата, испытали меньшую нагрузку на эндоскопические носовые полипы по сравнению с пациентами, получавшими мометазон в сочетании с плацебо (таблица 2). Продольный анализ CCL26 в плазме показал снижение после лечения дупилумабом, тогда как наблюдалась тенденция к снижению уровней CCL17 в сыворотке. У некоторых пациентов в ответ на лечение наблюдалось временное повышение эозинофилов в крови. В настоящее время проводятся клинические исследования фазы 3 (NCT02
8, NCT02898454).
Заключение
Астма и другие эозинофильные расстройства, такие как AD, EoE и CRSwNP, широко распространены, и число заболевших продолжает расти. Существуют подгруппы пациентов с каждым из этих состояний, которые не отвечают должным образом на стандарт медицинской помощи, имеют значительную заболеваемость, потребляют значительные медицинские расходы и, таким образом, представляют неудовлетворенную клиническую потребность.
Молекулярное фенотипирование сыграло важную роль в понимании биологии, лежащей в основе этих заболеваний.Таким образом, сейчас мы начинаем понимать роль различных цитокинов и иммунных эффекторных клеток, в частности цитокинов 2 типа и эозинофилов. ИЛ-5 был идентифицирован как ключевой фактор эозинофилопоэза, что привело к развитию множественных методов лечения, направленных на ИЛ-5 и эозинофилы. Эффективность этих препаратов указывает на жизненно важную роль эозинофилов при таких заболеваниях, как астма. Кроме того, существуют существенные доказательства роли ИЛ-13 (и ИЛ-4) в развитии эозинофилии и воспаления 2-го типа, полученных из моделей культур клеток in vitro, , моделей in vivo, животных и наблюдательных исследований на людях, что привело к интервенционным вмешательствам. исследования, направленные на эти пути при заболеваниях человека.Биологические препараты, нацеленные на путь IL-13, продемонстрировали эффективность, особенно в подгруппах пациентов с признаками эозинофильного заболевания. Текущие клинические испытания помогут глубже проанализировать вклад IL-13 в тканевую эозинофилию. Примечательно, что количество эозинофилов в крови используется в качестве биомаркера во многих из этих клинических исследований. Пациенты с «высоким» уровнем эозинофилов испытали больший клинический эффект от терапии против типа 2 по сравнению с пациентами с «низким» уровнем эозинофилов. Это также требует полного понимания роли эозинофилов в заболеваниях, вызываемых типом 2, а также определения механизмов, способствующих патологии заболевания у пациентов с низким уровнем воспаления типа 2 и эозинофилов.
Появление более совершенных моделей на мышах и продолжающиеся клинические испытания, нацеленные на несколько путей, включая IL-13, помогут лучше понять биологию эозинофилов и улучшить терапевтические стратегии для лечения эозинофильных расстройств в будущем.
Авторские взносы
ED, CH, KW и JA внесли существенный вклад в важный интеллектуальный контент, разработку рукописи и исправления. FC и JB также проводили эксперименты, анализировали и интерпретировали данные.Все авторы одобрили окончательный вариант рукописи.
Заявление о конфликте интересов
Авторы являются сотрудниками компании Genentech, Inc., входящей в группу компаний Roche, и могут иметь долю в компании Roche или названы соавторами патентных заявок, связанных с разработкой биологических методов лечения и биомаркеров для лечения астмы. Авторы не имеют других соответствующих аффилированных или финансовых связей с какой-либо организацией или организацией, имеющей финансовый интерес или финансовый конфликт с предметом или материалами, обсуждаемыми в рукописи, кроме тех, которые раскрыты.
Финансирование
Это исследование было поддержано Genentech, Inc.
Список литературы
4. Равин К.А., Лой М. Эозинофил в инфекции. Clin Rev Allergy Immunol (2016) 50 (2): 214–27. DOI: 10.1007 / s12016-015-8525-4
CrossRef Полный текст | Google Scholar
7. Houston JC, De Navasquez S, Trounce JR. Клинико-патологическое исследование смертельных случаев астматического статуса. Thorax (1953) 8 (3): 207–13. DOI: 10,1136 / thx.8.3.207
CrossRef Полный текст | Google Scholar
8. Ламас AM, Леон О.Г., Шлеймер Р.П. Глюкокортикоиды подавляют реакцию эозинофилов на гранулоцитарно-макрофагальный колониестимулирующий фактор. J Immunol (1991) 147 (1): 254–9.
PubMed Аннотация | Google Scholar
10. Минти А., Шалон П., Дерок Дж. М., Дюмон Х, Гиймот Дж. К., Кагад М. и др. Интерлейкин-13 — новый человеческий лимфокин, регулирующий воспалительные и иммунные реакции. Nature (1993) 362 (6417): 248–50.DOI: 10.1038 / 362248a0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Zhu Z, Homer RJ, Wang Z, Chen Q, Geba GP, Wang J, et al. Легочная экспрессия интерлейкина-13 вызывает воспаление, гиперсекрецию слизи, субэпителиальный фиброз, физиологические аномалии и продукцию эотаксина. J Clin Invest (1999) 103 (6): 779–88. DOI: 10.1172 / JCI5909
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Виллс-Карп М., Луимбази Дж., Сюй Х, Скофилд Б., Небен Т.Ю., Карп С.Л. и др.Интерлейкин-13: центральный медиатор аллергической астмы. Science (1998) 282 (5397): 2258–61. DOI: 10.1126 / science.282.5397.2258
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Нил Д.Р., Вонг С.Х., Беллози А., Флинн Р.Дж., Дейли М., Лэнгфорд Т.К. и др. Нуоциты представляют собой новый врожденный эффекторный лейкоцит, который обеспечивает иммунитет типа 2. Nature (2010) 464 (7293): 1367–70. DOI: 10.1038 / nature08900
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14.Ansel KM, Djuretic I, Tanasa B, Rao A. Регулирование дифференцировки Th3 и доступность локуса Il4. Annu Rev Immunol (2006) 24: 607–56. DOI: 10.1146 / annurev.immunol.23.021704.115821
CrossRef Полный текст | Google Scholar
16. Kasaian MT, Miller DK. IL-13 как терапевтическая мишень при респираторных заболеваниях. Biochem Pharmacol (2008) 76 (2): 147–55. DOI: 10.1016 / j.bcp.2008.04.002
CrossRef Полный текст | Google Scholar
17. Чандриани С., ДеПианто Д. Д., Н’Диай Э. Н., Аббас А. Р., Джекман Дж., Беверс Дж. И др.Эндогенно экспрессируемый IL-13RÎ ± 2 ослабляет опосредованные IL-13 ответы, но не активирует передачу сигналов в фибробластах легких человека. J Immunol (2014) 193 (1): 111–9. DOI: 10.4049 / jimmunol.1301761
CrossRef Полный текст | Google Scholar
18. Бадалян В., Томпсон Р., Аддо К., Бортвик Л.А., Фишер А.Дж., Орт Т. и др. Синергия TNF-α / IL-17 ингибирует биоактивность IL-13 посредством индукции IL-13RÎ ± 2. J Allergy Clin Immunol (2014) 134 (4): 975–8.e5. DOI: 10.1016 / j.jaci.2014.05.019
CrossRef Полный текст | Google Scholar
19. Вен Т., Бессе Дж. А., Минглер М.К., Фулкерсон П.С., Ротенберг М.Э. Система адаптивного переноса эозинофилов для прямой оценки легочного транспорта эозинофилов in vivo. Proc Natl Acad Sci U S. A (2013) 110 (15): 6067–72. DOI: 10.1073 / pnas.1220572110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Йоханссон М.В., Аннис Д.С., Мошер Д.Ф. α (M) β (2) интегрин-опосредованная адгезия и подвижность IL-5-стимулированных эозинофилов на периостине. Am J Respir Cell Mol Biol (2013) 48 (4): 503–10. DOI: 10.

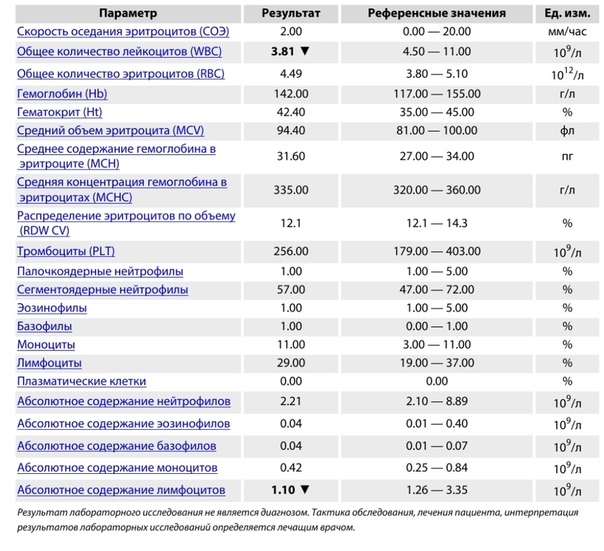

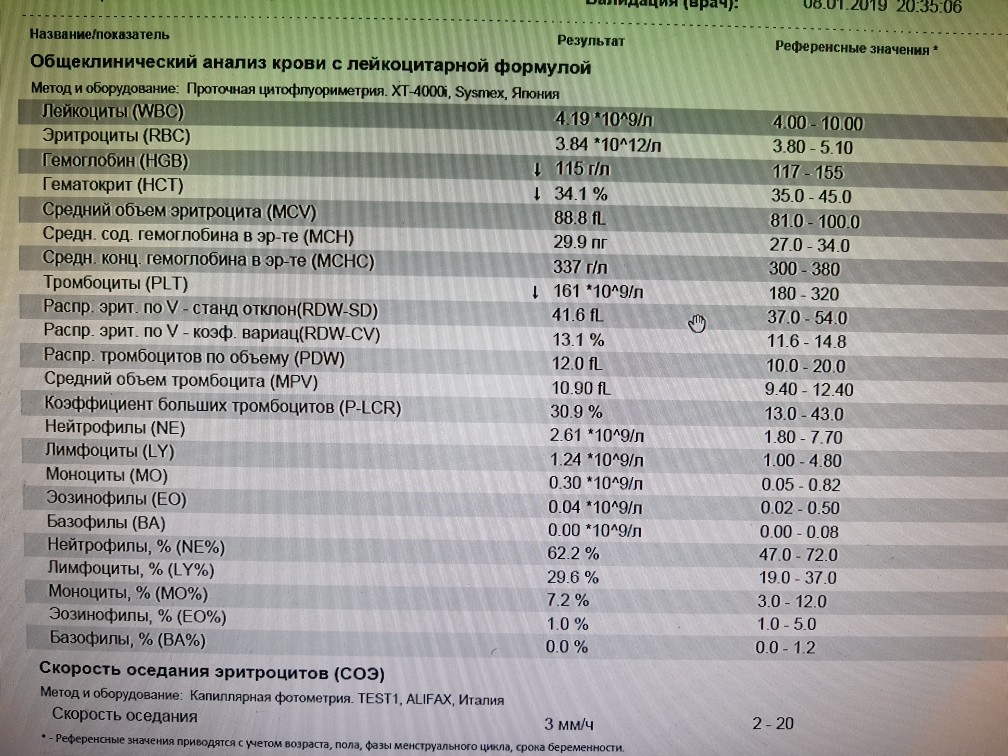 Это помогает измерить уровень эозинофилов, но поставить окончательный диагноз по этим анализам нельзя.
Это помогает измерить уровень эозинофилов, но поставить окончательный диагноз по этим анализам нельзя.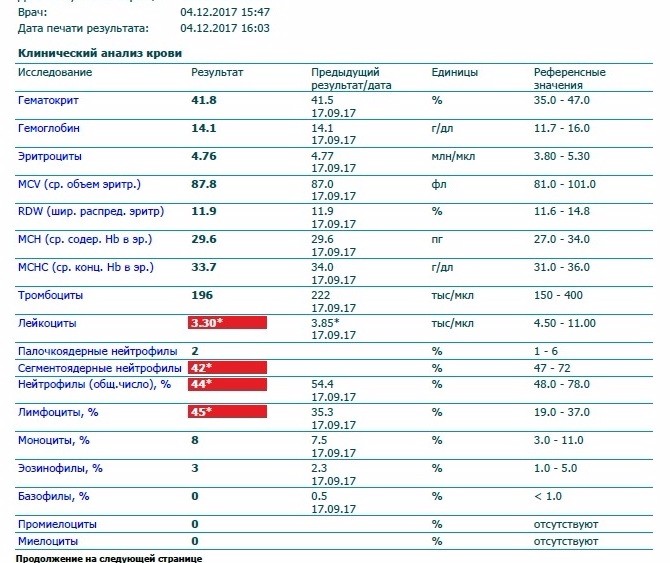 Обычно после устранения причины показатели нормализуются. Иногда количество эозинофилов может быть увеличено вследствие приема некоторых препаратов. Тогда следует отказаться от этих средств и все придет в норму.
Обычно после устранения причины показатели нормализуются. Иногда количество эозинофилов может быть увеличено вследствие приема некоторых препаратов. Тогда следует отказаться от этих средств и все придет в норму.

 Ссылка
Ссылка Выступают своего рода цементом для закупорки поврежденных сосудов.
Выступают своего рода цементом для закупорки поврежденных сосудов.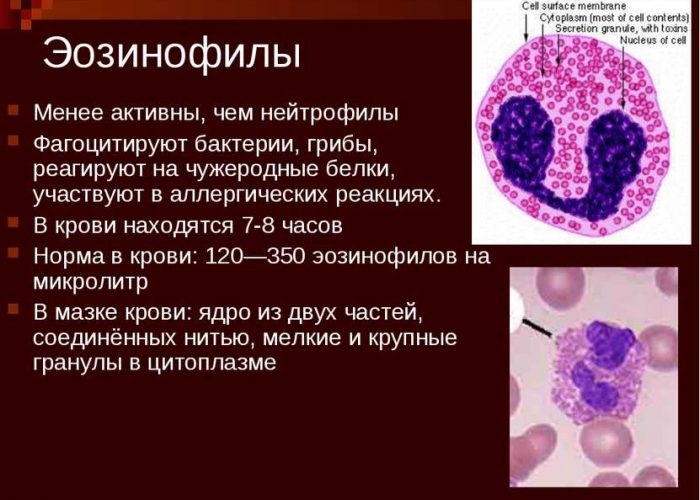 Но могут поглощать только относительно небольшие частицы вещества.
Но могут поглощать только относительно небольшие частицы вещества.
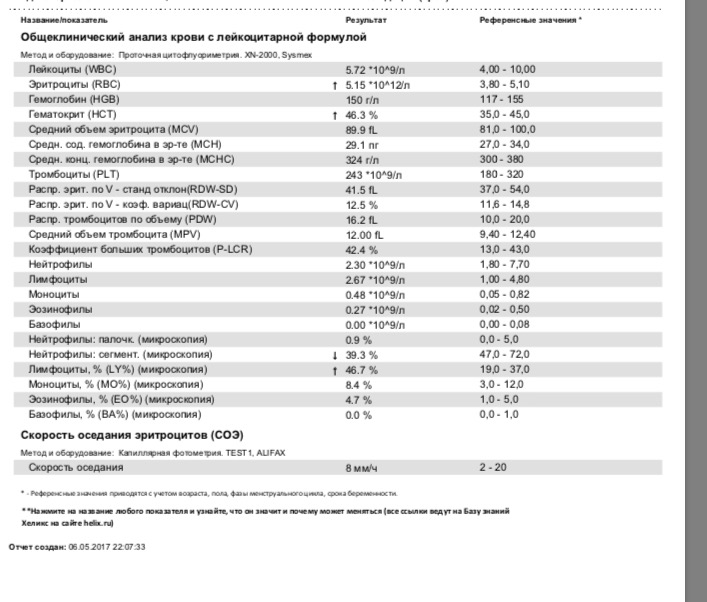 Которые затормозят интенсивность работы защитных сил организма. Поскольку чаще всего именно иммунитет атакует сосуды.
Которые затормозят интенсивность работы защитных сил организма. Поскольку чаще всего именно иммунитет атакует сосуды.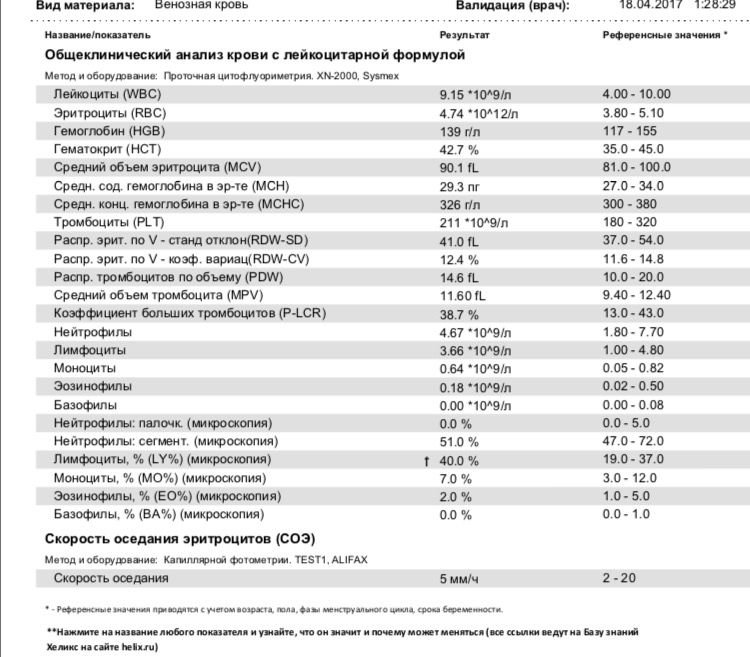 Поражение желудка.
Поражение желудка. Она же недостаточность работы надпочечников.
Она же недостаточность работы надпочечников.
 При систематических занятиях падение количества наблюдается постепенно.
При систематических занятиях падение количества наблюдается постепенно.