Статины и почему их не стоит бояться,
29 марта 2017 г.
Почему нужно принимать статины и не нужно их бояться?
Статины являются основным классом лекарственных средств, которые применяются для лечения пациентов с гиперлипидемиями и атеросклерозом.
За последние 15 лет проведены десятки рандомизированных клинических исследований со статинами. По их результатам было показано достоверное снижение сердечно-сосудистой и общей смертности независимо от пола, возраста, исходного уровня ХС.
В настоящее время в РФ зарегистрировано 6 препаратов этого класса: аторвастатин, ловастатин, симвастатин, правастатин, розувастатин и флувастатин.
Механизм действия и фармакологические эффекты.
Статины обладают как липидными, так и нелипидными (плейотропными) эффектами, к которым относят ативоспалительное, антипролиферативное и антиоксидантное действие. Снижение уровня ХС-ЛНизкой Плотности зависит от дозы статина. Каждое удвоение дозы приводит к дополнительному снижению уровня ХС-ЛНизкой Плотности на 6% (правило шести).
Влияние статинов на уровни TГ и ХС-ЛВысокой Плотности зависит от их исходных значений. Это связано с тем, что наряду со снижением уровня ХС-ЛНП, статины интенсифицируют процесс катаболизма ЛОНП и ЛПП, в составе которых есть ТГ. Статины снижают уровень ТГ в среднем на 15-20%.
Фармакокинетика статинов.
Основное место фармакологического действия всех статинов
Влияние терапии статинами на сердечно-сосудистую заболеваемость и смертность.
Результаты рандомизированных клинических исследований со статинами продемонстрировали достоверное снижение сердечно-сосудистой смертности, как в исследованиях по первичной, так и вторичной профилактике. В этих исследованиях, которые длились не менее 5 лет, принимали участие свыше 100 000 пациентов. Снижение уровня ХС-ЛНП на монотерапии статинами сопровождалось достоверным уменьшением частоты осложнений атеросклероза, включая сердечно-сосудистую смерть, нефатальный и фатальный Инфаркт Миокарда, МИ, периферический атеросклероз.
Статины и печень.
Пациентам с хроническими болезнями печени, неалкогольным стеатогепатитом или жировым гепатозом с нормальным уровнем печеночных ферментов терапия статинами не противопоказана.
Диетические рекомендации для снижения ОХС и ХС ЛПНП
|
Диетические рекомендации для снижения ОХС и ХС ЛПНП Употреблять предпочтительно |
Употреблять умеренно |
Употреблять редко в ограниченных количествах |
|
|||
|
Хлеб, крупы |
Из цельного зерна – 6 и более порций в день – количество зависит от ИМТ. 1 порция = 1 кусок хлеба, или 1 чашка (200 мл, 200 г) каши, или100г макаронных изделий или риса. |
Хлеб и макароны из рафинированной муки, белый рис, бисквит, кукурузные хлопья. |
Выпечка (булочки, круассаны) |
|
||
|
Овощи и фрукты |
Свежие и обработанные овощи, свежие и замороженные фрукты – не менее 5 порций в день. 1 порция: 1 чашка (200 г) свежих или вареных овощей, 1 яблоко, 1 банан, 1 апельсин, 1 груша, 2 киви, 2 сливы, 1 ломтик дыни или ананаса, 1 стакан сока
|
Сухофрукты, желе, джемы, консервированные овощи, фрукты, фруктовые чипсы |
Овощи, приготовлен-ные со сливочным маслом или соусами |
|
||
|
Бобовые |
Все (включая сою и соевый белок) – 3 – 4 порции в неделю. |
|||||
|
Мясо и рыба |
Постная и жирная рыба, птица без кожи – 100 г в день (рыбу желательно употреблять не менее 2-х раз в неделю, отдавая предпочтение рыбе северных морей) |
Постная говядина, баранина, свинина и телятина, морепродукты, моллюски |
Колбаса, сосиски, бекон, внутренние органы |
|||
|
Молочные продукты и яйца |
Снятое (обезжиренное) молоко и кисломолочные продукты – 1 чашка (200 мл), 30 г творога или сыра (с низким содержанием жира) в день. |
Молоко, другие молочные продукты, сыр с низким содержанием жира, |
Сыр, сливки, яичные желтки, цельное молоко и молочные продукты |
|||
|
Яйца |
Белок |
Желток 2-3 в неделю |
||||
|
Жиры, используемые для приготовления пищи, заправки к салатам |
Уксус, кетчуп, горчица, заправки, не содержащие жиров |
Растительные масла: подсолнечное, кукурузное — 2-3 чайные ложки, оливковое – не более 1 чайной ложки, мягкий маргарин (не более 5 г) майонез |
Сливочное масло, твердый маргарин, транс-жиры, пальмовое и кокосовое масла, свиной и бараний жир, заправки с яичными желтками. |
|||
|
Орехи, семечки |
Все |
Кокос |
||||
|
Сладости |
Низкокалорийные |
Сахар, мед, фруктоза, глюкоза, шоколад, конфеты |
Пирожное, мороженое |
|||
|
Приготовление пищи |
Гриль, варка, приготовление на пару |
Жарка, тушение |
Приготовление во фритюре |
|||
Заключение:
Нарушения липидного обмена являются одним из важных ФР развития и прогрессирования ССЗ. Своевременная и правильная диагностика гиперхолестеринемии — необходимый компонент рациональной профилактики и терапии атеросклероза.
Российское кардиологическое общество (РКО)
Национальное Общество по изучению Атеросклероза (НОА)
Российское общество кардиосоматической реабилитации и вторичной профилактики (РосОКР)
Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза
Российские рекомендации
V пересмотр.
Москва. 2012 год
Длительное применение розувастатина: критическая оценка пользы и рисков, сравнение с другими гиполипидемическими препаратами
В прямом сравнительном трайле розувастатин или аторвастатин применяли у пациентов с семейной гетерозиготной гиперхолестеринемией. Пациенты случайным образом были разделены на две группы с тем, чтобы получать 20 мг розувастатина или 20 мг аторвастатина. Через каждых 6 недель дозу удваивали таким образом, что к 12-18-й неделе была достигнута максимальная доза препаратов (80 мг). Во всех временных интервалах гиполипидемический эффект в виде снижения ЛПНП был существенно выше среди больных, принимавших розувастатин.

 В конце периода наблюдения выяснилось, что розувастатин снижает концентрацию ХС не-ЛПВП, апоВ и все липидные и аполипопротеидные соотношения (те, что подвергались оценке) в существенно большей степени, чем эквивалентные (мг) дозы аторвастатина и чем эквивалентные или более высокие дозы симвастатина и правастатина.
В конце периода наблюдения выяснилось, что розувастатин снижает концентрацию ХС не-ЛПВП, апоВ и все липидные и аполипопротеидные соотношения (те, что подвергались оценке) в существенно большей степени, чем эквивалентные (мг) дозы аторвастатина и чем эквивалентные или более высокие дозы симвастатина и правастатина.| Таблица 2. Эффективность статинов в различных дозировках в отношении снижения уровня ХС ЛПНП по сравнению с соответствующими базовыми показателями (после 6 недель терапии) | ||||
Суточная доза | 10 мг | 20 мг | 40 мг | 80 мг |
| Правастатин | -20% | -24% | -34% | — |
| Симвастатин | -28% | -35% | -41% | -46% |
| Аторвастатин | -38% | -43% | -48% | -51% |
| Розувастатин | -45% | -52% | -55% | — |
 Все участники были распределены на две группы: первые получали розувастатин в дозе 40 мг/день, вторые – аторвастатин по 80 мг/день в течение 6 недель. Несмотря на небольшие отличия, выяснилось, что розувастатин значительно более эффективно влияет на концентрации ЛПНП, мпЛПНП, соотношение ХС ЛПВП и ХС не-ЛПНП. При этом оба препарата примерно одинаковым образом снижали уровень ТГ.
В двух трайлах оценивалась эффективность терапии розувастатином после 52-недельного периода наблюдения. В первом двойном слепом мультицентровом исследовании приняли участие 412 пациентов с гиперлипидемией, которые получали фиксированные дозы розувастатина (5 или 10 мг/день) или аторвастатина (10 мг/день) в течение 12 недель. Если целевых показателей согласно NCEP ATP III не достигали, дозу корригировали (вплоть до максимальной – 80 мг/день). Через 12 недель оказалось, что розувастатин снижал уровень ЛПНП эффективнее, чем аторвастатин (47-53% и 44% соответственно).
Во втором подобном трайле 477 пациентов с гиперхолестеринемией получали розувастатин (5 или 10 мг/день), правастатин (20 мг) или симвастатин (20 мг) в течение 12 недель с последующим 40-недельным титрованием дозы (до 80 или 40 мг/день в зависимости от препарата).
Все участники были распределены на две группы: первые получали розувастатин в дозе 40 мг/день, вторые – аторвастатин по 80 мг/день в течение 6 недель. Несмотря на небольшие отличия, выяснилось, что розувастатин значительно более эффективно влияет на концентрации ЛПНП, мпЛПНП, соотношение ХС ЛПВП и ХС не-ЛПНП. При этом оба препарата примерно одинаковым образом снижали уровень ТГ.
В двух трайлах оценивалась эффективность терапии розувастатином после 52-недельного периода наблюдения. В первом двойном слепом мультицентровом исследовании приняли участие 412 пациентов с гиперлипидемией, которые получали фиксированные дозы розувастатина (5 или 10 мг/день) или аторвастатина (10 мг/день) в течение 12 недель. Если целевых показателей согласно NCEP ATP III не достигали, дозу корригировали (вплоть до максимальной – 80 мг/день). Через 12 недель оказалось, что розувастатин снижал уровень ЛПНП эффективнее, чем аторвастатин (47-53% и 44% соответственно).
Во втором подобном трайле 477 пациентов с гиперхолестеринемией получали розувастатин (5 или 10 мг/день), правастатин (20 мг) или симвастатин (20 мг) в течение 12 недель с последующим 40-недельным титрованием дозы (до 80 или 40 мг/день в зависимости от препарата). Через 52 недели большее число пациентов, получавших розувастатин (88% и 87,5% соответственно для разных режимов дозирования), достигли целевых показателей ЛПНП NCEP ATP III по сравнению с другими группами (правастатин – 60% и симвастатин – 73%).
В последние годы появились подтверждения теории о том, что «качество», а не «количество» ЛПНП оказывает влияние на кардиоваскулярный риск. Существует, по крайней мере, 4 подтипа частиц ЛПНП, причем повышенное содержание мпЛПНП ассоциируют с существенно более высоким кардиоваскулярным риском. На сегодня лишь в нескольких трайлах непосредственно изучалось влияние розувастатина на размеры ЛПНП и на их подклассы, но, вероятно, этот статин благоприятно влияет на упомянутые показатели.
Исследование JUPITER представляло собой рандомизированный двойной слепой контролируемый плацебо трайл, разработанный с тем, чтобы выяснить, снижает ли терапия розувастатином (20 мг/день) по сравнению с плацебо частоту основных кардиоваскулярных событий у 17 802 относительно здоровых людей с нормальным или низким уровнем ХС и повышенным уровнем СРП.
Через 52 недели большее число пациентов, получавших розувастатин (88% и 87,5% соответственно для разных режимов дозирования), достигли целевых показателей ЛПНП NCEP ATP III по сравнению с другими группами (правастатин – 60% и симвастатин – 73%).
В последние годы появились подтверждения теории о том, что «качество», а не «количество» ЛПНП оказывает влияние на кардиоваскулярный риск. Существует, по крайней мере, 4 подтипа частиц ЛПНП, причем повышенное содержание мпЛПНП ассоциируют с существенно более высоким кардиоваскулярным риском. На сегодня лишь в нескольких трайлах непосредственно изучалось влияние розувастатина на размеры ЛПНП и на их подклассы, но, вероятно, этот статин благоприятно влияет на упомянутые показатели.
Исследование JUPITER представляло собой рандомизированный двойной слепой контролируемый плацебо трайл, разработанный с тем, чтобы выяснить, снижает ли терапия розувастатином (20 мг/день) по сравнению с плацебо частоту основных кардиоваскулярных событий у 17 802 относительно здоровых людей с нормальным или низким уровнем ХС и повышенным уровнем СРП. Трайл был преждевременно остановлен после 1,9 года наблюдения, так как имелись несомненные доказательства снижения заболеваемости и смертности, ассоциированной с сердечно-сосудистыми событиями среди пациентов, получавших розувастатин. Частота первого основного сердечно-сосудистого события (несмертельный инфаркт, несмертельный инсульт, госпитализация по поводу нестабильной стенокардии, артериальная реваскуляризация или подтвержденная кардиоваскулярная смерть) составила 0,77 и 1,36 на 100 человеко-лет в группах розувастатина и плацебо соответственно.
Трайл был преждевременно остановлен после 1,9 года наблюдения, так как имелись несомненные доказательства снижения заболеваемости и смертности, ассоциированной с сердечно-сосудистыми событиями среди пациентов, получавших розувастатин. Частота первого основного сердечно-сосудистого события (несмертельный инфаркт, несмертельный инсульт, госпитализация по поводу нестабильной стенокардии, артериальная реваскуляризация или подтвержденная кардиоваскулярная смерть) составила 0,77 и 1,36 на 100 человеко-лет в группах розувастатина и плацебо соответственно.При анализе 15 548 пациентов, участвующих в трайле JUPITER (87% всей когорты), выяснилось, что частота сосудистых событий среди лиц, принимавших розувастатин и достигших ЛПНП < 1,8 ммоль/л, уменьшилась на 55%, а среди тех, которые достигли СРП < 2 мг/л, – на 62%. В целом, частота сосудистых событий уменьшилась на 65% среди пациентов, достигших показателей ЛПНП < 1,8 ммоль/л и СРП < 2 мг/л.
Безопасность Ингибиторы ГМГ-КоА-редуктазы в целом безопасны, особенно в свете способности этого класса препаратов снижать заболеваемость и смертность. Однако отказ от церивастатина из-за высокой частоты рабдомиолиза породил настороженность в отношении развития этого редкого осложнения.
С 1997 по 2000 г. сообщалось о 387 случаях рабдомиолиза, ассоциированного с терапией церивастатином, что составляет 50% всех случаев, о которых упоминалось за указанный период. Для сравнения доля остальных статинов в структуре этого осложнения составила для симвастатина 24%, аторвастатина – 11%, правастатина – 9%. По недавним данным, на 1 млн назначений всех статинов приходится 0,15 летальных случаев, обусловленных рабдомиолизом. Этот же показатель для церивастатина составляет 3,16. Такой высокий процент этого осложнения при терапии церивастатином, видимо, обусловлен высокой липофильностью и проницаемостью во внепеченочные ткани. При терапии статинами существует минимальный риск развития миопатии.
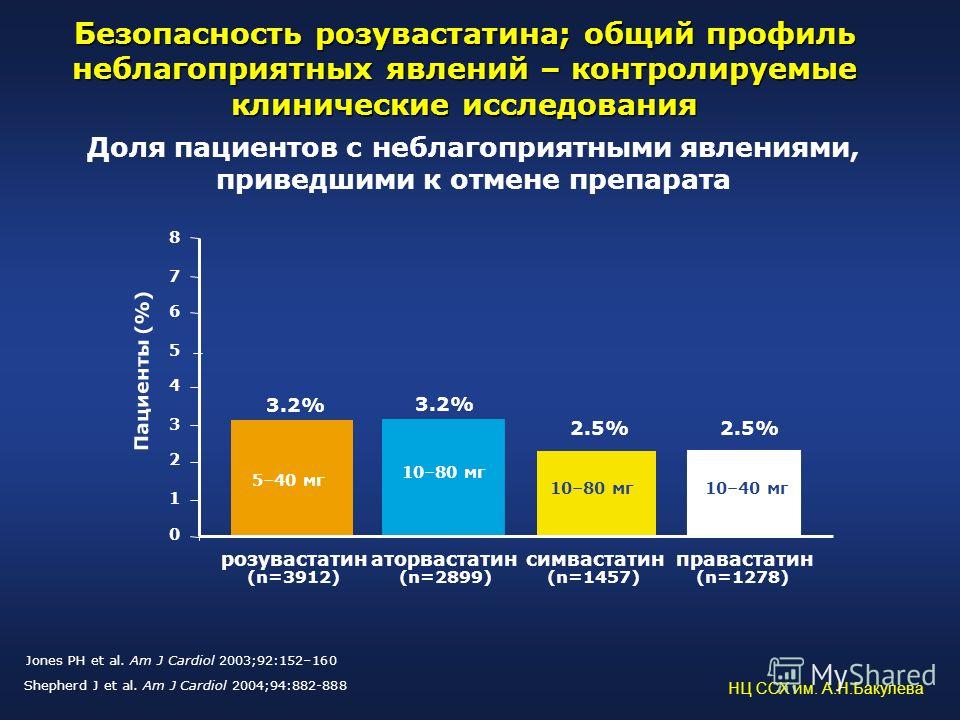
Частота побочных эффектов при лечении розувастатином сравнима с таковой для других статинов. Сообщается, что наиболее частыми побочными эффектами (частота – 5%), согласно данным контролируемых трайлов, были: фарингит (12,2%), боль (6,7%), головная боль (6,6%), синдром, подобный простуде (5,3%) и миалгия (5,1%).
Однако отказ от церивастатина из-за высокой частоты рабдомиолиза породил настороженность в отношении развития этого редкого осложнения.
С 1997 по 2000 г. сообщалось о 387 случаях рабдомиолиза, ассоциированного с терапией церивастатином, что составляет 50% всех случаев, о которых упоминалось за указанный период. Для сравнения доля остальных статинов в структуре этого осложнения составила для симвастатина 24%, аторвастатина – 11%, правастатина – 9%. По недавним данным, на 1 млн назначений всех статинов приходится 0,15 летальных случаев, обусловленных рабдомиолизом. Этот же показатель для церивастатина составляет 3,16. Такой высокий процент этого осложнения при терапии церивастатином, видимо, обусловлен высокой липофильностью и проницаемостью во внепеченочные ткани. При терапии статинами существует минимальный риск развития миопатии.
Частота побочных эффектов при лечении розувастатином сравнима с таковой для других статинов. Сообщается, что наиболее частыми побочными эффектами (частота – 5%), согласно данным контролируемых трайлов, были: фарингит (12,2%), боль (6,7%), головная боль (6,6%), синдром, подобный простуде (5,3%) и миалгия (5,1%). Частота элевации аланинаминотрансферазы (АЛТ) составила 0,5%, а встречаемость миопатии (увеличение КФК в 10 раз и более с появлением мышечных симптомов в виде слабости, боли или повышенной чувствительности) – 0,2%. Все случаи миопатии развивались у пациентов, которые получали розувастатин в дозе 80 мг/день, а повышения КФК регрессировали после отмены препарата.
В ретроспективном когортном исследовании сравнивали частоту госпитализаций, связанных с рабдомиолизом, миопатией, почечной или печеночной дисфункцией, и показатель внутригоспитальной летальности более чем у 48 тыс. пациентов, принимавших розувастатин и другие статины. Выяснилось, что нет отличий в частоте госпитализации, связанной с почечной или печеночной дисфункцией и летальностью при терапии розувастатином и другими статинами. Инцидентность рабдомиолиза и миопатии была очень низкой для всех статинов – настолько низкой, что нельзя было сделать достоверных выводов о различиях между препаратами. Частота рабдомиолиза на 1 тыс. человеко-лет составила 0,1 при лечении розувастатином и 0,06 – другими статинами, а миопатии – 0,2 и 0 соответственно.
Частота элевации аланинаминотрансферазы (АЛТ) составила 0,5%, а встречаемость миопатии (увеличение КФК в 10 раз и более с появлением мышечных симптомов в виде слабости, боли или повышенной чувствительности) – 0,2%. Все случаи миопатии развивались у пациентов, которые получали розувастатин в дозе 80 мг/день, а повышения КФК регрессировали после отмены препарата.
В ретроспективном когортном исследовании сравнивали частоту госпитализаций, связанных с рабдомиолизом, миопатией, почечной или печеночной дисфункцией, и показатель внутригоспитальной летальности более чем у 48 тыс. пациентов, принимавших розувастатин и другие статины. Выяснилось, что нет отличий в частоте госпитализации, связанной с почечной или печеночной дисфункцией и летальностью при терапии розувастатином и другими статинами. Инцидентность рабдомиолиза и миопатии была очень низкой для всех статинов – настолько низкой, что нельзя было сделать достоверных выводов о различиях между препаратами. Частота рабдомиолиза на 1 тыс. человеко-лет составила 0,1 при лечении розувастатином и 0,06 – другими статинами, а миопатии – 0,2 и 0 соответственно. Безопасность и переносимость розувастатина оценивали, основываясь на данных 16 876 пациентов, которые в рамках мультинациональной программы получали препарат в дозе 5-40 мг/день. Побочные эффекты встречались у 52,1% пациентов, которые получали розувастатин, а среди получавших плацебо – у 51,8%. Во всех сравнительных контролируемых трайлах профиль безопасности розувастатина в дозе 5-40 мг был аналогичным таковому для других статинов (аторвастатин – 10-80 мг, симвастатин – 10-80 мг, правастатин – 10-40 мг). Клинически значимые повышения АЛТ были нетипичны в группе розувастатина и препаратов сравнения, а повышение КФК в 10 раз и более от верхней границы нормы имело место у 0,3% пациентов, получавших розувастатин и другие статины. Миопатия, которая, вероятно, связана с лечением, встречалась у 0,03% пациентов, получавших розувастатин в дозе 5-40 мг. Частота позитивной протеинурии при терапии розувастатином в дозе 5-40 мг соответствовала таковой при терапии другими статинами, но наличие протеинурии не было предиктивным в отношении развития острой или хронической почечной патологии.
Безопасность и переносимость розувастатина оценивали, основываясь на данных 16 876 пациентов, которые в рамках мультинациональной программы получали препарат в дозе 5-40 мг/день. Побочные эффекты встречались у 52,1% пациентов, которые получали розувастатин, а среди получавших плацебо – у 51,8%. Во всех сравнительных контролируемых трайлах профиль безопасности розувастатина в дозе 5-40 мг был аналогичным таковому для других статинов (аторвастатин – 10-80 мг, симвастатин – 10-80 мг, правастатин – 10-40 мг). Клинически значимые повышения АЛТ были нетипичны в группе розувастатина и препаратов сравнения, а повышение КФК в 10 раз и более от верхней границы нормы имело место у 0,3% пациентов, получавших розувастатин и другие статины. Миопатия, которая, вероятно, связана с лечением, встречалась у 0,03% пациентов, получавших розувастатин в дозе 5-40 мг. Частота позитивной протеинурии при терапии розувастатином в дозе 5-40 мг соответствовала таковой при терапии другими статинами, но наличие протеинурии не было предиктивным в отношении развития острой или хронической почечной патологии. Однако как кратко-, так и долгосрочную терапию розувастатином ассоциируют с небольшим повышением скорости клубочковой фильтрации.
Однако как кратко-, так и долгосрочную терапию розувастатином ассоциируют с небольшим повышением скорости клубочковой фильтрации.В другом обсервационном трайле оценивали постмаркетинговую безопасность розувастатина. Основываясь на данных 11 680 пациентов (средняя длительность лечения – 9,8 месяцев) оказалось, что розувастатин хорошо переносится. Миалгия являлась самой частой причиной отмены препарата. Патологические показатели печеночных функций встречались в 2,5 раз чаще у пациентов, получавших розувастатин в дозе 40 мг/день, чем у тех, которые получали лишь 10 мг/день. В этой когорте не сообщалось о случаях рабдомиолиза.
Противовоспалительные эффекты розувастатина Недавние исследования указывают на множество механизмов, посредством которых статины снижают сердечно-сосудистый риск. В частности, ингибиторы ГМГ-КоА-редуктазы уменьшают инцидентность ИБС, улучшают эндотелиальную функцию, приводят к регрессу гипертрофии левого желудочка и препятствуют ремоделированию, замедляют атеросклеротический процесс, снижают сывороточные концентрации провоспалительных цитокинов. Недавно в одном из трайлов in vitro изучали влияние статинов на мононуклеарные клетки периферической крови и фибробластоподобные синовиоциты у 25 пациентов с ревматоидным артритом и у 20 здоровых доноров. При стимуляции фибробластоподобных клеток аторвастатином отмечалось существенное угнетение экспрессии провоспалительных цитокинов и хемокинов (IL-6, IL-8), что отражает выраженное противовоспалительное влияние аторвастатина in vitro при ревматоидном артрите. Более того, симвастатин и аторвастатин ингибируют СРП-индуцированную секрецию хемокинов, экспрессию молекул межклеточной адгезии (ICAM-1) и клеточную миграцию.
Влияние розувастатина на плазменные маркеры воспаления, концентрацию ингибиторов эндогенной NO-синтазы и форм реактивного кислорода, вырабатываемого циркулирующими лейкоцитами, изучали у нормо- и гипертензивных крыс. В эксперименте розувастатин снижал уровень провоспалительных цитокинов, повышал концентрацию IL-4 и уменьшал образование реактивных форм кислорода в циркулирующих моноцитах гипертензивных крыс.
Недавно в одном из трайлов in vitro изучали влияние статинов на мононуклеарные клетки периферической крови и фибробластоподобные синовиоциты у 25 пациентов с ревматоидным артритом и у 20 здоровых доноров. При стимуляции фибробластоподобных клеток аторвастатином отмечалось существенное угнетение экспрессии провоспалительных цитокинов и хемокинов (IL-6, IL-8), что отражает выраженное противовоспалительное влияние аторвастатина in vitro при ревматоидном артрите. Более того, симвастатин и аторвастатин ингибируют СРП-индуцированную секрецию хемокинов, экспрессию молекул межклеточной адгезии (ICAM-1) и клеточную миграцию.
Влияние розувастатина на плазменные маркеры воспаления, концентрацию ингибиторов эндогенной NO-синтазы и форм реактивного кислорода, вырабатываемого циркулирующими лейкоцитами, изучали у нормо- и гипертензивных крыс. В эксперименте розувастатин снижал уровень провоспалительных цитокинов, повышал концентрацию IL-4 и уменьшал образование реактивных форм кислорода в циркулирующих моноцитах гипертензивных крыс. Изучалось влияние розувастатина на экспрессию СРП в гепатоцитах человека. Результаты эксперимента указывают на прямое ингибирующее влияние розувастатина на IL-6-индуцированную экспрессию СРП в культуре клеток гепатомы и гепатоцитах человека. Возможно, статины снижают уровень СРП путем угнетения его образования в печени, а не из-за системных противовоспалительных эффектов.
Изучалось влияние розувастатина на экспрессию СРП в гепатоцитах человека. Результаты эксперимента указывают на прямое ингибирующее влияние розувастатина на IL-6-индуцированную экспрессию СРП в культуре клеток гепатомы и гепатоцитах человека. Возможно, статины снижают уровень СРП путем угнетения его образования в печени, а не из-за системных противовоспалительных эффектов.Противовоспалительные свойства розувастатина и других ингибиторов ГМГ-КоА-редуктазы могут быть исключительно полезны в клинике и требуют дальнейшего изучения.
Выводы Наиболее адекватный алгоритм фармакотерапии у пациентов с гиперхолестеринемией приведен на рисунке. Розувастатин может рассматриваться как ингибитор ГМГ-КоА-редуктазы второго поколения с уникальными фармакокинетическими и фармакодинамическими свойствами. Его химическая структура делает возможными дополнительные взаимодействия с энзимом, обусловливая более тесную связь. Исследования in vitro показали высокую степень активного транспорта в гепатоциты и наименьший IC50 для синтеза стиролов в гепатоцитах. Как следствие, розувастатин в дозе 10-80 мг оказался более эффективным липидснижающим средством по сравнению с миллиграмм-эквивалентными дозами с аторва-, симва- и правастатином. Более того, низкая липофильность розувастатина обусловливает низкую степень проникновения во внепеченочные ткани (например, эндотелиальные клетки пупочной вены и фибробласты) и меньший риск миотоксичности. В метаболизме розувастатина ферменты системы Р450 принимают незначительное участие, поэтому риск лекарственных взаимодействий с препаратами, которые расщепляет данная система, низок. Этот статин хорошо переносится, его профиль безопасности сравним с таковыми для других доступных на сегодня статинов. Кроме того, в экспериментах in vitro розувастатин проявляет выраженные противовоспалительные свойства. Таким образом, розувастатин может быть очень полезен в лечении гиперлипидемии.
Как следствие, розувастатин в дозе 10-80 мг оказался более эффективным липидснижающим средством по сравнению с миллиграмм-эквивалентными дозами с аторва-, симва- и правастатином. Более того, низкая липофильность розувастатина обусловливает низкую степень проникновения во внепеченочные ткани (например, эндотелиальные клетки пупочной вены и фибробласты) и меньший риск миотоксичности. В метаболизме розувастатина ферменты системы Р450 принимают незначительное участие, поэтому риск лекарственных взаимодействий с препаратами, которые расщепляет данная система, низок. Этот статин хорошо переносится, его профиль безопасности сравним с таковыми для других доступных на сегодня статинов. Кроме того, в экспериментах in vitro розувастатин проявляет выраженные противовоспалительные свойства. Таким образом, розувастатин может быть очень полезен в лечении гиперлипидемии.Перевод подготовил К. Кремец.
Статья печатается в сокращении.
Впервые опубликована в журнале Drug, Healthcare and Patient Safety, 2009, Vol. 1, P. 25-33.
1, P. 25-33.
1 Department of Internal Medicine, Geriatrics and Nephrologic Diseases, Section of Infectious Diseases, «Alma Mater Studiorum» University of Bologna, S. Orsola-Malpighi Hospital, Bologna, Italy.
Статины: совместимость и безопасность при лечении больных ишемической болезнью сердца
В.В. Бугаенко, ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» НАМН Украины, г. Киев
Атеросклероз является хроническим прогрессирующим заболеванием, характеризующимся непрерывным накоплением атероматозных бляшек в стенках артерий. Во всех современных руководствах как стратификация риска сердечно-сосудистых заболеваний, так и цель назначения липидоснижающей терапии основаны на определении и изучении уровней липидов: общего холестерина сыворотки (ОХС), липопротеинов низкой плотности (ХС-ЛПНП), липопротеинов очень низкой плотности (ХС-ЛПОНП), триглицеридов (ТГ).
Нарушения липидного обмена – один из важнейших факторов риска развития и прогрессирования сердечно-сосудистых заболеваний. Современная диагностика гиперлипидемий является необходимым условием организации рациональной профилактики и терапии кардиоваскулярных заболеваний.
Современная диагностика гиперлипидемий является необходимым условием организации рациональной профилактики и терапии кардиоваскулярных заболеваний.
Холестерин, триглицериды, фосфолипиды трансформируются в липидно-белковые комплексы – липопротеины (ЛП).
Дислипопротеинемия – это разнообразные нарушения спектра ЛП в сыворотке крови.
Фенотип гиперлипидемии определяется по классификации ВООЗ. Приведенные в таблице 1 данные позволяют судить о характере нарушений липидного спектра крови.
|
Общий ХС, ммоль/л (мг/дл) |
|
|
< 5,2 (< 200) |
Оптимальный |
|
5,2-6,1 (200-239) |
Пограничный |
|
> 6,2 (> 240) |
Высокий |
|
ХС-ЛПНП, ммоль/л (мг/дл) |
|
|
< 2,6 (≤ 100) |
Оптимальный |
|
2,6-3,3 (100-129) |
Пограничный |
|
3,4-4,0 (130-159) |
Повышенный |
|
4,1-4,8 (160-189) |
Высокий |
|
> 4,9 (≥ 190) |
Очень высокий |
|
ХС-ЛПОНП, ммоль/л (мг/дл) |
|
|
< 1 (< 40) |
Низкий |
|
> 1,6 (≥ 60) |
Высокий |
|
ТГ, ммоль/л (мг/дл) |
|
|
< 1/7 (< 150) |
Нормальный |
|
< 1,7-2,2 (150-199) |
Пограничный |
|
2,3-5,7 (200-499) |
Высокий |
|
≥ 5,7 (≥ 500) |
Очень высокий |
Примечания: ХС – холестерин; ХС-ЛПНП – липопротеины низкой плотности; ХС-ЛПОНП – липопротеины очень низкой плотности; ТГ – триглицериды. |
|
У больных ишемической болезнью сердца (ИБС) чаще всего имеют место следующие особенности нарушений липидного состава крови: содержание ОХС умеренно повышено или высокое, ХС-ЛПНП – повышены или незначительно повышены, но даже при этом специальном исследовании обнаруживают мелкие, плотные, легко окисляющиеся частицы ЛПНП типа В. Эти частицы легко проникают в субэндотелиальное пространство, активно захватываются макрофагами и таким образом инициируют атеросклеротический процесс. Содержание ТГ – нормальное или умеренно повышенное, а холестерин липопротеинов высокой плотности (ХС-ЛПВП) – на уровне нижней границы нормы или снижены. Таким образом, у больных ИБС преобладает фенотип IIa и IIb по классификации D. Frederickson (ВООЗ, 1970).
Оценка индивидуального фатального риска развития сердечно-сосудистых заболеваний в ближайшие 10 лет у лиц без клинических проявлений атеросклероза проводится по таблице SCORE (Systemic CОronary Risk Evaluation). Эта таблица разработана на основании результатов 12 эпидемиологических исследований с участием 205 178 человек. По шкале SCORE оценка риска производится в зависимости от пола, возраста, статуса курильщика, систолического артериального давления и концентрации ОХС.
Эта таблица разработана на основании результатов 12 эпидемиологических исследований с участием 205 178 человек. По шкале SCORE оценка риска производится в зависимости от пола, возраста, статуса курильщика, систолического артериального давления и концентрации ОХС.
Риск считается очень высоким, если при проекции данных пациента на карту SCORE он составляет более 10%, средним – в пределах 5-10 % и низким – менее 5 %.
В тех случаях, когда определяется очень высокий риск или высокий риск, необходимо проводить активные профилактические и лечебные мероприятия, направленные на устранение и коррекцию факторов риска.
В ряде исследований уже показано большее, чем основанное на определении содержания ОХС, прогностическое значение уровней проатерогенного аполипопротеина В100 (апоВ), антиатерогенного аполипопротеина А1 (апоА1) и их соотношения (апоВ/апоА1). Поэтому в 2008 г. Американская ассоциация диабета и Американская коллегия кардиологов заявили, что определение уровня апоB является необходимым дополнительным тестом при оценке адекватности терапии статинами.
Индекс апоВ/апоА1 показал значительно больший атрибутивный популяционный риск инфаркта миокарда – 54,0% (95% доверительный интервал [ДИ] – 50,6-57,4) в сравнении с такими традиционно используемыми индексами атерогенности, как ОХС/ХС-ЛПВП (31,95%; ДИ – 27,6-36,4) и ХС-ЛПНП/ХС-ЛПВП (37%) (р < 0,001).
Среди апоВ-содержащих ЛП наибольшее значение имеют ХС-ЛПОНП, которые продуцируются и секретируются гепатоцитами и активно участвуют в атерогенезе.
Существует две основные формы ЛПОНП: ЛПОНП1 и ЛПОНП2, которые отличаются размерами молекулы и содержанием ТГ. В настоящее время значение ЛПНП и других апоВ-содержащих ЛП в формировании и прогрессировании атеросклероза доказано, но при этом до сих пор остаются мало изученными внутренние молекулярные и клеточные механизмы.
В связи с этим существует несколько гипотез, объясняющих роль ЛПНП в процессах атерогенеза.
Гипотеза «ответ на повреждение» предполагает нарушение целостности эндотелия сосудов посредством инфильтрации ЛПНП, возникновение локальной воспалительной реакции, формирование дисфункции эндотелия и появление атеромы.
В соответствии с другой гипотезой «ответ на окислительный стресс», модифицированные посредством пероксидации ЛП оказывают воздействие на артериальную стенку и способствуют формированию атеромы [25, 26].
Статины являются основными препаратами в лечении гиперлипидемий IIa, IIb фенотипов. В рандомизированных клинических исследованиях была продемонстрирована их высокая эффективность по снижению содержания ОХС и ХС-ЛПНП. В этих же исследованиях наблюдали снижение частоты повторных осложнений ИБС: инфаркта миокарда, нестабильной стенокардии, внезапной смерти более чем на 25-40%. Снижалась смертность и от других причин [5, 8].
В Украине зарегистрированы все основные производимые в мире статины: ловастатин, правастатин, симвастатин, флувастатин, аторвастатин, розувастатин.
Ловастатин, правастатин, симвастатин были выделены из культуры грибов Aspergillus terrens, все остальные – получены синтетическим путем. Симвастатин и ловастатин – липофильные средства; флувастатин обладает промежуточной липофильностью; розувастатин, аторвастатин и правастатин – менее липофильны, что и определяет их способность проникать через клеточные мембраны (табл. 2).
2).
Свойства |
Ловастатин |
Симвастатин |
Правастатин |
Флувастатин |
Аторвастатин |
Розувастатин |
|
Время достижения максимальной концентрации в крови, ч |
2-4 |
1,3-2,4 |
0,9-1,6 |
0,5-1 |
2-3 |
3 |
|
Растворимость |
Липофильный |
Липофильный |
Гидрофильный |
Липофильный |
Липофильный |
Гидрофильный |
|
Метаболизация печенью, % |
> 70 |
78-87 |
46-66 |
> 68 |
70 |
63 |
|
Период полужизни в плазме, ч |
2-3 |
2-3 |
1,3-2,8 |
0,5-2,3 |
15-30 |
20 |
|
Интенсивность всасывания, % |
30 |
60-80 |
34 |
98 |
30 |
Умеренное |
|
Биодоступность, % |
5 |
5 |
18 |
19-29 |
12 |
20 |
Механизм действия всех статинов обусловлен подавлением основного фермента, участвующего в синтезе ХС (катализирующего превращение ГМГ-КоА [β-гидрокси-β-метилглутарил-КоА] в мевалоновую кислоту) – ГМГ-КоА-редуктазы печени. Поскольку мевалоновая кислота является одним из предшественников в синтезе холестерина, то в результате воздействия статинов в печеночных клетках возникает дефицит холестерина. В ответ на это в клетках увеличивается экспрессия поверхностных рецепторов, связывающих ЛПНП, при этом концентрация последних в плазме крови снижается.
Поскольку мевалоновая кислота является одним из предшественников в синтезе холестерина, то в результате воздействия статинов в печеночных клетках возникает дефицит холестерина. В ответ на это в клетках увеличивается экспрессия поверхностных рецепторов, связывающих ЛПНП, при этом концентрация последних в плазме крови снижается.
Основными переносчиками холестерина в организме являются ЛПНП. Поэтому, сравнивая различные статины между собой, всегда следует обращать внимание на то, в каких дозах и в какой мере они способны снижать уровень ЛПНП в плазме крови. В таблице 3 приведены начальные и примерные дозы статинов, необходимые для снижения уровня ХС-ЛПНП на 30-40%, что является обязательным условием для получения клинического эффекта терапии.
Статины, дозы (мг) |
Изменения в уровне липидов, |
|||||||
|
Аторвастатин |
Симвастатин |
Ловастатин |
Правастатин |
Розувастатин |
Всего |
ЛПНП |
ЛПВП |
ТГ |
|
— |
10 |
20 |
20 |
5 |
-22 |
-27 |
4-8 |
-10-15 |
|
10 |
20 |
40 |
40 |
10 |
-27 |
-34 |
4-8 |
-10-20 |
|
20 |
40 |
80 |
— |
— |
-32 |
-41 |
4-8 |
-15-20 |
|
40 |
80 |
— |
— |
— |
-37 |
-48 |
4-8 |
-20-30 |
|
80 |
— |
— |
— |
— |
-42 |
-55 |
4-8 |
-25-35 |
Примечания. ЛПНП – липопротеины низкой плотности; ЛПВП – липопротеины высокой плотности; ТГ – триглицериды. ЛПНП – липопротеины низкой плотности; ЛПВП – липопротеины высокой плотности; ТГ – триглицериды. |
||||||||
Следует помнить, что увеличение стандартных доз оказывает весьма незначительное дополнительное гиполипидемическое действие, которое составляет примерно 6-7% при повышении дозы вдвое [24], что может привести к увеличению риска развития побочных эффектов (так называемое «правило 6-ти»).
Анализ данных доказательной медицины относительно эффективности статинов у больных ИБС позволяет сделать следующие выводы:
- статины показаны всем больным ИБС;
- чем выше сердечно-сосудистый риск больного, тем более интенсивной должна быть терапия [15];
- обеспечение снижения уровня ХС-ЛПНП не менее чем на 1 ммоль/л (больше 30%) является более важной целью, чем достижение некоего «целевого» уровня этого показателя (рекомендации АНА/АСС 2006 г.).
Во всех проводимых клинических исследованиях установлена эффективность статинов и отмечено достоверное снижение смертности и летальности, вызванных кардиоваскулярными причинами, у больных ИБС [15, 16].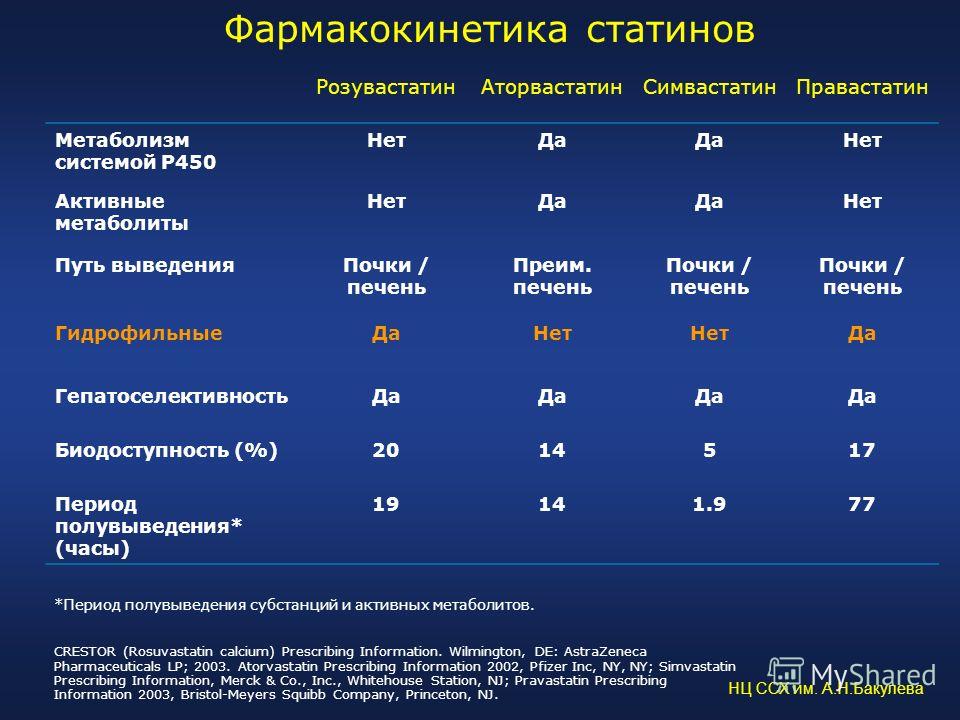 |
В исследовании ASTEROID (A Study to Evaluate the Effect of Rosuvastatin on Intervascular Ultrasound-Derived Coronary Ateroma Burden, 2006) было доказано благоприятное влияние статинов на атеросклеротическую бляшку, увеличение ее стабильности и как результат – снижение риска коронарных осложнений, суммарное улучшение прогноза [1, 19]. Анализ данных исследований (TNT, Corona, Gissi-HF) показал, что у больных ИБС с выраженной дисфункцией левого желудочка и развитием явлений хронической сердечной недостаточности (СН) III-IV функционального класса (ФК) по классификации NYHA отмечена хорошая переносимость и безопасность статинов.
При этом следует помнить, что снижать уровень ОХС до ≤ 3,5 ммоль/л не следует, поскольку у таких больных это рассматривается как маркер неблагоприятного прогноза (вследствие известного феномена мальнутриции [malnutrition]).
У пациентов с ИБС и СН I-II ФК при назначении статинов отмечено снижение риска прогрессирования СН (41% против 13%) [30]. Изучая прогноз у больных с СН, исследователи пришли к выводу, что позитивный эффект статинов (аторвастатина), скорее всего, не связан с общим снижением количества ишемических кардиоваскулярных событий, а, возможно, ассоциируется с редукцией плазменной концентрации ХС-ЛПНП [30]. Так, в целом, каждое снижение риска госпитализаций по поводу СН на 0,6% соответствует регрессу плазменного пула ХС-ЛПНП на 1 мг/дл (0,259 ммоль/л) (р = 0,007). Но в связи с отсутствием прямой корреляционной связи авторы [30] не исключают и плейотропное действие препарата. Тогда как другие исследователи [12, 13] показали, что использование статинов у больных с СН (n = 24 598) не только позволяет добиться существенного снижения риска госпитализаций по поводу СН (отношение рисков [ОР] – 0,79; 95% ДИ – 0,74-0,85), но и приводит к 24% снижению риска смертельного исхода (ОР – 0,76; 95% ДИ – 0,75-0,80), что рассматривается как класс-специфический эффект препаратов.
Изучая прогноз у больных с СН, исследователи пришли к выводу, что позитивный эффект статинов (аторвастатина), скорее всего, не связан с общим снижением количества ишемических кардиоваскулярных событий, а, возможно, ассоциируется с редукцией плазменной концентрации ХС-ЛПНП [30]. Так, в целом, каждое снижение риска госпитализаций по поводу СН на 0,6% соответствует регрессу плазменного пула ХС-ЛПНП на 1 мг/дл (0,259 ммоль/л) (р = 0,007). Но в связи с отсутствием прямой корреляционной связи авторы [30] не исключают и плейотропное действие препарата. Тогда как другие исследователи [12, 13] показали, что использование статинов у больных с СН (n = 24 598) не только позволяет добиться существенного снижения риска госпитализаций по поводу СН (отношение рисков [ОР] – 0,79; 95% ДИ – 0,74-0,85), но и приводит к 24% снижению риска смертельного исхода (ОР – 0,76; 95% ДИ – 0,75-0,80), что рассматривается как класс-специфический эффект препаратов.
Проанализировав течение СН у больных с СН неишемического генеза (n = 551) с фракцией изгнания левого желудочка < 40%, (средняя величина – 25%), авторы [12, 13] установили, что одногодичная выживаемость, не связанная с ургентной трансплантацией сердца была достоверно выше в группе пациентов, принимавших статины (80% против 57%; ОР – 0,35; ДИ – 0,19-0,62).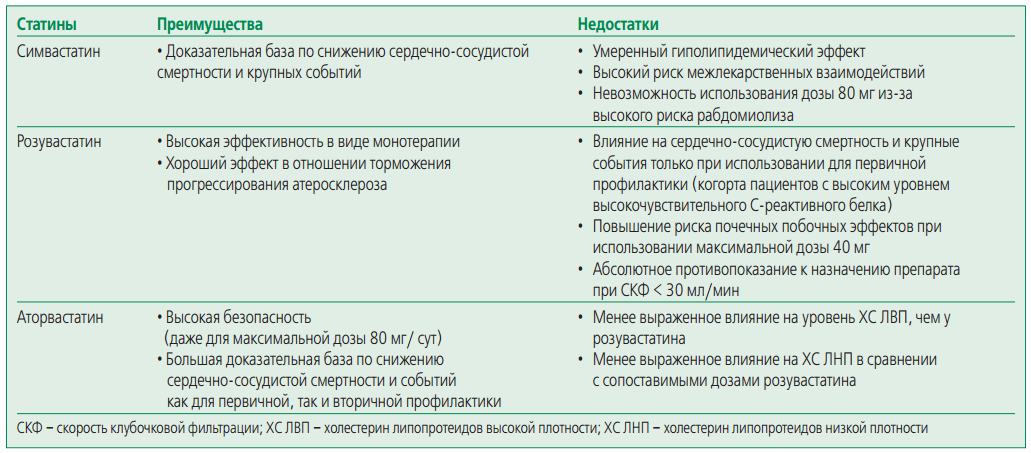 Следует отметить, что многие из этих исследований не были специально спланированы, а зачастую носили ретроспективный характер.
Следует отметить, что многие из этих исследований не были специально спланированы, а зачастую носили ретроспективный характер.
Используя пропорциональную модель Кокса, авторы [12] пришли к заключению, что применение статинов сопровождается снижением смертности на протяжении как первого года, так и последующих трех лет наблюдения (ОР – 0,80; 95% ДИ – 0,76-0,84 и ОР – 0,82; 95% ДИ – 0,79-0,85 соответственно).
В экспериментальной модели СН статины снижали активность ренин-ангиотензиновой и симпатоадреналовой систем [21, 22]. Кроме того, они ограничивали апоптоз адренергических рецепторов и способствовали оптимизации вариабельности сердечного ритма [16, 21, 22]. При этом плейотропные эффекты этого класса лекарственных средств рассматриваются как основные, а для дальнейшей оценки их значимости у пациентов с СН неишемического генеза необходимо проведение специально спланированных клинических исследований. По данным мета-анализа трех рандомизированных контролируемых исследований [11] установлено, что применение статинов после кардиохирургических вмешательств снижает риск развития послеоперационной фибрилляции предсердий на 40%. Также при назначении статинов перед проведением кардиохирургических операций сокращается частота развития послеоперационной фибрилляции предсердий, снижается риск развития инсультов и смертности в послеоперационном периоде [18]. При этом замечено, что эффект статинов зависит от дозы препарата и наиболее выражен при высоких дозах. Максимальная доза для аторвастатина и симвастатина составляет 20 мг. По-видимому, антиаритмический эффект статинов обусловлен не только плейотропным, но и противовоспалительным, антиоксидантным действием [47].
Также при назначении статинов перед проведением кардиохирургических операций сокращается частота развития послеоперационной фибрилляции предсердий, снижается риск развития инсультов и смертности в послеоперационном периоде [18]. При этом замечено, что эффект статинов зависит от дозы препарата и наиболее выражен при высоких дозах. Максимальная доза для аторвастатина и симвастатина составляет 20 мг. По-видимому, антиаритмический эффект статинов обусловлен не только плейотропным, но и противовоспалительным, антиоксидантным действием [47].
Назначая статины, врачу всегда следует помнить о том, что современные гиполипидемические лекарственные средства в достаточно широком диапазоне доз способствуют не только снижению содержания ХС-ЛПНП, но и не всегда благоприятно влияют на уровни других компонентов липидного профиля, особенно ХС-ЛПВП, ТГ. Различные препараты статинов, обладающие сходным по своей выраженности липидснижающим эффектом, могут значительно отличаться по частоте осложнений и фармакологическому действию.
Есть данные о том, что при лечении симвастатином снижается активность тканевого фактора и концентрация суммы фрагментов тромбина, что подтверждает предположение о прямом влиянии статинов на вязкость крови, микроциркуляцию, уровень фибриногена плазмы. Статины ингибируют АДФ-зависимую агрегацию тромбоцитов, угнетают продуцирование тромбоксана, уменьшают концентрацию тканевого активатора плазминогена 1-го типа [2].
В последнее время в литературе обсуждается вопрос о возможном взаимодействии клопидогреля и аторвастатина. Клопидогрель, являясь пролекарством, под действием СУР3А4 метаболизируется до активного 2-оксаклопидогреля, который блокирует АДФ-рецепторы тромбоцитов.
Аторвастатин также метаболизируется под действием СУР3А4, но не до активных метаболитов. В исследовании, выполненном in vitro с использованием микросом печени, показано, что аторвастатин на 90% ингибирует биотрансформацию клопидогреля до активного 2-оксаклопидогреля [9]. Авторы объясняют это существованием «метаболической» конкуренции между клопидогрелем и β-гидроксикислотным метаболитом аторвастатина СУР3А4. Исследователями [17] установлено, что у больных ИБС после стентирования коронарных сосудов аторвастатин, в отличие от правастатина, значительно снижал антиагрегантное действие клопидогреля.
Авторы объясняют это существованием «метаболической» конкуренции между клопидогрелем и β-гидроксикислотным метаболитом аторвастатина СУР3А4. Исследователями [17] установлено, что у больных ИБС после стентирования коронарных сосудов аторвастатин, в отличие от правастатина, значительно снижал антиагрегантное действие клопидогреля.
С 2004 г. была опубликована целая серия работ, которые, напротив, опровергают существование взаимодействия между аторвастатином и клопидогрелем. Проведенный подгрупповой анализ в рамках исследования CREDO (Clopidogrel for the Reduction of Events During Observation, 2002) также не выявил различий по конечным точкам в группе лиц, получавших статины и клопидогрель. При изучении частоты развития мионекрозов после проведенного стентирования [14] оказалось, что при сочетании клопидогреля с аторвастатином или симвастатином они наблюдались чаще, чем у больных, получавших правастатин или флувастатин (41,6% против 8%; р = 0,004). Полученные результаты, по-видимому, обусловлены взаимным «ослаблением» эффектов клопидогреля и статинов из-за конкурирующего взаимодействия на уровне СУР3А4.
Таким образом, на сегодняшний день существуют противоречивые данные о взаимодействии статинов и клопидогреля, метаболизирующихся СУР3А4, а оценка влияния на активность СУР3А4 данных лекарственных средств требует дальнейшего изучения.
Следует помнить о том, что при метаболизации не только статинов, но и большинства других фармакологических средств, применяемых при сердечно-сосудистых заболеваниях, окисление осуществляется при участии изофермента 3А4 цитохрома Р450. Установлено, что не только клопидогрель, но и блокаторы кальциевых каналов, амиодарон, варфарин, глитазоны, силденафил, многие противовирусные и противогрибковые препараты, циклоспорин, некоторые антибиотики широкого спектра действия метаболизируются одними и теми же изоферментами цитохрома Р450.
Так, при одновременном приеме верапамила, эритромицина и статинов концентрация последнего в крови возрастала примерно в 3 раза [27, 28], тогда как при сочетании аторвастатина с противогрибковым препаратом итраконазолом более чем в 2 раза возрастал и уровень концентрации статина в крови, и период его полувыведения [28]. Концентрация статинов возрастала также при взаимодействии с дигоксином, который является ингибитором Р-гликопротеина.
Концентрация статинов возрастала также при взаимодействии с дигоксином, который является ингибитором Р-гликопротеина.
Если для больных ИБС с дислипидемиями статины являются препаратами первой линии, то для уточнения схемы лечения пациентов с артериальной гипертензией и дислипидемиями было проведено хорошо спланированное исследование ASCOT-LLA (Anglo-Scandinavian Cardiac Outcomes Trial – Lipid Lowering Arm). Схема лечения больных с гипертонической болезнью, позволившая достичь наибольшего снижения риска развития ИБС, заключалась в приеме амлодипина и аторвастатина в одной таблетке. Были выявлены аддитивные (синергические) эффекты относительно некоторых маркеров эндотелиальной функции и развития атеросклеротической бляшки, включая высвобождение оксида азота. Пациенты достигли целевых уровней артериального давления и ХС-ЛПНП, а также имели более высокую расположенность к лечению [29].
Относительно лечения гиперлипидемии у лиц с ИБС и ВИЧ-инфицированных – в современных рекомендациях Международного общества по борьбе со СПИДом (International AIDS Society) сказано, что лицам с высоким кардиоваскулярным риском терапию необходимо начинать как можно раньше. Тактика лечения лиц с ИБС и ВИЧ должна основываться на рекомендациях для неинфицированных пациентов; алгоритм лечения больных ИБС – стандартный. Тем не менее, при назначении гиполипидемических препаратов необходимо помнить о возможных лекарственных взаимодействиях. На фоне применения ингибиторов протеаз концентрация симвастатина и ловастатина существенно увеличивается, что может привести к развитию рабдомиолиза, следовательно эти препараты у ВИЧ-инфицированных не применяются. В меньшей степени увеличивается концентрация аторвастатина, поэтому препарат может использоваться, но в меньших дозах. Правастатин является препаратом первой линии в терапии гиперлипидемий у пациентов с ВИЧ-инфекцией, поскольку он не метаболизируется СУР3А4. Флувастатин расщепляется СУР2С9 и может использоваться как средство второй линии.
Тактика лечения лиц с ИБС и ВИЧ должна основываться на рекомендациях для неинфицированных пациентов; алгоритм лечения больных ИБС – стандартный. Тем не менее, при назначении гиполипидемических препаратов необходимо помнить о возможных лекарственных взаимодействиях. На фоне применения ингибиторов протеаз концентрация симвастатина и ловастатина существенно увеличивается, что может привести к развитию рабдомиолиза, следовательно эти препараты у ВИЧ-инфицированных не применяются. В меньшей степени увеличивается концентрация аторвастатина, поэтому препарат может использоваться, но в меньших дозах. Правастатин является препаратом первой линии в терапии гиперлипидемий у пациентов с ВИЧ-инфекцией, поскольку он не метаболизируется СУР3А4. Флувастатин расщепляется СУР2С9 и может использоваться как средство второй линии.
Розувастатин минимально метаболизируется цитохромом Р450, но его концентрация, тем не менее, повышается на фоне терапии ингибиторов протеаз. Поэтому его доза должна ограничиваться до 10 мг.
Для этих больных безопасным и эффективным препаратом является эзетимиб, который назначают в дополнение к максимально переносимым дозам гиполипидемической терапии.
Следует отметить, что некоторые фармакологические средства, применяемые в кардиологической практике, наоборот, повышают активность цитохрома Р450, что приводит к снижению концентрации статинов в крови. Таким эффектом, в частности, обладают барбитураты, дексаметазон, омепразол, рифампицин, троглитазол, карбамазепин, циклофосфамид. Для повышения концентрации, а также получения необходимого гиполипидемического эффекта дозу статинов нужно увеличивать.
Особо следует отметить тот факт, что при взаимодействии статинов и варфарина наблюдается повышение содержания в крови одновременно обоих препаратов, при этом международное нормализированное отношение также повышается, что требует более частого его контроля. В кардиологической практике возможно сочетание статинов и фибратов (гемфиброзила). Следует помнить, что при таком сочетании риск развития побочных эффектов, в частности миопатии и рабдомиолиза, повышается в несколько десятков раз. В отличие от гемфиброзила, фенофибрат не метаболизируется цитохромом Р450, поэтому он может считаться препаратом выбора при совместном применении со статинами у больных ИБС с выраженной гипертриглицеридемией [23].
Следует помнить, что при таком сочетании риск развития побочных эффектов, в частности миопатии и рабдомиолиза, повышается в несколько десятков раз. В отличие от гемфиброзила, фенофибрат не метаболизируется цитохромом Р450, поэтому он может считаться препаратом выбора при совместном применении со статинами у больных ИБС с выраженной гипертриглицеридемией [23].
Важным является то, что все фибраты обладают определенной миотоксичностью, поэтому лицам с печеночной недостаточностью комбинированная терапия противопоказана, а при почечной недостаточности требуется частый контроль креатинина, так как эти препараты экскретируются почками. Поскольку статины липофильны (см. табл. 2) – они легко проникают в ЦНС и могут вызывать бессонницу. Среди всех липофильных статинов наибольшей липофильностью обладает церивастатин, далее следует симвастатин, флувастатин и аторвастатин.
Совсем недавно появились данные об опасности резкого прекращения приема статинов у больных с явлениями острого атеротромбоза (мозговой инсульт, острый коронарный синдром). Согласно результатам опубликованных исследований это ведет к избыточной активации гетеродимерных G-белков Rho и Rac, вследствие чего усиливается продуцирование активных соединений кислорода, снижается биодоступность оксида азота, активизируются воспалительные реакции, повышается риск тромбообразования. В связи с этим у больных с острым коронарным синдромом или острым ишемическим инсультом внезапное прекращение приема статинов недопустимо, так как возрастает риск внезапной смерти и развития тромботических осложнений, в то время как у больных ИБС со стабильной стенокардией прекращение приема этих лекарственных средств не сопровождается повышением риска нежелательных событий.
Согласно результатам опубликованных исследований это ведет к избыточной активации гетеродимерных G-белков Rho и Rac, вследствие чего усиливается продуцирование активных соединений кислорода, снижается биодоступность оксида азота, активизируются воспалительные реакции, повышается риск тромбообразования. В связи с этим у больных с острым коронарным синдромом или острым ишемическим инсультом внезапное прекращение приема статинов недопустимо, так как возрастает риск внезапной смерти и развития тромботических осложнений, в то время как у больных ИБС со стабильной стенокардией прекращение приема этих лекарственных средств не сопровождается повышением риска нежелательных событий.
Статины хорошо переносятся, однако у части больных их прием может сопровождаться болями в животе, метеоризмом, запорами, повышением уровня активности почечных ферментов, аланиновой и аспарагининовой трансаминаз (примерно у 1-5% лиц). Если уровень активности хотя бы одного из этих ферментов при двух измерениях превышает в 3 раза верхние пределы нормальных значений, прием статинов следует прекратить.
Активность трансаминаз следует контролировать каждые 6-8 недель в течение первых шести месяцев лечения статинами, затем такая оценка может проводиться реже. Пациент должен быть информирован о необходимости ограничивать или исключать употребление алкоголя во время лечения статинами.
Наиболее серьезными побочными эффектами статинов являются миопатия и рабдомиолиз. До настоящего времени не вполне ясен их механизм и не существует единых диагностических критериев.
К критериям миопатии относят появление боли или/и слабости в мышцах в сочетании с повышением активности сывороточной креатинфосфокиназы в 5 и более раз от верхней границы нормы. Миопатию могут вызвать все статины. По данным рандомизированных исследований, риск ее развития составляет 11 случаев на 10000 человеко-лет.
Рабдомиолиз – это тяжелая миопатия, сопровождающаяся освобождением содержащегося в мышцах миоглобина с развитием миоглобинурии, повышением уровня креатинина и развитием острой почечной недостаточности. Риск рабдомиолиза составляет 0,06 – примерно 3-4 случая на 1000 человеко-лет.
Риск рабдомиолиза составляет 0,06 – примерно 3-4 случая на 1000 человеко-лет.
К факторам, которые могут способствовать развитию миопатии и рабдомиолиза, относятся: пожилой возраст, женский пол, малая масса тела, гипотиреоз, почечная и печеночная недостаточность, интеркуррентные инфекции, тяжелые операции, травмы, алкоголизм, тяжелая физическая нагрузка, употребление сока грейпфрута [7].
Есть данные о том, что симвастатин, влияя на регуляцию экспрессии митохондриального РНК и митохондриального белка в клетке, предотвращает развитие гипертрофии левого желудочка сердца.
Было установлено, что в популяции больных в возрасте от 50 лет статины достоверно уменьшают частоту переломов бедренной кости. Это обусловлено способностью статинов влиять на формирование костной ткани, так как они стимулируют выработку остеогенного протеина-2 – фактора роста, пролиферацию и созревание остеобластов [3]. Все циркулирующие в крови статины, кроме правастатина, более чем на 85% находятся в соединении с белками плазмы, что обеспечивает низкую концентрацию в плазме фармакологически активных свободных статинов, вследствие чего риск побочных эффектов статинов уменьшается.
Статины после попадания в кишечник с желчью выводятся с калом, и только незначительная часть – с мочой (аторвастатин – 2%). При клиренсе креатинина < 60 ммоль/л дозу статинов (особенно церивастатина и симвастатина) необходимо снизить вдвое.
Приведенные данные свидетельствуют о незначительной частоте развития тяжелых побочных эффектов, тогда как выраженность клинического эффекта статинов в отношении предупреждения инфаркта миокарда и других сосудистых катастроф, значительно «превышает» риск тяжелых осложнений фармакотерапии.
Согласно последним рекомендациям Европейского общества кардиологов по профилактике сердечно-сосудистых заболеваний, целевой уровень ОХС для пациентов с установленным диагнозом ИБС или высоким риском сердечно-сосудистых событий (> 5% в течение 10 лет) составляет 4,5 ммоль/л (175 мг/дл), а содержание ХС-ЛПНП – меньше 2,5 ммоль/л (96 мг/дл). При плохой переносимости статинов снижение их дозы может быть компенсировано дополнительным назначением ингибиторов всасывания холестерина (эзетимиба), но клиническая эффективность такой комбинации не изучена. |
Таким образом, эффективность статинов на сегодняшний день доказана и определены преимущественные показания к их назначению.
Так, у пациентов с острым коронарным синдромом, а также при необходимости более выраженного влияния на липидный спектр крови у лиц со смешанной дислипидемией предпочтительней назначать аторвастатин. При умеренно выраженных изменениях липидного состава крови, преимущественно гиперхолестеринемии, целесообразным является применение симвастатина.
В настоящее время проводится исследование Assessment Acute Coronary Syndrom (JAPAN-ACS) по изучению препарата питавастатина.
Следует отметить, что приверженность к терапии статинами остается недостаточной. На протяжении двух лет только около 40% пациентов с ИБС и острым коронарным синдромом постоянно принимают статины.
Список литературы находится в редакции
Терапия » Розувастатин как основа первичной и вторичной профилактики сердечно-сосудистых заболеваний и их осложнений
Розувастатин как основа первичной и вторичной профилактики сердечно-сосудистых заболеваний и их осложнений
DOI: https://dx. doi.org/10.18565/therapy.2019.4.86-93
doi.org/10.18565/therapy.2019.4.86-93
А.А. Хрипунова, И.Г. Хрипунова, О.И. Боева
ФГБОУ ВО «Ставропольский государственный медицинский университет» Минздрава России
В статье представлен аналитический обзор российских и зарубежных исследований применения розувастатина для снижения сердечно-сосудистой заболеваемости и смертности, обусловленной атеросклерозом. Показана высокая эффективность этого лекарственного средства в достижении целевых значений общего холестерина, липопротеидов низкой плотности и триглицеридов как у пациентов очень высокого и высокого риска, так и при умеренном сердечно-сосудистом риске. При этом розувастатин может успешно применяться при наличии сопутствующей патологии, включая сахарный диабет, хроническую болезнь почек и хроническую сердечную недостаточность. Многочисленные положительные клинические эффекты розувастатина не ограничиваются его гиполипидемическим действием. Доказано, что он способен уменьшать объем атеросклеротической бляшки, обладает дезагрегантным действием, нормализует функцию эндотелия, снижает уровень провоспалительных цитокинов и С-реактивного белка, тем самым проявляя дополнительный антиишемический и противовоспалительный эффекты. Розувастатин обладает благоприятным профилем безопасности, а возможность достижения гиполипидемического эффекта при назначении меньших доз препарата позволяет свести к минимуму риск его побочных реакций. Применение розувастатина способствует не только увеличению клинической эффективности, но и снижению стоимости лечения.
Розувастатин обладает благоприятным профилем безопасности, а возможность достижения гиполипидемического эффекта при назначении меньших доз препарата позволяет свести к минимуму риск его побочных реакций. Применение розувастатина способствует не только увеличению клинической эффективности, но и снижению стоимости лечения.
Ключевые слова: атеросклероз, статины, профилактика, розувастатин, липопротеиды низкой плотности, сердечно-сосудистые заболевания, инфаркт миокарда, плейотропные эффекты
Литература
 В. Атеросклероз и дислипидемии: современные аспекты патогенеза, диагностики и лечения. ПатиСС., 2017. 128 с.
В. Атеросклероз и дислипидемии: современные аспекты патогенеза, диагностики и лечения. ПатиСС., 2017. 128 с.
 R. 3rd, Raichlen J.S., Riley W.A., Evans G.W., Palmer M.K., O’Leary D.H., Grobbee D.E., Bots M.L. METEOR Study Group. Effect of rosuvastatin on progression of carotid intima-media thickness in low-risk individuals with subclinical atherosclerosis: the METEOR Trial. JAMA. 2007; 297(12): 1344–53.
R. 3rd, Raichlen J.S., Riley W.A., Evans G.W., Palmer M.K., O’Leary D.H., Grobbee D.E., Bots M.L. METEOR Study Group. Effect of rosuvastatin on progression of carotid intima-media thickness in low-risk individuals with subclinical atherosclerosis: the METEOR Trial. JAMA. 2007; 297(12): 1344–53. Кардиоваскулярная терапия и профилактика. 2005; 4(1): 4–8.
Кардиоваскулярная терапия и профилактика. 2005; 4(1): 4–8. , Drexel H., Hoes A.W., Jennings C.S., Landmesser U., Pedersen T.R., Reiner Z., Riccardi G., Taskinen M.R., Tokgozoglu L., Verschuren W.M.M., Vlachopoulos C., Wood D.A., Zamorano J.L., Cooney M.T. ESC Scientific Document Group. 2016 ESC/EAS guidelines for the management of dyslipidaemias. European Heart Journal. 2016; 37(39): 2999–3058.
, Drexel H., Hoes A.W., Jennings C.S., Landmesser U., Pedersen T.R., Reiner Z., Riccardi G., Taskinen M.R., Tokgozoglu L., Verschuren W.M.M., Vlachopoulos C., Wood D.A., Zamorano J.L., Cooney M.T. ESC Scientific Document Group. 2016 ESC/EAS guidelines for the management of dyslipidaemias. European Heart Journal. 2016; 37(39): 2999–3058.
 Efficacy of rosuvastatin among men and women with moderate chronic kidney disease and elevated high-sensitivity C-reactive protein: a secondary analysis from the JUPITER (Justification for the Use of Statins in Prevention-an Intervention Trial Evaluating Rosuvastatin) trial. J Am Coll Cardiol. 2010; 55: 1266–73.
Efficacy of rosuvastatin among men and women with moderate chronic kidney disease and elevated high-sensitivity C-reactive protein: a secondary analysis from the JUPITER (Justification for the Use of Statins in Prevention-an Intervention Trial Evaluating Rosuvastatin) trial. J Am Coll Cardiol. 2010; 55: 1266–73. Atherosclerosis. 2007; 194(2): e154–e164.
Atherosclerosis. 2007; 194(2): e154–e164. Cardiovasc. Prev. Rehabil. 2009; 16: 712–21.
Cardiovasc. Prev. Rehabil. 2009; 16: 712–21. Consilium Medicum. 2011; 13 (5): 85–89.
Consilium Medicum. 2011; 13 (5): 85–89. J Am Coll Cardiol. 2014; 63(1):71–79. doi: 10.1016/j.jacc.2013.04.105.
J Am Coll Cardiol. 2014; 63(1):71–79. doi: 10.1016/j.jacc.2013.04.105.
Об авторах / Для корреспонденции
Алеся Александровна Хрипунова, к.м.н., доцент кафедры общественного здоровья и здравоохранения, медицинской профилактики и информатики с курсом дополнительного профессионального образования (ДПО) ФГБОУ ВО «Ставропольский государственный медицинский университет» Минздрава России.
Адрес: 355017, г. Ставрополь, ул. Мира, д. 310. Тел.: 8 (8652) 74-85-48. E-mail: [email protected]
Ирина Георгиевна Хрипунова, к.м.н., доцент кафедры терапии с курсом диетологии ФГБОУ ВО «Ставропольский государственный медицинский университет» Минздрава России. Адрес: 355017, Ставрополь,
ул. Мира, д. 310. Тел.: 8 (9624) 47-75-13. E-mail: [email protected]
Ольга Игоревна Боева, д.м.н., доцент, зав. кафедрой медицинской радиологии с курсом ДПО ФГБОУ ВО «Ставропольский государственный медицинский университет» Минздрава России. Адрес: 355017, Ставрополь, ул. Мира, д. 310. Тел.: 8 (8652) 35-25-76. E-mail: [email protected]
Симвастатин: ограничение медицинского применения. — ФГБУ НЦЭСМП Минздрава
Центр экспертизы безопасности лекарственных средств (ЦЭБЛС) напоминает Вам о том, что с применением некоторых препаратов может быть связан риск развития серьезных, жизнеугрожающих осложнений фармакотерапии, таких как миопатии и рабдомиолиз. Известно, что назначение лекарственных средств (ЛС) из группы статинов (Симвастатин, Ловастатин, Правастатин, Аторвастатин, Розувастатин) может быть ассоциировано с риском развития у пациентов серьезной, жизнеугрожающей неблагоприятной побочной реакции (НПР) — миопатии.
Известно, что назначение лекарственных средств (ЛС) из группы статинов (Симвастатин, Ловастатин, Правастатин, Аторвастатин, Розувастатин) может быть ассоциировано с риском развития у пациентов серьезной, жизнеугрожающей неблагоприятной побочной реакции (НПР) — миопатии.
Уважаемые коллеги!
Центр экспертизы безопасности лекарственных средств (ЦЭБЛС) напоминает Вам о том, что с применением некоторых препаратов может быть связан риск развития серьезных, жизнеугрожающих осложнений фармакотерапии, таких как миопатии и рабдомиолиз. Известно, что назначение лекарственных средств (ЛС) из группы статинов (Симвастатин, Ловастатин, Правастатин, Аторвастатин, Розувастатин) может быть ассоциировано с риском развития у пациентов серьезной, жизнеугрожающей неблагоприятной побочной реакции (НПР) — миопатии. Клинически миопатия проявляется слабостью, болью в мышцах и повышением уровня креатинкиназы в плазме крови. Одним из наиболее тяжелых осложнений является рабдомиолиз — синдром, развивающийся вследствие повреждения скелетных мышц с появлением в результате этого в крови свободного миоглобина (миоглобинемия). В начале заболевания возможны боль, мышечная слабость, отёчность мышц, потемнение мочи. Нередко рабдомиолиз приводил к развитию почечной недостаточности и летальному исходу.
В начале заболевания возможны боль, мышечная слабость, отёчность мышц, потемнение мочи. Нередко рабдомиолиз приводил к развитию почечной недостаточности и летальному исходу.
Факторами риска развития рабдомиолиза служат:
- Возраст пациента старше 65 лет;
- Гипотиреоидизм;
- Наличие патологии почек.
В недавно проведенном исследовании SEARCH было показано, что в группе пациентов, получающих Симвастатин в суточной дозе 80 мг, рабдомиолиз наблюдался значительно чаще (52 случая), чем в группе больных, которым был назначен Симвастатин в дозе 20 мг (1 случай).
На основании полученных сведений Агентство по контролю лекарственных средств и продуктов питания США (US FDA) приняло решение внести ряд дополнений в инструкцию по медицинскому применению Симвастатина, касающихся его дозировок и взаимодействия с другими препаратами, которые представлены ниже.
Дополнения, внесенные FDA в инструкцию по медицинскому применению Симвастатина от 06.
 08.2011.
08.2011.
- Рекомендуется назначать Симвастатин в интервале доз от 5 до 40 мг/сутки.
- Обычная начальная доза Симвастатина составляет 10 — 20 мг, назначаемые один раз в сутки, вечером.
- Пациентам, страдающим ишемической болезнью сердца (ИБС) или имеющим высокий риск развития осложнений на фоне ИБС, рекомендуется начинать терапию Симвастатином совместно с лечебной диетой.
- У больных с ИБС, имеющих дополнительные факторы риска развития осложнений со стороны сердечно – сосудистой системы, таких как сахарный диабет, патология периферических сосудов, поражение сосудов головного мозга или инсульт в анамнезе, рекомендуемая начальная суточная доза Симвастатина составляет 40 мг/сутки.
- Пациентам, страдающим гомозиготной наследственной гиперхолестеринемией, рекомендуется применять Симвастатин в суточной дозе 40 мг, вечером в дополнение к другим методам лечения гиперхолестеринемии, например, аферезу липопротеидов низкой плотности, или при невозможности их проведения.

- У подростков 10-17 лет начальная суточная доза составляет 10 мг в сутки однократно, вечером. Не рекомендуется назначать Симвастатин в суточной дозе более 40 мг у данной категории пациентов. В случае необходимости коррекцию проводимой терапии рекомендуется проводить каждые 4 недели.
- У пациентов с нарушенной функцией почек коррекция дозы не обязательна ввиду того, что препарат незначительно экскретируется с мочой, однако у пациентов с тяжелым поражением почек рекомендуемая начальная суточная доза Симвастатина составляет 5 мг/сутки под контролем функции почек.
- Регулярное определение уровня липидов в плазме крови следует начинать спустя 4 недели лечения.
Ограничения назначения Симвастатина в суточной дозе 80 мг:
- Не рекомендуется начинать лечение Симвастатином в суточной дозе 80 мг.
- Применение Симвастатина в суточной дозе 80 мг возможно только у пациентов, принимающих препарат в данной дозировке длительно (более года) без признаков поражения мышечной ткани.

- При необходимости назначения больным, принимающим Симвастатин в дозе 80 мг, других препаратов, в отношении которых приняты административные решения (список препаратов представлен ниже), рекомендуется заменить Симвастатин на другой препарат из группы статинов.
- В случае невозможности снижения уровня холестерина в крови пациентов, принимающих Симвастатин в дозе 40 мг, рекомендуется заменить данный препарат на другое ЛС, а не повышать его дозу, ввиду высокого риска развития миопатии и рабдомиолиза на фоне приема Симвастатина в дозе 80 мг.
- Симвастатин следует назначать строго в соответствии с инструкцией с учетом изменений, представленных ниже.
Возможные лекарственные взаимодействия:
- Противопоказано одновременное назначение Симвастатина со следующими ЛС:
- Итраконазол,
- Кетоконазол,
- Эритромицин,
- Кларитромицин,
- Телитромицин,
- Ингибиторы протеазы ВИЧ,
- Нефазодон,
- Гемфиброзил,
- Циклоспорин,
- Позаконазол,
- Даназол.

- Максимальная суточная доза Симвастатина не должна превышать 10 мг при его совместном применении со следующими препаратами:
- Амиодарон,
- Дилтиазем,
- Верапамил.
- Максимальная суточная доза Симвастатина не должна превышать 20 мг при его совместном применении с Амлодипином.
- Следует избегать употребления больших количеств грейпфрутового сока (более одного литра в сутки) совместно с Симвастатином.
Терапия статинами ассоциирована с повышением уровня ИРФ-1 у больных ИБС без сахарного диабета | Шпагина
Сердечно-сосудистые заболевания остаются ведущей причиной заболеваемости и смертности. За последние три десятилетия снижение смертности от сердечно-сосудистых заболеваний связано с улучшением контроля таких факторов риска, как уровень холестерина, артериальная гипертония (АГ) и курение. В то же время наблюдается увеличение количества больных с ожирением и, как следствие, сахарным диабетом 2-го типа (СД2). Увеличение продолжительности жизни и связанное с ним старение также приводит к росту сердечно-сосудистых заболеваний [1]. Недостаточная эффективность профилактики определяет поиск других факторов риска.
Увеличение продолжительности жизни и связанное с ним старение также приводит к росту сердечно-сосудистых заболеваний [1]. Недостаточная эффективность профилактики определяет поиск других факторов риска.
Сердечно-сосудистая система является важной мишенью для действия соматотропного гормона (СТГ) и инсулиноподобного ростового фактора-1 (ИРФ-1). ИРФ-1 был открыт Salmon и Daughaday в 1957 г. [2]. Изучается его роль в развитии и лечении таких заболеваний, как ревматоидный артрит, остеопороз, СД2, цирроз печени, онкологические и неврологические дегенеративные заболевания [3]. Множество исследований посвящено его действию на сердечно-сосудистую систему. ИРФ-1 — полипептидный гормон, состоящий из 70 аминокислотных остатков, синтезирующийся преимущественно в печени под действием СТГ и опосредующий большинство его биологических эффектов. Уровень ИРФ-1 достигает максимума в период полового созревания, а затем постепенно снижается. Рецепторы ИРФ-1 обнаружены в миокарде, гладкомышечных клетках аорты и клетках эндотелия. Предполагается, что он оказывает проатерогенное действие, так как способствует миграции и пролиферации гладкомышечных клеток сосудов. Помимо этого, возрастает синтез ИФР-1 активированными микрофагами в атеросклеротических бляшках. Однако ИРФ-1 обладает и положительными эффектами, стабилизируя атеросклеротическую бляшку за счет увеличения «выживаемости» гладкомышечных клеток сосудов.
Предполагается, что он оказывает проатерогенное действие, так как способствует миграции и пролиферации гладкомышечных клеток сосудов. Помимо этого, возрастает синтез ИФР-1 активированными микрофагами в атеросклеротических бляшках. Однако ИРФ-1 обладает и положительными эффектами, стабилизируя атеросклеротическую бляшку за счет увеличения «выживаемости» гладкомышечных клеток сосудов.
Многие исследования [4] показали, что низкие концентрации ИРФ-1 связаны с неблагоприятным сердечно-сосудистым прогнозом, включая инфаркт миокарда и сердечную недостаточность. Одним из возможных объяснений является тот факт, что низкий уровень ИРФ-1 обусловливает резистентность к инсулину и прогрессирование атеросклероза. Другим возможным объяснением является влияние ИРФ-1 на количество и функцию эндотелиальных клеток-предшественников, число которых снижается с возрастом. Так, СТГ-индуцированное повышение уровня ИРФ-1 увеличивало системную биодоступность оксида азота и количество эндотелиальных клеток-предшественников в организме здорового человека [5]. Кроме системного ИРФ-1, вырабатываемого печенью под действием СТГ, существует локальная паракринная система ИРФ-1. ИРФ-1, продуцируемый этой системой, оказывает кардио- и вазопротективный эффект и за счет противовоспалительного действия уменьшает размер атеросклеротической бляшки, главным образом, снижая активность цитокинов ИЛ-6 и ФНО-α [6].
Кроме системного ИРФ-1, вырабатываемого печенью под действием СТГ, существует локальная паракринная система ИРФ-1. ИРФ-1, продуцируемый этой системой, оказывает кардио- и вазопротективный эффект и за счет противовоспалительного действия уменьшает размер атеросклеротической бляшки, главным образом, снижая активность цитокинов ИЛ-6 и ФНО-α [6].
В 2017 г. опубликованы результаты работы Y. Higashi и соавт. [7], свидетельствующие о новом механизме антиатерогенного действия ИРФ-1. Так как макрофаги являются ключевым звеном атерогенеза и экспрессируют рецепторы к ИРФ-1, авторы изучали влияние ИРФ-1 на функцию этих клеток. Оказалось, что ИРФ-1 снижает накопление макрофагов и пенистых клеток внутри бляшки, а также увеличивает ее стабильность. Возможность применения ИРФ-1 для лечения атеросклероза является перспективной и активно изучаемой областью медицины.
Общее применение ИРФ-1 ограничено его побочными эффектами, такими как возможная стимуляция опухолевых процессов. Локальное введение может быть безопасным. В настоящее время проводится исследование (Evaluation of the Safety and Efficacy of Using Insulin-like Growth Factor-1 in Patients With a Heart Attack), в котором будет оценена эффективность внутрикоронарного введения препарата ИРФ-1 (Мекаcермина) пациентам с острым коронарным синдромом в целях уменьшения зоны некроза миокарда [8].
В настоящее время проводится исследование (Evaluation of the Safety and Efficacy of Using Insulin-like Growth Factor-1 in Patients With a Heart Attack), в котором будет оценена эффективность внутрикоронарного введения препарата ИРФ-1 (Мекаcермина) пациентам с острым коронарным синдромом в целях уменьшения зоны некроза миокарда [8].
Все пациенты, имеющие ИБС или факторы риска ее развития, согласно официальным рекомендациям, получают терапию статинами. В 2009 г. появились данные о том, что у мышей с нарушенной толерантностью к глюкозе введение флувастатина в течение двух недель повышало уровень ИРФ-1 в сыворотке и экспрессию гена ИРФ-1 [9]. Отдаленные последствия этого феномена пока не изучены.
Цель исследования — оценить действие терапии статинами на уровень ИРФ-1 и связанные с ним факторы риска ИБС.
Материал и методы
Дизайн исследования
Одномоментное одноцентровое наблюдательное исследование по типу «случай—контроль».
Критерии соответствия
В исследование включались пациенты в возрасте 45—65 лет с избыточной массой тела и ожирением I степени. У всех было получено информированное согласие на участие в клиническом исследовании.
У всех было получено информированное согласие на участие в клиническом исследовании.
Не включались пациенты с индексом массы тела (ИМТ) >35 кг/м2, вторичным ожирением, СД, жизнеугрожающими нарушениями ритма сердца, наличием критических стенозов клапанного аппарата сердца любой этиологии, медикаментозно не контролируемыми формами АГ, ХСН с систолической дисфункцией левого желудочка (ЛЖ), онкологическими заболеваниями, получающие заместительную гормонотерапию.
Для подтверждения ИБС всем пациентам 1-й группы была проведена коронароангиография (КАГ), выявлены гемодинамически значимые стенозы коронарных артерий: однососудистое поражение у 24 человек, двух- и трехсосудистое — у 13 и 33 человек соответственно.
Для исключения ИБС во 2-й группе (контроль) проводили тредмил-тест.
Условия проведения
Все пациенты находились на стационарном лечении в ФГБУ «НМИЦ эндокринологии» Минздрава России, в отделении интервенционной кардиологии и отделении терапии с группой ожирения.
Продолжительность исследования
Включение пациентов в исследование проведено в период 2011—2015 гг.
Описание медицинского вмешательства
Всем больным проводили общее клиническое обследование со сбором анамнеза, определением объема талии (ОТ), объема бедер (ОБ), ИМТ. Выполнены биохимический и гормональный анализы крови, проведен стандартный пероральный глюкозотолерантный тест (ПГТТ), эхокардиография (ЭхоКГ). У больных с ИБС проведена коронарография. У больных без ИБС проведен тредмил-тест.
Основной исход исследования
Определение содержания общего холестерина (ХС), ХС ЛПНП, ХС ЛПВП, ТГ, фибриногена, ИРФ-1 в крови, фракции выброса (ФВ), толщины межжелудочковой перегородки (МЖП), толщины задней стенки левого желудочка (ЗСЛЖ), конечного диастолического объема (КДО), конечного систолического объема (КСО), конечного диастолического размера (КДР) левого желудочка, ИМТ, степени АГ, соотношения ОТ/ОБ.
Анализ в подгруппах
В 1-ю группу включали больных с ИБС, подтвержденной КАГ. Во 2-ю группу — лиц без ИБС с отсутствием стенокардии, что было продтверждено тредмил-тестом. Для выявления факторов, влияющих на уровень ИРФ-1, больные были разделены на группы с нормальным и повышенным уровнем ИРФ-1.
Во 2-ю группу — лиц без ИБС с отсутствием стенокардии, что было продтверждено тредмил-тестом. Для выявления факторов, влияющих на уровень ИРФ-1, больные были разделены на группы с нормальным и повышенным уровнем ИРФ-1.
Методы регистрации исходов
Общее клиническое обследование включало сбор жалоб, анамнеза, оценку физикальных данных, антропометрических показателей (рост, масса тела), рассчитывали ИМТ по формуле Ketle: ИМТ (кг/м2)=масса(кг)/рост(м2), определяли ОТ, ОБ, соотношение ОТ/ОБ. В зависимости от ИМТ в соответствии с классификацией ВОЗ (1997) выделяли: нормальную массу тела (ИМТ 18,5—24,9 кг/м2), избыточную массу тела (ИМТ 25—29,9 кг/м2), ожирение I (ИМТ 30—34,9 кг/м2).
В 1-е сутки после поступления в стационар в сыворотке крови, взятой натощак после 14-часового голодания, оценивали уровни общего ХС, ТГ, ХС ЛПВП и ХС ЛПНП гомогенным энзиматическим колориметрическим методом и фибриногена клоттинговым методом. Определения проводили на биохимическом анализаторе НITACHI 912 («Roche») с использованием стандартных наборов фирмы. Уровень гормонов в сыворотке определяли иммуноферментным методом. Для определения содержания ИРФ-1 использовали анализатор LIAISON (DiaSorin) со стандартными фирменными наборами.
Уровень гормонов в сыворотке определяли иммуноферментным методом. Для определения содержания ИРФ-1 использовали анализатор LIAISON (DiaSorin) со стандартными фирменными наборами.
Пероральный тест на толерантность к глюкозе проводили в утреннее время после 14-часового голодания.
Геометрия сердца оценивалась у всех пациентов трансторакально с помощью ультразвуковой цифровой системы Philips AE33. Измерения проводились согласно рекомендациям Американской ассоциации ЭхоКГ [10]. Уровень ИРФ-1 классифицировался как низкий, нормальный и повышенный в соответствии с нормой, соответствующей возрасту и полу, а также использовалось ИРФ-1dif — отклонение от среднего значения, которое рассчитывалось как А-А1, где А — уровень ИРФ-1 пациента, А1 — среднее значение для данного возраста и пола. Границы нормы для уровня ИРФ-I в данном случае были следующими: 45—50 лет — 94—252 нг/мл; 51—55 года — 87—238 нг/мл; 56—60 лет — 81—225 нг/мл и 61—65 лет — 75—212 нг/мл.
Тредмил-тест проводили по модифицированному протоколу R. Bruce [11] на стресс-системе Q4500 («Quinton», США). Во время пробы осуществляли непрерывное мониторирование ЭКГ в отведениях II, V2, V5 на экране монитора и ежеминутную регистрацию ЭКГ в 12 стандартных отведениях на бумажную ленту.
Bruce [11] на стресс-системе Q4500 («Quinton», США). Во время пробы осуществляли непрерывное мониторирование ЭКГ в отведениях II, V2, V5 на экране монитора и ежеминутную регистрацию ЭКГ в 12 стандартных отведениях на бумажную ленту.
Селективная коронароангиография (КАГ) выполнялась по методике M. Judkins [12] на аппарате Axiom Artis («Siemens»). Гемодинамически значимым считали сужение просвета эпикардиальных коронарных артерий на 50% и более.
Этическая экспертиза
У всех пациентов до включения в исследование было получено информированное согласие.
Проведение научно-исследовательской работы одобрено ЛЭК ФГБУ «Эндокринологический научный центр». Выписка из протокола №1 от 13.01.10.
Статистический анализ
Принципы расчета размера выборки. Размер выборки предварительно не рассчитывался.
Методы статистического анализа данных. Статистический анализ проводился с использованием пакета программ IBM SPSS Statistics 22. 0. Количественные данные представлены в зависимости от соответствия переменных нормальному распределению: среднее арифметическое и стандартное отклонение или медиана и 25-й и 75-й процентиль. Количественные показатели проверялись на нормальность распределения с помощью критерия Колмогорова—Смирнова. Значимость различий в случае нормального распределения данных оценивали с помощью t-критерия Стьюдента, при отсутствии нормального распределения методом непараметрической статистики с помощью U-теста Манна—Уитни для двух независимых выборок. Значимыми считались различия при р<0,05. Для выявления и оценки связей между исследуемыми показателями применялся непараметрический корреляционный анализ Спирмена. Сравнение количественных признаков проводилось с помощью критерия Стьюдента. Значимость различий между группами для качественных показателей оценивали с помощью критерия χ2. Многофакторный анализ проводился методом линейной регрессии пошагово.
0. Количественные данные представлены в зависимости от соответствия переменных нормальному распределению: среднее арифметическое и стандартное отклонение или медиана и 25-й и 75-й процентиль. Количественные показатели проверялись на нормальность распределения с помощью критерия Колмогорова—Смирнова. Значимость различий в случае нормального распределения данных оценивали с помощью t-критерия Стьюдента, при отсутствии нормального распределения методом непараметрической статистики с помощью U-теста Манна—Уитни для двух независимых выборок. Значимыми считались различия при р<0,05. Для выявления и оценки связей между исследуемыми показателями применялся непараметрический корреляционный анализ Спирмена. Сравнение количественных признаков проводилось с помощью критерия Стьюдента. Значимость различий между группами для качественных показателей оценивали с помощью критерия χ2. Многофакторный анализ проводился методом линейной регрессии пошагово.
Результаты
Объекты (участники) исследования
В исследование включены всего 115 человек (средний возраст 55,8±6,1 года) с избыточной массой тела или ожирением I степени (ИМТ 28,6±3,8 кг/м2). В 1-ю группу вошли 70 человек с сохраненной систолической функцией левого желудочка и подтвержденной ИБС 2—3 ФК по NYHA. Во 2-ю группу (контрольная) включены 45 человек без ИБС, которые не получали гиполипидемическую терапию. Клиническая характеристика пациентов представлена в табл. 1. У всех больных оценивали факторы риска ИБС и уровень ИРФ-1. Пациенты обеих групп были сопоставимы по ИМТ и возрасту; мужчин было больше в группе больных ИБС. Группы значимо не различались по соотношению ОТ/ОБ, длительности течения АГ, проценту больных с нарушением толерантности к глюкозе (НТГ), процентному соотношению курящих. Все больные в группе ИБС, за исключением 4 человек, у которых ИБС была выявлена впервые, получали статины; 29 (41,1%) человек — розувастатин (средняя доза 10±4,8 мг), 25 (35,7%) — аторвастатин (средняя доза 20±9,2 мг), 12 (17,1%) — симвастатин (средняя доза 20±10 мг). Средняя продолжительность терапии составляла 6 мес, максимальная — 6 лет.
В 1-ю группу вошли 70 человек с сохраненной систолической функцией левого желудочка и подтвержденной ИБС 2—3 ФК по NYHA. Во 2-ю группу (контрольная) включены 45 человек без ИБС, которые не получали гиполипидемическую терапию. Клиническая характеристика пациентов представлена в табл. 1. У всех больных оценивали факторы риска ИБС и уровень ИРФ-1. Пациенты обеих групп были сопоставимы по ИМТ и возрасту; мужчин было больше в группе больных ИБС. Группы значимо не различались по соотношению ОТ/ОБ, длительности течения АГ, проценту больных с нарушением толерантности к глюкозе (НТГ), процентному соотношению курящих. Все больные в группе ИБС, за исключением 4 человек, у которых ИБС была выявлена впервые, получали статины; 29 (41,1%) человек — розувастатин (средняя доза 10±4,8 мг), 25 (35,7%) — аторвастатин (средняя доза 20±9,2 мг), 12 (17,1%) — симвастатин (средняя доза 20±10 мг). Средняя продолжительность терапии составляла 6 мес, максимальная — 6 лет.
Таблица 1. Клиническая характеристика пациентов с ИБС и без ИБС по традиционным факторам риска
Показатель | Группа ИБС (n=70) | Группа без ИБС (n=45) | р |
Возраст, годы | 56,6±6,2 | 54,5±5,7 | 0,041 |
Пол м/ж, % | 93/7 | 75,6/24,4 | 0,03 |
ИМТ, кг/м2 | 28,9±3,5 | 28,1±4,2 | 0,362 |
САД, мм рт. | 124±10,2/80±4,6 | 128±9/83±6,8 | 0,081/0,136 |
ОТ/ОБ | 0,98±0,09 | 1±0,06 | 0,493 |
Ожирение I степени, % | 37,2 | 38,5 | 0,917 |
Избыточная масса тела, % | 44,2 | 53,8 | 0,436 |
НТГ, % | 30 | 27,8 | 0,356 |
АГ, % | 82,2 | 60,7 | 0,03 |
Длительность АГ, годы | 6,2±6,6 | 5,6±6,7 | 0,59 |
Курение, % | 49,2 | 41,9 | 0,095 |
В биохимическом анализе крови наблюдались значимые различия уровней общего ХС, ХС ЛПНП, ХС ЛПВП, фибриногена между группами. Концентрации ТГ в обеих группах были одинаковыми (табл. 2).
Концентрации ТГ в обеих группах были одинаковыми (табл. 2).
Таблица 2. Показатели биохимического анализа крови в группах ИБС и без ИБС
Показатель | Группа ИБС (n=70) | Группа без ИБС (n=45) | p |
ХС общий, ммоль/л | 4,8±1,4 | 6±1,2 | 0,000 |
ХС-ЛПНП, ммоль/л | 2,9±1,1 | 3,5±0,9 | 0,010 |
ХС-ЛПВП, ммоль/л | 1±0,2 | 1,4±0,6 | 0,020 |
ТГ, ммоль/л | 1,9±1,1 | 1,9±1,6 | 0,822 |
Фибриноген, мг/л | 3,9±0,9 | 3,2±0,8 | 0,003 |
Основные результаты исследования
Уровень ИРФ-1 в группе пациентов с ИБС был выше, чем в группе без ИБС (табл. 3).
3).
Таблица 3. Уровень ИРФ-1 у пациентов с ИБС и без ИБС
Показатель | Группа ИБС (n=70) | Группа без ИБС (n=45) | р |
ИРФ-1, нг/мл | 195,9 (160,5; 248,3) | 167 (123,2; 212) | 0,014 |
ИРФ-1 dif, нг/мл | 42,5 (7,6; 95,2) | 10,2 (–32,4; 53,5) | 0,007 |
При сравнении больных с нормальным и повышенным уровнем ИРФ-1 выявлены значимые различия по следующим показателям: наличие АГ, КДР ЛЖ, длительность приема статинов, уровень фибриногена (табл. 4).
Таблица 4. Сравнение больных с нормальным и повышенным уровнями ИРФ-1
Показатель | Нормальная концентрация ИРФ-1 (n=83) | Повышенная концентрация ИРФ-1 (n=32) | р |
АГ, % | 66 | 88 | 0,05 |
Ожирение, % | 28,9 | 53 | 0,064 |
Курение, % | 41,2 | 64 | 0,097 |
КДР, мм | 49,1±4,3 | 50,4±6,0 | 0,047 |
Длительность приема статинов, годы | 0,4±0,5 | 1,2±1,1 | 0,04 |
ИБС, % | 51,8 | 83,9 | 0,006 |
Фибриноген, мг/л | 3,4±1,1 | 3,9±0,4 | 0,02 |
Найдена положительная корреляция уровня ИРФ-1 с толщиной МЖП, ЗСЛЖ, курением, содержанием фибриногена и терапией статинами, а также отрицательная корреляция с уровнем ХС, ХС ЛПНП, ХС ЛПВП (табл. 5). Корреляция уровня ИФР-1 с КДО, КСО и ФВ выявлена у больных, получающих терапию статинами более полугода. Отдельно проанализированы корреляции отклонения от среднего уровня ИРФ-1 (табл. 6).
5). Корреляция уровня ИФР-1 с КДО, КСО и ФВ выявлена у больных, получающих терапию статинами более полугода. Отдельно проанализированы корреляции отклонения от среднего уровня ИРФ-1 (табл. 6).
Таблица 5. Корреляции уровня ИРФ-1 c другими показателями
Показатель | ИРФ-1 |
МЖП, мм | R=0,229; p=0,029 |
ЗСЛЖ, мм | R=0,258; p=0,019 |
КДО, мл | R=0,452; p=0,026 |
ФВ, % | R=0,307; p=0,037 |
Курение | R=0,274; p=0,004 |
Фибриноген, мг/л | p≥0,05 |
ТГ, ммоль/л | R=0,316; p=0,006 |
Длительность приема статинов, лет | R=0,183; p=0,026 |
ХC, ммоль/л | R=–0,186; p=0,031 |
ХC ЛПВП, ммоль/л | R=–0,146; p=0,078 |
Таблица 6. Корреляции ИРФ-1dif с другими показателями
Корреляции ИРФ-1dif с другими показателями
Показатель | ИРФ-1dif |
МЖП, мм | R=0,247; p=0,02 |
ЗСЛЖ, мм | R=0,258; p=0,019 |
КДО, мл | R=0,422; p=0,036 |
КСО, мл | R=0,407; p=0,042 |
КДР, мм | R=0,27; p=0,014 |
ФВ, % | R=0,298; p=0,041 |
Степень АГ | R=0,187; p=0,04 |
АГ | R=0,231; p=0,025 |
Курение | R=0,3; p=0,009 |
Фибриноген, мг/л | R=0,274; p=0,033 |
Холестерин, ммоль/л | R=–0,213; p=0,016 |
ЛПНП, ммоль/л | R=–0,184; p=0,038 |
Длительность приема статинов, лет | R=0,311; p=0,000 |
Средний уровень ИРФ-1 повышался в прямой зависимости от выраженности гиполипидемического эффекта статинов, хотя разница не достигла статистической значимости (табл. 7). При изучении уровня ИРФ-1 в зависимости от дозы препарата были отдельно проанализированы пациенты, получающие розувастатин и аторвастатин. Числа больных, получавших симвастатин, было недостаточно для анализа. Найдена умеренная прямая зависимость между концентрацией ИРФ-1 и дозой розувастатина (R=0,521; р=0,028), но не аторвастатина.
7). При изучении уровня ИРФ-1 в зависимости от дозы препарата были отдельно проанализированы пациенты, получающие розувастатин и аторвастатин. Числа больных, получавших симвастатин, было недостаточно для анализа. Найдена умеренная прямая зависимость между концентрацией ИРФ-1 и дозой розувастатина (R=0,521; р=0,028), но не аторвастатина.
Таблица 7. Средний уровень ИРФ-1 при приеме статинов разного класса
Показатель | Симвастатин (n=12) | Аторвастатин (n=25) | Розувастатин (n=29) | р |
ИРФ-1, нг/мл | 198,9 | 214,9 | 227,3 | >0,05 |
ИРФ-1 dif, нг/мл | 66,7 | 72,8 | 79,1 | >0,05 |
При многофакторном регрессионном анализе в качестве независимых переменных были включены основные факторы риска: возраст, пол, ИМТ, уровень ХС, ТГ, ХС ЛПНП, ХС ЛПВП, фибриногена, курение, наличие АГ, а также длительность терапии статинами. В результате остался значимым один фактор — терапия статинами (β=0,415, В=20,5).
В результате остался значимым один фактор — терапия статинами (β=0,415, В=20,5).
Нежелательные явления
При проведении медицинских вмешательств в ходе исследования нежелательные явления отмечены не были.
Обсуждение
Резюме основного результата исследования
Терапия статинами ассоциирована с увеличением концентрации ИРФ-1 у пациентов без СД. Повышенный уровень ИРФ-1 коррелирует с факторами риска развития ИБС — АГ, липидным спектром, уровнем фибриногена, а также может негативно влиять на прогноз ХСН, изменяя геометрию миокарда.
Обсуждение основного результата исследования
Ухудшение сердечно-сосудистого прогноза наблюдается как при дефиците ИРФ-1, так и при повышении его уровня. В крупном исследовании с участием 6773 человек была выявлена статистически значимая связь повышенного уровня ИРФ-1 с высоким риском развития ИБС [13]. В другом исследовании [14], включавшем 4057 пациентов, была найдена значимая корреляция между низким уровнем ИРФ-1 и риском развития ИБС. Противоречивость результатов можно объяснить неоднородностью изучаемых групп в отношении возраста, проводимой терапии и сопутствующей патологией, в том числе СД2. В нашем исследовании группы больных были однородными по этим показателям (возраст 45—65 лет, отсутствие выраженной сопутствующей патологии и заместительной гормонотерапии. СД был исключен результатами ПГГТ. В группе ИБС значимо чаще выявлялось повышение уровня ИРФ-1. При анализе факторов, связанных с его повышением, найдена положительная ассоциация с длительностью терапии статинами и курением. С повышенным уровнем ИРФ-1 коррелировали и такие факторы, как АГ, концентрация фибриногена и показатели ЭхоКГ (толщина МЖП, ЗСЛЖ, КДР, КДО, КСО, ФВ).
Противоречивость результатов можно объяснить неоднородностью изучаемых групп в отношении возраста, проводимой терапии и сопутствующей патологией, в том числе СД2. В нашем исследовании группы больных были однородными по этим показателям (возраст 45—65 лет, отсутствие выраженной сопутствующей патологии и заместительной гормонотерапии. СД был исключен результатами ПГГТ. В группе ИБС значимо чаще выявлялось повышение уровня ИРФ-1. При анализе факторов, связанных с его повышением, найдена положительная ассоциация с длительностью терапии статинами и курением. С повышенным уровнем ИРФ-1 коррелировали и такие факторы, как АГ, концентрация фибриногена и показатели ЭхоКГ (толщина МЖП, ЗСЛЖ, КДР, КДО, КСО, ФВ).
Терапия статинами проводилась только в группе ИБС. Длительность лечения статинами была статистически значимо связана с превышеним уровня ИРФ-1 нормальных границ. В группе ИБС коэффициент корреляции (R) составлял всего 0,257 (p=0,017), но при добавлении к этой группе пациентов без ИБС, которые не принимали статины, коэффициент корреляции возрастал до 0,311 (p=0,000). Дозозависимое влияние на уровень ИРФ-1 проявлялось при приеме розувастатина (R=0,521; р=0,028), но не аторвастатина. Это можно объяснить меньшей терапевтической активностью препаратов класса аторвастатина или небольшим объемом выборки. Существуют доказательства прямого влияния статинов на уровень ИРФ-1. Ингибиторы ГМК-КoA-редуктазы снижают образование мевалоновой кислоты — раннего предшественника в биосинтезе холестерина. In vitro показано, что истощение запасов мевалоновой кислоты приводит к уменьшению уровня долихола и изопреноидов, которые необходимы для нормального функционирования рецептора ИРФ-1 [15]. В 2013 г. проведено первое двойное слепое плацебо-контролируемое исследование, обнаружившее снижение уровней ИРФ-1 и ИРФ-связывающего протеина-3 (ИРФСП3) при терапии больных СД аторвастатином. Изменение концентрации ИРФСП1 зависело от дозы аторвастатина: высокие его дозы (80 мг) снижали уровень ИРФСП1, низкие (10 мг) — повышали. Причины этого предположительно связаны с влиянием статинов на углеводный обмен [16].
Дозозависимое влияние на уровень ИРФ-1 проявлялось при приеме розувастатина (R=0,521; р=0,028), но не аторвастатина. Это можно объяснить меньшей терапевтической активностью препаратов класса аторвастатина или небольшим объемом выборки. Существуют доказательства прямого влияния статинов на уровень ИРФ-1. Ингибиторы ГМК-КoA-редуктазы снижают образование мевалоновой кислоты — раннего предшественника в биосинтезе холестерина. In vitro показано, что истощение запасов мевалоновой кислоты приводит к уменьшению уровня долихола и изопреноидов, которые необходимы для нормального функционирования рецептора ИРФ-1 [15]. В 2013 г. проведено первое двойное слепое плацебо-контролируемое исследование, обнаружившее снижение уровней ИРФ-1 и ИРФ-связывающего протеина-3 (ИРФСП3) при терапии больных СД аторвастатином. Изменение концентрации ИРФСП1 зависело от дозы аторвастатина: высокие его дозы (80 мг) снижали уровень ИРФСП1, низкие (10 мг) — повышали. Причины этого предположительно связаны с влиянием статинов на углеводный обмен [16]. Исследования с участием пациентов без диабета не проводились.
Исследования с участием пациентов без диабета не проводились.
Последние данные указывают на повышение риска СД у больных, получающих липидоснижающую терапию статинами [17]. Согласно результатам метаанализа, статины повышают риск развития СД на 9%, а высокие их дозы — на 12%. Прием статинов ухудшал гликемический профиль у больных СД. Предположительно это связано с выраженным структурным и функциональным сходством ИФР-1 и инсулина. Низкая концентрация ИРФ-1 ассоциируется с НТГ и СД. Находят ассоциацию также между гиперинсулинемией и высокой концентрацией ИРФ-1. Инсулин снижает содержание ИРФСП-1 и -2, которые ограничивают биодоступность ИРФ-1 для периферических тканей. Таким образом, высокий уровень ИРФ-1 связан с повышенным риском развития СД [18]. Исследование JUPITER (Justification for the Use of Statins in Prevention: an Intervention Trial Evaluation Rosuvastatin) выявило 27% повышение риска развития СД в группе, насчитывающей 18 тыс. человек. Дополнительное исследование показало 48% увеличение риска СД среди женщин, получающих Крестор [19]. Европейским обществом кардиологов в 2016 г. в качестве гиполипидемической терапии рекомендован прием препаратов только класса симвастатина и аторвастатина [1].
Европейским обществом кардиологов в 2016 г. в качестве гиполипидемической терапии рекомендован прием препаратов только класса симвастатина и аторвастатина [1].
Между курением и уровнем ИРФ-1 существует отрицательная связь. Прямое тормозящее влияние никотина на секрецию ИРФ-1 показано в исследовании с участием пациентов с ревматоидным артритом [20]. Имеются и данные о повышении уровня ИРФ-1 в сыворотке под влиянием курения [21]. Современное представление о механизмах влияния никотина на концентрацию ИРФ-1 исходит из дисфункции гипоталамо-гипофизарной оси, в которой центральную роль играют ГР, нейропептид Y и лептин [20]. Результаты нашего исследования свидетельствуют о том, что курение может быть одной из причин повышения ИРФ-1 как при ИБС, так и без нее. Влияние курения на уровень ИРФ-1 выражено слабее, чем действие ингибиторов ГМК-КоА-редуктазы, что подтверждают результаты регрессионного анализа. Для уточнения дозозависимого влияния разных классов ингибиторов ГМК-КоА-редуктазы на уровень ИРФ-1 необходимы динамические исследования с участием больщего числа пациентов.
Ограничения исследования
Ограничение исследования связано с отсутствием группы больных ИБС, не получающих терапию статинами. Формирование такой группы невозможно по этическим причинам. Так как уровень ИРФ-1 в сыворотке зависит от многих факторов, таких как возраст, сопутствующая патология и применяемая терапия, полученные результаты могут распространяться только на лиц, соответствующих критериям включения в данное исследование.
Заключение
Повышение уровня ИРФ-1 ассоциировано с такими факторами риска ИБС, как концентрация липидов, фибриногена и АГ, а также показателями ЭхоКГ, регистрируемыми в среднем через 6 мес от начала приема ингибиторов ГМК-КоА-редуктазы. Таким образом, повышенный уровень ИРФ-1 у пациентов без CД можно рассматривать как дополнительный фактор риска развития атеросклероза. Дозозависимый эффект розувастатина выражен отчетливее, чем влияние аторвастатина и симвастатина на уровень ИРФ-1. Будущие исследования должны ответить на вопрос о целесообразности применения розувастатина у пациентов с низким сердечно-сосудистым риском, а также оценить риск злокачественных новообразований. Изучение динамики ИРФ-1 у больных ИБС позволит контролировать терапию и побочные эффекты статинов, а также, вероятно, идентифицировать пациентов с повышенным риском СД.
Изучение динамики ИРФ-1 у больных ИБС позволит контролировать терапию и побочные эффекты статинов, а также, вероятно, идентифицировать пациентов с повышенным риском СД.
Дополнительная информация
Источник финансирования. Исследование проведено при поддержке ФГБУ «НМИЦ эндокринологии» Минздрава России.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов: концепция и дизайн исследования — О.В. Шпагина, И.З. Бондаренко; сбор и обработка материала — О.В. Шпагина, И.З. Бондаренко, Г.С. Колесникова; статистическая обработка данных и написание текста — О.В. Шпагина; редактирование — И.З. Бондаренко. Все авторы прочли и одобрили финальную версию статьи перед публикацией.
1. Piepoli MF, Hoes AW, Agewall S, et al. European guidelines on cardiovascular disease prevention in clinical practice: the sixth joint task force of the European society of cardiology and other societies on cardiovascular disease prevention in clinical practice (constituted by representatives of 10 societies and by invited experts) developed with the Special contribution of the European association for cardiovascular prevention & rehabilitation (EACPR). Eur Heart J. 2016;37(29):2315-2381. doi: 10.1093/Eurheartj/Ehw106
European guidelines on cardiovascular disease prevention in clinical practice: the sixth joint task force of the European society of cardiology and other societies on cardiovascular disease prevention in clinical practice (constituted by representatives of 10 societies and by invited experts) developed with the Special contribution of the European association for cardiovascular prevention & rehabilitation (EACPR). Eur Heart J. 2016;37(29):2315-2381. doi: 10.1093/Eurheartj/Ehw106
2. Salmon WDJr, Daughaday WH. A hormonally controlled serum factor which stimulates sulfate incorporation by cartilage in vitro. J Lab Clin Med. 1957;49(6):825-836.
3. Puche JE, Castilla-Cortazar I. Human conditions of insulin-like growth factor-I (IGF-I) deficiency. J Transl Med. 2012;10:224. doi: 10.1186/1479-5876-10-224
4. Higashi Y, Pandey A, Goodwin B, Delafontaine P. Insulin-like growth factor-1 regulates glutathione peroxidase expression and activity in vascular endothelial cells: implications for atheroprotective actions of insulin-like growth factor-1. Biochim Biophys Acta. 2013;1832(3):391-399. doi: 10.1016/J.Bbadis.2012.12.005
Higashi Y, Pandey A, Goodwin B, Delafontaine P. Insulin-like growth factor-1 regulates glutathione peroxidase expression and activity in vascular endothelial cells: implications for atheroprotective actions of insulin-like growth factor-1. Biochim Biophys Acta. 2013;1832(3):391-399. doi: 10.1016/J.Bbadis.2012.12.005
5. Bach LA. Endothelial cells and the IGF system. J Mol Endocrinol. 2015;54(1):R1-R13. doi: 10.1530/JME-14-0215
6. Higashi Y, Quevedo HC, Tiwari S, et al. Interaction between insulin-like growth factor-1 and atherosclerosis and vascular aging. Front Horm Res. 2014;43:107-124. doi: 10.1159/000360571
7. Higashi Y, Sukhanov S, Shai SY, et al. Insulin-like growth factor-1 receptor deficiency in macrophages accelerates atherosclerosis and induces an unstable plaque phenotype in apolipoprotein E-deficient mice. Circulation. 2016;133(23):2263-2278. doi: 10.1161/Circulationaha.116.021805
Circulation. 2016;133(23):2263-2278. doi: 10.1161/Circulationaha.116.021805
8. Caplice N, Devoe M, Choi J, et al. P2125 randomised placebo controlled trial evaluating the safety and efficacy of intracoronary insulin like growth factor 1 post percutaneous intervention for acute myocardial infarction. Eur Heart J. 2017;38(suppl_1). doi: 10.1093/eurheartj/ehx502.P2125
9. Jang HJ, Hong EM, Park SW, et al. Statin induces apoptosis of human colon cancer cells and down regulation of insulin-like growth factor 1 receptor VIA proapoptotic ERK activation. Oncol Lett. 2016;12(1):250-256. doi: 10.3892/Ol.2016.4569
10. Schiller NB, Shah PM, Crawford M, et al. Recommendations for quantitation of the left ventricle by two-dimensional echocardiography. J Am Soc Echocardiogr. 1989;2(5):358-367. doi: 10.1016/S0894-7317(89)80014-8
J Am Soc Echocardiogr. 1989;2(5):358-367. doi: 10.1016/S0894-7317(89)80014-8
11. Bruce RA, Blackmon JR, Jones JW, Strait G. Exercising testing in adult normal subjects and cardiac patients. Pediatrics. 1963;32:Suppl:742-756.
12. Judkins MP. Percutaneous transfemoral selective coronary arteriography. Radiol Clin North Am. 1968;6(3):467-492.
13. Schneider HJ, Klotsche J, Saller B, et al. Associations of age-dependent IGF-I SDS with cardiovascular diseases and risk conditions: cross-sectional study in 6773 primary care patients. Eur J Endocrinol. 2008;158(2):153-161. doi: 10.1530/Eje-07-0600
14. Friedrich N, Haring R, Nauck M, et al. Mortality and serum insulin-like growth factor (IGF)-I and IGF binding protein 3 concentrations. J Clin Endocrinol Metab. 2009;94(5):1732-1739. doi: 10.1210/Jc.2008-2138
J Clin Endocrinol Metab. 2009;94(5):1732-1739. doi: 10.1210/Jc.2008-2138
15. Siddals KW, Marshman E, Westwood M, Gibson JM. Abrogation of insulin-like growth factor-I (IGF-I) and insulin action by mevalonic acid depletion: synergy between protein prenylation and receptor glycosylation pathways. J Biol Chem. 2004;279(37):38353-38359. doi: 10.1074/Jbc.M404838200
16. Narayanan RP, Gittins M, Siddals KW, et al. Atorvastatin administration is associated with dose-related changes in IGF bioavailability. Eur J Endocrinol. 2013;168(4):543-548. doi: 10.1530/Eje-12-0844
17. Preiss D, Seshasai SR, Welsh P, et al. Risk of incident diabetes with intensive-dose compared with moderate-dose statin therapy: a metaanalysis. JAMA. 2011;305(24):2556-2564. doi: 10.1001/Jama.2011.860
doi: 10.1001/Jama.2011.860
18. Schneider HJ, Friedrich N, Klotsche J, et al. Prediction of incident diabetes mellitus by baseline IGF1 levels. Eur J Endocrinol. 2011;164(2):223-229. doi: 10.1530/Eje-10-0963
19. Ridker PM, Pradhan A, Macfadyen JG, et al. Cardiovascular benefits and diabetes risks of statin therapy in primary prevention: an analysis from the jupiter trial. Lancet. 2012;380(9841):565-571. doi: 10.1016/S0140-6736(12)61190-8
20. Erlandsson MC, Doria Medina R, Toyra Silfversward S, Bokarewa MI. Smoking functions as a negative regulator of IGF1 and impairs adipokine network in patients with rheumatoid arthritis. Mediators Inflamm. 2016;2016:3082820. doi: 10.1155/2016/3082820
21. Kaklamani VG, Linos A, Kaklamani E, et al. Age, sex, and smoking are predictors of circulating insulin-like growth factor 1 and insulin-like growth factor-binding protein 3. J Clin Oncol. 1999;17(3):813-817. doi: 10.1200/Jco.1999.17.3.813
Kaklamani VG, Linos A, Kaklamani E, et al. Age, sex, and smoking are predictors of circulating insulin-like growth factor 1 and insulin-like growth factor-binding protein 3. J Clin Oncol. 1999;17(3):813-817. doi: 10.1200/Jco.1999.17.3.813
Липофильные статины могут снижать риск развития рака печени при хроническом гепатите
Использование жирорастворимых статинов, вероятно, снижает риск развития гепатоцеллюлярной карциномы при хроническом вирусном гепатите, что позволяет снизить смертность в этой группе пациентов. Такие результаты получены в крупном сравнительном исследовании, включавшем более 16 тысяч пациентов и опубликованные в новом номере журнала «Annals of Internal Medicine».
Исследование было основано на ретроспективном анализе данных Шведского национального реестра, включавшего 63 279 взрослых пациентов с подтвержденным гепатитом B или гепатитом C, которые начали терапию статинами с 2005 по 2013 годы. Из них были выбраны 16 668 пациентов: 6554 принимали липофильные статины (аторвастатин, симвастатин, флувастатин или ловастатин), а 1780 – гидрофильные (правастатин или розувастатин). Группу контроля составили 8334 пациентов с гепатитом С, не принимавших статины.
Из них были выбраны 16 668 пациентов: 6554 принимали липофильные статины (аторвастатин, симвастатин, флувастатин или ловастатин), а 1780 – гидрофильные (правастатин или розувастатин). Группу контроля составили 8334 пациентов с гепатитом С, не принимавших статины.
Медиана наблюдения составила 8 лет, за это время было отмечено 616 случаев ГЦК и 1803 случая смерти, из них 462 по причине заболеваний печени. Риск развития гепатоцеллюлярной карциномы при приеме липофильных статинов снижался с 8,1% до 3,3% (ОР 0,56; 95% ДИ, 0,41-0,79).
Прием же гидрофильных статинов снижал риск до 6,8%, что не дало достоверных различий (ОР 0,95%; 95% ДИ, 0,86-1,08). Липофильные статины достоверно снижали риск смерти от заболеваний печени (отношение рисков (ОР) 0,76; 95% доверительный интервал (ДИ) 0,50–0,92), а у гидрофильных такой эффект отсутствовал (ОР 0,98; 95% ДИ 0,72–1,46). Авторы сделали дополнительные поправки на наличие у пациентов цирроза печени, применение противовирусной терапии и анамнез наркотической зависимости, однако эти факторы не влияли на снижение риска.
Эффект оказался дозозависимым: если кумулятивная принятая пациентом доза препарата составляла менее 300 терапевтических значений, риск развития рака снижался на 3,4%, а если более 600 терапевтических доз – на 5,9% (р <0,001). Дозозависимым было и снижение риска смерти от всех причин (–7,1% и –9,6% соответственно; р = 0,001). Примечательно, что снижение риска зависело от длительности приемы статина. Если препараты назначались в небольшой дозе, для развития максимального эффекта требовалось принимать их не менее 2 лет.
Различия в эффективности разных групп статинов объясняется тем, что липофильные препараты абсорбируются в гепатоциты через клеточные мембраны, в то время как гидрофильные требуют работы специфических белков-переносчиков, активность которых при фиброзе печени снижается.
Исследования in vitro показывают, что липофильные статины чаще предотвращают репликацию вируса гепатита, стимулируют противоопухолевый иммунитет и усиливают эффективность противовирусной терапии, чем гидрофильные.
Одной из основных целей лечения гепатита С в настоящее время является профилактика осложнений, в частности, развития карциномы печени, что делает результаты данного исследования очень актуальными. С другой стороны, его ограничениями являются сравнительный дизайн, небольшое число исходов и тот факт, что в него были включены преимущественно пациенты европеоидной расы, хотя широко известно, что эпидемиология гепатоцеллюлярного рака отличается у белых европейцев и у азиатов. Поэтому авторы признают, что необходимы хорошо спланированные рандомизированные исследования, прежде чем можно будет рекомендовать изменить клиническое применение этих препаратов.
Источники:
https://www.medscape.com/
https://annals.org/
Текст подготовил: к.м.н. Круглый Л.Б.
Розувастатин: победитель в статиновых войнах, здоровье пациентов не зависит потрачено в США на розувастатин, чем на любой другой статин. Тем не менее, доказательства его пользы для здоровья всегда были слабыми, и появляется все больше доказательств вредных побочных эффектов.
 Сидни Вулф объясняет, почему он считает, что препарат следует отозвать и почему его не следует использовать
Сидни Вулф объясняет, почему он считает, что препарат следует отозвать и почему его не следует использоватьВ прошлом году розувастатин (Крестор) был наиболее прописываемым фирменным препаратом в США — 22.Выпущено 3 миллиона рецептов и объем продаж 5,8 млрд долларов США (3,9 млрд фунтов стерлингов; 5,5 млрд евро). Мировые продажи в 2013 г. составили 8,2 млрд долларов США, что является третьим по величине показателем для любых брендовых лекарств2. все больше свидетельств рисков, как это произошло? Короткий ответ заключается в том, что среди статинов, все еще имеющихся на рынке, эффективность розувастатина в снижении уровня холестерина в миллиграммах превосходит все остальные, и этот факт используется в рекламных кампаниях. Но как насчет реального улучшения здоровья, предотвращения сердечных приступов и инсультов?
Меньше доказательств клинической пользы после утверждения.
Когда розувастатин был одобрен в США в 2003 году для снижения холестерина, три других статина — симвастатин, правастатин и ловастатин — уже получили дополнительное разрешение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов для снижения риска сердечно-сосудистых заболеваний. и четвертый, аторвастатин, показал такую клиническую пользу в 2004 году.3
и четвертый, аторвастатин, показал такую клиническую пользу в 2004 году.3
Но розувастатин не получил одобрения в отношении сердечно-сосудистого риска до 2010 года, и то только для первичной профилактики сердечных приступов и инсультов. Одобрение было основано на результатах исследования JUPITER, в которое вошли только пациенты с холестерином липопротеидов низкой плотности (ЛПНП) <130 мг / дл (3,4 ммоль / л) и с реактивным белком С ≥ 2 мг / л (19 нмоль / л). 4 и поэтому имеет ограниченную возможность обобщения.
Другие критические замечания в адрес исследования включают озабоченность по поводу того, что размер пользы от лечения мог быть преувеличен из-за преждевременного прекращения исследования.5 Моделирование показывает, что преждевременно прекращенные испытания постоянно переоценивают эффекты лечения. Это подтверждается исследованием, сравнивающим размер преимуществ в 91 рандомизированном контролируемом испытании, которое было прекращено досрочно или сокращено, с таковыми в 424 испытаниях без усечения, сопоставленных по тем же вопросам исследования болезни. Объединенные результаты показали, что испытания были прекращены досрочно, чтобы «систематически переоценивать эффекты лечения для исходов, которые привели к раннему прекращению», особенно с исследованиями, остановленными менее чем на 500 клинических событиях.6 Когда JUPITER был преждевременно прекращен из-за пользы, накопленное количество клинических событий составило 393.2 Относительно больший эффект, наблюдаемый в JUPITER, чем в других исследованиях статинов, почти наверняка, по крайней мере частично, связан с его преждевременным прекращением. Уменьшение пользы может быть перевешено рисками розувастатина.
Объединенные результаты показали, что испытания были прекращены досрочно, чтобы «систематически переоценивать эффекты лечения для исходов, которые привели к раннему прекращению», особенно с исследованиями, остановленными менее чем на 500 клинических событиях.6 Когда JUPITER был преждевременно прекращен из-за пользы, накопленное количество клинических событий составило 393.2 Относительно больший эффект, наблюдаемый в JUPITER, чем в других исследованиях статинов, почти наверняка, по крайней мере частично, связан с его преждевременным прекращением. Уменьшение пользы может быть перевешено рисками розувастатина.
К тому времени, когда розувастатин был одобрен для первичной профилактики в 2010 году, три наиболее назначаемых статина были одобрены как для первичной, так и для вторичной профилактики после многочисленных испытаний, в том числе у пациентов с повышенным холестерином ЛПНП, и показали положительный эффект (аторвастатин, четыре испытания; правастатин). , три испытания и симвастатин, два испытания). 3
3
Больше доказательств рисков
Помимо того, что доказательства клинической пользы розувастатина значительно ниже, чем у этих трех статинов, появляется все больше доказательств того, что этот препарат также несет более высокий риск серьезных побочных эффектов. Предварительно определенные результаты в исследовании JUPITER2 включали не только сердечно-сосудистые конечные точки, но и впервые возникший диабет. По иронии судьбы, причиной включения этой «обнадеживающей» конечной точки было то, что более раннее исследование показало, что правастатин снижает количество впервые возникших диабетов.7 8 В группе JUPITER, однако, была значительно более высокая частота (26%) впервые возникшего диабета в группе розувастатина по сравнению с группой плацебо.
Недавний обзор 17 рандомизированных исследований с участием 113 394 пациентов, сравнивающих риск нового развития диабета для различных статинов, подтвердил этот вывод.9 Лечение розувастатином по сравнению с плацебо было связано с 25% относительным увеличением риска развития диабета. ; правастатин был связан с наименьшим риском, увеличившись на 7%.Более раннее обсервационное исследование 240000 пациентов, начинающих лечение статинами, также показало, что розувастатин был связан с самым высоким повышенным риском диабета, а правастатин — с наименьшим.10
; правастатин был связан с наименьшим риском, увеличившись на 7%.Более раннее обсервационное исследование 240000 пациентов, начинающих лечение статинами, также показало, что розувастатин был связан с самым высоким повышенным риском диабета, а правастатин — с наименьшим.10
Различия в впервые возникшем диабете, вероятно, вызваны разными метаболическими эффектами розувастатина и правастатин. В другом рандомизированном исследовании пациентов с повышенным холестерином розувастатин значительно увеличивал уровни гликированного гемоглобина (HbA 1C ) и уровни инсулина натощак, а также снижал чувствительность к инсулину, тогда как правастатин значительно снижал HbA 1C и уровни инсулина натощак, а также повышал чувствительность к инсулину.11 Недавно были рассмотрены дополнительные доказательства различных метаболических эффектов статинов.12
В утвержденной FDA маркировке розувастатина теперь говорится: «В JUPITER была значительно более высокая частота сахарного диабета у пациентов, принимавших розувастатин (2,8%), по сравнению с пациентами, принимавшими плацебо. (2,3%) »13. На этикетках других статинов просто указано, что« при применении ингибиторов HMG-CoA редуктазы сообщалось о повышении уровня HbA1c и уровня глюкозы в сыворотке крови натощак ».
(2,3%) »13. На этикетках других статинов просто указано, что« при применении ингибиторов HMG-CoA редуктазы сообщалось о повышении уровня HbA1c и уровня глюкозы в сыворотке крови натощак ».
Другие серьезные проблемы были выявлены до утверждения розувастатина.Public Citizen выступила против утверждения розувастатина в 2003 г., 14 а в 2004 г. обратилась в FDA с просьбой запретить этот препарат из-за двух серьезных побочных реакций15. Первым был рабдомиолиз. Розувастатин — единственный статин, у которого рабдомиолиз был обнаружен в рандомизированных контролируемых клинических исследованиях до того, как препарат был одобрен. Даже с церивастатином, который в конечном итоге был запрещен из-за рабдомиолиза, в клинических испытаниях до его утверждения не было зарегистрировано ни одного случая. В недавнем исследовании 641 703 пациентов в Великобритании, которым назначались различные статины, у тех, кто принимал розувастатин, был значительно более высокий риск аномально повышенной активности креатинфосфокиназы, чем у пациентов, принимавших большие суточные дозы других статинов (симвастатин, правастатин или аторвастатин). 16
16
Второй серьезной проблемой, замеченной во время предварительных испытаний, были проблемы с почками. В то время розувастатин был единственным статином, который был связан с протеинурией и гематурией. Согласно документам FDA, «в подгруппе пациентов с мочой, положительной на тест-полоску [белок и кровь], процент пациентов с повышением сывороточного креатинина на 30% по сравнению с исходным уровнем составлял 14%, 16%, 24%, 33% и 41%. % для 5 мг, 10 мг, 20 мг, 40 мг и 80 мг розувастатина соответственно. . . Эти данные предполагают, что у некоторых пациентов с более высоким уровнем протеинурии и гематурии может развиться клинически значимое заболевание почек.17
Хотя FDA отклонило нашу петицию о запрете розувастатина в 2005 году, агентство согласилось с тем, что: «Кроме того, аномалии мочи, в частности протеинурия и гематурия, ранее не отмечавшиеся в обзоре применения других статиновых препаратов и не известные этого класса, спорадически наблюдались у небольшого процента пациентов, получавших розувастатин, причем наибольшая частота встречалась при дозе 80 мг ». 18
18
Дальнейшие опасения по поводу почечных эффектов розувастатина были замечены в рандомизированном исследовании, финансируемом AstraZeneca, в котором сравнивали высокие дозы розувастатина. с аторвастатином у больных сахарным диабетом с прогрессирующим заболеванием почек.19 Хотя розувастатин снижает концентрацию липидов в плазме в большей степени, чем аторвастатин, исследование показало, что «аторвастатин, по-видимому, обладает более выраженным ренопротекторным действием». Экскреция белка с мочой снизилась в течение одного года лечения аторвастатином в дозе 80 мг без значительных изменений в расчетной скорости клубочковой фильтрации (рСКФ). Однако у пациентов, получавших розувастатин в дозе 40 мг, «экскреция белка с мочой существенно не отличалась от исходного уровня, но у пациентов действительно наблюдалось значительное снижение рСКФ по сравнению с исходным уровнем, а в этой группе чаще наблюдались удвоение креатинина сыворотки и острая почечная недостаточность.”19
Почему препарат остается популярным
Учитывая наличие более серьезных рисков и меньшей клинической пользы, чем у других статинов, почему этот препарат так долго действовал?
Пророческий ответ можно найти в редакционной статье Lancet от октября 2003 г. «Статиновые войны: почему AstraZeneca должна отступить» 20. В ней говорилось, что исполнительный директор AstraZeneca Том МакКиллоп «пообещал сделать все возможное, чтобы убедить врачей. для назначения розувастатина, включая запуск рекламной кампании стоимостью 1 миллиард долларов в первый год.«Мы должны придать импульс», — сказал он [Маккиллоп] на недавней встрече инвесторов. «У вас есть шанс выпустить на рынок новый крупный продукт. Это наш шанс »». В заключении редакции: «Врачи должны рассказывать своим пациентам правду о розувастатине, поскольку по сравнению с его конкурентами розувастатин имеет худшую [клиническую] доказательную базу, подтверждающую его безопасное использование. AstraZeneca слишком сильно и быстро подтолкнула свою маркетинговую машину. Маккиллопу пора отказаться от этой беспринципной кампании ».
«Статиновые войны: почему AstraZeneca должна отступить» 20. В ней говорилось, что исполнительный директор AstraZeneca Том МакКиллоп «пообещал сделать все возможное, чтобы убедить врачей. для назначения розувастатина, включая запуск рекламной кампании стоимостью 1 миллиард долларов в первый год.«Мы должны придать импульс», — сказал он [Маккиллоп] на недавней встрече инвесторов. «У вас есть шанс выпустить на рынок новый крупный продукт. Это наш шанс »». В заключении редакции: «Врачи должны рассказывать своим пациентам правду о розувастатине, поскольку по сравнению с его конкурентами розувастатин имеет худшую [клиническую] доказательную базу, подтверждающую его безопасное использование. AstraZeneca слишком сильно и быстро подтолкнула свою маркетинговую машину. Маккиллопу пора отказаться от этой беспринципной кампании ».
Маккиллоп незамедлительно отреагировал, обвинив журнал в том, что он не говорит правду, а затем заявил: «Крестор — тщательно изученный и хорошо переносимый препарат с профилем безопасности, сопоставимым с другими продаваемыми статинами, в сочетании с большей способностью приводить пациентов к их целевым показателям холестерина, чем любой другой. другой отдельный продукт.Ссылаясь на неудовлетворенную потребность в адекватном лечении с помощью гиполипидемической терапии, Маккиллоп заявил, что «с этой насущной медицинской необходимостью немыслимо отказаться от наших усилий, направленных на то, чтобы сделать это лекарство более доступным для врачей и пациентов». 21
другой отдельный продукт.Ссылаясь на неудовлетворенную потребность в адекватном лечении с помощью гиполипидемической терапии, Маккиллоп заявил, что «с этой насущной медицинской необходимостью немыслимо отказаться от наших усилий, направленных на то, чтобы сделать это лекарство более доступным для врачей и пациентов». 21
Не прошло и года, как в декабре 2004 г. FDA США было вынуждено направить AstraZeneca письмо с требованием немедленно остановить рекламу в Washington Post , содержащую ложную и вводящую в заблуждение информацию о рисках Crestor.В объявлении говорилось, что «ученые из FDA, отвечающие за одобрение и постоянный обзор CRESTOR, совсем недавно, в прошлую пятницу, публично подтвердили, что CRESTOR безопасен и эффективен; и что высказанные опасения не имеют медицинского или научного обоснования », — цитируя веб-сайт FDA, который фактически не содержал такой информации22.
Объявление было ответом на статью Washington Post о кампании Public Citizen против препарата. , обсуждая проблемы безопасности, разделяемые нами и FDA.23 В статье Стивен Галсон, исполняющий обязанности директора Центра оценки и исследований лекарственных средств FDA, заявил, что FDA «очень обеспокоено Crestor с того дня, как он был одобрен, и мы очень внимательно за ним следим». Он также заявил, что агентство «обеспокоено теми же проблемами, что и Crestor, что и Public Citizen».
, обсуждая проблемы безопасности, разделяемые нами и FDA.23 В статье Стивен Галсон, исполняющий обязанности директора Центра оценки и исследований лекарственных средств FDA, заявил, что FDA «очень обеспокоено Crestor с того дня, как он был одобрен, и мы очень внимательно за ним следим». Он также заявил, что агентство «обеспокоено теми же проблемами, что и Crestor, что и Public Citizen».
В письме FDA к AstraZeneca говорится: «Печатная реклама« безопасности пациента »содержит ложные или вводящие в заблуждение заявления о безопасности, которые минимизируют риски, связанные с Crestor, тем самым предполагая, что Crestor более безопасен, чем было продемонстрировано существенными доказательствами или значительным клиническим опытом.В следующем году агентство снова написало компании о «вводящих в заблуждение заявлениях о превосходстве» Crestor в других рекламных материалах.24
Когда истек срок действия патентов на симвастатин, правастатин и аторвастатин, рост числа рецептов на генерики быстро сравнялся с резким снижением или превысил его. в рецептах фирменных наименований (данные IMS Health). Срок действия патента на розувастатин истекает в 2016 году, а вместе с ним и AstraZeneca необходимо продвигать его. Но ради здоровья населения мы должны надеяться, что недостатки препарата приведут к резкому сокращению его использования до следующего года.
в рецептах фирменных наименований (данные IMS Health). Срок действия патента на розувастатин истекает в 2016 году, а вместе с ним и AstraZeneca необходимо продвигать его. Но ради здоровья населения мы должны надеяться, что недостатки препарата приведут к резкому сокращению его использования до следующего года.
Примечания
Цитируйте это как: BMJ 2015; 350: h2388
Сноски
Конкурирующие интересы: Я прочитал и понял политику BMJ в отношении декларирования интересов и заявляю, что являюсь основателем Public Citizen.
Провенанс и экспертная оценка: Введен в эксплуатацию; внешняя экспертная оценка.
Ссылки
- ↵
IMS Health. 1 октября 2013 г. — 30 сентября 2014 г. IMS Health, 2014.
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- 000 00030003
- ↵
- ↵
De Zeeuw D, Anzalone DA, Cain VA, et al.
 Почечные эффекты аторвастатина и розувастатина у пациентов с диабетом с прогрессирующим заболеванием почек (ПЛАНЕТА I): рандомизированное клиническое исследование. Lancet Diabetes Endocrinol 2015 4 февраля [Epub перед печатью.]
Почечные эффекты аторвастатина и розувастатина у пациентов с диабетом с прогрессирующим заболеванием почек (ПЛАНЕТА I): рандомизированное клиническое исследование. Lancet Diabetes Endocrinol 2015 4 февраля [Epub перед печатью.] - ↵
- ↵
- ↵
- ↵
- ↵
Различия, сходства и что лучше для вас
Обзор лекарств и основные отличия | Условия лечения | Эффективность | Страхование и сравнение стоимости | Побочные эффекты | Лекарственные взаимодействия | Предупреждения | FAQ
По данным Центров по контролю и профилактике заболеваний (CDC), около 38% взрослых в США имеют высокий уровень холестерина. Если у вас высокий уровень холестерина, врач, скорее всего, посоветует вам, как важно соблюдать диету и заниматься спортом.Ваш врач, возможно, также упомянул о начале приема статинов. Статины — популярные лекарства, отпускаемые по рецепту, также известные как ингибиторы HMG-CoA редуктазы. Они работают, блокируя фермент (называемый HMG-CoA редуктазой), который необходим вашему организму для выработки холестерина.
Crestor и Lipitor — два популярных фирменных статина, используемых для снижения уровня холестерина. Оба препарата одобрены Управлением по контролю за продуктами и лекарствами США (FDA). Их используют вместе с диетой с низким содержанием насыщенных жиров и холестерина, чтобы снизить уровень холестерина.Хотя Крестор и Липитор являются статинами, это не одно и то же. Продолжайте читать, чтобы узнать больше о Crestor и Lipitor.
Каковы основные различия между Crestor и Lipitor?
Crestor и Lipitor — это гиполипидемические препараты. Они также известны как статины или ингибиторы HMG-CoA редуктазы. Оба лекарства доступны в фирменной и генерической форме и только в виде таблеток. AstraZeneca производит фирменный Crestor, а Pfizer производит фирменный Lipitor.Крестор и Липитор в основном используются у взрослых; однако в некоторых случаях они могут применяться у детей.
| Основные различия между Crestor и Lipitor | ||
|---|---|---|
| Класс препарата | Ингибитор HMG-CoA редуктазы (также известный как статин или гиполипидемический агент) | Ингибитор HMG-CoA редуктазы (также известный как статин или гиполипидемический агент) |
| Бренд / общий статус | Брендовые и универсальные | Брендовые и универсальные |
| Что такое общее название? | Розувастатин | Аторвастатин |
| В какой форме (формах) находится препарат? | Планшет | Планшет |
| Какая стандартная дозировка? | Пример: 10 мг в день | Пример: 20 мг в день |
| Как долго длится стандартное лечение? | Долгосрочные | Долгосрочные |
| Кто обычно принимает это лекарство? | Взрослые; дети 7 лет и старше (в отдельных случаях) | Взрослые; дети 10 лет и старше (в отдельных случаях) |
Условия, леченные Crestor и Lipitor
Crestor и Lipitor используются для снижения холестерина. Крестор или липитор следует использовать вместе с диетой с низким содержанием насыщенных жиров и холестерина, когда одна только диета не помогает снизить уровень холестерина. Крестор и липитор снижают общий холестерин, ЛПНП, АпоВ и триглицериды. Они также повышают уровень холестерина ЛПВП, хорошего холестерина.
Крестор или липитор следует использовать вместе с диетой с низким содержанием насыщенных жиров и холестерина, когда одна только диета не помогает снизить уровень холестерина. Крестор и липитор снижают общий холестерин, ЛПНП, АпоВ и триглицериды. Они также повышают уровень холестерина ЛПВП, хорошего холестерина.
Другие показания перечислены в таблице ниже. Крестор и липитор не изучались при лечении дислипидемий типа I и V по Фредриксону.
| Гиперлипидемия и смешанная дислипидемия у взрослых | Есть | Есть |
| Семейная гиперхолестеринемия у детей | Есть | Есть |
| Гипертриглицеридемия у взрослых | Есть | Есть |
| Первичная дисбеталипопротеинемия (гиперлипопротеинемия III типа) у взрослых | Есть | Есть |
| Гомозиготная семейная гиперхолестеринемия у взрослых | Есть | Есть |
| Замедление прогрессирования атеросклероза у взрослых | Есть | Есть |
| Профилактика сердечно-сосудистых заболеваний (инфаркт, болезни сердца) | Есть | Есть |
Крестор или липитор более эффективны?
Исследователи сравнили несколько статинов в клиническом испытании под названием STELLAR (Статиновая терапия для повышения уровня липидов в сравнении с дозами розувастатина). Они изучили влияние Lipitor, Crestor, Zocor и Pravachol на снижение холестерина ЛПНП (липопротеинов низкой плотности) через шесть недель.
Они изучили влияние Lipitor, Crestor, Zocor и Pravachol на снижение холестерина ЛПНП (липопротеинов низкой плотности) через шесть недель.
Исследование пришло к выводу, что Crestor снижает уровень холестерина ЛПНП на 8,2% больше, чем Lipitor, а Crestor снижает общий холестерин значительно больше, чем все другие изученные статины. Крестор также увеличивал холестерин ЛПВП (хороший вид холестерина) в большей степени, чем Липитор. У пациентов, которые принимали Крестор, в зависимости от дозы, 82-89% достигли целевого уровня холестерина ЛПНП по сравнению с 69-85% пациентов, принимавших липитор.Все статины переносились одинаково.
В другом исследовании под названием SATURN (Исследование коронарной атеромы с помощью внутрисосудистого ультразвука: эффект розувастатина по сравнению с аторвастатином) изучались высокие дозы Крестора — 40 мг в день и липитор 80 мг в день — и их влияние на прогрессирование коронарного атеросклероза. Коронарный атеросклероз — это сужение кровеносных сосудов и накопление отложений кальция и жира в артериях, что затрудняет поступление крови к сердцу и увеличивает риск ишемической болезни сердца.
В исследовании также рассматривались безопасность и побочные эффекты. После двух лет приема максимальной дозы в группе Crestor были более низкие уровни ЛПНП и несколько более высокие уровни ЛПВП, чем в группе Lipitor. (Хотя, возможно, стоит отметить, что это исследование финансировала AstraZeneca, производитель Crestor. Кроме того, эти препараты давались в самых высоких дозах, что не так часто встречается в клинических условиях для среднего пациента.) И Crestor, и Lipitor индуцировали регресс атеросклероза в аналогичной степени. Оба препарата хорошо переносились и имели низкую частоту лабораторных отклонений.
В клинических условиях оба препарата широко назначаются и хорошо переносятся. Наиболее эффективное лекарство для вас может быть определено вашим лечащим врачом, который может принять во внимание ваше состояние здоровья, историю болезни и лекарства, которые вы принимаете, которые могут взаимодействовать с Crestor или Lipitor.
Покрытие и сравнение стоимости Crestor и Lipitor
Crestor или Lipitor покрываются большинством страховых и рецептурных планов Medicare в виде генерических форм розувастатина или аторвастатина. Выбор фирменного продукта, скорее всего, приведет к более высокой доплате или может не покрываться.
Выбор фирменного продукта, скорее всего, приведет к более высокой доплате или может не покрываться.
Для типичного рецепта, состоящего из 30 таблеток по 10 мг розувастатина (дженерик Крестор), фактическая цена будет составлять около 134 долларов. Вы можете использовать бесплатный купон SingleCare, чтобы снизить цену до 11 долларов в участвующих аптеках.
Обычный рецепт на 30-20 мг таблеток аторвастатина (дженерик липитор) будет стоить приблизительно 82 доллара, если вы платите из своего кармана. Купон на общий Lipitor от SingleCare может снизить цену примерно до 15 долларов.
Поскольку планы различаются и могут меняться, обратитесь в свою страховую компанию для получения информации о покрытии Crestor и Lipitor.
| Обычно покрывается страховкой? | Да (универсальный) | Да (универсальный) |
| Обычно покрывается программой Medicare Part D? | Да (универсальный) | Да (общий) |
| Кол-во | Пример: таблетки 30, 10 мг | Пример: таблетки по 30, 20 мг |
| Стандартная доплата Medicare | 0–20 долларов | 0–15 долларов |
| Стоимость SingleCare | $ 11 + | $ 15 + |
Общие побочные эффекты Crestor vs.
 Липитор
ЛипиторНаиболее частыми побочными эффектами Крестора являются головная боль, боль в мышцах, боль в животе, тошнота и слабость.
Наиболее частыми побочными эффектами липитора являются простуда, боль в суставах, диарея, боль в конечностях и инфекции мочевыводящих путей.
Редкий, но серьезный побочный эффект Крестора и Липитора — миопатия (мышечная слабость) и рабдомиолиз (разрушение мышечной ткани, которое может быть очень разрушительным). См. Раздел предупреждений для получения дополнительной информации.
Возникновение побочных эффектов может зависеть от дозировки.Это далеко не полный список побочных эффектов. Могут возникнуть другие серьезные побочные эффекты. Поговорите со своим врачом о том, каких побочных эффектов следует ожидать от Crestor или Lipitor и как с ними бороться.
| Побочный эффект | Применимо? | Частота | Применимо? | Частота |
| Головная боль | Есть | 5,5% | № | – |
| Тошнота | Есть | 3. 4% 4% | Есть | 4% |
| Мышечные боли / боль | Есть | 2,8% | Есть | 3,8% |
| Боль в суставах | Есть | Варьируется | Есть | 6,9% |
| Боль в конечностях | № | – | Есть | 6% |
| Инфекция мочевыводящих путей | № | – | Есть | 5.7% |
| Слабость | Есть | 2,7% | Есть | 6,9% |
| Расстройство желудка | № | – | Есть | 4,7% |
| Запор | Есть | 2,4% | № | – |
| Диарея | № | – | Есть | 6,8% |
| Боль в животе | Есть | ≥2% | Есть | % не сообщается |
| Простуда | № | – | Есть | 8. 3% 3% |
Источник: DailyMed (Crestor), DailyMed (Lipitor)
Лекарственное взаимодействие Crestor vs. Lipitor
Важная реакция, которую нужно знать о липиторе, заключается в том, что вы не должны пить чрезмерное количество грейпфрутового сока (более 1,2 литра в день). Избыток грейпфрутового сока может повысить уровень липитора в организме, что повысит вероятность развития миопатии (мышечной слабости) и рабдомиолиза (разрушения мышечной ткани, что может быть очень разрушительным).
Эти мышечные проблемы чаще возникают при повышенном потреблении грейпфрутового сока, но потенциально могут возникать при меньших количествах. Если вы едите грейпфрут или пьете грейпфрутовый сок и принимаете липитор, спросите своего врача, сколько безопасно употреблять, или было бы лучше принять другое лекарство, которое не взаимодействует с грейпфрутом. Crestor не взаимодействует с грейпфрутовым соком.
Crestor и Lipitor имеют одни и те же лекарственные взаимодействия, например, с циклоспорином, гемфиброзилом, ниацином, фенофибратом, колхицином и некоторыми противовирусными препаратами, используемыми для лечения ВИЧ. Комбинация Крестора или Липитора с одним из этих препаратов может повысить уровень статинов, что приведет к более высокому риску миопатии и рабдомиолиза. В зависимости от комбинации лекарств и вашей истории болезни / условий вашему врачу может потребоваться скорректировать дозировку лекарства или выбрать альтернативное лекарство.
Комбинация Крестора или Липитора с одним из этих препаратов может повысить уровень статинов, что приведет к более высокому риску миопатии и рабдомиолиза. В зависимости от комбинации лекарств и вашей истории болезни / условий вашему врачу может потребоваться скорректировать дозировку лекарства или выбрать альтернативное лекарство.
Прежде чем принимать Крестор или Липитор, сообщите своему врачу обо всех лекарствах, которые вы принимаете, включая рецептурные, внебиржевые (OTC) и витамины, чтобы они могли определить, безопасен ли для вас Крестор или Липитор.
| Циклоспорин | Иммунодепрессант | Есть | Есть |
| Гемфиброзил | Лекарства от высоких триглицеридов | Есть | Есть |
| Некоторые противовирусные препараты от ВИЧ | Противовирусные препараты от ВИЧ | Есть | Есть |
| Итраконазол | Азол противогрибковый | № | Есть |
| Кларитромицин | Макролидный антибиотик | № | Есть |
| Даролутамид | Ингибиторы рецепторов андрогенов при раке простаты | Есть | № |
| Регорафениб | Ингибитор киназ при раке | Есть | № |
| Варфарин | Антикоагулянт | Есть | № |
| Ниацин | Антилипемическое средство | Есть | Есть |
| Фенофибрат | Антилипемическое средство | Есть | Есть |
| Колхицин | Средство против подагры | Есть | Есть |
| Maalox Mylanta Rolaids | Антациды | Есть | № |
| Грейпфрутовый сок | Грейпфрутовый сок | № | Есть |
| Рифампицин | Антимикобактериальный | № | Есть |
| Оральные контрацептивы | Оральные контрацептивы | № | Есть |
| Дигоксин | Сердечные гликозиды | № | Есть |
Предупреждения Crestor и Lipitor
- В редких случаях из-за приема статинов может возникнуть мышечная слабость и разрушение.
 Это может произойти с любой дозой, но чаще встречается с более высокими дозами. Используйте с осторожностью у пациентов в возрасте 65 лет и старше, пациентов с проблемами почек и пациентов с неконтролируемым гипотиреозом. Эти риски также увеличиваются, если некоторые другие лекарства принимаются в сочетании с Crestor или Lipitor, такие как фенофибрат, ниацин, циклоспорин, колхицин или некоторые противовирусные препараты, используемые для лечения ВИЧ. Если у вас есть необъяснимая мышечная боль, мышечная слабость или болезненность, особенно если вы также чувствуете усталость и / или у вас жар, немедленно сообщите об этом своему врачу.Крестор или липитор следует прекратить, если у вас значительно повысился уровень креатинкиназы или есть подозрение на миопатию.
Это может произойти с любой дозой, но чаще встречается с более высокими дозами. Используйте с осторожностью у пациентов в возрасте 65 лет и старше, пациентов с проблемами почек и пациентов с неконтролируемым гипотиреозом. Эти риски также увеличиваются, если некоторые другие лекарства принимаются в сочетании с Crestor или Lipitor, такие как фенофибрат, ниацин, циклоспорин, колхицин или некоторые противовирусные препараты, используемые для лечения ВИЧ. Если у вас есть необъяснимая мышечная боль, мышечная слабость или болезненность, особенно если вы также чувствуете усталость и / или у вас жар, немедленно сообщите об этом своему врачу.Крестор или липитор следует прекратить, если у вас значительно повысился уровень креатинкиназы или есть подозрение на миопатию. - В редких случаях состояние, называемое иммуноопосредованной некротической миопатией (IMNM), может возникнуть в результате лечения статинами. Признаки и симптомы включают мышечную слабость и изменения в лабораторных исследованиях.

- Пациентам следует сдать лабораторные анализы на ферменты печени перед началом приема Крестора или Липитора, во время лечения, если есть какие-либо признаки проблем с печенью и / или когда врач считает, что эти анализы крови подходят.Прием статинов может повышать уровень АСТ или АЛТ. В редких случаях у пациентов, принимавших статины, возникала печеночная недостаточность (летальная или нефатальная). Крестор или липитор следует немедленно прекратить, если происходит серьезное повреждение печени. Если у вас есть симптомы усталости, потери аппетита, потемнения мочи или пожелтения кожи или глаз, немедленно обратитесь к врачу.
- Используйте Crestor или Lipitor с осторожностью у пациентов, которые пьют много алкоголя.
- Crestor или Lipitor следует используйте с осторожностью у пациентов с заболеваниями печени в анамнезе.Людям с активным заболеванием печени не следует использовать Крестор или Липитор.
- Изменения уровней глюкозы и гемоглобина A1C могут происходить от Crestor или Lipitor.
 Риск увеличивается при одновременном приеме кетоконазола, спиронолактона или циметидина.
Риск увеличивается при одновременном приеме кетоконазола, спиронолактона или циметидина. - В редких случаях может произойти потеря памяти или спутанность сознания. Немедленно обратитесь к лечащему врачу за советом, если вы или ваш близкий заметите какие-либо изменения.
- Не принимайте две дозы Crestor или Lipitor в течение 12 часов друг после друга.
- Crestor или Lipitor можно принимать независимо от приема пищи в любое время дня. Таблетку проглотить целиком.
- Crestor или Lipitor никогда не следует использовать во время беременности из-за риска повреждения плода. Не кормите грудью, принимая Крестор или Липитор.
Дополнительные предупреждения Crestor:
- Пациенты, принимающие антикоагулянт (например, варфарин), должны находиться под тщательным наблюдением перед приемом Крестора, а часто и в начале лечения статинами, чтобы гарантировать стабильное МНО.
- Пациентам, принимающим антацид, содержащий алюминий и магний, следует принимать антацид не менее чем через два часа после приема Крестора.

Дополнительные предупреждения Lipitor:
- Избыточное потребление грейпфрутового и / или грейпфрутового сока (более 1,2 литра в день) в сочетании с липитором может увеличить риск миопатии и рабдомиолиза.
Часто задаваемые вопросы о Crestor vs. Lipitor
Что такое Crestor?
Crestor — это статин или ингибитор HMG-CoA редуктазы, обычно используемый для лечения высокого уровня холестерина.Его общее название — розувастатин. Crestor доступен как в фирменной, так и в универсальной форме, а также в виде таблеток.
Что такое липитор?
Lipitor, как и Crestor, представляет собой статиновый препарат, применяемый при высоком уровне холестерина. Его общее название — аторвастатин. Он доступен в форме таблеток как в фирменном, так и в виде дженерика.
Крестор и липитор — это одно и то же?
Крестор и липитор являются статинами. Они работают одинаково и имеют некоторое сходство. Однако это не совсем то же самое. Вы можете прочитать об их различиях в информации, изложенной выше. Другие статины, о которых вы, возможно, слышали, включают правахол (правастатин), Зокор (симвастатин), Ливало (питавастатин), Lescol (флувастатин) и Мевакор (ловастатин).
Вы можете прочитать об их различиях в информации, изложенной выше. Другие статины, о которых вы, возможно, слышали, включают правахол (правастатин), Зокор (симвастатин), Ливало (питавастатин), Lescol (флувастатин) и Мевакор (ловастатин).
Крестор или липитор лучше?
Исследования показывают, что оба препарата эффективны в снижении холестерина (см. Раздел выше). Некоторые исследования показывают, что Crestor немного более эффективен; однако оба препарата эффективны и хорошо переносятся. На основании вашей истории болезни узнайте у своего врача, подходит ли вам один из этих препаратов.
Могу ли я использовать Крестор или Липитор во время беременности?
Нет. Крестор или липитор нельзя принимать беременным женщинам. Оба препарата особенно противопоказаны к применению во время беременности. Они могут нанести вред будущему ребенку. Если вы принимаете Крестор или Липитор и обнаруживаете, что беременны, прекратите прием статинов и немедленно обратитесь к врачу за медицинской помощью.
Могу ли я использовать Crestor или Lipitor с алкоголем?
Как правило, безопасно употреблять небольшое или умеренное количество алкоголя, если вы принимаете Crestor или Lipitor.Однако, если у вас проблемы с печенью или вы употребляете чрезмерное количество алкоголя, посоветуйтесь со своим врачом, прежде чем смешивать статин и алкоголь. Людям с хроническим заболеванием печени следует полностью избегать употребления алкоголя при приеме статинов.
Крестор безопаснее, чем липитор?
Крестор и Липитор хорошо переносятся. Любой препарат имеет побочные эффекты, а также некоторые редкие, но серьезные потенциальные побочные эффекты. Исследования (см. Раздел выше) показали, что оба препарата хорошо переносились в ходе испытаний.
Каких продуктов следует избегать при приеме Крестора?
Когда вы принимаете Crestor (или Lipitor), вы должны придерживаться здоровой диеты с низким содержанием насыщенных жиров и холестерина.
Некоторые продукты, которые вам следует избегать, — это жирное мясо, жирные молочные продукты и сладости. Вместо этого сосредоточьтесь на таких продуктах, как фрукты, овощи, цельнозерновые продукты, бобы, орехи и нежирный белок, например курица и рыба.
Вместо этого сосредоточьтесь на таких продуктах, как фрукты, овощи, цельнозерновые продукты, бобы, орехи и нежирный белок, например курица и рыба.
Хотя Lipitor взаимодействует с грейпфрутовым соком (в больших количествах), Crestor можно безопасно принимать с грейпфрутовым соком.
Крестор заставляет вас набирать вес?
Crestor напрямую не связан с увеличением веса. Если вы принимаете Крестор и заметили изменение веса, обратитесь к своему врачу.
Crestor по сравнению с другими статинами: побочные эффекты, связанные с потерей веса
Если у вас есть какие-либо медицинские вопросы или опасения, обратитесь к своему врачу. Статьи в Health Guide основаны на рецензируемых исследованиях и информации, полученной от медицинских обществ и государственных учреждений.Однако они не заменяют профессиональные медицинские консультации, диагностику или лечение.
Чтобы лекарство сделало свое дело, его нужно принимать согласно предписаниям; в случае статинов, таких как Крестор, это каждый день. Исследователи обнаружили, что несоблюдение терапии статинами связано с повышенным риском сердечно-сосудистых событий и даже смерти (Lansberg, 2018).
Исследователи обнаружили, что несоблюдение терапии статинами связано с повышенным риском сердечно-сосудистых событий и даже смерти (Lansberg, 2018).
К сожалению, многие люди перестают принимать лекарства из-за побочных эффектов, расходов, медицинских проблем и по другим причинам (Maningat, 2013).В ответ на эту тенденцию другие исследователи предложили медицинским работникам тщательно обсудить эти потенциальные эффекты с пациентами и обсудить их проблемы (Maningat, 2013). Обязательно поговорите со своим врачом, если у вас есть какие-либо опасения по поводу терапии статинами.
Одна из распространенных проблем, связанных с новыми рецептами, — наберете ли вы вес. Некоторые лекарства печально известны этим побочным эффектом, но были некоторые споры о том, являются ли статины одним из них. Вот что вам нужно знать о Crestor и о том, приведет ли он к увеличению или снижению веса.
- Крестор, также известный как розувастатин кальция, представляет собой статиновый препарат, одобренный для снижения уровня ЛПНП («плохого» холестерина), общего холестерина и триглицеридов.

- Увеличение веса не было частым побочным эффектом, наблюдаемым в клинических испытаниях, посвященных безопасности и эффективности.
- Исследования показали, что люди, принимающие статины, со временем съедают больше.
- Одна теория, лежащая в основе этого увеличения потребления калорий, заключается в том, что некоторые статины могут снижать уровень гормона, который сообщает вашему телу, когда вы сыты, но необходимы дополнительные исследования.
Crestor (розувастатин кальций) — это статиновый препарат, производимый AstraZeneca, который помогает снизить уровень липопротеинов низкой плотности или холестерина ЛПНП у людей с гиперхолестеринемией (высоким уровнем холестерина). Он достигает этого эффекта двумя способами: блокируя выработку холестерина и побуждая вашу печень расщеплять холестерин, который уже находится в крови (Luvai, 2012). Помимо высокого уровня холестерина, Crestor также одобрен Управлением по контролю за продуктами и лекарствами США (FDA) для лечения высоких уровней триглицеридов.
Увеличение веса осложняется множеством нюансов, поэтому ответ на вопрос, вызывает ли Crestor увеличение веса, не так уж прост. Крестор не вызывает прямого увеличения веса, но может косвенно привести к увеличению веса. Наиболее частые побочные эффекты Крестора в клинических испытаниях включают головные боли, тошноту, миалгию (мышечные боли), астению (слабость или недостаток энергии) и запоры (FDA, 2010).
Прибавка в весе не отмечена как побочный эффект в этих клинических испытаниях, в которых изучалась безопасность и эффективность Crestor.Но дальнейшие исследования выявили два пути, по которым розувастатин может косвенно способствовать увеличению веса у людей, принимающих этот распространенный статин. Одно исследование показало увеличение потребления калорий у пользователей статинов по сравнению с теми, кто их не принимал, в период с 1999 по 2010 год.
Реклама
Более 500 генерических препаратов, каждый 5 долларов США в месяц
Перейдите в аптеку Ro, чтобы получать лекарства по рецепту всего за 5 долларов в месяц каждый (без страховки).
Исследователи наблюдали за людьми, принимающими статины — это не ограничивалось розувастатином — с 1999 по 2010 год, и сравнивали их с теми, кто их не принимал.Хотя в 1999–2000 годах пользователи статинов ели меньше жира и калорий, чем те, кто их не принимал, их потребление калорий и жиров увеличилось после 2000 года и превзошло показатели людей, не принимавших статины. У тех, кто не принимал статины, был стабильный режим питания, который со временем существенно не изменился. К концу исследования те, кто принимал статины, увеличили потребление калорий, а их ИМТ увеличивался быстрее, чем те, кто их не принимал (Sugiyama, 2014).
Одна из теорий этой тенденции состоит в том, что улучшение уровня холестерина при приеме статинов может снизить склонность людей следовать рекомендациям по питанию.Другая возможность заключается в том, что статины могут влиять на уровень лептина — гормона, который позволяет вам чувствовать сытость после еды и помогает регулировать аппетит (Singh, 2018).
Клинические испытания содержат противоречивые данные относительно этой теории; однако лабораторные исследования показывают, что статины уменьшают количество лептина, вырабатываемого вашим организмом (Singh, 2018). Более низкий уровень лептина уменьшает чувство сытости и способствует большему количеству еды. Чтобы знать наверняка, необходимы дальнейшие исследования.
Наиболее частыми побочными эффектами розувастатина являются головная боль, боль в животе или животе, мышечные боли, тошнота, слабость и запор (FDA, 2010).В редких случаях Crestor может вызывать более серьезные побочные эффекты, такие как повреждение мышц и проблемы с печенью (FDA, 2010). Иногда мышечные проблемы (миопатия), вызванные розувастатином, являются признаком разрушения мышц, также называемого рабдомиолизом; в некоторых тяжелых случаях это может вызвать почечную недостаточность.
Симптомы включают мышечную боль, болезненность и слабость. Предыдущие исследования также показали, что розувастатин может повышать уровень сахара в крови, особенно у людей с факторами риска диабета 2 типа (FDA, 2010). Наконец, некоторые люди также сообщали о спутанности сознания и потере памяти при приеме этого препарата.
Наконец, некоторые люди также сообщали о спутанности сознания и потере памяти при приеме этого препарата.
Немедленно обратитесь за медицинской помощью, если вы испытываете необъяснимую мышечную боль (особенно в сочетании с лихорадкой), необычную усталость или слабость, темную мочу, потерю аппетита, боль в верхней части живота или пожелтение белков глаз или кожи — это могут быть признаки повреждения мышц или печени.
Крестор против Липитора: что лучше для меня?
4 минуты чтения
Все статины имеют побочные эффекты — важно взвесить пользу от снижения уровня холестерина и снижения риска сердечных заболеваний от использования статинов с их потенциальными побочными эффектами.Некоторые люди перестают принимать статины из-за побочных эффектов; для других, принимающих много лекарств, могут иметь значение сопутствующие медицинские проблемы, расходы и т. д. (Ofori-Asenso, 2019). К сожалению, прекращение приема статинов увеличивает риск сердечных приступов и инсультов.
д. (Ofori-Asenso, 2019). К сожалению, прекращение приема статинов увеличивает риск сердечных приступов и инсультов.
Не существует идеального статина для всех. Одно исследование с участием взрослых старше 65 лет показало, что те, кто принимал аторвастатин (торговая марка Lipitor) или розувастатин, с большей вероятностью продолжали принимать препарат, чем те, кто принимал симвастатин (Ofori-Asenso, 2019).Однако другие исследования показали небольшую разницу между частотой побочных эффектов различных статинов (Bytyçi, 2017).
Мы точно знаем, что некоторые лекарства увеличивают риск развития побочных эффектов, если их принимать вместе со статинами. Эти потенциальные лекарственные взаимодействия включают циклоспорин, гемфиброзил, ниацин, фибраты (такие как фенофибрат) и ингибиторы протеаз, такие как ритонавир (FDA, 2010).
Возможно, вы слышали, что не следует пить грейпфрутовый сок со статинами.С химической точки зрения это относится только к статинам, которые метаболизируются ферментом CYP3A4 в печени, поскольку грейпфрут мешает этому ферменту — эти статины включают аторвастатин, симвастатин и ловастатин (Lee, 2016). Однако существуют некоторые свидетельства того, что с практической точки зрения может не быть проблемы с употреблением грейпфрутового сока со статинами (Lee, 2016). Если вы много пьете грейпфрутовый сок, проконсультируйтесь с врачом, прежде чем начинать прием статинов.
Однако существуют некоторые свидетельства того, что с практической точки зрения может не быть проблемы с употреблением грейпфрутового сока со статинами (Lee, 2016). Если вы много пьете грейпфрутовый сок, проконсультируйтесь с врачом, прежде чем начинать прием статинов.
- Бытычи, И., Баджрактари, Г., Бхатт, Д. Л., Морган, К. Дж., Ахмед, А., Ароноу, В. С., Банах, М., и Группа сотрудничества по метаанализу липидов и артериального давления (LBPMC) (2017). Гидрофильные и липофильные статины при ишемической болезни сердца: метаанализ рандомизированных контролируемых исследований. Журнал клинической липидологии, 11 (3), 624–637. https://doi.org/10.1016/j.jacl.2017.03.003
- Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA). (2010, 8 февраля). Крестор (розувастатин кальций) таблетки. Получено с https: // www.accessdata.fda.gov/drugsatfda_docs/label/2010/021366s016lbl.pdf
- Лансберг, П., Ли, А., Ли, З., Субраманиам, К.
 , и Сетия, С. (2018). Несоблюдение режима приема статинов: индивидуальные стратегии вмешательства, выходящие за рамки таблеток. Здоровье сосудов и управление рисками, Том 14, 91-102. https://doi.org/10.2147/vhrm.s158641
, и Сетия, С. (2018). Несоблюдение режима приема статинов: индивидуальные стратегии вмешательства, выходящие за рамки таблеток. Здоровье сосудов и управление рисками, Том 14, 91-102. https://doi.org/10.2147/vhrm.s158641 - Ли, Дж. У., Моррис, Дж. К., и Уолд, Н. Дж. (2016). Грейпфрутовый сок и статины. Американский журнал медицины, 129 (1), 26–29. https://doi.org/10.1016 / j.amjmed.2015.07.036
- Луваи А., Мбагая В., Холл А. С. и Барт Дж. Х. (2012). Розувастатин: обзор фармакологии и клинической эффективности при сердечно-сосудистых заболеваниях. Понимание клинической медицины: кардиология, 6, 17-33. https://doi.org/10.4137/cmc.s4324
- Манингат П., Гордон Б. Р. и Бреслоу Дж. Л. (2013). Как мы можем улучшить комплаентность пациентов и приверженность к длительной терапии статинами? Текущие отчеты об атеросклерозе, 15 (1), 291. https://doi.org/10.1007 / с11883-012-0291-7
- Офори-Асенсо, Р., Иломаки, Дж., Тейси, М., Си, С., Кертис, А. Дж., Зомер, Э.
 , Белл, Дж. С., Зунгас, С., и Лью, Д. (2019). Предикторы несоблюдения режима лечения и прекращения приема статинов в течение первого года среди пожилых людей: ретроспективное когортное исследование. Британский журнал клинической фармакологии, 85 (1), 227–235. https://doi.org/10.1111/bcp.13797
, Белл, Дж. С., Зунгас, С., и Лью, Д. (2019). Предикторы несоблюдения режима лечения и прекращения приема статинов в течение первого года среди пожилых людей: ретроспективное когортное исследование. Британский журнал клинической фармакологии, 85 (1), 227–235. https://doi.org/10.1111/bcp.13797 - Шахтер М. (2005). Химические, фармакокинетические и фармакодинамические свойства статинов: обновление. Фундаментальная и клиническая фармакология, 19 (1), 117-125.https://doi.org/10.1111/j.1472-8206.2004.00299.x
- Сингх П., Чжан Ю., Шарма П., Ковассин Н., Соучек Ф., Фридман П. А. и Сомерс В. К. (2018). Статины снижают экспрессию лептина в белых адипоцитах человека. Физиологические отчеты, 6 (2), E13566. https://doi.org/10.14814/phy2.13566
- Сугияма Т., Цугава Ю., Ценг К., Кобаяси Ю. и Шапиро М. Ф. (2014). Разные временные тенденции потребления калорий и жиров между пользователями статинов и лицами, не принимающими статины, среди взрослых в США.JAMA Internal Medicine, 174 (7), 1038-1045.
 https://doi.org/10.1001/jamainternmed.2014.1927
https://doi.org/10.1001/jamainternmed.2014.1927
Подробнее
Информация об использовании, дозировках, предупреждениях и отзывах
Crestor является частью семейства препаратов, снижающих уровень холестерина, известных как статины, в которое входят Lipitor, Zocor и Lescol. Лекарство разработано для работы с правильной диетой и упражнениями, чтобы снизить уровень плохого холестерина и замедлить накопление жировых отложений в стенках или кровеносных сосудах, что может предотвратить сердечные приступы и инсульты.
Розувастатин действует двумя способами:- Снижает количество холестерина, производимого печенью, блокируя ключевой фермент.
- Он позволяет печени усваивать и расщеплять холестерин уже в крови.
Активный ингредиент — розувастатин кальций. Было показано, что розувастатин снижает риск сердечного приступа и других побочных эффектов, связанных с сердцем, за 1,9 года использования. Но не было никаких долгосрочных исследований, в которых изучались бы эффекты приема этого или любых других статинов в течение 20 или 30 лет, что является периодом времени, в течение которого многие люди будут принимать это лекарство.
Было показано, что розувастатин снижает риск сердечного приступа и других побочных эффектов, связанных с сердцем, за 1,9 года использования. Но не было никаких долгосрочных исследований, в которых изучались бы эффекты приема этого или любых других статинов в течение 20 или 30 лет, что является периодом времени, в течение которого многие люди будут принимать это лекарство.
Crestor является частью класса препаратов, называемых статинами.
The U.Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США впервые одобрило это лекарство в 2003 году для использования у взрослых с высоким уровнем «плохого холестерина» и сердечными заболеваниями в анамнезе. В 2010 году FDA одобрило препарат для дополнительного использования, включая профилактику сердечных приступов, инсультов и некоторых сердечных процедур среди довольно здоровых людей с повышенным уровнем С-реактивного белка (СРБ), который является маркером воспаления.
AstraZeneca производит препарат, разрешенный к применению более чем в 115 странах мира.Общие версии доступны с 2016 года.
Дозировка и меры предосторожности
Crestor выпускается в таблетках, которые различаются по цвету, форме и размеру в зависимости от дозировки. Дозы варьируются от 5 до 40 мг один раз в день в любое время, с едой или без нее.
Обычная начальная доза составляет от 10 мг до 20 мг один раз в день. Но есть заметные исключения.
В марте 2004 года FDA потребовало обновить листок-вкладыш с лекарством, включив в него новые инструкции по дозировке для пациентов азиатского происхождения.Это изменение побудило врачей рассмотреть возможность начала приема азиатских пациентов всего с 5 мг один раз в день.
На этикетке препарата упоминаются исследования, которые показали, что уровень розувастатина в два раза выше у азиатских субъектов по сравнению с пациентами европеоидной расы, принимавшими ту же дозу. Такие повышенные уровни могут увеличить риск повреждения мышц.
Такие повышенные уровни могут увеличить риск повреждения мышц.
Этикетка предупреждает, что люди с известной гиперчувствительностью к ингредиентам препарата не должны его принимать. Розувастатин также не рекомендуется людям с активным заболеванием печени, беременным женщинам или женщинам, которые могут забеременеть, а также кормящим матерям.
Побочные эффекты и предупреждения
Наиболее частые побочные эффекты Крестора могут включать мышечные боли, слабость, боль в животе, тошноту и головную боль. Прием препарата также связан с риском повреждения почек и печени и с возможным повышенным риском развития диабета.
Сообщите своему врачу, если вы испытываете необъяснимую мышечную боль или слабость, или если у вас по-прежнему возникают мышечные проблемы даже после того, как врач сказал вам прекратить прием Крестора. Также следует предупредить врача, если у вас темная моча, пожелтели кожа или глаза, болит живот или изменился аппетит.Это могут быть признаки редких, но серьезных последствий для скелетных мышц, таких как миопатия или рабдомиолиз.
FDA потребовало, чтобы AstraZeneca добавила предупреждения на этикетку Crestor на основе клинических испытаний и постмаркетингового наблюдения.
Обязательные предупреждения включают:- АНОМАЛИТЫ ФЕРМЕНТОВ ПЕЧЕНИ
- Рекомендует врачам проверять ферменты печени перед назначением лекарства и во время лечения, если у пациента есть симптомы проблем с печенью.
- УВЕЛИЧЕНИЕ САХАРА В КРОВИ
- Сообщает о повышении уровня сахара в крови при приеме статинов
- ВЗАИМОДЕЙСТВИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ ИНГИБИТОРОВ ПРОТЕАЗА
- Меры предосторожности при приеме препарата вместе с ВИЧ или лекарствами от вируса гепатита С, называемыми ингибиторами протеазы, могут повышать уровень статинов в крови (это увеличивает риск повреждения мышц, включая рабдомиолиз, что может привести к почечной недостаточности)
Заявление об отзыве
Public Citizen подала прошение в FDA в 2004 и 2005 годах об отзыве Crestor. Группа медицинских исследований этой организации задокументировала случаи, когда у пациентов развился рабдомиолиз после приема препарата.
Группа медицинских исследований этой организации задокументировала случаи, когда у пациентов развился рабдомиолиз после приема препарата.
Рабдомиолиз — тяжелая форма повреждения мышц, которая может привести к необратимому повреждению почек, коме и иногда к смерти.
Public Citizen потребовал от FDA отозвать препарат, чтобы предотвратить дальнейшие случаи рабдомиолиза, почечной недостаточности или повреждения почек. FDA отклонило петиции, но позже агентство потребовало, чтобы AstraZeneca добавила на этикетку препарата предупреждения о риске развития рабдомиолиза с острой почечной недостаточностью.
РАСШИРЯТЬ
В своем годовом отчете за 2017 год AstraZeneca признала, что столкнулась с несколькими судебными исками Crestor по поводу рабдомиолиза и других травм.
«В США AstraZeneca защищала ряд судебных исков, в которых утверждалось, что в результате использования Crestor были причинены множественные виды травм, включая сахарный диабет, различные сердечные травмы, рабдомиолиз и / или повреждения печени и почек», — говорится в отчете. «AstraZeneca урегулировала все активные претензии по этому поводу».
«AstraZeneca урегулировала все активные претензии по этому поводу».
Международные проблемы безопасности
Хотя большинство статинов очень похожи, Крестор является одним из двух самых мощных статинов в снижении уровня ЛПНП, или «плохого» холестерина. Другой — Липитор.
Эта повышенная эффективность побудила некоторые регулирующие органы за пределами Соединенных Штатов с осторожностью подходить к одобрению Crestor.Более высокие дозы и более сильные статины представляют больший риск редких, но серьезных побочных эффектов, включая потенциально опасное для жизни мышечное заболевание, называемое миопатией.
В июне 2004 года AstraZeneca выпустила обновленную упаковку-вкладыш для использования в Европейском Союзе.
«Изменения в европейской маркировке являются ответом на постмаркетинговые сообщения о спонтанных нежелательных явлениях у пациентов, получающих Крестор, и выделяют определенные группы пациентов, которые могут подвергаться повышенному риску серьезной мышечной токсичности (миопатии), связанной с использованием Крестора, особенно на самом высоком разрешенном уровне. доза 40 мг », — говорится в сообщении FDA.
доза 40 мг », — говорится в сообщении FDA.
Сохраняющиеся опасения по поводу безопасности вынудили Германию, Норвегию, Польшу, Мальту и Испанию отложить получение разрешения. По данным Reuters, хотя большинство стран ЕС одобрили препарат в 2003 году или вскоре после этого, пять противников не дали одобрения до 2008 года.
Германия — крупнейшая экономика Европы. Согласно годовому отчету компании за 2010 год, получение разрешения на продажу препарата на рынке помогло его глобальным продажам вырасти более чем на 900 миллионов долларов в следующем году.
Общие версии
Патент AstraZeneca на Crestor истек в США 8 июля 2016 года.Это позволило другим компаниям получить одобрение FDA для генерических версий и начать производство одобренных.
По состоянию на февраль 2020 года не менее 20 производителей получили одобрение FDA на производство генерических версий розувастатина кальция. Агентство заявляет, что одобренные им дженерики имеют такое же качество и силу, как и фирменные версии.
Агентство заявляет, что одобренные им дженерики имеют такое же качество и силу, как и фирменные версии.
Crestor упали на 70 процентов с 1,2 миллиарда долларов в 2016 году до 373 миллионов долларов в 2017 году до 170 миллионов долларов в 2018 году. Тем не менее, AstraZeneca отметила в своих годовых отчетах за 2017 и 2018 годы, что препарат оставался одним из самых продаваемых.
Несмотря на растущую конкуренцию со стороны дженериков, лекарство по-прежнему принесло компании более 2,36 миллиарда долларов во всем мире в 2017 году и 1,43 миллиарда долларов в 2018 году. Но это представляет собой глобальное снижение на 30 и 39 процентов по сравнению с предыдущими годами.
Перед принятием решения о медицинском обслуживании проконсультируйтесь с врачом.
Поделиться этой страницей: https://www. drugwatch.com/crestor/Скопировать ссылку
drugwatch.com/crestor/Скопировать ссылку
Соображения в подходе к выбору подходящего статина
US Pharm. 2018; 43 (7): 22-26.
РЕФЕРАТ: Статины — это класс препаратов, широко используемых для первичной и вторичной профилактики сердечно-сосудистых событий.С шестью общими доступными статинами выбор подходящего агента может быть определен на основе факторов, специфичных для лекарства, включая соображения дозирования, взаимодействия лекарств и побочные эффекты. Индивидуальные планы лечения пациентов могут быть разработаны на основе данных важных клинических исследований, различий в руководящих принципах и текущих рекомендаций по лечению двух основных нежелательных явлений, связанных с применением статинов.
Краеугольным камнем лечения дислипидемии является использование ингибиторов 3-гидрокси-3-метилглутарил-кофермента А-редуктазы, более известных как статины . Имея на рынке множество дженериков и убедительные доказательства их использования, статины являются одними из наиболее широко назначаемых лекарств в мире. 1 Однако частое использование этих агентов привело к постоянным проверкам их безопасности и продолжающимся спорам об их роли в терапии. В этой статье, посвященной генерическим статинам, будут освещены дискуссии о роли статинов в терапии, обсуждено правильное использование и исследованы данные, касающиеся двух основных нежелательных явлений.
Имея на рынке множество дженериков и убедительные доказательства их использования, статины являются одними из наиболее широко назначаемых лекарств в мире. 1 Однако частое использование этих агентов привело к постоянным проверкам их безопасности и продолжающимся спорам об их роли в терапии. В этой статье, посвященной генерическим статинам, будут освещены дискуссии о роли статинов в терапии, обсуждено правильное использование и исследованы данные, касающиеся двух основных нежелательных явлений.
Из семи различных статинов, имеющихся на рынке, шесть доступны в общем виде ( ТАБЛИЦА 1 ). 2-7 Три доступных фирменных препарата — это питавастатин (Livalo), пероральная суспензия симвастатина (FloLipid) и ловастатин пролонгированного действия (Altoprev). 8-10 Роль фирменных препаратов в терапии ограничена, учитывая широкую доступность дженериков.
Аторвастатин и симвастатин также доступны в виде нескольких комбинированных продуктов. К ним относятся комбинация аторвастатина и амлодипина, блокатора кальциевых каналов (БКК), показанного при гипертонии, и комбинация симвастатина и эзетимиба, ингибитора абсорбции кишечного холестерина, также показанного при гиперхолестеринемии. 11,12 Комбинированные препараты статинов и ниацина (ниацин / ловастатин и ниацин / симвастатин) были удалены с рынка в 2016 году из-за отсутствия доказательств того, что добавление ниацина к пациентам, принимающим статины, дополнительно снижает сердечно-сосудистые (СС) исходы сверх того, что предусмотрено наблюдается только с статинами. 13
К ним относятся комбинация аторвастатина и амлодипина, блокатора кальциевых каналов (БКК), показанного при гипертонии, и комбинация симвастатина и эзетимиба, ингибитора абсорбции кишечного холестерина, также показанного при гиперхолестеринемии. 11,12 Комбинированные препараты статинов и ниацина (ниацин / ловастатин и ниацин / симвастатин) были удалены с рынка в 2016 году из-за отсутствия доказательств того, что добавление ниацина к пациентам, принимающим статины, дополнительно снижает сердечно-сосудистые (СС) исходы сверх того, что предусмотрено наблюдается только с статинами. 13
Статины неоднократно доказывали свою эффективность в снижении уровней холестерина ЛПНП (ХС-ЛПНП) и триглицеридов при одновременном повышении уровней холестерина ЛПВП (ХС-ЛПВП). 14 Кроме того, было показано, что они улучшают значимые исходы, ориентированные на пациента, такие как серьезные сердечно-сосудистые события (ССЭ), как при первичной, так и при вторичной профилактике. 15-19
15-19
В нескольких широко обсуждаемых рекомендациях по лечению обсуждается роль статинов в лечении гиперлипидемии. К ним относятся рекомендации Американского колледжа кардиологии / Американской кардиологической ассоциации (ACC / AHA) 2013 года и рекомендации Американской академии клинической эндокринологии (AACE) 2017 года. 14,20 Оба руководства предполагают, что после внесения изменений в образ жизни, включая отказ от курения, соблюдение режима физических упражнений и соблюдение диеты, полезной для сердца, статины являются терапией первой линии как для первичной, так и для вторичной профилактики сердечно-сосудистых заболеваний (ССЗ). ). 14,20 Однако рекомендации различаются в том, как определять, какие статины подходят для каких пациентов.
В руководстве ACC / AHA 2013 г. были представлены четыре группы лечения, нацеленные на терапию статинами:
1. Пациенты с предшествующим атеросклеротическим сердечно-сосудистым заболеванием (ASCVD), включая пациентов с предшествующим событием (например, острым коронарным синдромом, инфарктом миокарда в анамнезе, стабильная или нестабильная стенокардия, реваскуляризация коронарных или других артерий, инсульт, транзиторная ишемическая атака или заболевание периферических артерий предполагаемого атеросклеротического происхождения).
2. Пациенты, не имевшие в анамнезе события ASCVD, у которых уровень ХС-ЛПНП составляет 190 мг / дл или выше. Возраст не является основанием для исключения из этого критерия.
3. Пациенты в возрасте от 40 до 75 лет с диабетом, но без истории болезни ASCVD, и с уровнем LDL-C от 70 до 189 мг / дл.
4. Пациенты в возрасте от 40 до 75 лет без диабета, у которых в анамнезе не было случая ASCVD и уровень ХС-ЛПНП от 70 до 189 мг / дл. 20
Рекомендации ACC / AHA также вводят идею группировки статинов по интенсивности (т.например, их ожидаемая способность снижать уровень ХС-ЛПНП) ( ТАБЛИЦА 2 ). 20 Основываясь на группе лечения (как определено выше), руководство рекомендует конкретную интенсивность статинов для конкретных клинических ситуаций ( ТАБЛИЦА 3 ). 20 Для нескольких групп лечения требуется вычисление оценки риска ASCVD с использованием средства оценки риска ASCVD. Этот онлайн-инструмент учитывает возраст пациента, пол, расу, систолическое артериальное давление, общий холестерин, уровень холестерина ЛПВП, а также историю болезни, имеющую значение для лечения гипертонии, диабета или курения. 21 После ввода всех данных рассчитывается 10-летний риск пациента столкнуться с событием ASCVD.
21 После ввода всех данных рассчитывается 10-летний риск пациента столкнуться с событием ASCVD.
Эти рекомендации не применяются автоматически к определенным подгруппам пациентов. Например, следует осторожно подходить к применению статинов у пожилых людей. Хотя использование статинов для вторичной профилактики у пожилых пациентов дает значительную пользу, их использование для первичной профилактики неясно. 22-24 Кроме того, не было обнаружено, что пациенты с сердечной недостаточностью получают такие же преимущества от терапии статинами, как пациенты без сердечной недостаточности. 25 Основываясь на этих результатах, рекомендации по лечению включают ограничение назначения высокоинтенсивных статинов пациентами в возрасте до 75 лет и, возможно, отказ от статинов у пациентов с сердечной недостаточностью. 20 В целом решение об использовании статинов в этих группах не является однозначным и должно включать постоянный разговор между врачом и пациентом о потенциальных рисках и преимуществах терапии. 20
20
Вопреки рекомендации ACC / AHA от 2013 г. о начале терапии в соответствии с классификацией групп лечения, руководство AACE от 2017 г. рекомендует лечить отдельных пациентов на основе лабораторных данных. 14 Согласно этому руководству, риск для пациента определяется множеством основных, дополнительных и нетрадиционных факторов риска. Затем индивидуумов классифицируют в одну из пяти групп риска, каждая из которых имеет соответствующий целевой уровень ХС-ЛПНП и не-ХС-ЛПВП ( ТАБЛИЦА 4 ). Исходя из текущих уровней и индивидуальных целей, следует назначать статины по отдельности или в комбинации с другими агентами, исходя из ожидаемой способности снижать уровень ХС-ЛПНП или не-ХС-ЛПВП. 14
Комбинированное лечение с участием добавление второго агента к продолжающейся терапии статинами остается несколько спорной темой.В то время как более ранние испытания и руководства сводили к минимуму добавление других агентов к фоновой терапии статинами, недавние исследования и согласованные заявления, включая одно из ACC / AHA, поддерживают использование эзетимиба, эволокумаба или алирокумаба, последние два из которых являются пропротеинконвертазой субтилизином. / ингибиторы кексина 9 типа в качестве дополнительной терапии для вторичной профилактики. 20,26-31 При этом статины остаются универсальной терапией первой линии как в первичной, так и в вторичной профилактике; окончательная роль других конкретных агентов остается неясной.
/ ингибиторы кексина 9 типа в качестве дополнительной терапии для вторичной профилактики. 20,26-31 При этом статины остаются универсальной терапией первой линии как в первичной, так и в вторичной профилактике; окончательная роль других конкретных агентов остается неясной.
Выбор терапии статинами начинается с предпочтительного подхода клинициста к лечению, будь то метод ACC / AHA для групп лечения статинами или метод AACE для целей LDL-C или не-HDL-C. Исходя из этого, необходимо учитывать свойства каждого статина, чтобы определить лучший вариант для отдельного пациента. Не все статины одинаковы, и существует несколько ключевых различий, которые могут повлиять на выбор пациента, включая рекомендации по дозировке, лекарственные взаимодействия и нежелательные явления (НЯ).
Дозирование Хотя большинство статинов можно принимать независимо от еды, ловастатин с немедленным высвобождением (IR) следует принимать во время ужина из-за повышенной биодоступности. 4 Однако обратное верно для ловастатина с пролонгированным высвобождением, который не следует принимать с пищей из-за пониженной биодоступности. 8 Кроме того, хотя все статины можно вводить один раз в день, для IR флувастатина и ловастатина может потребоваться прием два раза в день. 3,4 Наконец, в то время как аторвастатин, правастатин и розувастатин можно вводить в любое время дня, флувастатин, ловастатин и симвастатин следует принимать вечером. 3,4,7 Симвастатин, в частности, показал значительно отличающуюся эффективность при приеме вечером по сравнению с утренним. 32
4 Однако обратное верно для ловастатина с пролонгированным высвобождением, который не следует принимать с пищей из-за пониженной биодоступности. 8 Кроме того, хотя все статины можно вводить один раз в день, для IR флувастатина и ловастатина может потребоваться прием два раза в день. 3,4 Наконец, в то время как аторвастатин, правастатин и розувастатин можно вводить в любое время дня, флувастатин, ловастатин и симвастатин следует принимать вечером. 3,4,7 Симвастатин, в частности, показал значительно отличающуюся эффективность при приеме вечером по сравнению с утренним. 32
Каждый статин имеет разные проблемы в отношении взаимодействий лекарство-лекарство и лекарство-еда из-за специфических путей, по которым каждый из них метаболизируется ( ТАБЛИЦА 5 ).Существует слишком много лекарственных взаимодействий, чтобы подробно обсуждать каждое; поэтому ниже описаны лишь некоторые избранные.
Фибраты: Хотя не было показано, что комбинация фибрата и статина существенно влияет на клинические исходы, пациентам все же могут назначать гемфиброзил, фенофибрат или фенофибриновую кислоту вместе со статином для борьбы с сильно неконтролируемой гипертриглицеридемией . 14,20,26,33 Поскольку оба этих класса связаны с токсичностью, связанной с мышцами, комбинированная терапия значительно увеличивает этот риск по сравнению с любой терапией отдельно. 33 Эта аддитивная токсичность чаще наблюдается у гемфиброзила, чем у других фибратов. 33 Таким образом, использование гемфиброзила противопоказано с симвастатином и его следует избегать с другими статинами. 7,20 Если статин и фибрат будут использоваться вместе, предпочтительнее фенофибрат или фенофибриновая кислота. 20,33 Однако, если необходимо использовать гемфиброзил, предпочтительным препаратом является флувастатин или, при тщательном контроле, аторвастатин или розувастатин (максимум 10 мг в день). 33
33
Амиодарон: Этот антиаритмический агент, показанный при фибрилляции желудочков, является известным ингибитором P-гликопротеина (Pgp) и ферментной системы CYP450, в частности CYP3A4 и, в меньшей степени, CYP2C9. 33,34 Таким образом, существуют максимальные рекомендуемые дозировки ловастатина (максимум 40 мг в день) и симвастатина (максимум 20 мг в день) при использовании с амиодароном. 4,7,33 Хотя аторвастатин метаболизируется через CYP3A4, корректировка дозировки не требуется (как и для других статинов), поскольку данные не указывают на серьезные НЯ при одновременном применении аторвастатина и амиодарона. 2,33
CCBs: Было показано, что как дигидропиридиновые (амлодипин), так и недигидропиридиновые CCB (дилтиазем, верапамил) имеют значимое лекарственное взаимодействие со статинами. Как и амиодарон, амлодипин, дилтиазем и верапамил ингибируют CYP3A4. 33,35-37 Амлодипин также оказывает ингибирующее действие на Pgp. 33,35 На основании НЯ, описанных в литературе, рекомендуется максимальная суточная доза ловастатина 20 мг при использовании с амлодипином, дилтиаземом или верапамилом. 4,33 Также рекомендуется, чтобы симвастатин не превышал 20 мг при использовании с амлодипином, но следует вводить более низкую дозу 10 мг при использовании с дилтиаземом и верапамилом. 7,33 Специальных рекомендаций по дозировке аторвастатина не существует, хотя следует проявлять осторожность при его назначении с любым из недигидропиридиновых БКК. 2,33
33,35 На основании НЯ, описанных в литературе, рекомендуется максимальная суточная доза ловастатина 20 мг при использовании с амлодипином, дилтиаземом или верапамилом. 4,33 Также рекомендуется, чтобы симвастатин не превышал 20 мг при использовании с амлодипином, но следует вводить более низкую дозу 10 мг при использовании с дилтиаземом и верапамилом. 7,33 Специальных рекомендаций по дозировке аторвастатина не существует, хотя следует проявлять осторожность при его назначении с любым из недигидропиридиновых БКК. 2,33
Побочные реакции на лекарства
Статины обычно хорошо переносятся; тем не менее, процент прекращения лечения остается высоким. 38 Прекращение терапии статинами и невозможность возобновления терапии статинами после возникновения побочных реакций на лекарства связаны с увеличением частоты сердечно-сосудистых заболеваний. 39 Опасения пациентов по поводу безопасности статинов в свете двух основных связанных со статинами НЯ — миотоксичности и впервые возникшего диабета — могут привести к прекращению приема статинов.
Миотоксичность: Статины долгое время ассоциировались с мышечной токсичностью, включая миалгию (мышечную боль без повышения креатинкиназы [CK]), миопатию (общий термин для обозначения мышечной болезни) и миозит (мышечное воспаление). последние два из которых включают значительные возвышения CK. 40,41 Все статины предупреждают о редком, но серьезном побочном эффекте рабдомиолиза. 2-7 Однако часто миотоксичность, приписываемая статинам, обусловлена эффектом ноцебо ; то есть человек считает, что лекарство причинит вред, а впоследствии оно причинит ожидаемый вред. 42,43 Следовательно, для обеспечения наилучшего результата фармацевты должны хорошо разбираться в этом часто сообщаемом побочном эффекте и его правильном лечении.
Неверно предполагать, что все сообщения о мышечных симптомах связаны с эффектом ноцебо; Необходима надлежащая проверка истории болезни пациента (ПМК), описание боли и связь со статинами. 44 Во-первых, исследование PMH на предмет повышения уровня КК и других потенциальных причин мышечной боли или слабости позволяет врачу лечить альтернативную лежащую в основе патофизиологию или корректировать факторы, которые могут изменять метаболизм статинов. Общие причины включают пожилой возраст, лекарственные взаимодействия, нарушение функции почек или печени, повышенную физическую активность и дефицит витамина D. 20,41
Общие причины включают пожилой возраст, лекарственные взаимодействия, нарушение функции почек или печени, повышенную физическую активность и дефицит витамина D. 20,41
Затем клиницист должен сравнить состояние пациента с обычно наблюдаемыми симптомами, индуцированными статинами.Мышечная токсичность, индуцированная статинами, обычно проявляется в виде боли, болезненности, судорог и слабости, обычно в мышцах ног. 20,41 Эти симптомы обычно усиливаются после физических упражнений и не проходят без отмены возбудителя. 41
Последний шаг — определить, существует ли причинно-следственная связь между симптомами и употреблением статинов. Если предполагается, что статины являются причиной симптомов от легкой до умеренной, рекомендуется временная отмена. Если симптомы не исчезнут примерно через 2 недели, скорее всего, причиной не является статин, и его следует возобновить с первоначальной дозы.Однако, если симптомы исчезнут, следует провести повторное исследование того же статина в той же или более низкой дозе. Если затем возникают аналогичные симптомы, следует предположить, что причиной являются статины, и прием статинов следует прекратить. После исчезновения симптомов следует назначить низкую дозу альтернативного статина и титровать до максимальной переносимой дозы. 20,41 Принятие и понимание пациентом этого процесса очень важно, поскольку в противном случае эффект ноцебо может привести к дальнейшим воспринимаемым реакциям.
Если затем возникают аналогичные симптомы, следует предположить, что причиной являются статины, и прием статинов следует прекратить. После исчезновения симптомов следует назначить низкую дозу альтернативного статина и титровать до максимальной переносимой дозы. 20,41 Принятие и понимание пациентом этого процесса очень важно, поскольку в противном случае эффект ноцебо может привести к дальнейшим воспринимаемым реакциям.
Существует несколько других стратегий управления и предотвращения этих симптомов. Во-первых, из-за более высокой вероятности появления симптомов врач может отказаться от применения наиболее липофильных статинов (ловастатин и симвастатин) в пользу более гидрофильных статинов (флувастатин, правастатин и розувастатин). 44 Симвастатин 80 мг ни в коем случае не следует назначать в качестве новой терапии ни у одного пациента из-за необычно высокой частоты симптомов со стороны мышц, связанных со статинами. 7,45 Альтернативные методы лечения, такие как коэнзим Q10, не продемонстрировали стойкой пользы, но могут быть рассмотрены у пациентов с психологически индуцированными симптомами. 41,44,46 Наконец, можно рассмотреть вопрос о дозировании с увеличенным интервалом, который включает дозирование статинов несколько раз в неделю, а не один раз в день. Такой подход улучшает приверженность и липидный профиль у пациентов с предшествующей непереносимостью статинов. 47-49
41,44,46 Наконец, можно рассмотреть вопрос о дозировании с увеличенным интервалом, который включает дозирование статинов несколько раз в неделю, а не один раз в день. Такой подход улучшает приверженность и липидный профиль у пациентов с предшествующей непереносимостью статинов. 47-49
Диабет с новым началом: Важным НЯ, связанным с использованием статинов, является диабет с новым началом. Было показано, что статины увеличивают риск развития диабета, хотя есть несколько важных оговорок. 50 Во-первых, хотя это можно рассматривать как своего рода классовый эффект, истинный риск каждого конкретного статина все еще неизвестен. 51,52 Согласно крупнейшему на сегодняшний день метаанализу, правастатин имел самый низкий риск, симвастатин и аторвастатин имели умеренный риск, а розувастатин имел самый высокий риск возникновения нового диабета. 53 Однако ни один из этих результатов не был статистически значимым. 53 Кроме того, данные о том, что риск диабета увеличивается с увеличением дозы статинов, противоречивы. 54
53 Кроме того, данные о том, что риск диабета увеличивается с увеличением дозы статинов, противоречивы. 54
Диабет, индуцированный статинами, наиболее распространен у лиц, уже находящихся в группе высокого риска развития диабета. 50,54 Сюда входят пожилые пациенты и пациенты с преддиабетом или метаболическим синдромом. 50,55 Одним из последовательных открытий было то, что для каждого нового случая диабета, вызванного статинами, можно предотвратить несколько ССЭ у пациентов с более высоким риском. 50 Следовательно, фармацевты должны рекомендовать тревожным пользователям статинов с умеренным или высоким риском сердечно-сосудистых осложнений, что риск развития диабета более чем компенсируется преимуществами снижения риска сердечно-сосудистых заболеваний.Однако соотношение риска и пользы неясно у пациентов с очень низким риском сердечно-сосудистых заболеваний. 50
Хотя терапия статинами не лишена рисков, ее преимущества в снижении сердечно-сосудистых исходов сделали ее краеугольным камнем профилактики сердечно-сосудистых заболеваний. Доступные руководства сильно различаются, но неизменным является то, что статины должны быть терапией первой линии для первичной и вторичной профилактики почти у каждого пациента. Широкая доступность дженериков статинов делает эти препараты все более доступными.Понимая, что не все статины одинаковы, фармацевт может помочь обеспечить наилучший результат для каждого пациента.
Доступные руководства сильно различаются, но неизменным является то, что статины должны быть терапией первой линии для первичной и вторичной профилактики почти у каждого пациента. Широкая доступность дженериков статинов делает эти препараты все более доступными.Понимая, что не все статины одинаковы, фармацевт может помочь обеспечить наилучший результат для каждого пациента.
1. Институт медицинской информатики IMS. Использование и расходы на лекарства в США: обзор 2015 г. и перспективы до 2020 г. https://morningconsult.com/wp-content/uploads/2016/04/IMS-Institute-US-Drug-Spending-2015.pdf. По состоянию на 18 марта 2018 г.
2. Липитор (аторвастатин)-вкладыш. Нью-Йорк, штат Нью-Йорк: Pfizer, Inc; Июнь 2017 г.
3. Лист-вкладыш Lescol / Lescol XL (флувастатин). Восточный Ганновер, Нью-Джерси: Novartis Pharmaceuticals Corp; Август 2017 г.
4. Мевакор (ловастатин)-вкладыш. Станция Уайтхаус, Нью-Джерси: Merck & Co, Inc; Февраль 2014.![]()
5. Правастатин-вкладыш. Принстон, Нью-Джерси: Компания Бристол-Майерс Сквибб; Июль 2016.
6. Крестор (розувастатин) вкладыш. Уилмингтон, Делавэр: AstraZeneca Pharmaceuticals LP; Август 2017.
7. Зокор (симвастатин) вкладыш. Станция Уайтхаус, Нью-Джерси: Merck & Co, Inc; Февраль 2015 г.
8. Альтопрев (ловастатин)-вкладыш. Цуг, Швейцария: Covis Pharma; Апрель 2017.
9. Флот-липид (симвастатин)-вкладыш. Бруксвилл, Флорида: Салерно Фармасьютикалз ЛП; Июль 2017.
10. Ливало (питавастатин) вкладыш в упаковку. Монтгомери, Алабама: Kowa Pharmaceuticals America, Inc; Ноябрь 2016.
11. Кадуэт (амлодипин / аторвастатин) вкладыш. Нью-Йорк, штат Нью-Йорк: Pfizer Inc; Октябрь 2017.
12. Виторин (эзетимиб / симвастатин) вкладыш. Станция Уайтхаус, Нью-Джерси: Merck & Co, Inc; Февраль 2018.
13. AbbVie Inc .; отзыв одобрения новых заявок на лекарства для Advicor и Simcor. www.federalregister.gov/documents/2016/04/18/2016-08894/abbvie-inc-withdrawal-of-approval-of-new-drug-applications-for-advicor-and-simcor. По состоянию на 18 марта 2018 г.,
14. Jellinger PS, Handelsman Y, Rosenblit PD, et al. Рекомендации Американской ассоциации клинических эндокринологов и Американского колледжа эндокринологов по лечению дислипидемии и профилактике сердечно-сосудистых заболеваний. Endocr Pract .2017; 23 (приложение 2): 1-87.
15. ЛаРоса Дж. К., Гранди С. М., Уотерс Д. Д. и др. Интенсивное снижение липидов с помощью аторвастатина у пациентов со стабильной коронарной болезнью. N Engl J Med . 2005; 352: 1425-1435.
16. Ридкер П.М., Дэниэлсон Э., Фонсека Ф.А. и др. Розувастатин для профилактики сосудистых событий у мужчин и женщин с повышенным уровнем С-реактивного белка. N Engl J Med . 2008; 359: 2195-2207.
17. Михайлова Б., Эмберсон Дж., Блэквелл Л. и др. Эффекты снижения холестерина ЛПНП при терапии статинами у людей с низким риском сосудистых заболеваний: метаанализ индивидуальных данных 27 рандомизированных исследований. Ланцет . 2012; 380: 581-590.
18. Baigent C, Landray MJ, Reith C, et al. Эффекты снижения холестерина ЛПНП с помощью симвастатина и эзетимиба у пациентов с хроническим заболеванием почек (Исследование защиты сердца и почек): рандомизированное плацебо-контролируемое исследование. Ланцет . 2011; 377: 2181-2192.
19. Cannon CP, Braunwald E, McCabe CH, et al. Интенсивное и умеренное снижение липидов с помощью статинов после острых коронарных синдромов. N Engl J Med . 2004; 350: 1495-1504.
20. Stone NJ, Robinson JG, Lichtenstein AH, et al. Руководство ACC / AHA 2013 г. по лечению холестерина в крови для снижения риска атеросклеротических сердечно-сосудистых заболеваний у взрослых: отчет Целевой группы Американского колледжа кардиологов / Американской кардиологической ассоциации по практическим рекомендациям. Тираж . 2014; 129 (25 приложение 2): S1-S45.
21. Американский колледж кардиологии. ASCVD Risk Estimator Plus. http://tools.acc.org/ASCVD-Risk-Estimator. По состоянию на 18 марта 2018 г.
22. Венгер Н.К., Льюис С.Дж., Херрингтон Д.М. и др.Результаты применения высоких или низких доз аторвастатина у пациентов в возрасте 65 лет и старше со стабильной ишемической болезнью сердца. Энн Интерн Мед. . 2007; 147: 1-9.
23. Shepherd J, Blauw GJ, Murphy MB, et al. Правастатин у пожилых людей с риском сосудистых заболеваний (ПРОСПЕР): рандомизированное контролируемое исследование. Ланцет . 2002; 360: 1623-1630.
24. Teng M, Lin L, Zhao YJ, et al. Статины для первичной профилактики сердечно-сосудистых заболеваний у пожилых пациентов: систематический обзор и метаанализ. Лекарства от старения . 2015; 32: 649-661.
25. Kjekshus J, Apetrei E, Barrios V, et al. Розувастатин у пожилых пациентов с систолической сердечной недостаточностью. N Engl J Med . 2007; 357: 2248-2261.
26. Ginsberg HN, Elam MB, Lovato LC, et al. Эффекты комбинированной липидной терапии при сахарном диабете 2 типа. N Engl J Med . 2010; 362: 1563-1574.
27. Kastelein JJ, Akdim F, Stroes ES, et al. Симвастатин с эзетимибом или без него при семейной гиперхолестеринемии. N Engl J Med .2008; 358: 1431-1443.
28. Cannon CP, Blazing MA, Giugliano RP и др. Эзетимиб добавлен к терапии статинами после острых коронарных синдромов. N Engl J Med . 2015; 372: 2387-2397.
29. Sabatine MS, Giugliano RP, Keech AC, et al. Эволокумаб и клинические исходы у пациентов с сердечно-сосудистыми заболеваниями. N Engl J Med . 2017; 376: 1713-1722.
30. Ллойд-Джонс Д.М., Моррис П.Б., Баллантайн С.М. и др. Актуальное обновление 2017 года ACC Expert Consensus Decision Pathway о роли нестатиновой терапии для снижения LDL-холестерина в управлении риском атеросклеротических сердечно-сосудистых заболеваний: отчет Целевой группы Американского колледжа кардиологов по экспертным консенсусным путям принятия решений. Джам Колл Кардиол . 2017; 70: 1785-1822.
31. ODYSSEY Результаты: результаты показывают, что использование ингибитора PCSK9 снижает частоту сердечно-сосудистых событий, уровень холестерина ЛПНП у пациентов с ОКС. Американский колледж кардиологии. www.acc.org/latest-in-cardiology/articles/2018/03/05/15/53/sat-9am-odyssey-outcomes-cv-outcomes-with-alirocumab-after-acs-acc-2018. По состоянию на 20 июня 2018 г.
32. Уоллес А., Чинн Д., Рубин Г. Прием симвастатина утром по сравнению с вечером: рандомизированное контролируемое исследование. BMJ . 2003; 327: 788.
33. Wiggins BS, Saseen JJ, Page RL, et al. Рекомендации по управлению клинически значимыми лекарственными взаимодействиями со статинами и избранными агентами, используемыми у пациентов с сердечно-сосудистыми заболеваниями: научное заявление Американской кардиологической ассоциации. Тираж . 2016; 134: e468-e495.
34. Вкладыш в упаковку пацерона (амиодарона). Мэйпл-Гроув, Миннесота: ООО «Апшер-Смит Лабораториз»; Июль 2017 г.
35. Норваск (амлодипин) вкладыш. Нью-Йорк, штат Нью-Йорк: Pfizer Inc; Октябрь 2017 г.
36. Кардизем (дилтиазем)-вкладыш. Бриджуотер, штат Нью-Джерси: Valeant Pharmaceuticals; Ноябрь 2016.
37. Калан (верапамил) вкладыш в упаковке. Нью-Йорк, штат Нью-Йорк: Pfizer Inc; Сентябрь 2017 г.
38. Риаз Х., Хан А.Р., Хан М.С. и др. Метаанализ плацебо-контролируемых рандомизированных контролируемых исследований распространенности непереносимости статинов. Ам Дж. Кардиол . 2017; 120: 774-781.
39. Zhang H, Plutzky J, Shubina M, Turchin A. Продолжение назначения статинов после побочных реакций и исходов для пациентов: когортное исследование. Энн Интерн Мед. . 2017; 167: 221-227.
40. Tomaszewski M, Stepien KM, Tomaszewska J, Czuczwar SJ. Миопатии, индуцированные статинами. Pharmacol Rep . 2011; 63: 859-866.
41. Stroes ES, Thompson PD, Corsini A, et al. Связанные со статинами мышечные симптомы: влияние на терапию статинами — Заявление группы консенсуса Европейского общества по атеросклерозу по оценке, этиологии и лечению. Eur Heart J . 2015; 36: 1012-1022.
42. Гупта А., Томпсон Д., Уайтхаус А. и др. Неблагоприятные события, связанные с неслепой, но не слепой терапией статинами в Англо-скандинавском исследовании сердечных исходов — группа снижения уровня липидов (ASCOT-LLA): рандомизированное двойное слепое плацебо-контролируемое исследование и его нерандомизированное неслепое расширение фаза. Ланцет . 2017; 389: 2473-2481.
43. Педро-Ботет Дж., Рубиес-Прат Дж. Мышечные симптомы, связанные со статинами: остерегайтесь эффекта ноцебо. Ланцет . 2017; 389: 2445-2446.
44. Laufs U, Filipiak KJ, Gouni-Berthold I, et al. Практические аспекты лечения статин-ассоциированных мышечных симптомов (САМС). Atheroscler Suppl . 2017; 26: 45-55.
45. Сообщение FDA по безопасности лекарств: новые ограничения, противопоказания и ограничения дозировки препарата Зокор (симвастатин) для снижения риска мышечных травм.www.fda.gov/Drugs/DrugSafety/ucm256581.htm. По состоянию на 18 марта 2018 г.
46. Banach M, Serban C, Sahebkar A, et al. Влияние коэнзима Q10 на статин-индуцированную миопатию: метаанализ рандомизированных контролируемых исследований . Майо Клин Proc . 2015; 90: 24-34.
47. Goldberg AS, DeGorter MK, Ban MR, et al. Эффективность и концентрации препарата в плазме крови при не ежедневном дозировании розувастатина. Банка J Cardiol . 2013; 29: 915-919.
48. Маталка М.С., Равнан М.С., Деедвания, ПК. Эффективна ли альтернативная суточная доза аторвастатина при лечении пациентов с гиперлипидемией? Исследование альтернативного дневного и ежедневного дозирования аторвастатина (ADDAS). Am Heart J . 2002; 144: 674-677.
49. Copher HR, Stewart RD. Ежедневное дозирование по сравнению с дозированием симвастатина через день у пациентов с гиперхолестеринемией. Фармакотерапия . 2002; 22: 1110-1116.
50. Rochlani Y, Kattoor AJ, Pothineni NV, et al. Баланс между первичной профилактикой и профилактикой статин-индуцированного сахарного диабета. Ам Дж. Кардиол . 2017; 120: 1122-1128.
51. Коррао Г., Ибрагим Б., Никотра Ф. и др. Статины и риск диабета: данные большого популяционного когортного исследования. Уход за диабетом . 2014; 37: 2225-2232.
52. Lim S, Oh PC, Sakuma I, Koh KK. Как сбалансировать кардиоренометаболические преимущества и риски статинов. Атеросклероз . 2014; 235: 644-648.
53. Navarese EP, Buffon A, Andreotti F, et al. Мета-анализ влияния различных типов и доз статинов на впервые возникший сахарный диабет. Ам Дж. Кардиол . 2013; 111: 1123-1130.
54. Crandall JP, Mather K, Rajpathak SN, et al. Использование статинов и риск развития диабета: результаты Программы профилактики диабета. BMJ Open Diabetes Res Care . 2017; 5: e000438.
55. Ганда ОП. Статин-индуцированный диабет: частота, механизмы и последствия. F1000Рес . 2016; 5.
Чтобы прокомментировать эту статью, свяжитесь с [email protected].
Сравнение эффективности и безопасности розувастатина 10 мг и аторвастатина 20 мг у пациентов из группы высокого риска с гиперхолестеринемией — проспективное исследование для оценки использования низких доз статинов аторвастатина и розувастатина (PULSAR) | Испытания
Автор М.К. является главным исследователем исследования и внес свой вклад в концепцию и дизайн исследования.Автор BB внес свой вклад в разработку исследования. Авторы JA, J-PB, HHG и SM — исследователи, участвовавшие в проведении исследования. Автор MP внес свой вклад в запланированный статистический анализ исследования и определение размера выборки. Автор Ф.С. занимался анализом и интерпретацией данных. Все авторы прочитали и одобрили окончательную рукопись.
Это исследование спонсируется AstraZeneca. В настоящее время МС входит в бюро спикеров и является консультантом компаний AstraZeneca, Merck, Pfizer и Schering-Plough, а также участвует в исследованиях, спонсируемых AstraZeneca и Hoffman La Roche.JA является членом нескольких консультативных советов AstraZeneca, читал лекции от их имени и участвовал в клинических испытаниях, спонсируемых AstraZeneca. Авторы FS, MP и BB работают в компании AstraZeneca. FS и BB владеют акциями AstraZeneca, а MP и BB имеют опционы на акции AstraZeneca. J-PB, HHG и SM заявляют, что у них нет конкурирующих интересов.
Мы благодарим доктора Кэтрин Рикрофт из Prime Medica Ltd., которая предоставила медицинскую письменную поддержку от имени AstraZeneca.
Мы благодарим исследователей, их соисследователей и координаторов исследования, а также пациентов, принявших участие в исследовании PULSAR. Помимо авторов, в исследовании приняли участие следующие исследователи:
Австралия : Дж. Карраш, Киппа-Ринг, Квинсленд; Р. Леман, Джилонг, Виктория; М. Маккирнан, Брисбен, Квинсленд; П. А. Филлипс, Бедфорд-Парк, Южная Австралия; Д. Дарнелл, Госфорд, Новый Южный Уэльс.
Финляндия : Южный Лехто, Куопио; Р. Корхонен, Саволиннан; Л. Хенттонен, Хаемеенлинна; Т.Х. Суоджанен, Сейняйоки; Дж. Салтево, Ювяскюля; У Венесмаа, Ювяскюля; Х. Дж. Граннас-Хонканен, Васса; Т Джерккола; Дж. Стрэнд, Оулу; Т. Пеллинен, Хельсинки.
Франция : П. Бофилс, Париж; O Dubourg, Boulongne Billancourt Cedex; Ж. Ф. Россо, Фалез; V Rohmer, Angers; Д-Гуэ, Ла-Рошель; Д. Рихтер, Ярни; Ж. Л. Жак, Марс-ла-тур; Г. Бертран, Мец; С. Кропка, Маранге Сильванге; Дж. Диллинджер, Монделанж; В Кастель, Ла Флеш; П. Совес, Ла Байль; П. Роджер, Базурж / Луар; Y Leroux, Сен-Жан-де-ла-Мот; Т Ле Рой, Ла Флеш; П. Ле Пеннек, Шоле; Д Рену, Шоле; Б. Фавро, Шоле; Т. Петелла, Ла-Тессуаль; J Tondut, Ла-Рошель; J Basle, Nieul Sur Mer; C Viel, Ла-Рошель; Б. Ледерманн, Ним Седекс; П. Гюнц, Сен-Макер-ан-Мод; П. Ремо, Анже; Паломба, Анже; D Marin, Briollay; Боссу, Бушемейн; М. Фрон, Мутье; Брюззе, Сент-Мари-о-Шен; B Dubedout, Ган; Y Leroy, Angers; Джи Форкада, Винсеннес; П. Журд, Хостенс; Л. Лекок, Мериньяк.
Нидерланды : Т. Костер, Гауда; JWF Elte, Роттердам; П. Виергевер, Ден Хедер; C Янус, Хорн; К. П. Боутер, с-Хертогенбос; Р.П. Верховен, Апелдорн; С. Рименс, Меппель; JGM Tans, Ден Хелдер.
Италия : А-Пухиа, Кантасаро; Си Сиртори, Милан; G Specchia, Милан; Р. Тревизан, Бергамо; Г. Гирланда, Рома; S Genovese, Милан; А Мезцетти, Кьети Скало; Гавацци, Бергамо; Зуппироли, Флоренция.
Мексика : CAA Salinas, Мехико; Р. Кастанеда-Лимонес, Мехико; RME Santalo, Гвадалахара; Л. Мехиа-Солис, Делагасион Мигель Идальго; К. П. Ромеро, Мехико; GF Salmon, Мехико; Г.Г. Гальвес, Гвадалахара; LAE Sifuentes, Монтерей.
США : HE Bays, Луисвилл, Кентукки; Элашкер, Кингтон, Нью-Йорк; С. К. Эллиот, Эвансвил, Индиана; Фарбер, Лос-Анджелес, Калифорния; А. М. Хеллер, Дэн Хосе, Калифорния; PR Honig, Филадельфия, Пенсильвания; AM Джексон, Бартлетт, Теннесси; Б. Крзнер, Балтимор, Мэриленд; Э. Ким, Альбукерке, Нью-Мексико; JD Krantzler, Поттстаун, Пенсильвания; А. Дж. Левин, Лос-Анджелес, Калифорния; Дж. Л. Ньюман, Виста, Калифорния; PH Филандер, Лас-Вегас, Невада; Т.Л. Полинг, Уичито, штат Калифорния; В. Б. Смит, Новый Орлеан, Луизиана; TJ True, Пелхэм, Алабама; П.Дж. Винкль, Сайпресс, Калифорния; Н. Биттар, Мэдисон, Висконсин; SEE Hafi, Хьюстон, Техас; Р. А. Хайри, Индианаполис, Индиана; К. Д. Клатт, Портленд, Орегон; Т.В. Литтлджон III, Уинстон-Салем, Северная Каролина; Т. Р. Смит, Честерфилд, Миссури; Н. Р. Патель, Биверкрик, Огайо; Дж. Э. Сазерленд, Ватерлоо, ИА; ST Olatunbosum, Чикаго, Иллинойс; MM Zimmerer, Занесвилл, Огайо; LI Gilderman, Pembroke Pines, FL; Р. Бресслер, Тусон, Аризона; В. Грейфф, Тусон, Аризона; DJ Mikolich, Гринвич, Род-Айленд; MU Weerasinghe, Рочестер, Нью-Йорк; АО Прети, Форт Майерс, Флорида; DJ Morin, Бристоль, Теннесси; JP Capo, Атланта, Джорджия; М. А. Каносса-Террис, Майами-Бич, Флорида; JA Hoekstra, Ричмонд, Вирджиния; Б. Любин, Норфолк, Вирджиния; Чен, Риверсайд, Калифорния; М.К. Коллинз, Алебастр, AL.
Сравнение эффективности и безопасности розувастатина, аторвастатина и правастатина у пациентов с дислипидемическим диабетом
Цели . Изучить эффективность и безопасность трех наиболее часто назначаемых статинов (розувастатин, аторвастатин и правастатин) для лечения дислипидемии среди пациентов с диабетом в Катаре. Объекты и методы . Это ретроспективное обсервационное популяционное исследование включало 350 последовательных пациентов с диабетом, которым был поставлен диагноз дислипидемии и которым в период с сентября 2005 г. по сентябрь 2009 г. был назначен любой из указанных статинов.Данные были собраны путем просмотра базы данных аптек, базы данных электронных медицинских карт (средство просмотра EMR) и медицинских карт пациента. Были проведены сравнения измерений липидного профиля на исходном уровне, а также через интервалы первого и второго года. Результаты . Розувастатин (10 мг) оказался наиболее эффективным в снижении уровня ХС ЛПНП (29,03%). Аторвастатин в наибольшей степени снижал уровень ХС ЛПНП в дозе 40 мг (22,8%), а правастатин — в наибольшей степени в дозе 20 мг (20,3%). Все три статина были безопасны в отношении мышечной и печеночной функций.Что касается функции почек, аторвастатин был самым безопасным статином, поскольку он привел к наименьшему количеству пациентов в конце 2 лет лечения с новым началом микроальбуминурии (10,9%), за которым следовали розувастатин (14,3%), а затем правастатин (26,6%). %). Заключение . В контексте Катара наиболее эффективным статином для снижения уровня ХС-ЛПНП был розувастатин в дозе 10 мг. Аторвастатин был самым безопасным статином в отношении функции почек. Для подтверждения этих результатов необходимы будущие крупномасштабные проспективные исследования.
1. Введение
Диабет в настоящее время общепризнан как «эквивалент риска ишемической болезни сердца» [1–4]. Это в основном объясняется высоким уровнем дислипидемии среди пациентов с диабетом, что считается одним из основных факторов, определяющих высокий процент смертей среди диабетиков от сердечно-сосудистых заболеваний (ССЗ) [5].
Различия в липидном профиле между диабетиками (особенно диабетиками 2 типа) и недиабетиками объясняют повышенный риск сердечно-сосудистых заболеваний [6].По сути, липидные профили СД2 состоят из повышения уровней триглицеридов (ТГ) (> 2 ммоль / л) и снижения холестерина липопротеинов высокой плотности (ХС-ЛПВП). Хотя уровни концентрации холестерина липопротеинов низкой плотности (ХС-ЛПНП) являются нормальными, частицы плотнее и меньше по размеру, что, как считается, увеличивает их атерогенный потенциал [7].
Многочисленные эпидемиологические исследования и рандомизированные контролируемые испытания документально подтвердили связь между повышенным уровнем ХС-ЛПНП и повышенным риском ССЗ как в популяциях диабетиков, так и в популяциях без диабета [8, 9].Таким образом, снижение уровня ХС-ЛПНП является основной целью терапии диабетической дислипидемии [5, 10]. С другой стороны, повышение уровня ХС-ЛПВП и снижение уровня триглицеридов было связано с умеренным снижением риска сердечно-сосудистых заболеваний и, таким образом, рассматривается как второстепенное значение [11].
Статины считаются первой фармакологической линией лечения дислипидемии у больных диабетом [12]. Считается, что снижение уровня ХС-ЛПНП является основным положительным эффектом лечения статинами; хотя влияние на ХС-ЛПВП и другие липопротеины также играет роль [5].В настоящее время существует семь утвержденных статинов, которые обычно назначаются, и у каждого свой профиль соотношения пользы и риска [13].
На сегодняшний день многочисленные рандомизированные исследования среди различных этнических групп документально подтвердили, что розувастатин является наиболее эффективным статином для снижения уровня ХС-ЛПНП и триглицеридов (ТГ) и повышения уровня ХС-ЛПВП [14, 15]. С другой стороны, аторвастатин, до утверждения розувастатина, был документально подтвержден как наиболее эффективный статин в снижении уровня ХС-ЛПНП [16]. С другой стороны, правастатин, доступный в более высоких дозах 20 мг и 40 мг, оказался немного менее эффективным; Основная причина его назначения пациентам связана с его гидрофильными свойствами, которые делают его более переносимым для пациентов с более высокими факторами риска помимо ССЗ [17].
Статины, как и все другие фармакологические методы лечения, неизбежно имеют побочные эффекты. Доказано, что лечение статинами влияет на мышечную систему, функцию печени и почек [18, 19]. В целом крупномасштабные рандомизированные клинические испытания неизменно демонстрируют, что терапия статинами вызывает лишь небольшое повышение риска побочных эффектов по сравнению с плацебо [20, 21]. Например, данные постмаркетинга сообщают об общей частоте нежелательных явлений менее 0.5% и частота событий миотоксичности менее 0,1% [22].
В Катаре в настоящее время нет руководств по лечению диабетиков с дислипидемией, и ни одно из предыдущих исследований не документально подтвердило эффективность и безопасность различных статинов, назначаемых пациентам с диабетом. Таким образом, настоящее исследование направлено на развитие этой растущей осведомленности о специфической для атеросклероза помощи пациентам с диабетом путем изучения эффективности и безопасности трех наиболее часто назначаемых статинов в Государстве Катар.
2. Методы
Это ретроспективное обсервационное популяционное исследование было проведено в больнице общего профиля Хамад, Медицинская корпорация Хамад, которая является главной больницей третичного уровня в Катаре, обслуживающей более 90% населения Катара [23].
2.1. Пациенты исследования
Исследуемая популяция была отобрана из последовательных пациентов с диабетом, которые поступили в больницу общего профиля Хамад с дислипидемией и получили указанные статины и прошли анализ крови натощак на липидный профиль перед началом лечения статинами в период с сентября 2005 года по сентябрь 2009 года.Диагноз и когда лечить дислипидемию у диабетиков в больнице общего профиля Хамад устанавливаются на основе критериев группы экспертов ВОЗ [24]; ВОЗ рекомендует проводить скрининг на липидные нарушения не реже одного раза в год у пациентов с диабетом и чаще, если это необходимо для достижения целей. С другой стороны, взрослые с уровнем липидов низкого риска (ХС ЛПНП <100 мг / дл [2,6 ммоль / л], ХС ЛПВП> 50 мг / дл [1,3 ммоль / л] и триглицериды <150 мг / дл [1,7 ммоль / л]) можно проверять каждые два года.
Критерии включения: пациенты с диабетом (уровень глюкозы в крови натощак ≥ 126 мг / дл [7.0 ммоль / л]), которым был прописан любой из указанных статинов (розувастатин, аторвастатин, правастатин) в течение 2005–2009 гг. (2 года в течение этого периода) для обеспечения использования статина не менее 2 лет, возраст ≥ 18 лет и уровень общего холестерина ≥4 ммоль / л, холестерина ЛПНП ≥2,5 ммоль / л, холестерина ЛПВП ≤ 1 ммоль / л у мужчин и ≤1,2 ммоль / л у женщин, а триглицериды натощак ≥ 1,7 ммоль / л, полученные в течение За 1 неделю до первого приема статинов, которые затем будут сравниваться с интервалами в первый и второй год.
В это исследование были исключены беременные женщины; пациенты с генетическими нарушениями; пациенты, принимающие одновременно другие липидоснижающие агенты, такие как секвестранты желчных кислот (холестирамин, колесевелам), ниацин, эзетимиб, фенофибрат и / или омега-3; пациенты с анамнезом стенокардии, тяжелыми сосудистыми заболеваниями или другими опасными для жизни заболеваниями; пациенты с нефропатией и / или гипотиреозом, активным заболеванием печени, проблемами желчных протоков или уровнем АЛТ> 3 ULN; пациенты с уровнем креатинкиназы> 10 ULN; пациенты, принимающие одновременно кортикостероиды, циклоспорин и / или заместительную гормональную терапию; пациенты, которые физически неактивны; пациенты с историей злоупотребления наркотиками или алкоголем.
Этическое одобрение IRB для данного исследования было получено Комитетом медицинских исследований Hamad Medical Corporation до начала сбора данных.
2.2. Сбор данных
Пациенты были идентифицированы как потребители статинов (розувастатин, аторвастатин, правастатин) в течение периода исследования (сентябрь 2005 г. — сентябрь 2009 г.) с использованием базы данных аптек. Листы сбора данных были разработаны исследователем для каждого пациента. В исследование было включено пятьдесят пациентов для каждой дозы статинов, и они должны были получать одну и ту же дозу в течение как минимум 2 лет между периодами, указанными ранее.Данные об этих пациентах были получены из 2 источников: электронной медицинской базы данных (EMR viewer) и файлов пациентов из отдела медицинских записей Hamad Medical Corporation (HMC). Предписанные дозы в HMC для больных диабетом с дислипидемией следующие: (i) розувастатин 10 мг и 20 мг, (ii) правастатин 20 мг и 40 мг, (iii) аторвастатин 10 мг, 20 мг и 40 мг.
Пациенты были проверены 3 раза, чтобы исключить дублирование, в результате чего общая выборка составила 350 пациентов.
2.3. Лист сбора данных
Исследователь разработал структурированный лист сбора данных для этого исследования. Измерения включали вопросы, касающиеся социально-демографических данных, истории болезни и сопутствующих факторов, привычек образа жизни, лабораторных исследований и антигипертензивных препаратов пациента (БРА и / или ингибиторов АПФ). Разработанный лист сбора данных был протестирован среди 25 пациентов в качестве пилотного исследования. После этого все расхождения, обнаруженные между листом сбора данных и данными, доступными в медицинской карте, были устранены.
Первая часть включала тип статинов, назначаемых пациенту в течение как минимум 2 лет непрерывно, и дозу статинов. Вторая часть включала информацию о социально-демографических характеристиках, включая возраст, пол, национальность, рост, вес и ИМТ. Во второй раздел были включены такие образ жизни, как курение и употребление алкоголя. В третьем разделе собрана информация о типе СД, его продолжительности и наличии гипертонии. Четвертый раздел включал элементы лабораторных исследований, таких как уровень глюкозы в крови натощак, гликированный гемоглобин (HbA1C), общий холестерин, уровни ЛПВП и ЛПНП, триглицериды, уровень креатинкиназы, креатинин сыворотки, билирубин, LFT, GGT и сывороточный альбумин, а также побочные эффекты. как микроальбуминурия и макроальбуминурия.Наконец, пятый раздел включал начало приема антигипертензивных препаратов (БРА и / или ингибиторов АПФ).
2.4. Статистический анализ
Данные были проанализированы с использованием SPSS версии 20. Тест Стьюдента использовался для определения значимости различий между средними значениями двух непрерывных переменных и подтвержден непараметрическим критерием Манна-Уитни. Кроме того, парный тест t был использован для определения разницы между исходным уровнем и 2 годами позже в отношении биохимических параметров, и это подтверждается тестом Вилкоксона, который является непараметрическим тестом, сравнивающим две парные группы.Были проведены тесты хи-квадрат и точные тесты Фишера для проверки различий в пропорциях категориальных переменных между двумя или более группами. Уровень считался пороговым значением или значимостью.
3. Результаты
В таблице 1 представлены социально-демографические характеристики исследуемой популяции. Большинство пациентов были катарцами, имели ИМТ> 30 кг / м 2 и имели сопутствующую артериальную гипертензию.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Непрерывные переменные представлены как среднее значение ± стандартное отклонение, а категориальные переменные — как числа (проценты). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Таблица 2 и рисунки 1 и 2 показывают сравнение эффективности каждого статина в каждой дозе (10 мг, 20 мг и 40 мг).Розувастатин (10 мг и 20 мг) оказался наиболее эффективным в снижении уровня ХС-ЛПНП (29,03% и 29,3% соответственно). Аторвастатин в наибольшей степени снижал уровень ХС ЛПНП в дозе 40 мг (22,8%), а правастатин — в наибольшей степени в дозе 20 мг (20,3%). Более того, розувастатин (10 мг) больше всего снижал уровень триглицеридов (-25,1%). Так было даже по сравнению с более высокими дозами розувастатина (20 мг) и более высокими дозами аторвастатина (20 мг и 40 мг) и правастатина (20 мг и 40 мг). Наконец, все статины, по-видимому, снижали, а не повышали уровень ХС-ЛПВП.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ЛПНП-C <100 2,5 ммоль / л / или диабет 2 типа. значение ≤ 0,001, значение ≤ 0,01 и значение ≤ 0,05. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
На рисунке 3 представлен процент пациентов с новым началом микроальбуминурии после приема статинов. Аторвастатин был самым безопасным статином, так как он привел к наименьшему количеству пациентов в конце 2-летнего лечения с новым началом микроальбуминурии (10.9%), затем розувастатин (14,3%), а затем правастатин (26,6%).
В таблице 3 представлен обзор профиля безопасности каждого из статинов в их различных дозах для пациентов. Статины оказались безопасными в отношении функций печени и мышц, так как ни у одного пациента не было пациентов с АЛТ> 3 ВГН или КК> 10 ВГН. Наблюдалось незначительное отрицательное влияние статинов на функцию почек из-за нового появления микроальбуминурии у некоторых пациентов; тем не менее ни один случай микроальбуминурии не перешел в более опасную макроальбуминурию.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4.Обсуждение
В настоящем исследовании розувастатин (10 мг и 20 мг) оказался наиболее эффективным статином для снижения уровня холестерина ЛПНП по сравнению с аторвастатином (10 мг, 20 мг и 40 мг) и правастатином (20 мг и 20 мг). 40 мг). Другими словами, розувастатин в самой низкой дозе в этом исследовании (10 мг) был более эффективен в снижении уровней ХС-ЛПНП, чем аторвастатин и правастатин в их самых высоких дозах (40 мг). Действительно, следует отметить, что розувастатин, который является последним статином, одобренным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов, неизменно считается наиболее эффективным в снижении уровней ХС-ЛПНП в последних исследованиях, сравнивающих его эффективность с другими. статины [25].Наши результаты согласуются с исследованием STELLAR, которое является одним из основных открытых, рандомизированных и многоцентровых исследований по сравнению розувастатина (10, 20, 40 или 80 мг) с аторвастатином (10, 20, 40 или 80 мг). правастатин (10, 20 или 40 мг) и симвастатин (10, 20, 40 или 80 мг) в разных диапазонах доз для снижения ХС ЛПНП [15]. Результаты исследования STELLAR показали, что розувастатин неизменно во всех дозах был наиболее эффективным в снижении уровня ХС-ЛПНП по сравнению со всеми другими статинами.
Снижение уровня триглицеридов — еще одна важная цель снижения риска сердечно-сосудистых заболеваний среди пациентов с диабетом [5]. В текущем исследовании наибольшее снижение уровня триглицеридов было (-25,1%) и было достигнуто у пациентов, принимавших розувастатин (10 мг). Так было даже по сравнению с более высокими дозами розувастатина (20 мг) и более высокими дозами аторвастатина (20 мг и 40 мг) и правастатина (20 мг и 40 мг). Однако важно отметить, что аторвастатин (10 мг и 40 мг) показал второе по величине снижение триглицеридов (-21.05%, и −21,56%,) соответственно. Эти результаты аналогичны результатам большинства исследований в литературе, которые показали несколько более высокое снижение уровня триглицеридов у пациентов, принимающих розувастатин, по сравнению с аторвастатином [26]. Таким образом, очевидно, что в отношении этого фактора (триглицеридов) и розувастатин, и аторвастатин эффективны для его снижения.
Повышение уровня ХС-ЛПВП — еще один важный фактор, который, как известно, снижает риск ССЗ [11, 27]. В текущем исследовании все статины, по-видимому, снижали, а не повышали уровни HDL-C.Розувастатин (20 мг) показал наименьшее снижение (-4,0%) и, таким образом, будет считаться наиболее эффективным; однако ни одно из значений статинов не было значимым.
В данном случае результаты настоящего исследования противоречат исследованиям в литературе. Например, исследование STELLAR [15] показало, что розувастатин (40 мг) является наиболее эффективным в отношении повышения уровня холестерина ЛПВП. Фактически, отмечается, что в разных диапазонах доз эффект розувастатина по увеличению холестерина ЛПВП был постоянным во всем диапазоне доз и был значительно выше () по сравнению с эффектами симвастатина и правастатина [15].Что касается исследования PULSAR [26], в котором изучались начальные дозы розувастатина и аторвастатина, они обнаружили, что повышение уровня ХС-ЛПВП было статистически значимо выше при применении розувастатина (10 мг), чем при применении аторвастатина (20 мг).
Ряд факторов мог объяснить расхождение между результатами текущего исследования и результатами, опубликованными в международной литературе. Из таблицы 1, в которой представлены характеристики пациентов, видно, что у многих пациентов было более двух факторов риска сердечно-сосудистых заболеваний.Например, пациенты страдали диабетом, большинство из них были старше 55 лет и страдали гипертонией. Кроме того, более двух третей пациентов страдали ожирением и катарцами. В других исследованиях диабета, проведенных в Катаре, было обнаружено, что катарская этническая принадлежность коррелирует с плохими привычками образа жизни, такими как малоподвижный образ жизни и неправильный выбор питания [2, 3]. Другими словами, у испытуемых было так много других факторов, которые привели к тому, что их уровни HDL-C были настолько низкими, что статины могли иметь лишь минимальный эффект.
Одна из наиболее частых жалоб, связанных с применением статинов, связана с влиянием статинов на мышечную функцию. Мышечные симптомы варьируются от миалгии, которая включает мышечную боль без повышения креатинкиназы (КК), до миозита, который является мышечным симптомом с повышенным уровнем КК [18]. В целом, повышение уровня КК более чем в десять раз выше верхней границы нормы считается значительным повышением, оправдывающим прекращение лечения статинами [28]. В текущем исследовании не было случаев повышения уровня КК> 10 ULN.Другими словами, все статины, независимо от дозы, считались безопасными при миозите.
Известно также, что использование статинов влияет на функцию печени [18]. В основном это измеряется бессимптомным повышением уровня ферментов печени АЛТ и АСТ, также известным как трансаминит [29]. В текущем исследовании ни у одного пациента не было повышенного уровня АЛТ> 3 верхней границы нормы. Таким образом, нежелательных явлений, связанных с функцией печени, при использовании любого из статинов в исследовании не было. Это неудивительно, поскольку в клинических испытаниях было получено 0.5–3,0% случаев повышения аминотрансфераз среди пациентов, получающих статины, и очень редкие эпизоды тяжелого поражения печени. В целом частота печеночной недостаточности у пациентов, принимающих статины, отличается от таковой в общей популяции [29].
В текущем исследовании три статина (аторвастатин 10, 20 и 40 мг; розувастатин 10 и 20 мг; и правастатин 20 и 40 мг) в разных дозах не оказали значительного влияния на креатинин сыворотки и СКФ через 2 года.Кроме того, три статина оказались относительно безопасными для пациентов с микроальбуминурией на исходном уровне, поскольку количество тех, у кого микроальбуминурия увеличилась, было очень минимальным. Фактически, правастатин (40 мг), по-видимому, уменьшил количество пациентов с исходной микроальбуминурией. С другой стороны, у пациентов без исходной микроальбуминурии, по-видимому, было относительно значительное начало микроальбуминурии у пациентов, принимавших правастатин (26,6%) и в меньшей степени розувастатин (14.3%) и аторвастатин (10,9%). Литература, касающаяся влияния статинов на микроальбуминурию, несколько противоречива. В то время как в некоторых исследованиях статинов сообщалось об уменьшении протеинурии [30] или отсутствии эффекта [31], часть литературы поддерживает выводы текущего исследования о том, что статины действительно имеют отрицательные эффекты, связанные с началом протеинурии [19]. Основная причина безопасности аторвастатина в отношении функции почек — это в некоторой степени уникальный метод метаболизма; в том, что он имеет наименьшую степень выведения почками (2%), за ним следуют флувастатин (5%), розувастатин (10%), ловастатин (10%), симвастатин (13%) и правастатин (20%) [32] .
5. Заключение
Результаты, полученные в текущем исследовании, показали, что розувастатин является наиболее эффективным статином при снижении холестерина ЛПНП, триглицеридов и общего холестерина в самой низкой дозе (10 мг). Более того, он меньше всего снижал уровень ХС-ЛПВП по сравнению с другими статинами. Таким образом, в катарской популяции больных с диабетом и дислипидемией он оказался наиболее эффективным статином.


 1 порция: ½ чашка ( 100 г)
1 порция: ½ чашка ( 100 г)



 ст.
ст. Почечные эффекты аторвастатина и розувастатина у пациентов с диабетом с прогрессирующим заболеванием почек (ПЛАНЕТА I): рандомизированное клиническое исследование. Lancet Diabetes Endocrinol 2015 4 февраля [Epub перед печатью.]
Почечные эффекты аторвастатина и розувастатина у пациентов с диабетом с прогрессирующим заболеванием почек (ПЛАНЕТА I): рандомизированное клиническое исследование. Lancet Diabetes Endocrinol 2015 4 февраля [Epub перед печатью.]  Это может произойти с любой дозой, но чаще встречается с более высокими дозами. Используйте с осторожностью у пациентов в возрасте 65 лет и старше, пациентов с проблемами почек и пациентов с неконтролируемым гипотиреозом. Эти риски также увеличиваются, если некоторые другие лекарства принимаются в сочетании с Crestor или Lipitor, такие как фенофибрат, ниацин, циклоспорин, колхицин или некоторые противовирусные препараты, используемые для лечения ВИЧ. Если у вас есть необъяснимая мышечная боль, мышечная слабость или болезненность, особенно если вы также чувствуете усталость и / или у вас жар, немедленно сообщите об этом своему врачу.Крестор или липитор следует прекратить, если у вас значительно повысился уровень креатинкиназы или есть подозрение на миопатию.
Это может произойти с любой дозой, но чаще встречается с более высокими дозами. Используйте с осторожностью у пациентов в возрасте 65 лет и старше, пациентов с проблемами почек и пациентов с неконтролируемым гипотиреозом. Эти риски также увеличиваются, если некоторые другие лекарства принимаются в сочетании с Crestor или Lipitor, такие как фенофибрат, ниацин, циклоспорин, колхицин или некоторые противовирусные препараты, используемые для лечения ВИЧ. Если у вас есть необъяснимая мышечная боль, мышечная слабость или болезненность, особенно если вы также чувствуете усталость и / или у вас жар, немедленно сообщите об этом своему врачу.Крестор или липитор следует прекратить, если у вас значительно повысился уровень креатинкиназы или есть подозрение на миопатию.
 Риск увеличивается при одновременном приеме кетоконазола, спиронолактона или циметидина.
Риск увеличивается при одновременном приеме кетоконазола, спиронолактона или циметидина.

 , и Сетия, С. (2018). Несоблюдение режима приема статинов: индивидуальные стратегии вмешательства, выходящие за рамки таблеток. Здоровье сосудов и управление рисками, Том 14, 91-102. https://doi.org/10.2147/vhrm.s158641
, и Сетия, С. (2018). Несоблюдение режима приема статинов: индивидуальные стратегии вмешательства, выходящие за рамки таблеток. Здоровье сосудов и управление рисками, Том 14, 91-102. https://doi.org/10.2147/vhrm.s158641 , Белл, Дж. С., Зунгас, С., и Лью, Д. (2019). Предикторы несоблюдения режима лечения и прекращения приема статинов в течение первого года среди пожилых людей: ретроспективное когортное исследование. Британский журнал клинической фармакологии, 85 (1), 227–235. https://doi.org/10.1111/bcp.13797
, Белл, Дж. С., Зунгас, С., и Лью, Д. (2019). Предикторы несоблюдения режима лечения и прекращения приема статинов в течение первого года среди пожилых людей: ретроспективное когортное исследование. Британский журнал клинической фармакологии, 85 (1), 227–235. https://doi.org/10.1111/bcp.13797 https://doi.org/10.1001/jamainternmed.2014.1927
https://doi.org/10.1001/jamainternmed.2014.1927