Склеродегенеративные поражения аортального клапана и наследственные нарушения соединительной ткани
АК — аортальный клапан
ВНОК — Всероссийское научное общество кардиологов
ДК — дисморфогенез костей
ДСиФ — диспластические синдромы и фенотипы
ДСТ — дисплазия соединительной ткани
КАС — кальцифицирующий аортальный стеноз
МАС — малые аномалии сердца
МВ — марфаноидная внешность
МД — миксоматозная дегенерация
МПФ — марфаноподобный фенотип
ННСТ — наследственные нарушения соединительной ткани
ПДС — повышенная диспластическая стигматизация
ПМК — пролабирование митрального клапана
СГМС — синдром гипермобильности суставов
СДПА — склеродегенеративные поражения клапанного аппарата аорты
ЭПФ — элерсоподобный фенотип
ЭхоКГ — эхокардиография
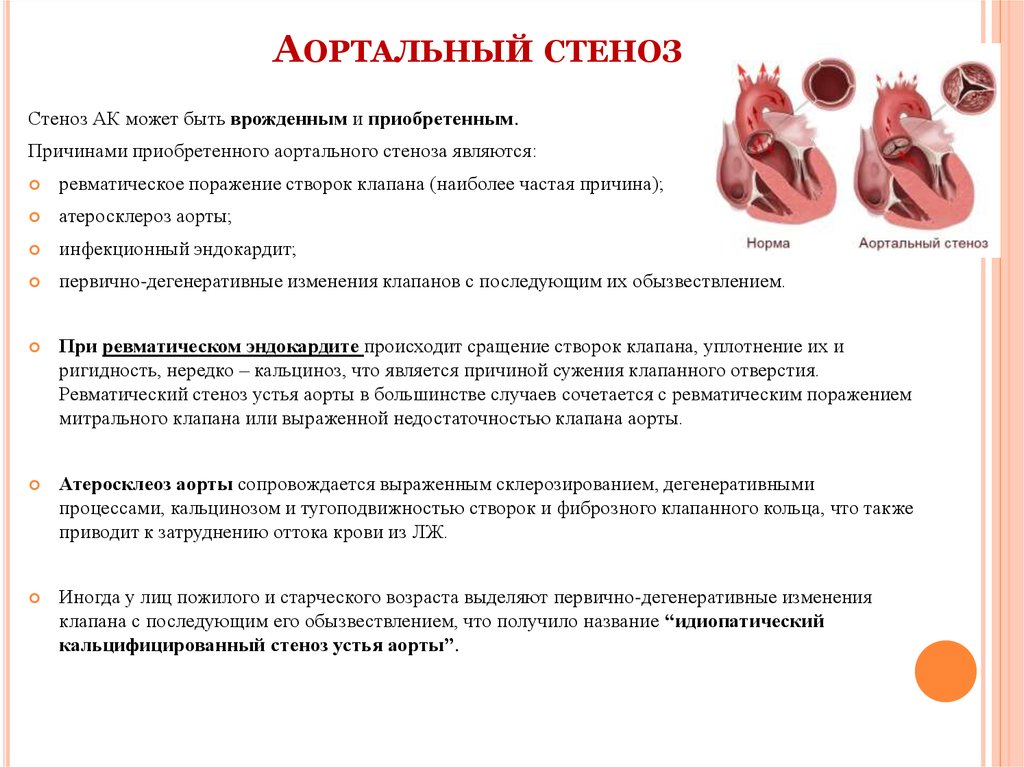
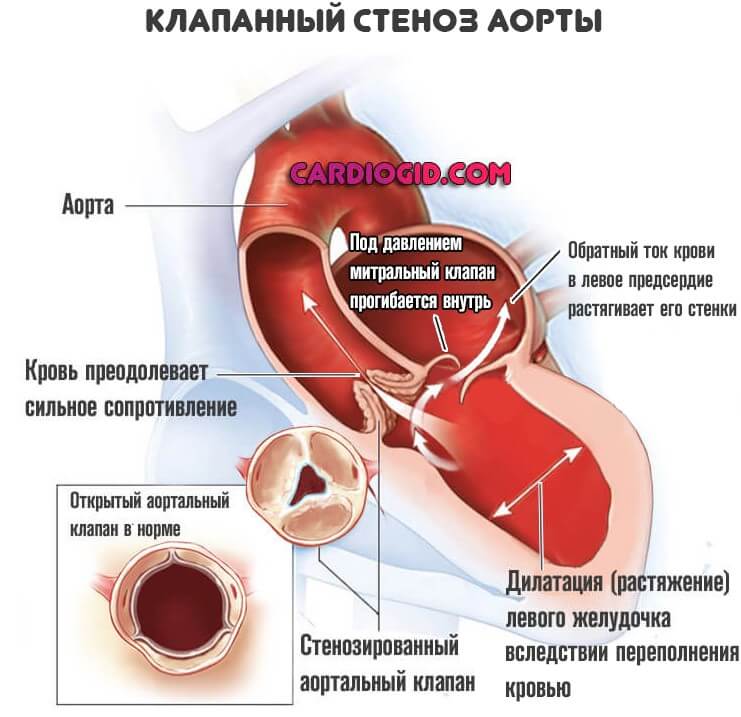
Склеродегенеративные поражения клапанного аппарата аорты (СДПА) — одна из наиболее распространенных патологий у лиц старших возрастных групп, а замена аортального клапана (АК) по поводу критического кальцифицирующего аортального стеноза (КАС) занимает 3-е место среди всех кардиохирургических вмешательств [1].
Роль наследственных нарушений соединительной ткани (ННСТ) в развитии СДПА ранее не рассматривалась. Помимо редких моногенных наследственных синдромов (Марфана, Элерса—Данло и др.) Комитетом экспертов Всероссийского научного общества кардиологов (ВНОК) в 2009 г. предложено выделять весьма распространенную группу ННСТ, имеющих полигенно-мультифакторную природу, которую принято обозначать термином «дисплазии соединительной ткани» (ДСТ). Последние согласно Российским рекомендациям по наследственным нарушениям соединительной ткани [2] следует делить на диспластические синдромы и фенотипы (ДСиФ). Прежде всего речь идет о первичном пролабировании митрального клапана (ПМК), марфаноидной внешности (МВ), марфано- и элерсоподобном фенотипах (МПФ и ЭПФ соответственно), а также о синдроме гипермобильности суставов (СГМС). Первые исследования, проведенные с использованием упомянутого подхода, показали его перспективность и позволили выявить роль МВ в изменении вегетативной регуляции ритма сердца у лиц молодого возраста и в развитии аритмического синдрома у пациентов с ИБС [3, 4].
Материалы и методы
Обследовали 150 пациентов (82 мужчин и 68 женщин) в возрасте от 42 до 83 лет. В основную группу включили 89 пациентов (средний возраст 60,7±8,9 года), среди которых у 56 (средний возраст 63,4±9,9 года) имелся КАС, а у 33 (59,7±7,5 года) при эхокардиографии (ЭхоКГ) выявлялись локальные уплотнения и акустическая тень от аортальных полулуний без увеличения скорости трансаортального потока (т.е. СДПА). В контрольную группу вошел 61 пациент без клинических, объективных и эхокардиографических признаков СДПА (средний возраст 61,3±7,6 года). У 25 обследованных больных с критическим КАС проведена хирургическая замена АК с последующим гистологическим исследованием аортальных полулуний. Замороженные срезы заслонок окрашивали суданом III, парафиновые — гематоксилином и эозином, толуидиновым синим, по ван Гизону с докрашиванием эластических волокон фукселином по Вейгерту и без него, конго красным с последующей поляризационной микроскопией.
Диагностику ДСиФ проводили по методике, предложенной нами ранее [5] и одобренной Комитетом экспертов ВНОК [2]. МВ диагностировалась при выявлении в процессе фенотипического обследования 4 малых костных признаков ДСТ и более. Первичное ПМК, выявленное при ЭхоКГ на основании признаков пролабирования одной или обеих створок митрального клапана более чем на 2 мм в парастернальной продольной позиции [6], делили на классический (толщина створок в диастолу ≥5мм) и неклассический (без утолщения створок).
Результаты
Анализ распространенности ДСиФ в сформированной выборке показал, что наиболее часто в старших возрастных группах встречаются лица с МВ (27, или 18% случаев) и ПМК (16, или 10,7% случаев). Среди пациентов с ПМК у 5 имелось классическое и 11 неклассическое ПМК. Другие ДСиФ (СГМС, ЭПФ) в нашей выборке оказались немногочисленными (2 и 1,3% соответственно).
В 29,3% случаев выявлено повышенное число стигм дизэмбриогенеза (3—5 признаков), что в соответствии с первыми Российскими рекомендациями по ННСТ предлагается рассматривать как вариант, близкий к норме, и классифицировать как повышенную диспластическую стигматизацию (ПДС). Таким образом, лишь у 1/3 обследованных лиц старших возрастных групп выявляется один из ДСиФ, наиболее распространенными из которых являются МВ и первичное ПМК.
Отдавая себе отчет в вероятной «смещенности» сформированной выборки, причиной которой мог стать целенаправленный поиск случаев поражения аорты, мы провели анализ распределения ДСиФ в группах лиц с эхокардиографическими признаками СДПА и без таковых. Результаты оценки распространенности ДСиФ в группах лиц со СДПА и без них представлены на
 Таким образом, стала очевидной взаимосвязь между костными признаками, которые принято ассоциировать с синдромом Марфана, и рядом родственных ему ННСТ, с одной стороны, и СДПА, с другой. Оказалось, что у лиц с СДПА 3 костных признака выявляются в 3 раза чаще, чем у лиц без СДПА (16,9 и 4,9% соответственно; р<0,05).
Таким образом, стала очевидной взаимосвязь между костными признаками, которые принято ассоциировать с синдромом Марфана, и рядом родственных ему ННСТ, с одной стороны, и СДПА, с другой. Оказалось, что у лиц с СДПА 3 костных признака выявляются в 3 раза чаще, чем у лиц без СДПА (16,9 и 4,9% соответственно; р<0,05).Мы проверили взаимосвязь между признаками дисморфогенеза костей (ДК) и показателями ЭхоКГ. Все пациенты с КАС были разделены на 2 группы. В 1-ю группу были включены пациенты с 1—2 костными признаками (n=17), во 2-ю — с 3 костными признаками и более (табл. 1). Как видно, в группе пациентов с 3 признаками ДК и более имеется более высокий максимальный трансаортальный градиент давления. Закономерность выявленных изменений подтверждается и более выраженными признаками ремоделирования сердца у этой группы пациентов. Речь идет о достоверном увеличении размеров левого и правого предсердий, толщины миокарда левого желудочка. Таким образом, наши данные позволяют утверждать, что между числом признаков ДК и выраженностью КАС имеется причинно-следственная связь.
Вопрос о взаимосвязи степени выраженности аортального стеноза и малыми аномалиями сердца (МАС) рассмотрен нами после формирования двух групп пациентов с различной степенью КАС. Как известно, последняя может быть оценена на основе определения скорости потока и трансаортального градиента давления [6, 7]. Легкий КАС выявлен нами у 17 пациентов, умеренный — у 5, выраженный/критический — у 34. Поскольку группа с умеренным КАС оказалась немногочисленной, мы распределили этих пациентов в группы с легким и выраженным стенозом АК, используя степень отклонения показателей от средних значений. Таким образом, были сформированы 2 группы пациентов с легким и выраженным КАС (n=20 и n=36 соответственно). Проведено сравнение частоты выявления МАС среди пациентов с различной степенью КАС
Как видно из представленных данных, МАС при выраженном КАС выявляются достоверно чаще, чем у пациентов с легким КАС. Среднее число МАС в группе с выраженным КАС оказалось значимо выше, чем у лиц с легким КАС.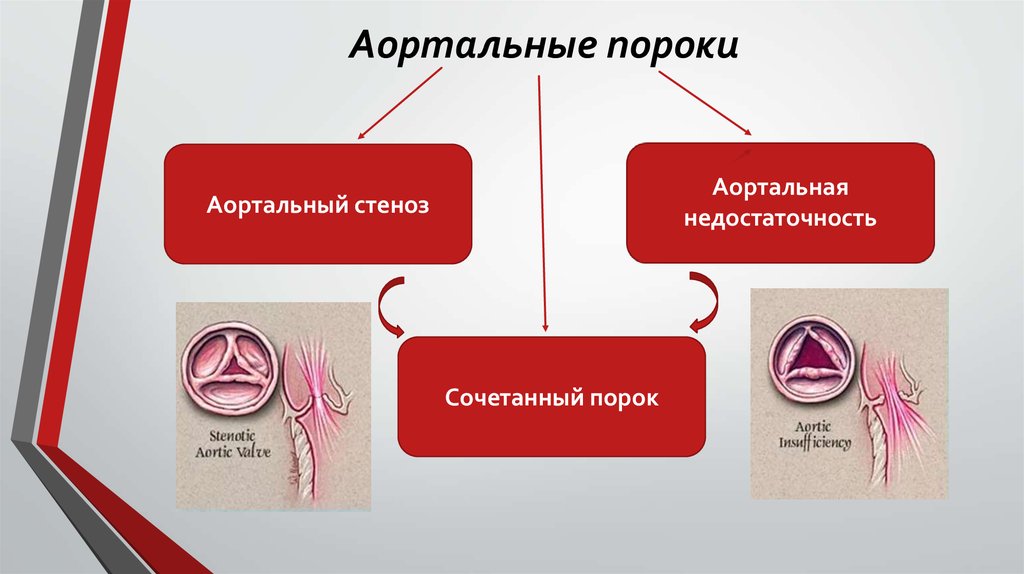
Анализ результатов фенотипического обследования 25 пациентов, оперированных по поводу критического КАС, показал, что у пациентов с миксоматозной дегенерацией (МД) удаленных аортальных полулуний (9 человек) имелось большее число признаков ДК, чем у пациентов без таковых (3,8±0,6 и 2,8±1,0 признака соответственно; p<0,01). Лишь у 3 (18,8%) из 16 пациентов без признаков МД створок выявлены диспластические фенотипы, в то время как у 7 (77,8%) из 9 лиц с МД выявлялся тот или иной ДСиФ (р<005). Из 7 указанных пациентов с МД аортальных полулуний у 4 выявлены признаки МВ, еще у 3 — первичное ПМК (2 случая неклассического и 1 классического ПМК). Еще у 2 оперированных пациентов с признаками МД показатели дизэмбриогенеза не выявлены.
Морфологически у пациентов с признаками МД створок АК (см. рис. 2 на цв. вклейке)Рисунок 2. Стеноз АК, ДСТ: заслонки клапана с участками миксоматоза (пунктирные стрелки) и кальциноза (сплошные стрелки). средняя длина аортальных полулуний была достоверно больше, чем у пациентов без признаков МД в створках АК (2,9±0,2 и 2,0±0,5 см соответственно; p<0,01). При гистологическом исследовании аортальных полулуний с МД удалось выявить, что пораженный клапан вне зон петрификатов был представлен полями миксоматозной ткани с нарушением нормальной гистоархитектоники (см. рис. 3 на цв. вклейке).Рисунок 3. ДСТ, кальциноз АК: миксоматоз (прерывистая стрелка) и петрификат (сплошная стрелка). Окраска гематоксилином и эозином, ув. 100. В участках с МД располагались плохо дифференцируемые мезенхимальные клетки. Наблюдались фрагментация, расщепление, спирализация, диссоциация коллагеновых и эластических волокон с их явным дефицитом. Во всех случаях в субэндотелиальном отделе и на границе pars spongiosa — pars fibrosa, а также по краю кальцинатов выявлялись депозиты амилоида, которые окрашивались конго красным в оранжево-красный цвет и давали яблочно-зеленое свечение в поляризованном свете. Депозиты были резистентны к предварительной обработке перманганатом калия. При иммуногистохимическом исследовании с антителами к АА-амилоиду, легким цепям κ и λ, к преальбумину экспрессии этих антигенов не выявлено. Кроме того, во всех случаях обнаружены признаки атеросклероза в виде пенистых клеток, отложений липидов и/или кристаллов холестерина. Хрящевая метаплазия выявлена в 2 (8%) клапанах, в одном из них она сопровождалась костной метаплазией.
Наблюдались фрагментация, расщепление, спирализация, диссоциация коллагеновых и эластических волокон с их явным дефицитом. Во всех случаях в субэндотелиальном отделе и на границе pars spongiosa — pars fibrosa, а также по краю кальцинатов выявлялись депозиты амилоида, которые окрашивались конго красным в оранжево-красный цвет и давали яблочно-зеленое свечение в поляризованном свете. Депозиты были резистентны к предварительной обработке перманганатом калия. При иммуногистохимическом исследовании с антителами к АА-амилоиду, легким цепям κ и λ, к преальбумину экспрессии этих антигенов не выявлено. Кроме того, во всех случаях обнаружены признаки атеросклероза в виде пенистых клеток, отложений липидов и/или кристаллов холестерина. Хрящевая метаплазия выявлена в 2 (8%) клапанах, в одном из них она сопровождалась костной метаплазией.
Обсуждение
Суммируя результаты проведенного исследования, следует подчеркнуть, что у лиц старших возрастных групп различные ДСиФ выявляются примерно в 1/3 случаев, а наиболее распространенными из них являются МВ, диагностируемая на основании выявления 4 малых признаков ДК, и первичное ПМК. Последний был представлен в 3,3% случаев классическим ПМК и в 7,3% случаев неклассическим, что существенно отличает наши данные от результатов Фрамингемского исследования (1,3% классическое и 1,1% неклассическое) [8]. Причина столь существенных различий лежит в том, что наше исследование не было популяционным. Кроме того, нельзя исключить, что существует причинно-следственная связь между ПМК как наследуемой патологией и СДПА, а наша выборка, безусловно, была смещенной в связи с целенаправленным поиском пациентов с поражением аорты. Наконец, необходимо понимать, что нельзя ставить знак равенства между фрамингемской и петербургской популяциями ни по уровню наследственной отягощенности, ни по уровню агрессивности окружающей среды.
Последний был представлен в 3,3% случаев классическим ПМК и в 7,3% случаев неклассическим, что существенно отличает наши данные от результатов Фрамингемского исследования (1,3% классическое и 1,1% неклассическое) [8]. Причина столь существенных различий лежит в том, что наше исследование не было популяционным. Кроме того, нельзя исключить, что существует причинно-следственная связь между ПМК как наследуемой патологией и СДПА, а наша выборка, безусловно, была смещенной в связи с целенаправленным поиском пациентов с поражением аорты. Наконец, необходимо понимать, что нельзя ставить знак равенства между фрамингемской и петербургской популяциями ни по уровню наследственной отягощенности, ни по уровню агрессивности окружающей среды.
Вторым важным результатом проведенного исследования является обнаружение причинно-следственной связи между СДПА и МВ, которая среди пациентов с признаками СДПА встречается в 5 раз чаще, чем в контрольной группе. МВ констатировали лишь в отсутствие признаков классического или неклассического ПМК. Кроме того, как показал проведенный анализ, у лиц с СДПА даже 3 признака ДК выявлялись в 3 раза чаще, чем у пациентов без признаков СДПА. Таким образом, наличие 3—4 костных признаков, перечисленных в пересмотренных Гентских критериях диагностики синдрома Марфана [9], в перечне критериев системного вовлечения соединительной ткани следует рассматривать как предиктор развития СДПА и КАС.
Кроме того, как показал проведенный анализ, у лиц с СДПА даже 3 признака ДК выявлялись в 3 раза чаще, чем у пациентов без признаков СДПА. Таким образом, наличие 3—4 костных признаков, перечисленных в пересмотренных Гентских критериях диагностики синдрома Марфана [9], в перечне критериев системного вовлечения соединительной ткани следует рассматривать как предиктор развития СДПА и КАС.
Вопрос о причинах выявленной взаимосвязи заслуживает специального обсуждения. По данным литературы, при неревматическом поражении АК в створках обнаруживается трансформирующий фактор роста TGF-β1 [10], который относится к мультипотентным цитокинам, участвующим не только в морфогенезе костной ткани, процессах восстановления тканей и регенерации кости, но и в развитии соединительнотканного каркаса сердца и аорты. Кроме того, дефект генов TGF-β1 и TGF-β2 и их рецепторов встречается при таких ННСТ, как синдромы Марфана и Льюиса—Дитца. Эти наследственные заболевания включают как нарушение морфогенеза костной ткани, так и поражение аорты. Так что выявленная нами связь между признаками ДК и СДПА, видимо, не случайна.
Так что выявленная нами связь между признаками ДК и СДПА, видимо, не случайна.
Остается открытым вопрос о том, является ли миксоматоз АК самостоятельной ННСТ или развивается в результате внешних воздействий. С одной стороны, несомненная связь СДПА с МВ подтверждает наследственную природу выявленного миксоматоза. Об этом же свидетельствует и то, что у 3 из 9 пациентов, оперированных по поводу КАС, имелось классическое или неклассическое ПМК. С другой стороны, трудно отказаться от мысли о роли вирусной инфекции в развитии миксоматозных изменений клапана. Вполне возможно, что нарушение гистоархитектоники АК при ННСТ создает благоприятные условия для фиксации и репликации вирусов герпеса. Роль последних в развитии МД убедительно продемонстрирована одним из авторов этой работы, обнаружившим у всех больных с МД в фибробластах АК вирус простого герпеса 1-го типа, а у 88% — 2-го типа [11].
Таким образом, полученные данные свидетельствуют о том, что стигмы ДК следует рассматривать как свидетельство участия пока еще не изученных наследственных механизмов развития СДПА, в том числе КАС. Есть все основания полагать, что признаки ДК и МВ следует рассматривать как один из важных предикторов формирования СДПА.
Есть все основания полагать, что признаки ДК и МВ следует рассматривать как один из важных предикторов формирования СДПА.
Заключение
У 1/3 пациентов старших возрастных групп выявляются ДСиФ, среди которых наиболее распространенными являются МВ (18%) и ПМК (10,7%). Наличие 3 костных признаков ДК и более и МВ следует рассматривать как предиктор развития СДПА. КАС ассоциирован с увеличенным числом МАС, которые выявляются достоверно чаще среди пациентов с критическим аортальным стенозом, чем у пациентов с легкой степенью стеноза. Морфологическое исследование створок АК более чем у 1/3 пациентов позволяет выявить признаки их МД. Последняя, как правило, выявляется у лиц с МВ или ПМК.
причины, симптомы, диагностика и лечение в Москве
Содержание↓[показать]
Склероз аорты является хронической патологией артериальной системы, для которой характерно уплотнение аорты вследствие нарушения обмена холестерина в организме. Наличие атеросклеротических изменений в стенках сосудов чаще всего выявляется у людей пожилого возраста, преимущественно у представителей мужского пола. Склероз аорты (или, как заболевание еще называют в просторечии – склероз сердца) считается наиболее частой и опасной локализацией патологического процесса. Как правило, холестериновые бляшки располагаются на отдельных участках аорты, однако в сложных случаях они могут поражать всю внутреннюю поверхность кровеносного сосуда. Ввиду ослабления притока крови к сердцу развивается коронарная недостаточность, которая может привести к летальному исходу. Кардиологи Юсуповской больницы назначают комплексное лечение при выявлении у пациента склероза аорты, направленное на компенсацию сердечной деятельности, нормализацию липидного обмена, предупреждение тяжелых осложнений.
Наличие атеросклеротических изменений в стенках сосудов чаще всего выявляется у людей пожилого возраста, преимущественно у представителей мужского пола. Склероз аорты (или, как заболевание еще называют в просторечии – склероз сердца) считается наиболее частой и опасной локализацией патологического процесса. Как правило, холестериновые бляшки располагаются на отдельных участках аорты, однако в сложных случаях они могут поражать всю внутреннюю поверхность кровеносного сосуда. Ввиду ослабления притока крови к сердцу развивается коронарная недостаточность, которая может привести к летальному исходу. Кардиологи Юсуповской больницы назначают комплексное лечение при выявлении у пациента склероза аорты, направленное на компенсацию сердечной деятельности, нормализацию липидного обмена, предупреждение тяжелых осложнений.
Склероз аорты: этиология и патогенез
Развитие патологии может быть спровоцировано следующими факторами:
- неправильным питанием;
- хроническими инфекционными заболеваниями – туберкулезом, сифилисом и т.
 д.;
д.; - эндокринными заболеваниями – сахарным диабетом, ожирением;
- стрессами и высоким уровнем адреналина в крови;
- гипертонией;
- аутоиммунными заболеваниями;
- табакокурением и злоупотреблением алкоголя;
- подагрой;
- малоподвижным образом жизни — гиподинамией;
- отсутствием физических нагрузок;
- наследственной предрасположенностью.
Облегчение состояния больного достигается устранением провоцирующих факторов либо снижением их воздействия.
Патогенез склероза аорты состоит из двух основных механизмов: сосудисто-тромбоцитарного и дислипидемического. В месте скопления тромбоцитов (на повреждении стенки сосуда) происходит образование микротромбов. Вследствие нарушения липидного обмена развивается гиперхолистеринемия. На сосудистых стенках отмечается скопление жиров, скрепленных с помощью соединительнотканных волокон, таким образом происходит образование атеросклеротических бляшек, по мере роста которых деформируется и сужается просвет сосудов. Склероз аорты сердца приводит к нарушению его кровоснабжения и развитию дисфункции.
Склероз аорты сердца приводит к нарушению его кровоснабжения и развитию дисфункции.
Склероз аорты сердца: клиническая картина
Симптоматика склероза аорты сердца может отличаться в соответствии с общим состоянием сосудов и местом локализации патологического очага. Для патологии характерно длительное, бессимптомное течение. Первые признаки склероза аорты могут обнаруживаться в пожилом возрасте, что обусловлено значительными патологическими изменениями, износом стенок сосуда. Тревогу у больных вызывает внезапное появление сильной боли в груди, повышение давления, затруднение дыхания, головокружения. Самочувствие пациента резко ухудшается, появляется одышка, боль в области груди, живота, развивается диспепсия.
У больного, страдающего склерозом аорты, происходит изменение внешнего вида: он выглядит старше своих лет, рано седеет или лысеет, взгляд становится тусклым, ухудшается тонус кожи (на ней отмечается большое количество складок и мелких ангиом), на нижних конечностях появляются трофические нарушения.
Поражение грудной части аорты сопровождается периодической жгучей болью в груди, осиплостью или охриплостью голоса, дисфагией, артериальной гипертензией, судорожным синдромом, появлением ранних признаков старения и предобморочных состояний.
Для поражения брюшной части аорты характерно возникновение давящей, невыраженной боли в эпигастрии, запоров, диареи, вздутия живота, снижения веса, онемения ног, отека ног, дистрофических процессов (в т.ч. гангрены), дистонии икроножных мышц, нарушения эрекции у мужчин.
Неврологи Юсуповской больницы при наличии у пациентов признаков, которые могут свидетельствовать о склерозе аорты, в короткие сроки проводят комплексную диагностику с оценкой состояния сердца, сосудистой системы, липидограммы, коагуляционной активности, после чего назначают индивидуальную программу лечения.
Склероз аорты: лечение патологии
Консервативная терапия склероза аорты предполагает длительный (а чаще – пожизненный) прием препаратов, способствующих нормализации обмена жиров в организме: секвестров желчных кислот, статинов, фибратов, гиполипидемических средств, полиненасыщенных жирных кислот, желчегонных препаратов, витаминов и минеральных веществ (С, В2, В6, РР).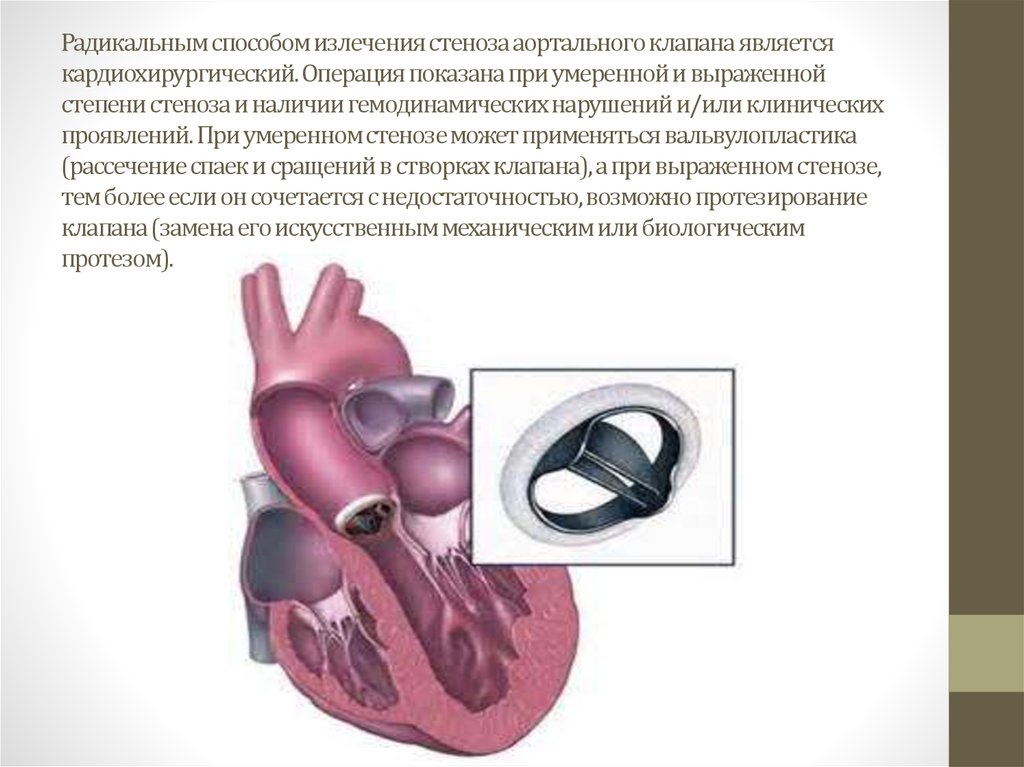
Хирургическое лечение склероза аорты представляет собой удаление атеросклеротической бляшки либо тромба с последующим протезированием аорты, благодаря чему происходит восстановление нормального кровотока. Проведение операции остро необходимо при инсульте, почечной недостаточности, ишемии почек, т.к. вследствие тромбоза артерии может развиться некроз и перитонит.
В Юсуповской больнице Москвы проводится диагностика и успешное лечение патологий сердечно-сосудистой системы, в т. ч. склероза аорты сердца. Оборудование клиники позволяет врачу с высокой точностью выявить заболевание и назначить своевременное лечение, благодаря чему предупреждается развитие опасных осложнений. Коррекция патологий проводится с использованием новейших технологий, для применения которых в Юсуповской больнице имеется вся необходимая современная аппаратура. Врач-координатор ответит на все интересующие вопросы по телефону.
Аортальный склероз: не просто шум, а маркер повышенного сердечно-сосудистого риска
1. Otto CM , Lind BK, Kitzman DW, et al. Сердечно-сосудистые ГС. Ассоциация склероза аортального клапана с сердечно-сосудистой смертностью и заболеваемостью у пожилых людей. N Engl J Med 1999; 341: 142–7. [PubMed] [Google Scholar]
Otto CM , Lind BK, Kitzman DW, et al. Сердечно-сосудистые ГС. Ассоциация склероза аортального клапана с сердечно-сосудистой смертностью и заболеваемостью у пожилых людей. N Engl J Med 1999; 341: 142–7. [PubMed] [Google Scholar]
2. Aronow WS , Ahn C, Shirani J, et al. Сравнение частоты новых коронарных событий у пожилых людей со склерозом клапанов аорты и без него. Ам Джей Кардиол 1999;83:599–600. [PubMed] [Google Scholar]
3. Chandra HR , Goldstein JA, Choudhary N, et al. Неблагоприятный исход при аортальном склерозе связан с ишемической болезнью сердца и воспалением. J Am Coll Cardiol 2004; 43: 169–75. [PubMed] [Google Scholar]
4. Taylor J , Clark BL, Garrison RJ, et al. Связь склероза аортального клапана с риском ишемической болезни сердца у афроамериканцев. Am J Cardiol 2005; 95: 401–4. [PubMed] [Академия Google]
5. Olsen MH , Wachtell K, Bella JN, et al. Влияние лозартана по сравнению с атенололом на склероз аортального клапана (подисследование LIFE). Am J Cardiol 2004; 94: 1076–80. [PubMed] [Google Scholar]
Влияние лозартана по сравнению с атенололом на склероз аортального клапана (подисследование LIFE). Am J Cardiol 2004; 94: 1076–80. [PubMed] [Google Scholar]
6. Olsen MH , Wachtell K, Bella JN, et al. Склероз аортального клапана связан с сердечно-сосудистыми событиями у пациентов с артериальной гипертензией (подисследование LIFE). Am J Cardiol 2005; 95: 132–6. [PubMed] [Google Scholar]
7. Агмон Ю , Хандерия Б.К., Джамиль Таджик А, и др. Воспаление, инфекция и склероз аортального клапана: мнение населения округа Олмстед (Миннесота). Атеросклероз 2004;174:337–42. [PubMed] [Google Scholar]
8. Yamaura Y , Nishida T, Watanabe N, et al. Связь склероза аортального клапана с утолщением интимы-медиа сонных артерий у здоровых добровольцев. Am J Cardiol 2004; 94: 837–9. [PubMed] [Google Scholar]
9. Poggianti E , Venneri L, Chubuchny V, et al. Склероз аортального клапана связан с системной эндотелиальной дисфункцией. J Am Coll Cardiol 2003; 41: 136–41. [PubMed] [Google Scholar]
J Am Coll Cardiol 2003; 41: 136–41. [PubMed] [Google Scholar]
10. Rosenhek R , Klaar U, Schemper M, et al. Легкий и умеренный аортальный стеноз: естественное течение и стратификация риска с помощью эхокардиографии. Европейское сердце J 2004; 25: 199–205. [PubMed] [Google Scholar]
11. Ngo DTM , Wuttke RD, Turner S, et al. Количественная оценка аортального склероза с использованием обратного ультразвукового рассеяния. J Am Soc Echocardiog 2004;17:1123–30. [PubMed] [Академия Google]
12. Fox E , Harkins D, Taylor H, et al. Эпидемиология кальцификации митрального кольца и ее прогностическая ценность для коронарных событий у афроамериканцев: когорта Джексона атеросклеротического риска в исследовании сообществ. Am Heart J 2004; 148: 979–84. [PubMed] [Google Scholar]
13. Fox CS , Vasan RS, Parise H, et al. Кальцификация митрального кольца предсказывает сердечно-сосудистые заболевания и смертность: исследование сердца Framingham. Тираж 2003; 107:1492–6. [PubMed] [Google Scholar]
Тираж 2003; 107:1492–6. [PubMed] [Google Scholar]
14. Iribarren C , Sidney S, Sternfeld B, et al. Кальцификация дуги аорты: факторы риска и связь с ишемической болезнью сердца, инсультом и заболеванием периферических сосудов. JAMA 2000;283:2810–5. [PubMed] [Google Scholar]
15. Walsh C , Cupples L, Levy D, et al. Кальцифицирующие отложения в брюшной аорте связаны с повышенным риском застойной сердечной недостаточности: исследование сердца Framingham. Am Heart J 2002; 144: 733–9. [PubMed] [Google Scholar]
16. Wilson PWF , Kauppila LI, O’Donnell CJ, et al. Кальцифицирующие отложения в брюшной аорте являются важным предиктором сосудистой заболеваемости и смертности. Тираж 2001; 103: 1529–34. [PubMed] [Google Scholar]
17. Walsh CR , Larson MG, Kupka MJ, et al. Ассоциация кальция аортального клапана, обнаруженного с помощью электронно-лучевой компьютерной томографии, с эхокардиографическим поражением аортального клапана и с отложениями кальция в коронарных артериях и грудной аорте.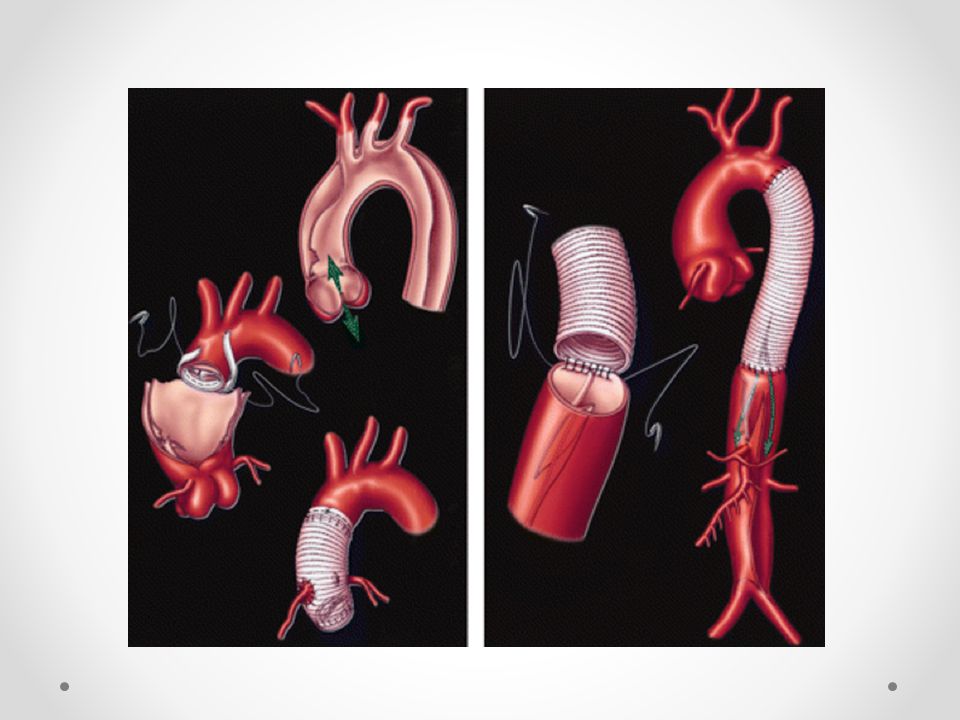 Ам Дж Кардиол 2004;93: 421–5. [PubMed] [Google Scholar]
Ам Дж Кардиол 2004;93: 421–5. [PubMed] [Google Scholar]
18. Lehto S , Niskanen L, Suhonen M, et al. Кальцификация медиальной артерии: запущенный предвестник сердечно-сосудистых осложнений при инсулиннезависимом сахарном диабете. Arterioscler Thromb Vasc Biol 1996;16:978–83. [PubMed] [Google Scholar]
19. Blacher J , Guerin AP, Pannier B, et al. Артериальные кальцификации, артериальная жесткость и сердечно-сосудистый риск при терминальной стадии почечной недостаточности. Гипертония 2001;38:938–42. [PubMed] [Google Scholar]
20. Otto CM , Burwash IG, Legget ME, et al. Проспективное исследование бессимптомного клапанного аортального стеноза: клинические, эхокардиографические и физические предикторы исхода. Тираж 1997; 95: 2262–70. [PubMed] [Google Scholar]
21. Cosmi JE , Kort S, Tunick PA, et al. Риск развития аортального стеноза у пациентов с «доброкачественным» утолщением аортального клапана. Arch Intern Med 2002; 162: 2345–7. [PubMed] [Академия Google]
Arch Intern Med 2002; 162: 2345–7. [PubMed] [Академия Google]
22. Faggiano P , Antonini-Canterin F, Erlicher A, et al. Прогрессирование склероза аортального клапана в аортальный стеноз. Am J Cardiol 2003; 91: 99–101. [PubMed] [Google Scholar]
23. Pohle K , Maffert R, Ropers D, et al. Прогрессирование кальцификации аортального клапана: связь с коронарным атеросклерозом и сердечно-сосудистыми факторами риска. Тираж 2001; 104: 1927–32. [PubMed] [Google Scholar]
24. Aronow WS , Ahn C, Kronzon I, и др. Ассоциация коронарных факторов риска и применения статинов с прогрессированием легкого клапанного аортального стеноза у пожилых людей. Am J Cardiol 2001; 88: 693–5. [PubMed] [Google Scholar]
25. Shavelle DM , Takasu J, Budoff MJ, et al. Ингибитор HMG-КоА-редуктазы (статин) и кальций аортального клапана. Ланцет 2002; 359: 1125–6. [PubMed] [Google Scholar]
26. Carabello BA . Аортальный склероз: окно в коронарные артерии? N Engl J Med 1999;341:193–5. [PubMed] [Google Scholar]
Carabello BA . Аортальный склероз: окно в коронарные артерии? N Engl J Med 1999;341:193–5. [PubMed] [Google Scholar]
27. Stewart MD , Siscovick MD, Lind MS. Клинические факторы, связанные с кальцинозом аортального клапана. J Am Coll Cardiol 1997; 29: 630–4. [PubMed] [Google Scholar]
28. Otto CM , Kuusisto J, Reichenbach DD, et al. Характеристика раннего поражения «дегенеративным» клапанным аортальным стенозом: гистологическое и иммуногистохимическое исследования. Тираж 1994; 90: 844–53. [PubMed] [Академия Google]
29. Чирков Ю.Ю. , Холмс А.С., Уиллоуби С.Р., и др. Ассоциация аортального стеноза с гиперагрегацией тромбоцитов и нарушением реакции на оксид азота. Am J Cardiol 2002; 90: 551–54. [PubMed] [Google Scholar]
Диагностика, лечение и факторы риска аортального склероза
На myheart.net мы помогли миллионам людей с помощью наших статей и ответов. Теперь наши авторы держат читателей в курсе важной информации через твиттер. Следите за доктором Ахмедом в Твиттере @MustafaAhmedMD
Теперь наши авторы держат читателей в курсе важной информации через твиттер. Следите за доктором Ахмедом в Твиттере @MustafaAhmedMD
Follow @MustafaAhmedMD
Что такое аортальный склероз?
Аортальный клапан — это клапан, который препятствует обратному течению крови, выбрасываемой из сердца в тело. Если бы не было аортального клапана, вся кровь, выкачиваемая из сердца из организма, могла бы попасть обратно! Есть две основные проблемы, которые могут возникнуть с аортальным клапаном. Аортальный клапан может быть негерметичным в состоянии, известном как аортальная регургитация, или аортальный клапан может стать тугим в состоянии, известном как аортальный стеноз. Склероз аортального клапана — это состояние, при котором аортальный клапан утолщается, но существенно не препятствует потоку, в отличие от стеноза аортального клапана, который действительно препятствует потоку.
Как это выглядит
Смотрите изображения ниже. Склеротический аортальный клапан толще, чем нормальный аортальный клапан. Склеротический аортальный клапан имеет более кальцинированный более яркий вид на УЗИ сердца.
Склеротический аортальный клапан имеет более кальцинированный более яркий вид на УЗИ сердца.
Симптомы
Аортальный склероз является бессимптомным заболеванием, то есть у него нет симптомов. Это может быть связано с наличием слабого шума, который выявляется при осмотре. Часто его можно обнаружить случайно у тех, кому делают эхокардиограмму по другим причинам.
Насколько это распространено?
Аортальный склероз становится более распространенным с возрастом, что имеет смысл, поскольку рассматривается как дегенеративное заболевание. Среди лиц моложе 60 лет менее 10% населения имеют аортальный склероз. У лиц старше 70 лет от 20 до 40% населения имеют аортальный склероз.
Станет ли аортальный склероз аортальным стенозом?
Аортальный склероз — это утолщение клапана без существенного влияния на функцию самого клапана. Стеноз аорты — это утолщение и сжатие клапана, что приводит к тому, что сердцу приходится работать с большей нагрузкой, и к возможности поступления в организм недостаточного количества крови.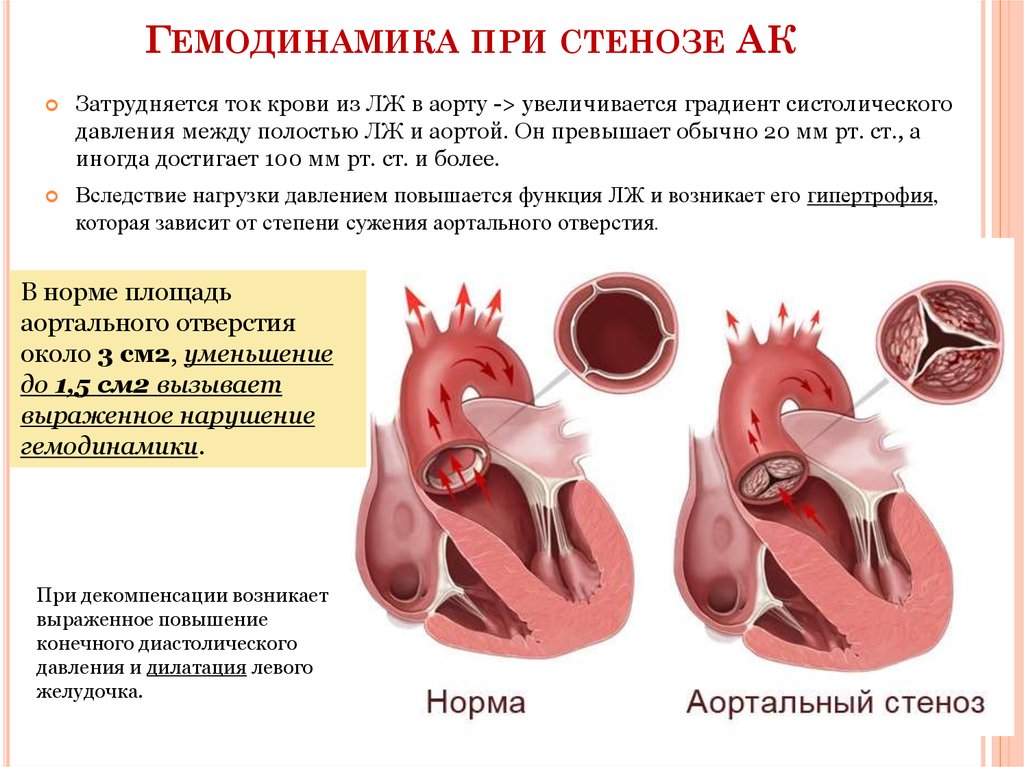 Риск прогрессирования аортального склероза в аортальный стеноз низок. Скорость прогрессирования до клинического аортального стеноза составляет менее 2% в год.
Риск прогрессирования аортального склероза в аортальный стеноз низок. Скорость прогрессирования до клинического аортального стеноза составляет менее 2% в год.
Факторы риска
- Возраст
- Быть мужчиной
- Высокое кровяное давление
- Диабет
- Курение
- Болезнь почек
- Высокий уровень холестерина
Опасен ли аортальный склероз?
В нескольких исследованиях изучалась связь между аортальным склерозом и развитием сердечно-сосудистых заболеваний. Наличие аортального склероза связано с повышенным риском сердечного приступа, инсульта, смерти от сердечного приступа или просто смерти от всех причин. Это не повод для беспокойства и на самом деле не удивительно, если взглянуть на факторы риска аортального склероза. Это те же самые факторы риска, которые связаны с другими формами сердечно-сосудистых заболеваний. Фактический риск развития этих событий все еще относительно невелик. Просто люди с аортальным склерозом имеют более высокий риск этих событий, чем люди без него.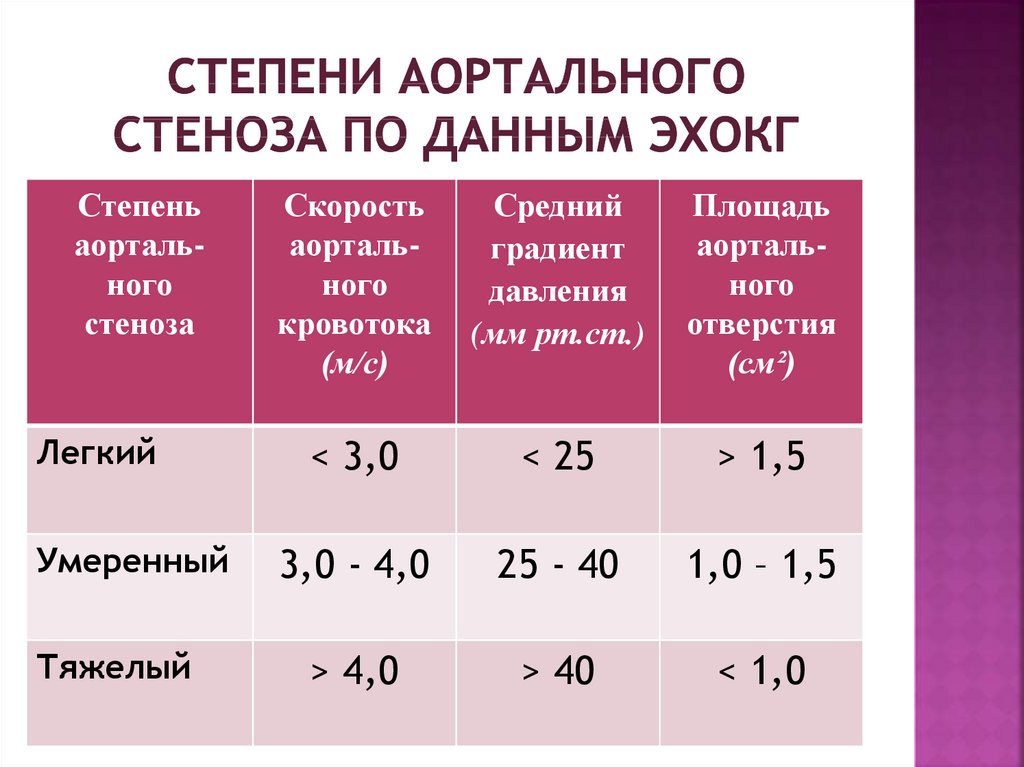 Следствием этого является то, что пациенты с аортальным склерозом должны обратить внимание на контроль типичных сердечных факторов риска, таких как артериальное давление, уровень холестерина, курение, диабет, диета и образ жизни.
Следствием этого является то, что пациенты с аортальным склерозом должны обратить внимание на контроль типичных сердечных факторов риска, таких как артериальное давление, уровень холестерина, курение, диабет, диета и образ жизни.
Нужна ли эхокардиограмма?
Сам по себе аортальный склероз обычно не требует наблюдения, и большинству пациентов не нужно планировать последующие исследования. В некоторых случаях очень утолщенных клапанов или в случаях, близких к диагнозу аортального стеноза, интерпретирующий кардиолог может предложить повторное исследование в какой-то момент, особенно если шум ухудшается или развиваются симптомы.
Лечение аортального склероза
Медикаментозного лечения аортального склероза не существует. Хорошей новостью является то, что маловероятно, что это приведет к серьезному поражению аортального клапана. Однако люди с аортальным склерозом подвержены более высокому риску сердечно-сосудистых заболеваний, поэтому им следует уделять особое внимание факторам риска сердечно-сосудистых заболеваний.

 д.;
д.;