Алгоритм оказания помощи «Кардиогенный шок»
Диагностика
Выраженное снижение артериального давления в сочетании с признаками нарушения кровоснабжения органов и тканей. Систолическое артериальное давление обычно ниже 90 мм рт. ст. пульсовое меньше 20 мм рт. ст.
Для диагностики шока обязательно наличие симптомов ухудшения периферическою кровообращения (бледно-цианотичная влажная кожа, спавшиеся периферические вены, снижение температуры кожи кистей и стоп): уменьшение скорости кровотока (время исчезновения белого пятна после надавливания на ногтевое ложе или ладонь более 2 с), снижение диуреза (меньше 20 мл/ч).
Могут быть различные нарушение сознания (от заторможенности до появления очаговой неврологической симптоматики и развития комы).
В большинстве случаев следует дифференцировать истинный кардиогенный шок с другими его разновидностями (рефлекторным, аритмическим, лекарственным, при медленно текущем разрыве миокарда, разрыве перегородки или папиллярных мышц, поражении правого желудочка), а также от ТЭЛА внутреннего кровотечения и артериальной гипотензии без шока.
внутреннего кровотечения и артериальной гипотензии без шока.
Основные опасности и осложнения:
- невозможность стабилизировать артериальное давление
- отек легких при повышении артериального давления или внутривенном введении жидкости
- тахикардия, тахиаритмия, фибрилляция желудочков
- асистолия
- рецидив ангинозной боли
- острая почечная недостаточность
Под минимально достаточным артериальным давлением понимать систолическое давление около 90 мм рт. ст. при появлении признаков улучшения перфузии органов и тканей.
При отсутствии норадреналина следует использовать адреналин. Скорость внутривенного вливания адреналина повышают постепенно от 1 мкг/мин до 6 мкг/мин. и выше до достижения минимально достаточного артериального давления.
Лечение кардиогенного шока – доврачебная помощь, медикаментозная терапия
Первая помощь при кардиогенном шоке
Кардиогенный шок – тяжелое состояние, вызванное сердечной недостаточностью, сопровождающейся снижением сократительной способности миокарда и выраженным снижением артериального давления.
- острый миокардит;
- инфаркт миокарда;
- острая недостаточность клапанов;
- тяжелая форма гипертрофической кардиомиопатии;
- тампонада сердца;
- разрыв межжелудочковой перегородки;
- геморрагический шок, ТЭЛА.
Кардиогенный шок патогенез
Возрастает тонус периферических сосудов, развивается острая недостаточность кровообращения с явным снижением АД. Часть крови выходит за пределы сосудистого русла в расширенные сосуды и развивается секвестрация крови с гиповолемией и снижением центрального венозного давления.
Виды кардиогенного шока
Согласно классификации, предложенной академиком Чазовым, существует четыре формы кардиогенного шока. Первая – рефлекторная, сопровождающаяся резким падением сосудистого тонуса и выраженным снижением АД. Вторая – истинная. Характеризуется уменьшением насосной функции сердца. Третья – ареактивная, возникающая на фоне обширного инфаркта миокарда. Для нее характерно резкое повышение тонуса периферических сосудов с максимальной выраженностью микроциркуляторных нарушений. Четвертая – аритмическая. Проявления – нарушения ритма и проводимости, снижение давления и появление признаков шока.
Кардиогенный шок при инфаркте миокарда – симптомы
Основные проявления нарастают быстро. Больной бледнеет, кожа становится холодной и липкой, артериальное давление резко снижается, пульс нитевидный, дыхание учащенное. Возможна потеря (спутанность) сознания. Алгоритм неотложной помощи при кардиогенном шоке:- вызвать «Скорую помощь»;
- уложить больного на твердую поверхность, слегка приподняв ноги;
- освободить грудную клетку от сдавливающей одежды;
- обеспечить доступ свежего воздуха;
- выполнить реанимационные мероприятия при остановке сердца.
Помощь при кардиогенном шоке, профилактика
Медицинская помощь заключается в повышении артериального давления до нормальных показателей.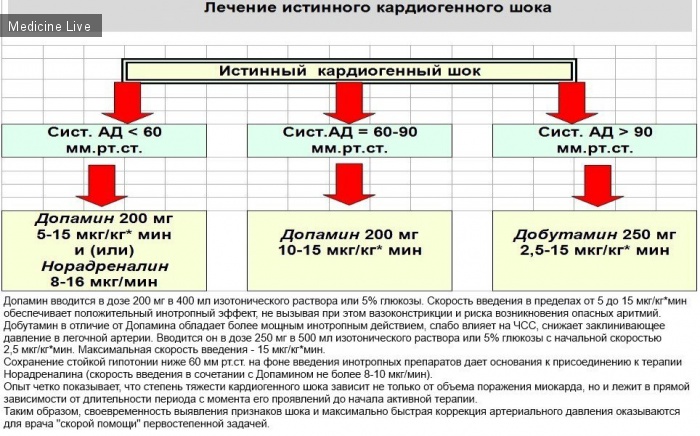 С этой целью применяют допамин или добутамин. При фибрилляции желудочков проводят дефибрилляцию, а при остановке сердца – непрямой массаж сердца. Помощь при кардиогенном шоке в условиях стационара: оксигенотерапия, назначение вазопрессоров, сердечных гликозидов, анальгетиков, преднизолона, гепарина, диуретиков. Дозировка и схема лечения расписывается врачом в каждом конкретном случае индивидуально. Профилактика:
С этой целью применяют допамин или добутамин. При фибрилляции желудочков проводят дефибрилляцию, а при остановке сердца – непрямой массаж сердца. Помощь при кардиогенном шоке в условиях стационара: оксигенотерапия, назначение вазопрессоров, сердечных гликозидов, анальгетиков, преднизолона, гепарина, диуретиков. Дозировка и схема лечения расписывается врачом в каждом конкретном случае индивидуально. Профилактика:- здоровый образ жизни, отказ от вредных привычек;
- рациональное питание;
- полноценный сон, борьба со стрессами;
- умеренные физические нагрузки;
- своевременное лечение любой сердечной патологии.

3.1.Класс I.Некоторые инфекционные и паразитарные болезни (A00-B99) | ||||
3.1.1. Стандарт скорой медицинской помощи детям при менингококковой инфекции неуточненной | A39.9 | дети | от 24.12.2012 №1444н | |
3.2.Класс IV.Болезни эндокринной системы, расстройства питания и нарушения обмена веществ (E00-E90) | ||||
3.2.2. Стандарт скорой медицинской помощи при гипергликемической коме | Е10. Е11.0 Е12.0 Е13.0 Е14.0 | взрослые | от 24.12.2012 №1428н | |
3.2.3. Стандарт скорой медицинской помощи при гипогликемии | Е15 Е16.2 | взрослые | от 20.12.2012 №1280н | |
3.3.Класс | ||||
3.3.4. Стандарт скорой медицинской помощи при органических, симптоматических психических расстройствах | F00 F01 F02 F03 F04 F05 F06 F07 F09 | взрослые | от 24. | |
3.3.5. Стандарт скорой медицинской помощи при психических расстройствах и расстройствах поведения, связанных с употреблением психоактивных веществ | F10 F11 F12 F13 F14 F15 F16 F17 F18 F19 | взрослые | от 24.12.2012 №1443н | |
3.3.6. Стандарт скорой медицинской помощи при шизофрении, шизотипических и бредовых расстройствах | F20 F21 F22 F23 F24 F25 F28 F29 | взрослые | от 20. | |
3.3.7. Стандарт скорой медицинской помощи при расстройствах настроения (аффективных расстройствах) | F30 F31 F32 F33 F34 F38 F39 | взрослые | от 24.12.2012 №1419н | |
3.3.8. Стандарт скорой медицинской помощи при невротических расстройствах, связанных со стрессом, и соматоформных расстройствах | F40 F41 F42 F43 F44 F45 F48 | взрослые | от 20. | |
3.3.9. Стандарт скорой медицинской помощи при расстройствах личности и поведения в зрелом возрасте | F60 F61 F62 F63 F64 F65 F66 F68 F69 | взрослые | от 20.12.2012 №1131н | |
3.4.Класс IX.Болезни системы кровообращения (I00-I99) | ||||
3.4.10. Стандарт скорой медицинской помощи при болезнях, характеризующихся повышенным кровяным давлением | I10 I11 I12 I13.0 I13. I13.2 | взрослые | от 24.12.2012 №1513н | |
3.4.11. Стандарт скорой медицинской помощи при остром коронарном синдроме без подъема сегмента ST | I20.0 I21.4 I21.9 | взрослые | от 24.12.2012 №1387н | |
3.4.12. Стандарт скорой медицинской помощи при остром коронарном синдроме с подъемом сегмента ST | I21.0 I21.1 I21.2 I21.3 | взрослые | от 24.12.2012 №1383н | |
3.4.13. Стандарт скорой медицинской помощи при легочной эмболии | I26 | взрослые | от 20. | |
3.4.14. Стандарт скорой медицинской помощи при внезапной сердечной смерти | I46.1 | взрослые | от 20.12.2012 №1113н | |
3.4.15. Стандарт скорой медицинской помощи при тахиаритмиях | I47.1 I47.2 I48 I49.9 | взрослые | от 20.12.2012 №1284н | |
3.4.16. Стандарт скорой медицинской помощи при сердечной недостаточности | I50 | взрослые | от 20. | |
3.4.17. Стандарт скорой медицинской помощи при инсульте | I64 | взрослые | от 20.12.2012 №1282н | |
3.4.18. Стандарт скорой медицинской помощи при расслоении аорты | I71.0 | взрослые | от 24.12.2012 №1442н | |
3.4.19. Стандарт скорой медицинской помощи при эмболии и тромбозе артерий | I74 | взрослые | от 24.12.2012 №1413н | |
3. | ||||
3.5.20. Стандарт скорой медицинской помощи при пневмонии | J12 J13 J14 J15 J16 J17 J18 | взрослые | от 24.12.2012 №1437н | |
3.5.21. Стандарт скорой медицинской помощи при стенозе гортани | J38.6 | взрослые | от 20.12.2012 №1124н | |
3.5.22. Стандарт скорой медицинской помощи детям при стенозе гортани | J38. | дети | от 20.12.2012 №1281н | |
3.5.23. Стандарт скорой медицинской помощи детям при астме | J45 | дети | от 20.12.2012 №1119н | |
3.5.24. Стандарт скорой медицинской помощи при астме | J45 | взрослые | от 20.12.2012 №1086н | |
3.5.25. Стандарт скорой медицинской помощи при астматическом статусе | J46 | взрослые | от 20. | |
3.5.26. Стандарт скорой медицинской помощи при спонтанном пневмотораксе | J93.0 | взрослые | от 24.12.2012 №1407н | |
3.5.27. Стандарт скорой медицинской помощи при острой респираторной недостаточности | J96.0 | взрослые | от 20.12.2012 №1080н | |
3.6.Класс XI.Болезни органов пищеварения (K00-K93) | ||||
3.6.28. Стандарт скорой медицинской помощи при желудочно-кишечном кровотечении | K92. | взрослые | от 24.12.2012 №1388н | |
3.7.Класс XII.Болезни кожи и подкожной клетчатки (L00-L99) | ||||
3.7.29. Стандарт скорой медицинской помощи при ангионевротическом отеке, крапивнице | L50.9 T78.3 | взрослые | от 24.12.2012 №1430н | |
3.8.Класс XIV.Болезни мочеполовой системы (N00-N99) | ||||
3.8.30. Стандарт скорой медицинской помощи при почечной колике | N23 | взрослые | от 24. | |
3.8.31. Стандарт скорой медицинской помощи при воспалительных болезнях мужских половых органов | N41.0 N41.2 N44 N45 N49 | взрослые, дети | от 20.12.2012 №1116н | |
3.8.32. Стандарт скорой медицинской помощи при травмах мужских мочеполовых органов, инородном теле в мужских мочеполовых органах, избыточной крайней плоти, фимозе и парафимозе | S30.2 S31.2 S31.3 S31.5 T19.0 T19.1 T19.9 N47 | взрослые | от 20. | |
3.8.33. Стандарт скорой медицинской помощи при кровотечении из женских половых органов | N93.9 O08.1 O20.9 O46.9 O67.9 | взрослые | от 24.12.2012 №1401н | |
3.9.Класс XV.Беременность, роды и послеродовой период (О00-О99) | ||||
3.9.34. Стандарт скорой медицинской помощи при кровотечении из женских половых органов | N93.9 O08.1 O20.9 O46.9 O67.9 | взрослые | от 24.12.2012 №1401н | |
3. | O15 | взрослые | от 24.12.2012 №1418н | |
3.9.36. Стандарт скорой медицинской помощи при самопроизвольных родах | O80.9 O84.0 O84.8 O84.9 | взрослые | от 24.12.2012 №1433н | |
3.10.Класс XVIII.Симптомы, признаки и отклонения от нормы, выявленные при клинических и лабораторных исследованиях, не классифицированные в других рубриках (R00-R99) | ||||
3.10.37. Стандарт скорой медицинской помощи при остром животе | R10. | взрослые | от 24.12.2012 №1410н | |
3.10.38. Стандарт скорой медицинской помощи при гематурии | R31 | взрослые | от 24.12.2012 №1386н | |
3.10.39. Стандарт скорой медицинской помощи при задержке мочи | R33 | взрослые | от 20.12.2012 №1083н | |
3.10.40. Стандарт скорой медицинской помощи при неуточненной коме | R40.2 | взрослые | от 24. | |
3.10.41. Стандарт скорой медицинской помощи детям при лихорадке | R50.9 | дети | от 24.12.2012 №1441н | |
3.10.42. Стандарт скорой медицинской помощи при обмороке | R55 | взрослые | от 24.12.2012 №1398н | |
3.10.43. Стандарт скорой медицинской помощи детям при судорогах | R56.8 | дети | от 20.12.2012 №1091н | |
3.10.44. | R56.8 | взрослые | от 20.12.2012 №1082н | |
3.10.45. Стандарт скорой медицинской помощи при кардиогенном шоке | R57.0 | взрослые | от 24.12.2012 №1432н | |
3.10.46. Стандарт скорой медицинской помощи при шоке | R57.9 | взрослые | от 24.12.2012 №1445н | |
3.11.Класс XIX.Травмы, отравления и некоторые другие последствия воздействия внешних причин (S00-T98) | ||||
3. | S00.0 S00.7 S00.8 S00.9 S01.0 S01.7 S01.8 S01.9 S02.0 S02.1 S02.7 S02.8 S02.9 S06 S09.7 S09.8 S09.9 | взрослые | от 24.12.2012 №1390н | |
3.11.48. Стандарт скорой медицинской помощи при травме глаза | S05 T15 | взрослые | от 20.12.2012 №1084н | |
3.11.49. Стандарт скорой медицинской помощи при асфиксии | T17. T17.3 T71 T75.1 | взрослые | от 24.12.2012 №1429н | |
3.11.50. Стандарт скорой медицинской помощи при травме позвоночника | S12 S13 S14 S14.1 S22.0 S22.1 S23.0 S23.1 S24.0 S24.1 S32.0 S32.1 S32.2 S33.0 S33.1 S33.5 S34.0 S34.1 T08 T09.3 | взрослые | от 24.12.2012 №1457н | |
3.11.51. Стандарт скорой медицинской помощи при травмах грудной клетки | S20.2 S20. S20.4 S20.7 S20.8 S21.1 S21.2 S21.7 S21.8 S21.9 S22.2 S22.3 S22.4 S22.5 S22.8 S22.9 S25 S26 S27 S28.0 S29 | взрослые | от 24.12.2012 №1389н | |
3.11.52. Стандарт скорой медицинской помощи при травмах живота, нижней части спины | S30.0 S30.1 S30.7 S30.8 S30.9 S31.0 S31.1 S31.7 S31.8 S35 S36 S37 S39 | взрослые | от 20.12.2012 №1123н | |
3. | S30.2 S31.2 S31.3 S31.5 T19.0 T19.1 T19.9 N47 | взрослые | от 20.12.2012 №1090н | |
3.11.54. Стандарт скорой медицинской помощи при травмах женских мочеполовых органов, инородном теле в женских мочеполовых органах | S30.2 S31.4 S31.5 T19 | взрослые | от 20.12.2012 №1078н | |
3.11.55. Стандарт скорой медицинской помощи при травме конечностей и (или) таза | S32. S32.4 S32.5 S33.4 S40 S41 S42 S43 S45 S46 S47 S48 S49 S50 S51 S52 S53 S55 S56 S57 S58 S59 S60 S61 S62 S63 S65 S66 S67 S68 S69 S70 S71 S72 S73 S75 S76 S77 S78 S79 S80 S81 S82 S83 S85 S86 S87 S88 S89 S90 S91 S92 S93 S95 S96 S97 S98 S99 | взрослые | от 24. | |
3.11.56. Стандарт скорой медицинской помощи при сочетанной травме | T00 T01 T02 T03 T04 T05 T06 T07 | взрослые | от 24.12.2012 №1394н | |
3.11.57. Стандарт скорой медицинской помощи при ожогах, гипотермии | T20 T21 T22 T23 T24 T25 T27 T29 T30 T31 T32 T68 | взрослые | от 20. | |
3.11.58. Стандарт скорой медицинской помощи при отморожениях | T33 T34 T35 | взрослые | от 28.12.2012 №1604н | |
3.11.59. Стандарт скорой медицинской помощи при отравлениях лекарственными средствами, медикаментами, биологическими веществами, токсическом действии веществ преимущественно немедицинского назначения | T36 T37 T38 T39 T45 T46 T47 T48 T49 T50 T56 T57 T60 T61 T62 T63 T64 T65 | взрослые | от 24. | |
3.11.60. Стандарт скорой медицинской помощи при отравлении наркотическими веществами | T40 | взрослые | от 20.12.2012 №1114н | |
3.11.61. Стандарт скорой медицинской помощи при отравлении веществами нейротропного действия | Т41 Т42 Т43 Т44 | взрослые | от 24.12.2012 №1448н | |
3.11.62. Стандарт скорой медицинской помощи при отравлениях алкоголем, органическими растворителями, галогенпроизводными алифатических и ароматических углеводородов | T51 T52 T53 | взрослые | от 24. | |
3.11.63. Стандарт скорой медицинской помощи при отравлении разъедающими веществами | T54 T55 | взрослые | от 24.12.2012 №1391н | |
3.11.64. Стандарт скорой медицинской помощи при отравлениях окисью углерода, другими газами, дымами и парами | T58 T59 | взрослые | от 24.12.2012 №1393н | |
3.11.65. Стандарт скорой медицинской помощи при тепловом и солнечном ударе | T67.0 | взрослые | от 20. | |
3.11.66. Стандарт скорой медицинской помощи при поражении электрическим током | T75.0 T75.4 | взрослые | от 20.12.2012 №1120н | |
3.11.67. Стандарт скорой медицинской помощи при анафилактическом шоке | T78.2 | взрослые | от 20.12.2012 №1079н | |
3.11.68. Стандарт скорой медицинской помощи при ангионевротическом отеке, крапивнице | L50.9 T78.3 | взрослые | от 24. | |
3.11.69. Стандарт скорой медицинской помощи при синдроме длительного сдавления | T79.6 | взрослые | от 24.12.2012 №1399н |
Алгоритм действий неотложной помощи при кардиогенном шоке
Кардиогенный шок – это опасное состояние, тяжело поддающееся медикаментозному лечению, часто ведущее к смерти пациента. Зная алгоритм неотложной помощи при кардиогенном шоке, можно спасти жизнь пациенту, поддержав жизненно важные функции организма до приезда скорой помощи. Как распознать первые признаки тяжелого состояния и что делать в экстренной ситуации, рассмотрим в статье.
Что такое кардиогенный шок
Кардиогенный шок развивается в основном на фоне мелкоочагового или обширного инфаркта миокарда. Вследствие этого резко нарушается кровообращение по всему организму. При развитии этого состояния спасти жизнь пациента удается лишь в 10% случаев, несмотря на своевременную помощь и реанимационные мероприятия.
При развитии этого состояния спасти жизнь пациента удается лишь в 10% случаев, несмотря на своевременную помощь и реанимационные мероприятия.
Возникает опасное состояние из-за резкого нарушения сократительной функции миокарда. Спровоцировать это может инфаркт миокарда, дилатационная кардиомиопатия, аортальный стеноз, повреждение межжелудочковой перегородки и другие заболевания. Кардиогенный шок влечет за собой критическое снижение артериального давления. Вместе с этим происходит активация симпатической нервной системы, что провоцирует возбуждение сердечной деятельности.
Резкое снижение сердечного выброса сопровождается уменьшением количества крови в артериях, это влечет за собой задержку жидкости в организме, нагрузка на сердечную мышцу увеличивается, развивается отек легких. В свою очередь, скопление недоокисленных продуктов метаболизма вызывает метаболический ацидоз.
Как распознать опасное состояние
Чем раньше оказана помощь при кардиогенном шоке, тем больше шансов сохранить жизнь пациента. Клиника всегда зависит от состояния, вызвавшего шок. При инфаркте миокарда человек испытывает сильную боль в грудной клетке, появляется чувство страха, паника. При сбоях сердечного ритма больной отмечает болевой синдром за грудиной, возникает замирание сердца или, наоборот, учащение сердечного ритма. Если причиной кардиогенного шока становится тромбоэмболия легочной артерии, человек задыхается, появляется слабость, иногда кашель с кровью.
Клиника всегда зависит от состояния, вызвавшего шок. При инфаркте миокарда человек испытывает сильную боль в грудной клетке, появляется чувство страха, паника. При сбоях сердечного ритма больной отмечает болевой синдром за грудиной, возникает замирание сердца или, наоборот, учащение сердечного ритма. Если причиной кардиогенного шока становится тромбоэмболия легочной артерии, человек задыхается, появляется слабость, иногда кашель с кровью.
Кардиогенный шок вызывает острую боль в груди и другие симптомы
Дальнейшее развитие шока сопровождается такими признаками:
- появлением холодного липкого пота;
- посинением губ, носа, кончиков пальцев;
- бледностью кожных покровов;
- беспокойством больного или его заторможенностью;
- набуханием шейных вен;
- снижением температуры конечностей;
- чувством паники и страха.
При легочной тромбоэмболии кожа на голове, в области груди и шеи становится землистого или мраморного оттенка.
Важно! При отсутствии необходимой помощи больной теряет сознание, прекращается сердечная и мозговая деятельность, наступает смерть.
Доврачебная неотложная помощь
При обнаружении признаков кардиогенного шока необходимо как можно скорее вызвать скорую помощь, оказать человеку неотложную помощь. Для этого следует выполнить такие действия:
- Больного уложить на любую поверхность, тело должно находиться в горизонтальном положении, ноги слегка приподняты. Такая позиция обеспечивает лучший приток крови к головному мозгу.
- Во время оказания экстренной помощи важно обеспечить доступ свежего воздуха в комнату. Для этого нужно открыть форточку или входную дверь. Нельзя допускать столпотворения возле пострадавшего.
- Шею и грудь человека нужно освободить от одежды. Если есть тесный воротник, галстук, шарф или другие предметы, их нужно снять.
- На начальном этапе нужно измерить артериальное давление пациента. При кардиогенном шоке оно всегда понижено.
 Чтобы нормализовать показатели, нужно дать больному препарат, в состав которого входит допамин, метазон или гидрокартизон.
Чтобы нормализовать показатели, нужно дать больному препарат, в состав которого входит допамин, метазон или гидрокартизон. - Если человек в сознании, допускается прием анальгезирующих лекарств.
После этого следует дождаться карету скорой помощи, после приезда врачей сообщить им, при каких обстоятельствах развился шок.
Доврачебная помощь при развитии шока должна быть немедленной
Реанимационные мероприятия
При потере сознания и остановке дыхания необходимо выполнить срочные реанимационные мероприятия. Искусственное дыхание выполняется рот в рот. Для этого голову человека нужно запрокинуть назад, подложив под шею валик из полотенца или любой другой ткани. Человек, выполняющий реанимацию, должен вдохнуть воздух, закрыть нос пострадавшего пальцами, выдохнуть воздух через рот пострадавшего. За одну минуту необходимо выполнить до 12 вдохов.
Во время оказания доврачебной помощи необходимо следить за пульсом больного. Если человек теряет сознание и сердечные удары не прослушиваются, нужно выполнить непрямой массаж сердца. Для его выполнения пациента кладут на спину, поверхность должна быть твердой. Человек, выполняющий массаж, должен расположиться сбоку от больного. Основания ладоней должны надавливать на область грудной клетки посредине. Толчки выполняются прямыми руками, сгибать их не нужно. Частота нажатий – не менее 60 толчков в минуту. Если реанимируется пожилой человек, количество толчков в минуту составляет до 50, у детей – 120 нажатий.
Для его выполнения пациента кладут на спину, поверхность должна быть твердой. Человек, выполняющий массаж, должен расположиться сбоку от больного. Основания ладоней должны надавливать на область грудной клетки посредине. Толчки выполняются прямыми руками, сгибать их не нужно. Частота нажатий – не менее 60 толчков в минуту. Если реанимируется пожилой человек, количество толчков в минуту составляет до 50, у детей – 120 нажатий.
Важно! При одновременном выполнении искусственного дыхания и непрямого массажа сердца следует чередовать 2 вдоха с 30 толчками.
Помощь больному в условиях стационара
Алгоритм действий врачей зависит от особенностей состояния больного. Первые медицинские мероприятия проводятся еще в машине скорой помощи. Здесь используют такие методы:
- использование оксигенотерапии – процедура помогает поддержать дыхание пациента, сохранить жизненно важные функции до приезда в больницу;
- применение наркотических анальгетиков. Это мероприятие помогает снизить сильный болевой синдром.
 Здесь используются такие лекарства, как Дроперидол, Промедол, Фентанил и другие;
Здесь используются такие лекарства, как Дроперидол, Промедол, Фентанил и другие; - чтобы исключить риск образования тромбов в артериях, человеку вводят гепарин;
- нормализовать частоту сердечных сокращений помогают растворы Добутамина, Дофамина, Норадреналина;
- улучшить питание сердечной мышцы помогает введение инсулина с глюкозой;
- устранить тахиаритмию помогают Панангин, Гилуритмал, Лидокаин;
- раствор натрия гидрокарбоната вводится для налаживания метаболических процессов организма.
Дальнейшее лечение кардиогенного шока в условиях клиники подразумевает продолжение терапии, начатой в домашних условиях и в карете скорой помощи. При поступлении больного в больницу проводится немедленное комплексное обследование организма. Это помогает выявить противопоказания и риск развития побочных эффектов, которые могут спровоцировать осложнение ситуации.
В условиях стационара проводятся реанимационные мероприятия, направленные на восстановление жизненно важных функций пациента
Дальнейший стандарт оказания помощи зависит от заболевания, вызвавшего развитие шока:
- состояние, при котором возникает отек легких, требует назначения Нитроглицерина, использования спиртовых растворов, мочегонных препаратов;
- сильная боль снимается с помощью сильных наркотических анальгетиков, к которым относят Морфин, Промедол, Фентанил;
- лечение сильно пониженного артериального давления проводится с помощью раствора Допамина;
- для сохранения дыхания у пациента в бессознательном состоянии проводится интубация трахеи;
- предотвратить кислородное голодание головного мозга и других органов помогает оксигенотерапия.

При тяжелом состоянии человека необходимо использование аппарата искусственного кровообращения и искусственной вентиляции легких. В этот период больному должна быть оказана необходимая сестринская помощь. Заключается она в выполнении гигиенических процедур, регулярном измерении артериального давления, температуры тела и кормлении пациента.
Экстренное операционное лечение
Если состояние пациента при кардиогенном шоке не улучшается после использования медикаментозной терапии и реанимационных мероприятий, врачи применяют хирургическое вмешательство, помогающее спасти жизнь человеку. Проводится операция исключительно в условиях стационара с использованием необходимого медицинского оборудования.
Для борьбы с симптомами кардиогенного шока используют следующие методики:
- аортокоронарное шунтирование – заключается в создании дополнительного кровеносного русла, которое используется в качестве моста перед предстоящей трансплантацией миокарда;
- внутриаортальная баллонная контрпульсация – методика проводится с помощью введения специального баллона, который раздувается при сокращении сердечной мышцы.
 Проводится процедура для нормализации кровяного давления;
Проводится процедура для нормализации кровяного давления; - чрескожная транслюминальная коронарная ангиопластика – подразумевает восстановление целостности кровеносных сосудов, что обеспечивает нормальную сократительную функцию сердца, поддержание жизненно важных процессов организма на должном уровне.
При отсутствии своевременных реанимационных мероприятий развиваются тяжелые последствия кардиогенного шока. К ним относят сердечную недостаточность, тромбоз вен головного мозга, трофические язвы желудка, кишечника и другие состояния. Даже при своевременной и грамотной медицинской помощи в 90% случаев наступает летальный исход. Объясняется это тяжелым течением кардиогенного шока и его частыми осложнениями. Чтобы избежать этого состояния, необходимо направить усилия на его профилактику. В данном случае профилактические мероприятия должны быть направлены на первопричину, то есть на предотвращение патологий, вызывающих риск развития шока. Правильное лечение сердечно-сосудистых заболеваний и своевременное обращение за медицинской помощью поможет значительно снизить риск кардиогенного шока.
Портативная усиленная наружная контрпульсация при остром коронарном синдроме и кардиогенном шоке: пилотное исследование
Joshua Cohen, William Grossman, Andrew D. Michaels
Резюме
Предпосылки: Усиленная наружная контрпульсация (УНКП) в настоящее время используется как терапия для амбулаторных пациентов, страдающих хронической рефрактерной стенокардией.
Гипотеза: Мы пытались определить безопасность и эффективность портативного УНКП блока для лечения пациентов, страдающих острым коронарным синдромом и/или кардиогенным шоком в отделении интенсивной терапии для больных с острой коронарной недостаточностью (CCU).
Методы: Десять пациентов с острым коронарным синдромом и/или кардиогенным шоком, которым противопоказана инвазивная внутриаортальная баллонная контрпульсация (IABP), стали участниками данного исследования. Каждый пациент проходил 2-4 одночасовых сеансов УНКП терапии в CCU. Гипокоагуляция или недавний феморальный доступ не были критериями исключения.
Результаты: Средний возраст пациентов был 58±19 лет (интервал 28-81), половину из них составляли женщины. У пациентов был либо острый коронарный синдром (n=4), либо кардиогенный шок (n=3), либо и то и другое (n=3). Кардиологическими критериями для участия в исследовании были: острый инфаркт миокарда с подъемом ST-сегмента нижней стенки с кардиогенным шоком (n=2), инфаркт миокарда без элевации ST-сегмента с постинфарктной стенокардией (n=2), или сердечной недостаточностью (n=1), нестабильная стенокардия с рефрактерной стенокадрией покоя (n=2), кардиогенный шок вследствие ишемической кардиомиопатии с острой митральной регургитацией (n=1), и кардиогенный шок вследствие неишемической кардиомиопатии (n=2). Во время и после УНКП терапии не было зарегистрировано неблагоприятных случаев, как, например, кровотечение, обострение сердечной недостаточности, ухудшение состояния кожи. Портативный блок УНКП не препятствовал постоянному лечению критических состояний.
Заключения: УНКП безопасна и возможна для срочной терапии тяжело больных с острым коронарным синдромом и/или кардиогенным шоком, которые не были выбраны кандидатами на IABP.
Ключевые слова: коронарная болезнь сердца, сердечная недостаточность, наружная контрпульсация, острый коронарный синдром, кардиогенный шок.
Введение
В современной клинической практике, усиленная наружная контрпульсация (УНКП) применяется для амбулаторного лечения рефрактерной стенокардии и сердечной недостаточности.1-5 УНКП оказывает антиангинальный эффект на пациентов со стресс-индуцированной ишемией миокарда. УНКП повышает диастолическое внутриаортальное давление, тем самым, повышая перфузию в коронарных артериях. Выкачивание воздуха из манжет в начале систолы уменьшает постнагрузку левого желудочка посредством систолической разгрузки.6 Эти острые гемодинамические эффекты, достигнутые с помощью УНКП, сравнимы с эффектами, полученными с помощью инвазивной внутриаортальной баллонной контрпульсацией (IABP).6
В то время, как использование IABP для лечения острых коронарных синдромов (ACS) и кардиогенного шока хорошо обосновано, остаются случаи, когда ее применение ограничено вероятными осложнениями: ишемия нижних конечностей, кровотечения и инфекции. 7,8 Для пациентов с противопоказаниями к IABP УНКП представляет потенциальный неинвазивный метод увеличения коронарной перфузии и разгрузки желудочка.
7,8 Для пациентов с противопоказаниями к IABP УНКП представляет потенциальный неинвазивный метод увеличения коронарной перфузии и разгрузки желудочка.
Так как предыдущие модели УНКП, использующие гидравлическую компрессионную систему, были мало эффективны в лечении кардиогенного шока9-12 и острого инфаркта миокарда13, исследования по использованию пневматических устройств УНКП в таких клинических ситуациях не проводились. Это предварительное исследование ставит своей целью определить безопасность и применимость портативного УНКП блока для лечения пациентов, страдающих острым коронарным синдромом и/или кардиогенным шоком в отделении интенсивной терапии для больных с острой коронарной недостаточностью (CCU).
Методы
Пациенты
В это одноцентровое исследование, включены взрослые пациенты CCU, госпитализированные с ОКС (нестабильная стенокардия IIIB/C класса по Браунвальду,14 инфарктом миокарда без элевации ST-сегмента или инфарктом миокарда с элевацией ST-сегмента) и/или кардиогенным шоком. Этим людям было отказано в проведении IABP. Критериями исключения были острая аортальная недостаточность, наджелудочковая тахиаритмия, тромбофлебит, активное бедренное кровотечение или гематома, неконтролируемая гипертония (>180/100 мм рт. ст.). Недавняя пункция бедренной артерии и декомпенсированная сердечная недостаточность, даже если больной был интубирован, не были критериями исключения. Пациенты или доверенные лица дали свое письменное согласие перед УНКП, а протокол был одобрен Комитетом по исследованию человека.
Этим людям было отказано в проведении IABP. Критериями исключения были острая аортальная недостаточность, наджелудочковая тахиаритмия, тромбофлебит, активное бедренное кровотечение или гематома, неконтролируемая гипертония (>180/100 мм рт. ст.). Недавняя пункция бедренной артерии и декомпенсированная сердечная недостаточность, даже если больной был интубирован, не были критериями исключения. Пациенты или доверенные лица дали свое письменное согласие перед УНКП, а протокол был одобрен Комитетом по исследованию человека.
Методы исследования
УНКП выполняли в CCU (TS3 прототип портативной модели, Вазомедикал, Инк., Вестбери, НЙ). Пациенты получали по 1 часовой терапии УНКП 2-4 раза через 24 часа. Три пары пневматических манжет, обворачиваемых вокруг ног, были соединены между собой шлангами для подачи сжатого воздуха с портативной компрессорной установкой (рис.1) в CCU. Аппарат УНКП последовательно накачивает воздухом манжеты синхронно с сердечным циклом пациента, который определяется электрокардиограммой. В начале систолы сжатый воздух выпускается для того, чтобы уменьшить систолическое аортальное давление. Контрпульсация была выполнена при давлении наполнения манжет от 80 до 300 mmHg. Пальцевую плетизмографию использовали для контроля за артериальной формой волны. Если системные артериальные и легочные катетеры использовали клинически, то параметры гемодинамики отмечали до, во время и после УНКП терапии. Диурез оценивали до и после УНКП с помощью катетера Фолея. Пациентов просили оценить выраженность боли в груди и одышку по шкале от 0 до 10 до и во время каждой терапии УНКП. Давление наполнения манжет начиная с минимального давления (80 mmHg) постепенно увеличивали через 1 час терапии, до уровня, который могли переносить пациенты. Места пункции бедренной артерии мониторировали для исключения повреждения сосудов.
В начале систолы сжатый воздух выпускается для того, чтобы уменьшить систолическое аортальное давление. Контрпульсация была выполнена при давлении наполнения манжет от 80 до 300 mmHg. Пальцевую плетизмографию использовали для контроля за артериальной формой волны. Если системные артериальные и легочные катетеры использовали клинически, то параметры гемодинамики отмечали до, во время и после УНКП терапии. Диурез оценивали до и после УНКП с помощью катетера Фолея. Пациентов просили оценить выраженность боли в груди и одышку по шкале от 0 до 10 до и во время каждой терапии УНКП. Давление наполнения манжет начиная с минимального давления (80 mmHg) постепенно увеличивали через 1 час терапии, до уровня, который могли переносить пациенты. Места пункции бедренной артерии мониторировали для исключения повреждения сосудов.
Статистический анализ
Непрерывные переменные представлены как средняя и среднеквадратическое отклонение. Для сравнения постоянных переменных до и через 30 минут после начала УНКП использовали парные t-тесты. Двусторонние значения вероятности р<0.05 принимали за значимые. Статистические обработка материала выполнена используя версию программы Stata 9.2 (Stata Corporation, College Station, Tx).
Двусторонние значения вероятности р<0.05 принимали за значимые. Статистические обработка материала выполнена используя версию программы Stata 9.2 (Stata Corporation, College Station, Tx).
Результаты
Исходные характеристики
10 человек включено в исследование, средний возраст которых составлял 58±19 лет (от 28 до 81), половину из них составляли женщины. У пациентов был либо ОКС (n=4), либо кардиогенный шок (n=3), либо и то и другое (n=3). Показания для включения в исследование были: острый инфаркт миокарда с подъемом ST-сегмента в области нижней стенки левого желудочка с кардиогенным шоком (n=2), инфаркт миокарда без элевации ST-сегмента нижней стенки с постинфарктной стенокардией (n=2), или сердечной недостаточностью (n=1), нестабильная стенокардия III класса с рефрактерной стенокадрией покоя (n=2), кардиогенный шок вследствие ишемической кардиомиопатии с острой митральной регургитацией (n=1), и кардиогенный шок вследствие неишемической кардиомиопатии (n=2). У двух пациентов была острая митральная регургитация. Два других были интубированы до включения в исследование и находились на искусственном вентиляции в период исследования.
У двух пациентов была острая митральная регургитация. Два других были интубированы до включения в исследование и находились на искусственном вентиляции в период исследования.
Решение не применять внутриаортальную контрпульсацию было принято лечащими врачами. Критериями отбора пациентов были: предпочтение неинвазивного подхода (n=6), тяжелая извитость подвздошной артерии, изъязвление брюшного отдела аорты, недавнее вмешательство на брюшном отделе аорты и подозрение на инфекционное осложнение через один день после имплантации бивентрикулярного кардиостимулятора. У 7 пациентов была пункция бедренной артерии в течение 48 часов до УНКП. Четырем пациентам имеющих артериальный и венозный бедренный доступ во время УНКП накладывали футляр.
Терапия УНКП
Пациенты получили в среднем от 2,5±0,7 часов УНКП терапии (от 2 до 4 ч., Таблица 2). Пациенты принимали дезагреганты и антитромботические средства, включая нефракционированный гепарин внутривенно (n=7), блокаторы гликопротеиновых рецепторов IIB/IIIA (n=5), аспирин (n=8), клопидогрель (n=7; Таблица 2). Артериальное давление измеряли инвазивно у 4 пациентов и неинвазивно у 6. Во время лечения было замечено значимое повышение среднего артериального давления, измеряемого через 30 минут после начала УНКП по сравнению с исходным уровнем (р=0,0002; таблица 3). Не было отмечено каких-либо серьезных изменений в частоте сердечных сокращений, пульсовой оксиметрии и диурезе. В то время, как тяжесть болей в груди не снизилась, одышка заметно уменьшилась во время УНКП (р=0,036). Во время и после лечения не зарегистрировано никаких осложнений, включая кровотечения, усиление сердечной недостаточности, повреждения кожного покрова из-за пневматических манжет. Не возникали такие проблемы, как излишний шум от воздушной компрессорной установки, передвижение TS3 аппарата в палаты ССU или вмешательство в уход за больным во время интенсивной терапии.
Артериальное давление измеряли инвазивно у 4 пациентов и неинвазивно у 6. Во время лечения было замечено значимое повышение среднего артериального давления, измеряемого через 30 минут после начала УНКП по сравнению с исходным уровнем (р=0,0002; таблица 3). Не было отмечено каких-либо серьезных изменений в частоте сердечных сокращений, пульсовой оксиметрии и диурезе. В то время, как тяжесть болей в груди не снизилась, одышка заметно уменьшилась во время УНКП (р=0,036). Во время и после лечения не зарегистрировано никаких осложнений, включая кровотечения, усиление сердечной недостаточности, повреждения кожного покрова из-за пневматических манжет. Не возникали такие проблемы, как излишний шум от воздушной компрессорной установки, передвижение TS3 аппарата в палаты ССU или вмешательство в уход за больным во время интенсивной терапии.
Рис.1 Портативная установка УНКП, подключенная к тяжело больному в отделении интенсивной терапии. Пациент находился в кардиогенном шоке после успешного стентирования правой коронарной артерии при остром инфаркте миокарда с подъемом сегмента ST. Внутриаортальную контрпульсацию нельзя было выполнить из-за тяжелой двусторонней извитости подвздошной артерии.
Внутриаортальную контрпульсацию нельзя было выполнить из-за тяжелой двусторонней извитости подвздошной артерии.
Таблица 1. Исходные клинико-демографические показатели больных
| Пациент |
Возраст (лет) | Пол | ОКС | Шок | Диабет | HTN | ИБС | PVD | Курит в настоящее время | Дислипедимия | LVEF (%) | Регургитация |
| 1 | 49 |
M | Y | N | Y | Y | Y | N | N | Y | 74 | умеренная |
| 2 | 45 |
M | Y | N | N | N | Y | N | N | Y | 52 | остаточная |
| 3 | 63 |
M | Y | Y | Y | Y | Y | N | Y | Y | 40 | умеренная |
| 4 | 81 |
F | Y | N | N | Y | Y | Y | N | Y | 70 | средняя |
| 5 | 76 |
M | Y | Y | Y | Y | Y | Y | N | Y | 53 | остаточная |
| 6 | 32 |
M | N | Y | Y | Y | N | N | N | N | 21 | умеренная |
| 7 | 74 |
F | Y | N | Y | Y | Y | N | N | Y | 54 | нет |
| 8 | 66 |
M | N | Y | N | N | Y | Y | N | Y | 41 | острая |
| 9 | 28 |
F | N | Y | N | N | Y | N | N | N | 39 | острая |
| 10 | 66 |
F | Y | N | N | Y | Y | N | N | Y | 75 | остаточная |
Сокращения: ОКС = острый коронарный синдром, HTN = гипертония, ИБС = коронарная болезньсердца, PVD = болезнь периферических сосудов, LVEF = фракция выброса левого желудочка
УНКП при нестабильной стенокардии
Пациент 4 была женщина в возрасте 81 года, госпитализированная с нестабильной стенокардией IIIB класса по классификации Браунвальда. Ангиография выявила окклюзию всех коронарных артерий и шунтов, которые сделаны во время двух предыдущих операций коронарного шунтирования. Ей нельзя было выполнить коронарную реваскуляризацию, и она получала внутривенные антиангинальные средства в палате CCU. После двух 1-часовых сеансов УНКП, частота и сила приступов стенокардии уменьшилась (от 8/10 до 3/10). Больная была выписана с рекомендацией продолжать лечение УНКП амбулаторно.
Ангиография выявила окклюзию всех коронарных артерий и шунтов, которые сделаны во время двух предыдущих операций коронарного шунтирования. Ей нельзя было выполнить коронарную реваскуляризацию, и она получала внутривенные антиангинальные средства в палате CCU. После двух 1-часовых сеансов УНКП, частота и сила приступов стенокардии уменьшилась (от 8/10 до 3/10). Больная была выписана с рекомендацией продолжать лечение УНКП амбулаторно.
УНКП при остром инфаркте миокарда
Пациент 2, 45 лет страдал синдромом ОКС без подъема сегмента ST. Экстренная коронарная ангиография выявила критические стенозы ствола левой коронарной артерии, левой передней нисходящей и правой коронарных артерий после тромболизиса и TIMI III кровотоком. Его направили на операцию аортокоронарного шунтирования, однако операция была отложена, так как больной принимал клопидогрель. Его госпитализировали в коронарный блок, где рецидивировала стенокардия. Приступы стенокардии уменьшились после УНКП терапии.
Пациент 5, 75-летний мужчина с анамнезом 3-сосудистого поражения коронарных артерии и диабета. Через 16 ч после стентирования правой коронарной артерии по поводу острого инфаркта миокарда с подъемом ST сегмента в области нижней стенки ЛЖ прошел курс УНКП терапии в коронарном блоке (рис.1). Пациент оставался в кардиогенном шоке, после обширного инфаркта правого желудочка, гипотонии, несмотря, на применение допамина и добутамина. Внутриаортальная контрпульсация была противопоказана из-за тяжелой двусторонней извитости подвздошной артерии. Его выписали из больницы на 6-й день, и он продемонстрировал хорошие показатели во время осмотра через 8 месяцев.
Таблица 2. УНКП терапия
| Пациент |
Продолжи- |
макс. давление при УНКП (mmHg) | Пункция бедренной артерии |
Пункция бедренной вены | Устройства закрытия | Аспирин | клопи- догрель |
Ингиби- торы GP IIB/IIIA |
Антитромбо- тические средства |
| 1 | 3 |
280 | недавнее 6F | нет | angioseal | Y | Y | Y | UFH |
| 2 | 2 |
280 | текущее 6F | текущее 6F | нет | Y | Y | Y | UFH |
| 3 | 3 |
280 | недавнее 6F | текущее 6F | angioseal | Y | Y | Y | нет |
| 4 | 1 | 160 |
нет | нет | нет | Y | Y | N |
LMW H |
| 5 | 2 | 160 | текущее 6F | текущее 6F | нет | Y | Y | Y | UFH |
| 6 | 4 |
300 | нет | текущее 6F | нет | N | N | N | нет |
| 7 | 2 |
160 | недавнее 6F | нет | preclose | Y | Y | Y | нет |
| 8 | 2 |
160 | недавнее 6F | нет | нет | Y | N | N | UFH |
| 9 | 2 |
300 | недавнее 6F | нет | нет | N | Y | N | UFH |
| 10 | 2 |
280 | нет | нет | нет | Y | N | N | UFH |
Сокращения: GP IIB/IIIA = гликопротеин IIB/IIIA, UFH = нефракционированный гепарин, LMWH = низкомолекулярный гепарин (эноксапарин)
Таблица 3. Гемодинамические и клинические эффекты первого часа УНКП
Гемодинамические и клинические эффекты первого часа УНКП
| среднее артериальное давление (mm/Hg) | частота сердечных сокращений (удар в минуту) | Сатурация (%) | диурез (мл/час) | тяжесть болей в груди (1-10) | одышка (1-10) | |||||||
| Пациент |
до | во время | до | во время | до | во время | до | во время | до | во время | до | во время |
| 1 | 99 |
112 | 55 | 56 | 98 | 98 | 50 | 50 | 4 | 3 | 0 | 0 |
| 2 | 80 |
88 | 66 | 79 | 97 | 98 | 40 | 40 | 1 | 1 | 0 | 0 |
| 3 | 68 | 74 | 107 | 108 | 95 | 94 | 35 | 35 | 0 | 0 | 4 | 2 |
| 4 | 99 | 104 | 67 | 67 | 99 | 99 | 60 | 60 | 5 | 5 | 0 | 0 |
| 5 | 71 |
77 | 69 | 70 | 99 | 99 | 30 | 25 | Intub | Intub | Intub | Intub |
| 6 | 49 |
60 | 110 | 110 | 97 | 97 | 20 | 100 | Intub |
Intub | Intub | Intub |
| 7 | 80 |
90 | 88 | 88 | 95 | 95 | 35 | 35 | 0 | 0 | 5 | 4 |
| 8 | 71 | 77 | 94 | 92 | 93 | 95 | 20 | 20 | 0 | 0 | 6 | 3 |
| 9 | 68 | 68 | 89 | 87 | 95 | 96 | 25 | 25 | 0 | 0 | 7 | 3 |
| 10 | 92 |
97 | 57 | 57 | 94 | 94 | 50 | 50 | 0 | 0 | 2 | 1 |
| Общее |
78±16 | 85±16* | 80±20 |
81±19 | 96±2 |
96±2 |
36±14 |
44±23 |
1,3±1,2 |
1,1±1,9 |
3,0±2,9 | 1,6±1,6 † |
Сокращения: Intub = интубированный пациент , * = значение р <0,001 t-теста по сравнению с исходом, † = значение р <0,05 t-теста по сравнению с исходом
УНКП при кардиогенном шоке
Пациент 6, 32-летний мужчина с неишемической кардиомиопатией и фракцией выброса левого желудочка 21%. За день до включения в исследование ему сделали операцию по имплантации дефибриллятора и бивентрикулярного кардиостимулятора. Вскоре после этого его интубировали из-за отека легких. У него была гипотония и плохой диурез, несмотря на применение фуросемида, допамина, добутамина и норэпинефрина. Через 16 часов после интубирования он начал курс УНКП, и постепенно диурез увеличился с 20 мл/ч до 100 мл/ч, через 30 минут после начала УНКП. Экстубацию выполнили через 3 дня, но он умер через 2 недели из-за остановки дыхания. У пациента 8 также наблюдался плохой диурез (20мл/ч) до УНКП. У больного был кардиогенный шок из-за ишемической кардиомиопатии и острой митральной недостаточности. У этого пациента не произошли улучшения в плане диуреза во время УНКП.
За день до включения в исследование ему сделали операцию по имплантации дефибриллятора и бивентрикулярного кардиостимулятора. Вскоре после этого его интубировали из-за отека легких. У него была гипотония и плохой диурез, несмотря на применение фуросемида, допамина, добутамина и норэпинефрина. Через 16 часов после интубирования он начал курс УНКП, и постепенно диурез увеличился с 20 мл/ч до 100 мл/ч, через 30 минут после начала УНКП. Экстубацию выполнили через 3 дня, но он умер через 2 недели из-за остановки дыхания. У пациента 8 также наблюдался плохой диурез (20мл/ч) до УНКП. У больного был кардиогенный шок из-за ишемической кардиомиопатии и острой митральной недостаточности. У этого пациента не произошли улучшения в плане диуреза во время УНКП.
Рис. 2 Артериальная кривая лучевой артерии пациента 9 в начале (а) и во время усиленной наружной контрпульсации при давлении накачивания манжет 300 мм рт. ст. Пациентке 9, 28-летней женщине вводили милринон и фуросемид внутривенно. Ей должны были сделать трансплантацию сердца из-за дилатационной кардиомиопатии.
Ей должны были сделать трансплантацию сердца из-за дилатационной кардиомиопатии.
Больная 9, 28-летняя женщина находилась на в/в инфузии милринона и фуросемида в ожидании трансплантации сердца по поводу дилатационной кардиомиопатии. Она хорошо перенесла УНКП, и показатели гемодинамики улучшились (рис. 2). Ей выполнили ортопическую трансплантацию сердца, и она показала хорошие результаты во время обследования через 9 месяцев. У обоих пациентов с острой митральной недостаточностью во время УНКП уменьшилась одышка.
Обсуждение
В настоящее время УНКП применяют для лечения рефрактерной стенокардии и сердечной недостаточности амбулаторно. Система УНКП не поддается транспортировке. Это экспериментальное исследование показало безопасность и применимость портативного прототипа прибора УНКП при лечении тяжело больных в палатах CCU. Это пилотное исследование показало безопасность и эффективность портативного прототипа прибора УНКП у больных в критических состояниях. Наблюдения подтверждают, что экстренная УНКП терапия может улучшить деятельность сердечно-сосудистой системы, и, возможно, клинические исходы у пациентов с ОКС и/или кардиогенным шоком.
Исследования гемодинамики и клинических эффектов УНКП начались в 1960-х используя, гидравлические компрессионные камеры. Сороф впервые применил наружную контрпульсацию у человека.9,10 Наружную контрпульсацию применяли у 20 пациентов с кардиогенным шоком. Как сообщалось, смертность 65% была ниже, чем при внутриаортальной контрпульсации.11
Наружная контрпульсация предотвращала гипотонию, вызванную вазодилататором нитропрусидом, обеспечивавшим систолическую разгрузку левого желудочка фармакологическим способом, в то время, как наружная контрпульсация улучшала перфузию миокарда.15 В многоцентровом исследовании 258 пациентов с острым инфарктом миокарда рандомизированы для наружной контрпульсации в течение 24 часов с момента установки диагноза или обычную терапию.13
У пациентов группы УНКП, госпитальная летальность была ниже (8,4%) по сравнению с контрольной группой (14,7%; р=0,12). У пациентов, получивших контрпульсацию, была ниже частота возвратной стенокардии, сердечной недостаточности и фибрилляции желудочков.
Были некоторые ограничения относительно ранних приборов наружной контрпульсации.9-13,15 Компрессионные баллоны для ног не были достаточно мощными, чтобы обеспечивать эффективную систолическую разгрузку. Исследования обмена веществ сердца показали, что IABP снижала потребление кислорода миокардом, в то время как наружная контрпульсация увеличила потребность в кислороде. В исследованиях по изучению кровотока коронарного синуса во время кардиостимуляции первые приборы наружной контрпульсации не показали показали острых метаболических и гемодинамических положительных эффектов.16,17
Современная пневматическая система УНКП увеличивает внутрикоронарное давление и кровоток.6 Улучшение коронарного перфузионного давления в дополнение к систолической разгрузке левого желудочка делает УНКП полезным гемодинамическим вспомогательным аппаратом. Недавнее исследование показало, что УНКП превосходит только медикаментозную терапию у стабильных амбулаторных больных с систолической дисфункцией левого желудочка. Это проявляется в улучшении толерантности к физической нагрузке, функционального класса сердечной недостаточности и качества жизни.18 Два наших пациента с острой митральной недостаточностью отметили уменьшение одышки во время УНКП. За время этого пилотного исследования мы не наблюдали какого-либо неблагоприятного воздействия из-за увеличения венозного возврата у пациентов с сердечной недостаточностью.
Это проявляется в улучшении толерантности к физической нагрузке, функционального класса сердечной недостаточности и качества жизни.18 Два наших пациента с острой митральной недостаточностью отметили уменьшение одышки во время УНКП. За время этого пилотного исследования мы не наблюдали какого-либо неблагоприятного воздействия из-за увеличения венозного возврата у пациентов с сердечной недостаточностью.
Это исследование ограничено небольшим количеством больных, включенных в одном центре. Так как исследование должно было определить безопасность и применимость УНКП, его целью не было оценить эффективность портативной УНКП в сравнению с другими методами лечения. Мы не можем заявить об изменениях аортального и диастолического артериального давления, так как у 6 из 10 пациентов давление измеряли неинвазивно. Субъективная оценка боли в груди и одышки была использована для определения безопасности.
В заключении можно сказать, что портативная система УНКП безопасна и применима для лечения тяжело больных, страдающих острым коронарным синдромом и/или кардиогенным шоком, которым нельзя проводить IABP. Для таких больных полезны острые гемодинамические эффекты увеличения коронарной перфузии и систолическая разгрузка левого желудочка при помощи УНКП, обосновывают предположение о том, что УНКП может улучшить клинические исходы пациентов с острым коронарным синдромом и/или кардиогенным шоком.
Для таких больных полезны острые гемодинамические эффекты увеличения коронарной перфузии и систолическая разгрузка левого желудочка при помощи УНКП, обосновывают предположение о том, что УНКП может улучшить клинические исходы пациентов с острым коронарным синдромом и/или кардиогенным шоком.
Список использованных сокращений:
CCU — отделение интенсивной терапии для больных с острой коронарной недостаточностью;
IABP — инвазивная внутриаортальная баллонная контрпульсация;
ACS – острый коронарный синдром;
TIMI – тромболизис инфаркта миокарда;
Список литературы:
13. Arora RR, Chou TM, Jain D, Fleishman B, Crawford L, et al.: The Multicenter Study of Enhanced External Counterpulsation (MUST-EECP): effect of EECP on exercise-induced myocardial ischemia and anginal episodes. J Am Coll Cardiol 1999; 33: 1833-1840.
14. Arora RR, Chou TM, Jain D, Fleishman B, Crawford L, et al.: Effects of enhanced external counterpulsation on Health-Related Quality of Life continue 12 months after treatment: a substudy of the Multicenter Study of Enhanced External Counterpulsation.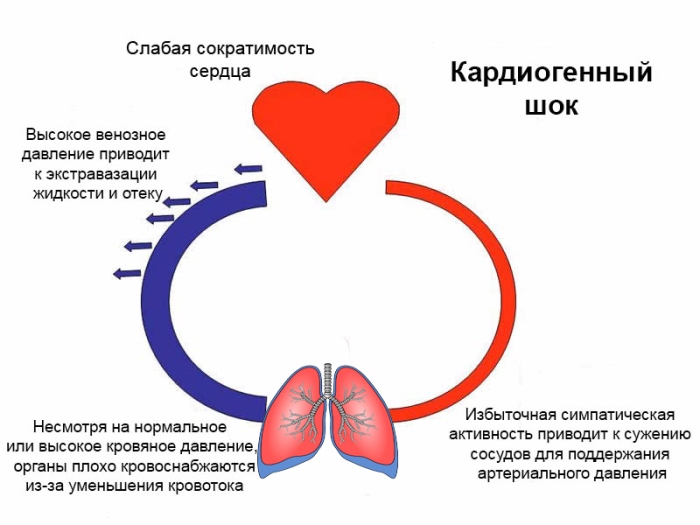 J Investig Med 2002; 50:25-32.
J Investig Med 2002; 50:25-32.
15. Lawson WE, Hui JCK, Soroff HS, Zheng ZS, Kayden DS, et al.: Efficacy of enhanced external counterpulsation in the treatment of angina pectoris. Am J Cardiol 1992; 70: 859-862.
16. Lawson WE, Hui JCK, Zheng ZS: Three-year sustained benefit from enhanced external counterpulsation in chronic angina pectoris. Am J Cardiol 1995; 75: 840-841.
17. Stys TP, Lawson WE, Hui JC, Fleishman B, Manzo K, et al.: Effects of enhanced external counterpulsation on stress radionuclide coronary perfusion and exercise capacity in chronic stable angina pectoris. Am J Cardiol 2002; 89: 822-824.
18. Michaels AD, Accad M, Ports TA, Grossman W: Left venticular systolic unloading and augmentation of intracoronary pressure and Doppler flow during enhanced external counterpulsation (EECP). Circulation 2002; 106: 1237-1242.
19. Meco M, Gramegna G, Yassini A, Bellisario A, Mazzaro E, et al.: Mortality and morbidity from intra-aortic ballon pumps. Risk analysis. J Cardiovasc Surg 2002; 43: 17-23.
J Cardiovasc Surg 2002; 43: 17-23.
20. Sirbu H, Busch T, Aleksic I, Friedrich M, Dalichau H: Ischaemic complications with intra-aortic ballon counterpulsation: incidence and menagement. Cardiovasc Surg 2000; 8:66-71.
21. Soroff HS, Birtwell WC, Giron F, Collins JA, Deterling RA Jr: Support of systemic circulation and left venticular assist by synchronous pulsation of extramural pressure. Surg Forum 1965; 16: 148-150.
22. Giron F, Birtwell WC, Soroff HS, Ruiz U, Collins JA, et al.: Assisted circulation by synchronous pulsation of extramural pressure. Surgery 1966; 60: 894-901.
23. Cohen LS, Mullins CB, Mitchell JH: Sequenced external counterpulsation and intraaortic ballon pumping in cardiogenic shock. Am J Cardiol 1973; 32: 656-661.
24. Mueller H: Are intra-aortic ballon pumping and external counterpulsation effective in the treatment of cardiogenic shock? Cardiovasc Clin 1977; 8: 87-102.
25. Amsterdam EA, Banas J, Criley JM, Loeb HS, Mueller H, et al.: Clinical assessment of external pressure circulatory assistance in acute myocardial infarction: report of a cooperative clinical trial. Am J Cardiol 1980; 45: 349-356.
Am J Cardiol 1980; 45: 349-356.
26. Gersh BJ, Braunwald E, Rutherford JD: Chronic coronary artery disease. In Heart Disease: A Textbook of Cardiovascular Medicine (6th ed.) (Eds. Braunwald E, Zipes DP, Libby P). Philadelphia, PA: Saunders, 2001.
27. Parmley WW, Chatterjee K, Charuzi Y, Swan HJ: Hemodynamic effects of noninvasive systolic unloading (nitroprusside) and diastolic augmentation (external counterpulsation) in patients with acute myocardial infarction. Am J Cardiol 1974; 33: 819-825.
28. Solignac A, Ferguson RJ, Bourassa MG: External counterpulsation: coronary hemodynamics and use in treatment of patients with stable angina pectoris. Cathet Cardiovasc Diagn 1977; 3: 37-45.
29. Kern MJ, Henry RH, Lembo N, Park RS, Lujan MS, et al.: Effects of pulsed external augmentation of diastolic pressure on coronary and systemic hemodynamics in patients with coronary artery disease. Am Heart J 1985; 110: 727-735.
30. Feldman AM, Silver MA, Francis GS, Abbottsmith CW, Fleishman BL, et al. : PEECH Investigators: Enhanced external counterpulsation improves exercise tolerance in patients with chronic heart failure. J Am Coll Cardiol 2006; 48: 1198-1205.
: PEECH Investigators: Enhanced external counterpulsation improves exercise tolerance in patients with chronic heart failure. J Am Coll Cardiol 2006; 48: 1198-1205.
Кардиогенный шок
Кардиогенный шок – это угрожающее для жизни человека состояние. Кардиогенный шок наблюдается при различных сердечно-сосудистых заболеваниях и характеризуется недостаточным кровоснабжением тканей с нарушением функций жизненно важных органов.
Этиология и патогенез
Различают истинный кардиологический шок, аритмический и рефлекторный. Истинный кардиогенный шок развивается за счет снижения сократимости миокарда. От истинного шока следует отличать аритмический, который возникает вследствие тахикардии, тахиаритмии или брадикардии.
Симптомы
При кардиогенном шоке обращают на себя внимание внешний вид пациента (осунувшееся лицо землистого цвета, запавшие глаза, бледность или цианоз), неподвижность и безучастность к окружающему, едва слышные, «неохотные» ответы на вопросы. Сознание может быть сохранено, но спутано, отмечаются апатия и сонливость. Пациенты жалуются на сильную слабость, головокружение, зябкость, ослабление зрения, шум в ушах, иногда на чувство тоски и страха. Часто на коже пациента выступают капли холодного пота, конечности холодные на ощупь. При кардиогенном шоке шейные вены наполнены кровью, дыхание обычно учащенное, поверхностное.
Сознание может быть сохранено, но спутано, отмечаются апатия и сонливость. Пациенты жалуются на сильную слабость, головокружение, зябкость, ослабление зрения, шум в ушах, иногда на чувство тоски и страха. Часто на коже пациента выступают капли холодного пота, конечности холодные на ощупь. При кардиогенном шоке шейные вены наполнены кровью, дыхание обычно учащенное, поверхностное.
Внимание! Если Вы обнаружили у себя хотя бы один из перечисленных симптомов, незамедлительно обратитесь к врачу! Сохраните свое здоровье и свою жизнь!
Диагностика
Для диагностики кардиогенного шока врач осуществляет сбор анамнеза, проводит осмотр пациента, пальпацию. Если у пациента наблюдается падение систолического артериального давления, уменьшение пульсового давления, признаки нарушения микроциркуляции (холодная кожа, бледность), то врач-кардиолог ставит диагноз: кардиогенный шок, и назначает соответствующее лечение.
В «Кардиологическом центре диагностики и NLS лечения» работают врачи высшей категории, кандидаты медицинских наук с большим опытом работы. Кардиологи Центра работают на результат, а главный результат для нас – здоровье наших пациентов.
Кардиологи Центра работают на результат, а главный результат для нас – здоровье наших пациентов.
Бывают случаи, когда одного физикального обследования пациента для постановки точного диагноза может быть недостаточно, тогда в ход идут инструментальные методы исследования. «Кардиологический центр диагностики и NLS лечения» оснащен новейшим оборудованием, среди которого ЭКГ-аппараты, ЭхоКГ, УЗИ, рентген, но главной гордостью центра является методика NLS-диагностики.
NLS-графия представляет собой новейший способ диагностики, который позволяет максимально точно выявить любое сердечно-сосудистое заболевание. Высокая точность метода положительно влияет на результаты оперативного лечения.
Преимущества «Кардиологического центра диагностики и NLS лечения»
Главное преимущество нашего центра – мы помогаем пациентам вернуть здоровье, а значит и полноценную жизнь. При этом Вам не обязательно отказываться от привычного для Вас образа жизни. Любой курс лечения мы подбираем с учетом его безопасности и безболезненности.
Врачи «Кардиологического центра диагностики и NLS лечения» — это высококвалифицированные специалисты, которые знают абсолютно все о сердечных заболеваниях.
Обратившись в наш Центр, Вы получите качественную помощь, заботу и внимание.
Кардиогенный шок, неотложная помощь, алгоритм
Человек, оказавшийся в состоянии кардиогенного шока, находится в шаге от внезапной остановки сердца, что обязательно без реанимационных экстренных мер повлечёт его скорую смерть. Поэтому реально может спасти его неотложная помощь при кардиогенном шоке, суть которой обязаны знать в близком кругу того, кто имеет серьёзные проблемы с миокардом, особенно после недавно перенесённого инфаркта.
Не исключено, что на улице или в общественном месте сердечнику станет плохо, и он не в меньшей степени будет нуждаться в грамотно оказанной помощи — она буквально спасёт ему жизнь, поэтому правильный экстренный её алгоритм не лишне будет знать каждому.
Что собой представляет кардиогенный шок
Мало кто даже в кругу сердечников подозревает, что такое риск кардиогенного шока, и что влечёт за собой такое состояние.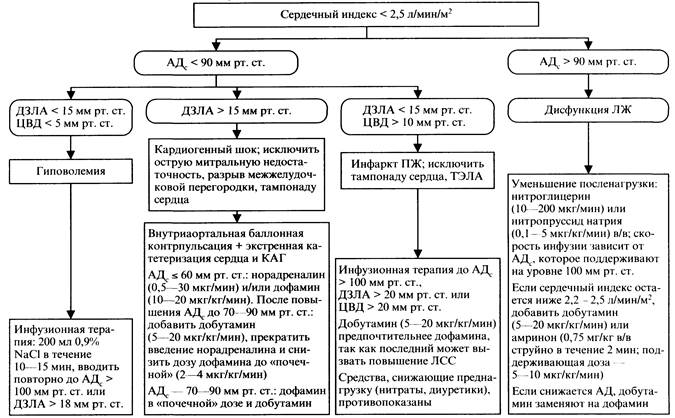 Приоткроем завесу медицинских тонкостей, чтобы полнее описать этот опасный процесс.
Приоткроем завесу медицинских тонкостей, чтобы полнее описать этот опасный процесс.
Кардиогенный шок заключает в себе крайне угрожающую степень недостаточного сокращения в левом сердечном желудочке, когда кровь перестаёт поступать в большой круг кровяного русла, по которому обращается насыщенная кислородом кровь, с параллельным критическим падением АД.
Сердце в разрезе
Насосная функция сердца испытывает сбой, а расслабленные сосуды не позволяют продвигать кровь и поставлять её к органам и тканям.
Начинают преимущественно страдать от кислородного голода жизненно важные системы и органы, в первую очередь ткани мозга, лёгкие, печень, селезёнка и почки — развиваются ацидоз и гипоксия.
Формируется порочный круг, где каждый сбой влечёт еще большее ухудшение, вовлекая новые негативные факторы. Картина выглядит так: внезапно человек впадает в бессознательное состояние, близкое к коллапсу, и умирает.
- Наступление кардиогенного шока чаще всего провоцирует обширный, не менее 40% вовлечённой ткани, инфаркт.

- Реже шоку способствуют стеноз (спазм желудочка), миокардит, недостаточность (расслабление желудочка), аритмия, механический разрыв перегородки левого желудочка, отравления веществами, блокирующими миокард.
- В зоне риска лица с перенесённым тяжёлым инфарктом, с сахарным диабетом и в пожилом возрасте.
Именно таких людей зачастую подстерегает угроза резкого ухудшения состояния, поэтому основные знания про кардиогенный шок, неотложную помощь и её алгоритм должны быть известны ближним.
Признаки, по которым можно распознать кардиогенный шок
Существует совокупность признаков, дающая окружающим понять, что человек впадает в состояние кардиогенного шока. Каждый из них в отдельности — это уже повод срочно вызвать неотложную бригаду!
- Впадение в состояние сопора либо комы, когда пострадавший либо частично реагирует на раздражители (свет, боль), либо когда реакция вовсе не фиксируется.
- Падение показателей артериального давления ниже критических (до 50/20).

- Ледяные конечности вследствие сбоя в кровообращении.
- Свист при дыхании, клокотание и влажный хрип.
- Бледная пятнами кожа (мраморный рисунок) на фоне холодного пота.
- Частый и слабый, до нитевидного, пульс.
- Исчезновение выпуклости вен на конечностях.
- Прекращение выделения мочи из-за нарушения функции почек.
В комплексе эти симптомы помогут идентифицировать случившийся коллапс, как кардиогенный шок, чтобы соблюсти присущий ему алгоритм экстренной помощи до приезда скорой.
Алгоритм доврачебной помощи для человека с кардиогенным шоком
Если у человека внезапно обнаружились признаки кардиогенного шока, то экстренные меры заключены в таком алгоритме:
- немедленный вызов неотложной медицинской бригады;
- придание горизонтального положения пострадавшему;
- обеспечение притока воздуха и освобождение от стесняющих грудную клетку и шею элементов одежды;
- замер пульса и показателей давления.
Важно! Если вызов скорой затруднён, то возможна самостоятельная транспортировка до стационара, главное — побыстрее доставить в руки докторов больного!
Нюансы доврачебной помощи
Остановимся на подробностях в оказании неотложной помощи для испытывающего кардиогенный шок, существенно влияющих на состояние больного, до того, как начнутся экстренные медицинские мероприятия.
- Главная задача — предотвратить падение давления, этому может помочь тёплый крепкий чай, если сохранена возможность глотать, либо несколько кристаллов соли на язык.
- Попутно расстёгивается вся имеющаяся на шее и груди одежда, окна распахиваются.
- Пострадавший осторожно укладывается, голова, грудной отдел и ноги приподнимаются примерно на 20 — 25º, чтобы способствовать лучшему поступлению крови.
- При возможности вводится любой из препаратов, повышающих АД и стимулирующих работу миокарда — Норадреналин, Норэпинефрин, Добутамин, Допамин, а также никотиновая кислота для расширения капиллярной сетки.
- Если человек стонет, значит, его беспокоит интенсивная боль, что не редкость для сердечного коллапса, поэтому даётся обезболивающее.
Важно! Необходимо измерить пульс и АД, показания записать и сразу же передать прибывшей бригаде неотложной помощи.
Экстренные медицинские меры при кардиогенном шоке
Вначале за человека, пребывающего в кардиогенном шоке, берутся реаниматологи — именно кардиологическая бригада прибывает на подобные вызовы. Несмотря на тяжесть коллапса, медики будут до последнего сражаться за жизнь пациента.
Несмотря на тяжесть коллапса, медики будут до последнего сражаться за жизнь пациента.
Комплекс врачебных мер включает:
- стабилизацию, а затем медленное повышение АД;
- подачу кислорода;
- запуск и стимуляцию сокращений желудочка;
- предотвращение тромбоза и снижение кровяной вязкости;
- очистку крови от продуктов распада и углекислоты;
- поддержание работы почек, печени и селезёнки;
- устранение отёков.
Параллельно регулируется электролитический баланс и проводится полноценное обезболивание.
Статистика и прогноз при кардиогенном шоке
Суть прогноза для пережившего кардиогенный шок сводится в итоге к одному — чем ранее будет оказана экстренная адекватная помощь со стороны реаниматологов, тем выше вероятность выживания.
- Даже при непродолжительном коллапсе существует риск необратимых осложнений в виде постоянных сбоев ритма, образования тромбов в артериях, кровоизлияний, некроза некоторых участков тканей, поражений лёгких, почек, селезёнки.

- Среднее по тяжести течение шока так же не гарантирует улучшения даже после удачных попыток поднять и стабилизировать показатели АД, но выживают в основном именно пострадавшие этой категории.
- Крайне тяжёлое течение, увы, возможности выжить практически не оставляет, поскольку организм пострадавшего совершенно не реагирует на реанимационные меры — неспроста эту форму шока медики называют ареактивной.
Статистика по кардиогенному шоку удручающая — в нашей стране это состояние уносит до 90 — 95% больных. В развитых странах удалось добиться показателей на уровне 50%.
Важно! Главным фактором выживаемости является экстренность лечебных мер — чем скорей они начнут осуществляться, тем выше шансы уцелеть после пережитого кардиогенного шока.
Кардиогенный шок — Диагностика и лечение
Диагноз
Кардиогенный шок обычно диагностируется в неотложных случаях. Врачи проверят наличие признаков и симптомов шока, а затем проведут тесты, чтобы определить причину. Тесты могут включать:
Врачи проверят наличие признаков и симптомов шока, а затем проведут тесты, чтобы определить причину. Тесты могут включать:
- Измерение артериального давления. У людей в шоке очень низкое кровяное давление.
- Электрокардиограмма (ЭКГ или ЭКГ). Этот быстрый неинвазивный тест регистрирует электрическую активность вашего сердца с помощью электродов, прикрепленных к вашей коже.Если у вас повреждена сердечная мышца или скопление жидкости вокруг сердца, сердце не будет нормально посылать электрические сигналы.
- Рентген грудной клетки. Рентген грудной клетки показывает размер и форму вашего сердца, а также наличие жидкости в легких.
- Анализы крови. У вас возьмут кровь для проверки на предмет повреждений органов, инфекции и сердечного приступа. Для определения содержания кислорода в крови может быть проведен анализ газов артериальной крови.
- Эхокардиограмма.
 Звуковые волны создают образ вашего сердца.Этот тест может помочь определить повреждение от сердечного приступа.
Звуковые волны создают образ вашего сердца.Этот тест может помочь определить повреждение от сердечного приступа. - Катетеризация сердца (ангиограмма). Этот тест может выявить закупоренные или суженные артерии. Врач вводит длинную тонкую трубку (катетер) через артерию в ноге или запястье и направляет ее к сердцу. Краситель проходит через катетер, благодаря чему артерии легче увидеть на рентгеновском снимке.
Дополнительная информация
Показать дополнительную информациюЛечение
Лечение кардиогенного шока направлено на уменьшение повреждений сердечной мышцы и других органов от недостатка кислорода.
Неотложное жизнеобеспечение
Большинство людей с кардиогенным шоком нуждаются в дополнительном кислороде. При необходимости вас подключат к дыхательному аппарату (аппарату ИВЛ). Вы будете получать лекарства и жидкость через капельницу в руке.
Лекарства
Жидкости и плазма вводятся через капельницу. Лекарства для лечения кардиогенного шока назначаются для увеличения насосной способности вашего сердца и снижения риска образования тромбов.
- Вазопрессоры. Эти лекарства используются для лечения низкого кровяного давления. К ним относятся дофамин, адреналин (Adrenaline, Auvi-Q), норэпинефрин (Levophed) и другие.
- Инотропные агенты. Эти лекарства, которые помогают улучшить насосную функцию сердца, можно давать до тех пор, пока не начнут действовать другие методы лечения. В их состав входят добутамин, дофамин и милринон.
- Аспирин. Аспирин обычно назначают немедленно, чтобы уменьшить свертываемость крови и поддержать движение крови по суженной артерии.Принимайте аспирин самостоятельно, ожидая прибытия помощи, только в том случае, если ваш врач ранее сказал вам сделать это при симптомах сердечного приступа.

- Антитромбоцитарный препарат. Врачи отделения неотложной помощи могут прописать вам лекарства, похожие на аспирин, чтобы предотвратить образование новых сгустков. Эти лекарства включают клопидогрель (плавикс), тирофибан (агграстат) и эптифибатид (интегрилин).
- Прочие разжижающие кровь препараты. Скорее всего, вам дадут другие лекарства, например гепарин, чтобы снизить вероятность образования тромбов в крови.Внутривенный или инъекционный гепарин обычно назначают в течение первых нескольких дней после сердечного приступа.
Операции и другие процедуры
Медицинские процедуры по лечению кардиогенного шока обычно направлены на восстановление кровотока через сердце. В их числе:
Ангиопластика и стентирование. Если во время катетеризации сердца обнаруживается закупорка, врач может ввести длинную тонкую трубку (катетер), снабженную специальным баллоном, через артерию, обычно в ноге, в заблокированную артерию в сердце.
 Попав в нужное положение, баллон ненадолго надувается, чтобы открыть засорение.
Попав в нужное положение, баллон ненадолго надувается, чтобы открыть засорение.В артерию можно вставить стент с металлической сеткой, чтобы со временем она оставалась открытой. В большинстве случаев врач установит стент, покрытый медленно высвобождающимся лекарством, чтобы артерию оставалось открытой.
- Баллонный насос. Ваш врач вставляет баллонный насос в главную артерию вашего сердца (аорту). Помпа раздувает и сдувает аорту, помогая кровотоку и снимая часть нагрузки с вашего сердца.
- Экстракорпоральная мембранная оксигенация (ЭКМО) . ECMO помогает улучшить кровоток и снабжает организм кислородом. Кровь перекачивается из вашего тела в аппарат искусственного кровообращения, который удаляет углекислый газ и отправляет кровь, наполненную кислородом, обратно в ткани тела.
Если лекарства и другие процедуры не помогают при лечении кардиогенного шока, ваш врач может порекомендовать операцию.
- Операция по аортокоронарному шунтированию. В этой операции используется здоровый кровеносный сосуд в ноге, руке или груди, чтобы создать новый путь для крови, чтобы она могла течь по заблокированной или суженной артерии.Ваш врач может предложить эту операцию после того, как ваше сердце успеет восстановиться после сердечного приступа. Иногда операция шунтирования проводится в качестве неотложной помощи.
- Операция по восстановлению травмы сердца. Иногда травма, например разрыв одной из камер сердца или повреждение сердечного клапана, может вызвать кардиогенный шок. Хирургия может решить проблему.
- Желудочковое вспомогательное устройство (VAD). Механическое устройство может быть имплантировано в брюшную полость и прикреплено к сердцу, чтобы помочь ему перекачивать кровь. VAD может продлить и улучшить жизнь некоторых людей с терминальной сердечной недостаточностью, которые ждут нового сердца или не могут перенести пересадку сердца.

- Пересадка сердца. Если ваше сердце настолько повреждено, что никакие другие методы лечения не работают, пересадка сердца может быть последним средством.
Дополнительная информация
Показать дополнительную информациюКлинические испытания
Изучите исследования клиники Мэйо, в которых тестируются новые методы лечения, вмешательства и тесты как средства предотвращения, обнаружения, лечения или контроля этого состояния.
09 февраля 2021 г.
Показать ссылки- Кардиогенный шок. Национальный институт сердца, легких и крови. https://www.nhlbi.nih.gov/health-topics/cardiogenic-shock. Проверено 28 декабря 2020 г.
- Рейентович А, и др. Клинические проявления и диагностика кардиогенного шока при остром инфаркте миокарда. https://www.uptodate.com/contents/search. Проверено 28 декабря 2020 г.
- Симптомы сердечного приступа и инсульта.
 Американская Ассоциация Сердца. https://www.heart.org/en/about-us/heart-attack-and-stroke-symptoms. Проверено 28 декабря 2020 г.
Американская Ассоциация Сердца. https://www.heart.org/en/about-us/heart-attack-and-stroke-symptoms. Проверено 28 декабря 2020 г. - Рекомендации Американской кардиологической ассоциации по диете и образу жизни. Американская Ассоциация Сердца. https://www.heart.org/en/healthy-living/healthy-eating/eat-smart/nutrition-basics/aha-diet-and-lifestyle-recommendations#.WZRP5YqQwmI. Проверено 28 декабря 2020 г.
- Рейентович А.А. Прогноз и лечение кардиогенного шока, осложнившего острый инфаркт миокарда.https://www.uptodate.com/contents/search. Проверено 28 декабря 2020 г.
- Goldman L, et al., Eds. Кардиогенный шок. В: Медицина Гольдмана-Сесила. 26-е изд. Эльзевир; 2020. https://www.clinicalkey.com. Проверено 28 декабря 2020 г.
- Weiner L, et al. Клиническая польза оксигенации веноартериально-экстракорпоральной мембранной оксигенации (VA-ECMO) у пациентов с лекарственным кардиогенным шоком: ретроспективное исследование реестра случаев ЭКМО Организации экстракорпорального жизнеобеспечения.
 Клиническая токсикология.2020; DOI: 10.1080 / 15563650.2019.1676896.
Клиническая токсикология.2020; DOI: 10.1080 / 15563650.2019.1676896. - 2020-2025 диетические рекомендации для американцев. Министерство здравоохранения и социальных служб США и Министерство сельского хозяйства США. https://www.dietaryguidelines.gov. По состоянию на 14 января 2021 г.
- Рекомендации по физической активности для американцев. 2-е изд. Министерство здравоохранения и социальных служб США. https://health.gov/our-work/physical-activity/current-guidelines. Проверено 28 декабря 2020 г.
- Манкад Р. (заключение эксперта). Клиника Майо.13 янв.2021 г.
- Переосмысление питья: каковы разные уровни употребления алкоголя? Национальный институт злоупотребления алкоголем и алкоголизма. https://www.rethinkingdrinking.niaaa.nih.gov/. Проверено 21 декабря 2020 г.
- AskMayoExpert. Физическая активность. Клиника Майо; 2020.
Связанные
Связанные процедуры
Показать другие связанные процедурыПродукты и услуги
Показать больше продуктов и услуг Mayo ClinicКардиогенный шок в условиях острого инфаркта миокарда
Методист Дебейки Кардиоваск Дж. 2020 январь-март; 16 (1): 16–21.
2020 январь-март; 16 (1): 16–21.
Навин К. Капур
МЕДИЦИНСКИЙ ЦЕНТР TUFTS, БОСТОН, МАССАЧУСЕТС
Кэтрин Л. Тайер
МЕДИЦИНСКИЙ ЦЕНТР TUFTS, БОСТОН, МАССАЧУСЕТС
Элрик Цвек
МЕДИЦИНСКИЙ ЦЕНТР TUFTSМЕДИЦИНСКИЙ ЦЕНТР TUFTS
, MASSACHUSETTS
Copyright © 2020 Хьюстонская методистская больница Хьюстон, ТехасЭта статья цитируется в других статьях в PMC.Abstract
Кардиогенный шок на фоне острого инфаркта миокарда остается основной причиной заболеваемости и смертности.Фактически, на острый инфаркт миокарда приходится 81% пациентов с кардиогенным шоком. Несмотря на успехи в фармакологических и аппаратных подходах к поддержке пациентов с кардиогенным шоком, за последние 20 лет не наблюдалось значительного улучшения показателей смертности, хотя многочисленные регистры позволяют по-новому взглянуть на этот сложный синдром. Ключевые элементы оптимального лечения включают интеграцию гемодинамических и метаболических данных для диагностики и стратификации риска, раннюю оценку и соответствующее включение устройств для острой механической поддержки кровообращения, а также организованный алгоритмический подход к принятию решений.
Ключевые слова: кардиогенный шок, острый инфаркт миокарда, острая механическая поддержка кровообращения, классификация шока, ранняя реваскуляризация, оценка риска
ВВЕДЕНИЕ
Примерно каждые 40 секунд кто-то в Соединенных Штатах переживает инфаркт миокарда. Острый инфаркт миокарда (ОИМ) составляет примерно 80% пациентов с кардиогенным шоком (КШ) .1 В этом сценарии КС обычно проявляется левожелудочковой недостаточностью. Однако в 20% случаев КС возникает из-за осложнений, связанных с ОИМ, таких как острая митральная регургитация, дефект межжелудочковой перегородки или подострый или острый разрыв свободной стенки.Правожелудочковая недостаточность также может способствовать развитию КС и чаще связана с инфарктом миокарда правого желудочка.
Из 805000 сердечных приступов, которые происходят каждый год в Соединенных Штатах, примерно 38% связаны с инфарктом миокарда с подъемом сегмента ST (ИМпST) .2 Электрокардиографические критерии ИМпST были хорошо определены Американским колледжем кардиологов, American Heart. Ассоциация, Европейское общество кардиологов и Всемирная федерация кардиологов () .3,4 ИМпST ассоциируется с двукратным повышением риска развития CS.5
Ассоциация, Европейское общество кардиологов и Всемирная федерация кардиологов () .3,4 ИМпST ассоциируется с двукратным повышением риска развития CS.5
Таблица 1.
Определение инфаркта миокарда 3,4
| ИНФАРКТ МИОКАРДА (ИМпST) |
Американский колледж кардиологов, Американская кардиологическая ассоциация, Европейское общество кардиологов, комитет Всемирной кардиологической федерации установил следующие критерии электрокардиограммы (ЭКГ) для ИМпST:
|
Новая блокада левой ножки пучка Гиса считается эквивалентом ИМпST. Пациенты с ранее существовавшей блокадой левой ножки пучка Гиса могут быть дополнительно оценены с использованием критериев Скарбосса: Пациенты с ранее существовавшей блокадой левой ножки пучка Гиса могут быть дополнительно оценены с использованием критериев Скарбосса:
|
| НЕТ ИНФАРКТ МИОКАРДА НА ПОДЪЕМЕ ST (ИМпST) |
ИМбпST диагностируется у пациентов, у которых есть симптомы, соответствующие острому кардиогенному шоку и повышению уровня тропонина, но без изменений ЭКГ, соответствующих ИМпST.Нестабильная стенокардия и ИМбпST различаются, прежде всего, наличием или отсутствием обнаруживаемой утечки тропонина. Повреждение миокарда ожидается при уровнях тропонина, превышающих верхний референсный предел 99-го процентиля, который указывается для каждого отдельного анализа. Конкретные ограничения можно найти во вкладышах производителей, в рецензируемых публикациях и на веб-сайте Международной федерации клинической химии и лабораторной медицины. Конкретные ограничения можно найти во вкладышах производителей, в рецензируемых публикациях и на веб-сайте Международной федерации клинической химии и лабораторной медицины. |
ИСХОДЫ ДЛЯ ПАЦИЕНТОВ ПРИ КАРДИОГЕННОМ ШОКЕ
Недавний анализ Национальной стационарной выборки показал, что частота КС среди пациентов с ИМпST увеличилась с 6.От 5% до 10,1% в период с 2003 по 2010 год. Он также показал, что внутрибольничная смертность для этих пациентов снизилась с 44,6% до 33,8% за тот же период времени6. Аналогичные результаты были представлены в анализе той же базы данных с 2003 по 2011 год. В этом анализе Национальный реестр сердечно-сосудистых данных (NCDR) сообщил, что 12,2% пациентов с ИМ с подъемом сегмента ST испытали КС в период с 2007 по 2011 г., а внутрибольничная летальность от ИМ с подъемом сегмента ST, осложненного КС, составила 33,1%. Авторы также отметили, что CS был менее распространен (4.3%) среди пациентов без ИМпST, но было связано с более высоким уровнем внутрибольничной смертности — 40,8% . 7
7
Несмотря на эти данные реестра, рандомизированные клинические испытания продолжают сообщать о показателях смертности от 40% до 60% для пациентов с ОИМ и шок (). В 1999 г. в исследовании SHOCK (следует ли проводить реваскуляризацию окклюзированных коронарных артерий при кардиогенном шоке) сообщалось о 30-дневной смертности 41% для пациентов моложе 75 лет, получивших раннюю реваскуляризацию, и 75% для пациентов старше 75 лет.В то время как исследование SHOCK не показало улучшения первичной конечной точки 30-дневной смертности, это было первое испытание, в котором сообщалось об улучшении 6-месячных исходов (вторичная конечная точка), связанных с ранней реваскуляризацией, среди всей когорты пациентов. Однако среди пациентов старше 75 лет 30-дневная и 6-месячная смертность были выше при ранней реваскуляризации по сравнению с одной медикаментозной терапией.8 Долгосрочные преимущества ранней реваскуляризации были подтверждены той же группой через 10 лет наблюдения. -вверх.9
Таблица 2.

Недавние клинические испытания по оценке вариантов лечения кардиогенного шока. IABP: внутриаортальный баллонный насос; ЧКВ: чрескожное коронарное вмешательство; ЗПТ: заместительная почечная терапия; ШОК: следует ли срочно реваскуляризировать окклюзированные коронарные сосуды для исследования кардиогенного шока; IABP-SHOCK II: Испытание внутриаортальной баллонной помпы для инфаркта миокарда с кардиогенным шоком; IMPRESS: Impella по сравнению с IABP снижает смертность у пациентов с ИМпST, получавших первичное ЧКВ в испытании тяжелого кардиогенного шока; КУЛПРИТ ШОК: ЧКВ только с поражением виновника по сравнению с многососудистым ЧКВ в испытании кардиогенного шока; DCSI: Detroit Cardiogenic Shock Initiative
| ИССЛЕДОВАНИЕ | ГОД | ПАЦИЕНТЫ | ПАЦИЕНТЫ | НАСЕЛЕНИЕ ПАЦИЕНТОВ | ПЕРВОНАЧАЛЬНОЕ ОБСЛУЖИВАНИЕ | ||
|---|---|---|---|---|---|---|---|
| ШОК | 1999 | 302 | Шок из-за левожелудочковой недостаточности, осложняющей инфаркт миокарда | Экстренная реваскуляризация или начальная медицинская стабилизация | 30-дневная летальность | по всем причинам смертность между группами лечения (46.||
| IABP — SHOCK II | 2012 | 600 | Шок, осложняющий острый инфаркт миокарда | Внутриаортальная баллонная контрпульсация или отсутствие интрааортальной баллонной контрпульсации | дней все | -причинить смертностьНет значимой разницы в смертности между группами лечения (39,7% против 41,3%; P = 0,69) | |
| IMPRESS | 2016 | 48 | Тяжелый шок, осложняющий острый инфаркт миокарда | Impella CP или внутриаортальный баллонный насос | 30-дневная смертность от всех причин | Нет значительных различий в смертности между Impella CP и IABP (46% против 50%, P =.96) | |
| CULPRIT SHOCK | 2017 | 706 | Шок, проявляющийся многососудистым поражением и острым инфарктом миокарда | ЧКВ только с повреждением сердца или немедленное многососудистое ЧКВ | , требующее смерти от 30 дней | ЧКВ только с повреждением кривизны было связано с немного сниженным риском смертности (OR: 0,84, P = 0,03) по сравнению с многососудистым PCI, но риск ЗПТ не отличался (OR: 0.71, P = .07) | |
| DCSI | 2018 | 41 | Острый инфаркт миокарда, осложненный кардиогенным шоком | Одноразовая группа лечения инвазивного гемодинамического мониторинга и быстрое начало | MCABне-IAB Выживаемость для эксплантата и изменение CPO | Выживаемость для эксплантата составила 85% против 51% в историческом контроле ( P <0,001), а CPO после процедуры увеличилось на 67% по сравнению с CPO до процедуры ( P <.001) |
Совсем недавно в исследовании IABP-SHOCK II (Внутриаортальная баллонная помпа для инфаркта миокарда с кардиогенным шоком) сообщалось, что использование внутриаортальной баллонной помпы для лечения ОИМ (как ИМпST, так и не ИМпST) ) не превосходил только медикаментозную терапию в снижении 30-дневной смертности. Показатели смертности в этом исследовании колебались от 39,7% до 41,3% в обеих группах лечения. В 2017 г. в исследовании CULPRIT SHOCK (ЧКВ с поражением только виновного по сравнению с ЧКВ с множеством сосудов при кардиогенном шоке) сообщалось, что вмешательство только при поражении виновных было связано со снижением 30-дневной смертности (43.3%) по сравнению с многососудистым вмешательством (51,6%) при ОИМ, осложненном КС (AMI-CS) ( P = 0,03) .10 Исследование Detroit Cardiogenic Shock Initiative, проводившееся одной рукой, показало, что ранняя механическая поддержка кровообращения ( MCS) было связано с улучшением выживаемости для эксплантата по сравнению с историческим контролем (85% против 51%, P <0,001) .11 Несмотря на это многообещающее снижение риска, данные коллективных испытаний не являются окончательными и позволяют предположить, что смертность от ОИМ с CS остается в основном неизменным за последние два десятилетия.
КЛАССИФИКАЦИЯ КАРДИОГЕННОГО ШОКА
Одним из объяснений различий в результатах клинических испытаний AMI-CS может быть отсутствие четких определений степени тяжести CS. В исходных классификациях Killip и Diamond-Forrester для оценки тяжести шока при ОИМ использовались результаты физикального обследования и гемодинамические данные для оценки перфузии и заложенности. Более поздняя классификация Даймонда-Форрестера определила четыре клинических подгруппы шока: (I) отсутствие застойных явлений в легких или периферической гипоперфузии, (II) изолированное застой в легких, (III) изолированная периферическая гипоперфузия и (IV) как застой в легких, так и гипоперфузия.Эти подмножества коррелировали с сердечным индексом и давлением заклинивания легочных капилляров и были связаны с увеличением смертности (12,13). С момента первоначального развития этой системы классификации несколько консенсусных заявлений подчеркнули необходимость в улучшенных определениях для диагностики CS, дополнительных систем классификации для оценки степени тяжести CS, алгоритмов использования устройств для лечения острого MCS (AMCS) и лучшего понимания гемодинамически ориентированного принятия решений при CS.
Таблица 3.
Классификация Diamond-Forrester по степени тяжести шока при остром инфаркте миокарда. 12,13
| КЛАСС | СЕРДЕЧНЫЙ ИНДЕКС (ММ / МИН) | PCWP (ММ / МИН) | PCWP (MM258 M HGORT) (%) |
|---|---|---|---|
| I | > 2 | <18 | 3 |
| II | > 2 | > 18 | 9 | III 18 | 23 |
| IV | <2 | > 18 | 51 |
| I | > 2 | <18 | 3 18 |
| II> 2 | 9 | ||
| III | <2 | <18 | 23 |
| IV | <2 | > 18 | 51 |
В ответ на th В связи с неудовлетворенными потребностями Общество сердечно-сосудистой ангиографии и вмешательств (SCAI) недавно предложило систему стадирования CS, основанную на единодушном мнении экспертов.Целью схемы классификации SCAI является облегчение ухода за пациентами и проведения исследований в области CS путем предоставления единой системы для идентификации пациентов с повышенным риском смерти () .14 Система SCAI включала пять классов CS: (A) с риском для CS, (B) начало CS, (C) классическое CS, (D) ухудшение CS, и (E) крайнее CS. Каждый этап определяется физическим обследованием, а также биохимическими и гемодинамическими данными. Эти определения были намеренно оставлены более общими, чтобы учесть вариабельность клинических параметров, доступных на момент презентации.Стадии C, D и E включают пациентов, которым требуется инотропная, вазопрессорная или краткосрочная терапия MCS для CS. Пациенты со стадией D представляют собой пациентов со стадией C с клиническим ухудшением, а пациенты со стадией E — это пациенты, у которых ухудшилось еще больше14. Клиническая применимость системы стадирования SCAI в настоящее время исследуется.
Таблица 4.
Схема классификации Общества сердечно-сосудистой ангиографии и вмешательств.13 CS: кардиогенный шок; JVP: яремное венозное давление; САД: систолическое артериальное давление; ЦВД: центральное венозное давление; PA sat: насыщение легочной артерии; BNP: натрийуретический пептид мозга; САД: среднее артериальное давление; PCWP: давление заклинивания легочных капилляров; РАП: давление в правом предсердии; PAPI: индекс пульсации легочной артерии; СКФ: скорость клубочковой фильтрации; LFT: тест функции печени; СЛР: сердечно-легочная реанимация; ЭКМО: экстракорпоральная мембранная оксигенация; BiPaP: двухуровневое положительное давление в дыхательных путях
| СТАДИЯ | ОПИСАНИЕ | ФИЗИЧЕСКОЕ ОБСЛЕДОВАНИЕ / ПРИКРЫТЫЕ РЕЗУЛЬТАТЫ | | 9019 9025 В настоящее время у пациента нет признаков или симптомов CS, но существует риск его развития.У пациента может быть обширный острый инфаркт миокарда или перенесенный инфаркт и / или острые симптомы хронической сердечной недостаточности. |
Нормальная молочная кислота Нормотензивное (САД ≥ 100 мм рт.ст. или нормальное) Если гемодинамика выполнена: |
MAP <60 мм рт. Ст. или > 30 мм рт. Ст. Падение от исходного значения Пульс ≥ 100 Если гемодинамика выполнена: |
C Classic CS | У пациента проявляется гипоперфузия, требующая вмешательства (инотропная, прессорная или механическая поддержка, включая ЭКМО) помимо объемной реанимации для восстановления перфузии. Эти пациенты обычно имеют относительную гипотензию. | Может включать: | Может включать: | Может включать: САД <90 мм рт. Ст. или САД <60 мм рт. Ухудшение / гибель | Пациент аналогичен категории C, но ему становится хуже и он не реагирует на начальные вмешательства. | Любая стадия C | Любая стадия C и : ухудшение | Любая стадия C и : требуется несколько прессов или добавление механических устройств поддержки кровообращения для поддержания перфузии | E Extremis | Пациент испытывает остановку сердца с продолжающейся СЛР и / или ЭКМО, поддерживая многочисленные вмешательства. |
«Пытаясь умереть» CPR (A-модификатор).2 Лактат ≥ 5 ммоль / л | |
|---|
Несколько регистров также начали предоставлять новое понимание CS. Рабочая группа по кардиогенному шоку (CSWG) — это национальный многоцентровый ретроспективный регистр, который использует реальный опыт пациентов с CS. Регистр CSWG, созданный в 2017 году, теперь включает более 1500 пациентов и содержит гемодинамические данные для анализа более 1000 пациентов. Это крупнейший в настоящее время в США реестр CS любого назначения, включающий опыт работы со всеми платформами устройств AMCS.Благодаря разнообразному профилю пациентов и доступности гемодинамических данных, этот регистр может предоставить ценную информацию путем стратификации риска смертности по разным этиологиям, сопутствующим патологиям и методам лечения шока для получения информации в будущих рандомизированных клинических исследованиях15. — это проспективный регистр, который определит, улучшит ли реализация алгоритма определения CS — с использованием данных гемодинамики и раннего начала AMCS с помощью устройства Impella CP клинические исходы у пациентов с AMI-CS.Недавний анализ реестра NCSI с участием 171 пациента с AMI-CS показал 72% выживаемость до выписки; он также выявил предикторы внутрибольничной смертности, включая возраст> 70 лет, креатинин> 2,0, лактат> 4,0 и сердечный выброс энергии <0,6 Вт. 16
Совсем недавно группа врачей из Института сердца и сосудов Inova провела тестирование улучшает ли алгоритм, направленный на выявление, стратификацию и раннее начало AMCS при CS, клинические исходы ().17 Через год после внедрения алгоритма они сообщили о значительном увеличении 30-дневной выживаемости (с 44% до 82%) среди пациентов с AMI-CS. Они также определили, что повышенный уровень лактата, использование вазопрессоров, диабет, диализ, возраст и низкий сердечный выброс или уровни индекса пульсации легочной артерии были связаны с увеличением 30-дневной смертности.
Алгоритм кардиогенного шока, разработанный Институтом сердца и сосудов INOVA. Переиздано с разрешения Elsevier Science & Technology Journals, из Standardized Team-Based Care for Cardiogenic Shock, Tehrani et al., 73 (13), 2019.17
РЕЗЮМЕ
Относительно незначительные улучшения в результатах CS за последние десятилетия требуют более тщательного научного исследования синдрома. Прошлые исследования помогли определить элементы, необходимые для определения и подтверждения оптимального лечения CS; они включают интеграцию гемодинамических и метаболических данных для диагностики и стратификации риска, раннюю оценку и соответствующее включение устройств AMCS, а также организованный алгоритмический подход к принятию решений.Отсутствие стандартного протокола лечения CS может быть препятствием для широкого использования единой системы классификации, но разнообразие разрабатываемых систем классификации, несомненно, является шагом к более широкому внедрению классификации CS. Недавние инициативы, такие как Схема классификации шока SCAI, Реестр рабочей группы по кардиогенному шоку, Национальная инициатива по кардиогенному шоку и проспективный реестр Института сердца и сосудов Inova, предоставят столь необходимую информацию, которая может улучшить результаты лечения пациентов и развитие проспективных исследований. проверка клинической применимости различных подходов к лечению.
КЛЮЧЕВЫЕ МОМЕНТЫ
Несмотря на успехи в фармакологических и аппаратных подходах к поддержке пациентов с кардиогенным шоком, за последние 20 лет не наблюдалось значительного улучшения показателей смертности.
Рандомизированные клинические испытания не продемонстрировали явного превосходства терапевтических стратегий. Неоднородность данных испытаний и регистров объясняется неудовлетворенной потребностью в соответствующих критериях классификации шока.
Ключевые элементы для оптимального лечения кардиогенного шока включают интеграцию гемодинамических и метаболических данных для диагностики и стратификации риска, раннюю оценку и соответствующее включение устройств механической поддержки кровообращения в острой форме, а также организованный алгоритмический подход к принятию решений.
Сноски
Раскрытие информации о конфликте интересов:
Доктор Капур является официальным консультантом и проводит исследования от имени Abbott, Abiomed, Boston Scientific, LivaNova, Medtronic, MD Start и preCARDIA.
СПИСОК ЛИТЕРАТУРЫ
1. Харьола В.П., Лассус Дж., Сионис А. и др. Клиническая картина и прогноз риска краткосрочной смертности при кардиогенном шоке. Eur J Heart Fail. 2015 Май; 17 (5): 501–9. CardShock Study Investigators; ОТЛИЧНАЯ сеть. [PubMed] [Google Scholar] 2.Письменная группа M. Mozaffarian D, Benjamin EJ et al. Обновление статистики сердечных заболеваний и инсультов за 2016 г .: отчет Американской кардиологической ассоциации. Тираж. 2016 26 января; 133 (4): e38–360. [PubMed] [Google Scholar] 4. Thygesen K, Alpert JS, Jaffe AS et al. Четвертое универсальное определение инфаркта миокарда (2018 г.). 13 ноября 2018 г .; 138 (20): e618 – e651. Исполнительная группа от имени Объединенного европейского общества кардиологов (ESC) / Американского колледжа кардиологов (ACC) / Американской кардиологической ассоциации (AHA) / Всемирной федерации сердца (WHF) Целевой группы по универсальному определению инфаркта миокарда.[PubMed] [Google Scholar] 6. Колте Д., Кхера С., Ароноу В.С. и др. Тенденции в отношении заболеваемости, лечения и исходов кардиогенного шока, осложняющего инфаркт миокарда с подъемом сегмента ST в США. J Am Heart Assoc. 2014 13 января; 3 (1) e000590-e. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Андерсон М.Л., Петерсон Э.Д., Пенг С.А. и др. Различия в профиле, лечении и прогнозе пациентов с кардиогенным шоком по классификации инфаркта миокарда: отчет NCDR. Результаты Circ Cardiovasc Qual.2013 ноя; 6 (6): 708–15. [PubMed] [Google Scholar] 8. Hochman JS, Sleeper LA, Webb JG et al. Ранняя реваскуляризация при остром инфаркте миокарда, осложненном кардиогенным шоком. ШОК Следователи. Должны ли мы экстренно реваскуляризовать окклюзию коронарных артерий при кардиогенном шоке. N Engl J Med. 1999 26 августа; 341 (9): 625–34. [PubMed] [Google Scholar] 9. Hochman JS, Sleeper LA, Webb JG et al. Ранняя реваскуляризация и длительная выживаемость при кардиогенном шоке, осложнившем острый инфаркт миокарда. JAMA.2006, 7 июня; 295 (21): 2511–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Тиле Х., Акин И., Сандри М. и др. Стратегии ЧКВ у пациентов с острым инфарктом миокарда и кардиогенным шоком. N Engl J Med. 2017 21 декабря; 377 (25): 2419–2432. [PubMed] [Google Scholar] 11. Базир МБ, Шрайбер Т., Диксон С. и др. Возможность ранней механической поддержки кровообращения при остром инфаркте миокарда, осложненном кардиогенным шоком: инициатива Детройтского кардиогенного шока. Катетер Cardiovasc Interv. 2018. 91 (3): 454–61.[PubMed] [Google Scholar] 12. Forrester JS, Diamond GA, Swan HJC. Корреляционная классификация клинико-гемодинамической функции после острого инфаркта миокарда. Am J Cardiol. 1977 Февраль; 39 (2): 137–45. [PubMed] [Google Scholar] 13. Киллип Т., 3-й, Кимбалл Джей Ти. Лечение инфаркта миокарда в коронарном отделении. Am J Cardiol. Октябрь 1967, 20 (4): 457–64. [PubMed] [Google Scholar] 14. Баран Д.А., Гринес С.Л., Бейли С. и др. Консенсусное заявление клинических экспертов SCAI по классификации кардиогенного шока: этот документ был одобрен Американским колледжем кардиологов (ACC), Американской кардиологической ассоциацией (AHA), Обществом интенсивной терапии (SCCM) и Обществом торакальных хирургов. (СТС) в апреле 2019 года.Катетер Cardiovasc Interv. 1 июля 2019 г .; 94 (1): 29–37. [PubMed] [Google Scholar] 15. Морин К., Джорд Л., Разави А. и др. TCT-492 Мультимодальное управление кардиогенным шоком в Соединенных Штатах: выводы из реестра рабочей группы по кардиогенному шоку. J Am Coll Cardiol. 2018 сентябрь; 72 (13 приложение B): B197. [Google Scholar] 16. Басир МБ, Капур Н.К., Патель К. и др. Улучшенные результаты, связанные с использованием протоколов шока: обновления Национальной инициативы по кардиогенному шоку. Катетер Cardiovasc Interv.1 июня 2019 г .; 93 (7): 1173–83. Национальная инициатива по исследованию кардиогенного шока. [PubMed] [Google Scholar] 17. Тегерани Б.Н., Трусделл А.Г., Шервуд М.В. и др. Стандартизированная командная помощь при кардиогенном шоке. J Am Coll Cardiol. 2019 9 апреля; 73 (13): 1659–69. [PubMed] [Google Scholar]Кардиогенный шок: новые определения и будущие направления в лечении
Введение
Несмотря на значительные успехи в реперфузионной терапии и устройствах чрескожной механической поддержки кровообращения (MCS), смертность среди пациентов с острым кардиогенным шоком (CS), остается упорно высоким, в пределах от 25% до 50%.1–3 В недавней большой когорте из 21 210 пациентов из Лондона с инфарктом миокарда с подъемом сегмента ST (ИМпST) КС наблюдался у 8,9% пациентов с увеличением заболеваемости с течением времени и высокой смертностью 45–70% 4. усилия были направлены на разработку руководящих принципов лечения и алгоритмов лечения для повышения выживаемости в этом крайне смертельном состоянии. Несмотря на растущую осведомленность, существует нехватка высококачественных данных клинических испытаний и большое разнообразие практик. Хотя точная патофизиология этой многофакторной, гемодинамически разнообразной популяции остается малоизученной, раннее распознавание и вмешательство для прерывания разрушительной «спирали кардиогенного шока» имеют решающее значение для выживания.5
Общепринятое определение CS — это состояние, при котором неэффективный сердечный выброс (СО) из-за первичной сердечной дисфункции приводит к неадекватной перфузии органов-мишеней. Текущие критерии определения CS, используемые в клинических испытаниях и руководствах, разнообразны, а рекомендации в значительной степени основаны на данных, полученных от пациентов с CS, вызванным острым коронарным синдромом (ACS) .1 2 6 Значительно меньше известно относительно идентификации и исходов в не- Популяция ОКС, особенно острая декомпенсация у пациентов с хронической сердечной недостаточностью — так называемый «острый хронический» КС.Улучшение понимания патофизиологического процесса и определение конкретных критериев для классификации в этой широко разнородной популяции имеет решающее значение для раннего выявления и надлежащего ведения пациентов с CS.
Патофизиология
Патофизиология CS плохо изучена из-за нехватки высококачественных клинических данных. Даже для наиболее частой причины, ОКС, существует значительная неоднородность (например, ИМпST по сравнению с ИМпST I и II типа с более специфическими переменными, такими как остановка сердца или почечная недостаточность), которая, вероятно, является информацией для лечения и влияет на результаты.В идеале, лечение CS должно включать общие поддерживающие меры, такие как фармакологическая поддержка кровообращения и MCS, титрованная для вмешательств, направленных на лечение конкретных механизмов во все более гранулярных деталях, таких как прерывание клеточных, метаболических и воспалительных путей. В отсутствие надежных многоцентровых когортных исследований, обеспечивающих подробное фенотипирование на уровне пациента, текущее лечение CS обязательно сосредоточено на количественно измеряемых и модифицируемых параметрах CS, полученных в результате инвазивной гемодинамической оценки.В целом, CS характеризуется начальным поражением, приводящим к нарушению CO, за которым следует прогрессирующее повреждение, завершающееся неадекватными и, в конечном итоге, дезадаптивными компенсаторными механизмами и быстрым ухудшением до гипоперфузии органа-мишени и полного сердечно-сосудистого коллапса.7–9 Это концептуализировано как порочный круг сердечное повреждение, системное ухудшение и дальнейшее сердечное нарушение (рисунок 1). Возможно, больше, чем какая-либо отдельная особенность, эта самовоспроизводящаяся петля обратной связи, охватывающая сердце и всего пациента, является тем, что лежит в основе CS.Прерывание этой «шоковой спирали» и восстановление сердечно-сосудистого гомеостаза является центральным элементом всеобъемлющей парадигмы лечения CS. Любая причина острого, тяжелого нарушения СО может вызвать этот каскад и ускорить КС.
Рисунок 1Концептуальный алгоритм лечения кардиогенного шока (КШ). Патофизиология CS характеризуется нарушением сердечного выброса, SIRS, гипоперфузией органа-мишени и дезадаптивными компенсаторными механизмами. Предотвращение прогрессирующего сердечного и системного компромисса требует раннего распознавания, обычно требующего катетеризации правой и левой катетеризации и прерывания порочного цикла путем устранения основных повреждений и начала механической поддержки кровообращения, соответствующей степени клинической декомпенсации.Клинические индексы, такие как CPI для функции ЛЖ, PAPi для функции правого желудочка и наличие злокачественных клинических признаков, таких как аритмия и гипоксемия, могут помочь принять решение о наиболее подходящем методе MSC. Би-В, бивентрикулярный; ИПЦ, индекс сердечной силы; LV, левый желудочек; MCS, механическая поддержка кровообращения; ИМ, инфаркт миокарда; PAPi, индекс пульсации легочной артерии; ССВО, синдром системной воспалительной реакции.
Острый инфаркт миокарда (ОИМ) с недостаточностью левого желудочка (ЛЖ) составляет 60–80% от CS6 10 (рис. 2).В классическом исследовании 22 пациентов, умерших от КС в результате ОИМ, было методично проведено клиническое, физиологическое и патологическое обследование.11 По сравнению с контрольными сердцами пациентов, внезапно умерших после ОИМ без интервального шока, сердца с КС показали значительную потерю функционального миокарда с вовлечением примерно 50% от LV. На тканевом уровне прогрессирующее распространение начального инфаркта в периинфарктный ишемический миокард происходит в двух взаимодополняющих направлениях. Во-первых, на периферических краях травмы в субэндокарде инфаркт распространяется наружу и становится трансмуральным.Во-вторых, боковые края трансмурального инфаркта проходят по окружности наружу. Распространение инфаркта опосредуется снижением CO и тканевой перфузии, в том числе самого сердца из-за (A) инфаркта. (B) Повышенная потребность в кислороде и потребление оставшегося жизнеспособного миокарда. (C) Дальнейшая ишемия по мере того, как сердце продолжает отказывать.12 Этот процесс часто происходит незаметно без признаков продолжающейся ишемии или инфаркта. ЭКГ свидетельствует о продолжающейся травме только у половины пациентов с КС.13 Таким образом, в контексте продолжающегося шока следует предполагать стойкое повреждение миокарда, которое происходит без явных клинических признаков. Множество факторов, управляющих метаболическим спросом и предложением миокарда, состоят из местных действующих лиц в центральной сердечно-сосудистой системе и периферической сосудистой сети, а также паракринных и гормональных сигналов от нервно-сосудистой системы и врожденной иммунной системы.
Рисунок 2Причины кардиогенного шока (адаптировано из Harjola et al [10]). ОКС, острый коронарный синдром; ИМ, инфаркт миокарда.
Хотя ОИМ является наиболее распространенной этиологией, следует рассмотреть другие сердечные заболевания (например, правожелудочковая недостаточность, 14 миоперикардит, аритмия, кардиомиопатия такоцубо, гипертрофическая кардиомиопатия, порок клапанов сердца, послеродовая кардиомиопатия) и экстракардиальные (например, расслоение аорты с острым расслоением аорты). или инфаркт миокарда, травматический разрыв хорды, массивная тромбоэмболия легочной артерии) причины также должны быть быстро диагностированы параллельно и, если они есть, лечиться однозначно.15 Учет этих неишемических этиологий служит напоминанием о том, что, хотя CS обычно сопровождается резко сниженной фракцией выброса CS — это физиологическое состояние депрессивного CO, плохо определенное с анатомической точки зрения, и может возникать только при незначительном нарушении фракции выброса.16
Неадаптивные компенсаторные механизмы ускоряют самовоспроизведение травмы. Местное и системное высвобождение катехоламинов временно увеличивает хронотропию и ионотропию миокарда за счет увеличения частоты аритмии и периферической вазоконстрикции, усугубления постнагрузки и несоответствия перфузии миокарда. Система системного воспалительного ответа, напротив, вызывает несоответствующее расширение сосудов, утечку капилляров, микрососудистую дисфункцию и гипоперфузию конечных органов, особенно в кишечном тракте, что предрасполагает к транслокации кишечника и сепсису.17 Более поздняя эволюция эффекторов, связанных с синдромом системного воспалительного ответа, включая фактор некроза опухоли-α и интерлюкин 6, также являются провоспалительными и кардиодепрессивными. Нейрогормональная активация ренин-ангиотензиновой системы приводит к увеличению задержки солей и воды, увеличивая бремя преднагрузки и декомпенсированной сердечной недостаточности. Способность прервать эти процессы и предотвратить или обратить вспять распространение повреждения миокарда до необратимого повреждения является центральным элементом гипотезы о том, что CS поддается лечению.Таким образом, цель терапии — спасти, поддержать и оптимизировать оставшийся жизнеспособный миокард.
Развивающееся управление
Учитывая сложность проведения рандомизированных исследований по КС, текущие рекомендации по ведению в основном являются эмпирическими или основаны на результатах нескольких исследований, обладающих достаточной мощностью для выявления различий в клинических исходах. Более того, единственным вмешательством с доказанным преимуществом в отношении смертности является ранняя реваскуляризация либо с помощью чрескожного коронарного вмешательства (ЧКВ), либо с помощью аортокоронарного шунтирования: исследование ДОЛЖНЫ ли мы экстренно реваскуляризировать окклюзированные коронарные сосуды при кардиогенном шоке (ШОК). медицинская стабилизация через 30 дней; однако значительное улучшение показателей смертности при ранней реваскуляризации наблюдалось через 6 месяцев, 1 год и 6 лет2.18 Частота реваскуляризации при КС постоянно увеличивается, но остается неоптимальной и составляет примерно 50% (только 60% пациентов получают катетеризацию сердца вообще) .19 Таким образом, доступ к экстренной реваскуляризации остается значительным препятствием.20 Хотя преимущества реваскуляризации виновных сосудов признаются В качестве стандартной практики реваскуляризация многососудистой коронарной артерии (ИБС) у пациентов с КС остается неясной (многососудистая реваскуляризация, Класс IIa B). Данные показывают, что пациенты с многососудистой ИБС имеют более высокую смертность21, и в метаанализе пациентов с ИМпST с многососудистым поражением без КС, реваскуляризация сосудов с экстренной кривизной сосудов с поэтапной многососудистой полной реваскуляризацией в рамках индексной госпитализации показала более низкую смертность.22 При ИМпST с КС опыт регистров из Франции23 и совсем недавно из Кореи24 поддерживает многососудистую реваскуляризацию. Тем не менее, исследование ЧКВ с поражением только виновного по сравнению с многососудистым ЧКВ при кардиогенном шоке (CULPRIT-SHOCK) показало более высокий риск смерти от всех причин и необходимость заместительной почечной терапии в группе многососудистого ЧКВ.25 Кроме того, в Оценке Xience и функции левого желудочка в исследовании чрескожного коронарного вмешательства при окклюзии после инфаркта миокарда с подъемом сегмента ST (EXPLORE) реваскуляризация хронической полной окклюзии (CTO) в течение недели после реваскуляризации ИМпST не улучшила размер или функцию ЛЖ.Однако исследование ограничено неясной полнотой реваскуляризации, рандомизацией к невиновным CTO PCI перед реваскуляризацией виновников и медленным набором. Анализ подгрупп показал тенденцию к положительному результату в когорте реваскуляризации CTO левой передней нисходящей артерии (LAD), где можно было ожидать наибольшего функционального преимущества. Роль полной многососудистой реваскуляризации при CS остается неопределенной.
Роль MCS
Знание фундаментальных принципов гемодинамики в CS имеет решающее значение для понимания полезности устройств MCS и помощи в принятии управленческих решений.Детали гемодинамики CS были обобщены ранее26 и кратко рассмотрены здесь. Петля давление-объем ЛЖ и изменения, которые происходят при КС, обеспечивают основу для понимания гемодинамических нарушений КС и механизма поддерживающих устройств. При КС конечный диастолический и систолический объемы увеличиваются, ударный объем уменьшается, а конечное систолическое давление снижается, что отражает общее снижение сократимости и выброса ЛЖ. 27 Устройства MCS изменяют гемодинамику в попытке восстановить СО и нормализовать перфузионное давление.28
В течение многих десятилетий разгрузка ЛЖ с контрпульсацией через внутриаортальный баллонный насос (IABP) была единственным чрескожным устройством, не позволяющим выполнить полную MCS с экстракорпоральной мембранной оксигенацией (ECMO). В одном из крупнейших рандомизированных исследований пациентов с КС, внутриаортальной баллонной контрпульсации при ОИМ, осложненном испытанием КС (IABP-SHOCK II), 600 пациентов были рандомизированы либо на IABP, либо на медикаментозную терапию. Никаких существенных различий в первичной конечной точке 30-дневной смертности от всех причин не наблюдалось.1 Последующий анализ также не показал разницы в смертности через 12 месяцев.29 Результаты этих клинических испытаний отражены в текущих рекомендациях Европейского общества кардиологов (ранняя реваскуляризация, класс 1B; использование IABP при CS, класс III) 6 30
Устройства MCS для управления CS значительно продвинулись вперед за последние шесть десятилетий. В то время как устройства продемонстрировали улучшение гемодинамики, рандомизированные испытания не показали преимущества в отношении смертности при использовании этих устройств.1 31–34 Хотя гемодинамические факторы представляют собой критический компонент патофизиологии CS, тот факт, что устройства MCS могут улучшить гемодинамику, не влияя на смертность, предполагает что патофизиология КС изучена не полностью, и методы лечения, направленные на поддержку только ЛЖ, оставляя без внимания правый желудочек (ПЖ), обеспечивают только частичную поддержку, могут быть неадекватными и имеют ограниченное окно для коррекции до того, как произойдет необратимое повреждение.Использование строгих гемодинамических определений может ограничить нашу способность распознавать и вмешиваться на ранних этапах патофизиологического течения до того, как произойдет гипоперфузия целевого органа. Кроме того, гемодинамические профили в субпопуляциях CS без ACS плохо изучены, и экстраполяция профилей ACS CS на этих пациентов может быть неуместной.
Клинические испытания устройств MCS также страдают от ограниченного набора и в основном включают только пациентов с CS из-за ОИМ (таблица 1). Одно из недавних испытаний, оценивающих современную MCS, Impella CP против IABP при ОИМ, осложненном кардиогенным шоком (IMPRESS), не показало различий в первичной конечной точке 30-дневной смертности при использовании устройства Impella CP по сравнению с IABP. .У 34 пациентов, включенных в это испытание, был тяжелый шок, все пациенты подвергались искусственной вентиляции легких до рандомизации, а 92% страдали внебольничной остановкой сердца, что вызывает обеспокоенность по поводу бесполезности в исследуемой популяции и оставляет вопросы о специфичности целевых групп без ответа . Клинические испытания, которые в настоящее время проводятся, направлены на изучение преимуществ более раннего вмешательства35, полной предварительной поддержки с веноартериальной (VA) -ECMO, 36 и комбинированной терапии с VA-ECMO и Impella CP.Для клинической практики необходим расширенный взгляд на КС, включающий весь спектр кардиальной и внесердечной этиологии, а также оптимальное использование фармакологической и механической поддержки.
Таблица 1Сводка испытаний устройств механической поддержки кровообращения (MCS)
Дополнительные гемодинамические параметры
Хотя для прогнозирования клинических исходов при CS было предложено несколько систем оценки 25 37, единый набор объективных параметров для идентификации этой разнообразной популяции пациентов не установлено.Сердечный энергетический выброс (CPO) (рассчитывается как среднее артериальное давление (MAP) × CO / 451) и индекс сердечной мощности (CPI) (рассчитывается как MAP × Cardiac Index / 451), где MAP = ((систолическое кровяное давление — диастолическое кровяное давление) / 3) + диастолическое артериальное давление. CPO и CPI представляют собой среднюю гидравлическую энергию, основанную на физическом правиле жидкостей: мощность = расход × давление. А именно, насосную способность сердца можно количественно оценить как одновременное произведение CO (потока) и MAP. В условиях отдыха для хорошо оплачиваемого взрослого мужчины среднего роста CPO и CPI составляют примерно 1 W38 и 0.5–0,7 Вт / м 2 соответственно. При стрессе или физических нагрузках CPO значительно увеличивается до 6 Вт. Эта способность увеличивать выработку сильно снижается при хронической сердечной недостаточности и, как было показано, позволяет прогнозировать долгосрочные результаты.39 CPO в покое при хронической сердечной недостаточности сохраняется и позволяет гемостаз и гемодинамическая стабильность. Следовательно, CPO в состоянии покоя при нормальной и хронической сердечной недостаточности может быть неотличимым. Однако при острой сердечной недостаточности любая способность к увеличению выработки задействуется для поддержания перфузии жизненно важных органов, и CPO в состоянии покоя часто нарушается, что отражает тяжесть декомпенсированного состояния.Одномерный и многомерный анализ данных реестра SHOCK Trial выявил CPO <0,53 и CPI <0,33 как самые сильные независимые гемодинамические корреляты внутрибольничной смертности при CS.40. В то время как сердечный индекс и MAP включены в принятые определения CS (таблица 2) эта относительно современная концепция мощности сердца - нет. Взаимозависимость сердечного индекса и MAP относительно CPI показана на рисунке 3 и демонстрирует важность интеграции потока и давления при оценке общей сердечной функции.Действительно, CS клинически представляет собой континуум от чистой отказов насоса (например, низкий уровень CO, но высокий MAP после острого инфаркта) до чистой вазоплегии (например, относительно сохраненный CO и низкий MAP после реперфузии или терминальной стадии сердечной недостаточности), который объединяется лежащей в основе сердечной недостаточностью. травма, повреждение.
Таблица 2Текущие клинические и пробные определения кардиогенного шока
Рисунок 3 КорреляцияСердечного индекса (CI) и среднего артериального давления (MAP) с индексом сердечной силы (CPI).
Будущие направления
Центральная парадигма в лечении CS — это прерывание самовоспроизводящейся петли обратной связи, связанной с инсультом миокарда, ухудшением сердечной деятельности и дальнейшим несоответствием коронарной и системной перфузии в контексте все более неадекватных компенсаторных механизмов (рис. 1).Таким образом, вмешательства направлены на ограничение повреждения миокарда после индексного повреждения, поддержку сердечной недостаточности и прерывание процессов, ответственных за прогрессирующую дисфункцию, до накопления непоправимого бремени травмы. Хотя диагноз часто можно быстро поставить только на клинической основе, инвазивный гемодинамический мониторинг для оценки CPI и давления заклинивания легочных капилляров имеет решающее значение для разработки многопрофильного подхода, включающего процедурные, механические и фармакологические вмешательства.Заблаговременное рассмотрение и начало лечения нацелены на коррекцию первоначального поражения, ограничение дальнейшего повреждения миокарда и адекватную поддержку больного сердца и конечных органов, если это необходимо для выздоровления. Наряду с рассмотрением срочной реваскуляризации, поддержка сердца и конечных органов имеет решающее значение для предотвращения прогрессирующего сердечно-сосудистого коллапса и предотвращения необратимого повреждения органов-мишеней.
Ионовазодилататоры и вазопрессоры продемонстрировали ограниченную эффективность при CS и часто являются контрпродуктивными.41 42 MCS для улучшения гемодинамики и перфузии становится все более доступным после распространения быстро запускаемых чрескожных вспомогательных устройств для левого желудочка (pLVAD). Первоначально применяемая в качестве дополнительной терапии после реваскуляризации, максимальной фармакологической терапии, медицинской оптимизации и установки IABP, использование устройств первой линии для pVAD может иметь лучшие результаты. Инициатива Detroit Cardiogenic Shock была региональным протоколом выполнимости ранней начальной MCS с микроаксиальной pLVAD Impella Impella CP (Abiomed, Danvers, Massachusetts, USA) до экстренной реваскуляризации, которая предполагала пользу.35 Результаты этого пилотного исследования требуют подтверждения в рамках действующей Национальной инициативы по борьбе с кардиогенным шоком (NCT03677180) и в более широком контексте, но потенциальное преимущество раннего MCS усиливает концепцию CS как системного нарушения сердечно-сосудистой системы с ограниченным периодом глобальная стабилизация гемодинамики, возможно, до устранения конкретных причинных повреждений, таких как продолжающаяся ишемия.
Вашингтонский университет (UW) разработал систематический и последовательный подход к острому CS с применением этой современной патофизиологической модели и включает проверенные индексы дисфункции LV и RV.Алгоритм UW CS включает в себя мультидисциплинарную шоковую команду, состоящую из представителей передовых кардиологов сердечной недостаточности, интервенционной кардиологии, кардиоторакальной хирургии и служб интенсивной терапии для стратификации риска и разработки комплексного подхода с использованием специфических для пациента факторов из клинических данных и инвазивной гемодинамики. Основным определяющим фактором является степень нестабильности ЛЖ, оцениваемая по CPI, или наличие признаков высокого риска, таких как гемодинамически значимая фибрилляция предсердий или злокачественные желудочковые тахиаритмии.Тяжелая нестабильность ЛЖ дополнительно стратифицируется по степени поражения ПЖ с использованием суррогатного индекса Индекс пульсации легочной артерии (соотношение давления в правом предсердии и систолического давления в легочной артерии) .43 Рекомендуемое вмешательство затем адаптируется к степени недостаточности ЛЖ и ПЖ в диапазоне от частичная разгрузка ЛЖ (например, Impella CP) для умеренной нестабильности ЛЖ без вовлечения ПЖ, полная разгрузка ЛЖ (например, Impella 5.0) для более тяжелой нестабильности ЛЖ и, наконец, канюляция VA-ECMO при тяжелой бивентрикулярной недостаточности или гипоксемической дыхательной недостаточности.Следует отметить, что эта парадигма не применяется к пациентам с острой или хронической декомпенсированной сердечной недостаточностью, приводящей к CS. Хотя они, несомненно, также подвержены риску, конкретные гемодинамические профили и пороговые значения для вмешательства, а также ожидаемые результаты, вероятно, сильно отличаются.
Наш алгоритм делает упор на быстрое выявление гемодинамических потребностей пациента и потребностей в интенсивной терапии, а также на развертывание специально адаптированных вмешательств. Внедрение такого подхода требует значительных ресурсов, поскольку для этого требуется опыт нескольких специалистов, чтобы одновременно рассмотреть несколько методов MCS и предложить наиболее подходящую поддержку.Это признает важность быстрого соответствия гемодинамическим потребностям пациента для оптимизации результатов независимо от наличия ресурсов. Таким образом, требуется регионализация лечения CS, позволяющая обеспечить комплексный и индивидуальный уход за пациентом. Безусловно, предлагаемый нами подход требует тщательного исследования для оценки осуществимости и подтверждения эффективности. С этой целью требуются испытания, специфичные для CS, с учетом уникальных характеристик пациентов и действующей патофизиологии.
Обзор лечения кардиогенного шока
Из этого современного обзора лечения кардиогенного шока следует помнить следующие ключевые моменты:
- Кардиогенный шок (КШ) — это гемодинамически сложный синдром, характеризующийся низким сердечным выбросом, который часто приводит к отказу полиорганной системы и смерти.
- Несмотря на последние достижения, клинические результаты остаются неудовлетворительными, а уровень смертности превышает 40%. В отсутствие достаточно мощных рандомизированных контролируемых исследований для руководства по терапии лучшие практики управления шоком остаются неоднородными.
- Новые данные из реестров Северной Америки поддерживают использование стандартизированных протоколов, ориентированных на быструю диагностику, раннее вмешательство, текущую гемодинамическую оценку и многопрофильную продольную помощь.
- Эффективная сортировка в отделениях неотложной помощи является ключом к раннему выявлению и лечению CS. При остром инфаркте миокарда (ОИМ) -CS это означает своевременное получение и интерпретацию электрокардиограммы в 12 отведениях персоналом скорой медицинской помощи и немедленный перевод в учреждение, где возможно чрескожное коронарное вмешательство.
- Несмотря на отсутствие пользы от рутинного использования катетера легочной артерии (PAC) при сердечной недостаточности, все больше данных подтверждают пользу ранней инвазивной оценки гемодинамики у пациентов с CS. Использование PAC может привести к более ранней и более точной идентификации фенотипа CS, так что медицинские и аппаратные методы лечения могут применяться индивидуально.
- Ограниченные данные подтверждают использование норэпинефрина в качестве предпочтительного средства первой линии, а ретроспективный анализ предполагает аналогичные результаты с добутамином и милриноном.
- В условиях динамических и зависящих от времени сложностей, связанных с ОИМ-КС, осложненным остановкой сердца, рекомендуется мультидисциплинарный подход к лечению с упором на оценку общего прогноза пациента, вероятность значимого неврологического восстановления и возможность реваскуляризации и устройства. терапии на основе.
- Целесообразно выборочное применение механической поддержки кровообращения (MCS) у подходящих пациентов с острым тяжелым или рефрактерным CS после ускоренной консультации с многопрофильной шоковой бригадой, которая состоит из интервенционного кардиолога, кардиоторакального хирурга, кардиолога-реаниматолога и специалиста по сердечной недостаточности.
- У отдельных пациентов с преобладанием КС в левом желудочке (ЛЖ) и нормотензивной гипоперфузией чистые вазодилататоры, такие как нитропруссид, могут улучшить сердечный выброс за счет снижения постнагрузки, в то время как сосудорасширяющие эффекты милринона и добутамина также могут быть эффективными при недостаточности ЛЖ с высокой постнагрузкой. Внутривенные или ингаляционные легочные вазодилататоры уменьшают постнагрузку правого желудочка (ПЖ) при легочной артериальной гипертензии и недостаточности ПЖ.
- Существует острая необходимость в прагматических рандомизированных клинических испытаниях существующих и новых методов лечения, которые должны быть адекватно оценены для дальнейшего информирования клинической практики, включая оптимальную роль MCS.
Клинические темы: Острые коронарные синдромы, аритмии и клинические EP, сердечная недостаточность и кардиомиопатии, инвазивная сердечно-сосудистая ангиография и вмешательство, легочная гипертензия и венозная тромбоэмболия, имплантируемые устройства, SCD / желудочковая аритмия, аритмия сердца, аритмия предсердий Легочная гипертензия, вмешательства и ACS
Ключевые слова: Острый коронарный синдром, Аритмии, Сердечный ритм, Сердечный выброс, Добутамин, Электрокардиография, Остановка сердца, Миллиардиан, 65865 Норитопин, , Чрескожное коронарное вмешательство, Гипертония, легочная, Шок, кардиогенный, Сортировка, Сосудорасширяющие агенты
<Вернуться к спискам
Функция | Обновленная информация об острой механической поддержке кровообращения при кардиогенном шоке
Временная механическая поддержка кровообращения (MCS) — привлекательный и интуитивно понятный вариант, когда медицинские подходы к поддержке ослабленного сердца недостаточны.Но хотя эта область растет, она также создала беспорядочную базу доказательств для ряда устройств и небольшого количества показаний.
«Отсутствуют данные рандомизированного исследования для всех устройств и подходов, будь то импелла или ЭКМО. На сегодняшний день самые качественные данные о кардиогенном шоке поступают из регистров. Данные крайне необходимы для выяснения роли острого MCS в кардиогенном шоке, «говорит Навин Капур, доктор медицины, FACC , сертифицированный интервенционный кардиолог и специалист по сердечной недостаточности / трансплантации сердца.
Капур, исполнительный директор сердечно-сосудистого центра исследований и инноваций в Медицинском центре Тафтса в Бостоне, добавляет, что в настоящее время проводится несколько важных испытаний. Отсутствие данных отражено в текущих европейских руководствах, которые рекомендуют рассматривать MCS у отдельных пациентов без какого-либо предпочтения при выборе устройства (класс IIa, уровень доказательности C), согласно обзору по этой теме Holger Thiele, MD , из Кардиологического центра Лейпцига при Лейпцигском университете, Германия. 1
Испытания сложны в этой области по ряду причин, включая трудности с отбором пациентов, сроками и бесполезностью, но исследователи находят инновационные способы обойти эти препятствия.
Отсутствие четких доказательств выгоды, похоже, не сильно повлияло на аргументы в пользу бизнеса. Согласно недавнему рыночному отчету, рынок устройств для чрескожной MCS оценивался в 1474,28 млн долларов США в 2019 году и, по прогнозам, достигнет 3964 долларов США.75 миллионов к 2027 году. 2 Ожидается, что совокупный годовой темп роста рынка в период с 2020 по 2027 год составит 13,5%.
«Темпы роста, однако, зависят от положительных результатов текущих испытаний, по крайней мере теоретически. Трудно сказать, где мы будем через пять лет с MCS», — говорит Тиле.
«Если все текущие испытания и запланированные испытания окажутся положительными, мы обязательно увидим огромный рост использования этих устройств. Однако может также оказаться, что эти испытания будут нейтральными или даже отрицательными, показывая вред от использования MCS.В этом случае будет снижение использования ».
Краткое описание MCS и кардиогенного шока
Кардиогенный шок — это клиническое проявление глубокого угнетения сократительной способности миокарда, будь то левое, правое или бивентрикулярное. Это сложный процесс, при котором недостаточный сердечный выброс приводит к снижению сердечного индекса, нарушению системной перфузии и гипоперфузии и дисфункции органов-мишеней, что часто осложняется системной воспалительной реакцией с тяжелыми клеточными и метаболическими аномалиями.
Щелкните изображение выше, чтобы увеличить его.От 70 до 80% кардиогенного шока возникает из-за острого инфаркта миокарда (ОИМ), а большая часть остального возникает у пациентов с декомпенсированной терминальной сердечной недостаточностью. Частота кардиогенного шока, по-видимому, увеличивается, в то время как результаты остаются неизменно плохими. Смертность после кардиогенного шока, связанного с ОИМ (AMICS), составляет около 50% во всем мире, но, вероятно, несколько снизилась за счет широкого внедрения ранней реваскуляризации. 3,4
«С 1967 по 1999 год выживаемость после шока составляла около 20%. Теперь, даже с учетом двух десятилетий достижений в области ранней реваскуляризации, внедрения региональных систем лечения ИМ и появления устройств для механической поддержки кровообращения, выживаемость сейчас колеблется на уровне 50 % », — говорит Бехнам Тегерани, доктор медицины, AACC .
Кардиогенный шок может быстро прогрессировать до полиорганной недостаточности без посторонней помощи.
«Это заболевание, при котором пациенты прогрессируют по пресловутой спирали смерти за очень короткий период времени — минуты и часы, а не дни или недели», — говорит Тегерани, медицинский директор лабораторий катетеризации сердца в INOVA Heart. и Институт сосудов в ВА.
Временная MCS для увеличения сердечного выброса чаще всего используется при лечении кардиогенного шока, резистентного к медикаментозной терапии. Доступен ряд устройств MCS, но три наиболее распространенных платформы — это внутриаортальный баллонный насос (IABP), чрескожные вспомогательные желудочковые устройства (VAD) (Impella, TandemHeart и другие) и вено-артериальная экстракорпоральная мембранная оксигенация. (VA-ECMO).
Устройства могут использоваться в различных конфигурациях, по отдельности или в комбинации друг с другом, и могут обеспечивать поддержку правого и / или левого желудочка.Сложность заключается в выборе устройства в области с полным отсутствием данных рандомизированных исследований.
Рандомизированных испытаний устройств MCS текущего поколения при ЧКВ высокого риска не проводилось, и очень мало испытаний при кардиогенном шоке. Большинство доступных доказательств получено из наблюдательных исследований.
IABP-SHOCK II — выдающееся, одно из немногих крупных рандомизированных испытаний, оно было отрицательным. Впервые опубликованный в 2012 году, он исследовал влияние IABP на 600 пациентов AMICS. 5 Все пациенты должны были пройти раннюю реваскуляризацию (чрескожную или хирургическую).
30-дневная (39,7% и 41,3%), однолетняя (52% и 51%) и шестилетняя (66,3% и 67%) показатели смертности не различались между группой IABP и медикаментозной терапией (контроль). рука. 6 Не было значительных различий во вторичных конечных точках или в мерах лечения, включая время до стабилизации гемодинамики или продолжительность пребывания в отделении интенсивной терапии.
Основываясь на данных IABP-SHOCK II, в котором он был главным исследователем, Тиле предполагает, что от 50 до 60% пациентов AMICS выживают без какого-либо устройства MCS, и введение устройства в эту группу не принесет никакой пользы. 1 Примерно от 40 до 50% смерть вероятна даже при MCS, в результате остается подгруппа из 15-25% пациентов с кардиогенным шоком, у которых MCS может повлиять на выживаемость (рис. 1).
«В настоящее время у нас нет данных, позволяющих однозначно предсказать, кто из 50–60% выживет», — говорит Тиле. «У нас есть несколько оценок, которые дают нам информацию, но они не идеальны, и никто не применял эти оценки в качестве перспективного способа их проверки для принятия клинических решений, таких как использование MCS.«
Он хотел бы видеть больше испытаний. «И мы должны приступить к этим испытаниям, не предвзято относясь к преимуществам MCS». Поскольку регулирующие органы одобрили устройства без доказательств их выживаемости, он также предполагает, что врачи должны настаивать на разработке прочной доказательной базы.
«Производители устройств на самом деле не заинтересованы в доказательстве того, что эти устройства улучшают выживаемость, пока это требуется только для того, чтобы показать некоторое влияние на кровяное давление и некоторые ограниченные данные по безопасности.Однако мы, врачи, вместе с Европейским агентством по лекарственным средствам и Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) должны запросить больше данных, чтобы действительно продемонстрировать пользу », — говорит Тиле.
Что касается Impella, чрескожного VAD, несмотря на показания FDA для шока, основанные на большом исследовании реестра, нет данных, показывающих, что он улучшает выживаемость больше, чем IABP. Исследование ISAR-SHOCK в 2006 г. было небольшим и показало, что Impella улучшает гемодинамику по сравнению с IABP, что неудивительно, поскольку оно обеспечивает больший кровоток, менее зависимый от собственного сердечного выброса, и непосредственно разгружает левый желудочек. 7
Однако это не улучшило выживаемость. С другой стороны, исследование IMPRESS in Severe Shock с использованием Impella CP по сравнению с IABP у 48 пациентов не показало каких-либо преимуществ в отношении гемодинамических переменных или лактата и еще раз не показало улучшения выживаемости. 8
Совсем недавно Амин и др. Использовали данные из базы данных Premier Healthcare и сопоставление склонностей, чтобы показать, что использование Impella быстро растет, но связано с более высокими шансами смерти и широкими вариациями кровотечений и инсультов. 9
А в феврале Санкет Дхрува, доктор медицины, FACC , и его коллеги опубликовали в JAMA анализ, в котором использовались регистры CathPCI и Chest Pain-MI, которые являются частью NCDR ACC, и показали, что пациенты, получавшие Impella, имели более высокий показатель -больничная смертность по сравнению с баллонным насосом. 10
«Эти исследования поднимают вопросы относительно профилей безопасности этих устройств и подчеркивают необходимость адекватных рандомизированных контролируемых испытаний для оценки как безопасности, так и эффективности», — говорит Тегерани.
Помимо отсутствия убедительных доказательств пользы, импелла связана с повышенным риском осложнений. Dhruva и др. Сообщили о 31,3% случаев серьезных кровотечений при применении Impella по сравнению с 16,0% при IABP (p <0,001).
В комментариях к Cardiology Капур отметил, что эти результаты подчеркивают важные проблемы безопасности у реальных пациентов, получающих краткосрочные MCS, такие как ECMO или Impella, но их следует интерпретировать с осторожностью, поскольку авторы не смогли полностью приспособиться к шоку. строгость. 7
«Мы наблюдаем более широкое использование ЭКМО и Импеллы при шоке, но сложность, конечно же, заключается в том, как решить, какой пациент получит какое устройство. Помните, что это устройства с довольно большим диаметром отверстия — ЭКМО варьируется по размеру артерии от 15 французских до «21 француз, и это большая дыра в твоей артерии. Импелла — 14 французов, но все же намного больше, чем баллонный насос, который составляет около 9 французов», — добавляет он.
По словам Тегерани, аналогичным образом отсутствуют рандомизированные контролируемые данные по TandemHeart и ограниченные данные по ЭКМО, хотя для последнего существует несколько текущих испытаний, оценивающих клиническую эффективность.
Множественное число анекдотов не является доказательством
Было высказано предположение, что максимальная медикаментозная терапия (объемная реанимация, вазодилататоры, инотропные средства) не считается оправданной конечной точкой рефрактерного циркуляторного шока, по крайней мере, в условиях хорошо обеспеченных ресурсами здравоохранения. 16
На просьбу прокомментировать альтернативы Impella, Капур отмечает, что даже в странах, которые не могут позволить себе устройство, сталкиваясь с пациентом с рефрактерным кардиогенным шоком, врачи часто используют баллонные насосы или ЭКМО.
«Это сложная ситуация, потому что разработка и использование этих устройств опережают доказательства», — говорит Капур.
«Возможно, они не хотят в этом признаваться, но многие люди не хотят рандомизировать пациентов, потому что они в основном считают, что если вы думаете, что пациенту перед вами будет больше пользы от импеллы, чем от баллонной помпы, это будет неправильно включать их в испытание. Но нам нужно, чтобы люди понимали, что нельзя просто рассказывать анекдот. Мы должны проводить эти рандомизированные испытания, иначе поле будет по-прежнему предметом горячих споров, и мы упустим возможность переехать циферблат вперед для пациентов.«
Смотрите на пациента, а не на устройство
Щелкните изображение выше, чтобы увеличить его.В связи с отсутствием четких доказательств, подтверждающих использование любого из доступных устройств MCS, делается шаг к рассмотрению стандартизированного ухода, ориентированного на пациента, вместо того, чтобы продвигать одно устройство над другим.
«Мы также пришли к пониманию того, что, когда мы становимся агностиками устройства и переходим к ориентации на пациента, когда мы стремимся лучше определить пациента и лучше определить алгоритм лечения конкретных подтипов пациентов, тогда мы можем переместить набрать уровень смертности », — говорит Капур в интервью.
Проблема как с ISAR-SHOCK, так и с IMPRESS заключалась в отсутствии протокола для поддержки времени запуска, так называемого времени от двери до поддержки или отлучения устройства от груди, добавляет он.
«Ввиду отсутствия рандомизированных контролируемых исследований для информирования руководства мы начинаем видеть, как разрабатываются протоколы для стандартизации отбора пациентов и оказания помощи», — говорит Тегеран.
Есть также надежда, что определение критериев отбора и уточнение клинических критериев, в конечном итоге, будет способствовать разработке хорошо обоснованных, информированных рандомизированных контролируемых испытаний.
Капур и его коллеги разработали алгоритм лечения AMICS, который подчеркивал быструю идентификацию и активацию катетерической лаборатории в AMICS, инвазивный гемодинамический мониторинг для оценки потребности в эскалации MCS и безопасного и быстрого отлучения от инотропов, а также раннее начало MCS.
Согласно результатам, опубликованным в прошлом году, использование протокола с контролем гемодинамики, теперь называемого Национальной инициативой по кардиогенному шоку (NCSI), было связано с впечатляющими 72% -ными показателями выживаемости до выписки, что намного выше, чем в исторических контрольных исследованиях.11 Большинство пациентов (92%) получали поддержку с помощью Impella CP.
Цели протоколабыли достигнуты у большинства пациентов, при этом 74% пациентов получали MCS перед ЧКВ, а среднее время оказания поддержки составило 85 минут. Инвазивный гемодинамический мониторинг проводился у 92% пациентов, и пациенты, пережившие имплантацию устройства, имели улучшение гемодинамики.
В отличие от сердечной недостаточности, где существует четкая схема классификации заболеваний, которая широко используется как в клинических, так и в исследовательских целях, у шока отсутствует четкий способ определения и сообщения о степени тяжести.
Чтобы восполнить этот пробел, Общество сердечно-сосудистой ангиографии и интервенции (SCAI) недавно предложило новую пятиступенчатую схему классификации CS, одобренную четырьмя другими организациями, включая ACC. 12
При ретроспективном анализе более 10 000 пациентов клиники Mayo CICU, госпитализированных с 2007 по 2015 год (с ретроспективной классификацией стадий шока с использованием данных госпитализации), нескорректированная больничная смертность выросла с 3,0% для стадии A до 67,0% для стадии E (p <0.001) (Рисунок 2). 13
Учитывая только стадии C, D и E SCAI, смертность увеличилась с 12,4% до 40,4% и 67,0% соответственно.
После многопараметрической корректировки каждая более высокая стадия шока SCAI была связана с повышенной госпитальной летальностью (скорректированное отношение шансов 1,53-6,80; все p <0,001) по сравнению со стадией шока A SCAI. Результаты были согласованы у пациентов с острым коронарным синдромом или сердечной недостаточностью.
«Исследование подчеркивает и подтверждает то, что мы видели в исследовании IABP-SHOCK II, а именно, что нецелесообразно группировать всех пациентов с кардиогенным шоком вместе при принятии решения о лечении и, конечно, при сообщении о смертности», — говорит Капур.
«Скорее, пациенты должны быть сгруппированы в соответствии с риском при обращении и основным заболеванием».
Работа в команде воплощает мечту в жизнь
Пациенты с кардиогенным шоком часто имеют динамическую патофизиологию и быстро меняющуюся клиническую картину гемодинамики. Попутно могут возникать и другие инсульты — аритмия, вазодилатация, ишемия и инфекция, которые резко изменяют траекторию болезни. Ранняя диагностика и направленная терапия имеют решающее значение, равно как и способность предвидеть возможные траектории пациента и управлять некардиальными осложнениями, связанными с шоком. 14
Командная помощь при кардиогенном шоке — это родственный подход к стандартизированной, независимой от устройств помощи, которая набирает обороты во всем мире.
Щелкните изображение выше, чтобы увеличить его.«Шоковые команды» могут включать специалистов в области интервенционной кардиологии, реанимации, сердечной недостаточности, анестезиологии, кардиоторакальной хирургии, перфузионных служб, медсестер и реабилитации.
«Результаты лечения болезненных процессов, таких как травмы, сепсис, инсульт и опухоли, улучшились благодаря внедрению командного подхода к лечению.В нашем учреждении мы применяем аналогичный междисциплинарный подход и добились значительных улучшений », — говорит Тегерани.
Судя по всему, коллективная забота улучшает исходы при кардиогенном шоке. В прошлом году группа Тегерани опубликовала обсервационное исследование, показывающее, что стандартизированный командный подход к управлению может существенно улучшить результаты (рис. 3). 15
В своем исследовании 204 пациента с КС (ОИМ, связанный с острой декомпенсированной сердечной недостаточностью) лечились многопрофильной шоковой бригадой с использованием стандартного протокола, в котором особое внимание уделялось раннему выявлению шока, обязательному инвазивному мониторингу гемодинамики, минимальному использованию вазопрессоров и инотропов и раннему MCS.Ударная группа смогла выбрать между несколькими модальностями MCS.
Тридцатидневная выживаемость улучшилась с 47% в 2016 году до 57,9% в 2017 году и 76,6% в 2018 году (p <0,01). Исследователи использовали логистический регрессионный анализ для разработки проверенной оценки риска с использованием семи факторов риска, которые оказались независимыми предикторами 30-дневной смертности. 15 Оценка показала хорошую дискриминацию с площадью под кривой 0,97.
На вопрос о пользе скоординированной помощи Тегерани перечислил несколько возможных сценариев.
«Предположим, вы интервенционный кардиолог с пациентом с ИМпST в лаборатории, и вы рассматриваете возможность использования устройства MCS. Вы можете обсудить варианты с кардиохирургом, который может установить несколько сообщений о целях лечения, отметив, что если определенная сумма поддержки не будет получено, будет использоваться ЭКМО или другое устройство более высокого уровня. В то же время специалист по сердечной недостаточности может захотеть начать рассмотрение этого пациента для включения в список трансплантата или LVAD, в то время как реаниматолог может заметить, что у пациента дисфункция почек или дыхательная недостаточность, с которыми они постараются как можно скорее справиться », — говорит Тегерани.
«Дело в том, чтобы иметь общую модель принятия решений, в которой учитываются все основы, и каждый четко понимает, каковы цели лечения для каждого отдельного пациента».
В этой области с нетерпением ждут результатов нескольких текущих испытаний, в частности, испытания DanGer Shock, в котором будут зачислены 360 пациентов AMICS из пяти датских центров и проведено тестирование устройства Impella CP на фоне лечебной терапии, предписанной руководящими принципами. В двух других продолжающихся исследованиях, EURO SHOCK и ECLS-SHOCK, будут рандомизированы 428 и 420 пациентов с AMICS, соответственно, для раннего вмешательства с терапией ЭКМО или стандартной медикаментозной терапии.
«До тех пор, пока мы не получим рандомизированные доказательства, подтверждающие использование устройств MCS для всех пациентов с шоковым состоянием, нам нужно будет продолжать уделять внимание уходу, основанному на групповом подходе и алгоритмах управления», — говорит Тегерани.
Автором этой статьи Дебра Л. Бек .
Список литературы
- Thiele H, Ohman EM, de Waha-Thiele S, Zeymer U, Desch S. Управление кардиогенным шоком, осложняющим инфаркт миокарда: обновление 2019. Eur Heart J 2019; 40: 2671-83.
- Доля рынка устройств для чрескожной механической поддержки кровообращения к 2027 году превысит 3 964,75 миллиона долларов США. MarketWatch. Доступ здесь 30 июня 2020 г.
- Хаджар Л.А., Тебул Ж.Л. Устройства механической поддержки кровообращения при кардиогенном шоке: современное состояние. Crit Care 2019; 23 (1): 76.
- Mandawat A, Rao SV. Устройства чрескожной механической поддержки кровообращения при кардиогенном шоке. Circ Cardiovasc Interv 2017; 10 (5): e004337.
- Thiele H, Zeymer U, Neumann F-J, et al. Внутриаортальная баллонная опора при инфаркте миокарда с кардиогенным шоком. N Engl J Med 2012; 367: 1287-96.
- Тиле Х., Зеймер У., Телеманн Н. и др. Внутриаортальный баллонный насос при кардиогенном шоке, осложняющем острый инфаркт миокарда. Обращение 2019; 139: 395-403.
- Уайтхед Э., Тайер К., Капур Н.К. Клинические испытания острой механической поддержки кровообращения при кардиогенном шоке и чрескожном коронарном вмешательстве высокого риска. Curr Opin Cardiol . 2020; 35 (4): 332-40.
- Ouweneel DM, Eriksen E, Sjauw KD, et al. Чрескожная механическая поддержка кровообращения в сравнении с внутриаортальным баллонным насосом при кардиогенном шоке после острого инфаркта миокарда. J Am Coll Cardiol 2017; 69: 278-287.
- Amin AP, Spertus JA, Curtis JP, et al. Развивающаяся картина использования импелл в США среди пациентов, перенесших чрескожное коронарное вмешательство с механической поддержкой кровообращения. Обращение 2020; 141: 273-84.
- Дхрува С.С., Росс Дж. С., Мортазави Б. Дж. И др. Связь использования внутрисосудистого микроаксиального вспомогательного устройства для левого желудочка и внутриаортального баллонного насоса с внутрибольничной летальностью и большим кровотечением у пациентов с острым инфарктом миокарда, осложненным кардиогенным шоком. JAMA 2020: фев. 10: [Epub перед печатью].
- Басир М.Б., Капур Н.К., Патель К. и др. Улучшение результатов, связанных с использованием протоколов шока: новости национальной инициативы по кардиогенному шоку. Катетер Cardiovasc Interv 2019; 93: 1173-83.
- Баран Д.А., Гринес К.Л., Бейли С. и др. Консенсусное заявление клинических экспертов SCAI по классификации кардиогенного шока: этот документ был одобрен Американским колледжем кардиологов (ACC), Американской кардиологической ассоциацией (AHA), Обществом интенсивной терапии (SCCM) и Обществом торакальных хирургов. (STS) в апреле 2019 г. Катетер Cardiovasc Interv 2019; 94: 29-37.
- Jentzer JC, van Diepen S, Barsness GW и др.Классификация кардиогенного шока для прогнозирования смертности в отделении интенсивной терапии сердца. J Am Coll Cardiol 2019; 74: 2117-28.
- Валлабхаджосюла С., Барснесс Г.В., Валлабхаджосюла С. Междисциплинарные бригады по кардиогенному шоку. Старение 2019; 11: 4774-76.
- Тегерани Б.Н., Трусделл АГ, Шервуд М.В. и др. Стандартизированная бригадная помощь при кардиогенном шоке. J Am Coll Cardiol 2019; 73: 1659-69.
- Шекар К., Грегори С.Д., Фрейзер Дж. Ф.Механическая поддержка кровообращения в новую эру: обзор. Crit Care 2016; 20.
Клинические темы: кардиохирургия, сердечная недостаточность и кардиомиопатии, инвазивная сердечно-сосудистая ангиография и вмешательство, кардиохирургия и сердечная недостаточность, острая сердечная недостаточность, трансплантация сердца
Ключевые слова: Публикации ACC, Cardiology Magazine, Шок, кардиогенный, Выбор пациентов, Медицинская бесполезность, Экстракорпоральная мембранная оксигенация, Национальные регистры кардиологов, Регистры сердца Отказ, Трансплантация сердца, Продольные исследования
<Вернуться к спискам
Лечение кардиогенного шока | Европейский журнал сердца
Аннотация
Кардиогенный шок (КШ) остается наиболее частой причиной смерти пациентов с острым инфарктом миокарда, хотя смертность может быть снижена с ∼80% до 40–50%.Помимо чрескожного коронарного вмешательства или аортокоронарного шунтирования, для лечения CS широко используются катехоламины, жидкости, внутриаортальная баллонная накачка (IABP), а также активные вспомогательные устройства. Однако существует лишь ограниченное количество доказательств для любого из вышеперечисленных методов лечения, за исключением ранней реваскуляризации и относительной неэффективности ВАБК. Таким образом, в этом обновленном обзоре будет описано лечение КС, осложняющего острый инфаркт миокарда, с уделением особого внимания методам реваскуляризации, основанным на фактических данных, лечению в отделениях интенсивной терапии, включая вентиляцию, режимы переливания крови, дополнительные лекарства и устройства механической поддержки.
Введение
Кардиогенный шок (КШ) определяется как состояние критической гипоперфузии эндоргана из-за снижения сердечного выброса. Примечательно, что CS формирует спектр от легкой гипоперфузии до глубокого шока. Установленные критерии диагностики КС: (i) систолическое артериальное давление <90 мм рт. Ст. В течение> 30 минут или вазопрессоры, необходимые для достижения артериального давления ≥90 мм рт. (ii) застой в легких или повышенное давление наполнения левого желудочка; (iii) признаки нарушения перфузии органов по крайней мере по одному из следующих критериев: (a) измененное психическое состояние; (б) холодная липкая кожа; (в) олигурия; (г) повышенный уровень лактата в сыворотке.Диагноз КС обычно может быть поставлен на основе простых для оценки клинических критериев без расширенного гемодинамического мониторинга, хотя ранее это рекомендовалось для оценки сердечного индекса и давления заклинивания легочных капилляров. 1
Острый инфаркт миокарда (ОИМ) с последующей желудочковой дисфункцией является наиболее частой причиной КС, составляющей около 80% случаев. Механические осложнения, такие как разрыв межжелудочковой перегородки (4%) или разрыв свободной стенки (2%), а также острая тяжелая митральная регургитация (7%), являются менее частыми причинами КС после ОИМ. 2 ХС, не связанный с ОИМ, может быть вызван декомпенсированным пороком клапанов сердца, острым миокардитом, аритмиями и т. Д. С гетерогенными вариантами лечения.
Кардиогенный шок, осложняющий ОИМ, встречается в пределах от 5 до 15%. 3–5 Это означает от ~ 40 000 до 50 000 пациентов в год в США и от ~ 60 000 до 70 000 в Европе. 6 Несмотря на успехи в лечении, в основном за счет ранней реваскуляризации с последующим снижением смертности, CS остается ведущей причиной смерти при ОИМ с коэффициентами смертности, приближающимися к 40–50% согласно недавним регистрам и рандомизированным исследованиям. 3–5,7
Основные причины, патофизиология и лечение КС, осложняющего ОИМ, были рассмотрены ранее. 1,6 В этом обновлении описывается научно обоснованное терапевтическое лечение КС, осложняющего ОИМ, с особым упором на методы реваскуляризации, лечение в отделениях интенсивной терапии, включая вентиляцию, схемы переливания крови, дополнительные лекарства и устройства механической поддержки.
Патофизиология и оценка прогноза
Патофизиология CS сложна и была резюмирована ранее. 1,6 Вкратце, ишемия вызывает глубокое угнетение сократительной способности миокарда, которое запускает порочную спираль снижения сердечного индекса и низкого кровяного давления, которые в сочетании ухудшают индекс мощности сердца и дополнительно способствуют коронарной ишемии. Снижение сердечного индекса вызывает тяжелую гипоперфузию ткани, которая наиболее точно измеряется лактатом сыворотки крови и может в конечном итоге привести к смерти, если круг не будет успешно прерван адекватными лечебными мерами. Было признано, что CS не может быть объяснен только потерей функции левого желудочка, но скорее является результатом нарушений во всей системе кровообращения.Первоначальному компенсаторному сужению сосудов впоследствии противодействует патологическое расширение сосудов. Среди прочего, развитие системного воспаления с утечкой капилляров, нарушение микроциркуляции и вазодилатация вносят свой вклад в порочный круг CS. Кровотечение и переливание дополнительно способствуют воспалительным нарушениям в шоковой спирали.
Путем многопараметрического моделирования на основе основных испытаний CS (SHOCK, TRIUMPH, IABP-SHOCK II) типичными факторами, связанными с более высокой смертностью, были пожилой возраст, аноксическое повреждение мозга, более низкая фракция выброса левого желудочка, более низкий индекс сердечной силы, более низкий систолический уровень крови. давление, потребность в вазопрессорной поддержке, ухудшение функции почек и более высокий уровень лактата в сыворотке. 8–10 Несколько других биомаркеров в дополнение к лактату сыворотки, в основном измеряющие степень воспаления, показали связь со смертностью. 11 На нарушение микроциркуляции и сосудистой утечки влияет дисбаланс между ангиопоэтином-1 и ангиопоэтином-2, который, как было показано, влияет на смертность. 12 При CS нарушение микроциркуляции можно легко измерить сублингвально с помощью визуализации темного поля в боковом направлении. Уменьшение плотности перфузируемых капилляров на исходном уровне и отсутствие улучшений, полученных в результате серийных измерений, были связаны с мрачным прогнозом. 13 Однако клиническая ценность этих новых биомаркеров и методов визуализации еще не определена окончательно.
Менеджмент
Реваскуляризация
Ранняя реваскуляризация, как показано в разделе «Должны ли мы экстренно реваскуляризовать окклюзированные коронарные сосуды при кардиогенном шоке» (ШОК), является наиболее важной стратегией лечения КС, осложняющего ОИМ. 14 Хотя исследование не смогло достичь основной конечной точки (превосходство ранней реваскуляризации над медикаментозной терапией в отношении 30-дневной смертности), наблюдалось значительное снижение смертности при более длительном периоде наблюдения 1/2, 1 и 6 лет. 14,15 Число, необходимое для спасения одной жизни путем ранней реваскуляризации по сравнению с начальной медицинской стабилизацией, составляет <8.
В текущих рекомендациях ранняя реваскуляризация путем чрескожного коронарного вмешательства (ЧКВ) или коронарного шунтирования (АКШ) является рекомендацией класса 1B. 16,17 Несмотря на то, что применение ранней реваскуляризации в клинической практике заметно увеличилось, показатели по регистрам все еще неудовлетворительны и составляют от 50 до 70%. 3–5 Следовательно, необходимы дополнительные усилия, чтобы убедить клиницистов признать пользу реваскуляризации, даже если предполагается, что связанный с этим риск будет высоким, например, у пожилых людей или после реанимации.
Реваскуляризация при многососудистой ишемической болезни сердца
Примерно 70–80% пациентов с КС имеют многососудистую болезнь, определяемую как коронарные стенозы / окклюзии более чем в одном сосуде. 7,14,18 Эти пациенты имеют более высокую смертность по сравнению с пациентами с поражением одного сосуда. 19 Текущие руководства рекомендуют раннюю реваскуляризацию посредством ЧКВ или АКШ в зависимости от анатомии коронарных артерий и возможности проведения ЧКВ. 16 Теоретически тип реваскуляризации может повлиять на результат. Однако существует большая неопределенность, поскольку во всех предыдущих исследованиях, оценивающих влияние реваскуляризации на исход, не указывался тип реперфузии. В настоящее время существует только четыре отчета о наблюдениях, оценивающих ЧКВ по сравнению с АКШ, и ограниченные данные предполагают аналогичные показатели смертности при АКШ и ЧКВ. 20 Несмотря на эти соображения, АКШ редко выполняется при КШ с частотой <5% в регистрах и рандомизированных исследованиях. 5,7
Таким образом, ЧКВ основного поражения является общепринятой стандартной практикой, в то время как оптимальное лечение дополнительных поражений, не являющихся виновником, неясно. Текущие рекомендации поощряют многососудистое ЧКВ всех критических стенозов или крайне нестабильных поражений в дополнение к первопричинному поражению (рекомендация класса IIa B) при CS. 16 Несмотря на эти рекомендации, многососудистое ЧКВ в настоящее время выполняется только от одной трети до одной четверти пациентов с КС с многососудистым поражением. 7,21
Из-за отсутствия проспективных данных эти рекомендации в основном основаны на патофизиологических соображениях. Примечательно, что, как показано в , Таблица 1 , все регистры, кроме одного, сравнивающего многососудистое ЧКВ и только ЧКВ, являющееся виновником поражения, показали численное или значительное повышение смертности при многососудистом подходе. 18,21–26 Поскольку нерандомизированные обсервационные исследования и регистры склонны к систематической ошибке при выборе лечения, существует острая потребность в рандомизированных данных.В настоящее время в проспективное рандомизированное многоцентровое исследование CULPRIT-SHOCK (Clinicaltrials.gov: NCT019) набирают пациентов в Европе, чтобы заполнить очевидный пробел в доказательствах. С первичной конечной точкой, определяемой как смертность и / или почечная недостаточность, требующая заместительной почечной терапии в течение 30 дней, 706 пациентов будут рандомизированы для немедленного многососудистого ЧКВ по сравнению с ЧКВ только с повреждением с потенциально последующим этапным ЧКВ.
Таблица 1Смертность для многососудистой системы vs.только виновник поражения ЧКВ при кардиогенном шоке в регистрах
| Испытание . | N . | Летальность многососудистого ЧКВ,% . | Летальность только от поражения ЧКВ,% . | Скорректированное отношение шансов или отношение рисков (95% ДИ) . |
|---|---|---|---|---|
| Webb et al . 18 | 74 | 55 | 20 | 2.75 (1.05–7.25) |
| Van der Schaaf et al . 22 | 161 | 60 | 53 | Не сообщается ( P = 0,05) |
| Cavender et al . 23 | 3087 | 36,5 | 27,8 | 1,5 (1,22–1,95) |
| Bauer et al . 21 | 336 | 48,8 | 37,4 | 1.28 (0,72–2,28) |
| Zeymer et al . 25 | 735 | 46,8 | 35,8 | 1,5 (1,15–1,84) |
| Ян и др. . 26 | 338 | 35,0 | 30,6 | 1,06 (0,61–1,86) |
| Mylotte et al . 24 | 266 | 20,4 | 43,9 | 0,57 (0,38–0,84) |
| Пробная . | N . | Летальность многососудистого ЧКВ,% . | Летальность только от поражения ЧКВ,% . | Скорректированное отношение шансов или отношение рисков (95% ДИ) . |
|---|---|---|---|---|
| Webb et al . 18 | 74 | 55 | 20 | 2,75 (1,05–7,25) |
| Van der Schaaf et al . 22 | 161 | 60 | 53 | Не сообщается ( P = 0.05) |
| Cavender et al . 23 | 3087 | 36,5 | 27,8 | 1,5 (1,22–1,95) |
| Bauer et al . 21 | 336 | 48,8 | 37,4 | 1,28 (0,72–2,28) |
| Zeymer et al . 25 | 735 | 46,8 | 35,8 | 1,5 (1,15–1,84) |
| Ян и др. . 26 | 338 | 35,0 | 30,6 | 1,06 (0,61–1,86) |
| Mylotte et al . 24 | 266 | 20,4 | 43,9 | 0,57 (0,38–0,84) |
Смертность от многососудистого поражения по сравнению только с возбудителем ЧКВ в регистрах кардиогенного шока
| N . | Летальность многососудистого ЧКВ,% . | Летальность только от поражения ЧКВ,% . | Скорректированное отношение шансов или отношение рисков (95% ДИ) . | |
|---|---|---|---|---|
| Webb et al . 18 | 74 | 55 | 20 | 2,75 (1,05–7,25) |
| Van der Schaaf et al . 22 | 161 | 60 | 53 | Не сообщается ( P = 0.05) |
| Cavender et al . 23 | 3087 | 36,5 | 27,8 | 1,5 (1,22–1,95) |
| Bauer et al . 21 | 336 | 48,8 | 37,4 | 1,28 (0,72–2,28) |
| Zeymer et al . 25 | 735 | 46,8 | 35,8 | 1,5 (1,15–1,84) |
| Ян и др. . 26 | 338 | 35,0 | 30,6 | 1,06 (0,61–1,86) |
| Mylotte et al . 24 | 266 | 20,4 | 43,9 | 0,57 (0,38–0,84) |
| Пробная . | N . | Летальность многососудистого ЧКВ,% . | Летальность только от поражения ЧКВ,% . | Скорректированное отношение шансов или отношение рисков (95% ДИ) . |
|---|---|---|---|---|
| Webb et al . 18 | 74 | 55 | 20 | 2,75 (1,05–7,25) |
| Van der Schaaf et al . 22 | 161 | 60 | 53 | Не сообщается ( P = 0,05) |
| Cavender et al . 23 | 3087 | 36.5 | 27,8 | 1,5 (1,22–1,95) |
| Bauer et al . 21 | 336 | 48,8 | 37,4 | 1,28 (0,72–2,28) |
| Zeymer et al . 25 | 735 | 46,8 | 35,8 | 1,5 (1,15–1,84) |
| Ян и др. . 26 | 338 | 35,0 | 30,6 | 1.06 (0,61–1,86) |
| Mylotte et al . 24 | 266 | 20,4 | 43,9 | 0,57 (0,38–0,84) |
Периоперационные антитромбоцитарные и антитромботические препараты
Антитромботическая терапия, включая антитромбоциты и антикоагулянты, является краеугольным камнем во время ЧКВ, и после публикации исследования SHOCK появились новые антитромбоцитарные методы лечения. 16,17 Специфических испытаний пероральных антитромбоцитов при КС не проводилось, однако хорошо известно, что при КС энтеральная резорбция нарушена.Помимо нарушения энтеральной перфузии, механическая вентиляция с невозможностью проглотить прасугрел / тикагрелор или клопидогрель играет важную роль в биодоступности этих препаратов. В общем, введение пероральных ингибиторов P2Y12 можно отложить, так как АКШ может потребоваться немедленно на основании ангиографических данных. Прасугрел / тикагрелор или клопидогрель в случае противопоказаний для применения новых пероральных антиагрегантов показан в дополнение к аспирину всем пациентам, подвергающимся ЧКВ. 16,17 Интубированным пациентам измельченные таблетки необходимо вводить через назогастральный зонд.Недавно у пациентов с инфарктом миокарда без КС было показано, что измельченный тикагрелор может улучшить ингибирование тромбоцитов по сравнению с не измельченными таблетками. 27
Хорошо известно, что восстановление нормального эпикардиального кровотока с помощью ЧКВ при КС происходит ниже по сравнению с пациентами, не получавшими КС, и невозможность достижения нормального кровотока влияет на смертность. 28 Из-за позднего и нарушенного начала пероральных антитромбоцитов ингибиторы гликопротеина IIb / IIIa могут быть полезными при CS. Данные наблюдений подтверждают потенциальную выгоду в отношении смертности при использовании внутривенных ингибиторов тромбоцитов при CS. 29 Однако в условиях CS существует только одно небольшое рандомизированное исследование с участием 80 пациентов (с перекрестным переходом в 35% в группе стандартного лечения), в котором не удалось подтвердить, что рутинное применение абциксимаба выше по сравнению со стандартным лечением с помощью возможность использования абциксимаба оставлена на усмотрение интервенционистов (, рис. 1, ). 30 Текущие соображения и опыт предполагают обильное использование ингибиторов гликопротеина IIb / IIIa у пациентов с высокой тромбовидной нагрузкой и медленным течением после ЧКВ, особенно для пациента CS.
Рисунок 1
Текущие данные рандомизированных клинических исследований CS в эпоху ЧКВ. Относительный риск и 95% доверительный интервал (ДИ) изображены для различных рандомизированных вмешательств. Исследование SOAP II было нейтральным в отношении смертности для всего исследования, поэтому заранее определенные результаты подгруппы кардиогенного шока следует интерпретировать с осторожностью. ШОК, ДОЛЖНЫ ли мы экстренно реваскуляризовать окклюзированные коронарные сосуды при кардиогенном шоке; SMASH, Швейцарское многоцентровое исследование ангиопластики при шоке; SOAP II, Возникновение сепсиса у пациентов с острыми заболеваниями II; TRIUMPH, Инъекция тиларгинина ацетата в рандомизированном международном исследовании у пациентов с нестабильным ИМ и кардиогенным шоком; IABP-SHOCK, Интрааортальный баллонный насос в шоке; IABP, внутриаортальный баллонный насос; LVAD, вспомогательное устройство левого желудочка; ЧКВ, чрескожное коронарное вмешательство; АКШ, аортокоронарное шунтирование; КС, кардиогенный шок.
Рисунок 1
Текущие данные рандомизированных клинических испытаний CS в эпоху ЧКВ. Относительный риск и 95% доверительный интервал (ДИ) изображены для различных рандомизированных вмешательств. Исследование SOAP II было нейтральным в отношении смертности для всего исследования, поэтому заранее определенные результаты подгруппы кардиогенного шока следует интерпретировать с осторожностью. ШОК, ДОЛЖНЫ ли мы экстренно реваскуляризовать окклюзированные коронарные сосуды при кардиогенном шоке; SMASH, Швейцарское многоцентровое исследование ангиопластики при шоке; SOAP II, Возникновение сепсиса у пациентов с острыми заболеваниями II; TRIUMPH, Инъекция тиларгинина ацетата в рандомизированном международном исследовании у пациентов с нестабильным ИМ и кардиогенным шоком; IABP-SHOCK, Интрааортальный баллонный насос в шоке; IABP, внутриаортальный баллонный насос; LVAD, вспомогательное устройство левого желудочка; ЧКВ, чрескожное коронарное вмешательство; АКШ, аортокоронарное шунтирование; КС, кардиогенный шок.
Во время ЧКВ дополнительные антикоагулянты, включая нефракционированный гепарин, низкомолекулярный гепарин или прямые ингибиторы тромбина, должны вводиться одновременно с антитромбоцитами. 16,17 В связи с отсутствием конкретных рандомизированных исследований по CS, применяются те же рекомендации, что и для других типов острого коронарного синдрома.
Реанимационное отделение
Жидкости, вазопрессоры, инотропы
Независимо от ранней реваскуляризации, основные лечебные меры включают начальную стабилизацию с увеличением объема для достижения эуволемии, вазопрессоры и инотропы, а также дополнительную терапию для профилактики или лечения дисфункции полиорганной системы (СПОН).Введение жидкости при CS в основном основано на патофизиологических соображениях.
Несмотря на частое использование катехоламинов, которые вводят примерно 90% пациентов с CS, 7 имеются лишь ограниченные данные рандомизированных исследований, сравнивающих катехоламины с CS. Кроме того, несмотря на положительное влияние на гемодинамику, нет рандомизированных данных, показывающих прогностическую пользу. В рандомизированном сравнении 1679 пациентов с шоком, включая 280 пациентов с CS, лечение дофамином по сравнению с норадреналином было связано со значительно большим количеством аритмических событий для всей когорты исследования, но с отсутствием значительного снижения смертности.Предварительно определенная подгруппа КС — процентная доля КС вследствие ОИМ не сообщается — имела более низкую смертность при применении норадреналина (, рис. 1, ). 31 Следовательно, при низком артериальном давлении норэпинефрин должен быть первым выбором в качестве вазопрессора. По аналогии с септическим шоком, целевое среднее артериальное давление следует титровать до 65–70 мм рт. Ст., Поскольку более высокое артериальное давление не связано с благоприятным исходом. 32 Текущие европейские рекомендации по ИМпST отчасти сбивают с толку и рекомендуют, в отличие от существующих доказательств, допамин (рекомендация IIa / C) перед норадреналином (рекомендация IIb / B), тогда как, с другой стороны, утверждается, что норэпинефрин предпочтительнее допамина, когда артериальное давление низкое. 17
Поскольку катехоламины увеличивают потребление кислорода миокардом, а вазоконстрикторы могут нарушать микроциркуляцию, а также перфузию тканей, их использование следует ограничить максимально короткой продолжительностью и минимально возможной дозой.
В качестве инотропного агента добутамин можно назначать одновременно с норадреналином в попытке улучшить сократительную способность сердца, что часто используется в клинической практике. 7 Другие инотропы, такие как левосимендан или ингибиторы фосфодиэстеразы, представляют интерес для CS, поскольку они улучшают сократимость миокарда без увеличения потребности в кислороде и возможности расширения сосудов.Однако, как показано в недавнем Кокрановском обзоре, текущие данные об инотропах и вазодилататорах при CS очень ограничены. 33 Только четыре очень небольших исследования соответствовали критериям отбора для этого метаанализа, а три исследования с 63 участниками с высоким общим риском систематической ошибки сравнивали левосимендан со стандартным лечением (эноксимон или добутамин) или плацебо. Левосимендан показал пограничное улучшение выживаемости по сравнению с эноксимоном (отношение рисков 0,33; 95% доверительный интервал 0,11–0,97; , рисунок 1, ).Наблюдались лишь небольшие различия в гемодинамике, продолжительности пребывания в стационаре и частоте серьезных сердечных побочных эффектов. 33
Оптимальное лечение СПОН в отделении интенсивной терапии имеет важное значение для лечения пациентов с КС, поскольку оно оказывает большое влияние на прогноз. Хотя это специально не исследовалось в CS, обычно рекомендуется несколько мер. 34 Если требуется инвазивная вентиляция, следует выполнить вентиляцию с защитой легких, чтобы предотвратить повреждение легких.В случае острой почечной недостаточности с клиническими признаками уремии, гидропической декомпенсации, метаболического ацидоза и / или рефрактерной гиперкалиемии необходимо измерить продукцию мочи и начать непрерывную заместительную почечную терапию. Кроме того, необходимо обеспечить оптимальное питание, гликемический контроль до уровня <11,0 ммоль / л, избегая гипогликемии, а также профилактику тромбоэмболии и стрессовых язв. 34 Поскольку во многом управление гемодинамикой зависит от оптимального давления наполнения, во всех сложных курсах следует использовать катетеры в легочную артерию, импульсный контур сердечного выброса (PiCCO ® ) или другие системы. 34 Однако с этими системами мониторинга не проводилось специального рандомизированного исследования CS.
Умеренное / тяжелое кровотечение часто встречается у пациентов с КС в диапазоне от 20 до 90% в зависимости от используемого определения, а также на него влияет одновременное использование механических поддерживающих устройств. 7,14,35,36 Раньше считалось, что повышение уровня гемоглобина при переливании крови увеличивает доставку кислорода и, таким образом, приносит пользу. Однако переливание крови при остром коронарном синдроме само по себе увеличивает смертность. 37 Изменения биологии оксида азота в эритроцитах в хранящейся крови могут частично объяснить, что приводит к начальной вазоконстрикции, агрегации тромбоцитов и неэффективной доставке кислорода. Кроме того, само кровотечение, а также переливание крови способствуют воспалению. 37 Недавние исследования у пациентов с кровотечением, не принимающих КС, могли четко продемонстрировать, что ограничительный режим переливания крови может улучшить исход, а общепринятые стратегии интенсивной терапии заключаются в том, чтобы избежать коррекции лабораторных аномалий, если нет клинической проблемы с кровотечением. 38,39
Гипотермия
Лечебная гипотермия предназначена для внебольничных пациентов с остановкой сердца с ритмом, требующим применения электрошока, для предотвращения травм головного мозга и повышения выживаемости. 40 Хотя в соответствующих рандомизированных исследованиях гипотермии пациенты с CS были исключены, гипотермия также обычно применяется к пациентам с CS после реанимации. В исследовании IABP-SHOCK II более 40% пациентов были реанимированы перед рандомизацией с последующей индуцированной гипотермией, что показало актуальность этого состояния при CS. 7 Испытания на животных и первые нерандомизированные испытания на людях показали улучшение гемодинамики и снижение использования катехоламинов при гипотермии при КС. 41 Применение гипотермии у нереанимированных пациентов с CS также может быть полезным с патофизиологических соображений с множеством полезных целей. 41 В настоящее время рандомизированное испытание с участием не реанимированных пациентов с КС изучает влияние гипотермии по сравнению со стандартным лечением на индекс мощности сердца (клинические испытания.gov: NCT018
Механическая опора
Чтобы преодолеть ограничения инотропов и вазопрессоров с ограниченными эффектами для поддержания адекватного перфузионного давления, предотвращения или отмены MODS механическая поддержка кровообращения для улучшения гемодинамики и результатов стала привлекательной. Активные чрескожные вспомогательные устройства для левого желудочка (LVAD) используются у пациентов, не отвечающих на стандартное лечение, включая катехоламины, жидкости, внутриаортальную баллонную накачку (IABP), а также могут играть роль в качестве лечения первой линии.Несмотря на растущее количество различных чрескожных устройств для механической поддержки при CS, данные, полученные в результате рандомизированных клинических испытаний по эффективности и безопасности, дифференциальным показаниям для различных устройств и оптимальному времени, ограничены. Несмотря на это отсутствие доказательств, все чаще выполняется чрескожная механическая поддержка с помощью активных устройств. 42
Доказательства механической поддержки кровообращения при CS-шоке были рассмотрены ранее. 6,43,44 Таким образом, здесь рассматриваются только основные достижения и новые соображения.
Внутриаортальная баллонная накачка
Внутриаортальная баллонная накачка — наиболее широко используемое устройство для механической поддержки при стабильной скорости имплантации с 2007 по 2011 год, составляющей ~ 50 000 в год, согласно национальному исследованию в США. 42 Внутриаортальная баллонная накачка улучшает диастолическое и снижает энсистолическое давление, не влияя на среднее кровяное давление. По сравнению с контролем IABP не улучшает соответствующие гемодинамические параметры, такие как сердечный индекс или индекс сердечной мощности. 45 До 2012 и 2013 годов американские и европейские руководящие принципы поддерживали использование IABP при CS с рекомендацией класса I. На основании систематического метаанализа эти рекомендации были понижены до уровня IIb B в рекомендациях ESC 2012 г. и до IIa B в американских рекомендациях 2013 г. 17,46 Из-за отсутствия рандомизированных исследований в этот метаанализ были включены только регистры с противоречивыми результатами, и в эпоху ЧКВ наблюдалась более высокая смертность после ВАБК. 47 В крупнейшем рандомизированном многоцентровом исследовании CS (IABP-SHOCK II) 600 пациентов с CS, осложняющим ОИМ, которым проводилась ранняя реваскуляризация, были рандомизированы для лечения IABP или традиционного лечения.По первичной конечной точке 30-дневной смертности (39,7 против 41,3%; P = 0,69) между двумя группами лечения не наблюдалось существенной разницы. 7 Также не было различий ни по одной из вторичных конечных точек, таких как лактат сыворотки, функция почек, дозы катехоламинов или продолжительность лечения в отделении интенсивной терапии. Кроме того, не удалось выделить подгруппы с потенциальным преимуществом поддержки IABP. 7 12-месячный контрольный анализ подтвердил эти отрицательные результаты со смертностью 52% в IABP vs.51% в контрольной группе ( P = 0,91). 10
Поскольку поддержка IABP существует уже почти пять десятилетий, отрицательные результаты IABP-SHOCK II вызвали некоторые дискуссии. Расчет размера выборки был основан на предположении о более высокой смертности в контрольной группе. Однако смертность была ниже ожидаемой и незначительно ниже по сравнению с другими предыдущими испытаниями CS, несмотря на аналогичные исходные характеристики. 14,48 Кроме того, как и во всех отрицательных испытаниях, нельзя однозначно исключить ошибку типа II.Определенная процентная ставка кроссовера также могла повлиять на результаты. Однако отсутствие пользы для какой-либо из исследованных вторичных конечных точек исследования, нейтральные результаты во всех анализах подгрупп, отсутствие пользы при 12-месячном наблюдении и в анализе состояния лечения свидетельствуют против любого клинически значимого эффекта IABP. 10 Кроме того, критиковалось, что время вставки IABP было оставлено на усмотрение оператора, что привело к вставке IABP перед PCI только в 13,4%. 7 Однако данные о времени вставки IABP, полученные из небольших реестров в CS, ограничены и противоречат большему количеству данных, даже показывающих вред, чем пользу от вставки IABP перед PCI. 49,50 Кроме того, рандомизированное испытание введения IABP перед ЧКВ у пациентов с высоким риском переднего инфаркта без КС не привело к влиянию на размер инфаркта. 51
Следовательно, результаты IABP-SHOCK II повлияли на последние рекомендации ESC по реваскуляризации с дальнейшим понижением рейтинга IABP с новой рекомендацией класса IIIA для рутинного использования при CS. 16 В настоящее время существует только показание для использования IABP при механических осложнениях с рекомендацией IIaC. 16
Чрескожные вспомогательные устройства для левого желудочка
Доступные в настоящее время устройства включают TandemHeart ™ (Cardiac Assist, Inc, Питтсбург, США) и микроаксиальные системы Impella ® 2.5, 5.0 и CP (Abiomed Europe, Ахен, Германия). Кроме того, появился новый паракорпоральный пульсирующий аппарат iVAC 2L ® (PulseCath BV, Нидерланды). Он вводится чрескожно через бедренную артерию и может обеспечивать пульсирующую поддержку ~ 2 л / мин с использованием экстракорпорального мембранного насоса через канюлю 17 F.Когда сердце находится в систолической фазе, кровь отсасывается из левого желудочка через просвет катетера в мембранный насос. Во время диастолической фазы насос выбрасывает кровь обратно через катетер, впоследствии открывая клапан катетера и доставляя кровь в восходящую аорту через боковой отток, тем самым создавая «дополнительное сердцебиение». Устройство непосредственно разгружает желудочек за счет активной аспирации и одновременно создает встречный пульсирующий поток в восходящей аорте.
Принцип действия различных устройств был описан ранее. 6,43,44 Рисунок 2 показывает различные устройства, а Таблица 2 предоставляет обновленный обзор технических характеристик и свойств разгрузки левого желудочка. Что касается доказательств, то с момента публикации в 2009 году метаанализа, в котором представлены результаты только трех рандомизированных испытаний, сравнивающих чрескожный LVAD (два испытания TandemHeart ™; одно Impella ® 2.5) и IABP, дополнительных рандомизированных испытаний не проводилось. выполнила. 35 Пациенты, получавшие активные LVAD, продемонстрировали более высокий сердечный индекс, более высокое среднее артериальное давление и более низкое давление заклинивания легочных капилляров. С другой стороны, кровотечения и воспаления были более частыми при терапии LVAD без разницы в 30-дневной смертности ( Рисунок 1 ). 35 Недавние наблюдательные исследования с использованием устройства Impella ® показали некоторые преимущества этого устройства при CS. При перекрестной оценке среди пациентов с рефрактерным CS, пациентов, которые были переведены на Impella 5.0 из 2,5 имели тенденцию к лучшей выживаемости при выписке. 52 В реестре USpella пациенты, непосредственно получавшие Impella перед ЧКВ при КС, имели в целом лучшую выживаемость при выписке из больницы по сравнению с пациентами, получавшими лечение после ЧКВ, даже с поправкой на возможные искажающие переменные. 53 Для системы iVAC пробные версии отсутствуют.
Таблица 2Технические характеристики имеющихся в настоящее время устройств чрескожной поддержки
| . | iVAC 2L ® . | TandemHeart ™ . | Импелла ® 5,0 . | Импелла ® 2,5 . | Импелла ® CP . | ECLS (несколько систем) . | |
|---|---|---|---|---|---|---|---|
| Размер катетера (F) | 11 (расширяемый) | — | 9 | 9 | 9 | ||
| Размер канюли (F) | 170008 | 210008 — 19 артериальный | 21 | 12 | 17–21 венозный 16–19 артериальный | ||
| Поток (л / мин) | Макс 2.8 | Макс. 4,0 | Макс. 5,0 | Макс. 2,5 | 3,7–4,0 | Макс. 7.0 | |
| Скорость насоса (об / мин) | Пульсирующая, 40 мл / удар | Макс. 7500 | Макс. 33000 | Макс. 51000 | Макс. 51000 | Макс. 5000 | |
| Установка / установка | Чрескожная (бедренная артерия) | Чрескожная (бедренная артерия + вена для левого предсердия) | Периферическая хирургия (бедренная артерия) | Чрескожная (бедренная артерия) | Чрезкожная артерия (бедренная артерия) | Чрескожный (бедренная артерия + вена) | |
| Разгрузка ЛЖ | + | ++ | ++ | + | + | — | |
| Антикоагулянт | + | + | + | + | + | ||
| Рекомендуемая продолжительность использования | −21 день | −14 дней | 10 дней | 10 дней | 10 дней | −7 дней | |
| + | + | + | + | + | + | ||
| FDA 901 96 | — | + | + | + | + | + | |
| Относительные затраты | ++ | +++++ | ++++ | +++ | ++ ++ | + (+) |
| . | iVAC 2L ® . | TandemHeart ™ . | Импелла ® 5,0 . | Импелла ® 2,5 . | Импелла ® CP . | ECLS (несколько систем) . | |
|---|---|---|---|---|---|---|---|
| Размер катетера (F) | 11 (расширяемый) | — | 9 | 9 | 9 | ||
| Размер канюли (F) | 170008 | 210008 — 19 артериальный | 21 | 12 | 17–21 венозный 16–19 артериальный | ||
| Поток (л / мин) | Макс 2.8 | Макс. 4,0 | Макс. 5,0 | Макс. 2,5 | 3,7–4,0 | Макс. 7.0 | |
| Скорость насоса (об / мин) | Пульсирующая, 40 мл / удар | Макс. 7500 | Макс. 33000 | Макс. 51000 | Макс. 51000 | Макс. 5000 | |
| Установка / установка | Чрескожная (бедренная артерия) | Чрескожная (бедренная артерия + вена для левого предсердия) | Периферическая хирургия (бедренная артерия) | Чрескожная (бедренная артерия) | Чрезкожная артерия (бедренная артерия) | Чрескожный (бедренная артерия + вена) | |
| Разгрузка ЛЖ | + | ++ | ++ | + | + | — | |
| Антикоагулянт | + | + | + | + | + | ||
| Рекомендуемая продолжительность использования | −21 день | −14 дней | 10 дней | 10 дней | 10 дней | −7 дней | |
| + | + | + | + | + | + | ||
| FDA 901 96 | — | + | + | + | + | + | |
| Относительные затраты | ++ | +++++ | ++++ | +++ | ++ ++ | + (+) |
Технические характеристики имеющихся в настоящее время чрескожных поддерживающих устройств
| . | iVAC 2L ® . | TandemHeart ™ . | Импелла ® 5,0 . | Импелла ® 2,5 . | Импелла ® CP . | ECLS (несколько систем) . | |
|---|---|---|---|---|---|---|---|
| Размер катетера (F) | 11 (расширяемый) | — | 9 | 9 | 9 | ||
| Размер канюли (F) | 170008 | 210008 — 19 артериальный | 21 | 12 | 17–21 венозный 16–19 артериальный | ||
| Поток (л / мин) | Макс 2.8 | Макс. 4,0 | Макс. 5,0 | Макс. 2,5 | 3,7–4,0 | Макс. 7.0 | |
| Скорость насоса (об / мин) | Пульсирующая, 40 мл / удар | Макс. 7500 | Макс. 33000 | Макс. 51000 | Макс. 51000 | Макс. 5000 | |
| Установка / установка | Чрескожная (бедренная артерия) | Чрескожная (бедренная артерия + вена для левого предсердия) | Периферическая хирургия (бедренная артерия) | Чрескожная (бедренная артерия) | Чрезкожная артерия (бедренная артерия) | Чрескожный (бедренная артерия + вена) | |
| Разгрузка ЛЖ | + | ++ | ++ | + | + | — | |
| Антикоагулянт | + | + | + | + | + | ||
| Рекомендуемая продолжительность использования | −21 день | −14 дней | 10 дней | 10 дней | 10 дней | −7 дней | |
| + | + | + | + | + | + | ||
| FDA 901 96 | — | + | + | + | + | + | |
| Относительные затраты | ++ | +++++ | ++++ | +++ | ++ ++ | + (+) |
| . | iVAC 2L ® . | TandemHeart ™ . | Импелла ® 5,0 . | Импелла ® 2,5 . | Импелла ® CP . | ECLS (несколько систем) . | |
|---|---|---|---|---|---|---|---|
| Размер катетера (F) | 11 (расширяемый) | — | 9 | 9 | 9 | ||
| Размер канюли (F) | 170008 | 210008 — 19 артериальный | 21 | 12 | 17–21 венозный 16–19 артериальный | ||
| Поток (л / мин) | Макс 2.8 | Макс. 4,0 | Макс. 5,0 | Макс. 2,5 | 3,7–4,0 | Макс. 7.0 | |
| Скорость насоса (об / мин) | Пульсирующая, 40 мл / удар | Макс. 7500 | Макс. 33000 | Макс. 51000 | Макс. 51000 | Макс. 5000 | |
| Установка / установка | Чрескожная (бедренная артерия) | Чрескожная (бедренная артерия + вена для левого предсердия) | Периферическая хирургия (бедренная артерия) | Чрескожная (бедренная артерия) | Чрезкожная артерия (бедренная артерия) | Чрескожный (бедренная артерия + вена) | |
| Разгрузка ЛЖ | + | ++ | ++ | + | + | — | |
| Антикоагулянт | + | + | + | + | + | ||
| Рекомендуемая продолжительность использования | −21 день | −14 дней | 10 дней | 10 дней | 10 дней | −7 дней | |
| + | + | + | + | + | + | ||
| FDA 901 96 | — | + | + | + | + | + | |
| Относительные затраты | ++ | +++++ | ++++ | +++ | ++ ++ | + (+) |
Рисунок 2
Схематические чертежи существующих чрескожных механических поддерживающих устройств для CS: внутриаортальный баллонный насос ( A ), Impella ® ( B ), TandemHeart ™, ( C ) экстракорпоральное жизнеобеспечение, ( D ) iVAC 2L ® .
Рисунок 2
Схематические чертежи существующих чрескожных механических поддерживающих устройств для CS: внутриаортальный баллонный насос ( A ), Impella ® ( B ), TandemHeart ™, ( C ) экстракорпоральное жизнеобеспечение, ( D ) iVAC 2L ® .
Системы экстракорпорального жизнеобеспечения
Неотъемлемыми элементами систем экстракорпорального жизнеобеспечения (ECLS) или ранее называемых экстракорпоральных мембранных оксигенаторов являются насос для крови, теплообменник и оксигенатор. 54 Основными недостатками этих устройств являются большие размеры канюли, потенциально вызывающие ишемию нижних конечностей и кровотечения, частые потребности в перфузиологах, отсутствие прямой разгрузки левого желудочка, повышение постнагрузки и ограниченное время поддержки. Кроме того, серьезные осложнения включают ишемию нижних конечностей (16,9%), компартмент-синдром (10,3%), ампутацию (4,7%), инсульт (5,9%), сильное кровотечение (40,8%) и значительную инфекцию (30,4%), как показано на недавний метаанализ 1866 пациентов с CS. 36 Частота осложнений может быть снижена за счет большего опыта чрескожной имплантации и обязательного введения антеградной перфузионной канюли. Преимуществами являются низкая стоимость по сравнению с другими чрескожными LVAD и высокий поток (, таблица 2, ). Имеется ограниченный опыт применения CS для чрескожного применения для веноартериальных ECLS с одним одноцентровым нерандомизированным ретроспективным анализом, показывающим улучшенные показатели выживаемости с ECLS по сравнению с историческим контролем. 55 В более позднем проспективном отчете госпитальная летальность пациентов с ECLS составила 63.2%. Группа пожилых пациентов старше 62 лет и пациентов с сердечно-легочной реанимацией даже характеризовалась 100% -ной смертностью, что ставило под сомнение неселективное использование ECLS. 56
Открытые вопросы механической поддержки
В терапии механическими устройствами остается множество открытых проблем, таких как оптимальное время введения устройства. Потенциальным преимуществом раннего использования при появлении CS может быть предотвращение MODS. Однако раннее использование может привести к осложнениям, связанным с инвазивными механическими поддерживающими устройствами, что приведет к неблагоприятному клиническому исходу у пациентов, у которых еще остались неинвазивные терапевтические возможности.Более того, правильный выбор пациентов важен и в настоящее время часто основан на субъективных критериях. Приблизительно 60% пациентов с CS выживут без какого-либо активного устройства, как показано в IABP-SHOCK II. 7 Возможны также бесполезные ситуации, когда даже самое лучшее из имеющихся устройств не сможет изменить клинический результат. Выбор времени и соответствующий выбор пациента также зависит от баланса между эффективностью любого устройства и связанными с ним осложнениями. Устройства с низким уровнем сложности могут быть выбраны более свободно на ранней стадии CS, тогда как более агрессивные устройства с более высокой скоростью потока могут быть зарезервированы для более серьезных CS.Оптимальная опора также не определена. Соотношение этих соображений показано на рис. 3 .
Рисунок 3
Соображения по использованию механической опоры для профилактики и лечения дисфункции полиорганной системы.
Рисунок 3
Соображения по использованию механической опоры для профилактики и лечения дисфункции полиорганной системы.
Продолжающееся датское рандомизированное многоцентровое исследование (DanShock; Clinicaltrials.gov: NCT01633502) сравнивает Impella ® CP со стандартным лечением и может дополнительно ответить, может ли активное устройство, имплантируемое на регулярной основе, снизить смертность. Несколько других устройств в настоящее время исследуются на предмет получения одобрения CE в Европе, например HeartMate PHP ™ (чрескожный сердечный насос; Thoratec, Плезантон, Калифорния, США).
Несмотря на все эти неопределенности, текущие европейские и американские руководства рекомендуют рассмотреть возможность использования чрескожного вспомогательного устройства для поддержки кровообращения при рефрактерном КС без какого-либо предпочтения при выборе устройства (рекомендация IIa / C). 16,17,46
Обобщая текущие данные и рекомендации ESC по ведению CS, 16,17 алгоритм лечения, отражающий клиническую практику, показан на рис. 4 . Дальнейшие подробности лечения механических осложнений выходят за рамки этого обзора и были суммированы ранее. 57
Рисунок 4
Алгоритм лечения пациентов с кардиогенным шоком, осложняющим острый инфаркт миокарда.Класс рекомендации и уровень доказательности в соответствии с рекомендациями ESC указывается, если таковые имеются. 16,17 IABP, внутриаортальный баллонный насос.
Рисунок 4
Алгоритм лечения пациентов с кардиогенным шоком, осложняющим острый инфаркт миокарда. Класс рекомендации и уровень доказательности в соответствии с рекомендациями ESC указывается, если таковые имеются. 16,17 IABP, внутриаортальный баллонный насос.
Перспективы на будущее
Рандомизированные клинические испытания КС трудновыполнимы, и только несколько рандомизированных клинических испытаний, направленных на выявление различий в клинических исходах, позволили достичь требуемого числа пациентов (, рис. 5, ). 7,14 Исследование SHOCK стало важной вехой, и последующее широкое применение ранней реваскуляризации привело к значительному снижению смертности в клинической практике. Неудача IABP в исследовании IABP-SHOCK II не следует рассматривать как конец самой аппаратной терапии, это может быть даже в большей степени основополагающим испытанием для получения адекватных доказательств в области аппаратной терапии. Сегодня сердечно-сосудистые исследования изучают практически любой открытый вопрос, и это также должно более строго применяться к CS.Следовательно, будущие исследования, оценивающие любое лекарство, вмешательство, стратегию или вспомогательное устройство, необходимо оценивать в соответствии с их клинической эффективностью. Исследователи сердечно-сосудистой системы, как правило, не должны препятствовать проведению этих важных рандомизированных исследований, поскольку лечение применялось в течение нескольких десятилетий. В нескольких руководящих документах содержатся рекомендации относительно включения в рандомизированные исследования пациентов, которые сами не могут дать информированное согласие. Существует множество открытых вопросов относительно лечения CS, что отражено в большом количестве рекомендаций с уровнем доказательности C в текущих руководствах. 16,17,46 Это должно быть мотивацией для будущих исследований в области CS.
Рисунок 5
Число пациентов, включенных в основные рандомизированные исследования кардиогенного шока.
Рисунок 5
Число пациентов, включенных в основные рандомизированные исследования кардиогенного шока.
Конфликт интересов: не объявлен.
Список литературы
1.
Кардиогенный шок. Текущие концепции и улучшение результатов
.Тираж
2008
;117
:686
—697
,2.
Кардиогенный шок, осложняющий острый инфаркт миокарда — этиология, лечение и исход: отчет из регистра исследований SHOCK
.J Am Coll Cardiol
2000
;36
:1063
—1070
,3.
Улучшение исхода кардиогенного шока на острой стадии инфаркта миокарда: отчет USIK 1995, USIC 2000 и FAST-MI French Nationwide Registries
.Eur Heart J
2012
;33
:2535
—2543
,4.
Тридцатилетние тенденции (1975–2005 гг.) В масштабах, лечении и показателях госпитальной смертности, связанных с кардиогенным шоком у пациентов с острым инфарктом миокарда: популяционная перспектива
.Тираж
2009
;119
:1211
—1219
,5.
Десятилетняя заболеваемость и лечение кардиогенного шока
.Ann Intern Med
2008
;149
:618
—626
,6.
Шок при остром инфаркте миокарда: мыс Горн для испытаний?
Eur Heart J
2010
;31
:1828
—1835
,7.
Интрааортальная баллонная опора при инфаркте миокарда с кардиогенным шоком
.N Engl J Med
2012
;367
:1287
—1296
.8.
Предикторы 30-дневной смертности пациентов с рефрактерным кардиогенным шоком после острого инфаркта миокарда, несмотря на наличие открытой инфарктной артерии
.Am Heart J
2009
;158
:680
—687
,9.
Система оценки степени тяжести для оценки риска пациентов с кардиогенным шоком: отчет SHOCK Trial and Registry
.Am Heart J
2010
;160
:443
—450
.10.
Внутриаортальная баллонная контрпульсация при остром инфаркте миокарда, осложненном кардиогенным шоком. Окончательные 12-месячные результаты рандомизированной внутриаортальной баллонной помпы при кардиогенном шоке II (IABP-SHOCK II), испытание
.Ланцет
2013
;382
:1638
—1645
.11.
Интерлейкин-6, -7, -8 и -10 прогнозируют исход острого инфаркта миокарда, осложненного кардиогенным шоком
.Clin Res Cardiol
2012
;101
:375
—384
.12.
Циркулирующие ангиопоэтины и смертность от сердечно-сосудистых заболеваний при кардиогенном шоке
.Eur Heart J
2013
;34
:1651
—1662
,13.
Нарушение микроциркуляции прогнозирует неблагоприятный исход у больных с острым инфарктом миокарда, осложненным кардиогенным шоком
.Eur Heart J
2010
;31
:3032
—3039
.14.
Ранняя реваскуляризация при остром инфаркте миокарда, осложненном кардиогенным шоком. ШОК Следователи. Должны ли мы экстренно реваскуляризовать окклюзированные коронарные сосуды при кардиогенном шоке
.N Engl J Med
1999
;341
:625
—634
.15.
Ранняя реваскуляризация и долгосрочное выживание при кардиогенном шоке, осложненном острым инфарктом миокарда
.JAMA
2006
;295
:2511
—2515
.16,
Авторы / рабочая группа m
.2014 ESC / EACTS Рекомендации по реваскуляризации миокарда: Целевая группа по реваскуляризации миокарда Европейского общества кардиологов (ESC) и Европейской ассоциации кардио-торакальной хирургии (EACTS) Разработано при особом участии Европейской ассоциации чрескожных сердечно-сосудистых вмешательств (EAPCI)
.Eur Heart J
2014
;35
:2541
—2619
.17.
Рекомендации ESC по ведению острого инфаркта миокарда у пациентов с подъемом сегмента ST
.Eur Heart J
2012
;33
:2569
—2619
,18.
Чрескожное коронарное вмешательство при кардиогенном шоке в исследовании SHOCK
.J Am Coll Cardiol
2003
;42
:1380
—1386
,19.
Корреляты годичной выживаемости у пациентов с кардиогенным шоком, осложняющим острый инфаркт миокарда: ангиографические данные исследования SHOCK
.J Am Coll Cardiol
2003
;42
:1373
—1379
.20.
Чрескожное коронарное вмешательство или аортокоронарное шунтирование при кардиогенном шоке и многососудистой ишемической болезни сердца?
Am Heart J
2010
;159
:141
—147
.21.
Использование и результаты многососудистого чрескожного коронарного вмешательства у пациентов с острым инфарктом миокарда, осложненным кардиогенным шоком (из реестра EHS-PCI)
.Am J Cardiol
2012
;109
:941
—946
,22.
Влияние многососудистой коронарной болезни с одновременной хронической тотальной окклюзией или без нее на годовую смертность пациентов, получавших первичное чрескожное коронарное вмешательство по поводу кардиогенного шока
.Am J Cardiol
2010
;105
:955
—959
,23.
Распространенность, предикторы и исходы госпитального вмешательства на артерии без инфаркта во время первичного чрескожного коронарного вмешательства по поводу инфаркта миокарда с подъемом сегмента ST (из Национального реестра сердечно-сосудистых данных)
.Am J Cardiol
2009
;104
:507
—513
,24.
Первичное чрескожное коронарное вмешательство у пациентов с острым инфарктом миокарда, реанимационной остановкой сердца и кардиогенным шоком.Роль первичной многососудистой реваскуляризации
.JACC: Cardiovasc Intv
2013
;6
:115
—125
,25.
Немедленное многососудистое чрескожное коронарное вмешательство в сравнении с вмешательством при повреждении у пациентов с острым инфарктом миокарда, осложненным кардиогенным шоком: результаты реестра ALKK-PCI
.EuroIntervention
2014
; .26.
Чрескожное коронарное вмешательство при кардиогенном шоке, осложненном острым инфарктом миокарда с подъемом сегмента ST
.Crit Care Med
2014
;47
:17
—25
,27.
Применение измельченных таблеток тикагрелора у пациентов с ИМпST: исследование тикагрелора в виде пюре или просто интегральных таблеток (MOJITO)
.Eur Heart J
2014
;35
(Приложение к тезисам)
:1030
,28.
Предикторы внутрибольничной летальности у 1333 пациентов с острым инфарктом миокарда, осложненным кардиогенным шоком, получавших первичное чрескожное коронарное вмешательство (ЧКВ)
.Eur Heart J
2004
;25
:322
—328
,29.
Терапия абциксимабом улучшает выживаемость у пациентов с острым инфарктом миокарда, осложненным ранним кардиогенным шоком, которым имплантировали стент коронарной артерии
.Am J Cardiol
2002
;90
:353
—357
.30.
Рутинное предварительное лечение абциксимабом по сравнению со стандартной перипроцедурной терапией у пациентов, перенесших первичное чрескожное коронарное вмешательство по поводу кардиогенного шока: исследование PRAGUE-7.Открытое рандомизированное многоцентровое исследование
.Acute Card Care
2011
;13
:116
—122
.31.
Сравнение дофамина и норэпинефрина при лечении шока
.N Engl J Med
2010
;362
:779
—789
.32.
Целевое значение высокого и низкого артериального давления у пациентов с септическим шоком
.N Engl J Med
2014
;370
:1583
—1593
.33.
Инотропные агенты и сосудорасширяющие средства при остром инфаркте миокарда, осложненном кардиогенным шоком или синдромом низкого сердечного выброса
.Кокрановская база данных Syst Rev
2014
,34.
Кардиогенный шок, вызванный инфарктом миокарда: диагностика, мониторинг и лечение — Немецко-австрийское руководство S3
.Dtsch Arztebl Int
2012
;109
:343
—351
,35.
Чрескожные вспомогательные устройства для левого желудочка в сравнении с контрпульсацией внутриаортального баллонного насоса для лечения кардиогенного шока: метаанализ контролируемых исследований
.Eur Heart J
2009
;30
:2102
—2108
,36.
Осложнения экстракорпоральной мембранной оксигенации для лечения кардиогенного шока и остановки сердца: метаанализ 1866 взрослых пациентов
.Ann Thorac Surg
2014
;97
:610
—616
.37.
Взаимосвязь переливания крови и клинических исходов у пациентов с острым коронарным синдромом
.JAMA
2004
;292
:1555
—1562
0,38.
Кровотечения и коагулопатии в отделениях интенсивной терапии
.N Engl J Med
2014
;370
:847
—859
.39.
Стратегии переливания крови при остром кровотечении из верхних отделов желудочно-кишечного тракта
.N Engl J Med
2013
;368
:11
—21
,40.
Часть 1: Краткое содержание: Международный консенсус 2010 г. по науке о сердечно-легочной реанимации и неотложной сердечно-сосудистой помощи с рекомендациями по лечению
.Тираж
2010
;122
:S250
—S275
.41.
Кардиогенный шок после инфаркта миокарда — системное заболевание, требующее системного лечения. Возможна ли терапевтическая гипотермия?
J Am Coll Cardiol
2012
;59
:644
—647
.42.
Национальные тенденции в использовании краткосрочной механической поддержки кровообращения: заболеваемость, исходы и анализ затрат
.Карточка J Am Coll
2014
;64
:1407
—1415
.43.
Чрескожные вспомогательные устройства для левого желудочка при кардиогенном шоке
.Eur Heart J
2007
;28
:2057
—2063
.44.
Механическая поддержка кровообращения при кардиогенном шоке
.Eur Heart J
2014
;35
:156
—167
.45.
Гемодинамические эффекты внутриаортальной баллонной контрпульсации у пациентов с острым инфарктом миокарда, осложненным кардиогенным шоком: проспективное рандомизированное исследование шока IABP
.Ударная
2012
;37
:378
—384
, 46.
2013 Руководство ACCF / AHA по лечению инфаркта миокарда с подъемом сегмента ST: отчет Фонда Американского колледжа кардиологов / Целевой группы Американской кардиологической ассоциации по практическим рекомендациям
.Тираж
2013
;127
:e362
—e425
.47.
Систематический обзор и метаанализ внутриаортальной баллонной помповой терапии при инфаркте миокарда с подъемом сегмента ST: следует ли изменить рекомендации?
Eur Heart J
2009
;30
:459
—468
.48Исследователи TRIUMPH
.Эффект тиларгинина ацетата у пациентов с острым инфарктом миокарда и кардиогенным шоком.Рандомизированное контролируемое исследование TRIUMPH
.JAMA
2007
;297
:1657
—1666
.49.
Сравнение госпитальной летальности при введении внутриаортальной баллонной контрпульсации до и после первичного чрескожного коронарного вмешательства по поводу кардиогенного шока, осложнившего острый инфаркт миокарда
.Am J Cardiol
2010
;105
:967
—971
,50.
Воздействие поддержки внутриаортального баллонного насоса, инициированного до и после первичного чрескожного коронарного вмешательства у пациентов с кардиогенным шоком в результате острого инфаркта миокарда
.Int J Cardiol
2013
;168
:3758
—3763
.51.
Внутриаортальная баллонная контрпульсация и размер инфаркта у пациентов с острым передним инфарктом миокарда без шока: рандомизированное исследование CRISP AMI
.JAMA
2011
;306
:1329
—1337
.52.
Аппараты Impella 2.5 и 5.0 для пациентов с инфарктом миокарда с подъемом сегмента ST и тяжелым и глубоким кардиогенным шоком: опыт отделения интенсивной терапии Академического медицинского центра
.Crit Care Med
2011
;39
:2072
—2079
.53.
Текущее использование Impella 2.5 при остром инфаркте миокарда, осложненном кардиогенным шоком: результаты из реестра USpella
.J Интервал Кардиол
2014
;27
:1
—11
.54.
Экстракорпоральная мембранная оксигенация при сердечно-легочных заболеваниях у взрослых
.Карточка J Am Coll
2014
;63
:2769
—2778
.55.
Раннее первичное чрескожное коронарное вмешательство с применением экстракорпорального мембранного оксигенатора улучшило 30-дневные клинические исходы у пациентов с инфарктом миокарда с подъемом сегмента ST, осложненным глубоким кардиогенным шоком
.Crit Care Med
2010
;38
:1810
—1817
.56.
Неотложная поддержка кровообращения у пациентов с рефрактерным кардиогенным шоком в удаленных учреждениях: пилотное исследование (программа Cardiac-RESCUE)
.Eur Heart J
2013
;34
:112
—120
.57.
Кардиогенный шок
. В: (eds),Чрескожная интервенционная сердечно-сосудистая медицина. Учебник PCR-EAPCI
.Париж
:Организация Европы
;2012
. С.1
—36
.Издается от имени Европейского общества кардиологов. Все права защищены. © Автор, 2015. Для получения разрешения обращайтесь по электронной почте: [email protected].
Рекомендации по кардиогенному шоку: Краткое изложение рекомендаций
[Рекомендации] ван Дипен С., Кац Дж. Н., Альберт Н. М. и др., Для Совета Американской кардиологической ассоциации по клинической кардиологии; Совет по сердечно-сосудистым заболеваниям и инсульту; Совет по качеству медицинской помощи и исследованиям результатов; и Миссия: Мост жизни.Современное лечение кардиогенного шока: научное заявление Американской кардиологической ассоциации. Тираж . 2017, 17 октября. 136 (16): e232-68. [Медлайн]. [Полный текст].
Алонсо Д. Р., Шейдт С., Пост М., Киллип Т. Патофизиология кардиогенного шока. Количественная оценка некроза миокарда, клинических, патологических и электрокардиографических корреляций. Тираж . 1973 Сентябрь 48 (3): 588-96. [Медлайн].
Reynolds HR, Hochman JS.Кардиогенный шок: современные концепции и улучшение результатов. Тираж . 2008 5 февраля. 117 (5): 686-97. [Медлайн].
Фунаро С., Ла Торре Дж, Мадонна М. и др., Для исследователей AMICI. Частота, детерминанты и прогностическая ценность обратного ремоделирования левого желудочка после первичного чрескожного коронарного вмешательства: результаты многоцентрового исследования контрастной визуализации острого инфаркта миокарда (AMICI). Eur Heart J . 2009 30 марта (5): 566-75.[Медлайн].
Forrester JS, Wyatt HL, Da Luz PL, Tyberg JV, Diamond GA, Swan HJ. Функциональное значение аномалий регионарного ишемического сокращения. Тираж . 1976 июл.54 (1): 64-70. [Медлайн].
Бейерсдорф Ф., Бакберг Г.Д., Акар С. и др. Кардиогенный шок после острой коронарной окклюзии. Патогенез, ранняя диагностика и лечение. Торакальная кардиоваскулярная хирургия . 1989 Февраль 37 (1): 28-36. [Медлайн].
Аль-Риси А., Аль-Заджали Н., Перри Дж. И др.Снижают ли бета-адреноблокаторы краткосрочную смертность после острого инфаркта миокарда? Систематический обзор и метаанализ. CJEM . 2008 май. 10 (3): 215-23. [Медлайн].
Чен З.М., Пан Х.С., Чен Ю.П. и др. Раннее внутривенное, а затем пероральное введение метопролола 45 852 пациентам с острым инфарктом миокарда: рандомизированное плацебо-контролируемое исследование. Ланцет . 2005 г., 5 ноября. 366 (9497): 1622-32. [Медлайн].
Kolte D, Khera S, Aronow WS и др.Тенденции в отношении заболеваемости, лечения и исходов кардиогенного шока, осложняющего инфаркт миокарда с подъемом сегмента ST в США. Дж. Эм Харт Асс . 2014 13 января 3 (1): e000590. [Медлайн].
Гольдберг Р. Дж., Самад Н. А., Ярзебски Дж., Гурвиц Дж., Бигелоу К., Гор Дж. М.. Временные тенденции кардиогенного шока, осложняющего инфаркт миокарда. N Engl J Med . 1999, 15 апреля. 340 (15): 1162-8. [Медлайн].
[Рекомендации] Roffi M, Patrono C, Collet JP, et al.Рекомендации ESC 2015 по ведению острых коронарных синдромов у пациентов без стойкого подъема сегмента ST: Целевая группа по лечению острых коронарных синдромов у пациентов без стойкого подъема сегмента ST Европейского общества кардиологов (ESC). Eur Heart J . 2016 14 января. 37 (3): 267-315. [Медлайн]. [Полный текст].
Graf T, Desch S, Eitel I, Thiele H. Острый инфаркт миокарда и кардиогенный шок: пути фармакологической и механической гемодинамической поддержки. Диск коронарной артерии . 2015 26 сентября (6): 535-44. [Медлайн].
Rab T, O’Neill W. Механическая поддержка кровообращения у пациентов с кардиогенным шоком. Trends Cardiovasc Med . 2018 5 декабря. [Medline].
Бабаев А, Фредерик П.Д., Pasta DJ, Every N, Сичровский Т, Хохман Ж.С. Тенденции ведения и исходы пациентов с острым инфарктом миокарда, осложненным кардиогенным шоком. ЯМА . 2005 27 июля.294 (4): 448-54. [Медлайн].
Fox KA, Steg PG, Eagle KA, Goodman SG, Anderson FA Jr, Granger CB и др. Снижение смертности и сердечной недостаточности при острых коронарных синдромах, 1999-2006 гг. ЯМА . 2007, 2 мая. 297 (17): 1892-900. [Медлайн].
Jeger RV, Radovanovic D, Hunziker PR, Pfisterer ME, Stauffer JC, Erne P, et al. Десятилетние тенденции в заболеваемости и лечении кардиогенного шока. Энн Интерн Мед. . 2008 4 ноя.149 (9): 618-26. [Медлайн].
[Рекомендации] Амстердам Э.А., Венгер Н.К., Бриндис Р.Г. и др. Для ACC, Целевой группы AHA по практическим рекомендациям и др. Руководство AHA / ACC от 2014 г. по ведению пациентов с острыми коронарными синдромами без подъема сегмента ST: отчет Целевой группы Американского колледжа кардиологов / Американской кардиологической ассоциации по практическим рекомендациям. Дж. Ам Кол Кардиол . 2014 Dec 23. 64 (24): e139-228. [Медлайн]. [Полный текст].
Кунадиан В., Цю В., Лудман П. и др. Для Национального института исследований сердечно-сосудистых заболеваний.Результаты у пациентов с кардиогенным шоком после чрескожного коронарного вмешательства в современную эпоху: анализ из базы данных BCIS (Британское общество сердечно-сосудистых вмешательств). JACC Cardiovasc Interv . 2014 г. 7 (12): 1374-85. [Медлайн].
Hamon M, Agostini D, Le Page O, Riddell JW, Hamon M. Прогностическое влияние поражения правого желудочка у пациентов с острым инфарктом миокарда: метаанализ. Crit Care Med .2008 июл.36 (7): 2023-33. [Медлайн].
Garan AR, Eckhardt C, Takeda K и др. Предикторы выживаемости и возможности отлучения от устройства краткосрочной механической поддержки кровообращения после острого инфаркта миокарда, осложненного кардиогенным шоком. Eur Heart J Acute Cardiovasc Care . 2018 7 (8): 755-65. [Медлайн].
Hasdai D, Califf RM, Thompson TD, Hochman JS, Ohman EM, Pfisterer M, et al. Предикторы кардиогенного шока после тромболитической терапии острого инфаркта миокарда. Дж. Ам Кол Кардиол . 2000, январь, 35 (1): 136-43. [Медлайн].
Пикард М.Х., Давидофф Р., Спящий Л.А. и следователи ШОК. Должны ли мы экстренно реваскуляризовать окклюзированные коронарные артерии при кардиогенном шоке. Эхокардиографические предикторы выживаемости и реакции на раннюю реваскуляризацию при кардиогенном шоке. Тираж . 2003 21 января. 107 (2): 279-84. [Медлайн].
Jeger RV, Lowe AM, Buller CE, Pfisterer ME, Dzavik V, Webb JG, et al.Гемодинамические параметры имеют прогностическое значение при кардиогенном шоке, но схожи после ранней реваскуляризации или начальной медицинской стабилизации: отчет SHOCK Trial. Сундук . 2007 декабрь 132 (6): 1794-803. [Медлайн].
Балига р. Управление кардиогенным шоком: научное заявление AHA. Доступно по адресу https://www.acc.org/latest-in-cardiology/ten-points-to-remember/2017/10/06/11/36/con Contemporary-management-of-cardiogenic-shock. 6 октября 2017 г .; Дата обращения: 5 августа 2019 г.
[Рекомендации] О’Гара П.Т., Кушнер Ф.Г., Ашейм Д.Д. и др. Для Фонда Американского колледжа кардиологов / Целевой группы Американской кардиологической ассоциации по практическим рекомендациям. Руководство ACCF / AHA по лечению инфаркта миокарда с подъемом сегмента ST, 2013: отчет Фонда Американского колледжа кардиологов / Целевой группы Американской кардиологической ассоциации по практическим рекомендациям. Тираж . 2013 29 января. 127 (4): e362-425. [Медлайн]. [Полный текст].
Hochman JS, Sleeper LA, White HD, Dzavik V, Wong SC, Menon V и др.Годовая выживаемость после ранней реваскуляризации по поводу кардиогенного шока. ЯМА . 2001, 10 января. 285 (2): 190-2. [Медлайн].
Shin TG, Choi JH, Jo IJ, Sim MS, Song HG, Jeong YK и др. Экстракорпоральная сердечно-легочная реанимация у пациентов с остановкой сердца в стационаре: сравнение с традиционной сердечно-легочной реанимацией. Crit Care Med . 2011 января 39 (1): 1-7. [Медлайн].
Чой М.С., Сунг К., Чо Й.Клинические жемчужины оксигенации веноартериальной экстракорпоральной мембраны при кардиогенном шоке. Корейский Circ J . 2019 августа 49 (8): 657-77. [Медлайн].
McGugan PL. Роль оксигенации веноартериальной экстракорпоральной мембраны в посткардиотомическом кардиогенном шоке. Crit Care Nurs Clin North Am . 2019 Сентябрь 31 (3): 419-36. [Медлайн].
Де Бакер Д., Бистон П., Девриендт Дж. И др. Для исследователей SOAP II. Сравнение дофамина и норэпинефрина при лечении шока. N Engl J Med . 2010 г., 4 марта. 362 (9): 779-89. [Медлайн].
Эллендер Т.Дж., Скиннер Дж.С. Применение вазопрессоров и инотропов в неотложной медицинской помощи при шоке. Emerg Med Clin North Am . 2008 26 августа (3): 759-86, ix. [Медлайн].
Naples RM, Harris JW, Ghaemmaghami CA. Аспекты критической помощи при ведении пациентов с острыми коронарными синдромами. Emerg Med Clin North Am . 2008 26 августа (3): 685-702, viii.[Медлайн].
Felker GM, Benza RL, Chandler AB и др., Для исследователей OPTIME-CHF. Этиология сердечной недостаточности и ответ на милринон при декомпенсированной сердечной недостаточности: результаты исследования OPTIME-CHF. Дж. Ам Кол Кардиол . 19 марта 2003 г. 41 (6): 997-1003. [Медлайн].
Gheorghiade M, Gattis WA, Klein L. OPTIME в испытании CHF: переосмысление использования инотропов в лечении обострения хронической сердечной недостаточности, приводящей к госпитализации. Eur J Heart Fail . 2003 5 (1): 9-12. [Медлайн].
Fuhrmann JT, Schmeisser A, Schulze MR, Wunderlich C, Schoen SP, Rauwolf T. и др. Левосимендан превосходит эноксимон при рефрактерном кардиогенном шоке, осложняющем острый инфаркт миокарда. Crit Care Med . 2008 г., 36 (8): 2257-66. [Медлайн].
De Luca L, Colucci WS, Nieminen MS, Massie BM, Gheorghiade M. Доказательное использование левосимендана в различных клинических условиях. Eur Heart J . 2006 27 (16) августа: 1908-20. [Медлайн].
Gruppo Italiano per lo Studio della Streptochinasi nell’Infarto Miocardico (GISSI). Эффективность внутривенного тромболитического лечения острого инфаркта миокарда. Ланцет . 1986 22 февраля. 1 (8478): 397-402. [Медлайн].
Gruppo Italiano per lo Studio della Streptochi-nasi nell’Infarto Miocardico (GISSI). Долгосрочные эффекты внутривенного тромболизиса при остром инфаркте миокарда: окончательный отчет исследования GISSI. Ланцет . 1987, 17 октября. 2 (8564): 871-4. [Медлайн].
Sanborn TA, Sleeper LA, Bates ER, et al. Влияние тромболизиса, контрпульсации внутриаортального баллонного насоса и их комбинации при кардиогенном шоке, осложняющем острый инфаркт миокарда: отчет SHOCK Trial Registry. Должны ли мы экстренно реваскуляризовать окклюзированные коронарные артерии при кардиогенном шоке? Дж. Ам Кол Кардиол . 2000 Сентябрь 36 (3 Дополнение A): 1123-9. [Медлайн].
Garatti A, Russo C, Lanfranconi M, Colombo T, Bruschi G, Trunfio S и др.Механическая поддержка кровообращения при кардиогенном шоке, осложняющем острый инфаркт миокарда: экспериментальный и клинический обзор. ASAIO J . 2007 май-июнь. 53 (3): 278-87. [Медлайн].
Cheng JM, den Uil CA, Hoeks SE, van der Ent M, Jewbali LS, van Domburg RT, et al. Чрескожные вспомогательные устройства для левого желудочка в сравнении с контрпульсацией внутриаортального баллонного насоса для лечения кардиогенного шока: метаанализ контролируемых исследований. Eur Heart J .2009 30 сентября (17): 2102-8. [Медлайн].
Sjauw KD, Engstrom AE, Vis MM, et al. Систематический обзор и мета-анализ внутриаортальной баллонной помповой терапии при инфаркте миокарда с подъемом сегмента ST: следует ли менять рекомендации ?. Eur Heart J . 2009 30 февраля (4): 459-68. [Медлайн].
Ramanathan K, Farkouh ME, Cosmi JE, French JK, Harkness SM, Džavík V, et al. Быстрое полное устранение системной гипоперфузии после контрпульсации внутриаортального баллонного насоса и выживаемость при кардиогенном шоке, осложнившем острый инфаркт миокарда. Сердце Дж. . 2011 Август 162 (2): 268-75. [Медлайн]. [Полный текст].
Thiele H, Zeymer U, Neumann FJ, et al. Внутриаортальная баллонная опора при инфаркте миокарда с кардиогенным шоком. N Engl J Med . 2012 Октябрь 4. 367 (14): 1287-96. [Медлайн].
Дудзинск JE, Gnall E, Kowey PR. Обзор устройств и стратегий чрескожной механической поддержки. Ред. Cardiovasc Med . 2018 30 марта, 19 (1): 21-6. [Медлайн].
Фритюрница ML, Бальзам LB. Механическая поддержка кровообращения при кардиогенном шоке у тяжелобольных. Сундук . 30 июля 2019 г. [Medline].
Windecker S. Чрескожные вспомогательные устройства для левого желудочка для лечения пациентов с кардиогенным шоком. Curr Opin Crit Care . 2007 октября, 13 (5): 521-7. [Медлайн].
Rose EA, Gelijns AC, Moskowitz AJ, Heitjan DF, Stevenson LW, Dembitsky W. и др.Длительное использование вспомогательного аппарата левого желудочка при терминальной стадии сердечной недостаточности. N Engl J Med . 2001 15 ноября. 345 (20): 1435-43. [Медлайн].
Фаррар Д. Д., Лоусон Дж. Х., Литвак П., Седерволл Г. Система VAD Thoratec как мост к трансплантации сердца. J Пересадка сердца . 1990 июль-авг. 9 (4): 415-22; обсуждение 422-3. [Медлайн].
Дамм Л., Хитли Дж., Радованцевич Б. Клинические результаты с HeartMate LVAD: обновление всемирного реестра. J Цирк поддержки при застойной сердечной недостаточности . 2001. 2: 5-7 (3).
Hochman JS, Sleeper LA, Webb JG, Sanborn TA, White HD, Talley JD и др. Ранняя реваскуляризация при остром инфаркте миокарда, осложненном кардиогенным шоком. ШОК Следователи. Должны ли мы экстренно реваскуляризовать окклюзию коронарных артерий при кардиогенном шоке. N Engl J Med . 1999 26 августа. 341 (9): 625-34. [Медлайн].
Антониуччи Д., Валенти Р., Мильорини А., Моски Г., Трапани М., Буонамичи П. и др.Отношение времени к лечению и смертности у пациентов с острым инфарктом миокарда, перенесших первичную коронарную ангиопластику. Ам Дж. Кардиол . 1 июня 2002 г. 89 (11): 1248-52. [Медлайн].
Hochman JS, Boland J, Sleeper LA, Porway M, Brinker J, Col J, et al. Современный спектр кардиогенного шока и влияние ранней реваскуляризации на смертность. Результаты международного реестра. ШОК, следователи реестра. Тираж . 1995 г. 1. 91 (3): 873-81.[Медлайн].
Jeger RV, Harkness SM, Ramanathan K и др., Для исследователей SHOCK. Экстренная реваскуляризация у пациентов с кардиогенным шоком при поступлении: отчет и регистр SHOCK. Eur Heart J . 2006 27 марта (6): 664-70. [Медлайн].
Hochman JS, Sleeper LA, Webb JG и др., Для исследователей SHOCK. Ранняя реваскуляризация и длительная выживаемость при кардиогенном шоке, осложнившем острый инфаркт миокарда. ЯМА . 2006, 7 июня. 295 (21): 2511-5. [Медлайн].
[Руководство] Пониковски П., Вурс А.А., Анкер С.Д. и др., Авторы / Члены рабочей группы. Рекомендации ESC по диагностике и лечению острой и хронической сердечной недостаточности от 2016 г .: Целевая группа по диагностике и лечению острой и хронической сердечной недостаточности Европейского общества кардиологов (ESC), разработанная при особом участии Ассоциации сердечной недостаточности (HFA). ) ESC. Eur Heart J .2016 14 июля. 37 (27): 2129-200. [Медлайн]. [Полный текст].
[Рекомендации] Рихал С.С., Найду С.С., Живертц М.М. и др. 2015 SCAI / ACC / HFSA / STS Консенсусное заявление клинических экспертов по использованию устройств чрескожной механической поддержки кровообращения в сердечно-сосудистой помощи: одобрено Американской кардиологической ассоциацией, Кардиологическим обществом Индии и Sociedad Latino Americana de Cardiologia Intervencion; Подтверждение ценности Канадской ассоциацией интервенционной кардиологии-Association Canadienne de Cardiologie d’intervention. Дж. Ам Кол Кардиол . 2015 19 мая. 65 (19): e7-e26. [Медлайн]. [Полный текст].
[Рекомендации] Feldman D, Pamboukian SV, Teuteberg JJ, et al. Рекомендации Международного общества по трансплантации сердца и легких по механической поддержке кровообращения, 2013: краткое содержание. J Пересадка легкого сердца . 2013 Февраль 32 (2): 157-87. [Медлайн]. [Полный текст].
Slottosch I, Liakopoulos O, Kuhn E, Deppe AC, Scherner M, Madershahian N, et al.Результаты после периферической экстракорпоральной мембранной оксигенационной терапии при посткардиотомическом кардиогенном шоке: опыт одного центра. J Surg Res . 2013 май. 181 (2): e47-55. [Медлайн].
Андерсон М.Л., Петерсон Э.Д., Пенг С.А. и др. Различия в профиле, лечении и прогнозе пациентов с кардиогенным шоком по классификации инфаркта миокарда: отчет NCDR. Результаты Circ Cardiovasc Qual . 2013 Ноябрь 6 (6): 708-15. [Медлайн].
Menon V, White H, LeJemtel T, et al. Клинический профиль пациентов с подозрением на кардиогенный шок из-за преобладающей левожелудочковой недостаточности: отчет SHOCK Trial Registry. Должны ли мы экстренно реваскуляризировать окклюзированные коронарные артерии при кардиогенном шоке? Дж. Ам Кол Кардиол . 2000 Сентябрь 36 (3 доп. A): 1071-6. [Медлайн].
Koprivanac M, Kelava M, Soltesz E, et al. Достижения в области временной механической поддержки для лечения кардиогенного шока. Эксперт Рев Мед Устройства . 2015 12 ноября (6): 689-702. [Медлайн].
Susen S, Rauch A, Van Belle E, Vincentelli A, Lenting PJ. Устройства поддержки кровообращения: фундаментальные аспекты и клиническое лечение кровотечений и тромбозов. J Тромб Haemost . 2015 13 октября (10): 1757-67. [Медлайн].
Miller PE, Guha A, Khera R, et al. Национальные тенденции в отношении инфекций, связанных с оказанием медицинской помощи, для пяти распространенных сердечно-сосудистых заболеваний. Ам Дж. Кардиол . 2019 16 июля. [Medline].
Правая стопа немеет: Немеет стопа правой ноги, причины и лечение. Ответ на health-post.ru
Первая помощь при вывихе суставов: Первая помощь при вывихе — симптомы, действия
Похожие записи
Детский массаж в Минске: польза, виды, техники и рекомендации специалистов
Каковы основные преимущества детского массажа для здоровья и развития ребенка. Какие виды детского массажа наиболее эффективны для разных возрастов. Как […]
Почему ребенок постоянно просит грудь: причины и решения
Почему грудничок часто требует грудь. Какие причины заставляют ребенка постоянно висеть на груди. Как определить, достаточно ли малышу молока. Что […]
Алфавит для иммунитета: укрепление защитных сил организма в сезон простуд
Как витаминно-минеральный комплекс Алфавит помогает укрепить иммунитет. Какие компоненты входят в состав Алфавита. Для кого предназначен Алфавит в сезон простуд. […]



 12.2012 №1109н
12.2012 №1109н  12.2012 №1103н
12.2012 №1103н  1
1 12.2012 №1126н
12.2012 №1126н 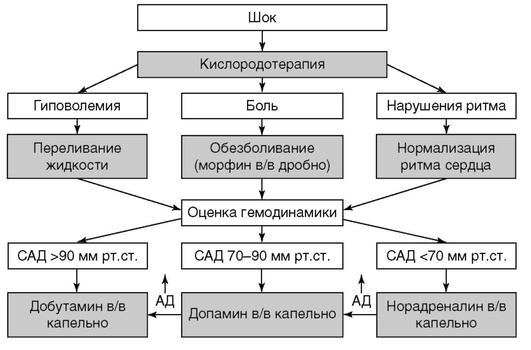 12.2012 №1283н
12.2012 №1283н  5.Класс X.Болезни органов дыхания (J00-J99)
5.Класс X.Болезни органов дыхания (J00-J99)  6
6 12.2012 №1087н
12.2012 №1087н  2
2 12.2012 №1385н
12.2012 №1385н  12.2012 №1090н
12.2012 №1090н  9.35. Стандарт скорой медицинской помощи при эклампсии
9.35. Стандарт скорой медицинской помощи при эклампсии  0
0 12.2012 №1431н
12.2012 №1431н  Стандарт скорой медицинской помощи при судорогах
Стандарт скорой медицинской помощи при судорогах  11.47. Стандарт скорой медицинской помощи при травмах головы
11.47. Стандарт скорой медицинской помощи при травмах головы  2
2 3
3 11.53. Стандарт скорой медицинской помощи при травмах мужских мочеполовых органов, инородном теле в мужских мочеполовых органах, избыточной крайней плоти, фимозе и парафимозе
11.53. Стандарт скорой медицинской помощи при травмах мужских мочеполовых органов, инородном теле в мужских мочеполовых органах, избыточной крайней плоти, фимозе и парафимозе  3
3 12.2012 №1384н
12.2012 №1384н  12.2012 №1278н
12.2012 №1278н  12.2012 №1375н
12.2012 №1375н  12.2012 №1392н
12.2012 №1392н  12.2012 №1115н
12.2012 №1115н  12.2012 №1430н
12.2012 №1430н  Чтобы нормализовать показатели, нужно дать больному препарат, в состав которого входит допамин, метазон или гидрокартизон.
Чтобы нормализовать показатели, нужно дать больному препарат, в состав которого входит допамин, метазон или гидрокартизон. Здесь используются такие лекарства, как Дроперидол, Промедол, Фентанил и другие;
Здесь используются такие лекарства, как Дроперидол, Промедол, Фентанил и другие;
 Проводится процедура для нормализации кровяного давления;
Проводится процедура для нормализации кровяного давления;
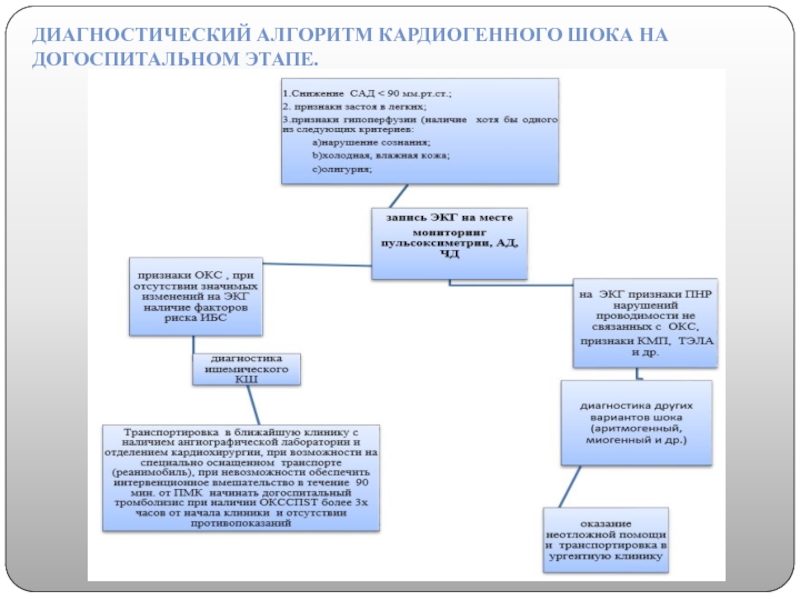

 Звуковые волны создают образ вашего сердца.Этот тест может помочь определить повреждение от сердечного приступа.
Звуковые волны создают образ вашего сердца.Этот тест может помочь определить повреждение от сердечного приступа.
 Попав в нужное положение, баллон ненадолго надувается, чтобы открыть засорение.
Попав в нужное положение, баллон ненадолго надувается, чтобы открыть засорение.
 Американская Ассоциация Сердца. https://www.heart.org/en/about-us/heart-attack-and-stroke-symptoms. Проверено 28 декабря 2020 г.
Американская Ассоциация Сердца. https://www.heart.org/en/about-us/heart-attack-and-stroke-symptoms. Проверено 28 декабря 2020 г. Клиническая токсикология.2020; DOI: 10.1080 / 15563650.2019.1676896.
Клиническая токсикология.2020; DOI: 10.1080 / 15563650.2019.1676896. 7% против 56,0%; P = .11)
7% против 56,0%; P = .11)