Хроническая тромбоэмболическая легочная гипертензия после острого эпизода тромбоэмболии легочной артерии: основные принципы диагностики и обзор современных возможностей лечения | Черепанова
Тромбоэмболия легочной артерии (ТЭЛА) — распространенная и прогностически весьма неблагоприятная патология, представляющая собой окклюзию легочной артерии (ЛА) или ее ветвей тромботическими массами [1-3]. Заболеваемость ТЭЛА варьирует от 35 до 83 случаев на 100 тыс. населения [4][5]. Это наиболее распространенная причина кардиоваскулярной смертности после инфаркта миокарда и инсульта и ведущая потенциально предотвратимая причина смерти у пациентов в стационаре [6]. Анализ базы данных пациентов в США показал, что госпитальная смертность при немассивной ТЭЛА и своевременно начатой терапии составляет 2,7%, а при массивной превышает 40% [7]. По данным регистра СИРЕНА госпитальная смертность от ТЭЛА в российских стационарах составляет 9,9% [8].
Хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ) является грозным и, к сожалению, недостаточно диагностируемым осложнением ТЭЛА [9]. Частота развития ХТЭЛГ у пациентов, перенесших ТЭЛА, составляет от 0,1 до 11,8% [10], а по некоторым данным этот показатель может превышать 14% [11]. Свой вклад в проблему диагностики вносит ошибочная классификация заболевания, нередко ХТЭЛГ при первом проявлении может быть определена как острая ТЭЛА [12][13]. Проведенный Gall H, et al. анализ публикаций и баз данных свидетельствует о недостаточной выявляемости ХТЭЛГ как в США, так и в Европе, а разработанная ими модель прогнозирует дальнейший рост распространенности данной патологии в ближайшее десятилетие [14]. В Российской Федерации от тяжелой ХТЭЛГ в течение 5 лет умирает 10-15% больных, перенесших массивную ТЭЛА [15]. Поэтому стратегия наблюдения за пациентами после ТЭЛА должна обеспечивать не только предотвращение рецидивов и уменьшение летальных исходов, но и раннее обнаружение ХТЭЛГ [1].
Частота развития ХТЭЛГ у пациентов, перенесших ТЭЛА, составляет от 0,1 до 11,8% [10], а по некоторым данным этот показатель может превышать 14% [11]. Свой вклад в проблему диагностики вносит ошибочная классификация заболевания, нередко ХТЭЛГ при первом проявлении может быть определена как острая ТЭЛА [12][13]. Проведенный Gall H, et al. анализ публикаций и баз данных свидетельствует о недостаточной выявляемости ХТЭЛГ как в США, так и в Европе, а разработанная ими модель прогнозирует дальнейший рост распространенности данной патологии в ближайшее десятилетие [14]. В Российской Федерации от тяжелой ХТЭЛГ в течение 5 лет умирает 10-15% больных, перенесших массивную ТЭЛА [15]. Поэтому стратегия наблюдения за пациентами после ТЭЛА должна обеспечивать не только предотвращение рецидивов и уменьшение летальных исходов, но и раннее обнаружение ХТЭЛГ [1].
Критерии постановки диагноза ХТЭЛГ и особенности патогенеза
ХТЭЛГ — это тяжелая патология, при которой на — блюдается хроническая обструкция крупных/средних ветвей ЛА и вторичные изменения микроциркуляторного русла легких, что в дальнейшем приводит к прогрессирующему повышению легочного сосудистого сопротивления (ЛСС) и давления в ЛА с развитием правожелудочковой сердечной недостаточности [15-18].
Критериями постановки диагноза ХТЭЛГ являются:
- наличие прекапиллярной легочной гипертензии (ЛГ) по данным катетеризации правых отделов сердца (КПОС): среднее давление в ЛА ≥25 мм рт.ст., давление заклинивания в ЛА ≤15 мм рт.ст., величина ЛСС >3 Ед Вуда;
- выявление хронических/организованных тромбов/эмболов в ЛА эластического типа (легочный ствол, долевые, сегментарные, субсегментарные ЛА) по данным ангиографии при компьютерной томографии (КТ) или селективной ангиопульмонографии; как минимум один сегментарный дефект перфузии по данным вентиляционно-перфузионной сцинтиграфии легких;
- эффективная антикоагулянтная терапия на про — тяжении не <3 мес. [16].
Согласно классификации ХТЭЛГ относится к 4 группе ЛГ [15][16] и характеризуется наличием патологически организованного тромбоэмболического материала и ремоделированием сосудов, инициированным или потенцированным сочетанием дефектного ангиогенеза, нарушения фибринолиза и эндотелиальной дисфункцией. Эти изменения приводят к ЛГ и в конечном счете к правожелудочковой недостаточности [19]. В патогенезе заболевания в дополнение к механической обструкции проксимальных артерий (основных, долевых, сегментарных) у пациентов развивается микроваскулопатия: утолщение и ремоделирование сосудов легочного микроциркуляторного русла, эксцентрический фиброз интимы, пролиферация фибромышечных клеток интимы и плексиформные поражения [20]. Эта микроваскулопатия наблюдается не только в участках легких, расположенных дистальнее окклюзированных ЛА, но также и в неокклюзированных ЛА. В редких случаях может наблюдаться дистальный тромбоз [18].
Эти изменения приводят к ЛГ и в конечном счете к правожелудочковой недостаточности [19]. В патогенезе заболевания в дополнение к механической обструкции проксимальных артерий (основных, долевых, сегментарных) у пациентов развивается микроваскулопатия: утолщение и ремоделирование сосудов легочного микроциркуляторного русла, эксцентрический фиброз интимы, пролиферация фибромышечных клеток интимы и плексиформные поражения [20]. Эта микроваскулопатия наблюдается не только в участках легких, расположенных дистальнее окклюзированных ЛА, но также и в неокклюзированных ЛА. В редких случаях может наблюдаться дистальный тромбоз [18].
Существенную роль в патофизиологии ХТЭЛГ играет метаболический путь оксид азота (NO) — растворимая гуанилатциклаза (рГЦ) — циклический гуанозинмонофосфат (цГМФ). NO, продуцируемый эндотелием сосудов, ингибирует агрегацию тромбоцитов и рост гладкомышечных клеток, а также посредством активации рГЦ участвует в синтезе цГМФ, вещества, влияющего на расслабление гладкой мускулатуры [20].
Факторы риска развития ХТЭЛГ
Зачастую ХТЭЛГ развивается после перенесенного острого эпизода ТЭЛА. Согласно международному регистру 75% пациентов с верифицированным диагнозом ХТЭЛГ имели задокументированный случай ТЭЛА в анамнезе [24]. Предрасполагающими факторами для развития осложнения считаются: ТЭЛА в анамнезе, крупный дефект перфузии при остром эпизоде ТЭЛА, молодой возраст, ТЭЛА в отсутствие провоцирующих факторов и др. [24][25]. Если при остром эпизоде ТЭЛА систолическое давление в ЛА >50 мм рт.ст., то, по данным наблюдений, спустя 12 мес. ХТЭЛГ развивается чаще [26]. Современные концепции также рассматривают другие факторы риска (ФР) ХТЭЛГ (рис. 1).
ХТЭЛГ развивается чаще [26]. Современные концепции также рассматривают другие факторы риска (ФР) ХТЭЛГ (рис. 1).
Рис. 1. ФР развития ХТЭЛГ (адаптировано из [1]).
Сокращения: КТ — компьютерная томография, ТГВ — тромбоз глубоких вен, ТЭЛА — тромбоэмболия легочной артерии, ХТЭЛГ — хроническая тромбоэмболическая легочная гипертензия, ЭхоКГ — эхокардиография.
Следует заметить, что развитие ХТЭЛГ возможно даже на фоне качественной антикоагулянтной терапии. Европейское исследование показало, что адекватная антикоагулянтная терапия, которую получали пациенты после эпизода острой ТЭЛА, не предотвратила у них случаев развития ХТЭЛГ в последующие 2 года [27]. В современной литературе отсутствуют данные, свидетельствующие о каких-либо различиях в частоте развития ХТЭЛГ у пациентов с венозной тромбоэмболией, получавших терапию антагонистами витамина К и новыми пероральными антикоагулянтами, однако тщательных исследований не проводилось [9].
Стратегия наблюдения за пациентами после ТЭЛА и диагностические обследования
Ранняя диагностика ХТЭЛГ может иметь важное значение в отношении дальнейших исходов [9]. Однако существует ряд причин, которые затрудняют своевременное выявление патологии, одна из них — неспецифичность симптомов ХТЭЛГ. У большинства больных в первые месяцы после эпизода ТЭЛА можно наблюдать стабильный мало- или даже бессимптомный период [1][28]. В этом случае заболевание будет заподозрено позднее и уже, к сожалению, в запущенной стадии. Одышка, повышенная утомляемость, боли в области сердца, головокружение, синкопальные состояния, кашель и кровохарканье, характерные для ХТЭЛГ, могут быть симптомами множества других заболеваний. Физикальные признаки, такие как отеки нижних конечностей, гепатомегалия, набухание шейных вен, акроцианоз, появляются при возникновении правожелудочковой недостаточности, что опять же свидетельствует о поздней стадии заболевания [15].
Однако существует ряд причин, которые затрудняют своевременное выявление патологии, одна из них — неспецифичность симптомов ХТЭЛГ. У большинства больных в первые месяцы после эпизода ТЭЛА можно наблюдать стабильный мало- или даже бессимптомный период [1][28]. В этом случае заболевание будет заподозрено позднее и уже, к сожалению, в запущенной стадии. Одышка, повышенная утомляемость, боли в области сердца, головокружение, синкопальные состояния, кашель и кровохарканье, характерные для ХТЭЛГ, могут быть симптомами множества других заболеваний. Физикальные признаки, такие как отеки нижних конечностей, гепатомегалия, набухание шейных вен, акроцианоз, появляются при возникновении правожелудочковой недостаточности, что опять же свидетельствует о поздней стадии заболевания [15].
Скрининговым инструментом диагностики выступает эхокардиография (ЭхоКГ), метод, позволяющий выявить ключевой признак ХТЭЛГ — наличие ЛГ [17][29]. С точки зрения эффективной диагностики оптимальное время для направления к специалисту — через 3 мес. стабильной антикоагулянтной терапии после эпизода острой ТЭЛА [1]. Обследование в более короткие сроки может потребоваться пациентам при наличии выраженной симптоматики или ухудшении состояния [9]. В повседневной практике ХТЭЛГ диагностируется спустя 14-24 мес. с момента появления симптомов [30]. Более длительная задержка в диагностике коррелирует с более высоким давлением в ЛА в момент постановки диагноза и повышенным риском смерти [31]. Это подчеркивает необходимость своевременной диагностики ХТЭЛГ.
стабильной антикоагулянтной терапии после эпизода острой ТЭЛА [1]. Обследование в более короткие сроки может потребоваться пациентам при наличии выраженной симптоматики или ухудшении состояния [9]. В повседневной практике ХТЭЛГ диагностируется спустя 14-24 мес. с момента появления симптомов [30]. Более длительная задержка в диагностике коррелирует с более высоким давлением в ЛА в момент постановки диагноза и повышенным риском смерти [31]. Это подчеркивает необходимость своевременной диагностики ХТЭЛГ.
Наличие у пациентов таких ФР ХТЭЛГ, как: молодой возраст, перенесенная ранее ТЭЛА, идиопатическая ТЭЛА, крупный дефект перфузии, сохраняется ЛГ при выписке из стационара, — указывает на необходимость активного диагностического поиска у таких пациентов [32]. Целесообразно приглашать их на осмотр через 3-6 мес. с выполнением ЭхоКГ, чтобы не пропустить формирование ХТЭЛГ (рис. 2) [1].
Рис. 2. Алгоритм наблюдения после острого эпизода ТЭЛА (адаптировано из [1]).
Сокращения: ЛГ — легочная гипертензия, МСКТ — многосрезовая компьютерная томография легких, ТЭЛА — тромбоэмболия легочной артерии, ХТЭЛГ — хроническая тромбоэмболическая легочная гипертензия, ЭхоКГ — эхокардиография.
Алгоритм диагностики ХТЭЛГ предполагает поэтапную верификацию диагноза (рис. 3) [33]. У пациентов с персистирующей или впервые возникшей, в т.ч. необъяснимой, одышкой после ТЭЛА ключевым моментом диагностики является проведение ЭхоКГ. При оценке вероятности ЛГ в первую очередь учитывается пиковая скорость трикуcпидальной регургитации, а также наличие дополнительных признаков: дилатация правого предсердия и правого желудочка (ПЖ), парадоксальное движение межжелудочковой перегородки с ее смещением в систолу в сторону ПЖ, диаметр ЛА, нижней половой вены, а также ряд других показателей (табл. 1) [15].
Таблица 1
Вероятность ЛГ на основании ЭхоКГ (адаптировано из [15])
Сокращения: ЛА — легочная артерия, ЛЖ — левый желудочек, НПВ — нижняя полая вена, ПЖ — правый желудочек, ПП — правое предсердие, ЭхоКГ — эхокардиографический.
Рис. 3. Этапы диагностики ХТЭЛГ (адаптировано из [33]).
Сокращения: КТ — компьютерная томография, КПОС — катетеризация правых отделов сердца, ЛГ — легочная гипертензия, ХТЭЛГ — хроническая тромбоэмболическая легочная гипертензия, ЭКГ — электрокардиография.
В случае выявления низкой или промежуточной вероятности ХТЭЛГ рекомендована комплексная оценка состояния пациента. Важно учесть наличие ФР, оценить уровень N-терминального фрагмента предшественника мозгового натрийуретического пептида (NT-proBNP) [1], концентрация которого отражает наличие и тяжесть заболевания [34]. Рекомендовано проведение кардиопульмонального нагрузочного тестирования. В совокупности эти дополнительные данные позволят определить дальнейшую тактику ведения пациента [1].
Пациентам с высокой вероятностью ЛГ рекомендовано сразу проведение вентиляционно-перфузионной сцинтиграфии, диагностической процедуры, которая обладает высокой чувствительностью (90-100%) и специфичностью (94 100%). У пациентов с ХТЭЛГ, как правило, выявляются дефекты перфузии в долевых и сегментарных зонах при отсутствии вентиляционных дефектов. Учитывая техническую недоступность выполнения данной процедуры в условиях большинства российских стационаров, рекомендовано проведение рентгенографии грудной клетки или многосрезовой КТ легких совместно с планарной перфузионной сцинтиграфией легких [17].
У пациентов с ХТЭЛГ, как правило, выявляются дефекты перфузии в долевых и сегментарных зонах при отсутствии вентиляционных дефектов. Учитывая техническую недоступность выполнения данной процедуры в условиях большинства российских стационаров, рекомендовано проведение рентгенографии грудной клетки или многосрезовой КТ легких совместно с планарной перфузионной сцинтиграфией легких [17].
В дальнейшем пациентам рекомендовано проведение КТ органов грудной клетки с внутривенным болюсным контрастированием и ангиопульмонографии для определения локализации организованных тромботических масс [17].
И в завершение диагностического алгоритма па — циентам с подозрением на ХТЭЛГ рекомендовано проведение КПОС. Данная процедура является “золотым стандартом” диагностики и позволяет верифицировать диагноз, а также определить тактику лечения. КПОС должна проводиться в условиях экспертного центра ввиду сложности выполнения и потенциальных рисков для пациента, связанных с процедурой [16].
Современные возможности лечения ХТЭЛГ.

Мультимодальный подход
Как указывалось выше, ранняя диагностика ХТЭЛГ — это насущная необходимость, позволяющая начать своевременное лечение. ХТЭЛГ — это уникальная форма ЛГ, поскольку она является единственной потенциально излечимой с помощью хирургического вмешательства [35]. Каждый пациент с верифицированной ХТЭЛГ должен быть оценен мультидисциплинарной командой специалистов на предмет возможности выполнения легочной тромбэндартерэктомии [16]. По данным анализа международного регистра по ХТЭЛГ, 3-летняя выживаемость у пациентов после оперативного вмешательства составила 89%, и 70% у тех, кто не получил хирургического лечения [36].
Если пациент признан неоперабельным на основании решения специалистов из двух экспертных центров, либо у пациента выявлена персистирующая/ рецидивирующая ХТЭЛГ, то в таком случае рекомендована терапия легочными вазодилататорами [15][17]. В настоящее время единственным препаратом с высоким классом доказательности в отношении данной группы пациентов является риоцигуат — стимулятор рГЦ [15].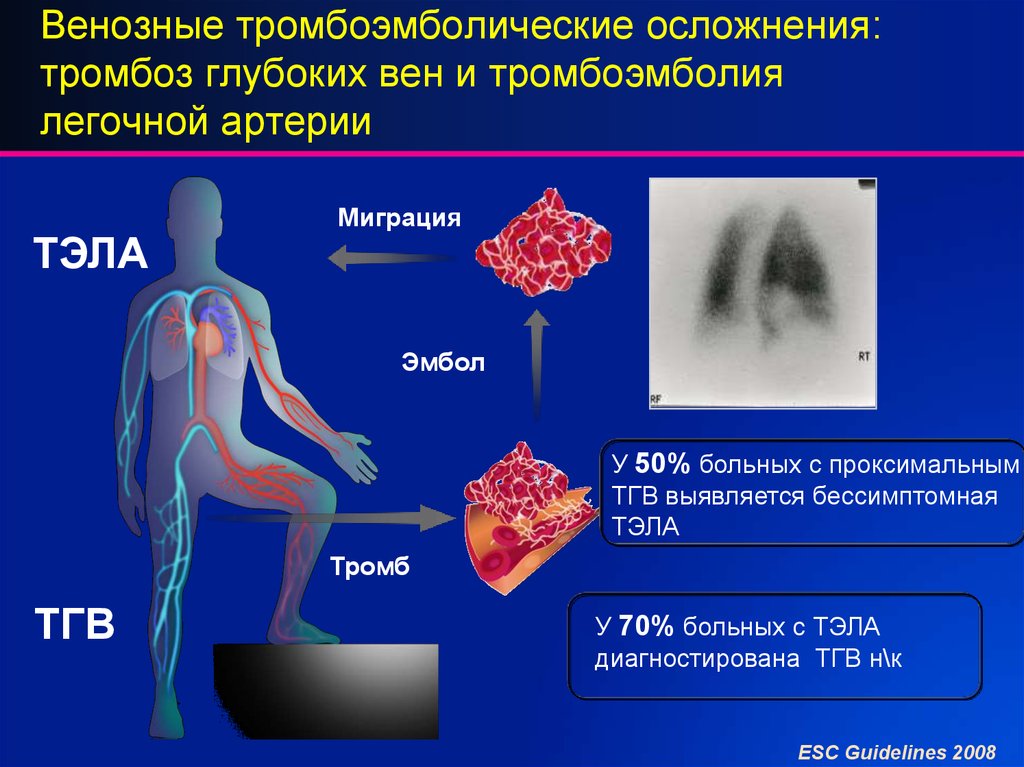 Препарат обладает двойным механизмом действия: сенсибилизирует фермент рГЦ к эндогенному NO путем стабилизации связи NO-рГЦ, а также напрямую стимулирует последний через другой участок связи, независимо от NO. Благодаря которому увеличивается синтез молекулы цГМФ, вещества, которое играет важную роль в регуляции процессов, влияющих на тонус сосудов, пролиферацию, фиброз и воспаление [37].
Препарат обладает двойным механизмом действия: сенсибилизирует фермент рГЦ к эндогенному NO путем стабилизации связи NO-рГЦ, а также напрямую стимулирует последний через другой участок связи, независимо от NO. Благодаря которому увеличивается синтез молекулы цГМФ, вещества, которое играет важную роль в регуляции процессов, влияющих на тонус сосудов, пролиферацию, фиброз и воспаление [37].
Профиль эффективности и безопасности препарата был изучен в ходе международного многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования III фазы, CHEST-1. Среди пациентов, включенных в исследование (n=261), были пациенты с неоперабельной ХТЭЛГ (72%) и с персистирующей/рецидивирующей ХТЭЛГ после оперативного лечения (28%). Через 16 нед. терапии был зафиксирован положительный результат по первичной конечной точке. Риоцигуат значимо улучшил переносимость физических нагрузок, прирост дистанции в тесте 6-минутной ходьбы (Т6МХ) в группе риоцигуата составил 46 м (95% доверительный интервал (ДИ): 25-67; P<0,001) по сравнению с группой плацебо. Позитивный результат также наблюдался по ряду вторичных конечных точек: снижение ЛСС -246 дин∙с∙см-5 (95% ДИ: от -303 до -190; Р<0,001), снижение уровня NT-proBNP -444 пг/мл (95% ДИ: от -843 до -45; Р<0,001), улучшение функционального класса (ФК) по Всемирной организации здравоохранения (Р=0,003). В исследовании был продемонстрирован благоприятный профиль безопасности риоцигуата [38].
Позитивный результат также наблюдался по ряду вторичных конечных точек: снижение ЛСС -246 дин∙с∙см-5 (95% ДИ: от -303 до -190; Р<0,001), снижение уровня NT-proBNP -444 пг/мл (95% ДИ: от -843 до -45; Р<0,001), улучшение функционального класса (ФК) по Всемирной организации здравоохранения (Р=0,003). В исследовании был продемонстрирован благоприятный профиль безопасности риоцигуата [38].
Долговременное лечение пациентов с ХТЭЛГ оценивалось в исследовании CHEST-2, включившем 237 пациентов, завершивших исследование CHEST-1. В ходе наблюдения за пациентами в течение 1 года было выявлено, что улучшения показателей Т6МХ, ФК по Всемирной организации здравоохранения, которые наблюдались в конце исследования CHEST-1, в целом сохранялись. Большинство пациентов (90%) получали риоцигуат в максимальной дозировке через 1 год терапии, при этом изменение дозировки наблюдалось нечасто, что свидетельствует в пользу переносимости препарата при длительном применении. Однолетняя выживаемость пациентов составила 97% [39].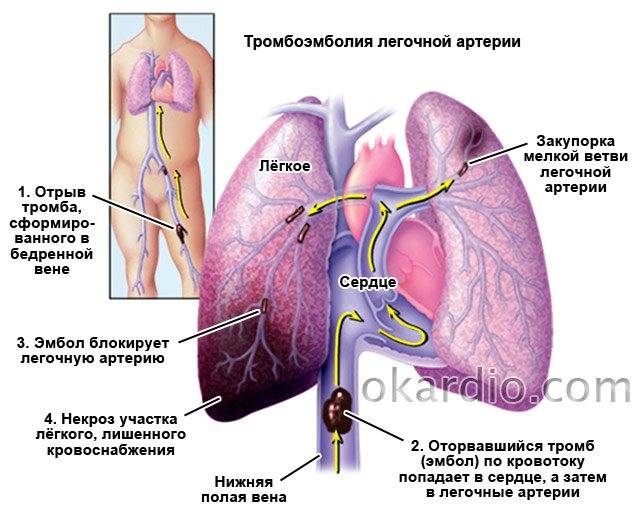
Благоприятный профиль безопасности препарата был продемонстрирован и при длительном наблюдении в условиях реальной клинической практики за пациентами с ХТЭЛГ. По результатам анализа финальных данных регистра EXPERT новых сигналов безопасности риоцигуата выявлено не было [40].
Важной опцией лечения у пациентов с ХТЭЛГ является выполнение баллонной ангиопластики (БАП) ЛА [15][41]. Появляется всё больше данных, демонстрирующих положительный эффект сочетанного применения медикаментозной терапии и хирургического лечения [9].
Японские специалисты в своем исследовании показали, что применение риоцигуата в качестве бридж-терапии при БАП ЛА у пациентов с “тяжелой” неоперабельной ХТЭЛГ может приводить к лучшим исходам. После проведения БАП ЛА только в группе риоцигуата наблюдалось достоверное снижение уровня мозгового натрийуретического пептида. Было также отмечено, что на фоне терапии риоцигуатом потребовалось значительно меньше сессий БАП ЛА и количества контраста для достижения среднего давления в ЛА <25 мм рт. ст., по сравнению с группой без медикаментозной терапии [42]. Благоприятный результат был показан в исследовании Wiedenroth CB, et al., которые изучали комбинированное лечение риоцигуатом и БАП ЛА у неоперабельных пациентов с ХТЭЛГ. Мультимодальная стратегия привела к улучшению ряда гемодинамических показателей, у большинства пациентов (94,4%) отмечалось улучшение ФК [43].
ст., по сравнению с группой без медикаментозной терапии [42]. Благоприятный результат был показан в исследовании Wiedenroth CB, et al., которые изучали комбинированное лечение риоцигуатом и БАП ЛА у неоперабельных пациентов с ХТЭЛГ. Мультимодальная стратегия привела к улучшению ряда гемодинамических показателей, у большинства пациентов (94,4%) отмечалось улучшение ФК [43].
Заключение
ХТЭЛГ является единственной потенциально излечимой формой ЛГ. Диагностическая настороженность в отношении пациентов, перенесших ТЭЛА, позволит своевременно выявить грозное осложнение, что может иметь важное значение в отношении дальнейших исходов. У симптоматических пациентов с типичными ФР и клиническими данными, указывающими на хроническое тромбоэмболическое сосудистое заболевание, необходима тщательная клиническая оценка и проведение ряда диагностических процедур для подтверждения или исключения ХТЭЛГ. Современные терапевтические и хирургические возможности, развитие мультимодальной стратегии лечения позволяют оказать помощь пациентам с ХТЭЛГ. Таким образом, важно не упустить драгоценное время, ведь именно быстрая и точная диагностика является залогом начала своевременного лечения.
Таким образом, важно не упустить драгоценное время, ведь именно быстрая и точная диагностика является залогом начала своевременного лечения.
Отношения и деятельность. Статья подготовлена при поддержке АО “Байер”, PP-ADE-RU-0153-1.
1. Konstantinides SV, Meyer G, Becattini C, et al.; ESC Scientific Document Group. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020;41(4):543- 603. doi:10.1093/eurheartj/ehz405.
2. Tapson VF. Acute pulmonary embolism. N Engl J Med. 2008;358(10):1037-52. doi:10.1056/NEJMra072753.
3. Jiménez D, de Miguel-Díez J, Guijarro R, et al.; RIETE Investigators. Trends in the Management and Outcomes of Acute Pulmonary Embolism: Analysis From the RIETE Registry. J Am Coll Cardiol. 2016;67(2):162-70. doi:10.1016/j.jacc.2015.10.060.
4. Lehnert P, Lange T, Müller CH, et al. Acute pulmonary embolism in a national Danish cohort: increasing incidence and decreasing mortality.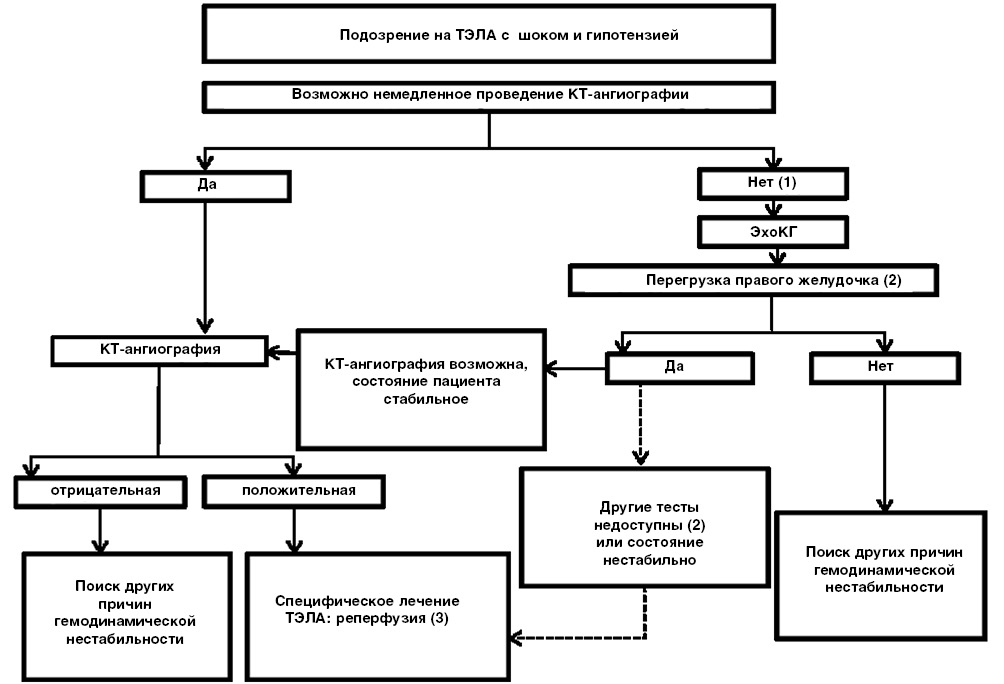 Thromb Haemost. 2018;118:539- 46. doi:10.1160/Th27-08-0531.
Thromb Haemost. 2018;118:539- 46. doi:10.1160/Th27-08-0531.
5. Бокерия Л.А., Затевахин И. И., Кириенко А. И. и др. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений. Флебология. 2015;9(4):2-52.
6. Heit JA. The epidemiology of venous thromboembolism in the community. Arterioscler Thromb Vasc Biol. 2008;28:370-2.
7. Smith SB, Geske JB, Kathuria P, et al. Analysis of national trends in admissions for pulmonary embolism. Chest. 2016;150:35-45. doi:10.1016/j.chest.2016.02.638.
8. Эрлих А.Д., Атаканова А.Н., Неешпапа А.Г. и др. Российский регистр острой тромбоэмболии лёгочной артерии СИРЕНА: характеристика пациентов и лечение в стационаре. Российский кардиологический журнал. 2020;25(10):3849. doi:10.15829/1560-4071-2020-3849.
9. Delcroix M, Torbicki A, Gopalan D, et al. ERS Statement on Chronic Thromboembolic Pulmonary Hypertension. Eur Respir J. 2021;57(6):2002828. doi:10.1183/13993003.02828-2020.
10./Ukr/24/6.jpg) Klok FA, Delcroix M, Bogaard HJ. Chronic thromboembolic pulmonary hypertension from the perspective of patients with pulmonary embolism. J Thromb Haemost. 2018;16(6):1040-51. doi:10.1111/jth.14016.
Klok FA, Delcroix M, Bogaard HJ. Chronic thromboembolic pulmonary hypertension from the perspective of patients with pulmonary embolism. J Thromb Haemost. 2018;16(6):1040-51. doi:10.1111/jth.14016.
11. Zhang M, Wang N, Zhai Z, et al. Incidence and risk factors of chronic thromboembolic pulmonary hypertension after acute pulmonary embolism: a systematic review and meta-analysis of cohort studies. J Thorac Dis. 2018;10(8):4751-63. doi:10.21037/jtd.2018.07.106.
12. Guerin L, Couturaud F, Parent F, et al. Prevalence of chronic thromboembolic pulmonary hypertension after acute pulmonary embolism. Prevalence of CTEPH after pulmonary embolism. Thromb Haemost. 2014;112:598-605. doi:10.1160/Th23-07-0538.
13. Simonneau G, Hoeper MM. Evaluation of the incidence of rare diseases: difficulties and uncertainties, the example of chronic thromboembolic pulmonary hypertension. Eur Respir J. 2017;49(2):1602522. doi:10.1183/13993003.02522-2016.
14. Gall H, Hoeper MM, Richter MJ, et al. An epidemiological analysis of the burden of chronic thromboembolic pulmonary hypertension in the USA, Europe and Japan. Eur Respir Rev. 2017;26:160121. doi:10.1183/16000617.0121-2016.
An epidemiological analysis of the burden of chronic thromboembolic pulmonary hypertension in the USA, Europe and Japan. Eur Respir Rev. 2017;26:160121. doi:10.1183/16000617.0121-2016.
15. Galiè N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur Heart J. 2016;37(1):67-119. doi:10.1093/eurheartj/ehv317.
16. Чазова И.Е., Мартынюк Т.В., Валиева З.С. и др. Евразийские клинические рекомендации по диагностике и лечению легочной гипертензии. Евразийский кардиологический журнал. 2020;(1):78-122. doi:10.38109/2225-1685-2020-1-78-122.
17. Российское кардиологическое общество. 2020 Клинические рекомендации. Легочная гипертензия, в том числе хроническая тромбоэмболическая легочная гипертензия. Министерство Здравоохранения Российской Федерации. Российский кардиологический журнал. 2021;26:4683. doi:10.15829/1560-4071-2021-4683 (В печати).
Легочная гипертензия, в том числе хроническая тромбоэмболическая легочная гипертензия. Министерство Здравоохранения Российской Федерации. Российский кардиологический журнал. 2021;26:4683. doi:10.15829/1560-4071-2021-4683 (В печати).
18. Kim NH, Delcroix M, Jais X, et al. Chronic thromboembolic pulmonary hypertension. Eur Respir J. 2019;53:1801915. doi:10.1183/13993003.01915-2018.
19. Dorfmüller P, Günther S, Ghigna M-R, et al. Microvascular disease in chronic thromboembolic pulmonary hypertension: a role for pulmonary veins and systemic vasculature. Eur Respir J. 2014;44:1275-88.
20. Simonneau G, Torbicki A, Dorfmüller P, et al. The pathophysiology of chronic thromboembolic pulmonary hypertension. Eur Respir Rev. 2017;26:160112. doi:10.1183/16000617.0112-2016.
21. Stasch JP, Evgenov OV. Soluble guanylate cyclase stimulators in pulmonary hypertension. Handb Exp Pharmacol. 2013;218:279-313.
22. Reesink HJ, Meijer RC, Lutter R, et al. Hemodynamic and clinical correlates of endothelin-1 in chronic thromboembolic pulmonary hypertension. Circ J. 2006;70:1058-63.
Circ J. 2006;70:1058-63.
23. Hoeper MM, Mayer E, Simonneau G, et al. Chronic thromboembolic pulmonary hypertension. Circulation. 2006;113:2011-20.
24. Pepke-Zaba J, Delcroix M, Lang I, et al. Chronic thromboembolic pulmonary hypertension (CTEPH): results from an international prospective registry. Circulation. 2011;124(18):1973-81. doi:10.1161/CIRCULATIONAHA.110.015008.
25. Lang IM, Simonneau G, Pepke-Zaba JW, et al. Factors associated with diagnosis and operability of chronic thromboembolic pulmonary hypertension. A case-control study. Thromb Haemost. 2013;110(1):83-91. doi:10.1160/Th23-02-0097.
26. Konstantinides CV, Torbick A, Giancarlo Agnelli G, et al. 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014;35:3033-80. doi:10.1093/eurheartj/ehn310.
27. Boon GJAM, van Rein N, Bogaard HJ, et al. Quality of initial anticoagulant treatment and risk of CTEPH after acute pulmonary embolism. PLoS One. 2020;15(4):e0232354. doi:10.1371/journal.pone.0232354. Erratum in: PLoS One. 2020;15(6):e0234298.
doi:10.1371/journal.pone.0232354. Erratum in: PLoS One. 2020;15(6):e0234298.
28. Ende-Verhaar YM, Cannegieter SC, Vonk Noordegraaf A, et al. Incidence of chronic thromboembolic pulmonary hypertension after acute pulmonary embolism: a contemporary view of the published literature. Eur Respir J. 2017;49(2):1601792. doi:10.1183/13993003.01792-2016.
29. Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2015;16(3):233-70. doi:10.1093/ehjci/jev014. Erratum in: Eur Heart J Cardiovasc Imaging. 2016;17(4):412. Erratum in: Eur Heart J Cardiovasc Imaging. 2016;17(9):969.
30. Ende-Verhaar YM, van den Hout WB, Bogaard H-J, et al. Healthcare utilization in chronic thromboembolic pulmonary hypertension after acute pulmonary embolism. J Thromb Haemost. 2018;16:2168-74. doi:10. 1111/jth.14266.
1111/jth.14266.
31. Klok FA, Barco S, Konstantinides SV, et al. Determinants of diagnostic delay in chronic thromboembolic pulmonary hypertension: results from the European CTEPH Registry. Eur Respir J. 2018;52(6):1801687. doi:10.1183/13993003.01687-2018.
32. Terapevticheskii arkhiv. 2016;88(9):90-101. (In Russ.) Чазова И. Е., Мартынюк Т.В. Клинические рекомендации по диагностике и лечению хронической тромбоэмболической легочной гипертензии (I часть). Терапевтический архив. 2016;88(9):90-101. doi:10.17116/terarkh301688990-101.
33. Wilkens H, Konstantinides S, Lang IM, et al. Chronic thromboembolic pulmonary hypertension (CTEPH): Updated Recommendations from the Cologne Consensus Conference 2018. Int J Cardiol. 2018;272S:69-78. doi:10.1016/j.ijcard.2018.08.079.
34. Hall C. NT-ProBNP: the mechanism behind the marker. J Card Fail. 2005;11(5 Suppl):S81-3. doi:10.1016/j.cardfail.2005.04.019.
35. Gopalan D, Delcroix M, Held M. Diagnosis of chronic thromboembolic pulmonary hypertension.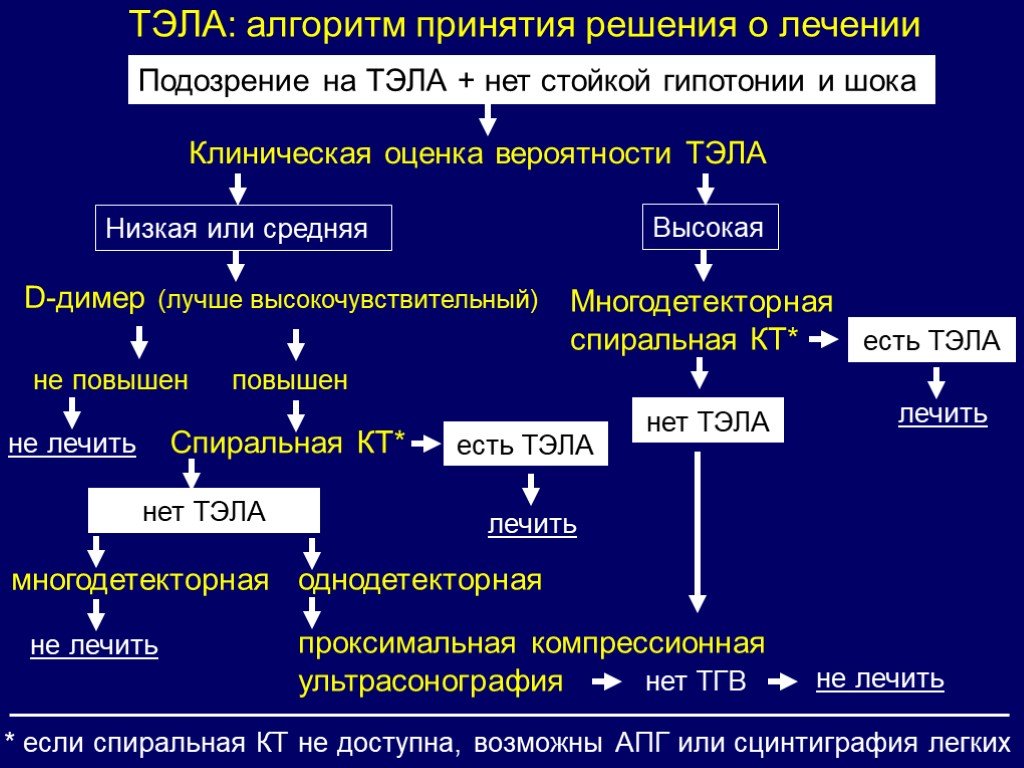 Eur Respir Rev. 2017;26:160108. doi:10.1183/16000617.0108-2016.
Eur Respir Rev. 2017;26:160108. doi:10.1183/16000617.0108-2016.
36. Delcroix M, Lang I, Pepke-Zaba J, et al. Long-term outcome of patients with chronic thromboembolic pulmonary hypertension: results from an international prospective registry. Circulation. 2016;133:859-71. doi:10.1161/CIRCULATIONAHA.115.016522.
37. Инструкция по медицинскому применению лекарственного препарата Адемпас® (ЛП-002639) Доступно по ссылке: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=bcc1261c-9c93-4a15-ada6-b72604f247fd&t=.
38. Ghofrani HA, D’Armini AM, Grimminger F, et al.; CHEST-1 Study Group. Riociguat for the treatment of chronic thromboembolic pulmonary hypertension. N Engl J Med. 2013;369(4):319-29. doi:10.1056/NEJMoa1209657.
39. Simonneau G, D’Armini AM, Ghofrani HA, et al. Predictors of long-term outcomes in patients treated with riociguat for chronic thromboembolic pulmonary hypertension: data from the CHEST-2 open-label, randomised, long-term extension trial. Lancet Respir Med. 2016;4(5):372-80. doi:10.1016/S2213-2600(16)30022-4.
Lancet Respir Med. 2016;4(5):372-80. doi:10.1016/S2213-2600(16)30022-4.
40. Ghofrani HA, Gomez Sanchez MA, Humbert M, et al. Riociguat treatment in patients with chronic thromboembolic pulmonary hypertension: Final safety data from the EXPERT registry. Respir Med. 2020;178:106220. doi:10.1016/j.rmed.2020.106220.
41. Lang I, Meyer BC, Ogo T, et al. Balloon pulmonary angioplasty in chronic thromboembolic pulmonary hypertension. Eur Respir Rev. 2017;26:160119. doi:10.1183/16000617.0119-2016.
42. Ueda J, Ogo T, Asano R, et al. P2597 Riociguat as a bridge therapy for balloon pulmonary angioplasty in patients with severe chronic thromboembolic pulmonary hypertension. European Heart Journal. 2017;38(Issue suppl_1):ehx502.P2597. doi:10.1093/eurheartj/ehx502.P2597.
43. Wiedenroth CB, Ghofrani HA, Miriam SD, et al. Sequential treatment with riociguat and balloon pulmonary angioplasty for patients with inoperable chronic thromboembolic pulmonary hypertension. Pulmonary Circulation. 2018;8(3):2045894018783996. doi:10.1177/2045894018783996.
2018;8(3):2045894018783996. doi:10.1177/2045894018783996.
Хроническая тромбоэмболическая легочная гипертензия: современный взгляд на проблему
Эпидемиология. Патогенез
Одним из важнейших направлений научных работ Е.И. Чазова было изучение тромбозов и эмболий, в частности тромбоэмболии легочной артерии (ТЭЛА). В монографии «Очерки неотложной кардиологии» [1] Е.И. Чазов точно описывает картину этой болезни, используя яркие клинические примеры, определяет сложности дифференциальной диагностики ТЭЛА.
В книге «Тромбозы и эмболии в клинике внутренних болезней» [2] Е.И. Чазов определяет тромбозы и эмболии легочной артерии как одну из актуальных проблем терапевтической клиники.
В работе приводятся эпидемиологические данные по ТЭЛА, описываются ее клиника и диагностика, упоминаются возможные механизмы развития болезни.
В монографии также ставится вопрос о связи ТЭЛА и хронической тромбоэмболической легочной гипертензии (ХТЭЛГ): «В последнее время многие авторы интенсивно изучают проблемы возникновения легочного сердца и гипертонии малого круга кровообращения. Появляются сообщения, что подобные состояния могут развиваться как хронический процесс в результате повторных эмболий или тромбозов в мелких ветвях легочной артерии. Возникает даже предположение, что этот процесс оказывает значительное влияние на возникновение и течение болезни Аэрца, одним из характерных симптомов которого является гипертония малого круга кровообращения… Мы полагаем, что тромбоэмболии мелких ветвей легочной артерии имеют известное значение для развития первичной легочной гипертонии, однако этот вопрос требует дальнейшего исследования».
Появляются сообщения, что подобные состояния могут развиваться как хронический процесс в результате повторных эмболий или тромбозов в мелких ветвях легочной артерии. Возникает даже предположение, что этот процесс оказывает значительное влияние на возникновение и течение болезни Аэрца, одним из характерных симптомов которого является гипертония малого круга кровообращения… Мы полагаем, что тромбоэмболии мелких ветвей легочной артерии имеют известное значение для развития первичной легочной гипертонии, однако этот вопрос требует дальнейшего исследования».
Сейчас многие предположения и суждения, высказанные более 40 лет тому назад Е.И. Чазовым, представляются упрощенными. Но тот фундамент, который был заложен в этих работах, послужил основой дальнейших исследований в данном направлении.
Работы по ХТЭЛГ активно продолжаются в НИИ клинической кардиологии им. А.Л. Мясникова ФГБУ НМИЦ кардиологии МЗ РФ.
Далее приводится современное представление о ХТЭЛГ, ее эпидемиологии, патогенезе, диагностике и основных подходах к лечению.
ХТЭЛГ — прекапиллярная форма легочной гипертензии (ЛГ), которая согласно современной классификации наряду с другими обструкциями легочной артерии (опухоли, сосудистые аномалии, эмболы) относится к IV группе ЛГ [3].
Точных эпидемиологических данных о распространенности ХТЭЛГ как в нашей стране, так и в мире в настоящее время нет. Среди всех форм ЛГ форма ХТЭЛГ встречается в 1,5—3% случаев [3]. Уникальность ХТЭЛГ в том, что она является потенциально излечимой формой ЛГ, поскольку имеет хороший функциональный и гемодинамический эффект при своевременном и успешно проведенном хирургическом лечении.
Принято считать, что чаще всего ХТЭЛГ представляет собой позднее осложнение острой ТЭЛА. По данным международного исследования, у 75% пациентов с ХТЭЛГ имел место в анамнезе как минимум один эпизод зарегистрированной ТЭЛА [4]. В 56% случаев причиной острой ТЭЛА послужил тромбоз глубоких вен нижних конечностей [5]. В 50% случаев после перенесенной острой ТЭЛА, на фоне адекватной антикоагулянтной терапии полного лизирования тромботических масс не происходит, это подтверждается данными сцинтиграфии легких, демонстрирующими наличие стойких дефектов перфузии [6].
Обструкция ветвей легочной артерии тромботическими массами и вторичные изменения микроциркуляторного русла легких приводят к повышению легочного сосудистого сопротивления (ЛСС) и давления в легочной артерии (ДЛА), что в свою очередь способствует развитию тяжелой дисфункции правых отделов сердца с формированием на начальных этапах изолированной правожелудочковой сердечной недостаточности, а при запущенном течении заболевания — бивентрикулярной сердечной недостаточности, которая и определяет крайне неблагоприятный прогноз у этой категории больных [11].
В большинстве исследований переоценивается встречаемость ХТЭЛГ после перенесенного эпизода острой ТЭЛА. Одной из причин такой переоценки является то, что многие пациенты на момент впервые диагностированного эпизода ТЭЛА уже имели ХТЭЛГ. Также в большинстве исследований ХТЭЛГ была диагностирована спустя несколько месяцев после эпизода острой ТЭЛА, что не характерно для данного заболевания, поскольку, как правило, ХТЭЛГ развивается после так называемого светлого промежутка — периода бессимптомного течения заболевания, который чаще всего длится несколько лет.

Согласно Европейскому регистру ХТЭЛГ в среднем от момента появления первых признаков заболевания до постановки диагноза проходит 1 год. В первую очередь это связано с неспецифичностью первых признаков заболевания: развивающаяся у пациента одышка, снижение толерантности к физическим нагрузкам могут быть проявлениями большого количества заболеваний, а отсутствие настороженности врачей первого звена приводят к задержке в постановке правильного диагноза.
На сегодняшний день существует немалое количество теорий, пытающихся объяснить причину неполного лизирования тромботических масс, однако ни одна из них не может полностью раскрыть патогенез данного процесса [13, 14].
Известно, что при развитии определенных клинических состояний наблюдается повышение активности тромбоцитов, что в свою очередь предрасполагает к патологическому тромбообразованию и формированию ХТЭЛГ. При сравнении 433 пациентов с ХТЭЛГ и 254 пациентов с другими формами ЛГ, такими как наличие внутрисердечных шунтов, инфицированные кардиостимуляторы, спленэктомия, предшествующий тромбоз вен нижних конечностей (особенно рецидивирующее течение), не 0 (I) группа крови, наличие волчаночного антикоагулянта/антифосфолипидных антител, заместительная гормональная терапия щитовидной железы и наличие в анамнезе злокачественных новообразований, а также аутоиммунные заболевания и заболевания крови врожденного и приобретенного характера, были обозначены как факторы, повышающие риск развития ХТЭЛГ [15—17]. Также по результатам нескольких исследований было высказано предположение, что при эмболии крупными тромбоэмболами, при рецидивирующей ТЭЛА происходит истощение физиологической фибринолитической системы, ее активности не хватает для полного лизирования сгустков [10, 18]. Такая своего рода неполноценность физиологической фибринолитической системы вызывает подозрение в отношении наличия врожденной склонности к гиперкоагуляционным состояниям вследствие врожденной патологии системы гемостаза. Однако известно, что такие классические тромбофилии, как дефицит протеина С, S и дефицит антитромбина III, а также мутации фактора V и II, у пациентов с ХТЭЛГ встречаются не чаще, чем в здоровой популяции [17]. Лишь повышенный уровень антифосфолипидных антител и волчаночного антикоагулянта были зарегистрированы у пациентов с ХТЭЛГ чаще, чем у пациентов с идиопатической ЛАГ. По данным других исследований, у 41% пациентов с ХТЭЛГ наблюдались повышенные уровни фактора свертывания VIII, фактора фон Виллебранда, адгезивного гликопротеина, который стабилизирует и активирует фактор VIII [19].
Также по результатам нескольких исследований было высказано предположение, что при эмболии крупными тромбоэмболами, при рецидивирующей ТЭЛА происходит истощение физиологической фибринолитической системы, ее активности не хватает для полного лизирования сгустков [10, 18]. Такая своего рода неполноценность физиологической фибринолитической системы вызывает подозрение в отношении наличия врожденной склонности к гиперкоагуляционным состояниям вследствие врожденной патологии системы гемостаза. Однако известно, что такие классические тромбофилии, как дефицит протеина С, S и дефицит антитромбина III, а также мутации фактора V и II, у пациентов с ХТЭЛГ встречаются не чаще, чем в здоровой популяции [17]. Лишь повышенный уровень антифосфолипидных антител и волчаночного антикоагулянта были зарегистрированы у пациентов с ХТЭЛГ чаще, чем у пациентов с идиопатической ЛАГ. По данным других исследований, у 41% пациентов с ХТЭЛГ наблюдались повышенные уровни фактора свертывания VIII, фактора фон Виллебранда, адгезивного гликопротеина, который стабилизирует и активирует фактор VIII [19].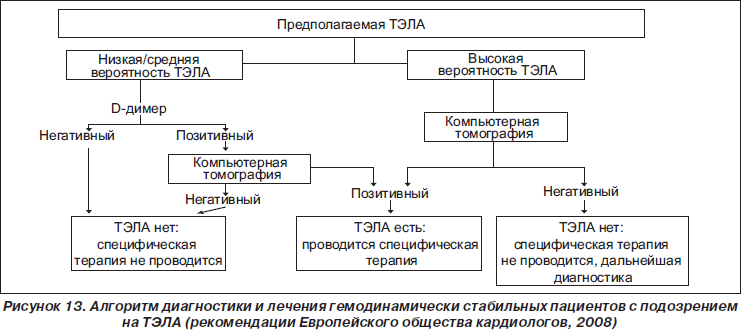 Также при ХТЭЛГ, по-видимому, имеют место аномалии в строении молекул фибриногена [20—22], сопровождающиеся модификацией структуры фибрина и самого сгустка, что проявляется резистентностью к физиологическому тромболизису и, таким образом, замедляет процесс разрешения тромботических масс. В исследовании, в котором проводилось сравнение фибриногена больных ХТЭЛГ со здоровой группой контроля, было показано, что фибриноген больных ХТЭЛГ более резистентен к плазминопосредованному лизису. Исследователи предположили, что это связано с измененной структурой фибрина и/или фибриногена. Помимо этого, измененная структура фибриногена была обнаружена и в сосудистой стенке легочной артерии, что, по мнению авторов, может влиять на переход острой ТЭЛА в ХЭТЛГ [22]. Еще в одном исследовании изучалась роль активируемого тромбином ингибитора фибринолиза. Уровень данного показателя был значительно повышен у пациентов с ХТЭЛГ, чем у больных легочной артериальной гипертензией и группой контроля, и коррелировал с резистентностью тромба к лизису, что демонстрирует значительную роль этого показателя в патогенезе заболевания [23].
Также при ХТЭЛГ, по-видимому, имеют место аномалии в строении молекул фибриногена [20—22], сопровождающиеся модификацией структуры фибрина и самого сгустка, что проявляется резистентностью к физиологическому тромболизису и, таким образом, замедляет процесс разрешения тромботических масс. В исследовании, в котором проводилось сравнение фибриногена больных ХТЭЛГ со здоровой группой контроля, было показано, что фибриноген больных ХТЭЛГ более резистентен к плазминопосредованному лизису. Исследователи предположили, что это связано с измененной структурой фибрина и/или фибриногена. Помимо этого, измененная структура фибриногена была обнаружена и в сосудистой стенке легочной артерии, что, по мнению авторов, может влиять на переход острой ТЭЛА в ХЭТЛГ [22]. Еще в одном исследовании изучалась роль активируемого тромбином ингибитора фибринолиза. Уровень данного показателя был значительно повышен у пациентов с ХТЭЛГ, чем у больных легочной артериальной гипертензией и группой контроля, и коррелировал с резистентностью тромба к лизису, что демонстрирует значительную роль этого показателя в патогенезе заболевания [23].
Наряду с вышеперечисленным еще одним ключевым механизмом в разрешении тромботических масс является неоангиогенез. В образцах сгустков, полученных после тромбэндартерэктомии (ТЭЭ), было обнаружено, что ангиогенез у пациентов с ХТЭЛГ был неполноценным, что также было доказано на экспериментальных моделях [24, 25].
Эндотелиальная дисфункция и ремоделирование сосудов малого круга кровообращения при ХТЭЛГМеханическая окклюзия легочной артерии тромботическими массами — это не единственный механизм формирования ЛГ при ХТЭЛГ. У всех пациентов с ХТЭЛГ имеет место в разной степени выраженная микроваскулопатия, которая представляет собой своего рода диффузный спазм дистального легочного русла с диаметром артерии около 0,1—0,5 мм вследствие высвобождения из тромбоцитов и эндотелия вазоконстрикторных и прокоагуляционных веществ [3]. Впервые данная патология была описана K. Мoser и C. Bloor при изучении гистологических образцов легочной ткани больных Л. Г. Исследователи наблюдали утолщение интимы и ремоделирование сосудов малого круга кровообращения в виде эксцентрического фиброза интимы, фиброзно-мышечной пролиферации интимы и плексиформные поражения [26, 27]. Такое же поражение было замечено ранее у пациентов с идиопатической ЛАГ, что и послужило основанием для использования препаратов, одобренных для лечения идиопатической ЛАГ при ХТЭЛГ.
Г. Исследователи наблюдали утолщение интимы и ремоделирование сосудов малого круга кровообращения в виде эксцентрического фиброза интимы, фиброзно-мышечной пролиферации интимы и плексиформные поражения [26, 27]. Такое же поражение было замечено ранее у пациентов с идиопатической ЛАГ, что и послужило основанием для использования препаратов, одобренных для лечения идиопатической ЛАГ при ХТЭЛГ.
В литературе такие изменения объясняются как результат перераспределения легочного кровотока между непораженными тромбами легочными артериями. Под действием непривычно высокого давления и напряжения возникают эндотелиальная дисфункция и ремоделирование сосудов малого круга кровообращения, что приводит к прогрессированию заболевания, постепенному увеличению ДЛА и ЛСС. Тем не менее эта микроваскулопатия наблюдается не только в непораженных областях легкого, но и в дистальных сегментах окклюзированных артерий, что нельзя объяснить простым перераспределением кровотока. В исследовании Р. Dorfmüller и соавт. [28] обнаружили, что у пациентов с ЛГ существуют анастомозы между системным и легочным кругами кровообращения (через бронхиальные артерии). Исследователи предположили, что данный вид компенсации формируется для поддержания перфузии в ишемизированном участке (зона кровоснабжения тромбированной легочной артерии), а как было указано выше, воздействие высокого системного артериального давления на легочное сосудистое русло приводит к эндотелиальной дисфункции и ремоделированию сосудов малого круга кровообращения. Продолжающееся ремоделирование сосудов малого круга кровообращения в конечном счете может привести к тромбообразованию in situ [29].
[28] обнаружили, что у пациентов с ЛГ существуют анастомозы между системным и легочным кругами кровообращения (через бронхиальные артерии). Исследователи предположили, что данный вид компенсации формируется для поддержания перфузии в ишемизированном участке (зона кровоснабжения тромбированной легочной артерии), а как было указано выше, воздействие высокого системного артериального давления на легочное сосудистое русло приводит к эндотелиальной дисфункции и ремоделированию сосудов малого круга кровообращения. Продолжающееся ремоделирование сосудов малого круга кровообращения в конечном счете может привести к тромбообразованию in situ [29].
Чаще всего тяжелое диффузное дистальное поражение легочного русла подозревается, когда степень механической непроходимости легочных артерий не соотносится с показателями ЛСС [30]. Такие больные имеют более высокий риск периоперационных и послеоперационных осложнений при проведении ТЭЭ из ветвей легочной артерии и большую вероятность сохранения резидуальной ЛГ [31—33].
Известно, что развитие выраженной микроваскулопатии ограничивает эффективность не только хирургического лечения, но также и эндоваскулярного лечения методом транслюминальной баллонной ангиопластики легочных артерий (ТЛА).
Таким образом, для возможности контроля за течением заболевания необходимо выявлять и лечить ХТЭЛГ до развития необратимого ремоделирования дистального легочного русла.
Диагностика ХТЭЛГДля определения тактики лечения в первую очередь необходима правильная, своевременная диагностика [3] (рис. 1). Рис. 1. Диагностический алгоритм при подозрении на наличие ХТЭЛГ.
Диагноз ХЭТЛГ устанавливается при выявлении следующих показателей, полученных как минимум через 3 мес после начала оптимальной антикоагулянтной терапии, если:
1. Среднее давление в легочной артерии 25 мм рт.ст. и выше при давлении заклинивания в легочной артерии (ДЗЛА) 15 мм рт.ст. и ниже.
2. Легочное сосудистое сопротивление более 2 Ед. Вуда (160 дин. с/см5).
Вуда (160 дин. с/см5).
3. Как минимум один сегментарный дефект перфузии по данным вентиляционно-перфузионной сцинтиграфии легких или обструкция ветвей легочной артерии по данным мультиспиральной компьютерной томографии ангиографии или инвазивной ангиопульмонографии, которая является «золотым стандартом» визуализации легочного артериального русла [3].
Характерными для ХТЭЛГ являются поражения легочных артерий в виде хронических окклюзий (мешотчатые и клиновидные поражения), кольцевидных стенозов, внутрисосудистых структур в виде мембран и перемычек. В зависимости от патологических изменений в легочном сосудистом русле поражение можно разделить на проксимальный тип — технически операбельная форма ХТЭЛГ, и дистальный тип — поражение на сегментарном уровне и микроваскулярное поражение, которые считаются неоперабельными [3].
Помимо преимущественной локализации тромботических масс в легочном сосудистом русле при определении операбельности пациента, чрезвычайно важным являются показатели центральной гемодинамики. Известно, что при ЛСС более 1200 дин. с/см5 операция двусторонней ТЭЭ сопровождается большей частотой осложнений и имеет более высокий риск летальности [30].
Известно, что при ЛСС более 1200 дин. с/см5 операция двусторонней ТЭЭ сопровождается большей частотой осложнений и имеет более высокий риск летальности [30].
Оценка операбельности пациента должна проводиться в экспертном центре мультидисциплинарной комиссией с обязательным участием кардиолога, сердечно-сосудистого хирурга, имеющего опыт проведения операций ТЭЭ, и специалиста по рентгенэндоваскулярной диагностике и лечению [3].
Молекулярные механизмы развития ХТЭЛГ. Точки воздействия патогенетической терапииПри изучении молекулярных механизмов развития ЛГ при ХТЭЛГ выявлено, что дефицит оксида азота (NO), простациклина, а также повышенная продукция эндотелина-1 являются основными звеньями патогенеза заболевания [31]. По результатам исследований одним из важных на сегодняшний день видится путь NO [34, 35]. Эндогенный NO образуется из L-аргинина при помощи кальций-зависимой NO-синтазы, под действием которой происходит окисление L-аргинина до L-цитруллина, NO и воды [36]. В здоровом организме NO играет ключевую роль в поддержании вентиляционно-перфузионного соотношения в легких за счет снижения уровня NO в областях с низкой вентиляцией, что приводит к вазоконстрикции и увеличению уровня NO в областях с повышенной вентиляцией, что приводит к вазодилатации. В конечном счете перераспределение кровотока в хорошо вентилируемые участки легкого обеспечивает эффективную оксигенацию. Известно, что NO регулирует расширение легочных сосудов, активируя растворимую гуанилатциклазу в гладкомышечных клетках артерий и повышая уровень цГМФ, приводит к снижению тонуса сосудов. Помимо этого, цГМФ обладает антипролиферативными и антифиброзирующими эффектами [37].
В здоровом организме NO играет ключевую роль в поддержании вентиляционно-перфузионного соотношения в легких за счет снижения уровня NO в областях с низкой вентиляцией, что приводит к вазоконстрикции и увеличению уровня NO в областях с повышенной вентиляцией, что приводит к вазодилатации. В конечном счете перераспределение кровотока в хорошо вентилируемые участки легкого обеспечивает эффективную оксигенацию. Известно, что NO регулирует расширение легочных сосудов, активируя растворимую гуанилатциклазу в гладкомышечных клетках артерий и повышая уровень цГМФ, приводит к снижению тонуса сосудов. Помимо этого, цГМФ обладает антипролиферативными и антифиброзирующими эффектами [37].
Несмотря на достигнутые в лечении ЛГ успехи, применение аналогов простациклина, антагонистов рецептора эндотелина, ингибиторов фосфодиэстеразы (ИФЭС) 5-го типа и их комбинаций не позволило в полной мере контролировать течение заболевания, а применение вдыхаемого NO и его донаторов было малоэффективным для долгосрочной терапии ввиду быстрого разрушения и развития толерантности. Вот почему необходимость в селективном, не зависящем от уровня NO вазодилататоре была так очевидна.
Вот почему необходимость в селективном, не зависящем от уровня NO вазодилататоре была так очевидна.
ИФЭС 5-го типа силденафил увеличивает эффекты эндогенного NO, повышая уровни цГМФ, однако большая часть пациентов с ЛГ не реагируют на лечение силденафилом в связи с крайне низким уровнем эндогенного NO, который на таком уровне не может повлиять на цГМФ в достаточной степени [38].
Прямая NO-независимая стимуляция рГЦ была впервые продемонстрирована в 1994 г., когда F. Ko и соавт. сообщили о цГМФ-стимулирующих свойствах бензилиндазола YC-1. В последующем были разработаны более эффективные два класса стимуляторов цГМФ: стимуляторы гуанилатциклазы или гем-зависимые активаторы (BAY 41−2272, BAY 41−8543, BAY 63−2521, риоцигуат) с пиразолопиридинилпиримидиновым ядром и стимуляторы гуанилатциклазы или гем-независимые активаторы (BAY 58−2667, цинацигуат, HMR-1766, атацигуат) [39, 40]. Каждый из указанных классов лекарственных препаратов продемонстрировал позитивные эффекты на экспериментальных моделях ЛГ, однако различные фармакокинетические эффекты, например ингибирование и индукция изоферментов цитохрома P450, не позволили BAY 41−2272 и BAY 41−8543 пройти доклинические испытания. В настоящее время для пациентов с неоперабельной формой ХТЭЛГ существует доказанная эффективная медикаментозная терапия. Препарат выбора риоцигуат повышает биосинтез цГМФ посредством прямой стимуляции и путем повышения чувствительности фермента в условиях низких концентраций эндогенного NO [41]. Наличие двойного действия в стимуляции рГЦ сделало риоцигуат более эффективным по сравнению с ИФДЭ-5. Другие классы препаратов, такие как ИФДЭ-5, антагонисты рецептора эндотелина и простаноиды, упоминаются в действующих рекомендациях с классом IIb [33]. В табл. 1 указан Таблица 1. Исследования, посвященные изучению эффективности патогенетической терапии при ХТЭЛГ Примечание. ФК — функциональный класс; СИ — сердечный индекс; СВ — сердечный выброс. список исследований, посвященных изучению эффективности патогенетической терапии при ХТЭЛГ [42].
В настоящее время для пациентов с неоперабельной формой ХТЭЛГ существует доказанная эффективная медикаментозная терапия. Препарат выбора риоцигуат повышает биосинтез цГМФ посредством прямой стимуляции и путем повышения чувствительности фермента в условиях низких концентраций эндогенного NO [41]. Наличие двойного действия в стимуляции рГЦ сделало риоцигуат более эффективным по сравнению с ИФДЭ-5. Другие классы препаратов, такие как ИФДЭ-5, антагонисты рецептора эндотелина и простаноиды, упоминаются в действующих рекомендациях с классом IIb [33]. В табл. 1 указан Таблица 1. Исследования, посвященные изучению эффективности патогенетической терапии при ХТЭЛГ Примечание. ФК — функциональный класс; СИ — сердечный индекс; СВ — сердечный выброс. список исследований, посвященных изучению эффективности патогенетической терапии при ХТЭЛГ [42].
С начала 60-х годов ХХ века и по сегодняшний день «золотым стандартом» лечения ХТЭЛГ остается операция двусторонней ТЭЭ, которая при успешном выполнении, помимо нормализации гемодинамических параметров и улучшения функционального статуса, позволяет обеспечить 5-летнюю выживаемость на уровне 74—89% [42, 43]. По данным J. Lewczuk и соавт., 2-летняя выживаемость больных с ХТЭЛГ при срДЛА более 30 мм рт.ст., при отсутствии хирургического лечения составляет 12% [44].
По данным J. Lewczuk и соавт., 2-летняя выживаемость больных с ХТЭЛГ при срДЛА более 30 мм рт.ст., при отсутствии хирургического лечения составляет 12% [44].
Учитывая технические особенности операции, показатель смертности в центре, где проводятся подобного рода вмешательства, не должен превышать 5% [43, 45]. К сожалению, не только недостаточные оснащенность и профессионализм специалистов центра являются ограничениями для проведения оперативного лечения. По данным международного регистра, только 63% пациентов с ХТЭЛГ признаются операбельными [46], оставшиеся 37% по решению междисциплинарной комиссии имеют неоперабельную форму, чаще всего к ним относят больных с дистальным типом поражения легочных сосудов, а также с тяжелой сопутствующей патологией [47, 48].
Высокий уровень смертности больных с ХТЭЛГ, признанных неоперабельными, и стремительное развитие эндоваскулярных методов лечения привели к появлению нового альтернативного метода лечения ХТЭЛГ — ТЛА. В 1988 г. Voorburg и соавт. впервые доложили об эффективном эндоваскулярном вмешательстве на легочных артериях у больного 30 лет с ХТЭЛГ. После поэтапной ангиопластики легочных артерий отмечалось снижение срДЛА с 46 до 35 мм рт.ст. В последующем к данном методу лечения вернулись лишь в 2001 г. Feinstein и соавт. Исследователи продемонстрировали хорошие результаты в улучшении гемодинамических параметров и функционального статуса у 18 пациентов с ХТЭЛГ. Однако количество жизнеугрожающих осложнений, таких как реперфузионный отек легких, который развился у 11 из 18 больных, и перфорация легочной артерии, приведшая к летальному исходу, не позволили методу на тот момент внедриться в повседневную клиническую практику. Спустя 10 лет японские ученые возродили данный метод лечения, усовершенствовав технику выполнения процедуры, разработав целый алгоритм подготовки больных перед эндоваскулярным лечением [49—51].
впервые доложили об эффективном эндоваскулярном вмешательстве на легочных артериях у больного 30 лет с ХТЭЛГ. После поэтапной ангиопластики легочных артерий отмечалось снижение срДЛА с 46 до 35 мм рт.ст. В последующем к данном методу лечения вернулись лишь в 2001 г. Feinstein и соавт. Исследователи продемонстрировали хорошие результаты в улучшении гемодинамических параметров и функционального статуса у 18 пациентов с ХТЭЛГ. Однако количество жизнеугрожающих осложнений, таких как реперфузионный отек легких, который развился у 11 из 18 больных, и перфорация легочной артерии, приведшая к летальному исходу, не позволили методу на тот момент внедриться в повседневную клиническую практику. Спустя 10 лет японские ученые возродили данный метод лечения, усовершенствовав технику выполнения процедуры, разработав целый алгоритм подготовки больных перед эндоваскулярным лечением [49—51].
С 2015 г. Европейским обществом кардиологов и Европейским респираторным обществом ТЛА при дистальном типе поражения введена в структуру алгоритма лечения ХТЭЛГ с классом рекомендаций IIb.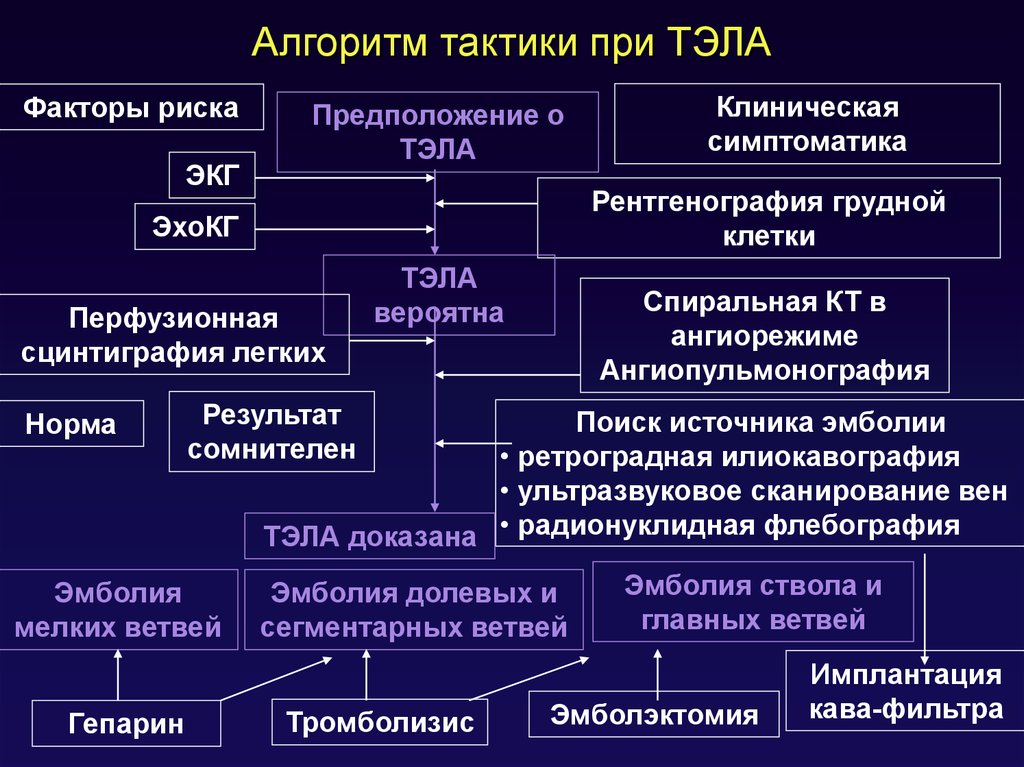 На сегодняшний день во всем мире ежегодно выполняется большое количество эндоваскулярных вмешательств на легочных артериях. Список наиболее крупных исследований в период с 2001 по 2017 г. представлен в табл. 2 [52]. Таблица 2. Список наиболее крупных исследований по изучению ТЛА
На сегодняшний день во всем мире ежегодно выполняется большое количество эндоваскулярных вмешательств на легочных артериях. Список наиболее крупных исследований в период с 2001 по 2017 г. представлен в табл. 2 [52]. Таблица 2. Список наиболее крупных исследований по изучению ТЛА
Согласно данным литературы, количество периоперационных и послеоперационных осложнений при выполнении ТЛА в среднем составляет 10—52% [53]. Такое относительно немалое количество осложнений объясняется особенностью строения сосудистой стенки легочной артерии. Более тонкая и более растяжимая легочная артерия при неаккуратном манипулировании катетером или баллоном может перфорироваться, привести к реперфузионному отеку.
При анализе всех опубликованных на сегодняшний день результатов, 30-дневная смертность больных, прошедших процедуру ТЛА, составила от 0 до 14,3% [52]. Отдаленные результаты шести исследований показали, что показатели 2-летней выживаемости пациентов после ТЛА составили от 89 до 100%. По данным того же обзора, 2-летняя смертность пациентов, прошедших ТЛА, и пациентов на медикаментозной терапии составила 1,3% против 13,2% соответственно, при этом не было значительной разницы в 2-летней смертности пациентов, прошедших ТЛА и ТЭЭ (2,1% против 4,8% соответственно) [54, 55].
По данным того же обзора, 2-летняя смертность пациентов, прошедших ТЛА, и пациентов на медикаментозной терапии составила 1,3% против 13,2% соответственно, при этом не было значительной разницы в 2-летней смертности пациентов, прошедших ТЛА и ТЭЭ (2,1% против 4,8% соответственно) [54, 55].
При изучении всех возникших при проведении ТЛА осложнений обнаружено, что кровоизлияния в паренхиму легких возникли в 17,8%, кровохарканье — в 14,0%, перфорация легочной артерии — в 2,9%. В 5,5% случаев пациенты нуждались в проведении инвазивной вентиляции легких [56—64].
По результатам многоцентрового ретроспективного анализа данных ТЛА в 7 лечебных учреждениях Японии (308 пациентов, 1408 сессий, в среднем одному пациенту было выполнено 4 вмешательства) гемодинамические показатели значительно улучшились у 249 пациентов [65]. По данным КПОС, достигнутые результаты сохранялись без отрицательной динамики и в отдаленном периоде (до ТЛА срДЛА составило 43,2±11,0 мм рт.ст., после последней процедуры ТЛА — 24,3±6,4 мм рт. ст., в отдаленном периоде — 22,5±5,4 мм рт.ст.). В большинстве отчетов по ТЛА, в которые были включены более 10 пациентов, указывается, что в среднем показатели срДЛА снижаются на 10—20 мм рт.ст. от исходного уровня после проведения 4—5 процедур ТЛА. Нельзя не отметить тот факт, что все пациенты получали как минимум один патогенетический препарат и терапию кислородом [65].
ст., в отдаленном периоде — 22,5±5,4 мм рт.ст.). В большинстве отчетов по ТЛА, в которые были включены более 10 пациентов, указывается, что в среднем показатели срДЛА снижаются на 10—20 мм рт.ст. от исходного уровня после проведения 4—5 процедур ТЛА. Нельзя не отметить тот факт, что все пациенты получали как минимум один патогенетический препарат и терапию кислородом [65].
Уменьшить количество наиболее частого осложнения — реперфузионного отека легких — удалось после разработки индекса PEPSI (Pulmonary Edema Predictive Scoring Index), расчет которого позволяет оценить риск реперфузионного отека в зависимости от количества открытых сосудов и степени улучшения кровотока по ним [67]. Индекс PEPSI является произведением исходного уровня ЛСС в единицах Вуда (дин·с/см5/80) и степени ожидаемого прироста кровотока после ангиопластики каждой сегментарной артерии. Для обеспечения максимальной безопасности при каждом вмешательстве значение индекса PEPSI не должно превышать 35.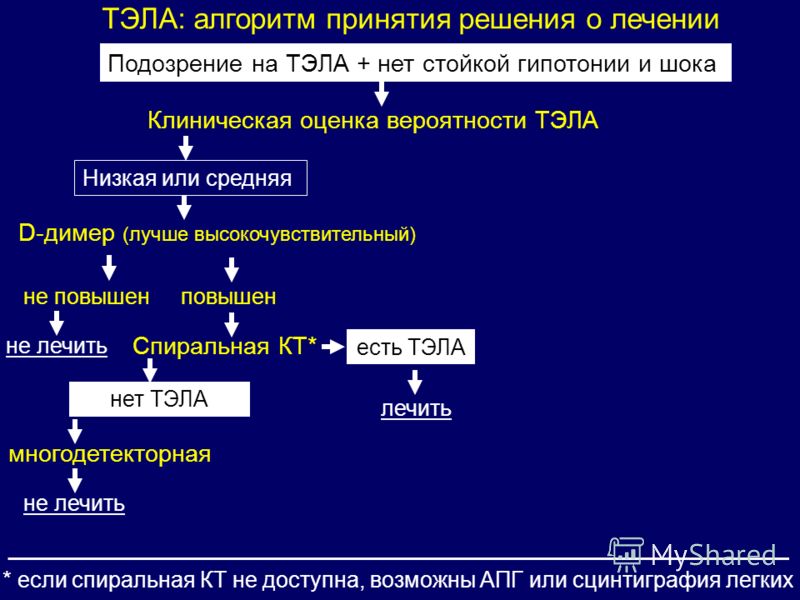 Степень прироста кровотока (∆PFG) аналогична оценке TIMI в коронарных артериях.
Степень прироста кровотока (∆PFG) аналогична оценке TIMI в коронарных артериях.
Согласно публикациям зарубежных исследователей, процедура ТЛА проводится чаще через бедренную вену. В России в ФГБУ НМИЦ кардиологии после разработки Н.М. Даниловым и соавт. [66] доступа через поверхностные вены предплечья для проведения диагностической КПОС и ТЛА используется только данный доступ. Важным преимуществом нового доступа является возможность проведения вмешательства при посттромбофлебитическом синдроме, установленном кава-фильтре и клипированной нижней полой вене.
За последние 5 лет в стратегии и технике проведения ТЛА произошла эволюция. Так, например, ранее японскими авторами рекомендовалось при выполнении процедуры для первого баллонирования использовать баллон, соответствующий размеру легочной артерии, что часто вызывало надрыв интимы легочной артерии с последующими осложнениями в виде кровохарканья. В настоящее время показано, что кровоток в достаточной степени восстанавливается после применения баллонов меньшего диаметра по сравнению с должным диаметром артерии [68].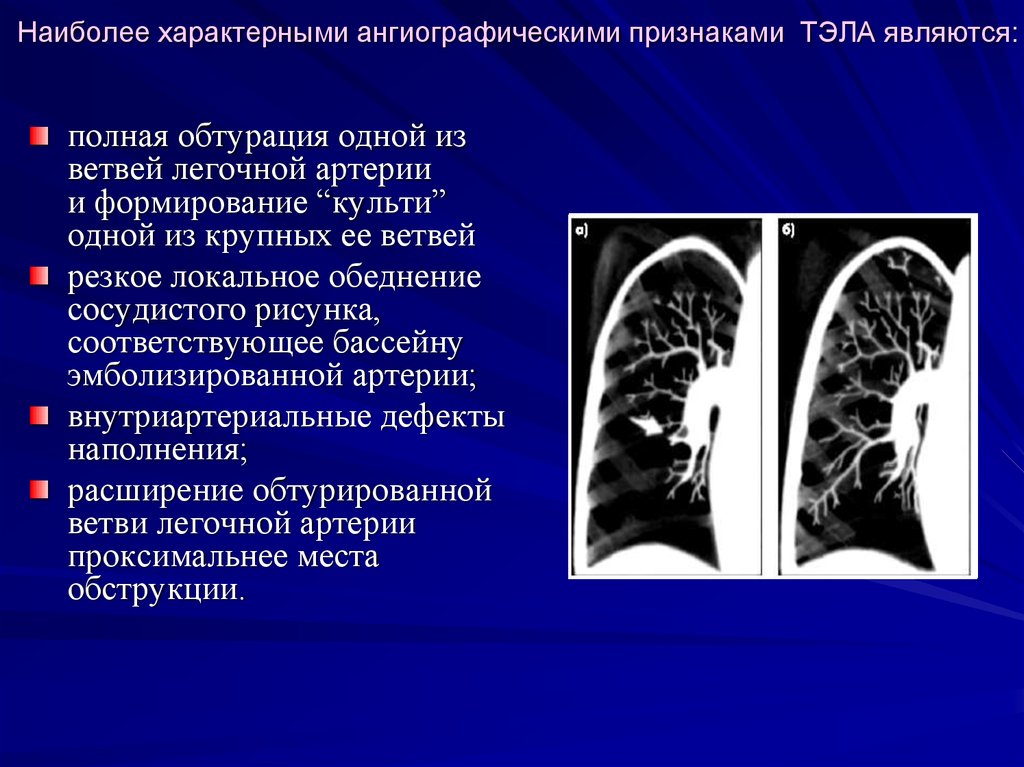 Наряду с этим было показано, что диаметр баллонированного сосуда дополнительно увеличивается с течением времени и в конечном счете градиент давления по обе стороны от пораженного участка выравнивается [69].
Наряду с этим было показано, что диаметр баллонированного сосуда дополнительно увеличивается с течением времени и в конечном счете градиент давления по обе стороны от пораженного участка выравнивается [69].
Считается, что для повышения эффективности и безопасности ТЛА необходимо выбрать оптимальный субстрат (артерию), на котором будет проводиться вмешательство. Для этого была разработана ангиографическая классификация типов поражения легочных артерий (рис. 2) Рис. 2. Ангиографическая классификация по типу поражений легочных артерий. Тип A — кольцеобразное поражение; тип B — поражение по типу сети; тип C — субтотальное поражение; тип D — тотальная окклюзия; тип E — выраженное дистальное поражение. [64].
При изучении типов и характера поражения легочных артерий по данным инвазивной ангиопульмонографии и МСКТ-ангиопульмонографии выяснилось, что частота осложнений и частота успеха от вмешательства напрямую зависит от типа поражения выбранного целевого сосуда. Эффективность была выше, а уровень осложнений был ниже при типах поражения, А и В (кольцеобразное поражение и поражение по типу сети). Ангиопластика тотально окклюзированных сосудов имела наименьший успех, а наибольшее количество осложнений развивалось при лечении субтотального поражения [64].
Ангиопластика тотально окклюзированных сосудов имела наименьший успех, а наибольшее количество осложнений развивалось при лечении субтотального поражения [64].
По мере накопления опыта расширяются и области применения ТЛА. Метод стал применяться у пациентов с резидуальной ЛГ, а также у больных с комбинированным поражением легочных сосудов (проксимальный и дистальный типы поражения легочных артерий). В практику уверенно входит гибридный подход лечения неоперабельной ХТЭЛГ, при котором оперативному лечению предшествует серия ТЛА до необходимого для хирургического вмешательства улучшения гемодинамических показателей. Дополнительными показаниями к ТЛА могут быть неэффективность или невозможность назначения патогенетической медикаментозной терапии. Противопоказаниями к ТЛА служит перечень состояний и сопутствующих заболеваний, лимитирующих любое эндоваскулярное вмешательство с использованием контрастных препаратов (тяжелая почечная недостаточность, аллергия на контрастный препарат, анемия, острый воспалительный процесс и др. ). Следует подчеркнуть, что тяжелая ЛГ, высокое ЛСС, гипоксемия и сниженный сердечный выброс не являются противопоказаниями, а скорее делают ТЛА методом выбора [70].
). Следует подчеркнуть, что тяжелая ЛГ, высокое ЛСС, гипоксемия и сниженный сердечный выброс не являются противопоказаниями, а скорее делают ТЛА методом выбора [70].
Есть немногочисленные данные, сравнивающие различные методы лечения ХТЭЛГ: лекарственную терапию, ТЛА, ТЭЭ. Несмотря на изначально худшие показатели гемодинамики у пациентов, подвергшихся ТЭЭ или ТЛА, по результатам исследования больные имели значительно более высокую выживаемость в течение 5 лет, чем больные, получавшие только медикаментозную терапию (98% против 64% соответственно) [68].
В табл. 3 представлены Таблица 3. Основные исследования, в которых сравнивали 3 метода лечения ХТЭЛГ основные исследования, в которых сравнивали 3 метода лечения ХТЭЛГ [52].
В дополнение к улучшениям в гемодинамике и функциональном статусе на сегодняшний день накоплены данные, указывающие, что ТЛА способствует обратному ремоделированию правых отделов сердца [71].
Таким образом, борьба с последствиями сосудистого тромбоза в малом круге кровообращения продолжается, появляются новые методы лечения и совершенствуются старые. Направление усилий по борьбе с ХТЭЛГ, более четкое понимание механизмов развития данного заболевания, заложенные Евгением Ивановичем Чазовым, позволяют всерьез надеяться на успех в сражении с грозным заболеванием.
Направление усилий по борьбе с ХТЭЛГ, более четкое понимание механизмов развития данного заболевания, заложенные Евгением Ивановичем Чазовым, позволяют всерьез надеяться на успех в сражении с грозным заболеванием.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Чазова Ирина Евгеньевна — Заместитель Генерального директора, директор института клинической кардиологии им. А.Л. Мясникова ФГБУ «НМИЦ Кардиологии» Минздрава России, академик РАН, профессор, д.м.н.
Карабашева Мадина Борисовна — аспирант отдела гипертонии; e-mail: [email protected] (автор, ответственный за переписку)
Данилов Николай Михайлович — д.м.н., ст. научный сотрудник отдела гипертонии
Матчин Юрий Георгиевич — д.м.н., руководитель лаборатории рентгенэндоваскулярных методов диагностики и лечения в амбулаторных условиях
признаков хронического воспаления, которых вы не ожидаете
Медицинский обзор Мелинды Ратини, DO, MS, 11 января 2022 г.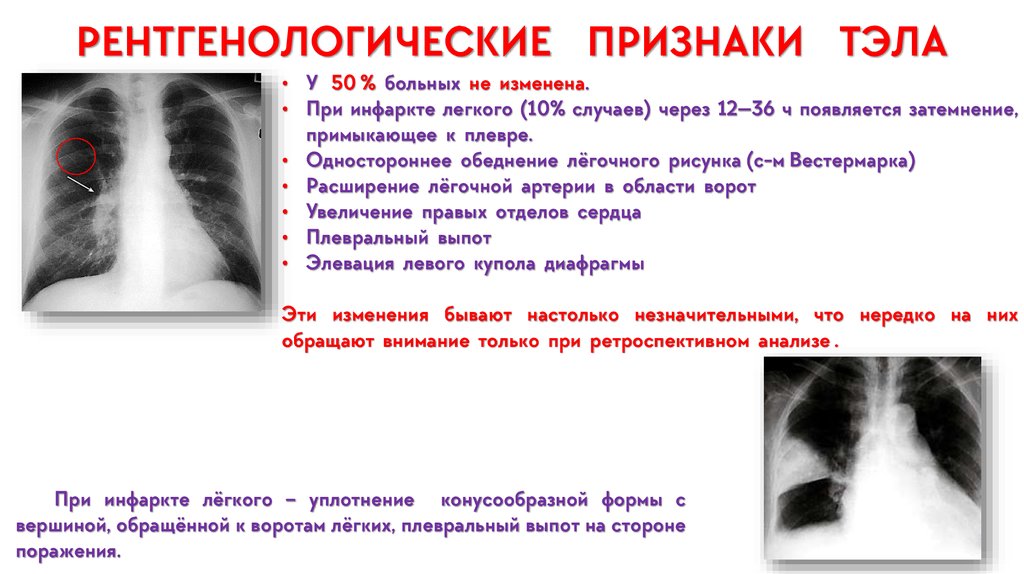 Например, при рассеянном склерозе иммунная система вашего организма атакует оболочки нервов. Это затрудняет передачу нервных сигналов. Вы можете чувствовать головокружение или потерю равновесия, особенно при ходьбе.
Например, при рассеянном склерозе иммунная система вашего организма атакует оболочки нервов. Это затрудняет передачу нервных сигналов. Вы можете чувствовать головокружение или потерю равновесия, особенно при ходьбе.
Инсулин помогает контролировать уровень сахара в крови. Воспаление может повлиять на то, насколько хорошо работает ваш инсулин. Пока не ясно, почему именно.
Резистентность к инсулину может привести к повышению уровня сахара в крови. Это может повредить ваши нервы и кровеносные сосуды. Это также может привести к диабету. У вас могут покалывать ноги, или вы можете чувствовать жажду и усталость. У вас может не быть симптомов. Ваш врач может помочь вам узнать, что происходит.
Иногда ваша иммунная система ошибочно атакует ваши мышцы и вызывает воспаление (ваш врач может назвать это миозитом). Это может начать разрушать мышечное волокно и сделать вас слабее. Обычно это происходит медленно, чаще всего в туловище, плечах и бедрах. В некоторых случаях вам может быть трудно делать простые вещи, такие как ходьба, купание и глотание.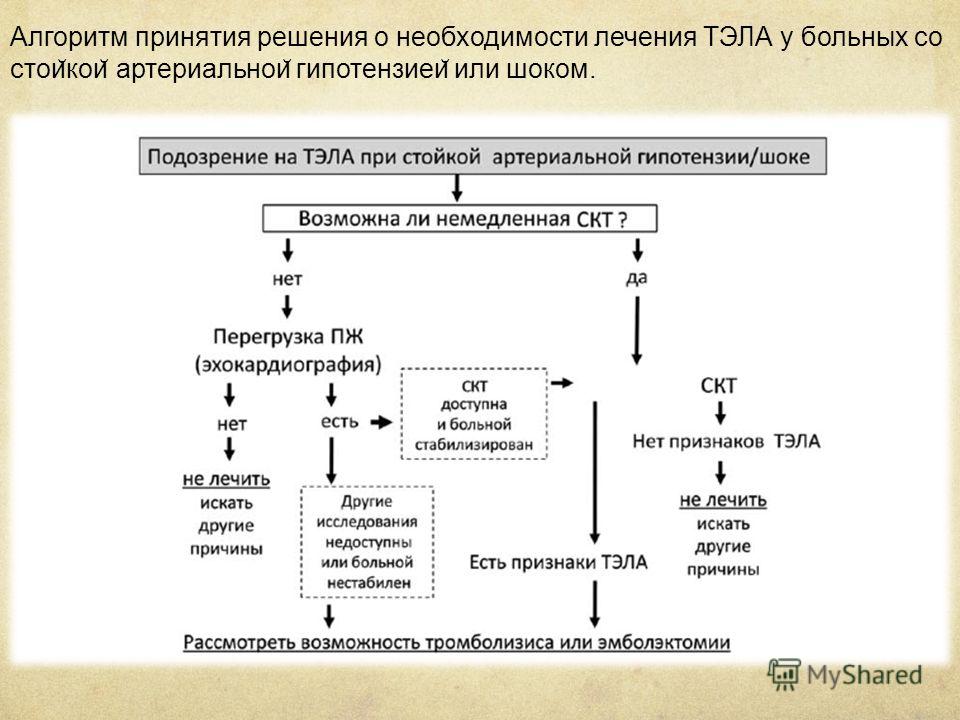
Воспалительное заболевание кишечника, или ВЗК, имеет две основные формы: язвенный колит и болезнь Крона. В обоих случаях ваша иммунная система чрезмерно реагирует и воспаляет толстую и тонкую кишку. Диарея — это то, что может случиться. Другими являются тошнота, боль в суставах, лихорадка и кожная сыпь.
При анкилозирующем спондилите хроническое воспаление обычно поражает позвоночник. Иногда он поражает бедра, шею, колени или грудь. У вас могут быть боли и скованность в нижней части спины, особенно по утрам. В серьезных случаях у вас может быть потеря движения. Поговорите со своим врачом, если заметите какие-либо симптомы. Своевременное лечение может помочь вам лучше контролировать свое состояние.
Это один из типичных признаков длительного воспаления и распространенный признак воспалительных заболеваний, таких как фибромиалгия, рассеянный склероз, волчанка и ревматоидный артрит. Поговорите со своим врачом, если у вас внезапное падение энергии. Это может быть признаком основного заболевания. Это тоже может быть излечимо.
Это тоже может быть излечимо.
Эта пурпурная мраморная сыпь выглядит перепончатой, как кружево. Воспалительные состояния (такие как волчанка и антифосфолипидный синдром) могут вызывать его. Обычно вы получаете это на руках и ногах. Вы могли бы заметить это больше на холоде.
Вы мало что можете сделать для лечения самой сыпи, но ваш врач может решить проблему, которая ее вызывает. Ваша сыпь может пройти сама по себе. Поговорите со своим врачом, если это не так или если вы заметили узелки или язвы.
Если вы набираете жир или проводите много времени вдыхая посторонние вещества, такие как сигаретный дым, ваше тело ответит воспалением. Это может привести к накоплению жировых бляшек на внутренних стенках артерий. Известный как артериосклероз, он является основной причиной сердечного приступа и инсульта. Только ваш врач может сказать, есть ли у вас затвердение артерий.
Воспаление в результате травмы, хирургического вмешательства или таких заболеваний, как антифосфолипидный синдром и ВЗК, может привести к чрезмерному свертыванию крови (так называемая гиперкоагуляция).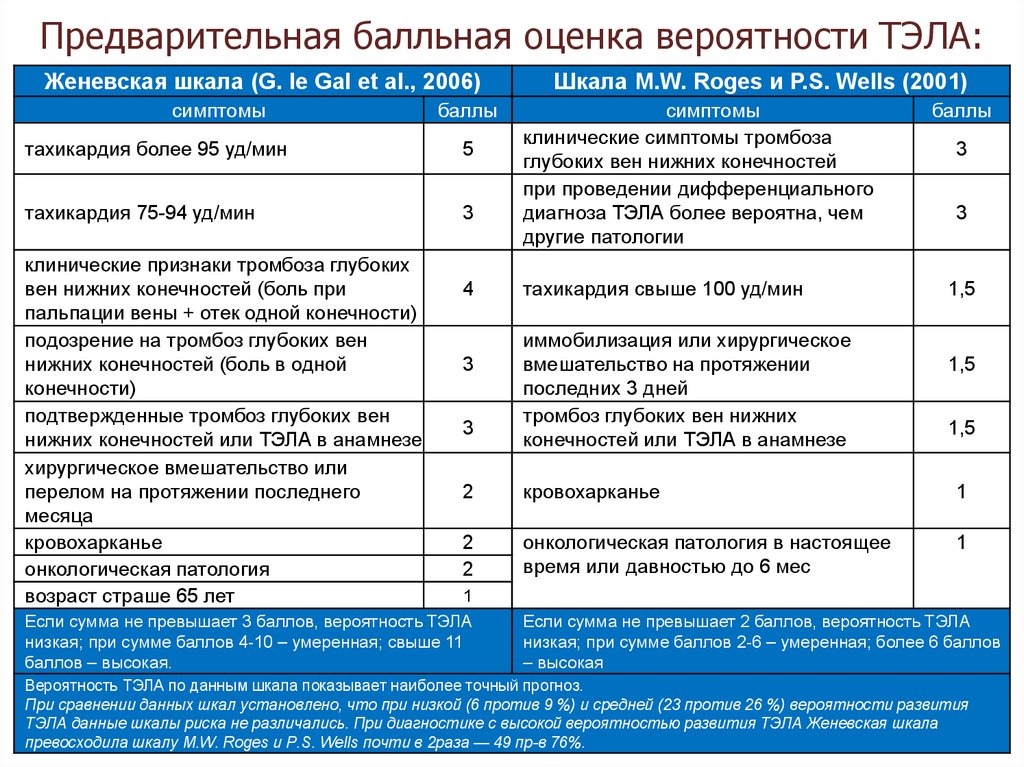 Это может вызвать отек и привести к более серьезным последствиям, таким как инсульт, сердечный приступ или легочная эмболия. Не всегда легко обнаружить гиперкоагуляцию, и вашему врачу может потребоваться некоторое время, чтобы выяснить, что ее вызывает. Могут помочь препараты, называемые антикоагулянтами.
Это может вызвать отек и привести к более серьезным последствиям, таким как инсульт, сердечный приступ или легочная эмболия. Не всегда легко обнаружить гиперкоагуляцию, и вашему врачу может потребоваться некоторое время, чтобы выяснить, что ее вызывает. Могут помочь препараты, называемые антикоагулянтами.
Распространенный симптом воспаления. Одно состояние, синдром Шегрена, влияет на ваши слюнные и слезные железы. Вы можете заметить ощущение песка или жжения в глазах, отек слюнных желез и сухость в носу и горле. Ваш врач может назначить лекарства, которые облегчат ваши симптомы и предотвратят серьезные осложнения, такие как потеря зрения и проблемы с зубами.
Ваша память и способность мыслить могут пострадать, если в организме появятся признаки воспаления. Ученые продолжают изучать связь. Ранние результаты показывают, что воспаление может способствовать развитию болезни Альцгеймера и других состояний, вызывающих деменцию. Особенно это касается пожилых людей. Планы здорового питания, такие как средиземноморская диета, облегчают воспаление и могут дольше поддерживать остроту вашего мозга.
ИЗОБРАЖЕНИЯ ПРЕДОСТАВЛЕНЫ:
1) peterspiro / Getty Images
2) Дмитрий Беляев / Getty Images
3) twinsterphoto / Getty Images
4) СасинПаракса / Thinkstock
5) tommaso79 / Getty Images
6) Stockbyte / Getty Images
7 SPLScience 8) Tussik13 / Getty Images
9) Sciepro / Getty Images
10) Alex_ugalek / Thinkstock
11) Janulla / Getty Images
Источники:
Alzheimer’s & Deencia 0061: «Связь между воспалительной диетой и глобальной когнитивной функцией и деменцией у пожилых женщин: исследование памяти Инициативы женского здоровья». Фонд открытия лекарств от болезни Альцгеймера: «Воспаление — причина болезни Альцгеймера?» Американская академия семейных врачей: «Инсулинорезистентность». Американский колледж ревматологии: «Синдром Шегрена». Кливлендская клиника: «Нарушения свертываемости крови (состояния гиперкоагуляции)», «Гипергликемия (высокий уровень сахара в крови)», «Рассеянный склероз: часто задаваемые вопросы». Лечение диабета: «Противовоспалительные средства при лечении диабета и его сосудистых осложнений». Эволюция, медицина и общественное здравоохранение: «Хронические воспалительные системные заболевания: эволюционный компромисс между чрезвычайно полезными, но хронически вредными программами». Письма FEBS: «Воспаление и резистентность к инсулину». Издательство Harvard Health Publishing: «Что такое воспаление?» Больница специальной хирургии: «Антифосфолипидный синдром (АФС)», «Ревматоидный артрит», «Воспалительные заболевания», «Анкилозирующий спондилоартрит», «Миозит», «Воспалительные заболевания». Университет Джона Хопкинса: «Симптомы синдрома Шегрена». Journal of Ophthalmic & Vision Research : «Сухость глаз: воспалительное заболевание глаз». Клиника Майо: «Livedo reticularis: Когда это вызывает беспокойство?» Medscape: «Livedo Reticularis». Национальный институт диабета, болезней органов пищеварения и почек: «Инсулинорезистентность и преддиабет». Ресурсы NCBI StatPearls: «Хроническое воспаление». Американская ассоциация спондилитов: «Спондилоартрит: группа сопутствующих заболеваний». Журналы по геронтологии. Серия A, Биологические науки и медицинские науки : «Повышенные маркеры воспаления связаны с продольными изменениями функции мозга у пожилых людей». Фонд миозита: «Полимиозит». World Journal of Gastroenterology : «Воспалительные заболевания кишечника: эпидемиология, патология и факторы риска гиперкоагуляции». © 2022 WebMD, LLC. Все права защищены. Посмотреть политику конфиденциальности и доверительную информацию Хроническое воспаление также называют медленным, длительным воспалением, длящимся от нескольких месяцев до нескольких лет. Цели: Определите этиологию хронического воспаления. Обобщите патофизиологию хронического воспаления. Опишите доступные варианты лечения и ведения хронического воспаления. Объясните стратегии межпрофессиональной бригады по улучшению координации помощи и коммуникации для улучшения контроля над хроническим воспалением и улучшения результатов. Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме. Воспаление является частью защитного механизма организма. Это процесс, посредством которого иммунная система распознает и удаляет вредные и чужеродные раздражители и начинает процесс заживления. Острое воспаление Повреждение тканей в результате травмы, микробной инвазии или вредных соединений может вызвать острое воспаление. Он начинается быстро, быстро становится тяжелым, а симптомы могут длиться несколько дней, например, целлюлит или острая пневмония. Подострое воспаление представляет собой период между острым и хроническим воспалением и может длиться от 2 до 6 недель. Хроническое воспаление Хроническое воспаление также называют медленным, длительным воспалением, продолжающимся в течение длительных периодов от нескольких месяцев до лет. Как правило, степень и последствия хронического воспаления зависят от причины травмы и способности организма восстанавливать и преодолевать повреждения. В этой статье рассматривается хроническое воспаление. Хроническое воспаление может возникнуть в результате:0170 Mycobacterium tuberculosis , простейшие, грибки и другие паразиты, которые могут сопротивляться защите хозяина и оставаться в тканях в течение длительного периода времени. Воздействие небольшого количества определенного раздражителя или инородного материала, который не может быть устранен ферментативным расщеплением или фагоцитозом в организме, включая вещества или промышленные химикаты, которые можно вдыхать в течение длительного периода времени, например, кремнеземная пыль. Аутоиммунное заболевание, при котором иммунная система распознает нормальный компонент организма как чужеродный антиген и атакует здоровые ткани, вызывая такие заболевания, как ревматоидный артрит (РА), системная красная волчанка (СКВ). Дефект в клетках, ответственных за опосредование воспаления, ведущий к персистирующим или рецидивирующим воспалениям, таким как аутовоспалительные заболевания (семейная средиземноморская лихорадка). Рецидивирующие эпизоды острого воспаления. Однако в некоторых случаях хроническое воспаление является независимой реакцией, а не следствием острого воспаления, например таких заболеваний, как туберкулез и ревматоидный артрит. Воспалительные и биохимические индукторы вызывают окислительный стресс и митохондриальную дисфункцию, такую как повышенное производство молекул свободных радикалов, конечные продукты усиленного гликирования (AGE), кристаллы мочевой кислоты (ураты), окисленные липопротеины, гомоцистеин и другие. Хронические воспалительные заболевания являются наиболее значительной причиной смерти в мире. Всемирная организация здравоохранения (ВОЗ) относит хронические заболевания к наибольшей угрозе здоровью человека. Ожидается, что распространенность заболеваний, связанных с хроническим воспалением, будет неуклонно расти в течение следующих 30 лет в Соединенных Штатах. в 2000 году почти 125 миллионов американцев жили с хроническими заболеваниями, а 61 миллион (21%) страдали более чем одним заболеванием. По недавним оценкам Rand Corporation, в 2014 году почти 60% американцев имели по крайней мере одно хроническое заболевание, 42% имели более одного и 12% взрослых имели 5 или более хронических заболеваний. Диабет : По данным Американской диабетической ассоциации, в 2015 году 30,3 миллиона человек, или 9,4 % населения Америки, страдали диабетом, и он стал 7-й по значимости причиной смерти в США. Сердечно-сосудистые заболевания: Согласно обновленному отчету Американской кардиологической ассоциации за 2017 год, на сердечно-сосудистые заболевания (ССЗ) приходится 1 из каждых трех смертей или примерно 800 000 смертей в Соединенных Штатах. Во всем мире на сердечно-сосудистые заболевания приходится 31% всех смертей, а на ишемическую болезнь сердца (ИБС) приходится большинство смертей из-за сердечно-сосудистых заболеваний, за которыми следуют инсульт (1 из 20 смертей в США) и сердечная недостаточность. Артрит и заболевания суставов : Они затрагивают примерно 350 миллионов человек во всем мире и почти 43 миллиона человек в Соединенных Штатах, или почти 20% населения. Ожидается, что к 2020 году это число превысит 60 миллионов человек. Почти 2,1 миллиона американцев страдают от ревматоидного артрита. Аллергии: Они занимают шестое место среди основных причин хронических заболеваний человека в Соединенных Штатах и ежегодно поражают более 50 миллионов американцев. Астма поражает более 24 миллионов человек в Соединенных Штатах, в том числе более 6 миллионов детей. В 2015 г. сенная лихорадка была диагностирована у 8,2% взрослых и 8,4% детей. Хроническая обструктивная болезнь легких (ХОБЛ): Третья по распространенности причина смерти в Соединенных Штатах в 2014 году, и почти у 15,7 миллионов американцев (6,4%) была диагностирована ХОБЛ. Большинство признаков острого воспаления сохраняются по мере того, как воспаление становится хроническим, включая расширение кровеносных сосудов (вазодилатацию), усиление кровотока, проницаемость капилляров и миграцию нейтрофилов в инфицированную ткань через капиллярную стенку (диапедез). В ответ на чужеродные или собственные антигены тканевые иммунные клетки, такие как макрофаги и дендритные клетки, высвобождают цитокины, такие как IL-1 и TNF-α. Эти цитокины побуждают эндотелиальные клетки в месте повреждения высвобождать селектины и интегрины, которые стимулируют хемотаксис и диапедез циркулирующих лейкоцитов. В дополнение к рекрутированию лейкоцитов тканевые макрофаги и дендритные клетки также играют роль в клиренсе антигена путем фагоцитоза, высвобождения цитокинов и служат антигенпрезентирующими клетками для лимфоцитов. Типы хронического воспаления Неспецифическое пролиферативное: Характеризуется наличием неспецифической грануляционной ткани, образованной инфильтрацией мононуклеарных клеток (лимфоцитов, макрофагов, плазматических клеток) и пролиферацией соединительных, фибробластных сосудов, сосудов , и эпителиальные клетки, например, воспалительный полипоподобный полип носа или шейки матки и абсцесс легкого. Гранулематозное воспаление: Специфический тип хронического воспаления, характеризующийся наличием отчетливых узелковых поражений или гранулем, образованных скоплением активированных макрофагов или их производных клеток, называемых эпителиоидными клетками, обычно окруженными лимфоцитами. Макрофаги или эпителиоидные клетки внутри гранулем часто сливаются, образуя Лангханса или гигантские клетки, такие как гигантские клетки инородного тела, Ашоффа, Рида-Штернберга и опухоли. Существует два типа : Гранулема, образованная из-за инородного тела или опосредованного Т-клетками иммунного ответа, называется гранулемой инородного тела, например, силикозом. Гранулема, образовавшаяся вследствие хронической инфекции, называется инфекционной гранулемой, например, при туберкулезе и проказе. Факторы риска, связанные с хроническим воспалением Несколько факторов риска способствуют вялотекущей воспалительной реакции. К ним относятся: Возраст: Пожилой возраст положительно коррелирует с повышенным уровнем нескольких воспалительных молекул. Связанное с возрастом увеличение воспалительных молекул может быть связано с митохондриальной дисфункцией или накоплением свободных радикалов с течением времени, а также с другими возрастными факторами, такими как увеличение висцерального жира. Ожирение: Многие исследования показали, что жировая ткань является эндокринным органом, секретирующим множество адипокинов и других медиаторов воспаления. Некоторые сообщения показывают, что индекс массы тела человека пропорционален количеству секретируемых провоспалительных цитокинов. Диета: Диета, богатая насыщенными жирами, трансжирами или рафинированным сахаром, связана с более высоким производством провоспалительных молекул, особенно у людей с диабетом или у людей с избыточным весом. Курение : Курение сигарет связано со снижением выработки противовоспалительных молекул и вызывает воспаление. Низкий уровень половых гормонов: Исследования показывают, что половые гормоны, такие как тестостерон и эстроген, могут подавлять выработку и секрецию нескольких провоспалительных маркеров, и было замечено, что поддержание уровня половых гормонов снижает риск некоторых воспалительных заболеваний. Стресс и расстройства сна: Физический и эмоциональный стресс связан с высвобождением воспалительных цитокинов. Стресс также может вызывать нарушения сна. Поскольку люди с нерегулярным графиком сна чаще страдают хроническим воспалением, чем постоянно спящие, нарушения сна также считаются одним из независимых факторов риска хронического воспаления. Симптомы хронического воспаления Некоторые общие признаки и симптомы, развивающиеся при хроническом воспалении, перечислены ниже. боль в теле, артралгия, миалгия Хроническая усталость и бессонница депрессия, тревога и дистремения настроения GASTRENTINGSEALSEATERS AS DESORDERS . потери Частые инфекции Тесты на хроническое воспаление К сожалению, не существует высокоэффективных лабораторных методов оценки пациентов на наличие хронического воспаления, и диагноз ставится только тогда, когда воспаление возникает в связи с другим заболеванием. Электрофорез белков сыворотки (ТФЭ) может показать сопутствующую гипоальбуминемию и поликлональное увеличение всех гамма-глобулинов (поликлональная гаммапатия). Два анализа крови, которые являются недорогими и хорошими маркерами системного воспаления, включают высокочувствительный С-реактивный белок (hsCRP) и фибриноген. Обнаружение провоспалительных цитокинов, таких как фактор некроза опухоли-альфа (ФНО-альфа), интерлейкин-1 бета (ИЛ-1бета), интерлейкин-6 (ИЛ-6) и интерлейкин-8 (ИЛ-8) дорогой метод, но может выявить конкретные факторы, вызывающие хроническое воспаление. Опять же, анализы не стандартизированы, как вч-СРБ, фибриноген и ТФЭ. Многие изменения в питании и образе жизни могут быть полезны для устранения триггеров воспаления и уменьшения хронического воспаления, как указано ниже. Диета с низким гликемическим индексом: Диета с высоким гликемическим индексом связана с высоким риском инсульта, ишемической болезни сердца и сахарного диабета 2 типа. Полезно ограничить потребление продуктов, способствующих воспалению, таких как газированные напитки, рафинированные углеводы, кукурузный сироп с фруктозой. Сокращение потребления общего количества насыщенных жиров и трансжиров: Некоторые пищевые насыщенные и синтетические трансжиры усиливают воспаление, а полиненасыщенные жиры омега-3 обладают противовоспалительным действием. Обработанные и упакованные продукты, содержащие трансжиры, такие как обработанные семена и растительные масла, выпечка (например, соевое и кукурузное масло), должны быть исключены из рациона. Фрукты и овощи: Черника, яблоки, брюссельская капуста, белокочанная капуста, брокколи и цветная капуста, которые богаты природными антиоксидантами, полифенолами и другими противовоспалительными соединениями, могут защитить от воспаления. Было показано, что потребление вишни и вишневого сока оказывает урикозурическое и ингибирующее действие на ИЛ-1 у пациентов с подагрой. Клетчатка : Высокое потребление растворимой и нерастворимой клетчатки связано со снижением уровня ИЛ-6 и ФНО-альфа. Орехи: , такие как миндаль, связаны со снижением риска сердечно-сосудистых заболеваний и диабета. Полифенолы зеленого и черного чая: Полифенолы чая связаны со снижением СРБ в клинических исследованиях на людях. Куркумин: Было показано, что составная часть куркумы связана со значительным улучшением при некоторых воспалительных заболеваниях на животных моделях. F ish Масло: Самый богатый источник омега-3 жирных кислот. Фасоль мунг: Богата флавоноидами (особенно витексином и изовитексином). Это традиционная пища и лекарственное растение, известное своим противовоспалительным действием. Микронутриенты : Магний, витамин D, витамин Е, цинк и селен). Магний считается одним из наиболее противовоспалительных диетических факторов, и его потребление связано со снижением активности вчСРБ, ИЛ-6 и ФНО-альфа. Витамин D проявляет свою противовоспалительную активность, подавляя медиаторы воспаления, такие как простагландины и усилитель ядерного фактора каппа-легкой цепи активированных В-клеток. Витамин Е, цинк и селен действуют в организме как антиоксиданты. Лигнаны кунжута : потребление кунжутного масла снижает синтез простагландинов, лейкотриенов и тромбоксанов и известно своей потенциальной гипотензивной активностью. Физические упражнения Клинические испытания на людях показали, что расход энергии при физических нагрузках снижает количество провоспалительных молекул и цитокинов независимо от потери веса. Обычные препараты для борьбы с хроническим воспалением Метформин обычно используется для лечения пациентов с диабетом II типа с дислипидемией и вялотекущим воспалением. Противовоспалительная активность метформина проявляется снижением циркулирующих ФНО-альфа, ИЛ-1бета, СРБ и фибриногена у этих пациентов. Статины являются противовоспалительными средствами, поскольку они уменьшают количество циркулирующих и клеточных биомедиаторов воспаления. Этот плейотропный эффект, по-видимому, частично способствует снижению частоты сердечно-сосудистых событий. Нестероидные противовоспалительные препараты (НПВП) , такие как напроксен, ибупрофен и аспирин, действуют путем ингибирования фермента циклооксигеназы (ЦОГ), который способствует воспалению, и в основном используются для облегчения боли, вызванной воспалением, у пациентов с артритом. Кортикостероиды также предотвращают несколько механизмов воспаления. Глюкокортикоиды назначают при некоторых воспалительных состояниях, включая воспалительный артрит, системную волчанку, саркоидоз и астму. Травяные добавки , такие как имбирь, куркума, каннабис, иссоп и Harpagophytum procumbens, обладают противовоспалительными свойствами, однако перед их использованием всегда следует проконсультироваться с врачом, а при использовании некоторых трав, таких как иссоп и каннабис, следует соблюдать осторожность. . Важно понимать, что хроническое воспаление — это не конкретное заболевание, а механистический процесс. Заболевания, связанные с хроническим воспалением, многочисленны и включают сердечно-сосудистые заболевания, диабет, злокачественные новообразования, аутоиммунные заболевания, хронические заболевания печени и почек и т.д. электрофорез, ревматоидный фактор, общий анализ крови, антинуклеарные антитела) могут подтвердить или исключить большинство дифференциальных диагнозов. Соответствующие диагностические и визуализирующие исследования могут быть полезны в определенных обстоятельствах, например, колоноскопия при подозрении на воспалительное заболевание кишечника. Невылеченное хроническое воспаление обычно имеет неблагоприятный прогноз. Заболеваемость и смертность от конкретных заболеваний зависят от причинно-следственного механического процесса, приводящего к хроническому воспалению. Хотя хроническое воспаление протекает незаметно, оно является причиной большинства хронических заболеваний и представляет серьезную угрозу для здоровья и долголетия людей. Воспаление считается основной причиной ряда заболеваний. Сердечно-сосудистые заболевания: Многие клинические исследования показали сильную и последовательную взаимосвязь между маркерами воспаления, такими как вчСРБ, и прогнозированием сердечно-сосудистых заболеваний. Кроме того, атеросклероз представляет собой провоспалительное состояние со всеми признаками хронического слабовыраженного воспаления и приводит к увеличению числа сердечно-сосудистых событий, таких как инфаркт миокарда, инсульт и другие. Рак: Хроническое слабовыраженное воспаление также участвует во многих типах рака, таких как рак почки, предстательной железы, яичников, гепатоцеллюлярный рак, рак поджелудочной железы, колоректальный рак, рак легких и мезотелиома. Диабет: Иммунные клетки, подобные макрофагам, проникают в ткани поджелудочной железы, высвобождая провоспалительные молекулы у больных диабетом. Как циркулирующие, так и клеточные биомаркеры подчеркивают, что диабет является хроническим воспалительным заболеванием. Хронические осложнения, связанные с диабетом, включают как микрососудистые, так и макрососудистые осложнения. Диабет увеличивает риск не только макрососудистых осложнений, таких как инсульты и сердечные приступы, но и микрососудистых осложнений, таких как диабетическая ретинопатия, невропатия и нефропатия. Ревматоидный артрит: У генетически восприимчивого хозяина хроническое воспаление, вызванное несколькими факторами окружающей среды, такими как курение и инфекции, приводит к системному аутоиммунному ответу, который вызывает локальный воспалительный ответ в суставах, инфильтрацию иммунных клеток и высвобождение цитокинов. . Сохранение хронического воспаления в синовиальной оболочке при неадекватно леченном РА связано с худшим прогнозом и рентгенологическим прогрессированием заболевания. Аллергическая астма: Комплексное хроническое воспалительное заболевание, связанное с неадекватным иммунным ответом и воспалением в проводящих дыхательных путях, включая снижение функции дыхательных путей и ремоделирование тканей. Хроническая обструктивная болезнь легких (ХОБЛ): Обструктивная болезнь легких, развивающаяся как хроническая воспалительная реакция на вдыхаемые раздражители и характеризующаяся длительными проблемами с дыханием. Болезнь Альцгеймера: У пожилых людей хроническое слабовыраженное воспаление связано со снижением когнитивных функций и деменцией. Хроническая болезнь почек (ХБП): Незначительное воспаление является общим признаком хронической болезни почек. Это может привести к задержке нескольких провоспалительных молекул в крови и способствует прогрессированию ХБП и смертности. Амилоидоз может быть результатом основного хронического воспаления, которое может привести к тяжелым почечным осложнениям. Воспалительные заболевания кишечника (ВЗК) — это группа хронических воспалительных заболеваний пищеварительного тракта. Он может развиваться как язвенный колит, вызывающий длительное воспаление и язвы в слизистой оболочке толстой и прямой кишки, или болезнь Крона, характеризующаяся воспалением слизистой оболочки пищеварительного тракта, распространяющимся на пораженные ткани, такие как рот, пищевод, желудок и задний проход. Хроническое воспаление может оказывать вредное воздействие на организм и является ключевым фактором, вызывающим почти все хронические дегенеративные заболевания. Ниже приведены некоторые из наиболее эффективных способов предотвращения хронического воспаления. Повышение потребления противовоспалительных продуктов: Важно избегать употребления простых сахаров, рафинированных углеводов, продуктов с высоким гликемическим индексом, транс-жиров и гидрогенизированных масел. Сведите к минимуму прием антибиотиков и НПВП: Следует избегать использования антибиотиков, антацидов и НПВП, поскольку это может нанести вред микробиому в кишечнике, вызывая воспаление в стенках кишечника, известное как дырявый кишечник, который, в свою очередь, высвобождает токсины и вызывает хронические , воспаление всего тела. Регулярные физические упражнения для поддержания оптимального веса: Широко известно, что жировая ткань у людей с ожирением или избыточным весом вызывает слабовыраженное системное воспаление. Регулярные физические упражнения помогают не только контролировать вес, но и снижают риск сердечно-сосудистых заболеваний, укрепляют сердце, мышцы и кости. Спите дольше: Ночной сон (в идеале не менее 7-8 часов) помогает стимулировать выработку гормонов роста и тестостерона в организме для самовосстановления. Меньше стресса: Хронический психологический стресс связан с повышенным риском депрессии, сердечных заболеваний и потери организмом способности регулировать воспалительную реакцию и нормальную защиту. Йога и медитация помогают облегчить воспаление, вызванное стрессом, и его вредное воздействие на организм. Существует несколько неизлечимых хронических воспалительных заболеваний. Большинство лечится симптоматической терапией. Межпрофессиональная команда, включающая врачей первичной медико-санитарной помощи, медсестер, физиотерапевтов, диетологов и специалистов, должна участвовать в лечении основной этиологии, а также в профилактике осложнений хронического воспаления. Обучение пациентов является ключом с упором на изменение диеты и образа жизни, включая снижение веса, регулярные физические упражнения, отказ от курения, здоровое питание и хорошую гигиену сна. К сожалению, в некоторых случаях для контроля хронического воспаления могут потребоваться пожизненные противовоспалительные препараты. Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме. Комментарий к этой статье. Фазы заживления раны, гемостаз, сосудистый ответ, воспаление, образование фиброплазии и грануляционной ткани, эпителизация, сокращение, созревание и ремоделирование. Предоставлено Wikimedia Commons, «Медицинская галерея Микаэля Хэггстрема (подробнее…) Биопсия кожи показывает умеренный склероз дермы и подкожного слоя (красные стрелки) с утратой сетчатых гребней (зеленые стрелки) и очаговым хроническим воспалением ( синие стрелки), что соответствует раннему морфее Предоставлено Амитом Сапра, доктором медицины Michels da Silva D, Langer H, Graf T. Воспалительные и молекулярные пути при сердечной недостаточности-ишемии, HFpEF и транстиретиновом сердечном амилоидозе. Int J Mol Sci. 2019 May 10;20(9) [бесплатная статья PMC: PMC6540104] [PubMed: 31083399] Zhang X, Wu X, Hu Q, Wu J, Wang G, Hong Z, Ren J., Лаборатория травм и хирургических инфекций. Митохондриальная ДНК при воспалении печени и окислительном стрессе. Жизнь наук. 201901 ноября; 236:116464. [PubMed: 31078546] Fritsch J, Abreu MT. Микробиота и иммунный ответ: что такое курица и что такое яйцо? Gastrointest Endosc Clin N Am. 2019 июль; 29 (3): 381-393. [PubMed: 31078242] Barcelos IP, Troxell RM, Graves JS. Митохондриальная дисфункция и рассеянный склероз. Биология (Базель). 2019 May 11;8(2) [бесплатная статья PMC: PMC6627385] [PubMed: 31083577] Tsai DH, Riediker M, Berchet A, Paccaud F, Waeber G, Vollenweider P, Bochud M. Влияние краткосрочного и долгосрочного воздействия твердых частиц на уровни воспалительных маркеров у населения в целом. Environ Sci Pollut Res Int. 26 июля 2019 г. (19): 19697-19704. [PubMed: 31079306] Дипак П.

Национальное общество рассеянного склероза: «Определение рассеянного склероза», «Симптомы рассеянного склероза». Хроническое воспаление — StatPearls — NCBI Bookshelf
Непрерывное обучение
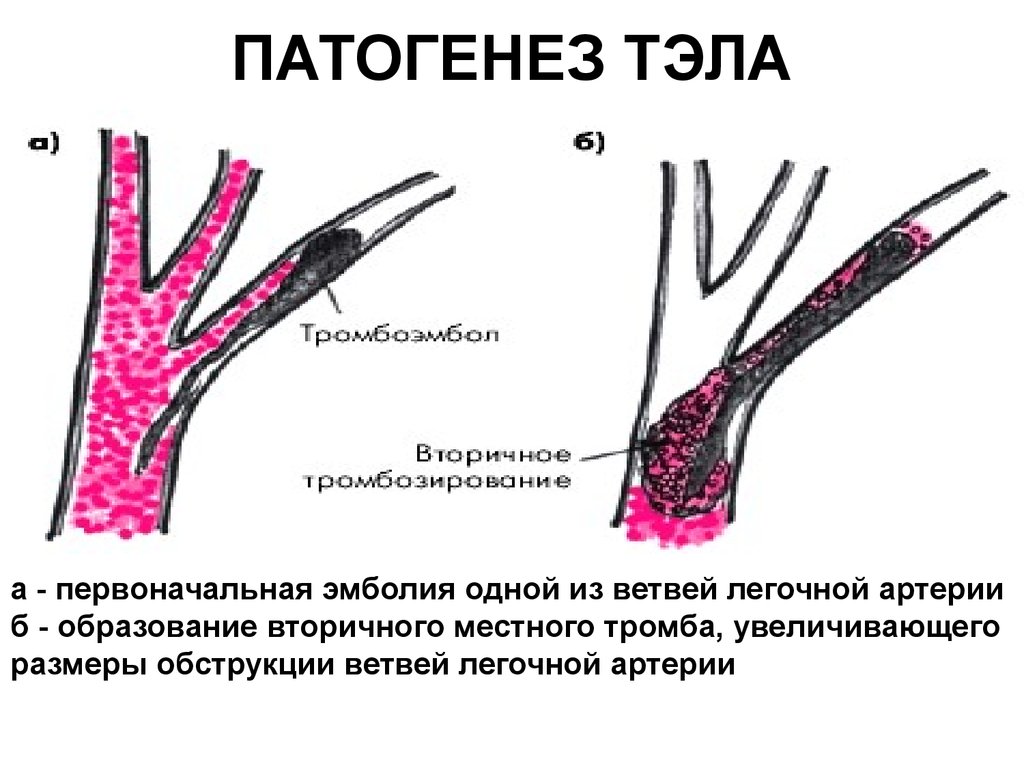 Как правило, степень и последствия хронического воспаления зависят от причины травмы и способности организма восстанавливать и преодолевать повреждения. В этом упражнении рассматривается патофизиология хронического воспаления и подчеркивается роль межпрофессиональной команды в принятии мер по контролю над патологией.
Как правило, степень и последствия хронического воспаления зависят от причины травмы и способности организма восстанавливать и преодолевать повреждения. В этом упражнении рассматривается патофизиология хронического воспаления и подчеркивается роль межпрофессиональной команды в принятии мер по контролю над патологией. Введение
 Воспаление может быть острым или хроническим.[1][2][3]
Воспаление может быть острым или хроническим.[1][2][3] Этиология

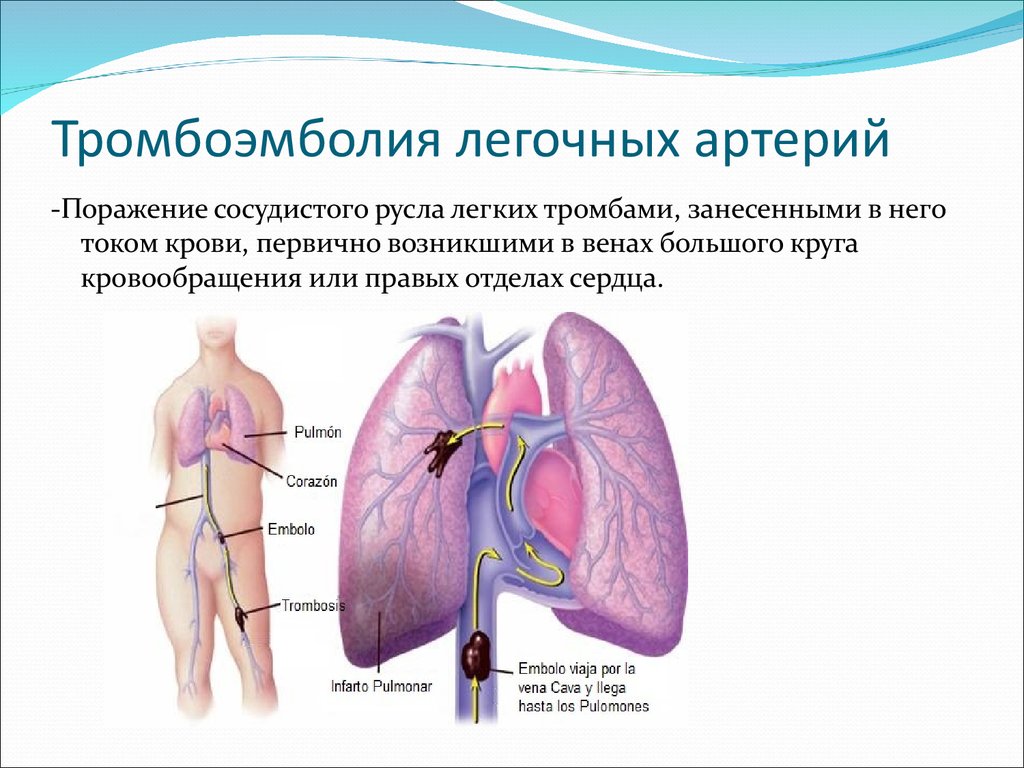
Эпидемиология
 Во всем мире 3 из 5 человек умирают из-за хронических воспалительных заболеваний, таких как инсульт, хронические респираторные заболевания, болезни сердца, рак, ожирение и диабет. [4][5][6] Распространенность некоторых специфических хронических заболеваний, опосредованных воспалением, следующая:
Во всем мире 3 из 5 человек умирают из-за хронических воспалительных заболеваний, таких как инсульт, хронические респираторные заболевания, болезни сердца, рак, ожирение и диабет. [4][5][6] Распространенность некоторых специфических хронических заболеваний, опосредованных воспалением, следующая:
Патофизиология
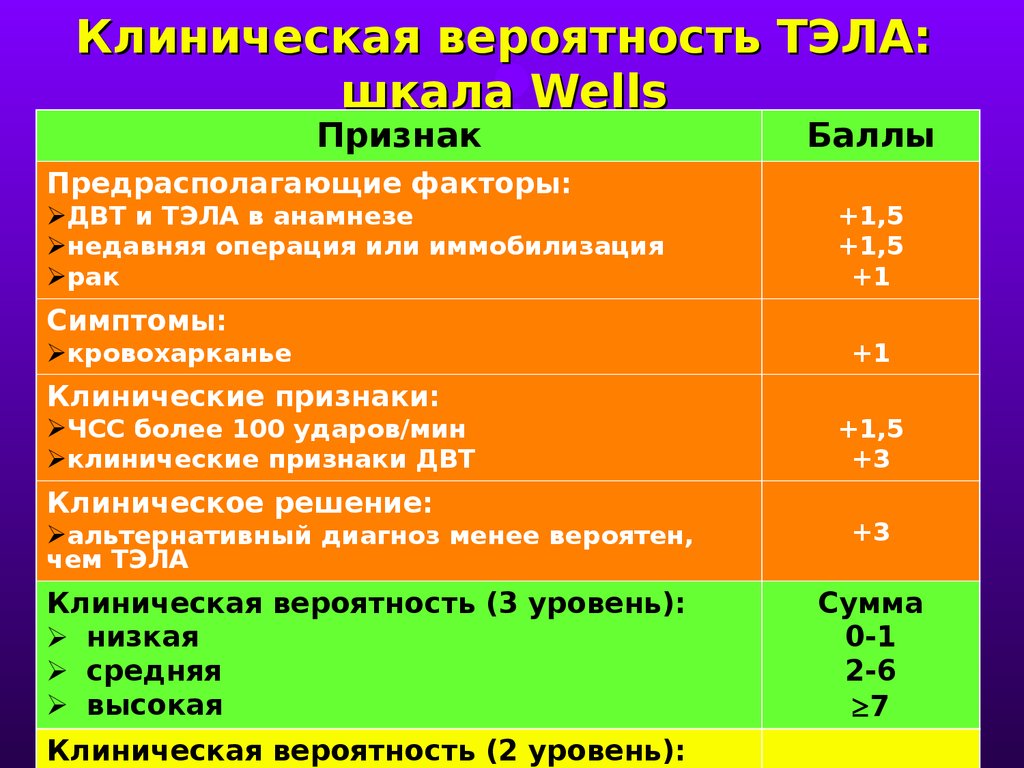 Однако вскоре состав лейкоцитов меняется, и макрофаги и лимфоциты начинают замещать короткоживущие нейтрофилы. Таким образом, отличительными признаками хронического воспаления являются инфильтрация первичных воспалительных клеток, таких как макрофаги, лимфоциты и плазматические клетки, в участке ткани, продуцирующие воспалительные цитокины, факторы роста, ферменты и, следовательно, способствующие прогрессированию повреждения ткани и вторичному восстановлению, включая фиброз. и образование гранулемы и т. д. [7] [8] [9].][10]
Однако вскоре состав лейкоцитов меняется, и макрофаги и лимфоциты начинают замещать короткоживущие нейтрофилы. Таким образом, отличительными признаками хронического воспаления являются инфильтрация первичных воспалительных клеток, таких как макрофаги, лимфоциты и плазматические клетки, в участке ткани, продуцирующие воспалительные цитокины, факторы роста, ферменты и, следовательно, способствующие прогрессированию повреждения ткани и вторичному восстановлению, включая фиброз. и образование гранулемы и т. д. [7] [8] [9].][10]  Как только циркулирующие лейкоциты попадают в местный очаг повреждения, они активируются различными цитокинами и хемокинами, секретируемыми макрофагами и дендритными клетками. При активации лейкоциты дополнительно выделяют цитокины и медиаторы воспаления. Нейтрофилы являются начальными клетками и преобладают в острой фазе воспаления. Нейтрофилы содержат гранулы, богатые лизоцимом, матриксными металлопротеиназами, миелопероксидазой, которые высвобождаются на чужеродный или собственный антиген, что приводит к его разрушению. Нейтрофилы также разрушают антиген путем фагоцитоза, высвобождения активных форм кислорода и цитокинов, таких как ИЛ-1, ИЛ-6 и ФНО-α. Лимфоциты, включая Т-лимфоциты и В-лимфоциты, являются следующей линией защиты, и они играют решающую роль в опосредовании воспаления с помощью нескольких сложных механизмов, включая секрецию цитокинов, костимуляцию лимфоцитов и продукцию антител и иммунных комплексов. Циркулирующие тромбоциты также могут играть роль в воспалении за счет агрегации тромбоцитов, образования тромбов и дегрануляции, высвобождая хемокины и медиаторы воспаления.
Как только циркулирующие лейкоциты попадают в местный очаг повреждения, они активируются различными цитокинами и хемокинами, секретируемыми макрофагами и дендритными клетками. При активации лейкоциты дополнительно выделяют цитокины и медиаторы воспаления. Нейтрофилы являются начальными клетками и преобладают в острой фазе воспаления. Нейтрофилы содержат гранулы, богатые лизоцимом, матриксными металлопротеиназами, миелопероксидазой, которые высвобождаются на чужеродный или собственный антиген, что приводит к его разрушению. Нейтрофилы также разрушают антиген путем фагоцитоза, высвобождения активных форм кислорода и цитокинов, таких как ИЛ-1, ИЛ-6 и ФНО-α. Лимфоциты, включая Т-лимфоциты и В-лимфоциты, являются следующей линией защиты, и они играют решающую роль в опосредовании воспаления с помощью нескольких сложных механизмов, включая секрецию цитокинов, костимуляцию лимфоцитов и продукцию антител и иммунных комплексов. Циркулирующие тромбоциты также могут играть роль в воспалении за счет агрегации тромбоцитов, образования тромбов и дегрануляции, высвобождая хемокины и медиаторы воспаления.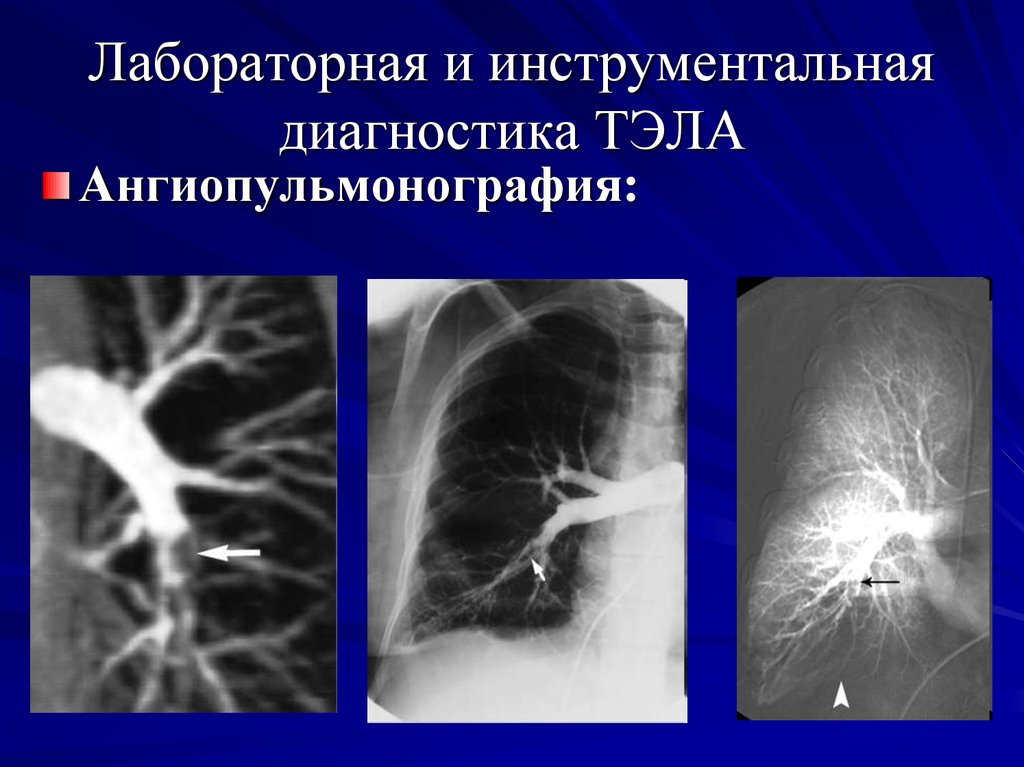
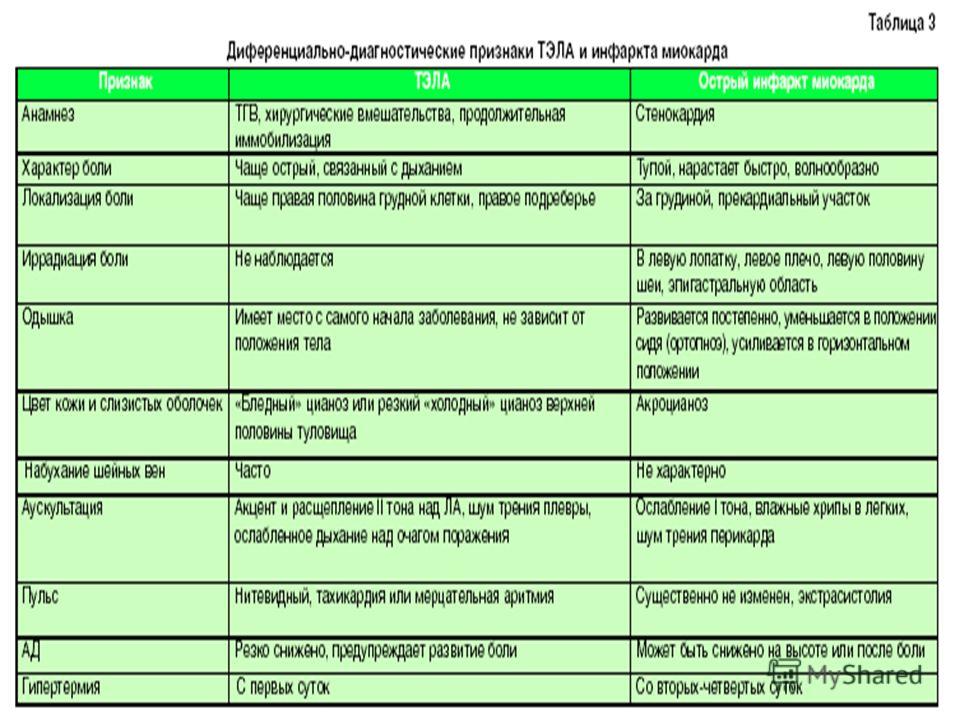
Исторический и физический
 Метаболический синдром хорошо иллюстрирует это.
Метаболический синдром хорошо иллюстрирует это.
Оценка
 Высокие уровни вч-СРБ указывают на воспаление, но он не является специфическим маркером хронического воспаления, поскольку он также повышен при остром воспалении, вызванном недавней травмой или болезнью. Нормальный уровень вчСРБ в сыворотке составляет менее 0,55 мг/л у мужчин и менее 1,0 мг/л у женщин. Нормальный уровень фибриногена составляет от 200 до 300 мг/дл. SAA (сывороточный амилоид А) также может указывать на воспаление, но не является стандартизированным тестом.
Высокие уровни вч-СРБ указывают на воспаление, но он не является специфическим маркером хронического воспаления, поскольку он также повышен при остром воспалении, вызванном недавней травмой или болезнью. Нормальный уровень вчСРБ в сыворотке составляет менее 0,55 мг/л у мужчин и менее 1,0 мг/л у женщин. Нормальный уровень фибриногена составляет от 200 до 300 мг/дл. SAA (сывороточный амилоид А) также может указывать на воспаление, но не является стандартизированным тестом. Лечение/управление
 Наиболее эффективным является похудение. Например, у пациентов с псориатическим артритом, который является хроническим воспалительным артритом, было показано, что только потеря веса независимо связана с клинически значимым улучшением активности заболевания и воспаления.
Наиболее эффективным является похудение. Например, у пациентов с псориатическим артритом, который является хроническим воспалительным артритом, было показано, что только потеря веса независимо связана с клинически значимым улучшением активности заболевания и воспаления.
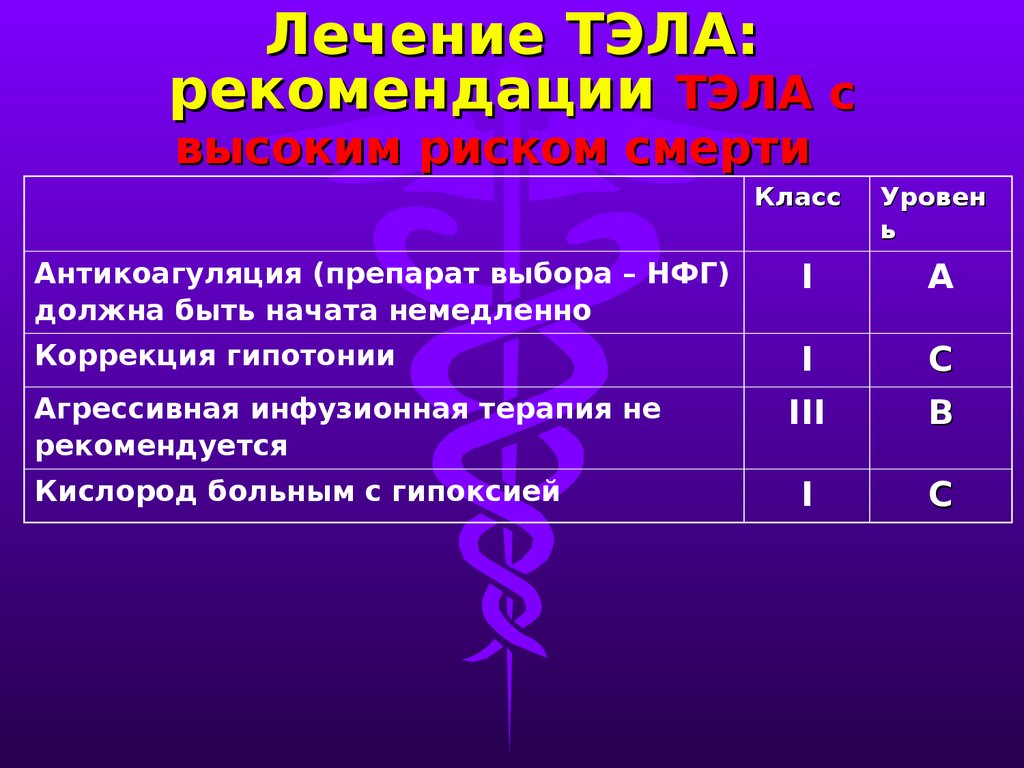 Более высокое потребление омега-3 жирных кислот связано со снижением уровней ФНО-альфа, СРБ и ИЛ-6.
Более высокое потребление омега-3 жирных кислот связано со снижением уровней ФНО-альфа, СРБ и ИЛ-6.

Дифференциальная диагностика

Прогноз
Осложнения



Устрашение и обучение пациентов
 Потребление цельного зерна, натуральных продуктов, большого количества овощей и фруктов, таких как авокадо, вишня, капуста и жирная рыба, такая как лосось, помогает победить воспаление.
Потребление цельного зерна, натуральных продуктов, большого количества овощей и фруктов, таких как авокадо, вишня, капуста и жирная рыба, такая как лосось, помогает победить воспаление.
Улучшение результатов медицинского обслуживания

Контрольные вопросы
Рисунок
Рисунок
Ссылки


