Инфекции, вызываемые стафилококками
Стафилококки хорошо известны как возбудители гнойно-септических инфекций у человека и животных. Наряду с представителями семейства Enterobacteriaceae они занимают ведущее место в этиологии гнойных заболеваний. Род Staphylococcus включает в себя 35 различных видов. В зависимости от способности продуцировать коагулазу, фермент, вызывающий коагуляцию плазмы крови, они подразделяются на две группы: коагулазопозитивные и коагулазонегативные. Место обитания стафилококков – человек и теплокровных животные, внешняя среда. Локализация у человека – кожа и слизистые оболочки, толстый кишечник. Источником стафилококковых инфекций является больной человек или здоровый носитель. Пути передачи: воздушно-капельный, воздушно-пылевой, контактный, пищевой. Восприимчивость к инфекции зависит от общего состояния организма и возраста. Наиболее восприимчивы дети, особенно новорожденные и грудного возраста. В норме способность стафилококка к инвазии и резистентность хозяина хорошо сбалансированы, поэтому инфекция не развивается, пока не создастся ситуация, когда встречаются высоковирулентный микроорганизм или макроорганизм со сниженной резистентностью.
Наиболее известным представителем коагулазопозитивных стафилококков является S.aureus (золотистый стафилококк). Он встречается в передних отделах носовых ходов у 20–40% здоровых взрослых людей. Приблизительно у 1/3 населения он постоянно выделяется из носа, у 1/3 отмечается транзиторное носительство и 1/3 свободна от носительства. S.aureus наиболее часто выделяется при гнойной патологии, вызывает целый ряд заболеваний: фолликулиты, фурункулы и карбункулы, гидроадениты, маститы, раневые инфекции, бактериемии и эндокардиты, менингиты, перикардиты, легочные инфекции, остеомиелиты и артриты, гнойные миозиты, пищевые отравления, синдром токсического шока. Упомянутые заболевания обусловливаются факторами патогенности: капсульными полисахаридами, пептидогликанами и тейхоевыми кислотами, протеином А, ферментами, гемолизинами, токсинами (эксфолиативный, энтеротоксины от А до Е, Н и I), суперантигеном, который принадлежит к энтеротоксину (TSST-1), вызывающему токсический шок синдром.
Все остальные коагулазопозитивные стафилококки выделяются в основном от животных и редко от человека, но в отдельных случаях могут вызывать у человека гнойно-воспалительные заболевания.
Среди коагулазонегативных стафилококков наиболее значимы в патологии человека S.epidermidis и S.saprophyticus. Они могут вызывать инфекции мочевыводящих путей, остеомиелиты, бактериемии, инфекции у новорожденных детей в палатах интенсивной терапии, заболевания глаз, кожные инфекции, поражают клапаны сердца, вызывают гнойные воспаления при операции по замене сердечных клапанов на искусственные, при шунтирование органов, использование внутривенных катетеров, катетеров при гемодиализе, а также при ангиопластике.
В настоящее время микроорганизмы рода Staphylococcus играют лидирующую роль среди возбудителей внутрибольничных инфекций. До определенного времени пенициллин был основным препаратом выбора при лечении тяжелых гнойных инфекций вызываемых  В ряде случаев устойчивость к полусинтетическим пенициллинам может быть обусловлена гиперпродукцией β-лактамаз. В этом случае устойчивость к полусинтетическим пенициллинам при определении ее в лабораторных условиях характеризуется как умеренная. Метициллин-резистентные штаммы
В ряде случаев устойчивость к полусинтетическим пенициллинам может быть обусловлена гиперпродукцией β-лактамаз. В этом случае устойчивость к полусинтетическим пенициллинам при определении ее в лабораторных условиях характеризуется как умеренная. Метициллин-резистентные штаммы
Показания к обследованию.
Материал для исследований. Кровь, СМЖ, гной, раневое отделяемое, грудное молоко, мазки из носа; смывы c медицинского оборудования и инвентаря.
Этиологическая лабораторная диагностика включает выделение возбудителя на питательных средах, выявление его ДНК.
Сравнительная характеристика методов лабораторной диагностики, показания к применению различных лабораторных исследований.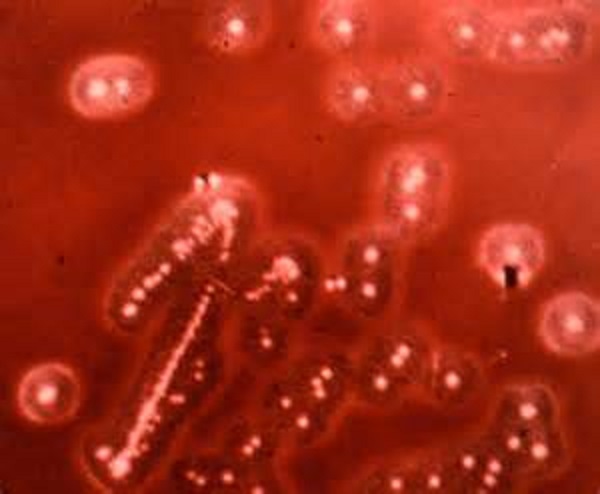 Техника выделения возбудителя в настоящее время хорошо отработана. Микроорганизмы довольно устойчивы к факторам внешней среды, поэтому если отобранный биологический материал невозможно сразу использовать для исследования, можно воспользоваться специальными контейнерами и траспортными средами. Подробнее техника отбора и транспортировки биологического материала в клинико- диагностическую лабораторию описана в разделе преаналитические этапы исследования. Для выделения возбудителя, как правило, достаточно 3–4 дня. Исключением является выделение стафилококков из крови. В этом случае успех техники во многом будет зависеть от правильного выбора времени для отбора крови и присутствия в крови пациентов антибактериальных препаратов.
Техника выделения возбудителя в настоящее время хорошо отработана. Микроорганизмы довольно устойчивы к факторам внешней среды, поэтому если отобранный биологический материал невозможно сразу использовать для исследования, можно воспользоваться специальными контейнерами и траспортными средами. Подробнее техника отбора и транспортировки биологического материала в клинико- диагностическую лабораторию описана в разделе преаналитические этапы исследования. Для выделения возбудителя, как правило, достаточно 3–4 дня. Исключением является выделение стафилококков из крови. В этом случае успех техники во многом будет зависеть от правильного выбора времени для отбора крови и присутствия в крови пациентов антибактериальных препаратов.
Особенности интерпретации результатов лабораторных исследований. При исследовании стерильного биологического материала (кровь, СМЖ) клиническое значение имеет обнаружение S.aureus в любых концентрациях. В нестерильном биологическом материале клиническое значение имеют только высокие концентрации S.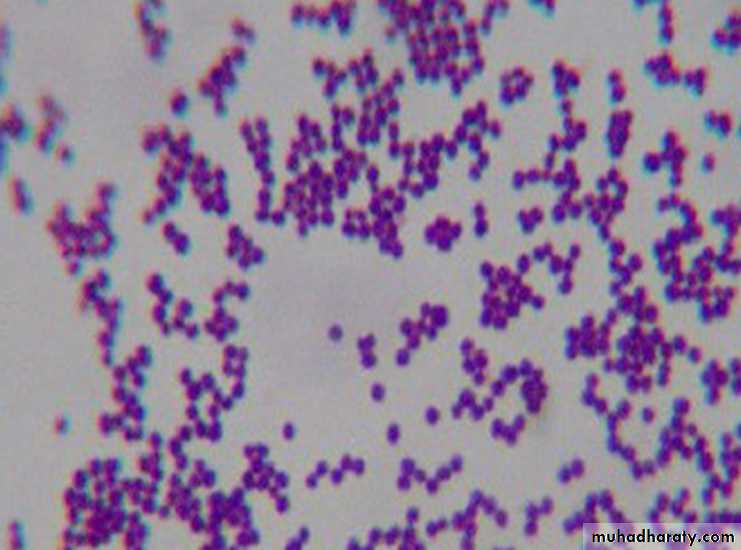 aureus, означающие его ведущую роль в воспалительном процессе.
aureus, означающие его ведущую роль в воспалительном процессе.
Фирмикуты — Firmicutes — qaz.wiki
В Firmicutes ( латинская : Firmus , сильный и кутис , кожи, относящийся к клеточной стенке) являются филюмом из бактерий , большинство из которых имеет грамположительную клеточную стенку структура. Однако некоторые из них, такие как Megasphaera , Pectinatus , Selenomonas и Zymophilus , имеют пористую псевдо-внешнюю мембрану, которая заставляет их окрашивать грамотрицательные бактерии . Ученые когда-то классифицировали Firmicutes, чтобы включить все грамположительные бактерии, но недавно определили, что они принадлежат к основной группе родственных форм, называемой группой с низким содержанием G + C , в отличие от актинобактерий . У них есть круглые клетки, называемые кокками (единичный кокк) или палочковидные формы (палочки).
Многие Firmicutes производят эндоспоры , устойчивые к высыханию и способные выжить в экстремальных условиях. Они встречаются в различных средах, и в эту группу входят некоторые известные патогены. Представители одной семьи, гелиобактерии , производят энергию посредством аноксигенного фотосинтеза . Фирмикуты играют важную роль в порче пива, вина и сидра.
Классы
Группа обычно делится на Clostridia , которые являются анаэробами , и Bacilli , которые являются облигатными или факультативными аэробами .
На филогенетических деревьях первые две группы проявляются как парафилетические или полифилетические , как и их основные роды, Clostridium и Bacillus . Тем не менее, Firmicutes в целом обычно считается монофилетическим или парафилетическим, за исключением Mollicutes .
Филогения
Филогения основана на выпуске 132 LTP на основе 16S рРНК, разработанном All-Species Living Tree Project , с принятой в настоящее время таксономией, основанной на Списке названий прокариот, стоящих в номенклатуре (LPSN), Национального центра биотехнологической информации (NCBI), и некоторые непроверенные названия клад из базы данных таксономии генома .
| Классификация фирмикутов | |||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Неназначенная Clostridia ss
|
Примечания:
♥ Имена кладов не зарегистрированы в Национальном центре биотехнологической информации (NCBI) или перечислены в Списке названий прокариот, стоящих в номенклатуре (LPSN).
♦ Семейство Synergistaceae (семейство Clostridiales XV Incertae Sedis) и Thermodesulfobiaceae было удалено из Firmicutes на основании того факта, что они не образуют с ним монофилетическую кладу.
Роды
По состоянию на 2016 год считалось, что более 274 родов принадлежат к типу Firmicutes, к числу известных родов Firmicutes относятся:
Бациллы, заказать Бациллы
Бациллы, отряд Lactobacillales
Clostridia
Рожистая
Последствия для здоровья
Фирмикуты составляют самую большую часть микробиома кишечника мыши и человека . Было показано, что подразделение Firmicutes как часть кишечной флоры участвует в резорбции энергии и потенциально связано с развитием диабета и ожирения . В кишечнике здорового взрослого человека самая многочисленная бактерия: Faecalibacterium prausnitzii (F. prausnitzii) , составляющая 5% всего кишечного микробиома, является членом типа Firmicutes. Этот вид напрямую связан с уменьшением легкого воспаления при ожирении. F. prausnitzii был обнаружен в более высоких концентрациях в кишечнике детей с ожирением, чем у детей без ожирения.
Во многих исследованиях было обнаружено более высокое содержание Firmicutes у лиц с ожирением, чем у худых людей. Более высокий уровень Lactobacillus (филума Firmicutes) был обнаружен у пациентов с ожирением, а в одном исследовании пациенты с ожирением, соблюдающие диету для похудания, показали снижение количества Firmicutes в кишечнике.
Более высокий уровень Lactobacillus (филума Firmicutes) был обнаружен у пациентов с ожирением, а в одном исследовании пациенты с ожирением, соблюдающие диету для похудания, показали снижение количества Firmicutes в кишечнике.
Также было показано, что изменение рациона мышей способствует изменению численности Firmicutes. Более высокая относительная численность Firmicutes наблюдалась у мышей, получавших западную диету (с высоким содержанием жиров / с высоким содержанием сахара), чем у мышей, получавших стандартную диету с низким содержанием жиров / высоким содержанием полисахаридов. Более высокое количество Firmicutes также было связано с большим ожирением и массой тела у мышей. В частности, среди мышей с ожирением наиболее распространенным был класс Mollicutes (в пределах филума Firmicutes). Когда микробиота мышей с ожирением с более высокой численностью Firmicutes была трансплантирована в кишечник мышей без микробов, мыши без микробов набрали значительное количество жира по сравнению с мышами, которым трансплантировали микробиоту тощих мышей с более низким содержанием Firmicutes.
Было обнаружено, что присутствие Christensenella (Firmicutes, в классе Clostridia), выделенной из фекалий человека , коррелирует с более низким индексом массы тела .
Рекомендации
внешняя ссылка
- Тип «Firmicutes» — JP Euzéby: Список прокариотических имен со статусом в номенклатуре
Стафилококк – симптомы, виды, причины возникновения и лечение заболевания
Возбудитель стафилококка — Staphylococcus aureus — это грамположительные неподвижные и не образующие спор анаэробные бактерии, которые имеют округлую форму (форму кокка) и растут гроздьями, поэтому фактически название микроорганизма означает “золотая гроздь винограда”.
О заболевании
При выращивании в чашке Петри с кровяным агаром колонии золотистого стафилококка имеют характерный золотисто-желтый цвет, отсюда и соответствующее название. Этот микроорганизм чрезвычайно распространен, им колонизировано около четверти населения планеты.
Этот микроорганизм чрезвычайно распространен, им колонизировано около четверти населения планеты.
Обычно он распространяется в носовой полости, паховой области, подмышках и других частях кожи, но в большинстве случаев является нормальной частью кожной флоры человека и не вызывает никаких проблем.
Однако при увеличении количества бактерий на коже, они начинают проникать в глубокие слои кожи через микротрещины и могут привести к кожным инфекциям и абсцессам.
Патологические процессы могут затрагивать не только различные внутренние органы, такие как печень, почки, селезенка, головной мозг, но и мышцы, кости и суставы, что ведет к крайне плачевным последствиям, поэтому при подозрении на наличие инфекции, следует немедленно обратиться к доктору.
Виды стафилококковых инфекций
Выделяют несколько наиболее распространенных видов стафилококков:
● Гемолитический стафилококк.
Чаще всего эта инфекция поражает верхние дыхательные пути, вызывая гнойную ангину, фарингит, тонзиллит, бронхит и другие воспалительные заболевания. Данные бактерии очень устойчивы и трудно поддаются терапии.
● Золотистый.
Данный микроорганизм чрезвычайно устойчив почти ко всем видам антибиотиков пенициллинового ряда, антисептикам, высоким температурам, активным прямым солнечным лучам. Он вызывает различные поражения кожи, такие как экзема, абсцесс, фурункулы, поражения желудочно-кишечного тракта, верхних дыхательных путей, слизистых оболочек, в худшем случае приводит к токсическому шоку.
● Эпидермальный.
Этот микроорганизм обитает на поверхности кожи и слизистых любого здорового человека и не несет никакого вреда. Но, если эта бактерия попадает в кровь человека с ослабленным иммунитетом, что чаще всего происходит при хирургических операциях, использовании неправильно обработанных инструментов, катетеров, происходит заражение крови, что ведет к воспалению внутренней оболочки сердца.
● Сапрофитный.
Несмотря на то, что этот вид наименее опасный, при заражении он приводит к общей интоксикации организма, вследствие выделения опасных токсинов и ферментов в процессе своей жизнедеятельности. Данные микроорганизмы часто становятся возбудителями воспаления уретры и мочевого пузыря. Преимущественно это характерно для женщин в силу анатомических особенностей строения их мочеполовой системы. При отсутствии лечения цистит влечет за собой воспаление почек и проблемы с зачатием ребенка.
Симптомы и формы стафилококка у взрослых и детей
Симптомы, которые ощущает больной, сильно разнятся в зависимости от способа и места инфицирования и состояния иммунитета. Но можно выделить ряд наиболее характерных признаков:
● повышенная температура;
● нагноение порезов, отечность, гнойные высыпания на коже и слизистых, зуд и покраснение глаз;
● отсутствие обоняния и носового дыхания;
● першение в горле, болезненность при глотании, сухой кашель;
● тошнота, рвота, общее ослабленное состояние;
● сильные головные боли, приступы эпилепсии, сильная одышка;
● болезненные ощущения в суставах.
Одной из самых распространенных форм стафилококков у взрослых людей является его бессимптомное носительство. Здоровый человек не ощущает каких-либо признаков заболевания до тех пор, пока не появится провоцирующий фактор, который даст толчок развитию болезни.
Для женщин наиболее опасен сапрофитная форма, способная привести к возникновению цистита. Это связано с тем, что уретра женщин располагается очень близко к влагалищу, из-за чего велика вероятность попадания патогенной микрофлоры, в том числе и палочки стафилококка, в уретральный канал, а затем и в мочевой пузырь, вызывая его воспаление.
Так как маленькие дети не обладают окрепшей иммунной системой, риск развития инфекции у ребенка достаточно велик. Причем привести к серьезным осложнениям у детей могут даже те виды стафилококка, которые во взрослом возрасте практически не вызывают проблем. Особенную опасность представляет стафилококк у детей в возрасте до года, так как он с легкостью, в кратчайшие сроки способен распространиться по организму и привести к серьезным последствиям вплоть до летального исхода.
Причем привести к серьезным осложнениям у детей могут даже те виды стафилококка, которые во взрослом возрасте практически не вызывают проблем. Особенную опасность представляет стафилококк у детей в возрасте до года, так как он с легкостью, в кратчайшие сроки способен распространиться по организму и привести к серьезным последствиям вплоть до летального исхода.
Причины возникновения
Наиболее часто бактерия попадает в организм человека через ранки и микротрещины на коже. Инфекция, проникнув через рану, начинает размножаться в крови, распространяясь по организму и поражая легкие, сердце, мозг, печень, почки, суставы.
При стафилококке заболевания могут быть самые различные такие, как пневмония, менингит, остеомиелит, эндокардит, сепсис и многие другие.
Заражение инфекцией стафилококк может произойти следующими способами:
● Контактно-бытовым путем при использовании личных предметов больного;
● Воздушно-капельным при близком общении с зараженным;
● Фекально-оральным на грязных фруктах, овощах и других продуктах питания, грязных посуде и руках;
● Вертикальным при прохождении ребенка через родовые пути зараженной матери при родах.
● Нередко инфицирование происходит во время хирургического вмешательства через медицинский инструментарий и во время проведения различных манипуляций.
Диагностика
Диагностировать наличие инфекции может только врач по результатам проведенного анализа на стафилококк.
Стоит помнить, что проведение анализа рекомендуется только, если присутствуют симптомы болезни. Наличие бактерии в биологическом материале может означать то, что человек является ее носителем, что само по себе является нормой.
Для анализа осуществляется забор материала из области, где предположительно развивается инфекция. Чтобы обнаружить патологический процесс проводятся несколько тестов, чтобы отследить динамику размножения бактерий. Если их число стремительно увеличивается, можно диагностировать наличие стафилококковой инфекции. Также дополнительный анализ позволит определить конкретный вид инфекции, чтобы доктор смог подобрать персональную схему лечения.
Чтобы обнаружить патологический процесс проводятся несколько тестов, чтобы отследить динамику размножения бактерий. Если их число стремительно увеличивается, можно диагностировать наличие стафилококковой инфекции. Также дополнительный анализ позволит определить конкретный вид инфекции, чтобы доктор смог подобрать персональную схему лечения.
Лечение
Лечение стафилококка может проводиться хирургическим способом при наличии гнойного поражения в области заражения. Также может потребоваться удалить инфицированный имплант, катетер и пр.
В качестве консервативного лечения стафилококка применяют антибиотики, антибактериальные средства в сочетании с иммуномодулирующей терапией. Препараты подбираются с учетом устойчивости стафилококка к большому ряду медикаментов. Большую эффективность показало применение бриллиантового зеленого раствора для обработки зараженных ран.
Какие анализы необходимо сдать
В первую очередь, для определения наличия инфекции сдается анализ на стафилококк.
При заболеваниях дыхательных путей сдают мазок из носо- и-ротоглотки, при цистите — мочу, при расстройстве ЖКТ — кал, при кожных поражениях — соскоб с кожи, а, если есть подозрения на обширное заражение, сдают кровь.
Также перед тем как начать лечение с применением антибиотиков, требуется сдать анализ на резистентность к этим медикаментам.
К какому врачу обращаться
Запущенными случаями заболевания занимается инфекционисту.
Но если у вас только появились подозрения и вы хотите получить точный диагноз, для начала вам следует обратиться к терапевту, с детьми – к педиатру. Доктор проведет диагностику и на основании полученных результатов выпишет вам направление к необходимому врачу.
Профилактика стафилококка
Главной мерой профилактики заражения стафилококком является постоянное соблюдение правил гигиены.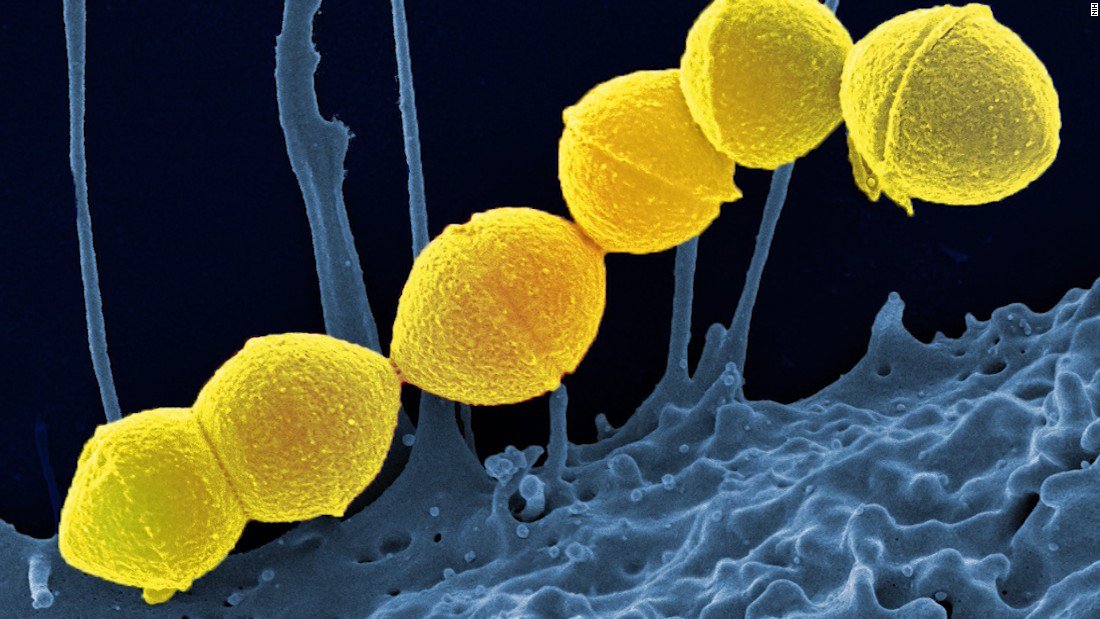 После пребывания в общественных местах или контакта с предметами общественного пользования необходимо тщательно мыть руки с мылом. Также важно не контактировать с главным источником заражения стафилококком — больными людьми.
После пребывания в общественных местах или контакта с предметами общественного пользования необходимо тщательно мыть руки с мылом. Также важно не контактировать с главным источником заражения стафилококком — больными людьми.
Как предотвратить заболевание
Чтобы предотвратить распространение стафилококка в организме и последующее развитие болезни, необходимо укреплять иммунитет. Для этого рекомендуется вести здоровый образ жизни, заниматься физической активностью, правильно питаться, соблюдая баланс витаминов и всех необходимых микроэлементов, потреблять достаточное количество воды.
Крепкий иммунитет сдержит активность патогенного микроорганизма в пределах безопасной нормы.
Будьте здоровы, дорогие пациенты!
Записаться на приемВведите пожалуйста свои данные
Вариабельность генов рекомбиназ и mecA стафилококковой хромосомной кассеты Staphylococcus haemolyticus Текст научной статьи по специальности «Биологические науки»
Вариабельность генов рекомбиназ и mecA стафилококковой хромосомной кассеты Staphylococcus haemolyticus
А. В. ПОЛОНСКАЯ’, *М. А. КОРНИЕНКО’, А. И. МАНОЛОВ’, Н. С. КУПЦОВ’, Г. Б. СМИРНОВ’, Л. А. ЛЮБАСОВСКАЯ2, Т. В. ПРИПУТНЕВИЧ2, Е. А. ШИТИКОВ’, Е. Н. ИЛЬИНА’
‘ Федеральный научно-клинический центр физико-химической медицины ФМБА, Москва
2 Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В. И. Кулакова, Москва
Variability of Recombinase Genes and Staphylococcal Cassette Chromosome mecA of Staphylococcus Haemolyticus
A. V. POLONSKAYA’, *M. A. KORNIENKO’, A. I. MANOLOV’, N. S. KUPTSOV’, G. B. SMIRNOV’, L. A. LYUBASOVSKAYA2, T. V. PRIPUTNEVICh3, E. A. SHITIKOV’, E. N. ILINA’
V. PRIPUTNEVICh3, E. A. SHITIKOV’, E. N. ILINA’
‘ Federal Research & Clinical Center of Physical-Chemical Medicine of Federal Medical Biological Agency, Moscow 2 National Medical Research Center for Obstetrics, Gynecology and Perinatology named after Academician V. I. Kulakova, Moscow
Коагулазо-отрицательные стафилококки (КОС), в частности Staphylococcus haemolyticus, играют важнейшую роль в этиологии внутрибольничных инфекций. Большинство КОС обладают устойчивостью к бета-лактамныш антибиотикам, которая реализуется за счёт продукции второго пенициллин-связывающего белка. Этот белок кодируется геном mecA и, совместно с генами рекомбиназ (ccr), входит в состав мобильного элемента стафилококков — стафилококковой хромосомной кассеты. В ходе исследования на коллекции из 142 геномов S.haemolyticus проведён анализ генов mecA и ccr. Ген mecA быш выявлен в 117 геномах (82,4%) и обладал выраженной консервативностью. На основании анализа последовательностей генов рекомбиназ установлено, что 118 образцов (83%) содержат ccr, причём описано 22 различных сочетания наличия гена mecA и генов рекомбиназ. Наиболее распространённым вариантом для S.haemolyticus явилось сочетание ccrA4B4 (25%). Для оценки вариабельности генов рекомбиназ предложены типо-специфические праймеры, работа который была валиди-рована на 54 клинических изолятах.
Ключевые слова: коагулазо-отрицательные стафилококки, S.haemolyticus, SCCmec, устойчивость к fi-лактамным антибиотикам
Coagulase-negative staphylococci (CNS), in particular Staphylococcus haemolyticus, play an important role in the etiology of nosocomial infections. Most CNS are resistant to beta-lactam antibiotics, which is realized through the production of the second penicillin-binding protein. This protein is encoded by the mecA gene and, together with the genes of recombinases (ccr), is part of the mobile element of staphylococci — the staphylococcal cassette chromosome. During the study, the mecA and ccr genes were analyzed using a collection of 142 genomes of S.haemolyticus. The mecA gene was detected in 117 genomes (82.4%) and had a pronounced conservation. Based on the analysis of recombinase gene sequences, it was established that 118 samples (83%) contain ccr, and 22 different combinations of the mecA and recombinase genes presence are described. The combination of ccrA4B4 was the most common for S.haemolyticus (25%). Type-specific primers were proposed, to assess the variability of recombinase genes, their performance was validated on 54 clinical isolates.
During the study, the mecA and ccr genes were analyzed using a collection of 142 genomes of S.haemolyticus. The mecA gene was detected in 117 genomes (82.4%) and had a pronounced conservation. Based on the analysis of recombinase gene sequences, it was established that 118 samples (83%) contain ccr, and 22 different combinations of the mecA and recombinase genes presence are described. The combination of ccrA4B4 was the most common for S.haemolyticus (25%). Type-specific primers were proposed, to assess the variability of recombinase genes, their performance was validated on 54 clinical isolates.
Keywords: coagulase-negative staphylococci, S.haemolyticus, SCCmec, resistance to fl-lactam antibiotics
Введение
Стафилококковая инфекция занимает одну из лидирующих позиций по частоте встречаемости в медицинской практике. При этом в последнее время наблюдается тенденция к возрастанию роли условно-патогенных коагулазо-отрицатель-ных стафилококков (КОС), а именно Б.НаетоуИ-еш, 8.гр1йггт1сИ$, Бмагпгп, в развитии внутри-больничных инфекций. КОС являются возбуди-
© Коллектив авторов, 2018
Адрес для корреспонденции: 119435, Москва, ул. Малая Пироговская, д. 1а. ФНКЦ ФМБА
телями около 30% случаев внутрибольничных инфекций кровотока, ассоциированных с использованием катетеров [1], их выявляют у 30% пациентов хирургических стационаров [2] и неонаталь-ных отделений [3].
Препаратами выбора при лечении стафилококковых инфекций являются в-лактамные антибиотики (БЛА) [4, 5]. Мишень их действия — участвующие в синтезе пептидогликана карбокси- и транспептидазы, известные также как пеницил-лин-связывающие белки (ПСБ). Связывание БЛА с ПСБ ведёт к инактивации ферментативной активности последних, прекращению роста и после-
дующей гибели микробной клетки. Уровень активности конкретных БЛА в отношении отдельных микроорганизмов в первую очередь определяется аффинностью этих антибиотиков к ПСБ [6].
Уровень активности конкретных БЛА в отношении отдельных микроорганизмов в первую очередь определяется аффинностью этих антибиотиков к ПСБ [6].
Повсеместное использование БЛА привело к увеличению числа микроорганизмов, устойчивых к действию этих антибиотиков. Большинство изо-лятов КОС (70—90%) устойчивы к метициллину и всем в-лактамным антибиотикам, тогда как у S.aureus таковыми являются только 20—30% изо-лятов [7]. Устойчивость стафилококков к этим антибиотикам обусловлена продукцией второго пе-нициллин-связывающего белка (РВР2а/ПСБ2а или РВР2’/ПСБ2′)[8]. Белок ПСБ2а, так же как и ПСБ, относится к классу транспептидаз и участвует в синтезе пептидогликана клеточной стенки стафилококков, при этом он имеет низкую аффинность к большинству полусинтетических пе-нициллинов и цефалоспоринов, продолжая функционировать в присутствии в-лактамных антибиотиков, нивелируя их действие.
ПСБ2а кодируется геном mecA, входящим в состав мобильного элемента — стафилококковой хромосомной кассеты (от англ. Staphylococcal cassette chromosome elements) (SCCmec). Основными компонентами SCCmec являются mec-ком-плекс и ccr-комплекс, а также дополнительный регион, так называемый J-участок. Mec-комплекс включает ген mecA, интактные или поврежденные регуляторные гены mecRl и mecl, а также ин-серционные последовательности IS431 и/или IS1272. Ccr-комплекс кодирует рекомбиназы, которые обеспечивают мобильность кассеты. Остальная часть кассеты представлена J-участками (J1, J2, J3), которые расположены по бокам и между комплексами mec и ccr, могут содержать различные гены устойчивости к тяжёлым металлам и бета-лактамным антибиотикам и псевдогены, которые не несут каких-либо значимых функций для клеток [10].
На данный момент описано три типа генов ccr. A, В и C. Каждый из трёх типов имеет несколько аллотипов. Считается, что если ccr гены обнаруживают менее 50% гомологии между собой, то они будут относиться к разным типам, а если их идентичность находится в пределах 50—85%, то к одному типу, но разным аллотипам [9].
Существуют SCCmec, не включающие ген mecA (псевдо SCCmec), но обладающие общими характеристиками SCCmec: наличием ccr генов (ccrAB или ccrC) и присутствием фланкирующих повторов, содержащих инсерционные последовательности [10].
Стафилококковые хромосомные кассеты активно используются для типирования стафилококков [11, 12], так как показано, что именно эта разновидность типирования наиболее подходит для исследования локальной эпидемиологии (для
оценки эпидемиологической ситуации по проблемным микроорганизмам в конкретном стационаре: определение родства микроорганизмов, установление источника инфекции, путей распространения микроорганизмов, исследования локальныгх вспышек).
Схема типирования SCCmec S.aureus заключается в определении типов тес-комплекса, типов и аллотипов ссг-комплекса при помощи амплификации со специфическими к каждому из элементов этих комплексов праймерами. На сегодняшний день описано 12 типов SCCmec, при этом новые типы выявляют ежегодно [13, 14].
После того, как SCCmec быши обнаружены у других видов стафилококков, например, у гемолитического и эпидермального, ранее разработанную схему стали применять и для типирования этих видов. Проблема такого подхода заключается в том, что, как показали исследования последних лет, у КОС SCCmec имеет более вариабельное строение [14]. В связи с этим схема типирования, разработанная для S.aureus, не отражает в полной мере особенности SCCmec коагулазо-отрицательных стафилококков, в том числе S.haemolyticus.
В рамках данной работы проведён анализ генов SCCmec S.haemolyticus: установлена вариабельность гена mecA, вымвлены1 основные типы рекомбиназ, а также предложена схема типирования рекомбиназ S.haemolyticus.
Материал и методы
Бактериальные изоляты. В исследование быта включена коллекция из 54 клинических изолятов S.haemolyticus. Образцы получены из ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. академика В. И. Кулакова» (38 изолята), Смоленского государственного медицинского университета (НИИ Антимикробной химиотерапии) (7 изолятов) и Ульяновского государственного технического университета (9 изолятов). Чистые бактериальные культуры были выделены из клинического материала (кала, крови, мочи, ликвора, со-скобов из зева, бронхоальвеолярного аспирата, отделяемого конъюнктивы, с повреждённой кожи, асцитической и плевральной жидкости, аутопсийного материала) путём пересева бактериальныгх клеток на питательную среду (5% кровяной агар, Oxoid). Для всех последующих манипуляций культивирование стафилококков проводили в триптон-соевом бульоне (Tryptic Soy Broth, Oxoid) при 37°С в аэробныгх условиях. Для видовой идентификации микроорганизмов использовали метод прямого масс-спектрометрического профилирования бактериального лизата [15].
Геномные последовательности. В работе использовали данные полногеномного секвенирования 168 образцов S.haemolyticus, представленных в базе данных NCBI (BioProjects: PRJEB2655 и PRJNA267549). Изоляты выделены из образцов крови человека, с раневых поверхностей, центральных венозных катетеров и др.
Кроме того, в рамках данной работы получены полногеномные последовательности трёх изолятов S.haemolyticus (SH527, Sh49 и SH864-1) методом высокопроизводительного секвенирования на приборе IonTorrent PGM (LifeTechnologies, США). Для приготовления библиотек использовали набор Ion Plus Fragment Library Kit
(Lifetechnologies, США) в соответствии с инструкциями производителя. Аннотированные последовательности изолятов представлены в базе данных NCBI под номерами JRAW00000000, JRAY00000000 и JRAX00000000.
Для подтверждения видовой принадлежности бактериальных геномов из базы NCBI использовали модуль таксономической классификации на основании уникальных видоспе-цифичных маркеров MetaPhlAn [16].
Биоинформатические методы анализа полногеномных данных. Сборка коротких геномных прочтений в контиги проведена при помощи алгоритма runAssembly (лаборатория биоинформатики, ФГБУ ФНКЦ физико-химической медицины ФМБА).
Множественное выравнивание нуклеотидных последовательностей и построение филогенетических деревьев проводили с использованием методов Parsimony и Distance программного обеспечения Seaview, version 4.6.1 [17] и Vector NTI 9.0 (Informax Inc, США).
Тип рекомбиназы определяли, сопоставляя нуклео-тидные последовательности анализируемых рекомбиназ и нуклеотидные последовательности референсных реком-биназ каждого типа (А1, А2, А3, А4, В1, В2, В3, В4, С), представленные на информационном ресурсе http://www.staphylococcus.net/.
Поиск определённых генов и белков осуществляли консольными алгоритмами Prokka [18] и BLAST [blast.ncbi.nlm. nih.gov/Blast.cgi].
Поиск однонуклеотидных полиморфизмов в гене mecA проводили алгоритмом VarScan [19]. В качестве референса использовался ген mecA S.haemolyticus штамма JCSC1435 (AP006716.1).
Молекулярно-генетические методы. Для выделения ДНК из бактериальных культур использовали набор «ДНК-экспресс» (ООО НПФ Литех, Россия) в соответствии с прилагаемыми инструкциями. Пробы ДНК хранились при -20°C.
Детекцию гена mecA, а также генов рекомбиназ стафилококковой кассеты осуществляли методом амплификации соответствующих генов. Для детекции mecA S.haemolyticus использовали стандартные праймеры [http://www.staphylococ-cus.net/]. Подбор праймеров для типирования рекомбиназ SCCmec S.haemolyticus осуществляли с помощью программного обеспечения Oligo MFC Application (Molecular Biology Insights, Inc., 6.3.1.1) (табл. 1). Подобранные праймеры были протестированы с помощью виртуальной ПЦР, реализованной сервисом ipcress (http://www.ebi.ac.uk/about/vertebrate-genomics/software/ipcress-manual) на созданной базе полногеномных последовательностей. Определение нуклеотидных последовательностей амплифицированных фрагментов ДНК
проводили модифицированным методом Сенгера с использованием ABI Prism Big Dye Terminator Cycle Sequencing Ready Reaction Kit и прибора ABI Prism 3730 Genetic Analyzer (Applied Biosystems, США) в соответствии с прилагаемыми инструкциями.
Результаты и обсуждение
При помощи модуля MetaPhlAn проведена видовая идентификация коллекции полногеномных данных, приписанных к гемолитическому стафилококку («=168), в результате которой 29 геномов были исключены из дальнейшего анализа по причине видового несоответствия и плохого качества сборки. Таким образом, была сформирована коллекция геномных последовательностей («=142) S.haemolyticus, 3 из которых были получены в лаборатории молекулярной генетики микроорганизмов ФНКЦ ФХМ в ходе данной работы.
На основе однонуклеотидных замен в «общих» («коровых» от англ. «core» — ядро) генах для всех образцов коллекции построено филогенетическое дерево (рис. 1), иллюстрирующее высокое генетическое разнообразие среди исследуемых геномов коллекции.
Cреди 142 образцов коллекции выявлено 117, содержащих ген mecA (рис. 1). Относительно рефе-ренсного гена mecA штамма S.haemolyticus JCSC1435 было найдено 4 однонуклеотидных полиморфизма (SNP, от англ. «single nucleotide polymorphism»): а18301 (Thr610Thr), c737t (Gly246Glu), a675t (Arg225Ser), a667g (Tyr223His). Аналогичную референсному штамму аминокислотную последовательность имели 33 образца (28,2%). Восемь образцов имели 2 SNPs относительно mecA S.haemolyticus JCSC1435: c737t и a675t. По одному образцу (0,85%) имели соответственно один (c737t) и два SNPs (a667g и c737t). Последовательность mecA наибольшего количества образцов (73/142, 62,4%) характеризовалась одним SNP (a675t) и была гомологична последовательности штамма S.aureus N315 (NG_047938.1), которая является ре-
Таблица 1. Праймеры для идентификации генов рекомбиназ SCCmec S.haemolyticus
Ген Последовательность праймеров (5′-3′) (прямой/обратный) Длина ампликона, п. о. Температура отжига, °C
ccrAl GTCAGTACAACGATATACGA 240 54
GAAAGAAGTCCTGACAAGT
ccrA2 TCAAAATGAGTCACCAACGG 750 54
TGGTTTCAATATAGGGGTA
ccrA3 TAAGCAATCAGGCAGAACGG 400 56
GTACTTGGTAGGGTTTACG
ccrA4 AGCGACGAATCAAATGTCC 540 54
GTTCAACGATATTGAGTGG
ccrBl CACCTGTTACTTATATTCTCTC 620 60
AATGGTTGGTTTGAGTGCAG
ccrB2 GTACAATCACATACATCTTAGC 632 60
TTCATATTTTTGAATACTTGGTC
ccrB3 ATAGTTGAAGACCTACATCGTC 336 60
TTTATGATTAAGTGCGTTAGCC
ccrB4 GAAGTATAGACACTGGAG 614 48
TTGATTCAATTCATCTTG
ccrC ATTTTGAATAATCCAGTC 200 50
GAAATCTCCACCAATAGG
Рис. 1. Филогенетическое дерево, построенное на основании анализа од-нонуклеотидных замен всех «общих» генов для образцов коллекции и характеристика генов SCCmec для них.
ференсной при анализе генетического разнообразия гена mecA золотистого стафилококка.
В ходе анализа генов рекомбиназ было выявлено, что 118 образцов из 142 содержат в составе геномов гены кассетных рекомбиназ. Причём в
Рис. 2. Филогенетический анализ генов рекомбиназ S.haemolyticus.
Филогенетические деревья построены на основании множественного выравнивания кассетных рекомбиназ.
а — рекомбиназы типа А; б- рекомбиназы типа В; в — рекомбиназа типа С.
19 полногеномных последовательностях ген mecA был найден, а рекомбиназы известных типов выявлены не были. В случае 5 последовательностей в геномах S.haemolyticus не были выявлены ни ген mecA, ни гены рекомбиназ.
На основании множественного выравнивания нуклеотидных последовательностей и построенного филогенетического дерева обнаруженные у 118 образцов рекомбиназы были разделены на три типа A, B и C. Типы А и В в свою очередь были подразделены на четыре ал-лотипа каждый (рис. 2).
Анализ филогенетических деревьев, построенных в пределах каждого из типов кассетных рекомби-наз (см. рис. 2), показал, что степень сходства между аллотипами лежит в пределах 67—80%, а внутри каждого аллотипа идентичность выше 85%. При этом нуклеотидные последовательности рекомбиназ золотистого стафилококка (показаны на рис. 2 треугольниками) довольно сильно отличаются от соответствующих аллотипов рекомбиназ гемолитического стафилококка (81—85% идентичности, что ниже
заявленной границы в 85%).
Что касается рекомбиназ типа С, то все нуклео-тидные последовательности показали идентичность более 90% (см. рис. 2).
На рис. 1 показан результат объединения филогенетического дерева, построенного на основе генов «коровых» белков, с наличием генов mecA и рекомбиназ трёх типов. В совокупности было вы-
В ПОМОЩЬ ПРАКТИКУЮЩЕМУВРАЧУ
Таблица 2. Распределение генов рекомбиназ и гена mecA в исследуемых выборках
Сочетание рекомбиназ и наличие гена тесА Геномная По данным анализа результатов
коллекция амплификации соответствующих генов
(и=142) у штаммов собранной коллекции (п=54)
mecA-ccг- 5 9
mecA-ccгA1B1+ 2
mecA-ccгA1B1+ccгB3+ 1
mecA-ccгA1B1+ccгA4B4+ccгC+ 1
mecA-ccгA3B3+ccгA4B4+ 3
mecA-ccгA4B4 5
mecA-ccгA4B4+ccгC+ 4
mecA-ccгB1+ 1
mecA-ccгB4+ 1
mecA-ccгC+ 2 4
mecA+ccг- 19 5
mecA+ccгA1+ 1
mecA+ccгA1B1+ 7
mecA+ccгA1B1+ccгA3B3+ 5
mecA+ccгA1B1+ccгC+ 1
mecA+ccгA1+ccгA4B4+ 4
mecA+ccгA1B1+ccгA3B3+ccгC+ 1
mecA+ccгA2+ 2
mecA+ccгA2B2+ 2
mecA+ccгA2+ccгB4+ 1
mecA+ccгA2B2+ccгA4B4+ 1
mecA+ccгA2+ccгA4B4+ 4
mecA+ccгA2B2+ccгA3B3+ccгA4B4+ccгC+ 2
mecA+ccгA3B3+ 6
mecA+ccгA3+ccгA4B4+ 1
mecA+ccгA3B3+ccгA4B4+ 3
mecA+ccгA4B4+ 35 16
mecA+ccгA4B4+ccгA2+ccгC+ 1
mecA+ccгA4B4+ccгC+ 7 5
mecA+ccгB4+ 1
mecA+ccrC+ 27 1
явлено 22 сочетания различных типов рекомби-наз и наличия или отсутствия гена mecA в исследуемых геномах (табл.гВ2, еегВ3 у штаммов коллекции обнаружены не были. Для выборочных штаммов результаты амплификации генов рекомбиназ были подтверждены методом секвенирования по Сэнгеру, в том числе для трёх штаммов 8И527, 8И39 и 8И864-1, подвергнутых полногеномному секвенированию. Типы рекомбиназ, определённых для этих штаммов методом амплификации с использованием предложенных праймеров, полностью совпадали с типом рекомбиназ, полученным на основании анализа геномных последовательностей этих штаммов. Кроме того, обнаружены штаммы, несущие ген mecA при отсутствии генов рекомбиназ (9,2%, 5/54) (см. табл. 2).
С развитием таких направлений медицины, как хирургия, неонатология, реаниматология, а также инвазивных технологий (гемодиализ, различные катетеры, импланты), значительно возросла роль внутрибольничных инфекций, возбудителями которых часто выступают КОС. Среди КОС превалируют штаммы, устойчивые к широкому спектру антибиотиков, в том числе и мети-циллиноустойчивые штаммы [20]. При этом КОС отличаются широким разнообразием БССтес и по всей вероятности являются резервуаром БССтес для более патогенного вида стафилококков — Б.аигет [21]. В настоящем исследовании были изучены особенности БССтес Б.каето1уН-ст, являющегося вторым по клинической значимости КОС. Кроме того, показано, что Б.Навтоуист по сравнению с другими КОС обладают повышенной тенденцией к развитию устойчивости к антибиотикам [22, 23].
Для оценки разнообразия кассеты Б.каето1уН-ст была сформирована коллекция геномных последовательностей, в которую вошли как образцы из МСВ1, так и секвенированные в ходе исследования. Штаммы Б.Ьаето1уИст, геномы которых вошли в коллекцию, были получены из 11 различных стран, а также выделены из разных источников (крови, кала, поверхность центральных венозных катетеров), что обеспечивало представленность выборки. Кроме того, на основании филогенетического анализа «основных» генов изучаемых образцов Б.Наето1уист (см. рис. 1) можно сделать вывод о генетическом разнообразии штаммов, вошедших в коллекцию.
В большинстве анализируемых полногеномных последовательностях был обнаружен ген тесА (82,4%), что подтверждает данные о высокой доле устойчивых к метициллину штаммов. При этом нуклеотидная последовательность тесА Б.Ьаето1уИст характеризовалась высокой консервативностью, а наибольшее количество образцов несло последовательность, идентичную последовательности аналогичного гена штамма Б.аигет N315. Стоит отметить, что ранее описаны несколько вариантов последовательности тесА, обладающих гомологией на уровне 70%: тесА1 Бжшп К11, тесА2 БМШтш С8В08, тесВ Масгососсш сазе1уйсш, тесС Б.аигет ЬОЛ251 [24]. В рамках данного исследования в геномах Б.Ьаето1уИст представленных генов выявлено не было.
Вопросу типирования рекомбиназ БССтес КОС, и в частности Б.каето1уйст, посвящён ряд работ, что связано с высокой степенью генетического разнообразия БССтес КОС. Описаны случаи, когда КОС содержат в составе своего генома более одного типа ссг БССтес [25]. Было показано, что для штаммов Б.Наето1уист наиболее часто характерны ссгС [26, 27, 28, 29]. Анализ коллекции
геномов показал что, наличие рекомбиназы С и гена mecA является часто встречающейся комбинацией (19%, 27/142 образцов), но в наибольшей части геномов при наличии гена mecA в состав SCCmec входят гены рекомбиназ типа А и В, относящиеся к 4 аллотипу (25%, 35/142 образцов).
Нужно отметить, что в данном исследовании были найдены штаммы S.haemolyticus, содержащие в своем геноме ген mecA, при отсутствии генов рекомбиназ SCCmec (13,4%, 19/142). Вероятно, это связано с наличием новых типов рекомби-наз с низкой гомологией с известными рекомби-назами. Эти данные подтверждают литературные источники, которые описывают случаи нетипиру-емых SCCmec. В некоторых исследованиях процент нетипируемых штаммов S.haemolyticus достигает 63,6% [26, 27, 28]. Также были установлены штаммы, в геноме которых при наличии генов рекомбиназ SCCmec отсутствовал ген mecA, т.е. штаммы с неполной (псевдо) SCCmec кассеты.
Полученные данные свидетельствуют о высокой вариабельности комбинации рекомбиназ, входящих в состав SCCmec кассеты S.haemolyticus, и соответственно о наличии различных типов этой кассеты. В совокупности с данными о наличии неполных (псевдо) SCCmec, описанный феномен косвенно свидетельствует о высокой частоте горизонтального переноса среди КОС и в частности среди S.haemolyticus. Кроме того, явление горизонтального переноса между штаммами S.haemolyticus подтверждает рис. 1. Из рис. 1 видно, что определённые типы рекомбиназ не связаны с какими-то определёнными кластерами филогенетического дерева, сформировавшихся в процессе эволюции «общих» генов.
Анализ филогенетических деревьев, построенных в пределах каждого из типов кассетных ре-комбиназ (см. рис. 2) показал отличие рекомби-наз гемолитического стафилококка от рекомби-наз S.aureus соответствующего аллотипа (81—85% идентичности, что ниже заявленной границы в 85%). В связи с чем, для штаммов S.haemolyticus было осуществлено тестирование праймеров, используемых для типирования SCCmec. Так, прай-меры на ген mecA с высокой точностью определяют наличие этого гена у S.haemolyticus, ввиду его высокой консервативности в пределах рода Staphylococcus. Однако праймеры на различные типы рекомбиназ не обладали достаточной гомологией с нуклеотидными последовательностями рекомбиназ S.haemolyticus для прохождения реакции амплификации. В связи с этим был предложен набор праймеров, подобранный непосредственно на основании сравнения нуклеотидных последовательностей рекомбиназ S.haemolyticus. Ещё одной причиной для создание альтернативной схемы типирования рекомбиназ S.haemolyticus является описание случаев нахождения штам-
мов S.-lactamase inhibitors. Curr Opin Microbiol 2011; 14 (5): 550—555.
5. Poole K. Resistance to beta-lactam antibiotics. Cell Mol Life Sci 2004; 61 (17): 2200—2223.
6. Сидоренко C.B., Яковлев C.B. Бета-лактамные антибиотики. РМЖ 1997; 21: 2.
7. Malhas A.M., Lawton R., Reidy M, Nathwani D, Clift B.A. Causative organisms in revision total hip & knee arthroplasty for infection: Increasing multi-antibiotic resistance in coagulase-negative Staphylococcus and the implications for antibiotic prophylaxis. Surgeon 2015; 13 (5): 250—255.
8. Laverdiere M. Trends in antibiotic resistance of staphylococci over an eight-year period: differences in the emergence of resistance between coagulase positive and coagulase-negative staphylococci. Microb Drug Resist 1998; 4 (2): 119—122.
9. Rolo J., Worning P., Nielsen J.B., Bowden R., Bouchami O., Damborg P. et al. Evolutionary origin of the staphylococcal cassette chromosome mec (SCCmec). Antimicrob Agents Chemother 2017; 61 (6) pii: e02302-16.
10. Shore A.C., Coleman D.C. Staphylococcal cassette chromosome mec: Recent advances and new insight. Int J Med Microbiol. 2013; 303 (6-7): 350—359.
11. Романов A.B., Дехнич A.B. Типирование MRSA: какие методы являются оптимальными для решения различных задач? Клиническая Микробиология и антимикробная химиотерапия. — 2011. — Т. 13. —№ 2. — С. 168—176. / Romanov A.V., Dekhnich A.V. Tipirovanie MRSA: kakie metody yavlyayutsya optimal’nymi dlya resheniya razlich-nykh zadach? Klinicheskaya Mikrobiologiya i antimikrobnaya khimioterapiya 2011; 13 (2): 168—176. [in Russian]
12. Shore A.C., Deasy E.C., Slickers P. et al. Detection of Staphylococcal Cassette Chromosome mec Type XI Carrying Highly Divergent mecA, mecl, mecRl, blaZ, and ccr Genes in Human Clinical Isolates of Clonal Complex 130 Methicillin-Resistant Staphylococcus aureus. Antimicrobial Agents and Chemotherapy 2011; 55 (8): 3765—3773.
13. Zhang Y., Agidi S., LeJeune J.T. Diversity of staphylococcal cassette chromosome in coagulase-negative staphylococci from animal sources. J Appl Microbiol 2009; 107 (4): 1375—1383.
14. Wu Z., Li F., Liu D., Xue H., Zhao X. Novel Type XII Staphylococcal Cassette Chromosome mec Harboring a New Cassette Chromosome Recombinase, CcrC2. Antimicrob Agents Chemother 2015; 59 (12): 7597—7601.
15. Корниенко M. A., Ильина E. H., Боровская A. Д., Эдельштейн M. B., Сухорукова M. B., Кострцева M., Говорун B. МПрямое бактериальное профилирование посредством MALDI масс-спектрометрии как метод быстрой классификации штаммов Staphylococcus aureus.
праймеров, были определены и соответствовали референсным.
Выражение признательности.
Работа финансировалась грантами Российского Научного Фонда 15-15-00158 и Российским фондом фундаментальных исследований 15-0408158. За счёт финансирования гранта 15-1500158 была собрана коллекция S.haemolyticus, проведены видовая идентификация и тестирование праймеров на рекомбиназы SCCmec. Работа по анализу геномных последовательностей, а также полногеномное секвенирование трёх изолятов S.haemolyticus проведены за счёт финансирования гранта 15-04-08158.
Биомедицинская химия. — 2012. — № 5. — С. 501—513. / Kornienko M. A., Il’ina E. N., Borovskaya A. D., Edel’shtejn M. V., Sukhorukova M. V., Kostrtseva M., Govorun V. M.Pryamoe bakterial’noe profilirovanie posredstvom MALDI mass-spektrometrii kak metod bystroj klassifikatsii shtammov Staphylococcus aureus. Biomeditsinskaya khimiya 2012; 5: 501—513. [in Russian]
16. Nicola S., Levi W., Ballarini A. Metagenomic microbial community profiling using unique clade-specific marker genes. Nature Methods 2012; 9: 811—814.
17. Galtier N., Gouy M., Gautier C. SeaView and Phylo_win, two graphic tools for sequence alignment and molecular phylogeny. Comput Applic Biosci 1996,12: 543—548.
18. Seemann T. Prokka: rapid prokaryotic genome annotation. Bioinformatics 2014; 30 (14): 2068—2069.
19. KoboldtD.C., Chen K., Wylie T., Larson D.E., McLellan M.D., Mardis E.R. et al. VarScan: variant detection in massively parallel sequencing of individual and pooled samples. Bioinformatics 2009; 25 (17): 2283—2285.
20. Diekema D.J., Pfaller M.A., Schmitz F.J, Smayevsky J, Bell J, SENTRY Partcipants Group. Survey of infections due to Staphylococcus species: frequency of occurrence and antimicrobial susceptibility of isolates collected in the United States, Canada, Latin America, Europe, and the Western Pacific region for the SENTRY Antimicrobial Surveillance Program, 1997-1999. Clin Infect Dis 2001; 32 Suppl 2: S114—132.
21. Hanssen A.M., Ericson Sollid J.U. SCCmec in staphylococci: genes on the move. FEMS Immunol Med Microbiol 2006; 46: 8—20.
22. Hope R., Livermore D.M., Brick G., et al. Non-susceptibility trends among staphylococci from bacteraemias in the UK and Ireland, 2001— 06. J Antimicrob Chemother 2008; 62: ii65—74.
23. Krediet T.G., Mascini E.M., van RooijE., Vooswijk J., Paauw A., Gerards L.J. et al. Molecular epidemiology of coagulase-negative staphylococci causing sepsis in a neonatal intensive care unit over an 11-year period. J Clin Microbiol 2004; 42 (3): 992—995.
24. Hiramatsu K., Tomasz A., de Lencastre H., Perreten V., Holden M.T., Coleman D.C. Guidelines for reporting novel mecA gene homologues.Ito T, International Working Group on the Classification of Staphylococcal Cassette Chromosome Elements (IWG-SCC). Antimicrob Agents Chemother 2012; 56 (10): 4997—4999.
25. Zong Z., Peng C., Lu X. Diversity of SCCmec Elements in Methicillin-Resistant Coagulase-Negative Staphylococci Clinical Isolates. PLoS One. 2011; 6 (5): e20191.
26. Iravani Mohammad Abadi M., Moniri R., Khorshidi A., Piroozmand A., Mousavi S.G., Dastehgoli K., Mirzaei Ghazikalayeh H. Molecular Characteristics of Nasal Carriage Methicillin-Resistant Coagulase Negative Staphylococci in School Students. Jundishapur J Microbiol 2015 Jun 27; 8 (6): e18591.
27. Salgueiro V.C., AzevedoM.B., lorioN.L., Amorim EdeL., dosSantosK.R. Staphylococcal cassette chromosome mec elements in methicillin-resistant coagulase-negative staphylococci from a Brazilian neonatal care unit. Pediatr Infect Dis J 2014; 33 (10): 1089—1090.
28. Sz.cz.uka E., Krajewska M., Lijewska D., Bosacka K., Kaznowski A. Diversity of staphylococcal cassette chromosome mec elements in nosocomial multiresistant Staphylococcus haemolyticus isolates. J Appl Genet 2016; 57 (4): 543—547.
29. Ito T., Ma X.X., Takeuchi F., Okuma K., Yuzawa H., Hiramatsu K. Novel type V staphylococcal cassette chromosome mec driven by a novel cassette chromosome recombinase, ccrC. Antimicrob Agents Chemother 2004; 48 (7): 2637—2651.
СВЕДЕНИЯ ОБ АВТОРАХ:
Полонская Алина Вадимовна — лаборант-исследователь лаборатории молекулярной генетики микроорганизмов ФГБУ ФНКЦ физико-химической медицины ФМБА, Москва Мария Андреевна Корниенко — к. б. н., научный сотрудник лаборатории молекулярной генетики микроорганизмов ФГБУ ФНКЦ физико-химической медицины ФМБА, Москва
Манолов Александр Иванович — к. б. н., младший научный сотрудник лаборатории биоинформатики ФГБУ ФНКЦ физико-химической медицины ФМБА, Москва Никита Сергеевич Купцов — лаборант-исследователь лаборатории молекулярной генетики микроорганизмов ФГБУ ФНКЦ физико-химической медицины ФМБА, Москва Георгий Борисович Смирнов — д. б. н., профессор, член-корреспондент РАН, главный научный сотрудник лаборато-
рии молекулярной генетики микроорганизмов ФГБУ ФНКЦ физико-химической медицины ФМБА, Москва Егор Александрович Шитиков — к. б. н., старший научный сотрудник лаборатории молекулярной генетики микроорганизмов ФГБУ ФНКЦ физико-химической медицины ФМБА, Москва
Елена Николаевна Ильина — д. б. н., профессор РАН, заместитель директора по научной работе ФГБУ ФНКЦ физико-химической медицины ФМБА, Москва Людмила Анатольевна Любасовская — к. м. н., заведующая отделением клинической фармакологии отдела микробиологии и клинической фармакологии ФГБУ «НМИЦ АГиП им. В. И. Кулакова» Минздрава России, Москва Татьяна Валерьевна Припутневич — д. м. н., заведующая отделом микробиологии и клинической фармакологии ФГБУ «НМИЦ АГиП им. В. И. Кулакова» Минздрава России, Москва
Стафилококкозы собак — Ветеринария и жизнь
Большое количество возбудителей в окружающей среде значительно усложняют жизнь домашних животных, в частности собаководов. Оградить животное от всех патогенов невозможно.
Поэтому, необходимо знать, как проявляются признаки заражения теми или иными микроорганизмами, в частности, патогенными стафилококками, и как лечить отдельно взятую инфекцию. Особенно распространены среди собак стафилококкозы.
Стафилококкозы — это группа заболеваний, причиной которых являются патогенные стафилококки видов: Staphylococcus aureus, Staphylococcus haemolyticus, Staphylococcus intermedius, Staphylococcus pseudintermedius, Staphylococcus epidermidis. Патология может развиваться по двум основным путям. Первый заключается в том, что стафилококк самостоятельно вызывает заболевание. В том случае, если он присоединяется к уже существующей проблеме, речь ведут о вторичной форме. Таким образом, стафилококк у собак может поражать различные органы (кожу, глаза, уши, слизистые оболочки носовой и ротовой полостей, мочеполовую систему, кровь и др.), но благодаря тому, что имеются характерные симптомы, можно вовремя заметить заболевание и начать лечение.
Стафилококк относится к грамположительным микроорганизмам. Он имеет шаровидную форму и определяется в виде скоплений, напоминающих гроздь винограда. Название бактерий возникло от лат. Staphylococcus, от греч. σταφυλή — «гроздь винограда» и греч. κόκκος — «зерно, ягода».
У каждой собаки имеется своя предрасположенность к возбудителю или же напротив, устойчивость.
При высокой сопротивляемости организма для инфицирования необходима огромная доза заражения.
В то же время, следует выделить основные предрасполагающие факторы, способствующие заболеванию:
— высокий уровень углеводов в организме собак;
— нарушение иммунитета;
— авитаминозы, а точнее недостаток витаминов A, E, группы В;
— отравление организма;
— заболевания кожи, в частности, клещи,блохи, аллергические реакции и пр.;
— настроенность иммунной системы в виде отсутствия устойчивости именно к этому возбудителю.
Практически все симптомы, которые вызывает стафилококк, связаны с состоянием кожи. Возможно, это объясняется тем, что у животного кожа не способна выполнять защитную функцию также эффективно, как, например, кожа человека. Наиболее часто регистрируется пиодермия, вызвать которую могут: золотистый стафилококк, гемолитический, псевдоинтермедиус и интермедиус, иногда эпидермальный стафилококк. Данная патология классифицируется в зависимости от того, на какую глубину распространяется патологический процесс. Поверхностная форма выражается в виде появления неглубоких эрозий и не сильно выраженного зуда. Прикосновение к ним вызывает болевые ощущения. Данная форма может быть с появлением влажных эрозий. Их провоцирует травма кожи или постоянное расчесывание вследствие наличия паразитов на коже собаки. Наиболее часто при этом золотистый стафилококк выявляется в области хвоста, на шее, под грудью и на лапах, в тех местах, где кожа наиболее тонкая и, следовательно, более уязвимая. Обострение заболевания может быть летом или весной, то есть в теплое время года.
Кроме этого пиодермия с поверхностным поражением кожи может регистрироваться у собак с выраженными кожными складками. В процессе жизнедеятельности в них скапливаются различные выделения и остатки корма. При отсутствии проветривания присоединяется инфекция, которой, как правило, и являются патогенные виды стафилококков.
Помимо кожного покрова, у собак стафилококк может поражать и слизистые оболочки ротовой полости, глаз, репродуктивных органов; уши.
Есть еще один симптом, который часто регистрируется у собак и не всегда владельцы догадываются, что его причиной также является стафилококк. Речь идет об отитах. Это может быть скрытое течение или бурно протекающая болезнь. В некоторых случаях патология поражает даже ткани внутреннего уха, что проявляется в виде язв и эрозий. Если данную патологию вовремя не вылечить, то может присоединиться конъюнктивит и ринит.
Чтобы распознать у собаки стафилококкоз, необходимо как можно раньше обратиться к врачу при появлении первых симптомов.
Основой диагностики стафилококкоза является бактериологический анализ. В качестве патологического материала в лабораторию направляют: пробы гноя, мокроты, смывы из носа, рта, дёсен, ушей и конъюнктивы, кровь, испражнения, пунктат из уха, соскобы с кожи, материалом для бактериологического исследования могут также служить пробы корма.
Специалисты ФГБУ «Краснодарская МВЛ» проводят диагностику стафилококкозов собак при помощи классических бактериологических методов, а также импортных тест-систем. Срок исследования составляет 4-5 дней.
Своевременно поставленный диагноз позволит грамотно провести лечение с учётом чувствительности выделенной культуры стафилококка к антибактериальным препаратам, получить лечебный эффект.
Источник: пресс-служба ФГБУ «Краснодарская МВЛ»
Бакпосев на флору и чувствительность к антибиотикам
Универсальное микробиологическое исследование, позволяющее определить наличие и основные культуральные свойства (титр, количество), чувствительность к основным группам антибактериальных препаратов) большинства аэробных микроорганизмов, растущих на обычных питательных средах. Для исследования подходит практически любой вид биологического материала. Анализ используют для микробиологической диагностики неспецифических инфекционных заболеваний, выявления возбудителей хронических инфекций, определения наиболее подходящего препарата для антибактериальной терапии. Чувствительность к антибиотикам для нормальной микрофлоры не определяется.
Список нормальной микрофлоры:
- Зев и нос:- Streptococcus viridians — Staphylococcus epidermidis — Staphylococcus saprophyticus — Staphylococcus haemolyticus — Дифтероиды — Neisseria spp (кроме Neissria meningitidis)
- Мазки урогенитальные (женские) – Lactobacillus — Сorynebacterium urealytica (дифтероиды) — Staphylococcus epidermidis (в титре ниже 1х10^4) — Staphylococcus saprophyticus(в титре ниже 1х10^4)
Указанные выше микроорганизмы относятся к постоянной нормальной микрофлоре и не требуют лечения антимикробными препаратами, т.к. при их отсутствии могут возникнуть проблемы «дисбактериоза» в указанных органах (снижение местного иммунитета, рецидивы хронических заболеваний) . Лечение этих микроорганизмов антибиотиками сравнимо, с лечением антибиотиками лакто- и бифидобактерий в кишечнике. При обнаружении микробиологическим методом микроорганизмов, составляющих нормальную микрофлору, или условно-патогенных микроорганизмов в титре менее диагностического не определяется чувствительность к антибиотикам и бактериофагам, так как это количество не является значимым и не требует лечения противомикробными препаратами.
Стоимость исследования
Характеристика грамположительной микрофлоры, выделенной из крови кардиохирургических пациентов
ГлавнаяСамойлова Л. М., Горбатых Ю. Н., Струнин О. В., Прохоров С. Н., Новикова М. А.
ННИИПК Им. Акад. Е.Н. Мешалкина, Новосибирск, Россия;
Цель исследования: Изучить структуру, выделенных из крови у кардиохирургических пациентов, грамположительных кокков и спектр их чувствительности к антибиотикам. Материалы и методы: Обследованы пациенты, оперированные в ННИИПК за период с 2007 по 2011 год. Всего взято 16586 образцов. Для бактериологического исследования крови использовали автоматизированную систему BacT/Alert 3D, идентификацию микроорганизмов проводили при помощи анализаторов ATB Ex * pression (BioMerieux, Франция) и Phoenix (BD, США). Результаты: За пятилетний период (с 2007 по 2011 гг.) при исследовании гемокультуры выделено 903 штамма микроорганизмов, из них 508 – грамположительные кокки, что составило 56,3%. В структуре выделенной кокковой флоры преобладал стафилококк, на его долю приходится 70,3%, из них 42,3% составил Staphylococcus epidermidis. Всего выделялось 13 видов стафилококков, прочие коагулазонегативные стафилококки составили 23,6%, чаще других регистрировался Staphylococcus hominis и Staphylococcus saprophyticus – 6,7% и 6,9% соответственно, Staphylococcus haemolyticus – 5,7%. На долю Staphylococcus aureus приходится 4,3% в структуре грамположительных кокков. Эпидермальный стафилококк характеризовался высокой частотой обнаружение метициллинрезистентных штаммов (91,2%). Все выделенные штаммы были чувствительны к ванкомицину и линезолиду. Также высокой активностью в отношении Staphylococcus epidermidis обладал моксифлоксацин (90,3%). Чувствительность выделенных штаммов к другим фторхинолонам (ципрофлоксацину, левофлоксацину) была невысока – (33%, 39,8%). Среди других препаратов следует отметить высокую активность фузидиевой кислоты (85,5%), к рифампицину были чувствительны 61,4% штаммов, к ко-тримоксазолу – 50% штаммов. Чувствительность Staphylococcus aureus к оксациллину была значительно выше – 66,7%, к ванкомицину и линезолиду чувствительны все выделенные штаммы. Энтерококки в структуре выделенных грамположительных кокков составили 25,6%, из них Enterococcus faecalis 12,4%, Enterococcus faecium 11,2%, прочие 1,9%. К ванкомицину были чувствительны 100% штаммов Enterococcus faecalis и Enterococcus faecium, к линезолиду чувствительны 95% и 92,7% штаммов соответственно, к гентамицину сохраняли чувствительность 26,4% и 18,3% шмаммов. Ампициллин был активен в отношении 89,4% штаммов Enterococcus faecalis и только 10% Enterococcus faecium. Стрептококк за исследуемый период составил 4,1% в структуре выделенных грамположительных кокков. Выводы: В структуре, выделенных из крови, грамположительных кокков преобладал метициллинрезистентный Staphylococcus epidermidis. К ванкомицину были чувствительны все выделенные штаммы стафилококка и энтерококка, высокой активностью обладал линезолид.Staphylococcus Haemolyticus — обзор
B грамположительных организмов
Фторхинолоны обладают хорошей активностью против Staphylococcus aureus и многих коагулазонегативных стафилококков (Barry, 1990; Eliopoulos and Eliopoulos, 1989); Сюда входят Staphylococcus epidermidis, Staphylococcus haemolyticus и мочевой патоген Staphylococcus saprophyticus . В 1980-х годах МПК фторхинолонов против стафилококков, включая метициллин-резистентные стафилококки, находились в пределах 0.25 и 2 мк г / мл. К сожалению, с 1989 г. метициллин-устойчивый S. aureus , устойчивый к фторхинолонам, был обнаружен в Соединенных Штатах и в остальном мире (Blumberg et al. ., 1991; Kaatz et al. ., 1991; Isaacs et al. al ., 1989; Maple et al. ., 1989; Schaeffer, 1989; Shalit et al. ., 1989). Эти штаммы имеют МИК в диапазоне 4–32 мкг мкг / мл. Такие соединения, как тосуфлоксацин и спарфлоксацин, ингибируют стафилококки при более низких концентрациях (т.е.е., 0,12 мкг мкг / мл) и будет ингибировать ряд устойчивых к метициллину S. aureus (MRSA), устойчивых к ципрофлоксацину, в концентрациях 1 мкг мкг / мл (Chin et al ., 1991).
Ряд фторхинолонов не обладают клинически эффективной активностью против стрептококков, таких как Streptococcus pyogenes , Streptococcus agalactiae и Streptococcus pneumoniae . Эноксацин, ломефлоксацин, пефлоксацин, амифлоксацин, норфлоксацин и флероксацин имеют МИК для этих видов в диапазоне 4–16 мк мкг / мл.Ципрофлоксацин, офлоксацин, темафлоксацин, тосуфлоксацин и спарфлоксацин подавляют виды стрептококков, причем наибольшая активность наблюдается со спарфлоксацином, тосуфлоксацином и некоторыми из перечисленных соединений, таких как OPC-17116 и PD-127391; соединения (Barry и др. ., 1992).
Активность фторхинолонов в отношении видов энтерококков также варьирует, хотя многие штаммы ингибируются 2 μ мкг / мл офлоксацина, ципрофлоксацина и темафлоксацина (Chin et al ., 1988). Тосуфлоксацин и спарфлоксацин более активны (Чин и др. ., 1991; Эспиноза и др. ., 1988). Listeria monocytogenes ингибируются новыми фторхинолонами, но не теми фторхинолонами, которые не ингибируют виды стрептококков (Neu, 1992).
Staphylococcus haemolyticus — microbewiki
Страница Microbial Biorealm по роду Staphylococcus haemolyticus
Классификация
Таксоны высшего порядка
Бактерии; Фирмикуты; Бациллы; Бациллы; Staphylococcaceae; Стафилококк
Виды
Гемолитический стафилококк
Описание и значение
Staphylococus haemolyticus — коагулазонегативный представитель рода Staphylococcus.Бактерии могут быть обнаружены на нормальной флоре кожи человека и могут быть выделены из подмышечных впадин, промежности и паховых областей человека. S.haemolyticus также является вторым по частоте встречаемости коагулазонегативных стафилококков в крови человека (1).
Не обладая коагулазой, ферментоподобным белком, который традиционно ассоциировался с вирулентным потенциалом стафилококков, коагулазонегативные стафилококки обычно считаются низковирулентными патогенами по сравнению с хорошо известным патогенным коагулазо-положительным Staphylococcus aureus .Однако недавние исследования показывают, что коагулазонегативные стафилококки стали основной причиной оппортунистической инфекции (2). Сам по себе Staphylococcus haemolyticus также является замечательным условно-патогенным микроорганизмом, который хорошо известен своим фенотипом с высокой устойчивостью к антибиотикам (3). Бактерии могут вызывать менингит, инфекции кожи или мягких тканей, инфекции протезных суставов или бактериемию (2). Способность бактерий одновременно противостоять нескольким типам антибиотиков наблюдалась и изучалась в течение длительного времени (2).Общие антибиотики, к которым у S. haemolyticus характерна резистентность , включают метициллин, гентамицин, эритормицин и, уникальные среди стафилококков, гликопептидные антибиотики (2). Гены устойчивости к каждому типу антибиотика могут быть расположены на хромосоме (метициллин), на плазмидах (эритромицин) или на хромосоме и плазмидах (гентамицин) (4).
Чтобы изучить способность Staphylococcus haemolyticus к множественной лекарственной устойчивости и его патогенные признаки, исследователи секвенировали весь геном одного штамма, JCSC1435 (3).Помимо генов устойчивости бактерий к антибиотикам, исследование последовательности также выявило удивительное количество гомологичных инсерционных последовательностей (IS), которые могут быть ответственны за частые геномные структуры, наблюдаемые в этом организме (4).
Структура генома
Геном Staphylococcus haemolyticus (штамм JCSC1435) включает кольцевую хромосому размером 2 685 015 п.н. и 3 плазмиды по 2300 п.н., 2366 п.н. и 8180 п.н. (3).
Сравнительный геномный анализ выявил значительное сходство между геномами S.haemolyticus и таковые из двух других хорошо известных стафилококков, S. aureus и S. epidermis . Помимо сопоставимых размеров генома, большая часть открытых рамок считывания (orfs) сохраняется как в последовательностях, так и в их порядке на хромосоме (3). Однако исследование также обнаружило область на хромосоме, уникальную для каждого из трех организмов. Эта область, расположенная рядом с точкой начала репликации хромосомы (oriC), поэтому называется «oriC Environment». Поскольку большая часть области может быть удалена без ущерба для роста, можно сделать вывод, что область oriC Environment не содержит генов, необходимых для жизнеспособности бактерий (3).С другой стороны, этот регион, скорее всего, отвечает за разнообразие видов стафилококков и позволяет бактериям успешно колонизировать и инфицировать человека-хозяина (3).
Помимо наличия области oriC Environment, в которой часто могут происходить перестройки генома, S.haemolyticus также обладает удивительно большим количеством инсерционных последовательностей (IS) (3). Эти IS могут либо инактивировать ген путем прямой интеграции в открытую рамку считывания, либо активировать ген, снабдив ген мощным промотором.Изменяя состав генома, элементы IS могут способствовать врожденной способности бактерий приобретать лекарственную устойчивость (3).
В то время как 6% орфов, обнаруженных в более вирулентном S.aureus , являются патогенными факторами, только 2% из них, обнаруженных в S.haemolyticus , являются патогенными факторами (3). Однако именно способность S.haemolyticus изменять свой геном и приобретать устойчивость к антибиотикам делает этот вид замечательным и трудно контролируемым условно-патогенным микроорганизмом.
Строение клетки и обмен веществ
Стенка клетки
Как грамположительный вид, как и другие стафилококки, S.haemolyticus имеет толстую пептидогликановую стенку за пределами своей мембраны и, следовательно, может быть мишенью антибиотиков, которые мешают процессу биосинтеза пептидогликана. Однако у некоторых штаммов S.haemolyticus развилась устойчивость к гликопептидным антибиотикам, таким как тейкопланин и ванкомицин (5, 13). Это уникальная способность стафилококков (5).Структура пептидогликана S.haemolyticus была изучена (5), чтобы выяснить факторы, ответственные за эту особую устойчивость.
Как и у других стафилококков, пептидогликан S.haemolyticus сильно сшит. Преобладающими поперечными мостиками являются COOH-Gly-Gly-Ser-Gly-Gly-Nh3 и COOH-Ala-Gly-Ser-Gly-Gly-Nh3. В устойчивых штаммах исследования обнаружили поперечные мостики, которые содержат дополнительный серин вместо глицина (таким образом, поперечными мостиковыми структурами являются COOH-Gly-Ser-Ser-Gly-Gly-Nh3 и COOH-Ala-Gly-Ser-Ser- Gly-Nh3) (5).Кроме того, присутствие нового цитоплазматического предшественника пептидогликана, UDP-мурамил-тетрапептида-D-лактата, было обнаружено в штаммах S.haemolyticus (5). Считается, что этот предшественник и изменения поперечных мостиков препятствуют совместному связыванию гликопептидных антибиотиков, таких как ванкомицин и тейкопланин, с их мишенями в S.haemolyticus (5).
Метаболизм
Полногеномное секвенирование S.haemolyticus (штамм JCSC1435) выявило некоторые orfs, кодирующие метаболические гены, уникальные для данного вида, такие как гены, участвующие в транспорте рибозы и рибита или биосинтезе основных компонентов нуклеиновых кислот и теховых кислот клеточной стенки ( 3).Благодаря этим уникальным орфам, S.haemolyticus обладает относительно высокой биосинтетической способностью. Штамму JCSC1435 требуется только аргинин для роста, тогда как штамму S.aureus N315 требуется доступность множества различных аминокислот: аланина, глицина, изолейцина, аргинина, валина и пролина (3).
S.haemolyticus (штамм JCSC1435) также обладает способностью ферментировать маннит, метаболическая характеристика, также обнаруженная у некоторых других «не золотистых» стафилококков (3).Однако генетический анализ показал, что определенные штаммы S.haemolyticus могли получить эту способность в результате горизонтального переноса генов локуса PTS маннитола от других видов бактерий (3). Это еще один пример, демонстрирующий гибкость генома S.haemolyticus .
Экология
Staphylococcus haemolyticus можно найти на коже и в организме многих млекопитающих, в том числе прозимий, обезьян, домашних животных и человека (1).Наиболее частые естественные места обитания бактерий у человека находятся в подмышечных впадинах (подмышечная область), в промежности (лобковая область) и в паховой области (1). S.haemolyticus успешно выживает в более сухих частях тела (1), а также часто встречается в культурах крови человека (3).
Известно, что S.haemolyticus продуцирует ингибитор гонококкового роста, GGI (1). Впервые было обнаружено, что это вещество вызывает утечку цитоплазмы в гонококковых клетках и в конечном итоге приводит к гибели клеток (1,6).Примечательно, что это вещество также может лизировать эритроциты, особенно лошади и человека (6).
Патология
Стафилококки обычно вызывают заболевания из-за их способности широко распространяться в тканях и выработки внеклеточных веществ (7). Одним из примеров таких веществ является коагулаза, ферментоподобный белок, продуцируемый S.aureus , который может откладывать фибрин на поверхности бактерий, изменяя их поглощение и разрушение фагоцитарными клетками (7).
Традиционно считается, что продукция коагулазы представляет собой инвазивный патогенный потенциал среди стафилококков (7). S.haemolyticus , однако, является коагулазонегативным видом. Таким образом, как и у других стафилококков, не относящихся к золотистым, его патогенные признаки не были хорошо изучены до недавнего времени, когда S.haemolyticus стала основной причиной нозокомиальных инфекций (инфекций, приобретенных во время лечения в больнице по поводу другого заболевания). Зарегистрированы случаи заражения S.haemolyticus включают сепсис (дисфункцию систем органов в результате иммунного ответа на тяжелую инфекцию), перитонит (воспаление серозной оболочки, выстилающей брюшную полость) и инфекции мочевыводящих путей, ран, костей и суставов (1). Сообщалось также, что в редких случаях S.haemolyticus вызывает инфекционный эндокардит, воспаление сердца (эндокарда), что может привести к серьезным осложнениям, таким как сердечная недостаточность или смерть (2). Общие клинические симптомы S.haemolyticus — это лихорадка и увеличение популяции лейкоцитов (лейкоцитоз) (2).
Являясь наиболее распространенным патогеном среди стафилококков, хорошо известны вирулентные факторы S.aureus . Среди них важны различные классы энтеротоксинов (токсины, выделяемые в нижних отделах кишечника, вызывающие пищевое отравление), токсины синдрома токсического шока и гемолизин (вещества, которые позволяют бактериям разрушать эритроциты) (8). Некоторые из этих веществ считались принадлежащими исключительно к S.aureus , но недавно были обнаружены и у других коагулазонегативных стафилококков, кроме aureus (1). Например, в одном исследовании, опубликованном в 1994 г., все исследуемые штаммы S.haemolyticus продуцировали гемолизины in vitro (9). Поэтому исследователи предположили, что гемолизины могут быть важным фактором, ответственным за высокую вирулентность этого вида стафилококков (9).
S.haemolyticus ’GGI родственны по функции и характеристикам другим относительным вирулентным факторам стафилококков, таким как дельта-лизин в S.aureus и SLUSH (синергетический гемолизин Staphylococcus lugdunensis ) в S.lugdunensis , последний из которых показывает значительное сходство по структуре с GGI (1). Эти данные свидетельствуют о связи между путями патогенеза и вирулентными факторами распространенных стафилококковых патогенов.
Применение в биотехнологии
Staphylococcus haemolyticus вместе с родственными ему стафилококками, такими как S.aureus и S.epidermis , обладает классом липазных ферментов, которые участвуют в процессе гидролиза длинноцепочечных триацилглицеронов (10). Благодаря уникальным полезным свойствам ферментов, таким как избирательность по длине цепи и хиральная селективность, они широко используются в промышленном производстве и синтезе жирных кислот, жиров, масел, сложных эфиров и пептидов (10).
Близкий родственник S.haemolyticus , коагулазонегативный Staphylococcus xylosus , был использован для создания системы вектор-хозяин, которая может экспрессировать рекомбинантные белки на поверхности бактериальной клетки (11).Впервые такая система могла быть построена на грамположительных видах. Этот метод значительно облегчает изучение рецепторов, субстрат-связывающих белков и других антигенных детерминант, экспрессируемых на поверхности бактерий (11).
Текущие исследования
Хотя Staphylococcus haemolyticus относительно менее вирулентен, чем некоторые другие стафилококки, такие как S.aureus , способность этого вида приобретать множественную антибиотикорезистентность представляет серьезную угрозу для медицинских учреждений во всем мире.Полногеномное секвенирование S.haemolyticus , проведенное исследовательской группой из Университета Джутендо в Токио, Япония, под руководством доктора Кейити Хирамацу (3), является очень важным и значительным шагом в решении этой проблемы. Информация, предоставляемая последовательностью генома, не только позволит провести дальнейшие исследования характерного для данного вида бактериального образа жизни, но также будет способствовать «разработке новых иммунотерапевтических и химиотерапевтических подходов для их контроля» (3).
После обнаружения большого количества копий IS в хромосоме, как упоминалось выше (3), Dr.Группа Хирамацу продолжает изучать другие типы генетической перестройки, которые также ответственны за частые структурные изменения генома S.haemolyticus . Недавние результаты пролили свет на новый механизм генетической перетасовки S.haemolyticus , в котором «точное удаление и самоинтеграция составного транспозона» (ISSha1) приводит к крупномасштабной инверсии / делеции хромосом, обнаруженной в клиническом штамме. JCSC1435 (12).
Помимо геномных и генетических подходов, проводятся клинические исследования в сочетании с молекулярными подходами для поиска более эффективных стратегий против развития S.haemolyticus устойчивых к антибиотикам штаммов. Исследования нацелены на многообещающую стратегию, в которой различные типы антибиотиков используются синергетически для борьбы с конкретными устойчивыми к антибиотикам штаммами. Некоторые примеры — комбинация гликопептидных и бета-лактамных антибиотиков против метициллин- и тейкопланинорезистентных штаммов стафилококков или комбинация ванкомицина и бета-лактамных антибиотиков (13).
Список литературы
1. Тристан, А., Лина, Г., Этьен, Дж.И Ванденеш Ф. в (редакторы Фишетти В., Новик Р., Ферретти Дж., Портной Д. и Руд Дж.) 572-586 (ASM Press, Вашингтон, округ Колумбия, 2006).
2. Falcone, M. et al. Эндокардит, вызванный Staphylococcus haemolyticus: клинико-микробиологический анализ 4 случаев. Диаг. Microbiol. Заразить. Дис. 57, 325-331 (2007).
3. Takeuchi, F. et al. Полногеномное секвенирование staphylococcus haemolyticus раскрывает чрезвычайную пластичность его генома и эволюцию видов стафилококков, колонизирующих человека.J. Bacteriol. 187, 7292-7308 (2005).
4. Фроггатт, Дж. У., Джонстон, Дж. Л., Галетто, Д. У. и Арчер, Г. Л. Устойчивость к противомикробным препаратам у внутрибольничных изолятов Staphylococcus haemolyticus. Противомикробный. Агенты Chemother. 33, 460-466 (1989).
5. Billot-Klein, D. et al. Синтез и структура пептидогликана в Staphylococcus haemolyticus, выражающем повышенные уровни устойчивости к гликопептидным антибиотикам. J. Bacteriol. 178, 4696-4703 (1996).
6. Уотсон, Д. К., Yaguchi, M., Bisaillon, J. G., Beaudet, R. & Morosoli, R. Аминокислотная последовательность ингибитора роста гонококков из Staphylococcus haemolyticus. Biochem. J. 252, 87–93 (1988).
7. Брукс, Дж., Бутел, Дж. И Морс, С. в медицинской микробиологии 197-202 (McGraw-Hill, Нью-Йорк, 2001).
8. Новик, Р. в грамположительных патогенах (ред. Фишетти, В., Новик, Р., Ферретти, Дж., Портной, Д. и Руд, Дж.) 496-510 (ASM Press, Вашингтон, округ Колумбия) , 2006).
9. Мольнар, К., Hevessy, Z., Rozgonyi, F. & Gemmell, C.G. Патогенность и вирулентность коагулазонегативных стафилококков в отношении адгезии, гидрофобности и продукции токсинов in vitro. J. Clin. Патол. 47, 743-748 (1994).
10. О, Б., Ким, Х., Ли, Дж., Кан, С. и О, липаза T. Staphylococcus haemolyticus: биохимические свойства, субстратная специфичность и клонирование генов. FEMS Microbiol. Lett. 179, 385-392 (1999).
11. Hansson, M. et al. Экспрессия рекомбинантных белков на поверхности коагулазонегативной бактерии Staphylococcus xylosus.J. Bacteriol. 174, 4239-4245 (1992).
12. Ватанабэ С., Ито Т., Моримото Ю., Такеучи Ф. и Хирамацу К. Точное удаление и самоинтеграция составного транспозона как модель спонтанной крупномасштабной инверсии / делеции хромосом. клинического штамма Staphylococcus haemolyticus JCSC1435. J. Bacteriol. 189, 2921-2925 (2007).
13. Виньяроли, К., Бьяваско, Ф. и Варальдо, П. Е. Взаимодействие между гликопептидами и бета-лактамами против изогенных пар чувствительных к тейкопланину и устойчивых штаммов Staphylococcus haemolyticus.Противомикробный. Агенты Chemother. 50, 2577-2582 (2006).
КМГ
Распространенность метициллин-резистентного Staphylococcus haemolyticus у домашних животных: перекрестное исследование | Annals of Clinical Microbiology and Antimicrobials
Wieler LH, Ewers C, Guenther S, Walther B, Lübke-Becker A: Метициллин-резистентные стафилококки (MRS) и энтеробактерии, продуцирующие бета-лактамазы расширенного спектра (ESBL) животные: внутрибольничные инфекции как одна из причин растущей распространенности этих потенциальных зоонозных патогенов в клинических образцах.Int J Med Microbiol. 2011, 301: 635-641. 10.1016 / j.ijmm.2011.09.009
PubMed Статья Google ученый
Kluytmans JA: Метициллин-устойчивый золотистый стафилококк в пищевых продуктах: повод для беспокойства, случай для самоуспокоенности ?. Clin Microbiol Infect. 2010, 16: 11-15. 10.1111 / j.1469-0691.2009.03110.x
PubMed CAS Статья Google ученый
Catry B, Van Duijkeren E, Pomba MC, Greko C, Moreno MA, Pyörälä S, Ruzauskas M, Sanders P, Threlfall E, Ungemach F, Törneke K, Munoz-Madeiro C, Torren-Edo J: Отражение MRSA в животные-производители пищевых продуктов и животные-компаньоны: эпидемиология и возможности борьбы со здоровьем человека и животных. Epidemiol Infect. 2010, 138: 626-644. 10.1017 / S0950268810000014
PubMed CAS Статья Google ученый
Chu VH, Woods CW, Miro JM, Hoen B, Cabell CH, Pappas PA, Federspiel J, Athan E, Stryjewski ME, Nacinovich F, Marco F, Levine DP, Elliott TS, Fortes CQ, Tornos P , Гордон Д.Л., Утили Р., Делахай Ф., Кори Г.Р., Фаулер В.Г.: Возникновение коагулазонегативных стафилококков как причина эндокардита нативного клапана.Clin Infect Dis. 2008, 46: 232-10.1086 / 524666
PubMed Статья Google ученый
Роджерс К.Л., Фей П.Д., Рупп М.Э .: Коагулазонегативные стафилококковые инфекции. Заражение Dis Clin North Am. 2009, 23: 73-98. 10.1016 / j.idc.2008.10.001
PubMed Статья Google ученый
Takeuchi F, Watanabe S, Baba T., Yuzawa H, Ito T, Morimoto Y, Kuroda M, Cui L, Takahashi M, Ankai A, Baba S, Fukui S, Lee JC, Hiramatsu K: Whole- секвенирование генома Staphylococcus haemolyticus раскрывает чрезвычайную пластичность его генома и эволюцию стафилококков, колонизирующих людей.J Bacteriol. 2005, 187: 7292-7308. 10.1128 / JB.187.21.7292-7308.2005
PubMed CAS PubMed Central Статья Google ученый
Barros EM, Ceotto H, Bastos MCF, DosSantos KRN, Giambiagi-deMarval M: Staphylococcus haemolyticus как важный больничный патоген и носитель генов устойчивости к метициллину. J Clin Microbiol. 2012, 50: 166-168. 10.1128 / JCM.05563-11
PubMed CAS PubMed Central Статья Google ученый
Froggatt JW, Johnston JL, Galetto DW, Archer GL: Устойчивость к противомикробным препаратам в нозокомиальных изолятах Staphylococcus haemolyticus . Противомикробные агенты Chemother. 1989, 33: 460-466. 10.1128 / AAC.33.4.460
PubMed CAS PubMed Central Статья Google ученый
Pereira PMA, Binatti VB, Sued BPR, Ramos JN, Peixoto RS, Simões C, DeCastro EA, Duarte JLMB, Vieira VV, Hirata R, Santos KRN, Guaraldi ALM, Pereira JAA hastaphylococus. среди новорожденных с бактериемией в отделении интенсивной терапии новорожденных Рио-де-Жанейро, Бразилия.Диагностика Microbiol Infect Dis. 2014, 78: 85-92. 10.1016 / j.diagmicrobio.2013.06.026
PubMed Статья Google ученый
Brzychczy M, Borszewska-Kornacka M, Gulczynska E, Wojkowska-Mach J, Sulik M, Grzebyk M, Luchter M, Heczko PB, Bulanda M: Распространенность антибиотикорезистентности у устойчивых к нескольким лекарственным средствам коагулаза-отрицательных стероидов изолированы от инвазивной инфекции новорожденных с очень низкой массой тела при рождении в двух польских отделениях интенсивной терапии.Анн Клин Микробиол Антимикроб. 2013, 12: 41-10.1186 / 1476-0711-12-41.
Артикул Google ученый
VanDuijkeren E, Box ATA, Heck MEOC, Wannet WJB, Fluit AC: метициллин-резистентные стафилококки, выделенные от животных. Vet Microbiol. 2004, 103: 91-97. 10.1016 / j.vetmic.2004.07.014.
CAS Статья Google ученый
Мудли А., Гуардабасси Л.: Клональное распространение метициллин-резистентных коагулазонегативных стафилококков среди лошадей, персонала и объектов окружающей среды в конюшнях.Vet Microbiol. 2009, 137: 397-401. 10.1016 / j.vetmic.2009.01.034
PubMed Статья Google ученый
Сидху М.С., Оппегаард Х., Девор Т.П., Сёрум Х: Устойчивость мультирезистентного стафилококка Staphylococcus haemolyticus в клинике ветеринарной клиники. Microb Drug Resist. 2007, 13: 271-280. 10.1089 / mdr.2007.756
PubMed CAS Статья Google ученый
Шитту А., Лин Дж., Моррисон Д., Колаволе Д.: Выделение и молекулярная характеристика мультирезистентных Staphylococcus sciuri и Staphylococcus haemolyticus , связанных с инфекциями кожи и мягких тканей. J Med Microbiol. 2004, 53: 51-55. 10.1099 / jmm.0.05294-0
PubMed CAS Статья Google ученый
Dubois D, Grare M, Prere MF, Segonds C, Marty N, Oswald E: Характеристики системы Vitek MS с матричной лазерной десорбционной ионизацией и времяпролетной масс-спектрометрией для быстрой идентификации бактерий в повседневной клинической практике. микробиология.J Clin Microbiol. 2012, 50: 2568-2576. 10.1128 / JCM.00343-12
PubMed PubMed Central Статья Google ученый
Аноним: Мультиплексная ПЦР для обнаружения гена mecA и идентификации Staphylococcus aureus . В: Протокол Национального института пищевых продуктов (DTU). Национальный институт пищевых продуктов, Технический университет Дании, Копенгаген, 06.02.2008,
Google ученый
Kim JH, Lee JY, Kim HR, Heo KW, Park SK, Lee JN, Yu SM, Shin JH: Острый лимфаденит с целлюлитом, вызванный Staphylococcus lugdunensis . Корейская лаборатория J Med. 2008, 28: 196-200. 10.3343 / kjlm.2008.28.3.196.
Артикул Google ученый
Cuny C, Layer F, Strommenger B, Witte W. Редкое появление метициллин-устойчивого Staphylococcus aureus CC130 с новым гомологом mecA у людей в Германии.PloS One. 2011, 6 (9): e24360-10.1371 / journal.pone.0024360
PubMed CAS PubMed Central Статья Google ученый
Хиротаки С., Сасаки Т., Кувахара-Араи К., Хирамацу К. Быстрая и точная идентификация стафилококков, ассоциированных с человеком, с помощью мультиплексной ПЦР. J Clin Microbiol. 2011, 49: 3627-3631. 10.1128 / JCM.00488-11
PubMed CAS PubMed Central Статья Google ученый
Schnellmann C, Gerber V, Rossano A, Jaquier V, Panchaud Y, Doherr MG, Thomann A, Straub R, Perreten V: наличие новых вариантов mecA и миль в час (C), придающих устойчивость к антибиотикам у Staphylococcus spp. . выделен из шкуры лошадей до и после поступления в клинику. J Clin Microbiol. 2006, 44: 4444-4454. 10.1128 / JCM.00868-06
PubMed CAS PubMed Central Статья Google ученый
Aarestrup FM, Agerso Y, Gerner-Smidt P, Madsen M, Jensen LB: Сравнение фенотипов устойчивости к противомикробным препаратам и генов устойчивости у Enterococcus faecalis и Enterococcus faecium от людей в сообществе, бройлеров и свиней в Дании. Диагностика Microbiol Infect Dis. 2000, 37: 127-137. 10.1016 / S0732-8893 (00) 00130-9
PubMed CAS Статья Google ученый
Perreten V, Vorlet-Fawer L, Slickers P, Ehricht R, Kuhnert P, Frey J: Обнаружение на основе микрочипов 90 генов устойчивости к антибиотикам грамположительных бактерий.J Clin Microbiol. 2005, 43: 2291-2302. 10.1128 / JCM.43.5.2291-2302.2005
PubMed CAS PubMed Central Статья Google ученый
Couto N, Belas A, Couto I, Perreten V, Pomba C: сравнительный анализ генетического родства, антимикробной и биоцидной чувствительности устойчивых к метициллину и чувствительных к метициллину Staphylococcus pseudintermedius из Португалии. Microb Drug Resist. 2014, 20: 364-371. 10.1089 / мкр.2013.0043
PubMed CAS Статья Google ученый
Kadlec K, Schwarz S: Идентификация нового транспозона dfrK , несущего транспозон Tn 559 , в метициллин-чувствительном штамме свиней Staphylococcus aureus ST398. Противомикробные агенты Chemother. 2010, 54: 3475-3477. 10.1128 / AAC.00464-10
PubMed CAS PubMed Central Статья Google ученый
Jensen LB, Hammerum AM, Bager F, Aarestrup FM: Устойчивость к стрептограмину среди Enterococcus faecium , выделенных от промышленных животных в Дании в 1997 году. Microb Drug Resist. 2002, 8: 369-374. 10.1089 / 107662
469642PubMed CAS Статья Google ученый
Nunes APF, Teixeira LM, Bastos CCR, Silva MG, Ferreira RB, Fonseca LS, Santos KRN: Геномная характеристика устойчивых к оксациллину Staphylococcus epidermidis и Staphylococcus haemolyticus, выделенных из медицинских центров Бразилии .J Hosp Infect. 2005, 59: 19-26. 10.1016 / j.jhin.2004.07.021
PubMed CAS Статья Google ученый
Тристан А, Лина Дж., Этьен Дж., Ванденеш Ф .: Биология и патогенность стафилококков, кроме Staphylococcus aureus и Staphylococcus epidermidis . Грамположительные возбудители. Под редакцией: Фишетти А., Новик Р.П., Ферретти Дж. Дж., Портной Д. А., Руд Дж. И.. 2006, 572-586. ASM Press, Вашингтон,
Google ученый
Podkowik M, Bystroń J, Bania J: Распространенность генов устойчивости к антибиотикам у стафилококков, выделенных из готовых к употреблению мясных продуктов. Pol J Vet Sci. 2012, 15: 233-237.
PubMed CAS Google ученый
Ruzauskas M, Couto N, Siugzdiniene R, Belas A, Klimiene I, Virgailis M, Pomba C: Распространенность и характеристика метициллин-резистентного Staphylococcus aureus , ассоциированного с животноводством. Vet Med Zoot. 2014, 66: 58-63.
Google ученый
Сепутиене В., Повилонис Дж., Рузаускас М., Виргайлис М., Жлабис П., Сузиделиене Е.: Устойчивость к хинолонам среди Salmonella enterica и Escherichia coli в Литве. Biologija. 2006, 3: 74-78.
Google ученый
Ruzauskas M, Siugzdiniene R, Seputiene V, Suziedeliene E, Virgailis M, Daugelavicius R, Spakauskas V, Zienius D, Sengaut J, Pavilonis A: Ситуация с антимикробной резистентностью кишечных бактерий, выделенных из кишечных бактерий животного происхождения, к quinolones и фторхинолоны.Vet Med Zoot. 2010, 50: 73-80.
Google ученый
Ruzauskas M, Siugzdiniene R, Suziedeliene E, Seputiene V, Pavilonis J: Устойчивость к противомикробным препаратам Enterococcus spp. распространение в продуктах птицеводства в Литве. J Food Saf. 2010, 30: 902-915. 10.1111 / j.1745-4565.2010.00249.x.
CAS Статья Google ученый
(PDF) Staphylococcus haemolyticus — новая угроза на закате антибиотиков. Возраст
Загружено с www.microbiologyresearch.org, автор:
IP: 85.89.171.244
On: Mon, 14 Dec 2015 16:14:05
Archer, G. L. & Climo, M. W. (1994). Антимикробная чувствительность
коагулазонегативных стафилококков. Антимикробные агенты Chemother 38,
2231–2237.
Арчиола, К. Р., Кампочча, Д. и Монтанаро, Л. (2002). Обнаружение
биопленкообразующих штаммов Staphylococcus epidermidis и S. aureus.
Expert Rev Mol Diagn 2, 478–484.
Обер, Г., Пассо, С., Лухт, Ф. и Дорче, Г. (1990). Отбор
устойчивых к ванкомицину и тейкопланину Staphylococcus haemolyticus
во время лечения тейкопланином инфекции S. epidermidis.
J Antimicrob Chemother 25, 491–493.
Баннерман Т. Л., Вадьяк Д. Л. и Клоос В. Э. (1991). Восприимчивость
видов и подвидов Staphylococcus к тейкопланину. Антимикроб
Агенты Chemother 35, 1919–1922.
Баррос, Э.М., Чеотто, Х., Бастос, М. С. Ф., Дос Сантос, К. Р. Н. &
Джамбиаджи-Демарваль, М. (2012). Staphylococcus haemolyticus как
важный больничный патоген и носитель генов устойчивости к метициллину
. J Clin Microbiol 50, 166–168.
Баррос, Э. М., Лемос, М., Соуто-Падро
´n, Т. и Джамбиаджи-де Марваль,
М. (2015). Фенотипическая и генотипическая характеристика образования биопленки
у Staphylococcus haemolyticus. Curr Microbiol 70, 829–834.
Беккер, К., Хейльманн, К. и Петерс, Г. (2014). Коагулазонегативные
стафилококки. Clin Microbiol Rev 27, 870–926.
Berglund, C. & So
¨derquist, B. (2008). Происхождение изолята Staphylococcus aureus, устойчивого к метициллину
, в отделении новорожденных в
Швеция — возможный горизонтальный перенос стафилококковой кассеты
хромосомы mec между метициллин-устойчивым Staphylococcus
haemolyticus aureus aureus.Clin Microbiol Infect 14,
1048–1056.
Biavasco, F., Vignaroli, C. & Varaldo, P.E. (2000). Устойчивость к гликопептиду
коагулазонегативных стафилококков. Eur J Clin Microbiol
Infect Dis 19, 403–417.
Биллот-Кляйн, Д., Гутманн, Л., Брайант, Д., Белл, Д., Ван Хейенорт, Дж.,
Гревал, Дж. И Шлес, Д. М. (1996). Синтез пептидогликана и структура
в Staphylococcus haemolyticus, экспрессирующая повышенные уровни устойчивости
к гликопептидным антибиотикам.JBacteriol 178, 4696–4703.
Blans, M. & Troelstra, A. (2001). Устойчивость к гликопептидам
Staphylococcus haemolyticus при лечении тейкопланином.
Infect Control Hosp Epidemiol 22, 263–264.
Бохниарц, М., Ваврон, В. и Щубял, М. (2013). Устойчивость к метициллину
коагулазонегативных стафилококков (ЦНС), выделенных из мастита
крупного рогатого скота. Pol J Vet Sci 16, 687–692.
Campanile, F., Bongiorno, D., Borbone, S., Фальконе, М., Джаннелла,
М., Вендитти, М. и Стефани, С. (2008). Активность даптомицина
in vitro против метициллин- и мультирезистентного Staphylococcus haemolyticus
инвазивных изолятов, несущих различные комплексы mec. Диагностика Microbiol
Infect Dis 61, 227–231.
Кавана, Дж. П., Хьерде, Э., Холден, М. Т. Г., Калке, Т., Клингенберг,
С., Флегстад, Т., Паркхилл, Дж., Бентли, С. Д. и Соллид, Дж. У. Э. (2014).
Полногеномное секвенирование выявило клональную экспансию
мультирезистентного Staphylococcus haemolyticus в европейских больницах.
J Antimicrob Chemother 69, 2920–2927.
Cercenado, E., Garcı
´a-Leoni, ME, Dı
´az, MD, Sa
´nchez-Carrillo, C.,
Catala
´n, P., De Quiro
‘s, JC & Bouza, E. (1996). Появление
устойчивых к тейкопланину коагулазонегативных стафилококков. J Clin
Microbiol 34, 1765–1768.
Чемберс, Х. Ф. (1988). Метициллин-резистентные стафилококки. Clin
Microbiol Rev 1, 173–186.
Сидрал, Т.А., Карвалью, М.К., Фигейредо, А.М.С. и де Мело, М.С.Н.
(2015). [Epub перед печатью]. doi: 10.1111 / apm.12426 26227107
Появление метициллин-резистентных коагулазонегативных стафилококков
, резистентных к линезолиду с мутациями гена рРНК C2190T и G2603T
. АПМИС.
Corse, J. & Williams, R.E. (1968). Антибиотикорезистентность коагулазы —
отрицательных стафилококков и микрококков. Дж. Клин Патол 21, 722–728.
Каннингем Р., Гурнелл М., Бейстон Р., Кокейн А. и Шелтон А.
(1997). Резистентность к тейкопланину у Staphylococcus haemolyticus,
развивается во время лечения. J Antimicrob Chemother 39, 438–439.
Дэниел Б., Салим М., Насир Г. и Фида А. (2014). Значение
Staphylococcus haemolyticus при внутрибольничных инфекциях. J Pioneer
Med Sci 4, 119–126.
Degener, J. E., Heck, M. E. C., van Leeuwen, W.J., Heemskerk, C.,
Crielaard, A., Joosten, P. & Caesar, P. (1994). Нозокомиальная инфекция
Staphylococcus haemolyticus и методы типирования для эпидемиологического исследования
. J Clin Microbiol 32, 2260–2265.
Энг, Р. Х. К., Ван, К., Персон, А., Кин, Т. Э. и Армстронг, Д.
(1982). Идентификация видов коагулазонегативных стафилококковых изолятов
из посевов крови. J Clin Microbiol 15, 439–442.
Энрайт, М.К., Робинсон, Д. А., Рэндл, Г., Фейл, Э. Дж., Грундманн, Х.
, и Спратт, Б. Г. (2002). История эволюции метициллина
устойчивого золотистого стафилококка (MRSA). Proc Natl Acad Sci U S A
99, 7687–7692.
Fajardo Olivares, M., Hidalgo Orozco, R., Rodrı
´guez Garrido, S.,
Rodrı
´guez-Vidigal, FF, Vera Tome
´, A. & Robles Marcos, M.
(2011). Активность ванкомицина, ципрофлоксацина, даптомицина и линезолида
против коагулазонегативной стафилококковой бактериемии.Ред.
Esp Quimioter 24, 74–78.
Флахаут, С., Виноградов, Э., Келли, К. А., Бреннан, С., Хирамацу, К.
и Ли, Дж. К. (2008). Структурная и биологическая характеристика капсульного полисахарида
, продуцируемого Staphylococcus haemolyticus.
J Bacteriol 190, 1649–1657.
Флюит, А. К., Карпай, Н., Майор, Э. А., Бонтен, М. Дж. М. и Виллемс, Р. Дж.
Л. (2013). Общий резервуар последовательностей гена ccrB между коагулазой-
отрицательными стафилококками и метициллин-резистентным золотистым стафилококком.
J Antimicrob Chemother 68, 1707–1713.
Fredheim, E.G.A., Klingenberg, C., Rohde, H., Frankenberger, S.,
Gaustad, P., Flaegstad, T. & Sollid, J.E. (2009). Формирование биопленки
с помощью Staphylococcus haemolyticus.J Clin Microbiol 47, 1172–1180.
Фроггатт, Дж. У., Джонстон, Дж. Л., Галетто, Д. У. и Арчер, Г. Л. (1989).
Устойчивость к противомикробным препаратам внутрибольничных изолятов Staphylococcus
haemolyticus. Антимикробные агенты Chemother 33, 460–466.
Джеммелл, К. Г. и Доусон, Дж. Э. (1982). Идентификация коагулазо-
отрицательных стафилококков с помощью системы API staph. J Clin Microbiol
16, 874–877.
Goldstein, F. W., Coutrot, A., Sieffer, A. & Acar, J. F. (1990).
Процентное соотношение и распределение резистентных штаммов к тейкопланину и ванкомицину-
среди коагулазонегативных стафилококков. Антимикроб
Агенты Chemother 34, 899–900.
Гупта, В., Гарг, С., Джайн, Р., Гарг, С. и Чандер, Дж. (2012). Линезолид
Гемолитический стафилококк, устойчивый к: отчет о первом случае из Индии.
Asian Pac J Trop Med 5, 837–838.
Хансен, А. М. и Эриксон Соллид, Дж. У. (2006). SCCmec у стафилококков:
гена в движении. FEMS Immunol Med Microbiol 46, 8–20.
Хирамацу К., Катаяма Ю., Юдзава Х. и Ито Т. (2002). Молекулярная
генетика метициллин-устойчивого золотистого стафилококка. Int J Med
Microbiol 292, 67–74.
Holden, MTG, Hsu, LY, Kurt, K., Weinert, LA, Mather, AE,
Harris, SR, Strommenger, B., Layer, F., Witte, W. и другие авторы
(2013 ).
Геномный портрет возникновения, эволюции и глобального распространения пандемии метициллин-устойчивого золотистого стафилококка.
Genome Res 23, 653–664.
Хоуп Р., Ливермор Д. М., Брик Г., Лилли М., Рейнольдс Р. и BSAC
Рабочие группы по надзору за сопротивлением (2008 г.).Не
тенденции восприимчивости стафилококков от бактериемии в Великобритании
и Ирландии, 2001–06. JAntimicrobChemother62 (Дополнение 2), ii65 – ii74.
T. Czekaj, M. Ciszewski и EM Szewczyk
2066 Microbiology 161
Сравнительное исследование липидомной адаптации, вызванной истощением питательных веществ у Staphylococcus haemolyticus и Staphylococcus epidermidis
Lipostmbrane, CO. бактерии. Nat Rev Microbiol 6 , 222–233, https: // doi.org / 10.1038 / nrmicro1839 (2008).
Артикул PubMed Google ученый
Силиакус, М. Ф., ван дер Ост, Дж. И Кенген, С. В. М. Адаптация мембран архей и бактерий к изменениям температуры, pH и давления. Extremophiles 21 , 651–670, https://doi.org/10.1007/s00792-017-0939-x (2017).
CAS Статья PubMed Central PubMed Google ученый
Krulwich, T. A. Щелочные прокариоты. Прокариоты: Справочник по биологии бактерий , Том 2 , Третье издание , 283–308, https://doi.org/10.1007/0-387-30742-7_10 (2006).
Хираока, С., Мацузаки, Х. и Сибуя, И. Активное увеличение синтеза кардиолипина в стационарной фазе роста и его физиологическое значение для Escherichia coli. FEBS Lett. 336 , 221–224 (1993).
CAS Статья PubMed Google ученый
Лопес, С. С., Алиса, А. Ф., Херас, Х., Ривас, Э. А. и Санчес-Ривас, К. Роль анионных фосфолипидов в адаптации Bacillus subtilis к высокой солености. Микробиология 152 , 605–616, https://doi.org/10.1099/mic.0.28345-0 (2006).
CAS Статья PubMed Google ученый
Сейдлова Г. и Свободова Дж. Развитие мембранных липидов у продуцента сурфактина Bacillus subtilis. Folia Microbiol (Praha) 53 , 303–307, https://doi.org/10.1007/s12223-008-0047-5 (2008).
CAS Статья Google ученый
Бари, П. С. Устойчивые к антибиотикам грамположительные кокки: значение для хирургической практики. World J Surg 22 , 118–126 (1998).
CAS Статья PubMed Google ученый
Шаффер, Р. К. Проблема устойчивости к антибиотикам Staphylococcus : уроки больничных яслей в середине 20-го века. Йельский институт биол. Медицины 86 , 261–270 (2013).
CAS PubMed Central PubMed Google ученый
Kloos, W. E. и Musselwhite, M. S. Распространение и устойчивость Staphylococcus и Micrococcus разновидностей и других аэробных бактерий на коже человека. Appl Microbiol 30 , 381–385 (1975).
CAS PubMed Central PubMed Google ученый
Дай Л. и др. . Staphylococcus epidermidis, извлеченные из постоянных катетеров, демонстрируют усиленное диспергирование биопленок и «самообновление» за счет подавления агр. BMC Microbiol 12 , 102, https://doi.org/10.1186/1471-2180-12-102 (2012).
CAS Статья PubMed Central PubMed Google ученый
Otto, M. Staphylococcus epidermidis — «случайный» возбудитель. Nat Rev Microbiol 7 , 555–567, https://doi.org/10.1038/nrmicro2182 (2009).
CAS Статья PubMed Central PubMed Google ученый
de Allori, M.C., Jure, M.A., Romero, C. & de Castillo, M.E. Устойчивость к противомикробным препаратам и образование биопленок в клинических изолятах коагулазонегативных штаммов Staphylococcus . Biol Pharm Bull 29 , 1592–1596 (2006).
Артикул PubMed Google ученый
Fredheim, E.G. и др. . Образование биопленок Staphylococcus haemolyticus. J Clin Microbiol 47 , 1172–1180, https://doi.org/10.1128/JCM.01891-08 (2009).
CAS Статья PubMed Central PubMed Google ученый
Nahaie, M. R., Goodfellow, M., Minnikin, D. E. & Hajek, V. Состав полярных липидов и изопреноидных хинонов в классификации Staphylococcus . J Gen Microbiol 130 , 2427–2437, https://doi.org/10.1099/00221287-130-9-2427 (1984).
CAS PubMed Google ученый
Sohlenkamp, C. & Geiger, O. Липиды бактериальных мембран: разнообразие структур и путей. FEMS Microbiol Ред. (2015).
ден Камп, Дж. А., Редай, И. и ван Динен, Л. Л. Фосфолипидный состав Bacillus subtilis. Дж. Бактериол 99 , 298–303 (1969).
Google ученый
Рой, Х. и Ибба, М. Широкий диапазон аминокислотной специфичности РНК-зависимого ремоделирования липидов под действием множества факторов устойчивости к пептидам. J Biol Chem 284 , 29677–29683 (2009).
CAS Статья PubMed Central PubMed Google ученый
Slavetinsky, C.J., Peschel, A. & Ernst, C.M. Аланил-фосфатидилглицерин и лизил-фосфатидилглицерин транслоцируются одними и теми же флиппазами MprF и обладают аналогичной способностью защищать от антибиотика даптомицина в Staphylococcus aureus. Противомикробные агенты Chemother 56 , 3492–3497 (2012).
CAS Статья PubMed Central PubMed Google ученый
Пешель, А. и др. . Staphylococcus aureus Устойчивость к человеческим дефенсинам и уклонение от уничтожения нейтрофилов с помощью нового фактора вирулентности MprF основана на модификации мембранных липидов L-лизином. J Exp Med 193 , 1067–1076 (2001).
CAS Статья PubMed Central PubMed Google ученый
Хебеккер, С. и др. . Структуры двух факторов устойчивости бактерий, опосредующих тРНК-зависимое аминоацилирование фосфатидилглицерина лизином или аланином. Proc Natl Acad Sci USA 112 , 10691–10696 (2015).
ADS CAS Статья PubMed Central PubMed Google ученый
Атила М. и Луо Ю. Профилирование и тандемный масс-спектрометрический анализ аминоацилированных фосфолипидов в Bacillus subtilis. F1000Res 5 , 121, https://doi.org/10.12688/f1000research.7842.2 (2016).
Артикул PubMed Central PubMed Google ученый
Атила М., Кацелис Г., Чумала П. и Луо Ю. Характеристика N-сукцинилирования L-лизилфосфатидилглицерина в Bacillus subtilis с использованием тандемной масс-спектрометрии. J Am Soc Mass Spectrom 27 , 1606–1613, https://doi.org/10.1007/s13361-016-1455-4 (2016).
CAS Статья PubMed Google ученый
Кронан, Дж. Э. младший, Вайсберг, Л. Дж. И Аллен, Р. Г. Регулирование синтеза липидов мембран в Escherichia coli.Накопление свободных жирных кислот аномальной длины во время ингибирования синтеза фосфолипидов. J Biol Chem 250 , 5835–5840 (1975).
CAS PubMed Google ученый
Миндич, Л. Контроль синтеза жирных кислот у бактерий. Дж. Бактериол 110 , 96–102 (1972).
CAS PubMed Central PubMed Google ученый
Блай, Э. Г. и Дайер, У. Дж. Быстрый метод экстракции и очистки общих липидов. Can J Biochem Phys 37 , 911–917 (1959).
CAS Статья Google ученый
Луо, Ю. Праймер аланилированной липотейхоевой кислоты в Bacillus subtilis. F1000Res 5 , 155 (2016).
Артикул PubMed Central PubMed Google ученый
Лейкер, Т. Дж., Баркли, Р. М. и Мерфи, Р. С. Анализ молекулярных видов диацилглицерина в экстрактах клеточных липидов с помощью масс-спектрометрии с электрораспылением с жидкостной хроматографией в нормальной фазе. Int J Mass Spectrom 305 , 103–109, https://doi.org/10.1016/j.ijms.2010.09.008 (2011).
CAS Статья PubMed Central PubMed Google ученый
Мерфи Р. и Аксельсен П. Х. Масс-спектрометрический анализ длинноцепочечных липидов. Mass Spectrom Rev 30 , 579–599, https://doi.org/10.1002/mas.20284 (2011).
ADS CAS Статья PubMed Google ученый
Coulon, D. & Bure, C. Ацилфосфатидилглицерин (ацил-PG) или N-ацилфосфатидилэтаноламин (NAPE)? J Масс-спектр 50 , 1318–1320, https://doi.org/10.1002/jms.3701 (2015).
ADS CAS Статья PubMed Google ученый
Печ-Канул, А. и др. . FadD необходим для утилизации эндогенных жирных кислот, высвобождаемых из липидов мембран. J Bacteriol 193 , 6295–6304, https://doi.org/10.1128/JB.05450-11 (2011).
CAS Статья PubMed Central PubMed Google ученый
Vadia, S. et al. . Доступность жирных кислот определяет емкость клеточной оболочки и размер микробных клеток. Curr Biol 27 , 1757–1767 e1755, https: // doi.org / 10.1016 / j.cub.2017.05.076 (2017).
CAS Статья PubMed Google ученый
Перси, М. Г. и Грундлинг, А. Синтез и функция липотейхоевой кислоты у грамположительных бактерий. Annu Rev Microbiol 68 , 81–100, https://doi.org/10.1146/annurev-micro-0-112949 (2014).
CAS Статья PubMed Google ученый
Czekaj, T., Ciszewski, M. & Szewczyk, E. M. Staphylococcus haemolyticus — новая угроза на закате эры антибиотиков. Микробиология 161 , 2061–2068, https://doi.org/10.1099/mic.0.000178 (2015).
CAS Статья PubMed Google ученый
Малахова Н. и ДеЛео Ф. Р. Мобильные генетические элементы Staphylococcus aureus. Cell Mol Life Sci 67 , 3057–3071, https: // doi.org / 10.1007 / s00018-010-0389-4 (2010).
CAS Статья PubMed Central PubMed Google ученый
Отто, M. Коагулазонегативные стафилококки как резервуары генов, способствующих инфицированию MRSA: Комменсальные виды стафилококков, такие как Staphylococcus epidermidis, признаны важными источниками генов, способствующих колонизации и вирулентности MRSA. Bioessays 35 , 4–11, https: // doi.org / 10.1002 / bies.201200112 (2013).
CAS Статья PubMed Google ученый
Отто М. Бактериальное зондирование антимикробных пептидов. Contrib Microbiol 16 , 136–149, https://doi.org/10.1159/000219377 (2009).
CAS Статья PubMed Central PubMed Google ученый
Мацуо, М., Оогай, Ю., Като, Ф., Sugai, M. & Komatsuzawa, H. Зависимость от фазы роста чувствительности к антимикробным пептидам у Staphylococcus aureus. Микробиология 157 , 1786–1797, https://doi.org/10.1099/mic.0.044727-0 (2011).
CAS Статья PubMed Google ученый
Lopalco, P., Stahl, J., Annese, C., Averhoff, B. & Corcelli, A. Идентификация уникальных видов кардиолипина и монолизокардиолипина в Acinetobacter baumannii. Sci Rep 7 , 2972, https://doi.org/10.1038/s41598-017-03214-w (2017).
ADS Статья PubMed Central PubMed Google ученый
Фишер, Р. А., Голлан, Б. и Хелайн, С. Стойкие бактериальные инфекции и персистирующие клетки. Nat Rev Microbiol 15 , 453–464, https://doi.org/10.1038/nrmicro.2017.42 (2017).
CAS Статья PubMed Google ученый
Tanaka, S. и др. . Mass ++: инструмент визуализации и анализа для масс-спектрометрии. J Proteome Res (2014).
Перенос устойчивости к мупироцину клинических штаммов Staphylococcus haemolyticus на Staphylococcus aureus через конъюгативные и подвижные плазмиды | Письма о микробиологии FEMS
Считается, чтоКоагулазонегативные стафилококки действуют как резервуары генов устойчивости к антибиотикам, которые могут передаваться в Staphylococcus aureus , тем самым препятствуя борьбе с этой бактерией.В этой работе мы проанализировали наличие плазмид, придающих устойчивость к антибиотику мупироцину, широко используемому для лечения и профилактики инфекций S. aureus в больничных условиях, в нозокомиальных штаммах S. haemolyticus . Около 12% из 75 протестированных штаммов были устойчивы к мупироцину, и этот фенотип коррелировал с присутствием плазмид. Было показано, что эти плазмиды разнообразны, будучи либо конъюгативными, либо мобилизуемыми, и способны передавать устойчивость к мупироцину S.aureus . Наши результаты подтверждают, что S. haemolyticus , исторически и ошибочно рассматриваемый как менее важный патоген, является резервуаром генов устойчивости, которые могут передаваться другим бактериям, таким как S. aureus , что подчеркивает необходимость более эффективных стратегий для обнаруживать и бороться с этим возникающим условно-патогенным микроорганизмом.
ВВЕДЕНИЕ
Мупироцин — это антибиотик, широко используемый при интраназальном лечении как для профилактики, так и для искоренения стафилококковых инфекций (Vilela, 2016).Этот антибиотик обладает бактериостатической активностью за счет связывания с изолейцил (Ile) -тРНК-синтетазой, продуктом гена ile S, тем самым предотвращая синтез белка (Thomas et al .2010). Мупироцин особенно важен для профилактики и лечения метициллин-резистентного Staphylococcus aureus , поскольку эта бактерия является ведущей причиной инфекций, связанных с оказанием медицинской помощи, во всем мире (Poovelikunnel, Gethin and Humphreys 2015). Часто сообщалось о повышении устойчивости к мупироцину, которое связано либо с точечными мутациями в гене ile S, которые обычно придают промежуточные уровни устойчивости (минимальная ингибирующая концентрация — МИК — от 4 до 256 мкг / мл -1 ), либо связаны с плазмидами, несущими отдельный ген Ile-тРНК синтетазы, mup A (или ileS -2), связанный с высокими уровнями (MIC ≥ 512 мкг / мл -1 ) устойчивости к мупироцину (Deeny et al .2015).
Было высказано предположение, что коагулазонегативные стафилококки (CoNS) могут действовать как резервуары генов, которые после горизонтального переноса генов повышают способность S. aureus противостоять антимикробной терапии (Otto 2013). Staphylococcus haemolyticus — условно-патогенный микроорганизм, обычно обнаруживаемый на коже и слизистых оболочках, и один из ЦНС, наиболее часто выделяемых в клинических случаях (Daniel et al .2014). Замечательный S. haemolyticus , характеризующий высокие показатели устойчивости стафилококков к противомикробным препаратам, делает эту бактерию новой угрозой для здоровья человека (Czekaj, Ciszewski and Szewczyk 2015).
Мы ранее показали присутствие различных плазмид, несущих устойчивость к мупироцину, у S. haemolyticus , и мы предположили роль этого вида как резервуара гена mup A (Ferreira et al .2011). Целью настоящего исследования было изучить возможность переноса детерминант устойчивости к мупироцину с S. haemolyticus на S. aureus , тем самым усиливая клиническую важность S. haemolyticus как источника плазмид, придающих устойчивость к антибиотикам . .
МАТЕРИАЛЫ И МЕТОДЫ
Скрининг и характеристика устойчивых к мупироцину
S. haemolyticusВ общей сложности 75 штаммов S. haemolyticus были выделены из гемокультуры пациентов в Морском госпитале Марсилио Диас, Рио-де-Жанейро (Бразилия) с 2005 по 2008 год. Все штаммы были идентифицированы как S. haemolyticus по цепи полимеразы. реакция (ПЦР) обнаружения видоспецифичного гена mvaA с использованием пары праймеров SH F / SH R (таблица 1), как было предложено Schuenck et al .(2008). Чувствительность к мупироцину оценивали методом дисковой диффузии в соответствии с ранее установленными протоколами (Oliveira et al .2007). Устойчивые штаммы были отобраны для дальнейших экспериментов и были дифференцированы с помощью паттернов хромосомных рестрикций, продуцируемых ферментом SmaI, разделенных с помощью гель-электрофореза в импульсном поле (PFGE), согласно Nunes et al . (2005). Кластерный анализ продуктов PFGE был выполнен с использованием программы Bionumerics (Applied Mathematics, Бельгия) с алгоритмом UPGMA (невзвешенный парно-групповой метод со средним арифметическим) и коэффициентом Жаккара.
Таблица 1.олигонуклеотидов, использованных в данной работе.
| Цель . | Грунтовка . | Последовательность (5′-3 ‘) . | Ампликон . | Источник . | ||||
|---|---|---|---|---|---|---|---|---|
| mup A | M1 | GTTTATCTTCTGATGCTGAG | 237 bp | Nunes et al . (1999) | ||||
| M2 | CCAGTTACACCGATATAA | |||||||
| MupA R | CTCTAATTC6000 913CCAACTableG | CTCTAATTC6000 и т.(1998) | ||||||
| IS 257 | 1234 | GGCATGGCGAAAATCCGTAG | Переменная | Woodford et al . (1998) | ||||
| 1235 | TGGCGTATTGATGAGACGTACATC | Переменная | ||||||
| мВА A | SH | BTCFTC | SH 9CTAC6 A | SH 91G58G 9CTAC 6 (2008) | ||||
| SH R | CACGAGCAATCTCATCACCT |
| Цель . | Грунтовка . | Последовательность (5′-3 ‘) . | Ампликон . | Источник . | ||||
|---|---|---|---|---|---|---|---|---|
| mup A | M1 | GTTTATCTTCTGATGCTGAG | 237 bp | Nunes et al . (1999) | ||||
| M2 | CCAGTTACACCGATATAA | |||||||
| MupA R | CTCTAATTC6000 913CCAACTableG | CTCTAATTC6000 и т.(1998) | ||||||
| IS 257 | 1234 | GGCATGGCGAAAATCCGTAG | Переменная | Woodford et al . (1998) | ||||
| 1235 | TGGCGTATTGATGAGACGTACATC | Переменная | ||||||
| мВА A | SH | BTCFTC | SH 9CTAC6 A | SH 91G58G 9CTAC 6 (2008) | ||||
| SH R | CACGAGCAATCTCATCACCT |
Олигонуклеотидов, использованных в данной работе.
| Цель . | Грунтовка . | Последовательность (5′-3 ‘) . | Ампликон . | Источник . | ||||
|---|---|---|---|---|---|---|---|---|
| mup A | M1 | GTTTATCTTCTGATGCTGAG | 237 bp | Nunes et al . (1999) | ||||
| M2 | CCAGTTACACCGATATAA | |||||||
| MupA R | CTCTAATTC6000 913CCAACTableG | CTCTAATTC6000 и т.(1998) | ||||||
| IS 257 | 1234 | GGCATGGCGAAAATCCGTAG | Переменная | Woodford et al . (1998) | ||||
| 1235 | TGGCGTATTGATGAGACGTACATC | Переменная | ||||||
| мВА A | SH | BTCFTC | SH 9CTAC6 A | SH 91G58G 9CTAC 6 (2008) | ||||
| SH R | CACGAGCAATCTCATCACCT |
| Цель . | Грунтовка . | Последовательность (5′-3 ‘) . | Ампликон . | Источник . | ||||
|---|---|---|---|---|---|---|---|---|
| mup A | M1 | GTTTATCTTCTGATGCTGAG | 237 bp | Nunes et al . (1999) | ||||
| M2 | CCAGTTACACCGATATAA | |||||||
| MupA R | CTCTAATTC6000 913CCAACTableG | CTCTAATTC6000 и т.(1998) | ||||||
| IS 257 | 1234 | GGCATGGCGAAAATCCGTAG | Переменная | Woodford et al . (1998) | ||||
| 1235 | TGGCGTATTGATGAGACGTACATC | Переменная | ||||||
| мВА A | SH | BTCFTC | SH 9CTAC6 A | SH 91G58G 9CTAC 6 (2008) | ||||
| SH R | CACGAGCAATCTCATCACCT |
Обнаружение плазмид и устойчивости к мупироцину
Плазмиды из устойчивых к мупироцину штаммов экстрагировали после выращивания клеток в течение ночи при 37 ° C в инфузии сердца мозга (BHI), содержащей мупироцин (150 мкг / мл -1 для высокорезистентных и 5 мкг / мл -1 для умеренно устойчивые штаммы) в соответствии с протоколом, установленным Giambiagi-deMarval et al .(1990). Плазмида устойчивости к мупироцину pMG1 из клинического штамма S. aureus HU1A длиной 35 т.п.н., которая ранее была охарактеризована нашей группой (Bastos et al. , 1999), была использована в качестве положительного контроля для стадии экстракции плазмиды. и как молекулярный маркер. Присутствие гена mup A в этих штаммах оценивали с помощью ПЦР с парой праймеров M1 / M2 (таблица 1), которая генерирует ампликон длиной 237 пар оснований (Nunes et al , 1999). Разнообразие аранжировок гена mup A, фланкированного последовательностью вставки IS 257 , оценивали с помощью отдельных реакций ПЦР со следующими комбинациями праймеров: M1 / 1234, M1 / 1235, MupA R /1234 и MupA R /1235, как описано ранее (Ferreira et al .2011).
Плазмидное отверждение
Плазмида-ассоциированная устойчивость к мупироцину была подтверждена индукцией потери плазмиды после внесения 100-кратных ежедневных разведений клеток, выращенных в BHI в течение 4 дней при 43 ° C, как описано ранее (Nunes et al , 1999). Отверждение плазмиды подтверждали с помощью ПЦР с парой праймеров M1 / M2 (как описано выше), а потерю устойчивости к мупироцину подтверждали с помощью тест-полосок E (AB Biodisk, Швеция) в соответствии с инструкциями производителя.
Конъюгация между
S. haemolyticus и S. aureusДля оценки способности S. haemolyticus переносить плазмиду, несущую устойчивость к мупироцину, к S. aureus , в качестве доноров были выбраны два разных штамма — MD46 и MD57, а также штамм S. aureus RN2677 (Kornblum и др. .1986). Мобилизации плазмиды из штамма MD46 (pMD46) должна была способствовать предшествующая вставка конъюгированной плазмиды pIP501 из Enterococcus faecalis I60, несущей устойчивость к хлорамфениколу (Evans and Macrina 1983).Полученный штамм MD46 + pIP501 был отобран в BHI, содержащем мупироцин (150 мкг мл -1 ) и хлорамфеникол (10 мкг мл -1 ), и использован в качестве донора. Конъюгации проводили на фильтрах в течение ночи, как описано Projan и Archer (1989), используя ~ 10 9 9 1276 КОЕ как донорских, так и реципиентных клеток. Трансконъюганты RN2677, содержащие pMD46 или плазмиду из MD57 (pMD57), отбирали на агаре BHI, содержащем мупироцин (150 мкг · мл -1 ), новобиоцин (5 мкг · мл -1 ) и рифампицин (5 мкг · мл -1 . ).Мобилизацию плазмиды pMD46 с помощью pIP501 подтверждали путем оценки непрерывности чувствительности трансконъюганта к хлорамфениколу (10 мкг / мл -1 ).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Уровни устойчивости к ряду противомикробных препаратов делают условно-патогенный микроорганизм S. haemolyticus новой угрозой в эпоху использования антибиотиков (Czekaj, Ciszewski and Szewczyk, 2015). Из 75 проанализированных в данной работе внутрибольничных штаммов девять (12%) были устойчивы к мупироцину.Из них шесть были классифицированы согласно Oliveira и др. . (2007) как устойчивые к высоким уровням (зоны ингибирования ≤14 мм при воздействии дисков мупироцина 5 мкг и 200 мкг, штаммы MD02, MD19, MD34, MD45, MD46 и MD56) и от трех до промежуточных уровней (зоны ингибирования ≤14 мм, когда подвергается воздействию 5 мкг мупироциновых дисков, но выше при воздействии 200 мкг дисков (штаммов MD22, MD33 и MD57) мупироцина (рис. 1). Остальные штаммы были чувствительны к мупироцину и имели зоны ингибирования 28–33 мм и 37–44 мм при воздействии дисков мупироцина 5 мкг и 200 мкг соответственно.За исключением штамма MD02, наши критерии соответствуют критериям, недавно запрещенным рекомендациями CLSI (2014). Однако CLSI определяет нормы только для определения штаммов S. aureus , которые обладают высокой устойчивостью к мупироцину.
Рисунок 1.
Профили гель-электрофореза в импульсном поле (PFGE) геномной ДНК, расщепленной рестриктазой SmaI, и уровни устойчивости к мупироцину клинических штаммов Staphylococcus haemolyticus , использованных в данной работе.PFGE-тип каждого штамма был определен с использованием порога сходства 80% (красная пунктирная линия). Уровни устойчивости к мупироцину определяли в соответствии с Oliveira et al . (2007). Граница 14 мм была принята для определения устойчивых штаммов с диском 5 мкг, а диск 200 мкг был использован для классификации их как устойчивых к высоким (RH) и промежуточным (RI) уровням мупироцина. NI = без зоны запрета.
Рисунок 1.
Профили гель-электрофореза в импульсном поле (PFGE) геномной ДНК, расщепленной ферментом рестрикции SmaI, и уровни устойчивости к мупироцину клинических штаммов Staphylococcus haemolyticus , использованных в данной работе.PFGE-тип каждого штамма был определен с использованием порога сходства 80% (красная пунктирная линия). Уровни устойчивости к мупироцину определяли в соответствии с Oliveira et al . (2007). Граница 14 мм была принята для определения устойчивых штаммов с диском 5 мкг, а диск 200 мкг был использован для классификации их как устойчивых к высоким (RH) и промежуточным (RI) уровням мупироцина. NI = без зоны запрета.
Штаммы были дифференцированы с помощью PFGE, и, приняв пороговое значение 80%, было показано, что они принадлежат к семи типам, названным A – G.Штаммы MD22, MD33 и MD57 имели почти идентичный рисунок полос и, таким образом, считались принадлежащими к одному и тому же типу PFGE (рис. 1), что согласуется с их фенотипом устойчивости к мупироцину. Хотя устойчивость к мупироцину не так широко распространена среди CoNS (Рудреш и др. .2015), в соответствии с нашими результатами, большая опасность исходит от того факта, что эти бактерии могут действовать как резервуары генов устойчивости к противомикробным препаратам для более опасных патогенов, таких как С.aureus (Отто 2013). Фактически, передача устойчивости к мупироцину среди других CoNS и S. aureus была продемонстрирована (Нунес и др. . 1999; Hurdle и др. . 2005), что всегда связано с наличием плазмидного гена для альтернативы. Ile-тРНК синтетаза, mup A.
Все девять устойчивых к мупироцину штаммов, изученных в этой работе, представляют собой высокомолекулярные плазмиды (> 35 т.п.н.), размеры которых аналогичны размерам, описанным ранее (Ferreira et al .2011). Согласно реакциям ПЦР, проведенным с олигонуклеотидами M1 / M2 (фиг. 2A), все они были положительными по гену mup A (фиг. 2B). Такое открытие было особенно неожиданным для штаммов со средним уровнем устойчивости к мупироцину, поскольку этот фенотип обычно связан с точечными мутациями в гене ile S вместо присутствия гена mup A (обычно связанного с высокими уровнями устойчивости к мупироцину) (Deeny et al .2015).Однако, поскольку пороговое значение МИК, ограничивающее высокую и промежуточную устойчивость к мупироцину, было впервые установлено для S. aureus и поскольку критерии CLSI (2014) ограничены определением высоких уровней устойчивости к мупироцину, мы полагаем, что те же границы не относятся к S. haemolyticus и поэтому требуют тщательного анализа.
Рисунок 2. Стратегия полимеразной цепной реакции (ПЦР)
, используемая для обнаружения присутствия гена устойчивости к мупироцину mupA и инсерционной последовательности IS 257 поблизости от него.( A ) сайты отжига праймеров, ( B ) обнаружение mupA в штаммах, устойчивых к мупироцину, ( C ) обнаружение mupA после отверждения плазмиды путем инкубации при высокой температуре — названия отвержденных штаммов изображены с дополнительным детектированием ‘c’ и ( D ) mupA при переносе конъюгированной плазмиды pMD57 в штамм-реципиент S. aureus RN2677 и переносе плазмиды pMD46 в штамм RN2677, который был мобилизован плазмидой pIP501 из Enterococcus faecalis I60.
Рисунок 2. Стратегия полимеразной цепной реакции (ПЦР)
, используемая для обнаружения присутствия гена устойчивости к мупироцину mupA и последовательности вставки IS 257 в его окрестности. ( A ) сайты отжига праймеров, ( B ) обнаружение mupA в штаммах, устойчивых к мупироцину, ( C ) обнаружение mupA после отверждения плазмиды путем инкубации при высокой температуре — названия отвержденных штаммов изображены с дополнительным детектированием ‘c’ и ( D ) mupA при переносе конъюгативной плазмиды pMD57 в S.aureus реципиентный штамм RN2677 и перенос плазмиды pMD46 в штамм RN2677, который был мобилизован плазмидой pIP501, из Enterococcus faecalis I60.
Потеря плазмиды методом высокотемпературного отверждения была достигнута для семи из девяти штаммов (данные не показаны), и, как и ожидалось, фенотип чувствительности к мупироцину, обнаруженный в вылеченных клетках, сопровождался потерей mup A ген (рис. 2B и C). Эти результаты подтверждают вывод о том, что плазмиды могут участвовать в устойчивости к мупироцину у штаммов, исследованных в этой работе, как мы ранее показали для других S.haemolyticus (Ferreira et al .2011).
ПЦР-амплификации гетерогенных соединений между mupA и последовательностью вставки IS 257 широко использовались для мониторинга плазмид устойчивости к мупироцину у стафилококков (Perez-Roth et al .2011). Поскольку IS 257 можно найти в разных направлениях и положениях вблизи mupA , эти реакции ПЦР также можно использовать для оценки разнообразия плазмид, содержащих обе последовательности (Ferreira et al .2011). С этой целью мы использовали такой метод с использованием плазмидной ДНК и различных комбинаций пары праймеров, которые отжигаются в гене mup A и IS 257 , как поясняется на схеме на фиг. 2A.
Хотя последовательность вставки IS 257 была обнаружена во всех устойчивых штаммах, использованные комбинации праймеров приводили к разным рисункам полос для каждой реакции, различающимся как наличием / отсутствием, так и размерами фрагментов, за исключением штаммов из одного и того же PFGE- типа, который также отображал идентичные профили (рис.S1, Дополнительная информация). Эти результаты показывают, что плазмиды из проанализированных штаммов S. haemolyticus разнообразны, причем IS257 фланкирует ген mupA в разных направлениях и положениях.
Чтобы оценить способность этих плазмид передаваться S. aureus , мы выбрали два штамма, принадлежащих к разным PFGE-типам, MD46 (тип B) и MD57 (тип A), и провели эксперименты по конъюгации с S. aureus штамм-реципиент RN2677.Плазмида из штамма MD57, названная pMD57, была успешно перенесена в S. aureus (частота конъюгации 9,4 × 10 -7 ), и полученный штамм трансконъюганта стал устойчивым к мупироцину из-за присутствия mup A. , что подтверждено ПЦР (рис. 2D). Поскольку при использовании MD46 в качестве донора трансконъюганты не получали, мы предположили, что плазмида из этого штамма, названная pMD46, не может быть самопереносимой, и решили проверить ее способность мобилизоваться конъюгативной плазмидой.Для достижения этой цели штамм MD46 сначала конъюгировали с E. faecalis I60, несущим плазмиду pIP501. Полученный штамм MD46 + pIP501 затем использовали в качестве донора. Как и ожидалось, в присутствии конъюгированной плазмиды плазмида pMD46 S. haemolyticus также была успешно мобилизована (частота мобилизации 2,0 × 10 -7 ) на S. aureus (фиг. 2D). Полученный штамм трансконъюганта был устойчив к мупироцину, новобиоцину, рифампицину, но все еще был чувствителен к хлорамфениколу, что показывает, что только pMD46 был перенесен в штамм-реципиент, что указывает на то, что pMD46 является мобилизуемой плазмидой.
Наши результаты показывают, что бразильские нозокомиальные штаммы S. haemolyticus содержат разнообразные плазмиды, содержащие ген mup A, кодирующий устойчивость к мупироцину. Эти плазмиды могут быть мобилизованы или конъюгированы и могут быть успешно перенесены в S. aureus , что создает угрозу для больничной среды и усиливает идею о том, что S. haemolyticus является резервуаром генов для S. aureus . как подчеркивающая необходимость эффективных стратегий для обнаружения и борьбы с этой условно-патогенной бактерией, исторически и ошибочно называемой менее важным патогеном, но в последнее время считающейся новой угрозой для здоровья человека.
ДОПОЛНИТЕЛЬНЫЕ ДАННЫЕ
Дополнительные данные.
Авторы благодарны Орландо душ Сантушу ( in memoriam ) за техническую помощь. Мупироцин был любезно предоставлен компанией GlaxoSmithKline.
ФИНАНСИРОВАНИЕ
Эта работа была поддержана фондами «Fundação Amparo à Pesquisa do Estado do Rio de Janeiro» () [номер гранта E-], «Conselho Nacional de Desenvolvimento Científico e Tecnológico» () [номер гранта] и «Coordenação de Aperfeessalíçoamento P Superior ‘() Proex [номер гранта].C.C.R. был получателем стипендии от [номер гранта].
Конфликт интересов. Не заявлено.
ССЫЛКИ
Bastos
MCF
Мондино
PJJ
Азеведо
MLB
и другие.Молекулярная характеристика и перенос между штаммами Staphylococcus плазмиды, придающей высокий уровень устойчивости к мупироцину
евро J Clin Microbiol
1999
18
393
8
Институт клинических и лабораторных стандартов (CLSI)
Стандарты эффективности тестирования чувствительности к противомикробным препаратам: Двадцать четвертое информационное приложение M100-S24
Уэйн, Пенсильвания, США
Институт клинических и лабораторных стандартов
2014
Чекай
т
Ciszewski
M
Шевчик
EM
Staphylococcus haemolyticus — новая угроза на закате антибиотиков
годаМикробиология
2015
161
2061
8
Даниил
В
Салем
M
Насир
г
и другие.Значение Staphylococcus haemolyticus при внутрибольничных инфекциях
J Pioneer Med Sci
2014
4
119
25
Дини
SR
Уорби
CJ
Tosas Auguet
O
и другие.Влияние устойчивости к мупироцину на передачу и контроль MRSA, связанного с оказанием медицинской помощи
J Антимикробный Chemoth
2015
70
3366
78
Эванс
RP
МладшийМакрина
FL
Streptococcal R плазмида pIP501: карта сайта эндонуклеазы, расположение детерминанты устойчивости и конструирование новых производных
Дж Бактериол
1983
154
1347
55
Феррейра
NC
Schuenck
RP
Сантос
KR и другие.Разнообразие плазмид и передача мупироцина высокого уровня mup Ген устойчивости в Staphylococcus haemolyticus
FEMS Иммунол Мед Микрофон
2011
61
147
52
Giambiagi-Marval
M
Мафра
MA
Penido
EG
и другие.Четкие группы плазмид, коррелированные с продукцией бактериоцина в Staphylococcus aureus
J Gen Microbiol
1990
136
1591
9
Препятствие
JG
О’Нил
AJ
Mody
л
и другие.In vivo Перенос высокой устойчивости к мупироцину от Staphylococcus epidermidis к метициллинорезистентным Staphylococcus aureus , связанный с неэффективностью профилактики мупироцином
J Антимикробный Chemoth
2005
56
1166
8
Корнблюм
Дж
Хартман
BJ
Новик
RP
и другие.Превращение гомогенно метициллин-устойчивого штамма Staphylococcus aureus в гетерогенную резистентность посредством инсерционной инактивации, опосредованной Tn551
евро J Clin Microbiol
1986
5
714
8
Нуньес
AP
Тейшейра
LM
Bastos
CC
и другие.Геномная характеристика устойчивых к оксациллину Staphylococcus epidermidis и Staphylococcus haemolyticus , выделенных из медицинских центров Бразилии
J Hosp Infect
2005
59
19
26
Нуньес
EL
душ Сантуш
KRМондино
PJ
и другие.Обнаружение гена ileS -2, кодирующего устойчивость к мупироцину, у метициллин-резистентных Staphylococcus aureus с помощью мультиплексной ПЦР
Диагностика Micr Infec Dis
1999
34
77
81
Oliveira
NE
Кардозо
AP
Marques Ede
А
и другие.Критерии интерпретации для дифференциации низкой и высокой устойчивости к мупироцину у Staphylococcus aureus
J Med Microbiol
2007
56
937
9
Отто
м.
Коагулазонегативные стафилококки как резервуары генов, способствующих инфицированию MRSA
Биологические исследования
2013
35
4
11
Perez-Roth
E
Армас-Гонсалес
E
Алькоба-Флорес
Дж
и другие.ПЦР-амплификация гетерогенных соединений IS 257-ileS2 для молекулярного мониторинга высокой устойчивости к мупироцину у стафилококков
J Антимикробный Chemoth
2011
66
471
5
Повеликуннель
т
Гетин
г
Хамфрис
H
Устойчивость к мупироцину: клинические последствия и потенциальные альтернативы для искоренения MRSA
J Антимикробный Chemoth
2015
70
2681
92
Projan
SJ
Лучник
GL
Мобилизация релаксируемой плазмиды pC221 Staphylococcus aureus конъюгативной плазмидой pGO1 включает три локуса pC221
Дж Бактериол
1989
171
1841
5
Рудреш
NS
Рави
GS
Motagi
А
и другие.Распространенность устойчивости к мупироцину среди стафилококков, ее клиническое значение и связь с клиническим применением
J Врачи лаборатории
2015
7
103
7
Schuenck
RP
Перейра
EM
Иорио
NL
и другие.Мультиплексный ПЦР-анализ для выявления метициллин-резистентных Staphylococcus haemolyticus
FEMS Иммунол Мед Микрофон
2008
52
431
5
Томас
СМ
Hothersall
Дж
Уиллис
класс
и другие.Устойчивость к антибиотику мупироцину и его синтез
Nat Rev Microbiol
2010
8
281
9
Вилела
RJ.
Инфекции мягких тканей носа
Вальдес
т
Вальехо
Дж
Инфекционные болезни в детской отоларингологии
Швейцария
Springer International
2016
85
91
Вудфорд
N
Уотсон
AP
Патель
S
и другие.Гетерогенное расположение гена высокой устойчивости к мупироцину mupA в Staphylococcus aureus
J Med Microbiol
1998
47
829
35
Гемолитический стафилококк — wikidoc
Главный редактор: C. Майкл Гибсон, M.S., M.Д. [1]
Обзор
Staphylococcus haemolyticus — это вид бактерии, принадлежащий к роду Staphylococcus . Это грамположительный кокк, отрицательный по коагулазе и положительный по каталазе. S. haemolyticus , часто обнаруживаемый как комменсальный организм на коже людей и животных, редко является причиной инфекций мягких тканей, обычно у пациентов с ослабленным иммунитетом.
S. haemolyticus устойчив ко многим антимикробным препаратам. [1] Зарегистрирована устойчивость к ванкомицину, и это вызывает беспокойство, поскольку такая устойчивость может быть приобретена другими, более патогенными стафилококками.
Лечение
Антимикробный режим
- 2. Метициллин-резистентный Staphylococcus epidermidis
- Предпочтительный режим: ванкомицин 1 г внутривенно каждые 12 часов с рифампицином или без него 600 мг / день PO qd
- Примечание. При глубоких инфекциях рассмотрите возможность добавления гентамицина с рифампицином 600 мг / день перорально 1 раз в день или без него в схему лечения [4]
- 3. Инфекции протеза
- Предпочтительный режим: оксациллин 1-2 г внутривенно каждые 4 часа ((или) ванкомицин 1 г внутривенно каждые 12 часов) И рифампицин 600 мг / день перорально 1 раз в день И гентамицин 3 мг / кг / день внутривенно / внутримышечно q8-24h подходит [4]
- Примечание: Продолжительность зависит от места заражения и степени тяжести.

 2014 исправление. Abin & Hollibaugh, 2017 {«Desulfuribacillia» ♥: «Desulfuribacillales» ♥: «Desulfuribacillaceae» ♥}
2014 исправление. Abin & Hollibaugh, 2017 {«Desulfuribacillia» ♥: «Desulfuribacillales» ♥: «Desulfuribacillaceae» ♥}