Геморрагический васкулит у детей | Симптомы и лечение геморрагического васкулита
Геморрагический васкулит начинается обычно остро, при субфебрильном, реже фебрильном повышении температуры тела, а иногда и без температурной реакции. Клиническая картина может быть представлена одним или несколькими из характерных синдромов (кожный, суставной, абдоминальный, почечный), в зависимости от чего выделяют простую и смешанную формы болезни.
Кожный синдром (пурпура) встречается у всех больных. Чаще в начале болезни, иногда вслед за абдоминальным или другим характерным синдромом на коже разгибательных поверхностей конечностей, преимущественно нижних, на ягодицах, вокруг крупных суставов появляется симметричная мелкопятнистая или пятнисто-папулёзная геморрагическая сыпь. Интенсивность сыпи различна — от единичных элементов до обильной, сливной, иногда в сочетании с ангионевротическими отёками. Высыпания носят волнообразный, рецидивирующий характер. У большинства геморрагический васкулит начинается с типичных кожных высыпаний — мелкопятнистые, симметрично расположенные элементы, похожие на синячки, не исчезающие при надавливании.
Суставной синдром — второй по частоте симптом геморрагического васкулита. Степень поражения суставов варьирует от артралгий до обратимых артритов. Поражаются преимущественно крупные суставы, особенно коленные и голеностопные. Появляются болезненность, отёк и изменение формы суставов, которые держатся от нескольких часов до нескольких дней. Стойкой деформации суставов с нарушением их функции не бывает.
Абдоминальный синдром, обусловленный отёком и геморрагиями в стенку кишки, брыжейку или брюшину, наблюдают почти у 70% детей. Больные могут жаловаться на умеренные боли в животе, которые не сопровождаются диспептическими расстройствами, не причиняют особых страданий и проходят самостоятельно или в первые 2-3 дня от начала лечения. Однако нередко сильные боли в животе носят приступообразный характер, возникают внезапно по типу колики, не имеют чёткой локализации и продолжаются до нескольких дней.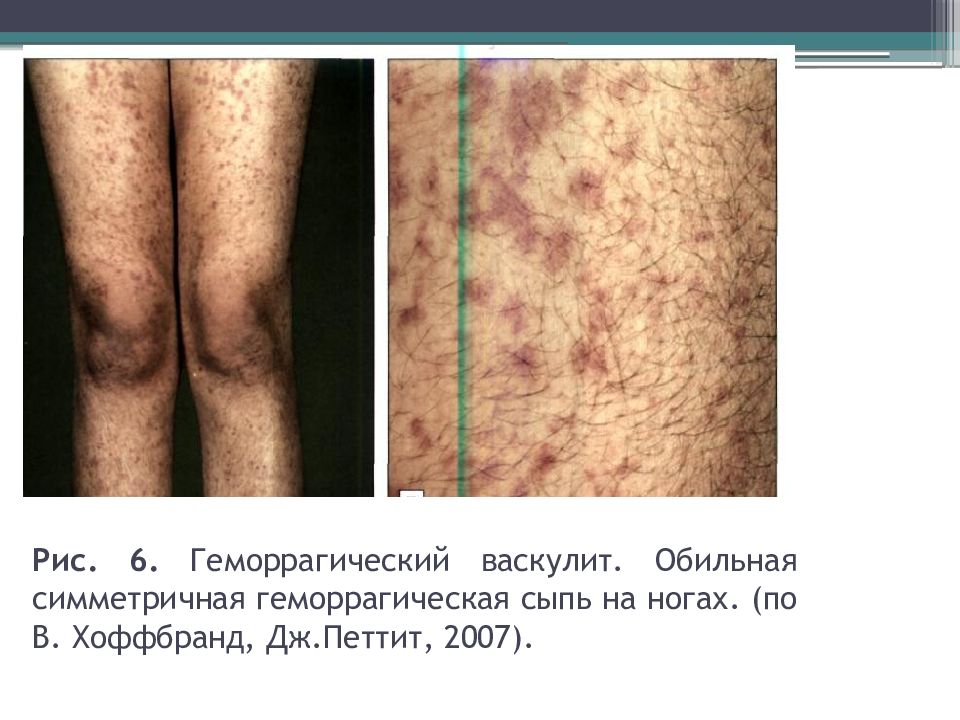 Может быть тошнота, рвота, неустойчивый стул, эпизоды кишечного и желудочного кровотечения. Наличие абдоминального синдрома с начала заболевания, рецидивирующий характер болей требуют совместного наблюдения пациента педиатром и хирургом, так как болевой синдром при геморрагическом васкулите может быть обусловлен как проявлением болезни, так и её осложнением (инвагинация, перфорация кишечника).
Может быть тошнота, рвота, неустойчивый стул, эпизоды кишечного и желудочного кровотечения. Наличие абдоминального синдрома с начала заболевания, рецидивирующий характер болей требуют совместного наблюдения пациента педиатром и хирургом, так как болевой синдром при геморрагическом васкулите может быть обусловлен как проявлением болезни, так и её осложнением (инвагинация, перфорация кишечника).
Почечный синдром встречается реже (40-60%) и в большинстве случаев не возникает первым. Он проявляется гематурией различной степени выраженности, реже — развитием гломерулонефрита (Шенлейна-Геноха нефрит), преимущественно гематурической, но возможно и нефротической формы (с гематурией). Гломерулонефрит морфологически характеризуется очаговой мезангиальной пролиферацией с отложением иммунных комплексов, содержащих IgA, а также СЗ компонент комплемента и фибрин. Иногда наблюдают диффузный мезангио-капиллярный гломерулонефрит, в тяжёлых случаях сочетающийся с экстракапиллярными полулуниями.
Течение геморрагического васкулита имеет циклический характер: чётко очерченный дебют спустя 1-3 нед после перенесённой острой вирусной или бактериальной инфекции, вакцинации и других причин и выздоровление через 4-8 нед. Описаны единичные наблюдения геморрагического васкулита у детей, протекающей крайне тяжело в виде молниеносной пурпуры.
Нередко течение приобретает волнообразный характер с повторными высыпаниями (в виде моносиндрома или в сочетании с другими синдромами), рецидивирующими на протяжении 6 мес, редко 1 года и более.
Хроническое течение свойственно вариантам с Шенлейна-Геноха нефритом или с изолированным непрерывно рецидивирующим кожным геморрагическим синдромом.
[20], [21], [22]
причины, описание симптомов, лечение, прогноз
Геморрагический васкулит (пурпура Шёнлейна–Геноха) – это патология воспалительного характера, поражающая главным образом мелкие сосуды.
Общие сведения
Согласно статистике, геморрагическим васкулитом страдает около 14 человек из 100000 населения. Наиболее часто данное заболевание поражает сосуды почек, органов ЖКТ и кожных покровов. При геморрагическом васкулите кожной формы у больных возникает характерная сыпь. Именно поэтому данную патологию еще называют аллергическим геморрагическим васкулитом.
Геморрагический васкулит (ГВ, болезнь Шенлейн-Геноха, аллергическая пурпура, капилляротоксикоз) относится к наиболее распространенным на сегодняшний день геморрагическим заболеваниям. По сути своей он является аллергическим васкулитом поверхностного характера с поражением мелких артериол, венул, а также капилляров. В Международной классификации болезней (МКБ) заболевание имеет название «аллергическая пурпура».
По сути своей он является аллергическим васкулитом поверхностного характера с поражением мелких артериол, венул, а также капилляров. В Международной классификации болезней (МКБ) заболевание имеет название «аллергическая пурпура».
Геморрагическим васкулитом страдают пациенты разных возрастов. Но болезнь Шенлейн-Геноха встречается в основном в детском возрасте — от 5 до 14 лет. Средняя распространенность среди детей этого возраста составляет 23-25 случая на 10 тыс. Наиболее подвержены заболеванию лица в возрасте 7-12 лет. У детей до 3 лет известны лишь отдельные случаи возникновения пурпуры. Подробнее о геморрагическом васкулите у детей.
Код МКБ 10 геморрагического васкулита имеет вид D65-D69. Это значит, что он относится к группе заболеваний под шифром D69, то есть имеет признаки аллергической пурпуры. В то же время D65 говорит о наличии внутрисосудистых патологий, при которых происходит нарушение свертываемости крови.
Ключевые понятия:
- Геморрагический васкулит – это васкулит, который поражает прежде всего мелкие сосуды и чаще возникает у детей чем у взрослых.

- Проявления могут включать пурпурную сыпь, артралгии, лихорадку, боль в животе, мелену и гломерулонефрит.
- Симптомы, как правило, ослабевают примерно через 4 недели.
- При необходимости для подтверждения диагноза необходимо провести биопсию пораженного участка кожи для выявления депозитов IgA.
- Лечение симптоматическое, а у взрослых следует рассмотреть использование кортикостероидов.
Патогенез и причины патологии
Возбудителями болезни Шлеймана-Геноха являются стрептококки, микоплазмы, а также респираторные инфекции. Именно поэтому заболевание чаще всего начинает проявлять свои первые симптомы спустя неделю-месяц после перенесенных тяжелых инфекционных заболеваний.
Однако причиной заболевания могут быть не только инфекции. Нередко толчком к развитию болезни становится переохлаждение, использование некачественной вакцины или неподходящих медикаментозных препаратов, аллергические реакции, а также укусы насекомых или ожоги. Причины геморрагического васкулита у взрослых могут заключаться в применении некоторых антибактериальных препаратов, особенно, пенициллиновой группы.
Причиной такого заболевания как геморрагический васкулит может быть нарушение иммунитета пациента. Замечено, что люди, склонные к различным проявлениям аллергических реакций, страдают болезнью Шенлейна Геноха несколько чаще. Так, иммунная система некоторых больных активирует систему комплимента, которая в итоге начинает атаковать сосуды собственного организма. Клетки иммунитета также могут внедряться в стенки пораженных сосудов. В результате этого происходит свертывание крови и, как следствие, тромбообразование. Так как стенки сосудов утрачивают свою целостность, то кровь, находящаяся в них, начинает выходить наружу. Этим и объясняется образование красных пятен при кожном геморрагическом васкулите.
Геморрагический васкулит у взрослых часто сочетается с нарушениями метаболизма. Беременность женщины также может стать провоцирующим фактором в развитии заболевания. Это связано с тем, что организм пациенток в этот период легко поддается влиянию различных неблагоприятных факторов извне. Геморрагический васкулит при беременности может сопровождаться отслоением плаценты, кислородным голоданием и недоразвитием плода.
Геморрагический васкулит при беременности может сопровождаться отслоением плаценты, кислородным голоданием и недоразвитием плода.
Какой врач лечит геморрагический васкулит?
При возникновении первых симптомов заболевания больной должен как можно скорее обратиться к своему участковом терапевту. И хотя он не занимается лечением данного заболевания, но может направить пациента к специалисту, который необходим. Как правило, к ревмтологу – врачу, который занимается лечением ревматических заболеваний.
К таким относятся и различные патологии соединительных тканей и суставов, характеризующиеся аутоиммунной природой. В эту группу заболевании входит и геморрагический васкулит. В н
причины, виды, описание симптомов, лечение, прогноз
Васкулит – это воспаление кровеносных сосудов.
Общие данные
Нарушения кровообращения в тканях и органах считается одной из ключевых причин смерти людей всех возрастов, а также виновником тяжелых случаев инвалидности у пациентов работоспособных категорий. Отклонения не всегда связаны со спонтанными причинами вроде эндокринных болезней или тромбоза. Возможны проблемы в самом сосуде. При васкулите поражаются как артерии, так и вены, капилляры, сосуды разных калибров независимо от вида и локализации. Возможны системные варианты заболевания, когда в расстройство вовлекается группы полых структур, это особенно опасно.
Единого мнения относительно происхождения патологического процесса в медицинской среде пока нет. Предполагается, что основная причина в инфекционном поражении, гиперсенсибилизации организма, когда тело становится чувствительным к малейшим колебаниям внутреннего или внешнего положения и сбой иммунной системы, которая начинает по ошибке атаковать собственные ткани.
Возникновение первичных системных васкулитов связано с нарушением иммунной реактивности, обусловленной, как правило, инфекционным агентом. Воспаление при системных васкулитах затрагивает все слои сосудистой стенки: оно может носить деструктивный характер, вызывать окклюзию сосуда, микроциркуляторные расстройства и, как следствие, ишемию органов вплоть до некрозов и инфарктов.
Воспаление при системных васкулитах затрагивает все слои сосудистой стенки: оно может носить деструктивный характер, вызывать окклюзию сосуда, микроциркуляторные расстройства и, как следствие, ишемию органов вплоть до некрозов и инфарктов.
Вторичный васкулит является элементом другой патологии и рассматривается как ее локальное факультативное проявление или осложнение (например, васкулит при скарлатине, менингите, сыпном тифе, сепсисе, псориазе, опухолях и т. д.). Чаще системными васкулитами страдают мужчины средней возрастной группы.
Лечение срочное, в стационаре. Потому как осложнения слишком тяжелы.
Механизм становления
В основе развития патологического процесса находятся два ключевых момента. В каких сочетаниях они встречаются в каждом конкретном случае сказать трудно, однако необходимо это выяснить. От подобной информации зависит подход к терапии и диагностике.
Аутоиммунный
Первый встречается сравнительно редко, по крайней мере, в чистом, изолированном виде. Суть заключается в повышении чувствительности организма к сторонним раздражителям, вплоть до воздействия незначительного количества аллергена, токсина бактерий. Иммунитет принимает клетки эндотелия, внутренней выстилки сосуда, за опасные вещества и инициирует выработку антител, которые разрушают ткани.
Суть заключается в повышении чувствительности организма к сторонним раздражителям, вплоть до воздействия незначительного количества аллергена, токсина бактерий. Иммунитет принимает клетки эндотелия, внутренней выстилки сосуда, за опасные вещества и инициирует выработку антител, которые разрушают ткани.
Возможно начало процесса без триггерного фактора, спонтанное. С точки зрения излечения этот механизм развития васкулита сложен, требуется применение иммунодепрессантов и группы поддерживающих, противовоспалительных препаратов.
Инфекционный
Играет большую роль. В основном он обуславливает вторичные формы васкулита. Причем очаг всегда находится вне сосуда. Это может быть больное горло, туберкулез, локализованный в легких или выделительной системе, перенесенный сифилис без лечения, венерические инфекции, прочие многочисленные варианты. Любой очаг рассматривается как потенциальный источник поражения.
Смешанные формы
Согласно профильным исследованиям, именно они в подавляющем большинстве случаев и встречаются. Происходит это по сложной схеме: на начальной стадии инфекционные агенты, тем более длительно существующие в организме проникают в структуры сосудов, но не активизируются. Потому симптомов васкулита нет. Однако именно они, продукты их жизнедеятельности вызывают иммунный ответ. В определенный момент защитные силы дают сбой и работают не так, как следовало бы.
Происходит это по сложной схеме: на начальной стадии инфекционные агенты, тем более длительно существующие в организме проникают в структуры сосудов, но не активизируются. Потому симптомов васкулита нет. Однако именно они, продукты их жизнедеятельности вызывают иммунный ответ. В определенный момент защитные силы дают сбой и работают не так, как следовало бы.
Васкулит далее развивается по деструктивному сценарию: возникает воспаление сосудистой стенки. Страдают как крупные структуры, так и более мелкие артериолы, вены, капилляры. Не всегда вместе. Возможны изолированные формы, когда вовлекается один сосуд или его фрагмент. В результате воспаления и отека происходит сужение просвета, диаметра полой структуры, кровоток ослабевает. Начинается острая ишемия тканей, которые питаются от пораженного сосуда. Вероятны фатальные итоги.
При своевременном лечении есть шансы свести все осложнения на нет, но в большей части случаев остается след от перенесенного заболевания. В виде фибриновых тяжей — спаек в сосуде или же рубцевании стенок, наращивании соединительной ткани, которая выступает естественным механическим препятствием.
В обоих случаях речь идет о нарушении кровообращения, хроническом. Потому создается высокий риск инвалидности или смерти, зависит от того, какой сосуд поражен.
Классификация
Развитие васкулитов различается по локализации (расположению основного очага), количеству областей аномального изменения, тяжести расстройства, типу патологического процесса. Критерии используются наравне, потому как от полученной информации, более точной оценки сути расстройства зависит схема воздействия, методы диагностики. Используются эти данные и в рамках прогнозирования после проведенной терапии, при определении динамики заболевания.
Исходя из происхождения патологического процесса, называют:
- Первичный васкулит. Развивается стремительно. Причину понять удается далеко не сразу даже опытному врачу. Потому как выраженных объективных проявлений нет или они скудны. Обычно момент становления болезни приходится на период после перенесенной инфекции или тяжелого эпизода аллергической реакции. Также сказываются рецидивы аутоиммунных расстройств: волчанки, артрита, ревматизма.
- Вторичная форма. Встречается несколько чаще. Однако невозможно точно сказать, замешан или нет в конкретном предполагаемом септическом случае сторонний процесс. Согласно профильным исследованиям, почти всегда это так и васкулит имеет смешанное, инфекционно-иммунное происхождение. Причинами выступает течение вирусных, бактериальных заболеваний. От простого ОРВИ до сифилиса, туберкулеза.
Ко вторичным же формам относятся варианты патологии, обусловленные глистными инвазиями, распадом раковых опухолей. Хотя они и имеют аутоиммунное происхождение.
По локализации выделяют системные и изолированные формы. И тех, и других довольно много. Среди первых называют:
- Гранулематоз Вегенера.
- Синдром Бехчета.
- Узелковый периартериит.
- Гигантоклеточный темпоральный артериит.
- Тромбангиит (болезнь Бюргера).
Что касается вторых, говорят о поражении сердца, головного мозга, сосудов конечностей, суставов (так называемый геморрагический васкулит), почек, печени.
Системный васкулит дает более тяжелые проявления, потому изначально прогноз по нему сложный. Исходя из типа сосуда, выделяют еще несколько разновидностей расстройства:
- Артериит. Как и следует из названия, поражает самые крупные структуры, которые и питают органы и ткани. Протекают наиболее тяжело. При развитии осложнений стремительно приводят к инвалидизирующим итогам, связанным с ишемией и гипоксией.
- Флебит. Поражение вен. Сопровождается менее активным течением, но часто приводит к некрозу тканей, необходимости оперативного вмешательства. В подавляющем большинстве моментов в процесс вовлекаются поверхностные вены нижних конечностей. Чуть реже верхних. Еще меньшее число случаев приходится на воспаление мозговых структур.
- Артериолит. Симптоматика смазанная, если нет системного течения.
- Капиллярит. Клиническая картина, несмотря на относительную безопасность состояния, мучительна для больного.
Наконец, классифицировать васкулит можно по тяжести расстройства.
- Легкая степень. Симптоматический комплекс минимален. Отмечается незначительный подъем температуры тела. Латентное течение также встречается.
- Средняя тяжесть. Выраженная клиника.
- Терминальная фаза. Несет большую опасность для здоровья и жизни. Часто заканчивается инвалидностью или смертью (примерно в 15-20% описанных случаев).
| Размер доминантных пораженных сосудов | Заболевания | Клинические проявления |
|---|---|---|
|
Крупный |
Болезнь Бехчета гигантоклеточный артериит; Артериит Такаясу | Перемежающаяся хромота Аномальные результаты АД и несимметричное наполнение пульса/отсутствие пульсовой волны на конечностях Признаки ишемии ЦНС (например, инсульт) |
|
Средний |
Кожный васкулит с поражением сосудов среднего калибра Узелковый полиартериит | В пораженных органах наблюдаются следующие симптомы инфаркта ткани:
|
|
Малый | Эозинофильный гранулематоз с полиангиитом Криоглобулинемический васкулит Гранулематоз, сопровождаемый полиангиитом Геморрагический васкулит (прежнее название пурпура Шенлейна-Геноха) Микроскопический полиангиит Кожный васкулит мелких сосудов |
Симптомы инфаркта ткани в пораженных органах похожи на симптомы поражения средних сосудов, за исключением поражений кожи, более характерных для пурпуры В почках: гломерулонефрит |
Причины
Факторы развития патологического процесса множественные. Среди таковых:
- Венерические заболевания. Особенно часто речь идет о сифилисе, запущенном, недостаточно пролеченном. Чуть реже имеет место герпетическое поражение.
- Туберкулез.
- Заболевания верхних, нижних дыхательных путей.
- Кариес, гингивит. Недостаточная гигиена ротовой полоти (как ни странно это звучит).
- Ревматизм в анамнезе.
- Аутоиммунные состояния прочих типов. От болезни Крона до системной красной волчанки и других.
Есть данные о некоей степени генетической предрасположенности к развитию процесса.
Симптомы и клинические проявления
Общие клинические симптомы для васкулитов всех разновидностей – это волнообразная лихорадка, при которой температура тела повышается в период вспышек поражения сосудов. Отмечаются также кожно-геморрагический и мышечно-суставный синдром. В патологический процесс может вовлекаться и периферическая нервная система. Это приводит к развитию полиневритов. Отмечается также истощение и многогранные висцеральные поражения.
В специализированной литературе для определения признаков поражения сосудов при этом заболевании иногда используют термин «васкулопатия».В целом симптомы системного васкулита в зависимости от разновидности могут быть разнообразными и затрагивают разные системы и органы. Возможны следующие проявления:
- Кожа – появляются высыпания, язвы, синеют пальцы, могут образовываться язвы в области гениталий, возможна гангрена.
- Легкие – проявляются одышка, кашель, харканье кровью, возможны эпизоды удушья.
- Нервная система – головная боль, головокружение, судороги, нарушение чувствительности и двигательной функции, инсульты.
- Слизистые оболочки – появление высыпаний и язвочек.
- Почки – увеличение показателей артериального давления, отеки.
- Пищеварительная система – диарея, боли в животе, кровь в стуле.
- Опорно-двигательный аппарат – припухлость и боли в суставах, болезненность мышц.
- Зрение — боли и резь в глазах, ухудшение зрения, покраснение глаз.
- Сердце и сосуды — нарушения работы сердца, боли за грудиной, скачки АД.
- ЛОР-органы – ухудшение обоняния и слуха, выделения из ушей и носа, осиплый голос, носовые кровотечения.
Геморрагический васкулит
Эта форма в основном протекает доброкачественно. Как правило, происходит ремиссия или выздоровление через несколько недель. Однако геморрагический васкулит может осложняться поражением кишечника или почек. Чаще всего при такой форме заболевания развивается поражение кожных покровов. Человека поражает геморрагическая сыпь — пальпируемая пурпура, которую слабо видно, но можно определить на ощупь. В самом начале болезни проявляется васкулит на ногах – сыпь локализуется в дистальных отделах нижних конечностей, а потом переходит на бедра, ягодицы.Также при этой форме болезни отмечается суставный синдром. Чаще всего поражаются крупные суставы ног.
Мигрирующие боли в суставах отмечаются в то время, когда появляются высыпания на коже. У части больных может отмечаться абдоминальный синдром, при котором происходит поражение ЖКТ. В таком случае отмечаются боли в животе, тошнота, рвота, боли в животе, желудочно-кишечные кровотечения. Возможен также почечный синдром.
Кожный
При этой разновидности болезни поражаются малые или средние сосуды дермы. Однако сосуды внутренних органов при этом не затрагиваются. Симптомы этой разновидности болезни схожи с признаками ряда заболеваний кожи. В частности, отмечаются капиллярные излияния, повреждение капилляров, узелки, крапивница. Если эта форма сопровождает системные болезни, пациента также беспокоит боль в суставах, повышение температуры тела.
Аллергический васкулит
При такой форме у больного проявляются эритематозные и геморрагические пятна, высыпания, узелки. Вероятен инфаркт кожи, когда в местах высыпаний образуется черная корка. В местах высыпаний проявляется жгучая боль либо зуд. Отмечаются кровоизлияния под ногтями на пальцах ног, болят мышцы и суставы. Чаще всего при такой форме васкулита появляется сыпь на бедрах, стопах, голени. Если недуг приобретает генерализированную форму, могут беспокоить высыпания на туловище и предплечьях.
К этой группе относят острую и хроническую узловатую эритему, индуративную эритему Базена, височный ангиит, болезнь Бехчета. Наиболее важные симптомы болезни Бехчета – это рецидивирующий стоматит, язвы на половых органах. Синдром Бехчета также поражает слизистую оболочку глаз, кожу. Характерные симптомы этой разновидности болезни – образование язв и эрозий. У больных с острой узловатой эритемой появляются узлы крупного размера, а цвет кожи под ними меняется от красного до зеленоватого.
Системный васкулит
Говоря о том, системный васкулит — что это за болезнь, следует отметить, что эта форма недуга развивается в случае нарушения иммунных механизмов у людей с разнообразными системными заболеваниями с поражениями соединительной ткани.При развитии гранулематоза Вегенера заболевание проявляется следующими симптомами: развиваются разрушительные изменения дыхательных путей, стенок сосудов и почек; появляются изъязвленные гранулемы на слизистых рта, носа, бронхов; развивается гломерулонефрит.
Болезнь приводит к тяжелым осложнениям – страдают внутренние органы, нервная система, органы зрения, кожа.Аутоиммунный васкулит при ревматизме распространяется на организм в целом. Его проявления зависят от стадии развития. Аутоиммунный вид болезни поражает кожные покровы, сосуды внутренних органов и мозга. Возрастает вероятность внутреннего кровотечения.
Криоглобулинемический васкулит
Это разновидность системной формы болезни, для которой характерно появление в клетках крови белков криоглобулинов. Они откладываются на стенках сосудов и постепенно их разрушают. Характерный признак этой болезни, имеющей прогрессирующую форму — поражение периферических нервов и постепенная потеря чувствительности. Если не начать лечения своевременно, это заболевание может спровоцировать двигательный паралич и потерю речи.
Уртикарный васкулит
Этот вид болезни – одна из разновидностей аллергической формы, при которой развивается хроническое воспаление поверхностных сосудов кожи. В самом начале таким больным часто ставят диагноз «хроническая крапивница». Болезнь протекает волнообразно. У человека появляются геморрагические узелки, волдыри, пятна на коже. Он часто ощущает жжение в тех местах, которые были поражены. Повышается температура, беспокоит боль в пояснице, суставах, мышцах, животе, головная боль. Повышается температура, развивается гломерулонефрит.
Узелковый периартериит
Развивается в основном у лиц мужского пола. Беспокоят боли в мышцах, понижается вес, поднимается температура. Иногда резко проявляются тошнота и рвота, сильная болезненность в животе. Болезнь может привести к инсультам и психическим нарушениям.
Болезнь Такаясу (неспецифический аортоартериит)
Артериит Такаясу – это прогрессирующий гранулематозный воспалительный процесс аорты и ее главных ветвей. Неспецифический аортоартериит (болезнь Такаясу) в основном поражает женщин в молодом возрасте. Около половины пациентов, у которых развивается артериит, страдают от первичных соматических симптомов. У них развивается лихорадка, бессонница, утомляемость, потеря веса, боль в суставах. Часто неспецифический аортоартериит приводит к развитию анемии и повышению СОЭ.
Еще примерно у половины больных предварительные соматические симптомы не развиваются, и отмечаются только поздние изменения сосудистой системы. В процессе развития болезни на ее поздних стадиях ввиду слабости стенок сосудов могут развиваться локализованные аневризмы. Болезнь также провоцирует развитие феномена Рейно. Поэтому важно, чтобы лечение было начато как можно раньше, и при этом четко соблюдался протокол лечения пациентов с болезнью Такаясу.
Гранулематоз Вегенера
При этой форме проявляется боль в околоносовых пазухах, язвы на слизистой носа, отмечается язвенно-некротический ринит. Может произойти разрушение носовой перегородки, что ведет к седловидной деформации носа. Также высока вероятность других серьезных нарушений: быстро развивается почечная недостаточность, отмечается одышка, кашель с кровью.
Синдром Черджа-Стросса
Это заболевание также называется эозинофильный гранулематоз с ангиопатей. В процессе его развития поражаются сосуды, вследствие чего ухудшается процесс снабжения кровью жизненно важных органов. Самый распространенный симптом васкулита Чарга-Стросса – астма. Однако кроме нее проявляются и другие симптомы: лихорадка, сыпь, кровотечение в ЖКТ, боль стоп и кистей. Иногда симптомы проявляются неярко, в других случаях развиваются тяжелые признаки, опасные для жизни.
Полиморфный дермальный ангиит
Это ангиит, при котором развивается хронический рецидивирующий дерматоз вследствие неспецифического воспалительного процесса в стенках сосудов кожи. В процессе развития заболевания преимущественно поражается кожа голеней. Но высыпания могут появляться и в других местах. Иногда их появлению предшествуют общие симптомы – повышенная температура, слабость, головная боль. Высыпания не сходят по несколько месяцев. После выздоровления существует риск рецидива. Выделяют много разновидностей этого заболевания в зависимости от особенностей сыпи.
Ливедо-ангиит
В основном развивается у женщин в период полового созревания. Изначально появляются стойкие ливедо-синюшные пятна на ногах. Реже они появляются в других местах. Пятна могут иметь разные размеры и очертания. При охлаждении выраженность усиливается. Со временем на местах пятен могут развиваться небольшие язвы, некрозы, кровоизлияния. Больных беспокоит зябкость, боли в ногах, болезненность в язвах.
Церебральный васкулит
Тяжелое заболевание, для которого характерно развитие воспалительного процесса стенок сосудов головного мозга. Церебральный вид этого заболевания может спровоцировать кровоизлияния, некроз тканей. В процессе развития болезни больного может беспокоить сильная головная боль. Возможен эпилептический пароксизм, очаговый неврологический дефицит. В процессе развития болезни вероятно проявление одного из комплексов симптомов:
- многоочаговые проявления, напоминающие клинику рассеянного склероза;
- острая энцефалопатия с психическими расстройствами;
- симптомы, характерные для объемного образования мозга.
Микроскопический васкулит
Эта форма в основном поражает мелкие сосуды. Встречается редко, может начаться как легочно-почечный синдром, к которому присоединяется быстро прогрессирующий гломерулонефрит и альвеолярные геморрагии. В самом начале заболевания развиваются общие проявления: лихорадка, миалгии, артралгии, снижение веса. Другие симптомы зависят от того, какие органы и системы поражаются. Чаще всего происходит поражение почек, реже – кожи, дыхательной системы, ЖКТ.
Гигантоклеточный темпоральный артериит
Болезнь поражает людей пожилого возраста. Ее симптомами являются слабость, волнообразная лихорадка, недомогание, сильные пульсирующие головные боли, припухлости в висках.
Диагностика
Алгоритм следующий:
- Клиническая оценка
- Основные лабораторные тесты для выявлени
Геморрагический васкулит — симптомы, фото и лечение
Геморрагический васкулит – это самое известное заболевание из васкулитов, которое также называют аллергической пурпурой, проявляющееся высыпаниями на коже из-за плохой свертываемости и циркуляции крови в сосудах. Обратите внимание на фото геморрагического васкулита ниже.
Сильнее всего подвержены данному недугу дети до 14 лет, но и взрослые в большей степени пожилые люди, так как их иммунитет уже достаточно слаб. Существует большое количество причин возникновения геморрагического васкулита.
Основными являются: генетическая предрасположенность, перенесенные заболевания верхних дыхательных путей, аллергия на лекарства, повреждение кожных покровов, пищевая аллергия, нарушение метаболизма, реакция на укусы насекомых, отравления различного характера, непереносимость на плановую прививку и т.д.
Классификация васкулита
- Существует 3 степени квалификации: в зависимости от клинической картины, от течения и степени заболевания.
- Васкулит подразделяется на основании клинического течения на кожный, почечный, суставной, абдоминальный или смешанные типы:
- Самый распространенный вариант, это кожный тип.
- Суставной тип охватывает как кожу человека, так и его суставы, они становятся припухлыми и очень болезненными.
- Почечный тип проявляется воспалительным процессом почек, переходящих в нефротический синдром.
- Абдоминальный тип включает в себя поражение кишечника.
- Течение заболевание бывает: быстрое (в течение 2-3 дней), острое (до месяца), затяжное (до 3 месяцев), хроническое (протекающим на постоянной основе).
- Степень заболевания геморрагического васкулита наблюдается малая, средняя и высокая.
Признаки заболевания
При легком течении заболевания температура не поднимается, высыпания покрывают маленькие участки кожи. Болезнь может заявить о себе и более агрессивно, сначала появится недомогание, заболит голова, произойдет расстройство желудка и повысится температура до 38С, также сыпью покроется большая площадь тела.
Тяжелое протекание васкулита выражается признаки, описанными выше, к которым может добавляться расстройство сердечной мышцы, поражение почек, сильные боли в суставах и даже возможно появление рвотных масс с кровью.
Отличие симптомов у взрослых и детей
Геморрагический васкулит у взрослых и детей существенно отличается. У взрослых начало болезни очень сложно определить, потому что симптомы незначительны, проблемы с кишечником наблюдаются менее чем у 50 % заболевших, возможны проявления ухудшения в работе почек, высыпания на небольшой площади.
- С началом болезни у детей появляется высокая температура, становится жидкий стул с каплями крови и также почечная недостаточность, сыпь охватывает значительную часть на коже.
Лечение васкулита
Если у Вас наблюдаются даже небольшие проявления геморрагического васкулита, нужно обратиться к специалисту для дальнейшей помощи. Вам будет назначена диета и необходимые лекарства.
При наблюдении более острых признаков, как проблемы с кишечником и почками нужно обязательно находиться в медицинском учреждении под контролем врачей. Чаще всего все препараты вводят внутривенно, также определенная диета присутствует.
Лечат противовоспалительными препаратами с добавлением антигистаминных средств, если Вы своевременно обратились за помощью, не дожидаясь осложнений.
- При тяжелой форме протекания болезни используют два метода лечения геморрагического васкулита: гормонотерапия и интенсивный плазмаферез.
Плазмаферез назначается при очень быстром протекании болезни, с помощью него производят забор крови и удалят из нее ненужные вирусы, антитела, токсины, а потом возвращают ее в кровоток. Таким образом, нормализуется кровь, увеличивается способность клеток противостоять бактериям, приобретается чувствительность больных к назначенным лекарственным средствам.
- После выписки больных, их ждет продолжительная реабилитация в домашних условиях, периодическое наблюдение у специалистов, и также назначены профилактические меры для повторного рецидива заболевания.
Фото геморрагического васкулита
- Также рекомендуем:
Источник: https://dermatologcentr.ru/gemorragicheskij-vaskulit/
Геморрагический васкулит: лечение, симптомы, фото, причины
Это заболевание, именуемое в медицине синдромом Шенляйна Геноха или аллергической (ревматической) пурпурой, диагностируется преимущественно у пациентов в возрасте 5-13 лет. У взрослых случаи геморрагического васкулита также частое явление.
Реже оно возникает у детей, не достигших 3-летнего возраста. Развитие данной болезни всегда сопряжено с повреждением стенок сосудистых русел, повышением степени их проницаемости, активацией процесса белкового обмена, повышенным продуцированием иммунных ответов.
Геморрагический васкулит: что это такое?
Геморрагический васкулит — это системное заболевание серии васкулитов, характеризуется поражением стенок наиболее мелких сосудов организма – капилляров, венул и артериол. Такое состояние всегда сопровождается нарушением структуры указанных кровеносных русел.
Как правило, заболевание протекает с наличием асептического воспаления, что существенно повышает вероятность образования тромбов. При наличии ревматической пурпуры страдают не только кровеносные русла кожного покрова, но и внутренних органов (суставов, почек, ЖКТ).
Причины геморрагического васкулита
Основной пусковой механизм данного заболевания – инфекция различной этиологии. Это могут быть грибки, бактерии или вирусы. Также на развитие болезни оказывает влияние прием определенных лекарственных препаратов, неблагоприятная экологическая обстановка, в которой проживает больной.
Предрасполагающими факторами к возникновению геморрагического васкулита являются:
- укусы насекомых;
- термические ожоги;
- травмы различного генеза;
- интоксикация вследствие попадания в организм биологических ядов;
- процедуры вакцинации;
- врожденные функциональные расстройства иммунной системы;
- простудные заболевания;
- перегрев либо переохлаждение организма;
- аллергические реакции, вызванные пищевыми агентами.
Опасность солнечных ожогов для организма человека, их лечение и профилактика осложнений: https://medknsltant.com/chto-delat-esli-obgorel-na-solntse/
Признаки и симптомы геморрагического васкулита, фото
фото симптомов на коже
1. Кожные высыпания
Симптомы геморрагического васкулита у взрослых проявляются геморрагическими папулами (сыпь) небольшого диаметра, которые образуются преимущественно на кожном покрове ягодиц, стоп, бедер, и голеней, реже – на коже верхней части туловища. Сыпь имеет насыщенный красный цвет и не исчезает при надавливании. Иногда папулы образуют конгломераты. Высыпания, как правило, расположены симметрично.
Большое значение имеет степень тяжести течения геморрагического васкулита. Симптомы при этом также могут иметь различную интенсивность.
При особо тяжелом течении заболевания в центре папул появляется небольшое скопление гнойного экссудата, что приводит к образованию эрозий. Если наблюдается хроническая форма, язвы имеют тенденцию к заживлению, после чего на коже отмечается обильное шелушение и стойкая пигментация.
2. Острое начало болезни
Аллергическая пурпура в основном возникает в весеннее время года и отличается острым течением на начальных стадиях своего развития. Зачастую это происходит после перенесенной инфекционной патологии органов дыхательной системы. Состояние нередко сопровождается повышением температуры тела, как субфебрильным, так и существенным.
3. Сбои в работе ЖКТ
Расстройство стула, приступы тошноты, многократная рвота, боли в зоне живота – все эти признаки свидетельствуют о том, что у больного развился геморрагический васкулит, синдромы абдоминальных проявлений которого могут иметь различную интенсивность. Причем пациенты не могут указать точную локализацию болей.
4. Поражение суставов
Данный симптом встречается у 75% больных. Синдром Шенляйна Геноха сопровождается болезненностью, отечностью и покраснением кожи в области суставов. Иногда такая симптоматика насколько выражена, что наблюдается ограничение подвижности сустава/суставов.
Чаще всего страдают крупные суставы, например, локтевые, голеностопные, коленные.
5. Поражение почек
У 3-ех пациентов из 10-ти заболевание сопровождается гломерулонефритом. При этом степень гематурии может являться различной. Поражение почек на фоне ревматической пурпуры может повлечь за собой развитие почечной недостаточности.
Признаки и симптомы гломерулонефрита — нефритический синдром: https://medknsltant.com/glomerulonefrit-diagnostika-simptomy-lechenie/
В медицине эту патологию принято классифицировать в зависимости от проявлений, которыми сопровождается ее течение.
- Кожно-абдоминальная. Поражаются органы пищеварительной системы, ярко выражен болевой синдром в области брюшины, нередко возникает кишечная колика, присутствует кожная сыпь.
- Кожная. При развитии данной формы заболевания поражение затрагивает только кожный покров, на котором появляются четко очерченные экзантемы темно-вишневого окраса. Чаще всего высыпания локализуются вблизи суставов на разгибательных поверхностях нижних (реже верхних) конечностей и ягодиц. На фоне экзантем появляется и папулезная сыпь, которой часто сопровождается, например, кожно-абдоминальный геморрагический васкулит. Кожная форма этой болезни имеет склонность к интенсивному зуду в районе образования папул и экзантем.
- Кожно-суставная. Наряду с геморрагическими папулами отмечается поражение суставных тканей. Чаще всего это коленные, голеностопные и локтевые суставы.
- Почечная. В этом случае у пациентов наблюдаются поражения почек различного генеза. Кожная сыпь отсутствует.
Кожно-суставная форма геморрагического васкулита заслуживает отдельного описания — ей присуще стремительное развитие. Иногда перед началом болезни человек испытывает головные боли и общее недомогание в сочетании с повышенной температурой тела.
На поверхности кожи, в результате многочисленных кровоизлияний, образуются мелкие красные пятна округлой формы. Чаще они сливаются друг с другом.
Также кожно-суставная форма патологии характеризуется появлением волдырей, воспалительных очагов, отечности кожных покровов и мягких тканей в области суставов. Если течение васкулита является особо тяжелым, кожно-суставная форма может перейти в некротическую форму.
Диагностика геморрагического васкулита
Изменения, которых претерпевают показатели биологических образцов пациента при лабораторном обследовании, нельзя назвать специфическими. С целью подтверждения диагноза обращают внимание на уровень:
- СОЭ;
- тромбоцитов;
- лейкоцитов;
- альфа-2-глобулинов;
- иммуноглобулинов А и G;
- реактивных протеинов;
- серомукоидов;
- фибринолиза;
- фибриногена;
- криоглобулинов;
- ДФА;
- антигиалуронидазы;
- фибринмономеров;
- антистрептолизина.
В ходе проведения исследований необходимо дифференцировать геморрагический васкулит. Диагностика заболевания не представляет сложности для медиков.
Трудность может заключаться лишь в определении его формы развития и возможности спутать, например, абдоминальную форму патологии с каким-либо другим заболеванием:
- кишечной непроходимостью;
- панкреатитом;
- холециститом;
- перитонитом;
- воспалением аппендикса.
Также геморрагические папулы могут являться одним из проявлений:
- тромбоцитопении;
- криоглобулинемического васкулита;
- паранеопластического синдрома;
- сепсиса;
- менингококкового менингита.
Лечение геморрагического васкулита
Традиционные методы
Длительность и характер лечения геморрагического васкулита у детей и взрослых зависят от степени тяжести, клинической формы и фазы его развития. При всех формах заболевания назначается прием антиагрегантов – Трентала и Курантила. В особо тяжелых случаях, с целью усилить антиагрегационный эффект, пациенту выписывают два указанных препарата одновременно.
Также назначают и прием антикоагулянтов. Смеха приема, разовая и суточная дозировки подбираются индивидуально для каждого пациента. Нередко больным назначают внутривенное или подкожное введение Гепарина. Во втором варианте лекарство попадает в организм через жировую клетчатку в районе брюшной полости.
При необходимости врач выписывает активаторы фибринолиза. Таковыми являются никотиновая кислота и все ее производные. Помимо указанных препаратов, назначаются:
- глюкокортикостероиды;
- витамины Е и А;
- мембраностабилизаторы;
- цитостатики;
- анальгетики;
- спазмолитики;
- энтеросорбенты;
- противовоспалительные.
При лечении геморрагического васкулита у взрослых может быть показано прохождение процедуры плазмафереза. Метод проведения выбирается исходя из тяжести патологии. Посредством плазмафереза можно добиться очищения плазмы крови от токсических агентов на молекулярном уровне.
Хирургия
Хирургические методы лечения проводятся в крайних случаях – когда требуется трансплантация новой
Геморрагический васкулит
Среди всех первичных васкулитов чаще всего встречается геморрагический васкулит или болезнь Шёнлейна-Ге́ноха. Эта патология еще известна как ревматическая пурпура. На фоне этого расстройства возникает сдвиг в системе гемостаза с последующим развитие микротромбоваскулита. Протекать может как молниеносно, так и хронически, поэтому лечение составляет в индивидуальном порядке.
Геморрагический васкулит (ГРВ или болезнь Шёнлейна-Ге́ноха) представляет собой воспалительное заболевание из группы васкулитов, при котором поражаются мелкие кровеносные сосуды (капилляры). Обычно является самоограниченным патологическим состоянием. Синонимы — аллергическая пурпура, аллергический васкулит, анафилактоидная пурпура, геморрагический капиллярный токсикоз, лейкоцитокластический васкулит, нетромбоцитопеническая идиопатическая пурпура, ревматическая пурпура, сосудистая пурпура.
Это наиболее распространенная форма воспаления сосудов у детей (среди васкулитов), которое приводит к воспалительным изменениям в мелких кровеносных сосудах.
В основе развития геморрагического васкулита лежит нарушение работы иммунной системы, из-за чего возникает воспаление сосудистой стенки. Болезнь чаще всего определяется у детей до 5 лет, и подобных случаях чаще всего развивается молниеносная форма ГРВ. При своевременном лечении удается повысить качество жизни больного.
Видео: Пурпура Шёнляйна-Геноха — Геморрагический васкулит
Признаки геморрагического васкулита
Симптомы ГРВ обычно начинаются внезапно и могут выражаться следующим образом:
- Головной болью.
- Лихорадкой.
- Потерей аппетита.
- Спазмами.
- Болью в животе.
- Болезненными менструациями.
- Крапивницей.
- Кровавой диареей.
- Болью в суставах.
Красные или фиолетовые пятна обычно появляются на коже и называются петехиями. В классическом случае высыпания появляются на ягодицах, спине и ногах.
(A и B) Классические поражения кожи при ГРВ с ощутимой пурпурой на конечностях. (C) Артрит и пурпура на нижней конечности. (D) Буллезные и некротические поражения нижних конечностей у пациента со сложным течением пурпуры.
Воспалительные изменения, связанные ГРВ, также могут развиваться в суставах, почках, пищеварительной системе и, в редких случаях, головном и спинном мозге (центральной нервной системе).
Особенности проявлений разных форм геморрагического васкулита:
- При пурпуре Шенлейна поражаются кожа и суставы, но при этом воспаление желудочно-кишечного тракта отсутствует.
- При пурпуре Геноха у больных определяются пурпурные пятна на коже и острые процессы в брюшной полости, например гломерулонефрит (тип заболевания почек). При этой форме ГРВ суставы не поражаются.
В дополнение к характерным красным пятнам на коже может определяться головная боль, потеря аппетита и / или лихорадка.
- Кожа обычно становится красной (диффузная эритема).
- Боли в животе становятся наиболее выраженными ночью.
- Кровь может присутствовать в стуле, а аномальное кровотечение (кровоизлияние) из желудочно-кишечного тракта диагностируется как кровавая диарея.
- Боли в суставах (артралгия) может определяться в любом суставе, но чаще всего поражаются коленные и в районе лодыжек.
- Некоторые люди с ГРВ испытывают рвоту и диарею, тогда как у других определяются тяжелые запоры и необычно темный стул (мелена).
Пятна пурпуры вызваны небольшими кровоизлияниями под кожу и не связаны с аномально низким уровнем тромбоцитов (нетромбоцитопеническое расстройство), что характерно для некоторых других форм пурпуры. Другие поражения кожи, связанные с ГРВ, включают крупные волдыри (крапивница) или язвы (некроз ткани), особенно на ягодицах и ногах.
Отек может возникать на лице и шее из-за аномального скопления жидкости в мягких тканях пораженных областей (ангионевротический отек). В редких случаях отек развивается в гортани, что может вызывать затруднение дыхания, способное привести к угрожающим жизни респираторным осложнениям.
У четверти-половины больных с ГРВ возникают проблемы с функцией почек, такие как гломерулонефрит, при котором повреждается почечная ткань. В результате нарушается процесс очищения крови от различных метаболитов. Патологический процесс выражается в определении крови в моче (гематурия) и воспалительных изменениях в почках. У некоторых людей может развиться тяжелое заболевание почек, включая нефропатию, хроническое воспаление почек (нефрит) и / или нефротический синдром, приводящий к почечной недостаточности.
В редких случаях часть кишечника пострадавшего может складываться сама в себя (инвагинация). Это приводит к значительной боли и, если консервативные меры не разрешают проблему, может потребоваться хирургическое вмешательство.
Когда вовлечена центральная нервная система, люди с этим расстройством могут испытывать сильные головные боли, перцептивные изменения, зрительные трудности (атрофия зрительного нерва) и / или судороги.
Причины геморрагического васкулита
Точная причина ГРВ полностью не выяснена, хотя исследования показывают, что она связана с ненормальным ответом иммунной системы. В некоторых случаях причинным фактором является чрезвычайная аллергическая реакция, развивающаяся на некоторые оскорбительные вещества (например, продукты или наркотики).
Исследования показывают, что геморрагический васкулит мо
Васкулит геморрагический | Лечение Сердца
Геморрагический васкулит и способы его лечения
Болезнь Шенляйна-Геноха, так ещё называют геморрагический васкулит — это заболевание, обусловленное поражением сосудов мелкого калибра (артериол, капилляров, венул) IgA- иммунными комплексами. В основном поражаются сосуды кожи, почек, кишечника и суставов. Триггерными факторами при этом заболевании выступают вакцинация, перенесённые инфекции верхних дыхательных путей (у детей), пищевая аллергия, укусы насекомых, переохлаждение. У взрослых на первом месте выступает приём лекарств.
Геморрагический васкулит может иметь:
- острое течение
- молниеносное
- хроническое с рецидивами и длительными ремиссиями.
- минимальную
- умеренную
- высокую активность.
По формам:
- кожная форма геморрагического васкулита и кожно-суставная
- абдоминальная и кожно-абдоминальная
- почечная и кожно-почечная
- смешанная
Клиническая картина заболевания
Симптомы геморрагического васкулита очень разнообразны, но у всех заболевших наблюдается поражение кожи. Оно может проявить себя в самом начале заболевания, так и после появления других признаков. Наиболее типичным является появление пурпуры — мелкопятнистых (1−3 мм) геморрагий, которые пальпируются. Эта сыпь симметрична и находится изначально на ступнях и голенях, в дальнейшем она может распространяться выше. Кроме пурпуры возможно появление и других элементов сыпи (везикулы, петехии, эритемы и даже участки некрозов).
Картина поражения суставов включает симметричные артриты или арталгии. Чаще всего поражаются голеностопные суставы, коленные. Редко — локтевые и лучезапястные.
При абдоминальном синдроме пациента будут беспокоить спастическая боль в животе, тошнота, рвота (иногда с примесью крови). Этот синдром у детей может проявляться до появления сыпи — это несёт в себе определённую опасность. А именно, имитируя клинику острого живота геморрагический васкулит может быть причиной необоснованных операций.
Вовлечение в патологический процесс почек наблюдается у 50% больных. Макро- или микрогематурия, протеинурия —
это то, что врач сможет увидеть в результатах анализов. Но, бывают случаи развития нефротического синдрома (гипопротеинемия, гиперхолестеринемия, гипоальбуминемия, потеря белка больше 3,5 г/сут и массивные отёки).
В одиночных случаях могут поражаться лёгкие (геморрагический плеврит, сосудистая пневмония) и центральная нервная система (головная боль, кровоизлияния, энцефалопатия).
Геморрагический васкулит у взрослых чаще всего возникает в возрасте 18−20 лет. В основном же пик этого заболевания приходится на 5−16 лет. Обычно все симптомы болезни проходят в течение месяца. Но, отдельно стоит поговорить о последствиях геморрагического васкулита. Поражение сосудов желудочно-кишечного тракта чревато развитием инвагинаций, кровотечений и даже перфораций. Одной из причин смерти может быть развитие перитонита.
При почечной клинике и хроническом, рецидивирующем процессе может развиваться хроническая почечная недостаточность, требующая диализа.
Геморрагический васкулит и беременность
Известно, что беременность также может спровоцировать начало геморрагического васкулита, а так же протекать на фоне него. Как и все системные заболевания, болезнь Шенляйна-Геноха, иногда сопровождается антифосфолипидным синдромом.
В свою очередь, этот синдром может спровоцировать задержке внутриутробного развития плода, самопроизвольным абортам, отслойке плаценты, привычному невынашиванию беременности. Поэтому, решить вопрос о беременности может только опытный и квалифицированный врач-ревматолог. Для выявления антифосфолипидного синдрома необходимо пройти ряд обследований. При протекании беременности на фоне геморрагического васкулита назначаются в низких дозах аспирин и гепарин.
Лечение геморрагического васкулита
Лечение геморрагического васкулита заключается в соблюдении постельного режима (в ходе наблюдений было замечено, что несоблюдение постельного режима приводит к увеличению количества высыпаний), диеты и приёме медикаментозных препаратов. При лёгком течении и кожно-суставных проявлениях болезни достаточно назначения нестероидных противовоспалительных препаратов (мовалис, ортофен).
Если же присутствует абдоминальный, почечный синдромы или тяжелое течение кожной формы геморрагического васкулита — всё это показания к назначению глюкокортикостероидов (преднизолон). В комплексном лечении используют инъекции гепарина. Возможно сочетание гепарина с антиагрегантами (дипиридамол). При тяжёлом течении и клинике ДВС-синдрома проводят инфузии свежезамороженной плазмы.
Лечение геморрагического васкулита у детей ничем не отличается от лечения у взрослых. Особенностями являются: применение препаратов и доз допустимых по возрасту, витаминотерапия, антигистаминные средства. Поскольку у детей наиболее частыми пусковыми факторами в развитии геморрагического васкулита являются инфекции, гельминты, то при необходимости можно провести антибиотикотерапию, дегельминтизацию.
Диета при геморрагическом васкулите
Диету при геморрагическом васкулите должны соблюдать как взрослые, так и дети. Она заключается в исключении из рациона продуктов, являющихся облигатными аллергенами. Это красные овощи и фрукты, кофе и шоколад, цитрусовые, мёд, рыба, раки. Гипоаллергенная диета исключает всевозможные пряности, яйца куриные, консервы, продукты, которые содержат всяческие пищевые добавки и красители. Разрешается:
- зелёные яблоки
- компоты из сухофруктов
- крупы рисовая, овсяная
- мясо индюшки, кролик
- яйца перепелиные
Прогноз:
При этом заболевании прогноз обычно благоприятный. Зачастую все симптомы болезни проходят сами по себе. Главным неблагоприятный прогностическим признаком считается персистирующая нефропатия.
ГЕМОРРАГИЧЕСКИЙ ВАСКУЛИТ
Геморрагический васкулит — острое инфекционно-аллергическое заболевание, при котором поражаются мелкие сосуды кожи, суставов, кишечника и почек. Появление заболевания связывают с инфекциями (стрептококковой, стафилококковой, вирусной, глистной), а также с лекарственной и пищевой аллергией. Большая роль в возникновении васкулита принадлежит очагам хронической инфекции в организме. Имеет значение и наследственная предрасположенность к аллергическим болезням.
Развитие. Микробный или другой причинный агент вызывает изменения в иммунной системе. Образуются аутоантитела, которые повреждают внутреннюю стенку мелких сосудов с последующим нарушением микроциркуляции и активации свертывающей системы крови.
Симптомы. Заболевание чаще начинается остро — с повышения температуры до 38-39°C. После этого в течение нескольких часов или дней у больного появляются изменения на коже, припухлость суставов, боли в животе. Характерно расположение высыпаний на коже: они симметричны, появляются на стопах, голенях, бедрах, ягодицах, разгибательной поверхности предплечий и плеч. В начале элементы имеют вид розового пятна с кровоизлиянием в центре, величиной от 2 до 5 мм. Сыпь возвышается над поверхностью бледной кожи. В течение нескольких дней сыпь меняет свою окраску от ярко-красной до коричневой с последующим исчезновением.
Из суставов часто поражаются коленные, голеностопные, лучезапястные. Отек и боли в суставах сохраняются 2—3 дня, затем исчезают, не оставляя последствий. Поражение кишечника может развиваться одновременно с кожными и суставными проявлениями, но в ряде случаев предшествует им. У больного появляются схваткообразные боли в животе, во время которых дети мечутся в постели и принимают вынужденное коленно-локтевое положение. Язык сухой, обложен белым налетом. Возможна рвота. На высоте болей появляется жидкий стул со слизью и кровью. К наиболее тяжелым проявлениям заболевания относится поражение почек. В этом случае больной жалуется на головные боли, слабость. Артериальное давление повышается. В моче обнаруживают эритроциты и белок. В неосложненных случаях выздоровление происходит через месяц.
Диагноз. Ставится при наличии симметричных геморрагических кровоизлияниях или высыпаниях на руках и ногах, ягодицах, при отечности и болезненности крупных суставов, болях в животе. Следует дифференцировать с ревматизмом. гломерулонефритом. аппендицитом. кишечными инфекциями.
Лечение. Ребенка необходимо госпитализировать. Режим постельный. Диета должна исключать острые, соленые, пряные продукты. Полезно обильное питье (чай, компот, минеральная вода, кисель). Из медикаментозной терапии рекомендуются сосудоукрепляющие препараты (витамин C. рутин), десенсибилизирующие (тавегил. супрастин ). Необходимо параллельное лечение очагов хронической инфекции. Прогноз заболевания благоприятный.
Профилактика. Рациональное питание. Исключение продуктов, провоцирующих заболевание.
Главным признаком геморрагического васкулита является красная сыпь
Содержание
Геморрагический васкулит (изначально назывался как болезнь Шёнляйна-Геноха) – это самый распространенный из системных васкулитов. В зарубежных странах, как правило, употребляется название «пурпура Шёнляйна-Геноха». Названо заболевание в честь врачей Шёнляйна (первым описал) и Геноха (написал о нем ценный научный труд). Название же «геморрагический васкулит» было введено в России врачом-ревматологом Насоновой. Заболевание обычно появляется у детей, но редко у малышей до 3 лет. Также почти не бывает в пожилом возрасте. Болезнь может быть очень опасной сама по себе и повлечь за собой необратимые последствия.
Геморрагический васкулит обычно появляется у детей
Что такое геморрагический васкулит
Геморрагический васкулит – это системное заболевание. Оно поражает мелкие сосуды и капилляры иммунными комплексами, которые циркулируют в крови. Другое название этой болезни – анафилактоидная пурпура. Для геморрагического васкулита характерны проявления на коже, он затрагивает почки, суставы, пищеварительные органы. Может проявиться практически в любом возрасте, однако это заболевание гораздо чаще возникает у мальчиков, и дети болеют чаще, чем взрослые.
Геморрагический васкулит можно разделить на разные группы по таким факторам, как форма, течение, степень тяжести. По клинической форме заболевание бывает простым (кожный), с поражением суставов, с поражением суставов и почек и смешанным. Характер течения анафилактоидной пурпуры может быть молниеносным, острым (до 2 месяцев), затяжным (до полугода) и хроническим. А по тяжести заболевание делится на легкую форму (удовлетворительное самочувствие, высыпания необильные или вообще отсутствуют), среднетяжелую (следы крови в моче, боли в суставах и животе) и тяжелую (с сильными высыпаниями, кровью в моче, элементами некроза).
У детей геморрагический васкулит обычно заканчивается благоприятно. Главное – вовремя выявить заболевание и не дать перейти в хроническое. Болезнь может еще долгое время рецидивировать. В крайне редких случаях последствием заболевания может стать хроническая почечная недостаточность. Также у детей в половине случаев кожные высыпания могут отсутствовать, тогда как у взрослых такая вероятность гораздо ниже. У взрослых больных чаще осложнения затрагивают сердце. Так как изначальные причины заболевания не до конца ясны, дети, переболевшие геморрагическим васкулитом, еще на протяжении 5 лет наблюдаются у врача, а если были затронуты почки, то до совершеннолетия. Шансы заболеть геморрагическим васкулитом после 20 лет крайне малы.
Заболевание поражает мелкие сосуды и капилляры
У взрослых заболевание гораздо чаще перетекает в тяжелую форму и нередко становится хроническим. Могут возникнуть очень опасные последствия, как язвы в желудке, участки некроза на коже, почечная недостаточность.
Симптомы и причины заболевания
Несмотря на то, что у детей сыпь может и отсутствовать, именно она является главным симптомом геморрагического васкулита. Сыпь обычно красная, может быть пурпурная и с течением болезни меняет цвет на коричневый. Даже после выздоровления может оставаться темная пигментация. Иногда может появляться кожный зуд и отек на руках и стопах, на губах и веках. Сыпь чаще всего появляется вокруг суставов (с внутренней стороны), на ягодицах, бедрах.
При молниеносной форме заболевания малыш может погибнуть в течение нескольких часов, в лучшем случае – дней. Это может произойти от острой почечной недостаточности, если срочно не начать лечение. При такой форме температура подскакивает до 39-40 градусов, состояние больного очень тяжелое, всегда есть поражение почек, симптомы сильно выражены.
Суставный синдром возникает обычно сразу после высыпаний. Он обычно длится несколько дней и сопровождается поражением суставов. Варьируется от кратковременной боли, до воспаления. Может рецидивировать вместе с заболеванием. Болезненные ощущения продолжаются от пары часов до нескольких дней, развивается деформация суставов. Но стойкого изменения суставов не бывает.
Еще одним признаком геморрагического васкулита, хотя и менее распространенным, является боль в животе. Этот симптом может проявляться как до высыпаний, так и вместе с ними. Боли в животе тоже бывают разными. Это может быть умеренная боль, которая практически не доставляет неприятностей и дискомфорта. Такие боли чаще всего проходят сами в первые дни после начала заболевания. В других случаях боли резкие и многократно повторяются на протяжении дня, продолжаются несколько суток. Больной жалуется на рвоту и тошноту, может повышаться температура. Изредка такие случаи сопровождаются кишечным или желудочным кровотечением.
Боль в животе – один из признаков васкулита
Поражения почек случаются реже предыдущих симптомов. Состояние почек зависит от тяжести самого заболевания. Они могут прийти в норму по ходу лечения. А может дойти до иммунного поражения клубочков почки (гломерулонефрит). У детей также иногда наблюдаются шумы в сердце. Больной может жаловаться на головокружение и головную боль. Это следствие поражения ЦНС (центральной нервной системы) из-за воспаления сосудов головного мозга.
Геморрагический васкулит очень опасен при беременности. Эта болезнь может послужить причиной развития антифосфолипидного синдрома. Он может стать причиной плацентарной недостаточности, задержки развития плода, отслойки плаценты.
Причиной, которая вызывает геморрагический васкулит, является циркуляция в крови активированных компонентов системы комплимента (комплекса сложных белков, находящегося в крови, который отвечает за иммунную защиту организма от чужеродных агентов). Это приводит к тому, что стенки микрососудов воспаляются, возникают микротромбообразования, которые поражают сосуды.
Что же вызывает сам процесс, пока доподлинно не известно. Ученые считают, что, скорее всего, факторами, провоцирующими геморрагический васкулит, могут быть аллергия на лекарства. укусы насекомых, вакцины или сыворотки, генетическая предрасположенность, любые перенесенные бактериальные или вирусные заболевания (как фарингит, грипп или ангина ), а также паразитарные инфекции. При остром развитии заболевание выглядит как аллергия. Если вместе с этим имела место радиация и перепады температуры (перегрев либо переохлаждение), то запускается аутоиммунный процесс, и клетки иммунитета воспринимают свои ткани как чужеродные и начинают их атаковать. При воспалении стенки сосудов становятся все менее эластичными. Таким образом разрушаются стенки капилляров и мелких сосудов.
Диагностика геморрагического васкулита
Для геморрагического васкулита нормой являются неспецифические изменения лабораторных показателей. Для того чтобы диагностировать заболевание, врачи смотрят на уровень СОЭ (скорость оседания эритроцитов может быть признаком воспаления) и лейкоцитов. Но такие исследования не укажут конкретно на данное заболевание. Они только говорят о том, что есть воспалительный процесс. Болезнь гораздо легче диагностировать, когда появляется пигментация кожи. У многих больных вместе с геморрагическим васкулитом начинает развиваться артрит. Это связано с поражением суставов. Хотя после лечение чаще всего деформации суставов не наблюдается. Более половины больных, особенно среди детей, жалуются на боли в животе. Они могут сопровождаться рвотой. На рентгенографическом исследовании ЖКТ (желудочно-кишечного тракта) заметна низкая работа кишечника и его сужение в некоторых участках.
Хотя геморрагический васкулит в большей части случаев лечится полностью или, по крайней мере, не имеет осложнений, в запущенном виде он очень опасен. Несвоевременно поставленный диагноз может привести к почечной недостаточности, непроходимости кишечника, деформации суставов. Так как лабораторные исследования не указывают на само заболевание, врачи ориентируются на первичные симптомы (сыпь, прогрессирующий артрит, болезни почек и ЖКТ).
Анализы крови укажут на воспаление
Лечение болезни
Характер и длительность лечения геморрагического васкулита зависит от фазы заболевания, его тяжести и формы. Больным требуется госпитализация и постельный режим. При геморрагическом васкулите назначается диета. А если болезнь быстро прогрессирует, то какое-то время придется голодать. Это необходимо, чтобы снизить нагрузку на ЖКТ. Из рациона необходимо полностью исключить шоколад, цитрусовые, соки и ягоды.
При любой форме заболевания для лечения используют антиагреганты, как курантил и трентал. Если форма заболевания тяжелая, то назначают оба препарата. Также используют антикоагулянты, подбирая дозу в строго индивидуальном порядке. Чтобы вылечить легкую форму заболевания, лечение длится несколько месяцев. При среднетяжелой – до полугода, а при тяжелой форме лечение может занять около года. При хроническом геморрагическом васкулите проводят повторные курсы лечения от 3 месяцев до полугода. А для того чтобы нормализовать проницаемость стенок сосудов, прописывают витамины (например, биотин, аскорбиновая кислота, рутин). При молниеносном течении заболевания назначают глюкокортикоиды, которые угнетают образование аутоантител.
У детей острые формы геморрагического васкулита лечатся трансфузионной терапией в течение 1-2 недель. Также используется плазмаферез. Он нужен для того, чтобы очистить кровь от антител, воспалительных субстанций, токсинов и бактерий. В целом лечение геморрагического васкулита для взрослых и детей одинаковое.
Также как вспомогательные средства используют лекарства наружного применения. Это могут быть мази для восстановления эластичности сосудов (ацеминовая мазь, солкосерил). При появлении эрозивно-язвенных повреждений кожи используют эпителизирующие мази (как солкосерил, мазь Микулича, Вишневского).
Для профилактики болезни необходимо ограничить контакт с аллергенами
Профилактика геморрагического васкулита
Для профилактики геморрагического васкулита необходимо ограничить контакт с веществами, которые вызывают аллергию. Сюда входят и лекарственные препараты, которые не следует принимать без сильной потребности, и необоснованные прививки. По возможности следует вообще отказаться от антибиотиков. Нужно избегать инфекционных заболеваний. То есть профилактика геморрагического васкулита заключается также в профилактике инфекций. Следует всячески поддерживать свой организм в хорошей форме. Для этого необходимо отказаться от вредных привычек, которые ослабляют организм, питаться правильно и не пренебрегать регулярными, но не чрезмерными физическими упражнениями. Также нужно стараться избегать стрессов. Профилактика рецидивов болезни заключается в санации очагов болезни, предотвращении обострений.
К сожалению, даже если придерживаться всех мер предосторожности, нельзя полностью исключить вероятность развития заболевания. Поэтому не рекомендуется откладывать визит к врачу и заниматься самолечением уже при первых признаках болезни. Вовремя поставленный диагноз позволит легко справиться с болезнью и предотвратит опасные осложнения.
Народные средства лечения заболевания
При геморрагическом васкулите эффективную помощь лекарствам предоставят народные средства лечения. Прежде чем принимать какое-либо народное средство, следует внимательно изучить его состав, чтобы исключить аллергические реакции.
Крепкий зеленый чай оказывает благотворное воздействие на стенки сосудов
Можно приготовить такой настой: измельченные листья мяты, тысячелистника, почек тополя, цветков бузины, календулы, хвоща, череды перемешать по 3 ст. ложки. Это все залить стаканом кипятка. Его нужно настоять в темном месте несколько часов и принимать по полстакана через каждые 3 часа.
Крепкий зеленый чай оказывает благотворное воздействие на стенки сосудов. Он делает их более эластичными и стимулирует образование крови. Пить его нужно как можно чаще, лучше не менее трех раз в день.
Хорошим народным методом лечения является своеобразная мазь. Лечебной смесью стоит смазывать проблемные места на коже и суставах. Для нее нужны сухие листья руты и сливочное масло (а можно и растительное) в пропорции 1:5, все смешивают и на две недели кладут в темное прохладное место. Потом смазывают тонким слоем проблемные участки.
Также можно взять три лимона, перемолоть их в мясорубке, смешать с полкило сахара и одной столовой ложкой измельченной гвоздики. Это все нужно залить полулитром водки в трехлитровой банке. Затем банку наполняют доверху теплой водой и ставят в темное место на две недели. Каждый день банку нужно взбалтывать. По истечении двух недель настой процеживают и принимают за полчаса до еды трижды в день. Когда закончится средство, нужно сделать недельный перерыв и можно повторить курс.
Все эти методы хороши при геморрагическом васкулите. Но они не заменят полноценного лечения и консультацию у квалифицированного специалиста. Диагностика и подбор лекарств тоже требует времени. Поэтому чем раньше врачи начнут лечение, тем больше вероятность благоприятного исхода болезни.
Васкулит — Диагностика и лечение
Диагноз
Ваш врач, скорее всего, начнет с изучения вашей истории болезни и проведения медицинского осмотра. Он или она может попросить вас пройти один или несколько диагностических тестов и процедур, чтобы либо исключить другие состояния, которые имитируют васкулит, либо диагностировать васкулит. Тесты и процедуры могут включать:
- Анализы крови. Эти тесты ищут признаки воспаления, такие как высокий уровень С-реактивного белка.Полный анализ крови может определить, достаточно ли у вас эритроцитов. Анализы крови, которые ищут определенные антитела, такие как тест на цитоплазматические антитела против нейтрофилов, могут помочь диагностировать васкулит.
- Анализы мочи. Эти тесты могут выявить, содержит ли ваша моча эритроциты или слишком много белка, что может сигнализировать о проблеме со здоровьем.
- Визуальные тесты. Неинвазивные методы визуализации могут помочь определить, какие кровеносные сосуды и органы поражены.Они также могут помочь врачу контролировать, реагируете ли вы на лечение. Визуализирующие обследования при васкулите включают рентген, ультразвук, компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ) и позитронно-эмиссионную томографию (ПЭТ).
- Рентген сосудов (ангиография). Во время этой процедуры гибкий катетер, напоминающий тонкую соломку, вводится в большую артерию или вену. Затем в катетер вводят специальный краситель (контрастное вещество) и делают рентгеновские снимки, когда краситель заполняет артерию или вену.Очертания ваших кровеносных сосудов видны на полученных рентгеновских снимках.
- Биопсия. Это хирургическая процедура, при которой ваш врач удаляет небольшой образец ткани из пораженного участка вашего тела. Затем ваш врач исследует эту ткань на наличие признаков васкулита.
Дополнительная информация
Показать дополнительную информациюЛечение
Лечение направлено на сдерживание воспаления с помощью лекарств и устранение любого основного заболевания, которое вызвало васкулит.В случае васкулита вы можете пройти две фазы лечения — сначала купирование воспаления, а затем предотвращение рецидива (поддерживающая терапия).
Обе фазы включают лекарства, отпускаемые по рецепту. Какие лекарства и как долго вам нужно их принимать, зависят от типа васкулита, пораженных органов и серьезности вашего состояния.
У некоторых людей лечение сначала оказывается успешным, а потом у них возникают обострения. Другие могут никогда не увидеть, что их васкулит полностью исчезнет, и им потребуется постоянное лечение.
Лекарства
Ваш врач может назначить кортикостероидные препараты, такие как преднизон или метилпреднизолон (Медрол), чтобы помочь контролировать воспаление. Побочные эффекты кортикостероидов могут быть серьезными, особенно если вы принимаете их в течение длительного времени. Возможные побочные эффекты включают увеличение веса, диабет и истончение костей (остеопороз). Если для долгосрочной (поддерживающей) терапии необходим кортикостероид, вы, скорее всего, получите самую низкую возможную дозу.
Могут быть назначены другие лекарства вместе с кортикостероидами для контроля воспаления, чтобы можно было быстрее уменьшить дозу кортикостероидов.Эти лекарства иногда называют стероидсберегающими и могут включать метотрексат (Trexall), азатиоприн (Imuran, Azasan), микофенолят (Cellcept) или циклофосфамид.
Конкретное лекарство, которое вам понадобится, зависит от типа и серьезности вашего васкулита, пораженных органов и любых других медицинских проблем, которые у вас есть. В зависимости от типа вашего васкулита могут быть рекомендованы биологические методы лечения, такие как ритуксимаб (Ритуксан) или тоцилизумаб (Актемра).
Хирургия
Иногда при васкулите в стенке кровеносного сосуда образуется баллонная выпуклость (аневризма).Эта выпуклость может потребовать хирургического вмешательства. Заблокированные артерии также могут потребовать хирургического лечения.
Клинические испытания
Изучите исследования клиники Мэйо, в которых тестируются новые методы лечения, вмешательства и тесты как средства предотвращения, обнаружения, лечения или контроля этого заболевания.
Помощь и поддержка
Одна из самых серьезных проблем в жизни с васкулитом может заключаться в том, чтобы справиться с побочными эффектами лекарств.Следующие предложения могут помочь:
- Узнайте о своем состоянии. Узнайте все, что можно, о васкулите и его лечении. Знайте о возможных побочных эффектах принимаемых вами лекарств и сообщайте своему врачу о любых изменениях в вашем здоровье.
- Следуйте своему плану лечения. Ваш план лечения может включать регулярные посещения врача, дополнительные анализы и проверку артериального давления.
- Выбирайте здоровую диету. Правильное питание может помочь предотвратить потенциальные проблемы, которые могут возникнуть в результате приема лекарств, такие как истончение костей, высокое кровяное давление и диабет.Выберите диету, в которой упор делается на свежие фрукты и овощи, цельнозерновые продукты, нежирные молочные продукты, нежирное мясо и рыбу. Если вы принимаете кортикостероидные препараты, спросите своего врача, нужно ли вам принимать добавки с витамином D или кальцием.
- Сделайте плановые прививки. Своевременное ведение вакцинации, например, от гриппа и пневмонии, может помочь предотвратить проблемы, которые могут возникнуть в результате приема лекарств, например инфекцию. Поговорите со своим врачом о вакцинации.
- Тренируйтесь большую часть дней недели. Регулярные аэробные упражнения, такие как ходьба, могут помочь предотвратить потерю костной массы, высокое кровяное давление и диабет, которые могут быть связаны с приемом кортикостероидов. Это также приносит пользу вашему сердцу и легким. Кроме того, многие люди считают, что упражнения улучшают их настроение и общее самочувствие. Если вы не привыкли тренироваться, начните медленно и постепенно наращивайте. Ваш врач может помочь вам спланировать программу упражнений, которая подходит именно вам.
- Поддерживайте сильную систему поддержки. Семья и друзья могут помочь вам справиться с этим заболеванием. Если вы считаете, что было бы полезно поговорить с другими людьми, живущими с васкулитом, попросите члена вашей медицинской бригады связаться с группой поддержки.
Подготовка к приему
Запишитесь на прием к лечащему врачу, если у вас есть признаки или симптомы, которые вас беспокоят. Если ваш врач подозревает, что у вас васкулит, он может направить вас к специалисту по суставам и мышцам (ревматологу), имеющему опыт оказания помощи людям с этим заболеванием.Вам также может пригодиться мультидисциплинарный подход. К каким специалистам вы обратитесь, зависит от типа и степени тяжести вашего состояния.
К специалистам, занимающимся лечением васкулита, относятся:
- Врачи суставов и соединительной ткани (ревматологи)
- Врачи головного мозга и нервной системы (неврологи)
- Глазные врачи (офтальмологи)
- Кардиологи (кардиологи)
- Врачи-инфекционисты
- Кардиологи (нефрологи)
- Легочные врачи (пульмонологи)
- Кожные врачи (дерматологи)
- Врачи мочеполовой системы (урологи)
Что вы можете сделать
Поскольку встречи могут быть короткими, а также потому, что часто нужно охватить много вопросов, хорошо подготовиться.Попробуйте:
- Помните о любых ограничениях перед записью. Во время записи на прием спросите, нужно ли вам что-нибудь сделать заранее, например, ограничить свой рацион.
- Перечислите все симптомы, которые вы испытываете, включая те, которые могут показаться не связанными с причиной, по которой вы записались на прием.
- Перечислите ключевую личную медицинскую информацию, включая другие недавние проблемы со здоровьем или серьезные стрессы, которые у вас были, а также любые лекарства, витамины и добавки, которые вы принимаете.
- Подумайте о том, чтобы взять с собой на прием члена семьи или друга. Кто-то из ваших сопровождающих может помочь вам запомнить, что говорит врач.
- Перечислите вопросы , которые вы хотите задать своему врачу.
В отношении васкулита можно задать несколько основных вопросов:
- Какой у меня васкулит?
- Что вызывает у меня васкулит?
- Нужно ли мне больше тестов?
- У меня васкулит острый или хронический?
- Пройдет ли мой васкулит сам по себе?
- Серьезен ли мой васкулит?
- Была ли какая-либо часть моего тела серьезно повреждена васкулитом?
- Можно ли вылечить мой васкулит?
- Какие у меня варианты лечения?
- Каковы преимущества и риски каждого лечения?
- Какое лечение, по вашему мнению, лучше всего подходит для меня?
- Как долго продлится лечение?
- У меня другое заболевание.Как мне вместе лучше всего справиться с этими условиями?
- Стоит ли обратиться к специалисту?
- У вас есть брошюры или другие печатные материалы, которые я могу взять с собой? Какие сайты вы рекомендуете?
Чего ожидать от врача
Ваш врач может спросить:
- Когда у вас впервые появились симптомы?
- Ваши симптомы были постоянными или случайными?
- Насколько серьезны ваши симптомы?
- Что может улучшить ваши симптомы?
- Что может ухудшить ваши симптомы?
Октябрь18, 2017
История, классификация и патофизиология васкулита мелких сосудов
1. Введение
Системные васкулиты представляют собой гетерогенную группу заболеваний, характеризующихся деструктивным воспалением и фибриноидным некрозом стенки кровеносных сосудов, окклюзией кровеносных сосудов и ишемией окружающих тканей. Типичные клинические проявления различаются в зависимости от размера пораженных кровеносных сосудов и включают лихорадку, потерю веса, недомогание, артралгии и артрит.Васкулиты могут быть идиопатическими, первичными, вторичными по отношению к другим заболеваниям, таким как системная красная волчанка (СКВ) и ревматоидный артрит (РА), или связаны с инфекциями, такими как инфекционный эндокардит, употреблением фармацевтических препаратов, таких как пропилтиоурацил и гидралазин, или другими химическими воздействиями. [1]. Васкулит может быть изолированным в отношении одного органа или сосуда и быть относительно незначительным клинически или проявляться как системное заболевание, излечивающее жизнь, с поражением нескольких органов и сосудов [2].
ANCA-ассоциированный системный васкулит (AASV) является наиболее распространенным первичным системным васкулитом мелких сосудов, который встречается у взрослых.AASV — это васкулит мелких сосудов, поражающий артериолы, венулы, капилляры, а иногда и артерии среднего размера, который обычно затрагивает несколько систем органов. Хотя это и нечасто, заболеваемость AASV увеличивается. AASV также называют паучиммунным васкулитом, потому что в васкулитных поражениях не обнаруживаются иммуноглобулины или компоненты комплемента.
AASV ассоциируется со значительной заболеваемостью и смертностью, почти всем пациентам требуется агрессивная иммуносупрессия. Без лечения летальность приближается к 100% за 5 лет [3].На основании клинических проявлений и преобладающего поражения органов случаи AASV классифицируются как гранулематоз Вегенера (WG), микроскопический полиангиит (MPA), синдром Черджа-Стросса (CSS) и почечный ограниченный васкулит (RLV). ANCA — это преимущественно антитела класса IgG, которые были впервые описаны в 1980-х годах Davies et al. у пациентов с некротическим гломерулонефритом [4]. Эти антитела направлены против антигенных компонентов нейтрофильных гранул или лизосом. Непрямая иммунофлуоресценция (IIF) фиксированных этанолом нейтрофилов выявляет цитоплазматическое (cANCA) или перинуклеарное (pANCA) окрашивание.Окрашивание cANCA коррелирует с реактивностью протеиназы-3 (PR3), тогда как окрашивание pANCA коррелирует с реактивностью по отношению к миелопероксидазе (MPO) или другим антигенам.
PR3-ANCA в основном выявляются у пациентов с WG, тогда как MPO-ANCA преимущественно обнаруживаются у пациентов с MPA и CSS. Эти заболевания имеют сходные патологические очаговые некротические поражения, хотя WG и CSS также имеют гранулематозные поражения [5].
Пурпура Геноха-Шенлейна (HSP) является наиболее частым системным васкулитом мелких сосудов у детей [6].HSP — это системный васкулит, поражающий мелкие сосуды и капилляры. Для HSP характерны пальпируемая пурпура, отек, боли в животе, боли в суставах и почечные симптомы [7]. Прогноз благоприятный, если у пациентов нет почечных симптомов. Почечные симптомы варьируются от перемежающейся гематурии и протеинурии до быстро прогрессирующего гломерулонефрита.
В этой главе мы обсудим патофизиологию наиболее распространенного первичного васкулита мелких сосудов у взрослых, AASV, а также наиболее распространенного васкулита мелких сосудов у детей, HSP.
2. История болезни
Пурпура была первым проявлением васкулита в сосудах меньшего размера, чем артерии. В 1808 году Виллан четко различил пурпуру, вызванную инфекциями, от неинфекционной пурпуры [8]. В течение следующего столетия Генох и его учитель Шенлейн описали широкий спектр признаков и симптомов, связанных с пурпурой и васкулитом мелких сосудов, включая артрит, периферическую невропатию, боль в животе, легочное кровотечение, носовое кровотечение, ирит и нефрит. [9].
В 1866 году Куссмаул и Майер описали пациента с общей слабостью, вызванной васкулитной невропатией, сопровождающейся тахикардией, болями в животе и появлением кожных узелков на туловище. Паралич мышц пациента быстро прогрессировал, что привело к смерти. При вскрытии на артериях среднего размера были обнаружены видимые узелки [10]. Куссмауль и Майер назвали это заболевание «узелковым периартериитом», потому что они наблюдали воспаление в периваскулярных оболочках и наружных слоях артериальных стенок и узловое утолщение сосудов.Однако позже название было изменено на «узелковый полиартериит» из-за широко распространенного поражения сосудов и того факта, что он поражает всю толщину стенки сосуда [1].
Заболевание в виде некротического васкулита, гранулематозных поражений всего дыхательного тракта и гломерулонефрита было впервые описано в 1897 году Питером МакБрайдом [11]. В 1931 г. Хайнц Клингер описал патологическую анатомическую картину этого заболевания у двух пациентов, умерших от системного васкулита [12].В 1936 году немецкий патолог Фридрих Вегенер описал трех пациентов с некротической гранулемой, а в 1939 году интерпретировал патологические и клинические данные как отдельное заболевание [13]. Goodman и Churg в 1954 г. написали подробное описание болезни, известной как «гранулематоз Вегенера» (WG), с определенными критериями: некротические гранулемы дыхательных путей, генерализованный васкулит и некротический гломерулонефрит [14]. DeRemee и его коллеги в 1976 году предложили классификацию ELK (E = верхние дыхательные пути, включая околоносовые пазухи; L = легкие; K = почки), что позволило им понять и управлять случаями, которые не соответствовали строгим критериям Goodman и Churg [15].В начале 1970-х годов Fauci и Wolff ввели лечение циклофосфамидом и кортикостероидами для лечения WG, что привело к почти полной и длительной ремиссии заболевания [16]. Кроме того, DeRemee опубликовал в 1985 г. отчет о преимуществах использования котримоксазола (триметоприм / сульфаметоксазол) в РГ с местным заболеванием [17]. В том же году крупный прорыв был сделан Van der Woude и соавторами, которые сообщили о чувствительности к аутоантителам и специфичности для этого заболевания. Эти аутоантитела реагировали с цитоплазмой фиксированных этанолом нейтрофилов и моноцитов и были названы антинейтрофильными цитоплазматическими аутоантителами (ANCA) [18].
3. Классификация
Существует 20 признанных первичных форм васкулита, которые классифицируются в зависимости от размера пораженных кровеносных сосудов. Васкулиты крупных сосудов, гигантоклеточный (височный) артериит и артериит Такаясу вызываются гранулематозным воспалением аорты и ее основных ветвей. В случае гигантоклеточного артериита существует особая предрасположенность экстракраниальных ветвей сонной артерии, часто с поражением височной артерии и частой ассоциацией с ревматической полимиалгией.Возраст пациента помогает различать эти два состояния, поскольку гигантоклеточный артериит редко встречается у пациентов в возрасте до 50 лет, а болезнь Такаясу чаще встречается у молодых пациентов [19].
Классический узелковый полиартериит поражает сосуды среднего размера и, следовательно, не должен включать гломерулонефрит или васкулит в артериолах, капиллярах или венулах. Болезнь Кавасаки — это васкулит сосудов среднего размера, который часто поражает коронарные артерии, связан с синдромом кожно-слизистых лимфатических узлов и наиболее часто встречается у детей [2].
Васкулиты мелких сосудов включают васкулит, связанный с иммунным комплексом, — геноха-Шоенлейна пупура и эссенциальный криоглобулинемический васкулит. Пупура Геноха-Шенлейна имеет преимущественно отложение иммунного комплекса IgA и поражает кожу, кишечник и клубочки с артритом и артралгией, в то время как криоглобулинемический васкулит вызывается отложением криоглобулинов преимущественно в мелких сосудах кожи и клубочках и часто связан с гепатитом. C. инфекция.Другой категорией васкулитов мелких сосудов является кожный лейкоцитокластический васкулит, который ограничивается только кожей, не имеет системного поражения и имеет лучший прогноз, чем васкулиты с системным поражением [2].
Примеры различных типов васкулита приведены в таблице 1.
| Пораженный доминантный сосуд | Первичный | Вторичный |
| Аортит, связанный с инфекцией RA (например,Сифилис) | ||
| Средние артерии | Классический PAN Болезнь Кавасаки | Инфекция (например, гепатит B) |
| Мелкие сосуды и средние артерии | Микрогранулематоз Вегенера * | * Синдром Чурджа-Стросса|
| Мелкие сосуды (лейкоцитокластические) | Пурпура Геноха-Шёнлейна Эссенциальная смешанная криоглобулинемия | Кожный лейкоцитокластический лейкоцитокласт 9024 **грамм. Гепатит В, С)
Таблица 1.
Классификация системных васкулитов.
(*) Заболевания, которые чаще всего связаны с ANCA, паузи-иммунным серповидным гломерулонефгритом и наиболее чувствительны к иммуносупрессии циклофосфамидом. (**) например, сульфаниламиды, пенициллины, тиазидные диуретики и многие другие. PAN = узелковый полиартериит. РА = ревматоидный артрит. СКВ = системная красная волчанка.
ANCA-ассоциированный системный васкулит (AASV) — это группа заболеваний, классифицируемых как васкулиты малых сосудов, которые связаны с антинейтрофильными цитоплазматическими антителами.AASV включают микроскопический полиангиит, гранулематоз Вегенера, синдром Черга-Струаса и почечный ограниченный васкулит. Вместе они ответственны за 5-6% случаев почечной недостаточности. Гистологически они характеризуются некротическим васкулитом, преимущественно поражающим мелкие кровеносные сосуды, и часто ассоциируются с слабым иммунным некротическим серповидным гломерулонефритом. Серологически эти заболевания представляют собой аутоантитела, направленные против компонентов нейтрофильных гранул [20].
В 1990 году три независимые группы показали, что азурофильный гранулярный фермент протеиназа 3 является целевым аутоантигеном, распознаваемым ANCA (PR3-ANCA) [21,22,23].Вместе с протеиназой 3 в качестве аутоантигена-мишени ANCA (MPO-ANCA) также был идентифицирован другой гранулярный белок, миелопероксидаза (MPO) [24]. Открытие ANCA имело решающее значение для понимания патогенеза болезни, а также стало ценным диагностическим инструментом. Американский колледж ревматологии опубликовал критерии классификации васкулитов в 1990 году, что привело к улучшению категоризации пациентов для клинических испытаний [25]. Однако эти критерии не подходили для диагностики пациентов с ANCA-ассоциированными васкулитами.Отдельный пациент мог одновременно соответствовать критериям WG, синдрома Чарджа Штрауса (CSS), узелкового полиартериита (PAN), гиперчувствительного васкулита и пупуры Геноха-Шенлейна. В 1994 г. конференция Chapel Hill Consensus (CHCC) приняла стандартизованные названия и определения васкулитов, основанные на размере пораженных кровеносных сосудов [26].
Недавно группа врачей из различных медицинских дисциплин собралась в Европейском агентстве по лекарственным средствам (EMEA) в Лондоне в сентябре 2004 г. и январе 2006 г. и разработала пошаговый алгоритм классификации AASV и PAN для эпидемиологических исследований.Их цель заключалась в разработке консенсусного подхода к применению определений CHCC и критериев ACR к AASV и PAN, чтобы облегчить сравнение эпидемиологических данных для различных васкулитов [27].
Без лечения пациенты с AASV имеют очень плохой прогноз со средней продолжительностью жизни 5 месяцев [28]. Текущие схемы лечения, основанные на циклофосфамиде и кортикостероидах, значительно улучшили прогноз для этих пациентов и увеличили среднее время выживания до 21.7 лет [29]. Хотя этот режим позволяет достичь длительной ремиссии и увеличения выживаемости пациентов с AASV, у него есть свои недостатки; худшие из них — опасные для жизни инфекции на ранних стадиях заболевания и риск злокачественных новообразований на поздних стадиях заболевания [30,31]. Кроме того, несмотря на тяжелую иммуносупрессию, у этого заболевания высокая частота рецидивов. Лучшее понимание механизмов, лежащих в основе AASV, может помочь в поиске лучших методов лечения этого серьезного и разрушительного заболевания.
4. Патофизиология ANCA-ассоциированного системного васкулита (AASV)
Патофизиология AASV остается в значительной степени неизвестной. Клинические и лабораторные данные свидетельствуют о многофакторном происхождении. Хотя связь между ANCA и паучиммунными васкулитами мелких сосудов была установлена, точная роль ANCA в патогенезе AASV еще полностью не выяснена. Неизвестно, играют ли ANCA прямую роль в проявлениях болезни или же антитела являются вторичными маркерами болезненного процесса.Имеющиеся данные позволяют предположить, что нейтрофилы, В- и Т-лимфоциты играют ключевую роль в патофизиологии AASV.
4.1. Патогенный ответ B-клеток и продукция B-клеток ANCA
являются прямыми предшественниками плазматических клеток, продуцирующих антитела. B-клетки также продуцируют аутоантитела и цитокины (интерлейкин IL-6, фактор некроза опухоли альфа-TNFα, IL-10), действуют как антигенпрезентирующие клетки и дифференцируются в B-клетки долговременной памяти. Csernak et al. показали, что у пациентов WG, ANCA продуцируются после активации B-клеток [32].Поликлональный B-клеточный лимфоидный инфильтрат в эндоназальном гранулематозном поражении включал PR3-ANCA-продуцирующие клетки с увеличением числа копий в трех генах VH. Гранулематозные поражения в WG состоят из кластеров PR3, окруженных инфильтратом, состоящим из созревающих B-клеток, антигенпрезентирующих клеток (APC) и CD4 + CD28- T-клеток Th2-типа. Это предполагает, что созревание эндоназальных В-клеток управляется антигенами и что В-клетки генерируют ANCA посредством контакта с PR3 или антигенным микробным эпитопом [33].
B-клетки распознают растворимые антигены через специфические B-клеточные рецепторы (BCR) и корецептор CD19, который усиливает передачу сигналов нижестоящего BCR.Сообщалось о нарушении регуляции CD19 у пациентов с AASV. Culton et al. показали, что экспрессия CD19 на 20% ниже в наивных B-клетках пациентов с AASV, чем в нормальных контрольных [34]. Напротив, В-клетки памяти некоторых пациентов с AASV экспрессируют больше CD19, чем нормальные контроли. Эта подгруппа B-клеток демонстрирует доказательства антигенной селекции, предполагая, что при AASV механизмы самотолерантности могут быть потеряны, что приводит к продукции аутореактивных B-клеток [34]. Эксперименты на трансгенных мышах показывают, что нарушение регуляции B-клеток, особенно в путях, ответственных за делецию (центральную и периферическую) аутореактивных B-клеток, также может играть роль в генерации аутоантител в AASV [35].Интересно, что экспрессия фактора активации В-клеток семейства TNF (BAFF) повышена у пациентов с WG [36]. Предполагается, что BAFF может управлять размножением B-клеток, что затем приводит к продукции ANCA. Истощение B-клеток с помощью ритуксимаба у пациентов с AASV снижает уровни ANCA и вызывает ремиссию заболевания [37,38]. Напротив, клинический рецидив коррелирует с увеличением уровня В-клеток [39]. Эти данные подтверждают вывод о том, что В-клетки играют центральную роль в продукции ANCA и что ANCA играют важную роль в патогенезе AASV.
4.2. Патогенный Т-ответ, повреждение тканей и образование гранулем
В нормальных условиях наивные Т-клетки активируются во время иммунного ответа на стимул антигена. Затем антиген-специфические Т-клетки дифференцируются в Т-клетки памяти, тогда как эффекторные Т-клетки подвергаются апоптозу. Недостаточность иммуноглобулинов в васкулитах, преобладание подклассов IgG1 и IgG4 IgG и наличие гранулематозных поражений указывают на то, что Т-клеточные иммунные ответы играют роль в патогенезе AASV [40].Это согласуется с тем фактом, что стратегии лечения, основанные на Т-клетках, вызывают клинически значимую ремиссию у пациентов с AASV [41,42].
Сообщается, что у пациентов с активным WG более высокая доля активированных Т-клеток и более высокая концентрация растворимых маркеров активации Т-клеток (включая растворимый рецептор IL-2 или CD30) коррелируют с активностью заболевания [43]. Высокие уровни маркеров активации также коррелируют с ANCA-позитивностью, что предполагает постоянную активацию Т-клеток, вероятно, вторичную по отношению к стойкому антигенному триггеру, как лежащему в основе патогенному фактору.Это согласуется с сообщениями о постоянной экспансии CD4 + эффекторных Т-клеток памяти (Tem) в сочетании с уменьшением количества наивных Т-клеток у пациентов с AASV [44,45]. О поляризации ответа Th2 и Th3 также сообщалось в AASV. В частности, ответ Th3-типа преобладает у пациентов с активным генерализованным WG или CSS, тогда как ответ Th2 преобладает у пациентов с локализованным WG или MPA, что указывает на то, что аберрантный ответ T-клеток играет роль в процессе заболевания [46,47 ]. CCR5 также экспрессируется на Т-клетках в ранних локализованных WG, что также может способствовать рекрутированию клеток, секретирующих цитокин Th2-типа, в воспалительные поражения в локализованных WG [48].Преобразование ответа типа Th2 в Th3 может лежать в основе прогрессирования от локализованной к генерализованной WG. Этот сдвиг может отражать экспансию В-клеток и Т-клеточно-зависимую продукцию PR3-ANCA, вторичную по отношению к взаимодействию между нейтрофилами и аутореактивными Т- и В-клетками в воспалительных поражениях, Рисунок 1.
Рисунок 1.
Патофизиология AASV. Стимуляция нейтрофилов TNF-α или IL-1β (прайминг), например во время предшествующей инфекции приводит к перемещению ANCA-антигенов, PR3 и MPO, из цитоплазматических гранул (специфических гранул и секреторных пузырьков) на поверхность клетки, где они доступны для ANCA, что приводит к дальнейшей активации ячейка.Активация нейтрофилов, вызванная ANCA, инициирует выработку АФК, дегрануляцию нейтрофилов с высвобождением воспалительных цитокинов и содержимого гранул (например, PR3 и HLE) из азурофильных гранул, что приводит к отслоению и лизису эндотелиальных клеток. Кроме того, активация нейтрофилов приводит к адгезии лейкоцитов (через ICAM-1, VCAM-1) и трансмиграции через эндотелий (через PECAM-1), а также к высвобождению АФК и протеаз в ткани. Суперантиген (например, экзотоксины стафилококка) или PR3, представленный Т-клеткам напрямую или через дендритные клетки, способны стимулировать пролиферацию Т-клеток, приводя к образованию гранулем и, наконец, к созреванию PR3-специфичных аутореактивных В-клеток, достигая высшей точки. в производстве ANCA.ROS = активные формы кислорода. PR3 = протеиназа 3, MPO = миелопероксидаза, HLE = эластаза лейкоцитов человека, ICAM = молекула межклеточной адгезии-1, VCAM-1 = молекула адгезии сосудистых клеток-1, PECAM-1 = молекула адгезии эндотелиальных клеток тромбоцитов-1, TCR = T- клеточный рецептор, MHC-II = главный комплекс гистосовместимости-II, TNF-α = фактор некроза опухоли-альфа, IL-1β = интерлейкин-1-бета.
Гранулемы в AASV напоминают зародышевый центр с кластером примированных нейтрофилов, окруженных дендритными клетками, Т- и В-клетками.CD4 + Т-клетки, вероятно, играют важную роль в гранулематозном ответе при AASV. Снижение субпопуляции CD4 + CD28 — Tem Т-клеток во время активного заболевания у пациентов с WG указывает на повышенную миграцию этих клеток к участкам воспаления [44]. В экспериментальной модели аутоиммунного гломерулонефрита, ассоциированного с антителами к МПО, было отмечено, что у мышей, лишенных CD4 + Т-клеток, во время введения антител против мышиных антител против GBM развивались значительно меньшие серповидные образования и клеточный ответ по сравнению с мышами. контролирует [49].У пациентов с ANCA-ассоциированным гломерулонефритом Tem-клетки являются преобладающим подтипом Т-клеток в инфильтрате клубочков [50]. Вместе эти наблюдения предполагают, что клеточно-опосредованный иммунный ответ вносит вклад в патогенез почечных поражений. Действительно, клетки CD4 + Tem от пациентов с WG лишены NKG2A (ингибиторный рецептор) и демонстрируют повышенную экспрессию NKG2D, который является членом семейства киллерных иммуноглобулиноподобных рецепторов [51]. Также сообщалось о значительном увеличении доли IL-17, продуцирующих CD4 + Т-клетки (клетки Th27) в стимулированных in vitro клетках периферической крови пациентов с WG [52].IL-17 индуцирует секрецию хемокинов, привлекающих нейтрофилы, и высвобождение провоспалительных цитокинов (IL-1β, TNF-α), способных увеличивать экспрессию PR3 на поверхности нейтрофилов. Сообщается, что пациенты с ANCA-позитивными WG имеют больше PR3-специфичных Th27-клеток, чем ANCA-негативные пациенты WG и здоровые люди из контрольной группы [52]. Следовательно, вероятно, что ответ Th2 играет важную роль в продукции антител и образовании гранулем при AASV.
4.3. Активация моноцитов и продукция провоспалительных цитокинов
Wickman et al. Сравнили профили моноцитов и цитокинов у пациентов с острым анти-PR3 васкулитом и у здоровых людей; сообщалось, что моноциты пациентов обладают пониженной способностью продуцировать кислородные радикалы [53].Ohlsson et al., Из нашей группы, сообщили о положительной корреляции между циркулирующими уровнями IL-8 и мРНК IL-8 моноцитов у пациентов с AASV, что указывает на длительную активацию иммунной системы [54]. Патологический анализ почечной ткани пациентов с AASV выявил присутствие моноцитов в серповидных клубочках и гранулемах [55]. Исследования in vitro показали, что ANCA способны стимулировать моноциты, что приводит к высвобождению цитокинов, включая IL-8, MCP-1, TNF-, IL-1, IL-6 и тромбоксан A2 [56,57].С другой стороны, экспрессия мембранного PR3 на моноцитах не коррелирует с активностью заболевания. Есть много возможных объяснений присутствия активированных моноцитов в серповидных клубочках. Например, возможно, что моноциты активируются прямым физическим взаимодействием с компонентами гломерулярных поражений, когда они достигают места поражения; альтернативно, дисфункциональный апоптоз может стимулировать активацию моноцитов [58].
4.4. Активация эндотелиальных клеток и повышенная экспрессия молекул адгезии
Повреждение эндотелия, инвазия нейтрофилов и некроз являются гистопатологическими особенностями AASV [59].Активированные эндотелиальные клетки экспрессируют высокие уровни молекул адгезии. При васкулите сообщалось об увеличении циркулирующих уровней эндотелиальных белков (тромбомодулина, vWF) и молекул адгезии (растворимая молекула межклеточной адгезии (sICAM) -1 и растворимая молекула адгезии эндотелиальных клеток к лейкоцитам (sELAM) -1) [60]. Woywodt et al. сообщили о наличии значительного количества циркулирующих эндотелиальных клеток и некротических фрагментов эндотелиальных клеток у пациентов с активным AASV [61]. Значительная часть циркулирующих эндотелиальных клеток (ЭК) имеет положительную окраску на тканевой фактор (ТФ), который связывает провоспалительные механизмы с тромбозом [61].Интересно, что экспрессия TF может быть индуцирована в EC за счет высвобождения PR3 и эластазы из нейтрофилов; это может быть опосредовано рецепторами PR3 на поверхности эндотелиальных клеток [62]. Некроз эндотелиальных клеток и высвобождение ТФ могут играть роль в развитии васкулитов. Механизм некроза эндотелиальных клеток еще полностью не выяснен. Хотя антитела против эндотелиальных клеток были обнаружены при AASV, их значение в этом отношении неясно [63]. Антигены ANCA, PR3 и MPO, могут связываться с эндотелиальными клетками через рецепторы эндотелиальных клеток [64,65].ANCA может связываться с антигенами, связанными с эндотелиальными клетками, что приводит к активации ЭК. Возможно, что активация нейтрофилов, вызванная ANCA, вызывает высвобождение цитотоксических ферментов, которые повреждают эндотелиальные клетки. У пациентов с AASV с поражением почек уровни циркулирующего ангиопоэтина-2 (Ang-2) коррелируют с повышенным количеством циркулирующих ЭК. Исследования in vitro позволяют предположить, что эндотелиально-специфическая ангиопоэтин (Ang) -Tie-лиганд-рецепторная система регулирует отслоение эндотелиальных клеток. По аналогии, Ang-2 может регулировать отслоение эндотелиальных клеток при AASV [66].
4.5. Факторы окружающей среды
Клинические и эпидемиологические данные демонстрируют, что факторы окружающей среды, в том числе кремнезем, асбест, лекарственные препараты (антитиреоидные препараты) и различные инфекции (бактериальный эндокардит, вирусный гепатит С), коррелируют с циркулирующим ANCA и развитием AASV [67,68 ]. Beaudreuil и др. Показали, что воздействие диоксида кремния связано с почти семикратным повышением риска ANCA-положительной реакции [69]. ANCA, как PR3, так и MPO, обнаруживаются в сыворотках пациентов с затяжными инфекциями; однако при большинстве инфекций ANCA направлены против широкого репертуара антигенов и имеют тенденцию быть двойными [70].Stegeman et al. описали связь между носовым S. aureus и рецидивами PR3-AAV [71]. Хронические инфекции могут вызывать нейтрофилы, которые в дальнейшем могут активироваться PR3-ANCA, что приводит к васкулиту. Также возможно, что некоторые экзогенные чужеродные белки (например, бактериальные, вирусные, грибковые) имитируют аутоантигены, которые генерируют ANCA и ANCA ответ. Например, PR3-ANCA обнаружен в сыворотке крови пациентов с бактериальным эндокардитом [72]. Длительное воздействие на иммунную систему специфических антигенов может подготовить почву для развития ANCA и последующего AASV.В соответствии с этой идеей было выдвинуто множество теорий, включая теорию антикомплементарного антитела PR3 [73] и теорию анатитела Anti-LAMP (ассоциированный с лизосомами мембранный белок) [74], которые выходят за рамки данного исследования.
4.6. Генетическая предрасположенность
В целом аутоиммунные заболевания наследуются по семейному признаку, что позволяет предположить, что пораженные люди несут генетические вариации, которые вносят вклад в восприимчивость к болезням. Отчеты о случаях показывают кластеры WG у братьев и сестер и близких родственников, а специфические ассоциации HLA (DR1-DQw1) у пациентов с AASV также предполагают существование локусов генетической предрасположенности [75,76,77].У пациентов с WG нейтрофилы с положительной экспрессией мембранного PR3 (mPR3 + ) более многочисленны, чем у здоровых контролей, что приводит к асимметричному бимодальному распределению mPR3 в сторону высокого фенотипа mPR3 + в WG [78]. Это явление может быть генетически детерминировано, потому что пропорция нейтрофилов mPR3 + является стабильным фенотипом у одного и того же человека в течение продолжительных периодов времени, она также передается в семьях и одинакова у близнецов [79]. Более того, пациенты с WG несут полиморфизм, который нарушает предполагаемый сайт связывания фактора транскрипции в промоторной области PR3 [80].Этот полиморфизм может приводить к повышенной экспрессии PR3 и объяснять высокий фенотип mPR3 + . Сообщалось о дополнительных полиморфизмах с участием CTLA-4 (влияющих на активацию Т-клеток), уровня альфа-1-антитрипсина (ингибитор протеазы PR3) и других генов / белков у пациентов с AASV [81,82,83,84].
5. Являются ли ANCA патогенными?
Вопрос о патогенности ANCA является спорным. ANCA отсутствуют у некоторых пациентов с васкулитом мелких сосудов, тогда как MPO-ANCA выявляются у пациентов с ревматоидным артритом и другими заболеваниями [85].Кроме того, недостаток иммунных комплексов в местах патологических поражений свидетельствует против прямой роли ANCA. Однако модели на животных с васкулитом мелких сосудов убедительно доказывают, что ANCA патогенны при AASV. Xiao et al продемонстрировали, что у мышей Rag2 — / — , у которых полностью отсутствует Т- и В-лимфоциты с рецепторами антигенов, развился тяжелый некротический гломерулонефрит и васкулит мелких сосудов, когда им вводили спленоциты против МПО, в то время как у мышей получили анти-BSA или нормальные спленоциты остались здоровыми.Точно так же у мышей Rag2 — / — и WT B6, которым инъецировали IgG против MPO, развился очаговый гломерулярный некроз и серповидное образование, что ясно указывает на то, что антитела были патогенными [86]. Neumann и др. Продемонстрировали избыточные иммунные отложения на ранних стадиях жизни мышей SCG / Kinjoh (у которых спонтанно развиваются васкулит мелких сосудов и p-ANCA) и предположили, что отложение иммунных комплексов приводит к воспалительному состоянию, которое при усилении ANCA, вероятно, приводят к тяжелому васкулиту [87].При биопсии почек у пациентов с AASV с поражением почек Bajema et al. Показали, что PR3, MPO, эластаза и лактоферрин локализованы внутри или вокруг фибриноидно-некротических поражений, а поражения содержат высокие уровни PR3 и эластазы, которые также обогащены внутри очагов [88 ]. Schlieben et al описали случай легочно-почечного синдрома у новорожденного, который получил MPO-ANCA путем пассивной передачи от матери, поддерживая идею о патогенности ANCA [89]. Модели на животных не были разработаны для описания патогенности PR3-ANCA, поскольку человеческий и мышиный PR3 имеют низкий уровень гомологии.Однако модель на животных васкулита и тяжелого сегментарного и некротического гломерулонефрита, аналогичная WG, была недавно разработана на мышах с тяжелым комбинированным иммунодефицитом, не страдающим ожирением, с тяжелым диабетом (NOD-SCID). В этой модели спленоциты выделяли от мышей NOD, иммунизированных рекомбинантным мышиным PR3, и переносили мышей NOD-SCID, у которых развилась патология заболевания. Эти данные предполагают, что PR3-ANCA может играть прямую роль в PR3-ANCA-ассоциированном заболевании почек; однако в этой модели специфический генетический фон и аутоиммунная предрасположенность к патологии почек являются предпосылками для проявления заболевания [90].
5.1. Роль апоптоза нейтрофилов в AASV
Повышенный апоптоз нейтрофилов наблюдался при AASV. Патологические образцы от пациентов WG показывают явное присутствие апоптотических и некротических нейтрофилов [91,92]. В образцах тканей от ANCA-положительного почечного васкулита наблюдались лейкоциты с деградировавшим ядерным материалом, подвергающиеся дезинтеграции и апоптозу [93]. Гистологически AASV характеризуется лейкоцитоклазом с инфильтрацией и накоплением непокрытых апоптотических и некротических нейтрофилов в тканях вокруг кровеносных сосудов и фибриноидным некрозом стенок кровеносных сосудов [94].Э / М исследования лейкоцитокластических поражений у пациентов с лейкоцитокластическим васкулитом показали, что может быть дефект клиренса апоптотических нейтрофилов. Меньшая часть нейтрофилов в этом исследовании показала типичные апоптотические изменения конденсированных и маргинальных ядер, в то время как большинство выявило интактные ядра с разрушенными цитоплазматическими органеллами и плазматическими мембранами [95]. Фактически, апоптозные нейтрофилы могут быть источником иммунологически облученных нейтрофильных антигенов, которые способствуют выработке ANCA.Было высказано предположение, что развитие ANCA-положительного васкулита представляет собой трехэтапный патологический процесс. Первый шаг включает экзогенный стимул, который увеличивает апоптоз нейтрофилов и макрофагов. Примером может служить воздействие вдыхаемого вещества, такого как диоксид кремния, который, как известно, вызывает апоптоз лимфоцитов периферической крови человека, а также индуцирует экспрессию Fas-лиганда в макрофагах легких (в vitro и в vivo ), способствуя Fas-зависимым макрофагам. апоптоз на мышиной модели силикоза [96,97].Аналогичным образом, другие постулируемые этиологические агенты для AASV (пропилтиоурацил, Streptococcus Pneumoniae ) также вызывают / ускоряют апоптоз [98,99]. Имеются также патологические свидетельства лейкоцитов с деградировавшим ядерным материалом, подвергающимся распаду в тканях, а при AASV наблюдались апоптотические клетки. Следовательно, кажется логичным предположить, что дефектный клиренс / повышенное воздействие апоптозных нейтрофилов может быть инициирующим фактором для продукции ANCA и развития AASV (шаг второй).Наконец, экологические и генетические факторы также могут вносить вклад в проявление болезни [100].
Существуют также экспериментальные данные, подтверждающие эту модель развития. Имеются данные о том, что в воспалительной среде аутоантигены (ядерные / цитозольные) представлены опсонизированными клетками, что, вероятно, приводит к образованию аутоантител. Kettritz et al. Использовали высокие дозы TNF-α для примирования нейтрофилов и продемонстрировали, что зависимый от каспазы 3 апоптоз ранних нейтрофилов сопровождался повышенной поверхностной экспрессией PR3 и MPO.Кроме того, эти нейтрофилы с ранним апоптозом показали подавление респираторного взрыва в ответ на ANCA [101].
Интересно, что Патри и др. Показали, что инъекция сингенных апоптотических нейтрофилов, но не свежевыделенных нейтрофилов, крысам Brown Norway приводила к развитию P-ANCA, большинство из которых специфично для эластазы, что снова указывает на то, что апоптотические нейтрофилы могут усиливать аутоиммунные реакции. ответ [102]. В другом исследовании внутрибрюшинная инфузия живых или апоптотических нейтрофилов человека (но не фиксированных или лизированных формалином нейтрофилов) мышам C57BL / 6J приводила к развитию ANCA, специфичного для лактоферрина или миелопероксидазы.Вторая внутривенная инфузия апоптотических нейтрофилов привела к развитию PR3-специфической ANCA. Снова не было обнаружено васкулитов у мышей, у которых развивалась ANCA [103].
Как уже известно из общей молекулярной биологии, нейтрофилы, мигрирующие в воспаленные участки, подвергаются спонтанному апоптозу, что приводит к их удалению без повреждения окружающей ткани. Макрофаги в крови распознают, помимо других сигналов поверхностных мембран, экстернализованный фосфатидилсерин (PS) на апоптотических нейтрофилах, что приводит к их безопасному удалению.Однако нейтрофилы, которые не очищаются таким образом, прогрессируют до вторичного некроза, процесса, который запускает высвобождение провоспалительных цитокинов. Похоже, что ANCA нарушают регуляцию процесса апоптоза нейтрофилов. В исследовании in vitro , проведенном Harper et al., ANCA ускоряли апоптоз нейтрофилов, примированных TNF, по механизму, зависящему от NADPH-оксидазы и генерации ROS. Это сопровождалось разобщением ядерных и цитоплазматических изменений с поверхностными мембранными изменениями.То есть, хотя апоптоз прогрессировал быстрее, не было соответствующего изменения в скорости экстернализации PS после активации нейтрофилов ANCA. Это нарушение регуляции создало «уменьшенное окно возможностей» для клиренса фагоцитов макрофагами, что привело к более провоспалительной среде [104]. Здесь необходимо отметить, что ANCA не смогли ускорить апоптоз у незапраймированных нейтрофилов. Кроме того, хотя по мере прогрессирования апоптоза экспрессия PR3 и MPO увеличивалась, ANCA не могли активировать эти нейтрофилы.Фактически, по мере старения этих нейтрофилов наблюдалось зависящее от времени уменьшение генерации АФК [104]. ANCA ускоряет апоптоз нейтрофилов в примированных нейтрофилах за счет генерации АФК, которые действуют как факторы усиления апоптоза. АФК имеют решающее значение, поскольку нейтрофилы, изолированные от пациентов с хронической гранулематозной болезнью (с дефектом продукции АФК), не показывают ускоренного апоптоза после активации ANCA [104]. Те же авторы в более позднем исследовании, а также другая независимая группа показали, что связывание ANCA с апоптотическими нейтрофилами усиливает фагоцитоз макрофагами, происходящими из моноцитов человека, но в то же время они увеличивают секрецию провоспалительных цитокинов, таких как IL-1, IL-8 и TNF-α [105,106].IL-1 и IL-8 способны замедлять апоптоз и являются мощными химиоаттрактантами. Выведение провоспалительных нейтрофилов приведет к дальнейшему привлечению клеток и сохранению воспаления. Аутоиммунному ответу может способствовать аберрантный фагоцитоз апоптотических нейтрофилов дендритными клетками. В недавнем исследовании было показано, что антитело против PR3 может также проникать в нейтрофилы человека ( in vitro, ) и приводить к усилению апоптотического процесса [107].
Понимание патогенеза апоптоза нейтрофилов и клиренса при AASV может помочь рационализировать существующие методы лечения и указать новые подходы к терапии [108].
5.2. Роль сетевых нейтрофилов (NET)
Недавно была описана новая форма смерти от PMN, названная «NETosis», характеризующаяся активным высвобождением хроматина [109]. Внеклеточные ловушки нейтрофилов (NET) представляют собой экструзии плазматической мембраны и ядерного материала, содержащие компоненты гранул и гистоны. Эти структуры связывают грамположительные и отрицательные бактерии, а также грибы. In vitro было показано, что NET связывают и убивают внеклеточные микроорганизмы; in vivo , они были зарегистрированы в таких условиях, как аппендицит, сепсис, преэклампсия и экспериментальные модели шигеллеза [110].Изменения, приводящие к образованию NET, следуют определенному паттерну, который инициируется потерей ядерной сегрегации на eu- и гетерохроматин. Как только хроматин и гранулярные компоненты смешиваются, NET высвобождаются из клетки после разрыва цитоплазматической мембраны посредством процесса, отличного от некроза или апоптоза, называемого НЕТозом. НАДФН-оксидаза играет роль в этом процессе, генерируя АФК, которые действуют как сигнальные молекулы. Fuchs et al. Продемонстрировали, что образование NET является частью активной гибели клеток, и что NET высвобождаются, когда активированные нейтрофилы умирают [111].
Kessenbrock et al. продемонстрировали, что ANCA-стимулированные нейтрофилы высвобождают NET, которые содержат PR3 и MPO в дополнение к хроматину и LL37 (антимикробный пептид, способный активировать дендритные клетки) [112]. Присутствие NETs in vivo было показано в тканях (биопсия почек от пациентов с васкулитом мелких сосудов) с максимальной концентрацией в областях, демонстрирующих нейтрофильную инфильтрацию, что позволяет предположить, что образование NET происходит преимущественно во время активного заболевания [112]. Сообщалось о повышенных уровнях циркулирующих нуклеосом у пациентов с AASV [113].Вполне вероятно, что на самом деле они могут быть производными и отражать образование NET в AASV. Короче говоря, NET могут стимулировать выработку ANCA посредством представления комплексов антиген-хроматин иммунной системе, или ANCA может стимулировать выработку NET, которые затем могут усугубить иммунный ответ, что приведет к сохранению аутоиммунного ответа, рис.
Рисунок 2.
Патофизиологическая модель внеклеточных ловушек нейтрофилов (NET) при ANCA-ассоциированном васкулите. ANCA может индуцировать TNF-α-примированные нейтрофилы к образованию NET.Отложение NET может активировать плазмацитоидные дендритные клетки, которые продуцируют большие количества интерферона-α, управляя аутоиммунным ответом. В этом контексте NET могут активировать аутореактивные B-клетки для производства ANCA, что приводит к порочному кругу производства NET, который поддерживает доставку комплексов антиген-хроматин в иммунную систему. Более того, сети могут также прилипать к эндотелию и вызывать повреждение эндотелия.
5.3. Недавние обновления
Эксперименты, проведенные нашей группой, показали, что уровни зрелого PR3, а также про-PR3 в плазме повышены при AASV [114,115,116].Также было замечено, что нейтрофилы mPR3 + более многочисленны в AASV по сравнению со здоровыми донорами, что согласуется с предыдущими исследованиями, предполагающими, что высокий процент клеток mPR3 + может быть фактором риска васкулита [78, 115]. Циркулирующие нейтрофилы и моноциты пациентов с AASV демонстрируют усиленную транскрипцию гена PR3 [117]. Вполне вероятно, что аберрантная экспрессия PR3 / mPR3 может отражать или быть маркером конкретного функционального дефекта нейтрофилов. Возможная причина высоких уровней PR3 в плазме — это выделение мембраны PR3.
Важным недавним открытием является то, что mPR3 и CD177 коэкспрессируются на одной и той же субпопуляции циркулирующих нейтрофилов у здоровых субъектов, а также у пациентов с AASV [118,119]. Наша группа продемонстрировала, что субпопуляция нейтрофилов mPR3 + / CD177 + была больше у пациентов с AASV по сравнению со здоровым контролем, что свидетельствует об отличном патофизиологическом фенотипе нейтрофилов у AASV [116]. Интересно, что более высокий уровень CD177-мРНК, но не PR3-мРНК, коррелирует с более высокой долей mPR3 + / CD177 + клеток, предполагая, что избыточная продукция CD177 может приводить к увеличению доли mPR3 + / CD177 + нейтрофилов [116].
Вполне вероятно, что эти две субпопуляции выполняют разные функции, которые могут иметь прямое отношение к патофизиологическим процессам. Мембрана CD177 помогает нейтрофилам прикрепляться к эндотелию, в то время как m-PR3 помогает этой позитивной субпопуляции мигрировать через эндотелий и интерстициальные ткани. Можно сделать вывод, что клетки mPR3 + / CD177 + обладают большей способностью к уничтожению, включая более высокую продукцию NET и ROS, чем субпопуляция mPR3 — / CD177 — .Упрощенно говоря, нейтрофилы mPR3 + / CD177 + могут быть обозначенными «боевыми» нейтрофилами, предназначенными для миграции из крови в ткани и обеспечения провоспалительных, микробицидных функций, в то время как mPR3-отрицательные нейтрофилы предназначены оставаться в внутрисосудистого компартмента и функционируют как противовоспалительные клетки до тех пор, пока они не потребуются для разрешения воспаления, продуцирования противовоспалительных медиаторов или фагоцитоза тканевых остатков и других мертвых нейтрофилов в месте воспаления.
Наша группа первой продемонстрировала более низкий уровень спонтанного апоптоза и на более длительную выживаемость in vitro нейтрофилов от пациентов с AASV в стадии ремиссии по сравнению с нейтрофилами от здоровых доноров крови [120].
В противоположность нашим результатам, Harper et al. показали, что нейтрофилы от пациентов с AASV, особенно с активным заболеванием, имеют повышенную скорость апоптоза [106].
6. Патофизиология пурпуры Геноха-Шенлейна (HSP)
Этиология HSP, а также его патогенез в значительной степени неизвестны.
6.1. Генетические факторы
Семейное объединение HSP в кластеры было описано и предполагает генетическую основу заболевания [121, 122]. В нескольких странах и этнических группах разные типы HLA были связаны с восприимчивостью к HSP [123,124]. Различные ассоциации типов HLA могут объяснить различия в проявлениях между разными этническими группами, но до сих пор из этих исследований нельзя было сделать никаких выводов, объясняющих патогенез HSP. Было обнаружено, что положительная реакция на HLAB35 увеличивает риск развития HSP [125].
Полиморфизм гена ангиотензиногена (M235T) может создавать риск развития нефрита Геноха-Шенлейна [126,127].
Полиморфизмы гена ангиотензин-1-превращающего фермента (АПФ) могут быть вовлечены в патогенез HSP или HSN, хотя данные противоречивы. Генотип инсерции (I) / делеции (D) полиморфизма в ACE может придавать чувствительность к HSP [126,127]. Полиморфизм DD был связан со стойкой протеинурией у пациентов с HSP в одном исследовании [128], тогда как в другом исследовании не было обнаружено корреляции между прогнозом HSP и генотипом ACE [129].
Вариации гена белка С4 комплемента могут сообщать восприимчивость к развитию HSP. Было описано, что нулевые изотипы C4 преобладают у значительно большей части пациентов с HSP и HSN, чем у контрольной группы [130, 131, 132]. Частичный или полный дефицит C4 может быть связан с нарушением клиренса иммунных комплексов и, таким образом, играть роль в патогенезе HSP [133]. Однако дефицит комплемента у пациентов с HSP встречается редко и преходяще [134].
Исследования полиморфизма генов, кодирующих провоспалительные цитокины (TNF-α, IL-1b, IL-8, TGF-β и VEGF), до сих пор не выявили каких-либо предрасполагающих факторов для HSP [135, 136].
Семейная средиземноморская лихорадка (FMF) — аутовоспалительное заболевание, вызываемое мутацией в гене MEFV, который в 7% случаев связан с HSP [137]. Дети с мутациями MEFV часто встречаются среди пациентов с HSP в странах с относительной распространенностью FMF [138, 139]. Значение этой ассоциации для общего патогенеза HSP, если вообще неясно.
6.2. Инфекционные и неинфекционные агенты
HSP обычно предшествуют инфекции, до 95% случаев локализуются в верхних дыхательных путях и появляются группами в семьях [140, 141, 142].Заболеваемость HSP наиболее высока в раннем детстве и демонстрирует отчетливые сезонные колебания с пиком осенью и зимой [6]. И раннее детство, и осенне-зимний период — периоды частых инфекций. Таким образом, клинические наблюдения указывают на важную роль инфекций в этиологии и патогенезе HSP.
Несколько исследований показали косвенную связь инфекций со стрептококками группы А и развития HSP [143,144,145]. Другие нашли серологические доказательства связи с инфекциями с другими бактериями, такими как Bartonella henselae, или вирусами, такими как парвовирус B19 и вирус гепатита C [146,147,148].
Было обнаружено, что неинфекционные агенты связаны с развитием HSP, особенно у взрослых. К ним относятся определенные препараты, такие как ингибиторы ангиотензин-превращающего фермента, антагонисты рецепторов ангиотензина II, антибиотики и нестероидные противовоспалительные препараты, а также укусы насекомых, вакцинация или пищевая аллергия [149].
6.3. IgA1 в HSP
Отложения IgA в HSP состоят из иммунных комплексов, в основном состоящих из IgA1 [150].
Было обнаружено, что образцы сыворотки от пациентов с HSN имеют повышенные уровни недостаточно гликозилированного полимерного IgA1 по сравнению с контролем [151].Однако у детей с HSP без поражения почек уровни были не выше, чем у детей в контрольной группе [
Паучий иммунный полумесяцный гломерулонефрит: ANCA-ассоциированный васкулит
Быстро прогрессирующий гломерулонефрит (RPGN) — синдром, выражающийся в стремительной потере. функции почек с особенностями гломерулонефрита, включая дисморфную эритроцитурию и гломерулярную протеинурию. RPGN ассоциируется с обширным серповидным формированием, и, таким образом, клинический термин RPGN часто используется взаимозаменяемо с патологическим термином серповидный гломерулонефрит (CGN).С иммунопатологической точки зрения, первичный RPGN подразделяется на паучиммунный GN (PICG), анти-GBM GN и иммунный комплекс GN. PICG, наиболее распространенная этиология первичной RPGN, относится к некротизирующему гломерулонефриту с небольшим количеством иммунных отложений или без них по данным иммунофлуоресценции (IF) или электронной микроскопии (EM). У большинства пациентов слабый иммунитет CGN является компонентом системного васкулита мелких сосудов, такого как гранулематоз с полиангиитом (GPA). Приблизительно 90% пациентов с PICG имеют циркулирующие антитела ANCA, что приводит к номенклатуре ANCA-ассоциированный васкулит (AAV).Недавние исследования выявили несколько других антител, связанных с PICG, которые, как теперь понимают, представляют собой сложный спектр заболеваний со значительным перекрытием с точки зрения клинического фенотипа и исходов. Кроме того, в патогенез этого заболевания недавно были вовлечены несколько генетических факторов и факторов окружающей среды. С новыми прогностическими классификациями, улучшенным пониманием иммунопатологических механизмов и новыми парадигмами лечения клинический и экспериментальный интерес к PICG остается высоким.
1. Введение: Эпидемиология и клинические результаты
На популяционном уровне мало что известно об эпидемиологии и исходах паучиммунного ГН. PICG представляет до 80% случаев RPGN, частота которых оценивается в 7–10 случаев на миллион человек в год в Соединенных Штатах [1]. Паучий иммунитет GN (PICG) имеет пристрастие к белым по сравнению с чернокожими, с примерно равным представительством среди мужчин и женщин [1]. Интересно, что GPA чаще встречается в более прохладном климате, тогда как MPA чаще встречается в более теплом климате.AAV в Азии чаще ассоциируется с MPO-ANCA, чем с PR3-ANCA [2]. Без лечения летальность от PICG составляет 80%. Однако при агрессивной иммуносупрессии 5-летняя выживаемость достигает 75% [3]. Пожилой возраст, диализная зависимость и легочное кровотечение — все это ухудшает шансы на выживание. Например, необратимая диализ-зависимая почечная недостаточность снижает 5-летнюю выживаемость до 35%. С точки зрения почечного исхода, около 25% пациентов прогрессируют до ТПН [4]. Лучшим предиктором почечных исходов является исходный креатинин сыворотки, а также степень повреждения почек и фиброза при биопсии.Хотя ремиссия может быть вызвана у большинства пациентов, около 40% пациентов рецидивируют, что указывает на необходимость тщательного наблюдения [1]. Здесь мы представляем случай почечно-ограниченного PICG с диализ-зависимой почечной недостаточностью. Последующее обсуждение направлено на то, чтобы детализировать патофизиологию PICG, выделяя при этом возможные направления для будущих научных исследований.
2. Номенклатура и классификация
Несмотря на то, что классификация «слабоиммунного» гломерулонефрита является описательной и актуальной, она может быть несколько неполной и вводящей в заблуждение.Исторически этот термин был придуман для характеристики отсутствия отложений линейного иммуноглобулина (тип I) или иммунного комплекса (тип II) при иммунофлуоресценции [1]. Это, однако, не означает, что иммунная система не участвует в патогенезе болезненного процесса. Напротив, слабоиммунный ГН является классическим аутоиммунным заболеванием почек и поэтому лечится как таковой.
Несмотря на попытки упростить систему классификации, термин «слабый иммунный гломерулонефрит» представляет собой сложный и перекрывающийся «спектр» болезненных процессов.Мы знаем, что около 10% случаев в патологическом континууме PICG являются ANCA-отрицательными, несмотря на схожие клинические особенности и результаты биопсии почек по сравнению с ANCA-положительными случаями [1]. Кроме того, хотя слабый иммунный некротизирующий GN обычно возникает в связи с вовлечением других органов как в GPA, так и в MPA, у некоторых пациентов наблюдается почечно-ограниченный , ANCA-положительный васкулит. До 80% этих пациентов имеют MPO-ANCA-позитивность, а у остальных — антитела против PR3-ANCA [5].Пациент, представленный в этом обзоре, имеет анти-PR3-ANCA, который после ремиссии имеет более высокую частоту рецидивов и в целом худший прогноз. Почечно-ограниченный васкулит считается частью спектра GPA и MPA, поскольку гистопатологические данные этих двух состояний часто неразличимы [6]. Клинически пациенты с почечно-ограниченным васкулитом более подвержены гломерулосклерозу при биопсии почек, чем пациенты с GPA или MPA, поскольку пациенты без внепочечных проявлений, вероятно, проявляются позже в ходе их заболевания [6].Кроме того, клинический фенотип усложняется тем, что при оценке с помощью электронной микроскопии у некоторых пациентов наблюдаются небольшие рассеянные иммунные отложения в мезангиуме и стенке капилляров клубочков. Это, в надлежащих клинических условиях и с положительными антителами к ANCA, по-прежнему классифицируется как «слабовоспалительный» гломерулонефрит [7]. Наконец, необходимо также упомянуть сущность заболевания, положительного по «двойным антителам», поскольку оно включает пациентов с признаками как ANCA-положительного RPGN, так и заболевания, направленного против GBM [8].
3.Случай
63-летняя женщина европеоидной расы с историей болезни сахарного диабета II типа в течение 7 лет (без ретинопатии или нейропатии), гипертонией и гипотиреозом обратилась с острым повреждением почек в марте 2015 г. Пациентка была отечна при обследовании и имела пик креатинина сыворотки 7,2 мг / дл. Первоначальные данные были также значимы для гиперкалиемии и гипертонии. Ей был назначен гемодиализ по поводу гиперкалиемии, перегрузки объемом и уремии. Лекарства перед госпитализацией включали эпизодический прием НПВП, метформина и ИАПФ, все из которых первоначально принимались.Анализ мочи показал 100 мг / дл белка с> 5 эритроцитами / HPF, без цилиндров при микроскопии. 24-часовая моча была определена на белок и составила 3 грамма. ANA, анти-ДНК, уровни комплемента, серологические исследования гепатита и ВИЧ, ASLO и анти-GBM были отрицательными. Серологический анализ ANCA показал, что уровень антител против миелопероксидазы (MPO) был <1, а уровень антител против протеиназы 3 (PR3) был повышен до 54,3. SPEP / UPEP не вносил вклад. На УЗИ почек почки были размером примерно 11 см и 14 см без признаков хронического заболевания почек, атрофии или гидронефроза.Пациенту была сделана биопсия почки, которая показала легкую хроническую форму на фоне нефросклероза, связанного с гипертензией, наряду с легкой атрофией канальцев и интерстициальным фиброзом (рис. 3). Острые гистологические данные при биопсии были значимы для очагового сегментарного некротизма (рис. 2) и диффузного серповидного гломерулонефрита (рис. 1), слабоиммунного типа, с умеренной или тяжелой активностью и легкой хронической формой. Кроме того, наблюдалась диффузная острая травма канальцев с очаговыми слепками красных кровяных телец. При биопсии не было выявлено вторичных по отношению к диабету изменений.Пациент получил индукционную терапию циклофосфамидом и внутривенными кортикостероидами и поддерживающую иммуносупрессию азатиоприном и пероральным преднизоном. Она оставалась зависимой от диализа, и у нее развились нежелательные побочные эффекты терапии азатиоприном, что потребовало ее прекращения. В настоящее время считается, что у нее ХПН.
4. Гистопатологическая классификация
Биопсия почек имеет решающее значение для диагностики PICG и RPGN в целом.Даже у пациентов с преимущественным поражением легких биопсия почки может быть предпочтительной, поскольку она связана с более высокой диагностической эффективностью и меньшим процедурным риском [9]. Отличительными патологическими признаками, связанными с PICG, являются некроз капиллярных петель, экстракапиллярная пролиферация с серповидным образованием, перигломерулярные и интерстициальные инфильтраты, некротический артериит, а также отсутствие или скудность иммунных отложений [10].
Полумесяц характеризуется экстракапиллярной пролиферацией внутри клубочка, частично или полностью заполняющей пространство Боумена.Он состоит из пролиферирующих клеток париетального эпителия, подоцитов, макрофагов и фибробластов. Формирование серпа стимулируется поступлением фибрина и других белков плазмы из просвета капилляров после разрыва базальной мембраны клубочка (GBM). За этим следует миграция Т-клеток, макрофагов и других воспалительных клеток к месту повреждения, ускорение высвобождения цитокинов и повреждение тканей. Эти «клеточные» полумесяцы могут, наконец, превратиться в фиброцеллюлярные или фиброзные полумесяцы с увеличенным внеклеточным матриксом и отложением коллагена.Таким образом, наличие разрыва ГБМ в склерозированном клубочке должно вызывать подозрение на предшествующее серповидное повреждение клубочка.
Расположение и степень серповидности, а также наличие склероза играют важную роль в определении клинического течения PICG [11, 12]. Berden et al. недавно представила гистопатологическую систему классификации, разработанную международной рабочей группой патологов почек. Они провели валидационное исследование на 100 биоптатах почек у пациентов с клинически и гистопатологически подтвержденным диагнозом ANCA-ассоциированного гломерулонефрита.Авторы разделили биопсию почек на четыре гистологические категории, видимые под световой микроскопией: очаговые, серповидные, смешанные и склеротические, в зависимости от соотношения присутствующих нормальных, клеточных, серповидных и склеротических клубочков. Их анализ показал, что эта система классификации имеет хорошую прогностическую ценность с точки зрения почечного исхода через 1 и 5 лет. Выживаемость почек через 1 год составила 93% для пациентов, чьи биопсии почек были классифицированы как очаговые на момент постановки диагноза, 84% для пациентов, чьи биопсии были классифицированы как серповидные, 69% для пациентов, чьи биопсии были классифицированы как смешанные, и 50% для пациентов. чьи биопсии были классифицированы как склеротические.Процент выживаемости почек через 5 лет составил 93% (очаговая), 76% (серповидная), 61% (смешанная) и 50% (склеротическая). В категории склероза почечная выживаемость через 7 лет составила только 25%. Несколько валидационных исследований, проведенных в Японии, Китае, Австралии, США, Нидерландах и Турции, дополнительно подтвердили, что изложенная гистопатологическая классификация ANCA-ассоциированного гломерулонефрита имеет прогностическую ценность с точки зрения почечного исхода [13-15]. Это было особенно верно для исключительных категорий очаговых и склеротических повреждений клубочков.
Хотя в PICG, по определению, иммунных отложений при иммунофлуоресцентной микроскопии и электронной микроскопии мало, в значительной части случаев действительно могут быть обнаружены отложения Ig при гистопатологическом исследовании [7, 16, 17]. Neumann et al. [17] показали, что наличие отложений Ig приводит к значительно большей протеинурии и может быть связано с худшим прогнозом. Это можно объяснить гипотезой о том, что ANCA и иммунные комплексы могут действовать синергетически, вызывая более серьезные повреждения клубочков.Также важно отметить, что экспериментальные модели на животных не исключили убедительно наличие иммунных отложений при ANCA-ассоциированном гломерулонефрите [18, 19]. Крысы, предварительно иммунизированные человеческим MPO-ANCA, которые впоследствии были перфузированы лизосомальными экстрактами и h3O2, развили CGN, а также показали отложение IgG и C3 в начале процесса заболевания. Более того, степень гистологического повреждения была пропорциональна количеству иммунных отложений IgG. Интересно, что отложения Ig не могли быть обнаружены на более позднем этапе развития болезни, что позволяет предположить, что присутствие иммунных комплексов может зависеть от времени и не обнаруживаться к моменту проведения биопсии у большинства пациентов.Наконец, есть сообщения о ANCA-ассоциированном гломерулонефрите, осложняющем связанные с иммунными комплексами заболевания, такие как IgA-нефропатия, мембранозный гломерулонефрит и постинфекционный гломерулонефрит [7, 20–22]. Таким образом, важно тестировать на ANCA даже в случаях иммунных отложений на почечной гистологии (поражения типа II).
5. Патофизиология
Несмотря на скудность иммунных отложений, PICG представляет собой классический иммунно-опосредованный болезненный процесс. Большинство исследований in vitro, in vivo, и клинических исследований указывают на участие ANCA в патогенезе этого заболевания [23–26].Одним из примеров прямых доказательств роли ANCA является случай неонатального микроскопического полиангиита, вторичного по отношению к трансплацентарной передаче MPO-ANCA [24]. Это открытие, хотя и интересно, требует дальнейшего обоснования в будущих исследованиях. Кроме того, было описано несколько животных моделей ANCA-ассоциированного почечного заболевания. Xiao et al. [25] вводили спленоциты от мышей, иммунизированных МПО, мышам с истощенными В- и Т-клетками и мышам дикого типа. У мышей-реципиентов развился слабый иммунный некротический серповидный гломерулонефрит и геморрагический легочный капиллярит, почти идентичные гистопатологии и фенотипу человеческого MPO-ANCA-ассоциированного васкулита.Перенос только IgG от MPO-иммунизированных мышей приводил к слабым иммунным очаговым некротическим некротическим эффектам CGN у реципиента, ясно демонстрируя роль антител против MPO. Хотя in vivo доказательства, подтверждающие роль MPO-ANCA, хорошо задокументированы, результаты еще не были убедительно воспроизведены для болезни PR3-ANCA на животных моделях [27]. Таким образом, некоторые эксперты подвергли сомнению роль антител PR3 в индукции заболевания ANCA и вместо этого предложили другие механизмы, такие как опосредованное Т-клетками воспаление.
Антинейтрофильные цитоплазматические аутоантитела (ANCA) специфичны для белков в цитоплазме нейтрофилов и моноцитов. Основными антигенами-мишенями у пациентов с васкулитом и гломерулонефритом являются миелопероксидаза (MPO) и протеиназа 3 (PR3). После связывания с целевыми антигенами PR3 или MPO, ANCA приводит к активации нейтрофилов и моноцитов после того, как клетки примированы низкими дозами цитокинов, таких как фактор некроза опухоли альфа (TNF- α ), интерлейкин-1 и интерлейкин- 18 [26, 28, 29].Есть результаты прайминга в поверхностной экспрессии PR3 и MPO, позволяющие взаимодействовать с ANCA. Активация нейтрофилов опосредуется вовлечением как рецепторов Fc , γ , так и Fab’2 [30, 31]. В частности, вовлечены рецепторы Fc , γ, IIa и IIIb. ANCA-опосредованная активация нейтрофилов приводит к продукции активных форм кислорода и высвобождению литических ферментов, таких как эластаза, которые повреждают эндотелиальные клетки [28, 32, 33]. ANCA также стимулирует высвобождение внеклеточных ловушек нейтрофилов (NET), которые состоят из волокон хроматина и аутоантигенов, включая MPO и PR3 [34, 35].NET могут повреждать эндотелиальные клетки и целые клубочки, а также могут участвовать в распространении аутоиммунного ответа ANCA [34]. Кроме того, стало ясно, что альтернативный путь активации комплемента играет роль в опосредовании повреждения тканей при PICG [36, 37]. Активированные нейтрофилы высвобождают различные факторы, такие как пропердин, которые активируют альтернативный путь с образованием C3. Пропердин, молекула, хранящаяся в нейтрофильных гранулах, высвобождается, когда C5a запускает активацию нейтрофилов.Это оптимизирует взаимодействие с ANCA и помогает активировать альтернативный путь комплемента. Все это запускает каскад событий, которые усиливают рекрутирование и активацию нейтрофилов, что приводит к широко распространенным некротическим повреждениям, наблюдаемым при AAV [37]. Важно отметить, что специфичность антигена ANCA, по-видимому, более тесно связана с фенотипом и прогнозом заболевания, чем с клиническим диагнозом GPA или MPA [38, 39]. PR3-ANCA связан с гранулематозным воспалением, более обширным внепочечным поражением и более высокой частотой рецидивов.Напротив, MPO-ANCA чаще встречается при почечно-ограниченном заболевании, проявляет большее рубцевание почек и в целом имеет худший прогноз для почек.
Антитела, отличные от ANCA, также изучались у пациентов с PICG. Kain et al. продемонстрировали, что новый подтип ANCA, антитела к лизосомальному мембранному белку 2 (LAMP-2), более распространены, чем антитела к MPO и PR3, у пациентов с подтвержденным биопсией слабым иммунным фокально-некротическим гломерулонефритом (FNGN) [40]. Они также показали развитие характерных поражений в почках крыс после инъекции им антител к LAMP-2 и апоптоза эндотелия человека in vitro с помощью моноклональных антител к человеческому LAMP-2 (h5B4).Последующее исследование, проведенное той же группой, не только показало высокую распространенность антител к LAMP-2 у пациентов с PICG, но также продемонстрировало, что они становятся неопределяемыми при лечении и часто обнаруживаются во время рецидива [41], что имеет очевидные клинические последствия. Однако в другом исследовании не удалось установить связь между антителами к LAMP-2 и PICG [42]. Некоторые исследователи предположили, что это различие в результатах может быть связано с критериями отбора пациентов и используемыми анализами [43].Тем не менее, эти наблюдения интригуют и заслуживают дальнейшего изучения. Наконец, антитела против плазминогена, обнаруженные у некоторых пациентов с AAV, связаны с повышенной восприимчивостью к тромбоэмболическим явлениям и большей тяжестью почечных и системных заболеваний [44, 45].
Несколько факторов окружающей среды теперь связаны с патогенезом PICG. Микробные факторы играют роль в инициировании аутоиммунного ответа посредством их имитации антигенов хозяина [40]. Предыдущие исследования показали, что пациенты с ГПД часто являются хроническими носителями Staphylococcus aureus через нос и что антимикробная терапия может уменьшить рецидивы [46, 47]. Инфекция S. aureus также может усиливать способность нейтрофилов образовывать NET при васкулите мелких сосудов [34]. Более свежие данные идентифицировали эпитоп LAMP-2 со 100% гомологией с фимбриальным адгезином (FimH), наблюдаемый у грамотрицательных бактерий [48]. Была выдвинута гипотеза, что иммунный ответ на FimH, наблюдаемый при уросепсисе, запускает антитела против LAMP-2 из-за молекулярной мимикрии.
Еще одна линия доказательств, подтверждающая роль микробных факторов, получена из исследований in vivo на животных , оценивающих роль toll-подобных рецепторов (TLR) в патогенезе PICG [49, 50].TLR — это класс рецепторов, присутствующих на лейкоцитах, которые способны распознавать инфекционные организмы и играют важную роль в создании врожденного иммунного ответа. Было обнаружено, что лигирование TLR4 играет роль в индукции AAV. Это приводит к стимуляции ответов Т-хелперов 17 (Th27) и Th2 посредством активации TLR2 и TLR9 соответственно [49].
Несколько немикробных факторов окружающей среды также были связаны с PICG. Кремнезем является известным фактором риска ANCA [51, 52]. Также известно, что некоторые препараты, такие как пропилтиоурацил, гидралазин, D-пеницилламин, цефотаксим, миноциклин, анти-TNF агенты, фенитоин и некоторые психоактивные агенты, вызывают ANCA-ассоциированные заболевания [53–56].
Роль аутоиммунных механизмов в паучиммунном CGN также подтверждается другой теорией, согласно которой первоначальный иммунный ответ генерируется против комплементарного пептида PR3 (cPR3) (генерируется антисмысловой цепью ДНК PR3) или скорее имитирует cPR3 чем против пептида PR3 [57–59]. Пациенты с заболеванием PR3-ANCA обладают не только циркулирующими антителами против смысловых пептидов PR3, но и отдельным набором антител против антисмысловых комплементарных пептидов PR3 (анти-cPR3).Иммунный ответ против cPR3 приводит к выработке антител против cPR3, которые, в свою очередь, генерируют антиидиотипические антитела, которые распознают не только идиотоп на антителах против cPR3, но также эпитоп на смысловом пептиде PR3 (исходный аутоантиген). Интересно, что ряд патогенов, таких как S. aureus , вирус Росс-Ривер и Entamoeba histolytica , имеют последовательности, сходные с пептидом cPR3, что делает их способными вызывать аутоиммунный ответ [58].Это обеспечивает еще одну связь между инфекцией и аутоиммунитетом при PICG.
Роль генетических факторов в патогенезе PICG очевидна из того факта, что не у каждого человека с факторами риска окружающей среды развивается болезнь. Также отмечается, что AAV чаще встречается в кавказской популяции. Понимание генетики AAV значительно улучшилось после публикации двух полногеномных ассоциативных исследований (GWAS) [60, 61]. Цель GWAS — исследовать большое количество однонуклеотидных полиморфизмов (SNP), которые покрывают большую часть генома человека.Интересно, что три основных подтипа AAV связаны с различными вариантами HLA, то есть гранулематоз с полиангиитом (Вегенера), GPA с HLA-DP1 , микроскопический полиангиит (MPA) с HLA-DQ и эозинофильный GPA (Churg-Strauss). с HLA-DRB4 . Также известно, что у пациентов с ГПД выше доля нейтрофилов с повышенной поверхностной экспрессией PR3 [62]. GWAS также выявили, что полиморфные варианты генов, кодирующих PR3 и его основной ингибитор, альфа-1-антитрипсин, сильно связаны с GPA, особенно с положительностью PR3-ANCA, независимо от клинического диагноза.Исследования подходов с использованием генов-кандидатов показали ассоциации с другими вариантами, вовлеченными в AAV, такими как те, которые принадлежат генам CTLA-4 и PTPN22 . Эти результаты еще не были воспроизведены в более крупных исследованиях [63–65].
Кроме того, важно обсудить роль иммунного ответа, опосредованного Т-клетками, в PICG. Широко известно, что CD4 + хелперные Т-клетки с секрецией гамма-интерферона участвуют в образовании гранулем. Гранулемы видны в основном в AAV PR3, а не в MPO AAV.Клетки Th27 играют главную роль в возникновении гранулематозного воспаления и повреждения сосудов в PR3 AAV [66]. Morgan et al. также показали уменьшение количества и функциональное нарушение регуляторных Т-клеток (Tregs) в GPA [67]. Наконец, согласно некоторым исследованиям, у пациентов с ANCA-опосредованным васкулитом нарушается функционирование Treg, а также присутствуют эффекторные Т-клетки, устойчивые к подавлению Treg [68].
В дополнение к продукции аутоантител В-клетки также обладают способностью представлять антигены Т-клеткам и могут модулировать ответы Т-клеток при васкулите мелких сосудов.Регуляторные В-клетки (Breg) представляют собой отдельные клетки субпопуляции В-клеток, которые регулируют действие популяции Т-клеток, секретируя ИЛ-10. Wilde et al. продемонстрировали уменьшение количества Breg как в активном, так и в покоящемся AAV [69]. Исследование также показало положительную корреляцию между Breg и Treg в AAV в состоянии покоя и что подавление Th2-клеток с помощью Breg может быть недостаточным при активном AAV.
Недавно были дополнительно выяснены патогенетические механизмы повреждения тканей при GPA, приводящие к седловидной деформации носа и разрушению орбиты [38, 70].Было признано, что фибробласты, выстилающие кость и хрящ, играют роль активированных эффекторных клеток деструкции ткани при GPA. В первой модели in vivo GPA, Kesel et al. подкожно коимплантировали образцы биопсии от пациентов с активным GPA или синуситом (контроль) со здоровым аллогенным носовым хрящом человека иммунодефицитным мышам [70]. Имплантаты GPA показали массивное разрушение коимплантированного человеческого хряща, тогда как разрушение хряща было лишь незначительным в контрольных образцах.Кроме того, разрушение хряща опосредовано человеческими фибробластами и может контролироваться кортикостероидами, подобно GPA у людей. Кроме того, при фиброзном заболевании легких было показано, что NETs способствуют дифференцировке и функции фибробластов, что указывает на то, что NET участвуют не только в воспалении, но и в результирующем фиброзе [38, 71].
6. Клинические проявления и естественный анамнез
Несмотря на немного более высокую специфичность, ANCA относится к слабиммунным RPGN, как анти-ДНК к системной красной волчанке.Микроскопический полиангиит (MPA), гранулематоз с полиангиитом (GPA), эозинофильный гранулематоз с полиангиитом (EGPA или синдром Чарджа-Стросса) и почечно-ограниченный малоиммунный серповидный GN (PICG) — все они связаны с ANCA. Термин «малоиммунный» RPGN охватывает все эти состояния. Общие неспецифические проявления системного воспалительного заболевания, такие как лихорадка, недомогание, анорексия, потеря веса, миалгия и артралгия, могут наблюдаться при любом из этих заболеваний. Клинические проявления каждой сущности различаются в зависимости от хроничности и локализации поражения.Пациенты без системного поражения могут обратиться позже в течение болезни. Гранулематозное поражение, особенно верхних дыхательных путей, является характерным признаком GPA, но не MPA; эозинофилия, астма и атопия обычно возникают при EGPA. В каждом из этих состояний у пациентов может быть легочное кровотечение, вызванное геморрагическим альвеолярным капилляритом, которое имеет лечебное и прогностическое значение [2]. Как упоминалось ранее, почечная недостаточность, наблюдаемая при PICG, обычно клинически проявляется как RPGN.Однако следует отметить, что пациенты с ГПД или МПА также могут иметь подострый или хронический нефрит. В одном исследовании, посвященном оценке клинических характеристик полулунного полумесяца с низким уровнем иммунитета, когорта из более чем 300 пациентов, обследованных при биопсии почек, имела средний возраст лет (от 2 до 92 лет), соотношение мужчин и женщин 1,0: 0,9. средняя концентрация креатинина в сыворотке крови в мг / дл (от 0,8 до 22,1 мг / дл) и протеинурия
Core Concepts — Внепеченочные состояния, связанные с гепатитом C — Оценка, стадия и мониторинг хронического гепатита C
Определение криоглобулинемии
Криоглобулинемия относится к присутствию одного (моноклонального) или нескольких (смешанных или поликлональных) белков крови в сыворотке, которые обратимо преципитируют in vitro при температурах ниже нормальной температуры тела (менее 37 ° C).[15] Белки крови, которые выпадают в осадок, называются криоглобулинами, и они снова растворяются при повторном нагревании сыворотки. Криоглобулины состоят либо из чистых иммуноглобулинов, либо из смеси иммуноглобулинов и комплемента [15].
Механизм заболевания
При смешанной криоглобулинемии, связанной с ВГС, заболевание органов-мишеней вызывается иммуноопосредованным механизмом. [15] В частности, иммунные комплексы, которые содержат частицы HCV, откладываются в стенках капилляров, венул или артериол, что приводит к активации эндотелия, стимуляции хемотаксических пептидов и воспалительной реакции; конечный результат — лейкоцитокластический васкулит.[16,17] У пациентов, у которых развивается криоглобулинемия, антигены ВГС вызывают хроническую стимуляцию В-лимфоцитов, которая, как считается, вызывает клональную экспансию В-клеток и выработку антител с потенциалом развития В-клеточной неходжкинской лимфомы. . [16]
Клинические проявления, связанные с криоглобулинемией
У большинства людей с хронической инфекцией ВГС и криоглобулинемией отсутствуют симптомы или неспецифические клинические проявления. Триада из пурпуры, миалгии и артралгии (триада Мельцера) является наиболее частым проявлением у лиц со смешанной криоглобулинемией, связанной с ВГС.[15,18] Примерно у 30% пациентов со смешанной криоглобулинемией развивается заболевание почек. [18] Дополнительные клинические признаки, которые могут развиться при смешанной криоглобулинемии, включают периферическую невропатию, язвы кожи и лимфопролиферативные расстройства. [19] Различные клинические синдромы могут быть связаны с криоглобулинемией. Наиболее частые проявления смешанной криоглобулинемии, связанной с ВГС, представлены в следующем списке: [15,17,18]
- Пальпируемая пурпура
- Хронические язвы ног
- Артралгии
- Слабость
- Миалгии
- Болезнь почек
- Периферическая невропатия
Классификация криоглобулинемии
Криоглобулинемия классически подразделяется на три типа в соответствии с системой классификации Бруэ 1974 г .; Обратите внимание, что тип I считается моноклональной криоглобулинемией, а типы II и III классифицируются как смешанная криоглобулинемия.[15,20]
- Криоглобулинемия I типа : Это заболевание состоит из изолированного моноклонального иммуноглобулина (IgM или IgG) и чаще всего возникает в сочетании с лимфопролиферативными нарушениями; Криоглобулинемия I типа составляет от 10 до 15% случаев криоглобулинемии.
- Криоглобулинемия II типа : Этот тип криоглобулинемии состоит из смешанных иммунных комплексов, обычно моноклональных IgM и поликлональных IgG. Этот тип криоглобулинемии чаще всего развивается у людей с хроническими вирусными инфекциями, такими как ВГС, вирус гепатита В и цитомегаловирус (ЦМВ), но также встречается у лиц с хроническими воспалительными состояниями, такими как системная красная волчанка, ревматоидный артрит и болезнь Шегрена. синдром.Криоглобулинемия 2 типа — наиболее распространенный тип криоглобулинемии, наблюдаемый у людей с инфекцией ВГС. Криоглобулины типа 2 обладают активностью ревматоидного фактора, что означает, что эти иммуноглобулины связываются с Fc-частью IgG.
- Криоглобулинемия III типа : Это заболевание состоит из смешанных иммунных комплексов, обычно образованных поликлональными IgM и IgG, и составляет от 25 до 30% случаев криоглобулинемии.
Связь между ВГС и смешанной криоглобулинемией
Во многих сообщениях показана тесная связь ВГС и смешанной криоглобулинемии, чаще всего криоглобулинемии типа II — более 90% людей со смешанной криоглобулинемией имеют признаки активной инфекции ВГС.[16,21,22] При смешанной криоглобулинемии, связанной с ВГС, иммунные комплексы, состоящие из иммуноглобулина и частиц ВГС, осаждаются во многих органах, включая кожу, почки и периферические нервные волокна. [15,17] Исследователи предположили, что распространение ревматоида активность фактора и криопреципитируемость ответственны за васкулит. Большинство пациентов со смешанной криоглобулинемией имеют признаки хронической инфекции HCV: исследования показали, что от 50 до 100% пациентов со случаями смешанной криоглобулинемии имеют инфекцию HCV.И наоборот, большинство людей с инфекцией ВГС не страдают смешанной криоглобулинемией. Лечение ВГС и достижение устойчивого вирусологического ответа (УВО) снижало риск развития проявлений смешанной криоглобулинемии. [23]
Криоглобулинемический васкулит
Термин «криоглобулинемический васкулит» ранее назывался эссенциальным криоглобулинемическим васкулитом, поскольку причина этого заболевания была неизвестна. [16] Ниже описаны основные особенности криоглобулинемического васкулита.Патофизиология криоглобулинемического васкулита
Криоглобулинемический васкулит считается системным васкулитом мелких сосудов.[17] При этом заболевании считается, что повреждение мелких сосудов происходит в результате отложения иммунных комплексов на стенке сосуда с последующей активацией каскада комплемента. [16] Только у 10-15% пациентов с криоглобулинемией развивается криоглобулинемический васкулит [16].
Проявления криоглобулинемического васкулита
Пациенты с хронической инфекцией ВГС, у которых развивается криоглобулинемический васкулит, чаще всего имеют кожные проявления, хотя может быть поражен любой орган.Пальпируемая пурпура очевидна у более чем 90% пациентов с криоглобулинемическим васкулитом и обычно является первым признаком криоглобулинемии. [16,17] Обнаружение пальпируемой пурпуры у пациента с хроническим гепатитом С должно вызвать немедленное подозрение на криоглобулинемический васкулит.
Диагностика криоглобулинемического васкулита
Конкретные критерии или классификация криоглобулинемического васкулита еще не определены. [15] Диагноз обычно ставится на основании анамнеза, кожной пурпуры, низкого уровня комплемента, присутствия криоглобулинов в сыворотке и гистологии, которая показывает воспаление мелких сосудов с иммунными отложениями, обнаруженными в стенках сосудов.[15]
Лечение криоглобулинемического васкулита, связанного с ВГС
Подход к лечению криоглобулинемического васкулита, связанного с ВГС, сложен и зависит от тяжести криоглобулинемии и поражения органов-мишеней. Из-за сложности и потенциальной серьезности этого расстройства лечение должно проводиться или проводиться совместно с врачом, имеющим опыт в этой области. Три компонента терапии, которые могут быть использованы при лечении криоглобулинемического васкулита, связанного с ВГС, включают: (1) противовирусную терапию хронической инфекции ВГС, (2) обычные иммунодепрессанты, (3) биологические методы лечения, которые действуют как удаление В-клеток. моноклональные антитела и (4) плазмаферез.[15,16,24] В целом подход к лечению зависит от степени тяжести заболевания, которая может варьироваться от легкой до умеренной (обычно с поражением только кожи), до тяжелой (с поражением органов) и опасной для жизни. (обычно быстро прогрессирует). [15] Цели лечения — быстрое купирование активного васкулита и предотвращение дальнейших рецидивов криоглобулинемического васкулита.
Методы лечения
Ниже перечислены методы лечения, которые часто используются при лечении пациентов с криоглобулинемическим васкулитом.
- ПППД-терапия хронической инфекции ВГС : Имеющиеся данные позволяют предположить, что у пациентов с хроническим криоглобулинемическим васкулитом с хронической ВГС-инфекцией частота УВО превышает 90% при использовании ПППД. [24,25,26] К сожалению, успешное лечение ВГС. терапия ПППД часто не вызывает ремиссии криоглобулинемического васкулита. [24,25,26] Таким образом, ПППД-терапия инфекции ВГС у лиц с криоглобулинемическим васкулитом должна рассматриваться как компонент общей стратегии лечения для успешного лечения этого тяжелого заболевания.
- Иммунодепрессанты : Обычно используемые иммунодепрессанты включают высокие дозы кортикостероидов, цитотоксические агенты (например, циклофосфамид) и мофетил микофенолят [15]. Кортикостероиды используются как компонент лечения большинства пациентов с криоглобулинемическим васкулитом, причем диапазон дозировки коррелирует с тяжестью заболевания. Использование цитотоксических агентов, таких как циклофосфамид, обычно используется в случаях, угрожающих жизни. Микофенолятмофетил — это иммунодепрессивное лекарство, которое более избирательно, чем циклофосфамид, подавляет пролиферацию и функции лимфоцитов.Микофенолятмофетил использовался в качестве менее токсичной альтернативы циклофосфамиду, но данные по этому подходу ограничены [18].
- Моноклональные антитела, истощающие В-клетки : Клональная экспансия В-клеток является ключевым аспектом смешанной криоглобулинемии. Ритуксимаб, моноклональное антитело к CD20, изменяет динамику В-клеток, удаляя увеличенные клоны у пациентов с криоглобулинемическим васкулитом. Кроме того, индуцированное ритуксимабом истощение В-клеток снижает количество клонов В-клеток, продуцирующих криоглобулины.[15,16] Это лечение может также обеспечить защиту от факторов, потенциально участвующих в патогенезе злокачественной трансформации B-клеток. Многочисленные исследования показали улучшение результатов при использовании ритуксимаба с лечением ВГС или без него у пациентов с криоглобулинемическим васкулитом. [16,24,27] Лечение ритуксимабом должен назначать эксперт (или по согласованию с экспертом), имеющий опыт с применением ритуксимаба.
- Плазмаферез : Некоторые эксперты использовали плазмаферез в качестве дополнительной терапии у пациентов с быстро прогрессирующим или опасным для жизни криоглобулинемическим васкулитом.Целью плазмафереза является удаление циркулирующих криоглобулинов для получения немедленного эффекта, но этот подход не влияет на долгосрочное прогрессирование заболевания. [18]
Красная волчанка — Диагностика, симптомы и лечение
Волчанка , пожалуй, самая типичная из аутоиммунных заболеваний . Он богат клиническими данными и остается плохо изученным. Узнайте, что такое волчанка, и какие органы поражены больше всего.Красная волчанка Заболевание характеризуется выработкой различных аутоантител или антител, которые атакуют сам организм.При волчанке наиболее распространены аутоантитела против ядра клетки и против собственной ДНК пациента. Итак, вы уже можете представить себе ущерб, который может вызвать болезнь, поскольку она создает антитела против структур, необходимых для нашей жизни.
Неизвестно, почему организм начинает вырабатывать эти антитела. Вероятно, существует комбинация генетических факторов, потому что заболевание чаще встречается при наличии положительного семейного анамнеза и еще не выявленных экологических факторах.
Волчанка поражает кожу, почки, суставы, легкие, сердце, кровеносные сосуды, клетки крови, нервную систему, желудочно-кишечный тракт и другие органы и ткани. Заболевание в девять раз чаще встречается у женщин, чем у мужчин, и возникает в любом возрасте, причем чаще в возрасте от 20 до 40 лет.
Волчанка — заболевание, трудно поддающееся лечению, и в тяжелых случаях требует интенсивного применения иммунодепрессантов. Хотя вылечить это непросто, некоторые результаты показывают, как медицина продвинулась вперед за последние десятилетия.В 50-е годы более 60% пациентов умирали, не дожив до пяти лет. Сегодня 80% живут по крайней мере двадцать лет.
Симптомы красной волчанки
Опишем наиболее частые симптомы волчанки. Это не означает, что у каждого пациента с волчанкой должны быть все проявления, описанные ниже. Бывают случаи волчанки с небольшим количеством симптомов и случаи с множеством.Соединения
Артрит коленного сустава Поражение суставов встречается у 95% пациентов с волчанкой.Двумя основными проявлениями являются артрит (воспаление суставов) и артралгия (боль в суставах без воспаления). Эти симптомы часто появляются за годы до постановки окончательного диагноза волчанки.
Артрит и артралгия волчанки имеют некоторые характеристики, которые отличают их от других заболеваний, поражающих также суставы:
- Они мигрирующие, т. Е. Боли в суставах переходят в точку между 24-48 часами. В один день могут болеть колени, в другой — кулаки, на третий — плечо, потом спина до колена и т. Д.
- Поражение симметричное, то есть когда болит одно колено, болит и другое.
- Обычно присутствует полиартрит или полиартралгия, что означает одновременную боль в нескольких суставах. Поражение одного сустава говорит в пользу других диагнозов, таких как подагра или септический артрит.
- Вообще сустав болит намного больше, чем может показаться.
Чаще всего поражаются суставы рук и пальцев (фаланги), запястья и колени.
Кожа
Другой очень часто поражаемый орган — это кожа. До 80% пациентов с волчанкой имеют какой-либо тип поражения кожи, особенно в местах, подверженных воздействию солнца.
Сыпь на лице Типичные поражения включают сыпь на скулах или на крыльях бабочки. Как видно на фотографиях, это красноватая область, которая покрывает щеки и нос. Малярная сыпь появляется, по крайней мере, у 50% пациентов, обычно длится несколько дней, и всегда есть возможность обратиться за помощью. Продолжительное воздействие флуоресцентных ламп также может вызвать волчанку.
Еще одним распространенным поражением кожи является дискоидная волчанка, которая характеризуется округлыми и красноватыми бляшками, чаще всего на лице, шее и волосистой части головы. Дискоидная волчанка может быть частью системной волчанки или быть единственным проявлением заболевания. В последнем случае прогноз лучше, так как нет вовлечения других органов.
Пациенты с изолированной дискоидной волчанкой имеют 10% шанс прогрессирования до системной красной волчанки. Чем более многочисленны дискоидные поражения, тем выше риск их распространения на другие органы.
Другим распространенным поражением кожи является выпадение волос, которое может поражать не только кожу головы, но и брови, ресницы и бороду. Однако язвы в полости рта, похожие на язвы, обычно безболезненны.
Феномен Рейно — это изменение цвета конечностей, вызванное спазмом кровеносных сосудов. Спазм артерий вызывает внезапную нехватку крови, покидающей бледную руку. Если спазм не проходит, из-за нехватки крови бледная рука становится фиолетовой. Эта ишемия может вызвать сильную боль.Когда спазм исчезает, быстрое возвращение крови делает кожу горячей и красной.
Феномен Рейно не является исключительным явлением при волчанке и может возникать даже у людей без какого-либо диагностированного заболевания. Холод, сигареты и кофеин могут быть триггерами этого симптома.
Почки
До 75% пациентов с волчанкой в ходе болезни получают повреждение почек.
Наиболее частая находка — потеря белка с мочой, называемая протеинурией. Другие важные выводы:
- Гематурия (кровь в моче), которая может быть макро- или микроскопической
- Повышение уровня креатинина в крови, указывающее на почечную недостаточность
- Гипертония
Гломерулонефрит Наиболее частым заболеванием почек является гломерулонефрит (повреждение почечных клубочков), вызванный аутоантителами.Существует пять основных типов гломерулонефрита при волчанке, объединенных термином волчаночный нефрит. Они есть:
- Волчанка I класса — минимальный мезангиальный гломерулонефрит
- Волчанка II класса — мезангиальный пролиферативный гломерулонефрит
- Волчанка III класса — очаговый пролиферативный гломерулонефрит
- Волчанка IV класса — диффузный пролиферативный гломерулонефрит
- Волчанка V класса — мембранозный гломерулонефрит
Классы III, IV и V являются наиболее серьезными, причем диффузный пролиферативный гломерулонефрит (класс IV) имеет худший прогноз.Минимальный мезангиальный гломерулонефрит (класс I) более мягкий.
Волчаночный нефрит классифицируется по классам, поскольку каждое из этих поражений требует различных методов лечения и прогноза. Поэтому очень важно определить, какой тип волчаночного нефрита у пациента.
Только на основании клинических данных невозможно установить, какой тип волчаночного нефрита существует, поскольку протеинурия, гематурия и почечный нефрит являются частыми находками при типах II, III, IV и V. Таким образом, все пациенты с волчанкой проявляют признаки почек. Необходимо провести биопсию почек, чтобы определить, какой тип повреждения клубочков вызывает аутоантитела.Также возможно, что у пациента одновременно имеется более одного класса волчаночного нефрита.
Классы I и II обычно не требуют специального лечения, однако классы III, IV и V имеют худший прогноз и высокий риск терминальной почечной недостаточности и обычно лечатся иммунодепрессантами. Наиболее распространены кортикостероиды (кортизон), циклофосфамид, циклоспорин, микофенолят мофетил и азатиоприн. Не получающие лечения пациенты или пациенты, у которых отсутствует хорошая реакция на лекарства, неизбежно нуждаются в гемодиализе.
Кровь
Аутоантитела могут также атаковать клетки крови, вырабатываемые костным мозгом. Наиболее распространенной является анемия, которая возникает не только из-за разрушения красных кровяных телец, но и из-за подавления их продукции в костном мозге.
Лейкопения Еще одно частое гематологическое изменение — уменьшение лейкоцитов (лейкоцитов), которое называется лейкопенией. Механизм такой же, как и при анемии, то есть разрушение и подавление его выработки. Следуя тем же рассуждениям, мы можем обнаружить снижение количества тромбоцитов, называемое тромбоцитопенией.
Когда наблюдается спад в трех линиях крови (эритроциты, лейкоциты и тромбоциты) одновременно, мы называем это панцитопенией.
Любое из этих изменений может быть фатальным из-за тяжелой анемии, инфекций из-за низкого количества лейкоцитов или спонтанного кровотечения из-за падения тромбоцитов. Лимфатический узел и селезенка также часто встречаются при волчанке, и их можно спутать с лимфомой.
Еще одна распространенная проблема при волчанке — появление тромбоза. Синдром антифосфолипидных антител — это заболевание, которое часто встречается у пациентов с волчанкой и связано с образованием множественных тромбов как в артериях, так и в венах, что может привести к таким состояниям, как инсульт, инфаркт почек, ишемия конечностей, венозный тромбоз ног. и легочная эмболия.
Суда
Помимо тромбоза, возникающего при синдроме антифосфолипидных антител, аутоантитела волчанки могут напрямую атаковать кровеносные сосуды, вызывая так называемый васкулит. Васкулит может поражать любой сосуд в организме и может повредить кожу, глаза, мозг, почки и т. Д.
Нерв
Волчанка может проявляться неврологическими и психиатрическими синдромами. Неврологические травмы возникают из-за тромбоза и васкулита, которые в конечном итоге вызывают инсульт.
Психиатрические расстройства также могут возникать из-за волчанки.Наиболее распространены психоз, при котором у пациента появляются странные мысли и галлюцинации, и слабоумие с прогрессирующей потерей памяти и способности выполнять простые задачи.
Прочее
Фактически любой орган может быть поражен волчаночными антителами. Перикардиальный выпот и плевральный выпот (вода в плевре и перикарде) являются частыми находками. Также могут возникнуть поражения желудочно-кишечного тракта, легких, сердечные приступы, поражения сердечного клапана и панкреатит.
Другие признаки, очень часто встречающиеся при волчанке, — это усталость (утомляемость), непреднамеренная потеря веса и постоянная субфебрильная температура.
АНА Диагноз волчанки ставится на основании клинических данных и определения антител в крови. Основным является ANA (антинуклеарные антитела), антитело против белков ядра клетки.
ANA почти всегда присутствует при системной волчанке, но может также возникать при других аутоиммунных заболеваниях, таких как гипотиреоз Хашимото, ревматоидный артрит, склеродермия и т. Д.
АНА, однако, может быть положительным у нормальных людей.Поэтому их наличие не обязательно подтверждает болезнь, но их отсутствие почти на 100% исключает диагноз волчанки. Случаи изолированной дискоидной волчанки без системного поражения являются исключением и не могут иметь положительных антител к ANA. Наличие двух других антител тесно связано с системной волчанкой: Anti-Sm и анти-ДНК (ds). Наличие типичных симптомов, положительного результата на ANA и одного из этих двух антител закрывает диагноз волчанки.
Волчанку обычно лечат кортикостероидами, хлорохином и противовоспалительными препаратами.В более тяжелых случаях требуются более тяжелые препараты, такие как циклофосфамид, микофенолятмофетил, азатиоприн и кортикостероиды в очень высоких дозах.Бениста В 2011 году препарат под названием Белимумаб (Бениста) был одобрен для лечения волчанки. Этот препарат представляет собой синтетические антитела против В-лимфоцитов, клеток, вырабатывающих защитные аутоантитела от волчанки. Белимумаб можно использовать в сочетании с существующими лекарствами и, по-видимому, снижает активность заболевания и количество рецидивов. Однако важно отметить, что исследования с этим препаратом не включали пациентов, которые ранее принимали циклофосфамид или имели неврологические или почечные повреждения при волчанке.Это означает, что препарат был протестирован только на пациентах с более легкими формами заболевания. Другой результат исследований показал, что препарат был гораздо менее эффективен у пациентов африканского происхождения, что не казалось хорошим вариантом для этой этнической группы.
В очень тяжелых случаях, таких как васкулит с диффузным легочным кровотечением, неврологические нарушения и т. Д., Вам может потребоваться лечение плазмаферезом для уменьшения количества циркулирующих аутоантител.
Пациенты с волчанкой могут переключать фазы кризиса и стадии ремиссии.Некоторые пациенты могут годами оставаться без симптомов. Некоторые факторы способствуют реактивации заболевания у пациентов в стадии ремиссии:
- Воздействие солнца
- Физическое или психическое напряжение
- Беременность
- Инфекции
- Сигареты
- Прерывание лечения
.

