Антибиотики при колите : названия и способы применения
Какие антибиотики пить при колите?
Больные, страдающие проблемами с кишечником, часто задаются вопросом: а какие антибиотики пить при колите? Наиболее действенными являются те антибактериальные препараты, которые плохо всасываются в кишечнике в кровь и практически в неизменном виде и в больших концентрациях выводятся из организма с фекалиями.
Также хороши антибактериальные лекарственные средства, которые обладают широким спектром действия, потому что, во-первых, не всегда можно с точностью определить, какая микрофлора была причиной колита. Кроме того, при тяжёлых формах заболевания возможны осложнения в виде появления иных инфекций кишечника. Поэтому важно выбрать наиболее действенное средство против как можно большего количества видов патогенной микрофлоры.
Антибиотики, которые плохо всасываются в кровь, хороши ещё и тем, что они обладают малой токсичностью для организма. Если принимать их перорально, то это сможет уберечь больного от большого количества побочных эффектов.
Конечно, не всегда и не всем показаны именно эти препараты, поэтому ниже будет приведен перечень наиболее действенных лекарственных средств при колите, обладающих разными характеристиками.
Названия антибиотиков при колите
В настоящее время существует множество антибактериальных препаратов, которые можно использовать для лечения проблем пищеварительной системы, вызванных бактериальной инфекцией. И, всё же, рекомендуем остановиться на проверенных временем препаратах, которые доказали свою эффективность в борьбе с патогенной микрофлорой.
Названия антибиотиков при колите, которые рекомендованы специалистами, следующие:
- Левомицетин.
- Тетрациклин.
- Олететрин.
- Полимиксина-в сульфат.
- Полимиксина-м сульфат.
- Стрептомицина сульфат.
- Неомицина сульфат.
- Мономицин.
Стоит понимать, что необходимость приёма любого из вышеуказанных препаратов будет определять специалист, взвесив все преимущества и недостатки каждого лекарственного средства для лечения конкретного заболевания. При этом нужно учитывать индивидуальные особенности пациента, наличие у него противопоказаний к выбранному препарату, а также высокой чувствительности к активным компонентам лекарственного средства, включая аллергические реакции. Кроме того, перед началом терапии с помощью выбранного медикамента важно проверить, насколько патогенная микрофлора кишечника чувствительна к активным веществам лекарства. Поэтому не стоит заниматься самолечением и назначать себе приём препарата самостоятельно без консультации и обследования у специалиста.
При этом нужно учитывать индивидуальные особенности пациента, наличие у него противопоказаний к выбранному препарату, а также высокой чувствительности к активным компонентам лекарственного средства, включая аллергические реакции. Кроме того, перед началом терапии с помощью выбранного медикамента важно проверить, насколько патогенная микрофлора кишечника чувствительна к активным веществам лекарства. Поэтому не стоит заниматься самолечением и назначать себе приём препарата самостоятельно без консультации и обследования у специалиста.
Антибиотики при язвенном колите
Язвенный колит является заболеванием, которое характеризуется воспалительными процессами в толстом кишечнике с образованием в нём язв. При этом поражается, чаще всего, слизистый эпителий прямой кишки, а также иных отделов толстого кишечника. Заболевание является рецидивирующим или непрерывным хроническим.
Язвенный колит возникает, как правило, по трём причинам: из-за нарушений иммунологического характера, вследствие развития кишечного дисбактериоза и благодаря изменённому психологическому состоянию больного. Антибиотики при язвенном колите могут применять только во втором случае, когда причиной заболевания служит какая-либо кишечная инфекция.
Антибиотики при язвенном колите могут применять только во втором случае, когда причиной заболевания служит какая-либо кишечная инфекция.
Кишечный дисбактериоз выявляется у семидесяти – ста процентов больных, страдающих язвенным колитом. И чем тяжелее сам патогенный процесс, тем сильнее проявляется язвенный колит и тем чаще его можно обнаружить. Дисбактериоз в кишечнике принимает непосредственное участие в развитии язвенных колитов. Это происходит потому, что условно-патогенная кишечная микрофлора вырабатывает в процессе своей жизнедеятельности различные токсические производные и так называемые «ферменты агрессии». Всё это приводит к поражению кишечных стенок и повреждает клетки эпителия. Данные микроорганизмы способствуют тому, что в кишечнике и организме человека возникает суперинфекция, микробная аллергия и аутоиммунные процессы нарушения его деятельности.
В данном случае показано применение различных антибактериальных средств, которые устранят первопричину заболевания.
[25], [26], [27], [28], [29], [30], [31], [32], [33]
Способ применения и дозы
Для того, чтобы использовать каждый препарат, необходимо внимательно прочитать дозировку, которая указана в инструкции. Хотя в большинстве случаев способ применения и дозы назначает специалист после консультации больного. Не следует заниматься самолечением и самостоятельно назначать себе какой-либо препарат из группы антибиотиков.
Обычно, приём лекарственных средств происходит следующим образом.
Таблетированная форма препарата предназначена для перорального использования. Таблетка глотается целиком, не раскусывается и не измельчается. Её необходимо запивать большим количеством жидкости.
Приём медикамента производится за полчаса до употребления пищи. Если у больных наблюдается тошнота от принятого препарата, то его рекомендуют использовать через час после окончания приёма пищи. Лекарство принимается через промежутки времени, которые должны быть равными.
Лекарство принимается через промежутки времени, которые должны быть равными.
Курс лечения и дозировка препарата назначается специалистом, поскольку является индивидуальной для каждого больного. Обычно взрослая доза составляет от двухста пятидесяти до пятисот миллиграммов на каждый приём лекарства, которые бывают от трёх до четырёх раз в сутки. Максимальная суточная доза медикамента составляет четыре грамма.
Дети от трёх до восьми лет принимают препарат по сто двадцать пять миллиграммов от трёх до четырёх раз в сутки. Дети от восьми до шестнадцати лет могут использовать лекарство в дозе по двести пятьдесят миллиграммов три или четыре раза в день.
Обычный курс терапии занимает от семи до десяти дней. Если препарат хорошо переносится пациентом и не имеется побочных проявлений, то курс лечения может увеличиться до четырнадцати дней.
Порошковая форма препарата используется в качестве основы для раствора, который применяется в качестве внутримышечных и внутривенных инъекций, то есть парентерально.
Раствор готовится следующим образом: содержимое флакона растворяется в двух или трёх миллилитрах воды для инъекций. Также можно использовать такое же количество 0,25- или 0,5-процентного раствора новокаина. Раствор Левомицетина вводится глубоко в ягодичную мышцу, а именно в её верхний квадрант.
Раствор для внутривенного струйного использования готовится следующим образом: содержимое флакона нужно растворить в десяти миллилитрах воды для инъекций или в таком же количестве 5- или 40-процентном растворе глюкозы. Длительность инъекции составляет промежуток от трёх минут, причём они проводятся через равное количество времени.
Курс лечения препаратом и дозировка рассчитывается специалистом, исходя из индивидуальных особенностей больного. Обычная разовая доза составляет от пятиста до тысячи миллиграммов, которые принимаются по два или три раза в сутки. Максимальное количество медикамента составляет четыре грамма в день.
Дети и подростки от трёх до шестнадцати лет могут использовать лекарство два раза в сутки в количестве двадцати миллиграммов на каждый килограмм тела больного.
Предварительно нужно определить, насколько патогенная микрофлора больного чувствительна к препарату. Лекарственное средство используется перорально.
Взрослые принимают по двести пятьдесят миллиграммов каждые шесть часов. Суточная доза может максимально может составить два грамма. Для пациентов детского возраста от семи лет препарат назначается по двадцать пять миллиграммов каждые шесть часов. Капсулы глотаются без разжёвывания.
Таблетки тетрациклина-депо назначаются взрослым по одной штуке каждые двенадцать часов в первые сутки, а в последующие – по одной штуке в сутки (375 миллиграммов). Дети принимают препарат в первый день по одной штуке каждые двенадцать часов, а затем в последующие дни – по одной штуке в день (120 миллиграммов).
Суспензии предназначены для детей в количестве от двадцати пяти до тридцати миллиграммов на один килограмм веса в сутки, данное количество лекарства распределяется на четыре приёма.
Сиропы взрослым применяются по семнадцати миллилитров в день, разделённые на четыре приёма. Для этого используется один-два грамма гранул. Дети принимают сироп в количестве двадцати – тридцати миллиграммов на один килограмм веса ребёнка. Этот объём препарата разделяют на четыре суточных приёма.
Препарат принимается пероральным способом. Наилучший способ – использовать лекарственное средство за полчаса до приёма еды, при этом препарат нужно запивать большим количеством питьевой воды в объёме до двухста миллилитров.
Капсулы глотаются, нельзя разрушать целостность их оболочек.
Курс лечения и дозировка препарата определяется специалистом, исходя из особенностей больного и характера его заболевания.
Обычно взрослые и подростки принимают по одной капсуле препарата четыре раза в сутки. Лучше всего это делать через одинаковые временные промежутки, например через шесть часов. Тяжёлая форма заболевания является показанием к увеличению дозировки препарата. Максимально можно принимать в сутки до восьми капсул. Средний по продолжительности курс лечения составляет от пяти до десяти суток.
Средний по продолжительности курс лечения составляет от пяти до десяти суток.
- Полимиксина-в сульфат.
Перед приёмом препарата важно определиться с наличием чувствительности к данному средству у патогенной микрофлоры, спровоцировавшей заболевание.
Внутримышечное и внутривенное (капельное) введение происходит только в стационарных условиях под наблюдением специалистов.
Для внутримышечного способа требуется от 0,5 до 0,7 миллиграммов на каждый килограмм веса больного, которые используются три или четыре раза в сутки. Максимальная суточная доза составляет не более двухста миллиграммов. Детям препарат вводится от 0,3 до 0,6 миллиграммов на один килограмм веса ребёнка три-четыре раза в сутки.
Внутривенное введение требует двадцать пять – пятьдесят миллиграммов препарата растворить в двухста-трёхста миллилитрах пятипроцентного раствора глюкозы. Затем раствор вводится капельным способом при скорости шестдесят-восемьдесят капель в минуту. Максимальная доза для взрослых в сутки – до ста пятидесяти миллиграммов препарата.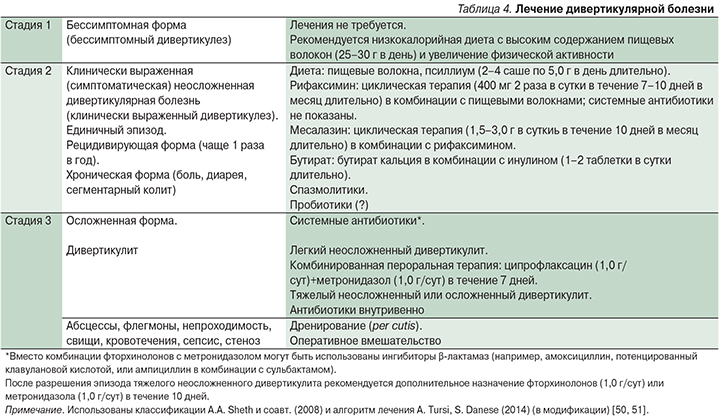 Дети получают внутривенно по 0,3 – 0,6 миллиграммов препарата на один килограмм веса ребёнка, который разводится тридцати-ста миллилитрах 5-10-процентного раствора глюкозы. При нарушенных почечных функциях дозировка препарата уменьшается.
Дети получают внутривенно по 0,3 – 0,6 миллиграммов препарата на один килограмм веса ребёнка, который разводится тридцати-ста миллилитрах 5-10-процентного раствора глюкозы. При нарушенных почечных функциях дозировка препарата уменьшается.
Внутрь лекарственное средство используется в форме водного раствора. Взрослые принимают по 0,1 грамму через каждые шесть часов, дети – по 0,004 грамма на каждый килограмм массы тела ребёнка три раза в сутки.
Курс лечения препаратом составляет от пяти до семи дней.
- Полимиксина-м сульфат.
Перед применением необходимо проверить, насколько патогенная микрофлора, вызвавшая болезнь, чувствительна к действию препарата.
Взрослым показано использование лекарства по пятьсот миллиграмм – одному грамму от четырёх до шести раз в сутки. Максимальное суточное количество препарата – два или три грамма. Курс лечения составляет пять – десять дней.
Детская доза медикамента в сутки составляет: для детей трёх — четырёх лет – сто миллиграмм на один килограмм мысы тела ребёнка, что разделяется на три или четыре приёма; для детей пяти – семи лет – 1,4 грамма в сутки; для детей восьми – десяти лет – 1,6 грамма; для детей одиннадцати – четырнадцати лет – два грамма в сутки. Курс лечения определяется характером и тяжестью заболевания, но не менее пяти дней и не более десяти суток.
Курс лечения определяется характером и тяжестью заболевания, но не менее пяти дней и не более десяти суток.
Рецидивы заболевания могут вызвать дополнительную необходимость применения препарата после перерыва в три-четыре дня.
- Стрептомицина сульфат.
Внутримышечное введение препарата предполагает разовое применение в количестве пятиста миллиграммов – одного грамма лекарства. Суточное количество медикамента составляет один грамм, максимальная суточная доза – два грамма.
Больные, которые имеют массу тела меньше, чем пятьдесят килограммов и люди, старше шестидесяти лет, могут принимать только до семидесяти пяти миллиграммов препарата в сутки.
Детская и подростковая доза в сутки составляет пятнадцать – двадцать миллиграммов на каждый килограмм веса ребёнка. Но в сутки нельзя использовать более половины грамма препарата для детей, а для подростков – более грамма.
Суточная доза препарата разделяется на три или четыре введения, с интервалами между инъекциями в шесть – восемь часов. Обычный курс терапии занимает от семи до десяти дней, максимальный срок лечения – четырнадцать дней.
Обычный курс терапии занимает от семи до десяти дней, максимальный срок лечения – четырнадцать дней.
- Неомицина сульфат.
Важно перед использованием медикамента протестировать патогенную микрофлору на наличие чувствительности к препарату.
Внутрь используется в таблетированной форме и в растворах.
Для взрослых разовое использование возможно в виде ста или двухста миллиграммов, суточное количество препарата составляет четыре миллиграмма.
Грудные дети и дошкольники могут принимать препарат в количестве четырёх миллиграммов на один килограмм массы тела ребёнка. Данное количество препарата разделяют на два суточных приёма. Терапия может длиться в течение пяти, максимум – семи суток.
Грудным детям рекомендуется применять раствор лекарства, который готовится из расчёта – один миллилитр жидкости на четыре миллиграмма препарата. При этом ребёнок может принимать столько миллилитров раствора, сколько килограммов он весит.
Лекарственное средство необходимо проверить на эффективность по отношению к микроорганизмам, вызвавшим заболевание.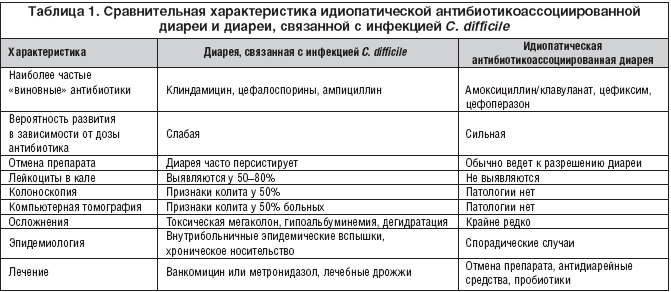
Перорально назначается взрослым по двести пятьдесят миллиграммов препарата, которые нужно принимать от четырёх до шести раз в сутки. Дети принимают от десяти до двадцати пяти миллиграммов на один килограмм веса в сутки, разделённых на два-три приёма.
Внутримышечным способом препарат используется взрослым по двести пятьдесят миллиграммов три раза в день. Детская доза – четыре или пять миллиграммов на один килограмм веса ребёнка, которые распределяют на три раза использования в сутки.
[34], [35], [36], [37], [38], [39], [40], [41]
основные средства и правила приёма
Колит – воспаление кишечника, различающееся по течению, клиническим признакам, степени поражения слизистой. Препараты для лечения колита кишечника подбираются врачом по индивидуальному плану на основе результатов анализов и аппаратных обследований. Направленность терапии – снятие воспаления, нормализация работы кишечника, облегчение симптомов заболевания.
Антимикробные средства при колите
Лечение колита кишечника медикаментами начинается с назначения антимикробных препаратов. В распоряжении врачей обширный перечень средств от колита:
В распоряжении врачей обширный перечень средств от колита:
- сульфаниламиды;
- нитрофураны;
- хинолоны;
- антибиотики.
Лечение колита медикаментами преследует цель – устранить причину воспаления (патогенных и условно-патогенных микробов). Каждый вид микробов чувствителен к определённому препарату. Поэтому для выбора самого эффективного средства проводят анализ чувствительности бактериальной флоры к медикаментам.
Сульфаниламиды
Терапию Фталазолом, Фтазином, Сульгином проводят при язвенном колите, дизентерии, обсеменении кишечной палочкой. Таблетки медленно всасываются из кишечника при пероральном приёме, создавая высокую концентрацию антимикробного средства. Противопоказаны сульфаниламиды беременным, кормящим, детям до 3-х лет, людям с больными почками.
Нитрофураны
Антибактериальная активность нитрофуранов распространяется на лямблии, шигеллы, клостридии, сальмонеллы, холерный вибрион. Капсулы Энтерофурила помогут при антибиотик-ассоциированном колите. Они подавляют развитие клостридий – возбудителей псевдомембранозного колита. Разрешён Энтерофурил детям с 1 месяца в форме суспензии. Капсулы 200 мг назначают взрослым по 4 раза за сутки на протяжении недели. Беременным и кормящим рекомендуется применять по веским показаниям.
Капсулы Энтерофурила помогут при антибиотик-ассоциированном колите. Они подавляют развитие клостридий – возбудителей псевдомембранозного колита. Разрешён Энтерофурил детям с 1 месяца в форме суспензии. Капсулы 200 мг назначают взрослым по 4 раза за сутки на протяжении недели. Беременным и кормящим рекомендуется применять по веским показаниям.
Хинолоны
Хинолоны – сравнительно новая группа противомикробных средств. Микроорганизмы пока не выработали устойчивость к хинолонам. Медикаментозное лечение колита этой группой препаратов избавляет от сальмонелл, шигелл, холеры, стафилококков. Применяются в лечении хронического колита Нолицин, Софазин, Медоциприн.
Антибиотики
Антибиотики при колите нужны с широким спектром действия. Новое поколение препаратов – полимиксины. Полимиксин В принимают для устранения сальмонелл, шигелл, клебсиелл, холеры. Лечение у взрослых колита Полимиксином В происходит в условиях стационара.
Для домашней антибиотикотерапии врач назначает:
- Левомицетин – помогает избавиться от острого и хронического воспаления, вызванного кишечной палочкой, сальмонеллой, стрептококками, стафилококками.
 Пьётся лекарство за полчаса до еды 3 раза за сутки. Курс лечения – 8 дней. Детям до 2-х лет, будущим и кормящим мамам не назначают.
Пьётся лекарство за полчаса до еды 3 раза за сутки. Курс лечения – 8 дней. Детям до 2-х лет, будущим и кормящим мамам не назначают. - Неомицин – лекарственный препарат из группы аминогликозидов. При приёме внутрь плохо всасывается, влияя преимущественно на микрофлору в кишечнике. Неомицин употребляют по рецепту врача из-за большого числа побочных действий.
- Альфа-Нормикс – лекарство устраняет избыточный рост патогенных бактерий, так как практически всё остаётся в тонкой и толстой кишке. Можно лечить колит кишечника у женщин во время беременности и лактации. Пить лекарство взрослым и детям от 12 лет показано по 1 таблетке через каждые 8 часов. Применяют антибиотик на протяжении недели.
Лечение колита медикаментами, особенно антибиотиками, происходит под контролем врача-гастроэнтеролога. Дозировка препаратов, длительность лечения колита, подбор эффективных медикаментов осуществляется строго индивидуально. Бессистемное употребление антибиотиков грозит осложнением воспалительного процесса антибиотик-ассоциированным колитом (ААК).
Антигельминтные средства при колите
Случается, воспаление кишечника вызывают паразитические черви – нематоды, острицы, аскариды. Выгнать паразитов можно применением медикаментов Немозол, Вермокс. Применяют средства от глистов у взрослых и детей с 2-3 лет по одной таблетке однократно, при необходимости повторяют через неделю. Средства от глистов токсичны для печени. Нельзя одновременно с противогельминтной терапией употреблять жирную еду, пить алкоголь, пользоваться слабительными.
Снятие боли и спазмов
Если антибиотики влияют на причину болезни, то спазмолитики устраняют болезненные спазмы воспалённого кишечника. Действие лекарств направлено на расслабление гладкой мускулатуры кишечника.
Но-Шпа – наиболее известный спазмолитик на базе дротаверина. Таблетки Но-Шпы используют после приёма пищи при приступах спастических болей в животе по 1-2 штуки до 3-х раз за сутки. Лечение продолжается максимум 2-3 дня. Если боль не стихает, обращаются к врачу.
Дюспаталин – влияет на мускулатуру кишечника напрямую, в большей мере действуя на толстый кишечник. Перистальтика не страдает, кишечник работает в нормальном режиме. Не проникает в грудное молоко, не оказывает токсичного действия на плод. Принимают утром и вечером за 20 минут до еды, запивая водой. Дюспаталин влияет на способность управления автомобилем и другие виды деятельности с повышенной концентрацией внимания.
Бускопан – используют при болях в животе различного генеза. Выпускается в таблетках и ректальных суппозиториях. Плохо всасывается из кишечника, оказывая преимущественное влияние на органы пищеварения. По 1 таблетке или суппозитории трижды за день снимают боль и спазм в кишечнике. Нельзя использовать более 2-х дней подряд.
Нормализация стула
Колит проявляется как запорами, так и диареей. Оба симптома малоприятны и нуждаются в специфической терапии.
Что делать при диарее
Нарушение пищеварения в виде диареи появляется от воспаления слепой и восходящей ободочной кишки. При язвенном колите, антибиотик-ассоциированной диарее, псевдомембранозном колите запрещён приём медикаментов на основе лоперамида.
Остановят диарею при воспалении слизистой толстого и тонкого кишечника средства:
- Тансал окажет вяжущее и противовоспалительное действие при колите. Содержит салицилат и танальбин. Принимают по таблетке 3 раза за день;
- Аллилсат – спиртовая вытяжка из чеснока. Подавляет гнилостные явления в кишечнике, нормализует стул. По 10-15 капель Аллилсата добавляют в 30 мл молока и выпивают до еды трижды в день;
- Смекта остановит диарею и впитает микробные токсины. Разрешена к использованию у грудничков, беременных, кормящих. Пакет порошка растворить в стакане воды и выпить 3-4 раза в день;
- Бевисал – содержит салицилат, соль висмута и экстракт красавки. Оказывает комплексное антимикробное, расслабляющее, противовоспалительное и вяжущее действие. Принимают по таблетке трижды в сутки.
Опасное осложнение диареи – обезвоживание. Больному требуется обильное тёплое питьё – слабый чай, отвар шиповника, компот, чистая вода. Хорошо восполняют утрату влаги солевые регидранты – Регидрон, Хумана, Оралит. Пакетик порошка растворяют в литре воды и выпивают за 3-4 приёма.
Что делать при запоре
Левосторонний хронический колит проявляется периодическими запорами. На помощь придут фармакологические средства:
- ректальные суппозитории Бисакодил, Дульколакс, а также свечи с ревенем, облепихой, глицерином;
- капли Гутталакс, Регулакс, Слабикап;
- слабительное Форлакс или Фортранс;
- сиропы с лактулозой;
Слабительные средства нельзя применять постоянно, запоры только усугубятся, а опорожнение без медикаментов станет невозможным.
Заживление слизистой кишечника
При колите, особенно в хронической стадии, страдает слизистая кишечника. Для её заживления используют свечи с облепихой, прополисом. Растительный препарат Регесол содержит экстракты более 50 целебных трав. Под его влиянием происходит затягивание ран, ускоряется регенерация, останавливается капиллярное кровотечение. Пьют по таблетке Регесола дважды в день в течение месяца.
Компания Эвалар предлагает общеукрепляющее средство «Зелёный овёс» для восстановления работы ЖКТ, снятия воспаления и регенерации тканей кишечника. Необходимо включить в ежедневный рацион больных колитом по одному порошку «Зелёного овса». Пакетик средства смешивают с тёплым супом или кашей.
Лактовит Форте заботится о восстановлении слизистой кишечника после дисбактериоза, антибиотик-ассоциированного и язвенного колита. Фолиевая кислота и цианкобаламин стимулируют регенерацию, укрепляют сосуды. Капсулу средства употребляют утром и вечером за 30 минут до еды в течение месяца.
Восстановление микрофлоры
Важным пунктом в вопросе, чем лечить колит кишечника, является состояние микробного сообщества толстой кишки. Для восстановления полезной микрофлоры кишечника большое значение имеют пробиотики и пребиотики. Пробиотики – препараты с живыми культурами нужных для пищеварения бактерий.
В аптечных сетях присутствуют:
- Эубикор;
- Энтерол;
- Аципол;
- Бактисубтил;
- Флорин Форте;
- Линекс;
- Хилак Форте;
- Бифифиформ;
- Бифидумбактерин;
- Пробифор.
Полезные бактерии из пробиотиков проникают в кишечник, колонизируют его, вытесняя патогенных микробов. Таким образом, восстанавливается естественный эубиоз и нормальное пищеварение.
Пребиотики – пищевые волокна, являющиеся питательным субстратом для полезных бактерий. Это растительная клетчатка, инулин, крахмал. Существуют комбинированные средства – синбиотики, содержащие пробиотик и пребиотик. К ним относятся: Бифилар, Мультифлора, Пропионикс, Максилак. Их употребление повышает эффективность лечения колита кишечника.
Диета при колите
Ни один медикамент не излечит от колита, если пренебрегать советами по питанию. Диета при колите состоит из протёртых вегетарианских супов, разваренных каш на воде, парового омлета, отварного нежирного мяса и рыбы без кожи. Продукты питания готовят максимально щадящим способом – варкой, запеканием, тушением в воде. Питаются тёплой пищей до 6 раз в сутки, исключая переедание, ограничивая горячие и холодные блюда. Из рациона убирают жирное, жареное, острое, копчёное, солёное. Отказываются от газообразующих продуктов – капусты, редиса, винограда, чёрного хлеба, сладостей. Пить нужно чистую воду, слабый чай, минералку без газа. Необходимо полностью отвергнуть алкоголь, курение и другие вредные привычки.
Медикаменты для лечения колита кишечника включают антимикробные, антигельминтные, симптоматические средства. В процессе лечения восстанавливается микрофлора кишечника, регенерируется слизистая. Параллельно медикаментозному лечению проводится диетотерапия для повышения эффективности фармакологических препаратов. Грамотно составленный план лечения позволит избавиться от колита или перевести болезнь в стадию длительной ремиссии.
Информация на нашем сайте предоставлена квалифицированными врачами и носит исключительно ознакомительный характер. Не занимайтесь самолечением! Обязательно обратитесь к специалисту!
Автор: Румянцев В. Г. Стаж 34 года.
Гастроэнтеролог, профессор, доктор медицинских наук. Назначает диагностику и проводит лечение. Эксперт группы по изучению воспалительных заболеваний. Автор более 300 научных работ.
В каких случаях и какие антибиотики назначают при колите кишечника
Такие препараты при колите кишечника может назначить только лечащий врач. В тяжелых случаях антибактериальная терапия может сочетаться с применением сульфаниламидов. Бесконтрольный прием антибиотиков любителями самолечения может вызвать серьезные осложнения в работе толстого кишечника, разрушение его микрофлоры, появление лихорадки и спастических болей в животе, что усугубляет течение заболевания.
Антибиотики для кишечника
Кишечные инфекции являются вторым по распространенности заболеванием. Первое место традиционно занимает ОРВИ. Но для лечения кишечника антибиотики используются лишь в 20% от всех диагностированных случаев.
Показанием к назначению препаратов становится развитие следующей симптоматики:
- значительное повышение температуры тела;
- боли в животе режущего характера;
- диарея, возникающая больше 10 раз в сутки;
- неукротимая рвота;
- признаки развития обезвоживания.
Препараты из категории антибиотиков могут назначаться при дисбактериозе, колитах и расстройстве стула (поносе).
Нормализация стула
Колит проявляется как запорами, так и диареей. Оба симптома малоприятны и нуждаются в специфической терапии.
Нарушение пищеварения в виде диареи появляется от воспаления слепой и восходящей ободочной кишки. При язвенном колите, антибиотик-ассоциированной диарее, псевдомембранозном колите запрещён приём медикаментов на основе лоперамида.
Остановят диарею при воспалении слизистой толстого и тонкого кишечника средства:
- Тансал окажет вяжущее и противовоспалительное действие при колите. Содержит салицилат и танальбин. Принимают по таблетке 3 раза за день;
- Аллилсат – спиртовая вытяжка из чеснока. Подавляет гнилостные явления в кишечнике, нормализует стул. По 10-15 капель Аллилсата добавляют в 30 мл молока и выпивают до еды трижды в день;
- Смекта остановит диарею и впитает микробные токсины. Разрешена к использованию у грудничков, беременных, кормящих. Пакет порошка растворить в стакане воды и выпить 3-4 раза в день;
- Бевисал – содержит салицилат, соль висмута и экстракт красавки. Оказывает комплексное антимикробное, расслабляющее, противовоспалительное и вяжущее действие. Принимают по таблетке трижды в сутки.
Применение метронидазола
Может наблюдаться синергизм с рифампицином и налидиксовой кислотой. Метронидазол устойчив к ферментам гнойного экссудата. Поэтому показан для местного применения в гнойных ранах и в полостях абсцессов, сохраняя активность в анаэробных условиях.
Обладает противоотечным действием, стимулирует процессы регенерации слизистой оболочки кишок, что важно при язвенном и псевдомембранозном колите.
Это не единственная классификация заболевания. Его также делят по форме протекания. Их две: острая и хроническая.
- Острый кишечный колит, в большинстве случаев, возникает в качестве симптома аллергии. Отрицательная реакция организма на аллерген появляется в результате контакта с ним. Симптоматика при острой форме этой болезни выражена явно. Больной, который столкнулся с данной проблемой, из-за плохого самочувствия полностью потеряет работоспособность.
- Что касается хронического колита, то при нем симптоматика выражена не так явно. Тем не менее, независимо от формы протекания недуга, пациент, которому его диагностировали, будет постоянно испытывать желудочный дискомфорт.
Какие антибиотики принимать при колите?
К большому сожалению, большое количество людей предпочитают самостоятельное установление диагноза и его лечение, нежели обращение к специалисту. Это может привести к большому количеству тяжелых осложнений.
Если у вас возникли болезненные ощущения в кишечной области, то вам стоит сразу же обратиться к гастроэнтерологу, который назначит полное проведение обследования, и в случае возникновения колита, выпишет вам прием соответствующих медикаментов и диеты для лечения заболевания. Далеко не при каждом виде колита назначаются антибиотики, однако, при тяжелых формах заболевания от этого никуда не деться. Какие же могут быть назначены лекарства совместно с антибиотиками? Как принимать их?
Лечение других заболеваний на букву — к
| Лечение кампилобактериоза |
| Лечение кандидоза кожи |
| Лечение кашля |
| Лечение кисты легких |
| Лечение кисты печени |
| Лечение кисты поджелудочной железы |
| Лечение кисты селезенки |
| Лечение кисты яичника |
| Лечение кластерной головной боли |
| Лечение клещевого энцефалита |
| Лечение климакса |
| Лечение кольпита |
| Лечение контагиозного моллюска |
| Лечение контрактуры Дюпюитрена |
| Лечение конъюнктивита |
| Лечение кори |
| Лечение костно-суставного туберкулеза |
| Лечение крапивницы |
| Лечение красного плоского лишая |
| Лечение краснухи |
| Лечение крипторхизма |
| Лечение ку-лихорадки |
Информация предназначена исключительно для образовательных целей. Не занимайтесь самолечением; по всем вопросам, касающимся определения заболевания и способов его лечения, обращайтесь к врачу. EUROLAB не несет ответственности за последствия, вызванные использованием размещенной на портале информации.
Метронидазол при колите
Метронидазол является противопротозойным и противомикробным препаратом, производным от 5-гитроимидазола. Воздействие заключается в том, что проводится биохимическое восстановление 5-нитрогруппы метронидазола посредством внутриклеточных транспортных протеинов анаэробного микроорганизма.
Препарат не имеет чувствительности к аэробным микроорганизмам и факультативным а
Какой антибиотик принимать при колите кишечника
Колит – воспаление кишечника, различающееся по течению, клиническим признакам, степени поражения слизистой. Препараты для лечения колита кишечника подбираются врачом по индивидуальному плану на основе результатов анализов и аппаратных обследований. Направленность терапии – снятие воспаления, нормализация работы кишечника, облегчение симптомов заболевания.
Антимикробные средства при колите
Лечение колита кишечника медикаментами начинается с назначения антимикробных препаратов. В распоряжении врачей обширный перечень средств от колита:
- сульфаниламиды;
- нитрофураны;
- хинолоны;
- антибиотики.
Лечение колита медикаментами преследует цель – устранить причину воспаления (патогенных и условно-патогенных микробов). Каждый вид микробов чувствителен к определённому препарату. Поэтому для выбора самого эффективного средства проводят анализ чувствительности бактериальной флоры к медикаментам.
Сульфаниламиды
Терапию Фталазолом, Фтазином, Сульгином проводят при язвенном колите, дизентерии, обсеменении кишечной палочкой. Таблетки медленно всасываются из кишечника при пероральном приёме, создавая высокую концентрацию антимикробного средства. Противопоказаны сульфаниламиды беременным, кормящим, детям до 3-х лет, людям с больными почками.
Нитрофураны
Антибактериальная активность нитрофуранов распространяется на лямблии, шигеллы, клостридии, сальмонеллы, холерный вибрион. Капсулы Энтерофурила помогут при антибиотик-ассоциированном колите. Они подавляют развитие клостридий – возбудителей псевдомембранозного колита. Разрешён Энтерофурил детям с 1 месяца в форме суспензии. Капсулы 200 мг назначают взрослым по 4 раза за сутки на протяжении недели. Беременным и кормящим рекомендуется применять по веским показаниям.
Хинолоны
Хинолоны – сравнительно новая группа противомикробных средств. Микроорганизмы пока не выработали устойчивость к хинолонам. Медикаментозное лечение колита этой группой препаратов избавляет от сальмонелл, шигелл, холеры, стафилококков. Применяются в лечении хронического колита Нолицин, Софазин, Медоциприн.
Антибиотики
Антибиотики при колите нужны с широким спектром действия. Новое поколение препаратов – полимиксины. Полимиксин В принимают для устранения сальмонелл, шигелл, клебсиелл, холеры. Лечение у взрослых колита Полимиксином В происходит в условиях стационара.
Для домашней антибиотикотерапии врач назначает:
- Левомицетин – помогает избавиться от острого и хронического воспаления, вызванного кишечной палочкой, сальмонеллой, стрептококками, стафилококками. Пьётся лекарство за полчаса до еды 3 раза за сутки. Курс лечения – 8 дней. Детям до 2-х лет, будущим и кормящим мамам не назначают.
- Неомицин – лекарственный препарат из группы аминогликозидов. При приёме внутрь плохо всасывается, влияя преимущественно на микрофлору в кишечнике. Неомицин употребляют по рецепту врача из-за большого числа побочных действий.
- Альфа-Нормикс – лекарство устраняет избыточный рост патогенных бактерий, так как практически всё остаётся в тонкой и толстой кишке. Можно лечить колит кишечника у женщин во время беременности и лактации. Пить лекарство взрослым и детям от 12 лет показано по 1 таблетке через каждые 8 часов. Применяют антибиотик на протяжении недели.
Лечение колита медикаментами, особенно антибиотиками, происходит под контролем врача-гастроэнтеролога. Дозировка препаратов, длительность лечения колита, подбор эффективных медикаментов осуществляется строго индивидуально. Бессистемное употребление антибиотиков грозит осложнением воспалительного процесса антибиотик-ассоциированным колитом (ААК).
Антигельминтные средства при колите
Случается, воспаление кишечника вызывают паразитические черви – нематоды, острицы, аскариды. Выгнать паразитов можно применением медикаментов Немозол, Вермокс. Применяют средства от глистов у взрослых и детей с 2-3 лет по одной таблетке однократно, при необходимости повторяют через неделю. Средства от глистов токсичны для печени. Нельзя одновременно с противогельминтной терапией употреблять жирную еду, пить алкоголь, пользоваться слабительными.
Снятие боли и спазмов
Если антибиотики влияют на причину болезни, то спазмолитики устраняют болезненные спазмы воспалённого кишечника. Действие лекарств направлено на расслабление гладкой мускулатуры кишечника.
Но-Шпа – наиболее известный спазмолитик на базе дротаверина. Таблетки Но-Шпы используют после приёма пищи при приступах спастических болей в животе по 1-2 штуки до 3-х раз за сутки. Лечение продолжается максимум 2-3 дня. Если боль не стихает, обращаются к врачу.
Дюспаталин – влияет на мускулатуру кишечника напрямую, в большей мере действуя на толстый кишечник. Перистальтика не страдает, кишечник работает в нормальном режиме. Не проникает в грудное молоко, не оказывает токсичного действия на плод. Принимают утром и вечером за 20 минут до еды, запивая водой. Дюспаталин влияет на способность управления автомобилем и другие виды деятельности с повышенной концентрацией внимания.
Бускопан – используют при болях в животе различного генеза. Выпускается в таблетках и ректальных суппозиториях. Плохо всасывается из кишечника, оказывая преимущественное влияние на органы пищеварения. По 1 таблетке или суппозитории трижды за день снимают боль и спазм в кишечнике. Нельзя использовать более 2-х дней подряд.
Нормализация стула
Колит проявляется как запорами, так и диареей. Оба симптома малоприятны и нуждаются в специфической терапии.
Что делать при диарее
Нарушение пищеварения в виде диареи появляется от воспаления слепой и восходящей ободочной кишки. При язвенном колите, антибиотик-ассоциированной диарее, псевдомембранозном колите запрещён приём медикаментов на основе лоперамида.
Остановят диарею при воспалении слизистой толстого и тонкого кишечника средства:
- Тансал окажет вяжущее и противовоспалительное действие при колите. Содержит салицилат и танальбин. Принимают по таблетке 3 раза за день;
- Аллилсат – спиртовая вытяжка из чеснока. Подавляет гнилостные явления в кишечнике, нормализует стул. По 10-15 капель Аллилсата добавляют в 30 мл молока и выпивают до еды трижды в день;
- Смекта остановит диарею и впитает микробные токсины. Разрешена к использованию у грудничков, беременных, кормящих. Пакет порошка растворить в стакане воды и выпить 3-4 раза в день;
- Бевисал – содержит салицилат, соль висмута и экстракт красавки. Оказывает комплексное антимикробное, расслабляющее, противовоспалительное и вяжущее действие. Принимают по таблетке трижды в сутки.
Опасное осложнение диареи – обезвоживание. Больному требуется обильное тёплое питьё – слабый чай, отвар шиповника, компот, чистая вода. Хорошо восполняют утрату влаги солевые регидранты – Регидрон, Хумана, Оралит. Пакетик порошка растворяют в литре воды и выпивают за 3-4 приёма.
Что делать при запоре
Левосторонний хронический колит проявляется периодическими запорами. На помощь придут фармакологические средства:
- ректальные суппозитории Бисакодил, Дульколакс, а также свечи с ревенем, облепихой, глицерином;
- капли Гутталакс, Регулакс, Слабикап;
- слабительное Форлакс или Фортранс;
- сиропы с лактулозой;
Слабительные средства нельзя применять постоянно, запоры только усугубятся, а опорожнение без медикаментов станет невозможным.
Заживление слизистой кишечника
При колите, особенно в хронической стадии, страдает слизистая кишечника. Для её заживления используют свечи с облепихой, прополисом. Растительный препарат Регесол содержит экстракты более 50 целебных трав. Под его влиянием происходит затягивание ран, ускоряется регенерация, останавливается капиллярное кровотечение. Пьют по таблетке Регесола дважды в день в течение месяца.
Компания Эвалар предлагает общеукрепляющее средство «Зелёный овёс» для восстановления работы ЖКТ, снятия воспаления и регенерации тканей кишечника. Необходимо включить в ежедневный рацион больных колитом по одному порошку «Зелёного овса». Пакетик средства смешивают с тёплым супом или кашей.
Лактовит Форте заботится о восстановлении слизистой кишечника после дисбактериоза, антибиотик-ассоциированного и язвенного колита. Фолиевая кислота и цианкобаламин стимулируют регенерацию, укрепляют сосуды. Капсулу средства употребляют утром и вечером за 30 минут до еды в течение месяца.
Восстановление микрофлоры
Важным пунктом в вопросе, чем лечить колит кишечника, является состояние микробного сообщества толстой кишки. Для восстановления полезной микрофлоры кишечника большое значение имеют пробиотики и пребиотики. Пробиотики – препараты с живыми культурами нужных для пищеварения бактерий.
В аптечных сетях присутствуют:
- Эубикор;
- Энтерол;
- Аципол;
- Бактисубтил;
- Флорин Форте;
- Линекс;
- Хилак Форте;
- Бифифиформ;
- Бифидумбактерин;
- Пробифор.
Полезные бактерии из пробиотиков проникают в кишечник, колонизируют его, вытесняя патогенных микробов. Таким образом, восстанавливается естественный эубиоз и нормальное пищеварение.
Пребиотики – пищевые волокна, являющиеся питательным субстратом для полезных бактерий. Это растительная клетчатка, инулин, крахмал. Существуют комбинированные средства – синбиотики, содержащие пробиотик и пребиотик. К ним относятся: Бифилар, Мультифлора, Пропионикс, Максилак. Их употребление повышает эффективность лечения колита кишечника.
Диета при колите
Ни один медикамент не излечит от колита, если пренебрегать советами по питанию. Диета при колите состоит из протёртых вегетарианских супов, разваренных каш на воде, парового омлета, отварного нежирного мяса и рыбы без кожи. Продукты питания готовят максимально щадящим способом – варкой, запеканием, тушением в воде. Питаются тёплой пищей до 6 раз в сутки, исключая переедание, ограничивая горячие и холодные блюда. Из рациона убирают жирное, жареное, острое, копчёное, солёное. Отказываются от газообразующих продуктов – капусты, редиса, винограда, чёрного хлеба, сладостей. Пить нужно чистую воду, слабый чай, минералку без газа. Необходимо полностью отвергнуть алкоголь, курение и другие вредные привычки.
Медикаменты для лечения колита кишечника включают антимикробные, антигельминтные, симптоматические средства. В процессе лечения восстанавливается микрофлора кишечника, регенерируется слизистая. Параллельно медикаментозному лечению проводится диетотерапия для повышения эффективности фармакологических препаратов. Грамотно составленный план лечения позволит избавиться от колита или перевести болезнь в стадию длительной ремиссии.
Информация на нашем сайте предоставлена квалифицированными врачами и носит исключительно ознакомительный характер. Не занимайтесь самолечением! Обязательно обратитесь к специалисту!
Автор: Румянцев В. Г. Стаж 34 года.
Гастроэнтеролог, профессор, доктор медицинских наук. Назначает диагностику и проводит лечение. Эксперт группы по изучению воспалительных заболеваний. Автор более 300 научных работ.
Задайте вопрос врачу
какие лекарства подходят для лечения
Такие препараты при колите кишечника может назначить только лечащий врач. В тяжелых случаях антибактериальная терапия может сочетаться с применением сульфаниламидов. Бесконтрольный прием антибиотиков любителями самолечения может вызвать серьезные осложнения в работе толстого кишечника, разрушение его микрофлоры, появление лихорадки и спастических болей в животе, что усугубляет течение заболевания.
Показания и противопоказания
Антибиотики — это лекарственные препараты, задачей которых является уничтожение бактерий, провоцирующих рост инфекционных заболеваний. Существует много типов антибиотиков, все они разные, так как их действие направлено на различные группы возбудителей. Но несмотря на то, что это довольно сильные медикаментозные средства, вылечить любое заболевание антибиотики не могут.
Большинство антибиотиков губительно влияют на полезную бактериальную флору слизистой кишечника, они способны спровоцировать развитие колита. Но есть антибиотики, которые применяются для лечения этого заболевания.
Назначение антибиотиков при колите кишечника напрямую зависит от типа патологии. Например, антибиотики для лечения инфекционного колита предупреждают размножение патогенных бактерий в организме. Лечение язвенного колита проводится совместным применением антибиотиков и сульфаниламидов.
Назначение антибиотиков при колите необходимо для угнетения роста патогенных бактерий, а противовоспалительные средства эффективно уменьшают раздражение и отек слизистой кишечника.
Показанием к назначению антибиотиков при колите является наличие в организме кишечной инфекции, которая привела к воспалительным изменениям слизистой толстой кишки.
Все инфекции кишечника делятся на три группы:
- бактериальные;
- вирусные;
- паразитарные.
Чаще всего колит развивается в результате шигеллезной дизентерии и сальмонеллеза, возбудителями этих заболеваний соответственно являются шигеллы и сальмонеллы. Реже встречаются случаи туберкулезного колита кишечника. Также заболевание могут вызвать вирусы по типу кишечного гриппа. Паразитарное происхождение колита заключается в заражении организма амебами или амебной дизентерией, лямблиозом.
Все эти инфекционные возбудители провоцируют воспалительный процесс в толстой кишке и требуют назначения антибактериальной терапии. Какие антибиотики при колите кишечника принимать больному, решает только врач. Но перед тем, как приступить к лечению этими препаратами, важно пройти соответствующую диагностику, которая определит инфекционного агента, ставшего причиной патологии.
Противопоказания к применению антибиотиков при колите:
- повышенная чувствительность к препарату;
- наличие грибковых инфекций;
- нарушения работы печени и почек;
- нарушение функций кроветворения.
С осторожностью принимать антибиотики при колите кишечника нужно в случае склонности к аллергическим реакциям, а также детям до 12 лет.
Обзор популярных препаратов
Рассмотрим, какие антибиотики при колите кишечника используются чаще всего.
Альфа Нормикс
Альфа Нормикс — это антибиотик широкого спектра действия. Благодаря выраженному бактерицидному действию этот препарат часто назначается для лечения колитов. Он формирует связь с бактериальными ферментами, ингибируя синтез бактериальных белков и РНК, в результате чего определяется бактерицидное действие препарата по отношению к чувствительной к нему флоре бактерий.
Антибактериальное влияние Альфа Нормикса направлено на снижение патогенной бактериальной нагрузки на кишечник, которая вызывает патологические состояния при колите.
Альфа Нормикс имеет следующий спектр действия:
- угнетает синтез аммиака, вызванного бактериальной флорой;
- снижает количество патогенных бактерий в ободочной кишке;
- снижает высокий уровень пролиферации;
- нейтрализует антигенную стимуляцию;
- минимизирует вероятность осложнений инфекционного характера.
Побочные действия:
- со стороны сердечно-сосудистой системы — повышение артериального давления;
- со стороны нервной системы — мигрень, бессонница;
- со стороны органов зрения — диплопия;
- со стороны органов дыхания — одышка, заложенность носа, сухость в ротоглотке;
- со стороны желудочно-кишечного тракта — метеоризм, боль в животе, расстройства стула, тенезмы, диспепсические расстройства, редко — анорексия, сухость губ;
- со стороны мочевыделительной системы — полиурия, глюкозурия, гематурия.
Пациентам, достигшим 12 лет, если врач не указал иного порядка применения препарата, Альфа Нормикс назначается по 1 таблетке каждые 8 часов, или 1800 мг препарата в сутки. Курс лечения до 7 дней.
Левомицетин
Левомицетин — это антибиотик, эффективный в отношении грамположительной и грамотрицательной микрофлоры, с ярко выраженным бактерицидным эффектом. После перорального приема Левомицетин быстро всасывается и абсорбируется в желудочно-кишечном тракте.
Побочные действия:
- со стороны желудочно-кишечного тракта — диспепсические расстройства, диарея, дисбактериоз, раздражение слизистой ротовой полости;
- со стороны органов кроветворения — эритроцитопения, тромбоцитопения, анемия;
- со стороны нервной системы — депрессия, неврит зрительного нерва, мигрень;
- аллергические реакции — сыпь на кожных покровах, отек.
Левомицетин выпускается в виде таблеток и порошка для инъекций. Таблетки принимают за 30 минут до еды по 250—500 мг 4 раза в день. Препарат в виде порошка разводится водой для инъекций в объеме 2 мл и вводится внутримышечно. Курс лечения определяет врач.
Фуразолидон
Фуразолидон — это антибиотик группы нитрофуранов, обладающий выраженным противомикробным эффектом по отношению к грамотрицательной аэробной флоре. Фармакологический эффект Фуразолидона при колите зависит от дозировки препарата.
Побочные действия:
- со стороны желудочно-кишечного тракта — диспепсические расстройства, снижение аппетита;
- со стороны сердечно-сосудистой системы — снижение артериального давления;
- со стороны нервной системы — головная боль, общая слабость, утомляемость;
- аллергические реакции — крапивница, повышение температуры.
Фуразолидон принимается внутрь. Таблетку нельзя жевать или измельчать, только глотать целиком, запивая водой. Взрослым назначается по 100-150 мг Фуразолидона после приема пищи 4 раза в сутки в течение 5-10 дней. Курс лечения зависит от тяжести патологического процесса.
Цифран
Антибиотик принадлежит к группе фторхинолов. Убивает бактерии, которые устойчивы к макролидам, тетрациклинам, сулфаниламидам и аминогликозидам.
Препарат обладает высокой биодоступностью, до 80%. Выпускается в форме таблеток по 500 мг. Необходимо принимать по 250-750 мг 2 раза в день. Максимальная суточная доза – 3 таблетки. Курс лечения не более месяца.
Противопоказан при индивидуальной непереносимости, беременности, грудном вскармливании и возрасте до 18 лет.
Побочные эффекты:
- тошнота;
- головокружение, головная боль;
- расстройство сна;
- обморочное состояние;
- нарушение сердечного ритма;
- повышение давления;
- аллергическая реакция;
- учащение мочеиспускания.
Фталазол
Это препарат из группы сульфаниламидов. Выпускается в форме таблеток. Действующее вещество – фталилсульфатиазол. Преимуществом данного средства является то, что действует непосредственно в кишечнике. Средство оказывает не только антибактериальный, но и противовоспалительный эффект.
Схема лечения подбирается врачом. В первые двое суток допускается употребление до 6 таблеток в день, затем дозировку нужно снизить. Фталазол нельзя принимать при индивидуальной непереносимости, болезнях крови, гепатите в стадии обострения, почечной недостаточности, гломерулонефрите, кишечной непроходимости и детском возрасте до 5 лет.
Побочные явления:
- головная боль и головокружение;
- тошнота и рвота;
- боль в животе;
- грибковые поражения слизистой рта;
- образование конкрементов в почках.
Энтерофурил
Это антибиотик с нифуроксазидом в качестве основного компонента. Преимуществом является то, что препарат действует непосредственно в кишечнике, не всасывается в желудке. Его можно применять при беременности, но под контролем врача.
Дозировка составляет 200 мг 4 раза в день.
Побочные явления возникают редко. Возможна тошнота, рвота или аллергия. Энтерофурил нельзя принимать при непереносимости фруктозы и других компонентов в составе средства.
Тетрациклин
Препарат из группы тетрациклинов. Он борется с такими возбудителями:
- гонококки, стафилококки и стрептококки;
- листерии;
- клостридии;
- сибирская язва;
- гемофильная, чумная и кишечная палочка;
- бледная спирохета;
- риккетсии и боррелии;
- хламидия трахоматис;
- дизентерийная амеба.
Препарат выпускается в двух формах: таблетки для взрослых и суспензия для детей старше 7 лет. Суточная доза для взрослого пациента не более 2 г (8 таблеток).
Тетрациклин противопоказан при аллергических реакциях, почечной недостаточности, грибковых заболеваниях, лейкопении и тяжелых патологиях печени.
Олететрин
Это антибиотик широкого спектра действия. Активными компонентами в составе является тетрациклин и олеандомицин. Эффективен в отношении большинства грамотрицательных бактерий.
Капсулы нужно принимать за 30 мин. до еды по 1 шт. 4 раза в день. Максимальная доза – 8 таблеток. Курс лечения – 5-10 дней.
Побочные эффекты:
- диспепсические нарушения;
- кандидоз слизистых;
- аллергия;
- дисбактериоз;
- дефицит витамина К и В.
Олететрин нельзя принимать при тяжелых болезнях почек и печени, детям до 12 лет, лейкопении, сердечно-сосудистой недостаточности, дефиците витамина К и В.
Полимиксина-в сульфат
Препарат из группы полимиксинов. Эффективен в отношении грамотрицательных бактерий. Препарат обладает низкой биодоступностью и высокой токсичностью по отношению к почкам, но зато его можно применять во время беременности. Он выпускается в форме водного раствора для приема внутрь, внутривенного и внутримышечного раствора. Курс лечения 5-7 дней.
Полимиксин-в-сульфат нельзя применять при аллергии, миастении, при тяжелых поражениях почек и повышенной чувствительности к компонентам в составе. Спектр побочных явлений большой, включает боль в животе, тошноту, почечный некроз, паралич дыхательных мышц, кандидоз, нарушение зрительной функции и другое.
Полимиксина-м сульфат
Антибиотик активен только в отношении кишечной, синегнойной и дизентерийной палочки, паратифа А и Б, а также бактерии брюшного тифа. Препарат обладает низкой биодоступностью, не применяется при беременности, для детей младше 5 лет, при нарушении работы почек и печени. При длительном применении возможны изменения в паренхиме почек.
Курс лечения 5-10 дней, дозировка подбирается врачом исходя из возраста.
Стрептомицина сульфат
Препарат из группы аминогликозидов. Он вводится внутривенно или внутримышечно, поскольку при пероральном применении не всасывается кишечником.
Средство не желательно использовать при беременности и грудном вскармливании. Противопоказан Стрептомицин сульфат также при миастении, нарушении кровообращения головного мозга, сердечно-сосудистой и почечной недостаточности, а также при облитерирующем эндартериите.
Побочные явления:
- аллергия;
- медикаментозная лихорадка;
- остановка дыхания;
- учащение сердцебиения;
- головная боль и головокружение;
- кровь в моче;
- диарея;
- потеря слуха на фоне длительного лечения.
Неомицина сульфат
Препарат из группы аминогликозидов. Выпускается в форме таблеток и растворов. Разовая доза 100-200 мг, суточная не более 400 мг.
Препарат подходит для лечения грудных детей.
Среди побочных явлений можно отметить ухудшение слуха. В таком случае прием необходимо немедленно прекратить.
Мономицин
Антибиотик эффективен, если колит вызван стафилококками, шигеллами, кишечной палочкой или протеем. Стрептококки и пневмококки устойчивы к Мономицину.
Препарат используется перорально или вводится внутримышечно. Побочные явления:
- функциональные нарушения работы почек;
- аллергия;
- неврит слухового нерва;
- диспепсические проявления.
Мономицин противопоказан при беременности, неврите слухового нерва, дегенеративных поражениях почек и печени, а также склонности к аллергическим реакциям.
Основные правила приема антибиотиков при колите
Лечение колита антибиотиками, какими бы современными и безопасными они ни были, может стать причиной нарушения функционирования кишечника, в результате чего повышается риск обострения хронического колита.
Для поддержки работы кишечника и нормализации микрофлоры совместно с антибиотикотерапией рекомендуется принимать Нистатин внутрь 500000-1000000 ЕД ежедневно. Можно заменить Колибактерином в дозировке 100-200 гр 2 раза в день через 30 минут после приема пищи.
Антибиотики при колите применяются с целью уничтожить патогенную флору в кишечнике, но прием этих препаратов может усилить имеющуюся диарею. Нужно немедленно сообщить врачу, если клиническая картина колита ухудшается, а также появилось головокружение, проблемы с дыханием, суставная боль и синяки под глазами. Срочно вызывайте скорую помощь, если обнаружился отек губ, горла или кровотечения неясной этиологии, которых не было прежде.
Если врач для лечения колита назначил антибиотики, сообщите ему о том, какие препараты принимаете в данный момент. Некоторые медикаментозные средства в сочетании с антибактериальными препаратами могут дать нежелательный эффект.
Антибиотики чаще всего не назначаются при язвенном колите кишечника, но врач может назначить их, если другие методы терапевтического воздействия оказались неэффективными. В остальных случаях антибактериальная терапия не используется, так как эффективность антибиотиков при язвенном колите не доказана.
Если колит спровоцирован длительным бесконтрольным назначением антибиотиков с целью лечения другого заболевания — возникает состояние антибиотикоассоциированный колит. В этом случае препарат сразу же отменяют и назначают дополнительное реабилитационное лечение больного с обязательным восстановлением нарушенной микрофлоры кишечника. Подробнее о том, как восстановить кишечник после антибиотиков →
Основным методом лечения колитов является диетотерапия и ведение здорового образа жизни. Антибиотики для лечения колита назначаются при условии, что заболевание возникло в результате кишечной инфекции. Также использование антибактериальной терапии оправдано в случае хронического колита, если произошло бактериальное инфицирование пораженной слизистой толстой кишки.
Антибиотики для лечения колита не являются панацеей, поэтому важно проявлять осторожность и избегать самолечения этими препаратами для исключения последствий от их применения.
Автор: Ольга Рогожкина, врач,
специально для Zhkt.ru
Полезное видео о хроническом колите
Какие антибиотики принимать при колите?
Антибиотики для кишечника
Кишечные инфекции являются вторым по распространенности заболеванием. Первое место традиционно занимает ОРВИ. Но для лечения кишечника антибиотики используются лишь в 20% от всех диагностированных случаев.
Показанием к назначению препаратов становится развитие следующей симптоматики:
- значительное повышение температуры тела;
- боли в животе режущего характера;
- диарея, возникающая больше 10 раз в сутки;
- неукротимая рвота;
- признаки развития обезвоживания.
Препараты из категории антибиотиков могут назначаться при дисбактериозе, колитах и расстройстве стула (поносе).
Антибиотики для лечения кишечной инфекции
Причиной инфекционного поражения ЖКТ становится проникновение в организм человека патогенной микрофлоры. Это могут быть стафилококки, простейшие, энтеровирусы, сальмонеллы и т. д.
Показанием к применению лекарственных средств из категории антибиотиков становится отсутствие положительной динамики лечения от назначенных ранее препаратов. Но при диагностировании дизентерии или холеры, они предписываются к приему сразу.
Для лечения кишечной патологии могут использоваться медикаменты из следующих категорий:
- цефалоспорины;
- фторхинолоны;
- тетрациклины;
- аминогликозиды;
- аминопенициллины.
Если говорить о конкретных препаратах, то чаще всего назначаются:
- Левомицетин. Антибиотик широкого спектра действия. Весьма эффективен в отношении холерного вибриона. Рекомендован при отсутствии терапевтического эффекта после приема иных медикаментозных средств. Запрещен к приему в детском возрасте.
- Тетрациклин. Практикуется для терапии кишечной инфекции, вызванной сальмонеллами, амебами. Эффективен в отношении возбудителя сибирской язвы, чумы, пситтакоза. Длительное лечение препаратами этой группы может провоцировать развитие дисбиоза, поэтому после антибиотиков тетрациклинового ряда больному рекомендован прием синбиотиков.
- Рифаксимин. Препарат менее агрессивен, чем тетрациклин, а потому может назначаться и взрослым, и детям.
- Ампициллин. Полусинтетическое средство, эффективное в отношении большого числа возбудителей. Разрешен детям и беременным женщинам.
- Ципрофлоксацин (из группы фторхинолонов). Не вызывает дисбиоза.
- Азитромицин (из группы макролидов). Подавляет рост патогенной микрофлоры за трое суток. Наиболее безопасный медикамент, практически не имеющий побочных эффектов.
- Амоксициллин.
Применение антибиотиков при дисбактериозе
Медикаменты из группы антибиотиков при развитии дисбиоза назначаются с целью подавления патогенных бактерий. Чаще всего к приему рекомендуются средства из следующих групп:
- пенициллины;
- тетрациклины;
- цефалоспорины;
- хинолоны.
Также может назначаться Метронидазол.
Поскольку антибиотики и без того пагубно влияют на состояние микрофлоры пищеварительного тракта, то применяются при дисбиозе тонкого кишечника, сопровождающемся синдромом мальабсорбции и нарушениями моторики.
Для лечения дисбактериоза чаще всего назначаются следующие препараты:
- Амоксициллин. Полусинтетическое средство из группы пенициллинов. Дает хороший результат при пероральном приеме, поскольку устойчив к агрессивной желудочной среде.
- Альфа Нормикс. Несистемный антибиотик широкого спектра воздействия. Активное вещество – рифаксимин. Показан при дисбиозах, вызванных диареей и инфекционными патологиями ЖКТ.
- Флемоксин Солютаб. Полусинтетический препарат пенициллиновой группы. Оказывает бактерицидный эффект.
- Левомицетин. Противомикробное средство широкого спектра действия. Назначается для лечения дисбактериоза, спровоцированного кишечной инфекцией, патологиями органов брюшной полости. Может назначаться и в качестве альтернативного препарата, если подобранные ранее медикаментозные средства не дали положительного результата.
При развитии дисбактериоза толстого кишечника к приему назначаются:
Лекарства эффективны в отношении дрожжевых грибков, стафилококков и протей, являющихся основной причиной дисбиоза толстого кишечника. На состояние естественной микрофлоры препараты значительного влияния не оказывают.
Антибиотики при колите
Лечение колитов бактериального происхождения невозможно без курсового применения антибиотиков. При неспецифической язвенной форме воспаления толстой кишки прием лекарств данной категории назначается в случае присоединения вторичной бактериальной инфекции.
В процессе терапии патологии могут использоваться:
- группа сульфаниламидов при легкой/средней тяжести заболевания;
- средства широкого спектра действия при тяжелом течении болезни.
С целью предупреждения развития дисбиоза больному рекомендован прием пробиотиков. Это может быть Нистатин либо Колибактерин. Последний содержит в составе живые кишечные палочки, способствующие восстановлению и нормализации микрофлоры.
При колитах могут назначаться следующие лекарства:
- Альфа Нормикс. Средство широкого спектра действия с ярко выраженным бактерицидным эффектом, что способствует снижению патогенной нагрузки.
- Фуразолидон. Препарат из группы нитрофуранов. Обладает противомикробным эффектом.
- Левомицетин. Средство активно в отношении патогенной микрофлоры, а также проявляет бактерицидный эффект. Поскольку на фоне приема Левомицетина могут развиваться многочисленные побочные симптомы, то дозировка и схема лечения должны подбираться индивидуально. Возможно внутримышечное введение препарата.
Самостоятельное лечение колита антибиотиками совершенно недопустимо. Подбирать медикаменты и определять схему приема должен квалифицированный специалист. Также врачу необходимо сообщить обо всех принимаемых медикаментах, чтобы исключить развитие негативных реакций при взаимодействии лекарственных средств.
Антибактериальные средства в лечении диареи
Средства из категории антибиотиков при диарее могут быть показаны только в одном случае: если происхождение расстройства кишечника имеет инфекционное происхождение. При вирусном характере препараты ожидаемого терапевтического результата не дадут.
Какие препараты можно начать принимать еще до консультации с медиками? Если человек уверен, что причиной расстройства стала инфекция, а стул не содержит примесей крови, то разрешен прием следующих средств:
Антибиотики для кишечника
Кишечные инфекции являются вторым по распространенности заболеванием. Первое место традиционно занимает ОРВИ. Но для лечения кишечника антибиотики используются лишь в 20% от всех диагностированных случаев.
Показанием к назначению препаратов становится развитие следующей симптоматики:
- значительное повышение температуры тела;
- боли в животе режущего характера;
- диарея, возникающая больше 10 раз в сутки;
- неукротимая рвота;
- признаки развития обезвоживания.
Препараты из категории антибиотиков могут назначаться при дисбактериозе, колитах и расстройстве стула (поносе).
Антибиотики для лечения кишечной инфекции
Причиной инфекционного поражения ЖКТ становится проникновение в организм человека патогенной микрофлоры. Это могут быть стафилококки, простейшие, энтеровирусы, сальмонеллы и т. д.
Показанием к применению лекарственных средств из категории антибиотиков становится отсутствие положительной динамики лечения от назначенных ранее препаратов. Но при диагностировании дизентерии или холеры, они предписываются к приему сразу.
Для лечения кишечной патологии могут использоваться медикаменты из следующих категорий:
- цефалоспорины;
- фторхинолоны;
- тетрациклины;
- аминогликозиды;
- аминопенициллины.
Если говорить о конкретных препаратах, то чаще всего назначаются:
- Левомицетин. Антибиотик широкого спектра действия. Весьма эффективен в отношении холерного вибриона. Рекомендован при отсутствии терапевтического эффекта после приема иных медикаментозных средств. Запрещен к приему в детском возрасте.
- Тетрациклин. Практикуется для терапии кишечной инфекции, вызванной сальмонеллами, амебами. Эффективен в отношении возбудителя сибирской язвы, чумы, пситтакоза. Длительное лечение препаратами этой группы может провоцировать развитие дисбиоза, поэтому после антибиотиков тетрациклинового ряда больному рекомендован прием синбиотиков.
- Рифаксимин. Препарат менее агрессивен, чем тетрациклин, а потому может назначаться и взрослым, и детям.
- Ампициллин. Полусинтетическое средство, эффективное в отношении большого числа возбудителей. Разрешен детям и беременным женщинам.
- Ципрофлоксацин (из группы фторхинолонов). Не вызывает дисбиоза.
- Азитромицин (из группы макролидов). Подавляет рост патогенной микрофлоры за трое суток. Наиболее безопасный медикамент, практически не имеющий побочных эффектов.
- Амоксициллин.
Применение антибиотиков при дисбактериозе
Медикаменты из группы антибиотиков при развитии дисбиоза назначаются с целью подавления патогенных бактерий. Чаще всего к приему рекомендуются средства из следующих групп:
- пенициллины;
- тетрациклины;
- цефалоспорины;
- хинолоны.
Также может назначаться Метронидазол.
Поскольку антибиотики и без того пагубно влияют на состояние микрофлоры пищеварительного тракта, то применяются при дисбиозе тонкого кишечника, сопровождающемся синдромом мальабсорбции и нарушениями моторики.
Для лечения дисбактериоза чаще всего назначаются следующие препараты:
- Амоксициллин. Полусинтетическое средство из группы пенициллинов. Дает хороший результат при пероральном приеме, поскольку устойчив к агрессивной желудочной среде.
- Альфа Нормикс. Несистемный антибиотик широкого спектра воздействия. Активное вещество – рифаксимин. Показан при дисбиозах, вызванных диареей и инфекционными патологиями ЖКТ.
- Флемоксин Солютаб. Полусинтетический препарат пенициллиновой группы. Оказывает бактерицидный эффект.
- Левомицетин. Противомикробное средство широкого спектра действия. Назначается для лечения дисбактериоза, спровоцированного кишечной инфекцией, патологиями органов брюшной полости. Может назначаться и в качестве альтернативного препарата, если подобранные ранее медикаментозные средства не дали положительного результата.
При развитии дисбактериоза толстого кишечника к приему назначаются:
Лекарства эффективны в отношении дрожжевых грибков, стафилококков и протей, являющихся основной причиной дисбиоза толстого кишечника. На состояние естественной микрофлоры препараты значительного влияния не оказывают.
Антибиотики при колите
Лечение колитов бактериального происхождения невозможно без курсового применения антибиотиков. При неспецифической язвенной форме воспаления толстой кишки прием лекарств данной категории назначается в случае присоединения вторичной бактериальной инфекции.
В процессе терапии патологии могут использоваться:
- группа сульфаниламидов при легкой/средней тяжести заболевания;
- средства широкого спектра действия при тяжелом течении болезни.
С целью предупреждения развития дисбиоза больному рекомендован прием пробиотиков. Это может быть Нистатин либо Колибактерин. Последний содержит в составе живые кишечные палочки, способствующие восстановлению и нормализации микрофлоры.
При колитах могут назначаться следующие лекарства:
- Альфа Нормикс. Средство широкого спектра действия с ярко выраженным бактерицидным эффектом, что способствует снижению патогенной нагрузки.
- Фуразолидон. Препарат из группы нитрофуранов. Обладает противомикробным эффектом.
- Левомицетин. Средство активно в отношении патогенной микрофлоры, а также проявляет бактерицидный эффект. Поскольку на фоне приема Левомицетина могут развиваться многочисленные побочные симптомы, то дозировка и схема лечения должны подбираться индивидуально. Возможно внутримышечное введение препарата.
Самостоятельное лечение колита антибиотиками совершенно недопустимо. Подбирать медикаменты и определять схему приема должен квалифицированный специалист. Также врачу необходимо сообщить обо всех принимаемых медикаментах, чтобы исключить развитие негативных реакций при взаимодействии лекарственных средств.
Антибактериальные средства в лечении диареи
Средства из категории антибиотиков при диарее могут быть показаны только в одном случае: если происхождение расстройства кишечника имеет инфекционное происхождение. При вирусном характере препараты ожидаемого терапевтического результата не дадут.
Какие препараты можно начать принимать еще до консультации с медиками? Если человек уверен, что причиной расстройства стала инфекция, а стул не содержит примесей крови, то разрешен прием следующих средств:
Какие антибиотики принимать при колите?
К большому сожалению, большое количество людей предпочитают самостоятельное установление диагноза и его лечение, нежели обращение к специалисту. Это может привести к большому количеству тяжелых осложнений.
Если у вас возникли болезненные ощущения в кишечной области, то вам стоит сразу же обратиться к гастроэнтерологу, который назначит полное проведение обследования, и в случае возникновения колита, выпишет вам прием соответствующих медикаментов и диеты для лечения заболевания. Далеко не при каждом виде колита назначаются антибиотики, однако, при тяжелых формах заболевания от этого никуда не деться. Какие же могут быть назначены лекарства совместно с антибиотиками? Как принимать их?
Метронидазол при колите
Метронидазол является противопротозойным и противомикробным препаратом, производным от 5-гитроимидазола. Воздействие заключается в том, что проводится биохимическое восстановление 5-нитрогруппы метронидазола посредством внутриклеточных транспортных протеинов анаэробного микроорганизма.
Препарат не имеет чувствительности к аэробным микроорганизмам и факультативным анаэробам, однако при наличии смешанного типа микрофлоры может воздействовать синергидно с антибиотиком, который эффективен против обычного типа аэробов.
Имеет свои противопоказания, заключающие в возникновении диарее и снижении аппетита, тошноте, рвоте, кишечных коликах, запорах, «металлическом» привкус во рту. Метронидазол прописывают больным колитом, так как после применения антибиотиков бывают различного рода осложнения или нежелательные последствия лечения.
Прием лекарства назначается только лечащим врачом в соответствии с клинической картиной больного, но зачастую прием по 500 мг 2 раза в сутки на протяжении 3-5 дней.
Как принимать Фталазол при колите?
Фталазол является сульфаниламидным препаратом, который в медленном темпе всасывается из полости желудочно-кишечного тракта. Основополагающая масса после введения внутрь будет задерживаться в кишечной полости, после чего начинает происходить отщепления активных молекулярных частей. Большая эффективность при лечении колита обуславливается тем, что создается высокая концентрация сульфаниламида в кишечной полости совместно с активностью препарата по отношению к кишечной флоре.
Перед тем, как назначить приём Фталазола совместно с антибиотиками, врачом определяется уровень чувствительности пациента. Какие рекомендации по приему Фталазола при колите:
- Взрослым: первые несколько дней по 1-2 г через каждые 4 часа, а последующие 3 дня половина дозы.
- Для детей назначается в 1 день 1,1г/кг в сутки. Препарат дается в равных дозах с перерывов в 4 часа и ночь. Последующий приём будет по 0,2-0,5 г с перерывом в 6-8 часов.
Альфа Нормикс при колите
Альфа Нормикс является антибиотиком, которое оказывает антибактериальное воздействие в широком спектре. Является бактерицидным препаратом, который назначается при колите. Он создает связь с бета-субъединицами бактериальных ферментов, и может ингибировать синтез РНК и бактериальных белков. Благодаря этому проявляются бактерицидные особенности по отношению к показателю чувствительности бактерий.
Благодаря антибактериальному спектру Альфа Нормикса при колите предоставляется возможность для снижения патогенных кишечных бактериальных нагрузок, обуславливающие некоторые патологические состояния. Данный препарат может снижать:
- Образование аммиака, вызванного бактериями.
- Повышенный уровень пролиферации.
- Наличие бактерий в полости ободочной кишки.
- Антигенную стимуляцию.
- Риск инфекционного осложнения.
Альфа Нормикс принимается внутрь. Для взрослых по 1 таблетке каждые 8 часов. Лечение не превышает 7 суток и должно быть определено клинической картиной пациента. Частота и доза может быть изменена врачом.
Левомицетин при колите
Препарат является антибиотиком, который эффективен в широком спектре грамположительных и грамотрицательных микроорганизмов. У него ярко выражено бактериостатическое воздействие, и при высокой концентрации по отношению к некоторым штаммам проявляется бактерицидное воздействие. После того, как был осуществлен пероральный прием, антибиотик быстро абсорбируется в полости желудочно-кишечного тракта.
Левомицетин выпускает в двух формах: таблетки и порошок для разведения инъекций. Таблетки принимаются за полчаса до приема пищи по 250 -500 мг для взрослых. Для детей рекомендовано употребление в дозе 125 мг 4 раза в сутки.
Антибиотик в порошке разводится при помощи 2-3 мг воды для инъекций внутримышечно. Продолжительность лечения Левомицетином при колите определяется только врачом.
Фуразолидон при колите
Фуразолидон является антибактериальным лекарственным средством группы нитрофуранов, синтетическим производным 5-нитрофурфуролом, которое обладает выраженным противомикробным взаимодействием по отношению к грамотрицательным аэробным микроорганизмам. Они в малой степени обладают чувствительностью к воздействию антибиотика грамположительных аэробных микроорганизмов.
Фармакологическое воздействие Фуразолидона при колите напрямую зависит от того, какая была применена доза, а если применять небольшие дозы, то просто оказывается бактериостатическая эффективность.
Препарат принимается перорально. Таблетка глотается целиком, её не нужно разжевывать или измельчать, при этом запивается большим количеством воды. Препарат пьют после употребления пищи. Длительность лечения колита Фуразолидоном и доза должны назначаться только врачом.
Какие бы не были у вас симптомы заболевания, все антибиотики при колите, должны прописываться строго специалистом.
Какие антибиотики принимать при колите?
К большому сожалению, большое количество людей предпочитают самостоятельное установление диагноза и его лечение, нежели обращение к специалисту. Это может привести к большому количеству тяжелых осложнений.
Если у вас возникли болезненные ощущения в кишечной области, то вам стоит сразу же обратиться к гастроэнтерологу, который назначит полное проведение обследования, и в случае возникновения колита, выпишет вам прием соответствующих медикаментов и диеты для лечения заболевания. Далеко не при каждом виде колита назначаются антибиотики, однако, при тяжелых формах заболевания от этого никуда не деться. Какие же могут быть назначены лекарства совместно с антибиотиками? Как принимать их?
Метронидазол при колите
Метронидазол является противопротозойным и противомикробным препаратом, производным от 5-гитроимидазола. Воздействие заключается в том, что проводится биохимическое восстановление 5-нитрогруппы метронидазола посредством внутриклеточных транспортных протеинов анаэробного микроорганизма.
Препарат не имеет чувствительности к аэробным микроорганизмам и факультативным анаэробам, однако при наличии смешанного типа микрофлоры может воздействовать синергидно с антибиотиком, который эффективен против обычного типа аэробов.
Имеет свои противопоказания, заключающие в возникновении диарее и снижении аппетита, тошноте, рвоте, кишечных коликах, запорах, «металлическом» привкус во рту. Метронидазол прописывают больным колитом, так как после применения антибиотиков бывают различного рода осложнения или нежелательные последствия лечения.
Прием лекарства назначается только лечащим врачом в соответствии с клинической картиной больного, но зачастую прием по 500 мг 2 раза в сутки на протяжении 3-5 дней.
Как принимать Фталазол при колите?
Фталазол является сульфаниламидным препаратом, который в медленном темпе всасывается из полости желудочно-кишечного тракта. Основополагающая масса после введения внутрь будет задерживаться в кишечной полости, после чего начинает происходить отщепления активных молекулярных частей. Большая эффективность при лечении колита обуславливается тем, что создается высокая концентрация сульфаниламида в кишечной полости совместно с активностью препарата по отношению к кишечной флоре.
Перед тем, как назначить приём Фталазола совместно с антибиотиками, врачом определяется уровень чувствительности пациента. Какие рекомендации по приему Фталазола при колите:
- Взрослым: первые несколько дней по 1-2 г через каждые 4 часа, а последующие 3 дня половина дозы.
- Для детей назначается в 1 день 1,1г/кг в сутки. Препарат дается в равных дозах с перерывов в 4 часа и ночь. Последующий приём будет по 0,2-0,5 г с перерывом в 6-8 часов.
Альфа Нормикс при колите
Альфа Нормикс является антибиотиком, которое оказывает антибактериальное воздействие в широком спектре. Является бактерицидным препаратом, который назначается при колите. Он создает связь с бета-субъединицами бактериальных ферментов, и может ингибировать синтез РНК и бактериальных белков. Благодаря этому проявляются бактерицидные особенности по отношению к показателю чувствительности бактерий.
Благодаря антибактериальному спектру Альфа Нормикса при колите предоставляется возможность для снижения патогенных кишечных бактериальных нагрузок, обуславливающие некоторые патологические состояния. Данный препарат может снижать:
- Образование аммиака, вызванного бактериями.
- Повышенный уровень пролиферации.
- Наличие бактерий в полости ободочной кишки.
- Антигенную стимуляцию.
- Риск инфекционного осложнения.
Альфа Нормикс принимается внутрь. Для взрослых по 1 таблетке каждые 8 часов. Лечение не превышает 7 суток и должно быть определено клинической картиной пациента. Частота и доза может быть изменена врачом.
Левомицетин при колите
Препарат является антибиотиком, который эффективен в широком спектре грамположительных и грамотрицательных микроорганизмов. У него ярко выражено бактериостатическое воздействие, и при высокой концентрации по отношению к некоторым штаммам проявляется бактерицидное воздействие. После того, как был осуществлен пероральный прием, антибиотик быстро абсорбируется в полости желудочно-кишечного тракта.
Левомицетин выпускает в двух формах: таблетки и порошок для разведения инъекций. Таблетки принимаются за полчаса до приема пищи по 250 -500 мг для взрослых. Для детей рекомендовано употребление в дозе 125 мг 4 раза в сутки.
Антибиотик в порошке разводится при помощи 2-3 мг воды для инъекций внутримышечно. Продолжительность лечения Левомицетином при колите определяется только врачом.
Фуразолидон при колите
Фуразолидон является антибактериальным лекарственным средством группы нитрофуранов, синтетическим производным 5-нитрофурфуролом, которое обладает выраженным противомикробным взаимодействием по отношению к грамотрицательным аэробным микроорганизмам. Они в малой степени обладают чувствительностью к воздействию антибиотика грамположительных аэробных микроорганизмов.
Фармакологическое воздействие Фуразолидона при колите напрямую зависит от того, какая была применена доза, а если применять небольшие дозы, то просто оказывается бактериостатическая эффективность.
Препарат принимается перорально. Таблетка глотается целиком, её не нужно разжевывать или измельчать, при этом запивается большим количеством воды. Препарат пьют после употребления пищи. Длительность лечения колита Фуразолидоном и доза должны назначаться только врачом.
Какие бы не были у вас симптомы заболевания, все антибиотики при колите, должны прописываться строго специалистом.
Антибиотики при колите: названия и способы применения
Какие антибиотики пить при колите?
Пациенты, страдающие проблемами с кишечником, часто задаются вопросом: какие антибиотики пить при колите? Наиболее эффективными считаются те антибактериальные препараты, которые плохо всасываются в кишечнике в кровь и практически в неизмененном виде и в высоких концентрациях выводятся из организма с калом.
Также хороши антибактериальные препараты, обладающие широким спектром действия, потому что, во-первых, не всегда можно с точностью определить, какая микрофлора стала причиной колита.Кроме того, при тяжелых формах заболевания могут возникнуть осложнения в виде появления других кишечных инфекций. Поэтому важно выбрать наиболее эффективное средство от как можно большего количества видов патогенной микрофлоры.
Антибиотики, которые плохо всасываются в кровь, хороши еще и тем, что обладают низкой токсичностью для организма. При приеме внутрь может избавить пациента от большого количества побочных эффектов. В этом случае цель — уничтожение болезнетворных микроорганизмов в кишечнике будет достигнута.
Конечно, не всегда и не всем показаны именно эти препараты, поэтому ниже представлен список самых эффективных лекарств от колита, имеющих разные характеристики.
Названия антибиотиков при колите
В настоящее время существует множество антибактериальных препаратов, которые можно использовать для лечения проблем пищеварительной системы, вызванных бактериальной инфекцией. И, тем не менее, рекомендуем ориентироваться на проверенные временем препараты, доказавшие свою эффективность в борьбе с патогенной микрофлорой.
Названия антибиотиков от колита, рекомендуемые специалистами, следующие:
- Левомицетин.
- Тетрациклин.
- Олетатеррин.
- Полимиксин сульфат.
- Полимиксин-м сульфат.
- Стрептомицин сульфат.
- Неомицин сульфат.
- Мономицин.
Подразумевается, что необходимость приема любого из вышеперечисленных препаратов определит специалист, взвесив все достоинства и недостатки каждого препарата для лечения того или иного заболевания. В этом случае необходимо учитывать индивидуальные особенности пациента, наличие противопоказаний к выбранному препарату, а также высокую чувствительность к активным компонентам препарата, включая аллергические реакции.Кроме того, перед тем, как начать терапию с помощью выбранного лекарства, важно проверить, чувствительна ли патогенная микрофлора кишечника к действующим веществам препарата. Поэтому не стоит заниматься самолечением и назначать себе прием препарата самостоятельно без консультации и обследования у специалиста.
Антибиотики при язвенном колите
Язвенный колит — заболевание, характеризующееся воспалительными процессами в толстом кишечнике с образованием в нем язв.При этом чаще всего поражается слизистый эпителий прямой кишки, а также другие отделы толстой кишки. Заболевание бывает рецидивирующим или постоянно хроническим.
Язвенный колит возникает, как правило, по трем причинам: из-за нарушений иммунологического характера, из-за развития дисбактериоза кишечника и из-за изменившегося психологического состояния пациента. Антибиотики при язвенном колите можно использовать только во втором случае, когда причиной заболевания является какая-либо кишечная инфекция.
Дисбактериоз кишечника выявляется у семидесяти — ста процентов больных язвенным колитом. И чем тяжелее сам патогенный процесс, тем больше проявляется язвенный колит и тем чаще его можно обнаружить. Дисбактериоз кишечника принимает непосредственное участие в развитии язвенного колита. Это связано с тем, что условно-патогенная микрофлора кишечника в процессе жизнедеятельности продуцирует различные токсические производные и так называемые «ферменты агрессии».Все это приводит к повреждению стенок кишечника и повреждению клеток эпителия. Эти микроорганизмы способствуют тому, что в кишечнике и организме человека происходит суперинфекция, микробная аллергия и аутоиммунные процессы нарушения его деятельности.
В этом случае показано применение различных антибактериальных средств, устраняющих первопричину заболевания. Параллельно применяется диетическое питание, сульфасалазин и его производные, глюкокортикоиды и иммунодепрессанты, а также симптоматическая терапия.
[25], [26], [27], [28], [29], [30], [31], [32], [33]
Способ применения и дозы
Для того, чтобы использовать каждый препарат, необходимо внимательно прочитать дозировку, которая указана в инструкции. Хотя в большинстве случаев способ применения и дозы назначает специалист после консультации пациента. Не занимайтесь самолечением и прописывайте себе препарат из группы антибиотиков.
Обычно лекарство вводят следующим образом.
Таблетированная форма препарата предназначена для приема внутрь. Таблетка глотает целиком, не трескается и не раздавливается. Его необходимо запивать большим количеством жидкости.
Лекарство принимают за полчаса до еды. Если у пациентов наблюдается тошнота от препарата, то рекомендуется использовать его через час после окончания приема пищи. Лекарство принимают с равными интервалами.
Курс лечения и дозировку препарата назначает специалист, так как он индивидуален для каждого пациента.Обычно доза для взрослых составляет от двухсот пятидесяти до пятисот миллиграммов для каждого лекарства, что может быть от трех до четырех раз в день. Максимальная суточная доза препарата — четыре грамма.
Детям от трех до восьми лет препарат принимают по сто двадцать пять миллиграммов от трех до четырех раз в день. Детям от восьми до шестнадцати лет можно принимать лекарство в дозе двести пятьдесят миллиграммов три или четыре раза в день.
Обычный курс терапии занимает от семи до десяти дней.Если препарат хорошо переносится пациентом и отсутствуют побочные эффекты, курс лечения может увеличиться до четырнадцати дней.
Порошковая форма препарата используется как основа для раствора, который применяется как внутримышечно, так и внутривенно, то есть парентерально. В детском возрасте показано только внутримышечное введение препарата.
Раствор готовят следующим образом: содержимое флакона растворяют в двух-трех миллилитрах воды для инъекций.Также можно использовать такое же количество 0,25- или 0,5-процентного раствора новокаина. Раствор Левомицетина вводят глубоко в ягодичную мышцу, а именно в ее верхний квадрант.
Раствор для внутривенного введения готовят следующим образом: содержимое флакона необходимо растворить в десяти миллилитрах воды для инъекций или в том же количестве 5- или 40-процентного раствора глюкозы. Продолжительность инъекций составляет от трех минут, и они проводятся через равное время.
Курс лечения препаратом и дозировку рассчитывает специалист, исходя из индивидуальных особенностей пациента. Обычная разовая доза составляет от 500 до 1000 миллиграммов, которые принимают два-три раза в день. Максимальное количество лекарства — четыре грамма в день.
Дети и подростки от трех до шестнадцати лет могут употреблять лекарство дважды в день в количестве двадцати миллиграммов на килограмм тела пациента.
Предварительно необходимо определить, насколько патогена микрофлора пациента к препарату.Препарат применяют внутрь.
Взрослые принимают двести пятьдесят миллиграммов каждые шесть часов. Суточная доза может достигать двух граммов. Детям с семи лет препарат назначают по двадцать пять миллиграммов каждые шесть часов. Капсулы глотают, не разжевывая.
Таблетки тетрациклин-депо назначают взрослым по одной штуке каждые двенадцать часов в первый день, а в последующие — по одной штуке в день (375 миллиграммов). Дети принимают препарат в первый день по одной штуке каждые двенадцать часов, а затем в последующие дни — по одной штуке в день (120 миллиграммов).
Суспензии предназначены для детей в количестве от двадцати пяти до тридцати миллиграммов на килограмм веса в сутки, это количество препарата делят на четыре приема.
Сиропыупотребляют взрослые по семнадцать миллилитров в день, разделенные на четыре приема. Для этого используется один-два грамма гранул. Дети принимают сироп в количестве от двадцати до тридцати миллиграммов на килограмм веса ребенка. Этот объем препарата разделен на четыре суточных приема.
Препарат принимают внутрь. Лучше всего употреблять лекарство за полчаса до еды, при этом препарат следует запивать большим количеством питьевой воды в объеме до двухсот миллилитров.
Капсулы проглатываются, нарушить целостность их оболочек невозможно.
Курс лечения и дозировку препарата определяет специалист, исходя из особенностей пациента и характера его заболевания.
Обычно взрослые и подростки принимают по одной капсуле препарата четыре раза в сутки.Лучше всего делать это через одинаковые промежутки времени, например, через шесть часов. Тяжелая форма заболевания — показание к увеличению дозировки препарата. Максимум можно принимать до восьми капсул в день. Средняя продолжительность лечения от пяти до десяти дней.
Перед приемом препарата важно определить наличие чувствительности к этому агенту у патогенной микрофлоры, спровоцировавшей заболевание.
Внутримышечное и внутривенное (капельное) введение происходит только в стационарных условиях под контролем специалистов.
Для внутримышечного метода требуется от 0,5 до 0,7 миллиграммов на килограмм веса пациента, которые используются три или четыре раза в день. Максимальная суточная доза не более двух часов
Инфекция C. difficile — Диагностика и лечение
Диагноз
Врачи часто подозревают C. difficile у любого, кто страдает диареей и имеет другие факторы риска заболевания C. difficile. В таких случаях врачи могут назначить один или несколько из следующих тестов.
Тесты стула
Токсины, вырабатываемые бактериями C. difficile, обычно можно обнаружить в образце стула. Существует несколько основных типов лабораторных тестов, в том числе:
- Полимеразная цепная реакция. Этот чувствительный молекулярный тест позволяет быстро обнаружить ген токсина B C. difficile в образце стула и является очень точным.
- GDH / EIA. В некоторых больницах используется тест на глутаматдегидрогеназу (GDH) в сочетании с тестом иммуноферментного анализа (EIA). GDH — очень чувствительный анализ, позволяющий точно исключить присутствие C. difficile в образцах стула.
- Иммуноферментный анализ. Иммуноферментный анализ (EIA) быстрее, чем другие тесты, но недостаточно чувствителен для выявления многих инфекций и имеет более высокий уровень ложно нормальных результатов. Обычно это не единственный используемый тест.
- Анализ цитотоксичности клеток. Тест на цитотоксичность исследует влияние токсина C. difficile на человеческие клетки, выращенные в культуре.Этот тип теста чувствителен, но он менее широко доступен, более сложен и требует от 24 до 48 часов для получения результатов. Обычно он используется в исследовательских целях.
В тестах на наличие C. difficile нет необходимости, если у вас нет диареи или водянистого стула, и они бесполезны для последующего лечения. Если у вас нет диареи, не следует проверять стул на C. difficile.
Обследование толстой кишки
В редких случаях для подтверждения диагноза C.difficile и поищите альтернативные причины ваших симптомов, врач может осмотреть внутреннюю часть толстой кишки. Этот тест (гибкая ректороманоскопия или колоноскопия) включает в себя введение гибкой трубки с маленькой камерой на одном конце в толстую кишку для поиска участков воспаления и псевдомембран.
Визуальные тесты
Если ваш врач обеспокоен возможными осложнениями, вызванными C. difficile, он или она может заказать рентген брюшной полости или компьютерную томографию (КТ), которая предоставит изображения вашей толстой кишки.Сканирование позволяет обнаружить такие осложнения, как утолщение стенки толстой кишки, расширение кишечника или, что реже, отверстие (перфорация) в слизистой оболочке толстой кишки.
Лечение
Первым шагом в лечении C. difficile является прекращение приема антибиотика, вызвавшего инфекцию, когда это возможно. В зависимости от серьезности инфекции, лечение может включать:
Антибиотики. Как ни странно, стандартное лечение C.difficile — еще один антибиотик. Эти антибиотики предотвращают рост C. difficile, что, в свою очередь, лечит диарею и другие осложнения. Ваш врач может назначить ванкомицин (Vancocin HCL, Firvanq) или фидаксомицин (Dificid).
Метронидазол (Флагил) может использоваться редко, если ванкомицин или фидаксомицин недоступны.
- Хирургия. Для людей, страдающих сильной болью, органной недостаточностью, токсическим мегаколоном или воспалением слизистой оболочки брюшной стенки, операция по удалению пораженной части толстой кишки может быть единственным вариантом.
Рецидивирующая инфекция
До 20% людей с C. difficile снова заболевают либо потому, что первоначальная инфекция так и не прошла, либо потому, что они были повторно инфицированы другим штаммом бактерий.
Ваш риск повторения выше, если вы:
- Старше 65
- Принимают другие антибиотики при другом заболевании, пока лечатся антибиотиками от инфекции C. difficile
- Имеете тяжелое основное заболевание, такое как хроническая почечная недостаточность, воспалительное заболевание кишечника или хроническое заболевание печени
Лечение рецидива болезни может включать:
- Антибиотики. Антибактериальная терапия при рецидиве может включать один или несколько курсов лечения. Как правило, рекомендации не рекомендуют повторять ту же терапию, которая использовалась для начальной инфекции и рецидива инфекции. Эффективность антибактериальной терапии снижается с каждым последующим рецидивом.
Трансплантат фекальной микробиоты (FMT). Также известный как трансплантат кала, FMT становится альтернативной стратегией лечения рецидивирующих инфекций, вызванных C. difficile.Хотя FMT считается экспериментальным и еще не одобрен FDA, клинические исследования в настоящее время продолжаются.
FMT восстанавливает здоровые кишечные бактерии, помещая стул другого человека (донора) в толстую кишку через колоноскоп или назогастральный зонд. Доноры проходят скрининг на наличие заболеваний, их кровь проверяется на инфекции, а стул тщательно проверяется на паразиты, вирусы и другие инфекционные бактерии, прежде чем использовать их для FMT .
Исследования показали, что FMT , выполненный один или несколько раз, имеет вероятность успеха более 85% при лечении инфекций, вызванных C. difficile.
- Пробиотики. Пробиотики — это организмы, такие как бактерии и дрожжи, которые продаются без рецепта. Роль этих продуктов в заражении C. difficile противоречива. Исследования не всегда доказывают, что доступные в настоящее время продукты помогают предотвратить или лечить инфекцию, вызванную C. difficile. Продвинутые пробиотики в настоящее время изучаются на предмет их потенциального использования при C.difficile, но в настоящее время недоступны.
Клинические испытания
Изучите исследования клиники Mayo Clinic, в которых тестируются новые методы лечения, вмешательства и тесты как средства предотвращения, обнаружения, лечения или управления этим заболеванием.
Образ жизни и домашние средства
Поддерживающее лечение диареи включает:
- Жидкости много. Выбирайте жидкости, содержащие воду, соль и сахар, например разбавленные фруктовые соки, безалкогольные напитки и бульоны.
- Полноценное питание. Если у вас водянистый понос, ешьте крахмалистые продукты, например картофель, лапшу, рис, пшеницу и овсянку. Другой хороший выбор — соленые крекеры, бананы, суп и вареные овощи. Если вы не голодны, сначала вам может потребоваться жидкая диета. После того, как диарея пройдет, у вас могут возникнуть временные трудности с перевариванием молока и молочных продуктов.
Янв.04, 2020
Определение антибиотиков в медицинском словаре
Антибиотики
Определение
Антибиотики можно неофициально определить как подгруппу противоинфекционных средств, которые получены из бактериальных источников и используются для лечения бактериальных инфекций. Другие классы препаратов, в первую очередь сульфаниламиды, могут быть эффективными антибактериальными средствами. Аналогичным образом, некоторые антибиотики могут иметь вторичное применение, например, демеклоциклин (декломицин, производное тетрациклина) для лечения синдрома несоответствующей секреции антидиуретического гормона (SIADH).Другие антибиотики могут быть полезны при лечении протозойных инфекций.Назначение
Антибиотики используются для лечения или профилактики бактериальной инфекции.
Описание
Классификации
Хотя существует несколько схем классификации антибиотиков, основанных на бактериальном спектре (широкий или узкий), пути введения (инъекционный или пероральный или местный) или типе активности (бактерицидный или бактериостатический), наиболее полезный основан на химической структуре.Антибиотики в рамках структурного класса обычно демонстрируют сходные модели эффективности, токсичности и аллергического потенциала.
ПЕНИЦИЛЛИНОВ. Пенициллины являются старейшим классом антибиотиков и имеют общую химическую структуру, которую они разделяют с цефалопсоринами. Эти две группы классифицируются как бета-лактамные антибиотики и обычно обладают бактерицидным действием, то есть убивают бактерии, а не препятствуют их росту. Пенициллины можно подразделить на другие группы. Натуральные пенциллины основаны на оригинальной структуре пенициллина G. Пенициллины, устойчивые к пенициллиназе, особенно метициллин и оксациллин, активны даже в присутствии бактериального фермента, который инактивирует большинство природных пенициллинов.Аминопенициллины, такие как ампициллин и амоксициллин, обладают расширенным спектром действия по сравнению с природными пенициллинами; Пенициллины расширенного спектра действия эффективны против более широкого круга бактерий. Обычно они включают покрытие для Pseudomonas aeruginaosa и могут обеспечивать пенициллин в комбинации с ингибитором пенициллиназы. ЦЕФАЛОСПОРИНЫ. Цефалоспорины и близкородственные цефамицины и карбапенемы, такие как пенциллины, содержат бета-лактамную химическую структуру.Следовательно, среди препаратов этих классов существуют образцы перекрестной резистентности и перекрестной аллергенности. Лекарства «головного мозга» являются одними из самых разнообразных классов антибиотиков и сами подразделяются на 1, 2 и 3 поколения. Каждое поколение имеет более широкий спектр деятельности, чем предыдущее. Кроме того, цефокситин, цефамицин, очень активен в отношении анаэробных бактерий, что позволяет применять его при лечении инфекций брюшной полости. Препараты 3-го поколения, цефотаксим, цефтизоксим, цефтриаксон и другие, проникают через гематоэнцефалический барьер и могут использоваться для лечения менингита и энцефалита.Цефалопсорины обычно являются предпочтительными средствами для хирургической профилактики.ФЛУРОХИНОЛОНЫ. Фторхинолоны являются синтетическими антибактериальными агентами, а не производными бактерий. Они включены сюда, потому что их можно легко заменить традиционными антибиотиками. Более ранний родственный класс антибактериальных средств, хинолоны, плохо всасывался и мог использоваться только для лечения инфекций мочевыводящих путей. Фторхинолоны, относящиеся к более старшей группе, представляют собой бактерицидные препараты широкого спектра действия, которые химически не связаны с пенициллинами или цефалопрозинами.Они хорошо распределяются в костной ткани и настолько хорошо всасываются, что в целом они столь же эффективны при пероральном введении, как и при внутривенной инфузии.
ТЕТРАЦИКЛИНЫ. Тетрациклины получили свое название, потому что имеют общую химическую структуру, состоящую из четырех колец. Они происходят от вида бактерий Streptomyces вида . Бактериостатические агенты широкого спектра действия, тетрациклины, могут быть эффективны против широкого спектра микроорганизмов, включая риккетсии и амебных паразитов.
МАКРОЛИДЫ.Макролидные антибиотики получены из бактерий Streptomyces и получили свое название, потому что все они имеют макроциклическую лактоновую химическую структуру. Эритромицин, прототип этого класса, имеет спектр и применение, аналогичное пенициллину. Новые члены группы, азитромицин и кларитиромицин, особенно полезны из-за их высокого содержания . Различные антибиотики уничтожают бактерии по-разному. Некоторые сокращают процессы, посредством которых бактерии получают энергию. Другие нарушают структуру стенки бактериальной клетки, как показано на иллюстрации выше.Третьи мешают производству основных белков.(Иллюстрация Electronic Illustrators Group.)
уровень проникновения в легкие. Кларитромицин широко используется для лечения инфекций Helicobacter pylori , вызывающих язву желудка. Другие классы антибиотиков включают аминогликозиды, которые особенно полезны из-за их эффективности при лечении инфекций, вызванных Pseudomonas aeruginosa ; линкозамины, клиндамицин и линкомицин, которые обладают высокой активностью в отношении анаэробных патогенов.Существуют и другие индивидуальные лекарства, которые могут быть полезны при определенных инфекциях.Рекомендуемая дозировка
Дозировка зависит от препарата, пути введения, патогена, места инфекции и степени тяжести. Дополнительные соображения включают функцию почек, возраст пациента и другие факторы. Проконсультируйтесь с рекомендациями производителя по дозировке и способу введения.
Ключевые термины
Бактерии — Крошечные одноклеточные формы жизни, вызывающие множество болезней и инфекций. Воспаление — Боль, покраснение, припухлость и жар, которые обычно возникают в результате травмы или болезни. Менингит — Воспаление тканей, окружающих головной и спинной мозг. Микроорганизм — Организм, который слишком мал, чтобы его можно было увидеть невооруженным глазом. Организм — Отдельная независимая единица жизни, такая как бактерия, растение или животное. Категория беременности — Система классификации лекарств в соответствии с установленными рисками их использования во время беременности. Категория A: контролируемые исследования на людях не выявили риска для плода. Категория B: исследования на животных указывают на отсутствие риска для плода, но не на людях; или побочные эффекты у животных, но не в хорошо контролируемых исследованиях на людях.Категория C: Нет адекватных исследований на людях или животных; или неблагоприятные эффекты на плод в исследованиях на животных, но данных на людях нет. Категория D: свидетельство риска для плода, но преимущества перевешивают риски. Категория X: Доказательства риска для плода. Риски перевешивают любые преимущества.Побочные эффекты
Все антибиотики вызывают риск чрезмерного роста нечувствительных бактерий. Производители перечисляют другие основные опасности по классам; тем не менее, поставщик медицинских услуг должен рассматривать каждый препарат индивидуально, чтобы оценить степень риска.Как правило, грудное вскармливание не рекомендуется во время приема антибиотиков из-за риска изменения кишечной флоры ребенка и риска маскировки инфекции у ребенка. Чрезмерное или неправильное использование может способствовать росту устойчивых патогенов.
Пенициллины: гиперчувствительность может быть обычным явлением, и сообщалось о перекрестной аллергенности с цефалоспоринами. Во время беременности пенициллины относятся к категории B.Цефалопсорины: Несколько цефалопсоринов и родственных соединений были связаны с судорогами.Цефметазол, цефоперазон, цефотетан и цефтриаксон могут быть связаны со снижением активности протромбина и нарушениями коагуляции. Сообщалось о псевдомембранозном колите при приеме цефалоспоринов и других антибиотиков широкого спектра действия. Некоторые препараты этого класса могут вызывать почечную токсичность. Категория беременности B.
Фторхинолоны: Ломефлоксацин связан с повышенной светочувствительностью. Все препараты этого класса вызывают судороги. Категория беременности C. Тетрациклины: демеклоциклин может вызывать повышенную светочувствительность.Миноциклин может вызвать головокружение. Не используйте тетрациклины у детей младше восьми лет и особенно в периоды развития зубов. Оральные тетрациклины связываются с анионами, такими как кальций и железо. Хотя доксициклин и миноциклин можно принимать во время еды, пациентам следует рекомендовать принимать другие антибиотики тетрациклинового ряда натощак и не принимать препараты с молоком или другими продуктами, богатыми кальцием. Никогда не следует назначать тетрациклин с истекшим сроком годности. Категория беременности D. Применение во время беременности может вызвать нарушения в развитии костей.Макролиды: эритромицин может усугубить слабость пациентов с миастенией. Азитромицин в редких случаях был связан с аллергическими реакциями, включая ангионевротический отек, анафилаксию и дерматологические реакции, включая синдром Стивенса-Джонсона и токсический эпидермальный некролиз. Пероральный эритромицин может вызывать сильное раздражение желудка, а при введении в виде инъекций может вызвать тяжелый флебит. Эти препараты следует применять с осторожностью пациентам с нарушением функции печени. Категория беременности B: азитромицин, эритромицин.Категория беременности C: кларитромицин, диритромицин, тролеандомицин. Аминогликозиды: препараты этого класса вызывают ототоксичность и почечную токсичность. Эти проблемы могут возникнуть даже при использовании обычных доз. Дозирование должно основываться на функции почек с периодическим исследованием функции почек и слуха. Категория беременности D.Рекомендуемое применение
Чтобы свести к минимуму риск побочных реакций и развития резистентных штаммов бактерий, следует ограничить использование антибиотиков в случаях, когда известно или имеется обоснованное предположение о бактериальной инфекции.Следует избегать использования антибиотиков при вирусных инфекциях. Избегайте использования фторхинолонов при банальных инфекциях.
При тяжелых инфекциях может быть целесообразна презумптивная терапия антибиотиками широкого спектра действия, такими как цефалоспорин 3-го поколения. Лечение следует сменить на средство узкого спектра действия, как только возбудитель будет идентифицирован. Если после 48 часов лечения наступит клиническое улучшение, следует рассмотреть возможность перорального приема антибиотиков.
Ресурсы
Периодические издания
«Внимание потребителей: устойчивость к антибиотикам растет!» Информационный бюллетень Народного медицинского общества 16 (август 1997 г.): 1.
Медицинская энциклопедия Гейла. Copyright 2008 The Gale Group, Inc. Все права защищены.
Обсуждение пациентом антибиотиков
В. Могу ли я прекратить прием антибиотиков? Врач прописал мне антибиотики на 10 дней. Принимаю их 5 дней, чувствую себя лучше. Могу я перестать их принимать?
A. вам нужно принять все свои таблетки, иначе они могут вернуться.
В. Почему важно не использовать антибиотики часто? Почему мой врач всегда так неохотно прописывает мне антибиотики?
А. Устойчивость к антибиотикам стала серьезной проблемой как в развитых, так и в слаборазвитых странах. К 1984 году у половины больных туберкулезом в Соединенных Штатах был штамм, устойчивый по крайней мере к одному антибиотику. В определенных условиях, например в больницах и некоторых детских учреждениях, уровень устойчивости к антибиотикам настолько высок, что обычные недорогие антибиотики практически бесполезны для лечения часто встречающихся инфекций. Это приводит к более частому использованию новых и более дорогих соединений, что, в свою очередь, приводит к повышению устойчивости к этим лекарствам.Начинается борьба за разработку новых антибиотиков, чтобы предотвратить поражение в будущих битвах с инфекцией. Поэтому врачи стараются избегать использования антибиотиков, когда в этом нет необходимости, и стараются сохранить определенное ограниченное использование этих лекарств.
В. Лечят ли антибиотики простуду? У меня простуда и насморк, следует ли мне принимать антибиотики?
A. Прием антибиотиков только при простуде может снизить ваши шансы на эффективность использования антибиотиков в случае серьезной проблемы.Ваш организм может выработать иммунитет к антибиотикам, поэтому их рекомендуется принимать только тогда, когда ваша иммунная система не может бороться с инфекциями. В большинстве случаев простуде нужно просто протекать, поэтому употребление большого количества жидкости и отдых могут позволить вашему телу омолодиться и бороться с простудой. Чтобы предотвратить простуду и вирусы, ищите продукты, которые помогают поддерживать хорошую иммунную систему, такие как витамин С. Сок алоэ — еще один хороший продукт для вашей иммунной системы. Когда мы сталкиваемся со стрессом и недостаточно отдыхаем, мы наносим ущерб нашей иммунной системе, поэтому профилактика может быть лучшим решением.Желаю вам удачи!
Дополнительные обсуждения об антибиотикахЭтот контент предоставляется iMedix и регулируется Условиями iMedix. Вопросы и ответы не одобряются и не рекомендуются и предоставляются пациентами, а не врачами.
Лечение антибиотиками может сопровождаться кишечными инфекциями. Зачем?
Ученые из Медицинской школы Стэнфордского университета объясняют, почему два потенциально смертельных патогена после лечения антибиотиками закрепляются в неблагоприятной среде кишечника.
Исследователи написали в журнале Nature , что их выводы могут помочь определить способы противодействия последствиям истощения «дружественных кишечных бактерий» после лечения антибиотиками.
Некоторые кишечные патогены могут вызывать серьезные проблемы во время курса антибиотиков. Старший автор, Джастин Зонненбург, доктор философии, сказал: «Антибиотики открывают двери для этих патогенов, чтобы они могли прижиться. Но как именно это происходит, не совсем понятно ».
Авторы объяснили, что количество углеводов в кишечнике значительно увеличивается через двадцать четыре часа после приема пероральных антибиотиков.Этот временный избыток углеводов плюс уменьшение количества «полезных бактерий» в кишечнике позволяет как минимум двум потенциально опасным для жизни патогенам быстро размножаться.
За последние десять лет ученые добились огромного прогресса в понимании того, что происходит в «сложной микробной экосистеме», существующей в толстом кишечнике каждого здорового млекопитающего, включая человека ».
Около 1000 различных типов микробов гармонично сосуществуют в кишечнике типичного здорового человека.Эти штаммы бактерий, населяющие эту сложную, но богатую питательными веществами нишу, адаптировались чрезвычайно хорошо, причем настолько хорошо, что без них нам было бы сложно выжить.
Дружественные бактерии, обитающие в кишечнике, синтезируют витамины, они являются ключом к управлению нашей иммунной системой, они участвуют в развитии и поддержании наших собственных тканей — они даже помогают регулировать кровяное давление.
Антибиотики разрушают экосистему кишечных микробов . Хорошие бактерии начинают быстро размножаться в течение нескольких дней, а в течение месяца их количество возвращается к норме.Однако, по словам авторов, «экосистема, по-видимому, страдает от безвозвратной утраты некоторых из составляющих ее бактериальных штаммов».
Ученые сравнивают эти полезные бактерии с газоном, который уничтожает сорняки (болезнетворные бактерии), с богатыми удобрениями, которые проходят через наш кишечник. Предыдущие исследования показали, что наши дружелюбные клопы выделяют химические вещества, которые мешают патогенным бактериям взять под контроль.
Существует теория, что когда нарушается наша внутренняя микробная экосистема, страдает реакция нашей иммунной системы.
Зонненбург сказал:
«Хотя эти гипотезы ни в коем случае не исключают друг друга, наша работа специально поддерживает предположение, что наши постоянные микробы сдерживают патогены, конкурируя за питательные вещества».
Когда эти защитные механизмы ослаблены, что обычно происходит вскоре после начала курса антибиотиков, патогенные микроорганизмы, такие как Clostridium difficile , могут найти точку опоры.
Как только эти два паразитических захватчика размножаются до достаточного количества, они вызывают воспаление. Хотя воспаление не является хорошей средой для восстановления полезных бактерий, C. difficile и сальмонелла процветают в нем .
Зонненбург и его коллеги сосредоточились на двух определенных питательных веществах в кишечнике — фукозе и сиаловой кислоте — обоих членах семейства сахаров. Это не сахара, с которыми большинство людей знакомо, но они жизненно важны для здорового выживания и производятся в каждой клетке человеческого тела. Они также содержатся в молочных продуктах, яйцах и мясе.
Клетки, выстилающие кишечник, выделяют длинные цепочки знакомых и экзотических сахаров, которые соединяются вместе, образуя слизь.
Слизь выполняет две функции:
- она предотвращает прохождение резидентных микробов через стенку кишечника в кровоток
- это жизненно важный источник пищи нескольких сахаров, включая сиаловую кислоту и фукозу, для местных микробов
«Наши кишечные микробы стали очень искусными в поедании слизи».
Зонненбург и его коллеги экспериментировали на лабораторных мышах, которые были выращены в среде, свободной от микробов. Эти мыши сильно отличались от нормальных мышей — в их кишечнике не было бактерий.
Ученые ввели единственный бактериальный штамм этим стерильным животным — Bacteroides thetaiotaomicron , дружественный бактериальный штамм, который обитает в кишечнике нормальных мышей и людей. B. theta содержит ферменты, которые отделяют молекулы сахара от цепочек слизи, свисающих со слизистой оболочки кишечника. B. theta не хватает ферментов для расщепления молекул, из которых состоит сиаловая кислота.
Может показаться бессмысленным для B. theta отделять молекулы сахара, которые он не может расщепить для употребления в пищу.Однако в нормальном кишечнике есть несколько других микробов, которые могут расщеплять молекулы сиаловой кислоты и фукозы. Нормальный кишечник полон микробов, которые могут измельчать продукты, в которых B. theta не может, но в которых нуждается.
Авторы называют это бартерной системой, экологи — симбиозом. (Возможно, B. theta разрыхляет эти сахарные остатки, чтобы добраться до других, съедобных остатков сахара под ними.)
В ряде экспериментов ученые вводили либо C. difficile , либо штамм Salmonella S.typhimurium у мышей, ранее свободных от микробов, которые были загружены B. theta . Оба эти штамма бактерий потенциально опасны для жизни, когда вызывают заболевание у пациентов, получающих антибиотики. Они также потребляют сиаловую кислоту для получения энергии, но не могут удалить ее из кишечной слизи.
Обнаружив, что C. difficile не может ни расщеплять фукозу, ни потреблять ее, команда сосредоточилась на том, как эти два патогена использовали сиаловую кислоту.
Путем введения одного патогенного и одного дружественного бактериального штамма в кишечник мышей, ранее не зараженных микробами, исследователи смогли продемонстрировать, что уровни сиаловой кислоты значительно увеличились в отсутствие полноценной микробной экосистемы кишечника, которая остановила бы их рост. .Наличие в кишечнике мышей всего лишь одного штамма хороших бактерий было приближенным к экосистеме кишечных микробов, уничтоженной антибиотиками.
И B theta , и S. typhimurium реплицировались быстрее в присутствии этих сахаров и никаких других конкурирующих микробов. B. theta создавал избыток сиаловой кислоты, который был настоящим праздником для патогенного штамма .
Затем ученые наблюдали, какое действие антибиотики могут оказывать на «нормальных» мышей с кишечными экосистемами.Они сообщили о таком же увеличении количества сиаловой кислоты и популяционном взрыве патогенных бактерий. Если мышей лечили только антибиотиками и не подвергали воздействию патогенов, уровни сиаловой кислоты приходили в норму в течение примерно трех дней, поскольку полезные бактерии начинали восстанавливаться.
Зонненбург сказал:
«Плохие парни в кишечнике поглощают питательные вещества, которые были высвобождены хорошими парнями, которые стали жертвами побочного ущерба, нанесенного антибиотиками. Антибиотики заставляют наши дружественные кишечные бактерии невольно помогать этим патогенам.
Мы считаем, что бактериальные патогены в кишечнике вызывают заболевание в два этапа. Другие показали, что как только эти патогены достигают достаточного количества, они используют уловки, вызывающие воспаление, чтобы уничтожить наших местных дружественных микробов — бесплатно для самих патогенов, потому что они разработали способы борьбы с этим. Но сначала они должны преодолеть критическое препятствие: при отсутствии воспаления, которое они пытаются вызвать, они должны каким-то образом достичь этой критической массы. Наша работа показывает, как они справляются с этим после приема дозы антибиотиков.Они пользуются преимуществом временного скачка количества доступных сахаров, выделяемых из кишечной слизи, оставленной убитыми комменсальными микробами ».
Команда считает, что однажды мы сможем создать лекарство, которое подавляет ферменты, используемые дружественными кишечными бактериями для высвобождения сиаловой кислоты из слизи, тем самым лишая патогенов их полноценного питания. Затем лекарство можно назначать вместе с антибиотиками. Они добавили, что пробиотики в виде штаммов бактерий, которые быстро переваривают сиаловую кислоту, также могут достичь аналогичного эффекта.
Исследование финансировалось Фондом Burroughs Wellcome и Национальными институтами здравоохранения (грант R01-DK085025).
Границы | Стратегии на основе пробиотиков для терапевтического и профилактического использования против множественных желудочно-кишечных заболеваний
Микробная экология желудочно-кишечного тракта человека
Микробиота кишечника человека представляет собой сложную экосистему, оказывающую значительное влияние на здоровье и благополучие человека, способствуя созреванию иммунной системы и обеспечивая прямой барьер против колонизации патогенов (Doré and Corthier, 2010).Он состоит из бактерий, архей, некоторых простейших, анаэробных грибов и различных бактериофагов и вирусов, и было подсчитано, что более 1000 видов микробов населяют кишечник человека (Tuohy et al., 2012). Присутствие большого количества микробов (до 5 × 10 11 бактериальных клеток на грамм содержимого кишечника) предполагает сильное регулирующее воздействие на человека-хозяина, а недавние результаты показывают, что микробиота кишечника может оказывать значительное влияние на наш вес. и настроение (Duca et al., 2014; Naseribafrouei et al., 2014). Состав и функция популяций микробов человека, связанных с различными участками тела, были изучены с помощью метагеномных инструментов в рамках двух недавних инициатив — проекта NIH Human Microbiome Project (HMP) и проекта European Metagenomics of the Human Intestine (metaHIT) ( Рабочая группа NIH HMP и др., 2009; Душко Эрлих и MetaHIT Consortium, 2011). Эти массовые молекулярные подходы уже выявили наличие трех различных кластеров или энтеротипов, которые соответствуют одному из трех наиболее распространенных родов кишечника человека — Bacteroides, Prevotella и Ruminococcus (Arumugam et al., 2013).
Бактерии, которые первоначально колонизируют толстую кишку младенца, являются факультативными анаэробами, такими как Escherichia coli и Streptococcus sp. Эти виды метаболизируют кислород в кишечнике, тем самым создавая анаэробные условия. Последующая колонизация во многом зависит от профиля питания и факторов окружающей среды (то есть санитарных условий). Было показано, что после полного формирования микрофлоры желудочно-кишечного тракта в ее состав входят такие роды, как Bacteroides, Bifidobacterium, Eubacterium, Clostridium, Lactobacillus, Fusobacterium и различные грамположительные кокки (Fooks et al., 1999; Wallace et al., 2011).
В желудочно-кишечном тракте (ЖКТ) микробиота выполняет различные функции, такие как переваривание основных питательных веществ и созревание эпителиальных клеток кишечника. Исследования на мышах показали ряд значительных эффектов микробиоты на хозяина: у реконструированных мышей, лишенных микробов, их кишечный эпителий был толще, кинетика энтероцитов — быстрее, короткоцепочечные жирные кислоты продуцировались в значительно более высоких концентрациях, и имелся нормальный уровень иммунологической активности по сравнению с стерильными животными (Aureli et al., 2011). Микробы также обладают способностью влиять на физиологические параметры, оказывая системное воздействие на липиды крови и в целом влияя на иммунную систему, а также подавляя вредные бактерии (Mikelsaar, 2011). Ингибирование патогенов кишечной микробиотой человека может обеспечить значительную пользу для здоровья человека за счет защиты от инфекции в качестве естественного барьера против воздействия патогенов в ЖКТ (Wallace et al., 2011). Такие факторы, как заражение пищевых продуктов патогенами, а также высокая концентрация антибиотиков в почве и кормах для животных, могут влиять на микробную экологию ЖКТ человека (Sapkota et al., 2007). Используя молекулярно-генетические инструменты, было показано, что антибиотики могут вызывать значительные изменения в доминирующей микробиоте толстой кишки, которые не обнаруживаются с помощью бактериологических (основанных на культуре) методов, с эффектами до 2 месяцев (Mangin et al., 1999). Несколько более специфических заболеваний включают нарушение экологии микрофлоры человека: острый гастроэнтерит, инфекция Clostridium difficile, (CDI), некротизирующий энтероколит у новорожденных, синдром раздраженного кишечника и инфекция Helicobacter pylori (Kotzampassi and Giamarellos-Bourboulis, 2012).Пробиотики в настоящее время изучаются на предмет их потенциального лечения этих вышеупомянутых заболеваний.
Пробиотические бактерии
В соответствии с популярным определением Продовольственной и сельскохозяйственной организации Объединенных Наций / Всемирной организацией здравоохранения и с грамматическими изменениями, внесенными Hill et al. (2014) пробиотики определены как «живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина» (FAO / WHO, 2001). К наиболее распространенным пробиотикам относятся представители лактобацилл, энтерококков, бифидобактерий и дрожжей (таблица 1).Кроме того, для достижения комплексного положительного эффекта пробиотиков можно использовать бактериальные смеси (Caballero-Franco et al., 2007).
ТАБЛИЦА 1. Микроорганизмы с заявленным пробиотическим потенциалом.
Предполагаемая польза для здоровья от пробиотиков включает уменьшение количества вредных организмов в кишечнике, выработку антимикробных факторов и стимуляцию иммунного ответа организма (Collado et al., 2007; Foligné et al., 2010; Konieczna et al., 2013). Некоторые из полезных эффектов пробиотиков (например,g., снижение уровня холестерина) еще предстоит подтвердить хорошо контролируемыми клиническими испытаниями. Тем не менее, растет число исследований, предоставляющих данные о влиянии пробиотических бактерий на иммунную систему человека и микрофлору ЖКТ (Holzapfel and Schillinger, 2002; Foligne et al., 2007; Verdú et al., 2009; Wen et al., др., 2012). Все чаще появляются сообщения о том, что микробиом человека / животного играет центральную роль в других ключевых аспектах функциональности здоровья, включая положительное влияние на лечение метаболических нарушений, таких как ожирение и диабет 2 типа, улучшение функции кишечника у пациентов с колоректальным раком. , потенциальные когнитивные и улучшающие настроение преимущества, антидепрессант и анксиолитическая (успокаивающая) активность (Desbonnet et al., 2008; Bravo et al., 2011; DiBaise et al., 2012; Ли и др., 2014a; Owen et al., 2014). Последний анксиолитический эффект даже привел к появлению нового термина «психобиотик», введенного Динаном и соавт. (2013) как «живой организм, который при проглатывании в достаточных количествах приносит пользу для здоровья пациентов, страдающих психическим заболеванием».
Продукты, содержащие пробиотические бактерии, обычно включают пищевые добавки и пищевые добавки. Живые пробиотики обычно доступны в кисломолочных продуктах и продуктах, обогащенных пробиотиками.Эти бактерии добавляются в различные продукты и напитки, от йогуртов до сухих завтраков. Существуют также таблетки, капсулы, порошки и саше, содержащие пробиотики в лиофилизированной форме. Функциональные продукты питания, определяемые как пищевые продукты с различными свойствами, связанными со здоровьем, часто включают штаммы бактерий с заявленными пробиотическими свойствами (Turroni et al., 2011). Научный интерес к пробиотикам растет в геометрической прогрессии: поиск опубликованных статей с ключевым словом «пробиотик» в базе данных NIH PubMed выявил 7265 статей за период с 2000 по 2010 год, 953 из которых являются клиническими испытаниями.В течение следующих 5 лет (до 20 мая 2015 г.) частота публикаций удвоилась: опубликовано 7979 статей, в том числе 778 клинических испытаний.
Молочнокислые бактерии
Молочнокислые бактерии (ЛАБ) представляют собой грамположительные неспорообразующие кокки, коккобациллы или палочки, которые, как правило, не имеют респираторного (ферментативного) метаболизма и лишены истинной каталазы. В отличие от бифидобактерий, которые активны в нижних отделах толстой кишки, лактобактерии преобладают в верхних отделах ЖКТ (Turroni et al., 2011). Эта группа также является нормальным членом микрофлоры человека, обнаруженной в ротовой полости, тонком кишечнике и эпителии влагалища, где, как считается, она играет полезную роль (Gomes and Malcata, 1999). Среди положительных эффектов лактобациллы могут улучшить пищеварение, всасывание и доступность питательных веществ (Wallace et al., 2011). Кроме того, LAB способны гидролизовать соединения, которые ограничивают биодоступность минералов, таких как танин и фитат, из-за активности танинацилгидролазы и фитазы (Turpin et al., 2010). Кроме того, было показано, что некоторые штаммы лактобацилл могут усиливать всасывание минералов в клетках Caco-2 и улучшать пищевой статус хозяина за счет производства витаминов группы B. Совсем недавно роль лактобацилл в энергетическом гомеостазе, особенно у пациентов с ожирением, стала объектом повышенного интереса (Guo et al., 2010; Mikelsaar, 2011). Еще одним потенциальным положительным воздействием LAB является их способность подавлять или убивать H. pylori , который в настоящее время считается основной причиной гастрита и пептических язв и является фактором риска злокачественных новообразований желудка (Hamilton-Miller, 2003).Кроме того, как Lactobacillus sp. и Bifidobacterium sp. штаммы могут уменьшать побочные эффекты эрадикационной терапии H. pylori (Canducci et al., 2002).
Педиококки также относятся к группе LAB и используются в промышленной ферментации пищевых продуктов и силоса (Raccach, 2014). Педиоцин-продуцент Pediococcus sp. Штаммы потенциально представляют интерес с точки зрения безопасности пищевых продуктов (Raccach, 2014), при этом три из них потенциально обладают пробиотическими свойствами — Pediococcus pentosaceus, P.parvulus и P. acidilactici . Османагаоглу и др. (2010) всесторонне изучили потенциал изолята P. pentosaceus человека для использования пробиотиков и сообщили, что этот штамм продуцировал бактериоцин против Listerial , имел отличные характеристики аутоагрегации, а также был способен коагрегировать с Salmonella enterica серотип typhimurium и энтеротоксигенный Escherichia coli (Osmanagaoglu et al., 2010). Антагонистическая активность против Listeria monocytogenes была также обнаружена у P.acidilactici (Guerra, Pastrana, 2002). Клинические испытания с использованием другого штамма Pediococcus sp. выявили, что введение P. parvulus снижает уровень холестерина в сыворотке и увеличивает количество фекалий Bifidobacterium sp. (Mårtensson et al., 2005).
Другой группой LAB, рекламируемых как пробиотики, являются энтерококки, которые, как сообщается, помогают поддерживать нормальную микрофлору кишечника и стимулируют иммунную систему (Bhardwaj et al., 2008). Исследования потенциальных пробиотических свойств E. faecium показали его эффективность в сокращении периода выздоровления от острой диареи (Benyacoub et al., 2003). Другое исследование Pieniz et al. (2014) показали, что E. durans обладают антимикробной активностью и антиоксидантной способностью, а также устойчивы к симулированному желудочному соку и солям желчных кислот. Хотя энтерококки обладают пробиотическим потенциалом, они считаются условно-патогенными микроорганизмами для людей, поскольку могут вызывать внутрибольничную инфекцию, а также обладают устойчивостью к ванкомицину (Tambyah et al., 2004). Из-за этих противоречивых свойств использование энтерококков в качестве пробиотиков остается предметом споров.
Бифидобактерии
Бифидобактерии являются основными составляющими микробиоты ЖКТ животных и человека. Это грамположительные неподвижные анаэробные сахаролитические бактерии (Gomes and Malcata, 1999). В кишечной среде бифидобактерии имеют комменсальные отношения со своими хозяевами и вносят свой вклад в питание хозяина за счет использования сложных углеводов, которые являются важными источниками углерода и энергии, но не разлагаются в желудке или кишечнике (Biavati, 1994).Эти вещества включают растительные пищевые волокна и связанные с диетой углеводы, такие как крахмал, галактан, сахароза, амилопектин и пуллулан (Ventura et al., 2007, 2012). Способность бифидобактерий метаболизировать неперевариваемые пищевые углеводы хозяина (пребиотики) может быть использована для избирательной стимуляции определенных штаммов, колонизирующих кишечник. Бифидобактерии, используемые в качестве пробиотиков, включают штаммы, принадлежащие к видам Bifidobacterium lactis, B. bifidum, B. animalis, B. thermophilum, B.breve, B. longum, B. infantis и B. adolescentis (таблица 1). Было показано, что эти бактерии ингибируют адгезию энтеротоксигенных E. coli , энтеропатогенных E. coli и C. difficile к эпителиальным клеткам кишечника, что является важным признаком использования этих бактерий в качестве пробиотиков (Tsai et al. , 2008). Дополнительные положительные эффекты штаммов бифидобактерий включают предотвращение или облегчение инфекционной диареи и улучшение симптомов воспалительного заболевания кишечника (Sanz, 2007).Также было показано, что бифидобактерии модулируют иммунный ответ хозяина против другой местной микрофлоры (например, B. adolescentis подавляет гуморальный иммунитет к Bacteroides thetaiotaomicron ; Scharek et al., 2000). Некоторые штаммы бифидобактерий подавляют индуцированных H. pylori генов в эпителиальных клетках человека (Shirasawa et al., 2010), в то время как другие Bifidobacterium sp. клетки и супернатанты культур оказывали ингибирующее действие на Streptococcus mutans и Streptococcus sobrinus , важные этиологические агенты при кариесе зубов человека (Lee et al., 2011).
Дрожжи
Saccharomyces boulardii — один из наиболее изученных видов пробиотиков, давно успешно применяемый при лечении множественных желудочно-кишечных расстройств. Введение этого пробиотика в лиофилизированной форме оказалось эффективным в случаях диареи за счет уменьшения продолжительности заболевания, независимо от его причины (McFarland, 2007; Dinleyici et al., 2012; Shan et al., 2013). Также сообщалось, что S. boulardii предотвращали и лечили рецидивы воспалительного заболевания кишечника, включая умеренные случаи язвенного колита (Guslandi et al., 2000; Гусланди и др., 2003; Choi et al., 2011). Об интересных результатах сообщили Lim et al. (2015), предполагая, что дрожжи могут усиливать рост других пробиотиков в кислых условиях: было обнаружено, что Saccharomyces cerevisiae EC-1118 значительно увеличивает жизнеспособность пробиотического штамма Lactobacillus rhamnosus HN001 при pH 2,5–4,0. Использование S. boulardii для уменьшения рецидива инфекции, вызванной C. difficile , все еще обсуждается из-за противоречивых результатов клинических испытаний (Flatley et al., 2015). Среди других видов дрожжей Torulaspora delbrueckii, Debaromyces hansenii, Yarrowia lipolytica, Kluyveromyces lactis, Kluyveromyces marxianus и Kluyveromyces lodderae продемонстрировали сильный антагонистический эффект против патогенных бактерий и высокую устойчивость к кислотам (Kumotura et al., 2004; Kumotura et al., 2004; ; Chen et al., 2010). Несмотря на отличные показатели безопасного использования, дрожжи все еще могут быть причиной локализованных инфекций у пациентов с ослабленным иммунитетом (Thygesen et al., 2012).
Akkermansia muciniphila
Другой недавно описанный микроорганизм с возможным пробиотическим потенциалом — это Akkermansia muciniphila — бактерия, разлагающая муцин, которая обитает в слоях кишечной слизи (Derrien et al., 2004). Согласно нескольким исследованиям, у пациентов с ожирением количество этой бактерии в ЖКТ значительно ниже (Collado et al., 2008; Karlsson et al., 2012). Последовательность генома A. muciniphila предполагает способность этой бактерии метаболизировать множество сложных углеводов, а также синтезировать несколько аминокислот, витаминов и кофакторов (van Passel et al., 2011). Его влияние на метаболические процессы в ЖКТ до конца не изучено; однако уже было показано, что эта бактерия может быть потенциальным средством лечения диабета II типа. Shin et al. (2014) показали, что пероральное введение A. muciniphila мышам индуцировало Foxp3-регуляторные Т-клетки во висцеральной жировой ткани, что ослабляло воспаление жировой ткани. На основании этих результатов было высказано предположение, что фармакологические манипуляции с микробиотой кишечника в пользу A.muciniphila может быть полезным при лечении диабета.
Faecalibacterium prausnitzii и другие клостридии
Другой бактерией, которая, как было продемонстрировано, оказывает значительное влияние на микробиоту желудочно-кишечного тракта человека, является Faecalibacterium prausnitzii из Clostridium sp. кластер IV. Этот микроорганизм составляет 5–15% от общей микробиоты фекалий, что делает его одной из самых распространенных бактерий, продуцирующих бутират в ЖКТ (Hold et al., 2003; Flint et al., 2012). Поскольку бутират является основным источником энергии для эпителиальных клеток кишечника, он необходим для поддержания целостности эпителиального барьера. Множественные полезные эффекты бутирата для здоровья также включают уменьшение прогрессирования рака, защиту от патогенов и стимуляцию иммунной системы (Macfarlane and Macfarlane, 2011). Снижение количества F. prausnitzii в образцах фекалий и биопсии наблюдалось в многочисленных исследованиях воспалительных заболеваний кишечника (особенно болезни Крона подвздошной кишки и язвенного колита), что позволяет предположить, что присутствие этого вида важно для нормальной функции ЖКТ (Ван и другие., 2007; Свидсинский и др., 2008; Andoh et al., 2012). Первая модель гнотобиотического грызуна с F. prausnitzii показала, что он может влиять на физиологию кишечника за счет выработки слизи O -гликанов, тем самым влияя на качество и количество продуцируемой слизи (Wrzosek et al., 2013). Хотя дисбактериоз F. prausnitzii может быть важным маркером в развитии заболевания, стандартные диагностические инструменты не разработаны, в основном из-за крайней чувствительности этого вида к кислороду.
Другие бактерии класса Clostridia также могут найти применение в качестве потенциальных пробиотиков, поскольку они широко распространены в микробиоте ЖКТ человека и могут играть важную роль в метаболизме и функции иммунной системы. Atarashi et al. (2013) показали, что смесь из 17 штаммов Clostridium sp., Принадлежащих к кластерам IV, XIV и XVIII, была способна подавлять экспериментальный колит у мышей посредством индукции регуляторных Т-клеток, продуцирующих интерлейкин-10. Аналогичный механизм подавления колита за счет продукции IL-10 индуцированными макрофагами наблюдался с использованием штамма C.butyricum MIYAIRI 588 (Hayashi et al., 2013). Согласно другому недавнему исследованию, при смешивании с B. infantis, C. butyricum был эффективен при лечении экспериментально вызванной диареи, связанной с антибиотиками, у мышей, а положительный эффект смеси был выше, чем у отдельных штаммов (Ling et al. , 2015). Однако, хотя клостридии потенциально могут использоваться в качестве пробиотиков, все еще недостаточно доказательств, подтверждающих их медицинскую эффективность и безопасность для людей.
Использование пробиотиков для профилактики и лечения заболеваний, связанных с антибиотиками
Хотя большинство антибиотиков в целом безопасны, некоторые из них могут вызывать опасные для жизни побочные эффекты.Противомикробные побочные эффекты — это нежелательные лекарственные реакции, затрагивающие одну или несколько систем органов. Более того, даже кратковременный курс антибиотиков может иметь долгосрочное негативное влияние на нормальную микробиоту кишечника человека (Jernberg et al., 2010). Наиболее часто используемые классы антибиотиков включают пенициллины, цефалоспорины, аминогликозиды, фторхинолоны, макролиды и тетрациклины; каждое из этих соединений может вызывать свои собственные побочные эффекты (Cunha, 2001). Фактически, большинство традиционно используемых антибиотиков могут вызывать проблемы со здоровьем в ЖКТ и обычно связаны с нарушениями в составе микрофлоры, вызванными выживанием и распространением устойчивых штаммов.Например, пенициллины, которые, как известно, имеют наименее частые и серьезные побочные эффекты, могут вызывать диарею, тошноту, рвоту и расстройство желудка. Фторхинолоны также считаются относительно безопасными, но также могут вызывать тошноту, рвоту, диарею и боль в животе (Bertino and Fish, 2000). Побочные эффекты макролидов включают тошноту, рвоту и диарею, связанные с ЖКТ, тогда как побочные эффекты тетрациклинов зависят от концентрации антибиотика в пораженном органе.Их общие побочные эффекты включают спазмы или жжение в желудке, диарею, боль во рту или языке (Rubinstein, 2001). Исследования в этой области продолжаются и уже предоставили доказательства эффективности использования пробиотиков для предотвращения проблем со здоровьем, возникающих в результате использования антибиотиков. Примерами таких заболеваний являются диарея, связанная с антибиотиками (AAD) и диарея, связанная с C. difficile и (CDAD; псевдомембранозный колит).
Диарея, связанная с антибиотиками, определяется как «диарея, не имеющая другого объяснения, которая возникает в связи с приемом антибиотиков» (Friedman, 2012).Однако легкие случаи инфекции C. difficile иногда также рассматриваются как причина ААД (Kelly et al., 1994). Заболевание является одним из наиболее частых побочных эффектов использования антибиотиков: у 5–39% пациентов, в зависимости от типа антибиотика (например, некоторые β-лактамные антибиотики с большей вероятностью вызывают диарейные побочные эффекты, чем цефалоспорины), и связаны с увеличением продолжительности и стоимости госпитализации (Videlock and Cremonini, 2012). Существует несколько механизмов воздействия антибиотиков на человека, которые могут привести к ААД.К ним относятся осмотическая диарея, вызванная подавлением анаэробных бактерий и снижением углеводного обмена, нарушением защитного действия комменсальных бактерий и снижением устойчивости слизистой оболочки толстой кишки к патогенным условно-патогенным бактериям. Полное восстановление нормальной микробиоты кишечника может занять несколько недель или даже месяцев (Friedman, 2012; Kaier, 2012).
Было проведено множество исследований по оценке эффективности пробиотиков при лечении ААД, и были получены данные, подтверждающие использование пробиотиков с одним штаммом и смешанных пробиотиков для лечения диареи (Surawicz, 2003; Szajewska et al., 2006; МакФарланд, 2009). Мета-анализ Hempel et al. (2012) выявили 82 исследования, которые предоставили доказательства эффективности пробиотиков в лечении ААД. Микроорганизмы, использованные в этих исследованиях, включали роды Lactobacillus, Bifidobacterium, Saccharomyces, Streptococcus, Enterococcus и Bacillus. Согласно Фридману (2012), несколько механизмов действия пробиотиков способствуют профилактике и лечению диареи: усиление барьерной функции слизистой оболочки за счет секреции муцинов, увеличение плотных контактов в эпителиальных клетках, обеспечение устойчивости к колонизации, производство бактериоцинов, увеличение выработки секреторного lgA. , вызывая сбалансированный ответ Т-хелперных клеток, увеличивая продукцию ИЛ-10 и трансформируя фактор роста бета.В совокупности эти факторы способствуют восстановлению нормального желудочно-кишечного баланса после повреждения антибиотиками (Friedman, 2012).
Clostridium difficile -ассоциированная диарея или псевдомембранозный колит представляет собой воспаление стенок кишечника, вызванное токсинами, продуцируемыми C. difficile . CDAD — одна из наиболее распространенных внутрибольничных инфекций и частая причина заболеваемости и смертности среди госпитализированных пациентов пожилого возраста. Осложнения включают шок, необходимость колэктомии, токсический мегаколон и, в тяжелых случаях, перфорацию стенки толстой кишки. C. difficile колонизирует ЖКТ после изменения нормальной микрофлоры кишечника при лечении антибиотиками (Bergogne-Bérézin, 2000; Ndegwa and Nkansah, 2008). Чрезвычайно высокие показатели CDAD были зарегистрированы в Квебеке с 2002 по 2005 годы, в общей сложности 14000 случаев (в 4,5 раза больше по сравнению с 1991 годом), при этом имеются данные, свидетельствующие о появлении высоковирулентного штамма C. difficile (Pepin et al. др., 2004, 2005).
Несколько исследований показали, что пробиотики помогают в профилактике и лечении CDAD.Gao et al. (2010) сообщили о более низком риске возникновения заболевания после приема препарата на основе двух штаммов Lactobacillus . S. boulardii также успешно использовался для лечения CDAD (McFarland et al., 1994). Однако необходимо крупное многоцентровое исследование для получения достаточных доказательств в поддержку использования пробиотиков в качестве лечения инфекций, связанных с C. difficile-.
Проблемы, связанные с переносом детерминантов устойчивости к антибиотикам
Многие штаммы пробиотиков обладают естественной устойчивостью к одному или нескольким антимикробным агентам (таблица 2).Хотя внутренняя устойчивость пробиотических бактерий к определенным антибиотикам может дать преимущества при их использовании для профилактики и лечения AAD, поднимался вопрос о возможной передаче детерминант устойчивости (Pflughoeft and Versalovic, 2012), особенно для штаммов, несущих плазмиды.
ТАБЛИЦА 2. Внутренняя устойчивость к антибиотикам нескольких широко используемых видов пробиотиков.
Курвалин (2006) определил два различных типа приобретенной устойчивости к антибиотикам у бактерий: (i) изначально непереносимая устойчивость, возникшая в результате одной или нескольких мутаций в местных генах, и (ii) переданная устойчивость, приобретенная от другой организм путем горизонтального переноса генов.Устойчивость к антибиотикам (как внутренняя, так и приобретенная) может возникать в результате трех основных механизмов: (i) изменение проницаемости внешней и / или внутренней мембраны и транспортной активности, что приводит к более низкому накоплению антибиотика в клетке, (ii) использование ферментов для детоксикации антибиотика и (iii) изменение сайта-мишени антибиотика (Guardabassi and Courvalin, 2006). Ген, ответственный за приобретение устойчивости к антибиотикам, часто находится на плазмиде или транспозоне, которые могут быть легко перенесены (Bennett, 2008).Фактически, опосредованная транспозоном передача генетического материала между видами недавно была описана как наиболее частый механизм, способствующий распространению устойчивости к антибиотикам у бактерий (Wozniak and Waldor, 2010).
Многочисленные исследования уже показали, что устойчивость к антибиотикам может передаваться между различными видами бактерий, которые обитают в ЖКТ человека. Например, сообщалось, что и Lactobacillus lactis , и Streptococcus thermophilus способны передавать устойчивость к эритромицину [ген erm (B) , расположенный на плазмиде] L.monocytogenes в условиях in vitro (Toomey et al., 2009). Другое исследование предоставило доказательства передачи in vivo устойчивости к ампициллину между двумя штаммами E. coli , сосуществующими в кишечнике человека: было продемонстрировано, что плазмида, несущая ген β-лактамазы, была перенесена из устойчивого к ампициллину E. coli к изначально чувствительному штамму (Karami et al., 2007). Devirgiliis et al. (2009) сообщили о переносе гена tet (M) (устойчивость к тетрациклину; расположенный в широком диапазоне транспозонов Tn 916 хозяев) от L.paracasei от до E. faecalis in vitro . В другой серии экспериментов плазмида pLFE1 устойчивости к эритромицину штамма M345 L. plantarum была успешно перенесена пяти различным видам: L. rhamnosus, Lc. lactis, Listeria innocua, E. faecalis и L. monocytogenes (Feld et al., 2009). Эти и другие примеры вызывают беспокойство по поводу безопасности; Штаммы, которые будут использоваться в качестве пробиотиков, должны быть тщательно отобраны, и только те, которые не содержат передающихся детерминант устойчивости к антибиотикам, следует считать безопасными (Radulovic et al., 2012).
Системы In vitro и In vivo , используемые для изучения эффектов пробиотиков
Новые стратегии на основе пробиотиков для терапевтического и профилактического использования против множества заболеваний ЖКТ набирают популярность во всем мире. Их эффективность была предсказана многочисленными исследованиями на животных моделях и доказана обширными исследованиями с участием людей. Тем не менее, начальным шагом в подтверждении пробиотических эффектов является обширная характеристика бактериального штамма, который будет использоваться в качестве пробиотика, который обычно выполняется в условиях in vitro путем изучения устойчивости бактерий к кислотам, устойчивости к желчи, использования источника углерода и агрегативных свойств. или ex vivo за их способность прикрепляться к клеткам млекопитающих (Kotikalapudi et al., 2010; Wood et al., 2012). Аналогичным образом, методы доставки пробиотиков, такие как лиофилизация или инкапсуляция, также проверяются на их защитный потенциал in vitro в моделируемых желудочных условиях (Klemmer et al., 2011; Wood et al., 2012; Khan et al., 2013; Wang и др., 2014). Наиболее популярными материалами, используемыми для инкапсуляции бактерий, являются альгинат, каррагинаны и камеди, поскольку они просты в обработке, устойчивы к низким pH и замораживанию и обычно считаются безопасными (Gbassi and Vandamme, 2012).Недавно мы сообщили об эффективной доставке B. adolescentis , инкапсулированного для этой цели в защитной матрице альгинат-гороховый белок, в нижнюю часть кишечника крыс (Varankovich et al., 2015).
Помимо основных синтетических растворов желудочного сока (низкий pH, 37 ° C), были разработаны более сложные системы, такие как SHIME (имитатор кишечной микробной экосистемы человека), предназначенные для моделирования различных частей ЖКТ человека (Cook et al. ., 2012). Штаммы пробиотиков и способы их доставки, предварительно выбранные in vitro , впоследствии тестируются на животных моделях.
Традиционно используемые модели на животных включают мышей и крыс. Считается, что более крупные животные, такие как кролики, собаки и свиньи, имеют больше общих черт с физиологией и микрофлорой ЖКТ человека (Kararli, 1995). Однако грызуны дешевы, стандартизированы и имеют короткий жизненный цикл; таким образом, их широкое использование в масштабных исследованиях. К исследованию воздействия пробиотиков на микрофлору животных можно подойти путем: (i) изучения количественных и качественных характеристик бактериальной микрофлоры у животных с использованием методов культивирования и / или молекулярной биологии, таких как полимеразная цепная реакция в реальном времени (qPCR), следующего поколения секвенирование (NGS) и флуоресценция in situ, гибридизация (FISH) или (ii) косвенная оценка эффективности лечения с использованием его для лечения искусственно вызванного заболевания.
Распространение конкретных видов микроорганизмов у здоровых людей все еще изучается и сравнивается с таковыми у пациентов с различными желудочно-кишечными заболеваниями. Нарушения микробиоты, даже в случае изменения численности одного вида (например, A. muciniphila ), могут быть причиной (и индикатором) развития болезни (Karlsson et al., 2012). В этом случае лечение пробиотиками может быть полезным для восстановления баланса микробиоты в кишечнике. Интересный пример количественного / качественного анализа микробиоты кишечника животных после введения пробиотика можно найти в исследовании Wang et al.(2015b): 454 пиросеквенирование генов 16S рРНК фекальных бактерий у мышей с ожирением и у худых мышей показало, что пробиотические штаммы сдвинули общую структуру кишечной микробиоты тучных животных в сторону тощих мышей, получавших нормальную диету, со значительными изменениями, наблюдаемыми в 83 операционные таксономические единицы. Из-за сложного анализа, необходимого для понимания конкретных механизмов развития болезни, а также механизма действия определенного пробиотического микроорганизма, использование моделей болезни, как правило, более распространено.
Модели болезней ЖКТ на грызунах
Как правило, для создания модели заболевания мышей инфицируют патогеном или раздражителем однократно или непрерывно (Pawlowski et al., 2010; Bhinder et al., 2013). Затем животных лечат пробиотиками с одновременным мониторингом симптомов заболевания и оценкой изменений микрофлоры кишечника. Следуя этому подходу, Verdú et al. (2008) инфицировали мышей H. pylori в течение 4–6 месяцев, чтобы исследовать влияние терапии пробиотиками на дисфункцию верхних отделов желудочно-кишечного тракта, вызванную хроническим H.pylori инфекция. Авторы сообщили, что при лечении пробиотиками замедленное опорожнение желудка у мышей значительно быстрее нормализовалось после эрадикации по сравнению с контрольными группами, где дисфункция наблюдалась в течение 2 месяцев после прекращения введения патогена. Мышей и крыс также использовали для оценки эффективности пробиотиков для лечения инфекций Salmonella и E. coli O157: H7 (Asahara et al., 2001, 2004), воспалительных заболеваний кишечника (Shiba et al., 2003) и подавление иммунитета (Lollo et al., 2012). Asahara et al. (2001) показали, что рост кишечника и последующая внекишечная транслокация перорально инфицированных Salmonella typhimurium у мышей подавлялись во время введения пробиотика B. breve . Позже та же группа сообщила, что B. breve также эффективен в защите мышей от продуцирующих токсичность Shiga E. coli 0157: H7 (Asahara et al., 2004). Экстраполяция результатов, полученных в исследованиях на животных и экспериментах in vitro, на человека, остается сложной задачей.Перед интерпретацией результата необходимо учитывать многие факторы, такие как различия в физиологии и составе микрофлоры соответствующих желудочно-кишечных систем.
В большинстве из экспериментов in vivo , изучающих влияние пробиотиков на популяции патогенных бактерий, используются мыши-гнотобиоты (обычно с системами микрофлоры человека в их ЖКТ; Bernet-Camard et al., 1997; Aiba et al., 1998; Gill et al. ., 2001; Pawlowski et al., 2010). Например, в исследовании Shiba et al.(2003), было обнаружено, что пробиотик B. infantis 1222 значительно подавляет системный ответ антител, вызываемый Bacteroides vulgates , репрезентативным патогенным Bacteroides sp. на модели воспалительного заболевания кишечника на мышах-гнотобиотах. Использование обычных мышей в качестве модели для исследования заболеваний человека более проблематично из-за значительных различий в микрофлоре кишечника животных и человека. Тем не менее, можно использовать специфические для мышей организмы в качестве моделей для изучения патогенов человека.Например, Ge et al. (2001) использовали инфекцию H. hepaticus в качестве модели на животных для изучения патогенеза желудочно-кишечных заболеваний у людей, вызываемых H. pylori. Совсем недавно Bhinder et al. (2013) описали модель мыши Citrobacter rodentium для изучения влияния патогенов и хозяев во время инфекционного колита. C. rodentium — специфический для мышей бактериальный патоген, тесно связанный с энтеропатогенными и энтерогеморрагическими штаммами E.coli (Borenstein et al., 2008). Несколько исследований инфекции C. rodentium с участием моделей мышей показали, что пробиотики уменьшают тяжесть симптомов и предотвращают смерть, вызванную патогенным агентом (Chen et al., 2005; Gareau et al., 2010; Mackos et al., 2013) . Chen et al. (2005) успешно вылечили колит у мышей, вызванный C. rodentium , с помощью пробиотика L. acidophilus . Gareau et al. (2010) аналогичным образом сообщили, что L. rhamnosus в сочетании с L.helveticus , были эффективны в профилактике и лечении того же болезненного состояния у мышей. Позже другая группа показала, что L. reuteri может ослабить тяжесть мышиного колита, вызванного C. rodentium (Mackos et al., 2013). Дальнейшее исследование взаимодействий «хозяин-патоген» и «пробиотик-патоген», вероятно, позволит лучше понять лечение инфекции C. rodentium у мышей и, возможно, инфекций E. coli у людей. Однако подтверждение преимуществ пробиотиков и возможных побочных эффектов в конечном итоге потребует испытаний на людях.
Клинические испытания на людях
Исследования на людях обычно проводятся в форме рандомизированных клинических испытаний с участием участников с некоторыми типами кишечных расстройств. После оценки соответствия критериям и набора участникам в качестве контроля назначают либо пробиотическое лечение, либо плацебо. Результаты этих экспериментов предоставили достаточно доказательств для того, чтобы рассматривать пробиотики как эффективное средство лечения множества заболеваний ЖКТ, таких как острый гастроэнтерит (Huang et al., 2002), синдром раздраженного кишечника (Nikfar et al., 2008) и некротический энтероколит (Alfaleh, Anabrees, 2014). Некоторые испытания, демонстрирующие эффективность представляющих интерес бактерий при лечении специфических желудочно-кишечных расстройств, перечислены в таблице 3. В одном недавнем исследовании, направленном на оценку эффективности S. cerevisiae при лечении синдрома раздраженного кишечника, у 179 взрослых был поставлен диагноз. состояние, были рандомизированы для получения один раз в день 500 мг S. cerevisiae или плацебо в течение 8 недель. Кардинальные симптомы (боль / дискомфорт в животе, вздутие живота / вздутие живота, затрудненное опорожнение кишечника) регистрировались ежедневно после 2-недельного подготовительного периода.Результаты показали, что оценка боли / дискомфорта в животе значительно снизилась во время приема пробиотиков (Pineton de Chamburn et al., 2015). Крупное испытание с участием 362 участников было проведено Whorwell et al. (2006), чтобы изучить влияние B. infantis на симптомы синдрома раздраженного кишечника: введение пробиотиков приводит к улучшению большинства симптомов более чем на 20% по сравнению с плацебо. Другое клиническое испытание на людях доказало эффективность Lactobacillus GG при лечении H.pylori : ежедневный прием пробиотика приводил к значительному уменьшению симптомов заболевания (диарея, тошнота и нарушение вкуса; Armuzzi et al., 2001). В целом, данные нескольких направлений исследований с участием людей предполагают, что пробиотические бактерии подавляют патогены желудочно-кишечного тракта путем простой конкуренции, преобладая в количестве и производя антибактериальные факторы (бактериоцины и небольшие органические молекулы, такие как жирные кислоты). Хотя более подробная информация о механизмах действия пробиотиков на микробиоту кишечника важна, большая база уже собранных данных доказала полезную роль в профилактике и лечении различных заболеваний ЖКТ у людей.
ТАБЛИЦА 3. Некоторые из основных испытаний пробиотиков для лечения желудочно-кишечных заболеваний на людях.
Заключение
Было показано, что многие штаммы родов Lactobacillus и Bifidobacterium , а также некоторые энтерококки и дрожжи обладают пробиотическими свойствами с потенциалом для профилактики и лечения ряда желудочно-кишечных расстройств. Эффективность пробиотических бактерий в лечении этих состояний подтверждается множеством клинических испытаний с участием пациентов любого возраста и пробиотических организмов, выбранных на основе лабораторных исследований.Примечательно, что большая часть работы в области пробиотиков была проведена in vitro , поскольку это важный этап в исследовании роста бактерий, продукции метаболитов, способности образовывать биопленки, конкурировать с патогенами, коагрегировать и производить противомикробные препараты. . Все эти характеристики являются важными факторами для идентификации потенциальных штаммов пробиотиков, которые обладают желаемыми свойствами, а также способностью закрепляться в кишечнике человека. Внутренняя устойчивость к антибиотикам и возможность передачи генетических детерминант — это два дополнительных фактора, которые необходимо учитывать на начальном этапе исследования пробиотиков.Новые предполагаемые виды пробиотиков, такие как A. muciniphila , еще предстоит протестировать как на животных, так и на людях; однако результаты, достигнутые на сегодняшний день, позволяют предположить, что они могут быть полезными при лечении или диагностике заболеваний ЖКТ.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарность
Финансовую поддержку этому проекту оказал Фонд развития сельского хозяйства Саскачевана.
Список литературы
Айба, Ю., Сузуки, Н., Кабир, А. М., Такаги, А., и Кога, Ю. (1998). Опосредованное молочной кислотой подавление Helicobacter pylori пероральным введением Lactobacillus salivarius в качестве пробиотика на модели гнотобиотиков на мышах. Am. J. Gastroenterol. 93, 2097–2101. DOI: 10.1111 / j.1572-0241.1998.00600.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аль-Фалех, К., Анабрис, Дж. (2014).Пробиотики для профилактики некротического энтероколита у недоношенных детей. Кокрановская база данных Syst. Ред. , 2014 г .: CD005496. DOI: 10.1002 / 14651858.CD005496.pub4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Андох А., Кузуока Х., Цудзикава Т., Накамура С., Хираи Ф., Судзуки Ю. и др. (2012). Многоцентровый анализ профилей фекальной микробиоты у японских пациентов с болезнью Крона. J. Gastroenterol. 47, 1298–1307. DOI: 10.1007 / s00535-012-0605-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Армуцци, А., Cremonini, F., Bartolozzi, F., Canducci, F., Candelli, M., Ojetti, V., et al. (2001). Эффект перорального приема Lactobacillus GG на побочные эффекты со стороны желудочно-кишечного тракта, связанные с антибиотиками, во время эрадикационной терапии Helicobacter pylori . Алимент. Pharmacol. Ther. 15, 163–169. DOI: 10.1046 / j.1365-2036.2001.00923.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Арумугам, М., Раес, Дж., Пеллетье, Э., Ле Пелье, Д., Ямада Т., Менде Д. Р. и др. (2013). Энтеротипы микробиома кишечника человека. Природа 473, 174–180. DOI: 10.1038 / nature09944
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Арвола Т., Лайхо К., Торккели С., Микканен Х., Салминен С., Маунула Л. и др. (1999). Профилактическое средство Lactobacillus GG снижает диарею, связанную с антибиотиками, у детей с респираторными инфекциями: рандомизированное исследование. Педиатрия 104, e64. DOI: 10.1542 / пед.104.5.e64
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Асахара, Т., Номото, К., Симидзу, К., Ватануки, М., и Танака, Р. (2001). Повышенная устойчивость мышей к инфекции Salmonella enterica serovar Typhimurium путем введения синбиотиков бифидобактерий и трансгалактозилированных олигосахаридов. J. Appl. Microbiol. 91, 985–996. DOI: 10.1046 / j.1365-2672.2001.01461.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Асахара, Т., Симидзу, К., Номото, К., Асахара, Т., Симидзу, К., и Номото, К. (2004). Пробиотики бифидобактерии защищают мышей от летального заражения шига-токсином Escherichia coli O157: H7. Инфекция. Иммун. 72, 2240–2247. DOI: 10.1128 / IAI.72.4.2240-2247.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Atarashi, K., Tanoue, T., Oshima, K., Suda, W., Nagano, Y., Nishikawa, H., et al. (2013). Индукция Treg рационально подобранной смесью штаммов клостридий из микробиоты человека. Природа 500, 232–236. DOI: 10.1038 / природа12331
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аурели П., Капурсо Л., Кастеллацци А. М., Клеричи М., Джованнини М., Морелли Л. и др. (2011). Пробиотики и здоровье: обзор, основанный на фактах. Pharmacol. Res. 63, 366–376. DOI: 10.1016 / j.phrs.2011.02.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Басу, С., Пол, Д. К., Гангули, С., Чаттерджи, М., и Чандра, П. К. (2009). Эффективность высоких доз Lactobacillus rhamnosus GG в борьбе с острой водянистой диареей у индийских детей: рандомизированное контролируемое исследование. J. Clin. Гастроэнтерол. 43, 208–213. DOI: 10.1097 / MCG.0b013e31815a5780
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Беннет П. М. (2008). Закодированная плазмидой устойчивость к антибиотикам: приобретение и передача генов устойчивости к антибиотикам в бактериях. руб. J. Pharmacol. 153, S347 – S357. DOI: 10.1038 / sj.bjp.0707607
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Benyacoub, J., Czarnecki-Maulden, G.L., Cavadini, C., Sauthier, T., Anderson, R.E., Schiffrin, E.J., et al. (2003). Добавление в корм Enterococcus faecium (SF68) стимулирует иммунные функции молодых собак. J. Nutr. 133, 1158–1162.
PubMed Аннотация | Google Scholar
Бергонь-Березен, Э. (2000). Лечение и профилактика диареи, связанной с приемом антибиотиков. Внутр. J. Antimicrob. Агенты 16, 521–526. DOI: 10.1016 / S0924-8579 (00) 00293-4
CrossRef Полный текст | Google Scholar
Берне-Камар, М. Ф., Ливин, В., Брассарт, Д., Низер, Дж. Р., Сервин, А. Л., и Худо, С. (1997). Штамм LA1 человека Lactobacillus acidophilus секретирует небактериоциновые антибактериальные вещества, активные in vitro и in vivo. Прил. Environ. Microbiol. 63, 2747–2753.
PubMed Аннотация | Google Scholar
Бертино, Дж.и Фиш Д. (2000). Профиль безопасности фторхинолонов. Clin. Ther. 22, 798–817. DOI: 10.1016 / S0149-2918 (00) 80053-3
CrossRef Полный текст | Google Scholar
Бхиндер, Г., Шам, Х.П., Чан, Дж. М., Морампуди, В., Якобсон, К., и Валланс, Б. А. (2013). Модель мыши Citrobacter rodentium : изучение вкладов возбудителя и хозяина в инфекционный колит. J. Vis. Exp. 72: e50222. DOI: 10.3791 / 50222
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бьяваско, Ф., Виньяроли, К., Лупиди, Р., Мансо, Э., Фачинелли, Б., и Варальдо, П. Э. (1997). In vitro антибактериальная активность LY333328, нового полусинтетического гликопептида. Антимикробный. Агенты Chemother. 41, 2165–2172.
Google Scholar
Биавати Б. (1994). Разложение сложных углеводов. Внутр. J. Food Microb. 24, 199–210. DOI: 10.1016 / 0168-1605 (94) -8
CrossRef Полный текст | Google Scholar
Бибилони Р., Федорак Р. Н., Таннок, Г.W., Madsen, K. L., Gionchetti, P., Campieri, M., et al. (2005). Пробиотическая смесь VSL # 3 вызывает ремиссию у пациентов с активным язвенным колитом. Am. J. Gastroenterol. 100, 1539–1546. DOI: 10.1111 / j.1572-0241.2005.41794.x
PubMed Аннотация | CrossRef Полный текст |
Границы | Влияние микробиоты на иммунную систему кишечника при язвенном колите и его вмешательство
Введение
Язвенный колит (ЯК) — это разновидность хронического рецидивирующего заболевания, которое характеризуется воспалением и изъязвлением слизистой оболочки кишечника (1–3).Заболевание вызывает значительную заболеваемость во всем мире, причем заболеваемость и распространенность со временем увеличиваются (4). ЯК также считается полигенным и множественным заболеванием, вызываемым рядом сложных факторов, таких как окружающая среда, гены и иммуномодулирующие факторы (5).
Микроокружение кишечника образует хорошую среду обитания для микробиоты, которая, как было показано в более ранних исследованиях, влияет на многие физиологические условия (6–8). Поскольку в последнее время кишечная микробиота считается важным органом человеческого тела, все большее количество исследований связывают эту микросреду с желудочно-кишечными заболеваниями.Поскольку состав кишечной микробиоты стабилен в течение определенного периода времени, многие исследования сделали вывод, что микробиота кишечника является потенциальным предиктором состояния здоровья и целью терапевтического вмешательства (9). Более того, сообщалось, что кишечная микробиота играет ключевую роль в воспалительном заболевании кишечника (ВЗК), включая ЯК и болезнь Крона (БК) (10). Учитывая сложность и разнообразие микробиоты кишечника человека, нельзя отрицать, что трудно продемонстрировать наличие конкретных бактериальных штаммов, которые играют определенную роль в патогенном механизме ВЗК.В отличие от хорошо исследованного компакт-диска, наши знания о ЯК относительно недостаточны, и остается много противоречий, требующих разъяснения.
В этом обзоре будут обсуждаться отношения между ЯК и несколькими популярными сообществами микробиоты, тесно связанными, а также потенциальные терапевтические мишени для ЯК, участвующие в регуляции микробиоты.
Часть I: Микробиота
Ободочная кишка имеет два слоя слизи, которые отличаются от тонкой кишки одним слоем слизи.Внутренний слой представляет собой слизистую оболочку, которая тесно связана с кишечным эпителием, что обеспечивает стерильную среду. Наружный слой представляет собой слизистый слой различной толщины, состоящий из муцинов, пептидов трилистника и секреторного IgA (11, 12). Хотя существует двунаправленное воздействие между микробиотой и хозяином, его прямое воздействие на эпителиальные клетки кишечника ограничено слоями слизи и антимикробными пептидами (AMP), такими как дефенсины и регенерирующим островковым 3-гамма (Reg3g) (7, 13, 14) .Здоровый и полный слизистый слой позволяет кишечной микробиоте прикрепляться к слизистому слою, а не напрямую касаться кишечных эпителиальных клеток. В нормальном кишечнике человека существует четыре типа микробиоты, включая Bacteroidetes, Firmicutes, Actinobacteria и Proteobacteria , два из которых ( Bacteroidetes и Firmicutes ) являются доминирующими в кишечнике (15–17). В кишечном тракте здоровых людей Firmicutes , сообщество грамположительных бактерий, подразделяются на две основные группы: Bacilli и Clostridia (в основном Clostridium кластера IV и Clostridium XIVa).Грамотрицательные бактерии Bacteroidetes обитают в кишечнике как один из самых распространенных родов. И некоторые исследования показали, что эти четыре группы относительно стабильны у здоровых людей (9, 18). Здесь, в этом разделе, мы сосредоточимся на описании микробиоты, которая тесно связана с патогенезом и прогрессированием ЯК (обобщены в Таблице 1 и на Рисунке 1).
Таблица 1 . Изменения потенциально полезной и вредной микробиоты при ЯК.
Рисунок 1 .Роль микробиоты кишечника в патогенезе ЯК. Картина описывает изменения в основной микробиоте кишечника в ЯК и ее влияние на желудочно-кишечный тракт. Эта иллюстрация содержит 11 типов кишечной микробиоты и их изменения, упомянутые в этом обзоре. Описаны механизмы, лежащие в основе воздействия определенной микробиоты на желудочно-кишечный тракт. Он включает микробиоту, действующую на клетки DC, секретируя такие вещества, как PSA, бутират и SCFA. Затем клетки DC дополнительно действуют на CD4 + T-клетки или регуляторные T (Treg) -клетки, подавляя воспаление.Существуют также механизмы, с помощью которых AIEC разрушает кишечный барьер и вызывает воспаление. Первые четыре вида микробиоты окрашены в темно-красный цвет, что соответствует вредоносной микробиоте. Остальные семь видов микробиоты окрашены в другие цвета, представляющие здоровую микробиоту. ЯК, язвенный колит; DC, дендритная клетка; PSA, полисахарид А; SCFA, короткоцепочечная жирная кислота; AIEC, адгезивно-инвазивный Escherichia coli .
Faecalibacterium prausnitzii
Модель F.prausnitzii — один из самых богатых видов. В нормальном организме человека имеется большая популяция из бактерий F. prausnitzii , занимая 6–8%, даже 20% среди всех видов микробиоты (17, 19–23). Некоторые исследования сообщают, что он является одним из основных продуцентов короткоцепочечной жирной кислоты (SCFA), называемой бутиратом, в кишечнике. SCFA обладает противовоспалительным эффектом, который является результатом производства регуляторных T (Treg) -клеток и снабжения энергией эпителиальных клеток кишечника (24, 25). Кроме того, он (SCFA) также оказывает противовоспалительное действие, регулируя секрецию противовоспалительных цитокинов, таких как IL-10 (26, 27).Также сообщалось, что противовоспалительные эффекты частично связаны с их нарушением активации NF-κB, блокируя выработку IL-8 (28, 29). Основываясь на этих предыдущих исследованиях, F. prausnitzii играет важную роль в защите функций толстой кишки через свои противовоспалительные механизмы.
Недавние исследования показали, что F. prausnitzii участвует в поддержании здоровья кишечника (26, 29–46). Следует отметить, что некоторые исследования показали, что существует значительная разница в F.prausnitzii между здоровыми людьми и пациентами с ЯК (30, 31, 33–38, 41, 46). По сравнению со здоровыми людьми, видов F. prausnitzii имели меньшее количество у пациентов с ЯК (30–35, 38, 40–44). Например, Machiels et al. представили анализ ПЦР в реальном времени, чтобы обнаружить, что F. prausnitzii у пациентов с ЯК имели меньшую численность, чем у здоровых людей. Они также продемонстрировали обратную корреляцию с активностью заболевания (46). Кроме того, Варела и др. обнаружили, что менее 12 месяцев ремиссии и более одного рецидива в год были связаны с низким уровнем F.prausnitzii . А восстановление популяции F. prausnitzii после рецидива связано с поддержанием клинической ремиссии (42). Фактически, филогенетический анализ показал, что существует по крайней мере два подтипа F. prausnitzii с различиями в распределении подтипов среди людей с расстройствами кишечника и здоровых субъектов (32, 39). Филогруппа I составляла 87% у здоровых субъектов и менее 50% у пациентов с ВЗК. Напротив, филогруппа II была обнаружена у пациентов с ВЗК> 75% и только у 52% у здоровых субъектов.Это исследование показывает, что даже несмотря на то, что большая часть популяции F. prausnitzii существует как у здоровых субъектов, так и у лиц с заболеваниями кишечника, последний имеет меньшее богатство, а среди болезней существует измененное распределение филотипов (39). Пока неизвестно, существуют ли какие-либо другие подтипы внутри вида или других видов Faecalibacterium . Помимо исследований на пациентах, есть также некоторые исследования экспериментальных данных. Например, Martín et al. сообщил, что администрация F.prausnitzii привело к значительному снижению тяжести ВЗК как на тяжелых, так и на умеренных моделях хронического колита. Они также продемонстрировали, что этот вид микробиоты может предотвратить физиологическое повреждение на мышиной модели хронического воспаления слабой степени (47, 48). Кроме того, Zhang et al. обнаружили, что F. prausnitzii ингибирует интерлейкин-17 для облегчения колоректального колита у крыс (49).
Хотя некоторые исследования показали характеристики F. prausnitzii , влияющие факторы F.prausnitzii до сих пор не выяснены. Например, лечение месалазином и иммунодепрессантами не восстановило количество F. prausnitzii (37). Напротив, также сообщалось, что количество F. prausnitzii увеличивалось во время индукционной терапии у пациентов (36).
Клостридиум
Clostridium — это сообщество грамположительных бактерий, которое включает несколько важных патогенов человека, таких как возбудитель ботулизма и важная причина диареи, Clostridium difficile . Clostridium вид обычно обитает в почве животных и человека, а также в кишечном тракте. Он также существует в качестве нормального резидента в здоровых нижних репродуктивных трактах женщин (50). Существует три основных вида ( C. difficile, Clostridium coccoides и Clostridium leptum ) видов Clostridium , связанных с UC.
Как грамположительная бактерия, C. difficile может продуцировать токсины и вызывать колит, особенно у пациентов, принимающих антибиотики, что приводит к разрушению комменсальной микробиоты (51, 52).Токсины, выделяемые C. difficile , могут оказывать сильное воздействие на слизистую оболочку кишечника. Следует отметить, что сообщалось, что инфекция Clostridium difficile (CDI) привела к повреждению кишечного барьера из-за секреции экзотоксина (53). CDI резко вырос за последние два десятилетия. Пациенты с ВЗК с большей вероятностью будут инфицированы C. difficile из-за иммуносупрессии и дисбиоза in vivo (54–56). Singh et al. показали, что люди с ВЗК имели 4.Риск ИКД в 8 раз выше, чем у лиц без ВЗК, и нет разницы между людьми с ЯК и БК (55). Интересно, что Mabardy et al. сообщили о снижении смертности среди пациентов с ВЗК и без ВЗК с C. difficile , но о большем снижении смертности среди пациентов с ВЗК (54). Частота и тяжесть ВЗК, связанных с ИКД, значительны, особенно у пациентов с ЯК с поражением толстой кишки, где вероятность хирургического вмешательства составляет 20% (57). Примечательно, что C. difficile вызывают рецидив ВЗК (58).Основная проблема, поднятая в настоящем исследовании, заключается в том, что ИКД возникает после лечения антибиотиками (59, 60). Пациенты с ЯК могут иметь более высокий риск заражения C. difficile из-за приема антибиотиков и иммуномодулирующих препаратов. Однако стоит упомянуть, что, помимо потенциальной патогенности C. difficile , нет прямых доказательств того, что C. difficile может вызывать ЯК.
Напротив, два других вида Clostridium относятся к C.coccoides (также называемые кластерами Clostridium XIVa) и C. leptum (а именно кластеры Clostridium IV), что, по-видимому, является достоверным фактором, связанным с ЯК (34, 43, 44). Clostridium кластеры IV и XIVa, как было продемонстрировано, играют важную роль в поддержании функции кишечника, продуцируя бутират (45, 61). Кроме того, сообщалось, что эти две микробиоты были снижены при возникновении ЯК, что указывает на потенциальную терапевтическую цель при лечении ЯК (43, 44).Например, сообщалось, что C. leptum индуцирует толерогенные дендритные клетки (DC) мышей и Treg-клетки in vitro , при этом нарушая иммунный воспалительный ответ (62).
Бактероиды
Bacteroides — это род грамотрицательных облигатных анаэробных бактерий, которые являются важными компонентами кишечных комменсальных бактерий млекопитающих. Bacteroides виды — это бациллы, не образующие эндоспоры, и могут быть подвижными или неподвижными в зависимости от вида хозяина. Bacteroides виды обычно генетически разнообразны и составляют доминирующую микробиоту в желудочно-кишечном тракте млекопитающих, играя фундаментальную роль в преобразовании сложных молекул в кишечнике хозяина в простые молекулы (63, 64).
Бактерии могут оказывать благотворное влияние на хозяина посредством иммунной регуляции и поддержания гомеостаза. Сообщалось, что при ЯК увеличилось количество Bacteroides fragilis , что могло усилить экспрессию мРНК противовоспалительных цитокинов, таких как IL-10, за счет секреции полисахарида A (PSA) (65–68) .Колонизированные B. fragilis могут обратить вспять CD4 + Т-клеточные дефекты и дисбаланс Th2 / Th3 у мышей, свободных от микробов (65). Кроме того, предполагалось, что B. fragilis может защитить от экспериментального колита, возможно, путем индукции CD4 + клеток через IL-10 (69, 70). Например, Round et al. сообщили, что B. fragilis направляет развитие Treg-клеток Foxp3 + и стерильную моноколонизацию животных путем увеличения подавляющей способности Treg и индукции продукции противовоспалительных цитокинов только из Т-клеток Foxp3 + в кишечнике (70).Помимо исследований, проведенных на пациентах, были получены экспериментальные данные на животных моделях. Например, сообщалось, что мышей Il10 — / — имели увеличенные пропорции видов Bacteroides (71). Кроме того, Okayasu et al. обнаружили, что количество Bacteroides было значительно увеличено у мышей с острым и хроническим ЯК (72).
На основании приведенных выше данных мы полагаем, что B. fragilis имеет решающее значение для поддержания здорового физиологического состояния хозяина.Однако B. fragilis не совсем полезен при ЯК. В отличие от предыдущих сообщений, сообщалось, что он проникает в ткани кишечника и вызывает повреждение у отдельных пациентов (73). Вдобавок было обнаружено, что другие роды Bacteroides ( Bacteroides vulgatus и Bacteroides ovatus ) также влияют на прогрессирование ВЗК (74–80).
Escherichia coli
Escherichia coli , обычно обнаруживаемая в нижнем отделе кишечника теплокровных организмов, принадлежит к семейству Enterobacteriaceae (большое семейство грамотрицательных бактерий, включающее множество вредоносных видов).Как комменсальная бактерия, широко встречающаяся у позвоночных, она ежегодно заражает множество людей внутрикишечными и внекишечными путями и, как сообщается, убивает более двух миллионов человек в год (81). Поскольку E. coli может передаваться в воде и отложениях, его часто используют в качестве тестового индикатора загрязнения воды. Температура и питательные вещества в этих средах могут поддерживать жизнеспособность сапрофитов E. coli (82, 83).
Сообщается, что число E.coli повышен в UC, будь то у мышей или пациентов с UC (21, 84–89). Например, количество E. coli в очагах воспаления у пациентов с ЯК значительно увеличилось по сравнению с контрольной группой. Между тем, метод сравнительного анализа был введен для анализа паттернов рестрикции E. coli , выделенных из воспалительных и неизмененных тканей, соответственно. Эти результаты показали, что местное воспалительное изменение не способствует развитию определенных штаммов E.coli (87). Siczek et al. также продемонстрировали, что введение NanoAg2 может уменьшить количество E. coli , облегчающих колит, в экспериментальных моделях ЯК (90). Некоторые другие отчеты, однако, показали, что количество E. coli не увеличилось значительно по сравнению со здоровым контролем (41, 91, 92). Учитывая, что увеличение числа E. coli связано со статусом активности пациентов с ЯК, причиной может быть разница в степени тяжести ЯК.Например, у активных пациентов с ЯК было обнаружено больше E. coli , чем у неактивных пациентов с ЯК или здоровых людей (87, 88, 93).
Escherichia coli от пациентов с БК подвздошной кишки, особенно слипчиво-инвазивных штаммов Escherichia coli (AIEC), как сообщается, обогащены у пациентов с ЯК (94, 95). Концентрация E. coli в образце слизистой оболочки выше, чем в образце фекалий (96). Инвазивная способность штаммов AIEC позволяет бактериям перемещаться через кишечный барьер человека в глубокие ткани.Кроме того, AIEC способен проникать в эпителиальные клетки кишечника, реплицироваться в макрофагах и индуцировать гранулемы in vitro (97). AIEC прикрепляется к N-гликозилированной хитиназе 3-like-1 на IEC через хитин-связывающий домен chiA, способствуя патогенным эффектам AIEC у мышей с колитом (98). Количество AIEC может повлиять на течение болезни. Кроме того, противовоспалительный препарат месалазин может уменьшать количество AIEC и снимать воспаление у пациентов с ВЗК (99).Следовательно, месалазин может служить потенциальной терапевтической стратегией при лечении ЯК, вызванного инфекцией AIEC.
Другое
Bifidobacterium , сообщество анаэробного грамположительного рода, находится в кишечнике повсюду (100). Bifidobacterium широко используется в качестве одного из пробиотиков, и исследования показали, что он играет важную роль в лечении ЯК. Было продемонстрировано, что пероральный прием Bifidobacterium может блокировать воспаление кишечника, воздействуя на клетки Tr1, что приводит к выработке IL-10, тем самым уменьшая колит у мышей с ослабленным иммунитетом (101, 102).Однако до сих пор, поскольку у нас мало знаний о связи между Bifidobacterium и UC, необходимы дальнейшие исследования по этому вопросу.
Helicobacter pylori обнаружен в желудочно-кишечном тракте и характеризуется микроаэрофильным метаболизмом и спиралевидной формой (103, 104). Хотя H. pylori широко распространен в эпителии желудка, исследования показали, что он также может быть обнаружен в толстой кишке и кале у пациентов с ЯК (105–108).Отношения между UC и H. pylori противоречивы и сложны. Например, это было продемонстрировано Engler et al. (109), что инфекция или лечение H. pylori значительно облегчили тяжесть DSS-индуцированного хронического колита, а также колита, вызванного переносом Т-клеток, как по клиническим симптомам, так и по гистопатологическим характеристикам, что указывает на защитную роль H. pylori. в UC. Однако некоторые эпидемиологические данные показали, что значимой корреляции между H.pylori и UC (110, 111). Таким образом, необходимы будущие исследования, чтобы различать истинную защитную роль H. pylori и исходы ЯК.
Fusobacterium — это анаэробные грамотрицательные бактерии, которые являются членами нормальной микробиоты полости рта и кишечника. Однако некоторые виды Fusobacterium , такие как адгезивные, инвазивные, провоспалительные виды, были идентифицированы как патогены ЯК (38, 112, 113). Относительное количество Fusobacterium в слизистой оболочке толстой кишки у моделей мышиного колита или пациентов с ВЗК увеличивается, среди которых 69% всех полученных от пациентов с ВЗК Fusobacterium были идентифицированы как Fusobacterium nucleatum (114–116).Более того, в качестве возможного патогена при ЯК были обнаружены комменсальные бактерии, в том числе Fusobacterium varium , который был одним из организмов слизистых оболочек, выделенных от пациентов с ЯК (112, 113).
Помимо перечисленных выше микробиоты, есть некоторые другие виды, связанные с патогенезом и прогрессированием ЯК, включая Roseburia hominis, Eubacterium rectale, Listeria monocytogenes и Candida albicans (33, 35, 44, 46, 117–120 ). Например, у больных ЯК р.hominis , хорошо известный вид бактерий филума Firmicutes , продуцирующий бутират, отличается от такового у здоровых людей числом (44, 46). E. rectale , как сообщается, значительно уменьшилась в численности (33, 44), особенно при педиатрическом ЯК (35). Грамположительный L. monocytogenes является внутриклеточным патогеном и часто передается в другие места. В последние годы исследования показали, что это может усугубить тяжесть ЯК (117). Однако в образцах эндоскопической биопсии ЯК было показано, что количество л.monocytogenes не отличался от нормальной группы. В результате он не поддерживает прямое действие L. monocytogenes в патогенезе ВЗК (118). C. albicans чаще всего выделяется у 91,7% пациентов с ЯК и может замедлить заживление ЯК (119, 120).
Часть II: Возможные цели терапии ЯК
В приведенном выше содержании роли и изменения нескольких видов микробиоты в ЯК были полностью обсуждены в приведенном выше содержании. Поскольку кишечная микробиота играет важную роль в возникновении и развитии ВЗК, поиск нового вмешательства, направленного на микробиоту, может иметь потенциальные терапевтические последствия для лечения ЯК.Сообщалось, что такие вмешательства, как NLRP и рецептор витамина D (VDR), могут влиять на патогенез и прогрессирование ЯК посредством регулирования состава микробиоты. Кроме того, было продемонстрировано, что несколько видов секретируемых белков служат потенциальными терапевтическими мишенями для ЯК. В этом разделе мы сосредоточимся на недавних исследованиях мишеней микробиоты, которые могут быть потенциальными терапевтическими стратегиями при лечении ЯК (показано на Рисунке 2).
Рисунок 2 .Возможные механизмы, контролируемые NLRP, VDR и Metrnl в регуляции гомеостаза кишечника и язвенного колита. Инфламмасомы NLRP3 и NLRP6 регулируют секрецию IL-1β и IL-18. IL-18 помогает поддерживать непатогенную микрофлору кишечника, что способствует здоровой среде кишечника. IL-18 не продуцируется у мышей Nlrp3 — / — или Nlrp6 — / — , что приводит к развитию потенциально патогенных видов. Nlrp12 — / — мышей приводит к более воспалительной среде, вызванной более высокой продукцией цитокинов, таких как IL-1β и IL-6.ATG16L1 снижается у мышей Vdr — / — , что приводит к снижению AMP. Кроме того, уменьшение ATG16L1 может также ингибировать продукцию IL-18 за счет повышения экспрессии NLRP3. У мышей с нокаутом Metrnl, специфичных к эпителиальным клеткам кишечника, снижение АМФ приводит к дисбалансу микробиоты. NLRP, семейство NLR, содержащие пириновый домен; VDR, рецептор витамина D; AMP, антимикробный пептид.
НЛРП
СемействоNOD-подобных рецепторов (NLR) является одной из важных групп PRR при ВЗК.Количество разновидностей NLR у человека и мышей составляет 22 и 30 соответственно (121). Они характеризуются центральным нуклеотидным связыванием и доменом олигомеризации. NLRP (семейство NLR, содержащие пириновый домен) могут активировать каспазу-1 и запускать воспалительный процесс (122).
Инфламмасома NLRP3 является наиболее изученной инфламмасомой и, как сообщается, дополнительно влияет на прогрессирование заболевания при ЯК, влияя на микробиоту (123). Предыдущие отчеты показали изменения в количестве и составе микробиоты у мышей Nlrp3 — / — . Nlrp3 — / — мышей, как сообщается, имеют большее количество микробиоты в толстой кишке, чем мыши дикого типа (124). Hirota et al. показали, что количество Firmicutes и Proteobacteria увеличено в толстой кишке у мышей Nlrp3 — / — по сравнению с группой дикого типа (125). Хотя Nlrp3 — / — мышей продемонстрировали высокую чувствительность к DSS-индуцированному UC в нескольких исследованиях, одно исследование выдвинуло противоположные результаты, доказывающие, что дефицит инфламмасомы NLRP3 защищает мышей от DSS (124–127).Следовательно, требуются дальнейшие усилия для определения эффектов и механизмов инфламмасомы NLRP3 в ЯК, чтобы мы могли использовать преимущества инфламмасомы NLRP3 при лечении ЯК в будущем.
Экспрессия инфламмасомы NLRP6 может быть обнаружена как в толстом, так и в тонком кишечнике. Сообщалось, что мышей Nlrp6 — / — более восприимчивы к ЯК, индуцированному DSS, с повреждением тканей, кровотечением и повышенной проницаемостью эпителия кишечника (126, 128).Предполагалось, что изменения в популяции микробиоты этих мышей могут быть результатом аберрантных взаимодействий хозяин-патоген на этом участке (129).
Инфламмасома NLRP12 также участвует в воспалительном процессе толстой кишки, особенно в защитной роли при остром колите. Nlrp12 — / — мышей проявляли большую тяжесть колита при введении DSS, чем мыши дикого типа (130, 131). Например, Заки и др. показали, что мышей Nlrp12, , — / — были очень уязвимы к воспалению толстой кишки, что указывает на связь с повышенной продукцией воспалительных цитокинов, включая IL-1β и IL-6.Эти эффекты были вызваны активацией связанных с воспалением путей, таких как сигналы NF-κB и ERK в макрофагах толстой кишки.
Текущая основная проблема заключается в том, что мы еще не смогли выяснить его нижестоящие медиаторы NLRPs и их инфламмасом. Неясно, какие факторы опосредуют эффекты и связаны ли наблюдаемые результаты с конкретной микробиотой или их комбинацией.
Рецептор витамина D
Витамин D — это группа жирорастворимых стероидных веществ, которые способствуют усвоению ионов кальция и магния.Кроме того, он имеет различные биологические эффекты, включая депрессию, сердечно-сосудистые заболевания и рак (132–134). VDR как ядерный рецептор витамина D играет важную роль в регуляции гомеостаза кишечной микробиоты и среды обитания комменсальных бактерий (135–139). Сообщалось, что аномалии сигнального пути VDR и низкая экспрессия связаны с UC (140–143).
Витамин D может не только регулировать иммунный ответ на кишечную микробиоту, но и изменять состав микробиоты (144, 145).

 Пьётся лекарство за полчаса до еды 3 раза за сутки. Курс лечения – 8 дней. Детям до 2-х лет, будущим и кормящим мамам не назначают.
Пьётся лекарство за полчаса до еды 3 раза за сутки. Курс лечения – 8 дней. Детям до 2-х лет, будущим и кормящим мамам не назначают.