Закупка медикаментов Аммиак, Бриллиантовый зеленый, Йод+[Калия йодид+Этанол] (КТРУ 21.20.10.259-000005-1-00021-0000000000000, 21.20.10.158-000004-1-00076-0000000000000, 21.20.10.158-000006-1-00072-0000000000000) для нужд ГБУЗ ВО «АРБ» на 2021 год.: процедура 0328300068920000101
| Организатор | ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ ЗДРАВООХРАНЕНИЯ ВЛАДИМИРСКОЙ ОБЛАСТИ «АЛЕКСАНДРОВСКАЯ РАЙОННАЯ БОЛЬНИЦА» (ИНН 3301000899) |
| Почтовый адрес | Российская Федерация, 601650, Владимирская обл, Александровский р-н, Александров г, Улица ВОССТАНИЯ 1905 ГОДА, 9 |
| Телефон | 7-49244-32161 |
| Способ проведения | Открытый аукцион в электронной форме |
| Электронная площадка | Государственные закупки (44-ФЗ), etp. |
| Дополнительные условия | Для субъектов малого и среднего предпринимательства |
Перейти на площадку Ход торгов
41 676,00
₽
| Дата публикации | 05.11.20 10:50:26 (МСК) |
| Дата и время окончания подачи заявок | до 13.11.20 13:00:00 (МСК) |
| Дата и время рассмотрения заявок | до 17.11.20 23:59:00 (МСК) |
| Дата проведения торгов | 18.11.20 10:33:00 (МСК) |
| Название организации (ИНН) | ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ ЗДРАВООХРАНЕНИЯ ВЛАДИМИРСКОЙ ОБЛАСТИ «АЛЕКСАНДРОВСКАЯ РАЙОННАЯ БОЛЬНИЦА» (ИНН 3301000899) |
| Место поставки | Российская Федерация, Владимирская обл, Александровский р-н, 601650, Владимирская обл. |
Публикация извещения
05.11.20 10:50:26
Ознакомьтесь с документацией и начинайте подготовку к торгам
Для участия в процедуре нужно:
Прием заявок
Идет прием заявок
Для подачи заявки нужно:
Так же вы можете:
Работа комиссии
Отменен(ы):
Лот 1
Процедура завершена
Аммиак и его воздействие на организм человека
Аммиак в переводе с греческого (hals ammoniakos) — амонова соль. Аммиак — бесцветный газ с резким запахом, температура плавления — 80° С, температура кипения — 36° С, хорошо растворяется в воде, спирте и ряде других органических растворителей. Синтезируют из азота и водорода. В природе образуется при разложении азотсодержащих органических соединений.
Чистый аммиак был получен английским химиком и философом Джозефом Пристли в 1774 году. Промышленную технологию получения аммиака разработали и осуществили в 1913 году немецкие химики Фриц. Габер и Карл Бош, получившие за свои исследования Нобелевские премии.
Промышленную технологию получения аммиака разработали и осуществили в 1913 году немецкие химики Фриц. Габер и Карл Бош, получившие за свои исследования Нобелевские премии.
Аммиак — один из самых важных продуктов химической промышленности. Большая часть получаемого в промышленности аммиака идет на приготовление азотной кислоты, азотных удобрений, красителей. Применяется аммиак и для получения взрывчатых веществ. Широко используются водные растворы аммиака. Как слабое летучее основание, он применяются в химических лабораториях и производствах. С помощью аммиака получают пищевую соду.
В медицине 10% водный раствор аммиака известен как нашатырный спирт. Резкий запах аммиака раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров, поэтому при обморочных состояниях или алкогольном отравлении пострадавшему дают вдыхать пары нашатырного спирта.
При пайке металлов используют хлорид аммония — нашатырь — Nh5Сl. При высокой температуре нашатырь разлагается с образованием аммиака, который очищает поверхности паяльника и спаиваемого изделия от оксидов металлов.
При высокой температуре нашатырь разлагается с образованием аммиака, который очищает поверхности паяльника и спаиваемого изделия от оксидов металлов.
При испарении жидкого аммиака поглощается большое количество теплоты, поэтому его используют в холодильных установках.
Аммиак используется для охлаждения каналов энергоснабжения Международной космической станции (МКС), которые обеспечивают МКС электричеством.
На станции есть два независимых аммиачных контура охлаждения, которые отводят тепло от охлаждаемого водой внутреннего оборудования, а также от электрических приборов, установленных на внешней поверхности МКС.
Жидкий аммиак вызывает сильные ожоги кожи, поэтому его обычно перевозят в стальных баллонах (окрашены в желтый цвет, имеют надпись «Аммиак» черного цвета), железнодорожных и автомобильных цистернах, по воде — в специальных танкерах, транспортируют также по трубопроводам.
Смесь аммиака с воздухом взрывоопасна. Аммиак горит при наличии постоянного источника огня. Емкости могут взрываться при нагревании.
Емкости могут взрываться при нагревании.
Газообразный аммиак является токсичным соединением. При его концентрации в воздухе рабочей зоны около 350 мг/куб. м (миллиграмм на кубический метр) и выше работа должна быть прекращена, а люди выведены за пределы опасной зоны. Предельно допустимая концентрация аммиака в воздухе рабочей зоны равна 20 мг/куб. м.
Аммиак опасен при вдыхании. При остром отравлении аммиаком поражаются глаза и дыхательные пути, при высоких концентрациях возможен смертельный исход. Вызывает сильный кашель, удушье, при высокой концентрации паров — возбуждение, бред. При контакте с кожей — жгучая боль, отек, ожег с пузырями. При хронических отравлениях наблюдаются расстройство пищеварения, катар верхних дыхательных путей, ослабление слуха.
При отравлении аммиаком необходимо принять следующие меры:
Первая медицинская помощь: промыть глаза и лицо водой, надеть противогаз или ватно-марлевую повязку, смоченную 5% раствором лимонной кислоты, открытые участки кожи обильно промыть водой, немедленно покинуть очаг заражения.
При попадании аммиака в желудок надо выпить несколько стаканов теплой воды с добавлением одной чайной ложки столового уксуса на стакан воды и вызвать рвоту.
Индивидуальная защита: изолирующий и фильтрующие противогазы марок М, КД, респиратор РПГ-67КД, при их отсутствии — ватно-марлевая повязка, смоченная 5% раствором лимонной кислоты, защитный костюм, резиновые сапоги, перчатки.
Зону поражения необходимо изолировать. В зону аварии входить только в полной защитной одежде.
При утечке и разливе: устранить источники открытого огня. Устранить течь. Для осаждения газов использовать распыленную воду.
Оповестить об опасности отравления местные органы власти. Эвакуировать людей из зоны, подвергшейся опасности заражения ядовитым газом. Не допускать попадания вещества в водоемы, тоннели, подвалы, канализацию.
При пожаре: убрать из зоны пожара, если это не представляет опасности, и дать возможность догореть. Не приближаться к горящим емкостям. Охлаждать емкости водой с максимального расстояния. Тушить распыленной водой, воздушно-механической пеной с максимального расстояния.
Тушить распыленной водой, воздушно-механической пеной с максимального расстояния.
Материал подготовлен на основе информации РИА Новости и открытых источников
Демонстрации — Трийодид азота
Демонстрации — Трийодид азота| Панель навигации | |
| ОСНОВНОЙ | Демонстрации |
Трийодид азота , NI 3 , представляет собой черный порошок, получаемый при кристаллы йода добавляют к раствору концентрированного водного аммиака. В то время как кристаллы NI 3 влажные, они стабильны, но когда вещество высыхает, NI 3 чувствителен к прикосновению и разлагается взрывным способом с образованием газообразного азота и паров йода:
2NI 3 (с) ——> N 2 (ж) + 3I 2 (г)
В следующих демонстрациях небольшое количество трийодида азота
приготовили и дали высохнуть на бумажном полотенце в вытяжном шкафу.
Видеоклип 1:
НАСТОЯЩИЙ,
445 КБ
Это видео состоит из двух видеоклипов, которые отличаются друг от друга
ракурсы камеры на ту же реакцию.
Видеоклип 2:
НАСТОЯЩИЙ,
911 KB
В этой версии я поместил трийодид влажного азота на четыре
кусочки фильтровальной бумаги, отделенные друг от друга металлом
уплотнительные кольца и дали материалу высохнуть около часа.
На видео показан один и тот же каскад с двух разных камер
углы; последний сегмент — тот же угол камеры, что и у
во-вторых, с воспроизведением в замедленном темпе.
Видеоклип 3:
НАСТОЯЩИЙ,
2,63
МБ
В этом видео куча трийодида азота была еще
слегка влажный,
и потребовалось немного больше времени, чтобы взорвать
!!! Опасности !!!
Хотя это не очень мощное взрывчатое вещество, достаточно большое количество
трийодид азота может нанести большой ущерб.
Процедуры
Взрывное разложение трийодида азота:
Каталожные номера
Ф. Альберт Коттон и Джеффри Уилкинсон, 9 лет0105 Высшая неорганическая химия, 5-е изд. Нью-Йорк: John Wiley & Sons, 1988, с. 331-332.
Марта Виндхольц (ред.), The Merck Index, 10-е изд. Рэуэй: Merck & Co. , Inc., 1983.
, Inc., 1983.
Трийодид азота — чувствительное контактное взрывчатое вещество | Выставочная химия
Создайте красивое облако пара, смешанного с газом, с помощью этой демонстрации безопасного контактного взрывчатого вещества
Контактные взрывчатые вещества редко встречаются в классе из-за их нестабильного характера и связанной с этим опасности детонации. Однако, используя следующий метод, небольшое количество сухого NI 3 (s) кристаллы могут быть использованы для получения впечатляющей «трещины» и красивого облака фиолетового пара йода, смешанного с газообразным азотом. Количество должно быть небольшим, чтобы демонстрация была безопасной. Не поддавайтесь искушению отклониться от метода.
Источник: Adrian Guy
Слева: сухие кристаллы NI3; справа: при контакте с пером
Набор
- Стакан 50 мл, коническая колба 100 мл
- Фильтровальная воронка и фильтровальная бумага
- стеклянная палочка для перемешивания
- пестик и ступка
- 0,48 г кристаллов йода
- 0,880 М концентрированный раствор аммиака
- 100 мл 5 М раствора NaOH
- термостойкий коврик; метр правило
Процедура
Работая в вытяжном шкафу, надев защитную маску и нитриловые перчатки, с помощью пестика и ступки измельчите 0,5 г кристаллов йода в мелкий порошок и перенесите в небольшой химический стакан. К йодному порошку добавляют примерно 4 мл концентрированного раствора аммиака и быстро перемешивают стеклянной палочкой. Дайте смеси постоять 9 0171 ca пять минут для завершения реакции.
К йодному порошку добавляют примерно 4 мл концентрированного раствора аммиака и быстро перемешивают стеклянной палочкой. Дайте смеси постоять 9 0171 ca пять минут для завершения реакции.
Для извлечения твердого взрывчатого вещества взболтайте смесь, чтобы взвесить твердое вещество в растворе аммиака, а затем вылейте на фильтровальную бумагу, которую держат над конической колбой. Пока стакан перевернут над фильтровальной бумагой, с помощью пластиковой пипетки впрыскивайте концентрированный раствор аммиака, чтобы смыть любые остатки NI 3 на фильтровальную бумагу.
Выключите вытяжной шкаф, чтобы предотвратить движение воздуха. Удалите влажную фильтровальную бумагу, содержащую NI 9.0029 3 (s), откройте и положите на термостойкий коврик, чтобы он лежал ровно. Оставьте сохнуть в вытяжном шкафу, приняв соответствующие меры предосторожности, чтобы студенты или другой персонал не приблизились к эксперименту – поставьте табуретки или что-то подобное перед вытяжным шкафом.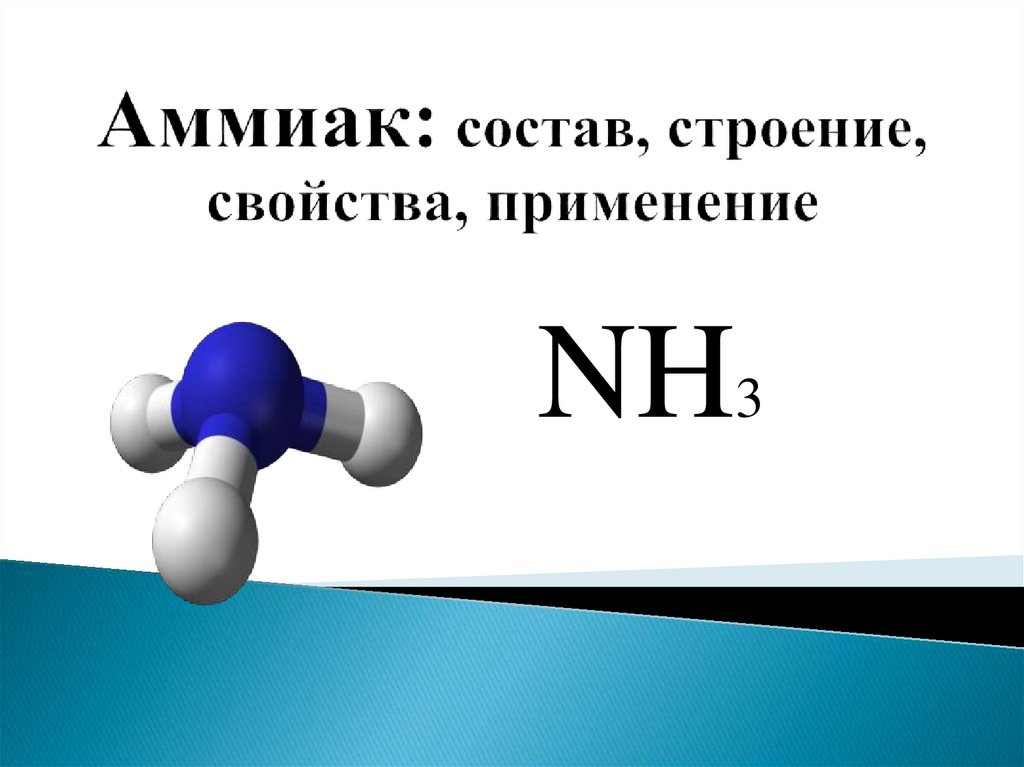
Чтобы уничтожить оставшееся взрывчатое вещество на стеклянном стержне или в стакане, добавьте 5 М раствор NaOH (предупреждение : коррозионное вещество ) и оставьте до тех пор, пока черное твердое вещество не перестанет быть видимым. Как только фильтровальная бумага высохнет, можно взорвать кристаллы, пощекотав их пером, прикрепленным к измерительной линейке. Влажность и комнатная температура могут продлить процесс сушки и снизить чувствительность взрывчатого вещества к удару, поэтому для его детонации может потребоваться более сильный «удар».
Надев защитную маску и держа линейку на расстоянии вытянутой руки, ударьте по NI 3 , чтобы произвести взрыв, а затем включите вытяжной шкаф, чтобы удалить облако паров йода. Коснитесь правилом стены, чтобы взорвать все оставшиеся NI 3 , которые прилипли. Поместите остатки фильтровальной бумаги в 5 М раствор NaOH, промойте до обесцвечивания и поместите в мусор.
Примечание : на фотографии (справа) показаны шесть сложенных друг на друга образцов массой 0,5 г, которые взрываются, но эти количества значительно превышают разрешенное без полицейского сертификата и не рекомендуются для демонстрации в классе из-за большого объема образующихся паров йода. .
.
Специальные насадки
Большинство пятен йода можно удалить с помощью 1 М раствора тиосульфата натрия. Холодные и влажные условия значительно увеличивают время высыхания. Если образец был все еще влажным при ударе, чистка окружающей области приведет к детонации и, следовательно, к удалению любых случайных/рассеянных кристаллов.
Учебные цели
Трийодид азота разлагается в соответствии со следующим уравнением:0023
Эта реакция дает прекрасную возможность учащимся старше 16 лет рассмотреть изменения энтропии во время реакции. Переход от двух молей упорядоченных твердых кристаллов к четырем молям газа согласуется с большой Δ S θ системой , и это можно легко визуализировать во время реакции, как и экзотермический характер реакции и таким образом, положительное изменение энтропии окружения (Δ S θ окружения = -Δ H / T ). Следовательно, общее изменение энтропии (Δ S θ Всего = Δ S θ Система +Δ S θ CRUEVING AS ). спонтанное изменение, которое будет идти к завершению.
спонтанное изменение, которое будет идти к завершению.
Безопасность
- Никогда не пытайтесь хранить NI 3 или ограничивать каким-либо образом, и не поддавайтесь искушению увеличить масштаб или отклониться от процедуры.
- Все этапы приготовления должны производиться в вытяжном шкафу, и вы должны носить защитную маску и перчатки.
- Концентрированный раствор аммиака вызывает коррозию, а йод вреден; оба могут обжечь кожу. Аммиак токсичен при вдыхании и, подобно парам йода, раздражает органы дыхания и глаза, а 5 М раствор NaOH вызывает коррозию. Утилизируйте все продукты в раковине в вытяжном шкафу с большим количеством воды.
- Если вы оставляете NI 3 сохнуть на ночь, убедитесь, что на запертой двери классной комнаты размещены таблички, препятствующие проникновению посторонних. Вытяжной шкаф может некоторое время не использоваться для других целей. Студенты и сотрудники должны быть предупреждены об этом.
- Демонстратору необходимы наушники, а учащиеся должны закрывать уши и носить защитные очки.


 roseltorg.ru
roseltorg.ru г. Александров, ул. Топоркова д.2
г. Александров, ул. Топоркова д.2