Расстройства кровообращения. Гиперемия — полнокровие. Застой. Ишемия
- Подробности
Общие характеристики нарушений крообращения:
1) нарушения кровообращения нельзя рассматривать в отрыве от нарушений лимфообращения и состояния системы крови, так как структурно и функционально эти системы связаны
2) нарушения крово- и лимфообращения ведут к нарушению тканевого и клеточного метаболизма, а значит, повреждению структуры клетки, развитию дистрофии или некроза.
Расстройства крово- и лимфообращения возникают не только в результате нарушения работы кровеносной и лимфатической системы, но и нейрогуморальной регуляции работы сердца, структурного полома на любом уровне – сердце, кровеносные сосуды, микроциркуляторное русло, лимфатические сосуды, грудной проток. При расстройстве регуляции деятельности сердца, развитии в нем патологического процесса возникают общие, а при расстройстве регуляции функции сосудистого русла на том или ином участке, как и структурном поломе его, — местные нарушения крово- и лимфообращения.
1. Полнокровие (гиперемия). Артериальное полнокровие.
Повышенное кровенаполнение органа, ткани вследствие увеличенного притока артериальной крови. Может иметь :
а) общий характер, что наблюдается при:
— увеличении объема циркулирующей крови (плетора)
— увеличении числа эритроцитов. (эритремия)
В таких случаях отмечается окраска кожных покровов красного цвета, повышается АД
б) местный характер
Различают:
— физиологическую гиперемию
Возникает при действии адекватных доз физических и химических факторов, при чувстве стыда и гнева (рефлекторные гиперемии), при усилении функции органов (рабочая гиперемия).
— патологическую гиперемию
Исходя из особенностей этиологии и механизма развития, различают:
1) ангионевротическую гиперемию
Наблюдается как следствие раздражения сосудорасширяющих нервов или паралича сосудосуживающих нервов.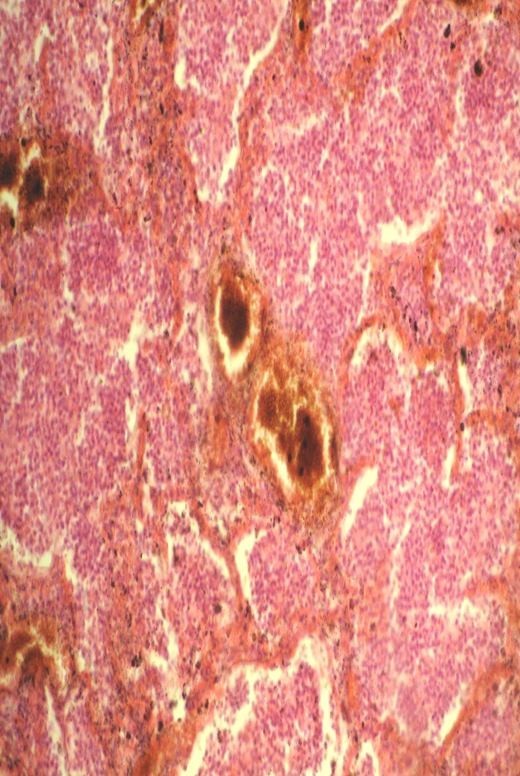
Кожа и слизистые становятся красными, припухшими, теплыми. Этот вид гиперемии может возникать н определенных участках тела при нарушении иннервации, на коже и слизистых при некоторых инфекциях, сопровождающимся поражением узлом симпатической нервной системы.
Обычно быстро проходит, не оставляет следов.
2) коллатеральную гиперемию
Возникает в связи с затруднением кровотока по магистральному артериальному стволу, закрытому тромбом или эмболом. Кровь устремляется по коллатеральным сосудам. Просвет рефлекторно расширяется, приток артериальной крови усиливается и ткань получается увеличенное количество крови.
Коллатеральная гиперемия является, по существу, компенсаторной, обеспечивая кровообращение при закрытии артериального ствола.
3) постанемическую гиперемию
Развивается в тех случаях, когда фактор, ведущий к сдавлению артерии и малокровию (опухоль, скопление жидкости в полости, жгут), быстро устраняется.
4) вакатная гиперемия
Развивается в связи с уменьшением барометрического давления. Она может быть общей (например, у водолазов и кессонных рабочих при быстром подъеме из области повышенного давления).Возникающая при этом гиперемия сочетается с газовой эмболией, тромбозом сосудов и кровоизлияниями.
Местная вакатная гиперемия появляется на коже под действием, например, медицинских банок, создающих над определенным участком ее разреженное пространство.
5) воспалительная гиперемия
Постоянный спутник воспаления и его обязательный компонент. Усиленный приток крови к воспаленному участку окрашивает его в красный цвет, он становится теплым на ощупь. Воспалительная гиперемия проходит вместе с окончанием воспаления.
6) гиперемия на почве артеривенозного свища
Возникает в тех случаях, когда, например, при огнестрельном ранении или другой травме образуется свищ (соустье) между близлежащими артерией и веной, артериальная кровь потечет в вену.
2. Полнокровие (гиперемия). Венозное полнокровие.
Повышенное кровенаполнение органа или ткани в связи с уменьшением (затруднением) оттока крови, приток крови при этом не изменен или уменьшен.
Застой венозной крови (застойная гиперемия) приводит к расширению вен и капилляров, замедлению в них кровотока, с чем связано развитие гипоксии, повышение проницаемости базальных мембран капилляров.
1) общее венозное полнокровие
Развивается при патологии сердца, ведущей к острой или хронической сердечно-сосудистой недостаточности. Оно может быть острым и хроническим.
а) острое общее венозное полнокровие
Является синдромом острой сердечной недостаточности. В результате гипоксического повреждения гистогематических барьеров, накопления продуктов нарушения тканевого обмена (ацидоз) и резкого повышения капиллярной проницаемости в тканях наблюдаются плазморрагия и отек, стазы в капиллярах, множественные диапедезные кровоизлияния, в паренхиматозных органах появляются дистрофические изменения.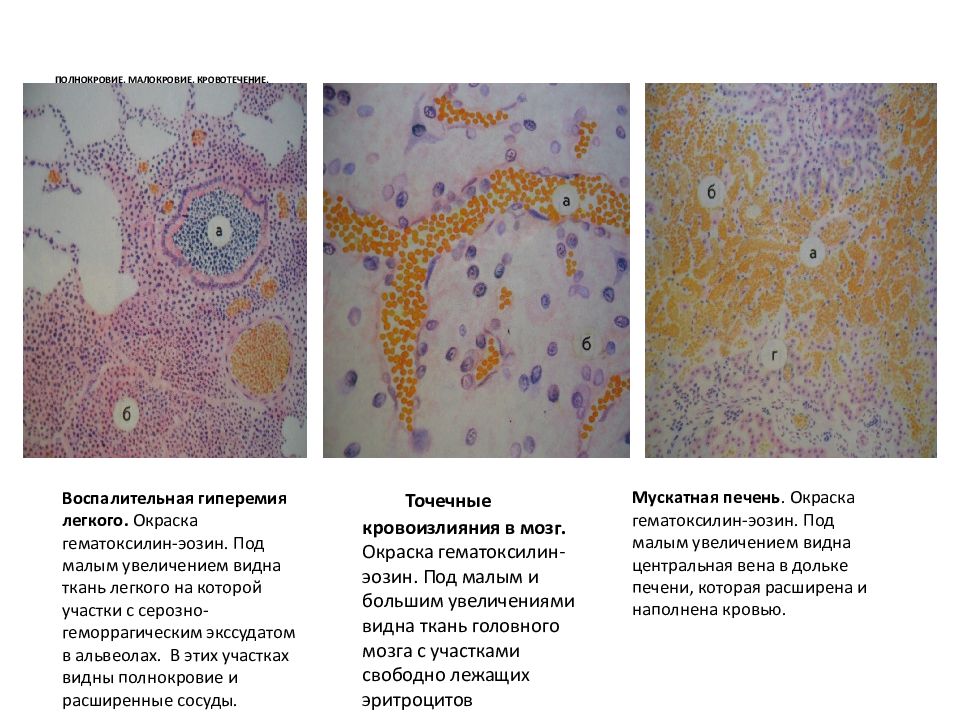
Наиболее часто развивается при инфаркте миокарда левого желудочка.
б) хроническое венозное полнокровие
Развивается при хронической сердечно-сосудистой недостаточности, осложняющей многие хронические заболевания сердца (пороки, ИБС, кардиомиопатии, хронический миокардит),правожелудочковой недостаточности кардиогенной природы, декомпенсированных пороках сердца, сжатии устьев полых вен опухолью средостения. ХВЗ приводит к тяжёлым изменениям органов и тканей. Длительно поддерживая состояние тканево гипоксии, оно определяет развитие не только плазморрагии, отека, стаза и кровоизлияний, дистрофии и некроза, но и атрофических и склеротических изменений (связаны с тем, что хроническая гипоксия стимулирует синтез коллагена фибробластами, в этом принимает участие HIF).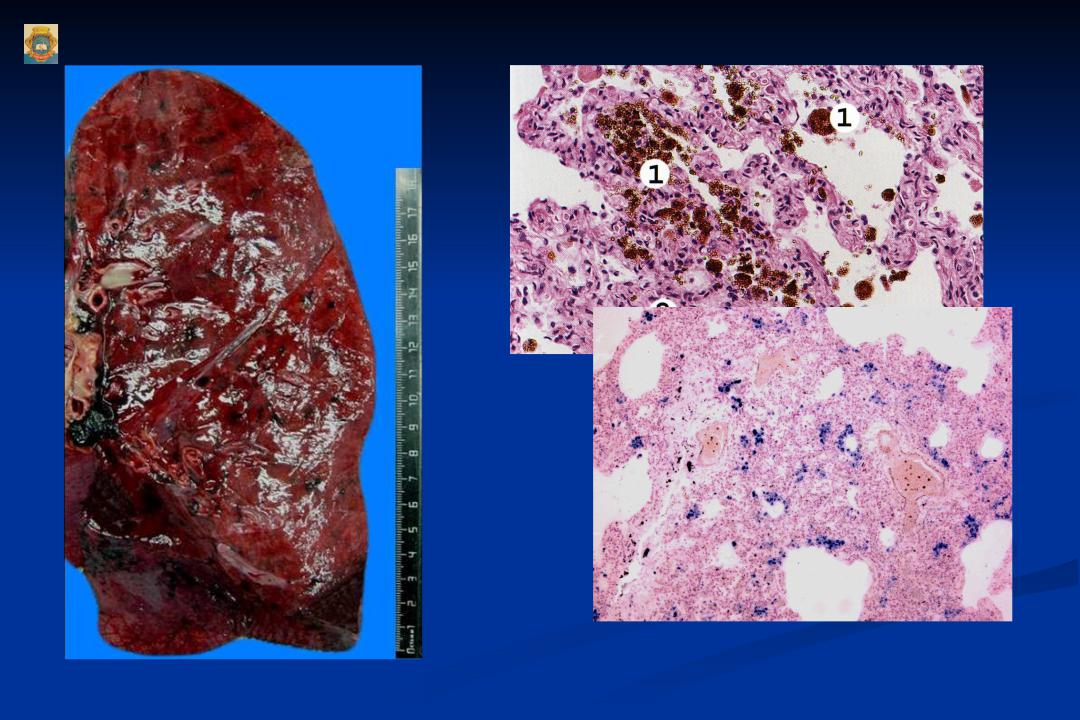
Соединительная ткань вытесняет паренхиматозные элементы, развивается индурация (застойное уплотнение) органов и тканей.
Также происходит капиллярно-паренхиматозный блок в связи с утолщением базальных мембран эндотелия и эпителия ха счет повышенной продукции коллагена фибробластами, гладкими мышечными клетками и липофибробластами.
При хроническим венозное застое кожа, особенно нижних конечностей, становится холодной и приобретает синюшную окраску (цианоз). Вены кожи и подкожной клетчатки расширены, переполнены кровью, также расширены и переполнены лимфой лимфатические сосуды. Выражены отек дермы и подкожной клетчатки, разрастание в коже соединительной ткани.
Морфологически застойно-паренхиматозный блок характеризуется:
-уменьшение числа функционирующих капилляров в результате склероза, индуцированного гипоксией. При этом происходит магистрализация кровотока, что еще сильнее ухудшает кровоснабжение паренхимы, что способствует склерозу.
-истинные капилляры преобразуются в емкостные.
Бурая индурация печени
Бурая индурация печени – гемосидероз, венозный застой в печени + склероз
Печень увеличена, плотная, ее края закруглены, поверхность разреза пестрая, серо-желтая с темно-красным крапом и напоминает мускатный орех.
При микроскопии видно, что полнокровны лишь центральные отделы долек, где гепатоциты разрушены. Эти отделы выглядят темно-красными. На периферии долек клетки печени находятся в состоянии дистрофии, нередко жировой, чем объясняется серо-желтый цвет печеночной ткани.
Избирательное полнокровие центра долек связано с тем, что застой печени охватывает прежде всего печёночные вены, распространяясь на собирательные и центральные вены, а затем и на синусоиды. Последние расширяются, но только в центральных и средних отделах дольки, где встречают сопротивление со стороны впадающих в синусоиды капиллярных разветвлений печеночной артерии, давление в которых выше, чем в синусоидах.
По мере нарастания полнокровия в центре долек появляются кровоизлияния, гепатоциты здесь подвергаются дистрофии, некрозу и атрофии. Гепатоциты периферии долек компенсаторно гипертрофируются и приобретают сходство с центролобулярными.
Разрастание соединительной ткани в зоне кровоизлияний и гибели гепатоцитов связано с пролиферацией клеткок синусоидов – адипоцитов, которые могут выступать в роли фибробластов, а вблизи центральных и собиратеьных вен – с пролиферацией фибробластов адвентиции этих вен. В результате разрастания соединительной ткани в синусоидах появляется непрерывная базальная мембрана (в нормальной печени она отсутствует, т. е. происходит капилляризация синусоидов, возникает капиллярно-паренхиматозный блок, который, усугубляя гипоксию, ведет к прогрессированию атрофических и склеротических изменений в печени.
Таким образом развивается застойный склероз печени.
При прогрессирующем склерозе появляются несовершенная регенерация гепатоцитов с образованием узлов-регенератов, перестройка и деформация органа. Развивается застойный (мускатный) цирроз печени, который также называют сердечным, так как он встречается при хронической сердечной недостаточности.
Развивается застойный (мускатный) цирроз печени, который также называют сердечным, так как он встречается при хронической сердечной недостаточности.
Бурая индурация легких
При хроническом венозном застое развиваются множественные кровоизлияния, обуславливающие гемосидероз легких, и разрастание соединительной ткани, склероз.
Легкие становятся большими, бурыми и плотными.
В морфогенезе основную роль играют застойное полнокровие и гипертензия в малом круге кровообращения, ведущие к гипоксии и повышению сосудистой проницаемости, отеку, диапедезным кровоизлияниям. Развитию этих изменений предшествует ряд адаптивны процессов в сосудистом русле легких. В ответ на гипертензию в малом круге кровообращения происходит гипертрофия мышечно-эластических структур мелких ветвей легочной вены и артерии с перестройкой сосудов по типу замыкающих артерий, что предохраняет капилляры легкого от резкого переполнения кровью.
Со временем адаптивные изменения сосудов легкого сменяются склеротическими, развиваются декомпенсация легочного кровообращения, переполнение капилляров межальвеолярных перегородок кровью.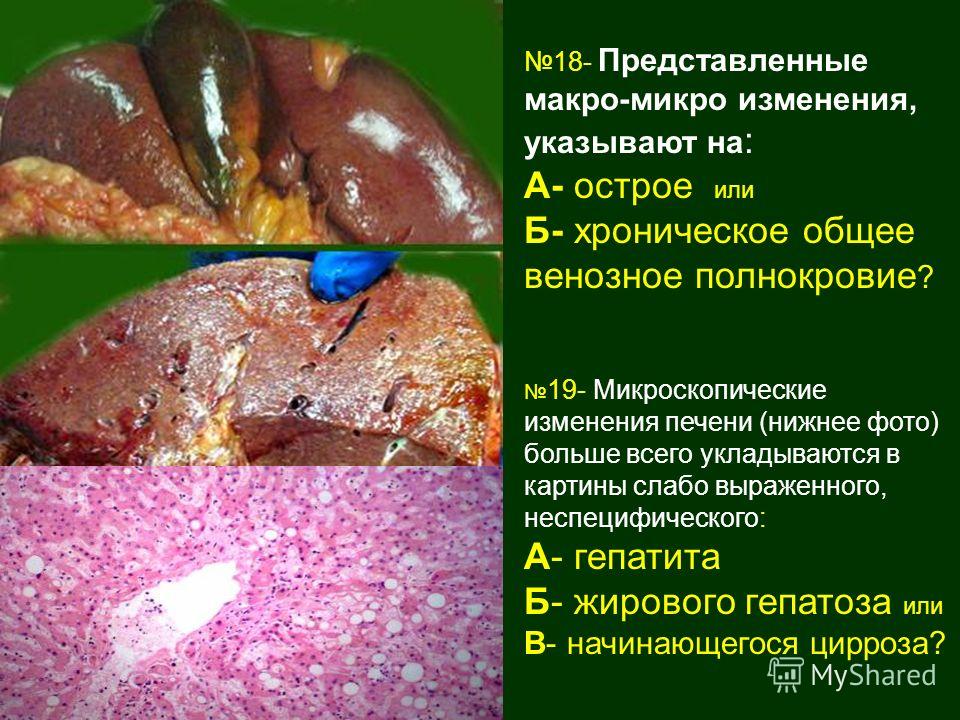
Нарастает гипоксия ткани, повышается сосудистая проницаемости, возникают множественные диапедезные кровоизлияния,
В альвеолах, бронхах, межальвеолярных перегородках, лимфатических сосудах и узлах легких появляются скопления нагруженных гемосидеринов клеток – сидеробластов и сидерофагов и свободнолежащего гемосидерина.
Возникает диффузный гемосидероз. Гемосидерин и белки плазмы (фибрин) «засоряют» строму и лимфатические дренажи легких, что ведет к резорбционной недостаточности их лимфатической системы, которая сменяется механической, Склероз кровеносных сосудов и недостаточность лимфатической системы усиливают легочную гипоксию, которая становится причиной пролиферации фибробластов, утолщения межальвеолярных перегородок. Возникает капиллярно-паренхиматозный блок. Развивается застойный склероз легких (более значителен в нижних отделах легких, где сильнее выражен венозный застой и больше скоплений пигментов и фибрина).
Имеет каудоапикальное распространение и зависит от степени и длительности венозного застоя в легких.
Прогрессированию пневмосклероза при хроническом венозном застое способствует недостаточность лимфообращения, которая объясняется накоплением пигментов и белков плазмы крови вследствие повышения сосудистой проницаемости (резорбционная недостаточность), затем склерозом стромы (механическая недостаточность). Кроме того, склеротические процессы в легких стимулируют SH-ферритином, входящим в состав гемосидерина.
Цианотическая индурация почек
Почки становятся большими, плотными и цианотичными. Особенно полнокровны вены мозгового вещества и пограничной зоны. На фоне венозного застоя развивается лимфостаз. В условиях гипоксии возникают дистрофия нефроцитов главных отделов нефрона и склероз, который не очень сильно выражен.
Цианотическая индурация селезенки
Селезенка увеличена, плотная, темно-вишневого цвета. Отмечается атрофия фолликулов и склероз пульпы.
2) местное венозное полнокровие
Наблюдается при затруднении отток венозной крови от определенного органа или части тела в связи с закрытием просвета вены (тромбом, эмболом) или сдавливание ее извне.
Примеры:
а) венозное полнокровие ЖКТ развивается при тромбозе воротной вены
б) мускатная печень и мускатный цирроз встречаются не только при общем полнокровии, но и при воспалении печеночных вен и тромбозе их просветов (облитерирующий тромбофлебит печеночных вен), что характерно для синдром Бадда-Киари
в) цианотическая индурация почек может появляться вследствие тромбоза почечных вен.
Местное венозное полнокровие может возникнуть и в результате развития венозных коллатералей при затруднении или прекращении оттока крови по основным венозным коллатералям (например, портокавальные анастомозы при затруднении оттока крови по воротной вене). Переполненные кровью коллатеральные вены резко расширяются, а стенка их истончается, что может быть причиной кровотечений (например, из расширенных и истончённых вен пищевода при циррозе печени).
С венозным полнокровием связано возникновение не только плазмогеморрагическх, дистрофических, атрофических, склеротических изменений, но и венозных (застойных) инфарктов.
3. Малокровие (ишемия)
Малокровием называют уменьшенное кровенаполнение ткани, органа, части тела в результате недостаточного притока крови. В ткани при ишемии развивается не только гипоксия, но и дефицит метаболитов, используемых клеткой в процессе гликолиза, активизирующего в условиях снижения доставки кислорода, что объясняет ускоренное развитие повреждения.
По распространенности малокровие можно разделить на:
-общее (анемия)
Заболевание кроветворной системы и характеризуется недостаточным содержанием эритроцитов и гемоглобина.
-местное
Изменения ткани, возникающие при малокровии связаны с гипоксией или аноксией (кислородным голоданием). В зависимости от причины ишемии, момента внезапности ее возникновения, длительности гипоксии и степень чувствительности к ней ткани при ишемии возникают либо тонкие изменения на уровне ультраструктур, либо грубые деструктивные изменения, вплоть до инфаркта.
Также повреждения клеток наблюдаются при восстановлении притока крови – реперфузионный синдром, который включает в себя три компонента:
1) перегрузка кальцием
Реперфузия ишемизированных клеток, утративших способность к синтезу достаточного уровня АТФ, приводит к потере контроля над обменов ионов. Внутриклеточное увеличение содержание кальция запускает апоптоз или активирует ферменты, нарушающие клеточные мембранные структуры.
Внутриклеточное увеличение содержание кальция запускает апоптоз или активирует ферменты, нарушающие клеточные мембранные структуры.
2) формирование активных форм кислорода
Ишемия индуцирует генерацию активных форм кислорода, таких как супероксид, пероксид, гидроксильный радикал. Свободные радикалы вызывают каскадный процесс повреждения клеточных мембран, протеинов и хромосом.
3) развитие воспаления
Также активные формы кислорода активируют воспалительный каскад.
При остром малокровии возникают дистрофические и некробиотические изменения. При этом происходит исчезновения из ткани гликогена, снижение активности окислительно-восстановительных ферментов и деструкция митохондрий. Острую ишемию стоит рассматривать как предынфарктное состояние. При длительном малокровии развиваются атрофия паренхиматозных элементов и склероз.
Окраска: для диагностики применяют различные соли тетразолия, теллурит калия, которые вне участков ишемии восстанавливаются и окрашивают ткань в серый ли черный цвет, а участки ишемии не окрашены.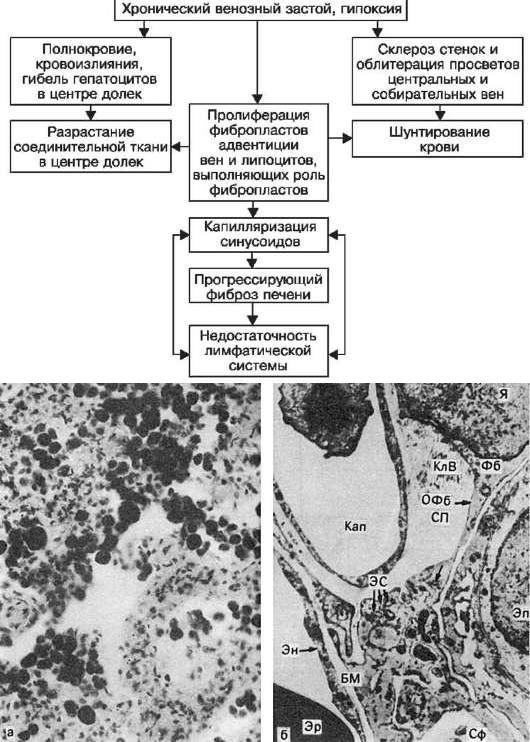
В зависимости от причин и условий возникновения различают:
а) ангиоспастическое малокровие
Возникает вследствие спазма артерии в связи с действием каких-либо раздражителей. Например, болевое раздражение может вызывать спазм артерий и малокровие определенных участков тела. Ангиоспастическая ишемия появляется и при отрицательных эмоциональных аффектах («ангиоспазм неотреагированных эмоций), и при воздействиях низких температур.
Ангиоспазм лежит в основе вено-артериального эффекта: при повышении венозного давления развивается спазм артериол.
б) обтурационное малокровие
Развивается вследствие закрытия просвета артерии тромбом (нередко завершает ангиоспазм) или эмболом, в результате разрастания соединительной ткани в просвете артерии при воспалении ее стенки (облитерирующий эндартериит) сужение просвета артерии атеросклеротической бляшкой.
в) компрессионное малокровие
Появляется при сдавлении артерии опухолью, выпотом, жгутом, лигатурой.
г) ишемия в результате перераспределения крови
Наблюдается в случаях гиперемии после анемии. Например, ишемия головного мозга при извлечении жидкости из брюшной полости, куда устремляется большая масса крови.
Малокровие вследствие спазма артерий обычно непродолжительно и не вызывает особых расстройств. Однако, при длительных спазмах возможно развитие дистрофии и инфаркта. Острое обтурационное малокровие особенно опасно, так как нередко ведет к инфаркту. Длительно существующее малокровие рано или поздно ведет к атрофии и склерозу.
Венозная гиперемия, определение, причины. Состояние микроциркуляции. Внешние проявления венозной гиперемии, их патогенез. Последствия венозной гиперемии.
Венозная гиперемия, определение, причины. Состояние микроциркуляции. Внешние проявления венозной гиперемии, их патогенез. Последствия венозной гиперемии.
Венозная гиперемия — увеличение кровенаполнения, но при уменьшении количества протекающей по сосудам ткани или органа крови. В отличие от артериальной гиперемии развивается в результате замедления или прекращения оттока венозной крови по сосудам.
В отличие от артериальной гиперемии развивается в результате замедления или прекращения оттока венозной крови по сосудам.
Основной причиной венозной гиперемии является механическое препятствие оттоку венозной крови от тканей или органа. Это может быть результатом сужения просвета венулы или вены при её компрессии (опухолью, отёчной тканью, рубцом, жгутом, тугой повязкой) и обтурации (тромбом, эмболом, опухолью), сердечной недостаточности, низкой эластичности венозных стенок, сочетающейся с образованием в них расширений (варикозов) и сужений.
Проявления
• Увеличение числа и диаметра просвета венозных сосудов в регионе гиперемии.
• Цианоз ткани или органа вследствие увеличение в них количества венозной крови и понижения содержания в венозной крови HbO2. Последнее является результатом утилизации кислорода тканью из крови в связи с медленным её током по капиллярам.
• Снижение температуры тканей или органов в зоне венозного застоя в результате увеличения объёма в них более холодной (в сравнении с артериальной) венозной крови и уменьшения интенсивности тканевого метаболизма (является результатом снижения притока артериальной крови к тканям в регионе венозной гиперемии).
• Отёк ткани или органа происходит вследствие увеличения внутрисосудистого давления в капиллярах, посткапиллярах и венулах. При длительной венозной гиперемии отёк потенцируется за счёт включения его осмотического, онкотического и мембраногенного патогенетических факторов (см. «Отёк» в главе 11 «Нарушения баланса воды»).
• Кровоизлияния в ткани и кровотечения (внутренние и наружные) в результате перерастяжения и микроразрывов стенок венозных сосудов (посткапилляров и венул).
• Изменения в сосудах микроциркуляторного русла.
† Увеличение диаметра капилляров, посткапилляров и венул в результате растяжения стенок микрососудов избытком венозной крови.
† Возрастание числа функционирующих капилляров на начальном этапе венозной гиперемии (в результате оттока венозной крови по ранее нефункционирующим капиллярным сетям) и снижение — на более поздних (в связи с прекращением тока крови в результате образования микротромбов и агрегатов клеток крови в посткапиллярах и венулах).
† Замедление (вплоть до прекращения) оттока венозной крови.
† Значительное расширение диаметра осевого «цилиндра» и исчезновение полосы плазматического тока в венулах и венах.
† «Маятникообразное» движение крови в венулах и венах — «туда‑обратно»:
‡ «Туда» — от капилляров в венулы и вены. Причина: проведение систолической волны сердечного выброса крови.
‡ «Обратно» — от вен к венулам и капиллярам. Причина: «отражение» потока венозной крови от механического препятствия (тромба, эмбола, суженного участка венулы).
Патогенные эффекты венозной гиперемии
Венозная гиперемия оказывает повреждающее действие на ткани и органы за счёт ряда патогенных факторов.
• Основные патогенные факторы: гипоксия (циркуляторного типа в начале процесса, а при длительном течении — смешанного типа), отёк ткани (в связи с увеличением гемодинамического давления на стенку венул и вен), кровоизлияния в ткани (в результате перерастяжения и разрывов стенок посткапилляров и венул) и кровотечения (внутренние и наружные).
• Последствия: снижение специфической и неспецифических функций органов и тканей, гипотрофия и гипоплазия структурных элементов тканей и органов, некроз паренхиматозных клеток и развитие соединительной ткани (склероз, цирроз) в органах.
Ишемия, определение, причины. Состояние микроциркуляции. Внешние проявления ишемии и их патогенез. Компенсаторные механизмы при ишемии. Последствия ишемии. Реперфузия крови, определение понятия, патогенез возникающих изменений, последствия.
Ишемия — несоответствие между притоком к тканям и органам артериальной крови и потребностью в ней. При этом потребность в кровоснабжении всегда выше реального притока крови по артериям.
Причины ишемии могут иметь различное происхождение и природу.
• По природе причины ишемии делят на физические, химические и биологические.
† Физические факторы: сдавление артериальных сосудов (например, опухолью, рубцовой тканью, инородным телом, жгутом), сужение или закрытие просвета изнутри (например, тромбом, эмболом, атеросклеротической бляшкой), действие чрезмерно низкой температуры.
† Химические факторы. Многие химические соединения обладают способностью вызывать сокращение ГМК артериальных сосудов и сужение их просвета. Примеры: никотин, ряд ЛС: мезатон, эфедрин, препараты адреналина, АДГ, ангиотензины.
† Биологические факторы: БАВ с сосудосуживающими эффектами (например, катехоламины, ангиотензин II, АДГ, эндотелин), БАВ микробного происхождения: их экзо‑ и эндотоксины, метаболиты с вазоконстрикторным действием.
• По происхождению выделяют ишемии, причина которых имеет эндогенное или экзогенное происхождение (инфекционное и неинфекционное).
Механизмы возникновения ишемии
Механизмы, обусловливающие преимущественное снижение притока артериальной крови к тканям и органам: нейрогенный, гуморальный и «механический».
• Нейрогенный механизм (нейротонический и нейропаралитический).
† Нейротонический. Характеризуется преобладанием эффектов симпатической нервной системы на стенки артериол в сравнении с парасимпатической. Это сопровождается повышенным выбросом норадреналина их адренергических терминалей.
Причины: активация симпатических влияний на ткани и органы (например, при различных вариантах стресса, действии на ткани низкой температуры, механической травмы, химических веществ) и повышение адренореактивных свойств стенок артериол (например, при сенсибилизации их к вазоконстрикторным агентам: в условиях повышенного уровня Ca2+ или цАМФ в миоцитах).
† Нейропаралитический. Характеризуется устранением или снижением («параличом») парасимпатических влияний на стенки артериол.
Причины. Торможение или блокада проведения нервных импульсов по парасимпатическим волокнам к артериолам (и в связи с этим — высвобождения ацетилхолина из терминальных нервных волокон в стенках артерий, артериол и прекапилляров). Такая ситуация может наблюдаться при невритах, механических травмах, развитии опухолей, хирургическом удалении ганглиев или пересечении парасимпатических нервов.
• Гуморальный механизм. Заключается в увеличении содержания в тканях веществ с вазоконстрикторным действием (например, ангиотензина II, АДГ, тромбоксана А2, адреналина, ПгF) и чувствительности рецепторов стенок артериол к агентам с сосудосуживающим действием (например, при увеличении в тканях [Ca2+] или [Na+]).
• Этиологический фактор механического характера. Характеризуется наличием механического препятствия движению крови по артериальным сосудам.
• Причины: сдавление (компрессия) артериального сосуда опухолью, рубцом, отёчной тканью, жгутом и уменьшение (вплоть до полного закрытия — обтурации) просвета артериолы (например, тромбом, агрегатом клеток крови, эмболом).
Механизмы возникновения ишемии, обусловливающие преимущественно значительное увеличение потребления тканями кислорода и/или субстратов обмена веществ. При этом потребность в кислороде и субстратах метаболизма превышает уровень их реальной доставки к тканям.
• Наиболее частая причина: Значительное повышение функции органа или ткани и возрастание в связи с этим — интенсивности метаболизма в них.
• Примеры.† Ишемия мышц (включая и миокард) при интенсивной и длительной физической нагрузке.† Ишемия миокарда при остром значительном повышении уровня АД (например, в условиях гипертензивного криза) и эмоциональном стрессе.
Последствия ишемии
• Характер, выраженность и масштаб последствий ишемии зависит от многих факторов. Наиболее значимыми являются:
† Скорость развития ишемии (чем она выше, тем более значительна степень повреждения тканей).
† Диаметр поражённой артерии или артериолы (чем он больше, тем тяжелее поражение).
† «Чувствительность» ткани или органа к ишемии (она особенно высока у ткани мозга, сердца, почек).
† Значение ишемизированного органа или ткани для организма (ишемия таких органов как мозг, сердце, почки может привести к гибели организма. В отличие от этого, ишемия участка кожи или какой‑либо скелетной мышцы совместима с жизнью).
† Степень развития коллатеральных сосудов и скорость включения или активации коллатерального кровотока в ткани или органе.
• Коллатеральный кровоток — система кровообращения в сосудах вокруг ишемизированного участка ткани и в нём самом.
† Включению (или возрастанию) коллатерального кровообращения способствуют наличие градиента давления крови выше и ниже суженного участка сосуда, накопление в зоне ишемии БАВ с сосудорасширяющим действием (аденозина, ацетилхолина, Пг, кининов и др.), активация местных парасимпатических влияний (способствующих расширению коллатеральных артериол) и высокая степень развития сосудистой сети (коллатералей) в поражённом органе или ткани.
† Группы органов и тканей в зависимости от степени развития артериальных сосудов и анастомозов между ними.
‡ С абсолютно достаточной коллатеральной сетью: скелетная мускулатура, брыжейка кишечника, лёгкие. В указанных образованиях совокупный просвет коллатеральных сосудов равен или превышает диаметр магистральной артерии. В связи с этим прекращение кровотока по ней не вызывает выраженной ишемии тканей в регионе кровоснабжения данной артерии.
‡ С абсолютно недостаточными коллатералями: миокард, почки, головной мозг, селезёнка. В этих органах суммарный просвет коллатеральных артерий значительно меньше диаметра магистральной артериальной ветви. В связи с этим окклюзия её приводит к выраженной ишемии или инфаркту ткани.
‡ С относительно достаточными (недостаточными) коллатералями: стенки кишечника, желудка, мочевого пузыря, кожа, надпочечники. В них совокупный просвет коллатеральных сосудов в более или менее выраженной степени меньше диаметра магистральной артерии. Окклюзия крупного артериального ствола в этих органах сопровождается большей или меньшей степенью их ишемии.
Эмболия, определение. Виды эмболий. Виды эмболов по происхождению, характеристика. Эмболия сосудов большого и малого круга кровообращения, воротной вены. Патогенез нарушения функции основных систем и органов. Последствия эмболии. Пути профилактики и лечения.
• Эмбол и эмболия.
† Эмбол — образование, циркулирующее в полостях сердца, кровеносных или лимфатических сосудах и в норме в них не встречающееся. По происхождению различают эндогенные и экзогенные эмболы, а по локализации в сосудах — артериальные и венозные.
‡ Экзогенные. Чаще всего — пузырьки воздуха (попадающие в крупные вены при их ранении) и инородные тела (например, осколки пули или ЛС на масляной основе при их введении в холодном состоянии).
‡ Эндогенные.
§ Фрагменты тромбов (тромбоэмболы).
§ Кусочки жировой ткани или кости, образующиеся при размозжении органов или переломах трубчатых костей.
§ Небольшие фрагменты распадающейся опухолевой или разрушенной нормальной ткани.
§ Конгломераты микробных клеток, много‑ и одноклеточные паразиты.
§ Пузырьки газов, в норме растворённых в плазме крови, но образующиеся при быстром переходе от более высокого барометрического давления к более низкому — при разгерметизации самолетов или космических аппаратов, а также при быстром подъёме с больших глубин.
‡ Артериальные эмболы. Закупоривают артериальные сосуды большого круга кровообращения (попадают из лёгочных вен или левых камер сердца), малого круга (заносятся из правых камер сердца или вен большого круга кровообращения).
‡ Венозные. Часто эмболы обнаруживают в мелких венозных сосудах воротной вены.
† Эмболия — циркуляция в кровеносном или лимфатическом русле образования, в норме в нём не встречающегося и закрытие либо сужение им кровеносного или лимфатического сосуда.
Изменения обмена веществ в очаге воспаления. Значение повреждения мембран клетки и ее органелл в патогенезе нарушения обмена веществ. Физико-химические изменения в очаге воспаления, их патогенез, последствия.
Причины изменения структуры клеток и других гистологических элементов:
• в течение первых минут — прямое действие флогогенного фактора;
• на более поздних этапах и дополнительно к прямому эффекту флогогенного фактора — влияние вторичных причин: метаболических, физико‑химических, микроциркуляторных и регуляторных расстройств.
Основные механизмы морфологических изменений:
• нарушения процессов энергетического обеспечения клеток;
• повреждение мембранного аппарата и ферментных систем;
• дисбаланс ионов и воды;
• нарушения местных (клеточных и органно‑тканевых) механизмов регуляции.
Проявления
• Развивающиеся в тканях изменения весьма разнообразны: от минимальных структурных отклонений до деструкции и некроза.
• Структурные изменения наблюдаются как в паренхиматозных клетках, так и в строме тканей и органов.
• Существенную роль в потенцировании повреждения клеточных и неклеточных структур играют высвобождающиеся из лизосом и активирующиеся в очаге воспаления гидролазы: протеазы, липазы, фосфолипазы, эластазы, коллагеназы и другие ферменты. Источником их являются как клетки самой повреждённой ткани, так и находящиеся в ней лейкоциты, а при септическом воспалении — и микроорганизмы.
• Для клеток при воспалительной альтерации характерны изменения в цитозоле, а также повреждение плазмолеммы и мембран органелл — митохондрий, лизосом, эндоплазматической сети, комплекса Гольджи и других. В связи с этим меняется их форма, размеры, число, а также функции органелл и клетки в целом.
Изменения обмена веществ
В очаге воспаления наблюдаются закономерные фазные изменения метаболизма. Их причины: действие флогогенного фактора и вторичные расстройства в ткани, выражающиеся в перестройке местных механизмов нервной и гуморальной регуляции, микроциркуляции, в формировании физико‑химических сдвигов.
На начальном этапе воспаления в ткани (не только зоны первичной, но и вторичной альтерации) преобладают реакции катаболизма, затем — при развитии артериальной гиперемии и активации процессов пролиферации, — как правило, начинают доминировать анаболические реакции.
Биологический «смысл» изменений метаболизма заключается в энергетическом и пластическом обеспечении местных адаптивных реакций в очаге воспаления, направленных на локализацию, уничтожение и элиминацию флогогенного агента, а также на ликвидацию патогенных последствий его воздействия.
Ионы и вода
Для ионов и воды характерен трансмембранный дисбаланс ионов, увеличение внутриклеточного содержания Na+ и Ca2+ и внеклеточного содержания K+ и Mg2+, гипергидратация клеток и отёк ткани в очаге воспаления.
Расстройства обмена веществ сопровождаются существенными и закономерными физико‑химическими сдвигами в очаге воспаления.
Физико‑химические изменения
Ацидоз
Воспалительная реакция характеризуется увеличением [Н+] и, соответственно, снижением рН в клетках и межклеточной жидкости — развитием ацидоза.
Причина метаболического ацидоза — накопление в очаге воспаления избытка недоокисленных соединений.
Механизмы развития метаболического ацидоза
• Образование большого количества «кислых» продуктов изменённого метаболизма вследствие:
† активации гликолиза, что сопровождается накоплением избытка молочной и пировиноградной кислот
† усиления протеолиза и липолиза с накоплением аминокислот, ВЖК и КТ.
• Нарушение оттока из очага воспаления продуктов как нормального, так и нарушенного обмена веществ. Последнее особенно выражено в связи с замедлением оттока венозной крови и развитием стаза в очаге воспаления.
• «Истощение» щелочных буферных систем (бикарбонатной, фосфатной, белковой и других) клеток и межклеточной жидкости, которые на начальном этапе воспаления нейтрализуют избыток кислых соединений.
Особенности изменения [Н+] в очаге воспаления
• Чем острее протекает воспаление, тем более выражен ацидоз: из компенсированного он быстро трансформируется в некомпенсированный.
• Как правило, [Н+] наибольшая в зоне первичной альтерации, она меньше в прилегающей к ней зоне вторичной альтерации и постепенно снижается по направлению к неповреждённой ткани.
• В отдельных участках интенсивной деструкции и аутолиза тканей, где накапливаются восстановленные органические и неорганические соединения, продукты промежуточного белкового распада (аммиак и его производные), может развиваться более или менее выраженный преходящий алкалоз. Однако, в целом для очага воспаления характерен ацидоз.
Гиперосмия
В очаге воспаления в большей или меньшей мере повышается осмотическое давление.
Причины
• Повышенное ферментативное и неферментное разрушение макромолекул (гликогена, гликозаминогликанов, протеогликанов и других).
• Усиленный в условиях ацидоза гидролиз солей и соединений, содержащих неорганические вещества.
• Поступление осмотически активных соединений из повреждённых и разрушенных клеток.
Гиперонкия
Увеличение онкотического давления в воспалённой ткани — закономерный феномен.
Причины
• Увеличение концентрации белка в очаге воспаления в связи с усилением ферментативного и неферментного гидролиза пептидов.
• Повышение гидрофильности белковых мицелл и других коллоидов в результате изменения их конформации при взаимодействия с ионами.
• Выход белков (в основном — альбуминов) из крови в очаг воспаления в связи с повышением проницаемости стенок микрососудов.
Причины экссудации
Основная причина экссудации — увеличение проницаемости стенок микрососудов вследствие множества процессов, повреждающих их стенку.
Механизмы экссудации:
1. Повышение проницаемости сосудов.
2. Увеличение гидростатичности давления в сосудах очага воспаления.
3. Увеличение коллоидно-осмотического давления в очаге воспаления в результате гиперосмии и гиперонкии.
Виды экссудата
Выделяют три основных типа экссудата: серозный, фибринозный и гнойный. В зависимости от наличия клеток, их типа, химического состава в экссудате различают также геморрагический и гнилостный его разновидности.
Серозный экссудат состоит из полупрозрачной жидкости, богатой белком (до 2–3%), и немногочисленных клеток, в том числе форменных элементов крови.
Фибринозный экссудат содержит большое количество фибриногена и фибрина.
Гнойный экссудат — мутная густая жидкость, содержащая до 6–8% белка и большое количество различных форм лейкоцитов, микроорганизмов, погибших клеток повреждённой ткани.
Наблюдается при:
а) инфекциях, вызванных кокковой флорой и патогенными грибами.
б) действии химических флогогенов (применение скипидара)
Пример гнойного экссудата:
а) фурункул — воспаление околоволосяного мешочка кожи;
б) карбункул — слияние многих фурункулов в один воспалительный очаг;
в) флегмона — острое разлитое гнойное воспаление подкожной клетчатки.
Результат гнойного воспаления — гнойное расплавление тканей. Продукт гнойного расплавления тканей — гной.
Гной — густая сливкообразная жидкость, желто-зелёная, сладковатая. При центрифугировании делится на 2 части: а) осадок — состоящий из клеток;
б) жидкая часть — гнойная сыворотка.
Клетки осадка (гнойные тельца) это нейтрофилы, моноциты, лимфоциты. Все эти клетки повреждены: вакуолизация цитоплазмы, гликоген и жир в ней, кариорексис и кариолизис.
Геморрагический экссудат содержит большое количество белка и эритроцитов, а также другие форменные элементы крови.
Гнилостный экссудат. Любой вид экссудата может приобрести гнилостный (ихорозный) характер при внедрении в очаг воспаления гнилостной микрофлоры (анаэробы).
Смешанные формы экссудата могут быть самыми разнообразными (например, серозно-фибринозный, гнойно-фибринозный, гнойно-геморрагический).
Эмиграция лейкоцитов
Спустя 1–2 часа после воздействия на ткань флогогенного фактора в очаге острого воспаления обнаруживается большое число вышедших (эмигрировавших) из просвета микрососудов нейтрофилов и других гранулоцитов, а позднее — через 15–20 и более часов — моноцитов, а затем и лимфоцитов. Эмиграция лейкоцитов — активный процесс их выхода из просвета микрососудов в межклеточное пространство.
Хронологическая упорядоченность эмиграции разных видов лейкоцитов в очаг острого воспаления обусловлена стадийностью образования и экспрессии на их поверхности молекул адгезии, а также стадийностью появления факторов хемотаксиса. К этим последним относят факторы комплемента C5а, фактор 4 тромбоцитов, метаболиты арахидоновой кислоты, лимфокины и другие.
Цитотоксины:
— компоненты комплемента
— калликреин
— денатурированные белки
— бактериальные токсины
— казеин
— пептон идр.
Цитотоксиногены:
— трипсин
— плазмин
— коллагеназа
— комплекс Аg + АТ
— гликоген
— бактериальные токсины
— лизосомальные ферменты
— лимфокины
Торможение хемотаксиса :
— гидрокортизон
— простагландины Е1 и Е2
— ЦАМФ
— колхицин
Механизм хемотаксиса:
1. Сокращение актомиозиновых нитей псевдоподий лейкоцитов.
2. Участие ионов Са++ и Мg++.
3. Увеличение поглощения О2.
4. Лейкоциты идут вслед за токами жидкости экссудата.
Сначала в очаг воспаления выходят нейтрофилы, затем — моноциты. Это закон эмиграции лейкоцитов Мечникова.
Причина:
1. Нейтрофилы более чувствительны к влиянию хемотоксинов.
2. Иной механизм эмиграции у моноцитов: моноцит внедряется в тело эндотелиальной клетки в виде большой вакуоли, проходит через её тело и выходит наружу. А не через межклеточные щели.
Роль нейтрофилов в очаге воспаления:
1. Появляются в очаге воспаления через 10 мин. после начала реакции воспаления.
2. Количество нейтрофилов достигает максимума через 4 — 6 час. после начала воспалительной реакции.
3. Фагоцитоз бактерии, продуктов распада, чужеродных частиц.
4. Поставка ферментов, катионных белков, активных форм кислорода.
5. Разрушение нейтрофилов — их остатки есть стимул для поступления и активности моноцитов.
Роль моноцитов в очаге воспаления:
1. Появляются в очаге воспаления через 16 — 24 час. после начала реакции воспаления.
2. Количество моноцитов достигает максимума через 72 час после начала.
3. Постепенно трансформируются в макрофаги:
— увеличивается объём цитоплазмы и органелл;
— увеличивается количество митохондрий и лизосом;
— образуются фаголизосомы;
— образуется медиаторы воспаления
— в результате активируется фагоцитоз!
Эмиграция и активизация моноцитов зависит от предыдущего выхода нейтрофилов. В эксперименте моноциты не накапливается в очаге в условиях нейтропении.
Вся масса клеток, которая накапливается в очаге воспаления, образует воспалительный инфильтрат. Этот инфильтрат есть причина припухлости в очаге воспаления.
Согласно представлениям И.И. Мечникова (1882), ключевым звеном механизма воспаления является именно фагоцитоз.
ФАГОЦИТОЗ- активный биологический процесс, заключающийся в поглощении чужеродного материала и его внутриклеточной деструкции специализированными клетками организма — фагоцитами.
Фагоцитоз осуществляют специальные клетки — фагоциты (преимущественно макрофаги и нейтрофилы). В ходе фагоцитоза образуются большие эндоцитозные пузырьки — фагосомы. Фагосомы сливаются с лизосомами и формируют фаголизосомы. Фагоцитоз индуцируют сигналы, воздействующие на рецепторы в плазмолемме фагоцитов.
Стадии фагоцитоза:
1 — адгезия частицы с помощью Fc-рецептора мембраны фагоцита;
2 — погружение адгезированной частицы в фагоцит и образование фагосомы;
3 — приближение и присоединение к фагосоме лизосом;
4 — слияние мембран фагосомы и лизосом с образованием фаголизосомы;
5 — разрушение поглощённой частицы.
Фагоциты
Термин «фагоцит» предложил И.И. Мечников. В настоящее время принято различать два основных класса фагоцитирующих клеток: микрофаги и макрофаги.
Микрофаги. К микрофагам отнесены полиморфноядерные гранулоциты: нейтрофилы (в наибольшей мере), эозино‑ и базофилы (существенно меньше). Их называют микрофагами, поскольку диаметр гранулоцитов сравнительно мал (6–8 мкм).
Макрофаги. Макрофагами (диаметр клеток достигает 20 мкм), или мононуклеарными фагоцитами называют моноциты крови и происходящие из них тканевые макрофаги. Все клетки моноцитарного генеза (например, клетки фон Купффера печени, остеокласты, клетки микроглии, альвеолярные макрофаги, перитонеальные макрофаги и т.д.) рассматривают как систему мононуклеарных фагоцитов (ранее эти фагоцитирующие клетки обозначали термином «ретикуло–эндотелиальная система»).
Объекты фагоцитоза
Объектами фагоцитоза для микрофагов являются микроорганизмы и инородные неживые частицы, а для макрофагов — повреждённые, погибшие и разрушенные клетки (чужеродные и собственного организма), а также инородные неживые частицы.
Терминология
Применительно к процессу фагоцитоза применяют следующие уточняющие определения.
• Собственно фагоцитоз: поглощение клеток, их фрагментов и их внутриклеточное переваривание.
• Незавершённый фагоцитоз (см. ниже)
• Иммунный (специфический) фагоцитоз и опсонизация (см. далее).
• Неспецифический фагоцитоз характерен, например, для альвеолярных макрофагов, захватывающих пылевые частицы различной природы, сажу и т.п.
• Ультрафагоцитоз: захватывание фагоцитом мелких корпускулярных частиц (пыли, попадающей с воздухом в лёгкие или инородных частиц в тканях).
Стадии фагоцитоза
В процессе фагоцитоза условно выделяют несколько основных стадий:
• Сближение фагоцита с объектом фагоцитоза.
• Распознавание фагоцитом объекта поглощения и адгезия к нему.
• Поглощение объекта фагоцитом с образованием фаголизосомы.
• Разрушение объекта фагоцитоза.
Общие признаки воспаления.
= лихорадка
= реакции соединительной ткани
= реакция кроветворной ткани
= лейкоцитоз
= увеличение СОЭ
= ускорение обмена веществ
= интоксикация
= изменение реактивности организма
Под хроническим воспалением понимают продолжительный процесс (недели и месяцы), при котором повреждение тканей, реактивные изменения и рубцевание развиваются одновременно. Несмотря на то что хроническое воспаление может следовать за острым, часто оно начинается как слабый, иногда бессимптомный, процесс.
Признаки острого воспаления
Признаки острого воспаления и их основные причины подразделяют на местные и общие (системные).
Местные признаки острого воспаления
Местные признаки острого воспаления сформулированы ещё в Античности. К ним отнесены rubor, tumor, dolor, calor, functio laesa.
Rubor
Системные изменения при остром воспалении
Лейкоцитоз — увеличение количества лейкоцитов в определённом объёме крови и, как правило, в организме в целом.
Причины • Действие флогогенного агента, особенно если он относится к микроорганизмам.
• Продукты, образующиеся и высвобождающиеся при повреждении собственных клеток активируют синтез непосредственных стимуляторов лейкопоэза — лейкопоэтинов и/или блокируют активность ингибиторов пролиферации лейкоцитов.
Лихорадка Основная причина лихорадки — образование избытка ИЛ1 и ИЛ6, обладающих, помимо прочего, также и пирогенным действием.
Диспротеинемия Причины диспротеинемии
• Увеличение в крови фракции глобулинов. Это связано с активацией гуморального звена иммунитета.
• При воспалении, сочетающемся с интоксикацией или расстройством функций ССС, дыхательной, эндокринной и других систем, может нарушаться синтез альбуминов в печени с развитием дисбаланса альбуминов и глобулинов.
Ускорение СОЭ Причины ускорения СОЭ
• Диспротеинемия.
• Изменение физико-химических параметров крови (развитие ацидоза, гиперкалиемии, увеличение уровня проагрегантов).
• Активация процессов адгезии, агрегации и оседания эритроцитов.
В отличие от острого воспаления, проявляющегося сосудистыми реакциями, фиброзным выпотом, отеком и выраженной инфильтрацией нейтрофилами, хроническое характеризуется инфильтрацией мононуклеарными клетками, включающими макрофаги, лимфоциты и плазматические клетки, отражающими персистирующую реакцию на повреждение; разрушением тканей, обычно вызываемым воспалительными клетками; попыткой восстановления разрушенных тканей путем их замещения соединительной тканью, а именно новообразованием мелких кровеносных сосудов (ангиогенез) и частично фиброзом.
Воспаление является одной из самых универсальных и самых древних реакций живых существ на вредности внешней и внутренней среды.
Как исторически сложившаяся функция, обусловленная всем ходом приспособления организма к окружающему миру, воспаление не перестает быть биологически целесообразным феноменом, даже если процесс чрезмерен и явно угрожает здоровью и жизни индивида
Важно подчеркнуть существование физиологических прототипов воспаления, т.е. наличие частичных слагаемых этого процесса (эмиграции, экссу-дации, альтерации, пролиферации), в нормальной жизни. Воспаление, прежде чем оно возникло как реактивный процесс сложной природы, проделало многовековой период развития частных своих сторон. Физиология, эмбриология широко отображают этот факт. Известно, что всякий нормальный акт пищеварения сопровождается обильной эмиграцией лейкоцитов в слизистую оболочку желудка и кишечника, а так-же и в их просвет. Это сопровождается и общим лейкоцитозом. Лейкоциты непрерывно эмигрируют через эпителиальный покров в полости рта, глотки, особенно на полях залегания лимфаденоидной ткани, например в области небных и. глоточных минда-лин; «слюнные тельца» и являются этими лейкоцитами.
Послеродовое очищение осуществляется при интенсивном участии лейкоцитов, напоминая вторичное очищение ран при их заживлении. Перестройка тканей и целых органов (так называемая морфаллаксия) при развитии эмбриона происходит, как правило, на фоне реактивных явлений с участием лейкоцитов, при наличии нек-розов, кровоизлияний. Это же можно наблюдать при редукции хвоста головастика, при преобразовании жаберных щелей у эмбриона человека. Сюда же относится физиологический «катар» евстахиевых труб и среднего уха у новорожденных. Аналогичные явления сопутствуют генезу лимфаденоидной ткани. Так, в процессе разрыхления эпителиальных пластов лейкоцитами, миграции последних на поверхность, в тканевую среду, в кровеносные и лимфатические сосуды, идет формирование миндалин, аденоидов, пейеровых бляшек, зобной железы.
Органогенетические тенденции намечаются часто и по ходу хронического воспаления в виде, например, массового формирования лимфатических фолликулов в толще воспаленного органа.
Развитию проблемы филогенеза воспаления посвящен капитальный труд И. И. Мечникова «Лекции по сравнительной патологии воспаления» и последующие работы, освещающие проблему фагоцитоза.
Развитие «орудий» воспаления восходит к бессосудистым существам. Воспалительная реакция здесь складывалась как чисто пролиферативная; ее и следует счи-тать филогенетически древнейшей. Но и при появлении сосудов (дождевой червь, три-тон, аксолотль, улитка) воспалительная реакция продолжает оставаться такой же, т.е. протекает без видимого участия сосудов. Только в дальнейшем, когда дифферен-цировались основные структурные элементы сосудов, эндотелий и происходящие из него адвентициальные клетки (у головоногих), развивается феномен эмиграции, спо-собность к нагноению и т.д. Дальнейшее усовершенствование воспалительной реак-ции осуществлялось не только за счет увеличения числа «орудий» (пролиферация и экссудация нарастали лишь в отношении их интенсивности), но и за счет ускорения темпов всего процесса, повышения «готовности» организма к развитию воспаления и умножения вариантов его течения (нормергия, гип- и гиперергия). Все это богатство вариаций отмечается уже у теплокровных и обусловлено усовершенствованием иннер-вации, а также повышением общей реактивности всех структур благодаря возрастаю-щей лабильности клеточных, сосудистых гуморальных реакций. По существу же, как указывал И. И. Мечников, это все «разные ступени одного непрерывного’ процесса».
Сравнивая скорость развертывания воспалительной реакции и ее относительную яркость у млекопитающих с таковыми у более ранних филогенетических форм, Rossle (1943) характеризует эту реакцию в последнем случае как искусственно, кинемато-графически растянутую.
Из экссудативных форм воспаления позднейшей, т.е. филогенетически самой молодой, является фибринозная. Фибрин усилил локализующую и отграничивающую «функцию» воспалительного процесса.
Усложнение процесса в филогенезе шло не только за счет увеличения числа «орудий», с помощью которых процесс осуществляется (клеточная пролиферация, экссудация, иннервационные, в основном вазомоторные механизмы, обменные, фар-ментативные реакции и т.д.), но и за счет образования новых, более тесных связей ме-жду «местным», т.е. очагом воспаления, и «общим», т.е. организмом. Эти связи не на-рушают принципа автоматизма развития воспаления на месте. Скорее они его обеспе-чивают, придавая индивидуальные черты каждой ответной реакции организма на воз-никшее повреждение. Очевидно, что у млекопитающих, а тем более у человека, диапа-зон этих черт должен быть особенно разнообразен, отражая разнообразие факторов внешней среды и все разнообразие функциональных систем.
В онтогенезе мы обнаруживаем те же этапы развития воспалительного процесса, как они слагались в филогенезе. Так, у плодов до 5—6 месяцев «готов-ность» к воспалению вообще отсутствует. При наличии внутриутробного заражения ткани таких плодов могут содержать огромные количества микроорганизмов, напри-мер спирохет (при врожденном сифилисе), без какой-либо реакции. Лишь позднее возникают очаговые и диффузные пролиферативные, а затем и экссудативные реакции, особенно ярко выраженные у новорожденных и грудных детей. Среди этих реакций наиболее поздно оформляется фибринозная. Не случайно у маленьких детей, до 3—4 лет, сравнительно редки крупозные пневмонии, дифтеритические формы дизентерии и т.п.
Как и всякий патологический процесс, воспаление по своей сущности процесс противоречивый. В нем сочетаются и мобилизация защитных сил организма, и явления повреждения («полом»). Возникнув в филогенезе как явление приспособительное, воспаление сохранило это свойство и у высших животных. Организм защищается от воздействия чуждых и вредных ему факторов путем отграничения воспалительн
Читайте также:
Венозная гиперемия. Патологическая физиология
Венозная гиперемия
Венозная гиперемия – это состояние повышенного кровенаполнения органа или ткани, обусловленное затрудненным оттоком крови по венам.
Венозное полнокровие может быть местным и распространенным. Местное венозное полнокровие возникает при затруднении оттока крови по крупным венозным стволам вследствие закупорки их тромбом, эмболом или при сдавлении вены извне опухолью, рубцом, отеком и т. д.
Условием, способствующим венозному застою, является длительное нефизиологическое положение той или иной части тела, неблагоприятное для местного оттока крови. При этом формируется гипостаз – гравитационная венозная гиперемия.
Причинами распространенного венозного полнокровия наиболее часто являются:
1) недостаточность функции сердца при ревматических и врожденных пороках его клапанов, миокардитах, инфаркте миокарда;
2) декомпенсация гипертрофированного сердца;
3) уменьшение присасывающего действия грудной клетки при экссудативном плеврите, гемотораксе и т. д.
По темпу развития и длительности существования данная патология может носить острый и хронический характер. Длительная венозная гиперемия возможна только при недостаточности коллатерального венозного кровообращения.
Микроциркуляторные расстройства при венозной гиперемии характеризуются:
1) расширением капилляров и венул;
2) замедлением кровотока по сосудам микроциркуляторного русла вплоть до стаза;
3) утратой деления кровотока на осевой и плазматический;
4) повышением внутрисосудистого давления;
5) маятникообразным или толчкообразным движением крови в венулах;
6) уменьшением интенсивности кровотока в области гиперемии;
7) нарушением лимфообращения;
8) увеличением артериовенозной разницы по кислороду.
К внешним признакам венозной гиперемии относятся:
1) увеличение, уплотнение органа или ткани;
2) развитие отека;
3) возникновение синюшности, т. е. цианотичной окраски.
При остром венозном полнокровии может наблюдаться выход эритроцитов из мелких сосудов в окружающие ткани. При скоплении значительного их количества в слизистых и серозных оболочках, коже формируются мелкие, точечные кровоизлияния. Вследствие усиления транссудации в тканях накапливается отечная жидкость. Количество ее может быть весьма значительным в подкожной клетчатке (анасарка), плевральных полостях (гидроторакс), брюшной полости (асцит), перикарде (гидроперикард), желудочках мозга (гидроцефалия). В условиях гипоксии в клетках паренхиматозных органов развиваются зернистая и жировая дистрофия, мукоидное набухание межуточного вещества. Эти изменения носят, как правило, обратимый характер и при устранении причины острое венозное полнокровие завершается полным восстановлением структуры и функции тканей.
При хроническом венозном полнокровии происходят развитие дистрофических процессов в тканях, атрофия паренхиматозных элементов с одновременным заместительным разрастанием клеток стромы и накоплением в ней коллагеновых волокон. Необратимое склерозирование и уплотнение органа сопровождается нарушением его функций и называется цианотической индурацией.
Данный текст является ознакомительным фрагментом.Читать книгу целиком
Поделитесь на страничкеДокумент без названия
Документ без названияВенозный застой
Венозный застой — частое осложнение травматических повреждений и реконструктивных операций. Венозный застой возникает, когда артериальный приток больше венозного оттока. Когда венозный отток затруднен из-за свертывания крови или разрушения вен, венозное давление увеличивается. Длительное повышение венозного давления приводит к вздутию, отеку, застою, ишемии и гибели клеток.
В послеоперационном периоде это может произойти, когда реконструктивный хирург просто не может найти и восстановить адекватное венозное кровообращение или когда сгустки блокируют венозный выход.Интраоперационная антикоагулянтная терапия и микрохирургические методы обычно используются для снижения частоты венозного застоя, но это остается значительным риском. Когда хирургическая коррекция венозного застоя невозможна и артериальный кровоток остается адекватным, хирурги могут использовать терапию пиявками для спасения перенесенного лоскута.
Пиявки увеличивают перфузию тканей за счет активного удаления скопившихся жидкостей и пассивно, способствуя кровотечению. Пиявочная терапия увеличивает оксигенацию пораженных тканей и дает время для неоваскуляризации и тромболизиса.
Медицинские пиявки хорошо приспособлены для лечения венозного застоя. Они безболезненно надрезают рану в форме тройки, которая медленно закрывается. Они выделяют слюну, которая: обезболивает кожу, расслабляет ткани и препятствует каскаду свертывания крови. Наконец, пиявка может извлекать в среднем 5 мл крови и жидкости во время кормления и еще 50 мл после отделения, когда рана продолжает сочиться. Удаление этого объема позволяет притоку новой крови. Подсчитано, что пиявка увеличивает поверхностную перфузию примерно на 1.6 см. диаметр вокруг головы пиявки.
Перед тем, как начать лечение пиявками, очень важно дифференцировать
между артериальной окклюзией и венозным застоем. Это потому, что лечение пиявками противопоказано.
при артериальной окклюзии . Недостаточный артериальный кровоток делает рану гораздо более тяжелой.
восприимчивы к заражению, в том числе от пиявки.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Мгновенно отзывы:
Лечение пиявками противопоказано при артериальной окклюзии.
RnCeus
Домашняя страница | Курс
каталог | Скидка
цены | Войти | Уход
вакансии | Справка
2012 © RnCeus Interactive, ООО
все права защищены.
Документ без названия
Документ без названияЦентральный Мониторинг венозного давления
Считается центральное венозное давление
прямое измерение артериального давления в правом предсердии и полой вене.Его получают, продевая центральный венозный катетер (подключичный двойной просвет.
показана центральная линия) в любую из нескольких крупных жил. Он имеет резьбу так, чтобы
кончик катетера упирается в нижнюю треть верхней полой вены.
Узел контроля давления прикреплен к дистальному порту многоканального
катетер центральной вены.
Помощь в размещении CVP
|
Катетер ЦВД является важным инструмент, используемый для оценки функции правого желудочка и состояния системной жидкости.
- Нормальное ЦВД 2-6 мм рт.
- CVP повышается на:
- повышенная гипергидратация венозный возврат
- сердечная недостаточность или стеноз ПА которые ограничивают венозный отток и приводят к венозному застою
- дыхание с положительным давлением, напряжение,
- ЦВД снижается при:
- гиповолемический шок от кровотечения, сдвиг жидкости, обезвоживание
- дыхание с отрицательным давлением что происходит, когда пациент демонстрирует ретракцию или механический отрицательный давление, которое иногда используется при тяжелых травмах спинного мозга.
Катетер ЦВД также является важным лечебный инструмент, позволяющий:
- Быстрая инфузия
- Настой гипертонических растворов и лекарства, которые могут повредить вены
- Последовательное исследование венозной крови
Мгновенно
Обратная связь:
Показания ЦВД помогают оценить функцию правого желудочка и жидкостный статус.
Есть два способа прочитать CVP форма волны:
1. Найдите среднее значение волны A .
- читать высшую точку А волна
- читать нижнюю точку буквы A волна
- добавить максимум к минимуму точка
- делим сумму на 2
- результат — среднее значение ЦВД
Волна А начинается как раз после окончания зубца P и представляет сокращение предсердия.Высшая точка волны А — это предсердное давление при максимальном сокращении. В течение Волна предсердного давления больше диастолического давления желудочков. В этот момент предсердие сокращается, трехстворчатый клапан открыт. Следовательно, верхняя точка волны A близко параллельна концу правого желудочка диастолическое давление. Помните, когда трикуспидальный клапан открыт и правый желудочек заполнен, желудочек, предсердие и полая вена соединены.Следовательно, эта точка — CVP.
2. Найдите Z-точку.
- Найдите точку Z, которая встречается от середины до конца QRS
- Считайте Z-точку
Точка Z совпадает с от середины до конца волны QRS. Это происходит непосредственно перед закрытием трикуспидального клапана. клапан. Следовательно, это хороший индикатор конечного диастолического давления правого желудочка. давление.Точка Z полезна, когда волны А не видны, как при предсердии. фибрилляция. ( c-волна возникает при закрытии трикуспидального клапан. Пик c-волны — это повышение предсердного давления, вызванное трикуспидальный клапан выпячивается обратно в предсердие.)
Мгновенно
Обратная связь:
Найти
Z-точка для считывания формы волны ЦВД, когда волны А не видны.
Хронический венозный застой — howMed
Увеличение объема крови в определенной ткани называется застоем. Это пассивный процесс, возникающий из-за нарушения оттока из ткани. Это может произойти по любой общей причине, например: при сердечной недостаточности. Также может быть какая-либо местная причина обструкции.
Гиперемия
Это увеличение объема крови в определенной ткани, но это активный процесс, возникающий в результате расширения артериол e.грамм. на коже во время упражнений или в месте воспаления.
Хронический венозный застой в легких
Морфология
Брутто
Цвет легких будет тускло-красновато-синим. Легкие тяжелые и влажные. На разрезах видны геморрагические области из-за обильной экстравазации альвеолярных капилляров.
Микроскопия
Набухшие альвеолярные капилляры в альвеолярных перегородках. Будут внутриальвеолярные кровоизлияния, альвеолярные перегородки и пространства содержат многочисленные клетки сердечной недостаточности.Утолщение или фиброз альвеолярных перегородок.
Хронический венозный застой печени
Брутто
Печень крупнее и влажная. На разрезе видны скопившиеся красные центры долек печени, окруженные бледными непораженными периферическими участками. Этот вид известен как печень мега ореха. В длительном случае хронического венозного застоя будет усиление фиброза, уменьшение размера печени, а паренхима разделится на дольки, и это состояние известно как цирроз печени.
Микроскопия
Центральная вена и синусоиды растянуты эритроцитами. Присутствуют некоторые участки кровотечения. Когда эти эритроциты фагоцитируются макрофагами, они называются сидерофагами. Виден центральный дольчатый некроз из-за скопления центральных вен. Также наблюдается жировая перемена из-за гипоксии в периферических гепатоцитах.
Хотите более четкую концепцию, также
Просмотреть все изображения о Хронический венозный застой в легких
Просмотреть все изображения о Хронический венозный застой в печени
Просмотреть все изображения о Хронический венозный застой в селезенке
Синдром тазовой венозной застоя | BSIR
Синдром тазовой венозной застоя
Д-р Шахин Диксон 1 , д-р Чарльз Росс Таппинг 1 , д-р Вей Чуен Лионг 2 и д-р Динук Варакаулле 2
Отделения радиологии, 1 Госпиталь Джона Рэдклиффа, Оксфорд и 2 Госпиталь Сток-Мандевиль, Эйлсбери
К началу
Что такое синдром тазовой венозной застоя?
Синдром застойных тазовых вен также известен как рефлюкс яичниковой вены.Это причина хронической тазовой боли примерно у 13-40% женщин. Хроническая тазовая боль — это боль внизу живота, которая длится более 6 месяцев. Таким образом, синдром тазовой заложенности является болезненным состоянием, часто вызываемым расширением яичников и / или тазовых вен (скорее как варикозное расширение вен, но в тазу). Варикозное расширение вен обычно наблюдается на ногах, когда вены становятся менее эластичными, а клапаны, препятствующие току крови в обратном направлении, перестают работать. Это заставляет кровь скапливаться под действием силы тяжести, вызывая расширенные, выпуклые и узловатые вены.То же самое происходит с тазовыми венами при синдроме тазовой венозной застойности (PVCS). Это давление приводит к боли при ЖЭП, а также может вызывать видимое варикозное расширение вен вокруг вульвы, влагалища, внутренней поверхности бедра, иногда на ягодицах и на ногах.
Чтобы понять, какие вены расширены и почему возникает варикозное расширение вен вокруг вульвы / влагалища и вниз по внутренней стороне бедра, важно немного знать анатомию. Диаграмма ниже ( Диаграмма 1 ) демонстрирует нормальную анатомию вен внутри тела.
Диаграмма 1: Нормальная анатомия вен : Обычно кровь перекачивается от ног через вены таза и брюшной полости к сердцу. Кровь обычно течет из яичников по яичниковым венам. Правая яичниковая вена соединяется с нижней полой веной, а левая яичниковая вена соединяется с левой почечной веной.
Когда клапаны в вене перестают работать или возникает препятствие для кровотока в венах, возвращающегося к сердцу, кровь течет в обратном направлении (т.е. не туда, подальше от сердца). Это вызывает варикозное расширение вен в тазу вокруг яичников, вульвы / влагалища, а также по внутренней поверхности бедра и ног, вызывая ПВК. Посмотрите на Диаграмма 2 и 3 , которые показывают, что происходит, когда вены становятся ненормальными.
Диаграмма 2 : Показывает, как выглядит расширенная вена и вызывает варикозное расширение вен вокруг яичника, потому что клапаны не работают. Кровоток идет в неправильном направлении, скапливаясь в венах и вызывая их расширение.
К началу
Каковы причины PVCS?
Причина расширения яичниковых / тазовых вен при ЖЭП изучена недостаточно. Чаще всего ПВК возникает у молодых женщин, и обычно у женщин, имевших не менее 2-3 детей. Во время беременности яичниковая вена может быть сдавлена увеличивающейся маткой или увеличена из-за усиленного кровотока.Считается, что это влияет на клапаны в вене, заставляя их перестать работать и позволяя крови течь в обратном направлении, что способствует развитию ПВС.
Существуют и другие причины, которые могут вызвать обструкцию яичниковых и тазовых вен, приводящую к ЖЭП, которые встречаются гораздо реже и являются результатом обструкции вен. PVCS также может быть связан с поликистозом яичников.
Способствующим фактором может быть отсутствие венозных клапанов из-за аномального развития.
К началу
Каковы симптомы и признаки?
Симптомы ПВК возникают из-за расширения тазовых вен и из-за того, что кровь течет в неправильном направлении (т.е.е. назад).
Варикозное расширение вен в тазу окружает яичник, а также может давить на мочевой пузырь и прямую кишку. Это может вызвать следующие симптомы:
- Тазовая боль или ноющая боль в области таза и нижней части живота
- Тянущее ощущение или боль в тазу
- Ощущение полноты в ногах
- Ухудшение стрессового недержания мочи
- Ухудшение симптомов, связанных с синдромом раздраженного кишечника
Боль — обычно самый частый симптом и длится более 6 месяцев.Боль обычно бывает с одной стороны, но может затрагивать обе стороны. Боль усиливается при стоянии, подъеме, когда вы устали, во время беременности, а также во время или после полового акта. На вены также влияет менструальный цикл / гормоны, поэтому боль может усиливаться во время менструации. Боль обычно уменьшается в положении лежа.
Однако не у каждой женщины с рефлюксом тазовых вен проявляются симптомы, и у многих они возникают только после беременности. Это связано с тем, что после беременности вены могут расширяться больше из-за сжатия матки.Затем это вызывает формирование варикозного расширения вен влагалища / вульвы ( Диаграмма 3 ). Варикозное расширение вен может уменьшиться после беременности, но со временем может ухудшиться.
Диаграмма 3: Демонстрирует распространение варикозного расширения вен по медиальной стороне внутренней поверхности бедра. Обычно это происходит после беременности или при отсутствии лечения.
К началу
Как диагностируется?
Первый способ диагностировать ПВС — типичные симптомы и обнаружение видимого варикозного расширения вен при осмотре.У многих женщин в анамнезе было варикозное расширение вен вокруг вульвы во время беременности. При осмотре вы можете увидеть эти вены вокруг вульвы, и они могут доходить до внутренней поверхности бедра. На внутренней стороне бедра есть мышечное сухожилие, по которому прощупываются и видны расширенные вены. Если вены лежат за этим сухожилием и / или проходят за ногой, скорее всего, они расширены из-за рефлюкса из яичниковых и / или тазовых вен.
Может быть полезно ультразвуковое исследование (УЗИ). Thi
Безопасность турникета: механизмы и предотвращение травм
Для повышения безопасности жгута для пациентов важно знать механизмы и способы предотвращения травм жгута.
Безопасность хирургического жгута
По достоверным оценкам, пневматические жгуты используются в более чем одном миллионе хирургических процедур ежегодно в Северной Америке. Вероятность травмы значительна, хотя использование более низких индивидуальных уровней давления на жгут и более короткое время наложения жгута сокращают количество, характер и степень зарегистрированных травм. Травмы, возникающие в результате использования пневматического жгута, чаще всего связаны с давлением в результате использования слишком высокого уровня давления жгута или использования недостаточно низкого уровня давления жгута.Ишемические травмы также могут возникать в результате длительного наложения жгута. Большинство таких травм могут быть преходящими и, возможно, не замеченными клинически, но некоторые травмы являются постоянными или обратимыми только в течение продолжительных периодов времени с длительной нетрудоспособностью, которую испытывает больной пациент.
При использовании хирургических жгутов рекомендуется принимать все разумные профилактические меры, чтобы свести к минимуму вероятность осложнений и травм, связанных с жгутом. Щелкните здесь, чтобы узнать о 10 передовых методах хирургических турникетов.
Осложнения и травмы, связанные с использованием хирургического жгута, включают [1]:
- Повреждение нерва
- Пост-турникетный синдром
- Интраоперационное кровотечение
- Синдром сдавления в компартменте
- Пролежни и химические ожоги
- Некроз пальца
- Токсические реакции
- Тромбоз
- Другие осложнения
1. Травма нерва
Повреждение нерва является наиболее частым осложнением при использовании жгутов во время операций на верхних конечностях, а также может возникать при наложении манжетов на бедро и голень.Впервые он был признан более 120 лет назад. Степень повреждения нерва может варьироваться от легкой временной потери функции до необратимого повреждения. Симптомы повреждения нерва включают неспособность обнаружить боль, тепло, холод или давление на кожу вдоль источника нерва; и медлительность или неспособность двигать большими или маленькими мышцами по команде.
Паралич конечностей также называют параличом нервов или синдромом паралича жгута. Когда это происходит, поражаются все моторные нервы дистальнее манжеты, что приводит к временной или постоянной неспособности двигать конечностью.Лучевой нерв — это наиболее часто поражаемый нерв. Симптомы паралича жгута: моторный паралич и потеря осязания, давления и проприоцептивных реакций.
Паралич может вызвать у пораженных пациентов значительную инвалидность и психологический стресс. Помимо воздействия на отдельного пациента, травма нерва, возникшая в результате несоблюдения передовых методов, также может привести к потенциальной юридической ответственности хирургического персонала и медицинского учреждения.
Повреждение нерва: механизм
Было высказано предположение, что частота травм нервов или так называемого пареза жгута может быть сильно занижена, например [2, 3].Чтобы свести к минимуму риск для пациента и потенциальную юридическую ответственность, важно понимание механизма таких травм и возможных профилактических мер.
Основной механизм повреждения нервов, связанного с жгутом, был исследован Ochoa et al. [4-6]. В экспериментах с широкими манжетами для жгута Ochoa et al. обнаружил характерное поражение с анатомическими особенностями и распределением, что позволяет предположить, что повреждение нервных волокон является результатом уровня давления сжатия и градиентов давления, приложенных от манжеты жгута.Отдельные раздвоенные нервные волокна, которые были сжаты под жгутом манжеты, были исследованы под электронным микроскопом, и в крупных миелинизированных волокнах были замечены характерные аномалии узлов Ранвье. В частности, узел Ранвье был смещен из своего обычного положения под соединением шванновских клеток, а паранодальный миелин был растянут с одной стороны узла и инвагинирован с другой стороны. При исследовании распределения поражений под манжетой смещение узлов Ранвье было наибольшим под краями манжеты с относительной или полной щадью под центром манжеты.Направление смещения узлов Ранвье было от манжеты к несжатой ткани. Поскольку градиент давления наиболее высок на краях манжеты, это открытие предполагает, что градиент давления внутри нерва между его сжатой и несжатой частями является фактором, ответственным за смещение. Другой важный вывод заключался в том, что степень смещения узла Ранвье была более умеренной при более низком уровне давления сжатия по сравнению с более высокими уровнями давления сжатия.
Эти результаты показывают, что вероятность повреждения нерва на основе жгута увеличивается по мере увеличения уровня давления пневматического жгута и увеличения градиента давления около краев манжеты жгута.
Рис. 1: (а) Нормальный узел нерва Ранвье на конечности, демонстрирующий узловую щель шириной 1-2 мм. (b) Аномальный узел Ранвье через четыре дня после сдавливания конечности и нерва жгутом манжеты. (c) Электронная микрофотография малой мощности узла, показанного на (b).Это узловое поражение сопровождается разрушением паранодального миелина. Восстановление может быть отложено из-за интрамиелина и периаксонального отека, что приводит к локализованному отеку, который уменьшается в количестве в течение нескольких месяцев и, возможно, является причиной задержки функционального восстановления. [5]
Нервная травма: меры профилактики
Поскольку повреждение нерва, связанное с жгутом, было связано с механическими, а не ишемическими факторами, механический стресс заслуживает наибольшего внимания для предотвращения повреждения нерва.В настоящее время рекомендуется в качестве наилучшей практики при любых обстоятельствах использовать минимальный уровень давления на жгут, необходимый для получения стабильного бескровного поля во время хирургической процедуры. Лучше всего этого можно достичь с помощью персонализированной системы жгута, которая применяет уровень давления жгута на основе давления окклюзии конечности каждого отдельного пациента (LOP), и в которой используются персонализированные манжеты для жгута, разработанные для минимизации градиентов давления в манжете и соответствия размеру конечности отдельного пациента и форма.Давление окклюзии конечности может быть определено как минимальное давление, необходимое в определенное время в определенной манжете для жгута, приложенной к определенной конечности пациента в определенном месте, чтобы остановить поток артериальной крови в конечность дистальнее манжеты. Щелкните здесь, чтобы узнать больше о давлении окклюзии конечности, конструкции манжеты жгута и градиентах давления. Таким образом, риск повреждений нервов, связанных с давлением, можно снизить, установив уровень давления жгута на основе давления окклюзии конечности и используя манжету для жгута, которая прикладывает низкий градиент давления к нижней конечности и соответствует нижней конечности пациента. размер и форма.
Рисунок 2: Персонализированная система жгута
Меры безопасности по предотвращению повреждения нервов и осложнений, вызванных давлением, можно резюмировать следующим образом:
- Убедитесь, что инструмент для жгута и манжета были тщательно проверены перед использованием в соответствии с установленными руководящими принципами и инструкциями производителя. Щелкните здесь для получения информации об осмотре инструментов для жгута и манжет. Убедитесь, что дисплей давления точно отражает уровень давления в камере манжеты.Было показано, что некоторые нервные травмы являются вторичными по отношению к неправильным показаниям давления, что приводит к наложению чрезмерного давления жгута.
- Убедитесь, что манжета для жгута выбрана в соответствии с размером и формой конечности в желаемом месте манжеты, и что выбранная манжета плотно и правильно наложена.
- Используйте рукав для защиты конечностей, соответствующий выбранной манжете, чтобы предотвратить образование складок, защемление и повреждение кожи и подкожных тканей, лежащих под манжетой. Нажмите здесь, чтобы узнать больше о подходящих рукавах для защиты конечностей.
- Используйте индивидуальное давление жгута на основе минимального давления, необходимого для остановки кровотока для каждого отдельного пациента (давление окклюзии конечности).
- Минимизируйте время наложения жгута.
- Помните о соответствующих соображениях безопасности перед использованием жгута, во время его использования и после использования жгута.
2. Синдром после наложения турникета
Пост-турникетный синдром проявляется выраженным, а иногда и длительным послеоперационным отеком конечности.Примерно половина всех отеков после наложения жгута вызывается возвращением крови к конечности после снятия жгута (гиперемия). Остальное — результат постишемической реактивной гиперемии, дополнительного увеличения крови для восстановления нормального кислотно-щелочного баланса в тканях. Постишемическая реактивная гиперемия отражает попытку организма очистить конечность от продуктов метаболизма аноксии. Позже может появиться дополнительный отек из-за отека или послеоперационной гематомы. Длительное кровотечение из операционной раны также существенно влияет на отек.Пост-турникетный синдром характеризуется отеком, скованностью, бледностью, слабостью без паралича и субъективным онемением без объективной анестезии.
Пост-турникетный синдром: механизм
Считается, что в отличие от нервных параличей пост-турникетный синдром возникает в первую очередь из-за продолжительной ишемии, а не из-за прямого механического воздействия на мышцы жгута манжеты. Таким образом, манжета для жгута может вызывать нервно-мышечное повреждение, вызывая ишемию в тканях, удаленных от манжеты жгута, а также в результате сжатия и ишемии в тканях под манжетой жгута.
Послеоперационная слабость, отек, скованность, дизестезия и боль могут быть ошибочно приписаны хирургической травме или отсутствию мотивации пациента, если у клинициста нет адекватного индекса подозрения на нервно-мышечное повреждение, связанное с жгутом. Рандомизированные проспективные исследования продемонстрировали аномалии ЭМГ в конечностях, обработанных обычным пневматическим жгутом. Эти нейрофизиологические изменения могут быть связаны со слабостью пораженной конечности и более длительным клиническим периодом восстановления; Фактически послеоперационные аномалии ЭМГ в некоторых случаях могут сохраняться до 5 месяцев.
Недавние экспериментальные исследования показывают, что величина повреждения скелетных мышц под жгутной манжетой связана со сложным взаимодействием уровня давления в манжете и продолжительности приложения давления.
Это осложнение может возникнуть у пациентов, которым наложили жгут в течение длительного периода времени, а также у пациентов, когда уровень давления манжеты жгута был недостаточным, что позволяло некоторый артериальный приток при блокировании венозного оттока в течение длительного периода времени.Недостаточное давление в манжете для жгута представляет собой особый риск для пожилых пациентов, у которых часто наблюдается обширная кальцификация крупных артерий, что делает сосуды менее податливыми или несоответствующими «стандартным» неперсонализированным уровням давления в жгуте. Пациенты с ревматоидным артритом, получающие стероидное лечение, могут столкнуться с той же проблемой, при которой невозможно легко получить бескровное поле из-за вызванной стероидами кальцификации сосудов. Из-за значимости послеоперационного кровотечения пациенты с длительным временем свертывания крови также подвержены риску пост-турникетного синдрома.
Пост-турникетный синдром: профилактика
Профилактические меры при синдроме после жгута аналогичны мерам при повреждении нерва. Во время предоперационной оценки необходимо проверить физиологическое состояние пациента, в том числе:
- История приема лекарств. Анамнез пациента должен указывать на регулярный прием любого лекарства, которое влияет на время свертывания крови или способствует развитию атеросклеротического заболевания сосудов. Среди них стероиды, аспирин и противозачаточные вещества.
- История гипертонии.
- Время свертывания.
- История прошлых случаев тромбоэмболии.
- Признаки кальцификации артерий.
Попытка свести к минимуму время наложения жгута и соблюдать любые рекомендуемые ограничения по времени наложения жгута. Может потребоваться более высокий, чем обычно, уровень давления на жгут, особенно в больших конечностях, и для пациентов из группы риска особенно важно измерить давление окклюзии конечности (LOP) отдельного пациента и установить индивидуальный уровень давления на жгут на основе LOP.Обратите внимание, что больше не рекомендуется устанавливать уровни давления в жгуте на высоких « стандартных » уровнях, таких как 300-350 мм рт.ст. для бедра и 250-300 мм рт.ст. для руки и голени, и больше не рекомендуется установить уровень давления жгута на основе систолического артериального давления.
3. Интраоперационное кровотечение
Интраоперационное кровотечение: механизм
Интраоперационное кровотечение может быть вызвано:
Причины и лечение венозного застоя в ногах
Если вы испытываете внезапные частые, постоянные и невыносимые боли в ноге, вам может потребоваться незамедлительно обратиться к врачу для надлежащего обследования.Причина в том, что боли в ногах могут быть вызваны несколькими факторами. Хотя некоторые из этих причин могут быть безвредными, есть большая вероятность, что основной причиной боли могло быть серьезное заболевание.
Одной из наиболее частых причин болей в ногах после длительного сидения или стояния может быть скопление жидкости в венах ног. Это состояние известно как венозный застой, который возникает, когда клапаны, которые присутствуют в венах ваших ног, не выполняют функцию эффективного перемещения крови от ног к сердцу.Это вызывает скопление крови в ногах и ступнях, что приводит к сильной боли, а иногда и к отеку.
Люди, страдающие венозным застоем, часто описывают свою боль как сильную судорогу или жжение, ощущаемое в основном в области голени. Они часто жалуются, что боль усиливается, когда они проводят длительное время сидя или стоя. Помимо длительного пребывания на ногах, серьезное ожирение также может быть одним из основных факторов, способствующих возникновению этого недуга.
Самый эффективный способ диагностировать это состояние — это проконсультироваться с врачом, который может проверить вашу историю болезни и провести медицинский осмотр.В случае подтверждения того, что причиной боли в ноге является венозный застой, врач может начать лечение, которое обычно включает:
- Повышение уровня физической активности в течение дня
- Сохранение ног повышены на некоторое время, особенно когда болят. Лучше всего держать ноги выше уровня сердца примерно пятнадцать-двадцать минут.
- Ношение компрессионного трикотажа
- Соблюдение правильной и питательной диеты, которая включает в себя все полезные и важные продукты, и в то же время ограничивает потребление продуктов, которые могут отрицательно повлиять на состояние.
- Пить много воды, то есть не менее 12 стаканов каждый день.
- Делайте короткие и короткие перерывы в работе, чтобы встать и немного передвигаться, после частых перерывов
Для облегчения боли, вызванной этим состоянием, также может потребоваться использование определенных лекарств.
