Лечение ушибов мягких тканей | Жуков Д.В., Устикова Н.В., Прохоренко В.М.
Введение
Повреждения мягких тканей сопровождают жизнь человека. Ушиб — это закрытое механическое повреждение мягких тканей, обусловленное кратковременным воздействием повреждающего фактора, которое не сопровождается образованием ран. При ушибе всегда происходит разрыв мелких сосудов с последующим кровоизлиянием, степень выраженности которого может быть различной. Повреждения мягких тканей, вне зависимости от причины, их вызвавших, составляют основное число обращений в учреждения первичного звена здравоохранения. Ушибы возникают, как правило, при падении или ударах о твердые предметы. У детей первых лет жизни преобладают бытовые, игровые травмы, ушиб мягких тканей лица и шеи. В более старшем возрасте основными видами травм являются транспортные, спортивные, уличные травмы [1]. Повреждение поверхностных мягких тканей всегда сопровождается отеком места повреждения в результате пропитывания кожи лимфой, кровью и местным асептическим воспалением.
Травмы мягких тканей сопровождаются болью различной интенсивности. Так, при ушибах крупных нервов и их окончаний боль всегда резкая, простреливающая. При ушибах туловища и конечностей (плечо, бедро) могут формироваться напряженные гематомы, с распирающими болями, иногда с поверхностным онемением.
Лечение ушибов мягких тканей традиционно направлено на устранение вышеперечисленных симптомов и исключение более тяжелой патологии [4].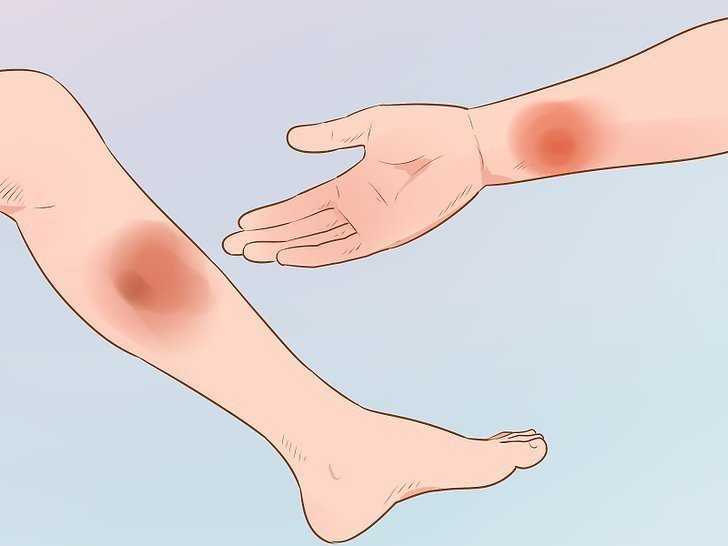 В настоящее время существуют стандарты лечения — клинические рекомендации по оказанию скорой медицинской помощи при повреждениях мягких тканей, где особое место отводится вопросам иммобилизации, туалету раны и обезболиванию [5]. Введение опиоидных и неопиоидных анальгетиков рекомендовано проводить в сочетании с антигистаминными препаратами (метамизолом натрия, тримеперидином, дифенгидрамином). Необходимо как можно раньше выполнить иммобилизацию. Даже при легких повреждениях лучше наложить на ушибленное место тугую повязку или выполнить иммобилизацию ортезом. Это обеспечит покой ушибленного сегмента, нормализует микроциркуляцию, уменьшит двигательную активность. Некоторые ортезные изделия обладают эффектом микромассажа, что тоже благотворно влияет на репаративные процессы. Вместе с этим проводится анальгезирующая терапия. Эти мероприятия необходимо выполнять в течение первых 3 сут. Затем возможно применение согревающих процедур, физиотерапевтических мероприятий. Местную терапию мазями и гелями возможно применять с 1-х суток, если они не обладают согревающим эффектом и не увеличивают проницаемость сосудов.
В настоящее время существуют стандарты лечения — клинические рекомендации по оказанию скорой медицинской помощи при повреждениях мягких тканей, где особое место отводится вопросам иммобилизации, туалету раны и обезболиванию [5]. Введение опиоидных и неопиоидных анальгетиков рекомендовано проводить в сочетании с антигистаминными препаратами (метамизолом натрия, тримеперидином, дифенгидрамином). Необходимо как можно раньше выполнить иммобилизацию. Даже при легких повреждениях лучше наложить на ушибленное место тугую повязку или выполнить иммобилизацию ортезом. Это обеспечит покой ушибленного сегмента, нормализует микроциркуляцию, уменьшит двигательную активность. Некоторые ортезные изделия обладают эффектом микромассажа, что тоже благотворно влияет на репаративные процессы. Вместе с этим проводится анальгезирующая терапия. Эти мероприятия необходимо выполнять в течение первых 3 сут. Затем возможно применение согревающих процедур, физиотерапевтических мероприятий. Местную терапию мазями и гелями возможно применять с 1-х суток, если они не обладают согревающим эффектом и не увеличивают проницаемость сосудов.
Ушиб мягких тканей, а соответственно, и боль неотъемлемо связаны между собой. Боль — это своеобразное психофизиологическое состояние человека, возникающее в результате воздействия сверхсильных или разрушительных раздражителей и вызывающих функциональные или органические нарушения в организме. Причем боль носит субъективный характер, ее восприятие основано на личном опыте, связанном с повреждением в раннем периоде жизни. Ее перцепция определяется не только источником боли, но и такими, на первый взгляд, неочевидными факторами, как психофизическая и эмоциональная характеристика индивидуума, его культурный уровень, семейное обучение и многие другие. Наиболее часто она характеризуется как психофизическое состояние человека, являющееся характерной реакцией на различные органические и функциональные нарушения, вызванные действием разнообразных раздражителей. Боль одновременно является физическим ощущением и эмоциональной реакцией на него. Эксперт по вопросам боли Марго Мак Кеффри дает свое емкое определение — это «все, что, по словам пациента, ранит его».
Функционирование ноцицептивной системы опосредовано нейрохимическими механизмами, реализуемыми эндогенными пептидами и медиаторами, среди которых гистамин, субстанция Р, кинины, простагландины, лейкотриены, ионы калия и водорода [4–6]. При боли активируются процессы гиперкоагуляции, пероксидного окисления липидов, увеличивается содержание протеолитических ферментов, что вызывает деструкцию тканей. Боль способствует развитию тканевой гипоксии, дистрофических процессов и нарушению микроциркуляции в тканях. Это, в свою очередь, усиливает альтерацию травмированных тканей [7].
Таким образом, боль является сложным психофизиологическим феноменом, который как с этической стороны, так и с позиции нормативно-правового регулирования требует лечения, направленного на облегчение боли [8]. Понимание сложности ее природы, механизмов развития и регулирования позволяет дифференцированно подходить к вопросу выбора анальгетической терапии.
К одним из наиболее эффективных средств защиты периферических ноцицепторов, не вызывающих депрессию витальных функций, относят нестероидные противовоспалительные препараты (НПВП). Современная концепция эффективного обезболивания ушибов и других видов травм предполагает мультимодальный подход — воздействие на различные звенья проведения болевой импульсации. В связи с этим целесообразно сочетать введение НПВП с опиатами или опиоидами при сильном болевом синдроме, например при шокогенных травматических повреждениях.
Современная концепция эффективного обезболивания ушибов и других видов травм предполагает мультимодальный подход — воздействие на различные звенья проведения болевой импульсации. В связи с этим целесообразно сочетать введение НПВП с опиатами или опиоидами при сильном болевом синдроме, например при шокогенных травматических повреждениях.
Нестероидные противовоспалительные препараты являются препаратами выбора при лечении легкой и умеренной боли. В основе их противовоспалительного действия лежит ингибирование циклооксигеназы (ЦОГ). Одним из представителей НПВП является кетопрофен, выпускаемый в различных формах (таблетированной, инъекционной, наружной). Тройной эффект — противовоспалительный, анальгезирующий и жаропонижающий — обусловлен блокированием ферментов ЦОГ-1 и ЦОГ-2 и, частично, липоксигеназы, что приводит к подавлению синтеза простагландинов (в т. ч. в ЦНС, вероятнее всего, в гипоталамусе) и тромбоксанов. Кетопрофен стабилизирует
 Не оказывает отрицательного влияния на состояние суставного хряща [9].
Не оказывает отрицательного влияния на состояние суставного хряща [9].
С точки зрения соотношения противовоспалительной и анальгетической активности кетопрофен представляется оптимальной молекулой. Так, согласно данным экспериментального исследования с использованием модели зубной боли, кетопрофен обладает наиболее выраженным противовоспалительным эффектом по сравнению с многими НПВП, при этом показатель клинической эффективности (суммарное снижение боли через 4 ч) наибольший для кетопрофена [10]. Важно отметить, что эти экспериментальные данные были подтверждены данными метаанализа 13 РКИ: в отношении купирования умеренной и тяжелой боли кетопрофен существенно превосходит диклофенак и ибупрофен [11].
Несмотря на то, что кетопрофен является «традиционным» неселективным НПВП, он в меньшей степени способен вызывать НПВП-ассоциированные осложнения со стороны желудочно-кишечного тракта и сердечно-сосудистой системы — данные финского популяционного исследования по оценке причин развития 9191 события в верхних отделах ЖКТ (в т.

Цель исследования: определить эффективность анальгетической терапии при ушибах верхних и нижних конечностей.
Материал и методыПроведено пилотное проспективное сравнительное исследование, в которое включено 54 пациента с ушибом мягких тканей плеча (n=27) и бедра (n=27). Ушибы у всех пациентов характеризовались образованием подкожного или внутрикожного кровоизлияния, отеком мягких тканей без повреждения мышц. Критерии включения: возраст 25–50 лет, компенсированная коморбидная патология. Критерии невключения: декомпенсированная или требующая постоянной медикаментозной поддержки сопутствующая патология; тяжелые повреждения мягких тканей; давность повреждения более 1 сут; самостоятельный прием анальгезирующих и других медикаментозных средств с целью обезболивания до первичного посещения. Все пациенты подписывали информированное согласие на участие в исследовании.
При первичном осмотре всем больным выполнено УЗИ места повреждения для исключения более тяжелой патологии. Оценку отека мягких тканей определяли на каждом посещении по объему окружности поврежденного сегмента конечности, измеряя в верхней, средней и нижней трети, и сравнивали с неповрежденной конечностью. Восстановление функции оценивали по возможности выполнения пациентом сгибания в локтевом и плечевом суставе и приседания не менее 10 раз, а также удержания груза 2,5 кг более 2 мин в вытянутой руке.
Оценку отека мягких тканей определяли на каждом посещении по объему окружности поврежденного сегмента конечности, измеряя в верхней, средней и нижней трети, и сравнивали с неповрежденной конечностью. Восстановление функции оценивали по возможности выполнения пациентом сгибания в локтевом и плечевом суставе и приседания не менее 10 раз, а также удержания груза 2,5 кг более 2 мин в вытянутой руке.
В зависимости от получаемой формы препаратов пациенты были разделены на 8 групп. 1-я группа (n=6) — пациенты с повреждением верхней конечности, получавшие таблетки кетопрофена (Кетонал®) в дозировке 100 мг 1 р/сут; 2-я группа — пациенты с повреждением верхней конечности (n=6), получавшие таблетки диклофенака в суточной дозировке 100 мг; 3-я группа (n=7) — пациенты с повреждением нижней конечности, получавшие таблетки кетопрофена в дозировке 100 мг 1 р/сут; 4-я группа (n=7) — пациенты с повреждением нижней конечности, получавшие таблетки диклофенака в дозировке 100 мг; 5-я группа (n=7) — пациенты с повреждениями верхней конечности, в курации которых использовали инъекционную форму кетопрофена в суточной дозировке 100 мг; 6-я группа (n=7) — пациенты с повреждениями верхней конечности, в лечении которых использовали инъекционную форму диклофенака 100 мг; 7-я группа (n=7) — пациенты с повреждениями нижней конечности, получавшие кетопрофен в инъекциях в дозе 100 мг; 8-я группа (n=7) — пациенты с повреждениями нижней конечности и применением инъекционной формы диклофенака.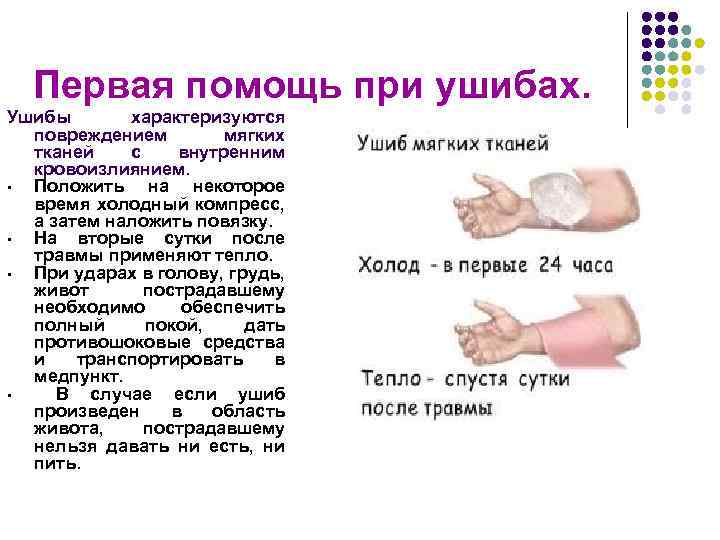
У всех пациентов помимо анальгезирующей терапии в 1-е сутки проводили иммобилизацию тугой повязкой места повреждения и применяли охлаждающие процедуры. При повторном визите (на 2-е сутки и далее ежедневно) оценивали интенсивность боли по ВАШ, выраженность отека. Лечение и наблюдение за пациентами прекращали при достижении стойкого анальгезирующего эффекта (по ВАШ), отсутствии нарастания отека мягких тканей, восстановлении функции конечности.
Результаты и обсуждениеСредний возраст пациентов составил 44,7 года. Соотношение мужчин и женщин было 1:1.
Как видно на рисунке 1, при ушибах верхней конечности кетопрофен в таблетках начинал проявлять свою активность уже на 10-й минуте, при ушибах нижней конечности — несколько позже, на 20-й минуте. Применение инъекционной формы (рис. 2) обеспечивало выраженный обезболивающий эффект уже на 5-й минуте. Как таблетированная, так и инъекционная форма кетопрофена продемонстрировали преимущество перед диклофенаком. К 3–4-м суткам во всех случаях удавалось добиться полного купирования боли. Продолжительность анальгезирующего действия препаратов не изучали ввиду большой психоэмоциональной составляющей и малой выборки пациентов. Особенностью оценки болевого синдрома при первичном обращении явилось то, что пациенты с ушибом плеча оценивали боли на 2–3 балла выше, чем пациенты с ушибом бедра (6–8 баллов).
К 3–4-м суткам во всех случаях удавалось добиться полного купирования боли. Продолжительность анальгезирующего действия препаратов не изучали ввиду большой психоэмоциональной составляющей и малой выборки пациентов. Особенностью оценки болевого синдрома при первичном обращении явилось то, что пациенты с ушибом плеча оценивали боли на 2–3 балла выше, чем пациенты с ушибом бедра (6–8 баллов).
Хотелось бы отметить, что, несмотря на эффективность инъекционной формы препарата, формой выбора для пациентов с повреждением руки, согласно опросу, оставалась таблетированная форма. У пациентов с повреждениями ноги предпочтительной оказалась инъекционная форма. Здесь приходится констатировать парадокс: при более выраженном болевом синдроме при ушибе верхней конечности более эффективная инъекционная форма используется значительно реже, чем у пациентов с повреждением нижней конечности.
Заключение
Таким образом, данное пилотное исследование подтвердило эффективность и быстрое начало анальгетического эффекта кетопрофена в лечении ушибов мягких тканей. Использование препарата позволяет полностью купировать болевой синдром в течение 3 сут. Полученные в рамках небольшой выборки данные дают основания расширить группу наблюдения для увеличения мощности исследования, сформировав клинические группы в зависимости от вида, степени повреждения и локализации травмы.
Использование препарата позволяет полностью купировать болевой синдром в течение 3 сут. Полученные в рамках небольшой выборки данные дают основания расширить группу наблюдения для увеличения мощности исследования, сформировав клинические группы в зависимости от вида, степени повреждения и локализации травмы.
Сведения об авторах:
Жуков Дмитрий Викторович — к.м.н., доцент кафедры травматологии и ортопедии ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; ORCID iD 0000-0002-4334-217X.
Устикова Нина Васильевна — врач-ревматолог ФГБУ «ННИТО им. Я.Л. Цивьяна» Минздрава России; 630091, Россия, г. Новосибирcк, ул. Фрунзе, д. 17.
Прохоренко Валерий Михайлович — д.м.н., профессор, заведующий кафедрой травматологии и ортопедии ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; ведущий научный сотрудник ФГБУ «ННИТО им. Я.Л. Цивьяна» Минздрава России; 630091, Россия, г. Новосибирcк, ул. Фрунзе, д. 17.
Новосибирcк, ул. Фрунзе, д. 17.
Контактная информация: Жуков Дмитрий Викторович, e-mail: [email protected]. Источник финансирования: публикация осуществлена при поддержке АО «Сандоз». Конфликт интересов: авторы получили вознаграждение за написание статьи. Никто из авторов не имеет финансовой заинтересованности в представленных материалах, методах и результатах. Статья поступила 22.03.2021, поступила после рецензирования 14.04.2021, принята в печать 28.04.2021.
About the authors:
Dmitry V. Zhukov — Cand. of Sci. (Med.), Associate Professor of the Department of Traumatology and Orthopedics, Novosibirsk State Medical University; 52, Krasnyi prospect, Novosibirsk, 630091, Russian Federation; ORCID iD 0000-0002-4334-217X.
Nina V. Ustikova — rheumatologist, Novosibirsk Research Institute of Traumatology and Orthopedics named after Ya.L. Tsivyan; 17, Frunze str., Novosibirsk, 630091, Russian Federation.
Valery M. Prokhorenko — Dr. of Sci. (Med.), Professor, Head of the Department of Traumatology and Orthopedics, Novosibirsk State Medical University; 52, Krasnyi prospect, Novosibirsk, 630091, Russian Federation; leading researcher of the Novosibirsk Research Institute of Traumatology and Orthopedics named after Ya.L. Tsivyan; 17, Frunze str., Novosibirsk, 630091, Russian Federation.
Contact information: Dmitry V. Zhukov, e-mail: [email protected]. Financial Disclosure: this article was published with the support of JSC Sandoz. Conflict of interests: authors received a reward for preparing a paper. No authors have a financial or property interest in any material, method or results mentioned. Received 22.03.2021, revised 14.04.2021, accepted 28.04.2021.
Лечение ушибов в Петрозаводске
- Предлагаем современную диагностику (рентген, УЗИ)
- Снимаем боль и воспаление
- Используем современные перевязочные материалы
- Назначаем эффективное восстановительное лечение
Ушиб – это закрытое (без нарушения целостности кожных покровов) повреждение мягких тканей. Это один из самых распространенных видов травм, с которым сталкивался каждый из нас.
Это один из самых распространенных видов травм, с которым сталкивался каждый из нас.
Обычно, при ушибах мягких тканей не требуется лечения и проходят самостоятельно, однако в ряде случаев требуется безотлагательная медицинская помощь (например, при ушибе головы). Кроме того, ушиб может сопровождать другие травмы (например, перелом), и может проявляться внутренними кровотечениями, и, к примеру, формирование гематом.
Симптомы ушиба
Итак, как определить, что у травмированного не перелом или рана, а обычный ушиб?
- при ушибе человек ощущает боль, появляется отек, а через некоторое время (зависит от силы удара) возникает кровоподтек.
- у детей и людей молодого и среднего возраста по кровоподтеку можно судить о силе и размере ушиба, а вот у пожилого человека это определить труднее, поскольку процессы в подкожном слое происходят немного по-другому
- если в результате ушиба в течение длительного времени сохраняется боль, необходимо срочно обратиться к врачу!
- при ушибе грудной клетки нарушается дыхание.

- ушиб живота может привести к разрыву печени, селезенки, кишечника, внутреннему кровотечению.
- ушиб головы вызывает черепно-мозговую травму
Лечение
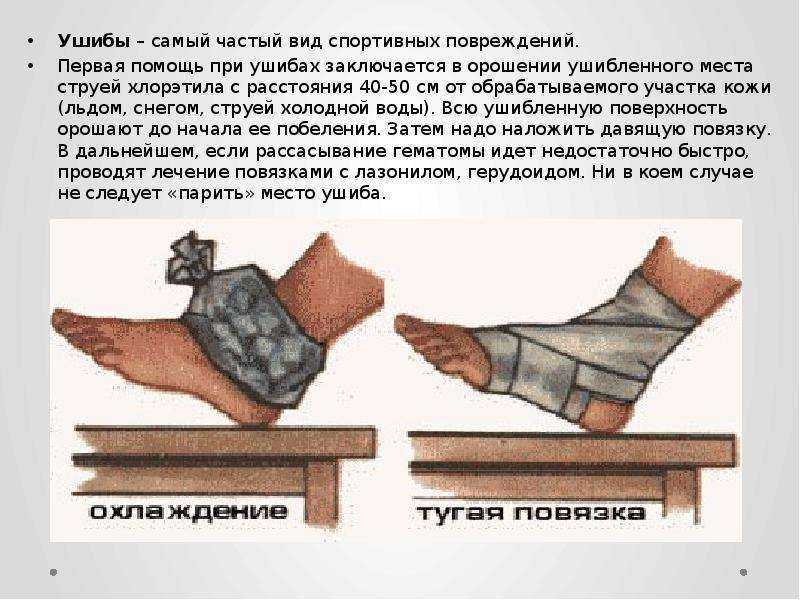
От давности ушиба зависит и способ его лечения. Первая помощь при ушибе – тщательный осмотр поврежденного места (например, сгибание-разгибание в случае повреждения конечности). Затем к месту ушиба прикладывают холод (это останавливает кровотечение и уменьшает боль).
Не рекомендуется принимать обезболивающие лекарства, чтобы в случае осложнений не упустить момент ухудшения состояния пациента. Если же пациента осмотрен врач и исключил повреждение внутренних органов, то можно применять обезболивающие препараты.
Холод эффективен лишь в течение первых часов с момента травмы. Тепло же рекомендуется лишь спустя двое суток после ушиба. Теплый компресс и физиолечение способствуют рассасыванию гематом, уменьшают боль.
Программа лечения данного заболевания в «Костной клинике» может включать в себя:
Магниторезонансная терапия
Подробнее
Криотерапия
Подробнее
Тераквантовая терапия
Подробнее
Инфракрасный прогрев
Подробнее
Электротерапия
Подробнее
Эхотермотерапия
Подробнее
Посмотреть все методикиПричины, лечение, когда обращаться за помощью
Кровоподтеки (экхимозы) возникают, когда мелкие кровеносные сосуды (капилляры) лопаются под кожей. Это может вызвать кровотечение в ткани кожи. Вы увидите изменение цвета из-за кровотечения под кожей, которое представляет собой синяк.
Это может вызвать кровотечение в ткани кожи. Вы увидите изменение цвета из-за кровотечения под кожей, которое представляет собой синяк.
У большинства из нас время от времени появляются синяки от ударов о предметы. В случаях сильного удара или травмы синяки часто неизбежны и более обширны. Тем не менее, случайный синяк или синяк в результате несчастного случая, как правило, не является причиной для беспокойства.
Однако, если у вас легко появляются синяки, у вас есть необъяснимые синяки или кровоподтеки сопровождаются кровотечением в другом месте, это может быть признаком состояния, требующего медицинской помощи.
В этой статье мы подробно рассмотрим, что может вызвать легкое появление синяков и когда важно обратиться к врачу.
Когда вы натыкаетесь на предмет, ваше тело обычно реагирует образованием сгустков крови, чтобы остановить кровотечение, что предотвращает образование синяков. Но иногда ваша кровь не может образовывать сгустки должным образом. Когда это происходит, вы можете заметить, что у вас легко появляются синяки.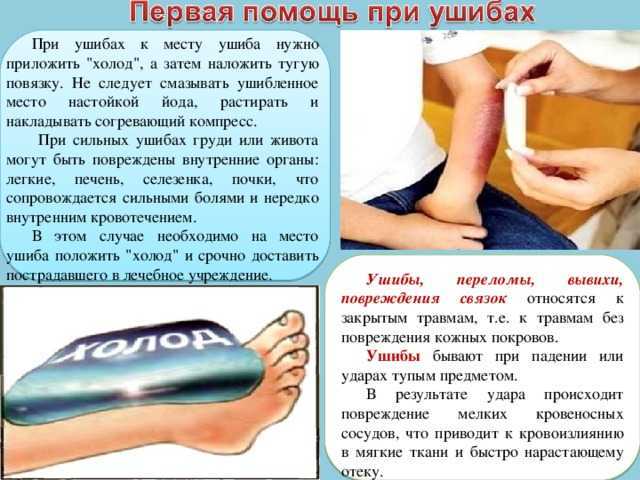
Синяки чаще встречаются у пожилых людей. Это потому, что ваша кожа имеет тенденцию становиться тоньше с возрастом. Кроме того, когда вы становитесь старше, вы, как правило, теряете часть жирового слоя кожи, который помогает защитить ваши кровеносные сосуды от повреждений.
Если вам кажется, что у вас легко появляются синяки, это также может быть связано с приемом лекарств, заболеванием или даже дефицитом витаминов. Эти причины более подробно описаны ниже.
Лекарства
Некоторые виды лекарств могут влиять на способность вашего организма образовывать тромбы, что может увеличить риск легкого образования синяков. Лекарства, которые, как известно, снижают способность вашей крови к свертыванию, включают следующее:
- Разбавители крови. Эти препараты часто используются для профилактики сердечных приступов и инсультов. Ваш лечащий врач может также назначить эти лекарства, если у вас есть фибрилляция предсердий, тромбоз глубоких вен, легочная эмболия или недавняя установка сердечного стента.
 Примеры этих препаратов включают:
Примеры этих препаратов включают:- варфарин (кумадин)
- клопидогрель (плавикс)
- ривароксабан (ксарелто)
- апиксабан (эликвис)
- нестероидные противовоспалительные препараты (НПВП). Эти лекарства обычно используются в качестве болеутоляющих средств. В отличие от других болеутоляющих средств, таких как ацетаминофен (тайленол), НПВП также уменьшают опухоль, вызванную воспалением. При длительном применении эти препараты могут усилить кровотечение. Общие НПВП включают:
- аспирин
- ибупрофен (адвил, мотрин)
- напроксен (алив)
- целекоксиб (целебрекс)
- стероиды. Некоторые виды стероидных препаратов могут вызвать более легкое появление синяков. Это особенно касается местных кортикостероидов, так как они могут истончить кожу. Топические стероиды часто используются при лечении экземы и других кожных высыпаний. Пероральные формы могут использоваться при астме, аллергии и тяжелых простудных заболеваниях.

- Некоторые травы и добавки. Считается, что некоторые травы и добавки влияют на способность вашего организма к свертыванию крови и могут привести к легкому образованию синяков, хотя данные о таких побочных эффектах в литературе ограничены. Некоторые примеры включают:
- рыбий жир
- чеснок
- пальметто
- гинкго
- женьшень
- зверобой
Вместо этого поговорите со своим врачом по этому вопросу.
Кроме того, всегда проверяйте, знает ли ваш врач или медицинский работник о каких-либо травах или добавках, которые вы принимаете, поскольку это может повлиять на способность вашей крови сворачиваться, особенно если ваш врач прописывает вам препараты, разжижающие кровь, или стероидные препараты.
Заболевания
Если у вас легко появляются синяки, неспособность образовывать сгустки крови может быть результатом основного заболевания. Образование тромбов зависит от хорошего питания, здоровой печени и здорового костного мозга.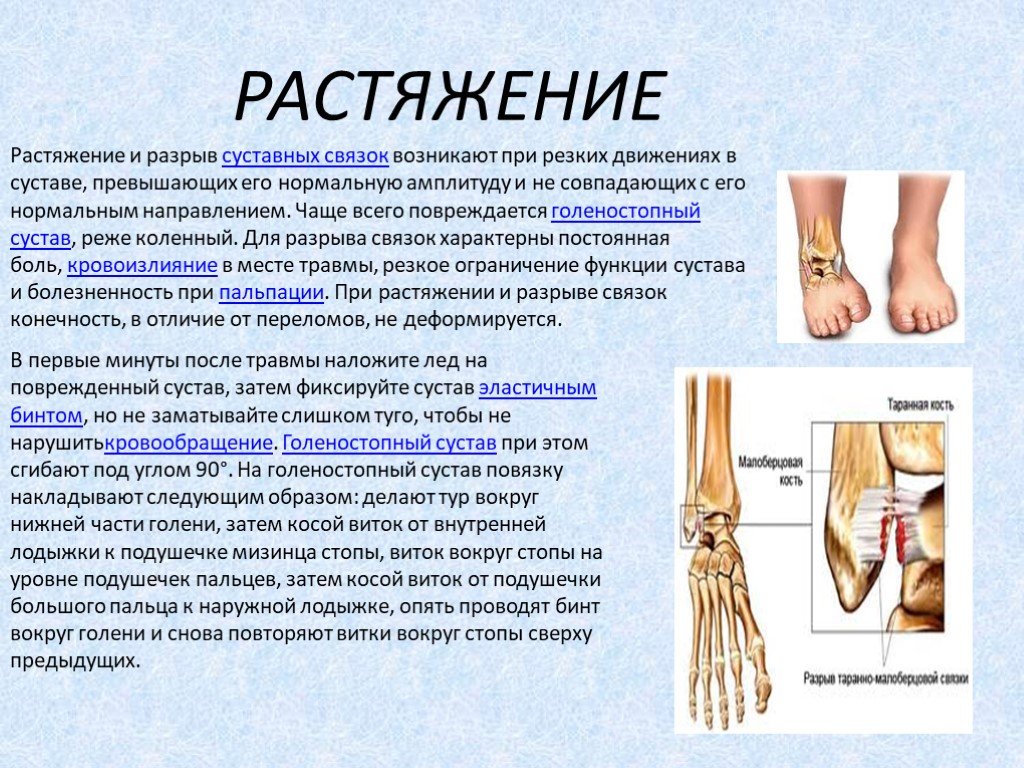 Если какой-либо из этих факторов немного отличается, синяки могут возникнуть легче.
Если какой-либо из этих факторов немного отличается, синяки могут возникнуть легче.
Некоторые медицинские состояния, которые могут вызвать легкое образование синяков, включают:
- Гемофилия A. Это состояние, также известное как классическая гемофилия или фактор VIII, обычно передается по наследству. Это вызвано отсутствием или дефектом белка свертывания крови, называемого фактором VIII. При гемофилии А вашей крови требуется много времени, чтобы сформировать сгустки, что может привести к синякам. Это редкое состояние может быть серьезным. Это не лечится, но лечится.
- Гемофилия B. При гемофилии B, также известной как «болезнь Кристмаса», ваше тело вырабатывает мало или совсем не вырабатывает фактор IX, другой тип белка, который помогает вашей крови сворачиваться. Это может привести к длительному или спонтанному кровотечению, что может привести к образованию синяков под кожей.
- Болезнь Виллебранда. Болезнь фон Виллебранда вызывается генетической мутацией, которая приводит к дефициту белка, известного как фактор фон Виллебранда (ФВ).
 Это тип белка, который помогает вашей крови свертываться.
Это тип белка, который помогает вашей крови свертываться. - Низкий уровень тромбоцитов. Тромбоциты — это тип клеток крови, которые слипаются вместе, образуя сгустки, чтобы остановить кровотечение. Когда у вас недостаточно тромбоцитов в крови, это может вызвать сильное кровотечение. Воздействие химиотерапии, радиации или токсичных химических веществ может повлиять на количество тромбоцитов. Некоторые заболевания также могут влиять на количество тромбоцитов, например:
- лейкемия
- цирроз печени
- апластическая анемия
- миелодисплазия
- Синдром Кушинга. Синдром Кушинга, также известный как гиперкортицизм, представляет собой состояние, при котором в организме наблюдается аномально высокий уровень гормона кортизола. Одним из возможных симптомов является легкое появление синяков на коже.
- Синдром Элерса-Данлоса (СЭД). Этот синдром охватывает группу наследственных заболеваний, поражающих соединительную ткань, особенно кожу, стенки кровеносных сосудов и суставы.
 Поскольку кожа, кровеносные сосуды и соединительная ткань вокруг кровеносных сосудов очень хрупкие, могут легко возникнуть синяки.
Поскольку кожа, кровеносные сосуды и соединительная ткань вокруг кровеносных сосудов очень хрупкие, могут легко возникнуть синяки. - Дефицит витаминов. Дефицит витаминов, которые способствуют свертыванию крови, таких как витамин К и витамин С, также может способствовать легкому образованию синяков. Недоедание может увеличить вероятность дефицита основных витаминов и питательных веществ. Ваш поставщик медицинских услуг может назначить анализ крови, чтобы проверить наличие дефицита витаминов, и может порекомендовать витаминные добавки в зависимости от результатов.
Случайные синяки не вызывают беспокойства, но легкие синяки могут вызывать беспокойство. Если вы заметили более частые кровоподтеки, важно поговорить с вашим лечащим врачом, чтобы он мог работать с вами, чтобы определить причину.
Помимо физического осмотра на наличие синяков, ваш лечащий врач, скорее всего, задаст вам вопросы о вашей семейной истории болезни.
Они также могут назначить анализы крови для измерения уровня тромбоцитов и времени, необходимого для свертывания крови. Это может помочь определить, как ваше тело реагирует на незначительные травмы, при которых лопаются капилляры и образуются синяки.
Это может помочь определить, как ваше тело реагирует на незначительные травмы, при которых лопаются капилляры и образуются синяки.
Дети часто более склонны к синякам, чем средний взрослый. Обычно это происходит из-за того, что вы ведете активный образ жизни, занимаетесь спортом или быстро двигаетесь.
Как и у взрослых, если у ребенка появляются синяки чаще, чем обычно, это может быть связано с приемом определенных лекарств или сопутствующими заболеваниями.
Позвоните в медицинский профессионал вашего ребенка, если ваш ребенок испытывает частые, необъяснимые синяки, а также:
- Drashes
- . Увеличенная живот
- лихорадка
- Пот и/или охлаждение
- Bone Dail случаях синяки проходят сами по себе без ухода. Через несколько дней ваше тело, как правило, реабсорбирует кровь, которая первоначально вызвала обесцвечивание. Тем не менее, есть шаги, которые вы можете предпринять, чтобы помочь синяку зажить.
- Холодный компресс.
 При отечности и боли в сочетании с кровоподтеками в первую очередь следует наложить холодный компресс. Не забудьте поставить барьер (например, ткань или тонкое полотенце) между холодным предметом и голой кожей. Положите компресс на кожу на 20 минут за один раз.
При отечности и боли в сочетании с кровоподтеками в первую очередь следует наложить холодный компресс. Не забудьте поставить барьер (например, ткань или тонкое полотенце) между холодным предметом и голой кожей. Положите компресс на кожу на 20 минут за один раз. - Высота над уровнем моря. Если поражена рука или нога, приподнимите конечность и прикладывайте холодный компресс на 15–20 минут за раз или до тех пор, пока опухоль не уменьшится.
- Лекарства, отпускаемые без рецепта. Вы можете принять ацетаминофен (тайленол) для снятия боли.
Несмотря на то, что определенные состояния и лекарства могут способствовать более легкому образованию синяков, вы все же можете предотвратить появление синяков. Один из способов — проявлять особую осторожность с возрастом. Кожа у пожилых людей, как правило, тоньше, что может увеличить риск появления синяков.
Вы также можете предотвратить появление синяков, выполнив следующие действия:
- Поговорите со своим лечащим врачом о любых лекарствах, которые могут вызывать кровотечение и синяки.
 Они могут работать с вами, чтобы изменить ваш план лечения. Никогда не прекращайте принимать какие-либо лекарства самостоятельно. Некоторые лекарства могут потребовать постепенного снижения дозы и тщательного наблюдения.
Они могут работать с вами, чтобы изменить ваш план лечения. Никогда не прекращайте принимать какие-либо лекарства самостоятельно. Некоторые лекарства могут потребовать постепенного снижения дозы и тщательного наблюдения. - Получение правильных питательных веществ также может помочь защитить от легких синяков. Старайтесь есть продукты, содержащие витамин С и витамин К, или подумайте о приеме пищевых добавок.
- Следи, куда идешь. Старайтесь не смотреть в телефон и не отвлекаться во время ходьбы.
- Используйте поручни, когда поднимаетесь или спускаетесь по лестнице.
- Проверьте свое зрение, чтобы убедиться, что вы видите достаточно четко, чтобы избежать препятствий, которые могут вас травмировать.
- Устраните бытовые опасности, о которые можно споткнуться или на которые можно наткнуться. Избавьтесь от беспорядка и проводов, из-за которых вы можете споткнуться или упасть.
- Улучшите чувство равновесия, выполняя упражнения на равновесие.

- Надевайте защитное снаряжение во время тренировки.
Позвоните своему врачу, если у вас появляются синяки чаще, чем обычно, и если кровоподтеки сопровождаются кровотечением из других мест. Это может указывать на серьезное состояние, которое требует немедленного внимания.
Также важно знать, что необъяснимые кровоподтеки могут быть признаком домашнего насилия или нападения. Медицинские работники по закону обязаны задавать вам вопросы, чтобы убедиться, что вы в безопасности в своей домашней ситуации.
Если вам нужна помощь в связи с насилием в семье или сексуальным насилием, обратитесь к медицинскому работнику или получите доступ к ресурсам и помощи в нашем справочнике ресурсов по вопросам насилия в семье.
Синяк возникает, когда капилляры лопаются под кожей, вызывая кровотечение в ткани кожи. В результате обесцвечивания от кровотечения синяк.
Синяки обычно не вызывают беспокойства. Но если вы заметили, что у вас появляются синяки чаще, чем обычно, или синяки стали больше и сопровождаются другими симптомами, лучше обратиться к врачу.

Увеличение кровоподтеков может быть побочным эффектом некоторых лекарств, особенно препаратов, разжижающих кровь, НПВП и стероидов. Это также может быть связано с основным состоянием здоровья или дефицитом витаминов.
Если вы считаете, что усиление синяков связано с приемом лекарств, не прекращайте прием лекарств и не изменяйте их дозировку. Вместо этого обсудите свои проблемы с врачом, чтобы найти план лечения, который лучше всего подходит для вас.
Причины, проблемы, лечение и прочее
Ушиб или ушиб — это повреждение кожи или тканей непосредственно под кожей. У всех иногда бывают синяки. Обычно причин для беспокойства нет.
Продолжайте читать, чтобы узнать больше о том, что вызывает кровоподтеки, о процессе заживления с цветовой кодировкой и о признаках, предупреждающих о необходимости обратиться к врачу.
Вы получаете синяк, когда разрывается небольшой кровеносный сосуд прямо под поверхностью кожи. Кожа не повреждена, поэтому кровь просачивается в ткани.
 Затем тромбоциты крови образуют сгусток, чтобы закрыть утечку.
Затем тромбоциты крови образуют сгусток, чтобы закрыть утечку.Вот различные виды синяков:
- Экхимоз — плоский синяк.
- Гематома — приподнятый синяк с припухлостью.
- Петехии — это крошечные фиолетовые или красные пятна, которые выглядят как кровоподтеки, если их сгруппировать вместе.
- Пурпура возникает без травм, вероятно, из-за нарушения свертываемости крови.
Повседневные вещи, вызывающие синяки, включают:
- падение
- удар обо что-то
- падение чего-либо на руку или ногу
- растяжение мышц, растяжение связок или перелом кости
кожи и меньше жира под кожей. Это может сделать вас синяк более легко.
Некоторые лекарства также могут облегчить образование синяков, например:
- антибиотики
- антиагреганты
- аспирин (Bayer, Bufferin)
- антикоагулянты
- местные и системные кортикостероиды
Некоторые состояния, которые могут привести к образованию синяков:
- дефицит витаминов B-12, C, K или фолиевой кислоты
- гемофилия
- лейкемия
- болезнь печени
- сепсис или другие инфекции
- тромбоцитопения
- васкулит
- болезнь фон Виллебранда
Синяк полностью исчезает через несколько недель.
 Цветовой переход выглядит примерно так:
Цветовой переход выглядит примерно так:- Красный. Сразу после травмы вы, вероятно, заметите красную отметину, которая становится более заметной, когда начинает течь кровь.
- Черный, синий или фиолетовый. Примерно через 24 часа синяк становится черным, синим или темно-фиолетовым по мере того, как в этой области скапливается больше крови.
- Желтый или зеленый. В течение 2-3 дней ваше тело начинает реабсорбировать кровь. Там большая концентрация желтого или зеленого.
- Светло-коричневый. К 10-14 дню синяк становится светло-коричневым, а затем полностью исчезает.
Синяк может рассосаться в центре до внешних краев. Процесс окрашивания и заживления варьируется от человека к человеку. Если у вас более темная кожа, у вас также могут быть более темные синяки.
Если нет признаков улучшения через 2 недели, это может быть признаком основного состояния здоровья.
 Расположение синяка, а также другие симптомы могут дать вашему врачу диагностические подсказки.
Расположение синяка, а также другие симптомы могут дать вашему врачу диагностические подсказки.Синяк меняет цвет и сжимается по мере заживления. Если этого не произойдет в течение 2 недель, возможно, что-то еще происходит.
Частые кровоподтеки
Легкие или частые кровоподтеки могут быть результатом низких или аномальных тромбоцитов или проблем со свертываемостью крови. Это может быть связано с основным заболеванием.
Это также может быть побочным эффектом лекарств. Например, антикоагулянты, антиагреганты и аспирин препятствуют свертыванию крови. Кортикостероиды могут истончить кожу. Даже пищевые добавки, такие как гинкго, могут разжижать кровь.
Если вы подозреваете, что причиной является прописанное лекарство, не прекращайте его прием. Вместо этого спросите своего врача, есть ли альтернативное лекарство.
Ваш врач может также назначить анализы крови для проверки уровня тромбоцитов или измерения времени свертывания крови.
Не заживающий синяк на ноге
Если у вас незаживающие петехии или кровоподтеки на ногах или икрах, это может быть связано с нехваткой тромбоцитов.
 Некоторые условия, которые могут вызвать это:
Некоторые условия, которые могут вызвать это:- беременность
- Определенные типы анемии
- Увеличенная селезенка
- Употребление алкоголя
- бактерии в крови
- Гемолитический уремический синдром
- Гепатит CI, ВИЧ, или другие вирусы
- 121121121121121121121112112912912 гг. Лекарства также могут влиять на количество тромбоцитов, например:
- противосудорожные препараты
- химиотерапевтические препараты
- гепарин
- хинин
- сульфаниламидные антибиотики 9
- перелом грудины заживление синяков может занять до 6 недель. Вы также можете испытывать некоторую боль и дискомфорт.
Всегда обращайтесь к врачу после травмы грудной клетки. Осложнения могут включать инфекцию и затрудненное дыхание.
Это рак?
Частые кровоподтеки или кровоподтеки, которые не заживают, могут быть признаком лейкемии. Другие симптомы лейкемии включают:
- усталость
- бледность кожи
- частые кровотечения
Воспалительный рак молочной железы может выглядеть как синяк на груди.
 Ваша грудь также может быть нежной и теплой. Воспалительный рак молочной железы может не включать уплотнения, как другие виды рака молочной железы.
Ваша грудь также может быть нежной и теплой. Воспалительный рак молочной железы может не включать уплотнения, как другие виды рака молочной железы.Если у вас есть признаки и симптомы лейкемии или воспалительного рака молочной железы, немедленно обратитесь к врачу.
У вас также могут появиться синяки и кровотечения во время лечения рака из-за:
- антибиотики
- химиотерапевтические препараты
- плохое питание
- облучение кроветворных костей
Вам, вероятно, не нужно обращаться к врачу при ежедневном ушибе. Конечно, немедленно обратитесь за медицинской помощью, если есть вероятность, что вы сломали кость. Рентген может подтвердить или исключить это.
Также обратитесь к врачу при следующих симптомах:
- болезненный отек вокруг синяка
- непрекращающаяся боль через 3 дня после незначительной травмы
- склонность к образованию синяков без видимой причины
- значительное кровотечение в анамнезе
- аномальное кровотечение из десен или носа
- утомляемость, бледность кожи, потеря аппетита или необъяснимая потеря веса история болезни, а также список принимаемых лекарств и БАДов.

Анализы крови позволяют проверить уровень тромбоцитов и измерить время свертывания крови. В зависимости от ваших симптомов вам также может потребоваться рентген или другие тесты визуализации, чтобы проверить наличие переломов костей. Первоначальные тесты плюс физический осмотр сообщат о следующих шагах.
Если во время заживления у вас появляется отек или боль, вы можете попробовать метод RICE:
- Отдых на ушибленной области.
- Лед синяк от 10 до 20 минут. Повторяйте несколько раз в день в течение 48 часов. Не кладите лед прямо на кожу. Предварительно заверните его в полотенце.
- Сожмите область, если есть отек, но будьте осторожны, чтобы не нарушить кровообращение.
- Приподнимите травму, чтобы уменьшить боль и отек.
Аспирин может вызвать более сильное кровотечение, поэтому от боли выбирайте ацетаминофен (тайленол). Вы также можете попробовать несколько домашних средств:
- Алоэ вера.

- Холодный компресс.


 Примеры этих препаратов включают:
Примеры этих препаратов включают:
 Это тип белка, который помогает вашей крови свертываться.
Это тип белка, который помогает вашей крови свертываться. Поскольку кожа, кровеносные сосуды и соединительная ткань вокруг кровеносных сосудов очень хрупкие, могут легко возникнуть синяки.
Поскольку кожа, кровеносные сосуды и соединительная ткань вокруг кровеносных сосудов очень хрупкие, могут легко возникнуть синяки. Они могут работать с вами, чтобы изменить ваш план лечения. Никогда не прекращайте принимать какие-либо лекарства самостоятельно. Некоторые лекарства могут потребовать постепенного снижения дозы и тщательного наблюдения.
Они могут работать с вами, чтобы изменить ваш план лечения. Никогда не прекращайте принимать какие-либо лекарства самостоятельно. Некоторые лекарства могут потребовать постепенного снижения дозы и тщательного наблюдения.

 Затем тромбоциты крови образуют сгусток, чтобы закрыть утечку.
Затем тромбоциты крови образуют сгусток, чтобы закрыть утечку.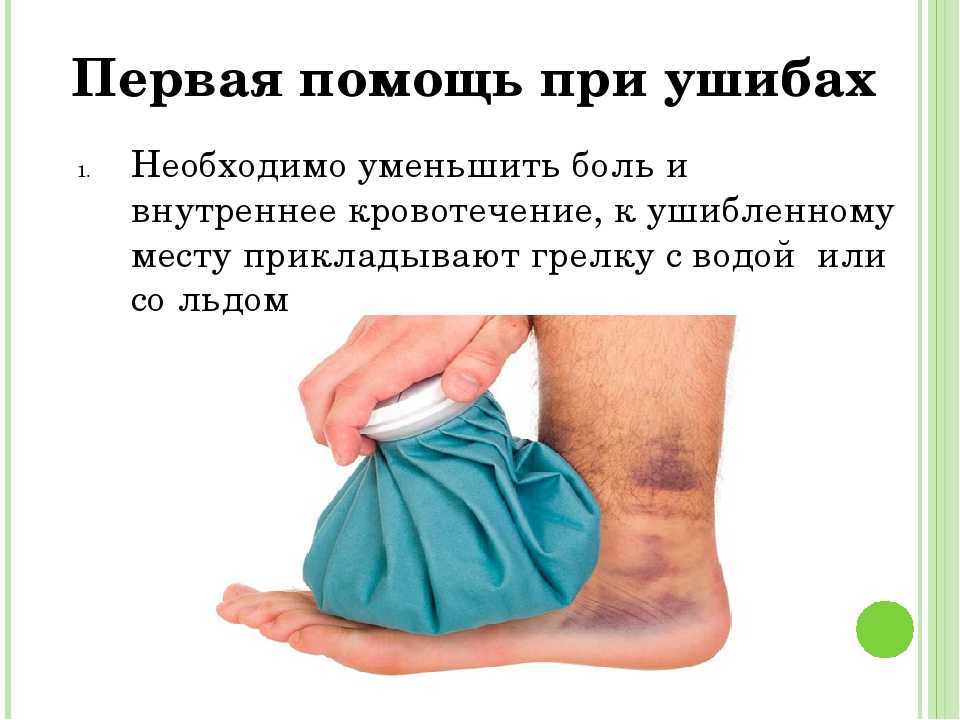 Цветовой переход выглядит примерно так:
Цветовой переход выглядит примерно так: Расположение синяка, а также другие симптомы могут дать вашему врачу диагностические подсказки.
Расположение синяка, а также другие симптомы могут дать вашему врачу диагностические подсказки. Некоторые условия, которые могут вызвать это:
Некоторые условия, которые могут вызвать это: Ваша грудь также может быть нежной и теплой. Воспалительный рак молочной железы может не включать уплотнения, как другие виды рака молочной железы.
Ваша грудь также может быть нежной и теплой. Воспалительный рак молочной железы может не включать уплотнения, как другие виды рака молочной железы.
