Как лечить суставы с помощью спиртовой настойки Йода
Для лечения суставов существует множество методов и медицинских препаратов, но они не смогли вытеснить старые способы, проверенные не одним поколением. Эффективность некоторых домашних рецептов вызывает сомнения, но есть и такие, действенность которых признается врачами. Один из них – настойки и растирки на основе йода с добавлением спирта, анальгина, аспирина, экстрактов растений, меда. Применение антисептика дает хорошие результаты в избавлении от болей в суставах, облегчения состояния при подагре.
Характеристика препарата
Йод – сравнительно молодое соединение, открытое французским химиком всего два столетия назад во время опытов с морскими водорослями. Полученное вещество заинтересовало ученых, и после нескольких лет изучения его свойств, они обнаружили, что йод в разной концентрации присутствует во всем, что формирует жизнь и существует на планете.
В медицине используется в основном спиртовой раствор йода.
- Для обработки кожных покровов и слизистых оболочек при лечении инфекционных заболеваний, сопровождающихся воспалением
- В качестве скорой помощи при неглубоких поражениях дермы
- Для обработки рук и поверхностей в медучреждениях
- При лечении атеросклероза, атрофического ларингита и др.
- При отравлениях ртутью и тяжелыми металлами.
Кроме того, йод используют для:
- Лечения синяков
- Ускорения заживления струпьев при герпесе
- Лечения грибковых заболеваний
- Облегчения состояния при подагре
- Терапии ОРВИ и заболеваний органов дыхания
- Отбеливания кожи и избавления от пигментных пятен.
Подробная инструкция по применению Йода находится здесь.
Йод для суставов
Боль в суставах возникает по разным причинам, но, к сожалению, немногие больные сразу же идут к врачам.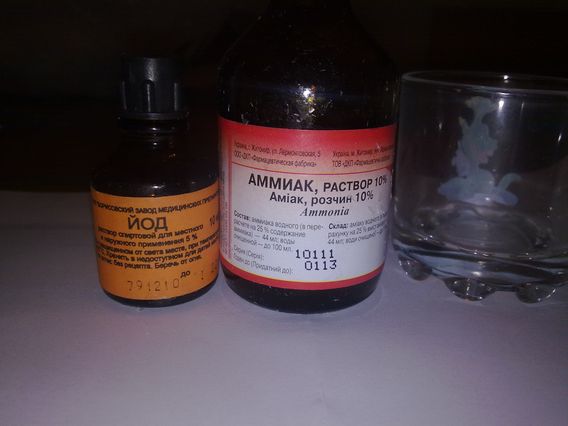 Большинство людей самостоятельно определяют себе диагноз. В результате самолечения болезнь прогрессирует, и к моменту обращения к докторам, находится в запущенном состоянии и требует серьезных мер. Поэтому прежде чем лечиться народными методами, надо сначала получить профессиональное медицинское заключение.
Большинство людей самостоятельно определяют себе диагноз. В результате самолечения болезнь прогрессирует, и к моменту обращения к докторам, находится в запущенном состоянии и требует серьезных мер. Поэтому прежде чем лечиться народными методами, надо сначала получить профессиональное медицинское заключение.
Йод относится к препаратам, применение которых при соблюдении противопоказаний и правильного применения не нанесет ущерба здоровью и поможет облегчить состояние при подагре или избавиться от болей в суставах, возникших по иным причинам. Настойки на основе антисептика помогают также при простудных заболеваниях, остеохондрозе, артритах и артрозах, ушибах и растяжении мышц.
Препарат обладает высокой биологической активностью, мощным противовоспалительным действием. Проникая сквозь кожу, он купирует очаг воспаления, улучшает состояние и препятствует деформации суставов.
Популярность применения антисептика объясняется хорошим терапевтическим эффектом, доступностью компонентов и незначительным количеством противопоказаний.
Рецепты средств с йодом
Выбирая рецепт для приготовления состава для компрессов или растираний – с соком лимона, медом или анальгином, – необходимо учитывать наличие аллергической реакции на тот или иной компонент, а также восприимчивость йода. Для этого проводится тест: на внутренней стороне руки надо нарисовать препаратом полоску и понаблюдать за состоянием организма. Если не возникло никаких неприятных эффектов, тогда можно приступать к лечению.
С лимонным соком. Для лечебной смеси надо взять равное количество 10- процентного йода и сока лимона, очищенного от мякоти. Компоненты смешать и слить в темный стеклянный флакон, хранить в холодильнике. Перед применением средство надо взболтать и нарисовать сетку на больном месте. Если полоски бледнеют и исчезают, значит организму не хватает элемента. Лечение проводят до тех пор, пока нарисованные полосы не перестанут бледнеть.
С медом. Смесь хорошо помогает при сильных болях. Чтобы приготовить состав, надо смешать по 1 чайной ложке соли, соды, добавить столько же меда, а затем ввести 7 капель йода. Смесь накладывают на предварительно распаренное место, закрывают теплым компрессом и держат 15-20 минут. После этого состав смывают и смазывают кожу кремом. Курс – 6 процедур.
С нашатырным спиртом. Смешать равное количество раствора аммиака и 10 %-го йода, оставить жидкость в темном месте на 4-5 суток, чтобы настоялась. Средство используется как растирка: наносится на больное место и втирается в кожу в течение нескольких минут. Процедуру можно проводить несколько раз в день. Компрессы делать нельзя, чтобы не получить ожог.
С камфорным спиртом. Смешать равное количество нашатырного и камфорного спирта (по 1 флакону), добавить 5-6 капель 10-процентного йода.
С чесноком. Во флакон из-под валерьянки поместить 3 размельченных зубчика чеснока, залить йодом и оставить настаиваться неделю.
Со спиртом. Популярная йодная сетка плохо помогает при лечении суставов или устранении боли при подагре. Для усиления эффекта вещество надо смешать с медицинским спиртом в соотношении 1:1 и держать в теплом месте, пока жидкость не станет бесцветной и прозрачной. Растиркой можно пользоваться два раза в сутки, после процедуры укутывать больные места не требуется.
С анальгином. Популярное средство, известное как Бабушкина растирка. Для приготовления смеси надо взять 300 мл спирта, влить в него по 1 флакону йода и камфарного спирта, добавить 10 размельченных в порошок таблеток анальгина и поставить в теплое место на 21 сутки для настаивания.
С золотым усом. Усиленная смесь на основе Бабушкиной растирки. Состав с лекарственным растением используется для растирания суставов при подагре, а также при артрозах и артритах. На 200 мл спирта берется по 40 мл йода, камфорного спирта и меновазина, 20 суставчиков уса, 40 таблеток (размельченных в порошок) анальгина и полстакана корней сабельника. Суставчики и корни измельчить, сложить в стеклянную банку, добавить остальные ингредиенты, укутать емкость и поставить на 3 недели в темное место настаиваться. Лекарственной смесью можно пользоваться не только при подагре, но и при воспалении седалищного нерва, а также при простудных заболеваниях.
На 200 мл спирта берется по 40 мл йода, камфорного спирта и меновазина, 20 суставчиков уса, 40 таблеток (размельченных в порошок) анальгина и полстакана корней сабельника. Суставчики и корни измельчить, сложить в стеклянную банку, добавить остальные ингредиенты, укутать емкость и поставить на 3 недели в темное место настаиваться. Лекарственной смесью можно пользоваться не только при подагре, но и при воспалении седалищного нерва, а также при простудных заболеваниях.
С «Тройным» одеколоном. Парфюмерное средство содержит множество эфирных масел, которые отлично борются с болями в суставах. На бутылку одеколона надо взять по 10 мл йода и валерианы, 6 таблеток анальгина. Все смешать и настаивать 5 суток.
Противопоказания
Использовать йод для растирания надо с осторожностью – это серьезный препарат с сильным действием и своими противопоказаниями. Его нельзя применять:
- Людям с аллергией на вещество
- При нарушениях работы ЩЖ
- При обострении хронических заболеваний
- При онкологии
- При температуре выше 38 °С.

Кроме того, нельзя превышать количество рекомендованных процедур, чтобы не спровоцировать йодизм.
забудьте про йод и нашатырь › Статьи и новости › ДокторПитер.ру
Вы помните, как делать искусственное дыхание? Знаете, чем помочь человеку, упавшему в обморок? Придется вспомнить и узнать. Смольный обязал всех работающих петербуржцев пройти курсы ОБЖ. А что реально нужно знать жителю современного города? Курс выживания от «МК» в Питере».
Не добивайте пострадавших
Что творят горожане при ДТП, пожарах, падениях с высоты, инструктор центра обучению первой помощи «First aid» и действующий спасатель Поисково-спасательной службы Петербурга насмотрелся на работе, а на курсах пытается это исправить.
— Чаще всего люди либо просто не знают, чем помочь пострадавшим, либо так помогают, что только добивают их, — говорит Максим. — Вытащат из машины, например, разложат рядком на обочине людей без сознания, да еще под голову им что-нибудь мягкое подпихнут. Скорой остается только смерть фиксировать — и не от полученных травм, а от удушения вследствие западения языка.
Скорой остается только смерть фиксировать — и не от полученных травм, а от удушения вследствие западения языка.
Идея всенародных курсов ОБЖ спасателя, с одной стороны, радует, с другой — пугает. Кто и чему там будет учить?
— Главное, чему надо обучить наших людей, — это навыкам вызова спецслужб, когда следует звать спасателей, когда пожарных, а когда достаточно неотложки. А еще с мобильника можно набирать 112, но лучше записать телефоны районных служб (хотя бы в своем районе), — рекомендует Штыб.
Максим поделился секретом: если вы дозвонились до службы спасения — не забудьте представиться и уточнить, высветился ли у них ваш телефонный номер. Такой звонок диспетчер с наименьшей вероятностью примет за ложный вызов и отправит к вам врачей, пожарных или спасателей в первую очередь.
Инфаркты, инсульты, обмороки: не травите пенсионерок нитроглицерином
— Однажды вызов поступил со швейной фабрики. Женщина потеряла сознание. Прибывшая бригада врачей забрала ее и повезла в больницу.
 По дороге состояние пациентки улучшилось, она пришла в себя и начала что-то несвязно бормотать, — рассказывает инструктор центра обучению первой помощи Яков Гинзбург. — Было видно: женщине что-то мешает говорить. Врач и спасатель заглянули ей в рот и обомлели — такое могли сотворить только ловкие руки швей. Вероятно, кто-то из них слышал, что без сознания человек может задохнуться, если у него западет язык. Чтобы этого не произошло, язык надо зафиксировать. Как? Конечно, булавкой. А булавок на швейной фабрике много. Вот они и прикололи язык к щеке, да как изящно — не проткнув щеку насквозь. О своем приеме они, правда, забыли проинформировать врачей.
По дороге состояние пациентки улучшилось, она пришла в себя и начала что-то несвязно бормотать, — рассказывает инструктор центра обучению первой помощи Яков Гинзбург. — Было видно: женщине что-то мешает говорить. Врач и спасатель заглянули ей в рот и обомлели — такое могли сотворить только ловкие руки швей. Вероятно, кто-то из них слышал, что без сознания человек может задохнуться, если у него западет язык. Чтобы этого не произошло, язык надо зафиксировать. Как? Конечно, булавкой. А булавок на швейной фабрике много. Вот они и прикололи язык к щеке, да как изящно — не проткнув щеку насквозь. О своем приеме они, правда, забыли проинформировать врачей. Такой способ в принципе существует. Но применяется на войне, в крайних случаях, и щеку бойца, потерявшего сознание, обычно прокалывают насквозь, так что трудно не заметить. В мирной жизни вполне достаточно перевернуть пострадавшего на бок, конечно, если нет подозрений на перелом шеи или спины.
— В метро был случай — старушке стало плохо. Сердобольные граждане не пожалели ей нитроглицерина, ведь в народном сознании если «плохо», то «плохо с сердцем». Скорая увозила бабушку в больницу с отравлением нитратами от лекарства, — говорит Яков. — А надо было всего-то вывести пенсионерку на свежий воздух.
Сердобольные граждане не пожалели ей нитроглицерина, ведь в народном сознании если «плохо», то «плохо с сердцем». Скорая увозила бабушку в больницу с отравлением нитратами от лекарства, — говорит Яков. — А надо было всего-то вывести пенсионерку на свежий воздух.
Зато, когда человеку действительно нужна помощь, наши люди проходят мимо. Пациентов с инсультом принимают за пьяных. Поведение у них действительно похожее — походка неуверенная, пошатывание, речь не связная. Только от инсультника обычно не пахнет перегаром.
Про нашатырный спирт как средство от обмороков вообще лучше забыть навсегда. Наши щедрые люди ведь дают понюхать больному не ватку и не пробочку, а прямо бутылку. Пары спирта серьезно повреждают дыхательные пути, вызывают химические ожоги. От обмороков неплохо помогают обычные громкие хлопки над ухом.
— Давать посторонним людям любые медицинские препараты в наши дни очень опасно. Если таблетка или укол человеку навредят, а он окажется ушлым, то потом может легко подать на вас в суд. То же самое вас ждет, если вы усугубите травму, — отметил Максим Штыб. — В Петербурге уже был такой случай. Эксперт из «Красного креста» тогда доказывал, что один человек помогал другому обоснованно, иного варианта не было. Едва удалось добиться оправдательного приговора.
То же самое вас ждет, если вы усугубите травму, — отметил Максим Штыб. — В Петербурге уже был такой случай. Эксперт из «Красного креста» тогда доказывал, что один человек помогал другому обоснованно, иного варианта не было. Едва удалось добиться оправдательного приговора.
Бытовые травмы: не мочитесь на посторонних
Вот лишь ряд классических ошибок, которые петербуржцы чаще всего допускают, оказывая помощь при несерьезных травмах.
* Заливают раны зеленкой или йодом. Эти вещества слишком агрессивные, ими можно обрабатывать только края ран, а не поврежденные ткани. Лучше пользоваться либо перекисью водорода, либо хлоргексидином (и то и другое продается в аптеках).
— От йода вообще во всем мире уже давно отказываются. На него все чаще встречается аллергия, это связано с общим увеличением числа аллергиков, — пояснил спасатель Штыб.
* Запрокидывают голову вверх при носовом кровотечении. В таком положении кровь обратно в капилляры не зальется, она, скорее, попадет в горло. Лучше наклонить голову вниз, а к переносице приложить холод.
Лучше наклонить голову вниз, а к переносице приложить холод.
* Растирают замерзшие щеки снегом. Он не согревает, а только царапает кожу и еще больше ее охлаждает.
* Мочатся на свежие раны и ожоги.
— Однозначно могу заявить: такая помощь только вредит, в раны заносятся микробы и инфекции, — заверил Яков Гинзбург. — Но у этого мифа есть историческое обоснование. Когда-то давно военные врачи рекомендовали в качестве антисептика мочу, но исключительно мужскую и исключительно трехдневной выдержки. Только в ней образуется достаточное количество аммиака, который препятствует разложению тканей. И если вы с собой не носите в баночке такое средство, не надо писать на других людей и на себя.
Несчастные случаи в метро: от электрички прячьтесь в канаве
Если в метро вы упали на рельсы, не пытайтесь выбраться на платформу своими силами до прибытия поезда. Рискуете умереть от удара током. Контактный рельс — это не левый и не правый из тех, что вы видите с платформы. Он «третий», расположен чаще всего слева от путей (но может быть и справа), на станциях его не видно под платформой. Сверху он прикрыт пластиковым коробом. И на него так и хочется встать, чтобы забраться на платформу. Но пластик нужен для оберегания металла от лишней пыли, на вес человека он не рассчитан, может легко сломаться, и удар током в 825 вольт гарантирован.
Он «третий», расположен чаще всего слева от путей (но может быть и справа), на станциях его не видно под платформой. Сверху он прикрыт пластиковым коробом. И на него так и хочется встать, чтобы забраться на платформу. Но пластик нужен для оберегания металла от лишней пыли, на вес человека он не рассчитан, может легко сломаться, и удар током в 825 вольт гарантирован.
— Не бегите от приближающейся электрички. Она все равно быстрее, — уверен Гинзбург. — Не пытайтесь вжаться в стенку, противоположную платформе. Расстояние от нее до вагонов только кажется большим. К тому же снизу у электрички расположены выходящие далеко в стороны токоприемники. Они имеются с обеих сторон и легко сломают ноги стоящему у стены.
Лучше всего укройтесь в канавке между рельсами. Это водосток. Там может быть грязно и мокро, но он довольно глубокий, взрослый человек в нем прекрасно помещается. Машинист наверняка вас там заметит, сообщит дежурной по станции, контактный рельс на время обесточат и безопасно извлекут вас наверх. Ложиться лучше всего лицом вниз, чтобы не видеть приближающегося поезда, не паниковать и не делать лишних движений. По той же причине предпочтительней лечь головой к электричке, чтобы ветром, который будет дуть из тоннеля, не задрало одежду и вы инстинктивно не потянулись ее поправлять.
Ложиться лучше всего лицом вниз, чтобы не видеть приближающегося поезда, не паниковать и не делать лишних движений. По той же причине предпочтительней лечь головой к электричке, чтобы ветром, который будет дуть из тоннеля, не задрало одежду и вы инстинктивно не потянулись ее поправлять.
— А на эскалаторе не стройте из себя героя и не ловите летящее на вас по ступенькам тело, — говорит Максим Штыб. — Подхватить можно только человека, стоящего от вас на две-три ступеньки выше. Если же бедолага уже катится и успел развить приличную скорость, то вы его не поймаете, а скорее всего, присоединитесь к его полету, и пострадавших будет уже двое.
ДТП: бойтесь помощников-дилетантов
Любая автоавария от царапины на зеркале до лобового столкновения с КамАЗом — это стресс для водителя и пассажиров. Реакция может быть непредсказуемой. Пострадавшие иногда сильно удивляют спасателей и медиков. Один человек в состоянии шока убежал на несколько километров от места ДТП. Когда по следам на снегу его догнали спасатели, он уже был мертв — скончался от болевого шока из-за множества переломов. В другой раз петербурженка въехала под фуру. Чтобы извлечь ее из машины, спасателям пришлось применять гидравлическую технику. В момент извлечения дамы из авто у нее странным образом замигала грудь и раздалась музыка. Недоумевающие спасатели не сразу поняли, что в лифчике горе-водительница прятала самое ценное — мобильный телефон.
В другой раз петербурженка въехала под фуру. Чтобы извлечь ее из машины, спасателям пришлось применять гидравлическую технику. В момент извлечения дамы из авто у нее странным образом замигала грудь и раздалась музыка. Недоумевающие спасатели не сразу поняли, что в лифчике горе-водительница прятала самое ценное — мобильный телефон.
Вообще у женщин милое дело вцепиться при спасательной операции в свою сумочку. Мужчины больше беспокоятся о машине, чем о себе, — в состоянии шока выбегают посмотреть, что помялось, могут сломанной ногой ударить по колесу и окончательно доломать конечность. Поэтому, если нет угрозы жизни, но очевидны травмы, лучше до прибытия медиков или спасателей не выбираться самостоятельно из авто.
— На КАД нередки случаи, когда люди гибнут не в аварии, а из-за того, что выходят посмотреть, сильно ли стукнулись, и их просто сбивают несущиеся мимо машины, — рассказывает Яков Гинзбург.
Вытаскивать человека из салона неспециалистам рекомендуется, только если автомобиль горит или у пострадавшего остановилось дыхание. Сердечно-легочную реанимацию сидящему больному не оказать.
Сердечно-легочную реанимацию сидящему больному не оказать.
Кстати, чтобы автомобиль не загорелся от замыкания в электронике, имеет смысл отключить аккумулятор — у большинства легковых машин он расположен под капотом, «обезвредить» его можно, если отсоединить хотя бы один из проводов.
Наводнения, землетрясения, ураганы: вода отступила — и вам пора
Как ни странно, но тут знания ОБЖ нашим людям помогают чаще, чем при бинтовании порезанных пальцев.
При урагане надо как можно скорее спрятаться в капитальном строении, а при землетрясении, наоборот, выбежать из здания. В сейсмоопасных районах страны это отработано, и люди справляются. В Питере землетрясения маловероятны, но запомнить правило не помешает, ведь мы часто путешествуем.
В нашем городе более вероятны наводнения. При затоплении, во-первых, надо подняться на возвышенность, во-вторых, захватить с собой чистой воды. О втором правиле народ чаще всего забывает. А пить окружающую воду нельзя, так как в ней растворены все местные нечистоты.
— Удивительно, но учившиеся в советских школах россияне запомнили, что перед цунами всегда происходит сильный отлив. Многим это спасло жизнь в 2004 году во время цунами в Таиланде. Когда океан резко отступил, иностранцы кинулись собирать ракушки и рыб с оголившегося дна, а наши побежали на холмы.
Уличные происшествия: долой скромность, раздевайтесь
Избегайте давки. Если уж попали в толпу, выбирайтесь к ее краю, там есть шанс, что вас выкинет в какую-нибудь нишу — к подъезду, под арку. Руки держите скрещенными на груди, чтобы их не переломали, сумки тоже несите перед собой. Если уроните — забудьте о них, не пытайтесь подобрать с земли, рискуете быть затоптанными.
— В последнее время участились случаи прорыва теплотрасс. Если человек попадает в кипяток и ему везет выбраться из разлива, нужно как можно скорее снять пропитавшуюся кипятком одежду, — советует Максим Штыб. — К сожалению, у нас многие из скромности стесняются это делать, отчего ожоги лишь усиливаются.
Источник: Елена Михина, «МК в Питере»
Нашатырный спирт: применение при опьянении и похмелье, формула и цена
Закрыть- Болезни
- Инфекционные и паразитарные болезни
- Новообразования
- Болезни крови и кроветворных органов
- Болезни эндокринной системы
- Психические расстройства
- Болезни нервной системы
- Болезни глаза
- Болезни уха
- Болезни системы кровообращения
- Болезни органов дыхания
- Болезни органов пищеварения
- Болезни кожи
- Болезни костно-мышечной системы
- Болезни мочеполовой системы
- Беременность и роды
- Болезни плода и новорожденного
- Врожденные аномалии (пороки развития)
- Травмы и отравления
- Симптомы
- Системы кровообращения и дыхания
- Система пищеварения и брюшная полость
- Кожа и подкожная клетчатка
- Нервная и костно-мышечная системы
- Мочевая система
- Восприятие и поведение
- Речь и голос
- Общие симптомы и признаки
- Отклонения от нормы
- Диеты
- Снижение веса
- Лечебные
- Быстрые
- Для красоты и здоровья
- Разгрузочные дни
- От профессионалов
- Монодиеты
- Звездные
- На кашах
- Овощные
- Детокс-диеты
- Фруктовые
- Модные
- Для мужчин
- Набор веса
- Вегетарианство
- Национальные
- Лекарства
- Пищеварительный тракт и обмен веществ
- Кровь и система кроветворения
- Сердечно-сосудистая система
- Дерматологические препараты
- Mочеполовая система и половые гормоны
- Гормональные препараты
- Противомикробные препараты
- Противоопухолевые препараты и иммуномодуляторы
- Костно-мышечная система
- Нервная система
- Противопаразитарные препараты, инсектициды и репелленты
- Дыхательная система
- Органы чувств
- Прочие препараты
- Врачи
- Клиники
- Справочник
- Аллергология
- Анализы и диагностика
- Беременность
- Витамины
- Вредные привычки
- Геронтология (Старение)
- Дерматология
- Дети
- Женское здоровье
- Инфекция
- Контрацепция
- Косметология
- Народная медицина
- Обзоры заболеваний
- Обзоры лекарств
- Ортопедия и травматология
- Питание
Аммиак
Производство аммиака имеет решающее значение для мирового сельского хозяйства, так как из него производятся все удобрения, содержащие азот.
Использование аммиака
Производство удобрений, безусловно, является наиболее важным применением аммиака. К ним относятся мочевина, соли аммония (фосфаты аммония, нитрат аммония, нитрат аммония кальция) и растворы аммиака.
Рис. 1 Использование аммиака.
Увеличивающееся количество аммиака, хотя и небольшое по сравнению с другими видами применения, используется в качестве концентрированного раствора для борьбы с выбросами оксидов азота из электростанций.
Годовое производство аммиака
Аммиак занимает второе место после серной кислоты как химическое вещество с наибольшим тоннажем. Его все чаще производят в странах с дешевыми источниками природного газа и угля (на Китай и Россию приходится около 40%). Крупнейшие заводы производят около 3000 тонн в день, и есть планы построить заводы, производящие 4000-5000 тонн в день, что означает, что общим мировым производством можно управлять с помощью 100 таких единиц. Текущее производство:
Текущее производство:
| Весь мир | 146 млн тонн |
| Китай | 48 млн тонн |
| Россия | 12 млн тонн |
| Индия | 11 млн тонн |
| U.С. | 9 млн тонн |
| Индонезия | 5 млн тонн |
| Тринидад и Тобаго | 5 млн тонн |
| Украина | 4 млн тонн |
Данные из:
Геологическая служба США, Сводные данные по минеральным сырьевым товарам, 2016 г.
Увеличение тоннажа производимого аммиака идет в ногу с увеличением загрязнения мира и повышением уровня жизни в нем. Ожидается, что к 2018 году спрос на аммиак вырастет почти до 200 млн тонн. 1 .
Ожидается, что к 2018 году спрос на аммиак вырастет почти до 200 млн тонн. 1 .
1. Международная ассоциация удобрений, 2014 г.
Производство аммиака
Производство аммиака из азота и водорода осуществляется в два основных этапа:
а) производство водорода
б) синтез аммиака (процесс Габера)
Производство водорода включает несколько различных процессов. На рисунке 2 показана их последовательность и расположение на аммиачной установке (шаги 1–5).Также показан конвертер, используемый для получения аммиака из водорода (этап 6). То, что происходит на каждом из этих шагов, описано под рисунком.
Рисунок 2 Завод по производству аммиака в Западной Австралии: 1 Установки десульфуризации |
(a) Производство водорода
Водород производится из различных видов сырья, в основном из природного газа, угля или нафты. Способы получения водорода из этого сырья рассматриваются отдельно.
Водород из природного газа (метан)
Это включает в себя два этапа:
i) производство синтез-газа (смесь оксида углерода и водорода (паровой риформинг))
ii) удаление окиси углерода и получение смеси водорода и азота (реакция сдвига)
(i) Производство синтез-газа
Каким бы способом ни был получен метан, он будет содержать некоторые органические соединения серы и сероводород, оба из которых необходимо удалить.В противном случае они отравят катализатор, необходимый для производства синтез-газа. В установке обессеривания органические соединения серы часто сначала превращаются в сероводород до реакции с оксидом цинка. Сырье смешивают с водородом и пропускают через катализатор из смешанных оксидов кобальта и молибдена на инертном носителе (специально обработанный оксид алюминия) при температуре около 700 К.
Затем газы пропускают через оксид цинка при температуре около 700 K и удаляют сероводород:
Первичный риформинг с водяным паром превращает метан и водяной пар в синтез-газ, смесь оксида углерода и водорода:
Высокие температуры и низкие давления способствуют образованию продуктов (принцип Ле Шателье).На практике реагенты пропускаются через катализатор из никеля, тонко разделенный на поверхности подложки из оксида кальция / оксида алюминия, содержащейся в вертикальных трубках из никелевого сплава. Трубки, до 350 параллельно включенных, нагреваются в печи выше 1000 К и под давлением ~ 30 атм. Это пример трубчатого реактора.
Вторичный риформинг с водяным паром реагирует на кислород из воздуха с некоторым количеством присутствующего водорода, и полученная смесь пропускается через никелевый катализатор.Пар и тепло, образующиеся при сгорании, преобразовывают большую часть остаточного метана. Среди ключевых реакций:
Среди ключевых реакций:
Выходящий газ из этой чистой экзотермической стадии имеет температуру ~ 1200 К и охлаждается в теплообменниках. Пар, образующийся из воды, используемой для охлаждения газов, используется для работы турбин и, следовательно, компрессоров, а также для предварительного нагрева реагентов.
В некоторых последних разработках используется отходящее тепло от установки вторичного риформинга непосредственно для обеспечения теплом установки первичного риформинга.
На этой стадии газ содержит водород, азот, монооксид углерода и диоксид углерода и около 0,25% метана. Поскольку воздух содержит 1% аргона, он также накапливается в синтез-газе.
(ii) Реакция сдвига
В этом процессе окись углерода преобразуется в двуокись углерода, при этом образуется больше водорода.
Проходит в два этапа. В первой реакции высокотемпературного сдвига газ смешивается с водяным паром и пропускается над катализатором на основе оксида железа / хрома (III) при температуре ~ 700 К в реакторе с неподвижным слоем. Это снижает концентрацию окиси углерода с 11%:
Это снижает концентрацию окиси углерода с 11%:
На второй стадии, реакция низкотемпературного сдвига , смесь газов проходит над медно-цинковым катализатором при примерно 500 К. Концентрация монооксида углерода дополнительно снижается до 0,2%.
Реакция проводится в два этапа по нескольким причинам. Реакция экзотермическая. Однако при высокой температуре выходная концентрация моноксида углерода все еще довольно высока из-за контроля равновесия.Медный катализатор, используемый на стадии низких температур, очень чувствителен к высоким температурам и не может эффективно работать на стадии высоких температур. Таким образом, основная часть реакции проводится при высокой температуре для рекуперации большей части тепла. Затем газ удаляют при низкой температуре, где равновесие гораздо более благоприятно, на очень активном, но нестабильном медном катализаторе.
Газовая смесь теперь содержит около 18% диоксида углерода, который удаляют путем промывки газа раствором основания с использованием одного из нескольких доступных методов. Предпочтение отдается органическому основанию (в абсорбере диоксида углерода ), растворе этаноламина, часто 2,2 ‘- (метилимино) бис-этанола (N-метилдиэтаноламин).
Предпочтение отдается органическому основанию (в абсорбере диоксида углерода ), растворе этаноламина, часто 2,2 ‘- (метилимино) бис-этанола (N-метилдиэтаноламин).
Диоксид углерода выделяется при нагревании раствора в стриппере диоксида углерода (). Большая часть его сжижается и продается, например, для газированных напитков, в качестве охлаждающей жидкости для атомных электростанций и для стимулирования роста растений в теплицах.
Последние следы оксидов углерода удаляются пропусканием газов над никелевым катализатором при 600 К:
Этот процесс известен как метанирование.Получается газ типичного состава: 74% водорода, 25% азота, 1% метана вместе с некоторым количеством аргона.
Водород из нафты
Если в качестве сырья используется нафта, необходима дополнительная стадия риформинга. Нафта нагревается с образованием пара, смешивается с паром и проходит по трубам, нагревается до 750 К и набивается катализатором, никель нанесен на смесь оксидов алюминия и магния. Основным продуктом является метан вместе с оксидами углерода, который затем перерабатывается паровой конверсией, как если бы это был природный газ, с последующей реакцией сдвига.
Основным продуктом является метан вместе с оксидами углерода, который затем перерабатывается паровой конверсией, как если бы это был природный газ, с последующей реакцией сдвига.
Водород из угля
Если используется уголь, его сначала тонко измельчают и нагревают в атмосфере кислорода и пара. Часть угля очень быстро сгорает в кислороде (менее 0,1 с), вызывая повышение температуры в печи, а остальная часть угля вступает в реакцию с паром:
Выбрасываемый газ содержит около 55% окиси углерода, 30% водорода, 10% двуокиси углерода и небольшие количества метана и других углеводородов. Эту смесь обрабатывают реакцией сдвига.
Основные проблемы использования угля включают в себя большое количество диоксида и триоксида серы, образующихся при сжигании угля, а также значительное количество других примесей, таких как мышьяк и бром, которые очень вредны для атмосферы и все они являются серьезными ядами для катализаторы в процессе. Также существует серьезная проблема с удалением золы.
Водород из биомассы
Синтез-газ можно производить из биомассы. Процесс изложен в разделе «Биоперерабатывающие заводы».
(b) Производство аммиака (процесс Габера)
В основе процесса лежит реакция между водородом и азотом в реакторе с неподвижным слоем. Газы в стехиометрических пропорциях нагреваются и пропускаются под давлением над катализатором (рис. 3).
Рис. 3 Схема, иллюстрирующая обычный реактор синтеза (конвертер).
Доля аммиака в равновесной смеси увеличивается с увеличением давления и падением температуры (принцип Ле Шателье).Количественные данные приведены в таблице 1. Для получения разумного выхода и благоприятной скорости используются высокие давления, умеренные температуры и катализатор.
| Давление / атм | Процентное содержание аммиака в состоянии равновесия в диапазоне температур | |||||
|---|---|---|---|---|---|---|
| 373 K | 473 K | 573 K | 673 K | 902 902 902 902 902 902 902 К|||
| 10 | – | 50. 7 7 | 14,7 | 3,9 | 1,2 | 0,2 |
| 25 | 91,7 | 63,6 | 27,4 | 8,7 | 2,9 | – |
| 50 | 94,5 | 74,0 | 39,5 | 15,3 | 5,6 | 1,1 |
| 100 | 96.7 | 81,7 | 52,5 | 25,2 | 10,6 | 2,2 |
| 200 | 98,4 | 89,0 | 66,7 | 38,8 | 18,3 | – |
| 400 | 99,4 | 94,6 | 79,7 | 55,4 | 31,9 | – |
| 1000 | – | 98.3 | 92,6 | 79,8 | 57,5 | 12,9 |
Таблица 1 Объемное процентное содержание аммиака в равновесной смеси для реакции
между азотом и водородом при различных температурах и давлениях.
В зависимости от конструкции реактора используется широкий диапазон условий. Используемые температуры варьируются от 600 до 700 К, а давление от 100 до 200 атмосфер.Большая работа проводится для повышения эффективности катализатора, чтобы можно было использовать давление до 50 атмосфер.
Поскольку реакция является экзотермической, добавляются холодные реагенты (азот и водород), чтобы снизить температуру в реакторах (рис. 3).
Аммиак обычно хранится на месте (шаг 7) и перекачивается в другую часть завода, где он превращается в удобрение (мочевину или соль аммония). Однако иногда его транспортируют морем (рис. 4) или автомобильным транспортом для использования на другом заводе.
Рис. 4 На заводе в Западной Австралии аммиак перекачивается по трубопроводу в ближайшую гавань (Рис. 2, этап 8) и транспортируется морским транспортом. В нем около 40 000 тонн сжиженного аммиака. В нем около 40 000 тонн сжиженного аммиака. С любезного разрешения Yara International ASA. |
Исходным катализатором, который использовал Хабер, был Fe 3 O 4 , который был восстановлен реагентом, водородом, до железа.Была проделана большая работа по улучшению катализатора, и было обнаружено, что небольшое количество гидроксида калия было эффективным в качестве промотора.
Недавние исследования были сосредоточены на поиске еще более эффективных катализаторов, которые позволили бы процессу протекать при более низких давлениях и температурах. Рутений на поверхности графита перспективен.
| Рисунок 5 Производство аммиака. |
Постскриптум
Процесс Габера настолько важен для нашей жизни, что за почти 90 лет он был удостоен трех Нобелевских премий по химии, присуждаемых немецким ученым, что является выдающимся рекордом.
Первый был передан в 1918 году Фрицу Хаберу, химику, который разработал процесс в лаборатории. Второй — Карлу Бошу, блестящие инженерные навыки которого сделали этот процесс жизнеспособным в массовом масштабе, но который ждал своей награды до 1931 года.
В 2007 году Герхард Эртль был удостоен премии за свои работы по катализу газовых реакций на твердых телах. Среди широкого круга изученных им реакций он получил доказательства адсорбции молекул азота и молекул водорода на поверхности железа и того, что эти адсорбированные молекулы диссоциируют на атомы.Затем эти атомы поэтапно соединяются с образованием молекулы аммиака. Следует помнить, что условия, использованные в этих исследованиях (менее 10 -10 атм), сильно отличаются от условий, используемых в промышленности, ок. 150 атм.
Сводка
Весь процесс производства аммиака из метана кратко представлен на Рисунке 5. Если уголь или нафта являются сырьем, необходимы дополнительные процессы. Нафта превращается в метан и оксиды углерода перед поступлением в установку первичного риформинга, а затем в реакцию конверсии.Уголь также превращается в водород и оксиды углерода, и эта смесь затем подвергается реакции сдвига.
Нафта превращается в метан и оксиды углерода перед поступлением в установку первичного риформинга, а затем в реакцию конверсии.Уголь также превращается в водород и оксиды углерода, и эта смесь затем подвергается реакции сдвига.
Дата последнего изменения: 18 октября 2016 г.
| | Аммиак ‘Когда органическое вещество, содержащее азот, подвергается деструктивной перегонке, образуется более 01’ меньше аммиака.Основными источниками аммиака являются: перегонка угля для получения газа или кокса, жидких сланцев, костей и других материалов животного происхождения; гнилостная моча; остатки сахарной промышленности свеклы и остатки после ферментации патоки для получения спирта; и отходящие газы доменных печей. Аммиак можно получить из азота, содержащегося в воздухе. 1) Ba (OH) 2 +3 C +2: N + 0 = Ba (C: N) 2 + h30 + CO2, Первая реакция осуществляется путем пропускания воздуха над гидроксидом или оксидом бария и углеродом, нагретыми до белого каления.Затем температуру понижают примерно до -1 · 10 ° С и впускают пар для разложения цианида бария согласно (2). Реакции не являются количественными, процесс неэкономичный и неважный. Основным источником аммиака является «газовый щелок» из гидравлической магистрали и скрубберов осветительного газового производства (с. 275). Азот, содержащийся в угле, в значительной степени превращается в аммиак и цианогеновые соединения посредством деструктивной перегонки. Основными солями аммония являются карбонат, сульфид и сульфидрат, летучие с паром, а также сульфат, тиосульфат, сульфит, сульфоцианид и ферроцианид, которые не летучие с паром.Эти соли вместе со свободным аммиаком находятся в «газовом щелоке». Газовый щелок оценивается по процентному содержанию солей аммония, что определяется путем перегонки с едким натром, поглощения паров нормальной серной кислотой и титрования несвязанной кислоты. 2 H» S + SO 2 = 2 H «O + 3 S. Принято меры к тому, чтобы аммиак не выходит вместе с газами, всегда присутствует небольшой избыток кислоты.Газообразный аммиак направляется в сатуратор по трубе, перфорированной с небольшими отверстиями и погруженной в кислоту. (Nh5) 2S04 + 2 NaCl = Na2S04 + 2 Nh5Cl. Кристаллизованный хлорид более или менее обесцвечен смолой, и его очищают сублимацией в железных или глиняных горшках или ретортах.Хлорид аммония собирается на крышке кастрюли в виде толстой волокнистой лепешки, и в этой форме он поступает в продажу под названием сал-конмониак. Обычно он содержит железо в качестве примеси. Раньше его производили путем сублимации сажи, полученной при закапывании сушеного верблюжьего навоза, но теперь почти весь его производят из газового щелока. Кристаллизованная соль часто продается под названием «хлористый аммиак» и обычно менее чиста, чем сали-аммиак: фуриат аммиака широко используется в технике для зарядки электрических батарей Leclanche; в процессе «цинкования» железа; в паяльных растворах; для изготовления «цемента ржавчины» для стыков труб; и в текстильной окраске.Карбонат аммония, который встречается в продаже, не является чистой солью, а представляет собой смесь кислого карбоната аммония (Nh5. HCOs) и соли карбаминовой кислоты (Nh3 · CO2, Nh5). Техническую соль получают путем нагревания смеси сульфата и порошкообразного карбоната кальция в железных ретортах. Пары конденсируются в камерах со свинцовой гильзой, а загрязненный продукт обычно сублимируется в чугунных котлах со свинцовыми крышками. В каждую кастрюлю вместе с солью наливают немного воды, в результате чего сублимированный продукт становится прозрачным, а не непрозрачно-белым.Температура этой второй сублимации не намного превышает 70 ° C. | Органическая химия для промышленности Неорганическая химия для промышленности |
Краткая информация: Йод в производстве метамфетамина
Название:
Дата публикации: июль 2002 г.
Идентификатор документа: 2002-L0490-002
Архивировано: 1 июля 2009 г. .Этот документ может содержать датированная информация. Остается предоставить доступ к историческим материалам.
В этом информационном бюллетене обсуждается использование йода в метамфетамине. производство, его опасности, доступность, кража и утечка, а также попытки при контроле по законодательству.
Ваши вопросы, комментарии и предложения на будущее
темы приветствуются в любое время. Адреса
предоставлено в конце страницы.
Обзор
Йод, используемый в метамфетамине Производство
Производство и наличие йода
Законодательство и контроль
Кража, утечка и контрабанда
Опасности, связанные с йодом
Outlook
Источники
Фотография бутылки и кристаллов йода.
NDICкристаллов йода, которые легально используются для различных коммерческих и в медицинских целях, часто используются незаконно для производства высококачественных d-метамфетамин. Следующий метод восстановления эфедрина / псевдоэфедрина использует йод в производственном процессе.
Йод / красный фосфор . Основные химические вещества — эфедрин или псевдоэфедрин, йод и красный фосфор. Требуемая иодоводородная кислота в этом вариация метода йодоводородной кислоты / красного фосфора производится реакция йода в воде с красным фосфором.Этот метод дает высокое качество d-метамфетамин. Другой метод йода / красного фосфора, ограниченный небольшими производственных партий, называется методом холодного приготовления, потому что химикаты, вместо нагрева помещаются в горячую среду, например, в прямую Солнечный лучик.
Федеральное правительство регулирует продажу кристаллов йода, которые легко доступны для законного использования. Однако импорт, экспорт, покупать или продавать кристаллы йода в США, если они используются, или предназначен для использования в производстве метамфетамина.Обычно производители метамфетамина приобретают кристаллы йода путем кражи или утечки, от мексиканских преступных группировок, которые контрабандой провозят йод в Соединенные Штаты через границы США и Мексики, или путем покупки и кристаллизации настойки йода, продажа которых не регулируется в большинстве штатов США.
Йод, используемый в Производство метамфетамина
Производители метамфетамина используют кристаллы йода для производства иодоводородной кислоты, предпочтительный реагент в способе восстановления эфедрина / псевдоэфедрина производство d-метамфетамина.Реагент — это химическое вещество, используемое в реакциях на превратить прекурсор в готовый продукт. Реагент не входит в состав готовый продукт. Регулирование йодоводородной кислоты Управлением по борьбе с наркотиками Администрация (DEA) в 1993 году сделала это химическое вещество практически недоступным в Соединенные Штаты.
Иодоводородная кислота может быть получена путем объединения кристаллов йода с водой и некоторая форма фосфора, включая красный фосфор, гипофосфористую кислоту или фосфористая кислота.В процессе производства метамфетамина кристаллы йода могут может использоваться для получения йодоводородной кислоты на отдельной стадии или может быть введен непосредственно в синтез метамфетамина.
К началу к содержанию
Производство йода и наличие
Йод, который на испанском языке называют йодо, а на жаргоне — черный, является естественным встречающийся минерал, который коммерчески доступен в виде кристаллов или настойки.Кристаллы йода обычно доступны в виде голубовато-черных или фиолетовых кристаллов, которые иметь металлический блеск. В газообразном состоянии (йод превращается в газ при температурах выше 68F) йод имеет фиолетовый цвет. Обычно йод выделяет резкий, отчетливый запах. Настойка йода — раствор йода в спирте — это широко доступный.
Настойка йода
Мелкие производители метамфетамина, которые не могут получить йод кристаллы иногда производят их из настойки йода, смешивая йод настойка с перекисью водорода.Это трудоемкий процесс, который дает очень небольшое количество кристаллов йода по отношению к количеству настойки и перекись водорода использовалась.
Настойка йода для человеческого антисептического использования на ранах и царапинах обычно продается в небольших количествах, обычно в бутылках по 1 унции, содержащих 2 процента йод. Эти маленькие бутылочки продаются по цене от 1 до 2 долларов. «Сильный» йод настойка (концентрация 7%) для ветеринарного применения продается в различных размерах от Бутылки объемом 16 унций в бочки на 50 галлонов.Продается бутылка крепкого йода на 16 унций от 4 до 6 долларов. Основными ингредиентами настойки йода являются этиловый спирт и вода.
Настойка йода не регулируется законодательством и продается в розничных магазинах, аптеки и магазины сельскохозяйственных товаров. Его легко получить через Интернет. на сайтах, где продаются товары для лошадей и ферм, а также в интернет-аптеках.
Кристаллы йода широко доступны и имеют следующие законные применения:
- Как производная, используемая для производства химикатов и полимеров, санитарных и чистящие составы, фармацевтические препараты, нейлоновые волокна, красители и чернила, а также фотопленка
- Как разработчик, помогающий следователям на месте преступления обнаруживать скрытые отпечатки пальцев на бумажных поверхностях
- В качестве пищевой добавки к поваренной соли
- Как обычный ингредиент в диетических добавках для домашнего скота
- Как элемент при производстве электрических лампочек
- Как средство для очистки воды и дезинфекции плавательных бассейнов
Как местный антисептик для людей, лошадей и крупного рогатого скота после кристаллы превращаются в настойку йода
Кристаллы йода можно купить в различных компаниях.Кристаллы обычно продаются в магазинах химикатов, кормов и прихваток магазины, ветеринарные клиники и поставщики. Йод также широко доступен на Интернет. Одна интернет-аптека, например, продает кристаллы йода в унциях. количества примерно за 14 долларов. Один фунт кристаллов йода продается по цене примерно 160 долларов. Владелец ранчо с большой фермой обычно может использовать до 2 унций пролечить стадо за 1 год. С другой стороны, производитель метамфетамина может используйте от 2 до 4 фунтов, чтобы произвести 1 фунт метамфетамина.
Компании в нескольких странах мира производят и продают йод. кристаллы коммерчески. Чилийские компании были крупнейшими в мире производителями йод в 2000 году, за ними следуют компании из Японии и США. В целом по всему миру Производство йода увеличилось с 13 726 тонн в 1994 году до 18 993 тонн в 2000 году. Производители кристаллов йода продают химическое вещество компаниям, которые либо используют йод. в производственных процессах или продавать оптом.
К началу к содержанию
Закон о всеобъемлющем контроле за метамфетамином 1996 года определяет йод как Список II хим.DEA предписывает вести подробный учет продаж йода. кристаллы, превышающие порог в 0,4 килограмма, установленный в 2000 году. который продает в общей сложности 0,4 кг (13,98 унции) кристаллов йода физическое лицо, корпорация, бизнес или другое юридическое лицо в течение 2-месячного периода должен получать данные, идентифицирующие покупателя, вести учет транзакций для 2 года и сообщайте о любых подозрительных транзакциях в DEA. Это правило не действует к настойкам йода или другим смесям йода.
Владение, распространение и использование перечисленных химических веществ, включая йод, подпадают под следующие запреты: 21 U.S.C. 841 (c) (1) — (3) запрещает любое лицо от сознательного или преднамеренного владения или распространения перечисленных химическое вещество с намерением, знанием или верой в то, что химическое вещество будет использоваться для производить контролируемое вещество. Он также запрещает человеку сознательно или умышленное уклонение от установленных требований к ведению документации или отчетности.(См. Текст Коробка.)
Корм Владелец магазина осужден
15 мая 2002 г. федеральное жюри осудил владельца магазина кормов в Саллисо, Оклахома, по 12 уголовным обвинениям в продажа кристаллов йода производителям метамфетамина. Расходы включены заговор с целью распространения перечисленных химикатов, владение и распространение перечисленные химические вещества, заговор с целью отмывания денег и отмывание денег. С января 1998 г. по сентябрь 2000 г. владелец магазина приобрел почти 5000 фунтов кристаллов йода по цене 8 долларов за унцию. кристаллы по 50 долларов за унцию для людей из Арканзаса, Канзаса, Миссури и Оклахома.В ходе судебного заседания свидетели показали, что владелец магазина знал кристаллы должны были использоваться для производства метамфетамина.
Источник: Восточный прокурор США Округ Оклахома; Ассошиэйтед Пресс .
Далее, 21 U.S.C. 843 (а) (7) запрещает любому лицу сознательно или умышленное производство, распространение, экспорт или импорт любых оборудование, химический продукт или материал, которые могут быть использованы для производства контролируемое вещество или перечисленное химическое вещество.Максимальные штрафы за каждый нарушение 21 U.S.C. 841 (c) (1) — (3) или 21 U.S.C. 843 (a) (7) — 10 лет тюремное заключение, штраф в размере 250 000 долларов или и то, и другое. Штрафы удваиваются за секунду или последующие осуждения.
В Калифорнии купля-продажа йода подлежит еще более строгим регулирование. Раздел 11107.1 Калифорнийского кодекса здоровья и безопасности требует ведение учета всех продаж кристаллов йода независимо от количества и продаж ограничены 8 унциями йода в 30-дневный период для любого человека.В продавец должен хранить оригинальный чек на продажу в течение 3 лет и вести учет продажи, которая включает имя покупателя, адрес, номер водительского удостоверения или другой государственный идентификационный номер, номерной знак и описание того, как покупатель будет использовать йод. И покупатель, и продавец должен подписать протокол. Покупатель также должен вести учет 3 лет, включая место и дату покупки, описание покупка, количество и стоимость покупки.Записи поддерживаются как продавцом, так и покупателем, должны быть доступны по закону исполнение по запросу. Продажа настойки йода на сумму 100 долларов США или less освобождается от этих требований.
К началу к содержанию
Кража, Утечка и контрабанда
В отчетах правоохранительных органов указано, что кража и утечка йода кристаллы чаще всего встречаются в западной половине США, особенно в штатах, где широко распространено производство метамфетамина и злоупотребление им.Сотрудники правоохранительных органов в Аризоне, Калифорнии, Айдахо, Неваде, Нью-Мексико, Оклахома и Орегон сообщили о многочисленных случаях кражи йода и диверсия. Большинство этих инцидентов произошло на предприятиях, которые кажутся законный. Склады кормов и прихваток, а также основные источники режущего агента MSM (метилсульфонилметан), являются конкретными целями.
MSM в качестве режущего агента
МСМ обычно используется в качестве пищевой добавки для лошадей и людей.Метамфетамин, производимый в Мексике и юго-западных штатах, обычно сокращается МСМ — белый порошок с низкой температурой плавления (109F). Он хорошо растворим и легко смешивается с большинством веществ, не оставляя следов, что делает его подходящий режущий агент для метамфетамина.
Лица, пытающиеся использовать йод для производства метамфетамина, могут проявлять одно или несколько из следующих подозрительных действий:
- Клиент не имеет законных оснований для покупки йода или не может обосновать запрошенное количество.
- Клиент покупает кристаллы йода для животных, но у него мало знание лошадей, крупного рогатого скота или другого домашнего скота.
- Клиент отказывается предоставлять личную информацию.
- Клиент повторно покупает максимальную разрешенную законом сумму в самый короткий допустимый интервал.
- Клиент одновременно покупает йод и другие используемые продукты для производства метамфетамина, такого как ацетон, спирт, топливо для походных печей, эфир, очиститель канализации, соляная кислота, каменная соль, дорожные факелы, необычное количество спички, или режущий агент МСМ.
- Клиент покупает более 4 жидких унций йодной настойки и покупает перекись водорода одновременно.
Производители метамфетамина также получают кристаллы йода от мексиканских преступников. группы, которые переправляют кристаллы из Мексики в США. НАС. Изъятия йода таможенной службой (USCS) в портах въезда (POE) вдоль Граница США и Мексики увеличилась примерно с 780 кг в 2000 г. до примерно 2140 кг в 2001 году.Большинство изъятий произошло в Южном Калифорния в ЭП Сан-Исидро и Отай-Меса. Изъятия также были произведены на ПВ. в Аризоне и Техасе.
К началу к содержанию
Опасности Связано с йодом
Йод — потенциально опасное химическое вещество, которое может вызвать серьезные травмы, если обрабатывались неправильно. Это вызывает особую озабоченность у сотрудников правоохранительных органов. или гражданские лица, которые сталкиваются с йодом на объектах по производству метамфетамина.Если йод контактирует с кожей, это может вызвать болезненное раздражение и химическое ожоги. Попадание в глаза может вызвать покраснение, ожоги и необратимые повреждения. Вдыхание газообразного йода может привести к респираторным заболеваниям или даже смерти — это особенно беспокоит, так как йод превращается в газ при 68F.
Сотрудникам правоохранительных органов, контактирующим с кристаллами йода, следует проявляйте особую осторожность при обращении, хранении или транспортировке химического вещества.Во время воздействия следует надевать ботинки, перчатки, защитные очки и респираторную одежду. к йоду. Хотя сам по себе йод не воспламеняется, он является сильным окислитель, который может воспламениться или вызвать взрыв при смешивании с другими горючими веществами или восстановители, такие как щелочные металлы, аммиак и фосфор. Йод должен хранить в плотно закрытой таре в прохладном, сухом месте, вдали от прямых солнечный свет, резкие перепады температуры и химические вещества, которые вступают в реакцию сильно при смешивании с йодом.
Вероятно использование йода при производстве метамфетамина увеличивать. Йод легко доступен, и его химические свойства позволяют легко превращаться в иодоводородную кислоту, предпочтительный реагент в незаконном производстве d-метамфетамина. Федеральные и государственные химические законы контроля, которые включают правила отчетности, максимальные пороги покупок, и руководство по вынесению приговоров, являются эффективными инструментами, которые правоохранительные официальные лица могут использовать для противодействия этой угрозе.Поскольку государства продолжают развиваться более строгие правила продажи и покупки йода кристаллов производители метамфетамина будут все чаще пытаться получить кристаллы йода в результате кражи, утечки или от мексиканских преступных группировок которые переправляют йод через Юго-западную границу в Соединенные Штаты. Производители могут также приобретать большее количество настойки йода и преобразовать его в кристаллы.
К началу к содержанию
Офис генерального прокурора Аризоны
Ассошиэйтед Пресс
Кодекс здоровья и безопасности штата Калифорния
Аппарат Президента
Управление национальной политики контроля над наркотиками
Зоны высокой интенсивности незаконного оборота наркотиков
Национальный метамфетамин Химическая инициативаMallinckrodt Baker Inc., www.jtbaker.com
Отчет Роскилла по металлам и минералам, www.roskill.co.uk
Министерство юстиции США
Управление по борьбе с наркотиками
Программа управления переадресацией
Офис прокурора США
Восточный округ ОклахомыМинистерство здравоохранения и социальных служб США
Центры по контролю и профилактике заболеваний
Национальный институт охраны труда и ЗдоровьеU.S. Министерство финансов
Таможенная служба США
Национальный Центр наркологической информации
319 Вашингтон-стрит, 5-й этаж
Johnstown, PA 15901Тел. (814) 532-4601
ФАКС (814) 532-4690
Электронная почта [email protected]Национальный Центр наркологической информации
8201 Гринсборо Драйв, офис 1001
Маклин, Вирджиния 22102-3840Тел.(703) 556-8970
ФАКС (703) 556-7807
Интернет-адреса
ADNET: http: // ndicosa
Министерство юстиции: http://www.usdoj.gov/archive/ndic/
LEO: home.leo.gov/lesig/archive/ndic/
Конец документа.
Аммиак — Учебный материал для IIT JEE
Происшествие
Аммиак (NH 3 ) является важным соединением азота и водорода .Он возникает в результате регулярного разложения тел растений и животных. Гибель и гниение животных и растений приводит к ухудшению содержания содержащихся в них соединений азота, производя аммиак . Аммиак также присутствует в почве в виде солей аммония .
Получение аммиака
Аммиак можно получить следующими способами:
Из хлорида аммония
Газообразный аммиак обычно производится в исследовательском центре путем медленного нагревания хлорида аммония (NH 4 Cl) и гашеной извести [Ca (OH) 2 ].
Рис.1: Получение аммиака
Аммиак легче воздуха, поэтому его нужно накапливать за счет нисходящего вытеснения воздуха. Поскольку он хорошо растворяется в воде, его нельзя накапливать. Пропускание газообразного аммиака через негашеную известь (CaO) сушит ее. Аммиак является незаменимым газом, поэтому его нельзя осушить, пропуская его через концентрированную серную кислоту или пятиокись фосфора (P 2 O 5 ), поскольку он реагирует с ними, образуя сульфат аммония или фосфат аммония по отдельности.
Хлорид кальция также нельзя использовать для осушки газообразного аммиака, так как он структурирует аммиаки с помощью CaCl 2
Гидролизом нитридов металлов
Гидролиз нитридов металлов, таких как нитриды магния и алюминия, водой или щелочами, также может дать газообразный аммиак.
Производство аммиака
Процесс Хабера
Получение аммиака по методике Габера включает прямое смешивание азота и водорода.
Эта реакция ( a ) экзотермическая, ( b ) обратимая и ( c ) протекает с уменьшением объема. Согласно принципу Ле Шателье, идеальные условия для размещения аммиака следующие:
Низкотемпературный
Температура должна оставаться настолько низкой, насколько это разумно (несмотря на то, что при странно низких температурах скорость реакции оказывается умеренной).Было обнаружено, что температура, повышающая выход аммиака для реакции, является наиболее экстремальной — около 500 ° C.
Высокое давление
Поскольку процедура Габера продолжается с уменьшением объема, она поддерживается высоким давлением. На практике используется давление 200-900 атмосфер.
Катализатор
Импульс обычно используется для увеличения скорости реакции. Тонко изолированное железо, содержащее молибден или оксид алюминия, используется в качестве стимула.Молибден или оксид алюминия (Al 2 O 3 ) выступают в качестве промотора и увеличивают производительность импульса. Было обнаружено, что смесь оксида железа и алюмината калия работает более адекватно.
Рис. 2: Производственное предприятие, используемое в процессе Габера
Сырьевая база
Газообразные азот и водород, используемые в качестве сырого материала в методике Габера, получают следующим образом.
Азот получают из жидкого воздуха, а водород из воды путем электролиза.
Водород может быть получен из водяного газа (смесь CO и H 2 ) с помощью процесса Bosch.
Водяной газ можно получить, пропустив пар над сильно раскаленным коксом.
При барботировании смеси водяного газа через воду CO 2 удаляется, как показано выше.
Смесь диоксида углерода, водорода и азота может быть получена путем обработки смеси водяного газа (CO + H 2 ), генераторного газа (CO + N 2 ) водяным паром в присутствии оксида железа — хрома. оксидный катализатор при 450 ° С.
Двуокись углерода можно выделить путем пропускания через воду под давлением.
Завод
Ниже приведены компоненты и процессы завода, производящего аммиак.
Компрессор
Комбинация водорода и азота в соотношении 1: 3 (по объему) сжимается до давления 200-900 атмосфер. Затем сжатый газ направляют в конвертер аммиака.
Рис.3: Конвертер аммиака
Преобразователь
Конвертер аммиака производится из хромованадиевой стали. Обычно он составляет 1,3 метра в высоту и 1 метр в диаметре. Преобразователь снабжен теплообменником в верхней части, а импульс упакован в фокальном сегменте преобразователя.Есть процесс подогрева комбинации газов. После того, как смесь газов проходит через отсек в основании, газы движутся вокруг импульса, поддерживаемого при 450-500 ° C, а затем проходят в теплообменник. Газы в конце попадают в камеру катализатора с образованием аммиака. Перед поступлением в конденсаторы конечный продукт и дополнительно непрореагировавшие газы проходят по каналам теплообменника и обменивают свое тепло на приближающуюся смесь газа, содержащую азот и водород.
Конденсаторы
Охлаждает и плавит аммиак. Консолидированный аммиак, называемый «щелочным аммиаком», заполняется в камеры под давлением.
Циркуляционный насос
Часть газов азота и водорода не конденсируется и проходит через конвертер.
Состав аммиака
Аммиак — ковалентный атом, о чем свидетельствует его точечная структура. Форма частицы аммиака обусловлена перекрытием орбиталей трех водородных и трех гибридных sp3-орбиталей азота в структуре центрального атома.Четвертая гибридная орбиталь sp3 задействована неподеленной парой. Это придает частицам аммиака треугольную пирамидальную форму. Край связи H-N-H составляет 107,3 °, что несколько не совсем соответствует тетраэдрическому краю 109 ° 28. Это происходит на том основании, что отталкивание пары связей — одиночной пары толкает связи N-H несколько внутрь. В твердом и жидком состояниях аммиак связан водородными связями.
Рис. 4: Тригонально-пирамидальная форма аммиака
Фиг.5: Точечная структура аммиака
Физические свойства аммиака
Аммиак — это газ без цвета .
Имеет резкий резкий запах с мыльным привкусом . В момент внезапного вдоха он атакует глаза , вызывая слезы .
Он на легче воздуха и, таким образом, собирается за счет нисходящего смещения воздуха .
Очень хорошо растворим в воде : Один объем воды разбивает около 1300 объемов газообразного аммиака. Газ не может собираться над водой из-за его высокой растворимости в воде из-за водородных связей.
Его можно легко расплавить при комнатной температуре , применив давление около 8-10 атмосфер .
Аммиак жидкий пузырьков на 239.6 К (-33,5 ° C) при давлении в одну атмосферу . Он имеет высокое значение скрытой теплоты парообразования (1370 Дж на каждый грамм) и впоследствии используется в составе холодильных установок ледогенераторов.
Жидкий аммиак затвердевает при 195,3 К (-77,8 ° C) с образованием твердого вещества , белого кристаллического по внешнему виду.
Химические свойства аммиака
Термическая стабильность
Аммиак исключительно инертен .В любом случае он может быть разложен на водород и азот, продвигаясь через металлические импульсы, которые были нагреты, или когда через него проходит электрический разряд.
Горючесть
Аммиак легко воспламеняется в воздухе. Тем не менее, он будет гореть в присутствии кислорода
Оксид азота получается, когда смесь аммиака и воздуха продвигается над платино-родиевым импетусом при 800 ° C
Базовый персонаж
Частица аммиака имеет твердую склонность отдавать свою неподеленную пару электронов азота различным атомам.Следовательно, он действует как сильная база Льюиса . В водных устройствах NH 3 ионизируется в соответствии с реакцией.
Константа равновесия при 298 K для этой реакции составляет 1,8 x 10 -5
% PDF-1.4 % 2221 0 объект> endobj xref 2221 92 0000000016 00000 н. 0000003305 00000 н. 0000003518 00000 н. 0000002183 00000 п. 0000003571 00000 н. 0000003700 00000 н. 0000003859 00000 н. 0000004040 00000 н. 0000005100 00000 н. 0000005264 00000 н. 0000007168 00000 н. 0000008228 00000 н. 0000009299 00000 н. 0000010375 00000 п. 0000011442 00000 п. 0000012506 00000 п. 0000013572 00000 п. 0000013730 00000 п. 0000013908 00000 п. 0000014082 00000 п. 0000014250 00000 п. 0000014414 00000 п. 0000014582 00000 п. 0000015041 00000 п. 0000015339 00000 п. 0000015413 00000 п. 0000015494 00000 п. 0000015614 00000 п. 0000015714 00000 п. 0000015763 00000 п. 0000015899 00000 н. 0000015948 00000 н. 0000016052 00000 п. 0000016152 00000 п. 0000016289 00000 п. 0000016338 00000 п. 0000016428 00000 п. 0000016523 00000 п. 0000016688 00000 п. 0000016736 00000 п. 0000016822 00000 п. 0000016907 00000 п. 0000017023 00000 п. 0000017071 00000 п. 0000017177 00000 п. 0000017225 00000 п. 0000017272 00000 п. 0000017378 00000 п. 0000017426 00000 п. 0000017542 00000 п. 0000017590 00000 п. 0000017730 00000 п. 0000017778 00000 п. 0000017931 00000 п. 0000017979 00000 п. 0000018093 00000 п. 0000018232 00000 п. 0000018389 00000 п. 0000018437 00000 п. 0000018538 00000 п. 0000018641 00000 п. 0000018749 00000 п. 0000018797 00000 п. 0000018902 00000 п. 0000018950 00000 п. 0000018998 00000 п. 0000019115 00000 п. 0000019163 00000 п. 0000019286 00000 п. 0000019334 00000 п. 0000019446 00000 п. 0000019494 00000 п. 0000019638 00000 п. 0000019686 00000 п. 0000019734 00000 п. 0000019782 00000 п. 0000019911 00000 п. 0000019959 00000 п. 0000020130 00000 н. 0000020178 00000 п. 0000020309 00000 п. 0000020357 00000 п. 0000020475 00000 п. 0000020523 00000 п. 0000020571 00000 п. 0000020619 00000 п. 0000020667 00000 п. 0000020715 00000 п. 0000020763 00000 п. 0000020812 00000 п. 0000020861 00000 п. 0000003084 00000 н. трейлер ] >> startxref 0 %% EOF 2224 0 obj> поток xb«b`c`2J 9 & 8 (00 (r80 (08 YNn EI
1:12) понять, как использовать расчет значений Rf для идентификации компонентов смеси
перейти к содержанию- Темы
- Списки характеристик
- Разделы спецификаций
- 1 Принципы химии
- (а) Состояния вещества
- (б) Элементы, соединения и смеси
- (в) Атомная структура
- (г) Периодическая таблица
- (e) Химические формулы, уравнения и расчеты
- (f) Ионная связь
- 1:37 понять, как образуются ионы в результате потери или усиления электронов
- 1:38 узнать заряды этих ионов: металлы в группах 1, 2 и 3, неметаллы в группах 5, 6 и 7, Ag⁺, Cu²⁺, Fe²⁺, Fe³⁺, Pb²⁺, Zn²⁺, водород (H⁺), гидроксид (OH⁻), аммоний (NH₄⁺), карбонат (CO₃²⁻), нитрат (NO₃⁻), сульфат (SO₄²⁻)
- 1:39 напишите формулы для соединений, образованных между ионами, перечисленными в 1:38
- 1:40 нарисуйте пунктирные диаграммы, чтобы показать образование ионных соединений путем переноса электрона, ограниченное комбинациями элементов из групп 1, 2, 3 и 5, 6, 7, необходимо показать только внешние электроны
- 1:41 un понять ионную связь с точки зрения электростатического притяжения
- 1:42 понять, почему соединения с гигантской ионной решеткой имеют высокие точки плавления и кипения
- 1:43 Знайте, что ионные соединения не проводят электричество в твердом состоянии, но проводят электричество при расплавлении и в водный раствор
- (ж) Ковалентная связь
- 1:44 знайте, что ковалентная связь образуется между атомами за счет совместного использования пары электронов
- 1:45 понимайте ковалентные связи с точки зрения электростатического притяжения
- 1: 46 понять, как использовать точечные и перекрестные диаграммы для представления ковалентных связей в: двухатомных молекулах, включая водород, кислород, азот, галогены и галогениды водорода, неорганических молекулах, включая воду, аммиак и диоксид углерода, органических молекулах, содержащих до двух атомов углерода , включая метан, этан, этен и те, которые содержат атомы галогена
- 1:47 объясняют, почему вещества с простой молекулярной структурой s — газы или жидкости, или твердые вещества с низкими температурами плавления и кипения.Термин «межмолекулярные силы притяжения» может использоваться для обозначения всех сил между молекулами
- 1:48 объясняет, почему точки плавления и кипения веществ с простой молекулярной структурой в целом увеличиваются с увеличением относительной молекулярной массы
- 1:49 объясняют, почему вещества с гигантскими ковалентными структурами представляют собой твердые тела с высокими температурами плавления и кипения
- 1:50 объясняют, как структуры алмаза, графита и фуллерена C 60 влияют на их физические свойства, включая электропроводность и твердость.
- 1:51 знайте, что ковалентный соединения обычно не проводят электричество
- (h) Металлические связи
- (i) Электролиз
- 2 Неорганическая химия
- (a) Группа 1 (щелочные металлы) — литий, натрий и калий
- (b) Группа 7 (галогены) — хлор, бром и йод
- (c) Газы в атмосфере
- (d) Ряд реакционной способности
- 2:15 понять, как металлы могут быть расположены в ряду реактивности на основе их реакций с: водой и разбавленной соляной или серной кислотой
- 2:16 понять, как металлы могут быть расположены в ряду реактивности на основе их реакций замещения между: металлы и оксиды металлов, металлы и водные растворы солей металлов
- 2:17 знать порядок реакционной способности этих металлов: калий, натрий, литий, кальций, магний, алюминий, цинк, железо, медь, серебро, золото
- 2 : 18 знать условия, при которых ржавеет железо
- 2:19 понять, как можно предотвратить ржавление железа с помощью: барьерных методов, цинкования и протекторной защиты
- 2:20 с точки зрения получения или потери кислорода и потери или увеличения электронов, поймите термины: окисление, восстановление, окислительно-восстановительный потенциал, окислитель, восстановитель, с точки зрения получения или потери кислорода и потери или усиления электронов
- 2:21 Практически: исследуйте реакции между ди лютная соляная и серная кислоты и металлы (например,грамм. магний, цинк и железо)
- (e) Извлечение и использование металлов
- (f) Кислоты, щелочи и титрование
- (g) Кислоты, основания и солевые препараты
- 2:34 знать общие правила прогнозирования растворимость ионных соединений в воде: обычные соединения натрия, калия и аммония растворимы, все нитраты растворимы, обычные хлориды растворимы, кроме серебра и свинца (II), обычные сульфаты растворимы, кроме сульфатов бария, кальция и свинец (II), обычные карбонаты нерастворимы, за исключением натрия, калия и аммония, обычные гидроксиды нерастворимы, за исключением гидроксидов натрия, калия и кальция (гидроксид кальция слабо растворим)
- 2:35 понять кислоты и основания с точки зрения переноса протона
- 2:36 понимаем, что кислота является донором протона, а основание — акцептором протона
- 2:37 описывают реакции соляной кислоты, серной кислоты и азотной кислоты с металлами, основания и карбонаты металлов (исключая реакции между азотной кислотой и металлами) с образованием солей
- 2:38 известно, что оксиды металлов, гидроксиды металлов и аммиак могут действовать как основания, а щелочи — это основания, растворимые в воде
- 2: 39 описывают эксперимент по приготовлению чистого сухого образца растворимой соли, исходя из нерастворимого реагента
- 2:40 (только Triple) описывают эксперимент по приготовлению чистого сухого образца растворимой соли, исходя из кислоты и щелочь
- 2:41 (только Triple) описать эксперимент по приготовлению чистого сухого образца нерастворимой соли, исходя из двух растворимых реагентов
- 2:42 Практически: приготовить образец чистого сухого гидратированного сульфата меди (II) кристаллы из оксида меди (II)
- 2:43 (только тройной) Практически: приготовьте образец чистого сухого сульфата свинца (II)
- (h) Химические испытания
- 2: 44a описывают испытания для этих газов : водород, диоксид углерода 9051 4
- 2:44 описывают испытания для этих газов: водород, кислород, углекислый газ, аммиак, хлор
- 2:45 описывают, как проводить испытание пламенем
- 2:46 знать цвета, образующиеся при испытаниях пламенем для этих катионов: Li⁺ красный, Na⁺ желтый, K⁺ сиреневый, Ca²⁺ оранжево-красный, Cu²⁺ сине-зеленый
- 2:47 описывают тесты для этих катионов: NH₄⁺ с использованием раствора гидроксида натрия и определение выделяющегося газа , Cu²⁺, Fe²⁺ и Fe³⁺ с использованием раствора гидроксида натрия
- 2:48 описывают испытания для этих анионов: Cl⁻, Br⁻ и I⁻ с использованием подкисленного раствора нитрата серебра, SO₄²⁻ с использованием подкисленного раствора хлорида бария, CO₃²⁻ с использованием соляной кислоты. кислоты и определения выделяющегося газа
- 2:49 описывают тест на присутствие воды с использованием безводного сульфата меди (II)
- 2:50 описывают физический тест, чтобы показать, является ли образец воды чистой
- 3 Физическая химия
- 4 Органическая химия
- (a ) Введение
- (b) Сырая нефть
- 4:07 знать, что сырая нефть представляет собой смесь углеводородов
- 4:08 описывает, как промышленный процесс фракционной перегонки разделяет сырую нефть на фракции
- 4:09 знать названия и использование основных фракций, полученных из сырой нефти: нефтеперерабатывающих газов, бензина, керосина, дизельного топлива, мазута и битума
- 4:10 знать тенденцию изменения цвета, температуры кипения и вязкости основных фракций
- 4:11 знать, что топливо — это вещество, которое при сгорании выделяет тепловую энергию
- 4:12 знать возможные продукты полного и неполного сгорания углеводородов с кислородом в воздухе
- 4:13 понять, почему окись углерода ядовита, с точки зрения ее воздействия о способности крови переносить кислород ссылки на гемоглобин не требуются
- 4:14 знайте, что в двигателях автомобилей достигнутая температура достаточно высока, чтобы позволить азоту и кислороду из воздуха вступить в реакцию, f Создание оксидов азота
- 4:15 объясните, как сжигание некоторых примесей в углеводородном топливе приводит к образованию диоксида серы
- 4:16 понять, как диоксид серы и оксиды оксидов азота способствуют возникновению кислотных дождей
- 4:17 описать как длинноцепочечные алканы превращаются в алкены и алканы с более короткой цепью путем каталитического крекинга (с использованием диоксида кремния или оксида алюминия в качестве катализатора и температуры в диапазоне 600-700 ° C)
- 4:18 объясняет, почему крекинг необходим, с точки зрения баланс между спросом и предложением для различных фракций
- (c) Алканы
- (d) Алкены
- (e) Спирты
- 4:29 (только тройной) знают, что спирты содержат функциональную группу -OH
- 4 : 30 (только Triple) понять, как рисовать структурные и отображаемые формулы для метанола, этанола, пропанола (только пропан-1-ол) и бутанола (только бутан-1-ол), и назвать каждое соединение, имена пропанол и бутанол приемлемы
- 4:31 (только Triple) знать, что этанол может быть окислен путем: сжигания на воздухе или кислороде (полное сгорание), реакции с кислородом в воздухе с образованием этановой кислоты (микробное окисление), нагревания с дихроматом калия (VI ) в разбавленной серной кислоте с образованием этановой кислоты
- 4:32 (только Triple) известно, что этанол можно получить путем: 1) реакции этена с паром в присутствии катализатора на основе фосфорной кислоты при температуре около 300 ° C и давлении около 60–70атм; и 2) ферментация глюкозы в отсутствие воздуха при оптимальной температуре около 30 ° C и с использованием ферментов в дрожжах
- 4:33 (только Triple), чтобы понять причины ферментации в отсутствие воздуха и при оптимальная температура
- (f) Карбоновые кислоты
- (g) Сложные эфиры
- (h) Синтетические полимеры
- 4:44 Известно, что аддитивный полимер образуется путем соединения множества небольших молекул, называемых мономерами
- 4:45 понять, как изобразить повторяющееся звено аддитивного полимера, включая поли (этен), поли (пропен), поли (хлорэтен) и (поли) тетрафторэтен
- 4:46 понять, как вывести структуру мономера из повторяющегося звена аддитивного полимера и наоборот
- 4:47 объясняют проблемы при утилизации аддитивных полимеров, в том числе: их инертность и неспособность к биоразложению, образование токсичных газов при их сжигании
- 4:48 (только тройной) знаю, что co Конденсационная полимеризация, при которой дикарбоновая кислота реагирует с диолом, дает полиэфир и воду
- 4:49 (только тройной) Поймите, как написать структурную и отображаемую формулу полиэфира, показывая повторяющуюся единицу, учитывая формулы мономеры, из которых он образован, в том числе реакция этандиовой кислоты и этандиола:
- 4:50 (только тройной) известно, что некоторые полиэфиры, известные как биополэфиры, являются биоразлагаемыми
- 1 Принципы химии
- testMyself 914739 Links.



 Речь идет о следующих реакциях: —
Речь идет о следующих реакциях: — Ликер измеряется по количеству унций концентрированного масла купороса, необходимого для нейтрализации одного галлона его; например, для ликера «восемь унций» требуется восемь унций масла купороса для соединения с аммиаком из одного галлона.С газовым щелоком смешивается или реже смола, но при стоянии она оседает на дно резервуара. Затем прозрачный щелок перегоняют для отделения аммиака. Есть несколько видов аппаратов для этой перегонки. В простейшей форме газовый щелок нагревают в одном кубе до тех пор, пока не будут удалены все летучие соли, а затем его втягивают в другой куб, куда добавляют «известковое молоко» и снова нагревают до тех пор, пока фумд-соли не разложатся и аммиак унесен. Аммиак и летучие соли конденсируются в сосуде, содержащем серную или соляную кислоту.Часть сероводорода и других газов с неприятным запахом выходит из абсорбционной емкости и направляется в дымоход или разлагается в печи Клауса. В Англии большая часть газового щелока перегоняется в кубах Коффи, но, поскольку использовать известь в этих кубах неудобно, большая часть фиксированных солей теряется.
Ликер измеряется по количеству унций концентрированного масла купороса, необходимого для нейтрализации одного галлона его; например, для ликера «восемь унций» требуется восемь унций масла купороса для соединения с аммиаком из одного галлона.С газовым щелоком смешивается или реже смола, но при стоянии она оседает на дно резервуара. Затем прозрачный щелок перегоняют для отделения аммиака. Есть несколько видов аппаратов для этой перегонки. В простейшей форме газовый щелок нагревают в одном кубе до тех пор, пока не будут удалены все летучие соли, а затем его втягивают в другой куб, куда добавляют «известковое молоко» и снова нагревают до тех пор, пока фумд-соли не разложатся и аммиак унесен. Аммиак и летучие соли конденсируются в сосуде, содержащем серную или соляную кислоту.Часть сероводорода и других газов с неприятным запахом выходит из абсорбционной емкости и направляется в дымоход или разлагается в печи Клауса. В Англии большая часть газового щелока перегоняется в кубах Коффи, но, поскольку использовать известь в этих кубах неудобно, большая часть фиксированных солей теряется. Газовый щелок, нагретый в выпрямителе, проходит в анализатор, где летучие соли аммиака и свободный аммиак отделяются и проходят через выпрямитель по пути в абсорбционный сосуд.Более современные аппараты Фельдмана, Гримеберга и Блюма сейчас широко используются на европейском континенте и в Америке. Аппарат Фельдмана (рис. 54) наиболее широко используется в этой стране. Газовый щелок всасывается из отстойника (F) в экономайзер (E), который состоит из длинной цилиндрической оболочки, содержащей несколько узких трубок, по которым протекает газовый щелок. В абсорбционной емкости (D) находится серная кислота, которая соединяется с парами аммиака, выходящими из куба по трубе (G).Высвободившиеся сероводород и диоксид углерода (D) собираются под колпаком. Теплота реакции между кислотой и аммиаком в значительной степени повышает температуру этих газов. Они проходят через выпускную трубу во внешнюю рубашку или кожух, окружающий трубы в экономайзере, где они нагревают газовый щелок, протекающий по маленьким трубкам, так что он становится горячим, когда достигает верхней части полотенца »(AB ) через трубу (K).
Газовый щелок, нагретый в выпрямителе, проходит в анализатор, где летучие соли аммиака и свободный аммиак отделяются и проходят через выпрямитель по пути в абсорбционный сосуд.Более современные аппараты Фельдмана, Гримеберга и Блюма сейчас широко используются на европейском континенте и в Америке. Аппарат Фельдмана (рис. 54) наиболее широко используется в этой стране. Газовый щелок всасывается из отстойника (F) в экономайзер (E), который состоит из длинной цилиндрической оболочки, содержащей несколько узких трубок, по которым протекает газовый щелок. В абсорбционной емкости (D) находится серная кислота, которая соединяется с парами аммиака, выходящими из куба по трубе (G).Высвободившиеся сероводород и диоксид углерода (D) собираются под колпаком. Теплота реакции между кислотой и аммиаком в значительной степени повышает температуру этих газов. Они проходят через выпускную трубу во внешнюю рубашку или кожух, окружающий трубы в экономайзере, где они нагревают газовый щелок, протекающий по маленьким трубкам, так что он становится горячим, когда достигает верхней части полотенца »(AB ) через трубу (K). В башне свободный аммиак.и его летучие соли вытесняются паром, который проходит через него. Щелок, содержащий фиксированные соли аммиака, затем проходит в нижнюю часть (AB), где он смешивается с «известковым молоком», в то время как вдувается пар. Затем смесь перетекает через трубу (M) в более мелкий дистиллятор (C ), где весь аммиак, высвобождаемый известью, вытесняется струей пара из S (S). Этот аммиак p проходит через (0 N) в первое полотенце ‘, где он смешивается с газом, выходящим из (AB), и абсорбируется в (D).Отработанные щелоки выходят через трубу (P), а осадок солей кальция, образованный в (B), отводится через равные промежутки времени через (R). Аппарат может работать без остановки месяцами.
В башне свободный аммиак.и его летучие соли вытесняются паром, который проходит через него. Щелок, содержащий фиксированные соли аммиака, затем проходит в нижнюю часть (AB), где он смешивается с «известковым молоком», в то время как вдувается пар. Затем смесь перетекает через трубу (M) в более мелкий дистиллятор (C ), где весь аммиак, высвобождаемый известью, вытесняется струей пара из S (S). Этот аммиак p проходит через (0 N) в первое полотенце ‘, где он смешивается с газом, выходящим из (AB), и абсорбируется в (D).Отработанные щелоки выходят через трубу (P), а осадок солей кальция, образованный в (B), отводится через равные промежутки времени через (R). Аппарат может работать без остановки месяцами.  Таким образом, летучие соли аммиака вытесняются теплом этих паров, вместе с ними уходят в резервуары для абсорбции кислоты, а газовый щелок втягивается в первую емкость и там обрабатывается известью. Это Молоток. Газообразный аммиак, высвобождаемый в любом из описанных выше кубов, обычно абсорбируется серной кислотой. Если используется разбавленная кислота (от 800 до 1000 TW), не происходит отделения кристаллов сульфата аммония в сатураторе, и щелок легко очищается от смолы и взвешенных примесей перед погружением для кристаллизации.В результате получается продукт самого светлого цвета. Если используется более концентрированная кислота (1400 Tw.), В сатураторе происходит отделение кристаллов сульфата аммония, и они «вылавливаются». Но они часто обесцвечиваются, так как у спиртного еще не было шанса осветлить отстаиванием. Как только кристаллы удаляются, в сатматор небольшим потоком вводится свежая кислота. Он всегда прикрыт крышкой или колпаком, через который по трубе отводятся грязные газы, состоящие в основном из сероводорода.
Таким образом, летучие соли аммиака вытесняются теплом этих паров, вместе с ними уходят в резервуары для абсорбции кислоты, а газовый щелок втягивается в первую емкость и там обрабатывается известью. Это Молоток. Газообразный аммиак, высвобождаемый в любом из описанных выше кубов, обычно абсорбируется серной кислотой. Если используется разбавленная кислота (от 800 до 1000 TW), не происходит отделения кристаллов сульфата аммония в сатураторе, и щелок легко очищается от смолы и взвешенных примесей перед погружением для кристаллизации.В результате получается продукт самого светлого цвета. Если используется более концентрированная кислота (1400 Tw.), В сатураторе происходит отделение кристаллов сульфата аммония, и они «вылавливаются». Но они часто обесцвечиваются, так как у спиртного еще не было шанса осветлить отстаиванием. Как только кристаллы удаляются, в сатматор небольшим потоком вводится свежая кислота. Он всегда прикрыт крышкой или колпаком, через который по трубе отводятся грязные газы, состоящие в основном из сероводорода. Их часто направляют в печь Клауса (стр. 85) и разлагают для извлечения серы, что позволяет избежать загрязнения атмосферы. Недавний патент «предусматривает сжигание этого газа в атмосфере, сильно пропитанной диоксидом серы, в результате чего происходит следующая реакция: —
Их часто направляют в печь Клауса (стр. 85) и разлагают для извлечения серы, что позволяет избежать загрязнения атмосферы. Недавний патент «предусматривает сжигание этого газа в атмосфере, сильно пропитанной диоксидом серы, в результате чего происходит следующая реакция: — Сырьем являются волосы, «мякоть» кожевенных заводов, обрезки кожи и т. Д. Их сушат и помещают в вертикальный чугунный цилиндр, снабженный люком вверху и внизу, а также через большую перфорированную трубу, проходящую через центр, примерно на 3/4 диаметра вверх. Горячие дымовые газы нагнетаются. воздушным компрессором через трубы пароперегревателя (печь, содержащая змеевики трубы, нагретые до яркого тепла катушки), и в нижнюю часть цилиндра, где они выходят через перфорированную трубу и вступают в прямой контакт с углем и , животный мир.* Летучие продукты нагрева выходят в верхней части реторты в гидравлическую магистраль, аналогичную тем, которые используются на газовых заводах. Смолистое вещество оседает в основном, а газы проходят через конденсаторы, которые представляют собой цилиндры с 4-дюймовыми трубками. Как конденсированные щелоки, так и газы проходят в абсорбционные резервуары, содержащие воду. Неабсорбированные газы проходят через «скруббер», такой же, как тот, который используется для газового щелока, для удаления последних следов аммиака. Промытые газы сжигаются под ретортой.Щелок, производимый в абсорберах и скрубберах, перегоняется в аммиачном перегонном кубе, обычно используется установка Фельдмана.
Сырьем являются волосы, «мякоть» кожевенных заводов, обрезки кожи и т. Д. Их сушат и помещают в вертикальный чугунный цилиндр, снабженный люком вверху и внизу, а также через большую перфорированную трубу, проходящую через центр, примерно на 3/4 диаметра вверх. Горячие дымовые газы нагнетаются. воздушным компрессором через трубы пароперегревателя (печь, содержащая змеевики трубы, нагретые до яркого тепла катушки), и в нижнюю часть цилиндра, где они выходят через перфорированную трубу и вступают в прямой контакт с углем и , животный мир.* Летучие продукты нагрева выходят в верхней части реторты в гидравлическую магистраль, аналогичную тем, которые используются на газовых заводах. Смолистое вещество оседает в основном, а газы проходят через конденсаторы, которые представляют собой цилиндры с 4-дюймовыми трубками. Как конденсированные щелоки, так и газы проходят в абсорбционные резервуары, содержащие воду. Неабсорбированные газы проходят через «скруббер», такой же, как тот, который используется для газового щелока, для удаления последних следов аммиака. Промытые газы сжигаются под ретортой.Щелок, производимый в абсорберах и скрубберах, перегоняется в аммиачном перегонном кубе, обычно используется установка Фельдмана.