ГОМЕОСТАТИЧЕСКАЯ ПРОЛИФЕРАЦИЯ КАК ОСНОВА НЕИЗБЕЖНОГО ФОРМИРОВАНИЯ ТОТАЛЬНОГО ИММУНОДЕФИЦИТА | Козлов
1. Козлов В.А. Свободная внеклеточная ДНК в норме и при патологии // Медицинская иммунология. 2013. Т. 15, № 5. С. 399-412. [Kozlov V.A. Svobodnaya vnekletochnaya DNK v norme i pri patologii [Free, extracellular dna in norm and pathology]. Meditsinskaya immunologiya = Medical Immunology, 2013, Vol. 15, no. 5, pp. 399-412].
2. Heninger A.K., Theil A., Petzold C., Huebel N., Kretschmer K., Bonifacio E., Monti P. IL-7 abrogates
3. suppressive activity of human CD4+CD25+FoxP3+ regulatory T cells and allows expansion of alloreactive and autoreactive T cells. J. Immunol., 2012, Vol. 189, no. 12, pp. 5649-5658.
4.
5. Kieper W.C., Burghardt J.T., Surt C.D. A role for TCR affinity in regulating na ve T cell homeostasis. J. Immunol., 2004, Vol. 172, no. 1, pp. 40-44.
6. Kimmig S., Przybylski G.K., Schmidt C.A., Laurisch K., M wes B., Radbruch A., Thiel A. Two subset of naive helper cells with distinct T cell receptor excision circle content in human adult peripheral blood. J. Exp. Med., 2002, Vol. 195, no. 6, pp. 789-794.
7. Koetz K., Bryl E., Spickschen K., O’Fallon W.M., Goronzy J.J., Weyand C.M. T cell homeostasis in patients with rheumatoid arthritis. Proc Natl Acad Sci USA, 2000, Vol. 97, no. 16, pp. 9203-9208.
16, pp. 9203-9208.
8. Lario M., Munoz L., Ubeda M., Borrero M.-J., Martinez J. Defective thymopoiesis and poor peripheral homeostatic replenish-ment of T-helper cells cause T-cell lymphopenia in cirrhosis. J. Hepatology, 2013, Vol. 59, pp. 723-730.
9. Liu Y., Lai L., Chen Q., Song Y., Xu S., Ma F., Wang X., Wang J., Yu H., Cao X., Wang Q. MicroRNA-494 is required for the accumulation and function of tumor-expanded myeloid-derived suppressor cells via targeting of PTEN. J. Immunol., 2012, Vol. 188, pp. 5500-5510.
10. Nesic D., Vukmanoviċ S. MHC class I is required for peripheral accumulation of CD8+ thymic emigrants. J. Immunol., 1998, Vol. 160, no. 8, pp. 3705-3712.
 , Moresi R., Donnini A., Lisa R.M. Reference values for CD4+ and CD8+ T lymphocytes with naïve or memory phenotype and their association with mortality in the elderly. Gerontology, 2009, Vol. 55, pp. 314-321.
, Moresi R., Donnini A., Lisa R.M. Reference values for CD4+ and CD8+ T lymphocytes with naïve or memory phenotype and their association with mortality in the elderly. Gerontology, 2009, Vol. 55, pp. 314-321.12. Sport s C., Hakim F.T., Memon S.A., Zhang H., Chua K.S., Brown M.R., Fleisher T.A., Krumlauf M.C., Babb R.R., Chow C.K., Fry T.J., Engels J., Buffet R., Morre M., Amato R.J., Venzon D.J., Korngold R., Pecora A., Gress R.E., Mackall C.L. Administration of rhIL-7 in humans increases in vivo TCR repertoire diversity by preferential expansion of na ve T cell subsets. J. Exp. Med., 2008, Vol. 205, no. 7, pp. 1701-1714.
13. Takeda S., Rodewald H.R., Arakawa H., Bluethmann H., Shimizu T. MHC class II molecules are not required for survival of newly generated CD4+ T cell, but affect their long0term life span. Immunity, 1996, Vol. 5, no. 3, pp. 217-228.
5, no. 3, pp. 217-228.
14. Van Belle T.L., Dooms H., Boonefaes T., Wei X.Q., Leclercq G., Grooten J. IL-15 augments TCR-induced CD4+ T cell expansion in vitro by in-habiting the suppressive function of CD25 high CD4+ T cells. PLoS One, 2012, Vol. 7, no. 9, e45299.doi:10.1371.
15. Weng N.P. Telomere and adaptive immunity. Mech Ageing Dev., 2008, Vol. 129, pp. 60-66.
16. Wrzesinski S.H., Wan Y.Y., Flavell R.A. Transforming growth factor-β and immune response: implication for anticancer therapy. Clin Cancer Res., 2007, Vol. 13, no. 18, pp. 5262-5270.
Клеточный цикл, пролиферация и апоптоз это взаимосвязанные и чрезвычайно важные процессы клеточной дифференцировки и поддержания тканевого гомеостаза.
Назад в раздел |
Пролиферация.
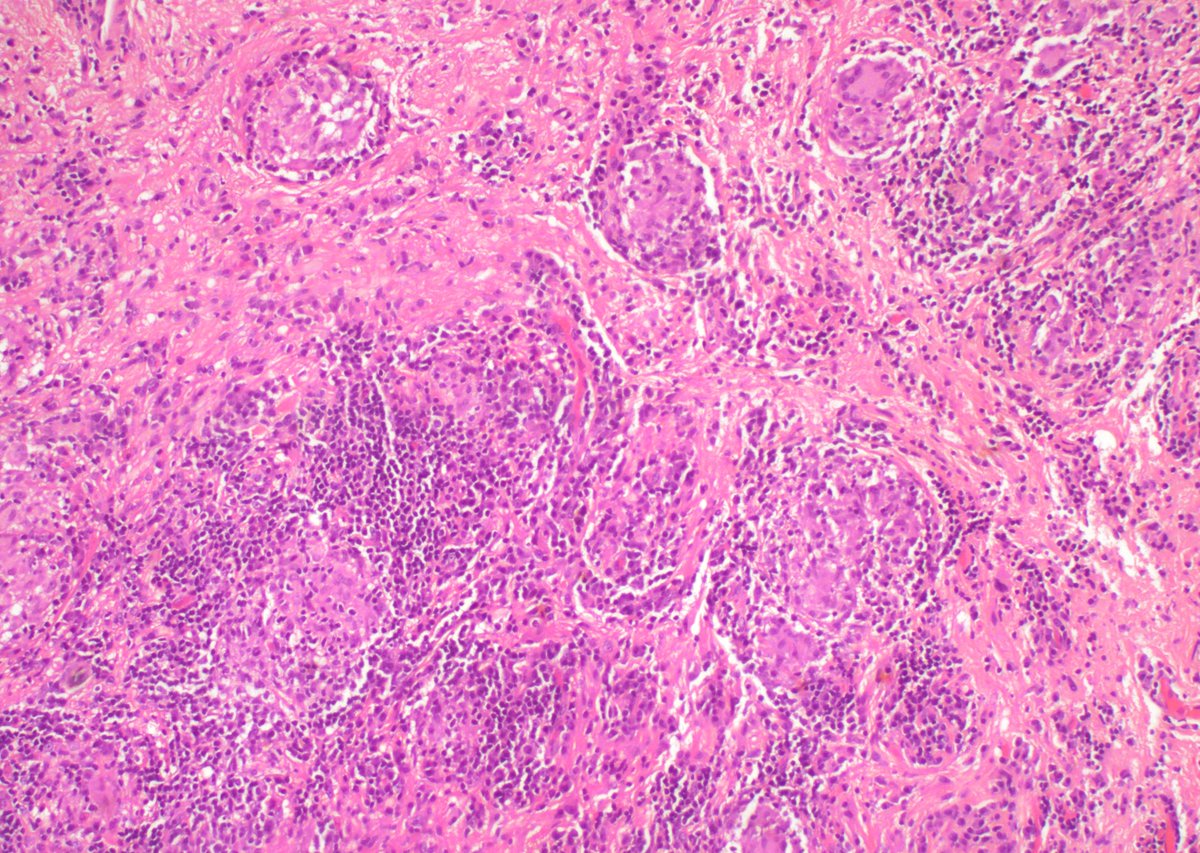
 Механизмы развития в очаге воспаления : Farmf
Механизмы развития в очаге воспаления : FarmfПролиферация. Механизмы развития в очаге воспаления
Пролиферация – процесс новообразования клеток посредством их размножения.
Пролиферация. Активация процесса
Основную функцию, связанную с инициацией пролиферации, берет на себя плазматическая мембрана клетки. Именно на ее поверхности происходят события, которые связаны с переходом покоящихся клеток в активированное состояние, предшествующее делению.
Плазматическая мембрана клеток за счет располагающихся в ней молекул-рецепторов воспринимает различные внеклеточные митогенные сигналы (фактор, вызывающий переход клетки из фазы покоя к клеточному делению) и обеспечивает транспорт в клетку необходимых веществ, принимающих участие в инициации пролиферативного ответа.
Митогенными сигналами могут служить контакты между клетками, между клеткой и матриксом, а также взаимодействие клеток с различными соединениями, стимулирующими их вступление в клеточный цикл, которые получили название факторов роста. Клетка, получившая митогенный сигнал на пролиферацию, запускает процесс деления.
При репаративных процессах в очаге воспаления регенерация клеток и фиброплазия достигаются как активацией процессов пролиферации, так и ограничением апоптоза клеток. Полного развития пролиферация соединительнотканных и органоспецифических клеточных элементов достигает после «очистки» зоны повреждения от клеточного детрита и инфекционных возбудителей воспаления тканевыми макрофагами и нейтрофилами.
В связи с этим следует отметить, что процессу пролиферации предшествует формирование нейтрофильного и моноцитарного барьеров, которые формируются по периферии зоны альтерации.
Восстановление и замещение поврежденных тканей начинается с выхода из сосудов молекул фибриногена и образования фибрина, который формирует своеобразную сетку, каркас для последующего клеточного размножения. Уже по этому каркасу распределяются в очаге репарации быстро образующиеся фибробласты (клетки соединительной ткани).
Уже по этому каркасу распределяются в очаге репарации быстро образующиеся фибробласты (клетки соединительной ткани).
Клеточные элементы органов и тканей, участвующие в пролиферации:
- К первой группе могут быть отнесены органы и ткани, клеточные элемен-ты которых обладают активной или практически неограниченной пролифе-рацией, достаточной для полного восполнения дефекта структуры в зоне воспаления (эпителий кожи, слизистых оболочек дыхательных путей).
- Ко второй группе относятся ткани с ограниченными регенерационными способностями (сухожилия, хрящи, связки, костная ткань, периферические нервные волокна).
- К третьей группе относятся те органы и ткани, где органоспецифические клеточные элементы не способны к пролиферации (сердечная мышца, клетки ЦНС).
Основными факторами, регулирующими процессы пролиферации и дифференцировки клеток в очаге воспаления, являются:
- Факторы роста, продуцируемые макрофагами, лимфоцитами, тромбоцитами, фибробластами и другими клетками, стимулированными в зоне воспаления.

- Пептид гена, родственного кальцитонину, стимулирует пролиферацию эндотелиальных клеток.
- Простагландины группы Е потенцируют регенерацию путем усиления кровоснабжения.
Пролиферация. Заживление раны.
Морфологически процесс заживления раны может протекать различно, в зависимости от степени инфицированности, общего состояния организма, характера лечебных мероприятий:
- Заживление первичным натяжением.
- Заживление вторичным натяжением.
- Заживление под струпом.
Заживление первичным натяжением происходит без нагноения и образования видимой межуточной ткани с последующим развитием линейного рубца. Протекает в ранах с ровными жизнеспособными краями.
Заживление вторичным натяжением происходит через нагноение с образованием видимой соединительной ткани и последующим развитием грубого рубца. Имеет место при развитии раневой инфекции и наличии обширных дефектов тканей, не допускающих первичного сопоставления стенок раны.
Заживление под струпом происходит без образования рубца в поверхностных ранах при сохраненном ростковом слое кожи. Быстрая регенерация эпидермиса происходит под струпом, состоящим из фибрина и форменных элементов крови.
Цитологический метод в диагностике опухолей и опухолеподобных процессов
Цитопатология, клиническая или диагностическая цитология, изучает клеточный состав патологических процессов. В качестве отдельной медицинской специальности официально признана в 1941 г. после работ Папаниколау Г. и Траута Н. К чести нашей страны разработка цитологического метода диагностики начата в 1938 г. в клинико-диагностической лаборатории Московского научно-исследовательского онкологического института им. П.А. Герцена. В 1941 г. профессор Н.Н. Шиллер-Волкова на сессии института доложила о первых результатах по исследованию выделений из влагалища, мокроты и пунктатов. В развитии цитологии можно выделить три основных этапа: эксфолиативная, в основном гинекологическая цитопатология; аспирационная цитология, бурный расцвет которой начинается с 80-х годов и связан с внедрением ультразвуковой диагностики, и современный этап развития определяется применением иммуноцитохимических и молекулярных методов исследования, а также автоматизированного скрининга в гинекологической цитологии.
Цитологический метод технически прост, быстр, сравнительно дешев, малотравматичен. Однако «легкость» цитологического метода обманчива, так как цитологическое исследование должно заканчиваться формулировкой заключения, основываясь на котором разрабатывается тактика лечения.
По способу получения материала цитологию можно подразделить на дооперационную (эксфолиативную, абразивную, аспирационную) и интраоперационную. Эксфолиативная цитология включает в себя исследование вагинальных мазков, мокроты, мочи, плевральной, перитонеальной, перикардиальной, цереброспинальной, синовиальной жидкости и т.д. Этот раздел цитологии отличается простотой техники получения большого количества различного типа клеток, в том числе воспалительного ряда. Клеточный материал может быть не очень хорошо сохранен. Для получения информативного материала с поверхности патологического очага удаляют гноевидные массы, корочки, некротический налет. Если полученный материал представляет жидкость, то в нее добавляется цитрат натрия, чтобы жидкость не свернулась.
Абразивная цитология получает материал из определенного участка внутренних органов, в том числе исследуются субэпителиальные поражения с помощью фиброоптических инструментов. При таком взятии материала клетки хорошо сохраняются, и препараты легко интерпретировать. Материал получают из шейки матки, вагины, эндометрия, респираторного, желудочно-кишечного, мочеполового тракта.
Тонкоигольная биопсия в настоящее время позволяет получить материал практически из любого органа. Метод постоянно совершенствуется и дает оптимальные результаты, что делает его в плане диагностики высокоэффективным и экономичным.
Взятый для цитологического исследования материал помещают на край предметного стекла и другим предметным или покровным стеклом равномерно, сильно не надавливая, тонким слоем распределяют по всей поверхности препарата.
В последние годы помимо рутинных цитологических мазков для получения качественных монослойных цитологических препаратов используется жидкостная система: пунктаты вносятся в специальную среду накопления, после чего центрифугируются в режиме 1000 оборотов в течение 5 минут при среднем ускорении на центрифуге (Суtospin-3, Суtospin-4). Применение методики жидкостной цитологии имеет ряд преимуществ: обеспечивает сохранность клеточных структур, уменьшает фон, клетки сосредотачиваются в одном месте – «окошке», что сокращает время просмотра препарата и значительно экономит дорогие сыворотки при проведении иммуноцитохимического исследова-
Применение методики жидкостной цитологии имеет ряд преимуществ: обеспечивает сохранность клеточных структур, уменьшает фон, клетки сосредотачиваются в одном месте – «окошке», что сокращает время просмотра препарата и значительно экономит дорогие сыворотки при проведении иммуноцитохимического исследова-
ния. Для создания архива и возможности последующего исследования материала используется методика Cell-block, при которой получаются препараты, занимающие промежуточное положение между цитологическими и гистологическими.
Влажная фиксация препарата в спирте сразу после взятия мазков применяется при окраске по Папаниколау. В остальных случаях мазки высушивают на воздухе, а затем фиксируют уже в лаборатории. Наиболее распространенный способ фиксации – в равных объемах спирта и эфира (смесь Никифорова). Для иммуноцитохимического исследования применяют фиксацию ацетоном. При окраске мазков используют панхромную окраску азур-эозином по методу Романовского – Гимза в различных модификациях (Лейшмана, Паппенгейма), а также окраска гематоксилином и эозином, особенно при исследовании гинекологического материала используется окраска по Папаниколау. Возможно при рутинном исследовании или специальной окраске выявление бактериальной флоры, в том числе бацилл Коха, лепры, хеликобактера, трихомонад и т.д.
Возможно при рутинном исследовании или специальной окраске выявление бактериальной флоры, в том числе бацилл Коха, лепры, хеликобактера, трихомонад и т.д.
Цитологическая диагностика основана на следующих принципах:
- Разница клеточного состава в норме и патологии.
- Оценка не одной отдельно взятой клетки, а совокупности клеток, большое значение придается фону препарата.
- Цитолог должен иметь патологоанатомический базис.
- Каждое исследование завершается формулировкой заключения.
Критерии цитологической диагностики злокачественных новообразований составляются из оценки клетки, ядра и ядрышка.
Клетка:
– увеличена в размере, иногда гигантская, редко размер близок к норме, что затрудняет цитологическую диагностику, например, при коллоидном, тубулярном раке, маститоподобном варианте долькового рака молочной железы, фолликулярном раке щитовидной железы, карциноиде, почечноклеточном светлоклеточном раке, высокодифференцированных веретеноклеточных саркомах;
– изменение формы и полиморфизм клеточных элементов;
– нарушение соотношения ядра и цитоплазмы в сторону увеличения доли ядра;
– диссоциация степени зрелости ядра и цитоплазмы, например, молодое ядро в ороговевшей цитоплазме при высокодифференцированном плоскоклеточном раке.
Ядро:
– увеличение размера, полиморфизм, бугристость, неравномерный рисунок хроматина, наиболее постоянный признак – неровность контуров, гиперхромия, фигуры клеточного деления в цитологических препаратах сравнительно редки.
Ядрышко:
– число ядрышек больше, чем в нормальной клетке, ядрышки увеличены в размере, неправильной формы.
Несмотря на присутствие критериев злокачественности у подавляющего большинства клеток, в некоторых клетках рака эти критерии могут отсутствовать или быть выражены в неполном объеме. Необходимо обращать внимание на особенности взаимного расположения клеток, характер межклеточных связей. Заключение формулируют по совокупности признаков при достаточном количестве клеточного материала. Попытка оценить мазок по неадекватно взятому материалу – наиболее частая причина ошибочных заключений.
Основные задачи цитологической диагностики состоят в следующем:
- Формулировка заключения до лечения.

- Интраоперационная срочная диагностика.
- Контроль эффективности лечения.
- Оценка важнейших факторов прогноза течения заболевания.
Цитологическое заключение до лечения включает:
- определение гистогенеза новообразований;
- установление степени дифференцировки опухолевого процесса;
- уточнение степени распространенности опухоли;
- изучение фоновых изменений;
- определение некоторых факторов прогноза;
- возможность исследования бактериальной флоры.
Современное цитологическое заключение не только констатирует наличие рака, но и указывает гистологический тип опухоли и степень дифференцировки согласно общепринятым международным классификациям (МКБ-О и ВОЗ).
Критериями достоверности цитологического метода являются результаты сопоставления с плановым гистологическим исследованием. Наибольший процент совпадений цитологического заключения с окончательным гистологическим заключением наблюдается при исследовании образований кожи, молочной, щитовидной железы, при метастатическом поражении лимфатических узлов. Результаты исследования гиперпластических процессов в эндометрии неудовлетворительны (достоверность 30–50%) и заставляют искать пути совершенствования диагностики. Достоверность цитологической диагностики патологии шейки матки составляет 75–90%. 3–24% исследований, в зависимости от локализации и способа получения материала, оказываются неудачными из-за неадекватно полученного, неинформативного материала.
Результаты исследования гиперпластических процессов в эндометрии неудовлетворительны (достоверность 30–50%) и заставляют искать пути совершенствования диагностики. Достоверность цитологической диагностики патологии шейки матки составляет 75–90%. 3–24% исследований, в зависимости от локализации и способа получения материала, оказываются неудачными из-за неадекватно полученного, неинформативного материала.
Таблица 1. Достоверность цитологических исследований
опухолей различных локализаций.
| Локализация | % совпадения цитологического и гистологического диагноза | % совпадения по данным литературы | % неудавшихся пункций |
|---|---|---|---|
| Легкое | 95,5-97 | 79-98 | 2,9-3,0 |
| Молочная железа | 95,8-97,4 | 90-96 | 2,6-8,3 |
| Лимфатические узлы | 98,4-98,7 | 90 | 1,6-10,7 |
| Кожа | 91,2-92,7 | 90-98 | 2,4-12,5 |
| Мягкие ткани (без указания гистологического типа опухоли) |
90,2-93,8 | 65-93,4 | 5-12,3 |
| Желудочно-кишечный тракт | 92,3-97,5 | 73-93,6 | 2,5-4,4 |
| Щитовидная железа | 85,5-93,2 | 57-94 | 1,6-4,2 |
| Шейка матки | 89,5-93,2 | 65-90 | 3,5-4,5 |
| Эндометрий | 78,9-84,8 | 30-90 | 3,8-15,4 |
| Почка | 86,2-89,3 | 76,4-91,3 | 7,1-11,5 |
| Экссудаты | 95,7-100 | – | 1,2-2,7 |
Уверенное цитологическое заключение о наличии злокачественного новообразования, совпадающее с клиническими симптомами и данными других диагностических исследований, расценивается как морфологическое подтверждение диагноза злокачественной опухоли. Это предъявляет к цитологическому методу высокие требования и заставляет искать пути предупреждения возможных ошибок. По характеру ошибки цитологов можно разделить на две большие группы: ложноотрицательные и ложноположительные. Ложноотрицательные заключения преобладают и приводят к гиподиагностике опухолевого процесса, чаще всего из-за небольшого количества информативного материала в пунктате. Имеются и объективные трудности в оценке изменений, связанные чаще с высокой дифференцировкой опухоли, например, практически невозможно диагностировать фолликулярный рак щитовидной железы с минимальной инвазией, трудно диагностируется тубулярный, маститоподобная форма долькового рака молочной железы.
Это предъявляет к цитологическому методу высокие требования и заставляет искать пути предупреждения возможных ошибок. По характеру ошибки цитологов можно разделить на две большие группы: ложноотрицательные и ложноположительные. Ложноотрицательные заключения преобладают и приводят к гиподиагностике опухолевого процесса, чаще всего из-за небольшого количества информативного материала в пунктате. Имеются и объективные трудности в оценке изменений, связанные чаще с высокой дифференцировкой опухоли, например, практически невозможно диагностировать фолликулярный рак щитовидной железы с минимальной инвазией, трудно диагностируется тубулярный, маститоподобная форма долькового рака молочной железы.
Гипердиагностика опухолей на нашем материале многие годы не превышает 1%, однако может служить причиной ненужного, а иногда и калечащего лечения. Истинная гипердиагностика, то есть ложное цитологическое заключение о наличии опухоли, объясняется несколькими наиболее типичными причинами.
Выраженная пролиферация клеточных элементов является наиболее частой причиной гипердиагностики рака. Например, пролиферация эпителия протоков и долек молочной железы при фиброаденоме и пролиферирующем аденозе, особенно при укрупнении ядер, наиболее часто приводит к гипердиагностике рака молочной железы. Правильной диагностике помогает анализ ядерных характеристик клеток опухоли: наличие ровных контуров ядра и равномерное распределение хроматина.
Реактивные изменения эпителия служат также нередкой причиной неадекватной цитологической диагностики. Наиболее тяжелые ошибки встречаются при ангиомиолипоме почки, при которой реактивные изменения почечного эпителия с укрупнением и полиморфизмом ядер приводят к ошибочному диагнозу высокодифференцированного почечноклеточного светлоклеточного рака. Диагностике ангиомиолипомы помогает обнаружение сосудистых структур и веретенообразных клеток, экспрессирующих виментин, десмин, НМВ-45.
Хронический аутоиммунный тиреоидит типа Хашимото сопровождается образованием сосочковоподобных структур, к оценке которых необходимо подходить осторожно и помнить, что при этом процессе реактивные изменения эпителия можно ошибочно принять за папиллярный рак щитовидной железы. Для хронических дерматитов, язв характерны атипические реактивные разрастания многослойного плоского эпителия, нередко представляющие непреодолимые трудности в дифференциальной диагностике с высокодифференцированным плоскоклеточным раком.
Выраженные дистрофические изменения клеток являются также одной из причин ошибочной цитологической диагностики. Например, выраженная жировая дистрофия гепатоцитов может привести к гипердиагностике метастаза почечноклеточного светлоклеточного рака, особенно при уже состоявшемся диагнозе рака почки.
Для хронических дерматитов, язв характерны атипические реактивные разрастания многослойного плоского эпителия, нередко представляющие непреодолимые трудности в дифференциальной диагностике с высокодифференцированным плоскоклеточным раком.
Выраженные дистрофические изменения клеток являются также одной из причин ошибочной цитологической диагностики. Например, выраженная жировая дистрофия гепатоцитов может привести к гипердиагностике метастаза почечноклеточного светлоклеточного рака, особенно при уже состоявшемся диагнозе рака почки.
Большую проблему цитологии представляет дифференциальная диагностика различных степеней диспластических изменений эпителия и внутриэпителиального рака. Присутствие при тяжелой дисплазии полиморфных крупных клеток с большими неправильно округлыми ядрами, иногда с увеличенными ядрышками, двуядерных клеток с тяжистым рисунком хроматина может быть неверно расценено как рак. При диспластических изменениях плоского эпителия необходимо учесть, что большинство клеток сходны с клетками глубоких слоев, крупные атипические клетки находятся в тесной связи с клетками без признаков атипии, имеются клетки стромы. Для объективизации дифференциальной диагностики различных степеней дисплазии и внутриэпителиального рака желательно проведение морфометрии клеток и ядер, что позволяет значительно снизить процент ошибочных заключений.
Для объективизации дифференциальной диагностики различных степеней дисплазии и внутриэпителиального рака желательно проведение морфометрии клеток и ядер, что позволяет значительно снизить процент ошибочных заключений.
Нередко причиной гипердиагностики метастатического поражения в лимфатических узлах являются комплексы клеток укрупненного эндотелия и гистиоцитов, образующих эпителиоподобные структуры, а также наличие макрофагов с содержанием бурого пигмента. При затруднениях диагностики помогает иммуноцитохимическое исследование с небольшим набором антител (VIII фактор, цитокератины, ЭМА, НМВ-45), позволяющее подтвердить или отвергнуть наличие метастазов рака или меланомы.
Во избежание ошибок морфологической диагностики большое значение имеет четкое указание на характер проведенного лечения. Например, прием довольно распространенного антибиотика тетрациклина приводит к накоплению в клетках щитовидной железы бурого пигмента и ошибочному диагнозу метастаза меланомы. Прием мерказолила при зобе сопровождается резким полиморфизмом фолликулярного эпителия, что служит причиной цитологической и даже гистологической гипердиагностики фолликулярного рака. Проведение лучевой терапии вызывает выраженные изменения не только опухолевых клеток, но и нормального эпителия: укрупнение, полиморфизм клеток, патологическое ороговение, что является причиной гипердиагностики рака.
Прием мерказолила при зобе сопровождается резким полиморфизмом фолликулярного эпителия, что служит причиной цитологической и даже гистологической гипердиагностики фолликулярного рака. Проведение лучевой терапии вызывает выраженные изменения не только опухолевых клеток, но и нормального эпителия: укрупнение, полиморфизм клеток, патологическое ороговение, что является причиной гипердиагностики рака.
Имеются и объективные диагностические проблемы, например, в дифференциальной диагностике между эндометриоидной высокодифференцированной аденокарциномой и атипической гиперплазией эндометрия, себоррейной (базальноклеточной) кератомой и базально-клеточным раком, инфекционным мононуклеозом и болезнью Ходжкина, где достаточно высокий процент ошибочных заключений и требуется дальнейшая разработка цитологических критериев диагностики.
Знание клинической картины, характера проведенного лечения, применение современных методик морфологической диагностики с использованием иммуноцитохимии и морфометрии способствует сведению случаев гипердиагностики к нулю.
Вместе с истинной цитологической гипердиагностикой существует ложная гипердиагностика, когда цитолог дает уверенное заключение о злокачественном процессе, а при гистологическом исследовании опухоли не обнаруживается, то есть фактически имеет место гистологическая гиподиагностика. Пересмотр цитологических препаратов несколькими высококвалифицированными специалистами, повторное взятие биопсии, клиническое течение заболевания в дальнейшем подтверждают результаты цитологического исследования. Больше всего ложной цитологической гипердиагностики относится к исследованию биопсийного материала из бронхов и гортани, а также при исследовании лимфатическиих узлов, когда при цитологическом исследовании выявлялись единичные комплексы анаплазированных клеток, несомненно принадлежащих раку. При приготовлении гистологических препаратов эти комплексы теряются в готовых гистологических препаратах. Реальная потеря немногочисленных опухолевых клеток при приготовлении гистологических препаратов не допускает игнорирования клиницистом данных цитологического исследования и приводит к «золотому» стандарту – совместному цитологическому и гистологическому исследованию биоптата.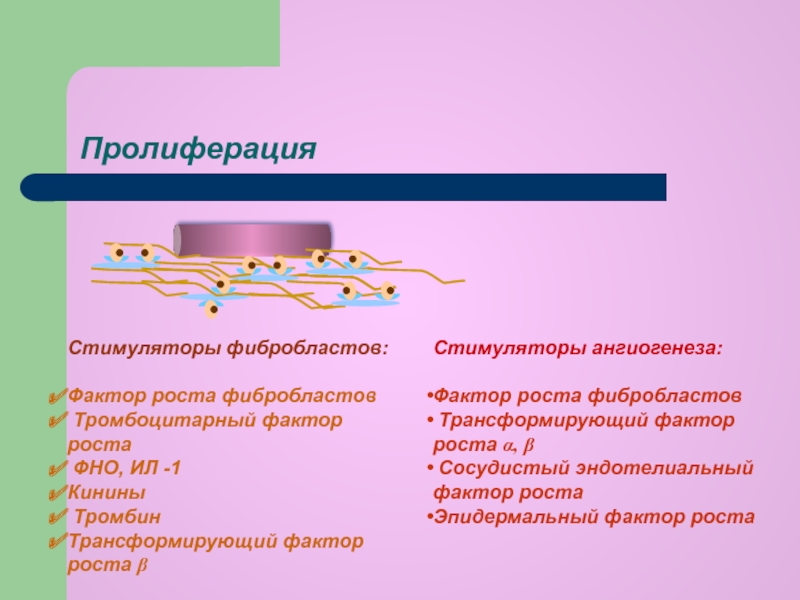
Интраоперационная цитологическая диагностика – одно из основных направлений цитологического метода исследования. Во время операции, используя цитологический метод, уточняется характер патологического процесса, степень распространенности с выявлением метастазов в лимфатические узлы, печень и другие органы, производится контроль радикальности выполненной операции с исследованием краев резекции. Роль цитологии возрастает при разработке показаний к расширенным лимфоаденэктомиям и при определении так называемых «сторожевых», или «сигнальных», лимфатических узлов, которых может быть шесть, и применение гистологического метода невозможно из-за длительности исследования. По данным ведущих клиник, ошибка срочного гистологического исследования «сторожевых» лимфатических узлов составляет 25%, поэтому они рекомендуют использовать интраоперационное цитологическое исследование отпечатков с поверхности разрезанного лимфатического узла. По нашим данным, достоверность срочного цитологического исследования по выявлению метастатического поражения лимфатических узлов составляет 97-99%.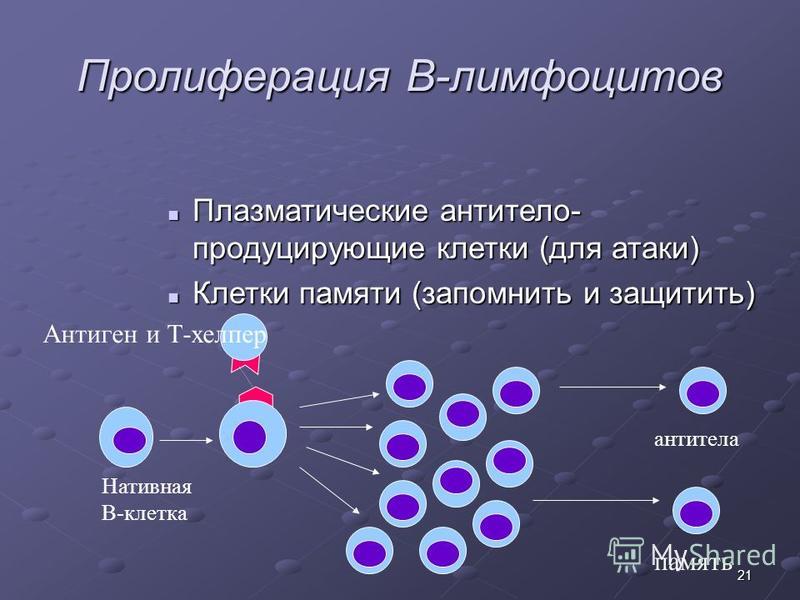
Надо отметить, что к срочному морфологическому исследованию могут быть противопоказания. Срочное интраоперационное морфологическое исследование не рекомендуется выполнять при подозрении на внутриэпителиальный рак с ограниченным очагом поражения из-за того, что не останется материала для планового гистологического исследования. Цитологические критерии внутриэпителиального рака только разрабатываются, и цитолог может дать заключение о раке, не указывая, что это Carcinoma in situ. При внутрипротоковых папилломах небольшого размера срочное гистологическое исследование лучше не выполнять, а цитологическое исследование достоверно поможет установить характер процесса.
При срочной морфологической диагностике существенно помогает макроскопическое исследование операционного материала. Опытный морфолог при визуальном исследовании уже может поставить диагноз, но для подтверждения диагноза необходимо микроскопическое исследование. Например, опухолевый узел классической звездчатой формы может быть при трех совершенно разных процессах: при раке, склерозирующем аденозе с центром Семба и липогранулеме. И только микроскопическое исследование позволяет правильно поставить диагноз.
И только микроскопическое исследование позволяет правильно поставить диагноз.
Цитологический метод позволяет в динамике, не травмируя пациента, изучать лечебный патоморфоз при химиолучевой и фотодинамической терапии.
XX столетие названо в медицинских кругах веком цитопатологии. Оценивая возможности цитологического метода, можно сказать, что есть еще возможности его развития в комбинации с другими дисциплинами и методами.
Иммуноцитохимическое исследование нередко является решающим в дифференциальной диагностике новообразований, когда при рутинном исследовании возникают непреодолимые трудности для установления гистогенеза отдельных опухолей, определения источника метастазирования, трактовки первично-множественных поражений.
За последние годы достигнут огромный прогресс в клиническом использовании различных биологических маркеров. В отличие от сывороточных маркеров, клеточные маркеры определяются непосредственно в опухолевых клетках ИЦХ исследованием, в основе которого лежит реакция антиген-антитело. В их числе онкогены, рецепторы эстрогенов и прогестерона, молекулы, опосредующие апоптоз, рецепторы факторов роста и т. д. Все эти показатели позволяют более детально изучить молекулярно-биологические особенности опухолевых клеток, ассоциированные со степенью дифференцировки, способностью к инвазии и метастазированию, чувствительностью к химиотерапии, и, следовательно, с особенностями течения и прогнозом заболевания в каждом конкретном случае.
В их числе онкогены, рецепторы эстрогенов и прогестерона, молекулы, опосредующие апоптоз, рецепторы факторов роста и т. д. Все эти показатели позволяют более детально изучить молекулярно-биологические особенности опухолевых клеток, ассоциированные со степенью дифференцировки, способностью к инвазии и метастазированию, чувствительностью к химиотерапии, и, следовательно, с особенностями течения и прогнозом заболевания в каждом конкретном случае.
Специфических маркеров дифференциальной диагностики злокачественных и доброкачественных опухолевых процессов не существует, но на сегодняшний день активно ведутся научные изыскания в решении этой проблемы. Так, равномерное окрашивание герминативных центров лимфоидных фолликулов с использованием антител bcl-2 указывает на фолликулярную лимфосаркому, в то время как негативная реакция свидетельствует о доброкачественном гиперпластическом процессе; реакция с антителами HBME-1 при ИЦХ исследовании опухолей щитовидной железы часто положительная в злокачественных новообразованиях и практически отсутствует при доброкачественных, в дифференциальной диагностике широко применяют галектин-3, экспрессирующийся карциномами щитовидной железы из А-клеток (папиллярный, фолликулярный) с отсутствием экспрессии в фолликулярных аденомах, зобах и нормальной ткани щитовидной железы.
Для установления гистогенеза и дифференциальной диагностики опухолей разработаны и постоянно совершенствуются, схемы C.R.Taylor и R.J. Cote (1994 г.). Разнообразие моноклональных антител, используемых в иммуноцитохимических исследованиях тонкоигольных пунктатов, в каждом конкретном случае позволяет ответить на вопрос, имеет ли данная опухоль эпителиальное происхождение или является саркомой, меланомой, лимфомой. Иммуноцитохимия широко применяется для иммунофенотипирования злокачественных лимфом, без чего, по современным канонам, невозможно начать лечение.
Иммуноцитохимическое исследование помогает в определении источника метастазирования при невыявленном первичном очаге. К сожалению, органоспецифических маркеров не так уж и много. К их числу могут быть отнесены специфический антиген предстательной железы (ПСA), позволяющий идентифицировать метастазы рака простаты более чем в 95% случаев; тиреоглобулин, экспрессирующийся в 92–98% фолликулярного и папиллярного рака щитовидной железы, и кальцитонин, экпрессирующийся в 80% медуллярных раков щитовидной железы В некоторых случаях рак щитовидной железы может экспрессировать и кальцитонин, и тиреоглобулин, что только с помощью иммуноферментной диагностики позволяет диагностировать диморфные А-С-клеточные раки.
Одним из первых показателей, вошедших в практику лечения больных раком молочной железы (РМЖ), и относящихся к категории клеточных маркеров, были рецепторы стероидных гормонов. Рецепторы стероидных гормонов – это белки, специфически и избирательно связывающие соответствующие стероиды после их проникновения в клетку.
По данным ВОЗ (2003 г.), экспрессия рецепторов эстрогенов (РЭ+) и прогестерона (РП+) в инвазивных протоковых раках составляет 70-80%; инвазивный дольковый рак в 70-95% экспрессирует РЭ, в 60-70% -РП, 100% экспрессия РЭ отмечена в инвазивном криброзном, муцинозных опухолях молочной железы. Эдокринная терапия наиболее эффективна у больных с первичными опухолями с высоким уровнем рецепторов стероидов. При метастатических поражениях степень реакции на эндокринную терапию также зависит от наличия РЭ и РП в опухоли: её эффективность составляет около 10–15% при гормонотрицательных опухолях, 27% при опухоли с РЭ+ и РП-, 46% при статусе РЭ- и РП+ и 75% при опухолях, содержащих РЭ+ и РП+. Рецепторположительные опухоли молочной железы имеют более высокую дифференцировку и более благоприятный прогноз.
Рецепторположительные опухоли молочной железы имеют более высокую дифференцировку и более благоприятный прогноз.
Необходимо отметить, что рецепторы гормонов в доброкачественных образованиях молочной железы еще мало изучены. Отмечено повышение числа РЭ+ клеток в нормальной ткани молочной железы с увеличением возраста, а также при склерозирующем аденозе, папилломах, фиброаденомах и листовидных опухолях. Коэкспрессия РЭ+/Ki-67+ с разной степенью выраженности и соотношения большей частью выявлялась в патологии, связанной с риском развития РМЖ.
Рецепторы эстрогенов экспрессируются в клетках рака эндометрия, яичников, шейки матки, щитовидной железы, кишечника, нейроэндокринных опухолей, в том числе карциноидов.
Иммуноцитохимическое исследование позволяет на дооперационном этапе установить важнейшие факторы прогноза опухолевого процесса и скоррегировать схемы лечения. Пролиферативная активность многих новообразований оценивается с помощью антител Ki-67 в злокачественных лимфомах, опухолях молочной, предстательной, поджелудочной железы, легких, гипофиза, толстой кишки. Обнаружена связь между значениями индекса пролиферации и степенью гистологической дифференцировки опухоли и клиническим прогнозом при раке эндометрия, яичников, легкого, молочной железы, мочевого пузыря, лимфомах, опухолях нервной системы.
Обнаружена связь между значениями индекса пролиферации и степенью гистологической дифференцировки опухоли и клиническим прогнозом при раке эндометрия, яичников, легкого, молочной железы, мочевого пузыря, лимфомах, опухолях нервной системы.
Гиперэкспрессия онкопротеина C-erbB-2(HER2/neu), являющегося рецептором эпидермального фактора роста 2-го типа, придающего клеткам свойство неограниченного деления, служит фактором риска рецидива заболевания для ряда опухолей: рака молочной железы, толстой кишки, лёгкого и др. Экспрессия онкобелка C-erbB-2 при ИГХ исследовании обнаруживается в 15–40% РМЖ. Выявление онкопротеина C-erbB-2, по мнению некоторых авторов, ассоциируется с высокой степенью злокачественности опухоли, отсутствием РЭ и РП, высокой митотической активностью, устойчивостью к химиотерапии и требует назначение герцептина.
Наличие метастазов в лимфатических узлах при опухолевом поражении является главным дискриминирующим прогностическим признаком. С помощью иммуноцитохимического исследования можно выявить единичные циркулирующие кератин-положительные клетки РМЖ в костном мозге и периферической крови. Применение ИЦХ исследования повышает выявляемость микрометастазов в лимфатических узлах на 3,2–24%.
С помощью иммуноцитохимического исследования можно выявить единичные циркулирующие кератин-положительные клетки РМЖ в костном мозге и периферической крови. Применение ИЦХ исследования повышает выявляемость микрометастазов в лимфатических узлах на 3,2–24%.
Иммуноцитохимические реакции оцениваются как качественно при уточнении гистогенеза опухоли, наличии метастаза в лимфатическом узле или другом органе, иммунофенотипировании лимфом, так и количественно – при оценке пролиферативной активности, экспрессии рецепторов гормонов в опухоли, онкопротеина С-erbB-2 и т.д. Иммуноцитохимическая реакция может быть ядерной, цитоплазменной и мембранной. Ядерная реакция проявляется интенсивным окрашиванием ядра и бывает при определении РЭ и РП, Ki–67, PCNA, p53 и т.д. Цитоплазменная реакция характеризуется диффузным окрашиванием цитоплазмы или отложением гранул в виде грубых пятен и зерен. Цитоплазменное окрашивание дают хромогранин, синаптофизин, белок S-100, виментин, десмин, тиреоглобулин, кальцитонин, цитокератины, bcl-2 и т. д. Оценка этой реакции требует большой осторожности и контроля, так как фоновое окрашивание цитоплазмы клеток может быть принято за истинную реакцию. Мембранное окрашивание наблюдается при проведении реакции с онкопротеином C-erbB-2 и ЭМА (эпителиальным мембранным антигеном). Окрашивание в таких случаях только цитоплазмы не должно учитываться как экспрессия антигена. Маркер крупноклеточной анаплазированной лимфомы CD-30 может экспрессироваться как в цитоплазме, так и на мембране клетки.
д. Оценка этой реакции требует большой осторожности и контроля, так как фоновое окрашивание цитоплазмы клеток может быть принято за истинную реакцию. Мембранное окрашивание наблюдается при проведении реакции с онкопротеином C-erbB-2 и ЭМА (эпителиальным мембранным антигеном). Окрашивание в таких случаях только цитоплазмы не должно учитываться как экспрессия антигена. Маркер крупноклеточной анаплазированной лимфомы CD-30 может экспрессироваться как в цитоплазме, так и на мембране клетки.
Для количественной оценки экспрессии маркера Мс. Carthy и соавторы разработали систему подсчета Histo score (H.S.). Система подсчета включает интенсивность иммуноцитохимической окраски, оцениваемую по 4-балльной шкале, и долю окрашенных клеток и представляет собой сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски на балл, соответствующий интенсивности реакции. Интенсивность окраски в баллах: 0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное, 4 – очень сильное окрашивание. Формула подсчета:
Формула подсчета:
Histochemical score = ∑ P(i)×i (гистосчет),
где i – интенсивность окрашивания, выраженная в баллах от 0 – 4,
Р(i) – процент клеток, окрашенных с разной интенсивностью.
Максимальное количество Histo score соответственно должно быть 400. Подсчет проводится в трех когортах по 100 опухолевых клеток в различных полях зрения (объектив х 40).
В практической работе допустимо использование полуколичественной оценки. Реакция считается отрицательной при полном отсутствии или экспрессии антигена менее 5%–10% опухолевых клеток, слабоположительной – от 5%–10% до 24% клеток, умеренно положительной – в 25%–75%, выраженной – более чем в 75% клеток. При оценке иммуноферментной реакции принимают во внимание интенсивность и полноту окрашивания цитолеммы клеток в центре опухолевого очага. Так, яркая, мембранная, беспрерывная по контуру клетки реакция обозначает выраженную экспрессию белка С-erbB-2 (+++), что в 95% случаев подтверждается амплификацией гена С-erbB-2, выявляемой с помощью FISH (флуоресцентной гибридизацией in situ).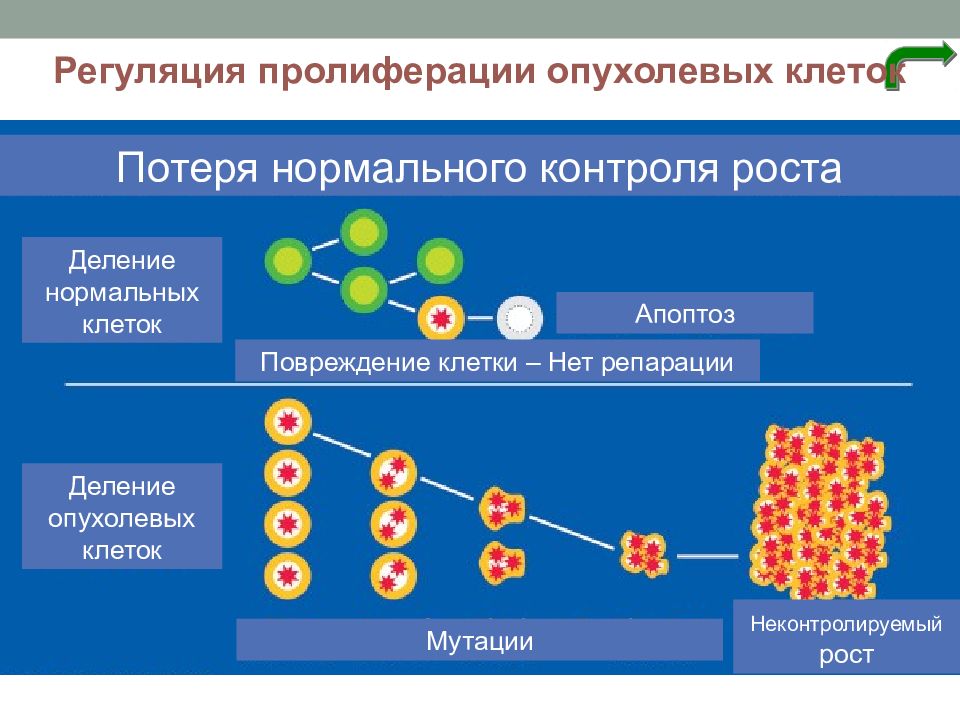
Сопоставляя данные иммуноцитохимических исследований различных опухолей с целью уточнения гистогенетической принадлежности и результатов послеоперационных морфологических заключений, получены следующие результаты: 89% совпадений при анализе опухолей щитовидной железы, 83% при уточнении гистогенеза первичной опухоли и метастазах в лимфатических узлах, 89% – при опухолях мягких тканей и кожи и 100% – при исследовании биологических жидкостей. При определении гормонального статуса РМЖ процент совпадения ИЦХ и ИГХ исследований составляет 88,3%, при исследовании пролиферативной активности – 83%, при определении онкопротеина C-erbB-2 – 93,2%.
При сравнении возможностей ИЦХ исследования при выполнении пункционной биопсии и ИГХ исследования при трепанобиопсии преимущества ИЦХ, на наш взгляд, несомненны. Пункционная биопсия – более простая процедура, не сопровождается такими осложнениями, как воспаление, кровотечение, и позволяет получить полноценный клеточный материал. При неудачной пункции и попадании в некроз, строму опухоли, окружающие ткани можно практически безболезненно повторить процедуру. Кроме того, отсутствует потеря и маскировка антигенов при проводке и депарафинизации материала с использованием агрессивных химических реагентов.
При неудачной пункции и попадании в некроз, строму опухоли, окружающие ткани можно практически безболезненно повторить процедуру. Кроме того, отсутствует потеря и маскировка антигенов при проводке и депарафинизации материала с использованием агрессивных химических реагентов.
Использование иммуноцитохимического исследования позволяет расширить возможности морфологических методов и на дооперационном этапе уточнить гистогенез, диагностировать первично-множественные поражения, степень распространения и оценить некоторые показатели прогноза и чувствительность опухоли к химиогормонотерапии.
На современном этапе развития в цитологии используются методы молекулярной и генной диагностики: гибридизация in situ, Southern Blotting, Nothern Blooting, Western Blotting, DNK Microarray и т.д) В научной и практической работе цитологи применяют проточную цитофотометрию.
Одним из путей совершенствования цитологического метода исследования является применение морфометрии, что позволяет получать объективные количественные параметры. Например, при обработке на компьютере выделены наиболее информативные морфометрические признаки, относящиеся к параметрам ядра с использованием основных диагностических морфометрических признаков: площадь, периметр, оптической плотности, коэффициент поляризации ядер, числа ядрышек, их площади и периметра. Разработаны объективные морфометрические признаки различных степеней дисплазии при дисгормонально-гиперпластических процессах молочной железы, шейки матки, что уменьшило долю субъективизма в определении различных степеней дисплазии.
Например, при обработке на компьютере выделены наиболее информативные морфометрические признаки, относящиеся к параметрам ядра с использованием основных диагностических морфометрических признаков: площадь, периметр, оптической плотности, коэффициент поляризации ядер, числа ядрышек, их площади и периметра. Разработаны объективные морфометрические признаки различных степеней дисплазии при дисгормонально-гиперпластических процессах молочной железы, шейки матки, что уменьшило долю субъективизма в определении различных степеней дисплазии.
Развиваются новые методы микроскопии: фазово-контрастная, флюоресцентная, конфокальная и т.д. Создание компьютерных систем обучения, развитие метода телеконсультации также предъявляют новые требования и, несомненно, будут способствовать развитию и совершенствованию цитологического метода диагностики.
Волченко Надежда Николаевна
д.м.н., профессор, руководитель отделения
онкоцитологии МНИОИ им.П.А.Герцена
Слово ПРОЛИФЕРАЦИЯ — Что такое ПРОЛИФЕРАЦИЯ?
Слово состоит из 12 букв: первая п, вторая р, третья о, четвёртая л, пятая и, шестая ф, седьмая е, восьмая р, девятая а, десятая ц, одиннадцатая и, последняя я,
Слово пролиферация английскими буквами(транслитом) — proliferatsiya
Значения слова пролиферация.
 Что такое пролиферация?
Что такое пролиферация?Пролиферация
Пролиферация (от лат. proles — отпрыск, потомство и fero — несу) — разрастание ткани организма путём размножения клеток делением.
ru.wikipedia.org
Пролиферация I Пролифера́ция (proliferatio; лат. proles потомство + ferre носить, приносить) новообразование клеток и внутриклеточных структур (митохондрий, эндоплазматической сети, рибосом и др.).
Медицинская эциклопедия
Пролиферация — разрастание ткани животного или растительного организма путем новообразования клеток. Различают физиологическую и патологическую пролиферации. лат.Proles — потомство + Fero — несу
glossary.ru
ПРОЛИФЕРАЦИЯ —одно из основных понятий философии науки П.
Лебедев С.А. Философия науки. — 2004Фсйерабенда, означающего размножение, максимальное увеличение разнообразия взаимно исключающих гипотез и теорий, как необходимое условие успешного развития науки.
Пролиферация (proliferation)
Пролиферация (proliferation) Пролиферация (proliferation) — Размножение клеток – увеличение числа клеток (в ткани, культуре), происходящее путем митотических делений.
www.xumuk.ru
Русский язык
Пролифера́ция, -и.
Орфографический словарь. — 2004
- пролитый
- пролиться
- пролить
- пролиферация
- пролификация
- прологарифмировавший
- прологарифмированный
Low proliferative level is a poor prognostic factor for colon adenocarcinoma | Raskin
Aim.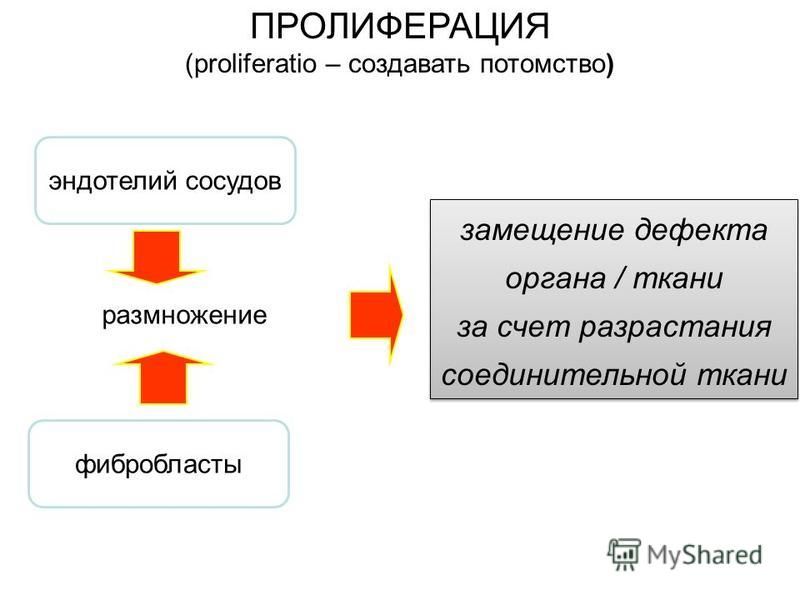 To match up the proliferative activity of colon adenocarcinoma cells with tumor stage and survival rate. Methods. Ki-67 protein expression was evaluated by immunohistochemical methods in 217 patients with primary colon adenocarcinoma. After epitope retrieval and endogenous peroxidase inhibiting by 3% solution of hydrogen peroxide, histologic samples were stained by antibodies to Ki-67 protein (clone SP6, dilution 1:300) and polymer systemic detection with diaminobenzidine as a chromogenic substrate. Nuclear counterstain was performed using Mayer’s hematoxylin solution. Results. Assessment of colon adenocarcinoma proliferative activity showed a significant difference between the number of cases with high (>70%) and relatively low (≤30%) proliferative levels in groups with metastatic cancers and non-metastatic tumors. In patients with no relapses, colon adenocarcinoma proliferative activity assessment showed proliferation level exceeding 70% in 21 (95%) out of 22 cases, in a single case proliferation level of 60% was found according to Ki-67, no cases of proliferation level lower than 50% was found.
To match up the proliferative activity of colon adenocarcinoma cells with tumor stage and survival rate. Methods. Ki-67 protein expression was evaluated by immunohistochemical methods in 217 patients with primary colon adenocarcinoma. After epitope retrieval and endogenous peroxidase inhibiting by 3% solution of hydrogen peroxide, histologic samples were stained by antibodies to Ki-67 protein (clone SP6, dilution 1:300) and polymer systemic detection with diaminobenzidine as a chromogenic substrate. Nuclear counterstain was performed using Mayer’s hematoxylin solution. Results. Assessment of colon adenocarcinoma proliferative activity showed a significant difference between the number of cases with high (>70%) and relatively low (≤30%) proliferative levels in groups with metastatic cancers and non-metastatic tumors. In patients with no relapses, colon adenocarcinoma proliferative activity assessment showed proliferation level exceeding 70% in 21 (95%) out of 22 cases, in a single case proliferation level of 60% was found according to Ki-67, no cases of proliferation level lower than 50% was found. Statistical analysis showed that proliferative activity was significantly lower in patients with metastatic colon adenocarcinoma compared to cases of adenocarcinoma without metastases (p= 0.0019). We observe one clinical case of aggressive colon adenocarcinoma with omental, peritoneal, paraumbilical metastases in 28-year old patient, in whom proliferative activity by Ki-67 was measured as 20%. Conclusion. Low proliferative level in colon adenocarcinoma is a poor prognostic factor for possible metastasing and cancer recurrence.
Statistical analysis showed that proliferative activity was significantly lower in patients with metastatic colon adenocarcinoma compared to cases of adenocarcinoma without metastases (p= 0.0019). We observe one clinical case of aggressive colon adenocarcinoma with omental, peritoneal, paraumbilical metastases in 28-year old patient, in whom proliferative activity by Ki-67 was measured as 20%. Conclusion. Low proliferative level in colon adenocarcinoma is a poor prognostic factor for possible metastasing and cancer recurrence.
Колоректальный рак — одна из наиболее распространённых злокачественных опухолей, которая также занимает лидирующие позиции по летальности от рака в мире [3]. Несмотря на то, что основным методом лечения служит оперативное вмешательство, с 1990 г. у пациентов с метастазами в лимфатические узлы стандартной считают адъювантную химиотерапию [2, 8]. Поиск молекулярных маркёров с прогностическим или предиктивным эффектом важен для подбора соответствующего лечения пациентам для исключения ненужных препаратов с токсичными побочными эффектами. Пролиферация опухолевых клеток — неотъемлемая черта злокачественной опухоли, часто связанная с её агрессивностью. Белок Ki-67 экспрессируется с G1- по М-фазу клеточного цикла, с его помощью можно оценивать пролиферирующий пул клеток. Ядерный белок Ki-67 кодируется геном MKI67, локализованным на хромосоме 10 (10q25-qter). Он относится к семейству перихромонуклеиновых протеинов, окружающих хромосомы в течение митоза. Ki-67 впервые описан Gerdes и соавт. в 1983 г. на клеточной линии, полученной из лимфомы Ходжкина [5]. Так как Ki-67 выявлялся только в делящихся клетках, его стали широко применять как маркёр пролиферации [6]. В интерфазе Ki-67 входит в состав гетерохроматина в области ядрышек [9], начиная с поздней стадии G1, участвует в формировании малых гранул в ядре, а в дальнейшем в фазах G2 и S — больших фокусов гетерохроматина с ядрышками.
Поиск молекулярных маркёров с прогностическим или предиктивным эффектом важен для подбора соответствующего лечения пациентам для исключения ненужных препаратов с токсичными побочными эффектами. Пролиферация опухолевых клеток — неотъемлемая черта злокачественной опухоли, часто связанная с её агрессивностью. Белок Ki-67 экспрессируется с G1- по М-фазу клеточного цикла, с его помощью можно оценивать пролиферирующий пул клеток. Ядерный белок Ki-67 кодируется геном MKI67, локализованным на хромосоме 10 (10q25-qter). Он относится к семейству перихромонуклеиновых протеинов, окружающих хромосомы в течение митоза. Ki-67 впервые описан Gerdes и соавт. в 1983 г. на клеточной линии, полученной из лимфомы Ходжкина [5]. Так как Ki-67 выявлялся только в делящихся клетках, его стали широко применять как маркёр пролиферации [6]. В интерфазе Ki-67 входит в состав гетерохроматина в области ядрышек [9], начиная с поздней стадии G1, участвует в формировании малых гранул в ядре, а в дальнейшем в фазах G2 и S — больших фокусов гетерохроматина с ядрышками. В М-фазе локализация Ki-67 полностью изменяется, переходя на поверхность конденсированных хромосом [12]. Было высказано много предположений относительно функций Ki-67 в митозе. Одни авторы утверждали, что такая локализация Ki-67 на поверхности хромосом является лишь распределением ядерных белков в дочерние клетки. Другие считали, что Ki-67 играет важную роль в конденсации и деконденсации хромосом. Эксперименты, проведённые Starborg [12] и Schluter [11], показали, что Ki-67 жизненно необходим в митозе клетки и что при его нейтрализации митоз останавливается. В литературе существуют противоречивые данные о влияние уровня пролиферации на прогноз при аденокарциноме толстой кишки. Целью исследованию было сопоставить пролиферативную активность со стадией опухолевого процесса и выживаемостью пациентов. Был исследован материал первичных опухолей от 217 больных, получавших лечение в Городском клиническом онкологическом диспансере Санкт-Петербурга и 122-й клинической больнице (табл. 1). Иммуногистохимическое исследование.
В М-фазе локализация Ki-67 полностью изменяется, переходя на поверхность конденсированных хромосом [12]. Было высказано много предположений относительно функций Ki-67 в митозе. Одни авторы утверждали, что такая локализация Ki-67 на поверхности хромосом является лишь распределением ядерных белков в дочерние клетки. Другие считали, что Ki-67 играет важную роль в конденсации и деконденсации хромосом. Эксперименты, проведённые Starborg [12] и Schluter [11], показали, что Ki-67 жизненно необходим в митозе клетки и что при его нейтрализации митоз останавливается. В литературе существуют противоречивые данные о влияние уровня пролиферации на прогноз при аденокарциноме толстой кишки. Целью исследованию было сопоставить пролиферативную активность со стадией опухолевого процесса и выживаемостью пациентов. Был исследован материал первичных опухолей от 217 больных, получавших лечение в Городском клиническом онкологическом диспансере Санкт-Петербурга и 122-й клинической больнице (табл. 1). Иммуногистохимическое исследование. Материал поступал в виде как парафиновых блоков, так и кусочков опухолей, залитых в 10% буферный формалин. В последнем случае выполняли вырезку материала и доведение фиксации в формалине до 24 ч. Затем проводили материал в 10 порциях изопропилового спирта и 3 парафинах. Приготавливали блоки, с них осуществляли срезы толщиной 4 мкм, которые помещали на стёкла с поли-L-лизиновым покрытием. Срезы подсушивали, депарафинировали и подвергали демаскировке антигенов при помощи цитратного буфера в условиях водяной бани, t=95 °C, 30 мин. После этого они остывали при комнатной температуре и промывались трис-буфером с твином. Каждый срез обводили парафиновым карандашом, после чего осуществляли ингибирование эндогенной пероксидазы 3% раствором водорода пероксида (перекиси водорода) в течение 20 мин. Затем на каждый срез наносили первое антитело (Ki-67, клон SP6, разведение 1:300), экспозиция длилась 30 мин на термостолике в условиях «водяной бани» при температуре 30 °C. Для визуализации реакции антиген-антитело применяли полимерную систему детекции «EnVision» компании «DAKO», в качестве хромогена использовали диаминобензидин.
Материал поступал в виде как парафиновых блоков, так и кусочков опухолей, залитых в 10% буферный формалин. В последнем случае выполняли вырезку материала и доведение фиксации в формалине до 24 ч. Затем проводили материал в 10 порциях изопропилового спирта и 3 парафинах. Приготавливали блоки, с них осуществляли срезы толщиной 4 мкм, которые помещали на стёкла с поли-L-лизиновым покрытием. Срезы подсушивали, депарафинировали и подвергали демаскировке антигенов при помощи цитратного буфера в условиях водяной бани, t=95 °C, 30 мин. После этого они остывали при комнатной температуре и промывались трис-буфером с твином. Каждый срез обводили парафиновым карандашом, после чего осуществляли ингибирование эндогенной пероксидазы 3% раствором водорода пероксида (перекиси водорода) в течение 20 мин. Затем на каждый срез наносили первое антитело (Ki-67, клон SP6, разведение 1:300), экспозиция длилась 30 мин на термостолике в условиях «водяной бани» при температуре 30 °C. Для визуализации реакции антиген-антитело применяли полимерную систему детекции «EnVision» компании «DAKO», в качестве хромогена использовали диаминобензидин. Контр-окрашивание ядер осуществляли при помощи гематоксилина Майера. После каждого из этапов до окрашивания диаминобензидином стёкла со срезами промывали в трис-буфере с твином (рН=7,1) фирмы «BioOptica». Стёкла заключали в среду «BioMaunt» фирмы «BioOptica». Мы проанализировали уровень пролиферации, определённый по Ki-67, в случаях аденокарциномы толстой кишки с метастазами и без них. Все случаи по пролиферативному уровню были разделены на группы: меньше 30%; больше 30%, но меньше 50%; больше 50%, но меньше 70%; больше 70% (табл. 2). Как видно из табл. 2, в группе аденокарцином без метастазов было два наблюдения, в которых пролиферация была ниже 30%. Однако необходимо учитывать, что оценка метастатического статуса в данной группе осуществлялась до операции при помощи компьютерной томографии и на удалённом материале гистологически (в группу вошли только те пациенты, у которых было забрано для исследования не менее 16 лимфатических узлов). Таким образом, выявленные два случая с относительно низким уровнем пролиферации могут быть сомнительны в плане метастатического потенциала, так как не был прослежен безрецидивный период.
Контр-окрашивание ядер осуществляли при помощи гематоксилина Майера. После каждого из этапов до окрашивания диаминобензидином стёкла со срезами промывали в трис-буфере с твином (рН=7,1) фирмы «BioOptica». Стёкла заключали в среду «BioMaunt» фирмы «BioOptica». Мы проанализировали уровень пролиферации, определённый по Ki-67, в случаях аденокарциномы толстой кишки с метастазами и без них. Все случаи по пролиферативному уровню были разделены на группы: меньше 30%; больше 30%, но меньше 50%; больше 50%, но меньше 70%; больше 70% (табл. 2). Как видно из табл. 2, в группе аденокарцином без метастазов было два наблюдения, в которых пролиферация была ниже 30%. Однако необходимо учитывать, что оценка метастатического статуса в данной группе осуществлялась до операции при помощи компьютерной томографии и на удалённом материале гистологически (в группу вошли только те пациенты, у которых было забрано для исследования не менее 16 лимфатических узлов). Таким образом, выявленные два случая с относительно низким уровнем пролиферации могут быть сомнительны в плане метастатического потенциала, так как не был прослежен безрецидивный период. Если сравнить распределение случаев по уровню пролиферации в зависимости от метастатического потенциала, то мы увидим следующие кривые (рис. 1). Как видно из рис. 1, пересечение кривых произошло в области [50%; 70%], но если для кривой метастатического рака это точка экстремума, то для неметастатического — точка с максимальным ростом. Точка экстремума для случаев pN0M0 лежит в области >70%, то есть с максимальным пролиферативным уровнем. Если сопоставить уровень пролиферации в группах с метастатическими аденокарциномами толстой кишки и неметастатическими опухолями с составлением таблицы сопряжения 2×2, то мы увидим следующую картину (табл. 3). Как видно из табл. 3, существует значительное отличие доли случаев с экстремально высоким уровнем пролиферации (>70%) и относительно низким (≤30%) в группах с метастатическим и неметастатическим раком. Это подтверждает наше предположение о том, что низкий уровень пролиферации в аденокарциномах толстой кишки — плохой прогностический признак.
Если сравнить распределение случаев по уровню пролиферации в зависимости от метастатического потенциала, то мы увидим следующие кривые (рис. 1). Как видно из рис. 1, пересечение кривых произошло в области [50%; 70%], но если для кривой метастатического рака это точка экстремума, то для неметастатического — точка с максимальным ростом. Точка экстремума для случаев pN0M0 лежит в области >70%, то есть с максимальным пролиферативным уровнем. Если сопоставить уровень пролиферации в группах с метастатическими аденокарциномами толстой кишки и неметастатическими опухолями с составлением таблицы сопряжения 2×2, то мы увидим следующую картину (табл. 3). Как видно из табл. 3, существует значительное отличие доли случаев с экстремально высоким уровнем пролиферации (>70%) и относительно низким (≤30%) в группах с метастатическим и неметастатическим раком. Это подтверждает наше предположение о том, что низкий уровень пролиферации в аденокарциномах толстой кишки — плохой прогностический признак. Высокий же уровень пролиферации не имеет самостоятельного прогностического значения. Для подтверждения данных выводов мы провели исследование на группе аденокарцином с прослеженным 5-летним клиническим периодом. Отличием данных случаев является тот факт, что у пациентов был прослежен 5-летний период, и в группу вошли только те пациенты, у которых не было метастазирования и рецидивов в течение этого времени. В 21 (95%) из 22 случаев пролиферация по Ki-67 была выше 70%, лишь в 1 наблюдении она составила 60%. Ни 1 случая с прослеженным 5-летним безрецидивным периодом и без развития метастазов с уровнем пролиферации менее 50% выявлено не было. Таким образом, это подтверждает наше предположение о том, что низкий уровень пролиферации в аденокарциномах толстой кишки — плохой прогностический признак. Более того, в 2 случаях с низким уровнем пролиферации из предыдущей группы следует ожидать в будущем развития метастазов или рецидива. Эта позиция позволяет понять данные предыдущего нашего исследования, где крайне высокая пролиферативная активность в аденокарциномах толстой кишки не сопровождалась высокой эффективностью химиотерапии, более того, все 9% случаев с низкой пролиферативной активностью имели регионарные или отдалённые метастазы [1].
Высокий же уровень пролиферации не имеет самостоятельного прогностического значения. Для подтверждения данных выводов мы провели исследование на группе аденокарцином с прослеженным 5-летним клиническим периодом. Отличием данных случаев является тот факт, что у пациентов был прослежен 5-летний период, и в группу вошли только те пациенты, у которых не было метастазирования и рецидивов в течение этого времени. В 21 (95%) из 22 случаев пролиферация по Ki-67 была выше 70%, лишь в 1 наблюдении она составила 60%. Ни 1 случая с прослеженным 5-летним безрецидивным периодом и без развития метастазов с уровнем пролиферации менее 50% выявлено не было. Таким образом, это подтверждает наше предположение о том, что низкий уровень пролиферации в аденокарциномах толстой кишки — плохой прогностический признак. Более того, в 2 случаях с низким уровнем пролиферации из предыдущей группы следует ожидать в будущем развития метастазов или рецидива. Эта позиция позволяет понять данные предыдущего нашего исследования, где крайне высокая пролиферативная активность в аденокарциномах толстой кишки не сопровождалась высокой эффективностью химиотерапии, более того, все 9% случаев с низкой пролиферативной активностью имели регионарные или отдалённые метастазы [1]. К схожим результатам пришли E.C. Fluge и соавт. [4], показав, что высокий пролиферативный уровень (>40%) является хорошим прогностическим маркёром для безрецидивного течения заболевания у пациентов с аденокарциномами ободочной кишки. Высокий уровень пролиферации наблюдается в ранних неметастатических формах аденокарцином толстой кишки [7]. E.B. Salminen и соавт. [10] показали, что высокий пролиферативный уровень, определённый по Ki-67, — хороший прогностический фактор для выживаемости пациентов в сравнении с низкой пролиферативной активностью. В наших исследованиях было клиническое наблюдение с агрессивной формой аденокарциномы толстой кишки с метастазами в сальник, брюшину и пупочную область у 28-летнего пациента. Пролиферативная активность, определённая по Ki-67, составила в данном случае 20%. ВЫВОД Низкая пролиферативная активность в аденокарциномах толстой кишки — плохой прогностический признак с точки зрения развития метастазов и рецидивов. Таблица 1 Характеристика пациентов Количество случаев Распределение по стадиям Средний возраст, годы Распределение по полу 217 I-II — 55 (25%), IV — 162 (75%) 59 М: 104 (48%), Ж: 157 (52%) Таблица 2 Уровень пролиферации в аденокарциномах толстой кишки в зависимости от метастатического статуса (n=217) Пролиферация по Ki-67 Метастатическая форма Неметастатическая форма Ki-67 ≤30% 30 (18,5%) 2 (3,6%) 30% <Ki-67 ≤50% 40 (24,7%) 5 (9,1%) 50% <Ki-67 ≤70% 49 (30,3%) 19 (34,5%) Ki-67 >70% 43 (26,5%) 29 (52,8%) Всего случаев 162 55 Рис.
К схожим результатам пришли E.C. Fluge и соавт. [4], показав, что высокий пролиферативный уровень (>40%) является хорошим прогностическим маркёром для безрецидивного течения заболевания у пациентов с аденокарциномами ободочной кишки. Высокий уровень пролиферации наблюдается в ранних неметастатических формах аденокарцином толстой кишки [7]. E.B. Salminen и соавт. [10] показали, что высокий пролиферативный уровень, определённый по Ki-67, — хороший прогностический фактор для выживаемости пациентов в сравнении с низкой пролиферативной активностью. В наших исследованиях было клиническое наблюдение с агрессивной формой аденокарциномы толстой кишки с метастазами в сальник, брюшину и пупочную область у 28-летнего пациента. Пролиферативная активность, определённая по Ki-67, составила в данном случае 20%. ВЫВОД Низкая пролиферативная активность в аденокарциномах толстой кишки — плохой прогностический признак с точки зрения развития метастазов и рецидивов. Таблица 1 Характеристика пациентов Количество случаев Распределение по стадиям Средний возраст, годы Распределение по полу 217 I-II — 55 (25%), IV — 162 (75%) 59 М: 104 (48%), Ж: 157 (52%) Таблица 2 Уровень пролиферации в аденокарциномах толстой кишки в зависимости от метастатического статуса (n=217) Пролиферация по Ki-67 Метастатическая форма Неметастатическая форма Ki-67 ≤30% 30 (18,5%) 2 (3,6%) 30% <Ki-67 ≤50% 40 (24,7%) 5 (9,1%) 50% <Ki-67 ≤70% 49 (30,3%) 19 (34,5%) Ki-67 >70% 43 (26,5%) 29 (52,8%) Всего случаев 162 55 Рис. 1. Распределение случаев аденокарциномы толстой кишки в зависимости от пролиферативного уровня в категориях с метастатическим раком и раком рN0M0. раскин.tif Таблица 3 Таблица сопряжённости 2×2 для метастатической и неметастатической аденокарцином с уровнем пролиферации до 30% и превышающим 70% Метастатическая форма Неметастатическая форма Пролиферация по Ki-67 ≤30% 30 (41%) 2 (6%) χ2=10,6883, р=0,0019 Пролиферация по Ki-67 >70% 43 (59%) 29 (94%)
1. Распределение случаев аденокарциномы толстой кишки в зависимости от пролиферативного уровня в категориях с метастатическим раком и раком рN0M0. раскин.tif Таблица 3 Таблица сопряжённости 2×2 для метастатической и неметастатической аденокарцином с уровнем пролиферации до 30% и превышающим 70% Метастатическая форма Неметастатическая форма Пролиферация по Ki-67 ≤30% 30 (41%) 2 (6%) χ2=10,6883, р=0,0019 Пролиферация по Ki-67 >70% 43 (59%) 29 (94%)
G A Raskin
Russian Research Centre for Radiology and Surgical Technologies, Saint-Petersburg, Russia Email: [email protected]
S V Petrov
Kazan State Medical University, Kazan, Russia- Раскин Г.А., Орлова Р.В., Петров С.В., Протасова А.Э. Иммуногистохимическое исследование аденокарциномы толстой кишки для оценки прогностических факторов // Вестн.
 Санкт-Петербург. ун-та. — 2012. — Серия 11. — №1. — С. 172-182.
Санкт-Петербург. ун-та. — 2012. — Серия 11. — №1. — С. 172-182. - Belac-Lovasic I., Petković M., Ferrari A.M. Evaluation of adjuvant chemotherapy in patients with colorectal cancer in Primorsko-Goranska and Istarska County — a twenty years retrospective study // Coll. Antropol. — 2011. — Vol. 35. — P. 111-114.
- Ferlay J., Shin H.R., Bray F. et al. GLOBOCAN 2008 v2.0, cancer incidence and mortality worldwide: IARC CancerBase No. 10 [Internet]. — Lyon, France: International Agency for Research on Cancer; 2010. — Available from: http://globocan.iarc.fr/Pages/fact_sheets_cancer.aspx.
- Fluge Ø., Gravdal K., Carlsen E. et al. Expression of EZh3 and Ki-67 in colorectal cancer and associations with treatment response and prognosis // Br. J. Cancer. — 2009. — Vol. 101, N 8. — P. 1282-1289.
- Gerdes J., Schwab U., Lemke H., Stein H. Producing of a mouse monoclonal antibody reactive with a human nuclear antigen associated with cell proliferation // Int.
 J. Cancer. — 1983. — Vol. 31. — P. 13-20.
J. Cancer. — 1983. — Vol. 31. — P. 13-20. - Gerdes J. Ki-67 and other proliferation markers useful for immnohistological diagnostic and prognostic evaluations in human malignancies // Semin. Cancer Biol. — 1990. — Vol. 1. — P. 99-106.
- Hoos A., Nissan A., Stojadinovic A. et al. Tissue microarray molecular profiling of early, node-negative adenocarcinoma of the rectum. A comprehensive analysis // Clin. Cancer Res. — 2002. — Vol. 8 — P. 38-41.
- Moertel C.G., Flemming T.R., Macdonald J.C. et al. 5-FU plus levamisole as effective adjuvant therapy after resection of stage III colon carcinoma: a final report // Ann. Intern. Med. — 1995. — Vol. 122. — P. 321-326.
- Saiwaki T., Kotera I., Sasaki M. et al. In vivo dynamics and kinetics of pKi-67: transition from a mobile to an immobile form at the onset of anaphase // Exp. Cell Res. — 2005. — Vol. 308, N 1. — P. 123-134.
- Salminen E.
 , Palmu S., Vahlberg T. et al. Increased proliferation activity measured by immunoreactive Ki-67 is associated with survival improvement in rectal/recto sigmoid cancer // World J. Gastroenterol. — 2005. — Vol. 11, N 21. — P. 3245-3249.
, Palmu S., Vahlberg T. et al. Increased proliferation activity measured by immunoreactive Ki-67 is associated with survival improvement in rectal/recto sigmoid cancer // World J. Gastroenterol. — 2005. — Vol. 11, N 21. — P. 3245-3249. - Schluter C., Duchrow M., Wohlenberg C. et al. The cell proliferation-associated antigen of antibody Ki-67: a very large, ubiquitous nuclear protein with numerous repeated elements, representing a new kind of cell cycle-maintaining proteins // J. Cell. Biol. — 1993. — Vol. 123, N 3. — P. 513-522.
- Starborg M., Gell K., Brundell E., Hoog C. The murine Ki-67 cell proliferation antigen accumulates in the nucleolar and heterochromatic regions of interphase cells and at the periphery of the mitotic chromosomes in a process essential for cell cycle progression // J. Cell. Sci. — 1996. — Vol. 109. — Pt. 1. — P. 143-153.
Views
Abstract — 583
PDF (Russian) — 215
Cited-By
Article Metrics
PlumX
Dimensions
| При биопсии могут наблюдаться гиперкератоз, складчатость эпидермиса, лейкоцитарная инфильтрация и пролиферация меланоцитов. | |
| Фиброваскулярная пролиферация также может вызвать тракционную отслойку сетчатки. | |
| В МКБ-10 это состояние называется диффузной кистозной мастопатией, или, если есть пролиферация эпителия, фибросклерозом молочной железы. | |
| Тремя основными стадиями заживления сухожилий являются воспаление, восстановление или пролиферация и ремоделирование, которые в дальнейшем можно разделить на консолидацию и созревание. | |
| После высвобождения вазоактивных и хемотаксических факторов начинается ангиогенез и пролиферация теноцитов. | |
| Эта неконтролируемая пролиферация путем митоза приводит к образованию первичной гетерогенной опухоли. | |
| Пролиферация клеток внутри лимфатического узла приведет к его расширению. | |
Эта пролиферация может еще больше увеличить скорость очистки миелина и играет важную роль в регенерации аксонов, наблюдаемых в ПНС. | |
| В некоторых случаях также может возникнуть узелковый вазит-доброкачественная пролиферация протокового эпителия. | |
| Продолжающаяся миграция и пролиферация клеток в конечном итоге приводят к образованию фиброзной бляшки. | |
| Пролиферация этих клеток позволяет капиллярному ростку одновременно расти в длину. | |
| Эти цитокины затем стимулируют иммунные функции, такие как активация иммунных клеток, пролиферация и дифференцировка. | |
| Значительная пролиферация инфекционного агента не происходит, это ограничивает способность ПЦР обнаруживать присутствие каких-либо бактерий. | |
| В своей самой крайней форме пролиферация, связанная с глиозом, приводит к образованию глиального рубца. | |
| Мастоцитоз-это редкое заболевание, при котором происходит пролиферация тучных клеток, вырабатывающих избыток гистамина. | |
Наиболее ярким примером этого является быстрое дублирование и пролиферация тандемных генов цинкового пальца в геномах млекопитающих. | |
| Также может присутствовать диффузная мезангиальная пролиферация или крестообразный гломерулонефрит. | |
| Другие результаты | |
| Нарушения миграции нейронов обусловлены аномальной миграцией, пролиферацией и организацией нейронов на ранних стадиях развития мозга. | |
| Отек-это преходящее аномальное увеличение части или области тела, вызванное не пролиферацией клеток, а накоплением жидкости в тканях. | |
| Также называемый неоваскуляризацией, процесс ангиогенеза происходит одновременно с пролиферацией фибробластов, когда эндотелиальные клетки мигрируют в область раны. | |
| Разница между прорастанием сосудов и пролиферацией фибробластов заключается в том, что первая усиливается гипоксией, а вторая тормозится гипоксией. | |
Далее наступает фаза пролиферации и синтеза, характеризующаяся пролиферацией остеогенных клеток из соседнего костного мозга в альвеолярную кость. | |
| Этот ген связан с пролиферацией, инвазией и рассеиванием раковых клеток толстой кишки в клеточной культуре, а также ростом опухоли и метастазированием у мышей. | |
| Хорошо известно, что метилирование ДНК связано с дифференцировкой и пролиферацией клеток. | |
| Эта фаза связана с падением уровня прогестагена, пролиферацией слизистой оболочки и ороговением. | |
| Паностеит также называют эозинофильным паностеитом, эностозом, эндостальной пролиферацией новой кости и эопаном. | |
| Связь между клеточной пролиферацией и митохондриями была исследована с использованием клеток HeLa рака шейки матки. | |
| Поздние стадии БАС также характеризуются значительным астроглиозом и пролиферацией астроцитов вокруг зон дегенерации. | |
| Нефрит может привести к повреждению клубочков, нарушая структуру клубочков с пролиферацией воспалительных клеток. | |
Он выступал против пролиферации. | |
Определение распространения по Merriam-Webster
pro · lif · er · ел | \ prə-ˈli-fə-rāt \распространился; разрастающийся
непереходный глагол
1 : для роста за счет быстрого производства новых частей, клеток, почек или потомства
переходный глагол
1 : вызвать рост за счет размножения
2 : вызывать увеличение числа или степени, как если бы за счет размножения
Определение и значение распространения | Словарь английского языка Коллинза
Примеры ‘распространение’ в предложении
распространение
Эти примеры были выбраны автоматически и могут содержать конфиденциальный контент. Читать далее… Он работал над ограничением распространения ядерного оружия и повышением эффективности правительства.
Читать далее… Он работал над ограничением распространения ядерного оружия и повышением эффективности правительства.Times, Sunday Times (2016)
Он работал над ограничением распространения ядерного оружия и повышением эффективности правительства.Times, Sunday Times (2016)
Существует реальная опасность распространения ядерного оружия.Times, Sunday Times (2007)
Они помогают бороться с распространением ядерного оружия и способствуют росту и стабильности.Times, Sunday Times (2010)
Он утверждает, что было бы глупо оставлять дыры в средствах ядерного сдерживания, когда распространение ядерного оружия представляет собой растущую опасность.Times, Sunday Times (2013)
Отсюда быстрая эволюция и распространение.Times, Sunday Times (2006)
Опасности распространения ядерного оружия гораздо более серьезны.Times, Sunday Times (2010)
Только по одной экологической проблеме произошло существенное изменение отношения — распространение ядерной энергетики.
Гренвилл, Дж. А. С. Коллинзская история мира в 20-м веке (1994)
Я отказываюсь рассматривать распространение мелких партий как конституционный кризис.Times, Sunday Times (2015)
Что он не сделал, так это уменьшил международную потребность принуждения Ирана к его обязательствам по ядерному распространению и региональному миру.Times, Sunday Times (2007)
Подробнее …
Хотя возражения против заявки варьировались от экономики предприятия до распространения ядерного оружия, значительный упор был сделан на радиационную защиту.Times, Sunday Times (2011)
Это было десятилетие, когда нам снова пришлось беспокоиться о распространении ядерного оружия.Times, Sunday Times (2009)
Опасения по поводу распространения ядерного оружия не ограничиваются Ближним Востоком.Times, Sunday Times (2009)
По тону ее голоса можно подумать, что она говорила о распространении ядерного оружия.Times, Sunday Times (2007)
Наша решительная позиция в отношении распространения всех видов оружия массового уничтожения на Ближнем Востоке и во всем мире хорошо известна.Times, Sunday Times (2012)
Проблема технологии заключается в том, что она слишком податлива для массового производства и, следовательно, не поддается быстрому распространению общей стандартной инфраструктуры.Джеффри А. Мур ЖИЗНЬ НА ЛИНИИ НЕИСПРАВНОСТЕЙ, ПЕРЕСМОТРЕННОЕ ИЗДАНИЕ (2002)
Пролиферация клеток — обзор
B Пролиферация
Пролиферация клеток — одно из первых событий активации B-клеток, которое необходимо для расширения антигена. -активированного пула В-клеток и обеспечения достаточного уровня иммунного ответа. Пролиферация В-клеток может быть запущена in vitro, несколькими способами. Включение BCR служит первичным стимулом, но, кроме того, несколько костимулирующих молекул или дополнительных рецепторов, таких как CD38, CD40 и CD19, могут напрямую стимулировать пролиферацию B-клеток или снижать порог активации B-клеток антигенами (Barrington et al., 2009 г .; Чен и Росс, 2005, 2007). Агонисты Toll-подобных рецепторов (TLR), такие как ДНК LPS и CpG, являются мультипотентными митогенами, которые стимулируют пролиферацию поликлональных B-клеток через TLR 4 и 9 соответственно (Hoshino et al. , 1999; Krieg et al. ). , 1995). Недавно было показано, что группа гликолипидных антигенов может стимулировать пролиферацию B-клеток посредством молекулы CD1d, подобной MHC I класса, присутствующей на некоторых B-клетках (Brigl and Brenner, 2010; Lang et al ., 2008), а также миелоидные клетки. Прототипом и наиболее часто изучаемым антигеном CD1d является альфа-галактозилцерамид, липид, извлеченный из морской губки; однако эндогенные гликолипидные антигены клеток млекопитающих также активируют CD1d (Zhou et al. , 2004).
RA играет различные роли в регулировании активации и дифференцировки В-клеток посредством своего влияния на эти внутренние сигнальные системы. Несколько линий доказательств показали, что регуляция пролиферации B-клеток с помощью RA зависит от природы встречающегося стимула.На физиологическом уровне (около 5-20 нМ) RA ингибировал скорость пролиферации очищенных В-клеток периферической крови человека, стимулированную анти-μ-антителом (Blomhoff et al. , 1992). В наивных B-клетках мышей, стимулированных анти-μ для инициации передачи сигналов BCR и анти-CD38 для лигирования молекулы CD38 на поверхности B-клеток, пролиферация была снижена в популяции в целом, но в группе большего размера, меньше циклически, и со временем появлялись более дифференцированные В-клетки, и эти клетки экспрессировали больше поверхностного (-ых) Ig, что свидетельствует об усиленном прогрессировании в направлении превращения в секретирующие антитела ПК (Chen and Ross, 2005).В модели in vitro T-клеточно-зависимой активации B-клеток RA снижает пролиферацию B-клеток, индуцированную лигированием BCR и CD40 и LPS (Chen and Ross, 2005, 2007). Снижение пролиферации B-клеток под действием RA в условиях различных стимулов предполагает участие общего пути, приводящего к негативной регуляции клеточного цикла и роста, когда B-клетки стимулируются перекрестным связыванием BCR-связанных рецепторов и TLR4. Надери и Бломхофф (1999) показали, что снижению пролиферации В-клеток в нормальных периферических В-клетках человека предшествовала остановка клеточного цикла, о чем свидетельствует измененная экспрессия нескольких факторов регуляции клеточного цикла.Негативная регуляция пути NF-κB также может способствовать ингибирующему эффекту RA на пролиферацию клеток, поскольку члены семейства NF-κB играют важную роль в контроле развития и пролиферации B-клеток (Chen et al ., 2002; Siebenlist и др. ., 2005). Исследования линии B-лимфоидных клеток в культуре также продемонстрировали, что RA подавляет пролиферацию, блокируя ионизированный кальциевый канал, который опосредует ранний кальциевый ответ после лигирования BCR (Bosma and Sidell, 1988).
В отличие от ингибирующего эффекта RA на пролиферацию B-клеток, стимулированного лигированием BCR и LPS, как обсуждалось выше, RA увеличивал пролиферацию B-клеток памяти, когда B-клетки стимулировались ДНК CpG, которая индуцирует активацию клеток через TLR9 (Ertesvag и др. , 2007). Повышенная скорость пролиферации В-клеток сопровождалась повышенной секрецией антител. В механистическом исследовании Ertesvag et al . (2007) продемонстрировали, что усиленная пролиферация и дифференцировка с помощью RA соответствует активации пути p38 MAPK, что приводит к фосфорилированию белка ретинобластомы и увеличивает уровень циклина D, факторов, которые стимулируют прогрессирование клеточного цикла.Мы также наблюдали, что RA увеличивает пролиферацию очищенных B-клеток селезенки мышей, стимулированных α-галактозилцерамидом, лигандом рецептора CD1d, что коррелирует с дифференцировкой B-клеток, о чем свидетельствует экспрессия sIgG1 и CD138 (Q. Chen, неопубликовано. data), в то время как RA уменьшал пролиферацию идентичных B-клеток, стимулированных LPS.
Эти противоположные результаты предполагают, что RA влияет на пролиферацию B-клеток по-разному, в зависимости от субпопуляции B-клеток, а также от стимула.В то время как RA ингибирует пролиферацию зрелых B-клеток, что может способствовать их дифференцировке из активированных B-клеток в направлении PC, RA способствует размножению субнабора B-клеток, которые подвергаются дальнейшей дифференцировке (Chen and Ross, 2005), причем оба процесса приводят к стимулированию производства антител. Кроме того, в то время как физиологические уровни RA ингибируют пролиферацию B-клеток, RA в той же концентрации также предотвращает спонтанный апоптоз B-лимфоцитов (Lomo et al. , 1998), что также позволяет предположить, что, хотя RA ингибирует пролиферацию зрелых B-клеток, он функционирует для поддержания функционального пула B-клеток, необходимого для эффективного ответа памяти.Необходимы дальнейшие исследования, чтобы лучше определить, является ли стадия активации В-клеток per se (наивная или память) или сам стимул, или и то, и другое, что определяет, способствует ли РА или ингибирует цикл и пролиферацию В-клеток.
Распространение — творческая диагностика
Пролиферация — это физиологический процесс деления клеток, который происходит почти во всех тканях, в результате чего количество клеток увеличивается. Митоз является основным способом деления клеток эукариотами, такими как многоклеточные организмы, митотическим путем для увеличения количества соматических клеток.Во время митотического деления клетки одна материнская клетка делится, чтобы произвести две дочерние клетки, чтобы заменить клетки, которые были повреждены или умерли, поэтому пролиферация клеток определяется балансом между клеточными делениями и потерей клеток в результате гибели или дифференцировки клеток. Процесс пролиферации клеток играет ключевую роль с момента эмбриогенеза до развития всего организма из одно- или двухклеточного эмбриона и продолжает играть важную роль в поддержании гомеостаза взрослой ткани за счет рециркуляции старых клеток новыми клетками.
Обзор пролиферации клеток
Раннее развитие характеризуется быстрым размножением эмбриональных клеток, которые затем дифференцируются с образованием многих специализированных типов клеток, из которых состоят ткани и органы многоклеточных животных. По мере дифференциации клеток скорость их пролиферации обычно снижается, и большинство клеток у взрослых животных задерживаются на стадии G0 клеточного цикла. Некоторые типы дифференцированных клеток никогда не делятся снова, но большинство клеток способны возобновить пролиферацию, как это требуется, чтобы заменить клетки, которые были потеряны в результате повреждения или гибели клеток.Кроме того, некоторые клетки непрерывно делятся на протяжении всей жизни, заменяя клетки, которые имеют высокую скорость обновления у взрослых животных. Таким образом, пролиферация клеток тщательно уравновешивается гибелью клеток, чтобы поддерживать постоянное количество клеток во взрослых тканях и органах.
В целом клетки взрослых животных можно разделить на три категории в отношении пролиферации клеток.
- Первая категория, такая как кардиомиоциты человека, больше не способна к размножению.Они производятся, дифференцируются и сохраняются на протяжении всей жизни организма во время эмбрионального развития. Они никогда не будут заменены, даже если они были потеряны из-за травмы.
- В отличие от первой категории, вторая может возобновить пролиферацию при входе в стадию G0 клеточного цикла, включая фибробласты кожи, гладкомышечные клетки, эндотелиальные клетки, выстилающие кровеносные сосуды, и эпителиальные клетки большинства внутренних органов, таких как печень, поджелудочная железа, почки, легкие, простата и грудь.
- Третья категория, включающая клетки крови, эпителиальные клетки кожи и эпителиальные клетки, выстилающие пищеварительный тракт, имеет короткую продолжительность жизни и должна быть заменена постоянной пролиферацией клеток у взрослых животных. Внутри них полностью дифференцированные клетки не размножаются сами по себе. Вместо этого они заменяются за счет пролиферации менее дифференцированных клеток, называемых стволовыми клетками.
Регламент пролиферации клеток
Широкий спектр факторов роста сочетается с рецепторными тирозинкиназами (RTK), которые являются вторым основным типом рецепторов клеточной поверхности, для регулирования пролиферации, дифференцировки и выживания клеток.
Факторы роста фибробластов (FGF) представляют собой семейство факторов роста, участвующих в заживлении ран и ангиогенезе. Было показано, что среди различных членов этого семейства FGF-2 и FGF-4 увеличивают пролиферацию клеток человека in vitro . FGF сигнализирует о пролиферации через каскад митоген-активируемой протеинкиназы (MAPK) в различных типах клеток.
FGF связывают рецепторы фактора роста фибробластов (FGFR), эпидермальные факторы роста (EGF) связывают рецепторы эпидермального фактора роста (EGFR), фактор роста эндотелия сосудов (VEGF) и фактор роста тромбоцитов (PDGF) связывают PDGFR и фактор роста гепатоцитов (HGF). ) связывает c-Met, который вызывает активацию фосфоинозитид-3 киназы (PI3K), превращая PIP2 в PIP3 и активируя Akt / протеинкиназу B (PKB) и митоген-активированную протеинкиназу (MAPK) Erk.Фосфорилированный Erk либо входит в ядро и активирует транскрипцию генов клеточной пролиферации, таких как c-myc, либо активирует нижестоящие рецепторы, такие как Rsk, которые затем активируют гены пролиферации.
- Костный морфогенетический белок (BMP)
Известно, что костный морфогенетический белок (BMP), принадлежащий к суперсемейству TGFβ, влияет на формирование кости. И BMP-2, и BMP-3 могут увеличивать пролиферацию клеток. Поскольку все эти факторы влияют на формирование костей с разной скоростью, а некоторые имеют большее влияние на пролиферацию, синергетические пары этих факторов роста могут использоваться в оптимальных дозах и в определенных точках во время процесса регенерации кости.
Серин также играет важную роль в синтезе биомолекул, поддерживающих пролиферацию клеток. Передача сигналов TGFβ происходит, когда TGFβ или факторы из этого семейства связываются с рецептором серин-треонинкиназы типа II, рекрутируя другой такой трансмембранный белок (рецептор I). Рецептор I фосфорилирует первичные внутриклеточные нисходящие молекулы SMAD, вызывая их транслокацию в ядро и специфическую транскрипцию генов. Рецептором I может быть ALK-1, ALK-2, ALK-3 или ALK-6, которые сигнализируют SMAD 1, SMAD 5 и SMAD 8, или могут быть ALK-4, ALK-5 или ALK-7, которые сигнализируют SMAD. 2 и SMAD 3.Передача сигналов через SMAD 1, SMAD 5 или SMAD 8 необходима для дифференцировки хондроцитов, в то время как передача сигналов через SMAD 2 или SMAD 3 блокирует дифференцировку хондроцитов. TGFβ и члены этого семейства факторов роста также могут передавать сигналы через пути митоген-активируемой протеинкиназы (MAPK), Rho GTPase и фосфоинозитид-3 киназы (PI3K). С другой стороны, было обнаружено, что митогенные эффекты BMP-3 опосредуются передачей сигналов TGFβ / активин, а не какими-либо путями передачи сигналов MAPK, причем ключевыми участниками являются ALK-4, SMAD 2 и SMAD 3.
- Notch2 внутриклеточный домен (NICD)
Передача сигналов Notch в первую очередь активируется, когда лиганды семейства DSL (Delta, Serrate / Jagged, LAG-2) активируют рецепторы Notch на соседних клетках. Это вызывает высвобождение и ядерную локализацию внутриклеточного домена Notch (NICD), который вместе с регуляторами транскрипции изменяет экспрессию генов-мишеней. Было показано, что сверхэкспрессия внутриклеточного домена Notch2 (NICD) подавляет клеточную пролиферацию и изменяет нейроэндокринный фенотип медуллярных клеток рака щитовидной железы.
Клеточная пролиферация в патофизиологии
Рак может возникнуть в результате аномального разрастания клеток любого типа. Наиболее важное различие для пациента — между доброкачественными опухолями, которые остаются ограниченными местом своего происхождения, и злокачественными опухолями, которые могут проникать в нормальные ткани и распространяться по всему телу. PSAT1 — это белок-кодирующий ген фосфосерин-аминотрансферазы, который катализирует биосинтез серина. Предыдущие исследования показали, что PSAT1 играет жизненно важную роль в пролиферации клеток, поскольку он действует как онкоген при раке толстой кишки и немелкоклеточном раке легкого (НМРЛ).PSAT1 сверхэкспрессируется при раке толстой кишки, где он способствует пролиферации клеток и устойчивости к химиотерапии, что приводит к плохому прогнозу. PSAT1 значительно повышается при ER-отрицательном раке молочной железы и коррелирует с плохим прогнозом пациента. Более того, было обнаружено, что PSAT1 регулируется ATF4, который затем активирует путь GSK-3β / β-катенин. Это привело к усилению экспрессии циклина D1 и стимулированию пролиферации клеток. Статистический анализ многих результатов показал, что повышающая регуляция PSAT1 коррелировала с развитием опухоли и плохим прогнозом.Эти наблюдения побудили нас задуматься о роли PSAT1 в инициации и развитии ER-отрицательного рака молочной железы.
Артикул:| 1. | Купер, Г. Клетка: молекулярный подход. 2-е издание. 2002 г. |
| 2. | Rodrigues, M .; и др. . Факторы роста регуляции пролиферации и выживаемости мультипотенциальных стромальных клеток. Исследования и терапия стволовых клеток . 2010, 1:32. |
Вернуться к ресурсам
Твиттер Facebook
Договор о нераспространении ядерного оружия (ДНЯО) — UNODA
ДНЯО — это исторический международный договор, целью которого является предотвращение распространения ядерного оружия и оружейных технологий, содействие сотрудничеству в мирном использовании ядерной энергии и достижение цели достижения ядерного разоружения и всеобщего и полного разоружения.Договор представляет собой единственное имеющее обязательную силу в многостороннем договоре обязательство государств, обладающих ядерным оружием, преследовать цель разоружения. Открытый для подписания в 1968 году, Договор вступил в силу в 1970 году. 11 мая 1995 года действие Договора было продлено на неопределенный срок. К Договору присоединилось в общей сложности 191 государство, в том числе пять государств, обладающих ядерным оружием. ДНЯО ратифицировало больше стран, чем любое другое соглашение об ограничении вооружений и разоружении, что свидетельствует о значении Договора.
Договор считается краеугольным камнем глобального режима ядерного нераспространения и важной основой для достижения ядерного разоружения.Он был разработан для предотвращения распространения ядерного оружия, для достижения целей ядерного разоружения и всеобщего и полного разоружения, а также для содействия сотрудничеству в мирном использовании ядерной энергии
Для достижения цели нераспространения и в качестве меры укрепления доверия между государствами-участниками Договор устанавливает систему гарантий, ответственность за которую несет Международное агентство по атомной энергии (МАГАТЭ). Гарантии используются для проверки соблюдения Договора посредством инспекций, проводимых МАГАТЭ.Договор поощряет сотрудничество в области мирных ядерных технологий и равный доступ к этой технологии для всех государств-участников, в то время как гарантии предотвращают перенаправление расщепляющегося материала для использования в оружии.
Резолюции Генеральной Ассамблеи
Положения Договора, в частности пункт 3 статьи VIII, предусматривают обзор действия Договора каждые пять лет, положение, которое было подтверждено государствами-участниками на Конференции 1995 года по рассмотрению и продлению действия ДНЯО.
Конференция 2015 года участников Договора о нераспространении ядерного оружия по рассмотрению действия Договора завершилась без принятия консенсуса по вопросам существа. После успешной обзорной конференции 2010 года, на которой государства-участники согласовали заключительный документ, включающий выводы и рекомендации в отношении последующих действий, включая выполнение резолюции 1995 года по Ближнему Востоку, итоги 2015 года представляют собой неудачу для начатого усиленного процесса обзора. обеспечить подотчетность в отношении деятельности по трем основным направлениям Договора в рамках пакета мер в поддержку бессрочного продления Договора в 1995 году.В настоящее время идет подготовительный процесс к Обзорной конференции 2020 года.
____________
- 11 мая 1995 года в соответствии с пунктом 2 статьи X Конференция участников Договора о нераспространении ядерного оружия по рассмотрению и продлению действия Договора постановила, что действие Договора должно оставаться в силе бессрочно (см. Решение 3).
Нормальная пролиферация клеток | EdCaN
Клетки образуют основные структурные и функциональные единицы организма. 1 Все клетки содержат клеточную мембрану, цитоплазму и ядро. 1 В ядре находится генетический материал или дезоксирибонуклеиновая кислота (ДНК), которая является основным строительным блоком для жизни. ДНК состоит из субъединиц, называемых генами. Каждый ген закодирован для определенного продукта, такого как белок или фермент. 2
Гены содержатся в хромосомах, и включены только необходимые гены. 2 Некоторые важные гены в контексте клеточной пролиферации включают:
- протоонкогенов: ген, участвующий в нормальном росте клеток.Мутации (изменения) в протоонкогене могут привести к тому, что он станет онкогеном, в котором он станет сверхактивным и может вызвать рост раковых клеток 3
- гена-супрессора опухоли: тип гена, который вырабатывает белок, называемый белком-супрессором опухоли, который помогает контролировать рост клеток. Мутации (изменения в ДНК) генов-супрессоров опухолей могут привести к раку. 3
Каждая ткань и орган в организме состоит из огромных популяций клеток, общее количество которых превышает 10 14 (100 000 000 000 000).Поразительные 10 12 (1 000 000 000 000) клеток умирают или теряются в течение обычного дня, и их необходимо заменять для поддержания жизни.
Процесс, при котором клетки растут и делятся, чтобы восполнить потерянные клетки, называется пролиферацией клеток. Это строго регулируемая деятельность в нормальной здоровой ткани. Синтез новых клеток уравновешивается с потерей клеток, так что общее количество клеток, составляющих все ткани и органы в организме, остается практически неизменным. 4-7
Рост клеток, репликация генетического материала и деление клеток — все это регулируется клеточным циклом, высокоупорядоченной серией событий, кульминацией которых является митоз (деление клетки, приводящее к возникновению двух дочерних клеток).Развитие клеточного цикла зависит от успешного прохождения ряда критических фаз, известных как контрольные точки, которые обеспечивают синтез полностью функционирующих дочерних клеток. 6-9
Учебная деятельность
Далее: Аномальная пролиферация клеток
Анализы пролиферации — Анализы живых клеток Incucyte® и приложения
Ключевые преимущества анализа пролиферации Incucyte®
Запросить дополнительную информацию Просмотреть публикации Incucyte ™ Proliferation
Визуализируйте и количественно оцените пролиферацию клеток с помощью покадровой визуализации
- Наблюдайте за ростом клеток с течением времени и измеряйте пролиферацию клеток с помощью интуитивно понятных инструментов анализа изображений Incucyte® и анализов пролиферации клеток.Подтверждение лечебных эффектов с изображениями и видеороликами
Количественная оценка пролиферации клеток в режиме реального времени с использованием слияния клеток (второй столбец), анализа клеток (третий столбец) или подсчета флуоресценции клеток (четвертый столбец) в клетках фибросаркомы HT-1080. Для подсчета флуоресцентных клеток клетки метили не возмущающей ядерной меткой, Incucyte Nuclight Red Lentivirus Reagent. Обратите внимание на увеличение слияния или количества объектов с течением времени и соответствующие показатели.В таблице сравнивается использование различных подходов.
Автоматический анализ кривых роста и экстраполяция времени удвоения
- Определите, как и когда проявились эффекты лечения без удаления клеток из стабильной среды инкубатора — идеально для долгосрочных исследований (от 0 до> 10 дней)
Автоматическое и неинвазивное измерение эффективности лечения. Анализ пролиферации инкуцитов позволяет автоматически отображать и анализировать каждую лунку 96/384-луночного планшета, чтобы обеспечить считывание микропланшета пролиферации клеток с течением времени (A).Курсы пролиферации показывают зависимые от концентрации эффекты лечения (B). Преобразуйте данные в кривые «концентрация-ответ» для сравнения фармакологии (C).
Простые и гибкие протоколы 96/384 лунок: без промывки, без фиксации, без подъема
- Планшет с клетками, добавление обработок и кинетическое считывание в системе анализа живых клеток Incucyte. Одновременное считывание до 6 384-луночных планшетов для скрининга со средней / высокой пропускной способностью
Просмотреть протокол анализа пролиферации инкуцитов
Просмотреть протокол увеличения количества клеток с пометкой
Мультиплекс с измерениями апоптоза и цитотоксичности
- Объедините анализы пролиферации Incucyte® с реагентами Incucyte® Cytotox, Incucyte® Annexin V или Incucyte® Caspase 3/7 для комплексных измерений цитотоксичности / апоптоза.Легко различать цитотоксические и цитостатические эффекты лечения.
Мультиплексный подсчет живых клеток с измерениями апоптоза с использованием Incucyte Proliferation Assays. Камптотецин (1 мкМ) обработал клетки фибросаркомы HT-1080 в присутствии реагента Incucyte Caspase 3/7 для обнаружения апоптоза. Используя Incucyte Cell-by-Cell Analysis, можно идентифицировать отдельные клетки в популяции и классифицировать их на основе зеленой флуоресценции, что позволяет рассчитать апоптотический индекс (% положительных зеленых клеток в популяции).
Количественно определить временные рамки и зависимость пролиферации и апоптоза от концентрации. Влияние камптотецина на клетки HT-1080: (A) количество клеток (B) апоптотический индекс и (C) кривые зависимости реакции от концентрации.
Изучите совместные культуры с помощью лентивирусных реагентов Incucyte® Nuclight
- Идентифицировать и количественно определить клетки в совместном культивировании путем маркировки лентивирусными реагентами Incucyte® Nuclight
Анализ пролиферации клеток для совместного культивирования Incucyte®. Замедленная съемка совместно культивируемых клеток HT1080 с ядерной меткой (зеленые ядра, Nuclight Green) и клеток A549 (красные ядра, Nuclight Red).
Влияние микросреды на химиотерапевтические препараты. Роль стромальных клеток в устойчивости клеток рака молочной железы к лапатинибу. Клетки аденокарциномы молочной железы SK-BR-3, меченные лентивирусным реагентом Incucyte® Nuclight Red, выращивали в монокультуре или в совместной культуре с немечеными стромальными фибробластами. Визуализация и анализ живых клеток инкуцитов показали, что лапатиниб сильно подавляет рост клеток SK-BR-3 в монокультуре (слева), но эффективность снижается, если клетки SK-BR-3 выращивают в совместной культуре со стромальными фибробластами (в центре и справа). .
Запросить дополнительную информацию Просмотреть публикации Incucyte® Proliferation
.
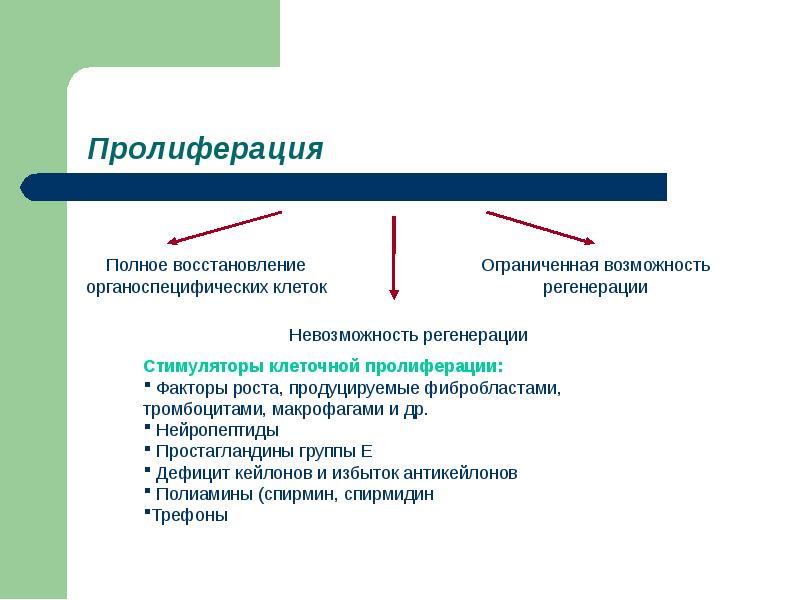
 В состав входят все необходимые реагенты, красители и специальные буферы для приготовления образцов ДНК из клеток и тканей
В состав входят все необходимые реагенты, красители и специальные буферы для приготовления образцов ДНК из клеток и тканей

 Фсйерабенда, означающего размножение, максимальное увеличение разнообразия взаимно исключающих гипотез и теорий, как необходимое условие успешного развития науки.
Фсйерабенда, означающего размножение, максимальное увеличение разнообразия взаимно исключающих гипотез и теорий, как необходимое условие успешного развития науки. Санкт-Петербург. ун-та. — 2012. — Серия 11. — №1. — С. 172-182.
Санкт-Петербург. ун-та. — 2012. — Серия 11. — №1. — С. 172-182. J. Cancer. — 1983. — Vol. 31. — P. 13-20.
J. Cancer. — 1983. — Vol. 31. — P. 13-20. , Palmu S., Vahlberg T. et al. Increased proliferation activity measured by immunoreactive Ki-67 is associated with survival improvement in rectal/recto sigmoid cancer // World J. Gastroenterol. — 2005. — Vol. 11, N 21. — P. 3245-3249.
, Palmu S., Vahlberg T. et al. Increased proliferation activity measured by immunoreactive Ki-67 is associated with survival improvement in rectal/recto sigmoid cancer // World J. Gastroenterol. — 2005. — Vol. 11, N 21. — P. 3245-3249. Что такое пролиферация
Что такое пролиферация