Периферический и плоскоклеточный рак легкого: 5 разновидностей
Периферический рак легкого – распространенная патология, коварство которой состоит в бессимптомном протекании начального периода болезни. Пациент не замечает значительного ухудшения самочувствия, потери трудоспособности и не обращается к врачу за помощью. Так упускается драгоценное время для избавления от недуга, и он трансформируется в запущенные стадии. Чтобы этого не произошло, нужно быть внимательным к знакам, подаваемым организмом.
Как определяются злокачественные опухоли дыхательного органа?
Разные виды рака легких затруднены для диагностики, потому что долгое время развиваются без выраженной симптоматики. Слабость, снижение работоспособности воспринимаются пациентами как проявления переутомления и не вызывают желания посетить врача, обследоваться.
Первое, что должно насторожить специалиста, – общие признаки, выявляемые при внешнем осмотре и опросе. Крупноклеточный рак легких сопровождается постоянным недомоганием, повышенной температурой, кашлем и нарушениями дыхания.
Чтобы определить бронхоальвеолярный рак легкого и другие типы патологии, назначаются следующие виды исследований:
- рентген;
- магниторезонансная и компьютерная томография;
- общие анализы крови и мочи;
- биохимия крови;
- гистологическое исследование злокачественного новообразования;
- изучение состава мокроты и т.д.
Врач назначает перечень исследований в зависимости от особенностей конкретного случая. Указанные анализы позволяют дифференцировать рак верхушки легкого от других заболеваний дыхательных путей: туберкулеза, пневмонии, хронического бронхита.
Практика показывает, что на ранних стадиях развития злокачественных новообразований пациенты редко обращаются к медикам. Большинство опухолей выявляется случайно, в ходе диспансеризаций, плановых осмотров. Специалисты видят проявления эндокринного железистого рака легкого на рентгенограмме и начинают лечение.
По данным статистики, при обнаружении патологии на 1-2 стадии, вероятность выздоровления составляет 90%. При диагностике на 3-4 она снижается до 20-30%. Чтобы не запустить опасную болезнь, необходимо не реже раза в год посещать врачебные осмотры.
Периферическая форма онкологии
Периферический рак легкого развивается в мелких бронхах, поэтому не имеет выраженной симптоматики. Часто опухоль выявляется случайно, во время прохождения планового медицинского осмотра. Клиническая картина становится яркой и настораживает пациента на 3-4 стадии болезни.
Злокачественное новообразование проявляется следующими общими симптомами:
- необоснованным повышением температуры;
- потерей массы тела.
К числу специфических признаков рака плевры легкого относится:
- сухой кашель;
- одышка;
- прожилки крови в мокроте.
Периферический рак левого легкого часто проявляется синдромом Горнера. Это боли, захватывающие область плеч, онемение пальцев рук, нарушение потоотделения верхних конечностей, мышечная слабость. Такая симптоматика часто ошибочно принимается за остеохондроз
Это боли, захватывающие область плеч, онемение пальцев рук, нарушение потоотделения верхних конечностей, мышечная слабость. Такая симптоматика часто ошибочно принимается за остеохондроз
Периферический рак правого легкого на запущенных стадиях способен давать неврологическую симптоматику, если опухолевое образование воздействует на шейное сплетение. При пережатии гортанного нерва в голосе пациента появляется характерная охриплость.
Периферический фиброз легких – это рак, лечение которого имеет благоприятный прогноз. Опухоль развивается медленно, даже на 2-3 стадии пациент не ощущает болей и сильного недомогания. Средняя продолжительность жизни с патологией – 10 лет. Для лечения используется химио- и лучевая терапия, проведение операции.
Центральная форма онкологии
Центральный рак легкого поражает часть дыхательного органа, где размещаются крупные кровеносные сосуды, нервные окончания. Такая форма болезни дает яркую и мучительную симптоматику с первой-второй стадии.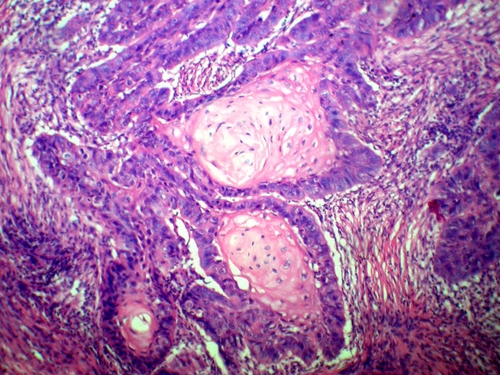
Центральный рак левого легкого проявляется следующей первичной симптоматикой, связанной с нарушением бронхиальной проходимости:
- приступообразным сухим кашлем, наиболее интенсивным в периоды ночного отдыха;
- слизистой мокротой с примесями гноя;
- кровохарканьем, легочным кровотечением;
- одышкой, преследующей онкобольного в том числе в состоянии покоя.
Общие симптомы патологии – усталость, вялость, резкое похудание, частое повышение температуры тела до 38 градусов.
Боли в области грудной клетки не всегда локализуются в месте развития опухоли. Возможно, что у пациента центральный рак правого легкого, а болит слева.
Пациент меняется внешне: наблюдается отечность верхней половины туловища, опухлость лица. При поражении гортанного нерва голос делается хриплым. Человека беспокоят частые головокружения, потери сознания. Метастазирование приводит к распространению болей по всему телу: наблюдаются неприятные ощущения в руках, спине, шее, суставах.
Метастазирование приводит к распространению болей по всему телу: наблюдаются неприятные ощущения в руках, спине, шее, суставах.
Осложнения патологии – пневмония, имеющая абсцедирующий характер. Мокрота делается гнойной, кашель – удушающим. Другое последствие – плеврит – накопление воспалительного вещества в полости дыхательного органа.
Эффективное лечение злокачественных опухолей центральной локализации отсутствует. На 3-4 стадии это уже неоперабельный рак легких из-за значительного распространения патологического процесса. Пациентам назначается поддерживающая лучевая терапия, прием медикаментов, симптоматическое лечение (противокашлевые препараты, обезболивающие и т.д.).
На 1-2 стадии еще операбельный – резекция доли дыхательного органа. После хирургического вмешательства онкобольному назначается химио- и (или) лучевая терапия.
Разница центрального и периферического рака легкого в прогнозе лечения. В первом случае шансы пациента невысоки, особенно при обнаружении проблемы на 3-4 стадии. Продолжительность жизни редко превышает 5 лет. Во втором случае терапия более эффективна, онкобольные живут 10 лет и более.
Продолжительность жизни редко превышает 5 лет. Во втором случае терапия более эффективна, онкобольные живут 10 лет и более.
Гистологические типы опухоли
В зависимости от строения клеток, возникающих в злокачественном процессе, опухоли делятся на два типа:
- Мелкоклеточный рак легкого
Это тип опухоли, отличающийся высокой агрессивностью и злокачественностью. Он составляет около 15% всех случаев и преимущественно поражает лиц мужского пола возраста 50-60 лет.
Изначальное развитие мелкоклеточного рака легкого начинается с центральной формы. Болезнь стремительно прогрессирует: вскоре начинается метастазирование в кости скелета, головной мозг, печень, надпочечники. Продолжительность жизни без терапевтических мероприятий составляет не более трех месяцев.
Развитие мелкоклеточного рака легкого начинается с продолжительного кашля, который ошибочно воспринимается как «норма» для злостного курильщика. Вскоре добавляются общие симптомы: слабость, головные боли, отсутствие аппетита, потеря веса.
- Немелкоклеточный рак легкого
Это более 80% случаев заболевания. Опухоль развивается медленно и имеет более благоприятный прогноз, чем мелкоклеточная вариация. При ранней диагностике возможно полное излечение пациента.
Заболевание развивается постепенно, симптомы практически не проявляются до 3-4 стадии. Немелкоклеточный рак легкого сопровождается диспноэ, возникновением неприятного запаха изо рта, затрудненным дыханием (особенно в ночные часы), болями грудной клетки, повышенной температурой и общей слабостью. При метастазировании наблюдаются дополнительные симптомы: ломота в костях, увеличение лимфоузлов, головные боли, нарушения проходимости пищевода.
Видео
Видео – как защитить себя от рака лёгкого?
Типы патологии по строению клеток
В зависимости от особенностей клеточного развития выделяют такие разновидности рака:
- Низкодифференцированный плоскоклеточный рак легкого
Пораженные болезнью клетки похожи по внутреннему строению походят на здоровые. Патология поражает преимущественно пациентов после 50-ти лет, медленно развивается, ее проявления на первой-второй стадии практически отсутствуют. После хирургического вмешательства человек может прожить еще до 10-ти лет. Прогноз в целом благоприятный.
Патология поражает преимущественно пациентов после 50-ти лет, медленно развивается, ее проявления на первой-второй стадии практически отсутствуют. После хирургического вмешательства человек может прожить еще до 10-ти лет. Прогноз в целом благоприятный. - Низкодифференцированный рак легкого
Развитие недифференцированного рака легкого происходит стремительно. Клетки практически ничем не похожи на своих «предшественников», из которых они произошли в результате нарушения генетического кода. Патология развивается агрессивно, яркая симптоматика проявляется на ранних стадиях. Прогноз для пациента крайне неблагоприятный. - Умеренный немелкоклеточный рак легкого (умеренно дифференцированный плоскоклеточный)
Это средняя степень дифференцировки. Опухоль развивается быстрее, чем в первом случае, но не столь стремительно, как во втором. Успех терапевтических мероприятий зависит от стадии, на которой диагностировали болезнь.
Гистологические типы раковой опухоли
С точки зрения гистологии злокачественные образования делятся на две группы:
- Плоскоклеточный ороговевающий рак легкого
Особенность патологии – стремительное прогрессирование метастаз. Пораженные клетки быстро разносятся по всему телу с лимфотоком.
Пораженные клетки быстро разносятся по всему телу с лимфотоком. - Плоскоклеточный неороговевающий рак легкого
Пораженные клетки делятся со скоростью, превышающей темп развития здоровых тканей, что обуславливает быстрый рост злокачественного новообразования.
Реже встречаются проявления железистого рака легкого. Это форма болезни поражает преимущественно женщин после 40 лет.
Лечение и диагностика раковых опухолей, например, бронхогенный рак, – актуальная проблема современной медицины. Несмотря на прогресс науки, эффективные методы борьбы со злокачественными новообразованиями на поздних стадиях отсутствуют.
Справиться с патологией можно, если она обнаружена на начальном этапе развития. Чтобы не запустить опасную болезнь, необходимо проходить регулярные обследования у врача и следить за состоянием собственного организма.
Этим болеют тысячи россиян. От болезни не застрахован никто: Наука и техника: Lenta.ru
Услышав диагноз «рак легкого», хочется сдаться и опустить руки.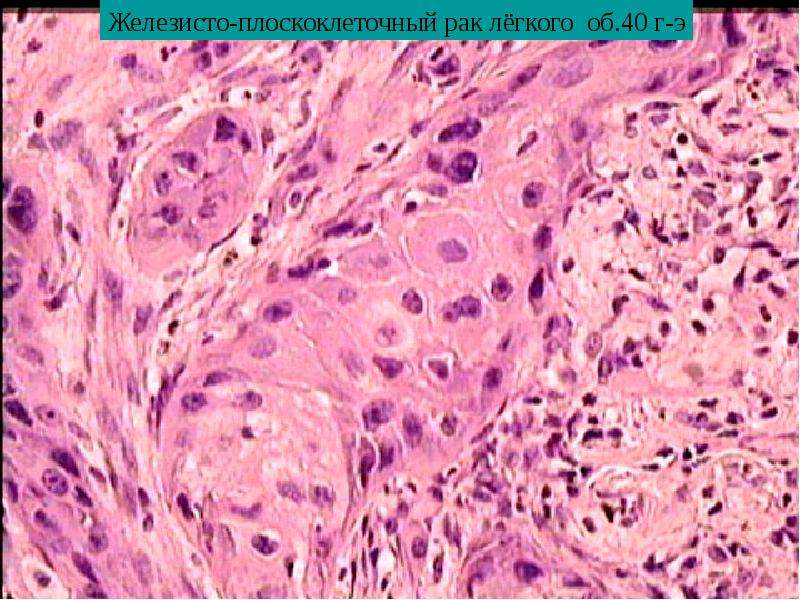 Это заболевание – самая частая причина смерти от онкологического заболевания у мужчин, а у женщин он уступает лишь раку молочной железы. Однако современные методы лечения помогают продлить жизнь пациента на годы, особенно когда опухоль диагностирована на ранних стадиях. «Лента.ру» рассказывает, какие варианты терапии доступны пациентам.
Это заболевание – самая частая причина смерти от онкологического заболевания у мужчин, а у женщин он уступает лишь раку молочной железы. Однако современные методы лечения помогают продлить жизнь пациента на годы, особенно когда опухоль диагностирована на ранних стадиях. «Лента.ру» рассказывает, какие варианты терапии доступны пациентам.
Рак легкого – это злокачественная опухоль, развивающаяся из эпителиальных клеток бронхов разного калибра. Когда клетки эпителия по тем или иным причинам начинают неконтролируемо делиться, возникает злокачественная опухоль, которая постепенно разрастается и вытесняет нормальные клетки эпителия.
Гистологический срез плоскоклеточного рака — одного из подтипов немелкоклеточного рака легкого
Изображение: librepathology.org
Рак легкого делится на типы в зависимости от того, как выглядят вышедшие из-под контроля клетки и какого они размера. Самый распространенный тип — немелкоклеточный рак легкого, который составляет примерно 85 процентов от всех случаев рака легкого.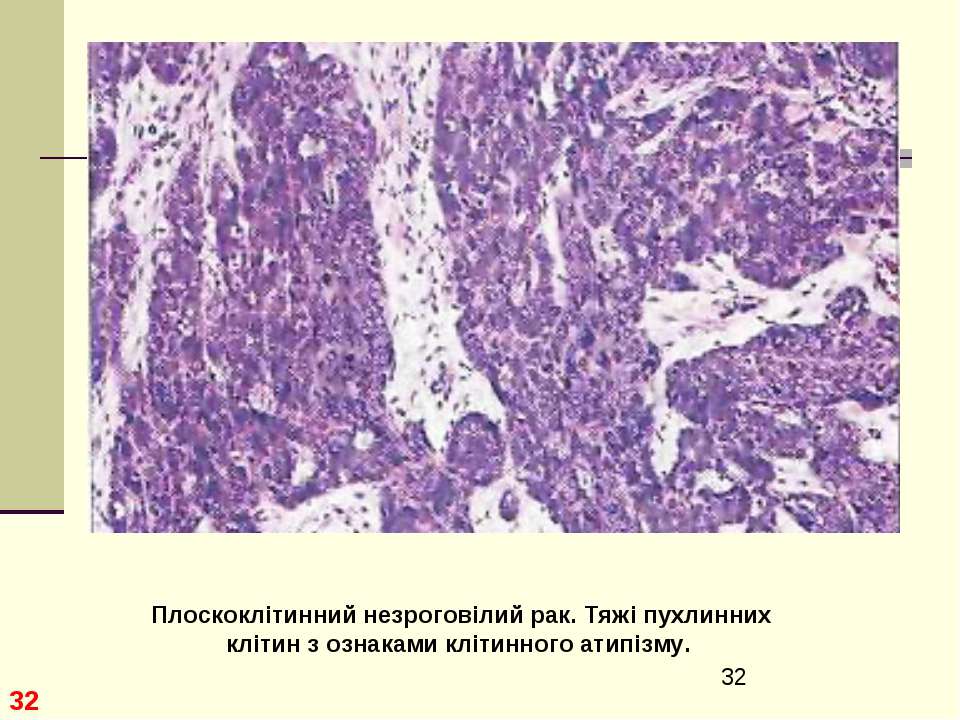
Цитологическая картина мелкоклеточного рака легкого
Изображение: Wikimedia.org
Другой тип – мелкоклеточный рак легкого – встречается намного реже. Он опасен тем, что его клетки делятся очень быстро. В большинстве случаев такой рак рано распространяется и в другие органы через кровь или лимфу (дает метастазы). Вследствие раннего метастазирования, в том числе, в оба легких, эффективно удалить его хирургическим путем бывает невозможно. Вместе с тем, использование противоопухолевой химиотерапии замедляет рост опухоли, а в ряде случаев приводит к полному излечению; особенно эффективными являются комбинации противоопухолевых препаратов и сочетание лекарственного метода с лучевой терапией.
Немелкоклеточный рак легкого, напротив, более устойчив к химиотерапии, но его бывает легче удалить при помощи операции.
Подходящий метод лечения и эффективность терапии зависят не только от разновидности рака, но и от его стадии. Злокачественные опухоли врачи классифицируют по системе TNM.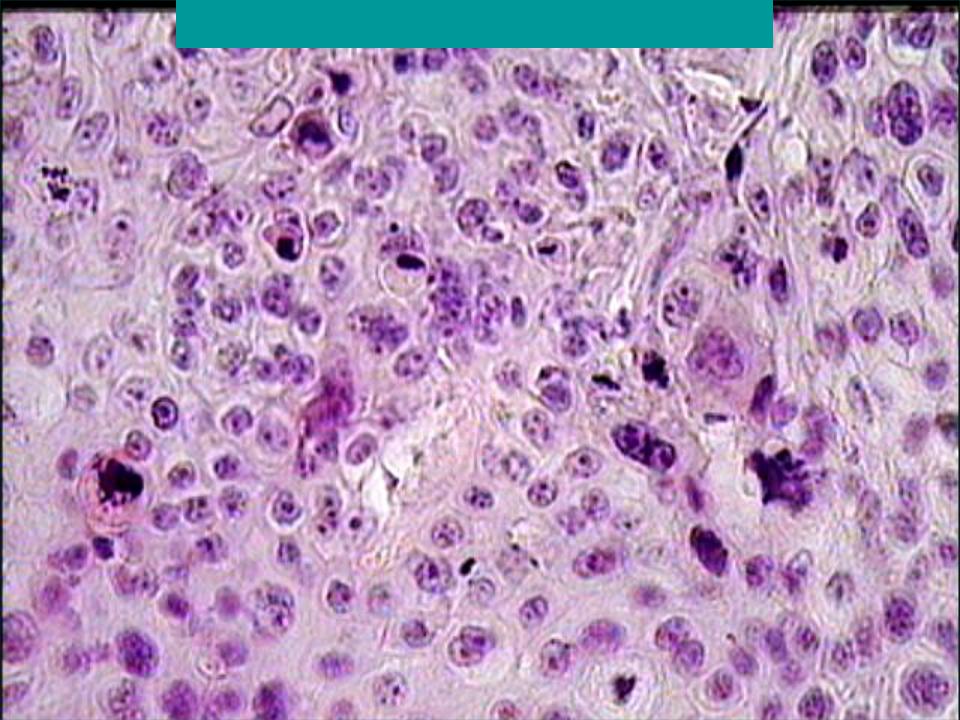
Аббревиатура образована по первым буквам слов tumor (опухоль), nodes (лимфатические узлы), metastasis (метастазы). Эти параметры помогают оценить размер опухоли, а также степень ее распространенности. Существует также классификация опухолей по стадиям от I до IV — в зависимости от размера, расположения и наличия метастазов.
В зависимости от стадии рак легкого можно разделить на локализованный (I-II стадии) и распространенный (III-IV стадии).
Избавиться от локализованного немелкоклеточного рака легкого может помочь хирургическая операция, после которой до 60 процентов пациентов проживут минимум пять лет. Нередко больные, которых отказались оперировать по месту обращения, стремятся найти другого хирурга. Они собирают деньги на операцию, выезжают за рубеж, но не учитывают, что операцию можно выполнить далеко не каждому, а иногда оно будет опаснее, чем другие методы лечения. Больным с мелкоклеточным раком легкого удалить опухоль хирургически можно только в том случае, если поражено одно легкое.
После операции больному нередко назначают курс химио- или лучевой терапии на тот случай, если в организме еще остались клетки опухоли. Это снижает вероятность возвращения болезни (рецидива). Такой подход рекомендуется при немелкоклеточном раке легкого, начиная со стадии IIB. На третьей стадии, которая считается условно операбельной, используется комбинированное лечение с применением лучевой или химиотерапии (*).
Лучевая терапия может стать хорошим вариантом для лечения рака легкого в том случае, когда опухоль невозможно удалить хирургическим путем или существует риск операционных осложнений. Но в одиночку этот метод редко справляется, поэтому для усиления действия его сочетают с химиотерапией.
Химиотерапия для немелкоклеточного рака легкого может стать дополнением к хирургической операции. Она может стать и основным способом лечения для пациентов, которым операция по различным причинам не может быть проведена. Лекарства замедляют деление клеток или убивают их. Оба метода помогают продлить жизнь пациентов.
Для мелкоклеточного рака легкого химиотерапия будет основным лечением, зачастую в сочетании с лучевой терапией. Облучение уничтожает опухолевые клетки в лимфатических узлах, если заболевание распространилось и на них (**).
Преимущества лучевой и химиотерапии даются высокой ценой. Качество жизни пациентов ухудшают побочные эффекты: сильные боли, потеря волос, постоянная тошнота, когнитивные нарушения. При лечении страдают не только клетки опухоли, но и здоровые клетки организма. Комбинация этих подходов подойдет только пациентам с удовлетворительным общим состоянием (0-1 балл по шкале ECOG, основанной на степени двигательной активности, по которой определяется функциональный статус). К сожалению, несмотря на все эти жертвы, болезнь отступает далеко не всегда. Поэтому исследователи всего мира десятилетиями вели поиски более эффективных и безопасных методов терапии, при которых здоровые клетки не страдали бы.
Частичное решение данной проблемы было найдено в 1980-х годах.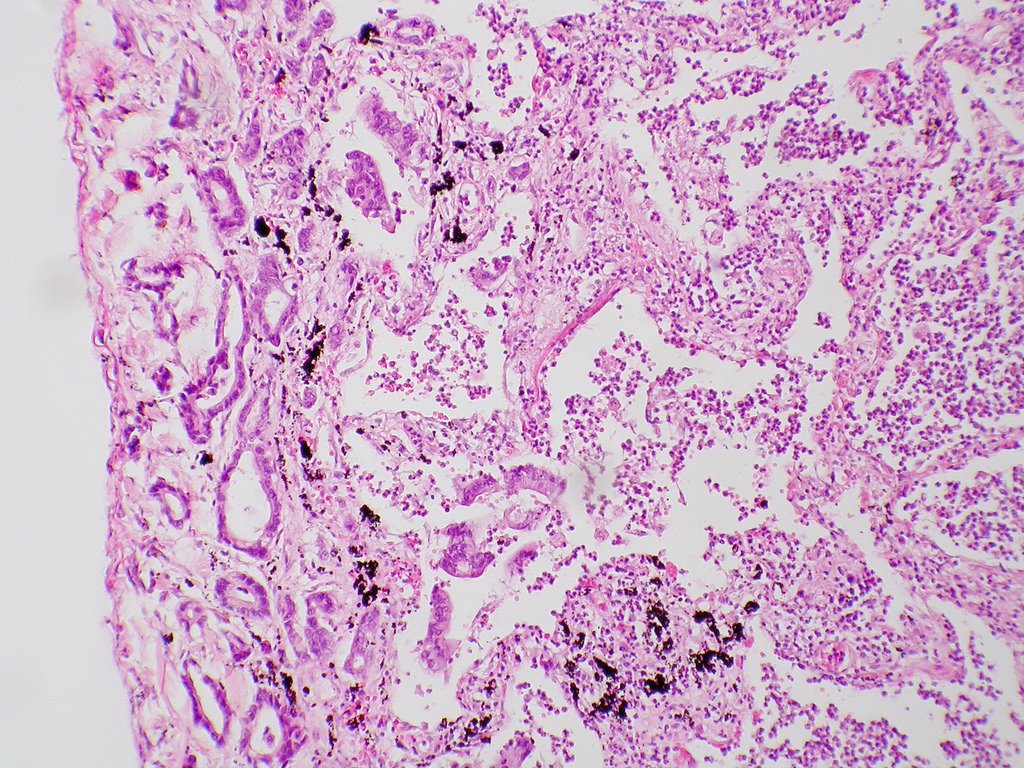 Именно тогда ученые экспериментально доказали, что клетки опухоли можно убивать при помощи лекарств, которые химически связываются со специфической «мишенью» — белками, располагающимися в большей степени на раковых клетках и, в меньшей степени на всех остальных клетках организма. Так появилась таргетная терапия (от английского target — «мишень»).
Именно тогда ученые экспериментально доказали, что клетки опухоли можно убивать при помощи лекарств, которые химически связываются со специфической «мишенью» — белками, располагающимися в большей степени на раковых клетках и, в меньшей степени на всех остальных клетках организма. Так появилась таргетная терапия (от английского target — «мишень»).
В борьбе против немелкоклеточного рака легкого применяется несколько типов таргетной терапии: препараты, влияющие на рост кровеносных сосудов, и препараты, воздействующие на специфические белки, которые появляются в клетках из-за генетических нарушений. Эти лекарства могут быть эффективны даже на поздних стадиях, а также в тех случаях, когда другая терапия не помогла или когда болезнь возвращается.
Препараты первого типа нацелены на белок, стимулирующий рост сосудов. Его подавление лишает опухоль питания.
Вторая группа препаратов нацелена на специфические белки, кодируемые генами EGFR, ALK или ROS-1, которые отвечают за деление и рост клеток.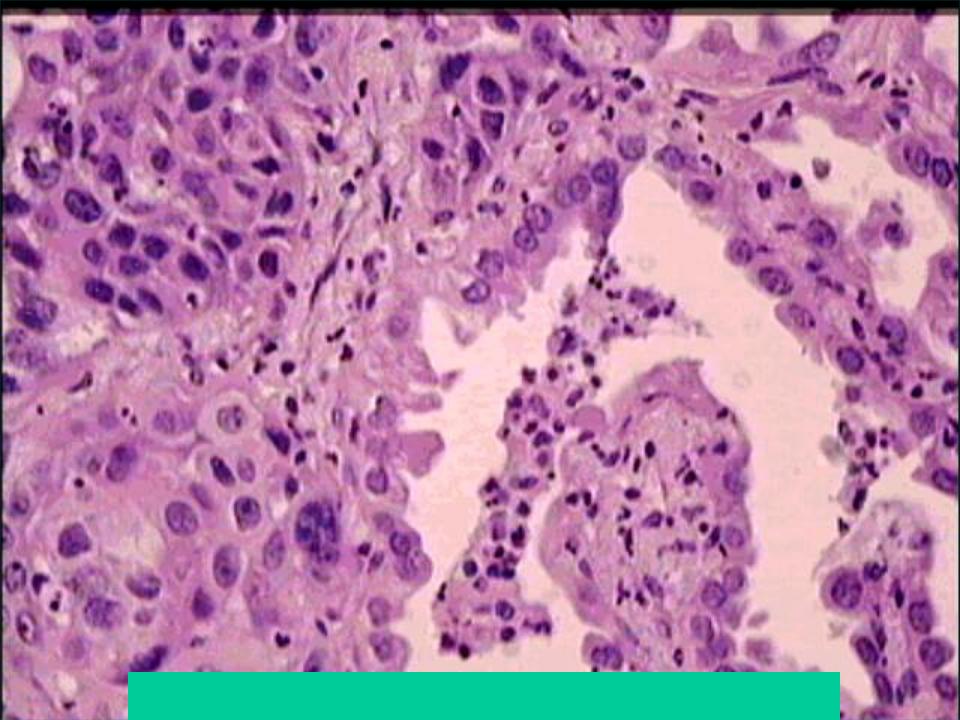 Некоторые мутации могут приводить к повышенному синтезу этих белков, из чего следует неконтролируемое деление и развитие опухоли.
Некоторые мутации могут приводить к повышенному синтезу этих белков, из чего следует неконтролируемое деление и развитие опухоли.
Генетические нарушения или мутации, приводящие к избыточному синтезу белков, на которые нацелена таргетная терапия, есть у 10-35 процентов пациентов с немелкоклеточным раком легкого, поэтому данный вид лечения может применяться далеко не у всех больных. Что же делать остальным?
В последнее десятилетие набирает обороты новое направление в медицине — иммуноонкология. Несколько лекарств этого типа уже одобрены для лечения немелкоклеточного рака легкого. Как и в случае с таргетной терапией, важную роль играют белки на поверхности опухолевых клеток или биомаркеры. В одиночку иммуноонкологические препараты могут применяться примерно у одной трети больных, опухолевые клетки которых имеют экспрессию специфических белков на поверхности, но в комбинации с химиотерапией лечение может применяться вне зависимости от этого условия, то есть даже при отсутствии биомаркеров. Иммуноонкологические препараты изменили прогноз при немелкоклеточном раке легкого, поскольку при наличии в опухоли высокой экспрессии специфических белков каждый третий пациент живет более 5 лет (***).
Иммуноонкологические препараты изменили прогноз при немелкоклеточном раке легкого, поскольку при наличии в опухоли высокой экспрессии специфических белков каждый третий пациент живет более 5 лет (***).
Чтобы понять, как это работает, вспомним об исследованиях Джеймса Эллисона и Тасуку Хондзе, которые получили Нобелевскую премию по физиологии и медицине «за открытие терапии рака при помощи подавления негативной иммунной регуляции» в 2018 году. Что это значит и как это может быть связано с лечением злокачественных опухолей?
Иммунная регуляция — настройка интенсивности, с которой иммунитет реагирует на опасность, будь то бактерия, клетка опухоли или клетка, зараженная вирусом. Эта система похожа на полицию, которая должна охранять порядок в государстве. Если полиция сработает плохо, пропустит и не обезвредит нарушителей, у человека может возникнуть рак. Если же иммунитет будет чересчур строгим, то пострадают невиновные — обычные клетки, которые никому не угрожают. Такой сценарий может привести к аутоиммунным заболеваниям — например, диабету, псориазу, системной красной волчанке.
Нобелевские лауреаты исследовали белки под названием PD-1 и CTLA-4. Эти белки находятся на поверхности Т-клеток, или Т-лимфоцитов (одного из типов иммунных клеток). Оба белка становятся «выключателями» активированных Т-клеток, чтобы они не атаковали нормальные клетки организма. Различие между ними заключается в фазе иммунного ответа, в которой они действуют: CTLA-4 работает в фазу активации Т-лимфоцитов, PD-1 — непосредственно в месте уничтожения патогена (в т.ч., опухолевой клетки). Предотвращение активации PD-1 или CTLA-4 называется подавлением негативной иммунной регуляции.
Подробнее об этом виде терапии – в ролике Национального института здоровья США (на английском)
Эти белки действуют как контрольные точки, которые не дают Т-лимфоцитам вершить расправу слишком опрометчиво. Но если в организме уже развивается злокачественная опухоль, то иммунитет, судя по всему, работал слишком слабо. Поэтому ученые придумали блокировать эти и другие контрольные точки. Если не останавливать Т-клетки, они быстрее заметят нарушения и начнут сами сражаться против опухоли.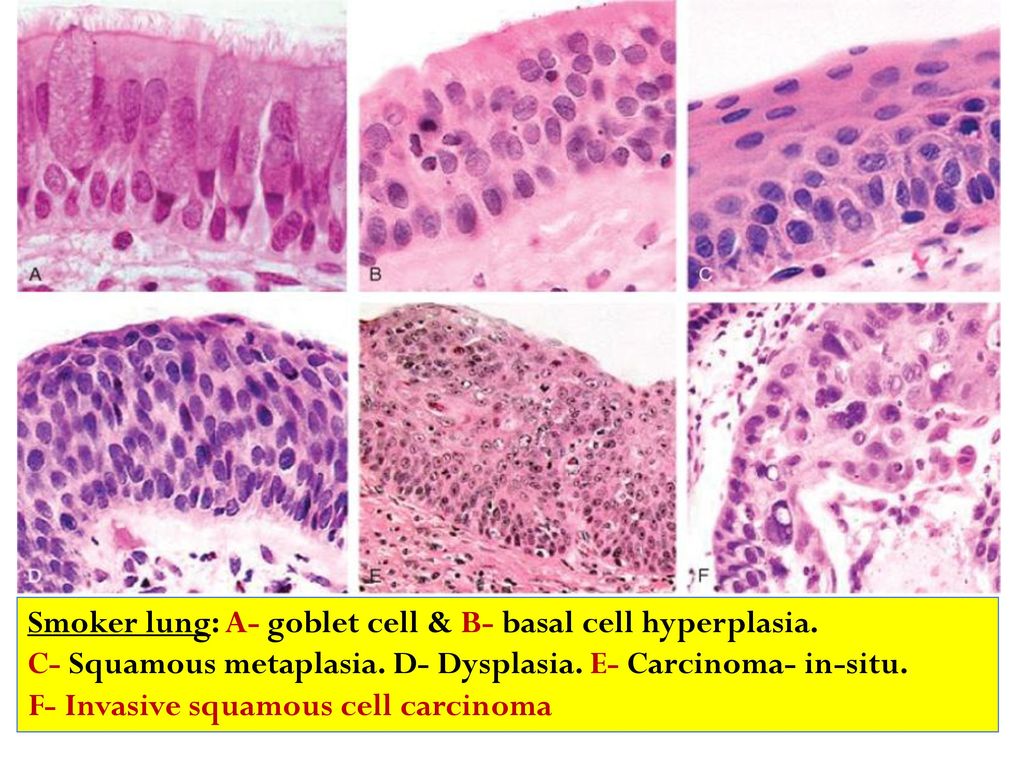 Эта идея стала революцией в лечении рака и привела к рождению нового направления терапии. Неудивительно, что за нее вручили самую престижную научную награду.
Эта идея стала революцией в лечении рака и привела к рождению нового направления терапии. Неудивительно, что за нее вручили самую престижную научную награду.
Особенности организма пациентов — от генетики и общего состояния здоровья до вида рака, его распространенности и молекулярного подтипа — делают каждый случай индивидуальным. Врачи принимают решение о тактике лечения, учитывая множество характеристик. Поэтому если вы где-то услышали, что лучше всего от рака легкого помогает химиотерапия, таргетная, иммунотерапия или, наоборот, операция, это еще не значит, что такой подход будет лучшим для вас. Но узнав особенности опухоли, ее распространенность и наличие биомаркеров, можно вместе с лечащим врачом выбрать оптимальный план лечения.
Не всегда рекомендованная схема лечения срабатывает сразу, и приходится переходить на другую. Порой рак возвращается через годы после проведенного с эффектом лечения, и для этих случаев также можно подобрать действенные методы.
Современная медицина быстро движется вперед: вероятность продлить жизнь онкологическим больным есть даже в тех случаях, которые казались безнадежными еще десять лет назад. Но ничто так не повышает шансы на успех, как ранняя диагностика. Поэтому стоит уделять внимание к своему здоровью и регулярно проходить медосмотр: чем быстрее удастся заметить нарушения, тем выше вероятность, что будет поставлен своевременный диагноз. Благодаря этому можно будет обойтись малыми жертвами.
Но ничто так не повышает шансы на успех, как ранняя диагностика. Поэтому стоит уделять внимание к своему здоровью и регулярно проходить медосмотр: чем быстрее удастся заметить нарушения, тем выше вероятность, что будет поставлен своевременный диагноз. Благодаря этому можно будет обойтись малыми жертвами.
***
Информация предоставлена при поддержке ООО «МСД Фармасьютикалс», 119021, Россия, г. Москва, ул. Тимура Фрунзе, д.11, стр. 1, тел. +7-495-916-70-94
Необходима консультация специалиста здравоохранения.
RU-NON-00117 04.2020
* — Лактионов К.К., Артамонова Е.В., Бредер В.В., Горбунова В.А., Моисеенко Ф.В., Реутова Е.В. и соавт. Практические рекомендации по лекарственному лечению немелкоклеточного рака легкого. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2019 (том 9). С. 32–48.
** — Чубенко В.А., Бычков М.Б., Деньгина Н.В., Кузьминов А.Е., Сакаева Д.Д., Семенова А.И. Практические рекомендации по лекарcтвенному лечению мелкоклеточного рака легкого. Злокачественные опухоли : Практические рекомендации RUSSCO #3s2, 2019 (том 9). С.49–54.
Злокачественные опухоли : Практические рекомендации RUSSCO #3s2, 2019 (том 9). С.49–54.
*** — DOI: 10.1200/JCO.19.00934 Journal of Clinical Oncology 37, no. 28 (October 01, 2019) 2518-2527.
Цитологическая диагностика мукоэпидермоидного рака легкого uMEDp
На конкретном примере продемонстрирована значимость комплексного морфологического исследования с использованием жидкостной цитологии, клеточных блоков и иммунофенотипирования для верификации диагноза «мукоэпидермоидный рак легкого».Рис. 1. Осадок перикардиальной жидкости. Цитологический препарат групп опухолевых клеток, формирующих железистоподобные структуры (окраска по Романовскому – Гимзе, 20-кратное увеличение)
Рис. 2. Мокрота. Цитологический препарат групп опухолевых клеток в виде солидного комплекса (окраска по Романовскому – Гимзе, 20-кратное увеличение)
Рис.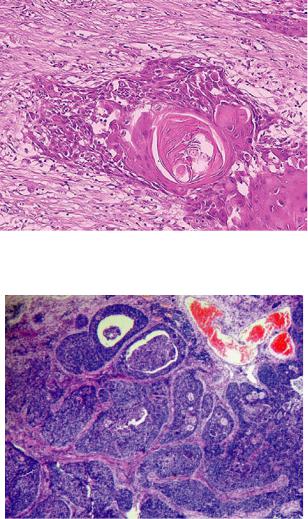 3. Отпечаток браш-биопсии. Цитологический препарат опухолевых клеток с центрально расположенными ядрами, плотной цитоплазмой и признаками секреторной активности (окраска по Романовскому – Гимзе, 100-кратное увеличение)
3. Отпечаток браш-биопсии. Цитологический препарат опухолевых клеток с центрально расположенными ядрами, плотной цитоплазмой и признаками секреторной активности (окраска по Романовскому – Гимзе, 100-кратное увеличение)
Рис. 4. Материал браш-биопсии. Цитологический препарат опухолевых клеток с центрально расположенными ядрами, эозинофильной цитоплазмой и признаками секреции (окраска по Романовскому – Гимзе, 40-кратное увеличение)
Рис. 5. Мокрота. Положительная ИЦХ-реакция на MUC-1 в клетках опухоли (окраска по Романовскому – Гимзе, 20-кратное увеличение)
Рис. 6. Осадок перикардиальной жидкости. Положительная ИЦХ-реакция на р63 в клетках опухоли (окраска по Романовскому – Гимзе, 20-кратное увеличение)
Рис. 7. Мокрота. Положительная ИЦХ-реакция на р53 в клетках опухоли (окраска по Романовскому – Гимзе, 20-кратное увеличение)
Рис. 8. Осадок перикардиальной жидкости. Положительная ИЦХ-реакция на СК5/6 в клетках опухоли (окраска по Романовскому – Гимзе, 20-кратное увеличение)
8. Осадок перикардиальной жидкости. Положительная ИЦХ-реакция на СК5/6 в клетках опухоли (окраска по Романовскому – Гимзе, 20-кратное увеличение)
Введение
Мукоэпидермоидный рак бронха – редкая опухоль, подобная опухоли сиалоцитарного происхождения и характеризующаяся наличием клеток, вырабатывающих слизь и кератин, и клеток промежуточного типа. Мукоэпидермоидную опухоль с двойным метапластическим потенциалом P. Masson и L. Berger (1924) первоначально обнаpужили в слюнной железе. Были выявлены как доброкачественные опухоли, так и опухоли, склонные к рецидивированию и метастазированию. H. Smetana и соавт. (1952) описали такие же опухоли, исходящие из клеточных элементов бронхиальных желез. Эти новообразования длительный период времени относили к аденомам бронхов. Однако выяснилось, что они ведут себя как злокачественные новообразования [1, 2]. Последние годы для их обозначения используется термин «мукоэпидермоидный рак».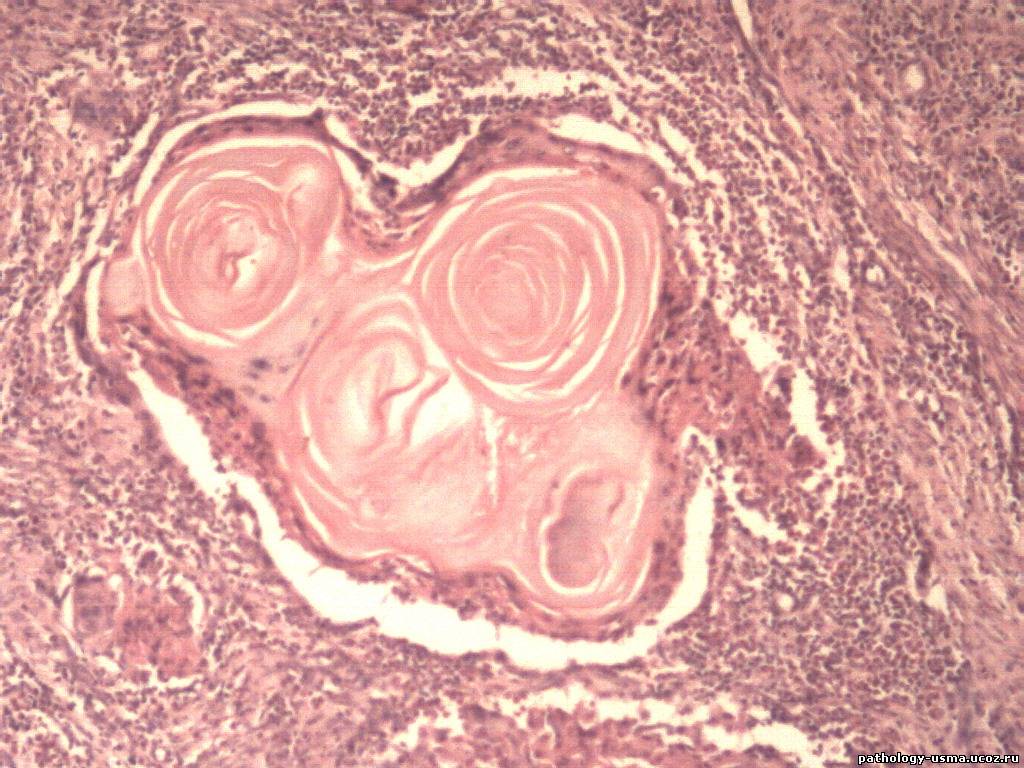
Мукоэпидермоидные опухоли составляют около 2% злокачественных опухолей нижних дыхательных путей и 6% (3–9%) опухолей трахеобронхиальных желез.
Патология встречается у лиц от девяти до 78 лет. Средний возраст больных – 34,8 года. Однако около 50% пациентов моложе 30 лет. Соотношение заболевших мужчин и женщин оценивается как 9:1.
К 1980 г. описано более 80 случаев мукоэпидермоидного рака дыхательных путей (пять на 1000 случаев бронхогенного рака), 51 из них у детей [3].
Мукоэпидермоидный рак трахеи впервые был описан P.E. Larson и соавт. (1965), затем G.P. Trentini и соавт. (1970) и H. Said и соавт. (1988). Анализируя собственные наблюдения, исследователи отметили, что в трахее элементы данной опухоли чаще встречаются в сочетании с другими гистологическими структурами. Мукоэпидермоидный рак трахеи в чистом виде описали N.K. Leonardi и соавт. (1978).
В настоящее время известны 12 задокументированных случаев мукоэпидермоидного рака трахеи, в том числе три случая у детей [9].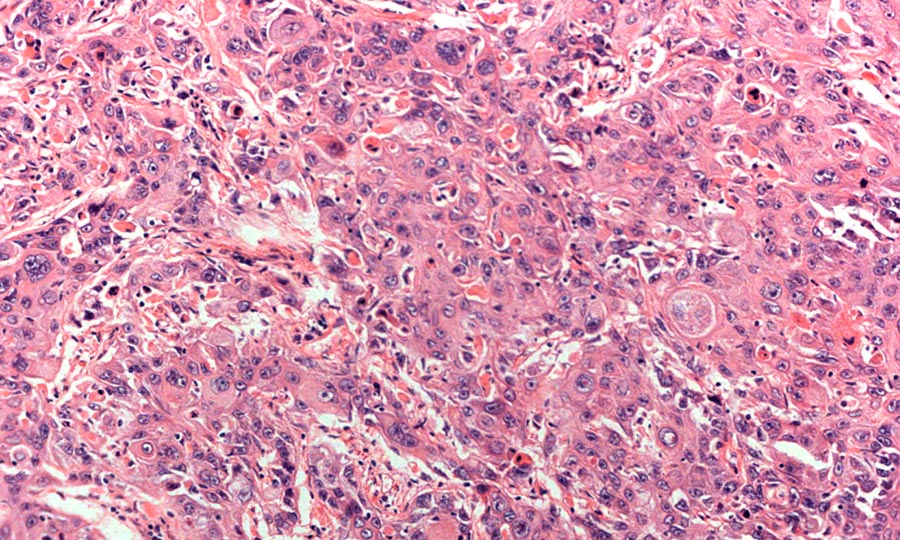 Среди отечественных исследователей впервые об этой локализации опухоли упомянул К.Ф. Юдаев [4].
Среди отечественных исследователей впервые об этой локализации опухоли упомянул К.Ф. Юдаев [4].
Мукоэпидермоидная опухоль имеет вид эндофитного или экзофитного образования диаметром от 0,8 до 6,0 см. Располагается, как правило, на задней/боковой стенке бронха или на границе с главным бронхом и покрыта слизистой оболочкой [5]. Микроскопически паренхима опухоли с высокой степенью дифференцировки состоит из железистых структур, трубочек, кист и солидных комплексов. Железистый компонент доминирует более чем в половине случаев. Призматические муцинозные элементы, бокаловидные клетки или светлые кубические онкоцитарные клетки выстилают железы или кисты. Кисты могут разрываться, в результате слизь попадает в окружающую строму и создаются условия для гранулематозного процесса. Кроме того, выявляются базальные и промежуточные (транзиторные) клетки, реже – кератиноциты, формирующие солидные очаги, гнезда и тяжи. Полигональные клетки промежуточного типа имеют центрально расположенные ядра и амфофильную или слабоэозинофильную цитоплазму.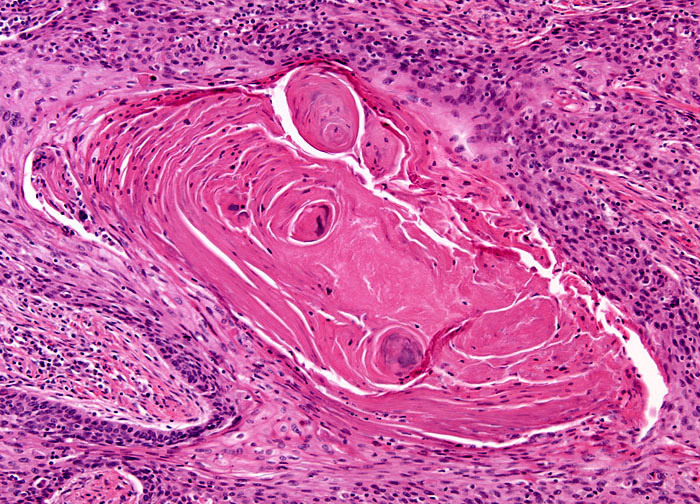 Ороговевающие клетки с эозинофильной или прозрачной цитоплазмой обладают межклеточными мостиками, однако роговых жемчужин не формируют. Строма обычно гиалинизирована и может напоминать амилоид. В ней отмечаются очаги обызвествления или окостенения.
Ороговевающие клетки с эозинофильной или прозрачной цитоплазмой обладают межклеточными мостиками, однако роговых жемчужин не формируют. Строма обычно гиалинизирована и может напоминать амилоид. В ней отмечаются очаги обызвествления или окостенения.
До 80% случаев наблюдений представлены низкодифференцированной формой мукоэпидермоидного рака, при которой описанные выше признаки двухфазной специализации опухолевой паренхимы сглажены. Кроме того, при данной форме рака клеточный полиморфизм и митотическая активность опухолевой паренхимы выражены сильнее. Примерно у половины больных отмечаются признаки инвазии в легочной паренхиме [5–7].
По цитологической картине отличить мукоэпидермоидный рак от умеренно дифференцированной аденокарциномы практически невозможно. Опухоль можно распознать при исследовании отпечатков с биоптата. В данном случае цитологическая картина будет иметь следующие особенности: элементы базального, реже – шиповатого слоя эпидермиса образуют массивные скопления, присутствуют секретирующие слизь опухолевые клетки, встречаются также элементы с железистой дифференцировкой в виде отдельных клеток, клеточных групп и железистоподобных структур.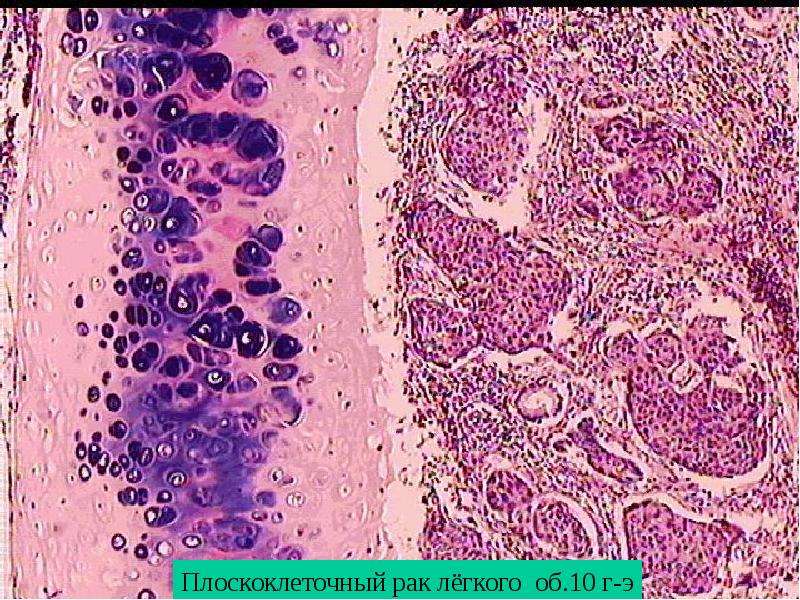 Размеры и форма железистых клеток варьируются в зависимости от количества слизи в цитоплазме. В мазках иногда обнаруживаются группы опухолевых клеток с вакуолизированной или пенистой цитоплазмой. Их наличие особенно характерно для мукоэпидермоидного рака.
Размеры и форма железистых клеток варьируются в зависимости от количества слизи в цитоплазме. В мазках иногда обнаруживаются группы опухолевых клеток с вакуолизированной или пенистой цитоплазмой. Их наличие особенно характерно для мукоэпидермоидного рака.
К клиническим признакам относятся раздражение или обструкции дыхательных путей (кашель, кровохарканье, лихорадка), а также пневмония или ателектаз. Примерно у четверти пациентов клиническая симптоматика отсутствует [7–9].
Клинический случай
Нами проведена морфологическая диагностика мукоэпидермоидного рака у пациента В. 39 лет. Больной был направлен в стационар с диагнозом «правосторонняя внебольничная пневмония».
Из анамнеза известно, что в течение месяца пациент жаловался на сухой кашель, усиливающийся в положении лежа на спине и на правом боку, повышение температуры тела – максимально до 38,5 ºС в вечернее время.
При поступлении выполнена компьютерная томография органов грудной клетки и головного мозга: двусторонний гидроторакс, справа осумкованный, в перикарде выпот, объемные образования головного мозга и отек головного мозга в стадии компенсации. Осложнение основного заболевания – угроза тампонады сердца.
Осложнение основного заболевания – угроза тампонады сердца.
В тот же день проведены пункция плевральной полости слева, перикарда и дренирование перикарда. Из плевральной полости эвакуировано около 800 мл экссудата, из перикарда – 300 мл.
При цитологическом исследовании осадка выпотной жидкости обнаружены элементы злокачественной опухоли, имеющие сходство с аденокарциномой. Поэтому были взяты мокрота, мазки-отпечатки и браш-биопсия правого легкого (бронх первого порядка, нижний и средний долевой бронх). В материалах выявлены злокачественные клетки с центрально расположенными ядрами и эозинофильной цитоплазмой, некоторые с признаками секреции (рис. 1–4).
Гистогенез опухоли был неясен, поэтому было проведено иммуноцитохимическое (ИЦХ) исследование с использованием панели антител: TTF-1, СК7, СК5/6, р63, р53, MUC-1. В клетках опухоли не наблюдалось экспрессии TTF-1, однако окраска на CK5/6, p63, р53, MUC-1 дала резко положительный результат, в 40% клеток опухоли положительная реакция на СК7 (рис. 5–8).
5–8).
Исходя из клинических проявлений заболевания и результатов цитологического и ИЦХ-исследований, сделано заключение: иммунофенотип опухоли соответствует мукоэпидермоидному раку легкого.
Результаты гистологического исследования материала биопсии: в стенке бронха множественные очаги опухолевого роста, состоящие из гнезд и тяжей атипичных крупных клеток с полиморфными гиперхромными ядрами, множественными патологическими митозами.
Результаты иммуногистохимического исследования: СК7, p63, Ki67 – экспрессия положительная, TTF-1, CD56, CgA – реакция отрицательная. Иммунофенотип опухоли соответствует плоскоклеточному раку. Индекс пролиферации 50%.
Заключение: низкодифференцированный плоскоклеточный рак (G3).
В описанном клиническом случае имела место сложная в диагностическом плане морфологическая картина. В экссудате, полученном из полости перикарда, обнаружены клетки злокачественной опухоли эпителиальной природы.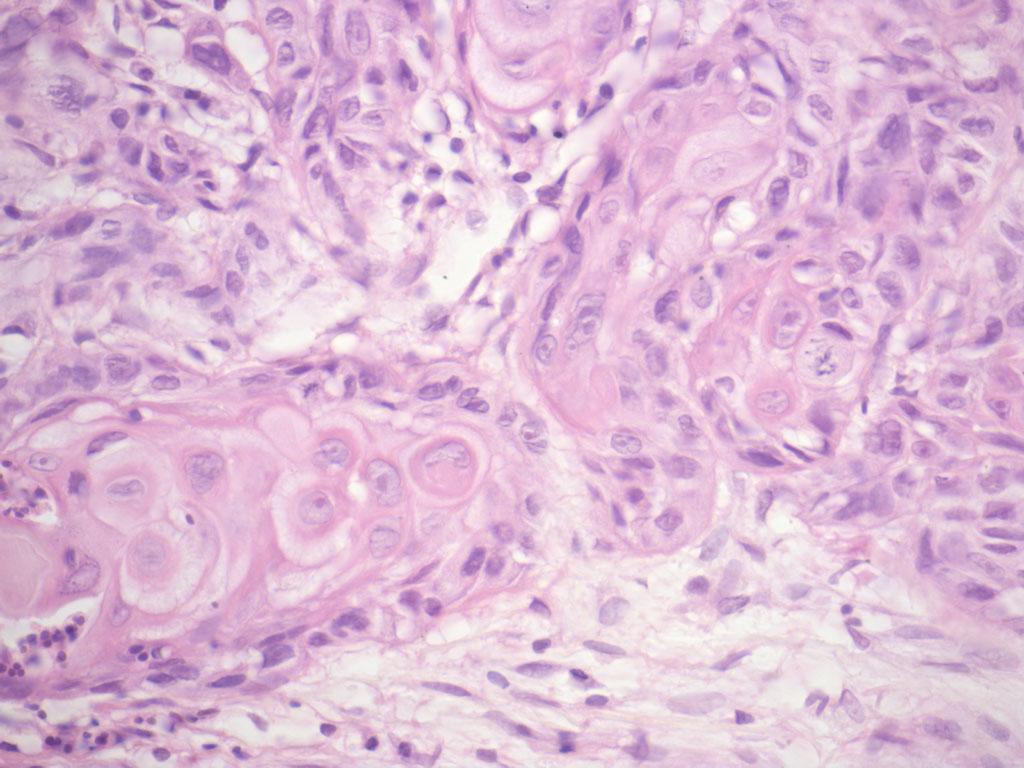 Морфологический диагноз цитопатологом установлен с помощью дополнительного метода исследования – иммунофенотипирования опухоли. На основании результатов ИЦХ-исследования предоперационно установлен диагноз – мукоэпидермоидный рак, метастатическое поражение перикардиальной и плевральной полостей.
Морфологический диагноз цитопатологом установлен с помощью дополнительного метода исследования – иммунофенотипирования опухоли. На основании результатов ИЦХ-исследования предоперационно установлен диагноз – мукоэпидермоидный рак, метастатическое поражение перикардиальной и плевральной полостей.
Заключение
При наличии железистого и плоскоклеточного компонентов в традиционных цитологических препаратах, приготовленных из биологического материала, необходимо проводить комплексное морфологическое исследование с использованием жидкостной цитологии, клеточных блоков и иммунофенотипирование. Определение гистогенеза опухоли и ее органной принадлежности позволяет значительно повысить точность цитологической диагностики.
Плоскоклеточный Неороговевающий Рак Легкого 4 Стадия Прогноз
Данное онкологическое заболевание возникает из клеток плоского эпителия. Они могут присутствовать в пищеводе и гортани, в ротовой полости, в шейке матки и мочевом пузыре.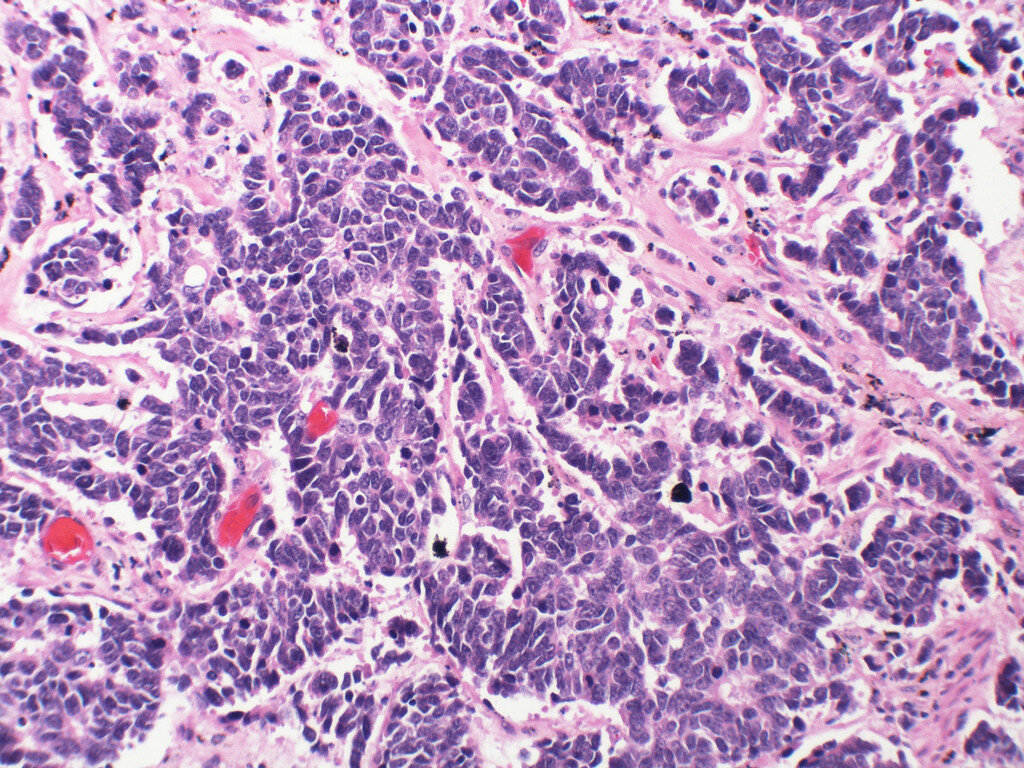 Поэтому опухоль может развиться в любом органе человека. На сегодняшний день плоскоклеточный рак легкого имеет неутешительные прогнозы. Но своевременное лечение может существенно продлить жизнь пациента.
Поэтому опухоль может развиться в любом органе человека. На сегодняшний день плоскоклеточный рак легкого имеет неутешительные прогнозы. Но своевременное лечение может существенно продлить жизнь пациента.
Рак лёгких можно победить. Как вылечить рак легких рассказывает онколог, к.м.н. Андрей Пылёв:
21/5/ · Плоскоклеточный рак Плоскоклеточный неороговевающий рак лёгкого – не рассматривается с точки зрения дифференциации болезни. 4 стадия:5/5(2). Плоскоклеточный рак легкого 4 стадия – прогноз. К сожалению, на данном этапе любое лечение малоэффективно, в большинстве случаев назначается паллиативная терапия. Плоскоклеточный рак легкого развивается из клеток плоского эпителия, который присутствует в полости рта, гортани, пищеводе, шейке матки, поэтому это онкологическое новообразование может появиться в любом органе.
Таким образом, эта патология может развиться в любом органе.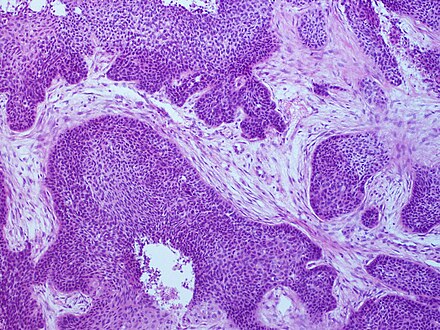 Клиническое протекание плоскоклеточного рака отличается от иных разновидностей онкологии. По статистике, правое легкое поражается чаще левого. Борьба с таким раком основана на использовании традиционных методов, применяемых в лечении других онкологических отклонений. Кроме того, выделяют 2 второстепенные формы: медиастинальную и диссеминированную. При центральном легочном раке происходит формирование карциномы главных бронхов.
Клиническое протекание плоскоклеточного рака отличается от иных разновидностей онкологии. По статистике, правое легкое поражается чаще левого. Борьба с таким раком основана на использовании традиционных методов, применяемых в лечении других онкологических отклонений. Кроме того, выделяют 2 второстепенные формы: медиастинальную и диссеминированную. При центральном легочном раке происходит формирование карциномы главных бронхов.
Рак, я тебя не боюсь! Рак легкого. Жить здорово! 24.05.2019:
Эффективное лечение плоскоклеточного рака легкого при помощи системы заболеваний, для плоскоклеточного рака легкого выделяют 4 стадии: По гистологическому признаку разделяют плоскоклеточный ороговевающий. Рак легкого – одно из самых распространенных онкологических заболеваний в мире как Прогноз заболевания, как правило, неблагоприятен: пятилетняя плоскоклеточный рак (ороговевающий, неороговевающий, базалоидная Целью лечения IV стадии НМРЛ является замедление прогрессирования.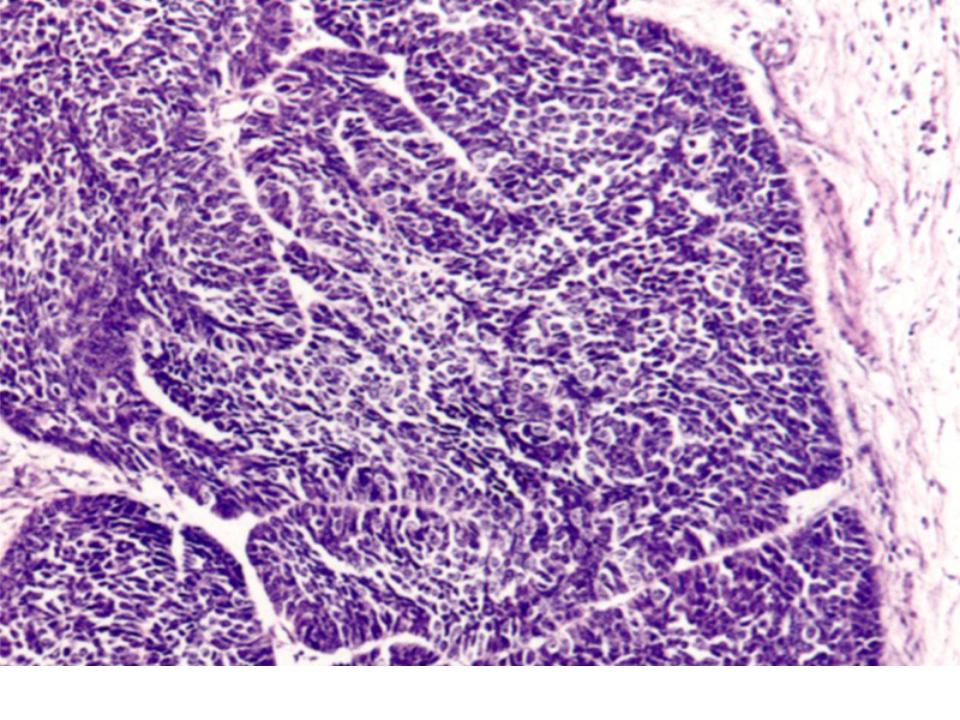 Ещё более удручает статистика смертности от рака лёгкого: Для дифференцированного плоскоклеточного рака характерно медленное целом негативный прогноз, объединяет несколько форм морфологически сходных характера и степени заболевания рака легких классифицируют 4 стадии.
Ещё более удручает статистика смертности от рака лёгкого: Для дифференцированного плоскоклеточного рака характерно медленное целом негативный прогноз, объединяет несколько форм морфологически сходных характера и степени заболевания рака легких классифицируют 4 стадии.
Рак легких — самая распространенная онкологическая патология во всем мире, при которой происходит зарождение злокачественной опухоли в тканях этого органа. Среди видов опухоли, чаще всего диагностируется плоскоклеточный рак легкого. Даже сегодня, прогнозы касательно именно этой болезни сложно назвать благоприятными, но диагностирование процесса во время его ранней стадии, пока еще не произошло серьезных осложнений, и вовремя начатое лечение рака легкого, могут спасти больного человека и значительно продлить ему жизнь. Плоскоклеточный рак легкого берет начало из клеток плоского эпителия, данная ткань состоит в строении многих органов, и поэтому подобная болезнь имеет возможность появиться в какой угодно точке организма. Кроме того, плоскоклеточный рак обладает своей специфической симптоматикой, имеющая массу отличий от других форм злокачественных новообразований.
Кроме того, плоскоклеточный рак обладает своей специфической симптоматикой, имеющая массу отличий от других форм злокачественных новообразований.
Метастаз плоскоклеточного рака легкого в лимфоузлы:
Прогноз при плоскоклеточном раке легкого заключительной стадии неблагоприятен — больные с опухолью на четвертой стадии живут в среднем около полугода, иногда 8 месяцев. В бронхах скапливается излишнее количество мокроты и появляется «привычный кашель курильщика» (хронический бронхит, т. е. дополнительный фактор риска, из-за которого может развиться плоскоклеточный рак легкого).
Изучить природу появления плоскоклеточных новообразований ученым пока не удалось, однако они определили факторы, которые могут спровоцировать рост раковой опухоли в легком:. Среди перечисленных причин, наиболее частой является курение. Еще есть и другие распространенные причины, способные вызывать развитие плоскоклеточного рака в области легкого:.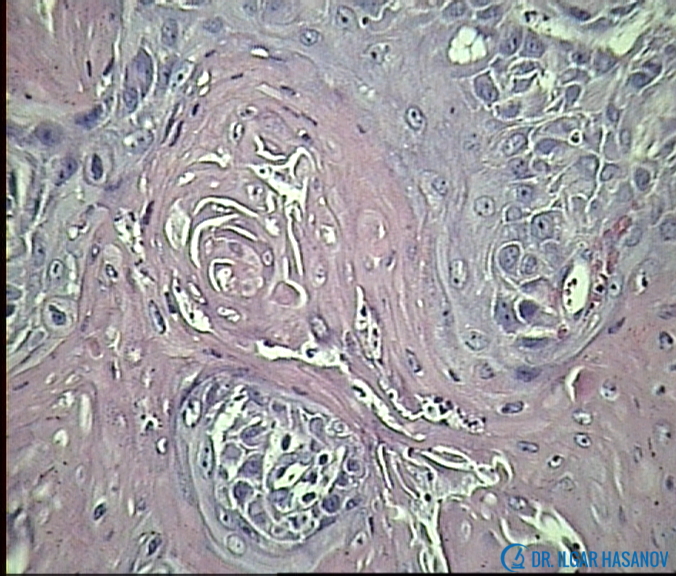 Независимо от причины развития плоскоклеточной формы рака в области легких, при обнаружении первых признаков патологии следует без замедлений обратиться за помощью врачей. Чем раньше будет начато лечение патологии, тем больше шансы вылечить болезнь. Исходя из клеточного строения опухоли, плоскоклеточный рак в области легких имеет такие гистологические формы:.
Независимо от причины развития плоскоклеточной формы рака в области легких, при обнаружении первых признаков патологии следует без замедлений обратиться за помощью врачей. Чем раньше будет начато лечение патологии, тем больше шансы вылечить болезнь. Исходя из клеточного строения опухоли, плоскоклеточный рак в области легких имеет такие гистологические формы:.
Мелкоклеточный рак лёгкого. Локальная стадия:
Неороговевающий рак легкого является умеренно дифференцированным. В течении плоскоклеточного рака легкого выделяют 4 стадии, которые. Плоскоклеточный рак легкого (25–40% случаев НМЛР)1,2 — развивается из клеток Прогноз заболевания, как правило, неблагоприятный. Стадия IV, Опухоль метастазирует в другие органы и системы, например, печень. Рак лёгкого (бронхогенный рак, бронхогенная карцинома, разг. рак легких) IV стадия — опухоль выходит за пределы лёгкого с распространением на соседние органы и Медленнее всего растёт дифференцированный плоскоклеточный рак; для Наличие метастазов значительно ухудшает прогноз.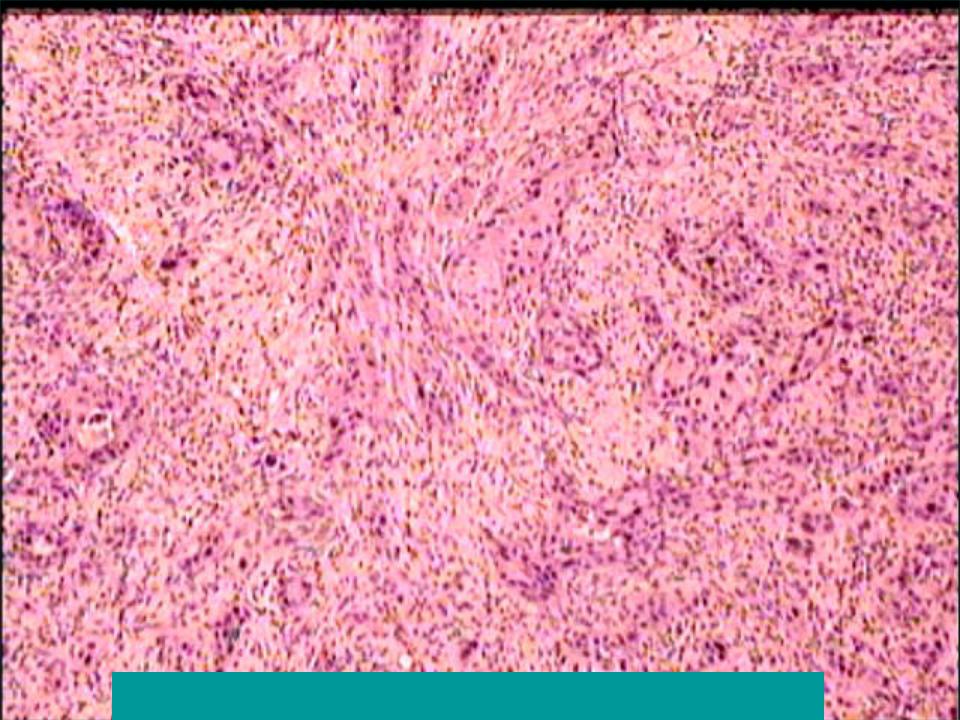
Рак легких — злокачественное образование, происходящее из эпителиальных клеток легкого. Заболеваемость данным типом опухоли за последние десятилетия увеличилась намного быстрее, нежели злокачественные образования других органов. Правильная классификация рака легких поможет составить представление о типе опухоли, ее росте и размерах, покажет на ее распространение в организме. Имея все эти характеристики можно с уверенностью прогнозировать течение болезни и результат лечения. Гистологическая классификация является главным типом классификации рака легких в составлении прогноза и лечении. В зависимости от элементов бронхиального эпителия различают следующие виды рака легких:. Рак легких у мужчин, встречается в 30 раз чаще нежели у представительниц слабого пола. Поражает в основном длительно курящих людей.
Роль хирургии в лечении III стадии рака легкого (РНЦХ)
👉 Признаки и современные методы лечения рака легкого. Рак легкого лечение. 12+
Рак легкого лечение. 12+
Беломорская Центральная районная больница.
Статья для общего ознакомления.
Рак (cancer) — злокачественная опухоль, возникающая из клеток эпителия кожи, слизистых оболочек и паренхиматозных органов. Иногда термин «рак» используют для обозначения всех злокачественных новообразований.
Строение опухоли в значительной степени связано со структурно-функциональными особенностями клеток органа или ткани, из которых она развивается. В большинстве случаев в тканях, соприкасающихся с внешней средой (коже, красной кайме губ, слизистой оболочке полости рта, языка, гортани, пищевода, заднего прохода) и покрытых многослойным плоским эпителием, возникает плоскоклеточный (ороговевающий или неороговевающий) рак. Он может также развиваться и в бронхах в результате метаплазии эпителия. Из эпителия желез исходит железистый рак — аденокарцинома. По степени дифференцировки принято выделять высоко-, умеренно, мало и недифференцированные варианты рака.
Из эпителия желез исходит железистый рак — аденокарцинома. По степени дифференцировки принято выделять высоко-, умеренно, мало и недифференцированные варианты рака.
В зависимости от соотношения паренхимы (особенно опухолевых клеток) и стромы, состоящей из соединительной ткани и сосудов, различаютпростой рак, когда паренхима и строма находятся в равном соотношении, медуллярный рак, характеризующийся более развитой паренхимой, и скирр, илифиброзный рак с выраженным преобладанием стромы. Клетки опухоли нередко частично сохраняют функциональные особенности той ткани, из которой они возникли в результате неопластической трансформации, в связи с чем опухоль нередко продуцирует различные вещества (например, слизь), часто в значительном количестве. Некоторыераковые опухоли состоят из клеток, напоминающих клетки органа на различных этапах его развития, в связи с чем возникли такие термины, как «гипернефрома», «гепатоцеллюлярный рак».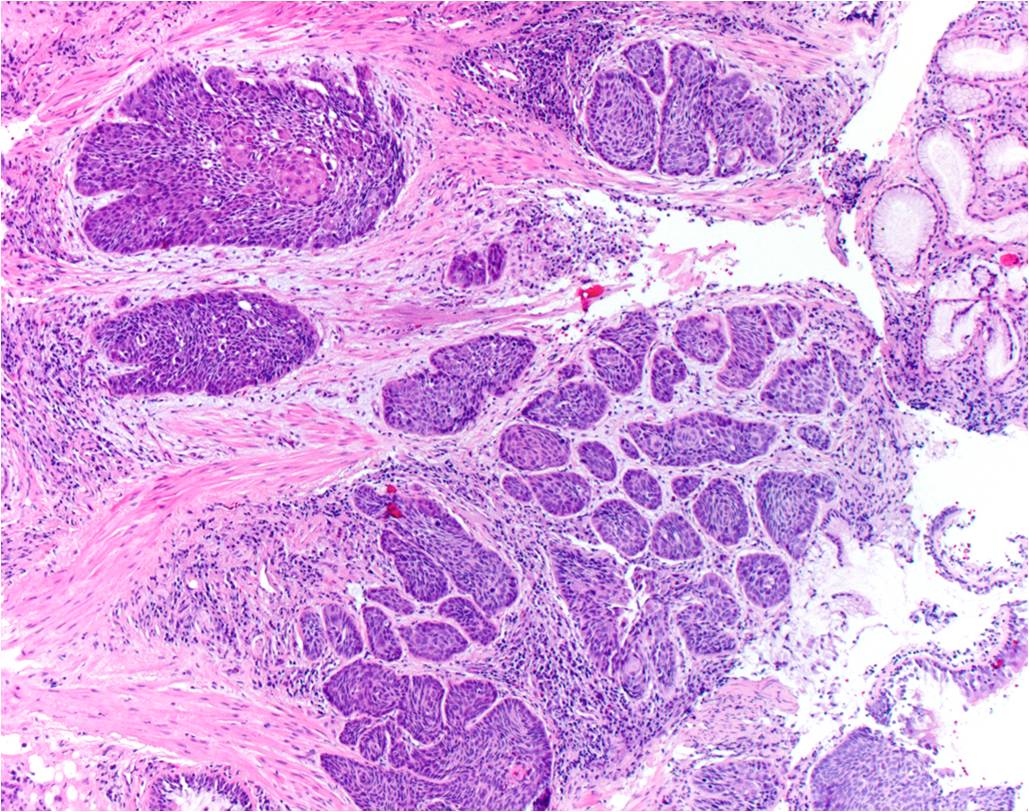 Сходство некоторых опухолей с эмбриональными тканями явилось причиной появления термина «эмбриональный рак».
Сходство некоторых опухолей с эмбриональными тканями явилось причиной появления термина «эмбриональный рак».
Метастазирование в большинстве случаев происходит лимфогенным путем в регионарные или отдаленные лимфатические узлы, однако нередко наблюдается и гематогенное распространение процесса с появлением метастазов в органах и костях. Отмечается своеобразная тропность при метастазировании опухолей некоторых локализаций к определенным органам и тканям. Так, для рака щитовидной, молочной, предстательной железы, а также почки характерны метастазы в кости скелета, рак легкого нередко метастазирует в надпочечники.
Симптомы
Клинические проявления рака зависят главным образом от локализации опухоли, ее биологических особенностей (степени дифференцировки, темпов роста), стадии распространения. Симптоматика различна, однако имеется несколько наиболее часто встречающихся и постоянных признаков. К ним можно отнести «беспричинное» похудание, снижение аппетита или изменение его в отношении некоторых пищевых продуктов,немотивированную слабость, нарушение стула, упорный кашель,изменение тембра голоса, постоянные или преходящие боли в груди или животе, «необъяснимые» повышения температуры тела, неприятные ощущения при глотании или прохождении пищи по пищеводу, анемию, появление крови в кале и моче, уплотнений в молочной железе и выделений из соска, выделений из половых путей, в т.ч. и кровянистых,особенно на фоне менопаузы.
К ним можно отнести «беспричинное» похудание, снижение аппетита или изменение его в отношении некоторых пищевых продуктов,немотивированную слабость, нарушение стула, упорный кашель,изменение тембра голоса, постоянные или преходящие боли в груди или животе, «необъяснимые» повышения температуры тела, неприятные ощущения при глотании или прохождении пищи по пищеводу, анемию, появление крови в кале и моче, уплотнений в молочной железе и выделений из соска, выделений из половых путей, в т.ч. и кровянистых,особенно на фоне менопаузы.
Заподозрить опухоль можно на основании патологических проявлений со стороны других органов и систем (см. Паранеопластические синдромы, Параонкологические дерматозы). При появлении одного или нескольких из этих симптомов (учитывая пол и возраст пациента) необходимо срочно целенаправленно и углубленно обследовать больного.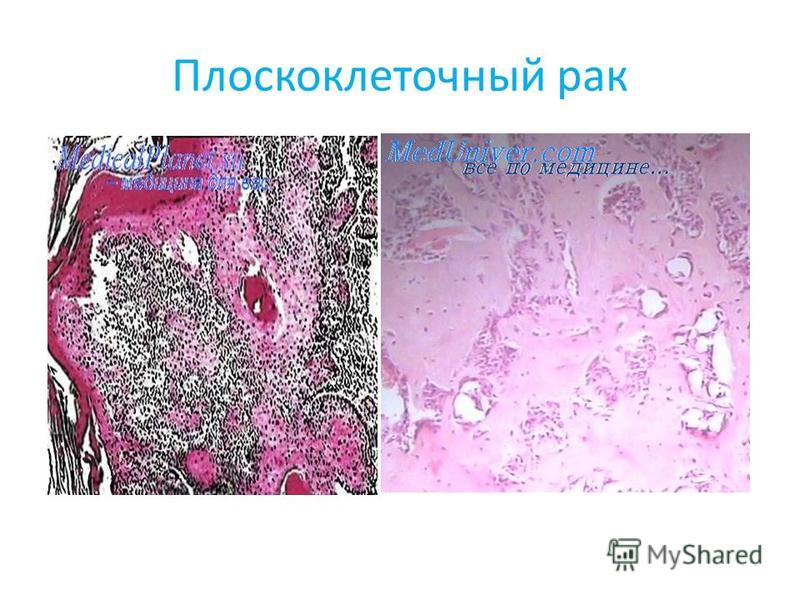 В некоторых случаях первые клинические признаки рака бывают связаны с метастатическим поражением. Например, первичный рак почки может проявиться патологическим переломом длинной трубчатой кости в области метастаза, возникшим в результате умеренной нагрузки или слабой травмы.
В некоторых случаях первые клинические признаки рака бывают связаны с метастатическим поражением. Например, первичный рак почки может проявиться патологическим переломом длинной трубчатой кости в области метастаза, возникшим в результате умеренной нагрузки или слабой травмы.
Своевременная диагностика рака в значительной мере определяется онкологической настороженностью врача, проводящего первичный прием. Тщательный сбор анамнеза, внимательный осмотр и детальное физикальное обследование позволяют иногда уже и на ранних стадиях заболевания заподозрить наличие рака той или иной локализации и направить пациента на уточняющее диагностическое исследование к соответствующему специалисту или непосредственно вонкологическое учреждение. При этом подтверждающие диагноз цитологическое и гистологическое исследования могут быть произведены амбулаторно.
Диагностика должна быть нацелена на выявление ранних стадий заболевания, так называемых малых раков и преинвазивных форм (carcinoma in situ). Очень важно помнить о существовании группыпредопухолевых заболеваний, при наличии которых наряду с лечением необходимо динамическое наблюдение за больным, что увеличивает возможность раннего выявления рака. Важным моментом в диагностике, особенно для последующего лечения, являетсяопределение стадии процесса в соответствии с принятой классификацией (см. Опухоли).
Очень важно помнить о существовании группыпредопухолевых заболеваний, при наличии которых наряду с лечением необходимо динамическое наблюдение за больным, что увеличивает возможность раннего выявления рака. Важным моментом в диагностике, особенно для последующего лечения, являетсяопределение стадии процесса в соответствии с принятой классификацией (см. Опухоли).
Лечение
Лечение рака в зависимости от характера опухоли (локализация, строение опухоли, стадия заболевания) предусматривает использование различных методов. Среди хирургических методов кроме радикальных операций в виде иссечения опухоли или ееудаления вместе с пораженным органомширокое распространение получиладеструкция опухоли с помощью низких температур (криодеструкция) илилазерного излучения. Некоторые виды рака чувствительны к действию ионизирующего излучения (см.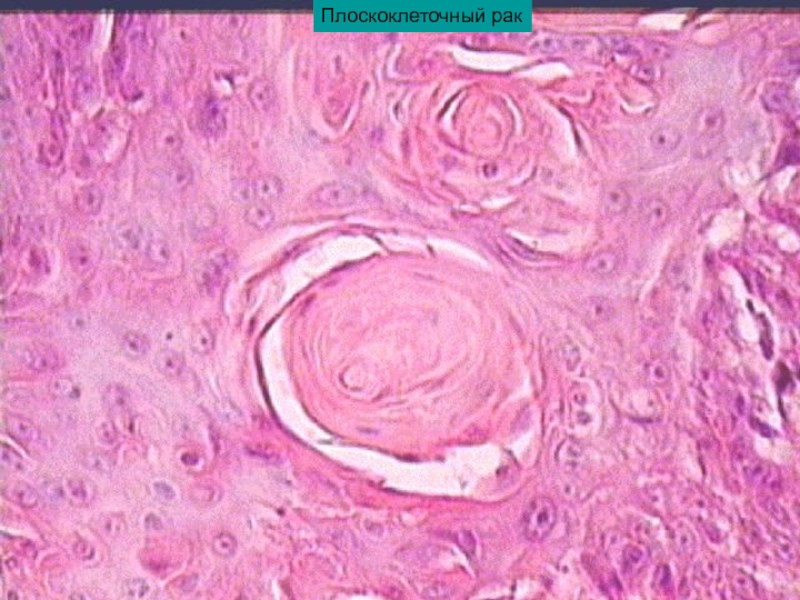 Лучевая терапия), при других эффективна химиотерапия (см. Противоопухолевые средства).
Лучевая терапия), при других эффективна химиотерапия (см. Противоопухолевые средства).
Широкое распространение получило комбинированное лечение с одновременным или последовательным применением различных методов. Так, для закрепления эффекта, а также с целью профилактики метастазов до или после оперативного вмешательства назначают химиотерапию или химиотерапию в сочетании с лучевой терапией. Лечебная тактика определяется индивидуально в зависимости от локализации, форм рака, стадии заболевания и ряда других показателей с учетом наиболее эффективных схем и режимов введения противоопухолевых средств Более подробные сведения о клинических проявлениях, диагностике и лечении рака различной локализации представлены в статьях, посвященных отдельным органам, например Желудок, Кишечник,Легкие, Матка и др.
Прогноз зависит от многих факторов — локализации, стадии, морфологического варианта опухоли, возраста больного.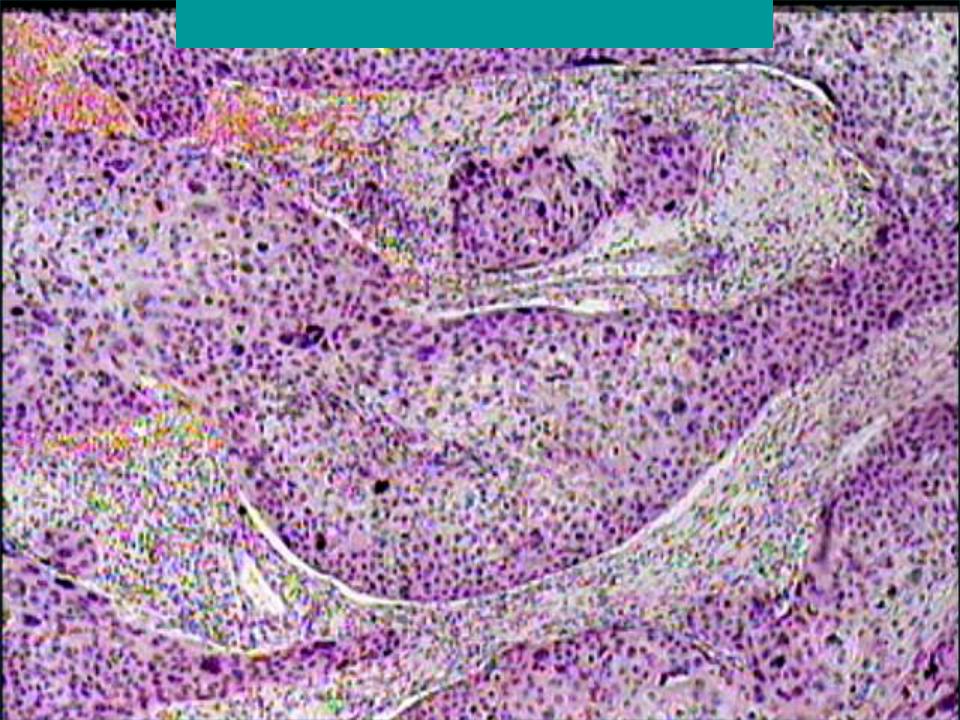 Большое значение для прогноза имеет выявление рака на ранних стадиях его развития, т.к. многие виды рака, например рак кожи, губы, шейки матки, при раннем выявлении и адекватном лечении могут быть полностью излечены.
Большое значение для прогноза имеет выявление рака на ранних стадиях его развития, т.к. многие виды рака, например рак кожи, губы, шейки матки, при раннем выявлении и адекватном лечении могут быть полностью излечены.
Профилактика
Профилактика рака основывается на тех же принципах, что и профилактика всех злокачественных опухолей:
Основные усилия исследователей направлены на разработку критериевранней (в доклинической фазе развития болезни)диагностики опухоли, что может обеспечить максимальный эффект лечебных мероприятий. Одним из путей ранней диагностики опухолей служат массовые профилактические осмотры населения или осуществление массового скрининга среди групп риска (по возрасту, профессиональной вредности) для выявления фоновых заболеваний, предопухолевых состояний и опухолей на ранних стадиях. Раннему выявлению наиболее доступны опухоли так называемых визуальных локализаций (т.е. органов видимых и легко пальпируемых): кожи, периферических лимфатических узлов, нижней губы, полости рта, щитовидной железы, молочной железы, шейки матки.
Раннему выявлению наиболее доступны опухоли так называемых визуальных локализаций (т.е. органов видимых и легко пальпируемых): кожи, периферических лимфатических узлов, нижней губы, полости рта, щитовидной железы, молочной железы, шейки матки.
В основе профилактических мероприятий международного и государственного масштаба лежит охрана окружающей среды(воздуха, воды, почвы, продуктов питания, лекарственных средств и др.) от канцерогенных загрязнений. С этой целью заключаются международные договоры и конвенции, издаются специальные законы и регламентирующие акты, внедряются безопасные (чистые) технологии. Индивидуальные меры предусматривают соблюдение здорового образа жизни, включающего главным образом устранение вредных привычек — курения и злоупотребления алкоголем (особенно в отношении опухолей печени, пищевода и желудка), выполнение правил личной, и прежде всего половой, гигиены, имея в виду канцерогенное действие смегмы.
Карцинома – особенности лечения — Хемотека
Карциномами называют опухоли, которые развиваются из слизистых оболочек и эпителиальных тканей, выстилающих большинство органов. Ежегодно диагноз ставят 15 млн пациентов и 9,6 млн людей умирают от карцином. Название этому виду образований придумал Гиппократ. Перевод термина на латынь соответствует слову «рак». Поэтому карцинома и рак – это одно и тоже.
Ежегодно диагноз ставят 15 млн пациентов и 9,6 млн людей умирают от карцином. Название этому виду образований придумал Гиппократ. Перевод термина на латынь соответствует слову «рак». Поэтому карцинома и рак – это одно и тоже.
Эпителиальные клетки постоянно находятся в группе риска по образованию опухолей:
- Они постоянно обновляются и активно делятся, что повышает вероятность мутаций и сбоев.
- Являясь поверхностными и выстилающими эти ткани, наиболее часто контактируют с токсинами и подвергаются воздействию других мутирующих факторов.
Поэтому, среди злокачественных образований карциномы – самые распространенные. Обнаруживаются опухоли в основном у людей средних лет и пожилых.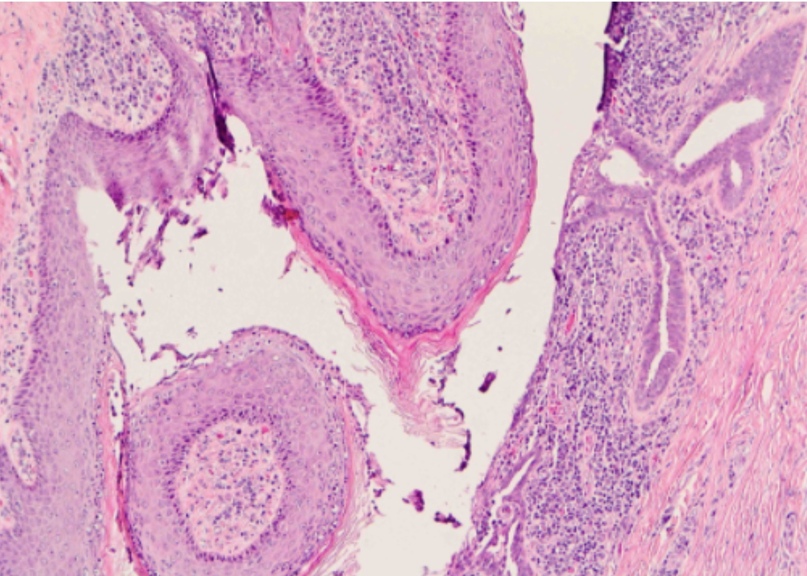
Классификация и особенности
В зависимости от того, какой тип клеток поражает мутация, выделяют карциному:
- Базальноклеточную. Растет на коже, отличается медленным развитием и редко дает метастазы. Похожа на красное гладкое пятно, покрытое коркой.
- Плоскоклеточную. Формируется на внутреннем эпителии и слизистых оболочках. При этом клетки перерождаются и по строению напоминают многослойный кожный эпидермис. Такие образования могут ороговевать (продуцировать кератин) и тогда речь идет о плоскоклеточном ороговевающем раке. Он более дифференцирован и благоприятен по прогнозу. Неороговевающий рак считается агрессивным.

- Аденокарциному. Представляет собой образование, появляющееся из эндокринных клеток, присутствующих в эпителии.
К редким видам относят нейроэндокринную, мукоэпидермоидную, сосочковую карциномы.
Расти опухоли могут экзофитно и эндофитно. В первом случае рак разрастается во внутренний просвет органа, перекрывая его. Во втором – опухоль поражает внутренние слои. По форме может напоминать узел или инфильтрированную область без четких границ.
По строению клеток карциномы делятся на крупноклеточные, мелкоклеточные, веретеноклеточные, светлоклеточные.
В зависимости от того, насколько видоизменились структуры, карциномы разделяют на высоко- и низкодифференцированные. Последние мало похожи на ткань, в которой образовались, и отличаются быстрым и агрессивным ростом.
В своем развитии рак проходит 4 стадии и стадию предрака. Метастазирует лимфогенным путем. По крови распространяется на последнем, четвертом, этапе.
Карциномы разных органов
Наиболее подвержены раку:
- Легкие (11,6%).
- Молочная железа (11,6%).
- Толстый кишечник (10,2%).
- Простата (7,1%).
- Желудок (5,7%).
- Печень (4,7%).
- Шейка матки (3,2%).
Карцинома легких
Характерна для мужчин старше 60 лет, особенно часто встречается у курящих. Формируется в крупных или мелких бронхах в основном правого легкого. Для дыхательных путей характерны аденокарциномы. Они развиваются в виде узла или имеют древовидную форму. Проявляются кашлем, одышкой, болями в груди и кровохарканьем. Обнаруживаются на 2-3 стадии. Лечение на этом этапе эффективно для 40-60% больных. Основной метод – операция, с последующим облучением и химиотерапией.
Обнаруживаются на 2-3 стадии. Лечение на этом этапе эффективно для 40-60% больных. Основной метод – операция, с последующим облучением и химиотерапией.
Рак молочной железы
Представлен аденокарциномой, которая постепенно видоизменяет всю ткань молочной железы. Поражает дольки или протоки. Обнаруживается у женщин старше 45 лет в период пременопаузы и менопаузы. В репродуктивном возрасте встречается редко. Провоцирующими факторами считаются гормональные изменения во время гормонотерапии, менопаузы, использования оральных контрацептивов. Обнаруживается в виде малоподвижного узла или уплотнения. Протекает с проявлением воспалительных реакций (рожистая, отечная форма) и без. Во втором случае образование не вызывает беспокойства и вероятней всего обнаруживается во время самоосмотра. Основной метод лечения – мастэктомия и прием блокаторов эстрогена. При ранней диагностике лечение успешно в 90% случаев.
Карциномы толстого кишечника
Наиболее характерны для прямой кишки. Формируются в основном аденокарциномы, а у анального канала – плоскоклеточный рак. Большую роль в развитии играет наличие геморроя, полипов, частые запоры и неправильное питание. Вызывают опухоли толстого кишечника расстройство стула, недержание кала, кровотечения. Лечение эффективно только на начальных этапах.
Формируются в основном аденокарциномы, а у анального канала – плоскоклеточный рак. Большую роль в развитии играет наличие геморроя, полипов, частые запоры и неправильное питание. Вызывают опухоли толстого кишечника расстройство стула, недержание кала, кровотечения. Лечение эффективно только на начальных этапах.
Карцинома простаты
Гормонозависимый рак, который связан с воспалительными заболеваниями железы. Могут быть как малодифференцированные, так и дифференцированные образования. Аденокарциномы развиваются в каналах железы и в альвеолах, хранящих секрет простаты. Плоскоклеточный рак характерен для наружной оболочки органа. Из малодифференцированного железистого эпителия формируются анапластические карциномы. В 90% случаев рак простаты выявляют на поздних стадиях. Мужчину беспокоит болезненность и трудности с мочеиспусканием, кровянистые выделения. Для лечения используют местные варианты: контактное облучение, криоабляцию, ультразвук. Эффективна гормональная кастрация.
Рак желудка
Карцинома формируется в антральном и пилорическом отделах желудка. Может выглядеть как язва, инфильтрат или полип. Опухоли достигают крупных размеров в 8-10 сантиметров. Развиваются медленно. В некоторых случаях бессимптомное течение может длиться до 6 лет. На развитой стадии характерна мелена, кровь в рвотных массах, отвращение к мясной пище и постоянные несварения. Карцинома активно прорастает в соседние ткани и очень плохо поддается лечению. Начиная со второй стадии шансы на выздоровление составляют 7%.
Карцинома печени
В печени формируется гепатоцеллюлярная карцинома, которая представляет собой перерожденные гепатоциты. Но бывают и другие варианты (цистаденокарцинома, фиброламеллярная карцинома). В большинстве случаев рак является метастатическим от других образований. У больных наблюдается увеличение живота, скопление жидкости в брюшной полости, сильная интоксикация, кровотечения. Лечат карциному печени оперативным путем.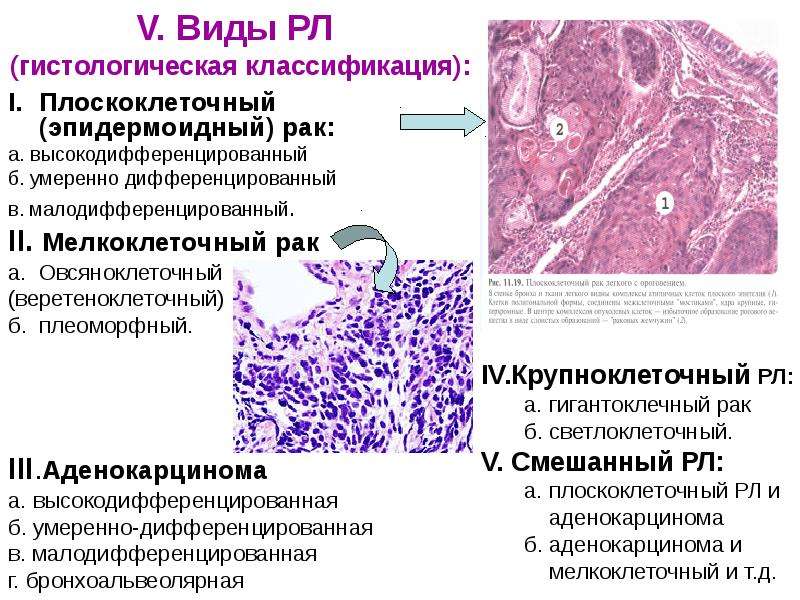
Рак шейки матки
Опухоль может формироваться с внутренней или наружной стороны матки. Внутри образуются аденокарциномы, а из наружного эпителия плоскоклеточный рак. Если формируется ороговевающая разновидность, то прогрессирование идет медленно. Неороговевающий плоскоклеточный рак приводит к образованию глубоких язв и быстрому развитию опухоли. Провоцирующим фактором являются: ВПЧ, аборты, противозачаточные. Обнаруживают рак на последних стадиях. Выявить патологию помогают постоянные кровянистые или желтые выделения и ноющие боли внизу живота. Для лечения используют различные варианты резекции.
Профилактика канцерогенеза
Карцинома успешно лечится на первых двух стадиях. Основная проблема – в отсутствии симптомов в этот период из-за чего большинство опухолей просто не выявляются вовремя. Поэтому наибольшее значение имеют регулярные профилактические осмотры. Именно они позволяют выявить рак в самом начале его развития. Это дает шансы на выживание в 80-95% случаев.
Чтобы снизить вероятность мутаций клеток нужно соблюдать правильный режим пребывания на солнце, отказаться от работы на вредных производствах, не курить и не увлекаться спиртными напитками. Как бы это банально не звучало, но правильное питание и здоровый образ жизни наиболее действенные меры профилактики канцерогенеза.
Примечание!
Информация, размещенная в этом материале, предоставляется в ознакомительных целях. Установление показаний к лечению и назначение противоопухолевых препаратов может делать исключительно лечащий врач. Обязательно проконсультируйтесь с врачом!
Автор: Центр персонализированной фармации «Хемотека»
Немелкоклеточный рак легкого
Согласно морфологической классификации ВОЗ выделяют четыре основные группы рака легкого: плоскоклеточный рак (40 % больных), аденокарцинома (40–50 %) мелкоклеточный рак (МРЛ) (15–20 %), крупноклеточный рак (5–10 %) [1].
Немелкоклеточный рак легкого (НМРЛ) — это злокачественная эпителиальная опухоль легких, в которой отсутствуют мелкоклеточные компоненты. Гистологические подтипы НМРЛ традиционно включают плоскоклеточный рак, аденокарциному, аденосквамозный и крупноклеточный рак, однако гистологические различия могут быть неясными, особенно в случае плохо дифференцированных опухолей. Во многих случаях опухоли НМРЛ имеют гетерогенную гистологию в пределах одного и того же повреждения. Патологи разрабатывают классификации в соответствии с доминирующим подтипом. Хотя морфология остается золотым стандартом для диагностики, недавно были предприняты значительные усилия для выяснения молекулярной биологии этих опухолей [2].
В западных странах в последние годы наблюдается рост заболеваемости аденокарциномами и снижение заболеваемости плоскоклеточным раком. Сокращение спроса на табак в США коррелирует с увеличением относительной заболеваемости аденокарциномой, особенно бронхиолоальвеолярной карциномой (БАК). Гистологические данные о НМРЛ менее распространены в развивающихся странах, однако похоже, что плоскоклеточный рак является наиболее распространенным видом, и различия в заболеваемости тем или иным видом рака могут отчасти быть связаны с различием в потреблении сигарет и отношении к курению в разных географических регионах [2].
Гистологические данные о НМРЛ менее распространены в развивающихся странах, однако похоже, что плоскоклеточный рак является наиболее распространенным видом, и различия в заболеваемости тем или иным видом рака могут отчасти быть связаны с различием в потреблении сигарет и отношении к курению в разных географических регионах [2].
Аденокарциномы представляют собой злокачественные эпителиальные опухоли с железистой дифференцировкой. Их можно подразделить на ацинарные, папиллярные, альвеолярно-клеточный рак и солидную аденокарциному, продуцирующую муцин, хотя аденокарциномы смешанного типа являются наиболее распространенными. Эти опухоли происходят из альвеолярных, бронхиальных или бронхиолярных эпителиальных клеток. Атипичная аденоматозная гиперплазия была описана как потенциальный предшественник БАК, не продуцирующей муцин. Аденокарциномы метастазируют преимущественно через лимфатические сосуды или гематогенно. Приблизительно 20 % пациентов с аденокарциномой имеют отдаленные метастазы при постановке диагноза.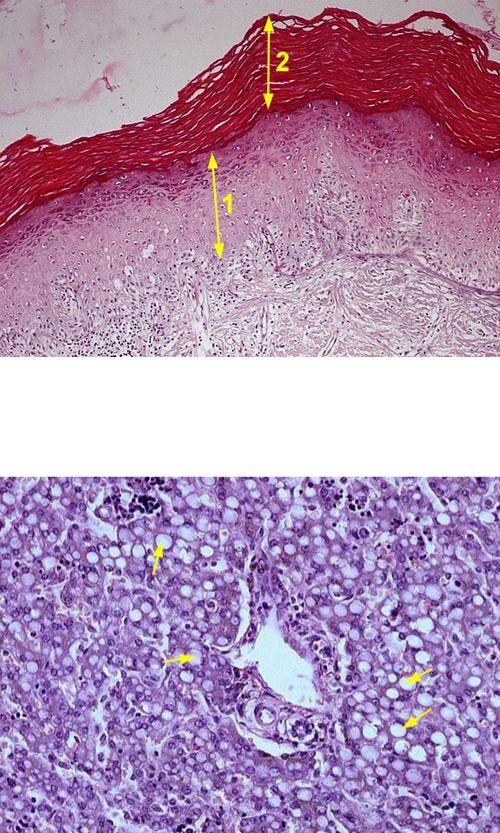 Типичная локализация метастатических опухолей: мозг, кости, надпочечники и печень. Большинство аденокарцином являются положительными на фактор транскрипции щитовидной железы 1 (TTF1), а клетки метастатической аденокарциномы из других участков обычно являются отрицательными на TTF1. БАК, продуцирующие муцин, происходят из бронхиальных слизистых клеток и обычно являются TTF1-негативными и CK20-положительными [2].
Типичная локализация метастатических опухолей: мозг, кости, надпочечники и печень. Большинство аденокарцином являются положительными на фактор транскрипции щитовидной железы 1 (TTF1), а клетки метастатической аденокарциномы из других участков обычно являются отрицательными на TTF1. БАК, продуцирующие муцин, происходят из бронхиальных слизистых клеток и обычно являются TTF1-негативными и CK20-положительными [2].
Плоскоклеточный рак часто расположен в центре легкого и происходит из эпителиальных клеток бронхов. Они обладают характерными маркерами, связанными с кератинизацией: большинство экспрессируют высокомолекулярный кератин, CK5 и CK6, но не экспрессируют TTF1 (экспрессия CK19 и CK20 не считается характерной для плоскоклеточного рака). Кроме того, p63 все чаще идентифицируется как маркер плоскоклеточной дифференцировки [2].
Крупноклеточные карциномы составляют примерно 5 % случаев рака легких. Эти опухоли не обнаруживают признаков плоскоклеточной или железистой дифференцировки.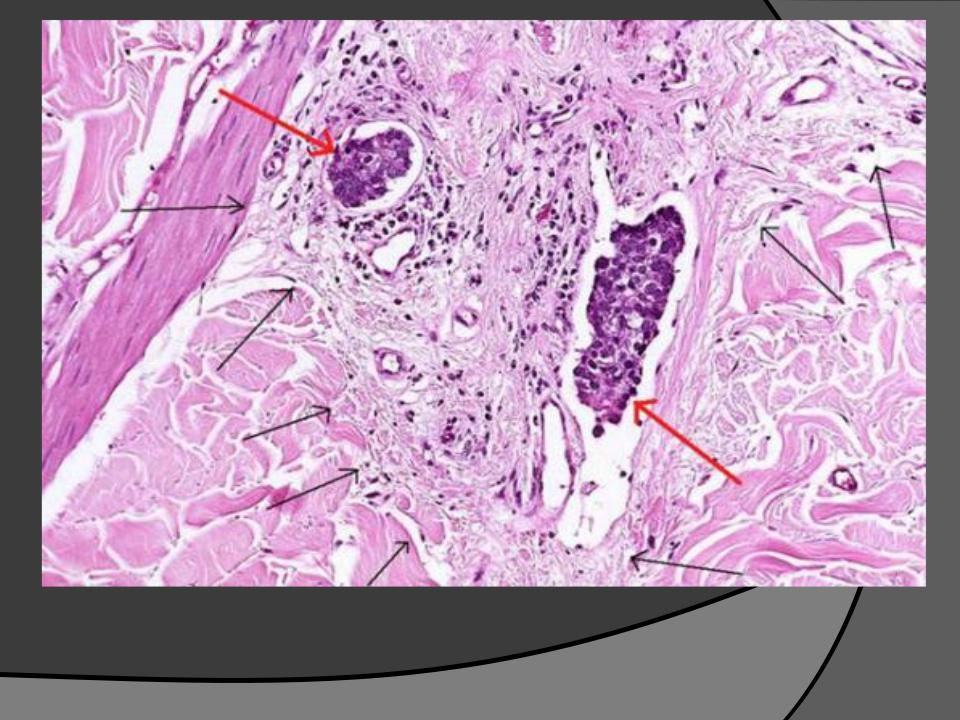 Крупноклеточные нейроэндокринные карциномы обладают гистологическими особенностями, свидетельствующими о нейроэндокринной дифференцировке, и экспрессируют нейрональные маркеры, такие как молекулы адгезии нейрональных клеток, хромогранин и синаптофизин, но остаются отличными от мелкоклеточного рака легкого. Приблизительно 50 % крупноклеточных карцином экспрессируют TTF1 (крупноклеточный НМРЛ, экспрессирующий TTF1, считается отличным от аденокарциномы), однако CK 1, 5, 10, 14 и 20 редко выражены [2].
Крупноклеточные нейроэндокринные карциномы обладают гистологическими особенностями, свидетельствующими о нейроэндокринной дифференцировке, и экспрессируют нейрональные маркеры, такие как молекулы адгезии нейрональных клеток, хромогранин и синаптофизин, но остаются отличными от мелкоклеточного рака легкого. Приблизительно 50 % крупноклеточных карцином экспрессируют TTF1 (крупноклеточный НМРЛ, экспрессирующий TTF1, считается отличным от аденокарциномы), однако CK 1, 5, 10, 14 и 20 редко выражены [2].
Классификация [1]:
- Плоскоклеточный рак:
• Папиллярный
• Светлоклеточный
• Мелкоклеточный
• Базальноклеточный - Аденокарцинома:
• Ацинарная
• Папиллярная
• Бронхиолоальвеолярный рак
• Солидный рак с образованием муцина
• Другие - Крупноклеточный рак:
• Крупноклеточная нейроэндокринная карцинома
• Другие
Международная гистологическая классификация (2015) [1]
- Преинвазивные образования:
• Атипичная аденоматозная гиперплазия
• Аденокарцинома in situ: немуцинозная или муцинозная
• Плоскоклеточная карцинома in situ
• Диффузная идиопатическая легочная нейроэндокринная гиперплазия - Аденокарцинома:
• Со стелющимся типом роста (lepedic) G1
• Ацинарная G II
• Папиллярная
• Микропапиллярная G III
• Солидная
• Инвазивная муцинозная аденокарцинома
• Смешанная инвазивная муцинозная и немуцинозная аденокарцинома
• Коллоидная
• Фетальная
• Кишечного типа - Плоскоклеточный рак:
• Ороговевающий
• Неороговевающий
• Базалоидный - Нейроэндокринные опухоли:
• Мелкоклеточный рак
• Комбинированный мелкоклеточный рак
• Крупноклеточная нейроэндокринная карцинома
• Комбинированная крупноклеточная нейроэндокринная карцинома
• Карциноидные опухоли: типичный карциноид и атипичный карциноид - Крупноклеточная карцинома:
• Плеоморфная карцинома
• Веретеноклеточная карцинома
• Гигантоклеточная карцинома
• Карциносаркома
• Легочная бластома - Другие неклассифицируемые опухоли:
• Лимфоэпителиомаподобная карцинома
• NUT карцинома
• Опухоли по типу опухолей слюнных желез:
— Мукоэпидермоидная карцинома
— Аденокистозный рак
— Эпителиально-миоэпителиальная карцинома
— Плеоморфная аденома
Биомаркеры
Перестройки гена, кодирующего киназу анапластической лимфомы (ALK)
Приблизительно 5 % пациентов с НМРЛ имеют перестройки ALK.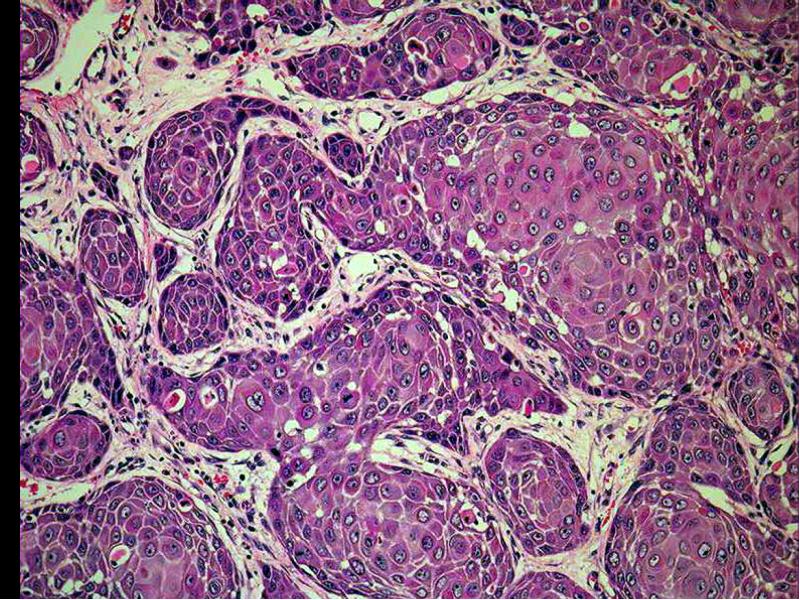 Эти пациенты, как правило, имеют гистологию аденокарциномы и никогда не курят или курят немного. Два теста были одобрены FDA для автономного тестирования или быстрого предварительного скрининга: диагностический тест на флуоресцентную гибридизацию in situ (FISH) и иммуногистохимический анализ. Секвенирование нового поколения может использоваться, если платформа была должным образом разработана и проверена [3].
Эти пациенты, как правило, имеют гистологию аденокарциномы и никогда не курят или курят немного. Два теста были одобрены FDA для автономного тестирования или быстрого предварительного скрининга: диагностический тест на флуоресцентную гибридизацию in situ (FISH) и иммуногистохимический анализ. Секвенирование нового поколения может использоваться, если платформа была должным образом разработана и проверена [3].
Первоначальная терапия, направленная на ALK
Алектиниб является пероральным препаратом, который блокирует активность киназы анапластической лимфомы и используется для лечения немелкоклеточного рака легких. Он был разработан Chugai Pharmaceutical Co. Japan, которая является частью группы Hoffmann-La Roche [4].
Перестройки гена ROS1
Перестройки гена ROS1 встречаются примерно у 1–2 % пациентов с НМРЛ, чаще у более молодых женщин (средний возраст 50 лет) с аденокарциномой, которые никогда не курят, и у пациентов, отрицательных по отношению к мутациям EGFR и KRAS и ALK. NCCN Guidelines Panel рекомендует тестирование ROS1 на основании эффективности кризотиниба и церитиниба. Тестирование может проводиться с использованием FISH. Секвенирование нового поколения также можно использовать, если платформа была должным образом спроектирована и утверждена. Иммуногистохимическое тестирование на ROS1 требует подтверждения всех положительных результатов из-за низкой специфичности методики тестирования. Единственный дополнительный диагностический тест был одобрен FDA для перегруппировок ROS1. Тем не менее врачи могут использовать любой надлежащим образом проверенный тест.
NCCN Guidelines Panel рекомендует тестирование ROS1 на основании эффективности кризотиниба и церитиниба. Тестирование может проводиться с использованием FISH. Секвенирование нового поколения также можно использовать, если платформа была должным образом спроектирована и утверждена. Иммуногистохимическое тестирование на ROS1 требует подтверждения всех положительных результатов из-за низкой специфичности методики тестирования. Единственный дополнительный диагностический тест был одобрен FDA для перегруппировок ROS1. Тем не менее врачи могут использовать любой надлежащим образом проверенный тест.
Терапия первой линии
Кризотиниб ингибирует перестройки ROS1 и одобрен FDA для пациентов с местно-распространенным или метастатическим ROS1-положительным НМРЛ [3].
Мутации BRAF V600E
BRAF представляет собой серин/треонинкиназу, которая является частью сигнального пути MAP/ERK. BRAF V600E является наиболее распространенной из точечных мутаций BRAF, встречающихся у 1–2 % пациентов с аденокарциномой легкого, которые обычно являются курильщиками в настоящем или прошлом. Мутации BRAF обычно не перекрываются с мутациями EGFR или перестройками ALK. Комиссия NCCN рекомендует тестировать мутации BRAF на основании данных, показывающих эффективность дабрафениба/траметиниба. ПЦР в реальном времени, секвенирование Сэнгера и секвенирование нового поколения являются наиболее часто используемыми методами оценки для мутаций BRAF [3].
Мутации BRAF обычно не перекрываются с мутациями EGFR или перестройками ALK. Комиссия NCCN рекомендует тестировать мутации BRAF на основании данных, показывающих эффективность дабрафениба/траметиниба. ПЦР в реальном времени, секвенирование Сэнгера и секвенирование нового поколения являются наиболее часто используемыми методами оценки для мутаций BRAF [3].
Рак легких состоит из популяций клеток с неодинаковыми молекулярно-генетическими, эпигенетическими и фенотипическими особенностями. Это явление, называемое внутриопухолевой гетерогенностью, добавляется к уже хорошо известной межопухолевой гетерогенности, которая ответственна за огромное количество типов и подтипов в каждой основной гистологической категории, как это определено в классификации ВОЗ 2015 года. Внутриопухолевая гетерогенность влияет на тактику взятия биопсии опухоли, планирование лечения и развитие лекарственной устойчивости. Опухолевыми типами, которые проявляют наибольшую гистологическую гетерогенность, являются аденокарцинома, железисто-плоскоклеточная карцинома, плеоморфный рак и легочная крупноклеточная нейроэндокринная карцинома. Однако внутриопухолевая гетерогенность не ограничивается гистологическими различиями, поскольку молекулярная гетерогенность (мутации, изменения числа копий), метилирование ДНК, профили экспрессии мРНК и экспрессия PDL1 вариабельны даже внутри одной опухоли Получение полного молекулярного ландшафта каждой опухоли и выбор правильной мишени действительно является важной задачей, которую необходимо решить для успешного лечения опухолей и избежания лекарственной резистентности, обусловленной внутриопухолевой гетерогенностью [5].
Однако внутриопухолевая гетерогенность не ограничивается гистологическими различиями, поскольку молекулярная гетерогенность (мутации, изменения числа копий), метилирование ДНК, профили экспрессии мРНК и экспрессия PDL1 вариабельны даже внутри одной опухоли Получение полного молекулярного ландшафта каждой опухоли и выбор правильной мишени действительно является важной задачей, которую необходимо решить для успешного лечения опухолей и избежания лекарственной резистентности, обусловленной внутриопухолевой гетерогенностью [5].
Основной гистологический тип ассоциирован с характерными генетическими чертами, гистологическая гетерогенность больше зависит от профилей экспрессии и сигнальных путей (эмбриональных, стволовых клеток, EMT), чем от драйверных мутаций, что ставит под сомнение механизмы пластичности и устойчивости опухоли [5].
Диагностические проблемы включают в себя размер образца: один компонент может отсутствовать в небольшом образце с ассоциированными мутациями. Также неодинаковы характеристики первичной и метастатической опухолей [5].
Источники:
- Бычков М.Б., Горбунова В.А. Клинические рекомендации по диагностике и лечению больных раком легкого // М.: Общероссийский союз общественных объединений ассоциация онкологов России. – 2014.
- Langer C. J. et al. The evolving role of histology in the management of advanced non–small-cell lung cancer //Journal of clinical oncology. – 2010. – Т. 28. – №. 36. – С. 5311-5320.
- Ettinger D. S. et al. NCCN guidelines insights: non–small cell lung cancer, version 5.2018 //Journal of the National Comprehensive Cancer Network. – 2018. – Т. 16. – №. 7. – С. 807-821.
- McKeage K. Alectinib: a review of its use in advanced ALK-rearranged non-small cell lung cancer //Drugs. – 2015. – Т. 75. – №. 1. – С. 75-82.
- Brambilla E. MS05. 03 Tumor Heterogeneity in Lung Cancer //Journal of Thoracic Oncology. – 2018. – Т. 13. – №. 10. – С. S259-S260.
Кератинизирующая плоскоклеточная карцинома: Malacards
1004-03-1
1-фтор-1h-пиримидин-2,4-дион
1upf
2,4-дигидрокси-5-фторпиримидин
2,4-диоксо-5-фторприимидин
2,4-диоксо-5-фторпиримидин
47576_FLUKA
4921-97-5
5 Фторурацил
5 Фторурацил биосин
5 FU lederle
5 FU Lederle
5 FU medac
5 HU шестнадцатеричный
5 HU Hexal
51-21-8
5-Фарасил
5-Фтор-2,4 (1H, 3H) -пиримидиндион
5-Фтор-2,4 (1H, 3H) -пиримидиндион [Чехия]
5-фтор-2,4-дигидроксипиримидин
5-фтор-2,4-дигидроксипиримидин [Чехия]
5-фтор-2,4-пиримидиндиол
5-фтор-2,4-пиримидиндиол [Чехия]
5-Фторацил
5-Фторацил [немецкий]
5-фторацил
5-фтор урацил
5-фтор-1H-пиримидин-2,4-дион
5-Фтор-2,4 (1H, 3H) -пиримидиндион
5-фтор-2,4-пиримидиндион
5-фторпиримидин-2,4-диол
5-фторпиримидин-2,4 (1H, 3H) -дион
5-фторпиримидин-2,4-дион
5-фторурацил
5-фторурацил
5-Фторурацил-биосин
5-фторурацил
5-фторурацил [немецкий]
5-Флурацил
5-фтоурацил
5FU
5-ФУ
5-ФУ (ТН)
5-FU lederle
5-ФУ Ледерле
5-ФУ medac
5-HU шестигранник
5-HU Hexal
79108-01-3
AC-11201
AC1L1FTE
AC1Q4N2X
AccuSite
Актино-Хермаль
Адрусил
Адрусил (Теннесси)
AI3-25297
АКОС000119162
АКОС003237897
Allergan Марка Фторурацила
Allergan Торговая марка фторурацила
Арумель
BB_NC-0576
биосин Марка фторурацила
Биосин марка фторурацила
BSPBio_002048
C07649
C4h4FN2O2
Карац
Карац (Теннесси)
Carzonal
CCRIS 2582
ЧЕБИ: 46345
CHEMBL185
CID3385
Cinco FU
CPD000038082
CPD0-1327
CSP Марка фторурацила
ЦСП Марка фторурацила
Cytosafe
D005472
D00584
Дакота марка фторурацила
Дакота Бренд фторурацила
Dakota, фторурацил
Дакота, фторурацил
DB00544
Dermatech марка фторурацила
Dermatech Торговая марка фторурацила
Дермик марка фторурацила
Dermik Торговая марка фторурацила
DivK1c_000054
Эффлудерм
Эффлудерм (свободное основание)
Efudex
Efudix
Эфурикс
EINECS 200-085-6
EU-0100536
Ф 6627
F0151
F6627_SIGMA
F8423_SIGMA
Феррер марка фторурацила
Феррер Торговая марка фторурацила
Fiverocil
Фторо Урацил
фтор Урацил icn
Фтороурацил ICN
Фторобластин
Фтороплекс
Фтороплекс (TN)
фторурацил
Фторурацил
Фторурацил (JP15 / USP / INN)
Фторурацил [USAN: INN: BAN: JAN]
Фторурацил гры
Фторурацил GRY
Мононитрат фторурацила
Мононитрат фторурацила
Монокалиевая соль фторурацила
Монокалиевая соль фторурацила
Мононатриевая соль фторурацила
Мононатриевая соль фторурацила
Калийная соль фторурацила
Фторурацил калиевая соль
Фторурацил Тева марка
Фторурацил Тева Бренд
Фторурацил
Фтор-урацил
Фторурацил [DCIT]
Плоскоклеточный рак легкого | Фонд LUNGevity
Плоскоклеточный рак легкого или плоскоклеточный рак Рак, который начинается на коже или в тканях, выстилающих или покрывающих внутренние органы легкого, является одним из типов немелкоклеточного рака легкого (НМРЛ). типы клеток, обнаруженных в раке, и то, как клетки выглядят под микроскопом.Плоскоклеточный рак легкого классифицируется как таковой по тому, как клетки выглядят под микроскопом. Плоскоклеточный рак легкого начинается с плоскоклеточных клеток — тонких, плоских клеток, которые при рассмотрении под микроскопом выглядят как чешуя рыбы. Они выстилают дыхательные пути легких изнутри. Плоскоклеточный рак легкого также называют эпидермоидной карциномой. Рак, который начинается в плоскоклеточных клетках. 1,2
типы клеток, обнаруженных в раке, и то, как клетки выглядят под микроскопом.Плоскоклеточный рак легкого классифицируется как таковой по тому, как клетки выглядят под микроскопом. Плоскоклеточный рак легкого начинается с плоскоклеточных клеток — тонких, плоских клеток, которые при рассмотрении под микроскопом выглядят как чешуя рыбы. Они выстилают дыхательные пути легких изнутри. Плоскоклеточный рак легкого также называют эпидермоидной карциномой. Рак, который начинается в плоскоклеточных клетках. 1,2
Плоскоклеточные опухоли легких Аномальная масса ткани, которая возникает, когда клетки делятся больше, чем они должны, или не умирают, когда они обычно должны возникать в центральной части легкого или в одном из основных дыхательных путей (левый или правый бронх Один из больших воздушных путей). проходы, ведущие от трахеи (дыхательного горла) к легким).Расположение опухоли отвечает за такие симптомы, как кашель, затрудненное дыхание, боль в груди и кровь в мокроте, слизь и другие вещества, выводимые из легких при кашле.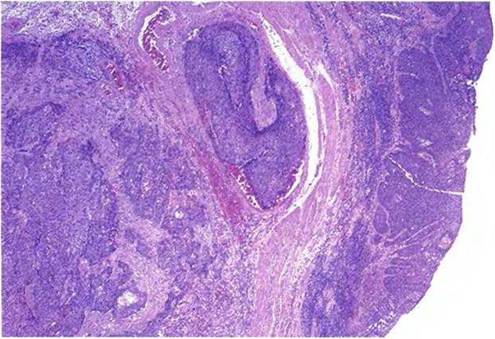 Если опухоль вырастает до больших размеров, рентген грудной клетки — это тип высокоэнергетического излучения, которое может проходить через тело и на пленку, делая снимки областей внутри грудной клетки, которые могут использоваться для диагностики заболевания или компьютерной томографии (КТ). или CAT) сканирование Процедура, при которой компьютер, подключенный к рентгеновскому аппарату, делает серию подробных снимков участков внутри тела, может обнаруживать полость, полую область или отверстие в легком.Полость — это заполненное газом или жидкостью пространство внутри опухолевой массы или узелка. Рост или уплотнение, которые могут быть злокачественными (рак) или доброкачественными, и являются классическим признаком плоскоклеточного рака легких. Плоскоклеточный рак легкого может распространяться на несколько участков, включая мозг, позвоночник и другие кости, надпочечники и печень. 3,4,5
Если опухоль вырастает до больших размеров, рентген грудной клетки — это тип высокоэнергетического излучения, которое может проходить через тело и на пленку, делая снимки областей внутри грудной клетки, которые могут использоваться для диагностики заболевания или компьютерной томографии (КТ). или CAT) сканирование Процедура, при которой компьютер, подключенный к рентгеновскому аппарату, делает серию подробных снимков участков внутри тела, может обнаруживать полость, полую область или отверстие в легком.Полость — это заполненное газом или жидкостью пространство внутри опухолевой массы или узелка. Рост или уплотнение, которые могут быть злокачественными (рак) или доброкачественными, и являются классическим признаком плоскоклеточного рака легких. Плоскоклеточный рак легкого может распространяться на несколько участков, включая мозг, позвоночник и другие кости, надпочечники и печень. 3,4,5
Около 30% всех случаев рака легких классифицируются как плоскоклеточный рак легкого. Он сильнее связан с курением, чем любой другой тип немелкоклеточного рака легкого.К другим факторам риска плоскоклеточного рака легких относятся возраст, семейный анамнез и воздействие пассивного курения Дым, возникающий при сжигании табачных изделий, и дым, выдыхаемый курильщиками, минеральная и металлическая пыль, асбест Группа минералов, которые имеют форму крошечные волокна, или радон — радиоактивный газ, который выделяется ураном, веществом, обнаруженным в почве и горных породах. 4
Он сильнее связан с курением, чем любой другой тип немелкоклеточного рака легкого.К другим факторам риска плоскоклеточного рака легких относятся возраст, семейный анамнез и воздействие пассивного курения Дым, возникающий при сжигании табачных изделий, и дым, выдыхаемый курильщиками, минеральная и металлическая пыль, асбест Группа минералов, которые имеют форму крошечные волокна, или радон — радиоактивный газ, который выделяется ураном, веществом, обнаруженным в почве и горных породах. 4
Дополнительные сведения о признаках и симптомах, которые могут указывать на плоскоклеточный рак легкого, см. В разделе «Признаки и симптомы».Обратите внимание, что плоскоклеточный рак легкого может не вызывать никаких симптомов, особенно на ранней стадии развития, и что признаки и симптомы не являются специфическими для плоскоклеточного рака легкого и могут быть вызваны другими состояниями.
Диагностика рака легких — сложный процесс. Помимо определения наличия у пациента рака легких, диагностика включает в себя категоризацию рака легких таким образом, чтобы определить лучший план лечения.
Как диагностируется плоскоклеточный рак легкого?
Различные тесты используются для диагностики рака легких и определения того, распространился ли он на другие части тела.Некоторые из них также могут помочь решить, какие методы лечения могут работать лучше всего. Шаги и тесты, используемые для диагностики плоскоклеточного рака легкого, включают:
- Визуальные тесты
- Лабораторные исследования
- Биопсия (Биопсия ткани — единственный способ подтвердить диагноз рака легких.)
Диагностические подходы, используемые для индивидуума, будут зависеть от истории болезни и состояния, симптомов, местоположения узелка (ов) и других результатов тестов.
Дополнительную информацию о различных этапах и тестах для постановки диагноза рака легких см. В разделе «Диагностика рака легких».
Стадии рака легкого
Стадия — это способ описания того, где находится рак, если или где он распространился, и влияет ли он на другие части тела. Врачи используют диагностический тест для определения стадии рака, поэтому определение стадии может быть неполным, пока не будут завершены все тесты. Знание стадии помогает врачу порекомендовать план лечения. Рак легких поддается лечению на любой стадии.
Врачи используют диагностический тест для определения стадии рака, поэтому определение стадии может быть неполным, пока не будут завершены все тесты. Знание стадии помогает врачу порекомендовать план лечения. Рак легких поддается лечению на любой стадии.
Система стадирования, используемая для плоскоклеточного рака легкого, представляет собой систему TNM, где комбинация значений, присвоенных раку пациента по трем критериям — T (опухоль), N (узел) и M (метастаз), — определяет стадию рака. .Этапы варьируются от 0 до IV. Чем выше номер стадии, тем более запущен рак. Только IV стадия метастатическая. 23,24
Дополнительную информацию о том, как определяются стадии, и характеристиках каждой стадии, см. В разделе «Стадия рака легкого».
Биомаркеры
Биомаркеры — это признаки рака, которые помогают предсказать, как он может реагировать на определенные виды лечения.
Биомаркеры, используемые в настоящее время для определения методов лечения плоскоклеточного рака легкого:
- Драйвер мутации в раковой ДНК
- Уровни белка PD-L1
- Мутационная нагрузка опухоли в раковой ДНК
Плоскоклеточный рак легкого у пациента может иметь одну из известных управляющих мутаций — изменения в ДНК пациента, которые приводят к раку легких или помогают ему прогрессировать./Large_cell_carcinoma_of_the_lung_-59b83f5bd088c00011ce3f84.jpg) В то время как исследователи достигают прогресса в понимании причинных мутаций при плоскоклеточном раке легкого, еще не существует целевых методов лечения, специально одобренных FDA для его лечения, которые требуют тестирования биомаркеров. Однако некоторые из них изучаются в клинических испытаниях, поэтому знание профиля биомаркеров рака может предоставить больше вариантов лечения. В соответствии с руководящими принципами Национальной комплексной онкологической сети (NCCN) всем пациентам с плоскоклеточным раком легких на поздней стадии рекомендуется рассмотреть вариант тестирования биомаркеров, называемый комплексным тестированием биомаркеров.Пациентам следует обсудить тестирование биомаркеров со своим врачом. 6,27
В то время как исследователи достигают прогресса в понимании причинных мутаций при плоскоклеточном раке легкого, еще не существует целевых методов лечения, специально одобренных FDA для его лечения, которые требуют тестирования биомаркеров. Однако некоторые из них изучаются в клинических испытаниях, поэтому знание профиля биомаркеров рака может предоставить больше вариантов лечения. В соответствии с руководящими принципами Национальной комплексной онкологической сети (NCCN) всем пациентам с плоскоклеточным раком легких на поздней стадии рекомендуется рассмотреть вариант тестирования биомаркеров, называемый комплексным тестированием биомаркеров.Пациентам следует обсудить тестирование биомаркеров со своим врачом. 6,27
Ниже приведены мутации-драйверы, которые были идентифицированы для плоскоклеточного рака легкого в настоящее время. 7
PD-L1 — это белковый биомаркер, используемый для определения того, может ли пациенту с плоскоклеточным раком легких получить пользу от лечения одним из иммунотерапевтических препаратов — пембролизумабом (Keytruda®), который одобрен FDA специально для лечения плоскоклеточного рака легких. пациенты. 6
пациенты. 6
Мутационная нагрузка опухоли (TMB) — это общее количество мутаций, которые приводят к изменениям в белке раковых клеток. TMB используется для определения того, получит ли пациент с раком легких пользу от специфического лечения иммунотерапией. 28,29,30
Дополнительные сведения о мутациях драйвера, PD-L1, TMB и тестировании биомаркеров см. В разделах «Тестирование биомаркеров», «Таргетная терапия» и «Иммунотерапия».
Вопросы, которые следует обсудить с вашей медицинской бригадой при планировании лечения, включают:
- Какие у меня варианты лечения?
- Какой план лечения вы мне порекомендуете?
- Какова наша цель с этим (-ми) лечением (-ами)? Чтобы избавиться от рака? Чтобы замедлить его рост? Чтобы лечить симптомы?
- Сколько времени займет мое лечение?
- Когда мне нужно определиться с планом лечения?
- Каковы риски и возможные побочные эффекты различных вариантов лечения?
- Покроет ли моя страховка эти варианты лечения?
Дополнительные наборы полезных вопросов и контрольные списки можно найти в разделе «Сторонникам и защитникам».
Есть несколько вариантов лечения плоскоклеточного рака легкого. Какие из них используются для лечения рака легких конкретного пациента, будет зависеть от стадии рака, общего состояния здоровья пациента, в том числе от того, насколько хорошо функционируют органы тела пациента, и предпочтений пациента. Один только возраст пациента не позволяет предсказать, получит ли пациент пользу от лечения. 8,9
Пациенты могут участвовать в принятии решения о плане лечения настолько, насколько они хотят.Пациенты должны обсудить все варианты, понять, какова цель каждого варианта (например, лечение или контроль), рассмотреть преимущества и риски каждого из них, проверить возможные побочные эффекты, понять, как это может повлиять на повседневную жизнь, выяснить что лечение будет значить в финансовом отношении, и не стесняйтесь получить второе мнение, если есть нерешенные проблемы. 25,26
Какие варианты лечения одобрены в настоящее время?
Утвержденные варианты лечения плоскоклеточного рака легкого включают:
- Хирургический
- Лучевая терапия
- Химиотерапия
- Ингибиторы ангиогенеза
- Иммунотерапия
Кроме того, изучаются новые методы лечения плоскоклеточного рака легкого. Они доступны через клинические испытания. 10
Они доступны через клинические испытания. 10
Для получения дополнительной информации об утвержденных вариантах лечения НМРЛ по стадиям см. Раздел «Варианты лечения немелкоклеточного рака легкого по стадиям».
Хирургия
Хирургия является вариантом лечения рака легких только тогда, когда пациент достаточно здоров для операции, а опухоль:
- обнаружен рано (в одном легком),
- можно полностью безопасно удалить, а
- не распространился в грудную клетку или другие органы 11,27
Хирургия — лучший шанс на излечение.Среди видов хирургии — лобэктомия, клиновидная резекция, сегментэктомия, пневмонэктомия и рукавная резекция — лобэктомия — удаление всей доли — в настоящее время считается наиболее эффективной. 12,27
Для получения дополнительной информации о различных вариантах хирургического вмешательства, о том, когда они используются и чего ожидать после операции, см. Раздел «Варианты лечения: Хирургия».
Лучевая терапия
Лучевая терапия — это вид лечения рака, при котором используются мощные энергетические волны для уничтожения раковых клеток или уменьшения размера опухолей.Он работает, повреждая способность раковых клеток размножаться. Радиация убивает только раковые клетки прямо на пути радиации. 2,12
Тип лучевой терапии, наиболее часто используемый для лечения немелкоклеточного рака легкого, включая плоскоклеточный рак легкого, — это дистанционная лучевая терапия (ДЛТ), которая представляет собой излучение, направленное на рак легкого извне. В зависимости от ситуации пациента можно использовать разные типы ДЛТ. 12
Для получения дополнительной информации о лучевом лечении, в том числе о том, как оно работает, как и когда оно проводится, о различных видах и общих побочных эффектах, см. Раздел «Варианты лечения: лучевая терапия».
Химиотерапия
Химиотерапия — это системное лекарственное лечение, которое чаще всего вводится внутривенно пациентам с раком легких, которое убивает быстро растущие раковые клетки, путешествуя по крови, чтобы достичь раковых клеток, где бы они ни находились. Химиотерапия также убивает быстрорастущие здоровые клетки, что способствует побочным эффектам, которые может испытывать пациент.
Химиотерапия также убивает быстрорастущие здоровые клетки, что способствует побочным эффектам, которые может испытывать пациент.
Чаще всего препараты на основе платины цисплатин или карбоплатин комбинируются с другим химиотерапевтическим препаратом для лечения плоскоклеточного рака легкого.Примером этого является цисплатин в сочетании с гемцитабином. 12
Существует еще один препарат, одобренный FDA как средство первой линии для лечения пациентов с метастатическим плоскоклеточным раком легкого. Препарат Нецитумумаб (Portrazza TM ) одобрен для использования в комбинации с цисплатином и гемцитабином. Этот препарат, по-видимому, работает, блокируя экспрессию белка EGFR, хотя для определения наличия мутации EGFR не требуется тестирования биомаркеров. 13,14
Кроме того, ингибитор тирозинкиназы (TKI) афатиниб (Gilotrif®) одобрен FDA для лечения пациентов с метастатическим плоскоклеточным раком легкого, прогрессирующим после химиотерапии на основе платины.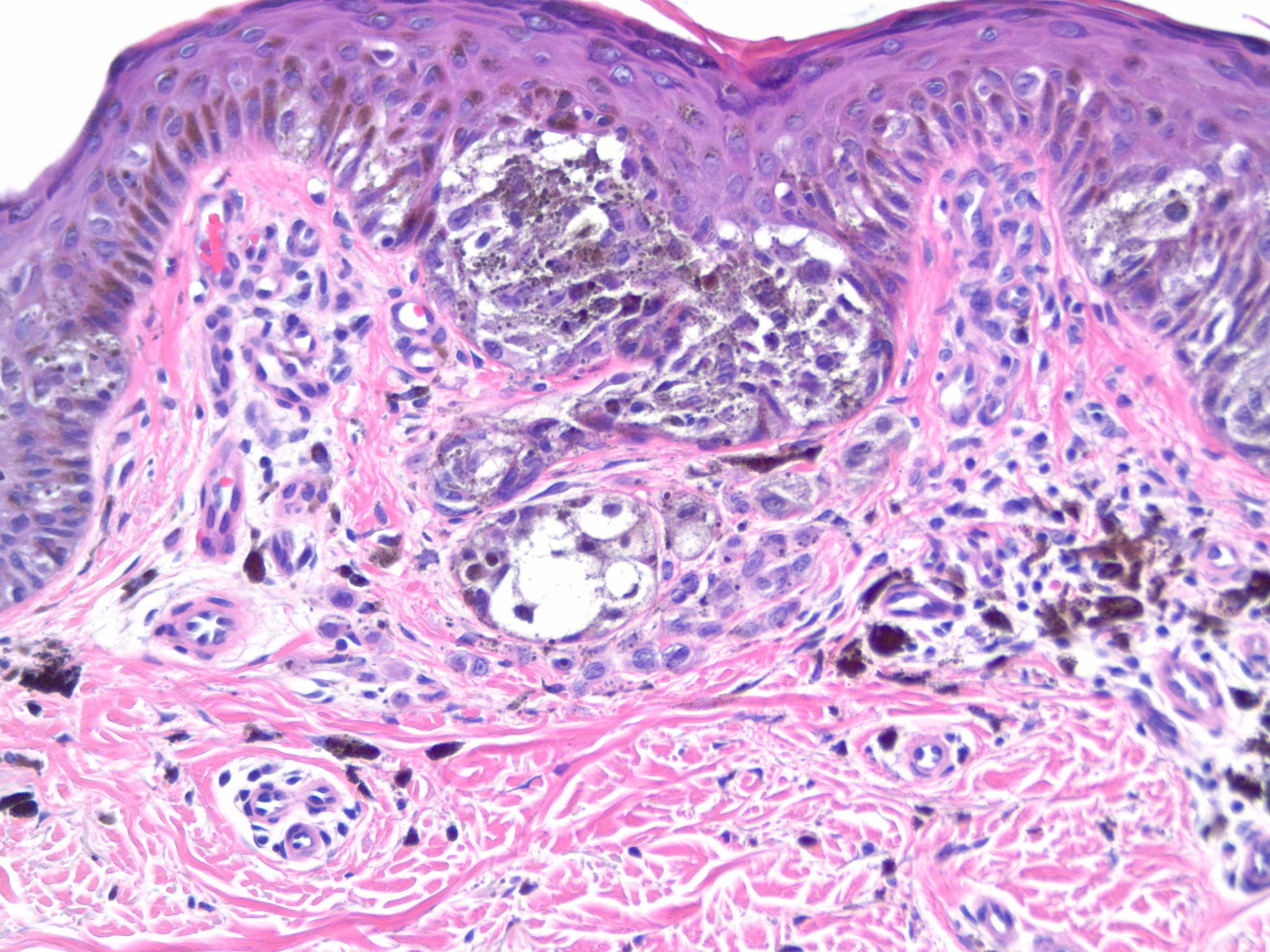 15
15
Для получения дополнительной информации о химиотерапии, в том числе о том, как она работает, как и когда ее назначают, а также о возможных побочных эффектах и способах борьбы с ними, см. Раздел «Варианты лечения: химиотерапия».
Ингибиторы ангиогенеза
По мере развития и роста организм создает новые кровеносные сосуды, снабжающие кровью все клетки. Этот процесс называется ангиогенезом. Когда новые кровеносные сосуды снабжают раковые клетки кислородом и питательными веществами, они помогают раковым клеткам расти и распространяться. 16
Ингибиторы ангиогенеза помогают остановить или замедлить рост или распространение опухолей, не давая им образовывать новые кровеносные сосуды. Затем опухоли умирают или перестают расти, потому что не могут получать кислород и питательные вещества, в которых они нуждаются. Ингибиторы действуют путем блокирования рецепторов фактора роста эндотелия сосудов (VEGF) раковых клеток. 16
В настоящее время два ингибитора ангиогенеза одобрены FDA для лечения немелкоклеточного рака легкого, но только один из них, рамуцирумаб (Cyramza®), одобрен для лечения плоскоклеточного рака легкого. Этот препарат одобрен FDA в комбинации с химиотерапевтическим доцетакселом для лечения пациентов с метастатическим немелкоклеточным раком легкого, включая плоскоклеточный рак легкого, заболевание которых прогрессировало после химиотерапии на основе платины. 17
Этот препарат одобрен FDA в комбинации с химиотерапевтическим доцетакселом для лечения пациентов с метастатическим немелкоклеточным раком легкого, включая плоскоклеточный рак легкого, заболевание которых прогрессировало после химиотерапии на основе платины. 17
Другой ингибитор ангиогенеза, бевацизумаб (Авастин®), является вариантом , а не для лечения плоскоклеточного рака легкого из-за риска легочного кровотечения. 18,19
Для получения дополнительной информации об ингибиторах ангиогенеза, о том, как они действуют, как и когда они назначаются, а также о возможных побочных эффектах и способах борьбы с ними, см. Раздел «Варианты лечения: ингибиторы ангиогенеза».
Иммунотерапия
Иммунотерапия — это вид терапии, который увеличивает естественную способность иммунной системы пациента бороться с раком. Вместо того, чтобы пытаться остановить или убить раковые клетки пациента напрямую, как это делают большинство других методов лечения рака, иммунотерапия тренирует собственную естественную иммунную систему пациента, чтобы распознавать раковые клетки и выборочно нацеливать и убивать их.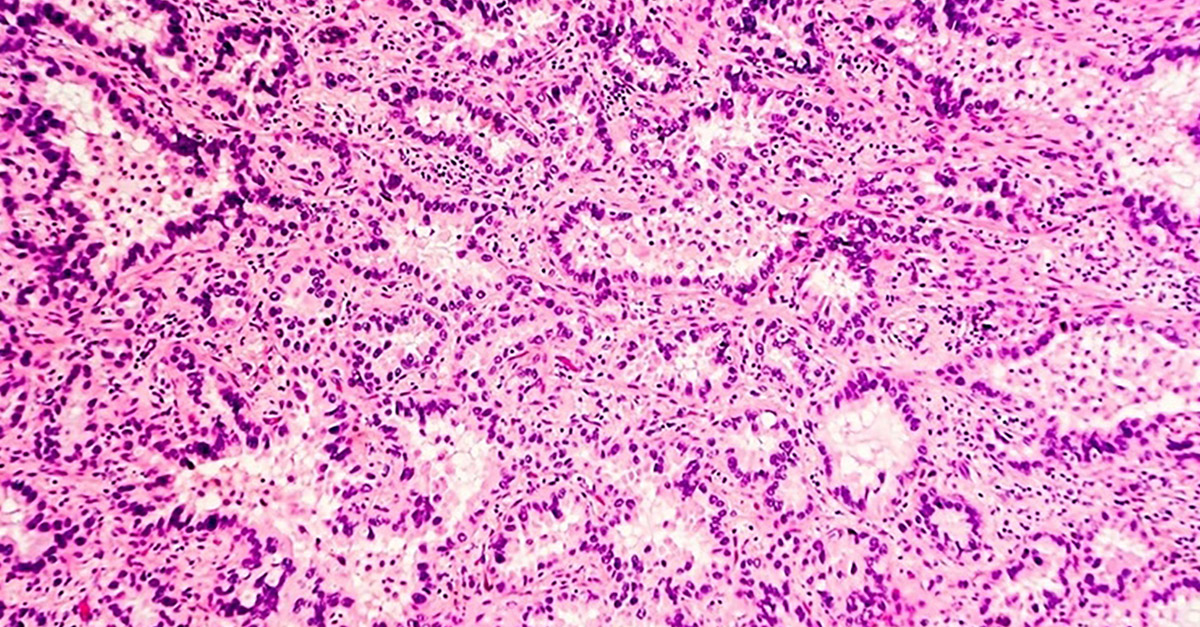 20,21
20,21
В настоящее время существует четыре одобренных FDA иммунотерапевтических препарата для пациентов с немелкоклеточным раком легкого, включая плоскоклеточный рак легкого.Эти препараты относятся к типу иммунотерапевтических средств, называемых ингибиторами иммунных контрольных точек, которые действуют путем нацеливания и блокирования отказоустойчивых механизмов иммунной системы. Цель состоит в том, чтобы не дать иммунной системе ограничить себя, чтобы иммунная система могла нацеливаться на раковые клетки. 21
Примечание: Важно сообщить вашей медицинской бригаде, если вы испытываете какие-либо проблемы во время лечения, чтобы они могли разобраться, связаны ли проблемы с лечением или нет.Также важно сообщить команде, есть ли у вас в анамнезе аутоиммунное заболевание. Возможно, иммунотерапия может усугубить аутоиммунные заболевания.
Дополнительную информацию об иммунотерапии, принципах работы иммунной системы, методах лечения, возможных побочных эффектах, других изучаемых видах иммунотерапии и вопросах, которые следует задать вашим лечащим врачам, см. В разделе «Варианты лечения: иммунотерапия».
В разделе «Варианты лечения: иммунотерапия».
Плоскоклеточная карцинома имитирует мелкоклеточную карциному легкого: клинический случай | Журнал хирургических историй болезни
Аннотация
Плоскоклеточный рак (SCC) составляет примерно 20% случаев рака легких в США.В классификации опухолей легких, принятой Всемирной организацией здравоохранения 2015 года, SCC делится на три подтипа: ороговевающий, некератинизирующий и базалоидный вариант. Некератинизирующий подтип — это плохо дифференцированная опухоль, которая может гистологически проявляться по-разному, и одна из которых является редким вариантом, сильно напоминающим мелкоклеточную карциному. В результате одной только гистологической диагностики недостаточно для правильной диагностики карциномы легких. В последние несколько лет иммуногистохимия все чаще используется для дифференциации опухолей легких.Комбинация морфологического и иммуногистохимического окрашивания должна быть основой для диагностики всех карцином легких, поскольку более доступные методы лечения становятся все более доступными.
ВВЕДЕНИЕ
Плоскоклеточный рак (SCC) составляет ~ 20% всех случаев рака легких, диагностируемых в США каждый год [1]. Классификация Всемирной организации здравоохранения (ВОЗ) 2004 г. признала четыре варианта плоскоклеточного рака легкого: светлоклеточный, мелкоклеточный. , папиллярный и базалоидный [2].Однако, поскольку мелкоклеточные и светлоклеточные варианты встречались редко, эти термины были изменены в 2015 году, а SCC были переклассифицированы как базалоидные и ороговевшие или некератинизирующие в зависимости от степени гистологической дифференцировки, хорошо или плохо дифференцированные, соответственно [3, 4]. Исторически золотым стандартом диагностики подтипов карциномы легких были морфологические различия, наблюдаемые при световой микроскопии с использованием окраски гематоксилином и эозином (HE) [5]. SCC идентифицируется при световой микроскопии по наличию ороговения и межклеточных мостиков [5]. Однако этот метод осложняется плохо дифференцированными некератинизирующими карциномами, которые не имеют этого характерного гистологического вида и затрудняют дифференциацию от гистологии первичной мелкоклеточной карциномы легкого [3]. Таким образом, диагностика опухоли легкого требует добавления иммуногистохимии, которая играет важную роль в дифференциации биоптатов с одинаковыми гистологическими характеристиками [3]. Цели этого описания случая: (i) сообщить и рассмотреть случай пациента с диагнозом SCC плохо дифференцированного некератинизирующего подтипа; (ii) оценить гистологическую морфологию и иммуногистохимию SCC плохо дифференцированного некератинизирующего подтипа и (iii) прокомментировать важность иммуногистохимического (ИГХ) подтверждения в диагностике опухолей легких.
Однако этот метод осложняется плохо дифференцированными некератинизирующими карциномами, которые не имеют этого характерного гистологического вида и затрудняют дифференциацию от гистологии первичной мелкоклеточной карциномы легкого [3]. Таким образом, диагностика опухоли легкого требует добавления иммуногистохимии, которая играет важную роль в дифференциации биоптатов с одинаковыми гистологическими характеристиками [3]. Цели этого описания случая: (i) сообщить и рассмотреть случай пациента с диагнозом SCC плохо дифференцированного некератинизирующего подтипа; (ii) оценить гистологическую морфологию и иммуногистохимию SCC плохо дифференцированного некератинизирующего подтипа и (iii) прокомментировать важность иммуногистохимического (ИГХ) подтверждения в диагностике опухолей легких.
ДЕЛО
Пациент в анамнезе имел гипертонию, сахарный диабет 2 типа и гиперлипидемию. За три года до этого у пациента при цитологическом исследовании была диагностирована мелкоклеточная карцинома левого легкого, и он прошел курс химиотерапии под наблюдением. Пациент поступил на биопсию левого легкого и размещение левого подключичного срединного порта после обнаружения язычного узелка. В целом образец язычного узелка имел размеры 3,3 × 3.0 × 1,4 см, а вырезанные срезы показали желтовато-коричневую массу размером 1,5 × 2 см. Микроскопическое исследование показало, что опухоль состоит из гнезд маленьких синих клеток с высоким соотношением ядер / цитоплазмы (N / C) и высокой митотической активностью (рис. 1). Морфологических признаков плоской дифференцировки не выявлено. Опухолевые клетки имеют отчетливые ядрышки, и отсутствие формования снижает вероятность мелкоклеточной карциномы. Окрашивание ИГХ показывает, что опухолевые клетки были положительны по маркерам плоскоклеточных клеток (p40, p63 и CK5 / 6) (рис.2), Pan Keratin, TTF1 (очаговые) и отрицательны по нейроэндокринным маркерам (CD56, хромогранин и синаптофизин) (рис.3) и CD45. Иммуноокрашивание Ki 67 имеет ~ 70% положительности. В сочетании с морфологическими особенностями этот иммунохимический профиль подтвердил диагноз плохо дифференцированной некератинизирующей плоскоклеточной карциномы, а не мелкоклеточной карциномы.
Пациент поступил на биопсию левого легкого и размещение левого подключичного срединного порта после обнаружения язычного узелка. В целом образец язычного узелка имел размеры 3,3 × 3.0 × 1,4 см, а вырезанные срезы показали желтовато-коричневую массу размером 1,5 × 2 см. Микроскопическое исследование показало, что опухоль состоит из гнезд маленьких синих клеток с высоким соотношением ядер / цитоплазмы (N / C) и высокой митотической активностью (рис. 1). Морфологических признаков плоской дифференцировки не выявлено. Опухолевые клетки имеют отчетливые ядрышки, и отсутствие формования снижает вероятность мелкоклеточной карциномы. Окрашивание ИГХ показывает, что опухолевые клетки были положительны по маркерам плоскоклеточных клеток (p40, p63 и CK5 / 6) (рис.2), Pan Keratin, TTF1 (очаговые) и отрицательны по нейроэндокринным маркерам (CD56, хромогранин и синаптофизин) (рис.3) и CD45. Иммуноокрашивание Ki 67 имеет ~ 70% положительности. В сочетании с морфологическими особенностями этот иммунохимический профиль подтвердил диагноз плохо дифференцированной некератинизирующей плоскоклеточной карциномы, а не мелкоклеточной карциномы.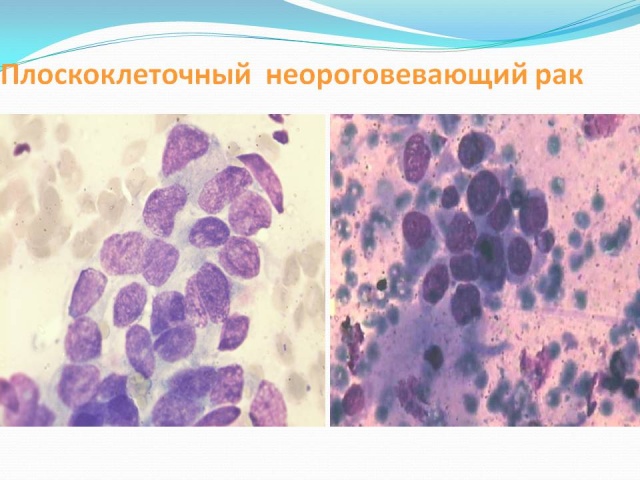
Рисунок 1
Микроскопическое исследование выявляет гнездо маленьких синих клеток с высоким отношением N / C (HE × 40).
Рисунок 1
Микроскопическое исследование выявляет гнездо маленьких синих клеток с высоким отношением N / C (HE × 40).
Рисунок 2
Опухолевые клетки иммунопозитивны в отношении p63 (ИГХ × 40).
Рисунок 2
Опухолевые клетки иммунопозитивны в отношении p63 (IHC × 40).
Фигура 3
Опухолевые клетки иммунонегативны в отношении хромогранина (ИГХ × 40).
Рисунок 3
Опухолевые клетки иммунонегативны по хромогранину (ИГХ × 40).
ОБСУЖДЕНИЕ
Гистологическая идентификация с окрашиванием HE является надежным методом диагностики высокодифференцированных опухолей SCC кератинизирующего типа с четкими морфологическими паттернами, включая кератинизацию и межклеточные мосты [3]. Однако он не подходит для различения плохо дифференцированных гистологических подтипов немелкоклеточной карциномы, и для диагностики рекомендуется дополнительное окрашивание ИГХ [3]. Для сравнения, текущая рекомендация ВОЗ по диагностике мелкоклеточной карциномы касается только морфологии, а иммуногистохимия указывается в качестве полезного адъюванта, но не является обязательной для диагностики [6]. Некоторые ограничения морфологической диагностики мелкоклеточной карциномы включают артефакты раздавливания, некроз опухоли, ограниченное представление опухоли и трудности в различении мелкоклеточной карциномы и низкодифференцированного некератинизирующего варианта плоскоклеточной карциномы, как показано в случае нашего пациента [7].Имея это в виду, иммуногистохимия может быть важным вспомогательным средством в диагностике плоскоклеточного рака.
Однако он не подходит для различения плохо дифференцированных гистологических подтипов немелкоклеточной карциномы, и для диагностики рекомендуется дополнительное окрашивание ИГХ [3]. Для сравнения, текущая рекомендация ВОЗ по диагностике мелкоклеточной карциномы касается только морфологии, а иммуногистохимия указывается в качестве полезного адъюванта, но не является обязательной для диагностики [6]. Некоторые ограничения морфологической диагностики мелкоклеточной карциномы включают артефакты раздавливания, некроз опухоли, ограниченное представление опухоли и трудности в различении мелкоклеточной карциномы и низкодифференцированного некератинизирующего варианта плоскоклеточной карциномы, как показано в случае нашего пациента [7].Имея это в виду, иммуногистохимия может быть важным вспомогательным средством в диагностике плоскоклеточного рака.
Большинство мелкоклеточных карцином демонстрируют иммунофенотип TTF-1 + / p63- / высокомолекулярный кератин-, тогда как низкодифференцированный некератинизирующий подтип SCC демонстрирует противоположную реактивность, демонстрируя иммунофенотип TTF-1 / p63 + / высокомолекулярный кератин + [ 7]. В частности, окрашивание p63 обратно связано с ороговением, что делает p63 важным маркером плоскоклеточной дифференцировки в низкодифференцированной плоскоклеточной карциноме [7].
В частности, окрашивание p63 обратно связано с ороговением, что делает p63 важным маркером плоскоклеточной дифференцировки в низкодифференцированной плоскоклеточной карциноме [7].
Как показано в этом тематическом исследовании, использование только морфологической диагностики может привести к неправильному диагнозу, поскольку он плохо различает мелкоклеточную карциному и низкодифференцированный некератинизирующий подтип плоскоклеточной карциномы. Различие между этими опухолями становится значительно более важным по мере достижения прогресса в химиотерапии, а таргетная иммунная терапия становится более доступной [3]. Направленные иммунотерапевтические агенты для лечения ПКР, одобренные для использования Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов, включают антагонист PD1 пембролизумаб, и в настоящее время продолжаются исследования других нацеленных путей и рецепторов, включая FGFR и путь PI3K – AKT [8].Напротив, антиапоптотические белки Bcl-2 и пути самообновления, такие как hedgehog и NOTCH, были идентифицированы как потенциальные мишени для лечения мелкоклеточной карциномы [9].
ЗАКЛЮЧЕНИЕ
Слабо дифференцированный некератинизирующий вариант SCC является необычным подтипом SCC. Гистологически он сильно напоминает мелкоклеточную карциному и может быть легко диагностирован без использования иммуногистохимии. Панель TTF-1, p63 и высокомолекулярного кератина является полезным дополнением к гистологическому исследованию для различения двух опухолей.Слабо дифференцированным некератинизирующим вариантом SCC является TTF-1- / p63 + / высокомолекулярный кератин + /, что отличает его от мелкоклеточного рака, которым является TTF 1 + / p63- / высокомолекулярный кератин-. Комбинация гистологии и окрашивания ИГХ должна регулярно использоваться в клинической практике, чтобы гарантировать правильную дифференциацию между подтипами. По мере того, как становятся доступными более целенаправленные иммунные методы лечения рака легких, различение этих подтипов будет иметь решающее значение для их лечения.
ЗАЯВЛЕНИЕ О КОНФЛИКТЕ ИНТЕРЕСОВ
Не объявлено.
Список литературы
1.Cruz
C
,Lynn
T
,Matthay
R
.Рак легкого: эпидемиология, этиология и профилактика
.Clin Chest Med
2011
;32
:1
—61
.2.Перес-Морено
P
,Brambilla
E
,Thomas
R
,Soria
J
.Плоскоклеточный рак легкого: молекулярные подтипы и терапевтические возможности
.Clin Cancer Res
2012;18
:2443
—51
.3.Travis
W
,Brambilla
E
,Nicholson
A
,Yatabe
Y
,Austin
J
, 9000 et al.Классификация опухолей легких Всемирной организацией здравоохранения 2015 г.Влияние генетических, клинических и радиологических достижений с момента классификации 2004 г.
.J Thorac Oncol
2015;10
:1243
—60
.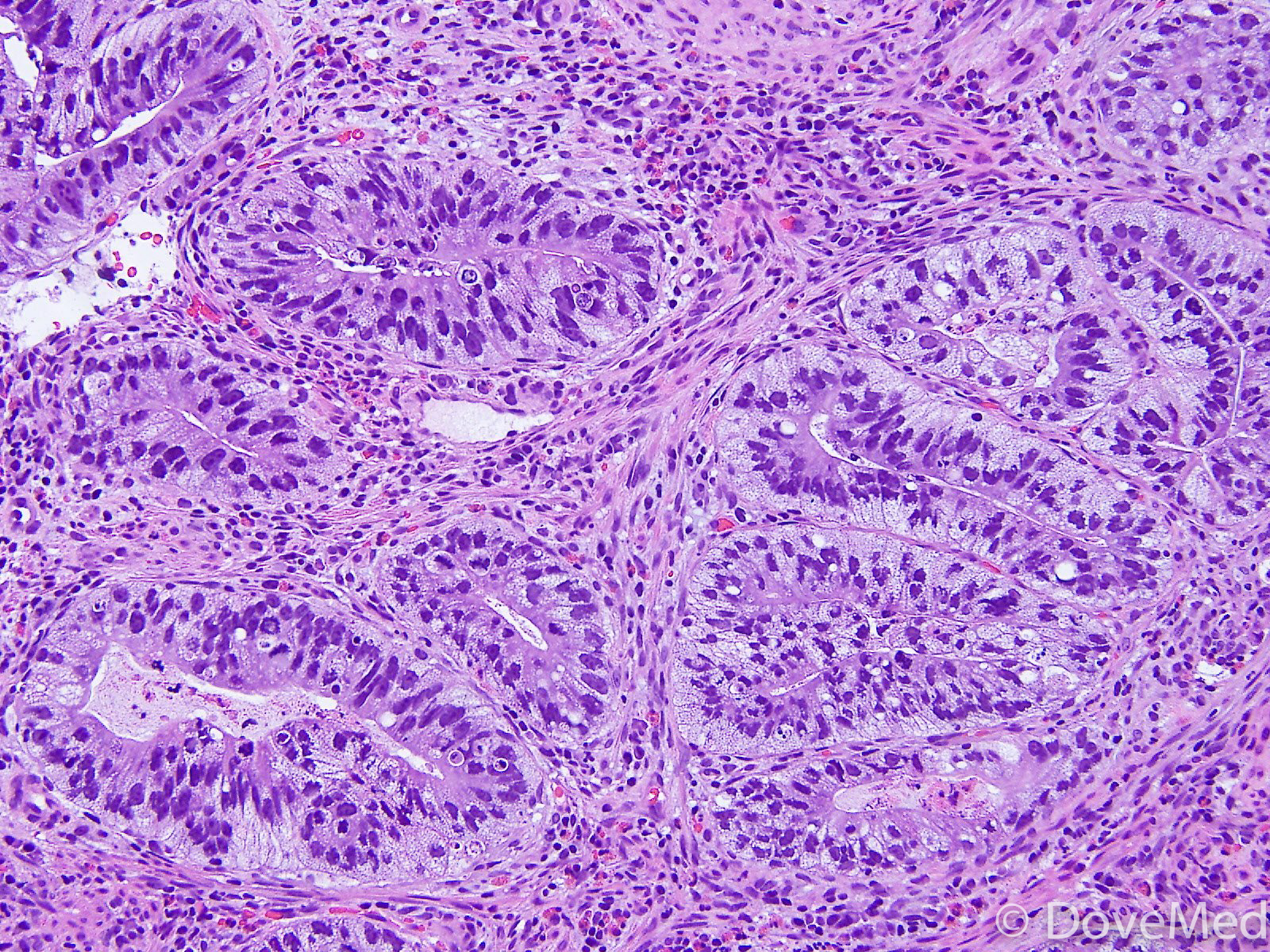 4.
4.Kadota
K
,Nitadori
J
,Rekhtman
N
,Jones
D
,Adusumilli
PS
,000 Travis
Переоценка и реклассификация резецированных карцином легких, первоначально диагностированных как плоскоклеточная карцинома с помощью иммуногистохимического анализа
.Am J Surg Pathol
2015
;39
:1170
—80
. 5.Beasley
MB
,Brambilla
E
,Travis
W
.Классификация опухолей легких Всемирной организации здравоохранения 2004 г.
.Семин Рентгенол
2005
;40
:90
—7
.6.Fruh
M
,De Ruysscher
D
,Popat
S
,Peters
S
,Felip
E
.Мелкоклеточный рак легкого (SCLC): клинические практические рекомендации ESMO по диагностике, лечению и последующему наблюдению
.Рак легких
2013
;24
:99
—105
.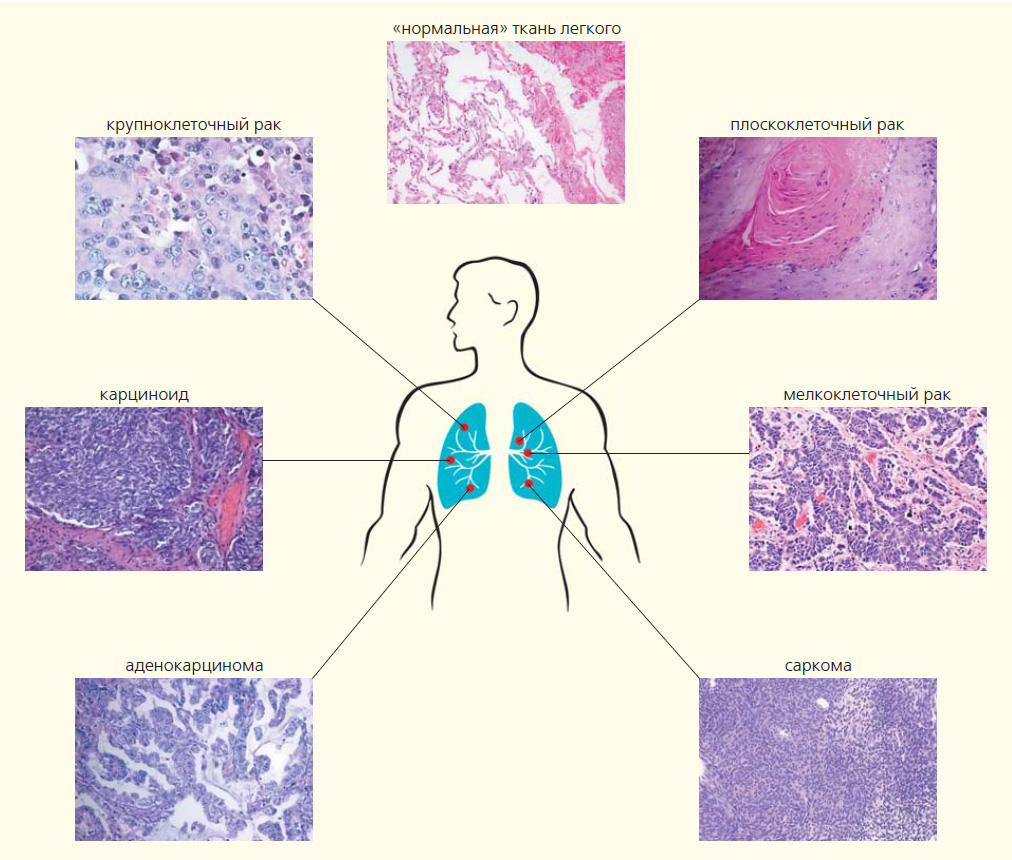 7.
7.Zhang
H
,Liu
J
,Cagle
P
,Allen
T
,Laga
A
,Zander
D
Отличие мелкоклеточной карциномы легких от низкодифференцированной плоскоклеточной карциномы: иммуногистохимический подход
.Mod Pathol
2005
;18
:111
—8
.8.Derman
B
,Mileham
K
,Bonomi
P
,Batus
M
,Fidler
M
.Лечение запущенной плоскоклеточной карциномы легкого: обзор
.Transl Lung Cancer Res
2015
;4
:524
—32
.9.Gadgeel
SM
.Таргетная терапия и иммунотерапия мелкоклеточного рака легкого
.Curr Treat Option ON
2018
;19
:53
.Опубликовано Oxford University Press и JSCR Publishing Ltd. © Автор (ы) 2020.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons.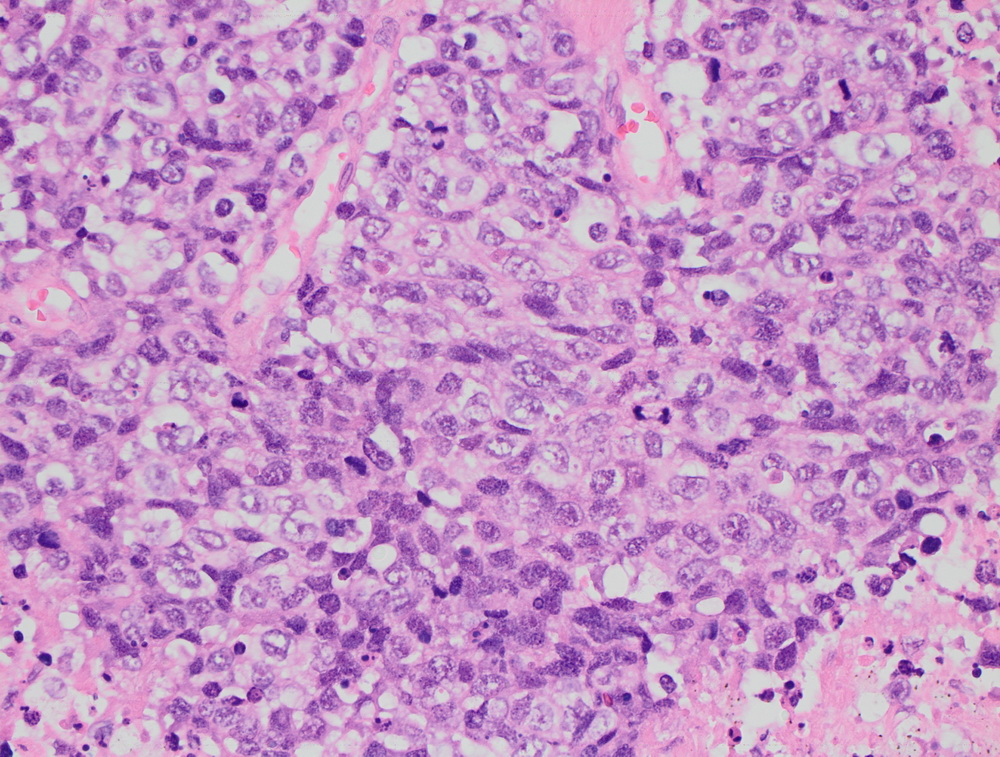 org/licenses/by/4.0). /), что разрешает неограниченное повторное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
org/licenses/by/4.0). /), что разрешает неограниченное повторное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.Таргетная терапия запущенного плоскоклеточного рака легкого | Таргетная онкология
Abstract
Плоскоклеточный рак легкого — уникальная подгруппа немелкоклеточного рака легкого (НМРЛ) с агрессивным фенотипом. В отличие от аденокарциномы легкого, где геномное профилирование является частью стандарта лечения, а таргетная терапия обычно используется, данные об активности и эффективности таргетных агентов для этой подгруппы пациентов ограничены. Плоскоклеточный рак также представляет собой определенные терапевтические проблемы в силу того, что он проявляется у пожилых пациентов, его физическое расположение в грудной клетке, характер метастазов и связь с сопутствующими заболеваниями могут поставить под угрозу проведение лечения и усугубить токсичность.За последнее десятилетие мы добились огромного прогресса в понимании биологии и молекулярных характеристик этого заболевания. Новые целевые методы лечения, особенно моноклональные антитела, такие как рамуцирумаб и нецитумумаб, и иммунотерапия, такая как ниволумаб и пембролизумаб, привели к увеличению выживаемости, что также наблюдается при плоскоклеточном НМРЛ. Кроме того, с доступностью секвенирования генома мы теперь можем предложить точное нацеливание на соответствующие действенные цели.Здесь мы рассматриваем доступные в настоящее время и одобренные терапевтические агенты для лечения метастатического плоскоклеточного НМРЛ и клинические испытания, посвященные таргетной терапии.
Новые целевые методы лечения, особенно моноклональные антитела, такие как рамуцирумаб и нецитумумаб, и иммунотерапия, такая как ниволумаб и пембролизумаб, привели к увеличению выживаемости, что также наблюдается при плоскоклеточном НМРЛ. Кроме того, с доступностью секвенирования генома мы теперь можем предложить точное нацеливание на соответствующие действенные цели.Здесь мы рассматриваем доступные в настоящее время и одобренные терапевтические агенты для лечения метастатического плоскоклеточного НМРЛ и клинические испытания, посвященные таргетной терапии.
Введение
Рак легких остается наиболее частой причиной смертности от рака в Соединенных Штатах. 1 Из всех случаев рака легких более 85% классифицируются как немелкоклеточный рак легкого (НМРЛ), причем плоскоклеточный рак (SqCC) составляет примерно 30%. SqCC, когда-то самый распространенный подтип НМРЛ, за последние два десятилетия снизился в заболеваемости, что в основном связано с общим снижением частоты курения и изменениями в сигаретных фильтрах, которые способствуют дистальной доставке табачного дыма в легкие.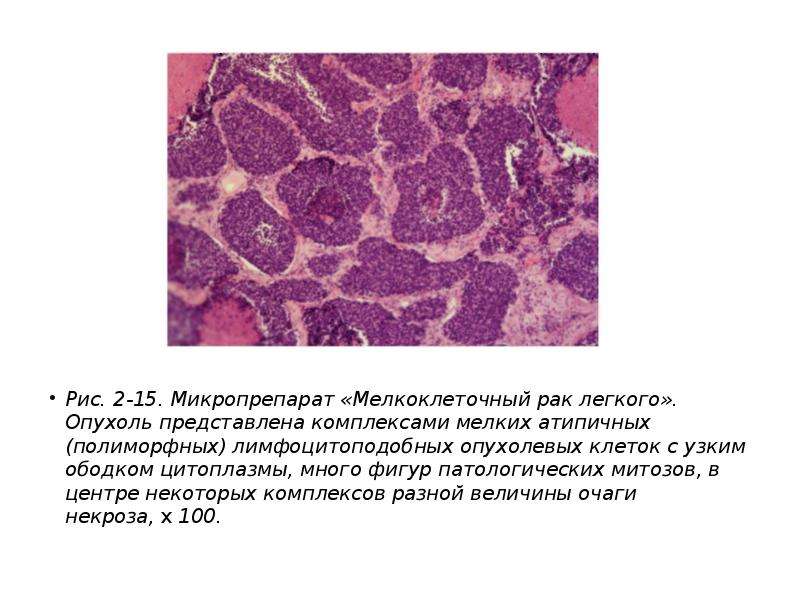 2 Последнее способствовало увеличению заболеваемости аденокарциномой, которая составляет большинство пациентов с НМРЛ. 3 Несмотря на снижение заболеваемости, СКК легких остается распространенным злокачественным новообразованием, на которое ежегодно приходится около 85 000 новых случаев в США и более 400 000 случаев во всем мире. SqCC создает множество терапевтических проблем, связанных с демографическими данными пациента, характеристиками опухоли и биологией опухоли. Пациенты, как правило, старше, с высокой частотой курения и более высокой частотой сопутствующих заболеваний, включая низкий легочный резерв и наличие ХОБЛ. 3,4 Кроме того, SqCC часто затрагивает центральные дыхательные пути, и расположение этих опухолей вблизи крупных кровеносных сосудов может создавать проблемы лечения, включая кровотечение и кровохарканье, что, в свою очередь, может противопоказать использование определенных терапевтических агентов. 4
2 Последнее способствовало увеличению заболеваемости аденокарциномой, которая составляет большинство пациентов с НМРЛ. 3 Несмотря на снижение заболеваемости, СКК легких остается распространенным злокачественным новообразованием, на которое ежегодно приходится около 85 000 новых случаев в США и более 400 000 случаев во всем мире. SqCC создает множество терапевтических проблем, связанных с демографическими данными пациента, характеристиками опухоли и биологией опухоли. Пациенты, как правило, старше, с высокой частотой курения и более высокой частотой сопутствующих заболеваний, включая низкий легочный резерв и наличие ХОБЛ. 3,4 Кроме того, SqCC часто затрагивает центральные дыхательные пути, и расположение этих опухолей вблизи крупных кровеносных сосудов может создавать проблемы лечения, включая кровотечение и кровохарканье, что, в свою очередь, может противопоказать использование определенных терапевтических агентов. 4
При наличии широко распространенного геномного секвенирования и введения специфических целевых агентов для подгрупп пациентов с аденокарциномой, например, с активирующими мутациями в рецепторе эпидермального фактора роста (EGFR) или гене киназы анапластической лимфомы (ALK) перестройки, выживаемость пациентов с неплоскоклеточным метастатическим НМРЛ значительно улучшилась. 5-7 В то же время терапевтический прогресс при плоскоклеточном раке легкого был относительно медленным, с относительной стагнацией показателей выживаемости в диапазоне 9-11 месяцев без существенного улучшения вплоть до самого недавнего времени8. недавно одобренный necitumumab, не было других одобрений Управления по контролю за продуктами и лекарствами США (FDA) специально для SqCC легкого. Лечение SqCC легкого остается неудовлетворенной потребностью, и необходимы новые стратегии лечения, включая специфические целевые методы лечения, которые обеспечили бы клинически значимые результаты без неблагоприятного воздействия на качество жизни.
5-7 В то же время терапевтический прогресс при плоскоклеточном раке легкого был относительно медленным, с относительной стагнацией показателей выживаемости в диапазоне 9-11 месяцев без существенного улучшения вплоть до самого недавнего времени8. недавно одобренный necitumumab, не было других одобрений Управления по контролю за продуктами и лекарствами США (FDA) специально для SqCC легкого. Лечение SqCC легкого остается неудовлетворенной потребностью, и необходимы новые стратегии лечения, включая специфические целевые методы лечения, которые обеспечили бы клинически значимые результаты без неблагоприятного воздействия на качество жизни.
В последнее время молекулярное генотипирование привело к применению целевых агентов для мутаций, распространенных в SqCC. 9 В этом обзоре целевого лечения плоскоклеточного рака легкого освещаются эти недавние молекулярные достижения и обсуждается потенциальная роль новых молекулярных агентов, которые в настоящее время оцениваются для лечения запущенного SqCC.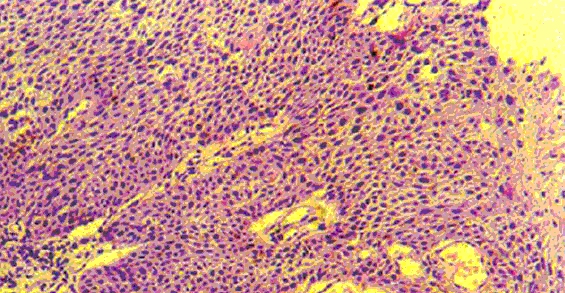
Первая линия терапии Advanced SqCC
Дублеты на основе платины являются краеугольным камнем первой линии системной паллиативной терапии для продвинутой SqCC.Более ранние испытания, проведенные с использованием схемы на основе цисплатина или карбоплатина с использованием различных платиновых партнеров, а именно паклитаксела, гемцитабина или доцетаксела, не показали каких-либо существенных различий в выживаемости.10 Позднее при поздних стадиях СКК гемцитабин-цисплатин по сравнению с пеметрекседцисплатином наблюдался положительный эффект на выживаемость. (n = 473; 10,8 против 9,4 месяца, соответственно) в рандомизированном клиническом исследовании фазы III. 11,12 Основываясь на этих результатах, платиновый агент плюс гемцитабин или таксан остается наиболее часто используемой комбинацией первой линии, при этом выбор агентов обычно основан на токсичности и ранее существовавших медицинских проблемах.Набпаклитаксел — еще один вариант лечения пациентов с поздней стадией SqCC. 13,14 В анализе подгруппы исследования фазы III (n = 1052, комбинация наб-паклитаксел-карбоплатин первой линии продемонстрировала значительное улучшение скорости ответа по сравнению с паклитаксел-карбоплатином (41% против 24%; P < Хотя улучшение частоты ответа не привело к значительному увеличению выживаемости ни при SqCC (10,7 против 9,5 месяцев; отношение рисков [HR] 0,89), ни при неплоскоклеточном НМРЛ (13.1 против 13,0 месяцев; HR, 0,95), наб-паклитаксел плюс агент платины, обычно карбоплатин, остается жизнеспособным вариантом лечения первой линии для пациентов с SqCC, который может предложить некоторые преимущества, в основном меньшую частоту периферической нейропатии, меньшее количество реакций на инфузию и более короткое время инфузии. 14
13,14 В анализе подгруппы исследования фазы III (n = 1052, комбинация наб-паклитаксел-карбоплатин первой линии продемонстрировала значительное улучшение скорости ответа по сравнению с паклитаксел-карбоплатином (41% против 24%; P < Хотя улучшение частоты ответа не привело к значительному увеличению выживаемости ни при SqCC (10,7 против 9,5 месяцев; отношение рисков [HR] 0,89), ни при неплоскоклеточном НМРЛ (13.1 против 13,0 месяцев; HR, 0,95), наб-паклитаксел плюс агент платины, обычно карбоплатин, остается жизнеспособным вариантом лечения первой линии для пациентов с SqCC, который может предложить некоторые преимущества, в основном меньшую частоту периферической нейропатии, меньшее количество реакций на инфузию и более короткое время инфузии. 14
Кроме того, нецитумумаб, моноклональное антитело второго поколения, нацеленное на EGFR, было недавно одобрено (ноябрь 2015 г.) в комбинации с гемцитабином-цисплатином для лечения первой линии метастатического SqCC. Это одобрение было получено после демонстрации более высокой выживаемости при комбинированной терапии по сравнению с одной химиотерапией (11,5 против 9,9 месяцев; ОР 0,84; 95% ДИ от 0,74 до 0,96; P = 0,01), выживаемость без прогрессирования (ВБП) (5,7 против 5,5 месяцев; ОР 0,85; 95% ДИ от 0,74 до 0,98; P = 0,02) и уровень контроля заболевания (82% против 77%; P = 0,043). 15 Это было одно из первых испытаний, показавших более высокую выживаемость нового агента в сочетании с химиотерапией по сравнению с одной химиотерапией при SqCC легкого.Профиль безопасности нецитуумумаба соответствует антителам EGFR в комбинации с химиотерапией, с более частыми венозными тромбоэмболиями и повышенной частотой кожных реакций степени> 3 и гипомагниемии. 15
Это одобрение было получено после демонстрации более высокой выживаемости при комбинированной терапии по сравнению с одной химиотерапией (11,5 против 9,9 месяцев; ОР 0,84; 95% ДИ от 0,74 до 0,96; P = 0,01), выживаемость без прогрессирования (ВБП) (5,7 против 5,5 месяцев; ОР 0,85; 95% ДИ от 0,74 до 0,98; P = 0,02) и уровень контроля заболевания (82% против 77%; P = 0,043). 15 Это было одно из первых испытаний, показавших более высокую выживаемость нового агента в сочетании с химиотерапией по сравнению с одной химиотерапией при SqCC легкого.Профиль безопасности нецитуумумаба соответствует антителам EGFR в комбинации с химиотерапией, с более частыми венозными тромбоэмболиями и повышенной частотой кожных реакций степени> 3 и гипомагниемии. 15
Вторая и последующая линия терапии для SqCC
Парадигма терапии второй линии для SqCC значительно изменилась с утверждением ниволумаба и пембролизумаба в марте 2015 и октябре 2015, соответственно. Эти ингибиторы контрольных точек, которые блокируют путь белка запрограммированной гибели клеток (PD-1), восстанавливают функцию иммунной системы и позволяют Т-клеткам действовать надлежащим образом против опухолей.Одобрение анти-PD-1 агента ниволумаба для лечения второй линии запущенного SqCC было основано на результатах исследования фазы III Checkmate 017, сравнивающего ниволумаб с доцетакселом (n = 272). 16,17 Пациенты, получавшие ниволумаб, имели значительно более длительную медианную общую выживаемость по сравнению с пациентами, получавшими доцетаксел (9,2 против 6,0 месяцев; ОР 0,59; 95% ДИ от 0,44 до 0,79; P <0,001), повышенная медиана ВБП ( 3,5 против 2,8 месяца; ОР смерти или прогрессирования заболевания 0,62; 95% ДИ 0.47 до 0,81; P <0,001) и повышенная скорость ответа (20% против 9%; P = 0,008). Годовая выживаемость составила 42% и 24% соответственно. Средняя продолжительность ответа не была достигнута в группе ниволумаба по сравнению с 8,4 месяцами в группе доцетаксела.
Эти ингибиторы контрольных точек, которые блокируют путь белка запрограммированной гибели клеток (PD-1), восстанавливают функцию иммунной системы и позволяют Т-клеткам действовать надлежащим образом против опухолей.Одобрение анти-PD-1 агента ниволумаба для лечения второй линии запущенного SqCC было основано на результатах исследования фазы III Checkmate 017, сравнивающего ниволумаб с доцетакселом (n = 272). 16,17 Пациенты, получавшие ниволумаб, имели значительно более длительную медианную общую выживаемость по сравнению с пациентами, получавшими доцетаксел (9,2 против 6,0 месяцев; ОР 0,59; 95% ДИ от 0,44 до 0,79; P <0,001), повышенная медиана ВБП ( 3,5 против 2,8 месяца; ОР смерти или прогрессирования заболевания 0,62; 95% ДИ 0.47 до 0,81; P <0,001) и повышенная скорость ответа (20% против 9%; P = 0,008). Годовая выживаемость составила 42% и 24% соответственно. Средняя продолжительность ответа не была достигнута в группе ниволумаба по сравнению с 8,4 месяцами в группе доцетаксела. Нежелательные явления 3 или 4 степени, связанные с лечением, регистрировались реже при приеме ниволумаба по сравнению с доцетакселом (7% против 55%). В исследовательском анализе у ограниченного числа пациентов, который использовал низкие пороговые значения для экспрессии PD-L1, преимущества OS и PFS с ниволумабом наблюдались независимо от уровней экспрессии PD-L1 в опухоли.Другой анти-PD-1 агент, пембролизумаб, получил ускоренное одобрение в США для лечения второй линии пациентов с распространенным НМРЛ, включая SqCC, опухоли которых экспрессируют PD-L1, на основе анализа подгрупп пациентов в KEYNOTE-001. исследование с показателем доли опухоли (TPS) экспрессии PD-L1 ≥50% (n = 61), в котором наблюдалась частота ответа 41% и большая продолжительность ответа18. Кроме того, во второй линии фазы II / III КЛЮЧЕВОЕ ПРИМЕЧАНИЕ В исследовании -010 (n = 1034) пембролизумаб продемонстрировал более длительную ОВ по сравнению с доцетакселом у пациентов с TPS PD-L1 ≥50% и TPS ≥1% независимо от гистологии.
Нежелательные явления 3 или 4 степени, связанные с лечением, регистрировались реже при приеме ниволумаба по сравнению с доцетакселом (7% против 55%). В исследовательском анализе у ограниченного числа пациентов, который использовал низкие пороговые значения для экспрессии PD-L1, преимущества OS и PFS с ниволумабом наблюдались независимо от уровней экспрессии PD-L1 в опухоли.Другой анти-PD-1 агент, пембролизумаб, получил ускоренное одобрение в США для лечения второй линии пациентов с распространенным НМРЛ, включая SqCC, опухоли которых экспрессируют PD-L1, на основе анализа подгрупп пациентов в KEYNOTE-001. исследование с показателем доли опухоли (TPS) экспрессии PD-L1 ≥50% (n = 61), в котором наблюдалась частота ответа 41% и большая продолжительность ответа18. Кроме того, во второй линии фазы II / III КЛЮЧЕВОЕ ПРИМЕЧАНИЕ В исследовании -010 (n = 1034) пембролизумаб продемонстрировал более длительную ОВ по сравнению с доцетакселом у пациентов с TPS PD-L1 ≥50% и TPS ≥1% независимо от гистологии.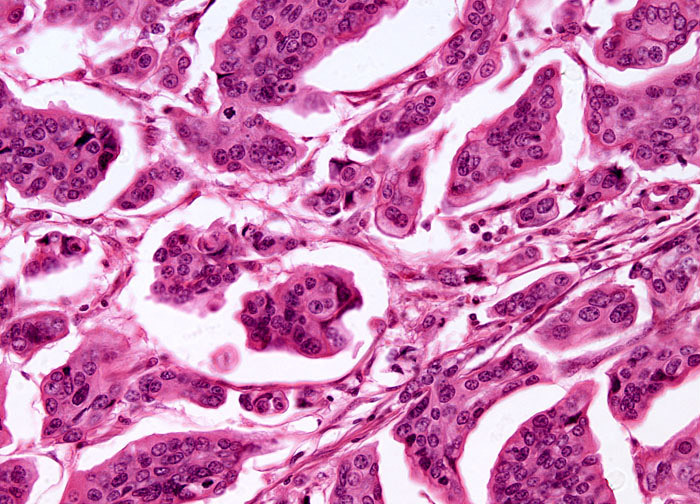 19 Это преимущество было также замечено для подгруппы SqCC с HR 0,74 (ДИ 0,50–1,09). Другие анти-PD-1 и анти-PD-L1 агенты, такие как атезолизумаб и дурвалумаб, находятся в фазе III разработки для лечения распространенного НМРЛ, включая SqCC.
19 Это преимущество было также замечено для подгруппы SqCC с HR 0,74 (ДИ 0,50–1,09). Другие анти-PD-1 и анти-PD-L1 агенты, такие как атезолизумаб и дурвалумаб, находятся в фазе III разработки для лечения распространенного НМРЛ, включая SqCC.
Другие агенты, такие как доцетаксел или эрлотиниб, считаются разумными терапевтическими вариантами, но они не одобрены специально для лечения СКК. Рамицирумаб, моноклональное антитело, нацеленное на VEGFR2, оценивали в рандомизированном исследовании фазы III (REVEL, n = 1253) в комбинации с доцетакселом у пациентов с распространенным НМРЛ, прогрессирующим после первичной химиотерапии на основе платины, независимо от гистологии опухоли.Рамуцирумаб плюс доцетаксел продемонстрировал улучшение медианы ОВ по сравнению с одним доцетакселом в общей популяции (10,5 против 9,1 месяцев; ОР 0,86; 95% ДИ 0,75–0,98; P = 0,023) .20 Сопоставимые, но не значимые преимущества ОВ наблюдались в подгруппе SqCC (n = 328 [26%]; 9,5 против 8,2 месяца; ОР 0,88; 95% ДИ от 0,69 до 1,13). Это единственный антиангиогенный препарат, у которого есть показания для SqCC.
Это единственный антиангиогенный препарат, у которого есть показания для SqCC.
Таргетная терапия для SqCC
До недавнего времени было мало что известно о геномике SqCC.Благодаря доступности секвенирования генов и всесторонних геномных исследований наше понимание мутационного профиля SqCC значительно улучшилось. 9 Прогресс был медленным и все еще отстает от аденокарциномы. Генетические изменения в аденокарциномах легких и SqCC различны; например, в SqCC мало мутаций KRAS и EGFR. SqCC также имеет тенденцию быть генетически более сложным, с высокой частотой сложных мутаций и амплификацией множества рецепторов.Мы узнали, что SqCC легких характеризуются высокой общей мутационной нагрузкой со скоростью 8,1 мутаций на мегабазу. 9 Почти все SqCC обнаруживают соматические мутации TP53.
Наиболее частые изменения наблюдались в путях, связанных с ростом, пролиферацией и выживанием опухоли. Кроме того, привлекательными являются амплификация рецептора-1 фактора роста фибробластов ( FGFR1 ) (примерно 25% SqCC с использованием 3,5-кратной амплификации, наблюдаемая примерно в 5%), мутации рецептора-2 дискоидинового домена (DDR2) (~ 4%). , действенные цели.
, действенные цели.
В рамках проекта «Атлас генома рака» (TCGA) 178 образцов опухоли SqCC были проанализированы на предмет геномных изменений путем секвенирования всего экзома, секвенирования мРНК и других методов для всестороннего определения геномного ландшафта SqCC. Гены, такие как CDKN2A / RB1, NFE2L2 / KEAP1 / CUL3, PI3K / AKT и SOX2 / TP63 / NOTCh2 , также обычно изменялись. 9 В другом недавнем исследовании комплексный геномный анализ у пациентов с удаленным SqCC (n = 157) выявил соматические мутации у 73.9% случаев, с TP53, (56,1%), CDKN2A, (8,9%), PIK3CA (8,9%), KRAS (4,5%) и EGFR (3,2%). Изменения числа копий гена были выявлены в 75,8% случаев, включая амплификацию SOX2 (31,2%), делецию CDKN2A (21,7%), делецию PTEN (16,6%), амплификацию FGFR1 (15,9%), Амплификация EGFR (14,0%), амплификация CCND1 (14,0%), амплификация HER2 (9,6%) и амплификация PDGFRA (7.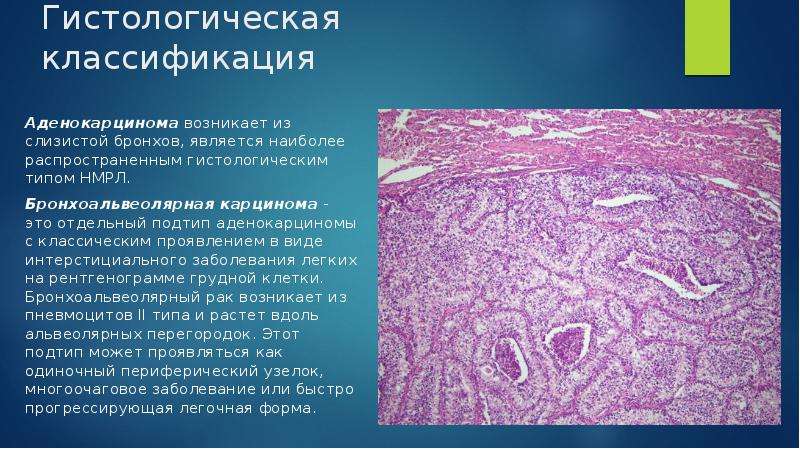 6%). Положительная экспрессия VEGFR2, и PD-L1 и потеря экспрессии PTEN наблюдались в 80,5%, 47,2% и 42,7% случаев соответственно. 21
6%). Положительная экспрессия VEGFR2, и PD-L1 и потеря экспрессии PTEN наблюдались в 80,5%, 47,2% и 42,7% случаев соответственно. 21
Из-за генетического разнообразия и отсутствия явных онкогенных факторов, влияющих на это заболевание, существует необходимость в разработке клинических испытаний, ориентированных исключительно на SqCC, которые могут оценить терапию с использованием одного агента и комбинированную терапию.
The Lung-MAP (основные клинические исследователи [ИП]: доктора Вали Пападимитракопулу, Рой Хербст, Дэвид Гандара; статистический ИП Мэри У.Redman) — это основной протокол нескольких исследований, который включает геномное тестирование опухолей с помощью платформы секвенирования следующего поколения (NGS) (Foundation Medicine) для пациентов с SqCC после прогрессирования на терапии первой линии. Этот протокол, возглавляемый SWOG, представляет собой партнерство с участием Национального института рака (NCI) и его Руководящего комитета по злокачественным новообразованиям грудной клетки (TMSC), Фонда NIH (FNIH), фармацевтической промышленности, групп защиты интересов, таких как Friends of Cancer Research ( FOCR) и Федеральное управление по лекарствам (FDA).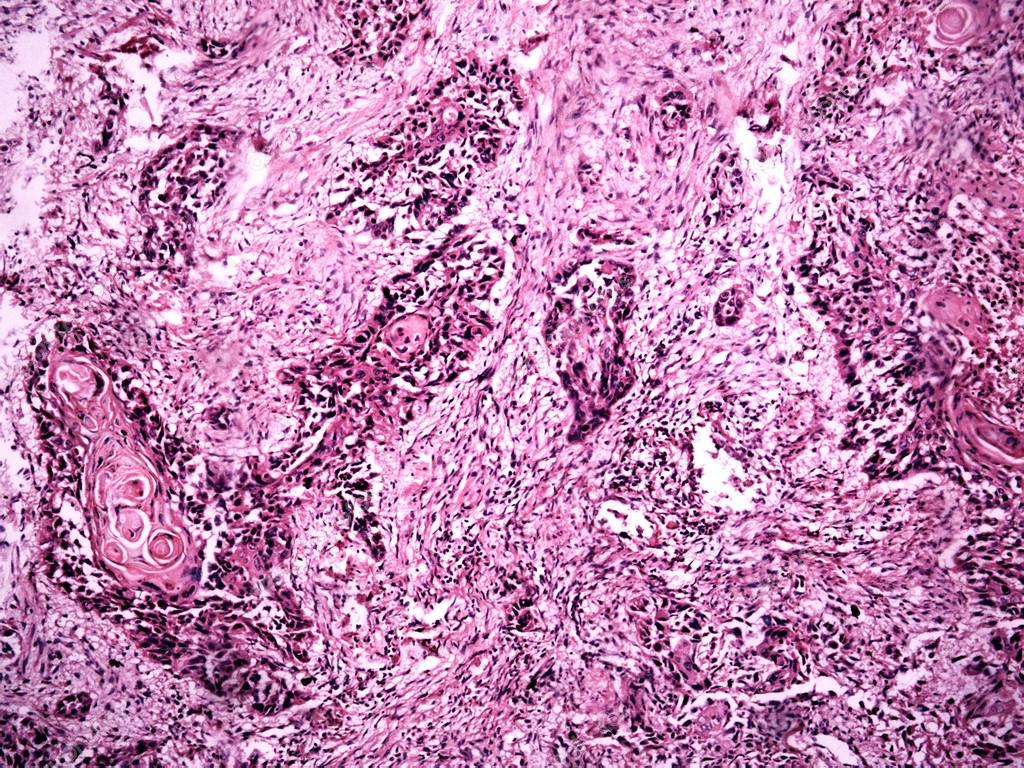 Это наиболее полное и совместное клиническое исследование рака легких, проводимое в Соединенных Штатах Америки, с целью определения безопасных и эффективных режимов, соответствующих прогностическим биомаркерам и таргетным лекарствам. После геномного тестирования пациенты распределяются по одному из нескольких подисследований, каждое из которых оценивает экспериментальную таргетную терапию, основанную на идентификации потенциальных предиктивных биомаркеров, связанных с каждым подисследованием. Эти субисследования проводятся как исследования фазы II в одной группе, без рандомизации по доцетакселу, что делает его более привлекательным для пациентов с конкретными целевыми мутациями.Основная цель этих исследований — общий процент ответов. Если уровень объективного ответа, наблюдаемый в исследовании фазы II, будет сочтен достаточным, исследование перейдет в исследование фазы III, в котором пациенты будут рандомизированы для целевой терапии на основе биомаркеров по сравнению со стандартной терапией.
Это наиболее полное и совместное клиническое исследование рака легких, проводимое в Соединенных Штатах Америки, с целью определения безопасных и эффективных режимов, соответствующих прогностическим биомаркерам и таргетным лекарствам. После геномного тестирования пациенты распределяются по одному из нескольких подисследований, каждое из которых оценивает экспериментальную таргетную терапию, основанную на идентификации потенциальных предиктивных биомаркеров, связанных с каждым подисследованием. Эти субисследования проводятся как исследования фазы II в одной группе, без рандомизации по доцетакселу, что делает его более привлекательным для пациентов с конкретными целевыми мутациями.Основная цель этих исследований — общий процент ответов. Если уровень объективного ответа, наблюдаемый в исследовании фазы II, будет сочтен достаточным, исследование перейдет в исследование фазы III, в котором пациенты будут рандомизированы для целевой терапии на основе биомаркеров по сравнению со стандартной терапией. Каждое подисследование будет работать автономно, открываться и закрываться независимо от других подисследований. Кроме того, он предлагает пациентам как таргетное лечение, так и иммунотерапевтическое лечение, все в рамках общего протокола.Пациентам предлагаются группы иммунотерапии без соответствующих генетических изменений, и текущее исследование основывается на быстро меняющемся стандарте лечения. Дизайн Lung-MAP позволяет добавлять новые субисследования, оценивающие либо новые пары биомаркер / лекарство, либо новые таргетные методы лечения.
Каждое подисследование будет работать автономно, открываться и закрываться независимо от других подисследований. Кроме того, он предлагает пациентам как таргетное лечение, так и иммунотерапевтическое лечение, все в рамках общего протокола.Пациентам предлагаются группы иммунотерапии без соответствующих генетических изменений, и текущее исследование основывается на быстро меняющемся стандарте лечения. Дизайн Lung-MAP позволяет добавлять новые субисследования, оценивающие либо новые пары биомаркер / лекарство, либо новые таргетные методы лечения.
РИСУНОК 1
отображает общую схему для Lung-MAP и исходных тестируемых мишеней лекарств, PI3K, FGFR, CDK 4/6 . Пациенты, не являющиеся кандидатами на участие в подисследовании, основанном на биомаркерах, могут записаться на подисследование без совпадения и получать терапию ниволумабом или комбинацией ниволумаба и ипилимумаба.Быстрое получение результатов скрининга NGS в течение 16 дней позволяет в режиме реального времени назначить их в соответствующее подисследование.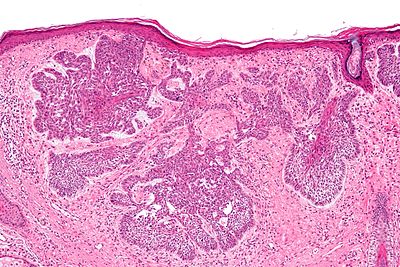 Lung-MAP может изменить способ разработки новых лекарств при раке легких, и этот подход будет экстраполирован на другие условия при раке легких, а также на другие типы опухолей. Аналогичные усилия предпринимаются и в других странах, например, исследование SAFIR02_LUNG, проводимое во Франции (NCT02117167), и национальное исследование матрицы легких в Великобритании (NCT02664935). Это открытые рандомизированные исследования фазы II, в которых используется высокопроизводительный анализ генома в качестве инструмента принятия терапевтических решений, направленных на сравнение целевого лечения, назначенного в соответствии с выявленными молекулярными аномалиями опухоли, со стандартной терапией.
Lung-MAP может изменить способ разработки новых лекарств при раке легких, и этот подход будет экстраполирован на другие условия при раке легких, а также на другие типы опухолей. Аналогичные усилия предпринимаются и в других странах, например, исследование SAFIR02_LUNG, проводимое во Франции (NCT02117167), и национальное исследование матрицы легких в Великобритании (NCT02664935). Это открытые рандомизированные исследования фазы II, в которых используется высокопроизводительный анализ генома в качестве инструмента принятия терапевтических решений, направленных на сравнение целевого лечения, назначенного в соответствии с выявленными молекулярными аномалиями опухоли, со стандартной терапией.
Путь фосфоинозитид-3-киназы
Фосфоинозитид-3-киназа ( PI3K ) представляет собой липидкиназу, участвующую в пролиферации, выживании и миграции опухолевых клеток при активации рецепторами фактора роста и интегринами. PI3K катализирует фосфорилирование фосфатидилинозитол-4,5-бисфосфата (PIP2) с образованием фосфатидилинозитол-3,4,5-трифосфата (PIP3), второго мессенджера, участвующего в фосфорилировании AKT и связанных белков в пути AKT-mTOR. .Активирующие и трансформирующие мутации, а также амплификация в субъединице p110α PI3K обычно обнаруживаются в солидных и гематологических опухолях. Кроме того, путь PI3K-AKT активируется при многих типах рака за счет передачи сигналов рецепторной тирозинкиназы, потери гомолога тензина фосфатазы (PTEN) или мутаций RAS. 22,23 GDC-0032 (тазелисиб) — мощный селективный низкомолекулярный ингибитор класса 1 для перорального применения PI3K , профиль безопасности которого был установлен в исследованиях фазы I, с частичными ответами на повышение дозы у пациентов с PIK3CA мутантные опухоли NSCLC.
.Активирующие и трансформирующие мутации, а также амплификация в субъединице p110α PI3K обычно обнаруживаются в солидных и гематологических опухолях. Кроме того, путь PI3K-AKT активируется при многих типах рака за счет передачи сигналов рецепторной тирозинкиназы, потери гомолога тензина фосфатазы (PTEN) или мутаций RAS. 22,23 GDC-0032 (тазелисиб) — мощный селективный низкомолекулярный ингибитор класса 1 для перорального применения PI3K , профиль безопасности которого был установлен в исследованиях фазы I, с частичными ответами на повышение дозы у пациентов с PIK3CA мутантные опухоли NSCLC.
Циклинзависимая амплификация киназы
Циклинзависимые киназы (CDK) образуют гетеродимерные белковые комплексы с циклинами и играют ключевую роль в развитии клеточного цикла и регуляции транскрипции. Было продемонстрировано, что плоскоклеточный рак легкого имеет изменения CCND1 и амплификации CDK4 / 6.9. Палбоциклиб, перорально активный пиридопиримидин, является мощным и высокоселективным обратимым ингибитором циклин-зависимой киназы (CDK) 4 и CDK6.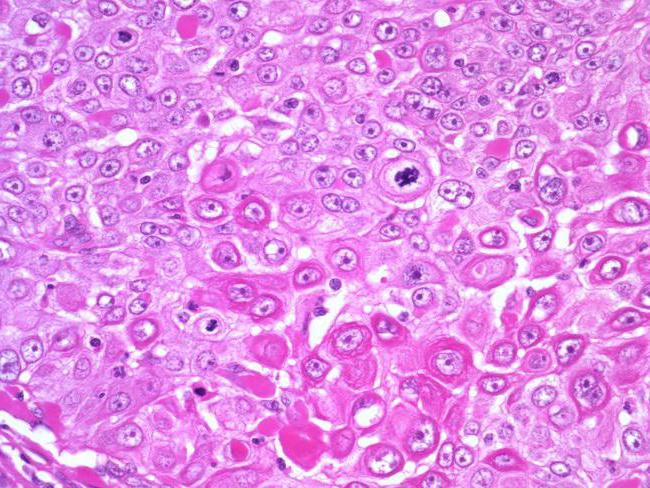 Соединение предотвращает синтез клеточной ДНК, запрещая продвижение клеточного цикла от G1 к S-фазе, что продемонстрировано на лабораторных моделях и ранних клинических испытаниях.Палбоциклиб был протестирован в рамках исследования фазы I повышения дозы, при котором наблюдалась значительная часть пациентов со стабильным заболеванием. Он был одобрен при метастатическом раке груди для лечения гормонально-положительного заболевания. 24-27
Соединение предотвращает синтез клеточной ДНК, запрещая продвижение клеточного цикла от G1 к S-фазе, что продемонстрировано на лабораторных моделях и ранних клинических испытаниях.Палбоциклиб был протестирован в рамках исследования фазы I повышения дозы, при котором наблюдалась значительная часть пациентов со стабильным заболеванием. Он был одобрен при метастатическом раке груди для лечения гормонально-положительного заболевания. 24-27
Мутация / амплификация FGFR
Существует убедительное доклиническое обоснование для тестирования активности AZD4547 у пациентов с плоскоклеточным раком легкого, несущим аберрации рецептора фактора роста фибробластов ( FGFR ).Амплификации FGFR1 связаны с НМРЛ и были описаны до 20% плоскоклеточного рака легких с мутациями и слияниями в FGFR 2 и 3, встречающихся с меньшей частотой (каждый <4%). 21,28 AZD4547 является мощным и селективным ингибитором тирозинкиназ рецепторов FGFR 1, 2 и 3 (конечные точки ферментного и клеточного фосфорилирования) и имеет значительно более низкую эффективность в отношении ингибирования FGFR4, рецептора инсулиноподобного фактора роста 1 (IGF1R) и рецептор домена вставки киназы (KDR). Ингибирование FGFR-опосредованной передачи сигналов может приводить к антипролиферативной и / или проапоптотической активности, может иметь антиангиогенный эффект и может играть роль в резистентности к терапии ингибиторами сосудистого эндотелиального фактора роста (VEGF). В небольшом клиническом исследовании плоскоклеточного НМРЛ было по крайней мере 1 PR у 14 пациентов, получавших AZD4547. Пациент имел усиление FGFR1. 29
Ингибирование FGFR-опосредованной передачи сигналов может приводить к антипролиферативной и / или проапоптотической активности, может иметь антиангиогенный эффект и может играть роль в резистентности к терапии ингибиторами сосудистого эндотелиального фактора роста (VEGF). В небольшом клиническом исследовании плоскоклеточного НМРЛ было по крайней мере 1 PR у 14 пациентов, получавших AZD4547. Пациент имел усиление FGFR1. 29
Другие цели
Другие цели с активными агентами, которые находятся в стадии исследования, включают PDGFR (NCT02109016), путь AKT и амплификацию MET .Специфические ингибиторы, нацеленные на TORC1 / 2, находятся в стадии активной разработки (NCT02417701), и активно исследуются комбинированные терапии с ингибированием FGFR + MEK (селуметиниб) (NCT02583542).
Заключение
Плоскоклеточный рак легкого остается терапевтической проблемой из-за его проявления, характеристик пациента, локализации заболевания и более высокой частоты сопутствующих заболеваний.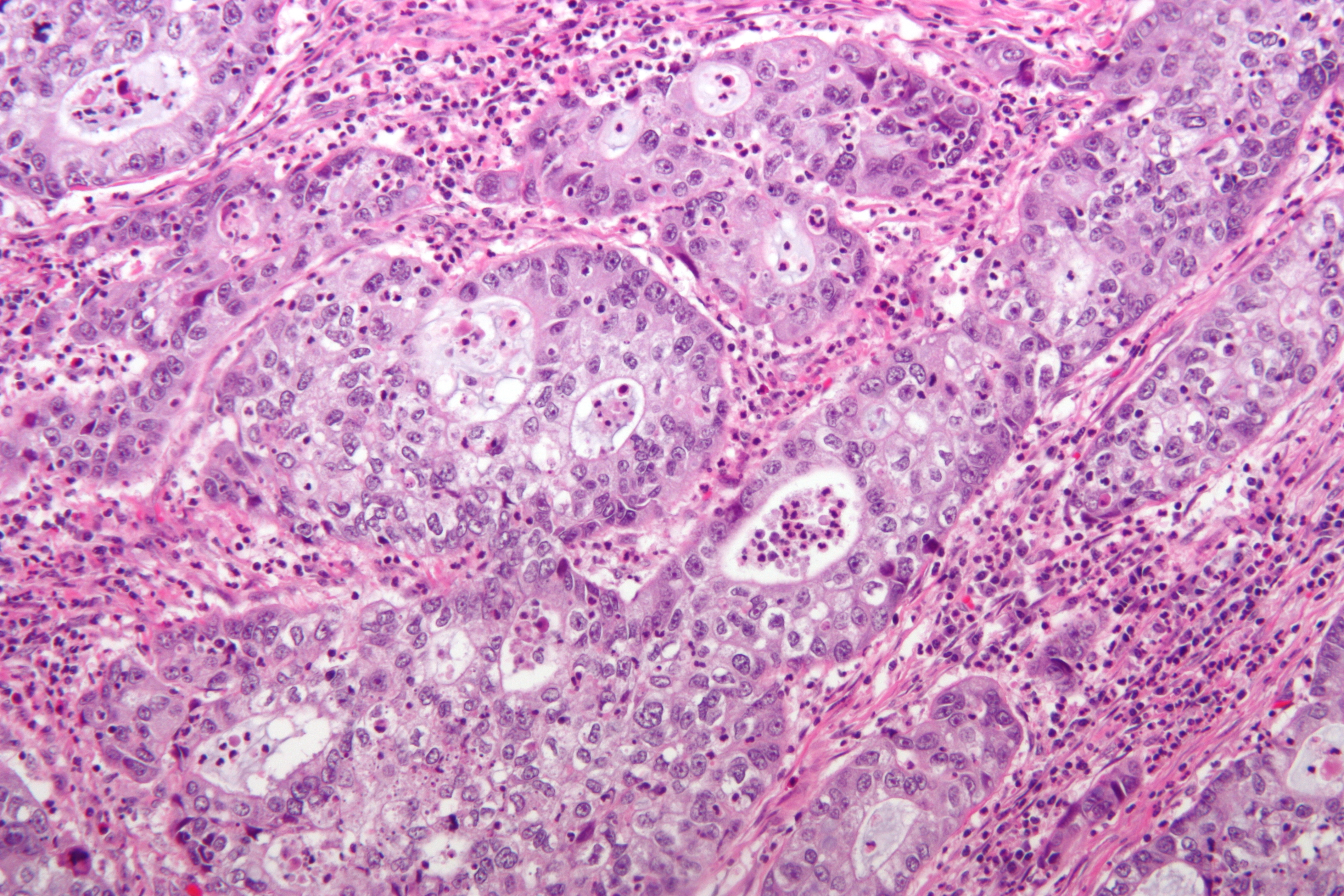 Несмотря на то, что мы добились значительных успехов в терапии SqCC, включая одобрение иммунотерапевтических препаратов, остается значительная потребность в разработке целевых методов, обусловленная нашим улучшенным пониманием геномики SqCC.
Несмотря на то, что мы добились значительных успехов в терапии SqCC, включая одобрение иммунотерапевтических препаратов, остается значительная потребность в разработке целевых методов, обусловленная нашим улучшенным пониманием геномики SqCC.
Ссылки :
- Сигель Р.Л., Миллер К.Д., Джемал А: Статистика рака, 2015. CA Cancer J Clin. 2015; 65: 5–29.
- Джемал А., Тун М.Дж., Райс Л.А. и др.: Ежегодный отчет для страны о статусе рака, 1975–2005 гг., С указанием тенденций в области рака легких, употребления табака и борьба против табака. J Natl Cancer Inst. 2008; 100: 1672–94.
- Путила Дж., Гуо Н.Л .: Объединение ХОБЛ с клинической, патологической и демографической информацией уточняет прогноз и предсказание реакции на лечение немелкоклеточного рака легкого. PLoS One. 2014; 9: e100994.
- Согаард М., Томсен Р.В., Боссен К.С. и др.: Влияние коморбидности на выживаемость при раке: обзор.
 Clin Epidemiol. 2013; 5: 3–29.
Clin Epidemiol. 2013; 5: 3–29. - Пао В., Миллер В., Заковски М. и др. Мутации гена рецептора EGF часто встречаются при раке легких у «никогда не курильщиков»; и связаны с чувствительностью опухолей к гефитинибу и эрлотинибу. Proc Natl Acad Sci US A. 2004; 101: 13306-133011.
- Lynch TJ, Bell DW, Sordella R, et al: Активация мутаций в рецепторе эпидермального фактора роста, лежащая в основе реакции немелкоклеточного легкого рак на гефитиниб. N Engl J Med. 2004; 350: 2129–39.
- Mok TS, Wu YL, Thongprasert S, et al: Гефитиниб или карбоплатин-паклитаксел при аденокарциноме легких. N Engl J Med. 2009; 361: 947—957.
- Morgensztern D, Waqar S, Subramanian J, et al: Повышение выживаемости при немелкоклеточном раке легкого стадии IV: наблюдение, эпидемиология и обзор конечных результатов с 1990 по 2005 год. J Thorac Oncol. 2009; 4: 1524-1529.
- Комплексная геномная характеристика плоскоклеточного рака легких. Природа. 2012; 489: 519–525.
- Шиллер Дж. Х., Харрингтон Д., Белани С. П. и др.: Сравнение четырех режимов химиотерапии для запущенного немелкоклеточного рака легкого. N Engl J Med. 2002; 346: 92–98.
- Scagliotti GV, Parikh P, von Pawel J, et al: Исследование фазы III, сравнивающее цисплатин плюс гемцитабин с цисплатином плюс пеметрексед у не получавших химиотерапии пациентов с далеко зашедшей стадией немелкоклеточного рака легкого. J Clin Oncol. 2008; 26: 3543-3551.
- Скаглиотти Г., Ханна Н., Фосселла Ф. и др.: Дифференциальная эффективность пеметрекседа в соответствии с гистологией НМРЛ: обзор двух исследований фазы III. Онколог. 2009; 14: 253–263.
- Соцински М.А., Бондаренко И.Н., Карасева Н.А.: Результаты выживаемости рандомизированного исследования III фазы наб-паклитаксела и карбоплатина по сравнению с паклитакселом и карбоплатином на основе кремофора в качестве терапии первой линии при распространенном немелкоклеточном раке легкого. J Clin Oncol. 2011; 29: 2011 (доп .; абстр. 7551).
- Соцински М.А., Лангер С.Дж., Окамото I и др.: Безопасность и эффективность еженедельного приема nab (R) -паклитаксела в комбинации с карбоплатином в качестве терапии первой линии у пожилых пациентов с далеко зашедшим немелкоклеточным раком легких. Ann Oncol. 2013; 24: 314–321.
- Тэтчер Н., Хирш FR, Люфт А.В. и др.: Нецитумумаб плюс гемцитабин и цисплатин по сравнению с гемцитабином и цисплатином в качестве терапии первой линии у пациентов с плоскоклеточным немелкоклеточным раком легкого IV стадии (SQUIRE): открытое маркированное рандомизированное контролируемое исследование III фазы. Ланцет Онкол. 2015; 16: 763–774.
- Ризви Н.А., Мазьер Дж., Планчард Д. и др.: Активность и безопасность ниволумаба, ингибитора иммунных контрольных точек против PD-1, для пациентов с запущенным, рефрактерным плоскоклеточным немелкоклеточным раком легкого (CheckMate 063) : фаза 2, исследование одной рукой. Ланцет Онкол. 2015; 16: 257–265.
- Brahmer J, Reckamp KL, Baas P, et al: Nivolumab против доцетаксела при запущенном плоскоклеточном немелкоклеточном раке легкого. N Engl J Med. 2015; 373: 123–135.
- Гарон Е.Б., Ризви Н.А., Хуэй Р. и др.: Пембролизумаб для лечения немелкоклеточного рака легкого. N Engl J Med. 2015; 372: 2018-2028.
- Herbst RS, Baas P, Kim DW, et al: Пембролизумаб в сравнении с доцетакселом для ранее леченного PD-L1-положительного распространенного немелкоклеточного рака легкого (KEYNOTE-010): рандомизированное контролируемое исследование. Ланцет. 2016; 387: 1540–1550.
- Гарон Э.Б., Чулеану Т.Е., Арриета О. и др .: Рамуцирумаб плюс доцетаксел по сравнению с плацебо плюс доцетаксел для лечения второй линии немелкоклеточного рака легкого стадии IV после прогрессирования заболевания на терапии на основе платины (REVEL): многоцентровое двойное слепое рандомизированное исследование 3 фазы. Ланцет. 2014; 384: 665-673.
- Tao D, Han X, Zhang N, et al: Профилирование генетических изменений у пациентов с резектированными плоскоклеточными карциномами легких. Oncotarget , 2016.
- Shayesteh L, Lu Y, Kuo WL, et al: PIK3CA участвует в качестве онкогена в раке яичников. Nat Genet. 1999; 21: 99-102.
- Wu G, Xing M, Mambo E, et al: Соматическая мутация и увеличение числа копий PIK3CA при раке груди человека. Breast Cancer Res. 2005; 7: R609-616.
- Демишель А., Кларк А.С., Тан К.С. и др.: Палбоциклиб (PD0332991), ингибитор CDK 4/6 (PD0332991) при Rb + распространенном раке молочной железы: активность фазы II, безопасность и прогностическая оценка биомаркеров. Clin Cancer Res. 2015; 21: 995-1001.
- Kenji T, Mukai H, Naito Y, et al: Исследование фазы 1 палбоциклиба, циклинзависимого ингибитора киназы 4/6, у японских пациентов. Cancer Sci. 2016; 107: 755–763.
- Niesvizky R, Badros AZ, Costa LJ, et al: Фаза 1/2 исследования ингибитора циклин-зависимой киназы (CDK) 4/6 палбоциклиба (PD-0332991) с бортезомибом и дексаметазоном при рецидивирующей / рефрактерной множественной миеломе. Лейк Лимфома. 2015; 56: 3320–3328.
- Вон Д. Д., Хван В. Т., Лал П. и др.: Фаза 2 испытания ингибитора циклин-зависимой киназы 4/6 палбоциклиба у пациентов с опухолями зародышевых клеток, экспрессирующими ретинобластому. Рак. 2015; 121: 1463–1468.
- Weiss J, Sos ML, Seidel D, et al: Частая и очаговая амплификация FGFR1 ассоциируется с терапевтически поддающейся лечению зависимостью от FGFR1 при плоскоклеточном раке легкого. Sci Transl Med. 2010; 2: 62ra93.
- Gavine PR, Mooney L, Kilgour E, et al: AZD4547: пероральный биодоступный, мощный и селективный ингибитор семейства тирозинкиназ рецептора фактора роста фибробластов. Cancer Res. 2012; 72: 2045-2056.
% PDF-1.6 % 1 0 obj > endobj 121 0 объект > / Шрифт >>> / Поля [] >> endobj 2 0 obj > поток 2017-03-31T13: 14: 52 + 09: 002017-03-31T13: 14: 48 + 09: 002017-03-31T13: 14: 52 + 09: 00Adobe InDesign CS5 (7.0) application / pdfuuid: 3e0400c8-fe4a-438b-bae9-c4fdaf3bed64uuid: d1bbefdb-f0ac-463b-bf35-0dc50a1a0b75 Adobe PDF Library 9.9 конечный поток endobj 3 0 obj > endobj 15 0 объект > / Font> / ProcSet [/ PDF / Text] / Свойства >>> / Затенение >>> / TrimBox [0.0 0,0 595,276 793,701] / Тип / Страница >> endobj 59 0 объект > / Font> / ProcSet [/ PDF / Text / ImageC] / XObject >>> / TrimBox [0.0 0.0 595.276 793.701] / Type / Page >> endobj 82 0 объект > / Font> / ProcSet [/ PDF / Text] / XObject >>> / TrimBox [0.0 0.0 595.276 793.701] / Type / Page >> endobj 86 0 объект > / Font> / ProcSet [/ PDF / Text] / XObject >>> / TrimBox [0.0 0.0 595.276 793.701] / Type / Page >> endobj 88 0 объект > / Font> / ProcSet [/ PDF / Text / ImageC] / XObject >>> / TrimBox [0.0 0,0 595,276 793,701] / Тип / Страница >> endobj 105 0 объект > / Font> / ProcSet [/ PDF / Text] / XObject >>> / TrimBox [0.0 0.0 595.276 793.701] / Type / Page >> endobj 109 0 объект > / Font> / ProcSet [/ PDF / Text] / XObject >>> / TrimBox [0.0 0.0 595.276 793.701] / Type / Page >> endobj 119 0 объект > / Font> / ProcSet [/ PDF / Text] / XObject >>> / TrimBox [0.0 0.0 595.276 793.701] / Type / Page >> endobj 120 0 объект > поток HdWko7> г uE; Vr {c.ː $ «- Vd צ% I 䛻 L) HhX f (V`d = JTL’muX,) dAu *, + c «_} Ys6> 0 (FHʖI2Ã = Ab% Z: 䡌 % Ъ @ — + & Vl (j -R! Ѽ /> p * = ul: J9 & ~ δ2 у! F` Rg + E -cVg84z «GU.5`d *% kw% r? QjlFA5 {. ~ PL & l] pHm.geH’T \ j] 0r5_2d | NBb.1]%> 7mT4Ԓș a | «F
Плоскоклеточный рак легкого, статья
Непрерывное образование
Плоскоклеточный рак легкого, также известный как плоскоклеточный рак легкого, представляет собой тип немелкоклеточного рака легкого (НМРЛ). Плоскоклеточные опухоли легких часто возникают в центральной части легкого или в основных дыхательных путях, таких как левый или правый бронх.Главный возбудитель клеточной трансформации — табачный дым. В этом упражнении рассматривается оценка и лечение плоскоклеточного рака легкого и подчеркивается роль межпрофессиональной группы в ведении пациентов с этим заболеванием.
Целей:
- Определите этиологию плоскоклеточного рака легкого.
- Изучите соответствующий анамнез, физикальное состояние и оценку плоскоклеточного рака легкого.
- Опишите доступные варианты лечения плоскоклеточного рака легкого.
- Обобщите стратегии межпрофессиональной группы по улучшению координации помощи и коммуникации для улучшения ухода за пациентами с плоскоклеточным раком легкого и улучшения результатов.
Введение
Плоскоклеточный рак легкого, также известный как плоскоклеточный рак легкого, представляет собой тип немелкоклеточного рака легкого (НМРЛ).Среди НМРЛ наиболее распространена аденокарцинома, за которой следует плоскоклеточный рак легкого, особенно у женщин. Это объясняется изменением характера курения сигарет, но окончательных доказательств нет.
Этиология
Примерно 80% случаев рака легких у мужчин и 90% случаев у женщин связаны с курением. [1] [2] SCC более тесно связан с курением, чем любой другой тип NSCLC. К другим факторам риска SCC относятся возраст, семейный анамнез, воздействие вторичного табачного дыма, минеральных и металлических частиц или асбеста.
Эпидемиология
Рак легких — наиболее распространенный вид рака и причина смертности от рака во всем мире. [3] Заболеваемость раком легких в 2018 году оценивалась в 2 093 876 случаев во всем мире, что составляет 11,6% глобального бремени рака. Расчетная смертность от рака легких в 2018 г. составила 1 761 007 смертей во всем мире, что составляет около 18,4% глобальной смертности от рака. [4]
Глобальное распределение заболеваемости раком легких в 2018 г. было следующим: Азия (58.5%), Европе (22,4%), Северной Америке (12,1%), ЛАК (4,3%), Африке (1,9%) и Океании (0,81%) [4].
Примерно 85% всех случаев рака легких являются НМРЛ. Аденокарцинома и плоскоклеточный рак являются наиболее распространенными подтипами, на которые приходится 50% и 30% случаев НМРЛ соответственно. [3]
Патофизиология
SCC Заболевание легких возникает в результате трансформации плоскоклеточных клеток, выстилающих дыхательные пути. Плоские клетки — это тонкие плоские клетки, выстилающие многие органы человеческого тела.Плоскоклеточные опухоли легких часто возникают в центральной части легкого или в основных дыхательных путях, таких как левый или правый бронх. Основным возбудителем клеточной трансформации является табачный дым, который содержит более 300 вредных агентов и 40 потенциальных канцерогенов. Трансформированные плоские клетки характеризуются ороговением и / или межклеточными мостиками и часто демонстрируют высокую частоту мутаций. [4]
Гистопатология
Правильный гистологический диагноз становится все более важным, потому что он может предсказать ответ и токсичность лечения.[5] Диагноз SCC может быть подтвержден, если минимум 10% опухолевой массы резецированных образцов демонстрируют особенности трансформации, такие как кератинизация или внутриклеточные мостики. Если дифференцированный плоский элемент опухоли минимален, ставится диагноз малодифференцированного ПКР. Панель иммуногистохимии (ИГХ) вместе с окраской муцина может помочь идентифицировать подтипы НМРЛ. SCC также демонстрирует сильную экспрессию плоских биомаркеров, включая белки p63 и p40.
В 2015 году Всемирная организация здравоохранения пересмотрела классификацию, чтобы признать три варианта SCC на основе гистологического исследования: [6]
- Keratinizing
- Некератинизирующий
- Базалоид: базалоидный компонент составляет более 50% ткани с минимальными областями плоской дифференцировки
История и физика
Симптомы НМРЛ могут включать кашель, боль в груди, одышку, кровь в мокроте, хрипы, охриплость голоса, повторяющиеся инфекции грудной клетки (включая бронхит и пневмонию), потерю веса, потерю аппетита и усталость.Однако пациенты с НМРЛ часто не проявляют никаких симптомов на ранних стадиях заболевания. Метастазы могут возникать при запущенном заболевании, а симптомы могут включать боль в костях, ущемление спинного мозга и неврологические симптомы (головная боль, слабость или онемение конечностей, головокружение, судороги).
Оценка
После физического обследования для оценки ПКР можно использовать общий анализ крови (CBC), рентген грудной клетки или компьютерную томографию (CT) при условии, что опухоль имеет достаточный размер.Наличие полости, заполненной газом или жидкостью в опухолевой массе, является классическим признаком SCC. [1] Другие признаки могут включать легочные узелки, массу или инфильтрат, расширение средостения, ателектаз, увеличение корней и плевральный выпот. Дополнительные исследования, включая КТ брюшной полости с контрастированием, магнитно-резонансную томографию головного мозга (МРТ) с контрастированием и тесты функции легких (PFT), также могут быть выполнены после постановки первоначального диагноза. Также проводится оценка PD-L1, EGFR, онкогена слияния ALK и других мутаций.
Лечение / менеджмент
Лечение зависит от стадии рака. Хирургическая резекция — это первая линия лечения I и II стадий. Для 1А химиотерапия не играет никакой роли. Для 1B в некоторых случаях рассматривается хирургическая резекция с адъювантной химиотерапией, если размер опухоли превышает 4 см. Стадия II лечится хирургическим вмешательством с последующей химиотерапией, обычно предпочтительна лобэктомия, но при плохих кандидатах на операцию можно рассмотреть возможность субдолевой резекции.На стадии I и II лучевая терапия рассматривается, если после операции есть положительные границы, а также при плохих кандидатах на хирургическое вмешательство.
Большинство опухолей III стадии неоперабельны. На стадии IIIA, которая определенно назначается во время операции резекции, может рассматриваться возможность последующей адъювантной химиотерапии, но химиотерапия с лучевой терапией является обычным выбором. Для стадии IIIB используется комбинированная химиотерапия и лучевая терапия. На IV стадии используется химиотерапия с паллиативным облучением. Множественные рандомизированные контролируемые испытания и масштабные метаанализы подтверждают превосходство комбинированных схем химиотерапии при распространенном НМРЛ.[2] Кроме того, в зависимости от статуса мутации также используется таргетная терапия. При запущенном НМРЛ терапия должна основываться на молекулярных особенностях опухоли.
При НМРЛ с соматической мутацией показана терапия специфическими ингибиторами [7]. Для мутации рецептора роста эпидермиса используются ингибиторы тирозинкиназы, такие как эрлотиниб, гефитиниб, афатиниб. Кризотиниб — первая линия мутации ALK. Рассматривается НМРЛ, у которого отсутствует эта мутация, в зависимости от экспрессии лиганда 1 запрограммированной гибели (PD-L1), только иммунотерапия или иммунотерапия с комбинированной химиотерапией.Химиотерапия для неоадъювантной и адъювантной терапии включает цисплатин с винорелбином или этопозидом, винбластин, гемцитабин, доцетаксел или пеметрексед. Пациентам, которые не переносят цисплатин, рекомендуется применение паклитаксела с карбоплатином. Системная терапия первой линии на поздних стадиях включает бевацизумаб, карбоплатин и паклитаксел. Другими вариантами являются цетуксимаб с цисплатином и винорелбином или эрлотиниб с химиотерапией на основе платины.
Дифференциальная диагностика
SSC легкого необходимо дифференцировать от других видов рака легких, включая мелкоклеточный рак легкого (SCLC) и другие NSCLC, такие как аденокарцинома и крупноклеточная карцинома.
Хирургическая онкология
Хирургическое лечение является предпочтительным методом лечения I и II стадии. На стадии IIIA хирургическое вмешательство рассматривается только в отдельных случаях.
Радиационная онкология
Лучевая терапия рассматривается для стадий I и II с положительными границами после операции или у плохих кандидатов на хирургическое вмешательство, у которых полная лобэктомия невозможна. Для стадии III лучевая терапия, наряду с химиотерапией, является лечением выбора.На стадии IV лучевая терапия применяется только в качестве паллиативной меры.
Соответствующие исследования и текущие испытания
Иммунотерапевтический атезолизумаб (моноклональное антитело против PDL1, RG7446, MPDL3280A против PD-L1 (лиганд запрограммированной смерти 1) оценивается в клинических испытаниях фазы III в качестве потенциального лечения первой линии для пациентов с неплоскоклеточным или плоскоклеточным недугом. — мелкоклеточный рак легкого, опухоли которого экспрессируют PDL 1. Также продолжается испытание фазы I по оценке атезолизумаба в комбинации с эрлотинибом или алектинибом у пациентов с немелкоклеточным раком легкого.IPA-3 или OTSSP167 и ауранофин имели высокий синергетический эффект в клеточных линиях плоскоклеточной карциномы мутантных EGFR или KRAS и снижали объем опухоли на моделях мышей [8].
Управление токсичностью и побочными эффектами
Химиотерапия на основе платины вместе со вторыми активными цитотоксическими агентами обычно назначается пациентам, которым требуется химиотерапия. Вероятность токсичности увеличивается после четырех-шести циклов терапии и не рекомендуется после этого.У пациентов без оптимального ответа поддерживающую терапию можно продолжить одним или несколькими компонентами, но обычно терапию на основе платины прекращают из-за ее серьезной токсичности [9]. Пациентов следует контролировать на предмет нефротоксичности, ототоксичности, цитопении и выраженной нейропатии. Обычно считается, что фолиевая кислота, витамин b12 и иногда дексаметазон помогают избежать некоторых побочных эффектов химиотерапии.
Стадия
Определение стадии рака легкого основано на изображениях компьютерной томографии в соответствии с системой стадирования опухолевых узлов и метастазов (TNM).Это краткое изложение 8-го издания TNM по раку легких, выпущенного IASLC (Международной ассоциацией по изучению рака легких) и заменяющего 7-е издание TNM [10].
Предлагаемые дескрипторы T, N и M для восьмого издания классификации TNM для рака легких
| T: Первичная опухоль | |
| Tx | Первичная опухоль не может быть оценена или опухоль не может быть доказана по наличию злокачественных клеток в мокроте или смывах из бронхов, но не визуализирована с помощью визуализации или бронхоскопии |
| T0 | Нет свидетельств первичной опухоли |
| Tis | Карцинома in situ |
| T1 | Опухоль ≤3 см в наибольшем размере, окруженная легким или висцеральной плеврой без бронхоскопических доказательств инвазии проксимальнее, чем долевой бронх (т.э., не в главном бронхе) |
| T1a (миль) | Минимально инвазивная аденокарцинома |
| T1a | Опухоль ≤1 см в наибольшем измерении |
| T1b | Опухоль> 1 см, но ≤2 см в наибольшем измерении |
| T1c | Опухоль> 2 см, но ≤3 см в наибольшем измерении |
| T2 | Опухоль> 3 см , но ≤5 см или опухоль с любой из следующих характеристик: |
| — Вовлекает главный бронх независимо от расстояния от киля, но без вовлечения киля | |
| — Поражение висцеральной плевры | |
| — Связанный с ателектазом или обструктивным пневмонитом, который распространяется на прикорневую область, затрагивая часть или все легкое | |
| T2a | Опухоль> 3 см, но ≤4 см в наибольшем измерении |
| T2b | Опухоль> 4 см, но ≤5 см в наибольшем измерении |
| T3 | Опухоль> 5 см, но ≤7 см в наибольшем измерении или связана с отдельным опухолевым узлом (ами) в той же доле, что и первичная опухоль, или напрямую поражает любую из следующих структур: грудную стенку (включая париетальную плевру и верхнюю борозду) опухоли), диафрагмальный нерв, париетальный перикард |
| T4 | Опухоль> 7 см в наибольшем измерении или связана с отдельными опухолевыми узлами в ипсилатеральной доле, отличной от первичной опухоли, или поражает любую из следующих структур: диафрагма, средостение, сердце, магистральные сосуды, трахея , возвратный гортанный нерв, пищевод, тело позвонка и киль |
| N: Поражение региональных лимфатических узлов | |
| Nx | Региональные лимфатические узлы не поддаются оценке |
| N0 | Нет метастазов в регионарные лимфатические узлы |
| N1 | Метастазы в ипсилатеральные перибронхиальные и / или ипсилатеральные внутригрудные лимфатические узлы и внутрилегочные узлы, включая поражение путем прямого распространения |
| N2 | Метастазы в ипсилатеральный средостенный и / или субкаринальный лимфатический узел (-а) |
| N3 | Метастазы в контралатеральном средостении, контралатеральном внутригрудном, ипсилатеральном или контралатеральном лимфатическом узле (ах) или надключичных лимфатических узлах |
| M: отдаленные метастазы | |
| M0 | Нет отдаленных метастазов |
| M1 | Наличие отдаленных метастазов |
| M1a | Отдельный узел (ы) опухоли в контралатеральной доле; опухоль с плевральным или перикардиальным узлом (ами) или злокачественный плевральный или перикардиальный выпот |
| M1b | Одиночный внегрудной метастаз |
| M1c | Множественные внегрудные метастазы в один или несколько органов |
Примечание. Изменения в седьмой редакции выделены жирным шрифтом.
- а. Необычная поверхностная распространяющаяся опухоль любого размера с инвазивным компонентом, ограниченным стенкой бронха, которая может простираться проксимальнее главного бронха, также классифицируется как T1a.
- г. Одиночная аденокарцинома, ≤ 3 см с преимущественно лепидным рисунком, и ≤ 5 мм инвазии в любом одном очаге.
- г. Опухоли T2 с этими особенностями классифицируются как T2a, если ≤4 см в наибольшем измерении или если размер не может быть определен, и T2b, если> 4 см, но ≤5 см в наибольшем измерении.
- г. Большинство плевральных (перикардиальных) выпотов при раке легких возникают из-за опухолей. Однако у некоторых пациентов множественные микроскопические исследования плевральной (перикардиальной) жидкости отрицательны на опухоль, и жидкость не содержит крови и не является экссудатом. Когда эти элементы и клиническая оценка показывают, что выпот не связан с опухолью, выпот следует исключить как дескриптор стадии.
- e. Это включает поражение одного удаленного (нерегионального) лимфатического узла.
Предлагаемые группы стадий для восьмого издания классификации TNM рака легкого
| Оккультная карцинома | TX | N0 | M0 |
| 0 ступень | ТИС | N0 | M0 |
| Стадия IA1 | T1a (миль) | N0 | M0 |
| T1a | N0 | M0 | |
| Стадия IA2 | T1b | N0 | M0 |
| Стадия IA3 | T1c | N0 | M0 |
| Стадия IB | T2a | N0 | M0 |
| Стадия IIA | T2b | N0 | M0 |
| Стадия IIB | T1a – c | N1 | M0 |
| T2a | N1 | M0 | |
| T2b | N1 | M0 | |
| T3 | N0 | M0 | |
| Стадия IIIA | T1a – c | N2 | M0 |
| T2a — b | N2 | M0 | |
| T3 | N1 | M0 | |
| Т4 | N0 | M0 | |
| Т4 | N1 | M0 | |
| Стадия IIIB | T1a – c | N3 | M0 |
| T2a – b | N3 | M0 | |
| Т3 | N2 | M0 | |
| Т4 | N2 | M0 | |
| Стадия IIIC | Т3 | N3 | M0 |
| Т4 | N3 | M0 | |
| Стадия IVA | Любой T | любой N | M1a |
| Любой T | Любой N | M1b | |
| IVB этап | Любой T | любой N | M1c |
Прогноз
Плоскоклеточный рак легкого может распространяться на несколько участков, включая мозг, позвоночник и другие кости, надпочечники и печень.Из-за отсутствия целенаправленной терапии SCC и поздней стадии обнаружения прогноз для таких пациентов часто неблагоприятный.
Осложнения
Осложнения SCC легкого могут включать:
- Одышку, если опухоль блокирует основные дыхательные пути или вызывает накопление жидкости вокруг легких (плевральный выпот)
- Кровотечение в дыхательных путях, приводящее к кровохарканью
- Метастазы, вызывающие боль и неврологические осложнения
Послеоперационный и реабилитационный уход
Предоперационная гимнастика и программа реабилитации показали значительные послеоперационные результаты и снижение послеоперационных легочных осложнений.[11]. Однако только послеоперационная легочная реабилитация без предоперационных упражнений показала лишь незначительное или умеренное влияние на послеоперационную способность к физической нагрузке при краткосрочном наблюдении, но долгосрочное влияние на функциональную способность неизвестно. [12]
Консультации
- Пульмонология
- Кардиоторакальная хирургия
- Медицинская онкология
- Хирургическая онкология
- Паллиативная помощь
- Психиатрия
Сдерживание и обучение пациентов
Обучение тому, как избегать или уменьшать факторы риска, такие как табачные изделия и причины профессиональных заболеваний (например, использование средств индивидуальной защиты), может снизить развитие SCC.Обучение раннему скринингу рака с помощью компьютерной томографии грудной клетки с низкой дозой важно для раннего выявления и лечения, чтобы предотвратить опухолевую нагрузку. Консультирование пациентов о стадиях рака и шансах на полное излечение в случае раннего выявления и консультирование по паллиативной помощи на поздних стадиях очень важно для снижения стресса как для пациентов, так и для близких.
Улучшение результатов команды здравоохранения
Учитывая сложность ухода, необходимого для лечения этого состояния, необходима межпрофессиональная медицинская бригада, включая врачей первичного звена, кардиоторакальных хирургов, медицинских онкологов, онкологов-радиологов, онкологов-хирургов и паллиативную помощь.Сильное сотрудничество и общение внутри межпрофессиональной команды жизненно важны для улучшения результатов.
(Щелкните изображение, чтобы увеличить)
Плоскоклеточный рак легкого.
Медицинский журнал Новой Англии. Изображения в клинической медицине. ID PUB MED: 30207918. Доктор Бхану Саббула
% PDF-1.7 % 118 0 объект > endobj xref 118 92 0000000016 00000 н. 0000003071 00000 н. 0000003282 00000 н. 0000003334 00000 н. 0000003370 00000 н. 0000003640 00000 н. 0000003763 00000 н. 0000003851 00000 н. 0000003885 00000 н. 0000003998 00000 н. 0000004044 00000 н. 0000004373 00000 п. 0000004853 00000 н. 0000005567 00000 н. 0000006280 00000 н. 0000006367 00000 н. 0000006969 00000 н. 0000007114 00000 п. 0000007913 00000 п. 0000008388 00000 п. 0000008959 00000 н. 0000009446 00000 п. 0000009556 00000 п. 0000009933 00000 н. 0000010394 00000 п. 0000010834 00000 п. 0000010942 00000 п. 0000011275 00000 п. 0000012176 00000 п. 0000012702 00000 п. 0000013315 00000 п. 0000013399 00000 п. 0000014016 00000 п. 0000014975 00000 п. 0000015721 00000 п. 0000016754 00000 п. 0000017752 00000 п. 0000018024 00000 п. 0000018331 00000 п. 0000018420 00000 п. 0000018588 00000 п. 0000019603 00000 п. 0000020480 00000 п. 0000020629 00000 п. 0000021457 00000 п. 0000025704 00000 п. 0000025785 00000 п. 0000026078 00000 п. 0000026148 00000 п. 0000026597 00000 п. 0000031478 00000 п. 0000034112 00000 п. 0000034891 00000 п. 0000035299 00000 п. 0000035321 00000 п. 0000042946 00000 п. 0000049245 00000 п. 0000049287 00000 п. 0000049357 00000 п. 0000049429 00000 п. 0000049700 00000 п. 0000049824 00000 п. 0000049873 00000 п. 0000049951 00000 н.

 Патология поражает преимущественно пациентов после 50-ти лет, медленно развивается, ее проявления на первой-второй стадии практически отсутствуют. После хирургического вмешательства человек может прожить еще до 10-ти лет. Прогноз в целом благоприятный.
Патология поражает преимущественно пациентов после 50-ти лет, медленно развивается, ее проявления на первой-второй стадии практически отсутствуют. После хирургического вмешательства человек может прожить еще до 10-ти лет. Прогноз в целом благоприятный. Пораженные клетки быстро разносятся по всему телу с лимфотоком.
Пораженные клетки быстро разносятся по всему телу с лимфотоком.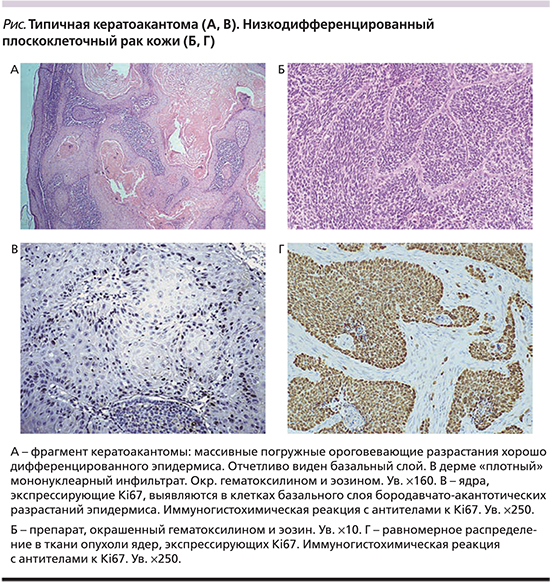
 Clin Epidemiol. 2013; 5: 3–29.
Clin Epidemiol. 2013; 5: 3–29.