лимфоматоидный папулез, первичная анапластическая крупноклеточная лимфома кожи > Клинические рекомендации РФ (Россия) 2013-2017 > MedElement
ЛиП характеризуется повторными высыпаниями самопроизвольно разрешающихся папулезных элементов. Количество высыпаний может варьировать от единичных до нескольких десятков (иногда сотен), характерен эволюционный полиморфизм элементов. Наиболее частая локализация – кожа туловища и проксимальных отделов конечностей. Описаны случаи появления высыпаний на ладонях и подошвах, лице, волосистой части головы и в аногенитальной области.
Клиническая картина обычно представлена быстрорастущими бессимптомными папулами красного или синюшно-красного цвета до 2 см в диаметре, которые существуют от трех недель до нескольких месяцев, затем разрешаются бесследно или изъязвляются, оставляя после себя гиперпигментные пятна или атрофические рубчики.
Клиническая картина АКЛК обычно представлена солитарными, сгруппированными или множественными узлами (в том числе подкожными), имеющими тенденцию к изъязвлению.
В большинстве случаев ЛиП характеризуется хроническим доброкачественным течением без влияния на выживаемость, однако пациенты с ЛиП имеют высокий риск развития вторичных кожных или нодальных лимфопролиферативных заболеваний, включая грибовидный микоз (ГМ), кожную или нодальную анапластическую крупноклеточную лимфому и лимфому Ходжкина. Эти ЛиП-ассоциированные лимфомы развиваются в 4-25% случаев у пациентов с ЛиП и могут предшествовать, возникать одновременно или после начала ЛиП, что необходимо учитывать в процессе установления диагноза.
АКЛК также характеризуется благоприятным прогнозом с 5-летней выживаемостью между 76% и 96%.
На настоящий момент остается неразрешенным вопрос, могут ли при ЛиП поражаться лимфатические узлы и висцеральные органы. Возникновение CD30+ лимфопролиферативного процесса в лимфатических узлах и висцеральных органах рекомендовано расценивать как ассоциированную с ЛиП вторичную анапластическую крупноклеточную лимфому.
Опухоль забрюшинного пространства: код по МКБ — 10, классификация, симптомы и диагностика
Главная-Жировики (липома)
Липосаркома забрюшинного пространства – это редкое злокачественное новообразование мезенхимального происхождения, возникающие в любой области скопления жировой ткани. Среди других видов сарком опухоль встречается в 20% случаев.
Что такое и код по МК-10 липосаркомы
забрюшинного пространстваЗабрюшинное пространство находится между париетальной брюшиной и внутрибрюшной фасцией.
Полость вмещает почки, надпочечники, мочеточник, поджелудочную железу, 2/3 12-перстной кишки, восходящую и нисходящую петли ободочной кишки, брюшную часть аорты и нижней полой вены, начало лимфатического грудного протока, нервные сплетения.
Внутренние органы разделены жировой клетчаткой, из которой формируются доброкачественные и злокачественные новообразования. Самым неблагоприятным уплотнением считается липосаркома (по МКБ-10 код С48).
Особенности опухоли из жировой ткани:
- Группа риска – мужчины в пожилом возрасте.
- Природа возникновения не установлена.
- Медленный рост, бессимптомное течение.
- Большой размер, неправильная форма, плотная консистенция.
- Липосаркома в забрюшинном пространстве формируется из мезенхимальных клеток.
- Метастазирует по кровеносным сосудам. Развивается печеночная энцефалопатия, дыхательная недостаточность.
- Сдавливает или смещает место дислокации внутренних органов.
Симптомы и способы диагностики
Высокодифференцированная липосаркома, локализованная в забрюшинном пространстве проявляется специфическими симптомами:
- При достижении больших размеров уплотнение можно нащупать пальпаторно. Форма: овальная. Структура: мягкая или твердая.
- Увеличение массы тела, сопровождающийся болью в пояснице. Больной резко набирает 15-20 кг.
- Увеличение объема талии на 30 см.
- Расстройство пищеварения, мочеиспускания.

- Если липосаркома в забрюшинном пространстве отодвинула одну почку, пациент ощущает постоянную боль в области расположения органа.
- Возникают тромбозы, флебиты, параличи по причине сдавливания нервных сплетений и сосудов.
- На последней стадии болезнь проявляется общей интоксикацией организма. Состояние сопровождается субфебрильной температурой тела, общей слабостью, отсутствием аппетита, заметным снижением веса.
Методы диагностики онкопатологии:
- С помощью анамнеза устанавливаются специфические жалобы (увеличение массы тела, дискомфорт в брюшной полости).
- Пальпация.
- Общеклинические анализы показывают патологические изменения в кровеносном русле и мочеиспускательном канале.
- УЗИ органов брюшной полости определяет наличие деформаций вследствие сдавления опухолью. Способ выявляет размер и форму.
- МРТ, КТ показывают плотность.
- При подозрении на метастазирование липосаркомы в забрюшинном пространстве проводят рентген легких, позвоночника, МРТ головного мозга.

Стадии липосаркомы
В онкологии используют международную классификацию новообразований по структуре и степени развития:
- Высокодифференцированная опухоль характеризуется медленным ростом, структурным подобием липомы. Различают две формы: воспалительную и склерозирующую. В первом случае уплотнение состоит из зрелых липоцитов, которые разделены между собой фиброзными прослойками. Воспалительная высокодифференцированная саркома имеет аналогичное строение и характеризуется выраженной лимфоплазмоцитарной инфильтрацией.
- Миксоидная опухоль состоит из разных видов клеток: зрелых, веретенообразных, округлых, молодых бластов. Образована мукоидной стромой, где проходит множество кровеносных сосудов. Миксоидная липосаркома местами состоит из низкодифференцированных клеток. Выявление этого элемента ухудшает прогноз заболевания.
- Круглоклеточная – подвид миксоидной. Полностью состоит из низкодифференцированных клеток. Под микроскопом выявляются области с круглыми бластами и небольшим количеством сосудов.

- Плеоморфная образована одноименными клетками, которые имеют гигантские размеры, окружены веретенообразными, круглыми бластами.
- Недифференцированная липосаркома представлена клетками с низкой и высокой дифференциацией. Напоминает плеоморфную фибросаркому, злокачественную гистиоцитому.
- Смешанная сочетает несколько гистологических вариантов.
Существует 4 стадии развития злокачественного новообразования липосаркомы в забрюшинном пространстве:
- На стадии IА опухоль имеет размеры до 5 см, не дает метастазов, не поражает регионарные лимфатические узлы. Образование может прорастать в фасцию.
- Стадия IB характеризуется большими размерами нароста (больше 5 см). Не прорастает в фасцию. Поражение лимфоузлов и метастазы отсутствуют.
- На второй стадии злокачественное уплотнение достигает больших размеров, прорастает глубоко в окружающие ткани, не дает метастазов. Регионарные лимфоузлы не увеличиваются.
- Третья – характеризуется огромными размерами.
 Заболевание проявляется яркой клинической картиной с выраженными симптомами интоксикации.
Заболевание проявляется яркой клинической картиной с выраженными симптомами интоксикации. - При четвертой стадии наблюдается поражение регионарных лимфоузлов, метастазирование во внутренние органы. Болезнь проявляется типичными онкопатологическими симптомами: резким снижением массы тела, повышенной утомляемостью, постоянными болезненными ощущениями в животе.
Особенности лечения липосаркомы забрюшинного пространства
Основные методы лечения рака: химиотерапия и оперативное вмешательство.
Нуждаетесь в совете опытного врача?
Получите консультацию врача в онлайн-режиме. Задайте свой вопрос прямо сейчас.
Задать бесплатный вопрос
Во время операции врачи вырезают нарост с захватом окружающих тканей, где могут остаться атипические клетки. По правилам абластики от опухоли отступают 5 см и иссекают полученный участок. Если липосаркома вросла во внутренние органы, их приходится убирать. Полученный материал направляется в лабораторию с целью установления структуры.
После хирургических мероприятий пациенту назначают лучевую терапию для закрепления эффекта.
Оперативное вмешательство+химиотерапия проводится при метастазировании липосарком в забрюшинном пространстве. Онкологи назначают внутрикапельное введение Метотрексата, Циклофосфана, Преднизолона. Терапия дополняется обезболивающими препаратами.
Запрещено применение народных средств.
Во время восстановительного периода пациент должен избегать физических, психоэмоциональных нагрузок, вести здоровый образ жизни. Рекомендуется ежегодно проходить МРТ для контроля состояния забрюшинного пространства. Существует риск возникновения рецидива (40-50% случаев).
Прогноз течения заболевания
Высокодифференцированные опухоли лучше поддаются лечению, чем недифферинцированные формы, которые быстро растут и рано дают метастазы.
Уплотнение, состоящая из высокодифференцированных клеток, редко метастазирует. Отсутствие поражения внутренних органов повышает шансы на выздоровление.
Хирургическое лечение, химиотерапия в большинстве случаев дает ожидаемый результат. Соблюдение врачебных рекомендаций ускоряет процесс восстановления. Липосаркома в забрюшинном пространстве отступает через несколько месяцев интенсивной терапии. Согласно статистическим данным пятилетняя выживаемость составляет около 50%.
Диагноз забрюшинной саркомы не приговор! Своевременная диагностика и лечение снижают риск летального исхода.
Статья прошла проверку редакцией сайта
Ссылка на основную публикацию
Не нашли подходящий совет?
Задайте вопрос врачу или смотрите все вопросы…
Рейтинг статьи:
Загрузка…
Внеорганные забрюшинные опухоли :: Симптомы, причины, лечение и шифр по МКБ-10
Название: Внеорганные забрюшинные опухоли.
Внеорганные забрюшинные опухоли. Группа злокачественных и доброкачественных новообразований мезодермального, нейрогенного и эмбриогенного происхождения, локализующихся в забрюшинном пространстве. Характерно длительное бессимптомное течение.
При забрюшинных опухолях большого размера наблюдаются диспепсические расстройства, нарушения мочеиспускания, одышка, неврологические симптомы и отеки нижних конечностей. При злокачественных поражениях на поздних стадиях выявляются признаки раковой интоксикации.
Диагноз выставляется с учетом данных КТ, МРТ, УЗИ, биопсии и других исследований. Лечение – операция, радиотерапия, химиотерапия.
Внеорганные забрюшинные опухоли – группа новообразований, происходящих из тканей забрюшинного пространства, в том числе из жировой, мышечной, соединительной и нервной ткани, лимфоузлов, лимфатических и кровеносных сосудов и эмбриональных элементов.
Группа забрюшинных опухолей не включает в себя онкологические процессы в органах, расположенных в данном пространстве, а также метастатические поражения забрюшинных лимфоузлов при опухолях других локализаций. Причинами объединения столь разнородных заболеваний в одну группу являются сходные особенности клинического течения, общие методы диагностики и терапии.
Причинами объединения столь разнородных заболеваний в одну группу являются сходные особенности клинического течения, общие методы диагностики и терапии.
Забрюшинные опухоли могут быть как злокачественными, так и доброкачественными. Встречаются редко, по различным данным составляют от 0,03 до 0,3% от общего количества онкологических заболеваний. Некоторые специалисты полагают, что эта цифра занижена из-за диагностических затруднений при выявлении данной патологии. Обнаруживаются преимущественно в возрасте 50 лет и старше.
Представители обоих полов страдают одинаково часто. Лечение осуществляют специалисты в области онкологии, неврологии и сосудистой хирургии.
Внеорганные забрюшинные опухоли Забрюшинным пространством называют пространство между задним листком брюшины, диафрагмой, мышцами спины, позвоночником и мышцами, выстилающими дно малого таза. В этой анатомической зоне локализуются поджелудочная железа, почки, надпочечники, мочеточники, часть двенадцатиперстной кишки и часть толстого кишечника. Пространство между органами заполнено клетчаткой, в которой располагаются нервные сплетения, лимфоузлы, лимфатические и кровеносные сосуды. Забрюшинная клетчатка разделена фасциями на несколько отделов. Внеорганными забрюшинными опухолями считаются любые узлы, расположенные в данном пространстве за исключением новообразований, происходящих из перечисленных выше органов, а также метастатических поражений лимфоузлов и опухолей, прорастающих в забрюшинное пространство из других анатомических зон (например, из брюшной полости). В основе наиболее популярной классификации забрюшинных опухолей, созданной Аккерманном в 1954 году, лежат гистогенетические особенности неоплазий. Согласно этой классификации различают три больших подгруппы таких новообразований: мезодермальные, нейрогенные и происходящие из элементов эмбриональных тканей.
Пространство между органами заполнено клетчаткой, в которой располагаются нервные сплетения, лимфоузлы, лимфатические и кровеносные сосуды. Забрюшинная клетчатка разделена фасциями на несколько отделов. Внеорганными забрюшинными опухолями считаются любые узлы, расположенные в данном пространстве за исключением новообразований, происходящих из перечисленных выше органов, а также метастатических поражений лимфоузлов и опухолей, прорастающих в забрюшинное пространство из других анатомических зон (например, из брюшной полости). В основе наиболее популярной классификации забрюшинных опухолей, созданной Аккерманном в 1954 году, лежат гистогенетические особенности неоплазий. Согласно этой классификации различают три больших подгруппы таких новообразований: мезодермальные, нейрогенные и происходящие из элементов эмбриональных тканей.Мезодермальные забрюшинные опухоли.
• Происходящие из жировой ткани: липомы (доброкачественные) и липосаркомы (злокачественные). • Происходящие из гладкомышечной ткани: лейомиомы (доброкачественные) и лейомиосаркомы (злокачественные). • Происходящие из поперечно-полосатой мышечной ткани: рабдомиомы (доброкачественные) и рабдомиосаркомы (злокачественные). • Происходящие из соединительной ткани: фибромы (доброкачественные) и фибросаркомы (злокачественные). • Происходящие из кровеносных сосудов: гемангиомы (доброкачественные) и ангиосаркомы (злокачественные), гемангиоперицитомы (доброкачественные и злокачественные). • Происходящие из лимфатических сосудов: лимфангиомы (доброкачественные) и лимфангиосаркомы (злокачественные). • Происходящие из остатков первичной мезенхимы: миксомы (доброкачественные) и миксосаркомы (злокачественные). • Неясного гистогенеза: ксантогранулемы (доброкачественные).
• Происходящие из поперечно-полосатой мышечной ткани: рабдомиомы (доброкачественные) и рабдомиосаркомы (злокачественные). • Происходящие из соединительной ткани: фибромы (доброкачественные) и фибросаркомы (злокачественные). • Происходящие из кровеносных сосудов: гемангиомы (доброкачественные) и ангиосаркомы (злокачественные), гемангиоперицитомы (доброкачественные и злокачественные). • Происходящие из лимфатических сосудов: лимфангиомы (доброкачественные) и лимфангиосаркомы (злокачественные). • Происходящие из остатков первичной мезенхимы: миксомы (доброкачественные) и миксосаркомы (злокачественные). • Неясного гистогенеза: ксантогранулемы (доброкачественные).
Нейрогенные забрюшинные опухоли.
• Происходящие из оболочек нервов: нейрофибромы (доброкачественные), нейролемоммы (доброкачественные и злокачественные). • Происходящие из симпатических нервных ганглиев: ганглионевромы (доброкачественные) и ганглионейробластомы (злокачественные). • Происходящие из хромаффинных и нехромафинных клеток параганглиев и внеогранно расположенных участков ткани надпочечников: параганглиомы (доброкачественные, злокачественные), феохромоцитомы, рак из клеток надпочечников.
Забрюшинные опухоли из эмбриональных остатков. Тератомы, хордомы.
Причины появления забрюшинных опухолей пока не выяснены. Ученые выделяют ряд факторов, способствующих развитию этой патологии. В числе таких факторов – специфические и неспецифические генетические нарушения, воздействие ионизирующего излучения и некоторых химических веществ.
На возможную связь с ионизирующим облучением указывает повышенная вероятность возникновения забрюшинных опухолей у пациентов, ранее получавших радиотерапию в процессе лечения других онкологических заболеваний.
Существуют исследования, свидетельствующие о повышении риска развития некоторых видов новообразований данной локализации при воздействии гербицидов и пестицидов, особенно – диоксина и производных феноксиацетоновой кислоты. Механизм стимуляции роста забрюшинных опухолей в подобных случаях пока не выяснен.
Есть версии, как о прямом воздействии, так и об опосредованном влиянии в результате подавления иммунитета при токсическом воздействии химикатов.
Особенностью забрюшинных опухолей является длительное отсутствие клинической симптоматики, обусловленное наличием большого количества рыхлой клетчатки и относительной подвижностью соседних органов. Некоторые новообразования достигают огромных размеров, не вызывая нарушений функций пищеварительной и мочевыводящей системы. В литературе встречаются описания отдельных узлов массой от 13 до 51 кг. Еще одним типичным признаком забрюшинных опухолей является отсутствие специфических симптомов. Клиническая картина заболевания обусловлена не видом новообразования, а его локализацией (в нижней, верхней или боковой части забрюшинного пространства), близостью тех или иных органов и анатомических образований (кровеносных сосудов, нервов, лимфатических протоков). Пациенты с забрюшинными опухолями обычно впервые обращаются к врачу в связи с постоянными болями в животе. При пальпации у 80% больных определяются узлы различного размера и консистенции. В половине случаев прощупывание забрюшинной опухоли сопровождается болью различной интенсивности. Возможны жалобы на тошноту, рвоту, преждевременное появление чувства насыщения и нарушения стула. При новообразованиях, локализующихся в нижней части забрюшинного пространства, могут наблюдаться расстройства мочеиспускания, вызванные сдавлением мочевого пузыря. При высоко расположенных забрюшинных опухолях иногда развивается одышка, обусловленная давлением на диафрагму. На ранних стадиях у многих больных выявляются гипотермия и гипергидроз нижней конечности на стороне поражения. На поздних этапах болезни гипотермия конечности сменяется гипертермией. Развитие этого симптома при забрюшинных опухолях обусловлено начальным раздражением и последующим параличом симпатического нерва.
Возможны жалобы на тошноту, рвоту, преждевременное появление чувства насыщения и нарушения стула. При новообразованиях, локализующихся в нижней части забрюшинного пространства, могут наблюдаться расстройства мочеиспускания, вызванные сдавлением мочевого пузыря. При высоко расположенных забрюшинных опухолях иногда развивается одышка, обусловленная давлением на диафрагму. На ранних стадиях у многих больных выявляются гипотермия и гипергидроз нижней конечности на стороне поражения. На поздних этапах болезни гипотермия конечности сменяется гипертермией. Развитие этого симптома при забрюшинных опухолях обусловлено начальным раздражением и последующим параличом симпатического нерва.
Ассоциированные симптомы: Одышка. Отсутствие аппетита. Потеря веса. Рвота. Тошнота.
Диагноз устанавливается на основании жалоб, результатов внешнего осмотра и дополнительных исследований. Пациентов с подозрением на забрюшинную опухоль направляют на УЗИ, КТ и МРТ органов брюшной полости и забрюшинного пространства.
Перечисленные диагностические методы позволяют определить структуру и локализацию новообразования, оценить степень вовлеченности близлежащих органов и выявить отдаленные метастазы в печени.
Учитывая ряд признаков (форма, плотность, наличие или отсутствие капсулы, уровень гомогенности, степень васкуляризации), после проведения УЗИ, МРТ и КТ специалист может оценить злокачественность забрюшинной опухоли и выдвинуть обоснованные предположения о типе новообразования.
Для оценки состояния пищеварительной и мочевыводящей системы применяют рентгенконтрастные методы (ирригоскопию и экскреторную урографию). Для выявления герминогенных новообразований назначают тесты на определение альфа-фетопротеина и хорионического гонадотропина.
Поскольку основным методом лечения забрюшинных опухолей является их радикальное удаление, биопсию обычно не проводят из-за высокого риска обсеменения и недостаточной целесообразности исследования. Исключением являются ситуации, когда забор материала осуществляется для планирования операции, определения резектабельности новообразования или исключения метастатического характера онкологического поражения.
Единственным радикальным способом лечения является оперативное вмешательство. В зависимости от локализации удаление забрюшинной опухоли производят с использованием бокового доступа, срединной лапаротомии или торакоабдоминального доступа.
Более чем у половины пациентов операция включает в себя резекцию близлежащих органов: почки, поджелудочной железы, двенадцатиперстной кишки или толстой кишки. Эффективность пред- и послеоперационной радиотерапии и химиотерапии при забрюшинных опухолях пока остается под сомнением.
Показанием к использованию этих лечебных методик является доказанная злокачественность новообразования при наличии сомнений в его операбельности.
Данные об операбельности забрюшинных опухолей сильно различаются. В литературе встречаются указания как на 25%, так и на 95% резектабельность подобных новообразований.
Послеоперационная летальность при удалении забрюшинных опухолей составляет около 5%, вероятность развития местных рецидивов в отдаленном периоде – около 50%.
До 5 лет с момента операции доживает менее 10% пациентов, страдающих злокачественными новообразованиями.
При доброкачественных забрюшинных опухолях прогноз более благоприятный, однако, высокая вероятность рецидивирования обуславливает необходимость большого количества повторных хирургических вмешательств.
42a96bb5c8a2acfb07fc866444b97bf1 Модератор контента: Васин А.С.
Злокачественное новообразование забрюшинного пространства
Материал из Wikimed
Рубрика МКБ-10: C48.0
МКБ-10 / C00-D48 КЛАСС II Новообразования / C00-C97 Злокачественные новообразования / C45-C49 Злокачественные новообразования мезотелиальной и мягких тканей / C48 Злокачественное новообразование забрюшинного пространства и брюшины
Определение и общие сведения[править]
Первичные опухоли забрюшинного пространства представляют собой гетерогенную группу мезенхимальных, нейрогенных, нейроэндокринных и герминогенных новообразований, составляющих около 1% всех солидных опухолей.
Мезенхимальные опухоли
Мезенхимальные опухоли, происходящие из мезенхимальных клеток в мышцах, жировой и соединительной ткани, подразделяют на доброкачественные (фибромы, лейомиомы, ангиомы) и злокачественные (саркомы). Доброкачественные мезенхимальные опухоли встречают редко. Лечение оперативное. Прогноз благоприятный.
Эпидемиология
Треть опухолей забрюшинного пространства составляют саркомы. Средний возраст заболевших около 50 лет. Соотношение заболевших мужчин и женщин — 1:1.
Этиология и патогенез[править]
Клинические проявления[править]
Наиболее распространёнными гистологическими типами злокачественных опухолей данной локализации выступают липосаркома (41%), лейомиосаркома (28%), злокачественная фиброзная гистиоцитома (7%) и фибросаркома (6%). Около 50% ретроперитонеальных сарком имеет высокую степень дифференцировки.
Опухоли данной группы склонны к местноинвазивному росту с инвазией магистральных сосудов в 34% и паренхиматозных органов более чем в 50% наблюдений. Для всех ретроперитонеальных сарком, кроме липосаркомы, характерно гематогенное метастазирование с поражением лёгких, печени и костей (15-34%).
Для всех ретроперитонеальных сарком, кроме липосаркомы, характерно гематогенное метастазирование с поражением лёгких, печени и костей (15-34%).
Липосаркомам свойственна низкая частота появления отдалённых метастазов (7%).
Злокачественное новообразование забрюшинного пространства: Диагностика[править]
Нередко забрюшинные саркомы проявляются как пальпируемые опухоли живота значительных размеров, не вызывающие появления других жалоб. В связи с этим на момент выявления размер данных опухолей, как правило, превышает 5 см.
Рост новообразования и его инвазия в окружающие структуры может привести к появлению жалоб, связанных с гастроинтестинальной обструкцией (кишечная непроходимость), прорастанием стенки кишки опухолью (кишечное кровотечение), сдавлением нижней полой вены (отёки нижней половины тела, асцит, гепатоспленомегалия, «голова медузы»), сдавлением корешков спинномозговых нервов (боль).
Методом выбора в диагностике забрюшинных опухолей служит КТ, позволяющая выявить новообразование и оценить его синтопию с окружающими тканями, а также исключить метастатическое поражение органов брюшной полости. КТ даёт возможность определить содержание жировой ткани в опухоли, что важно в диагностике липосарком.
КТ даёт возможность определить содержание жировой ткани в опухоли, что важно в диагностике липосарком.
МРТ также позволяет получить объективную информацию о размерах опухоли и её соотношении с соседними органами. Всем больным с забрюшинными неорганными опухолями обязательно выполняют рентгенографию органов грудной клетки для исключения метастазов в лёгкие.
Биопсия до начала лечения рекомендуется лишь в тех случаях, когда верификация диагноза может повлиять на тактику ведения пациента (назначение дооперационной химиотерапии).
Дифференциальный диагноз[править]
При ретроперитонеальных саркомах дифференциальную диагностику проводят с опухолями надпочечника, почки, поджелудочной железы. Для исключения гастроинтестинальных новообразований следует выполнять гастродуоденоскопию и колоноскопию.
Также необходимо исключить забрюшинные метастазы герминогенных опухолей яичка и первичные внегонадные герминогенные новообразования. При этом существенную помощь оказывает определение уровней β-субъдиницы хорионического гонадотропина человека (ХГЧ) и α-фетопротеина (АФП), которые повышаются при герминогенных опухолях.
От забрюшинных сарком следует дифференцировать увеличенные забрюшинные лимфатические узлы при лимфоме; с этой целью рекомендуют биопсию.
Злокачественное новообразование забрюшинного пространства: Лечение[править]
Стандарт лечения ретроперитонеальных сарком — операция. Удаление новообразований данной группы нередко ассоциировано с техническими трудностями, обусловленными большими размерами опухолей и сложной анатомией забрюшинного пространства. Радикальное оперативное вмешательство технически выполнимо у 70% больных.
С целью полного удаления ретроперитонеальных сарком примерно в 30% наблюдений требуется резекция нижней полой вены и/или аорты, в 63-86% наблюдений — резекция или удаление смежных органов, таких как почка, толстая и тонкая кишка, поджелудочная железа, мочевой пузырь.
Нерадикальное удаление забрюшинных сарком не увеличивает выживаемость пациентов, за исключением больных ретроперитонеальной липосаркомой.
Для забрюшинных сарком характерна высокая частота местных рецидивов после радикального оперативного лечения, достигающая 50-70%.
Возможно позднее локальное рецидивирование, через 5 и даже 10 лет после операции. Около 90% больных с местными рецидивами опухоли погибает от прогрессирования болезни. Это диктует длительное тщательное наблюдение за больными.
С целью улучшения результатов оперативного лечения ретроперитонеальных сарком предпринимали попытки введения в схему лечения облучения и терапии цитостатиками. Данных, свидетельствующих об эффективности неоадъювантной и адъювантной лучевой терапии, не получено.
В нерандомизированных исследованиях проведение интраоперационного облучения снижало частоту местных рецидивов в два раза. Роль неоадъювантной химиотерапии при забрюшинных саркомах не изучена.
Согласно метаанализу Sarcoma Meta-analysis Collaboration, включившему 1568 больных, подвергнутых радикальному оперативному удалению локализованных сарком всех локализаций, адъювантная цитостатическая терапия приводит к достоверному увеличению безрецидивной выживаемости на 10%.
Метод выбора в лечении солитарных или единичных метастазов и местных рецидивов ретроперитонеальных сарком — операция.
Роль дополнительной химиотерапии и лучевой терапии при метастатических и рецидивных опухолях не определена.
Диссеминированные ретроперитонеальные саркомы служат показанием к проведению паллиативной химиотерапии.
У данной категории больных продемонстрирована умеренная эффективность доксорубицина, ифосфамида и дакарбазина в режиме монотерапии.
Комбинация ифосфамида с доксорубицином повышает частоту объективных ответов по сравнению с монотерапией данными препаратами, однако увеличения выживаемости при этом не наблюдают.
Все больные ретроперитонеальными саркомами нуждаются в тщательном наблюдении после окончания лечения.
При высокодифференцированных опухолях после завершения лечения рекомендуют КТ грудной полости, брюшной полости и таза каждые 3 мес в течение 1-го года, каждые 6 мес — в течение 2-3-го года, каждые 12 мес — с 4-го года и пожизненно.
При низкодифференцированных новообразованиях после завершения лечения аналогичное исследование проводят чаще (каждые 3 мес в течение 1-3-го года, каждые 6 мес — в течение 4-5-го года, каждые 12 мес с 5 года до смерти больного).
Общая 5-летняя выживаемость больных ретроперитонеальными саркомами составляет 46-71%. Факторы прогноза выживаемости — гистологический тип, степень дифференцировки опухоли, стадия опухолевого процесса, вид лечения и радикальность оперативного удаления опухоли.
Наиболее благоприятным морфологическим вариантом служит высокодифференцированная липосаркома. Появление отдалённых метастазов уменьшает медиану выживаемости до 6-12 мес.
Наилучших результатов позволяет добиться агрессивная оперативная тактика, при этом радикальное удаление локализованных опухолей позволяет добиться 5-летней общей выживаемости, достигающей 53,6%, рецидивов первичного опухолевого очага и солитарных метастазов — 25-39%.
Профилактика[править]
Прочее[править]
Нейрогенные опухоли
Нейрогенные забрюшинные опухоли подразделяют на ганглионарные (ганглионейромы, ганглионейробластомы, нейробластомы), параганглионарные (феохромоцитома, параганглиома) и опухоли нервных оболочек (нейролеммома, нейрофиброма, злокачественная футлярная опухоль).
Нейрогенные опухоли чаще всего располагаются в паравертебральной области и надпочечниках. Большинство новообразований данной группы, исключая нейробластому и ганглионейробластому, развивается у взрослых.
Методом выбора в диагностике этой группы новообразований является КТ.
Радиологическая картина нейрогенных опухолей представляет собой хорошо отграниченное солидное или дольчатое объёмное образование; возможно наличие кальцинатов.
- Лечение
- Лечение оперативное.
- Прогноз
- Прогноз зависит от течения заболевания: при злокачественных нейрогенных опухолях — неблагоприятный, при доброкачественных — хороший.
- Нейроэндокринные опухоли
- Определение и общие сведения
Нейроэндокринные опухоли — группа новообразований, развивающихся в различных органах или имеющих внеорганное происхождение, клетки которых содержат нейросекреторные гранулы и продуцируют особые пептиды. Выделяют три группы внеорганных нейроэндокринных опухолей: карциноид, мелкоклеточная карцинома и недифференцированная карцинома.
Клинические проявления
Клиническое течение первичного ретроперитонеального карциноида аналогично карциноидной опухоли любого происхождения (проявления первичной опухоли и её метастазов в сочетании или без карциноидного синдрома, вызванного выработкой серотонина в опухоли). Мелкоклеточная карцинома — агрессивная опухоль, биологически сходная с мелкоклеточным раком лёгкого. Недифференцированная карцинома составляет 10% нейроэндокринных опухолей и, как правило, не вызывает эндокринных проявлений.
Лечение
Лечение локализованных нейроэндокринных опухолей забрюшинного пространства оперативное. Диссеминированный опухолевый процесс служит показанием к проведению системного лечения.
Как правило, используют режимы, основанные на цисплатине, доксорубицине и этопозиде. Частота объективных ответов на химиотерапию — 67-82%.
При карциноиде с паллиативной целью для подавления карциноидного синдрома возможно применение соматостатина, а также интерферона альфа.
Внегонадные герминогенные опухоли
Определение и общие сведения
От 3 до 10% герминогенных опухолей имеет первичную внегонадную локализацию, при этом в 50% наблюдений поражено забрюшинное пространство. Клинические наблюдения ретроперитонеальных герминогенных новообразований описаны во всех возрастных группах, однако пик заболеваемости приходится на 20-35 лет.
Все герминогенные опухоли как тестикулярного, так и внегонадного происхождения, подразделяют на семиномы и несеминомы (опухоль желточного мешка, эмбриональный рак, хориокарцинома, тератома), что существенно влияет на прогноз.
Как правило, к моменту обращения большинство ретроперитонеальных герминогенных опухолей имеет значительные размеры и вовлекает в процесс органы забрюшинного пространства. До 90% этих пациентов имеют метастазы. Чаще всего поражены лёгкие, надключичные и медиастинальные лимфатические узлы, печень.
Клинические проявления
Для первичных внегонадных герминогенных опухолей характерно длительное бессимптомное течение. По мере увеличения новообразований возможно постепенное появление жалоб, связанных со сдавлением магистральных сосудов, двенадцатиперстной кишки и мочеточников опухолью. Развитие отдалённых метастазов вызывает соответствующие клинические проявления.
По мере увеличения новообразований возможно постепенное появление жалоб, связанных со сдавлением магистральных сосудов, двенадцатиперстной кишки и мочеточников опухолью. Развитие отдалённых метастазов вызывает соответствующие клинические проявления.
Диагностика
При наличии объёмного образования забрюшинного пространства у молодого пациента, особенно мужского пола, в круг рассматриваемых диагнозов должна входить герминогенная опухоль.
Помимо обязательного физикального обследования необходимо выполнение УЗИ органов мошонки, рентгенографии и КТ органов грудной клетки, КТ брюшной полости и забрюшинного пространства, а также определение уровня сывороточных маркеров — АФП, β-ХГЧ и ЛДГ.
Сканирование костей и КТ головного мозга следует производить по показаниям, при наличии соответствующей симптоматики или при повышении уровня β-ХГЧ более 10 000 Ед/л. Тонкоигольная биопсия с последующим цитологическим и иммуногистохимическим исследованием полученного материала позволяет подтвердить диагноз внегонадной герминогенной опухоли в 71% наблюдений.
Лечение
Тактика лечения первичных ретроперитонеальных герминогенных опухолей определяется гистологическим вариантом новообразования и степенью распространённости опухолевого процесса.
Доброкачественная (зрелая) тератома резистентна к лучевой и химиотерапии. Метод выбора — оперативное удаление опухоли. Рецидивы опухоли после выполнения радикального оперативного вмешательства редки.
Даже больные, подвергнутые паллиативным циторедуктивным операциям, имеют длительную выживаемость.
Оптимальная тактика лечения злокачественных внегонадных герминогенных опухолей забрюшинного пространства не выработана.
В настоящее время наиболее эффективно у пациентов с внегонадной семиномой проведение индукционной химиотерапии, основанной на цисплатине (4 цикла ВЕР: цисплатин 20 мг/м2 1-5 дни, этопозид 100 мг/м2 1-5 дни, блеомицин 30 мг/м2 1, 3, 5-й дни).
У 20% пациентов после индукции выявляют резидуальные опухоли, за которыми рекомендуют наблюдать. В случае увеличения остаточных опухолевых масс возможно проведение химиотерапии второй линии, основанной на ифосфамиде, или оперативного вмешательства.
В случае увеличения остаточных опухолевых масс возможно проведение химиотерапии второй линии, основанной на ифосфамиде, или оперативного вмешательства.
Первичная внегонадная несеминома забрюшинного пространства служит показанием к проведению индукционной химиотерапии, основанной на цисплатине (4 цикла ВЕР), с последующим удалением резидуальной опухоли. При выявлении жизнеспособных клеток герминогенной опухоли в удалённых забрюшинных массах проводят два цикла адъювантной химиотерапии, основанной на цисплатине.
Прогноз
Несмотря на значительное улучшение результатов лечения герминогенных опухолей после появления цисплатина и этопозида, прогноз больных внегонадными новообразованиями остаётся плохим.
Отдалённая выживаемость этой категории пациентов в разных сериях наблюдений колеблется от 13% до 88%. Наиболее важный фактор, влияющий на отдалённые результаты, — гистологический вариант опухоли.
Общая 5-летняя выживаемость больных зрелой тератомой составляет 100%, семиномой — 88%, злокачественной несеминомой — 45%.
Источники (ссылки)[править]
Урология [Электронный ресурс] / Под ред. Н.А. Лопаткина — М. : ГЭОТАР-Медиа, 2011. — http://www.rosmedlib.ru/book/ISBN9785970419908.html
Дополнительная литература (рекомендуемая)[править]
Действующие вещества[править]
Опухоль забрюшинного пространства
Первичные забрюшинные новообразования представляют собой группу редких и разных по происхождению доброкачественных и злокачественных опухолей, возникающих внутри забрюшинного пространства, но вне основных органов этого пространства.
Забрюшинная опухоль может иметь источником любую ткань, присутствующую в забрюшинном пространстве и представлять различные патологические типы опухолей. Злокачественные опухоли забрюшинного пространства встречаются в четыре раза чаще, чем доброкачественные поражения.
Эти новообразования чаще встречаются у взрослых, но могут быть обнаружены в любом возрасте.
Опухоли поджелудочной железы, почек, надпочечников рассматриваются отдельно и к данной группе новообразований не относятся.
Причины возникновения и факторы риска
Точные причины развития забрюшинных опухолей не установлены. Предполагается, что лучевая терапия использования в прошлом для лечения других онкозаболеваний может играть провоцирующую роль в возникновении забрюшинных опухолей.
Наиболее частые новообразования забрюшинного пространства, саркомы, связаны с рядом редких наследственных синдромов, которые могут рассматриваться как факторы риска.
Факторы риска забрюшинных сарком
- Синдром невоидного базально-клеточного рака (синдром Горлина).
- Семейный аденоматозный полипоз (ФАП; синдром Гарднера).
- Синдром Ли-Фраумени.
- Туберозный склероз (болезнь Борнвилля).
- Нейрофиброматоз типа 1 (NF1, болезнь фон Реклингхаузена).
- Синдром Вернера (прогерия взрослых).
Виды опухолей
- По происхождению твердые поражения можно разделить на четыре группы — мезенхимальные, нервные, зародышевых клеток и лимфопролиферативные.

- Мезенхимальные опухоли (саркомы) составляют треть забрюшинных опухолей с преобладанием двух гистологических подтипов — липосаркомы (70%) и лейомиосаркомы (15%).
- Забрюшинные поражения у взрослых
| Солидные опухоли | Кистозные образования |
| Лимфома | Лимфангиома |
| Липосаркома | Цистоаденома |
| Злокачественная фиброзная гистиоцитома | Цистаденокарцинома |
| Лейомиосаркома | Кистозная мезотелиома |
| Нейрогенные опухоли (шванномы,симпатобластомы) | Зрелая тератома |
| Опухоли зародышевых клеток |
Признаки и симптомы
В обнаружении такого новообразования как забрюшинная опухоль, симптомы играют второстепенную роль. Такие неоплазии очень долго никак не проявляют себя. А когда симптоматика уже развивается — она совершенно неспецифична.
У большинства пациентов с опухолью забрюшинного пространства отмечается:
- боли в животе или пояснице;
- раннее чувство сытости;
- дискомфорт в животе;
- вздутие живота.

Опухоль забрюшинного пространства, симптомы которой достаточно выраженно проявляются, либо уже имеет большие размеры, либо за счет инвазивного роста уже проросла в соседние органы.
Диагностика
Забрюшинная опухоль — это редкая неоплазия, диагностика и лечение которой могут быть сложными. И для их проведения требуется многопрофильная команда врачей в специализированном центре.
При подозрении на опухоль забрюшинного пространства диагностика предусматривает использование средств медицинской визуализации (КТ, МРТ, ПЭТ-КТ) и исследование результатов биопсии.
Выявление гистологического подтипа — важная часть диагноза. Идентификация гистологического подтипа важна, потому что это может повлиять на прогноз и варианты лечения.
Лечение
ХирургияКраеугольный камень лечения опухоли забрюшинного пространства — максимальное полное хирургическое удаление.
Операция должна обеспечить макроскопически полное иссечение опухоли (R0 или R1), сводя к минимуму вероятность сохранения каких-либо ее остатков. В идеале резекция должна затрагивать все потенциально вовлеченные структуры, которые были определены тщательной предоперационной визуализацией в сочетании с интраоперационными данными.
В идеале резекция должна затрагивать все потенциально вовлеченные структуры, которые были определены тщательной предоперационной визуализацией в сочетании с интраоперационными данными.
И тут важно, чтобы операция проводилась в крупном профильном центре, врачи которого обладают специализированными знаниями и опытом. А еще лучше, если в распоряжении хирургов будут высокотехнологичные средства интраоперационной флуоресцентной визуализации, которые дадут возможность оценивать расположение хирургического края опухоли в процессе ее удаления.
Это оборудование есть в распоряжении онкологов из института Жюля Борде в Брюсселе.
Операции по удалению забрюшинных опухолей, и особенно липосарком, приводят к более низким локальным показателям рецидивов, чем классические иссечения.
А в сравнении с расширенной резекцией, когда удаляется практически все в забрюшинном пространстве, высокотехнологичные операции позволяют сохранить в целости большую часть органов и мышц, помогая избежать полной инвалидизации.
- По данным исследования STRASS (NCT01344018), итоговые результаты которого были озвучены на ежегодном собрании Американского общества клинической онкологии в 2019 году — неоадъювантная радиолучевая терапия достоверно продлевает выживаемость пациентов с забрюшинными саркомами.
- Неоадъювантные методы лечения (химиотерапия, внешнее лучевое воздействие или комбинированное облучение и химиотерапия) безопасны для правильно отобранных пациентов и могут быть рассмотрены после тщательного анализа на многопрофильной комиссии по диагностике ретроперитонеальной саркомы, когда риск рецидива высок.
- В Бельгийских онкологических клиниках основу неоадъювантной химиотерапии неоплазий забрюшинного пространства составляют доксорубицин и ифосфамид.
Причем ифосфамид, как было отмечено, обладает выраженным радиопротекторным действием в отношении здоровых структур забрюшинного пространства.
Поэтому этот препарат используется в Бельгии еще и для снижения уровня нежелательных побочных эффектов лучевой терапии.
В институте онкологии Жюля Борде ведутся работы по специализации химиотерапии новообразований забрюшинного пространства в соответствии с гистологическим подтипом. Это, например, использование таксанов для ангиосаркомы, гемцитабина и доцетаксела для лейомиосаркомы и трабектедина для лейомиосаркомы и миксоидной/круглоклеточной липосаркомы.
Анализ предварительных результатов этой работы выявил улучшение выживаемости как у пациентов, получавших неоадъювантную химиотерапию, так и у пациентов, получавших адъювантное лечение. Однако пока использование этих схем и комбинаций препаратов в большей степени экспериментальное, и пациенты института Борде могут получить такое лечение в рамках программы клинического тестирования.
Прогноз
Прогноз при опухолях забрюшинного пространства зависит от гистологического типа неоплазии и возможности резекции. Вероятность полной хирургической резекции с отрицательным краем зависит от биологии опухоли и инвазии в соседние висцеральные органы и сосудистые структуры и может зависеть от хирургического опыта и ведения пациентов в центрах с большим опытом.
Частота рецидивов высока (до 90% при некоторых типах опухолей), поэтому постоянное наблюдение становится важной частью дальнейшего ведения больного.
Забрюшинные саркомы имеет гораздо худший прогноз, чем саркомы конечностей, с пятилетней местной безрецидивной выживаемостью после полной резекции — от 55% до 78%. А общая общей пятилетняя выживаемость составляет от 39% до 68%.
Такой серьезный прогноз обусловлен тем, что опухоли возникают в анатомически сложном и хирургически недоступном месте с окружающими их жизненными структурами, ограничивающими возможности широкой резекции.
Получите больше информации по лечению редких опухолей забрюшинного пространства в Бельгии. Напишите нам или закажите обратный звонок. Мы максимально полно ответим на все ваши вопросы.
Медицинские классификации
Различные медицинские классификации необходимые в статистической работе врача и его клинической практике.
ICPC-2
Международная классификация первичной медицинской помощи (International Classification for Primary Care — ICPC) разработана Всемирной организацией семейных врачей WONCA для эффективного ведения пациентов на первичном звене.
МКБ-С
МКБ–С, или международная классификация стоматологических болезней является извлечение МКБ–10 и представляет собой классы болезней полости рта и смежных систем.
МКБ-О
Международная классификация онкологических заболеваний (МКБ-О) — специальное тематическое расширение Международной Классификации Болезней. МКБ-О имеет двухосевую структуру с системой кодирования по топографии и морфологии опухолей. Морфологический код содержит пять знаков, первые четыре из которых описывают гистологический тип опухоли, а пятый — её биологические свойства
МКБ-10
Международная статистическая классификация болезней и проблем, связанных со здоровьем (англ. International Statistical Classification of Diseases and Related Health Problems) — документ, используемый как ведущая статистическая и классификационная основа в здравоохранении большинства стран мира.
- Некоторые инфекционные и паразитарные болезниКласс I
- Новообразования Класс II
- Болезни крови, кроветворных органов и отдельные нарушения, вовлекающие иммунный механизм Класс III
- Болезни эндокринной системы, расстройства питания и нарушения обмена веществ Класс IV
- Психические расстройства и расстройства поведенияКлас V
- Болезни нервной системыКласс VI
- Болезни глаза и его придаточного аппаратаКласс VII
- Болезни уха и сосцевидного отросткаКласс VIII
- Болезни системы кровообращенияКласс IX
- Болезни органов дыханияКласс X
- Болезни органов пищеваренияКласс XI
- Болезни кожи и подкожной клетчаткиКласс XII
- Болезни костно-мышечной системы и соединительной тканиКласс XIII
- Болезни мочеполовой системыКласс XIV
- Беременность, роды и послеродовой периодКласс XV
- Отдельные состояния, возникающие в перинатальном периодеКласс XVI
- Врожденные аномалии (пороки развития), деформации и хромосомные нарушенияКласс XVII
- Симптомы, признаки и отклонения от нормы, выявленные при клинических и лабораторных исследованиях, не классифицированные в других рубрикахКласс XVIII
- Травмы, отравления и некоторые другие последствия воздействия внешних причинКласс XIX
- Внешние причины заболеваемости и смертностиКласс XX
- Факторы, влияющие на состояние здоровья населения и обращения в учреждения здравоохраненияКласс XXI
- Временные обозначения новых диагнозов неясной этиологии или для использования в чрезвычайных ситуацияхКласс XXII
NCSP
Скандинавский перечень медицинских манипуляций (NCSP) — основана исходя из практического опыта хирургов скандинавских стран. Он представляет собой первую общеевропейскую классификацию хирургических процедур.
Он представляет собой первую общеевропейскую классификацию хирургических процедур.
ACHI
Австралийской классификации медицинских вмешательств (англ. Australian Classification of Health Interventions, ACHI)
Стр. 13
ности (C56)
M8480/0 Муцинозная аденома
M8480/3 Муцинозная аденокарцинома
M8480/6 Псевдомиксома брюшины (C78.6)
M8481/3 Слизьпродуцирующая аденокарцинома
M8490/3 Перстневидно-клеточный рак
M8490/6 Метастатический перстневидно-клеточный рак
M850-M854 Протоковые, дольковые и медуллярные новообразования
M8500/2 Внутрипротоковый рак неинфильтрирующий БДУ
M8500/3 Инфильтрирующий протоковый рак (C50.-)
M8501/2 Комедокарцинома неинфильтрирующая (D05.-)
M8501/3 Комедокарцинома БДУ (C50.-)
M8502/3 Ювенильный рак грудной железы (C50.-)
M8503/0 Внутрипротоковая папиллома
M8503/2 Неинфильтрирующая внутрипротоковая папиллярная аденокарцино-
ма (D05. |
Саркоидоз глазами участников Российского респираторного конгресса. XX Национальный конгресс по болезням органов дыхания
Саркоидоз – относительно доброкачественный эпителиоидноклеточный гранулематоз неизвестной природы, интерес к которому в последние годы значительно возрос по ряду объективных причин. При переходе от МКБ-9 к МКБ-10 болезнь перешла из класса инфекционных в класс иммунных заболеваний. В России саркоидоз перешел от фтизиатров в общую лечебную сеть и к пульмонологам. Знания о саркоидозе значительно расширились – от международного соглашения 1999 года [1] до межнациональных рекомендаций по саркоидозу, где появились уровни доказательности. Внедрение современных методов визуализации, совершенствование бронхологии и торакальной хирургии, и особенно – эндохирургии, привели к ускорению диагностики этого заболевания, позволяя в большинстве случаев свести к минимуму так называемую «пробную терапию».
Участниками конгресса было отмечено, что в настоящее время фтизиатрические учреждения перешли от тотального применения системных стероидов под защитой противотуберкулезных препаратов к дифференцированному лечению, осторожному отношению к синдрому Лефгрена. И одновременно – к достаточно агрессивной пульс-терапии при полиорганном и угрожающем жизни поражении многих органов и систем. Накапливается опыт применения цитостатиков и антител против фактора некроза опухоли-альфа. Благодаря инициативе Роберта Боугмана из Цинциннати (США), работам ученых из Белоруссии и Татарстана ведется изучение пентоксифиллина. Наводивший когда-то тератогенный ужас талидомид также нашел свое применение при саркоидозе и получил одобрение FDA. Ведется дискуссия о роли никотина в возникновении и даже моделировании течения саркоидоза. Обсуждается и находится в стадии изучения сочетание тетрациклинов, азитромицина и олмесартана в лечении саркоидоза, с точки зрения гипотезы иммунного ответа на внутриклеточные патогены.
Тема саркоидоза звучала на ХХ конгрессе Российского респираторного общества в разных аспектах. 18 ноября состоялся симпозиум «Диссеминированные процессы в легких неопухолевой природы – дифференциальная диагностика», на котором председательствовали профессора Е.И. Шмелев, М.М. Илькович и А.А. Визель. Дифференциальную диагностику саркоидоза представил ведущий научный сотрудник Центрального НИИ туберкулеза РАМН В.В. Романов. Наиболее важным аспектом дифференциально-диагно-стической работы в России остается исключение туберкулеза, за которым следуют опухолевые заболевания, пневмония и интерстициальные болезни легких. Точку зрения на диссеминированный туберкулез с позиции пульмонолога изложил профессор А.А. Визель (Казань), который представил эту форму туберкулеза посредством описания скиалогической диагностики, клинической диагностики на уровне приемного покоя и дифференцированных подходов к лечению. В докладе А.А. Сперанской и А.С. Захарова дифференциальная диагностика была дополнена легочными синдромами при диффузных болезнях соединительной ткани. Внелегочные проявления саркоидоза изложил профессор А.А. Визель. На ХХ конгрессе впервые состоялся разбор случая саркоидоза у ребенка, который провели профессора И.К. Волков и Н.А. Геппе.
Внелегочные проявления саркоидоза изложил профессор А.А. Визель. На ХХ конгрессе впервые состоялся разбор случая саркоидоза у ребенка, который провели профессора И.К. Волков и Н.А. Геппе.
Памяти одного из отечественных корифеев учения о саркоидозе академика А.Е. Рабухина был посвящен симпозиум «Саркоидоз: когда, кого и как мы лечим». Результаты годичного наблюдения за 188 гистологически верифицированными больными саркоидозом представила ассистент Казанского медуниверситета И.Ю. Визель. Она отметила, что спонтанная ремиссия происходила только у трети больных. Одним из неблагоприятных прогностических факторов оказалась пробная противотуберкулезная терапия, проводимая больным с отрицательной туберкулиновой пробой и отрицательными результатами бактериологических исследований на туберкулез. Наиболее перспективным оказалось воздействие на фактор некроза опухоли-альфа. Известную в России Московскую фтизиопульмонологическую школу представил профессор С.Е. Борисов, который прогноз течения саркоидоза связал с клинико-морфологическими проявлениями заболевания и различными схемами стартовой терапии. Опыт работы с саркоидозом этой группы ученых превышает 30 лет, а уровень гистологических и клинических исследований ежегодно высоко оценивают эксперты Европейского респираторного общества. Эфферентные методы лечения саркоидоза и их влияние на прогноз заболевания были изложены в докладе, подготовленном тремя лидерами Центрального НИИ туберкулеза – профессорами Е.И. Шмелевым, И.Э. Степаняном и В.В. Романовым. Экстракорпоральная модификация лимфоцитов является одним из эффективных методов стероидной терапии саркоидоза, при котором больной не страдает от системных нежелательных реакций препаратов коры надпочечника. Лидеры Санкт-Петербургской пульмонологической школы – профессор М.М. Илькович и к.м.н. О.П. Баранова представили многолетний опыт разгрузочной диетотерапии саркоидоза. Очень интересный доклад был представлен молодыми хирургами, работающими в Омске под руководством к.м.н. Н.В. Овсянникова, – «Заболеваемость и возможности диспансерного наблюдения больных саркоидозом в г. Омске». Активная позиция пульмонологов позволила вывести на международный уровень верификацию и лечение этого гранулематоза.
Опыт работы с саркоидозом этой группы ученых превышает 30 лет, а уровень гистологических и клинических исследований ежегодно высоко оценивают эксперты Европейского респираторного общества. Эфферентные методы лечения саркоидоза и их влияние на прогноз заболевания были изложены в докладе, подготовленном тремя лидерами Центрального НИИ туберкулеза – профессорами Е.И. Шмелевым, И.Э. Степаняном и В.В. Романовым. Экстракорпоральная модификация лимфоцитов является одним из эффективных методов стероидной терапии саркоидоза, при котором больной не страдает от системных нежелательных реакций препаратов коры надпочечника. Лидеры Санкт-Петербургской пульмонологической школы – профессор М.М. Илькович и к.м.н. О.П. Баранова представили многолетний опыт разгрузочной диетотерапии саркоидоза. Очень интересный доклад был представлен молодыми хирургами, работающими в Омске под руководством к.м.н. Н.В. Овсянникова, – «Заболеваемость и возможности диспансерного наблюдения больных саркоидозом в г. Омске». Активная позиция пульмонологов позволила вывести на международный уровень верификацию и лечение этого гранулематоза.
Сборник работ конгресса содержал отдельный раздел по саркоидозу, представленный учеными и врачами из разных уголков нашей страны [2]. Сотрудники Оренбургской медицинской академии (В.Б. Долгополов и соавт.) представили оценку качества раннего выявления саркоидоза органов дыхания (СОД) в условиях города и села у населения сельского района с населением в 22,3 тыс. человек и городского района областного центра с населением в 110 тыс. человек. В сельской местности отмечены просмотры у 19,0% обследованных лиц (328 из 1726). Ошибки в раннем выявлении патологии наиболее часто наблюдались при изменениях срединной тени, малых очаговых тенях и ограниченных диссеминациях. Среди городского населения просмотры наблюдались реже и отмечены только у 9,0%. Среди городских больных СОД просмотр патологии, по данным рентгенологического архива, отмечен у 15 из 210 (7,1%), среди сельских больных – у 20 из 95 (21,1%). Авторы заключили, что качество раннего выявления СОД среди сельского населения ниже, чем среди городского, поскольку просмотр патологии в селах достигает 21,1%, а в городе 7,1%.
Исследователи из Иркутского государственного медуниверситета (Ф.Н. Пачерских и соавт.) наблюдали 78 больных саркоидозом органов дыхания, в том числе 35 с внелегочными поражениями. У 13 больных был саркоидоз кожи по типу ознобленной волчанки. Течение саркоидоза в этом регионе не отличалось от описанного в международном положении о саркоидозе 1999 года: острое начало заболевания с наличием лихорадки, узловатой эритемы, артралгии способствовало благоприятному течению процесса, наступлению спонтанной ремиссии или ремиссии после одного курса гормональной терапии. Сочетание саркоидоза органов дыхания с поражением кожи по типу ознобленной волчанки, периферических или забрюшинных лимфоузлов сопровождалось хроническим, рецидивирующим течением, повторными курсами гормональной или цитостатической терапии. Исследователи из Курска (А.Ю. Черников, О.Ю. Борова) констатировали, что у женщин в возрасте 36–55 лет отмечено более неблагоприятное течение саркоидоза, чем у женщин в возрасте 21–35 и 56–70 лет, что, по-видимому, было связано с гормональной перестройкой женского организма на фоне климактерического периода. Курские фтизиатры и дерматологи (А.Ю. Черников, Т.П. Исаенко) проанализировали 300 пациентов с гистологически подтвержденным саркоидозом и установили, что у 63 пациентов (21%) была узловатая эритема, которая не является проявлением саркоидоза кожи. Саркоидоз кожи был выявлен только у 5 пациентов (1,6%). Авторы отметили, что кожные поражения являются редким проявлением саркоидоза, однако их наличие представляет сложную терапевтическую задачу для специалиста и отражает склонность к хроническому течению процесса у пациента.
Курские фтизиатры и дерматологи (А.Ю. Черников, Т.П. Исаенко) проанализировали 300 пациентов с гистологически подтвержденным саркоидозом и установили, что у 63 пациентов (21%) была узловатая эритема, которая не является проявлением саркоидоза кожи. Саркоидоз кожи был выявлен только у 5 пациентов (1,6%). Авторы отметили, что кожные поражения являются редким проявлением саркоидоза, однако их наличие представляет сложную терапевтическую задачу для специалиста и отражает склонность к хроническому течению процесса у пациента.
Ряд работ был посвящен инвазивной диагностике саркоидоза. Пульмонологи из Санкт-Петер-бурга (О.П. Баранова и соавт.) проанализировали 123 результата биопсии и сопоставили их с клиническими диагнозами. Материал для гистологического исследования был получен чаще – при биопсии легких, реже – при биопсии слизистой бронхов, лимфатических узлов средостения (или периферических). Помимо обычных гистологических окрасок гематоксилином-эозином, пикрофуксином по Ван-Гизону, проводилось иммуногистохимическое исследование (ИГХ). В пяти случаях установлено сочетание саркоидоза с различными заболеваниями соединительной ткани и у одного пациента выявлено течение прогрессирующего саркоидоза на фоне хронического персистирующего гепатита. У четырех больных была диагностирована профпатология, в четырех случаях был установлен экзогенный аллергический альвеолит. У двух человек изменения в легких развились на фоне лечения гепатита С интерфероном. С помощью ИГХ исследования у двух больных было установлено лимфопролиферативное заболевание, у двух – туберкулез, сочетавшийся с токсико-аллергическим альвеолитом. У пациентки со смешанным заболеванием соединительной ткани в ткани легких были выявлены гранулемы, сформированные без гигантских клеток Пирогова-Лангханса. Был сделан предельно важный вывод о том, что гистологическое исследование необходимо, но ведущая роль в установлении клинического диагноза саркоидоза при обнаружении эпителиоидно-клеточных гранулем в биопсийном материале отводится клиницисту.
В пяти случаях установлено сочетание саркоидоза с различными заболеваниями соединительной ткани и у одного пациента выявлено течение прогрессирующего саркоидоза на фоне хронического персистирующего гепатита. У четырех больных была диагностирована профпатология, в четырех случаях был установлен экзогенный аллергический альвеолит. У двух человек изменения в легких развились на фоне лечения гепатита С интерфероном. С помощью ИГХ исследования у двух больных было установлено лимфопролиферативное заболевание, у двух – туберкулез, сочетавшийся с токсико-аллергическим альвеолитом. У пациентки со смешанным заболеванием соединительной ткани в ткани легких были выявлены гранулемы, сформированные без гигантских клеток Пирогова-Лангханса. Был сделан предельно важный вывод о том, что гистологическое исследование необходимо, но ведущая роль в установлении клинического диагноза саркоидоза при обнаружении эпителиоидно-клеточных гранулем в биопсийном материале отводится клиницисту.
Созвучны этим данным результаты анализа 110 больных, прошедших диагностические операции в Республиканском клиническом онкологическом диспансере Мин-здрава Татарстана в связи с выявлением на рентгенотомограммах изменений, требующих дифференциальной диагностики с опухолями средостения и легких (А. В. Потанин и соавт.). Заключительные диагнозы были следующими: у 87 пациентов (79,1%) был диагностирован саркоидоз, у 19 (17,3%) – лимфома, у 2 (1,8%) – тимома, у 1 (0,9%) – киста средостения и у 1 (0,9%) – туберкулез.
В. Потанин и соавт.). Заключительные диагнозы были следующими: у 87 пациентов (79,1%) был диагностирован саркоидоз, у 19 (17,3%) – лимфома, у 2 (1,8%) – тимома, у 1 (0,9%) – киста средостения и у 1 (0,9%) – туберкулез.
О.П. Баранова и соавт. из НИИ пульмонологии СПбГМУ им. академика И.П. Павлова провели микробиологическое исследование бронхиального содержимого с использованием количественного метода (смывы из бронхов и жидкость бронхоальвеолярного лаважа) и установили очень низкий уровень пневмотропных патогенных микроорганизмов (0,15). Группа исследователей из Казани (А.А. Визель и соавт.) проанализировали состояние внешнего дыхания у 329 вновь выявленных больных саркоидозом, подтвержденным гистологическими исследованиями. Авторы отметили, что только IV стадия легочного саркоидоза, синдром Лефгрена и курение были факторами, достоверно влиявшими на параметры спирограммы.
Три работы были посвящены прогнозу течения саркоидоза. Д.Н. Бойко и соавт. (Украина) установили, что интерлейкины-1, -8, -10 и фактор некроза опухоли-α сыворотки крови оказались наиболее диагностически ценными в плане прогнозирования течения саркоидоза. Эти параметры также отличались при сравнении с больными, которые регулярно получали кортикостероидную терапию в течение 6 месяцев. А.Ю. Черников и О.Ю. Боброва (Курск) на основании анализа 30 амбулаторных карт пациентов с многократно рецидивирующим течением саркоидоза органов дыхания, выявленных с 1996 по 2004 г., заключили, что многолетняя непрерывная глюкокортикостероидная терапия имеет преимущество над прерывистой по уровню контроля над клинической симптоматикой. Однако она значительно чаще приводит к развитию серьезных осложнений и не оказывает влияния на снижение частоты необратимых последствий саркоидоза. И.Ю. Визель и соавт. (Казань) изучили в течение года состояние 188 больных с гистологически подтвержденным саркоидозом и констатировали, что при синдроме Лефгрена положительная динамика была отмечена у 69% больных, тогда как без него – у 46,9% (p 0,05). Применение противотуберкулезных препаратов сопровождалось улучшением рентгенологической картины в 28,3%, а при отсутствии их применения – у 57% (p 0,01).
Эти параметры также отличались при сравнении с больными, которые регулярно получали кортикостероидную терапию в течение 6 месяцев. А.Ю. Черников и О.Ю. Боброва (Курск) на основании анализа 30 амбулаторных карт пациентов с многократно рецидивирующим течением саркоидоза органов дыхания, выявленных с 1996 по 2004 г., заключили, что многолетняя непрерывная глюкокортикостероидная терапия имеет преимущество над прерывистой по уровню контроля над клинической симптоматикой. Однако она значительно чаще приводит к развитию серьезных осложнений и не оказывает влияния на снижение частоты необратимых последствий саркоидоза. И.Ю. Визель и соавт. (Казань) изучили в течение года состояние 188 больных с гистологически подтвержденным саркоидозом и констатировали, что при синдроме Лефгрена положительная динамика была отмечена у 69% больных, тогда как без него – у 46,9% (p 0,05). Применение противотуберкулезных препаратов сопровождалось улучшением рентгенологической картины в 28,3%, а при отсутствии их применения – у 57% (p 0,01). Применение только системных ГКС сопровождалось улучшением в 50% случаев, а без лечения (только витамин Е) – 34,6%. Среди же получавших только пентоксифиллин улучшение рентгенологической картины произошло в 61,7%. Среди больных, которым был назначен метотрексат, улучшение наступило в 88,9% случаев, тогда как у остальных – в 48,3%. Был сделан вывод о том, что в течение первого года наблюдения наибольшая частота улучшения рентгенологической картины у больных саркоидозом была обсусловлена анти-TNF препаратами – пентоксифиллином и метотрексатом.
Применение только системных ГКС сопровождалось улучшением в 50% случаев, а без лечения (только витамин Е) – 34,6%. Среди же получавших только пентоксифиллин улучшение рентгенологической картины произошло в 61,7%. Среди больных, которым был назначен метотрексат, улучшение наступило в 88,9% случаев, тогда как у остальных – в 48,3%. Был сделан вывод о том, что в течение первого года наблюдения наибольшая частота улучшения рентгенологической картины у больных саркоидозом была обсусловлена анти-TNF препаратами – пентоксифиллином и метотрексатом.
Таким образом, саркоидоз был и остается объектом исследований пульмонологов, дискуссий на симпозиумах, однако этиология заболевания и строго обоснованные протоколы лечения пока не определены.
— ГБУ «КОКБ» Курганская областная клиническая больница — Официальный сайт
20 тысяч пациентов
ежегодно доверяют нам заботу о своем здоровье и проходят лечение в стационаре
10 тысяч операций
ежегодно выполняется в КОКБ, многие из которых уникальны
600 пациентов в день
обращаются в областную консультативную поликлинику, прием
проводится по 25 специальностям
1251 сотрудников
сегодня работает в КОКБ, в том числе 188 врачей и 534 средних медицинских работников
6
докторов
медицинских наук
18 кандидатов медицинских наук, 8 заслуженных врачей РФ трудятся сегодня к КОКБ
72,9% врачей
имеют высшую и первую категорию
6 корпусов
больничный городок состоит из 6 корпусов, хозяйственных служб
19
специализированных
отделений
в состав больницы входят 19 отделений на 516 коек
4
сертифицированные
лаборатории
Все виды анализов с использованием современного оборудования
1865
электронных
листков нетрудоспособности
выдано за 2019 год
3 врача
ГБУ «КОКБ» в 2019 году удостоились награды «Лучший врач года»
24 врача
ГБУ «КОКБ» являются главными внештатными специалистами Департамента здравоохранения Курганской области
Публикации в СМИ
Синдром Шёгрена (СШ) — системное аутоиммунное заболевание, характеризующееся развитием аутоиммунной экзокринопатии, что приводит к возникновению ксеростомии и ксерофтальмии, сухости слизистых оболочек носа, гортани, трахеи, бронхов, женских половых органов, атрофическому гастриту. Статистические данные. Распространённость: 0,6–3,0% в общей популяции. Преобладающий возраст — старше 30 лет. Преобладающий пол — женский (10–25:1).
Статистические данные. Распространённость: 0,6–3,0% в общей популяции. Преобладающий возраст — старше 30 лет. Преобладающий пол — женский (10–25:1).
Этиология и генетические особенности • Одним из этиологических факторов считают хроническую вирусную инфекцию (ЦМВ, вирус Эпстайна–Барр, ретровирусная HTLV-1, HCV). У больных ВИЧ-инфекцией развивается лимфоцитарный сиаладенит, лимфоцитарная интерстициальная пневмония, напоминающие СШ. Обнаруживают ассоциацию с HLA B8, HLA Dw3, HLA DR3, HLA DRw52, аллелью DQA1*0501.
Патогенез. Хроническая вирусная инфекция индуцирует активацию Т- и В-лимфоцитов. В ходе активации CD4+-лимфоцитов синтезируются цитокины (ИЛ-1, ИЛ-6, g-ИФН, ФНО-a), индуцирующие экспрессию Аг главного комплекса гистосовместимости класса II на эпителиальных клетках слюнных и слёзных желёз. Это приводит к Аг-специфической активации лимфоцитов и развитию аутоиммунных реакций против экзокринных желёз. Активированные В-лимфоциты синтезируют
Активированные В-лимфоциты синтезируют g-глобулины в больших количествах. Активация В-лимфоцитов проходит три стадии: поликлональную (клинически проявляется экзокринопатией), поли-олиго-моноклональную (выявляют клинические системные проявления), моноклональную (клинически выявляют лимфомы).
Классификация. Различают первичный CШ, не ассоциируемый с другими ревматическими заболеваниями, и вторичный СШ, возникающий на фоне ревматоидного артрита, СКВ, полимиозита/дерматомиозита, хронического активного гепатита, билиарного цирроза печени, саркоидоза и в рамках СПИД.
Клиническая картина
• Поражение экзокринных желёз •• Сухой кератоконъюнктивит: зуд, жжение, резь в глазах, при присоединении инфекции — язвы и перфорации роговицы •• Сиаладенит: сухость во рту, хронический паренхиматозный паротит, на поздних стадиях — прогрессирующий пришеечный кариес, затруднения при глотании пищи •• Хронический панкреатит •• Сухость слизистых оболочек носа, глотки, гортани, трахеи, половых органов, кожи •• Поражение ЖКТ: хронический атрофический гастрит с секреторной недостаточностью, поражение двенадцатиперстной кишки с возникновением гипомоторной дискинезии, поражение толстой кишки с появлением болезненности при её пальпации и развитии запоров у больного.
• Системные проявления •• Поражение суставов: артралгии, рецидивирующий неэрозивный артрит мелких суставов с развитием деформаций (анкилозы не характерны) •• Поражение мышц: миалгии, миозит •• Поражение лимфатической системы: регионарная лимфаденопатия, генерализованная лимфаденопатия, лимфопролиферативные заболевания (лимфома, макроглобулинемия Вальденстрёма). Клиническое развитие последних можно заподозрить при стойком и значительном увеличении околоушных слюнных желёз, генерализованной лимфаденопатии и спленомегалии •• Поражение лёгких: интерстициальная пневмония, интерстициальный лёгочный фиброз, плеврит •• Поражение почек: почечный ацидоз, аминоацидурия и фосфатурия с развитием нефрогенного диабета, хронический интерстициальный нефрит (гломерулонефрит возникает редко, чаще у пациентов с криоглобулинемией), амилоидоз •• Феномен Рейно •• Васкулит (5–10%) •• Поражение кожи: гипергаммаглобулинемическая или криоглобулинемическая пурпура, хроническая крапивница, кожные язвы •• Поражение нервной системы: множественный мононеврит, асептический менингит, эпилептические припадки, поражения ЦНС, напоминающие рассеянный склероз •• Тиреоидит с гипо- или гиперфункцией щитовидной железы.
Особенности ВИЧ-ассоциированного СШ • Частое поражение мужчин • Ассоциация с HLA-DR5 • Низкая частота ксерофтальмии • Лимфоцитарный гепатит, гастрит, нефрит, интерстициальная пневмония, асептический менингит.
Лабораторные данные
• ОАК: увеличение СОЭ, лейкопения. Возможна гемолитическая анемия. Тромбоцитопения не характерна; при её обнаружении следует провести пункцию костного мозга для исключения миелодиспластических реакций, лимфомы, лекарственной миелодепрессии • Гипергаммаглобулинемия • Смешанная моноклональная криоглобулинемия II типа • При исследовании АНАТ методом непрямой иммунофлюоресценции выявляют периферический (соответствующий наличию АТ к ДНК) или крапчатый (соответствующий наличию АТ к рибонуклеопротеинам) типы свечения • С помощью иммуноферментных методов выявляют АТ к Ro-La и к органоспецифическим Аг париетальных клеток желудка, щитовидной железы, гладкой мускулатуры • Наличие РФ (95%) в высоком титре • Увеличение концентрации СРБ не типично • ОАМ: протеинурия (редко) • Обнаружение в моче лёгких цепей моноклональных иммуноглобулинов (при СШ с системными проявлениями).
Инструментальные данные
• Сухой кератоконъюнктивит •• Тест Ширмера: снижение слёзоотделения (менее 10 мм за 5 мин). Тест позволяет оценить количество слёз, выделяемых за 5 мин после раздражения полоской промокательной бумаги, заложенной за нижнее веко. Показателем служит длина полоски, смоченной слезами (норма — 15 мм у молодых, 10 мм у пожилых) •• Окрашивание эпителия конъюнктивы и роговицы бенгальским розовым и флюоресцеином. Тест с использованием бенгальского розового красителя высокоспецифичен и информативен. При СШ бенгальский розовый окрашивает точечные эрозии конъюнктивы и участки отслоившегося эпителия.
• Паренхиматозный паротит •• Сиалография: обнаружение полостей диаметром не менее 1 мм •• Снижение секреторной активности слюнной железы при стимуляции аскорбиновой кислотой — менее 2,5 мл за 5 мин •• Биопсия слюнных желёз нижней губы: лимфоплазмоклеточная инфильтрация (более 1 очага, состоящего из более чем 50 лимфоцитов).
Диагностическая тактика (Vitali C. et al., 1993)
et al., 1993)
• Офтальмологические симптомы •• Сухость в глазах в течение последних 3 мес и более •• Ощущение песка в глазах •• Использование препарата искусственная слеза более 3 р/сут.
• Стоматологические симптомы •• Ощущение сухости во рту в течение последних 3 мес и более •• Рецидивирующий или персистирующий отёк слюнных желёз в зрелом возрасте •• Необходимость запивания сухой пищи жидкостью.
• Офтальмологические проявления. Объективные признаки поражения глаз, установленные на основании одного из 2 тестов •• Тест Ширмера: увлажнение полоски бумаги менее 5 мм в течение 5 мин •• Счёт при окраске бенгальским розовым >4 по системе Bijsterveld.
• Гистопатологические признаки: в биоптате малых слюнных желёз определяют более 1 конгломерата мононуклеарных клеток в железистой ткани объёмом 4 мм3.
• Объективные признаки поражения слюнных желёз, установленные с помощью сцинтиграфии, сиалографии или сиалометрии (нестимулированный ток слюны составляет <1,5 мм в течение 15 мин).
• Аутоантитела. Наличие по крайней мере одного из следующих типов АТ •• АТ к Ro/SS-A или La/SS-B •• АНАТ •• РФ.
Диагноз считают достоверным при наличии 4 из 6 выше перечисленных критериев. Чувствительность — 93,5%, специфичность — 94%.
Критерии исключения диагноза СШ: предсуществующая лимфома, СПИД, саркоидоз, реакция «трансплантат против хозяина».
Дифференциальная диагностика. Идентификация клинической картины СШ ставит вопрос, первичный это синдром или вторичный. Следует помнить, что кроме системных заболеваний соединительной ткани, СШ может развиваться в рамках саркоидоза или СПИДа. Важен поиск АТ к ВИЧ. При саркоидозе на рентгенограмме лёгких — характерные изменения прикорневых лимфатических узлов.
ЛЕЧЕНИЕ
Общая тактика. Сочетание системного назначения иммунодепрессивных препаратов и местной заместительной терапии.
Лекарственное лечение • Начальная стадия заболевания при отсутствии признаков системного поражения •• Преднизолон 10–15 мг/сут с постепенным снижением дозы через 2–3 нед до поддерживающей 5–10 мг/сут •• Гидроксихлорохин 0,4 г/сут, хлорохин 0,25 г/сут • При выраженных проявлениях поражения экзокринных желёз при отсутствии системных проявлений •• Преднизолон 10–15 мг/сут, затем переход на поддерживающую дозу 5–10 мг/сут •• Хлорамбуцил 4–6 мг/сут с переходом на поддерживающую дозу 2–4 мг/сут • Системные проявления (лёгочный фиброз, криоглобулинемический васкулит) •• Пульс-терапия метилпреднизолоном и циклофосфамидом (подробно см. Волчанка системная красная), затем — длительная терапия преднизолоном и хлорамбуцилом. При лечении цитостатиками необходимо регулярное проведение общих анализов крови, мочи, функциональных проб печени. При сопутствующей ВИЧ-инфекции цитостатики противопоказаны •• При криоглобулинемии — плазмаферез • Офтальмологические проявления •• Местно 0,5% р-р метилцеллюлозы •• Лечебные контактные линзы •• Для профилактики вторичной инфекции — промывание глаз р-рами нитрофурала, цитрали с рибофлавином • Стоматологические проявления •• Новокаиновые блокады околоушных слюнных желёз •• Введение в протоки слюнных желёз антибиотиков •• Аппликации 30% р-ра диметил сульфоксида на область околоушных и подчелюстных слюнных желёз — 20 сеансов по 25–30 мин.
Волчанка системная красная), затем — длительная терапия преднизолоном и хлорамбуцилом. При лечении цитостатиками необходимо регулярное проведение общих анализов крови, мочи, функциональных проб печени. При сопутствующей ВИЧ-инфекции цитостатики противопоказаны •• При криоглобулинемии — плазмаферез • Офтальмологические проявления •• Местно 0,5% р-р метилцеллюлозы •• Лечебные контактные линзы •• Для профилактики вторичной инфекции — промывание глаз р-рами нитрофурала, цитрали с рибофлавином • Стоматологические проявления •• Новокаиновые блокады околоушных слюнных желёз •• Введение в протоки слюнных желёз антибиотиков •• Аппликации 30% р-ра диметил сульфоксида на область околоушных и подчелюстных слюнных желёз — 20 сеансов по 25–30 мин.
Осложнения • Лимфомы • Изъязвления роговицы • Язвы конечностей при развитии васкулита.
Прогноз. Жизненный прогноз в целом благоприятный. Прогноз ухудшается при развитии лёгочного фиброза, криоглобулинемии и, особенно, лимфопролиферативных заболеваний.
Синонимы • Сухой синдром • Ксеродерматоз • Синдром Предтеченского–Гужеро–Шёгрена • Синдром Гужеро–Шёгрена.
Сокращение. СШ — синдром Шёгрена.
МКБ-10. M35.0 Сухой синдром [Шёгрена].
Frontiers | Унаследованные иммунодефициты с высокой предрасположенностью к лимфопролиферативным заболеваниям, вызванным вирусом Эпштейна – Барра
Вирус Эпштейна-Барра (EBV) — это вирус семейства гамма-герпеса, который инфицирует большинство людей с выраженным тропизмом к В-лимфоцитам. EBV — это онкогенный вирус, который, как известно, является возбудителем нескольких типов новообразований, включая B-, T- и NK-клеточные лимфомы, карциномы носоглотки и желудка, а также опухоли гладких мышц, связанные с вирусом Эпштейна – Барра (EBV-SMT).110 000–200 000 случаев рака в год во всем мире связаны с EBV (1).
Резервуар ВЭБ строго человеческий. После 35 лет заболеваемость инфекцией среди населения в целом составляет более 90%. Первичная инфекция происходит в ротоглотке, где вирионы EBV инфицируют эпителиальные клетки и В-лимфоциты через молекулу CD21. Во время первичной инфекции ВЭБ стимулирует активацию и рост латентно инфицированных В-лимфобластов (2, 3). Эти пролиферирующие B-клетки экспрессируют гены, трансформирующие латентный рост EBV, которые обеспечивают персистентность EBV (программа с латентным периодом III) и в основном устраняются специфическими CD8 + T-клетками, которые сильно разрастаются во время иммунного ответа.Врожденные цитотоксические лимфоциты, такие как NK-клетки, γδ Т-клетки и iNKT-клетки, особенно ранние дифференцированные KIR-отрицательные NK-клетки и Vγ9Vδ2-T-клетки, также, как полагают, играют важную роль на ранней фазе первичной инфекции путем распознавания литически и латентно EBV-реплицирующие клетки соответственно (2, 4, 5). Некоторые В-клетки, инфицированные ВЭБ, ускользают от иммунного ответа за счет подавления экспрессии латентных генов (программа с латентностью 0) и приобретают фенотип памяти, становясь невидимыми для иммунной системы и создавая резервуар для ВЭБ.
Первичная инфекция происходит в ротоглотке, где вирионы EBV инфицируют эпителиальные клетки и В-лимфоциты через молекулу CD21. Во время первичной инфекции ВЭБ стимулирует активацию и рост латентно инфицированных В-лимфобластов (2, 3). Эти пролиферирующие B-клетки экспрессируют гены, трансформирующие латентный рост EBV, которые обеспечивают персистентность EBV (программа с латентным периодом III) и в основном устраняются специфическими CD8 + T-клетками, которые сильно разрастаются во время иммунного ответа.Врожденные цитотоксические лимфоциты, такие как NK-клетки, γδ Т-клетки и iNKT-клетки, особенно ранние дифференцированные KIR-отрицательные NK-клетки и Vγ9Vδ2-T-клетки, также, как полагают, играют важную роль на ранней фазе первичной инфекции путем распознавания литически и латентно EBV-реплицирующие клетки соответственно (2, 4, 5). Некоторые В-клетки, инфицированные ВЭБ, ускользают от иммунного ответа за счет подавления экспрессии латентных генов (программа с латентностью 0) и приобретают фенотип памяти, становясь невидимыми для иммунной системы и создавая резервуар для ВЭБ. Последующая стимуляция этих ВЭБ-содержащих «резервуарных» В-клеток памяти приведет к реактивации ВЭБ из латентного периода в литический цикл, тем самым способствуя инфицированию новых В-клеток и их размножению. В конечном итоге лимфобласты, трансформированные EBV, могут привести к лимфоме. В некоторых очень редких случаях EBV может также инфицировать Т-клетки и NK-клетки. Этот своеобразный профиль инфекции скорее наблюдается в азиатских и южноамериканских популяциях и связан с хронической виремией, инфильтрацией органов EBV-положительными лимфоцитами и опасными для жизни лимфопролиферативными расстройствами (LPD), включая гемофагоцитарный синдром и / или EBV-положительными. Лимфома Т / NK-клеток.Механизмы, лежащие в основе патогенеза этой инфекции, точно не известны, как и ее генетические детерминанты, которые считаются олигогенными или полигенными (6, 7). Эта необычная инфекция ВЭБ не рассматривается в этом обзоре.
Последующая стимуляция этих ВЭБ-содержащих «резервуарных» В-клеток памяти приведет к реактивации ВЭБ из латентного периода в литический цикл, тем самым способствуя инфицированию новых В-клеток и их размножению. В конечном итоге лимфобласты, трансформированные EBV, могут привести к лимфоме. В некоторых очень редких случаях EBV может также инфицировать Т-клетки и NK-клетки. Этот своеобразный профиль инфекции скорее наблюдается в азиатских и южноамериканских популяциях и связан с хронической виремией, инфильтрацией органов EBV-положительными лимфоцитами и опасными для жизни лимфопролиферативными расстройствами (LPD), включая гемофагоцитарный синдром и / или EBV-положительными. Лимфома Т / NK-клеток.Механизмы, лежащие в основе патогенеза этой инфекции, точно не известны, как и ее генетические детерминанты, которые считаются олигогенными или полигенными (6, 7). Эта необычная инфекция ВЭБ не рассматривается в этом обзоре.
Первый контакт с EBV обычно происходит в младенчестве и подростковом возрасте путем оральной передачи и в большинстве случаев протекает бессимптомно. Однако у некоторых иммунокомпетентных людей, особенно в подростковом возрасте, первичная инфекция вызывает инфекционный мононуклеоз (ИМ), самоизлечивающееся лимфопролиферативное заболевание, которое клинически характеризуется лихорадкой, болью в горле, болями в теле, увеличением лимфатических узлов и общей усталостью (3).Лимфопролиферация состоит из устойчивой и устойчивой экспансии CD8 + Т-клеток и инфицированных В-клеток, отражающих сильный иммунный ответ на вирус. Примечательно, что CD8 + EBV-специфические Т-клетки могут составлять более 40% циркулирующих Т-клеток у некоторых субъектов (8).
Однако у некоторых иммунокомпетентных людей, особенно в подростковом возрасте, первичная инфекция вызывает инфекционный мононуклеоз (ИМ), самоизлечивающееся лимфопролиферативное заболевание, которое клинически характеризуется лихорадкой, болью в горле, болями в теле, увеличением лимфатических узлов и общей усталостью (3).Лимфопролиферация состоит из устойчивой и устойчивой экспансии CD8 + Т-клеток и инфицированных В-клеток, отражающих сильный иммунный ответ на вирус. Примечательно, что CD8 + EBV-специфические Т-клетки могут составлять более 40% циркулирующих Т-клеток у некоторых субъектов (8).
У лиц с ослабленным иммунитетом реактивация EBV и сохранение пролиферирующих латентных трансформирующих рост В-клеток, инфицированных EBV, связаны с тяжелыми патологиями, которые могут иметь летальный исход.К ним относятся гемофагоцитарный лимфогистиоцитоз (HLH), также называемый вирус-ассоциированным гемофагоцитарным синдромом, доброкачественные B-клеточные LPD и B-клеточные лимфомы, включая лимфомы Ходжкина и неходжкинские лимфомы, такие как лимфома Беркитта (лимфома Беркитта и диффузная крупноклеточная лимфома B-DL). ) (1). Такие нарушения, определяемые как посттрансплантационные лимфролиферативные расстройства, часто наблюдаются у пациентов с трансплантацией органов при иммуносупрессивном лечении. Точно так же ВИЧ-инфицированные пациенты с синдромом приобретенного иммунодефицита (СПИД) часто испытывают лимфопролиферативные нарушения, вызванные ВЭБ, которые представляют собой одну из наиболее частых причин смерти пациентов со СПИДом (9).Эти наблюдения подчеркивают, что реактивация EBV из латентно инфицированных EBV В-клеток часто происходит у нормальных людей на протяжении всей жизни и должна строго контролироваться адаптивным иммунным ответом.
) (1). Такие нарушения, определяемые как посттрансплантационные лимфролиферативные расстройства, часто наблюдаются у пациентов с трансплантацией органов при иммуносупрессивном лечении. Точно так же ВИЧ-инфицированные пациенты с синдромом приобретенного иммунодефицита (СПИД) часто испытывают лимфопролиферативные нарушения, вызванные ВЭБ, которые представляют собой одну из наиболее частых причин смерти пациентов со СПИДом (9).Эти наблюдения подчеркивают, что реактивация EBV из латентно инфицированных EBV В-клеток часто происходит у нормальных людей на протяжении всей жизни и должна строго контролироваться адаптивным иммунным ответом.
Помимо приобретенных форм, за последние 20 лет было выявлено несколько наследственных комбинированных иммунодефицитов (CID), ведущих к особой восприимчивости к EBV-инфекции и развитию EBV-обусловленных заболеваний (10–12). Эти генетические дефекты включают мутации в Sh3D1A, ITK, MAGT1, CTPS1, CD27, CD70, CORO1A и RASGRP1 (Таблица 1). В этих генетически детерминированных формах пенетрантность восприимчивости к ВЭБ высока, более чем у 50% пациентов имелся хотя бы один тяжелый эпизод ДПЗ, вызванный ВЭБ, включая лимфомы Ходжкина и неходжкинские лимфомы (Таблица 2). Тем не менее, ряд носителей этих дефектов генов могут также страдать от других тяжелых вирусных инфекций, вызванных CMV, VZV, HSV, HHV-6 или HPV. Это особенно верно в отношении дефицита CTPS1 и CORO1A, поскольку пациенты часто имели инфекции VZV и HPV соответственно.Бактериальные инфекции, в частности рецидивирующие легочные инфекции, отмечаются у ряда пациентов и могут быть начальной клинической картиной. Это может быть связано с гипогаммаглобулинемией и / или дисгаммаглобулинемией, связанной с низким количеством В-клеток памяти CD27 + , которые часто наблюдаются при этих дефектах. Эти фенотипы, вероятно, являются результатом или, как было доказано, являются результатом аномалий в Т-клеточной помощи В-клеткам из-за дефектов созревания и / или активации Т-хелперных клеток.
В этих генетически детерминированных формах пенетрантность восприимчивости к ВЭБ высока, более чем у 50% пациентов имелся хотя бы один тяжелый эпизод ДПЗ, вызванный ВЭБ, включая лимфомы Ходжкина и неходжкинские лимфомы (Таблица 2). Тем не менее, ряд носителей этих дефектов генов могут также страдать от других тяжелых вирусных инфекций, вызванных CMV, VZV, HSV, HHV-6 или HPV. Это особенно верно в отношении дефицита CTPS1 и CORO1A, поскольку пациенты часто имели инфекции VZV и HPV соответственно.Бактериальные инфекции, в частности рецидивирующие легочные инфекции, отмечаются у ряда пациентов и могут быть начальной клинической картиной. Это может быть связано с гипогаммаглобулинемией и / или дисгаммаглобулинемией, связанной с низким количеством В-клеток памяти CD27 + , которые часто наблюдаются при этих дефектах. Эти фенотипы, вероятно, являются результатом или, как было доказано, являются результатом аномалий в Т-клеточной помощи В-клеткам из-за дефектов созревания и / или активации Т-хелперных клеток. Внутренние дефекты в развитии и функции В-клеток также могут непосредственно способствовать гипо / дисгаммаглобулинемии, как в случае дефицита RASGRP1, CTPS1, CD27, для чего есть четкие доказательства того, что эти гены непосредственно участвуют в развитии и / или функционировании В-клеток. Однако эти дефекты B-клеток не влияют на способность EBV инфицировать B-клетки и его онкогенную активность. CD4 + Т-клеточная лимфопения и / или уменьшение наивных Т-клеток также является частым фенотипом, который можно рассматривать как иммунологический признак дефекта Т-клеток (13, 14).Также часто обнаруживается, что NK-клетки и iNKT-клетки уменьшены или отсутствуют. Наконец, некоторые из этих недостатков связаны с очень уникальными особенностями, независимо от высокого риска развития лимфопролифераций, вызванных ВЭБ, которые помогают в диагностике, таких как аутоиммунитет, воспалительное заболевание кишечника (ВЗК), поражение легких и неврологические расстройства, которые развиваются в Дефицит RASGRP1, XIAP-, ITK- и CORO1A соответственно (таблица 1).
Внутренние дефекты в развитии и функции В-клеток также могут непосредственно способствовать гипо / дисгаммаглобулинемии, как в случае дефицита RASGRP1, CTPS1, CD27, для чего есть четкие доказательства того, что эти гены непосредственно участвуют в развитии и / или функционировании В-клеток. Однако эти дефекты B-клеток не влияют на способность EBV инфицировать B-клетки и его онкогенную активность. CD4 + Т-клеточная лимфопения и / или уменьшение наивных Т-клеток также является частым фенотипом, который можно рассматривать как иммунологический признак дефекта Т-клеток (13, 14).Также часто обнаруживается, что NK-клетки и iNKT-клетки уменьшены или отсутствуют. Наконец, некоторые из этих недостатков связаны с очень уникальными особенностями, независимо от высокого риска развития лимфопролифераций, вызванных ВЭБ, которые помогают в диагностике, таких как аутоиммунитет, воспалительное заболевание кишечника (ВЗК), поражение легких и неврологические расстройства, которые развиваются в Дефицит RASGRP1, XIAP-, ITK- и CORO1A соответственно (таблица 1).
Таблица 1 . Подтипы лимфомы при первичных иммунодефицитах, связанных с высокой предрасположенностью к развитию лимфопролиферативных заболеваний, вызванных ВЭБ.
Таблица 2 . Подтипы лимфомы при первичных иммунодефицитах, связанных с высокой предрасположенностью к развитию лимфопролиферативных заболеваний, вызванных ВЭБ.
За последние два десятилетия эти унаследованные дефекты представляли собой очень уникальный в моделях natura для расшифровки иммунного ответа на EBV. Молекулярная и генетическая характеристика этих расстройств и их исследование выявили несколько неожиданных и новых путей, необходимых для эффективного иммунитета к EBV, но в более общем плане участвующих в иммунном надзоре за раком В-лимфоцитов и адаптивных иммунных ответах.
Дефицит Sh3D1A / SLAM-ассоциированного белка (SAP)
Дефицит Sh3D1A / SAP (также известный как Х-связанный лимфопролиферативный синдром типа 1-XLP-1 или синдром Пуртило) вызывается гемизиготными мутациями в гене, сцепленном с Х-хромосомой Sh3D1A (15–19). Сообщалось о более чем 100 пациентах с гемизиготными вредными мутациями в Sh3D1A , но если рассматривать литературу до открытия гена, это, вероятно, более 200 случаев (20–22). Клиническими особенностями XLP-1 являются фульминантный или тяжелый мононуклеоз, вызванный EBV, со всеми клиническими признаками HLH, включая фульминантный гепатит, некроз печени, гипоплазию костного мозга, неврологические нарушения в 20-30% случаев, гипогаммаглобулинемию (50%) и B. -клеточная лимфома (25–30%), часто имеющая абдоминальную локализацию.Также можно наблюдать несколько других редких фенотипов, таких как васкулит (2–5%), апластическая анемия (2–5%) и хронический гастрит (18, 23–26). Все фенотипы могут возникать независимо, а некоторые развиваются без каких-либо признаков EBV-инфекции (10–20%) или до EBV-инфекции, например, HLH, гипогаммаглобулинемия, лимфома, апластическая анемия и васкулит (24–26). Сообщалось также о некоторых редких случаях Т-клеточной лимфомы (23, 27). Однако у значительной части пациентов первоначально имелся комбинированный вариабельный иммунодефицит (CVID), связанный с тяжелыми рецидивирующими бактериальными инфекциями, включая диссеминированный аспергиллез и E.
Сообщалось о более чем 100 пациентах с гемизиготными вредными мутациями в Sh3D1A , но если рассматривать литературу до открытия гена, это, вероятно, более 200 случаев (20–22). Клиническими особенностями XLP-1 являются фульминантный или тяжелый мононуклеоз, вызванный EBV, со всеми клиническими признаками HLH, включая фульминантный гепатит, некроз печени, гипоплазию костного мозга, неврологические нарушения в 20-30% случаев, гипогаммаглобулинемию (50%) и B. -клеточная лимфома (25–30%), часто имеющая абдоминальную локализацию.Также можно наблюдать несколько других редких фенотипов, таких как васкулит (2–5%), апластическая анемия (2–5%) и хронический гастрит (18, 23–26). Все фенотипы могут возникать независимо, а некоторые развиваются без каких-либо признаков EBV-инфекции (10–20%) или до EBV-инфекции, например, HLH, гипогаммаглобулинемия, лимфома, апластическая анемия и васкулит (24–26). Сообщалось также о некоторых редких случаях Т-клеточной лимфомы (23, 27). Однако у значительной части пациентов первоначально имелся комбинированный вариабельный иммунодефицит (CVID), связанный с тяжелыми рецидивирующими бактериальными инфекциями, включая диссеминированный аспергиллез и E. coli сепсис (28–31). В недавней литературе было зарегистрировано только пять случаев других тяжелых вирусных инфекций, вызываемых HHV-6, HHV-7, LCMV или HLH без триггера EBV (22, 26, 32, 33). Это подчеркивает, что SAP играет уникальную роль в иммунитете к EBV, когда он не требуется при других вирусных инфекциях, за исключением очень редких случаев.
coli сепсис (28–31). В недавней литературе было зарегистрировано только пять случаев других тяжелых вирусных инфекций, вызываемых HHV-6, HHV-7, LCMV или HLH без триггера EBV (22, 26, 32, 33). Это подчеркивает, что SAP играет уникальную роль в иммунитете к EBV, когда он не требуется при других вирусных инфекциях, за исключением очень редких случаев.
Sh3D1A кодирует небольшой адаптерный белок из 128 аминокислот, названный SAP, однозначно экспрессируемый в Т- и NK-клетках. SAP состоит только из уникального домена Sh3, который специфически связывается с внутрицитоплазматическим доменом рецепторов семейства SLAM (SLAMF), которые являются самолигандами и участвуют в гомотипических межклеточных взаимодействиях, за исключением 2B4 (также известного как CD244). или SLAMF4), который связывает CD48 (34–36).С одной стороны, SAP функционирует как настоящий адаптерный белок благодаря своей способности рекрутировать тирозинкиназу FynT на рецепторы SLAMF, таким образом связывая их с нижестоящими сигнальными путями. С другой стороны, SAP действует также как белок-блокатор, ингибируя рекрутирование Sh3-содержащих фосфатаз в SLAMF (15, 35, 37-39). Ранние исследования документально подтвердили нарушения цитотоксичности NK-клеток в отношении EBV-инфицированных B-клеток у пациентов с XLP-1 (40, 41). Дальнейшие исследования показали, что эти дефекты связаны с двумя рецепторами SLAM, 2B4 и SLAMF6 (также известными как NTB-A или Ly108), которые обладают способностью запускать и активировать цитотоксичность NK- и CD8 + Т-клеток по отношению к В-клеткам, инфицированным EBV, или трансформированные В-клетки при нормальной экспрессии SAP (42–46).Известно, что B-клеточные лимфомы и EBV-инфицированные B-клетки экспрессируют высокие уровни лигандов для SLAMF-R, включая CD48, лиганд 2B4 (47). Эта экспрессия может сигнализировать об аномальных «опасных» пролиферирующих В-клетках NK-клеткам и Т-лимфоцитам. Следующие исследования продемонстрировали, что стимулирующая функция 2B4 и SLAMF6, которая зависит от FynT, не только теряется в отсутствие SAP, но также смещается в сторону ингибирования других стимулирующих путей цитотоксичности клеток в NK- и CD8 + T-клетках.
С другой стороны, SAP действует также как белок-блокатор, ингибируя рекрутирование Sh3-содержащих фосфатаз в SLAMF (15, 35, 37-39). Ранние исследования документально подтвердили нарушения цитотоксичности NK-клеток в отношении EBV-инфицированных B-клеток у пациентов с XLP-1 (40, 41). Дальнейшие исследования показали, что эти дефекты связаны с двумя рецепторами SLAM, 2B4 и SLAMF6 (также известными как NTB-A или Ly108), которые обладают способностью запускать и активировать цитотоксичность NK- и CD8 + Т-клеток по отношению к В-клеткам, инфицированным EBV, или трансформированные В-клетки при нормальной экспрессии SAP (42–46).Известно, что B-клеточные лимфомы и EBV-инфицированные B-клетки экспрессируют высокие уровни лигандов для SLAMF-R, включая CD48, лиганд 2B4 (47). Эта экспрессия может сигнализировать об аномальных «опасных» пролиферирующих В-клетках NK-клеткам и Т-лимфоцитам. Следующие исследования продемонстрировали, что стимулирующая функция 2B4 и SLAMF6, которая зависит от FynT, не только теряется в отсутствие SAP, но также смещается в сторону ингибирования других стимулирующих путей цитотоксичности клеток в NK- и CD8 + T-клетках. (43, 48, 49).Дополнительные данные на мышах показали, что этот ингибирующий эффект не зависит от FynT, но зависит от блокирующей активности SAP и приводит к уменьшению образования конъюгата между CD8 + T или NK-клетками и экспрессирующими SLAMF клетками-мишенями, такими как B-клетки (50, 51). В этом контексте другие пути активации цитотоксичности, такие как NKG2D, могут не компенсировать дефектную функцию 2B4 и SLAMF6. Ингибирующая активность 2B4 и SLAMF6 в отсутствие SAP может оказывать транс-ингибирующее действие на активирующие рецепторы (такие как рецепторы, активирующие NKG2D и / или клетки-киллеры) при совместном взаимодействии с цитотоксическим синапсом.
(43, 48, 49).Дополнительные данные на мышах показали, что этот ингибирующий эффект не зависит от FynT, но зависит от блокирующей активности SAP и приводит к уменьшению образования конъюгата между CD8 + T или NK-клетками и экспрессирующими SLAMF клетками-мишенями, такими как B-клетки (50, 51). В этом контексте другие пути активации цитотоксичности, такие как NKG2D, могут не компенсировать дефектную функцию 2B4 и SLAMF6. Ингибирующая активность 2B4 и SLAMF6 в отсутствие SAP может оказывать транс-ингибирующее действие на активирующие рецепторы (такие как рецепторы, активирующие NKG2D и / или клетки-киллеры) при совместном взаимодействии с цитотоксическим синапсом.
Важно отметить, что цитотоксичность NK-клеток и CD8 + T-клеток по отношению к другим APC или клеткам-мишеням, кроме B-клеток, включая негематопоэтические клетки или / и SLAMF-отрицательные клетки-мишени, была сохранена и даже увеличена для цитотоксичности NK-клеток (47 , 52, 53). Недавние исследования на мышах показывают, что эта чрезмерная цитотоксичность NK-клеток зависит от роли SAP и SLAMF6 в лицензировании / обучении NK-клеток (52). В отсутствие SAP повышается ответная реакция NK-клеток на SLAM-отрицательные клетки.У пациентов с XLP-1 была зарегистрирована повышенная цитотоксичность NK в отношении SLAMF-отрицательных клеток-мишеней K562 (54), связанная с повышенной CD16- и NKp46-зависимой цитотоксичностью (52). Таким образом, экстрагематопоэтические проявления, связанные с HLH, наблюдаемые у пациентов с XLP-1, такие как обширное повреждение печени, могут быть вызваны этой повышенной цитотоксичностью NK-клеток по отношению к негематопоэтическим клеткам.
В отсутствие SAP повышается ответная реакция NK-клеток на SLAM-отрицательные клетки.У пациентов с XLP-1 была зарегистрирована повышенная цитотоксичность NK в отношении SLAMF-отрицательных клеток-мишеней K562 (54), связанная с повышенной CD16- и NKp46-зависимой цитотоксичностью (52). Таким образом, экстрагематопоэтические проявления, связанные с HLH, наблюдаемые у пациентов с XLP-1, такие как обширное повреждение печени, могут быть вызваны этой повышенной цитотоксичностью NK-клеток по отношению к негематопоэтическим клеткам.
Помимо своей функции в отношении цитотоксичности T-клеток NK- и CD8 + , SAP также важен для ограничения роста CD8 + T-клеток.SAP-дефицитные Т-клетки как у мышей, так и у человека демонстрируют повышенную выживаемость из-за нарушения гибели клеток, вызванной активацией (AICD), важный путь заключается в сокращении пула Ag-специфичных Т-клеток во время иммунных ответов (55, 56) . Положительная роль SAP в отношении AICD зависит от SLAMF6, который передает сигналы для экспрессии проапоптотических молекул Bim и FasL (55). Вместе эти отдельные дефекты, безусловно, способствуют неспособности ВЭБ-специфических Т-клеток элиминировать В-клетки, инфицированные ВЭБ, и их неконтролируемой экспансии и активности во время первичной инфекции, ведущей к молниеносному мононуклеозу или HLH.Тот факт, что у пациентов также часто развивается В-клеточная лимфома, не относящаяся к ВЭБ, свидетельствует о важной роли пути SLAM – SAP в иммунном надзоре за В-клетками.
Вместе эти отдельные дефекты, безусловно, способствуют неспособности ВЭБ-специфических Т-клеток элиминировать В-клетки, инфицированные ВЭБ, и их неконтролируемой экспансии и активности во время первичной инфекции, ведущей к молниеносному мононуклеозу или HLH.Тот факт, что у пациентов также часто развивается В-клеточная лимфома, не относящаяся к ВЭБ, свидетельствует о важной роли пути SLAM – SAP в иммунном надзоре за В-клетками.
Дефицит XIAP
Дефицит XIAP (также известный как Х-связанный лимфопролиферативный синдром типа 2 / XLP-2) вызван гемизиготными мутациями в гене XIAP , кодирующем Х-связанный ингибитор белка апоптоза XIAP (54, 57). XIAP представляет собой антиапоптотическую молекулу, входящую в состав ингибитора семейства белков апоптоза (IAP).XIAP является мощным ингибитором программной гибели клеток, но он также необходим для функции (NOD) -подобных рецепторов распознавания образов (NLR) NOD 1 и 2 и регуляции активности инфламмасом NLRP3 (58–61). В настоящее время зарегистрировано более 100 пациентов с дефицитом XIAP. Первоначально описанный в 2006 году в когорте пациентов с клиническим фенотипом, близким к фенотипу Sh3D1A-дефицитных пациентов (XLP-1), дефицит XIAP был далее обозначен как XLP-2, поскольку XIAP расположен в непосредственной близости от Sh3D1A на Х-хромосоме (57).Однако в течение последних 10 лет было накоплено множество наблюдений о том, что эти два заболевания различаются по многим аспектам, в частности, нет доказательств того, что они функционально связаны. Основными клиническими фенотипами дефицита XIAP являются предрасположенность к развитию HLH в контексте EBV-инфекции (36%), рецидивирующая спленомегалия, соответствующая минимальной форме HLH (57%), и IBD (26%) с особенностями Болезнь Крона (57, 62, 63). HLH часто менее серьезен, чем дефицит XLP-1 с очень редким неврологическим поражением (24).У некоторых пациентов также развились различные аутовоспалительные симптомы, такие как увеит, артрит, кожные абсцессы, узловатая эритема и нефрит (62, 63). Таким образом, сегодня, хотя восприимчивость к EBV остается одним из важных и серьезных клинических проявлений дефицита XIAP, более половины пациентов никогда не испытывали особой чувствительности к EBV (57, 62).
Первоначально описанный в 2006 году в когорте пациентов с клиническим фенотипом, близким к фенотипу Sh3D1A-дефицитных пациентов (XLP-1), дефицит XIAP был далее обозначен как XLP-2, поскольку XIAP расположен в непосредственной близости от Sh3D1A на Х-хромосоме (57).Однако в течение последних 10 лет было накоплено множество наблюдений о том, что эти два заболевания различаются по многим аспектам, в частности, нет доказательств того, что они функционально связаны. Основными клиническими фенотипами дефицита XIAP являются предрасположенность к развитию HLH в контексте EBV-инфекции (36%), рецидивирующая спленомегалия, соответствующая минимальной форме HLH (57%), и IBD (26%) с особенностями Болезнь Крона (57, 62, 63). HLH часто менее серьезен, чем дефицит XLP-1 с очень редким неврологическим поражением (24).У некоторых пациентов также развились различные аутовоспалительные симптомы, такие как увеит, артрит, кожные абсцессы, узловатая эритема и нефрит (62, 63). Таким образом, сегодня, хотя восприимчивость к EBV остается одним из важных и серьезных клинических проявлений дефицита XIAP, более половины пациентов никогда не испытывали особой чувствительности к EBV (57, 62). Пациенты с дефицитом XIAP также никогда не болеют лимфомой, в отличие от пациентов с дефицитом SAP, что, вероятно, связано с антиапоптотической функцией XIAP, которая может защитить пациентов от рака, и XIAP в настоящее время рассматривается как многообещающая терапевтическая мишень для лечения рака (64) .
Пациенты с дефицитом XIAP также никогда не болеют лимфомой, в отличие от пациентов с дефицитом SAP, что, вероятно, связано с антиапоптотической функцией XIAP, которая может защитить пациентов от рака, и XIAP в настоящее время рассматривается как многообещающая терапевтическая мишень для лечения рака (64) .
Т-лимфоцитов от пациентов с XLP-2 демонстрируют повышенный AICD в ответ на активацию Т-клеточного рецептора (TCR) и повышенный апоптоз при стимуляции FAS / CD95 и TRAIL-R (54). С другой стороны, моноциты пациентов демонстрировали нарушение продукции цитокинов и хемокинов (TNF-α, IL-10, IL-8 и MCP-1) при стимуляции лигандами NOD2 (63, 65). Хотя механизмы вызванного EBV HLH при дефиците XIAP остаются неясными, предполагается, что чрезмерное AICD может поставить под угрозу экспансию и пролиферацию активированных EBV-специфических Т-клеток, таких как дефицит CTPS1, CD27 или CD70 (см. Ниже) (58).В этих условиях накопление апоптотических клеток и персистенция В-клеток, инфицированных EBV, может привести к аномальному воспалению, усиленному нарушением регуляции инфламмасом и / или дефектной активацией популяций миелоидных клеток NOD1 / 2. Вместе с тем, Т-лимфоциты и миелоидные дефекты могут вносить вклад в ВЭБ-управляемый ГЛГ у пациентов с дефицитом XIAP.
Вместе с тем, Т-лимфоциты и миелоидные дефекты могут вносить вклад в ВЭБ-управляемый ГЛГ у пациентов с дефицитом XIAP.
Дефицит ITK
Дефицит ITK — это аутосомно-рецессивное заболевание, вызванное биаллельными мутациями в ITK . К настоящему времени в литературе описаны 13 пациентов из 8 семей (66–72).Все пациенты с EBV-ассоциированными рецидивирующими доброкачественными доброкачественными опухолями или злокачественными В-клеточными лимфопролиферациями, включая лимфому Ходжкина, наблюдались у пяти пациентов, а у одного из них развился EBV-SMT (69). Лимфопролиферация В-клеток часто локализуется в легких, и более чем у 50% также развиваются легочные инфекции. ITK (IL-2-индуцируемая тирозинкиназа) представляет собой хорошо охарактеризованную протеинтирозинкиназу семейства TEC / BTK, специфически экспрессируемую в Т-лимфоцитах и NK-клетках. ITK участвует в передаче сигналов TCR благодаря своей способности фосфорилировать и активировать PLC-γ1, ключевой фермент, который стимулирует потоки Ca ++ за счет выработки IP3, оба являются важными вторичными посредниками активации Т-клеток (73, 74) . ITK также участвует в передаче сигналов CXCR4 (75). Исследования на мышах продемонстрировали важность ITK для иммунитета, особенно в ответах Т-клеток CD4 + (73, 76). Недавний отчет показал, что ITK также необходим для эффективных CD8 + Т-клеточных ответов у мышей (77). В отсутствие ITK рост CD8 + Т-клеток и созревание в цитолитические эффекторные Т-клетки нарушается, что приводит к снижению цитотоксических ответов CD8 + Т-клеток. Было проведено очень мало исследований, чтобы охарактеризовать ITK-дефицитные Т-клетки от пациентов, хотя были получены и изучены производные Т-клеточные линии от ITK-дефицитных пациентов, показывающие снижение мобилизации Ca ++ (67).У одного пациента была зарегистрирована дефектная пролиферация Т-клеток в ответ на вовлечение TCR (69). Хотя точный механизм (ы), лежащий в основе предрасположенности к EBV при дефиците ITK, должен быть установлен, недавнее исследование CD8 + Т-клеток от мышей с дефицитом ITK (77) убедительно подтверждает это в Т-клетках от ITK-дефицитных пациентов, TCR сигналы активации нарушаются, что приводит к дефектному размножению и созреванию EBV-специфических CD8 + Т-клеток, как при дефиците CD70 и CD27 (см.
ITK также участвует в передаче сигналов CXCR4 (75). Исследования на мышах продемонстрировали важность ITK для иммунитета, особенно в ответах Т-клеток CD4 + (73, 76). Недавний отчет показал, что ITK также необходим для эффективных CD8 + Т-клеточных ответов у мышей (77). В отсутствие ITK рост CD8 + Т-клеток и созревание в цитолитические эффекторные Т-клетки нарушается, что приводит к снижению цитотоксических ответов CD8 + Т-клеток. Было проведено очень мало исследований, чтобы охарактеризовать ITK-дефицитные Т-клетки от пациентов, хотя были получены и изучены производные Т-клеточные линии от ITK-дефицитных пациентов, показывающие снижение мобилизации Ca ++ (67).У одного пациента была зарегистрирована дефектная пролиферация Т-клеток в ответ на вовлечение TCR (69). Хотя точный механизм (ы), лежащий в основе предрасположенности к EBV при дефиците ITK, должен быть установлен, недавнее исследование CD8 + Т-клеток от мышей с дефицитом ITK (77) убедительно подтверждает это в Т-клетках от ITK-дефицитных пациентов, TCR сигналы активации нарушаются, что приводит к дефектному размножению и созреванию EBV-специфических CD8 + Т-клеток, как при дефиците CD70 и CD27 (см. ниже).
ниже).
Дефицит MAGT1
Дефицит MAGT1, также называемый болезнью XMEN (для X-сцепленного иммунодефицита, дефекта магния, EBV-инфекции и синдрома неоплазии), вызывается гемизиготными мутациями в MAGT1 . На сегодняшний день выявлено 11 пациентов мужского пола с дефицитом MAGT1, и у всех развилась предрасположенность к EBV-инфекции с хронической виремией и B-клеточными лимфомами, включая Hodgkin и DLBCL (78–82). У одного пациента первоначальной клинической картиной была саркома Капоши, связанная с HHV-8 (80).Одной из особенностей этого заболевания является В-клеточный лимфоцитоз, связанный с лимфопенией CD4 (83). MAGT1 кодирует широко экспрессируемый трансмембранный транспортер Mg ++ , участвующий в поддержании свободных базальных внутриклеточных пулов Mg ++ . Однако MAGT1 также связывается с комплексом N -олигосахарилтрансферазы и, следовательно, может играть роль в N-гликозилировании белка (84). После открытия иммунодефицита MAGT1, MAGT1-зависимый приток Mg ++ был зарегистрирован в Т-клетках при включении TCR. Важно отметить, что эта мобилизация Mg ++ , как было показано, участвует в активации PLC-γ1 и последующем зависимом притоке Ca ++ (78). Примечательно, что все эти события были заметно нарушены в активированных MAGT1-дефицитных Т-клетках в ответ на TCR, но пролиферация Т-клеток считалась нормальной или сниженной (85). На основании этих данных было высказано предположение, что MAGT1 может быть необходим для активации PLC-γ1, возможно, воздействуя на ITK. В недавнем исследовании, что интересно, мобилизация Ca ++ была только умеренно снижена и задержана в Т-клетках пациента-носителя делеции, охватывающей MAGT1 (80).В соответствии с этим другой недавний отчет показал, что MAGT1-дефицитные Т-клетки от мышей демонстрируют нормальный приток кальция при активации TCR, в то время как приток кальция нарушается в B-клетках в ответ на стимуляцию BCR (86). Расхождения между этими недавними наблюдениями и более ранними исследованиями неизвестны. В любом случае было дополнительно показано, что MAGT1 необходим для экспрессии и функции NKG2D и его сигнального адаптера DAP10 (79).
Важно отметить, что эта мобилизация Mg ++ , как было показано, участвует в активации PLC-γ1 и последующем зависимом притоке Ca ++ (78). Примечательно, что все эти события были заметно нарушены в активированных MAGT1-дефицитных Т-клетках в ответ на TCR, но пролиферация Т-клеток считалась нормальной или сниженной (85). На основании этих данных было высказано предположение, что MAGT1 может быть необходим для активации PLC-γ1, возможно, воздействуя на ITK. В недавнем исследовании, что интересно, мобилизация Ca ++ была только умеренно снижена и задержана в Т-клетках пациента-носителя делеции, охватывающей MAGT1 (80).В соответствии с этим другой недавний отчет показал, что MAGT1-дефицитные Т-клетки от мышей демонстрируют нормальный приток кальция при активации TCR, в то время как приток кальция нарушается в B-клетках в ответ на стимуляцию BCR (86). Расхождения между этими недавними наблюдениями и более ранними исследованиями неизвестны. В любом случае было дополнительно показано, что MAGT1 необходим для экспрессии и функции NKG2D и его сигнального адаптера DAP10 (79). NKG2D представляет собой активирующий рецептор NK-клеток, экспрессируемый на NK-клетках, γδ T-клетках и CD8 + T-клетках, который распознает гомологичные белки MHC класса I, индуцированные клеточным стрессом в ответ на инфекцию или неоплазию.Важно отметить, что лиганды NKG2D активируются на EBV-инфицированных B-клетках и EBV-ассоциированных лимфопролиферациях (87, 88). В соответствии с дефектной экспрессией NKG2D, MAGT1-дефицитные CD8 + Т-клетки проявляли нарушенную цитотоксическую активность против аутологичных В-клеток, трансформированных EBV. Важно отметить, что добавка магния in vivo и in vitro восстанавливала базальную внутриклеточную концентрацию Mg ++ , экспрессию NKG2D, клеточную цитотоксичность и иммунитет к EBV у пациентов с дефицитом MAGT1 (79).Дефектное N-гликозилирование NKG2D, связанное с повышенным убиквитинилированием, приводящее к ускоренному обмену белков, может рассматриваться как основной механизм, объясняющий нарушение функции NKG2D.
NKG2D представляет собой активирующий рецептор NK-клеток, экспрессируемый на NK-клетках, γδ T-клетках и CD8 + T-клетках, который распознает гомологичные белки MHC класса I, индуцированные клеточным стрессом в ответ на инфекцию или неоплазию.Важно отметить, что лиганды NKG2D активируются на EBV-инфицированных B-клетках и EBV-ассоциированных лимфопролиферациях (87, 88). В соответствии с дефектной экспрессией NKG2D, MAGT1-дефицитные CD8 + Т-клетки проявляли нарушенную цитотоксическую активность против аутологичных В-клеток, трансформированных EBV. Важно отметить, что добавка магния in vivo и in vitro восстанавливала базальную внутриклеточную концентрацию Mg ++ , экспрессию NKG2D, клеточную цитотоксичность и иммунитет к EBV у пациентов с дефицитом MAGT1 (79).Дефектное N-гликозилирование NKG2D, связанное с повышенным убиквитинилированием, приводящее к ускоренному обмену белков, может рассматриваться как основной механизм, объясняющий нарушение функции NKG2D. Таким образом, эти наблюдения подчеркивают существенную роль пути NKG2D в иммунитете к EBV, хотя точная роль MAGT1 в передаче сигналов TCR еще предстоит выяснить.
Таким образом, эти наблюдения подчеркивают существенную роль пути NKG2D в иммунитете к EBV, хотя точная роль MAGT1 в передаче сигналов TCR еще предстоит выяснить.
CD27 Дефицит
Этот дефицит вызван биаллельными мутациями в CD27 , который кодирует белок, принадлежащий к суперсемейству рецепторов TNF (TNFSFR), также известный как TNFSFR7.На сегодняшний день зарегистрировано 18 пациентов, и у всех развились ДПЗ, связанные с ВЭБ, включая злокачественные пролиферации В-клеток, лимфому Ходжкина, В-лимфому, и у нескольких пациентов развился HLH, вызванный EBV (89–92). У некоторых пациентов также наблюдались воспалительные симптомы, такие как увеит и язвы во рту. CD27 связывается с CD70 (также называемым TNFSF7), членом лигандов надсемейства TNF. CD27 высоко экспрессируется Т-клетками, включая покоящиеся Т-клетки и небольшую часть В-клеток, соответствующих В-клеткам памяти (93–95).CD27 представляет собой костимуляторную молекулу активации Т-клеток, и было показано, что взаимодействия CD27-CD70 у мышей увеличивают выживаемость Т-клеток, эффекторные функции и рост Т-клеток памяти, в частности CD8 + Т-клеток во время анти- вирусные иммунные ответы (96, 97). Понимание механизма, лежащего в основе высокой предрасположенности к EBV при дефиците CD27, было недавно дано путем идентификации пациентов с дефицитом CD70 (см. Ниже).
Понимание механизма, лежащего в основе высокой предрасположенности к EBV при дефиците CD27, было недавно дано путем идентификации пациентов с дефицитом CD70 (см. Ниже).
CD70 Дефицит
Пять пациентов с гомозиготными вредными мутациями в CD70 были зарегистрированы в 2017 году и один — в 2018 году (91, 98, 99).У пяти из шести пациентов развилась лимфома Ходжкина и рецидивирующая В-клеточная лимфопролиферация, а у одного изначально были клинические признаки, вызывающие синдром Бехчета, и у него был нехарактерный вирусный энцефалит. У всех пациентов была дисгаммаглобулинемия, а у двух пациентов развились другие инфекции. По многим аспектам дефицит CD70 является фенокопией дефицита CD27. В мононуклеарных клетках периферической крови CD70 экспрессируется только очень небольшой частью B-клеток (91), но его экспрессия сильно повышается на активированных B-клетках и EBV-инфицированных B-клетках во время первичной инфекции в миндалинах пациентов с IM (91). .Известно, что B-клеточные лимфомы и некоторые другие виды рака, такие как солидные карциномы, экспрессируют CD70 (94). Идзава и др. продемонстрировали, что экспрессия CD70 на EBV-инфицированных В-клетках стимулирует рост EBV-специфических цитолитических Т-клеток через TCR-CD27-зависимую костимуляцию. Когда CD70 отсутствует на EBV-инфицированных B-клетках или CD27 на T-клетках, EBV-специфические T-клетки не могут расти, что приводит к снижению цитотоксических реакций по отношению к EBV-инфицированным B-клеткам (91). Также было замечено снижение экспрессии 2B4 и NKG2D на Т-клетках памяти CD8 + у пациентов с дефицитом CD70, что также может способствовать неспособности Т-клеток устранять В-клетки, инфицированные ВЭБ (98).Эти данные демонстрируют, что ось CD70 – CD27 представляет собой ключевой компонент защитного иммунитета к EBV. Более того, роль оси CD27 – CD70 в противоопухолевом иммунном надзоре за аномальными В-клетками подтверждается наблюдениями, что CD70 часто обнаруживается соматически мутировавшим в В-лимфомах, возможно, чтобы избежать иммунного надзора (91).
Идзава и др. продемонстрировали, что экспрессия CD70 на EBV-инфицированных В-клетках стимулирует рост EBV-специфических цитолитических Т-клеток через TCR-CD27-зависимую костимуляцию. Когда CD70 отсутствует на EBV-инфицированных B-клетках или CD27 на T-клетках, EBV-специфические T-клетки не могут расти, что приводит к снижению цитотоксических реакций по отношению к EBV-инфицированным B-клеткам (91). Также было замечено снижение экспрессии 2B4 и NKG2D на Т-клетках памяти CD8 + у пациентов с дефицитом CD70, что также может способствовать неспособности Т-клеток устранять В-клетки, инфицированные ВЭБ (98).Эти данные демонстрируют, что ось CD70 – CD27 представляет собой ключевой компонент защитного иммунитета к EBV. Более того, роль оси CD27 – CD70 в противоопухолевом иммунном надзоре за аномальными В-клетками подтверждается наблюдениями, что CD70 часто обнаруживается соматически мутировавшим в В-лимфомах, возможно, чтобы избежать иммунного надзора (91).
CTPS1 Дефицит
Дефицит CTPS1 — это аутосомно-рецессивный иммунодефицит, вызванный уникальной гомозиготной вредной мутацией в CTPS1 с эффектом основателя в популяции северо-западной Англии. До настоящего времени было зарегистрировано 12 пациентов, и все, кроме одного, имели предрасположенность к EBV, включая тяжелый инфекционный мононуклеоз, LPD и B-клеточную лимфому, которая была исходной клинической картиной в 40% случаев (100–102). У половины из них также развились другие вирусные инфекции, включая CMV, VZV и HHV-6. Некоторые из них также перенесли рецидивирующие бактериальные инфекции с Haemophilus influenza, Streptococcus pneumonia и / или Neisseria meningitis . CTPS1 кодирует CTP синтетазу или синтазу 1, ключевой фермент синтеза de novo нуклеотида CTP, который является ограничивающим нуклеотидом в клетках (103).CTP является критическим предшественником в метаболизме нуклеиновых кислот. CTP продуцируется двумя путями: спасательным путем и путем синтеза de novo . Путь восстановления использует цитидин, продукт разложения нуклеиновых кислот. Синтез CTP « de novo » зависит от двух ферментов CTPS1 и CTPS2, которые катализируют АТФ-зависимое аминирование UTP в CTP с переносом аммиака (-Nh4) из гидролизованного глутамина.
До настоящего времени было зарегистрировано 12 пациентов, и все, кроме одного, имели предрасположенность к EBV, включая тяжелый инфекционный мононуклеоз, LPD и B-клеточную лимфому, которая была исходной клинической картиной в 40% случаев (100–102). У половины из них также развились другие вирусные инфекции, включая CMV, VZV и HHV-6. Некоторые из них также перенесли рецидивирующие бактериальные инфекции с Haemophilus influenza, Streptococcus pneumonia и / или Neisseria meningitis . CTPS1 кодирует CTP синтетазу или синтазу 1, ключевой фермент синтеза de novo нуклеотида CTP, который является ограничивающим нуклеотидом в клетках (103).CTP является критическим предшественником в метаболизме нуклеиновых кислот. CTP продуцируется двумя путями: спасательным путем и путем синтеза de novo . Путь восстановления использует цитидин, продукт разложения нуклеиновых кислот. Синтез CTP « de novo » зависит от двух ферментов CTPS1 и CTPS2, которые катализируют АТФ-зависимое аминирование UTP в CTP с переносом аммиака (-Nh4) из гидролизованного глутамина. В нормальных тканях активность CTPS довольно низкая, в то время как она высока в пролиферирующих клетках, таких как раковые клетки, включая лимфому.Важно отметить, что CTPS1 очень мало в покоящихся Т-клетках и быстро и сильно активируется в ответ на стимуляцию TCR (100). У пациентов с дефицитом CTPS1 пролиферация Т-клеток в ответ на вовлечение TCR заметно нарушена, в то время как другие Т-клеточные ответы, включая продукцию цитокинов, AICD и цитотоксичность, не затрагиваются, и Т-клетки обычно пролиферируют в ответ на IL-2. Добавление ЦТФ или цитидина в культуральную среду восстанавливало Т-клеточную пролиферацию активированных Т-клеток. Экспрессия CTPS1 также повышается в активированных В-клетках.Однако роль CTPS1 в B-клетках может быть менее важной, чем в T-клетках, поскольку у пациентов чаще развиваются инфекции, связанные с дефектом T-клеток, а отсутствие CTPS1 не влияет на пролиферацию EBV-инфицированных B-клеток и их трансформацию EBV. . Обнаружение дефицита CTPS1 подчеркивает важность экспансии Т-клеток во время противовирусных реакций, особенно при первичной инфекции, вызванной ВЭБ, поскольку 40% циркулирующих Т-клеток могут быть специфичными для ВЭБ (8).
В нормальных тканях активность CTPS довольно низкая, в то время как она высока в пролиферирующих клетках, таких как раковые клетки, включая лимфому.Важно отметить, что CTPS1 очень мало в покоящихся Т-клетках и быстро и сильно активируется в ответ на стимуляцию TCR (100). У пациентов с дефицитом CTPS1 пролиферация Т-клеток в ответ на вовлечение TCR заметно нарушена, в то время как другие Т-клеточные ответы, включая продукцию цитокинов, AICD и цитотоксичность, не затрагиваются, и Т-клетки обычно пролиферируют в ответ на IL-2. Добавление ЦТФ или цитидина в культуральную среду восстанавливало Т-клеточную пролиферацию активированных Т-клеток. Экспрессия CTPS1 также повышается в активированных В-клетках.Однако роль CTPS1 в B-клетках может быть менее важной, чем в T-клетках, поскольку у пациентов чаще развиваются инфекции, связанные с дефектом T-клеток, а отсутствие CTPS1 не влияет на пролиферацию EBV-инфицированных B-клеток и их трансформацию EBV. . Обнаружение дефицита CTPS1 подчеркивает важность экспансии Т-клеток во время противовирусных реакций, особенно при первичной инфекции, вызванной ВЭБ, поскольку 40% циркулирующих Т-клеток могут быть специфичными для ВЭБ (8).
CORO1A Дефицит
Дефицит регулятора актина CORO1A (Coronin-1A) был выявлен у девяти пациентов (104–108).Пациенты поступили с тяжелыми инфекциями, у пяти из них развилась В-клеточная лимфома, вызванная ВЭБ. У четырех пациентов были тяжелые проявления кожно-слизистого иммунодефицита, включая бородавчатую эпидермодисплазию-HPV (EV-HPV) (104, 108). У трех пациентов также наблюдались неврологические отклонения, включая симптомы аутизма. Пациенты с дефицитом CORO1A характеризуются глубокой Т-клеточной лимфопенией с сильно уменьшенными или почти отсутствующими наивными клетками, связанными с нарушением выработки тимуса. CORO1A-дефицитные Т-клетки от пациентов показали повышенный спонтанный in vitro апоптоз , задержку активации ERK1 / 2, повышенный нитчатый актин, но нормальную или пониженную пролиферацию Т-клеток на митогены и антигены и нормальный поток кальция и цитотоксичность.Предполагается, что дефицит CORO1A в первую очередь является иммунодефицитом Т-клеток, вызванным нарушением выхода тимуса, миграции и выживания зрелых Т-клеток, тем самым влияя на гомеостаз лимфоцитов, отбор репертуара и предопределенность клонов (109). CORO1A принадлежит к семейству коронинов, которые представляют собой эволюционно консервативные внутриклеточные актин-связывающие белки, экспрессирующиеся на высоком уровне в большинстве популяций лейкоцитов (110). Было показано, что в Т-клетках CORO1A является негативным регулятором образования разветвленного F-актина и необходим для опосредованной хемокинами миграции и выживания лимфоцитов, учитывая тот факт, что накопление F-актина, как известно, токсично для клеток (108, 111 ).Однако CORO1A в Т-клетках также участвует во множестве путей, включая передачу сигналов TCR и TGF-β и образование иммунологических синапсов (IS) (112–115). Наряду с этим сообщалось о дефектной дегрануляции NK-клеток у одного пациента в связи с повышенной плотностью F-актина в цитотоксическом синапсе (113). Неврологические отклонения, обнаруженные у пациентов, вероятно, объясняются ролью коронина-1A в развитии нервной системы, о которой сообщалось у мышей (116). Наконец, недавно было показано, что коронин 1A необходим для переноса нейтрофилов.
CORO1A принадлежит к семейству коронинов, которые представляют собой эволюционно консервативные внутриклеточные актин-связывающие белки, экспрессирующиеся на высоком уровне в большинстве популяций лейкоцитов (110). Было показано, что в Т-клетках CORO1A является негативным регулятором образования разветвленного F-актина и необходим для опосредованной хемокинами миграции и выживания лимфоцитов, учитывая тот факт, что накопление F-актина, как известно, токсично для клеток (108, 111 ).Однако CORO1A в Т-клетках также участвует во множестве путей, включая передачу сигналов TCR и TGF-β и образование иммунологических синапсов (IS) (112–115). Наряду с этим сообщалось о дефектной дегрануляции NK-клеток у одного пациента в связи с повышенной плотностью F-актина в цитотоксическом синапсе (113). Неврологические отклонения, обнаруженные у пациентов, вероятно, объясняются ролью коронина-1A в развитии нервной системы, о которой сообщалось у мышей (116). Наконец, недавно было показано, что коронин 1A необходим для переноса нейтрофилов. Эти наблюдения предполагают, что иммунные дефекты у пациентов могут ограничиваться не только Т-клетками (117). Хотя четко не установлено, почему пациенты с дефицитом CORO1A восприимчивы к ВЭБ, весьма вероятно, что низкая выживаемость Т-клеток может привести к дефектному размножению ВЭБ-специфических Т-клеток CD8 + , что приведет к нарушению контроля над ВЭБ- инфицированные В-клетки. Интересно, что у четырех пациентов развился EV-HPV, который может приблизить дефицит CORO1A к первичным иммунодефицитам (PIDs), связанным с частыми и обширными инфекциями HPV, особенно такими, как дефицит MST1 / STK4 и DOCK8, которые характеризуются лимфопенией CD4, дефектными Т-клетками. миграция и / или аномальная полимеризация F-актина и образование IS (118).
Эти наблюдения предполагают, что иммунные дефекты у пациентов могут ограничиваться не только Т-клетками (117). Хотя четко не установлено, почему пациенты с дефицитом CORO1A восприимчивы к ВЭБ, весьма вероятно, что низкая выживаемость Т-клеток может привести к дефектному размножению ВЭБ-специфических Т-клеток CD8 + , что приведет к нарушению контроля над ВЭБ- инфицированные В-клетки. Интересно, что у четырех пациентов развился EV-HPV, который может приблизить дефицит CORO1A к первичным иммунодефицитам (PIDs), связанным с частыми и обширными инфекциями HPV, особенно такими, как дефицит MST1 / STK4 и DOCK8, которые характеризуются лимфопенией CD4, дефектными Т-клетками. миграция и / или аномальная полимеризация F-актина и образование IS (118).
Дефицит RASGRP1
Дефицит RASGRP1 вызван биаллельными мутациями в RASGRP1 . К настоящему времени три разные нулевые гомозиготные мутации были идентифицированы у четырех пациентов, у которых развились тяжелые ДПЗ, вызванные ВЭБ, включая две лимфомы Ходжкина. У одного также была EBV-SMT (119–121). RASGRP1 кодирует регулируемый диацилглицерином фактор обмена гуанидина, предпочтительно экспрессируемый в Т- и NK-клетках (122, 123), который действует как активатор малого G-белка RAS и каскада киназ нижестоящего RAF-MEK-ERK (также известного как путь киназ MAP).В Т-лимфоцитах RASGRP1 является основным активатором пути киназ MAP (124, 125). Т-клетки с дефицитом RASGRP1 показали нарушение активации ERK / MAPK и снижение пролиферации Т-клеток в ответ на митогены и антигены (119, 120). В первом отчете также было показано, что Т-клетки с дефицитом RASGRP1 обладают пониженной цитотоксичностью и миграционной способностью клеток (120). NK-клетки также проявляли пониженную клеточную цитотоксичность. Прямая роль RASGRP1 в динамике цитоскелета во время экзоцитоза литических гранул в NK- и T-клетках и в миграции T-клеток подтверждается его способностью взаимодействовать с легкой цепью динеина DYNLL1 и активировать RhoA, соответственно (120).Эта роль может объяснять нарушенные цитотоксические ответы, наблюдаемые в RASGRP1-дефицитных Т- и NK-клетках.
У одного также была EBV-SMT (119–121). RASGRP1 кодирует регулируемый диацилглицерином фактор обмена гуанидина, предпочтительно экспрессируемый в Т- и NK-клетках (122, 123), который действует как активатор малого G-белка RAS и каскада киназ нижестоящего RAF-MEK-ERK (также известного как путь киназ MAP).В Т-лимфоцитах RASGRP1 является основным активатором пути киназ MAP (124, 125). Т-клетки с дефицитом RASGRP1 показали нарушение активации ERK / MAPK и снижение пролиферации Т-клеток в ответ на митогены и антигены (119, 120). В первом отчете также было показано, что Т-клетки с дефицитом RASGRP1 обладают пониженной цитотоксичностью и миграционной способностью клеток (120). NK-клетки также проявляли пониженную клеточную цитотоксичность. Прямая роль RASGRP1 в динамике цитоскелета во время экзоцитоза литических гранул в NK- и T-клетках и в миграции T-клеток подтверждается его способностью взаимодействовать с легкой цепью динеина DYNLL1 и активировать RhoA, соответственно (120).Эта роль может объяснять нарушенные цитотоксические ответы, наблюдаемые в RASGRP1-дефицитных Т- и NK-клетках. В недавнем отчете Winter et al., Тем не менее, было обнаружено, что NK-клетки с дефицитом RASGRP1 и CD8 + Т-клетки имеют нормальную дегрануляцию при стимуляции (119). Расхождения между этими исследованиями неизвестны. Однако в различных отчетах у пациентов с дефицитом RASGRP1 постоянно отмечалось низкое количество NK-клеток, что могло способствовать снижению цитотоксичности NK-клеток. Winter et al.далее проанализировали возможные механизмы, лежащие в основе восприимчивости EBV при дефиците RASGRP1, и показали, что RASGRP1-дефицитные Т-клетки не могут нормально расти (119). В частности, Т-клетки с недостаточностью RASGRP1 имели нарушенную CD27-зависимую пролиферацию в сторону В-клеток, экспрессирующих CD70, EBV, что является критическим путем для размножения EBV-специфических Т-клеток (см. Выше). Интересно, что нарушение пролиферации активированных Т-клеток с дефицитом RASGRP1 коррелирует с их неспособностью повышать экспрессию белка CTPS1, что указывает на роль пути RASGRP1 / MAPK в экспрессии CTPS1, но также и в других факторах, участвующих в пролиферации Т-клеток, таких как CTP или цитидин не смог восстановить нарушенную пролиферацию Т-клеток с дефицитом RASGRP1 (119).
В недавнем отчете Winter et al., Тем не менее, было обнаружено, что NK-клетки с дефицитом RASGRP1 и CD8 + Т-клетки имеют нормальную дегрануляцию при стимуляции (119). Расхождения между этими исследованиями неизвестны. Однако в различных отчетах у пациентов с дефицитом RASGRP1 постоянно отмечалось низкое количество NK-клеток, что могло способствовать снижению цитотоксичности NK-клеток. Winter et al.далее проанализировали возможные механизмы, лежащие в основе восприимчивости EBV при дефиците RASGRP1, и показали, что RASGRP1-дефицитные Т-клетки не могут нормально расти (119). В частности, Т-клетки с недостаточностью RASGRP1 имели нарушенную CD27-зависимую пролиферацию в сторону В-клеток, экспрессирующих CD70, EBV, что является критическим путем для размножения EBV-специфических Т-клеток (см. Выше). Интересно, что нарушение пролиферации активированных Т-клеток с дефицитом RASGRP1 коррелирует с их неспособностью повышать экспрессию белка CTPS1, что указывает на роль пути RASGRP1 / MAPK в экспрессии CTPS1, но также и в других факторах, участвующих в пролиферации Т-клеток, таких как CTP или цитидин не смог восстановить нарушенную пролиферацию Т-клеток с дефицитом RASGRP1 (119).
Две мутации гетерозиготного соединения RASGRP1 , не влияющие на экспрессию белка RASGRP1, также недавно были идентифицированы у двух братьев и сестер с множественными грибковыми, бактериальными и вирусными инфекциями, включая EBV и CMV, и у обоих также развились признаки аутоиммунитета, вызывающие аутоиммунный лимфопролиферативный синдром (126). . В соответствии с этим у мышей с дефицитом RASGRP1 развился аутоиммунный LPD, напоминающий системную красную волчанку, когда становился старше (127, 128), а RASGRP1 рассматривается как локус риска для аутоиммунитета (129–131).Т-клетки от двух пациентов показали дефектную активацию TCR, связанную с нарушением пролиферации и AICD. Однако эксперименты по комплементации с RASGRP1 дикого типа были безуспешными, оставляя возможность того, что другие или дополнительные генетические события вносят вклад в этот конкретный фенотип и / или эти мутации не ведут себя как мутации с потерей функции. Эти наблюдения могут указывать на корреляцию генотип-фенотип.
Пути борьбы с инфекцией ВЭБ
В результате исследований этих генетических нарушений было выявлено несколько ключевых путей, необходимых для эффективного иммунитета к EBV (11).Интересно, что эти пути участвуют в межклеточном взаимодействии и перекрестной связи между Т- и В-клетками и, по-видимому, играют решающую роль в иммунном надзоре за В-клетками Т-клетками, что согласуется с В-клетками как привилегированной мишенью ВЭБ-инфекция и резервуар ВЭБ. Эти пути вовлекают пары рецептор-лиганд, экспрессируемые Т- и В-клетками, соответственно (Рисунок 1). Наиболее известным и глубоко изученным является путь SLAMR – SAP, который является дефектным при синдроме дефицита SAP / XLP-1 и в основном включает два рецептора SLAM, 2B4 и NTB-A; однако другие SLAMR, такие как CD229, также могут быть задействованы, как предполагают исследования на мышах и людях (47, 49).Эти пути, по-видимому, важны для распознавания В-клеток, инфицированных EBV, Т-клетками и для активации цитотоксических ответов Т- и NK-клеток в отношении В-клеток, инфицированных EBV. Другой важный путь зависит от рецептора NKG2D, который, как хорошо известно, активирует цитотоксические ответы Т- и NK-клеток. В отсутствие MAGT1 экспрессия NKG2D на CD8 + Т-клетках и NK-клетках нарушается, что приводит к дефектному уничтожению В-клеток, инфицированных EBV (79). Тем не менее, было бы интересно узнать, разрастаются ли EBV-специфические Т-клетки нормально у MAGT1-дефицитных пациентов, поскольку NKG2D также участвует в выживании и увеличении CD8 + Т-клеток во время вирусных инфекций.Пара молекул CD27 – CD70 образует критическую ось, необходимую для выживания и размножения ВЭБ-специфических Т-клеток (91). Ключевая роль экспансии / пролиферации Т-клеток в контроле В-клеток, инфицированных ВЭБ, также подчеркивается дефицитом CTPS1 и RASGRP1, при котором способность Т-лимфоцитов пролиферировать в ответ на антигенную стимуляцию специфически нарушена.
Другой важный путь зависит от рецептора NKG2D, который, как хорошо известно, активирует цитотоксические ответы Т- и NK-клеток. В отсутствие MAGT1 экспрессия NKG2D на CD8 + Т-клетках и NK-клетках нарушается, что приводит к дефектному уничтожению В-клеток, инфицированных EBV (79). Тем не менее, было бы интересно узнать, разрастаются ли EBV-специфические Т-клетки нормально у MAGT1-дефицитных пациентов, поскольку NKG2D также участвует в выживании и увеличении CD8 + Т-клеток во время вирусных инфекций.Пара молекул CD27 – CD70 образует критическую ось, необходимую для выживания и размножения ВЭБ-специфических Т-клеток (91). Ключевая роль экспансии / пролиферации Т-клеток в контроле В-клеток, инфицированных ВЭБ, также подчеркивается дефицитом CTPS1 и RASGRP1, при котором способность Т-лимфоцитов пролиферировать в ответ на антигенную стимуляцию специфически нарушена.
Рисунок 1 . Схематическое изображение идентифицированных дефектных путей при иммунодефицитах, предрасполагающих к высокой восприимчивости к В-клеточным лимфопролиферативным заболеваниям, вызванным вирусом Эпштейна-Барра (EBV). Дефектные компоненты проводящих путей отмечены желтым цветом. Было показано, что нарушены три неизбыточных пути: путь SLAMF6 / 2B4 / SLAM-ассоциированного белка (SAP), путь CD70 / CD27 и путь NKG2D / MICA / MAGT1. В какой-то момент некоторые из этих путей могут сходиться к дистальным эффекторным молекулам, таким как RASGRP1 и CTPS1, которые необходимы для размножения Т-клеток. Связь CORO1A с этими путями неизвестна. Помимо существенной роли CD8 + Т-клеток, NK и iNKT-клетки, которые часто уменьшаются при этих первичных иммунодефицитах, могут играть роль в иммунном ответе против EBV, особенно на ранней стадии первичной инфекции.Считается также, что Т-клетки Vγ9δ2 играют важную роль в первичной инфекции, узнавая латентно реплицирующиеся В-клетки ВЭБ.
Дефектные компоненты проводящих путей отмечены желтым цветом. Было показано, что нарушены три неизбыточных пути: путь SLAMF6 / 2B4 / SLAM-ассоциированного белка (SAP), путь CD70 / CD27 и путь NKG2D / MICA / MAGT1. В какой-то момент некоторые из этих путей могут сходиться к дистальным эффекторным молекулам, таким как RASGRP1 и CTPS1, которые необходимы для размножения Т-клеток. Связь CORO1A с этими путями неизвестна. Помимо существенной роли CD8 + Т-клеток, NK и iNKT-клетки, которые часто уменьшаются при этих первичных иммунодефицитах, могут играть роль в иммунном ответе против EBV, особенно на ранней стадии первичной инфекции.Считается также, что Т-клетки Vγ9δ2 играют важную роль в первичной инфекции, узнавая латентно реплицирующиеся В-клетки ВЭБ.
Большинство из этих недостатков характеризуется заметным снижением или отсутствием инвариантных популяций Т-клеток iNKT и связанных со слизистой оболочкой инвариантных Т (MAIT) -клеток, что поднимает вопрос о роли этих клеток в иммунитете к ВЭБ. Клетки iNKT обладают врожденными свойствами, включая быструю активацию и выработку большого количества цитокинов.Эти клетки участвуют в различных иммунных ответах, включая противовирусный иммунитет. Модели на мышах предоставили доказательства того, что SAP, ITK и RASGRP1 непосредственно участвуют в развитии / гомеостазе / функции клеток iNKT (132–137). Анализ пациентов с дефицитом XIAP также показал, что эти клеточные дефекты могут быть вторичными по отношению к инфекции EBV, что приводит к истощению клеток в связи с особенно высокой чувствительностью клеток iNKT и MAIT к AICD (138). Существует лишь ограниченное количество исследований, в которых оценивалась роль клеток iNKT в инфицировании EBV, хотя было показано, что клетки iNKT, в частности клетки CD8 + iNKT, обладают способностью непосредственно лизировать EBV-инфицированные B-клетки, экспрессирующие CD1d, и ограничивать распространение В-клетки, трансформированные EBV, in vitro и in vivo (139–141).Однако пациенты с дефицитом RORC, у которых отсутствуют клетки iNKT и MAIT, не особенно восприимчивы к EBV, что указывает на то, что эти клетки не играют критической роли в иммунитете к EBV (142).
Клетки iNKT обладают врожденными свойствами, включая быструю активацию и выработку большого количества цитокинов.Эти клетки участвуют в различных иммунных ответах, включая противовирусный иммунитет. Модели на мышах предоставили доказательства того, что SAP, ITK и RASGRP1 непосредственно участвуют в развитии / гомеостазе / функции клеток iNKT (132–137). Анализ пациентов с дефицитом XIAP также показал, что эти клеточные дефекты могут быть вторичными по отношению к инфекции EBV, что приводит к истощению клеток в связи с особенно высокой чувствительностью клеток iNKT и MAIT к AICD (138). Существует лишь ограниченное количество исследований, в которых оценивалась роль клеток iNKT в инфицировании EBV, хотя было показано, что клетки iNKT, в частности клетки CD8 + iNKT, обладают способностью непосредственно лизировать EBV-инфицированные B-клетки, экспрессирующие CD1d, и ограничивать распространение В-клетки, трансформированные EBV, in vitro и in vivo (139–141).Однако пациенты с дефицитом RORC, у которых отсутствуют клетки iNKT и MAIT, не особенно восприимчивы к EBV, что указывает на то, что эти клетки не играют критической роли в иммунитете к EBV (142). При некоторых из этих иммунодефицитов также часто наблюдаются измененные функции и уменьшение количества NK-клеток. Роль NK-клеток может быть особенно важной в детстве, поскольку KIR-отрицательные ранние дифференцированные NK-клетки, которые увеличивались преимущественно во время IM и нацелены на литически реплицирующиеся EBV B-клетки, постепенно исчезали в первое десятилетие жизни (143).Недавние данные показали, что пациенты с тяжелым комбинированным иммунодефицитом (ТКИД), которым была проведена трансплантация костного мозга, хотя и лишенные NK-клеток после восстановления иммунитета, демонстрируют эффективный иммунитет к ВЭБ, поскольку ни у одного из них не развились нарушения лимфопролиферации, вызванные ВЭБ, даже через 39 лет после трансплантации ( 144). Это говорит о том, что NK-клетки не являются необходимыми для иммунитета против EBV на протяжении всей жизни. В любом случае, хотя они не являются ключевыми компонентами, накопление этих различных клеточных дефектов может участвовать в предрасположенности к EBV в этих генетических условиях, особенно в детстве.
При некоторых из этих иммунодефицитов также часто наблюдаются измененные функции и уменьшение количества NK-клеток. Роль NK-клеток может быть особенно важной в детстве, поскольку KIR-отрицательные ранние дифференцированные NK-клетки, которые увеличивались преимущественно во время IM и нацелены на литически реплицирующиеся EBV B-клетки, постепенно исчезали в первое десятилетие жизни (143).Недавние данные показали, что пациенты с тяжелым комбинированным иммунодефицитом (ТКИД), которым была проведена трансплантация костного мозга, хотя и лишенные NK-клеток после восстановления иммунитета, демонстрируют эффективный иммунитет к ВЭБ, поскольку ни у одного из них не развились нарушения лимфопролиферации, вызванные ВЭБ, даже через 39 лет после трансплантации ( 144). Это говорит о том, что NK-клетки не являются необходимыми для иммунитета против EBV на протяжении всей жизни. В любом случае, хотя они не являются ключевыми компонентами, накопление этих различных клеточных дефектов может участвовать в предрасположенности к EBV в этих генетических условиях, особенно в детстве. Лимфопения CD4 Т-клеток, которая наблюдается при некоторых из этих заболеваний, также может участвовать в восприимчивости к ВЭБ, хотя роль Т-клеток CD4 + в контроле инфекции ВЭБ четко не установлена (3). Противодействуя важной роли CD4 + Т-клеток, пациенты с дефицитом MHC класса II имеют тяжелую лимфопению CD4, у них не развиваются LPD, вызванные EBV, и у них нормальное количество B-клеток. Хотя на самом деле это не рассматривается, некоторые из этих дефектов также могут иметь внутренние последствия для B-клеток, которые дополнительно способствуют пролиферации и / или лимфомагенезу B-клеток, инфицированных EBV, в дополнение к иммунной недостаточности.В этом отношении было показано, что CD70 вызывает обратную передачу сигналов, участвующую в апоптозе В-клеток, а недавнее исследование мышей с дефицитом MAGT1 выявило регуляторную роль MAGT1 в развитии и пролиферации В-клеток, которая может объяснять B-лимфоцитоз, обнаруженный у MAGT1-дефицитных пациенты (86, 145).
Лимфопения CD4 Т-клеток, которая наблюдается при некоторых из этих заболеваний, также может участвовать в восприимчивости к ВЭБ, хотя роль Т-клеток CD4 + в контроле инфекции ВЭБ четко не установлена (3). Противодействуя важной роли CD4 + Т-клеток, пациенты с дефицитом MHC класса II имеют тяжелую лимфопению CD4, у них не развиваются LPD, вызванные EBV, и у них нормальное количество B-клеток. Хотя на самом деле это не рассматривается, некоторые из этих дефектов также могут иметь внутренние последствия для B-клеток, которые дополнительно способствуют пролиферации и / или лимфомагенезу B-клеток, инфицированных EBV, в дополнение к иммунной недостаточности.В этом отношении было показано, что CD70 вызывает обратную передачу сигналов, участвующую в апоптозе В-клеток, а недавнее исследование мышей с дефицитом MAGT1 выявило регуляторную роль MAGT1 в развитии и пролиферации В-клеток, которая может объяснять B-лимфоцитоз, обнаруженный у MAGT1-дефицитных пациенты (86, 145).
Дифференциальная диагностика
Учитывая важность ответа Т-клеток CD8 + для иммунитета к EBV, неудивительно, что LPD, управляемые EBV, также обнаруживаются при других PID, связанных с дефектами Т-клеток, но с меньшей частотой.Вирусы герпеса, в частности EBV, часто являются триггером HLH у пациентов с семейным гемофагоцитарным лимфогистиоцитозом (FHL), группой заболеваний, связанных с нарушением цитолитической активности CD8 + T-клеток и NK-клеток. Эти заболевания вызваны дефектами гена перфорина и компонентов механизма экзоцитоза литических гранул (146). У пациентов с CVID или CID, особенно с теми, которые влияют на выживаемость, миграцию и мобилизацию F-актина в T-клетках, также могут развиваться заболевания, связанные с EBV (12).К ним относятся, среди прочего, дефицит NFκB1 (147), MST1 / STK4 (148, 149), WASP (150), DOCK8 (151), GATA2 (152) и мутации с усилением функции в PIK3CD , известные как вызывают активированный синдром PI3K-дельта (153). Пациенты с гипоморфными мутациями в генах, участвующих в развитии Т-клеток, таких как RAG1 / 2, DCLRE1C (ARTEMIS) или ZAP-70, также могут испытывать восприимчивость к EBV (154–156). Следует учитывать, что пациенты с наиболее тяжелыми Т-клеточными дефектами никогда не будут иметь проблем с ВЭБ, поскольку у них очень рано развиваются тяжелые инфекции (кроме ВЭБ), требующие быстрой трансплантации костного мозга до того, как они столкнутся с ВЭБ.Наконец, некоторые из этих иммунодефицитов (SCID) также связаны с серьезным блокированием развития B-клеток, клеточного контекста, который, по всей вероятности, не позволяет установить и распространить инфекцию EBV.
Пациенты с гипоморфными мутациями в генах, участвующих в развитии Т-клеток, таких как RAG1 / 2, DCLRE1C (ARTEMIS) или ZAP-70, также могут испытывать восприимчивость к EBV (154–156). Следует учитывать, что пациенты с наиболее тяжелыми Т-клеточными дефектами никогда не будут иметь проблем с ВЭБ, поскольку у них очень рано развиваются тяжелые инфекции (кроме ВЭБ), требующие быстрой трансплантации костного мозга до того, как они столкнутся с ВЭБ.Наконец, некоторые из этих иммунодефицитов (SCID) также связаны с серьезным блокированием развития B-клеток, клеточного контекста, который, по всей вероятности, не позволяет установить и распространить инфекцию EBV.
Терапия
На данный момент единственным лечебным средством от этих ВЗОМТ является трансплантация гемопоэтических стволовых клеток (ТГСК). Первые исследования больших когорт пациентов с XLP-1 и XLP-2 показали плохую выживаемость с ТГСК или без нее (23, 157). Этот уничижительный прогноз был частично связан с использованием полных режимов кондиционирования, связанных с высокой токсичностью для пациентов (XIAP) и / или отсутствием ремиссии HLH во время HSCT. В последние несколько лет использование кондиционеров с пониженной интенсивностью и разработка новых методов лечения, таких как алемтузумаб (анти-CD52-антитело), значительно улучшили лечение этих заболеваний (33, 158, 159). Кроме того, ритуксимаб (антитело к CD20) в настоящее время играет важную роль в лечении LPD, связанных с этими PID, у пациентов, находящихся в ремиссии после получения этого лечения.
В последние несколько лет использование кондиционеров с пониженной интенсивностью и разработка новых методов лечения, таких как алемтузумаб (анти-CD52-антитело), значительно улучшили лечение этих заболеваний (33, 158, 159). Кроме того, ритуксимаб (антитело к CD20) в настоящее время играет важную роль в лечении LPD, связанных с этими PID, у пациентов, находящихся в ремиссии после получения этого лечения.
Заключительные замечания
Молекулярная характеристика семейных форм восприимчивости к ВЭБ предоставила за последние 20 лет новые диагностические инструменты для этих заболеваний.Анализ больших когорт и отчетов о случаях выявил фенотипы, не связанные с ВЭБ, связанные с этими ВЗОМТ, такие как ВЗК, поражение легких, неврологические расстройства или другие типичные инфекции (например, ВПЧ), которые могут дополнительно помочь в постановке диагноза. Тем не менее, все еще есть ряд пациентов с высокой предрасположенностью к EBV, у которых молекулярная / генетическая основа их заболевания неизвестна и еще предстоит определить. В свете знаний, полученных в ходе исследований генетически детерминированных форм восприимчивости к ВЭБ, мы можем предположить, что эти не охарактеризованные формы вызваны дефектами в молекулах / компонентах, участвующих во взаимодействиях Т-В-клеток, и необходимы для цитолитических ответов Т-клеток и / или экспансия Т-клеток.
В свете знаний, полученных в ходе исследований генетически детерминированных форм восприимчивости к ВЭБ, мы можем предположить, что эти не охарактеризованные формы вызваны дефектами в молекулах / компонентах, участвующих во взаимодействиях Т-В-клеток, и необходимы для цитолитических ответов Т-клеток и / или экспансия Т-клеток.
Авторские взносы
SL написал рукопись и сделал рисунок 1. SW собрал данные для таблиц 1 и 2, составил таблицы и участвовал в написании рукописи.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Финансирование
SL — старший научный сотрудник Национального центра научных исследований CNRS (Франция).SW поддерживается программой Imagine Institut PhD, финансируемой Fondation Bettencourt-Schueller. Работа лаборатории активации лимфоцитов и восприимчивости к EBV, возглавляемой SL, поддерживается грантами Ligue Contre le Cancer-Equipe Labellisée (Франция), INSERM (Франция), Национального агентства исследований, Франция (ANR-14-CE14 -0028-01 (SL) и ANR-10-IAHU-01 (Imagine Institut)), Фонд редких заболеваний (Франция), Ассоциация Франсуа Апетит (Франция), Французское общество борьбы с раком и лейкемией Enfant et de l’Adolescent (SFCE), AREMIG (Франция), Fédération Enfants et Santé (Франция) и Европейский исследовательский совет (ERC-2009-AdG_200
№ FP7-249816).
Список литературы
1. Коэн Дж. И., Фаучи А. С., Вармус Х., Набель Дж. Дж. Вирус Эпштейна-Барра: важная мишень вакцины для профилактики рака. Sci Transl Med (2011) 3: 107fs107. DOI: 10.1126 / scitranslmed.3002878
CrossRef Полный текст | Google Scholar
2. Хислоп А.Д., Тейлор Г.С., Соус D, Рикинсон А.Б. Клеточные реакции на вирусную инфекцию у людей: уроки вируса Эпштейна-Барра. Annu Rev Immunol (2007) 25: 587–617. DOI: 10.1146 / annurev.иммунол.25.022106.141553
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Тейлор Г.С., Лонг Х.М., Брукс Дж. М., Рикинсон А.Б., Хислоп А.Д. Иммунология болезни, вызванной вирусом Эпштейна-Барра. Annu Rev Immunol (2015) 33: 787–821. DOI: 10.1146 / annurev -munol-032414-112326
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Джауд З., Гетлейн Л.А., Горовиц А., Аззи Т., Немат-Горгани Н., Олив Д. и др. Две альтернативные стратегии врожденного иммунитета к вирусу Эпштейна-Барра: одна с использованием NK-клеток, а другая NK-клеток и Т-клеток гаммадельта. J Exp Med (2017) 214: 1827–41. DOI: 10.1084 / jem.20161017
J Exp Med (2017) 214: 1827–41. DOI: 10.1084 / jem.20161017
CrossRef Полный текст | Google Scholar
6. Фудзивара С., Кимура Х., Имадоме К.-И, Араи А., Кодама Е., Морио Т. и др. Текущее исследование хронической активной инфекции вируса Эпштейна-Барра в Японии. Pediatr Int. (2014) 56: 159–66. DOI: 10.1111 / ped.12314
CrossRef Полный текст | Google Scholar
8. Каллан М.Ф., Тан Л., Аннелс Н., Огг Г.С., Уилсон Д.Д., О’Каллаган Калифорния и др. Прямая визуализация антиген-специфических CD8 + Т-клеток во время первичного иммунного ответа на вирус Эпштейна-Барра in vivo. J Exp Med (1998) 187: 1395–402. DOI: 10.1084 / jem.187.9.1395
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Veillette A, Perez-Quintero LA, Latour S. Х-сцепленные лимфопролиферативные синдромы и связанные с ними аутосомно-рецессивные расстройства. Curr Opin Allergy Clin Immunol (2013) 13: 614–22. DOI: 10.1097 / ACI.0000000000000008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Sayos J, Wu C., Morra M, Wang N, Zhang X, Allen D, et al.Продукт гена Х-сцепленного лимфопролиферативного заболевания SAP регулирует сигналы, индуцируемые через корецептор SLAM. Nature (1998) 395: 462–9. DOI: 10.1038 / 26683
Sayos J, Wu C., Morra M, Wang N, Zhang X, Allen D, et al.Продукт гена Х-сцепленного лимфопролиферативного заболевания SAP регулирует сигналы, индуцируемые через корецептор SLAM. Nature (1998) 395: 462–9. DOI: 10.1038 / 26683
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Коффи А.Дж., Бруксбанк Р.А., Брандау О., Оохаши Т., Хауэлл Г.Р., Бай Дж.М. и др. Ответ хозяина на инфекцию EBV при Х-сцепленном лимфопролиферативном заболевании является результатом мутаций в гене, кодирующем Sh3-домен. Нат Генет (1998) 20: 129–35. DOI: 10.1038/2424
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Николс К.Э., Харкин Д.П., Левиц С., Крайнер М., Колквист К.А., Дженовезе С. и др. Инактивация мутаций в гене, кодирующем домен Sh3, при Х-сцепленном лимфопролиферативном синдроме. Proc Natl Acad Sci U S. A (1998) 95: 13765–70. DOI: 10.1073 / pnas.95.23.13765
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Гаспар Х. Б., Шарифи Р., Гилмор К. К., Трэшер А. Дж.. Х-сцепленное лимфопролиферативное заболевание: клинические, диагностические и молекулярные перспективы. Br J Haematol (2002) 119: 585–95. DOI: 10.1046 / j.1365-2141.2002.03851.x
Гаспар Х. Б., Шарифи Р., Гилмор К. К., Трэшер А. Дж.. Х-сцепленное лимфопролиферативное заболевание: клинические, диагностические и молекулярные перспективы. Br J Haematol (2002) 119: 585–95. DOI: 10.1046 / j.1365-2141.2002.03851.x
CrossRef Полный текст | Google Scholar
20. Purtilo DT, Sakamoto K, Barnabei V, Seeley J, Bechtold T, Rogers G, et al. Заболевания, вызванные вирусом Эпштейна-Барра, у мальчиков с Х-сцепленным лимфопролиферативным синдромом (XLP): обновленная информация об исследованиях реестра. Am J Med (1982) 73: 49–56. DOI: 10.1016 / 0002-9343 (82) -8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21.Сумеги Дж., Хуанг Д., Ланьи А., Дэвис Дж. Д., Симайер Т.А., Маеда А. и др. Корреляция мутаций гена Sh3D1A и инфекции вируса Эпштейна-Барра с клиническим фенотипом и исходом при Х-сцепленном лимфопролиферативном заболевании. Кровь (2000) 96: 3118–25.
PubMed Аннотация | Google Scholar
22. Канеган Х, Ян Х, Чжао М., Ямато К., Иноуэ М., Хамамото К. и др. Клинические особенности и исходы Х-сцепленного лимфопролиферативного синдрома типа 1 (дефицит SAP) в Японии, выявленные с помощью комбинации проточного цитометрического анализа и генетического анализа. Pediatr Allergy Immunol (2012) 23: 488–93. DOI: 10.1111 / j.1399-3038.2012.01282.x
Канеган Х, Ян Х, Чжао М., Ямато К., Иноуэ М., Хамамото К. и др. Клинические особенности и исходы Х-сцепленного лимфопролиферативного синдрома типа 1 (дефицит SAP) в Японии, выявленные с помощью комбинации проточного цитометрического анализа и генетического анализа. Pediatr Allergy Immunol (2012) 23: 488–93. DOI: 10.1111 / j.1399-3038.2012.01282.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Стенд C, Гилмор К.С., Вейс П., Геннери А.Р., Слаттер М.А., Чапел Н и др. Х-сцепленное лимфопролиферативное заболевание из-за дефицита SAP / Sh3D1A: многоцентровое исследование проявлений, лечения и исходов заболевания. Кровь (2011) 117: 53–62. DOI: 10.1182 / кровь-2010-06-284935
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24.Пахлопник Шмид Дж., Каниони Д., Мошоус Д., Тузот Ф., Махлауи Н., Хаук Ф. и др. Клинические сходства и различия пациентов с Х-сцепленным лимфопролиферативным синдромом типа 1 (дефицит XLP-1 / SAP) по сравнению с типом 2 (дефицит XLP-2 / XIAP). Кровь (2011) 117: 1522–9. DOI: 10.1182 / кровь-2010-07-298372
Кровь (2011) 117: 1522–9. DOI: 10.1182 / кровь-2010-07-298372
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Талаат К.Р., Ротман Дж. А., Коэн Дж. И., Санти М., Чой Дж. К., Гусман М. и др. Лимфоцитарный васкулит с поражением центральной нервной системы возникает у пациентов с Х-сцепленным лимфопролиферативным заболеванием в отсутствие инфекции вируса Эпштейна-Барра. Педиатр по раку крови (2009) 53: 1120–3. DOI: 10.1002 / pbc.22185
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Грей П.Е., О’Брайен Т.А., Уэгл М., Танге С.Г., Палендира Ю., Росциоли Т. и др. Церебральный васкулит при Х-сцепленном лимфопролиферативном заболевании, излеченный подобранной трансплантацией неродственной пуповинной крови. J Clin Immunol (2015) 35: 604–9. DOI: 10.1007 / s10875-015-0194-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27.Seemayer TA, Gross TG, Egeler RM, Pirruccello SJ, Davis JR, Kelly CM и др. Х-сцепленное лимфопролиферативное заболевание: двадцать пять лет после открытия. Pediatr Res (1995) 38: 471–8. DOI: 10.1203 / 00006450-199510000-00001
Х-сцепленное лимфопролиферативное заболевание: двадцать пять лет после открытия. Pediatr Res (1995) 38: 471–8. DOI: 10.1203 / 00006450-199510000-00001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Морра М., Силандер О., Кальпе С., Чой М., Этген Х., Майерс Л. и др. Изменения гена Sh3D1A Х-сцепленного лимфопролиферативного заболевания при синдроме общего вариабельного иммунодефицита. Кровь (2001) 98: 1321–5.DOI: 10.1182 / blood.V98.5.1321
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Иствуд Д., Гилмор К.С., Нистала К., Мини К., Чапел Н., Шеррелл З. и др. Распространенность дефектов генов SAP у пациентов мужского пола с диагнозом общего вариабельного иммунодефицита. Clin Exp Immunol (2004) 137: 584–8. DOI: 10.1111 / j.1365-2249.2004.02581.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Нистала К., Гилмор К.С., Крэнстон Т., Дэвис Э.Г., Голдблатт Д., Гаспар Х. В. и др.Х-сцепленное лимфопролиферативное заболевание: три атипичных случая. Clin Exp Immunol (2001) 126: 126–30. DOI: 10.1046 / j.1365-2249.2001.01599.x
В. и др.Х-сцепленное лимфопролиферативное заболевание: три атипичных случая. Clin Exp Immunol (2001) 126: 126–30. DOI: 10.1046 / j.1365-2249.2001.01599.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Соресина А., Лугарис В., Гилиани С., Кардинале Ф, Арменио Л., Катталини М. и др. Мутации гена Sh3D1A, связанного с Х-сцепленным лимфопролиферативным заболеванием, имитируют общий вариабельный иммунодефицит. Eur J Pediatr (2002) 161: 656–9. DOI: 10.1007 / s00431-002-1083-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32.Лю Дж, Тиан В., Ван Ф, Тэн В., Чжан И, Тонг С. и др. Материнское начало мутации Sh3D1A de novo и вирусной инфекции лимфоцитарного хориоменингита у пациента с Х-сцепленным лимфопролиферативным заболеванием типа 1: отчет о клиническом случае. Mol Med Rep (2015) 11: 3291–4. DOI: 10.3892 / mmr.2015.3173
CrossRef Полный текст | Google Scholar
33. Марш Р.А., Близинг Дж. Дж., Чандракасан С., Джордан М.Б., Дэвис С.М., Филипович А.Х. Трансплантация кондиционирующих гемопоэтических клеток пониженной интенсивности является эффективным методом лечения пациентов с SLAM-ассоциированным белковым дефицитом / Х-сцепленным лимфопролиферативным заболеванием 1 типа. Пересадка костного мозга Biol (2014) 20: 1641–5. DOI: 10.1016 / j.bbmt.2014.06.003
Дж., Чандракасан С., Джордан М.Б., Дэвис С.М., Филипович А.Х. Трансплантация кондиционирующих гемопоэтических клеток пониженной интенсивности является эффективным методом лечения пациентов с SLAM-ассоциированным белковым дефицитом / Х-сцепленным лимфопролиферативным заболеванием 1 типа. Пересадка костного мозга Biol (2014) 20: 1641–5. DOI: 10.1016 / j.bbmt.2014.06.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Veillette A, Dong Z, Perez-Quintero LA, Zhong MC, Cruz-Munoz ME. Важность и механизм функции переключения адаптеров семейства SAP. Immunol Rev (2009) 232: 229–39. DOI: 10.1111 / j.1600-065X.2009.00824.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Латур С., Ронкагалли Р., Чен Р., Бакиновски М., Ши Х, Шварцберг П.Л. и др.Связывание домена SAP Sh3 с доменом FynT Sh4 раскрывает новый механизм рецепторной передачи сигналов в иммунной регуляции. Nat Cell Biol (2003) 5: 149–54. DOI: 10.1038 / ncb919
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Латур С., Гиш Дж., Хелгасон С.Д., Хамфрис Р.К., Поусон Т., Вейлетт А. Регулирование передачи сигнала, опосредованного SLAM, с помощью SAP, продукта Х-связанного лимфопролиферативного гена. Nat Immunol (2001) 2: 681–90. DOI: 10.1038 /
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40.Харада С., Бехтольд Т., Сили Дж. К., Пуртило Д. Т.. Клеточно-опосредованный иммунитет к вирусу Эпштейна-Барра (EBV) и активность естественных киллеров (NK) при Х-сцепленном лимфопролиферативном синдроме. Int J Cancer (1982) 30: 739–44. DOI: 10.1002 / ijc.20610
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Харада С., Сакамото К., Сили Дж. К., Линдстен Т., Бехтольд Т., Йец Дж. И др. Иммунная недостаточность при Х-сцепленном лимфопролиферативном синдроме. I. Дефекты, специфичные для вируса Эпштейна-Барра. J Immunol (1982) 129: 2532–5.
PubMed Аннотация | Google Scholar
42. Танье С.Г., Филлипс Дж. Х., Ланье Л.Л., Николс К.Э. Функциональная потребность в SAP в 2B4-опосредованной активации естественных клеток-киллеров человека, что выявлено при Х-сцепленном лимфопролиферативном синдроме. J Immunol (2000) 165: 2932–6. DOI: 10.4049 / jimmunol.165.6.2932
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Паролини С., Боттино С., Фалько М., Аугульяро Р., Джилиани С., Франческини Р. и др.Х-сцепленное лимфопролиферативное заболевание. Молекулы 2B4, проявляющие скорее ингибирующую, чем активирующую функцию, ответственны за неспособность естественных клеток-киллеров убивать клетки, инфицированные вирусом Эпштейна-Барра. J Exp Med (2000) 192: 337–46. DOI: 10.1084 / jem.192.3.337
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Боттино С., Фалько М., Паролини С., Марченаро Э., Аугульяро Р., Сивори С. и др. NTB-A [коррекция GNTB-A], новая поверхностная молекула, связанная с Sh3D1A, вносящая вклад в неспособность естественных клеток-киллеров убивать В-клетки, инфицированные вирусом Эпштейна-Барра, при Х-связанном лимфопролиферативном заболевании. J Exp Med (2001) 194: 235–46. DOI: 10.1084 / jem.194.3.235
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Дюпре Л., Андолфи Г., Танье С.Г., Клементи Р., Локателли Ф., Арико М. и др. SAP контролирует цитолитическую активность CD8 + Т-клеток против EBV-инфицированных клеток. Кровь (2005) 105: 4383–9. DOI: 10.1182 / кровь-2004-08-3269
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Шарифи Р., Синклер Дж.К., Гилмор К.С., Аркрайт П.Д., Киннон С., Трэшер А.Дж. и др.SAP опосредует специфические функции цитотоксических Т-клеток при Х-сцепленном лимфопролиферативном заболевании. Кровь (2004) 103: 3821–7. DOI: 10.1182 / кровь-2003-09-3359
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Hislop AD, Palendira U, Leese AM, Arkwright PD, Rohrlich PS, Tangye SG, et al. Нарушение функции CD8 + Т-клеток, специфичных для вируса Эпштейна-Барра, при Х-сцепленном лимфопролиферативном заболевании ограничивается мишенями В-клеток, положительных по семейству SLAM. Кровь (2010) 116: 3249–57.DOI: 10.1182 / кровь-2009-09-238832
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Bloch-Queyrat C, Fondaneche MC, Chen R, Yin L, Relouzat F, Veillette A, et al. Регулирование естественной цитотоксичности адаптером SAP и Src-родственной киназой Fyn. J Exp Med (2005) 202: 181–92. DOI: 10.1084 / jem.20050449
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Донг З., Круз-Муньос М.Э., Чжун М.С., Чен Р., Латур С., Вейлетт А.Важная функция адаптеров семейства SAP в наблюдении за гемопоэтическими клетками естественными клетками-киллерами. Nat Immunol (2009) 10: 973–80. DOI: 10.1038 / ni.1763
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Донг З., Дэвидсон Д., Перес-Кинтеро Л.А., Куросаки Т., Сват В., Вейлетт А. Адаптер SAP контролирует активацию NK-клеток, регулируя ферменты Vav-1 и SHIP-1, и усиливая конъюгаты с клетками-мишенями. Иммунитет (2012) 36: 974–85.DOI: 10.1016 / j.immuni.2012.03.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Чжао Ф., Кэннонс Дж. Л., Датта М., Гриффитс Г. М., Шварцберг П. Л.. Положительная и отрицательная передача сигналов через рецепторы SLAM регулируют организацию синапсов и пороги цитолиза. Иммунитет (2012) 36: 1003–16. DOI: 10.1016 / j.immuni.2012.05.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Wu N, Zhong MC, Roncagalli R, Perez-Quintero LA, Guo H, Zhang Z, et al.Механизм, управляемый гемопоэтическими клетками, с участием рецептора SLAMF6, адаптеров SAP и фосфатазы SHP-1 регулирует образование NK-клеток. Нат Иммунол (2016) 17: 387–96. DOI: 10.1038 / ni.3369
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Palendira U, Low C, Chan A, Hislop AD, Ho E, Phan TG, et al. Молекулярный патогенез чувствительности к EBV у XLP, выявленный при анализе женщин-носителей с гетерозиготной экспрессией SAP. PLoS Biol (2011) 9: e1001187.DOI: 10.1371 / journal.pbio.1001187
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Rigaud S, Fondaneche MC, Lambert N, Pasquier B., Mateo V, Soulas P, et al. Дефицит XIAP у человека вызывает Х-связанный лимфопролиферативный синдром. Nature (2006) 444: 110–4. DOI: 10.1038 / nature05257
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Сноу А.Л., Марш Р.А., Крамми С.М., Рорс П., Янг Л.Р., Чжан К. и др. Апоптоз Т-клеток, индуцированный рестимуляцией, нарушается у пациентов с Х-сцепленным лимфопролиферативным заболеванием, вызванным дефицитом SAP. Дж. Клин Инвест (2009) 119: 2976–89. DOI: 10.1172 / JCI39518
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Чен Г., Тай А.К., Линь М., Чанг Ф., Терхорст К., Хубер Б.Т. Повышенная пролиферация CD8 + Т-клеток у мышей с дефицитом SAP связана с нарушением гибели клеток, вызванной активацией. Eur J Immunol (2007) 37: 663–74. DOI: 10.1002 / eji.200636417
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Агилар К., Латур С.Х-связанный ингибитор дефицита белка апоптоза: больше, чем Х-связанный лимфопролиферативный синдром. J Clin Immunol (2015) 35: 331–8. DOI: 10.1007 / s10875-015-0141-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Винс Дж. Э., Вонг В. В., Джентл I, Лоулор К. Э., Аллам Р., О’Рейли Л. и др. Ингибиторы белков апоптоза ограничивают зависимую от киназы RIP3 активацию интерлейкина-1. Иммунитет (2012) 36: 215–27. DOI: 10.1016 / j.immuni.2012.01.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60.Damgaard RB, Fiil BK, Speckmann C, Yabal M, zur Stadt U, Bekker-Jensen S и др. Мутации, вызывающие заболевание, в домене XIAP BIR2 нарушают NOD2-зависимую иммунную передачу сигналов. EMBO Mol Med (2013) 5: 1278–95. DOI: 10.1002 / emmm.201303090
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Криг А., Корреа Р., Гарнизон Дж. Б., Ле Неграте Дж., Валлийский К., Хуанг З. и др. XIAP обеспечивает передачу сигналов NOD посредством взаимодействия с RIP2. Proc Natl Acad Sci U S A (2009) 106: 14524–9.DOI: 10.1073 / pnas.01106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Speckmann C, Lehmberg K, Albert MH, Damgaard RB, Fritsch M, Gyrd-Hansen M, et al. Дефицит Х-сцепленного ингибитора апоптоза (XIAP): спектр проявлений, выходящих за рамки гемофагоцитарного лимфогистиоцитоза. Clin Immunol (2013) 149: 133–41. DOI: 10.1016 / j.clim.2013.07.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Агилар К., Ленуар К., Ламберт Н., Бег Б., Брусс Н., Каниони Д. и др.Характеристика болезни Крона у Х-сцепленных ингибиторов пациентов мужского пола с дефицитом апоптоза и симптоматических носителей женского пола. J Allergy Clin Immunol (2014) 134: 1131–41.e9. DOI: 10.1016 / j.jaci.2014.04.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Гу Л., Чжан Х, Лю Т., Чжоу С., Ду И, Сюн Дж. И др. Открытие двойных ингибиторов MDM2 и XIAP для лечения рака. Cancer Cell (2016) 30: 623–36. DOI: 10.1016 / j.ccell.2016.08.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65.Амманн С., Эллинг Р., Гирд-Хансен М., Дакерс Дж., Бредиус Р., Бернс С.О. и др. Новый функциональный тест для диагностики дефицита X-сцепленного ингибитора апоптоза (XIAP). Clin Exp Immunol (2014) 176: 394–400. DOI: 10.1111 / cei.12306
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Huck K, Feyen O, Niehues T., Ruschendorf F, Hubner N, Laws HJ, et al. У девочек, гомозиготных по индуцируемой IL-2 мутации Т-клеточной киназы, которая приводит к дефициту белка, развивается фатальная лимфопролиферация, связанная с EBV. Дж. Клин Инвест (2009) 119: 1350–8. DOI: 10.1172 / JCI37901
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Linka RM, Risse SL, Bienemann K, Werner M, Linka Y, Krux F, et al. Мутации потери функции в IL-2-индуцибельной киназе ITK у пациентов с EBV-ассоциированными лимфопролиферативными заболеваниями. Лейкемия (2012) 26: 963–71. DOI: 10.1038 / leu.2011.371
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68.Мансури Д., Махдавиани С.А., Халилзаде С., Мохаджерани С.А., Хасанзад М., Садр С. и др. Дефицит IL-2-индуцируемой Т-клеточной киназы с легочными проявлениями из-за диссеминированной инфекции вируса Эпштейна-Барра. Int Arch Allergy Immunol (2012) 158: 418–22. DOI: 10.1159 / 000333472
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Сервас Н.К., Кагдас Д., Бан С.А., Бинеманн К., Зальцер Э., Тезкан И. и др. Идентификация дефицита ITK как новой генетической причины идиопатической CD4 + Т-клеточной лимфопении. Кровь (2014) 124: 655–7. DOI: 10.1182 / кровь-2014-03-564930
CrossRef Полный текст | Google Scholar
70. Cipe FE, Aydogmus C, Serwas NK, Tugcu D, Demirkaya M, Bicici FA, et al. Дефицит ITK: как лечить ВЭБ перед лимфомой? Детский врач по раку крови (2015) 62: 2247–8. DOI: 10.1002 / pbc.25648
CrossRef Полный текст | Google Scholar
71. Кагдас Д., Эрман Б., Ханоглу Д., Тавил Б., Кусконмаз Б., Айдын Б. и др. Течение IL-2-индуцибельной Т-клеточной киназы в семье: лимфоматоидный гранулематоз, лимфома и аллогенная трансплантация костного мозга у одного брата или сестры; а в другом — смерть. Пересадка костного мозга (2017) 52: 126–9. DOI: 10.1038 / bmt.2016.185
CrossRef Полный текст | Google Scholar
72. Степенский П., Вайнтрауб М., Янир А., Ревель-Вилк С., Крук Ф., Хак К. и др. Дефицит IL-2-индуцируемой Т-клеточной киназы: клиническая картина и терапевтический подход. Haematologica (2011) 96: 472–6. DOI: 10.3324 / haematol.2010.033910
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Андреотти А.Х., Шварцберг П.Л., Джозеф Р.Э., Берг Л.Дж.Передача сигналов Т-клеток регулируется киназой семейства Tec, Itk. Cold Spring Harb Perspect Biol (2010) 2: a002287. DOI: 10.1101 / cshperspect.a002287
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Лю К.К., Баннелл С.К., Гурняк С.Б., Берг Л.Дж. Высвобождение кальция, инициированное Т-клеточным рецептором, не связано с емкостным поступлением кальция в Itk-дефицитные Т-клетки. J Exp Med (1998) 187: 1721–7. DOI: 10.1084 / jem.187.10.1721
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75.Фишер А.М., Мерсер Дж. К., Айер А., Рагин М. Дж., Август А. Регулирование миграции хемокинового рецептора 4 CXC с помощью тирозинкиназы ITK семейства Tec. J Biol Chem (2004) 279: 29816-20. DOI: 10.1074 / jbc.M312848200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Шеффер Е.М., Дебнат Дж., Яп Дж., Маквикар Д., Ляо XC, Литтман Д.Р. и др. Потребность в Tec-киназах Rlk и Itk в передаче сигналов Т-клеточного рецептора и иммунитета. Science (1999) 284: 638–41.DOI: 10.1126 / science.284.5414.638
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Капник С.М., Стинкомб Дж.С., Гриффитс Г.М., Шварцберг П.Л. Индуцибельная Т-клеточная киназа регулирует приобретение цитолитической способности и дегрануляции в CD8 (+) CTL. J Immunol (2017) 198: 2699–711. DOI: 10.4049 / jimmunol.1601202
CrossRef Полный текст | Google Scholar
78. Ли Ф.Й., Шень-Делаланд Б., Канеллопулу С., Дэвис Дж. К., Мэтьюз Х. Ф., Дуек Д. К. и др.Роль второго мессенджера Mg2 +, выявленная иммунодефицитом Т-клеток человека. Nature (2011) 475: 471–6. DOI: 10.1038 / nature10246
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Шейн-Делаланд Б., Ли Ф.Й., О’Коннор Г.М., Лукач М.Дж., Цзян П., Чжэн Л. и др. Mg2 + регулирует цитотоксические функции NK и CD8 Т-клеток при хронической EBV-инфекции через NKG2D. Наука (2013) 341: 186–91. DOI: 10.1126 / science.1240094
PubMed Аннотация | CrossRef Полный текст | Google Scholar
80.Бриджида I, Кириако М., Ди Чезаре С., Читтаро Д., Ди Маттео Дж., Джаннелли С. и др. Большая делеция гена MAGT1 у пациента с классической саркомой Капоши, лимфопенией CD4 и инфекцией EBV. J Clin Immunol (2017) 37: 32–5. DOI: 10.1007 / s10875-016-0341-y
CrossRef Полный текст | Google Scholar
81. Дхалла Ф, Мюррей С., Сэдлер Р., Шень-Делаланд Б., Садаока Т., Сойле Э. и др. Идентификация новой мутации в MAGT1 и прогрессирующей мультифокальной лейкоэнцефалопатии у 58-летнего мужчины с болезнью XMEN. J Clin Immunol (2015) 35: 112–8. DOI: 10.1007 / s10875-014-0116-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82. Патироглу Т., Халук Акар Х., Гилмор К., Унал Э., Акиф Оздемир М., Биби С. и др. Случай синдрома XMEN, представленный тяжелыми аутоиммунными нарушениями, имитирующими аутоиммунное лимфопролиферативное заболевание. Clin Immunol (2015) 159: 58–62. DOI: 10.1016 / j.clim.2015.04.015
CrossRef Полный текст | Google Scholar
83.Ли Ф.Й., Шень-Делаланд Б., Су Х., Узель Г., Мэтьюз Х., Ленардо М.Дж. Болезнь XMEN: новый первичный иммунодефицит, влияющий на регуляцию Mg2 + иммунитета против вируса Эпштейна-Барра. Кровь (2014) 123: 2148–52. DOI: 10.1182 / кровь-2013-11-538686
PubMed Аннотация | CrossRef Полный текст | Google Scholar
85. Li FY, Lenardo MJ, Chaigne-Delalande B. Потеря MAGT1 отменяет поток Mg2 +, необходимый для передачи сигналов Т-клеток, и приводит к новому первичному иммунодефициту человека. Magnes Res (2011) 24: S109–14.DOI: 10.1684 / mrh.2011.0286
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. Готру С.К., Гил-Пулидо Дж., Бейерсдорф Н., Дифенбах А., Беккер И.С., Фогтл Т. и др. Передний край: несбалансированный гомеостаз катионов в B-клетках с дефицитом MAGT1 нарушает регуляцию развития B-клеток и передачи сигналов у мышей. J Immunol (2018) 200 (8): 2529–34. DOI: 10.4049 / jimmunol.1701467
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87. Папуорт И.Ю., Ван Э.С., Роу М.Переход от латентной инфекции к продуктивной в В-клетках, инфицированных вирусом Эпштейна-Барра, связан с сенсибилизацией к уничтожению NK-клеток. J Virol (2007) 81: 474–82. DOI: 10.1128 / JVI.01777-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. van Montfrans JM, Hoepelman AI, Otto S, van Gijn M, van de Corput L, de Weger RA, et al. Дефицит CD27 связан с комбинированным иммунодефицитом и стойкой симптоматической вирусом EBV. J Allergy Clin Immunol (2012) 129: 787–93.e6. DOI: 10.1016 / j.jaci.2011.11.013
CrossRef Полный текст | Google Scholar
90. Алхайри О.К., Перес-Беккер Р., Дриссен Дж. Дж., Аболхассани Х., ван Монфранс Дж., Борт С. и др. Новые мутации в TNFRSF7 / CD27: клиническая, иммунологическая и генетическая характеристика дефицита CD27 человека. J Allergy Clin Immunol (2015) 136: 703–12.e10. DOI: 10.1016 / j.jaci.2015.02.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91. Идзава К., Мартин Э., Судаис К., Бруно Дж., Бутбоул Д., Родригес Р. и др.Унаследованный дефицит CD70 у людей показывает критическую роль пути CD70-CD27 в иммунитете к инфекции вируса Эпштейна-Барра. J Exp Med (2017) 214: 73–89. DOI: 10.1084 / jem.20160784
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92. Зальцер Е., Дашки С., Чу С., Гомберт М., Сантос-Валенте Е., Гинзель С. и др. Комбинированный иммунодефицит с угрожающим жизни ВЭБ-ассоциированным лимфопролиферативным заболеванием у пациентов с отсутствием функционального CD27. Haematologica (2013) 98: 473–8.DOI: 10.3324 / haematol.2012.068791
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Klein U, Rajewsky K, Kuppers R. Человеческий иммуноглобулин (Ig) M + IgD + В-клетки периферической крови, экспрессирующие поверхностный антиген клеток CD27, несут соматически мутированные гены вариабельной области: CD27 как общий маркер для соматически мутировавших В-клеток (памяти) . J Exp Med (1998) 188: 1679–89. DOI: 10.1084 / jem.188.9.1679
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94.Джейкобс Дж., Дескулмейстер В., Зваенепол К., Рольфо С., Тишина К., Ротти С. и др. CD70: новая мишень в иммунотерапии рака. Pharmacol Ther (2015) 155: 1–10. DOI: 10.1016 / j.pharmthera.2015.07.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Танье С.Г., Лю Ю.Дж., Аверса Дж., Филлипс Дж. Х., де Фрис Дж. Э. Идентификация функциональных В-клеток памяти селезенки человека по экспрессии CD148 и CD27. J Exp Med (1998) 188: 1691–703. DOI: 10.1084 / jem.188.9.1691
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96. Hendriks J, Gravestein LA, Tesselaar K, van Lier RA, Schumacher TN, Borst J. CD27 необходим для создания и длительного поддержания Т-клеточного иммунитета. Nat Immunol (2000) 1: 433–40. DOI: 10.1038 / 80877
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Abolhassani H, Edwards ES, Ikinciogullari A, Jing H, Borte S, Buggert M, et al. Комбинированный иммунодефицит и индуцированное вирусом Эпштейна-Барра В-клеточное новообразование у людей с наследственным дефицитом CD70. J Exp Med (2017) 214: 91–106. DOI: 10.1084 / jem.20160849
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99. Каорси Р., Русмини М., Вольпи С., Кьеза С., Пасторино С., Семента А. Р. и др. Дефицит CD70 из-за новой мутации у пациента с тяжелой хронической инфекцией ВЭБ, проявляющейся в виде периодической лихорадки. Фронт Иммунол (2017) 8: 2015. DOI: 10.3389 / fimmu.2017.02015
CrossRef Полный текст | Google Scholar
100. Мартин Э., Палмик Н., Санкуер С., Ленуар К., Хаук Ф., Монгеллаз С. и др.Дефицит CTP-синтазы 1 у человека показывает его центральную роль в пролиферации лимфоцитов. Nature (2014) 510: 288–92. DOI: 10.1038 / природа13386
PubMed Аннотация | CrossRef Полный текст | Google Scholar
101. Кучук З.Й., Чжан К., Филипович Л., Близинг Дж. Дж. Дефицит CTP-синтазы 1 у успешно пересаженных братьев и сестер с комбинированным иммунодефицитом и хронической активной инфекцией EBV. J Clin Immunol (2016) 36: 750–3. DOI: 10.1007 / s10875-016-0332-z
CrossRef Полный текст | Google Scholar
102.Грузовик Дж., Келли Д.Ф., Тейлор Дж. М., Кинцлер А. К., Лестер Т., Продавец А и др. Вариабельный фенотип и дискретные изменения иммунных фенотипов при дефиците CTP-синтазы 1: отчет о 2 братьях и сестрах. J Allergy Clin Immunol (2016) 138: 1722–5.e6. DOI: 10.1016 / j.jaci.2016.04.059
CrossRef Полный текст | Google Scholar
103. Эванс Д.Р., Гай Х.И. Биосинтез пиримидина у млекопитающих: свежий взгляд на древний путь. J Biol Chem (2004) 279: 33035-8. DOI: 10.1074 / JBC.R400007200
CrossRef Полный текст | Google Scholar
104. Стрей-Педерсен А., Жуанги Е., Крекер А., Бертуч А.А., Браун Б.С., Джангиани С.Н. и др. Сложные гетерозиготные мутации CORO1A у братьев и сестер с синдромом кожно-слизистого иммунодефицита, вызванным бородавчатой эпидермодисплазией, контагиозным моллюском и гранулематозной туберкулоидной лепрой. J Clin Immunol (2014) 34: 871–90. DOI: 10.1007 / s10875-014-0074-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
105.Shiow LR, Roadcap DW, Paris K, Watson SR, Grigorova IL, Lebet T, et al. Регулятор актина коронин 1A является мутантом у линии мышей с дефицитом тимуса и у пациента с тяжелым комбинированным иммунодефицитом. Nat Immunol (2008) 9: 1307–15. DOI: 10.1038 / ni.1662
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Мошоус Д., Мартин Э., Карпентье В., Лим А., Каллебаут И., Каниони Д. и др. Секвенирование всего экзома выявляет дефицит коронина-1A у 3 братьев и сестер с иммунодефицитом и EBV-ассоциированной лимфопролиферацией B-клеток. J Allergy Clin Immunol (2013) 131: 1594–603. DOI: 10.1016 / j.jaci.2013.01.042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107. Пунвани Д., Пельц Б., Ю. Дж., Арва Н.С., Шафернак К., Кондратович К. и др. Коронин-1А: иммунодефицит у людей и мышей. J Clin Immunol (2015) 35: 100–7. DOI: 10.1007 / s10875-015-0130-z
CrossRef Полный текст | Google Scholar
108. Yee CS, Massaad MJ, Bainter W., Ohsumi T.K., Foger N, Chan AC и др.Рецидивирующие вирусные инфекции, связанные с гомозиготной мутацией CORO1A, которая нарушает олигомеризацию и ассоциацию цитоскелета. J Allergy Clin Immunol (2016) 137: 879–88.e2. DOI: 10.1016 / j.jaci.2015.08.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
111. Фогер Н., Рангелл Л., Даниленко Д.М., Чан А.С. Потребность в коронине 1 в трафике Т-лимфоцитов и клеточном гомеостазе. Наука (2006) 313: 839–42. DOI: 10.1126 / science.1130563
PubMed Аннотация | CrossRef Полный текст | Google Scholar
112.Мюллер П., Масснер Дж., Джаячандран Р., Комбалюзье Б., Альбрехт I, Гатфилд Дж. И др. Регулирование выживаемости Т-клеток посредством опосредованного коронином-1 генерации инозитол-1,4,5-трифосфата и мобилизации кальция после срабатывания Т-клеточного рецептора. Nat Immunol (2008) 9: 424–31. DOI: 10.1038 / ni1570
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113. Мейс Э.М., Orange JS. Функция литического иммунного синапса требует деконструкции филаментозного актина коронином 1A. Proc Natl Acad Sci U S A (2014) 111: 6708–13.DOI: 10.1073 / pnas.1314975111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
114. Kaminski S, Hermann-Kleiter N, Meisel M, Thuille N, Cronin S, Hara H, et al. Коронин 1A является важным регулятором сигнального пути рецептора TGFbeta / SMAD3 в Th27 CD4 (+) Т-клетках. J Autoimmun (2011) 37: 198–208. DOI: 10.1016 / j.jaut.2011.05.018
CrossRef Полный текст | Google Scholar
115. Siegmund K, Thuille N, Posch N, Fresser F, Baier G. Новая протеинкиназа C тета: комплекс коронина 1A в Т-лимфоцитах. Сигнал сотовой связи (2015) 13:22. DOI: 10.1186 / s12964-015-0100-3
CrossRef Полный текст | Google Scholar
116. Джаячандран Р., Лю Х, Боседасгупта С., Мюллер П., Чжан С.Л., Мошоус Д. и др. Коронин 1 регулирует познание и поведение посредством модуляции передачи сигналов цАМФ / протеинкиназы А. PLoS Biol (2014) 12: e1001820. DOI: 10.1371 / journal.pbio.1001820
PubMed Аннотация | CrossRef Полный текст | Google Scholar
117. Пик Р., Бегандт Д., Стокер Т.Дж., Сальвермозер М., Том С., Ботчер Р.Т. и др.Коронин 1А, новый игрок в биологии интегринов, контролирует перенос нейтрофилов при врожденном иммунитете. Кровь (2017) 130: 847–58. DOI: 10.1182 / кровь-2016-11-749622
PubMed Аннотация | CrossRef Полный текст | Google Scholar
119. Винтер С., Мартин Э., Бутбул Д., Ленуар С., Буджемаа С., Пети А. и др. Потеря RASGRP1 у людей снижает экспансию Т-клеток, что приводит к чувствительности к вирусу Эпштейна-Барра. EMBO Mol Med (2018) 10 (2): 188–99. DOI: 10.15252 / emmm.201708292
CrossRef Полный текст | Google Scholar
120.Зальцер Э., Кагдас Д., Хонс М., Мейс Э.М., Гарнкарц В., Петрончки О.Ю. и др. Дефицит RASGRP1 вызывает иммунодефицит с нарушением динамики цитоскелета. Nat Immunol (2016) 17: 1352–60. DOI: 10.1038 / ni.3575
PubMed Аннотация | CrossRef Полный текст | Google Scholar
121. Platt CD, Fried AJ, Hoyos-Bachiloglu R, Usmani GN, Schmidt B., Whangbo J, et al. Комбинированный иммунодефицит с EBV-положительной В-клеточной лимфомой и бородавчатой эпидермодисплазией из-за новой гомозиготной мутации в RASGRP1. Clin Immunol (2017) 183: 142–4. DOI: 10.1016 / j.clim.2017.08.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
122. Кортум Р.Л., Рукетт-Джазданян А.К., Самельсон Л.Е. Передача сигналов киназы, регулируемая Ras и внеклеточными сигналами, в тимоцитах и Т-клетках. Trends Immunol (2013) 34: 259–68. DOI: 10.1016 / j.it.2013.02.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
123. Хогквист К. RasGRP: недостающее звено для активации Ras в тимоцитах. Trends Immunol (2001) 22:69. DOI: 10.1016 / S1471-4906 (00) 01845-7
CrossRef Полный текст | Google Scholar
124. Roose JP, Mollenauer M, Gupta VA, Stone J, Weiss A. Путь диацилглицерин-протеинкиназы C-RasGRP1 направляет активацию Ras при стимуляции антигенного рецептора Т-клеток. Mol Cell Biol (2005) 25: 4426–41. DOI: 10.1128 / MCB.25.11.4426-4441.2005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
125. Warnecke N, Poltorak M, Kowtharapu BS, Arndt B, Stone JC, Schraven B, et al.Активация Erk, опосредованная TCR, не зависит от Sos и Grb2 в периферических Т-клетках человека. EMBO Rep (2012) 13: 386–91. DOI: 10.1038 / embor.2012.17
PubMed Аннотация | CrossRef Полный текст | Google Scholar
126. Мао Х, Ян В., Латур С., Ян Дж., Винтер С., Чжэн Дж. И др. Мутация RASGRP1 при заболевании, подобном аутоиммунному лимфопролиферативному синдрому. J Allergy Clin Immunol (2017). DOI: 10.1016 / j.jaci.2017.10.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
127.Бартлетт А., Бульманн Дж., Стоун Дж., Лим Б., Баррингтон Р.А. Множественное нарушение контрольной точки толерантности к В-клеткам у мышей с дефицитом Rasgrp1. J Immunol (2013) 191: 3605–13. DOI: 10.4049 / jimmunol.1202892
PubMed Аннотация | CrossRef Полный текст | Google Scholar
128. Дейли С.Р., Коакли К.М., Ху Д.Й., Рэндалл К.Л., Дженн С.Н., Лимнандер А. и др. Мутация Rasgrp1 увеличивает экспрессию CD44 наивных Т-клеток и приводит к mTOR-зависимому накоплению Т-клеток Helios (+) и аутоантител. Элиф (2013) 2: e01020.DOI: 10.7554 / eLife.01020
CrossRef Полный текст | Google Scholar
129. Сан К., Молинерос Дж. Э., Лугер Л. Л., Чжоу XJ, Ким К., Окада Ю. и др. Генотипирование с высокой плотностью иммунных локусов позволяет выявить новые варианты риска СКВ у лиц азиатского происхождения. Нат Генет (2016) 48: 323–30. DOI: 10,1038 / нг.3496
PubMed Аннотация | CrossRef Полный текст | Google Scholar
130. Zhou XJ, Nath SK, Qi YY, Sun C, Hou P, Zhang YM и др. Новым выявлены ассоциации вариантов RGS1 и RASGRP1 при нефропатии IgA. Sci Rep (2016) 6: 35781. DOI: 10.1038 / srep35781
PubMed Аннотация | CrossRef Полный текст | Google Scholar
131. Qu HQ, Грант С.Ф., Брэдфилд Дж. П., Ким С., Фракелтон Е., Хаконарсон Х. и др. Связь RASGRP1 с диабетом 1 типа выявляется при комбинированном наблюдении за двумя полногеномными исследованиями. J Med Genet (2009) 46: 553–4. DOI: 10.1136 / jmg.2009.067140
PubMed Аннотация | CrossRef Полный текст | Google Scholar
132. Паскье Б., Инь Л., Фонданеч М.С., Релузат Ф., Блох-Кейра С., Ламберт Н. и др.Дефектное развитие NKT-клеток у мышей и людей, лишенных адаптера SAP, продукта гена X-сцепленного лимфопролиферативного синдрома. J Exp Med (2005) 201: 695–701. DOI: 10.1084 / jem.20042432
PubMed Аннотация | CrossRef Полный текст | Google Scholar
133. Gadue P, Stein PL. Предшественники NK-Т-клеток обладают дифференциальной регуляцией цитокинов и требуют Itk для эффективного созревания. J Immunol (2002) 169: 2397–406. DOI: 10.4049 / jimmunol.169.5.2397
PubMed Аннотация | CrossRef Полный текст | Google Scholar
134.Felices M, Berg LJ. Киназы Tec Itk и Rlk регулируют созревание NKT-клеток, продукцию цитокинов и выживаемость. J Immunol (2008) 180: 3007–18. DOI: 10.4049 / jimmunol.180.5.3007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
135. Шен С., Чен Й, Горентла Б.К., Лу Дж., Стоун Дж. С., Чжун ХР. Критические роли RasGRP1 в развитии инвариантных NKT-клеток. J Immunol (2011) 187: 4467–73. DOI: 10.4049 / jimmunol.1003798
PubMed Аннотация | CrossRef Полный текст | Google Scholar
136.Николс К.Э., Хом Дж., Гонг С.И., Гангули А., Ма С.С., Кэннонс Дж. Л. и др. Регулирование развития NKT-клеток с помощью SAP, белка, дефектного в XLP. Nat Med (2005) 11: 340–5. DOI: 10,1038 / нм1189
PubMed Аннотация | CrossRef Полный текст | Google Scholar
137. Дас Р., Бассири Х., Гуан П., Винер С., Банерджи П.П., Чжун М.К. и др. Адаптерная молекула SAP играет важную роль во время инвариантной цитотоксичности NKT-клеток и образования литических синапсов. Кровь (2013) 121: 3386–95.DOI: 10.1182 / кровь-2012-11-468868
PubMed Аннотация | CrossRef Полный текст | Google Scholar
138. Герарт С., Сиберил С., Мартин Э., Ленуар К., Агилар С., Пикард С. и др. Клетки iNKT и MAIT человека проявляют PLZF-зависимую проапоптотическую предрасположенность, которая уравновешивается XIAP. Кровь (2013) 121: 614–23. DOI: 10.1182 / кровь-2012-09-456095
PubMed Аннотация | CrossRef Полный текст | Google Scholar
139. Chung BK, Tsai K, Allan LL, Zheng DJ, Nie JC, Biggs CM и др.Врожденный иммунный контроль В-клеток, инфицированных ВЭБ, с помощью инвариантных естественных Т-клеток-киллеров. Кровь (2013) 122: 2600–8. DOI: 10.1182 / кровь-2013-01-480665
PubMed Аннотация | CrossRef Полный текст | Google Scholar
140. Юлин Х, Жуйцзин X, Ли Л., Сян Дж., Руи З., Юйцзюань В. и др. EBV-индуцированные CD8 + NKT-клетки человека подавляют онкогенез за счет EBV-ассоциированных злокачественных новообразований. Cancer Res (2009) 69: 7935–44. DOI: 10.1158 / 0008-5472.CAN-09-0828
PubMed Аннотация | CrossRef Полный текст | Google Scholar
141.Сяо В., Ли Л., Чжоу Р., Сяо Р., Ван И, Цзи Х и др. EBV-индуцированные человеческие CD8 (+) NKT-клетки синергируют CD4 (+) NKT-клетки, подавляя EBV-ассоциированные опухоли при индукции Th2-смещения. Cell Mol Immunol (2009) 6: 367–79. DOI: 10,1038 / cmi.2009.48
PubMed Аннотация | CrossRef Полный текст | Google Scholar
142. Окада С., Маркл Дж. Г., Диник Е. К., Меле Ф., Авербух Д., Лагос М. и др. ИММУНОДЕФИЦИТ. Нарушение иммунитета к Candida и Mycobacterium у людей с биаллельными мутациями RORC. Наука (2015) 349: 606–13. DOI: 10.1126 / science.aaa4282
PubMed Аннотация | CrossRef Полный текст | Google Scholar
143. Аззи Т., Лунеманн А., Мурер А., Уеда С., Безиат В., Мальмберг К.Дж. и др. Роль рано дифференцированных естественных клеток-киллеров в инфекционном мононуклеозе. Кровь (2014) 124: 2533–43. DOI: 10.1182 / кровь-2014-01-553024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
144. Велли Ф, Барлогис В., Валлентин Б., Невен Б., Пипероглу С., Эббо М. и др.Доказательства избыточности врожденных лимфоидных клеток у человека. Nat Immunol (2016) 17: 1291–9. DOI: 10.1038 / ni.3553
PubMed Аннотация | CrossRef Полный текст | Google Scholar
145. Парк ГБ, Ким Ю.С., Ли Х.К., Сон Х., Чо Д.Х., Ли В.Дж. и др. Стресс-опосредованный эндоплазматическим ретикулумом апоптоз В-клеток, трансформированных EBV, путем перекрестного связывания CD70 зависит от генерации активных форм кислорода и активации путей p38 MAPK и JNK. J Immunol (2010) 185: 7274–84.DOI: 10.4049 / jimmunol.1001547
PubMed Аннотация | CrossRef Полный текст | Google Scholar
147. Boztug H, Hirschmugl T, Holter W., Lakatos K, Kager L, Trapin D, et al. Гаплонедостаточность NF-kappaB1, вызывающая иммунодефицит и лимфопролиферацию, вызванную ВЭБ. J Clin Immunol (2016) 36: 533–40. DOI: 10.1007 / s10875-016-0306-1
CrossRef Полный текст | Google Scholar
148. Nehme NT, Schmid JP, Debeurme F, Andre-Schmutz I., Lim A., Nitschke P, et al.Мутации MST1 при аутосомно-рецессивном первичном иммунодефиците, характеризующемся нарушением выживаемости наивных Т-клеток. Кровь (2012) 119: 3458–68. DOI: 10.1182 / кровь-2011-09-378364
PubMed Аннотация | CrossRef Полный текст | Google Scholar
149. Абдоллахпур Х., Аппасвами Г., Котларз Д., Дистелхорст Дж., Байер Р., Шаффер А.А. и др. Фенотип дефицита STK4 человека. Кровь (2012) 119: 3450–7. DOI: 10.1182 / кровь-2011-09-378158
PubMed Аннотация | CrossRef Полный текст | Google Scholar
150.Du S, Scuderi R, Malicki DM, Willert J, Bastian J, Weidner N. Ходжкинские и неходжкинские лимфомы, возникающие у двух братьев с синдромом Вискотта-Олдрича, и обзор литературы. Pediatr Dev Pathol (2011) 14: 64–70. DOI: 10.2350 / 10-01-0787-CR.1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
151. Aydin SE, Kilic SS, Aytekin C, Kumar A, Porras O, Kainulainen L, et al. Дефицит DOCK8: клинико-иммунологический фенотип и варианты лечения — обзор 136 пациентов. J Clin Immunol (2015) 35: 189–98. DOI: 10.1007 / s10875-014-0126-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
153. Колтер Т.И., Чандра А., Бэкон С.М., Бабар Дж., Кертис Дж., Скреатон Н. и др. Клинический спектр и особенности синдрома активированной фосфоинозитид-3-киназы δ: крупное когортное исследование пациентов. J Allergy Clin Immunol (2016) 139 (2): 597–606.e4. DOI: 10.1016 / j.jaci.2016.06.021
CrossRef Полный текст | Google Scholar
154.Ньюэлл А., Дади Х., Голдберг Р., Нган Б.Я., Грюнебаум Э., Ройфман С.М. Диффузная большая В-клеточная лимфома как признак дефицита Zap-70. J Allergy Clin Immunol (2011) 127: 517–20. DOI: 10.1016 / j.jaci.2010.09.016
CrossRef Полный текст | Google Scholar
155. Schuetz C, Huck K, Gudowius S, Megahed M, Feyen O, Hubner B и др. Иммунодефицитное заболевание с мутациями RAG и гранулемами. N Engl J Med (2008) 358: 2030–8. DOI: 10.1056 / NEJMoa073966
PubMed Аннотация | CrossRef Полный текст | Google Scholar
156.Felgentreff K, Lee YN, Frugoni F, Du L, van der Burg M, Giliani S и др. Функциональный анализ встречающихся в природе мутаций DCLRE1C и корреляции с клиническим фенотипом дефицита ARTEMIS. J Allergy Clin Immunol (2015) 136: 140–150.e7. DOI: 10.1016 / j.jaci.2015.03.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
157. Марш Р.А., Рао К., Сатвани П., Лемберг К., Мюллер И., Ли Д. и др. Аллогенная трансплантация гемопоэтических клеток при дефиците XIAP: международное исследование показывает плохие результаты. Кровь (2013) 121: 877–83. DOI: 10.1182 / кровь-2012-06-432500
PubMed Аннотация | CrossRef Полный текст | Google Scholar
158. Ворт А.Дж., Николаева О., Кьеза Р., Рао К., Вейс П., Амролия П.Дж. Успешная трансплантация стволовых клеток с кондиционированием на основе антител при дефиците XIAP с рефрактерным гемофагоцитарным лимфогистиоцитозом. Кровь (2013) 121: 4966–8. DOI: 10.1182 / кровь-2013-01-478735
CrossRef Полный текст | Google Scholar
159. Оно С., Окано Т., Хосино А., Янагимати М., Хамамото К., Накадзава И. и др.Трансплантация гемопоэтических стволовых клеток при дефиците XIAP в Японии. J Clin Immunol (2017) 37: 85–91. DOI: 10.1007 / s10875-016-0348-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
X-связанный лимфопролиферативный синдром — NORD (Национальная организация по редким заболеваниям)
УЧЕБНИКИ
Kobayashi RH. Х-связанный лимфопролиферативный синдром. В: Справочник НОРД по редким заболеваниям. Липпинкотт Уильямс и Уилкинс. Филадельфия, Пенсильвания. 2003: 400.
Джейнвей Калифорния младший, Трэверс П., Уолпорт М., Шломчик М.Дж. Иммунобиология, 6 изд. Издательство Garland Science. Нью-Йорк, штат Нью-Йорк; 2005: 486-87.
Франк М.М., Остин К.Ф., Кламан Н.Н. и др. Ред. Иммунологические заболевания Самтера. 5-е изд. Литтл Браун и компания, Бостон, Массачусетс; 1995: 407.
СТАТЬИ В ЖУРНАЛЕ
Бхат Р., Эйссманн П., Эндт Дж., Хоффманн С., Ватцл С. Тонкая настройка иммунных ответов на рецепторы, связанные с SLAM. J Leukoc Biol. 2006; 79: 417-24.
Erdos M, Uzvolgyi E, Nemes Z, Torok O, et al.Характеристика новой болезненной мутации Sh3D1A в семье с Х-сцепленным пролиферативным заболеванием. Hum Mutat. 2005; 25: 506.
Табата Ю., Вильянуэва Дж., Ли С.М., Чжан К. и др. Быстрое обнаружение внутриклеточного белка Sh3D1A в цитотоксических лимфоцитах пациентов с Х-сцепленным лимфопролиферативным заболеванием и членов их семей. Кровь. 2005; 105: 3066-71.
Латур С., Вейлетт А. Семейство адаптеров SAP в иммунной регуляции. Semin Immunol. 2004; 16: 409-19.
Энгель П., Эк MJ, Терхорст К.Семейства SAP и SLAM в иммунных реакциях и Х-сцепленном лимфопролиферативном заболевании. Nat Rev Immunol. 2003; 3: 813-21.
ИЗ ИНТЕРНЕТА
МакКусик В.А., изд. Интернет-Менделирующее наследование в человеке (OMIM). Университет Джона Хопкинса. Лимфопролиферативный синдром, Х-сцепленный, регистрационный номер; 308240: Дата последнего редактирования; 20.07.2005.
Х-сцепленное лимфопролиферативное заболевание. Больница Грейт-Ормонд-стрит для детей NHS Trust. Информационный лист. nd. 3 стр.
www.teamhartley.co.uk/whatis.asp
Х-связанный лимфопролиферативный синдром. Первичные иммунодефицитные заболевания. Ресурсный центр по первичному иммунодефициту. 2006 Фонд Джеффри Моделла. 4 стр.
www.info4pi.org
Что такое XLP? XLP Canada. nd. 1шт.
www.xlp.ca/what.html
Saville MW. Лимфпролиферативный синдром, связанный с Х-хромосомой. эмедицина. Последнее обновление: 29 октября 2004 г. 5 стр.
www.emedicine.com/med/topic1370.htm
Winter SS. Лимфопролиферативные заболевания.эмедицина. Последнее обновление: 7 апреля 2006 г. 5 стр.
www.emedicine.com/ped/topic1345.htm
Р. Ким, М. Эми и К. Танабе, Иммуноредактирование рака от иммунного надзора к иммунному бегству, Иммунология, том 1, выпуск 1, стр. 1-14, 2007.
DOI: 10.1046 / j.1440- 1711.2002.01115.x
Р. Марин, Ф. Руис-кабелло, С. Педриначи, Р. Мендес и П. Хименес, Анализ экспрессии HLA-E в опухолях человека, Иммуногенетика, том 54, выпуск 11, стр. 767-775, 2003 г.
И.Альгарра, А. Гарсия-лора, Т. Кабрера, Ф. Руис-Кабелло и Ф. Гарридо, Выбор вариантов опухоли с измененной экспрессией классических и неклассических молекул MHC класса I: последствия для иммунного ускользания от опухоли, Иммунология рака, иммунотерапия , vol.53, issue.10, pp.904-910, 2004.
DOI: 10.1007 / s00262-004-0517-9
М. Камполи и С. Ферроне, Изменения антигена HLA в злокачественных клетках: эпигенетические механизмы и биологическое значение, Онкоген, том 14, выпуск 45, стр. 5869-5885, 2008.
DOI: 10.1128 / MCB.20.7.2592-2603.2000
Н. Руа-Фрейсс, П. Моро, С. Ферроне и Э. Карозелла, HLA-G-белки при раке: обеспечивают ли они механизм выхода опухолевых клеток ?, Исследования рака, том 65, выпуск 22, стр. .10139-10144, 2005.
DOI: 10.1158 / 0008-5472.CAN-05-0097
Б. Селигер, Х. Абкен и С. Ферроне, Экспрессия HLA-G и MIC в опухолях и их роль в противоопухолевом иммунитете, Тенденции в иммунологии, том 24, выпуск 2, стр.82-87, 2003 .
DOI: 10.1016 / S1471-4906 (02) 00039-X
Н.Бангиа и С. Ферроне, Модуляция механизма презентации антигена (APM) и растворимые молекулы HLA в опухолевом микроокружении: обеспечивают ли они клеткам опухоли механизмы спасения от распознавания цитотоксическими Т-лимфоцитами?, Иммунологические исследования, том 90, выпуск 3–4 , pp.3-4, 2006.
DOI: 10.1038 / 226366a0
М. Камполи и С. Ферроне, Механизмы ускользания от опухоли: потенциальная роль растворимых антигенов HLA и лигандов, активирующих NK-клетки, Тканевые антигены, том 23, выпуск 4, стр. 321-334, 2008.
DOI: 10.1111 / j.1399-0039.2008.01106.x
Р. Бахри, Ф. Хирш, А. Хосе, Н. Руас-Фрейсс и Н. Бидере, Растворимый HLA-G ингибирует прогрессирование клеточного цикла в аллореактивных Т-лимфоцитах человека, Журнал иммунологии, том 176, выпуск 3. , pp.1331-1339, 2006.
DOI: 10.4049 / jimmunol.176.3.1331
P. Contini, M. Ghio, A. Poggi, G. Filaci и F. Indiveri, Растворимые молекулы HLA-A, -B, -C и -G индуцируют апоптоз в T- и NK-клетках CD8 + и ингибируют цитотоксический T ?? β-клеточная активность посредством лигирования CD8, European Journal of Immunology, vol.33, issue 1, pp.125-134, 2003.
DOI: 10.1002 / immu.2003
W. Tabayoyong и N. Zavazava, Повторное посещение Soluble HLA, Leukemia Research, том 31, выпуск 2, стр.121-125, 2007.
DOI: 10.1016 / j.leukres.2006.06.008
URL: http: / /www.ncbi.nlm.nih.gov/pmc/articles/PMC1876709
Л. Дерре, М. Корвайзье, Б. Шарро, А. Моро и Э. Годфруа, Экспрессия и высвобождение HLA-E клетками меланомы и меланоцитами: потенциальное влияние на ответ цитотоксических эффекторных клеток, Журнал иммунологии, т.177, выпуск 5, стр. 3100-3107, 2006.
DOI: 10.4049 / jimmunol.177.5.3100
Л. Дерре, М. Корвайзье, М. Пандольфино, Э. Диц и Ф. Жотеро, Экспрессия CD94 / NKG2-A на Т-лимфоцитах человека индуцируется IL-12: последствия для адоптивной иммунотерапии, Журнал иммунологии, vol.168, issue.10, pp.4864-4870, 2002.
DOI: 10.4049 / jimmunol.168.10.4864
L. Drean, E. Vely, F. Olcese, L. Cambiaggi, A. Guia et al., Ингибирование антиген-индуцированного ответа Т-клеток и индуцированной антителами цитотоксичности NK-клеток с помощью NKG2A: ассоциация NKG2A с SHP-1 и Протеин-тирозинфосфатазы SHP-2, European Journal of Immunology, vol.24, issue 1, pp.264-276, 1998.
DOI: 10.1002 / (SICI) 1521-4141 (199801) 28:01 <264 :: AID-IMMU264> 3.0.CO; 2-O
К. Мальмберг, В. Левицкий, Х. Норелл, К. Дематос и М. Карлстен, IFN-?? защищает краткосрочные клеточные линии карциномы яичников от лизиса CTL посредством CD94 / NKG2A-зависимого механизма, Journal of Clinical Investigation, том 110, выпуск 10, стр. 1515-1523, 2002.
DOI: 10.1172 / JCI0215564
Д. Спейзер, М. Питтет, Д. Валмори, Р. Данбар и Д. Римольди, Экспрессия in vivo естественных рецепторов, ингибирующих клетки-киллеры, с помощью меланомы человека — специфических цитолитических Т-лимфоцитов, Журнал экспериментальной медицины, вып.155, выпуск 6, стр. 775-782, 1999.
DOI: 10.1002 / (SICI) 1521-4141 (199805) 28:05 <1611 :: AID-IMMU1611> 3.0.CO; 2-6
V. Rebmann, H. Nuckel, U. Duhrsen и H. Grosse-wilde, HLA-G в B-хроническом лимфоцитарном лейкозе: клиническая значимость и функциональные последствия, Семинары по биологии рака, том 17, выпуск 6, стр. .430-435, 2007.
DOI: 10.1016 / j.semcancer.2007.06.011
В. Ребманн, Дж. Регель, Д. Столке и Х. Гросс-Уайлд, Секреция молекул sHLA-G при злокачественных новообразованиях, Семинары по биологии рака, т.13, выпуск 5, стр. 371-377, 2003.
DOI: 10.1016 / S1044-579X (03) 00028-2
В. Ребманн, С. Вагнер и Х. Гросс-Вайлд, Экспрессия HLA-G при злокачественной меланоме, Семинары по биологии рака, том 17, выпуск 6, стр. 422-429, 2007.
DOI: 10.1016 / j.semcancer.2007.06.010
П. Шутт, Б. Шутт, М. Свитала, С. Бауэр и Г. Стаматис, Прогностическая значимость растворимого лейкоцитарного антигена человека ??? G и общих молекул человеческого лейкоцитарного антигена класса I у пациентов с раком легких, Human Immunology, vol. .71, вып.5, с.489-495, 2010.
DOI: 10.1016 / j.humimm.2010.02.015
Y. Sebti, L. Friec, G. Pangault, C. Gros, F. Drenou et al., Растворимые молекулы HLA-G увеличиваются при лимфопролиферативных заболеваниях, иммунология человека, том 64, выпуск 11, стр.1093- 1101, 2003.
DOI: 10.1016 / j.humimm.2003.08.345
C. Zhu, C. Wang, X. Zhang, J. Zhang и W. Li, Уровни sHLA-G в сыворотке: полезный индикатор для дифференциации колоректального рака от доброкачественных колоректальных заболеваний, International Journal of Cancer, vol.66, issue 3, pp.617-622, 2011.
DOI: 10.1002 / ijc.25372
Г. Сингер, В. Ребманн, Ю. Чен, Х. Лю и С. Али, HLA-G является потенциальным онкомаркером при злокачественном асците, Clin Cancer Res, том 9, выпуск 12, стр.4460- 4464, 2003.
N. Arreygue-garcia, A. Daneri-navarro, A. Del-toro-arreola, A. Cid-arregui и O. Gonzalez-ramella, Повышенный уровень сыворотки основного комплекса гистосовместимости цепи A класса I (MICA) белка и снижение экспрессии NKG2D на NK и Т-клетках у пациентов с раком шейки матки и предшественниками, BMC Cancer, vol.33, вып.1, стр.16, 2008.
DOI: 10.1002 / immu.2003
С. Холденридер, П. Стибер, А. Петерфи, Д. Нагель и А. Стейнл, Растворимый MICA при злокачественных заболеваниях, Международный журнал рака, том 53, выпуск 3, стр. 684-687, 2006.
DOI: 10.1002 / ijc.21382
S. Holdenrieder, P. Stieber, A. Peterfi, D. Nagel и A. Steinle, Растворимый MICB при злокачественных заболеваниях: анализ диагностической значимости и корреляции с растворимым MICA, Иммунология рака, иммунотерапия, т.285, вып. 12, стр. 1584-1589, 2006.
DOI: 10.1007 / s00262-006-0167-1
Э. Леви, М. Бьянкини, В. Эйв, Э. Баррио, М. Браво и др., Белок лейкоцитарного антигена-Е человека сверхэкспрессируется при первичном колоректальном раке человека, Международный журнал онкологии, том 32, выпуск 3 , pp.633-641, 2008.
DOI: 10.3892 / ijo.32.3.633
А. Спраг и Р. Халил, Воспалительные цитокины при сосудистой дисфункции и сосудистых заболеваниях, Биохимическая фармакология, том 78, выпуск 6, стр. 539-552, 2009.
DOI: 10.1016 / j.bcp.2009.04.029
S. Coupel, A. Moreau, M. Hamidou, V. Horejsi и J. Soulillou, Экспрессия и высвобождение растворимого HLA-E является иммунорегуляторным свойством активации эндотелиальных клеток, Кровь, том 109, выпуск 7, стр. .2806-2814, 2007.
DOI: 10.1182 / blood-2006-06-030213
О. Холманских, Н. Ван-барен, Ф. Брассер, С. Оттавиани, Дж. Ванакер, Интерлейкины 1 ?? и 1 ?? секретируемые некоторыми линиями клеток меланомы, сильно снижают экспрессию MITF-M и дифференцировочных антигенов меланоцитов, International Journal of Cancer, vol.125, issue.7, pp.1625-1636, 2010.
DOI: 10.1002 / ijc.25182
С. Йерува, Г. Рамадори и Д. Раддац, NF — ?? B-зависимая синергическая регуляция экспрессии гена CXCL10 с помощью IL-1 ?? и IFN- ?? в линиях эпителиальных клеток кишечника человека, International Journal of Colorectal Disease, том 19, выпуск 3, стр. 305-317, 2008.
DOI: 10.1007 / s00384-007-0396-6
С. Бракарда, Дж. Беллмунт, Б. Меличар, С. Негриер и Э. Баджетта, Общая выживаемость пациентов с метастатической почечно-клеточной карциномой, первоначально получавших бевацизумаб плюс интерферон-?? 2a и последующую терапию ингибиторами тирозинкиназы: a ретроспективный анализ III фазы исследования AVOREN, BJU International, vol.76, выпуск 2, стр.214-219, 2011.
DOI: 10.1111 / j.1464-410X.2010.09707.x
С. Угурель, В. Ребманн, С. Ферроне, В. Тилген и Х. Гросс-Уайлд, Уровень растворимого лейкоцитарного антигена-G в сыворотке крови повышен у пациентов с меланомой и дополнительно повышается интерфероном-? иммунотерапия, Рак, том 42, выпуск 2, стр. 369-376, 2001.
DOI: 10.1002 / 1097-0142 (20010715) 92: 2 <369 :: AID-CNCR1332> 3.0.CO; 2-U
С. Мишлен, К. Галлегос, Д. Дубнер, Б. Фавье и Е. Карозелла, Ионизирующее излучение модулирует поверхностную экспрессию лейкоцитарного антигена-G человека в клеточной линии меланомы человека, Human Immunology, vol.70, вып. 12, стр. 1010-1015, 2009.
DOI: 10.1016 / j.humimm.2009.07.030
Д. Бейнбридж, С. Эллис и И. Сарджент, HLA-G подавляет пролиферацию CD4 + Т-лимфоцитов, Журнал репродуктивной иммунологии, том 48, выпуск 1, стр. 17-26, 2000.
DOI: 10.1016 / S0165-0378 (00) 00070-X
С. Фурнель, М. Агерре-гирр, Х. Хук, Ф. Ленфант и А. Алам, Передний край: растворимый HLA-G1 запускает опосредованный лигандом CD95 / CD95 апоптоз в активированных клетках CD8 + путем взаимодействия с CD8, The Journal иммунологии, т.164, issue.12, pp.6100-6104, 2000.
DOI: 10.4049 / jimmunol.164.12.6100
F. Gros, F. Cabillic, O. Toutirais, A. Maux и Y. Sebti, Растворимые молекулы HLA-G ухудшают перекрестные помехи естественных киллеров / дендритных клеток через ингибирование дендритных клеток, Европейский журнал иммунологии, том 43, выпуск. 3, pp.742-749, 2008.
DOI: 10.1002 / eji.200736918
Н. Rouas-freiss, R. Goncalves, C. Menier, J. Dausset и E. Carosella, Прямые доказательства в поддержку роли HLA-G в защите плода от цитолиза естественных киллеров матки матери, Труды Национальной Академии наук, т.94, issue.21, pp.94-11520, 1997.
DOI: 10.1073 / pnas.94.21.11520
В. Гро, Дж. Ву, К. Йи и Т. Спис, Растворимые лиганды МИК, полученные из опухоли, ухудшают экспрессию NKG2D и активацию Т-клеток, Nature, том 17, выпуск 6908, стр. 734-738, 2002.
DOI: 10.1126 / science.285.5428.730
М. Чжун, X. Венг, З. Лян, С. Лу и Дж. Ли, Димеризация растворимого HLA-G с помощью фрагмента IgG-Fc усиливает опосредованное ILT2 ингибирование аллоответа Т-клеток, Трансплантация, том 87, вып.1, с.8-15, 2009.
DOI: 10.1097 / TP.0b013e31818b6141
А. Перир, Г. Фрегни, С. Виттнебель, С. Гад и М. Аллард, Мутации гена фон Хиппеля-Линдау придают повышенную чувствительность к естественным клеткам-киллерам светлоклеточной почечно-клеточной карциномы. Онкоген; Epub перед печатью, 2011.
.



 Заболевание проявляется яркой клинической картиной с выраженными симптомами интоксикации.
Заболевание проявляется яркой клинической картиной с выраженными симптомами интоксикации. До 5 лет с момента операции доживает менее 10% пациентов, страдающих злокачественными новообразованиями.
До 5 лет с момента операции доживает менее 10% пациентов, страдающих злокачественными новообразованиями. Возможно позднее локальное рецидивирование, через 5 и даже 10 лет после операции. Около 90% больных с местными рецидивами опухоли погибает от прогрессирования болезни. Это диктует длительное тщательное наблюдение за больными.
Возможно позднее локальное рецидивирование, через 5 и даже 10 лет после операции. Около 90% больных с местными рецидивами опухоли погибает от прогрессирования болезни. Это диктует длительное тщательное наблюдение за больными. Роль дополнительной химиотерапии и лучевой терапии при метастатических и рецидивных опухолях не определена.
Роль дополнительной химиотерапии и лучевой терапии при метастатических и рецидивных опухолях не определена.


 -)
M8503/3 Внутрипротоковая папиллярная аденокарцинома с инвазией
(C50.-)
M8504/0 Внутрикистозная папиллярная аденома
M8504/2 Неинфильтрирующий внутрикистозный рак
M8504/3 Внутрикистозный рак БДУ
M8505/0 Внутрипротоковый папилломатоз БДУ
M8506/0 Аденома соска (D24)
M8510/3 Медуллярный рак БДУ
M8511/3 Медуллярный рак с амилоидной стромой (C73)
M8512/3 Медуллярный рак с лимфоидной стромой (C50.-)
M8520/2 Дольковый рак in situ (D05.0)
M8520/3 Дольковый рак БДУ (C50.-)
M8521/3 Инфильтрирующий дуктулярный рак (C50.-)
M8522/2 Внутрипротоковый рак и дольковый рак in situ (D05.7)
M8522/3 Инфильтрирующий протоковый и дольковый рак (C50.-)
M8530/3 Воспалительный рак (C50.-)
M8540/3 Болезнь Педжета молочной железы (C50.-)
M8541/3 Болезнь Педжета и инфильтрирующий протоковый рак молочной
железы (C50.-)
M8542/3 Болезнь Педжета экстрамаммарная (исключая болезнь Педжета
(костей))
M8543/3 Болезнь Педжета и внутрипротоковый рак молочной железы
(C50.
-)
M8503/3 Внутрипротоковая папиллярная аденокарцинома с инвазией
(C50.-)
M8504/0 Внутрикистозная папиллярная аденома
M8504/2 Неинфильтрирующий внутрикистозный рак
M8504/3 Внутрикистозный рак БДУ
M8505/0 Внутрипротоковый папилломатоз БДУ
M8506/0 Аденома соска (D24)
M8510/3 Медуллярный рак БДУ
M8511/3 Медуллярный рак с амилоидной стромой (C73)
M8512/3 Медуллярный рак с лимфоидной стромой (C50.-)
M8520/2 Дольковый рак in situ (D05.0)
M8520/3 Дольковый рак БДУ (C50.-)
M8521/3 Инфильтрирующий дуктулярный рак (C50.-)
M8522/2 Внутрипротоковый рак и дольковый рак in situ (D05.7)
M8522/3 Инфильтрирующий протоковый и дольковый рак (C50.-)
M8530/3 Воспалительный рак (C50.-)
M8540/3 Болезнь Педжета молочной железы (C50.-)
M8541/3 Болезнь Педжета и инфильтрирующий протоковый рак молочной
железы (C50.-)
M8542/3 Болезнь Педжета экстрамаммарная (исключая болезнь Педжета
(костей))
M8543/3 Болезнь Педжета и внутрипротоковый рак молочной железы
(C50. -)
M855 Ацинарно-клеточные новообразования
M8550/0 Ацинарно-клеточная аденома
M8550/1 Ацинарно-клеточная опухоль
M8550/3 Ацинарно-клеточный рак
M856-M858 Сложные эпителиальные новообразования
M8560/3 Железисто-плоскоклеточный рак
M8561/0 Аденолимфома (D11.-)
M8562/3 Эпителиально-миоэпителиальный рак
M8570/3 Аденокарцинома с плоскоклеточной метаплазией
M8571/3 Аденокарцинома с хрящевой и костной метаплазией
M8572/3 Аденокарцинома с веретеноклеточной метаплазией
M8573/3 Аденокарцинома с апокринной метаплазией
M8580/0 Тимома доброкачественная (D15.0)
M8580/3 Тимома злокачественная (C37)
M859-M867 Специфические новообразования половых желез
M8590/1 Опухоль стромы полового тяжа
M8600/0 Текома БДУ (D27)
M8600/3 Текома злокачественная (C56)
M8601/0 Текома лютеиновая (D27)
M8602/0 Склерозирующая опухоль стромы (D27)
M8610/0 Лютеома БДУ (D27)
M8620/1 Гранулезоклеточная опухоль БДУ (D39.1)
M8620/3 Гранулезоклеточная опухоль злокачественная (C56)
M8621/1 Гранулезоклеточная опухоль (D39.
-)
M855 Ацинарно-клеточные новообразования
M8550/0 Ацинарно-клеточная аденома
M8550/1 Ацинарно-клеточная опухоль
M8550/3 Ацинарно-клеточный рак
M856-M858 Сложные эпителиальные новообразования
M8560/3 Железисто-плоскоклеточный рак
M8561/0 Аденолимфома (D11.-)
M8562/3 Эпителиально-миоэпителиальный рак
M8570/3 Аденокарцинома с плоскоклеточной метаплазией
M8571/3 Аденокарцинома с хрящевой и костной метаплазией
M8572/3 Аденокарцинома с веретеноклеточной метаплазией
M8573/3 Аденокарцинома с апокринной метаплазией
M8580/0 Тимома доброкачественная (D15.0)
M8580/3 Тимома злокачественная (C37)
M859-M867 Специфические новообразования половых желез
M8590/1 Опухоль стромы полового тяжа
M8600/0 Текома БДУ (D27)
M8600/3 Текома злокачественная (C56)
M8601/0 Текома лютеиновая (D27)
M8602/0 Склерозирующая опухоль стромы (D27)
M8610/0 Лютеома БДУ (D27)
M8620/1 Гранулезоклеточная опухоль БДУ (D39.1)
M8620/3 Гранулезоклеточная опухоль злокачественная (C56)
M8621/1 Гранулезоклеточная опухоль (D39. 1)
M8622/1 Ювенильная гранулезоклеточная опухоль БДУ (D39.1)
M8623/1 Опухоль полового тяжа с кольцевыми трубочками (D39.1)
M8630/0 Андробластома доброкачественная
M8630/1 Андробластома БДУ
M8630/3 Андробластома злокачественная
M8631/0 Опухоль из клеток Сертоли-Лейдига
M8632/1 Гинандробластома (D39.1)
M8640/0 Опухоль из клеток Сертоли БДУ
M8640/3 Рак из клеток Сертоли (C62.-)
M8641/0 Опухоль из клеток Сертоли с накоплением липидов (D27)
M8650/0 Доброкачественная опухоль из клеток Лейдига (D29.2)
M8650/1 Опухоль из клеток Лейдига БДУ (D40.1)
M8650/3 Злокачественная опухоль из клеток Лейдига (C62.-)
M8660/0 Хилусноклеточная опухоль (D27)
M8670/0 Липидно-клеточная опухоль яичника (D27)
M8671/0 Опухоль адреналовых остатков [гнезд]
M868-M871 Параганлиомы и гломусные опухоли
M8680/1 Параганглиома БДУ
M8680/3 Параганглиома злокачественная
M8681/1 Симпатическая параганглиома
M8682/1 Парасимпатическая параганглиома
M8683/0 Ганглиоцитарная параганглиома (D13.
1)
M8622/1 Ювенильная гранулезоклеточная опухоль БДУ (D39.1)
M8623/1 Опухоль полового тяжа с кольцевыми трубочками (D39.1)
M8630/0 Андробластома доброкачественная
M8630/1 Андробластома БДУ
M8630/3 Андробластома злокачественная
M8631/0 Опухоль из клеток Сертоли-Лейдига
M8632/1 Гинандробластома (D39.1)
M8640/0 Опухоль из клеток Сертоли БДУ
M8640/3 Рак из клеток Сертоли (C62.-)
M8641/0 Опухоль из клеток Сертоли с накоплением липидов (D27)
M8650/0 Доброкачественная опухоль из клеток Лейдига (D29.2)
M8650/1 Опухоль из клеток Лейдига БДУ (D40.1)
M8650/3 Злокачественная опухоль из клеток Лейдига (C62.-)
M8660/0 Хилусноклеточная опухоль (D27)
M8670/0 Липидно-клеточная опухоль яичника (D27)
M8671/0 Опухоль адреналовых остатков [гнезд]
M868-M871 Параганлиомы и гломусные опухоли
M8680/1 Параганглиома БДУ
M8680/3 Параганглиома злокачественная
M8681/1 Симпатическая параганглиома
M8682/1 Парасимпатическая параганглиома
M8683/0 Ганглиоцитарная параганглиома (D13. 2)
M8690/1 Опухоль яремного гломуса (D44.7)
M8691/1 Опухоль аортального гломуса (D44.7)
M8692/1 Опухоль каротидного гломуса (D44.6)
M8693/1 Экстраадренальная параганглиома БДУ
M8693/3 Экстраадренальная параганглиома злокачественная
M8700/0 Феохромоцитома БДУ (D35.0)
M8700/3 Феохромоцитома злокачественная (C74.1)
M8710/3 Гломангиосаркома
M8711/0 Гломусная опухоль
M8712/0 Гломангиома
M8713/0 Гломангиомиома
M872-M879 Невусы и меланомы
M8720/0 Пигментный невус БДУ (D22.-)
M8720/2 Меланома in situ (D03.-)
M8720/3 Злокачественная меланома БДУ
M8721/3 Узловая меланома (C43.-)
M8722/0 Баллоноклеточный невус (D22.-)
M8722/3 Баллоноклеточная меланома (C43.-)
M8723/0 Галоневус (D22.-)
M8723/3 Злокачественная меланома регрессирующая (C43.-)
M8724/0 Фиброзная папула носа (D22.3)
M8725/0 Нейроневус (D22.-)
M8726/0 Гигантоклеточный невус (D31.4)
M8727/0 Диспластичный невус (D22.-)
M8730/0 Беспигментный невус (D22.-)
M8730/3 Амелонотическая [беспигментная] меланома (C43.
2)
M8690/1 Опухоль яремного гломуса (D44.7)
M8691/1 Опухоль аортального гломуса (D44.7)
M8692/1 Опухоль каротидного гломуса (D44.6)
M8693/1 Экстраадренальная параганглиома БДУ
M8693/3 Экстраадренальная параганглиома злокачественная
M8700/0 Феохромоцитома БДУ (D35.0)
M8700/3 Феохромоцитома злокачественная (C74.1)
M8710/3 Гломангиосаркома
M8711/0 Гломусная опухоль
M8712/0 Гломангиома
M8713/0 Гломангиомиома
M872-M879 Невусы и меланомы
M8720/0 Пигментный невус БДУ (D22.-)
M8720/2 Меланома in situ (D03.-)
M8720/3 Злокачественная меланома БДУ
M8721/3 Узловая меланома (C43.-)
M8722/0 Баллоноклеточный невус (D22.-)
M8722/3 Баллоноклеточная меланома (C43.-)
M8723/0 Галоневус (D22.-)
M8723/3 Злокачественная меланома регрессирующая (C43.-)
M8724/0 Фиброзная папула носа (D22.3)
M8725/0 Нейроневус (D22.-)
M8726/0 Гигантоклеточный невус (D31.4)
M8727/0 Диспластичный невус (D22.-)
M8730/0 Беспигментный невус (D22.-)
M8730/3 Амелонотическая [беспигментная] меланома (C43. -)
M8740/0 Пограничный невус БДУ (D22.-)
M8740/3 Злокачественная меланома в пограничном невусе (C43.-)
M8741/2 Предраковый меланоз БДУ (D03.-)
M8741/3 Злокачественная меланома при предраковом меланозе (C43.-)
M8742/2 Меланотическая веснушка Гетчинсона БДУ (D03.-)
M8742/3 Злокачественная меланома в меланотической веснушке Гетчинсо-
на (C43.-)
M8743/3 Поверхностно распространяющаяся меланома (C43.-)
M8744/3 Акральная лентигинозная меланома злокачественная (C43.-)
M8745/3 Десмопластическая меланома злокачественная (C43.-)
M8750/0 Интрадермальный невус (D22.-)
M8760/0 Сложный невус (D22.-)
M8761/1 Гигантский пигментный невус БДУ (D48.5)
M8761/3 Злокачественная меланома в гигантском пигментном невусе
(C43.-)
M8770/0 Эпителиоидный и веретеноклеточный невус (D22.-)
M8770/3 Смешанная эпителиоидно-веретеноклеточная меланома
M8771/0 Эпителиоидно-клеточный невус (D22.-)
M8771/3 Эпителиоидно-клеточная меланома
M8772/0 Веретеноклеточный невус (D22.
-)
M8740/0 Пограничный невус БДУ (D22.-)
M8740/3 Злокачественная меланома в пограничном невусе (C43.-)
M8741/2 Предраковый меланоз БДУ (D03.-)
M8741/3 Злокачественная меланома при предраковом меланозе (C43.-)
M8742/2 Меланотическая веснушка Гетчинсона БДУ (D03.-)
M8742/3 Злокачественная меланома в меланотической веснушке Гетчинсо-
на (C43.-)
M8743/3 Поверхностно распространяющаяся меланома (C43.-)
M8744/3 Акральная лентигинозная меланома злокачественная (C43.-)
M8745/3 Десмопластическая меланома злокачественная (C43.-)
M8750/0 Интрадермальный невус (D22.-)
M8760/0 Сложный невус (D22.-)
M8761/1 Гигантский пигментный невус БДУ (D48.5)
M8761/3 Злокачественная меланома в гигантском пигментном невусе
(C43.-)
M8770/0 Эпителиоидный и веретеноклеточный невус (D22.-)
M8770/3 Смешанная эпителиоидно-веретеноклеточная меланома
M8771/0 Эпителиоидно-клеточный невус (D22.-)
M8771/3 Эпителиоидно-клеточная меланома
M8772/0 Веретеноклеточный невус (D22. -)
M8772/3 Веретеноклеточная меланома БДУ
M8773/3 Веретеноклеточная меланома типа А (C69.4)
M8774/3 Веретеноклеточная меланома типа В (C69.4)
M8780/0 Голубой невус БДУ (D22.-)
M8780/3 Голубой невус злокачественный (C43.-)
M8790/0 Клеточный голубой невус (D22.-)
M880 Опухоли и саркомы мягких тканей БДУ
M8800/0 Опухоль мягких тканей доброкачественная
M8800/3 Саркома БДУ
M8800/6 Саркоматоз БДУ
M8801/3 Веретеноклеточная саркома
M8802/3 Гигантоклеточная саркома (исключая кости M9250/3)
M8803/3 Мелкоклеточная саркома
M8804/3 Эпителиоидная саркома
M881-M883 Фиброматозные новообразования
M8810/0 Фиброма БДУ
M8810/3 Фибросаркома БДУ
M8811/0 Фибромиксома
M8811/3 Фибромиксосаркома
M8812/0 Периостальная фиброма (D16.-)
M8812/3 Периостальная фибросаркома (C40.-, C41.-)
M8813/0 Фасциальная фиброма
M8813/3 Фасциальная фибросаркома
M8814/3 Детская фибросаркома
M8820/0 Эластофиброма
M8821/1 Агрессивный фиброматоз
M8822/1 Абдоминальный фиброматоз
M8823/1 Десмопластическая фиброма
M8824/1 Миофиброматоз
M8830/0 Фиброзная гистиоцитома БДУ
M8830/1 Атипичная фиброзная гистиоцитома
M8830/3 Фиброзная гистиоцитома злокачественная
M8832/0 Дерматофиброма БДУ (D23.
-)
M8772/3 Веретеноклеточная меланома БДУ
M8773/3 Веретеноклеточная меланома типа А (C69.4)
M8774/3 Веретеноклеточная меланома типа В (C69.4)
M8780/0 Голубой невус БДУ (D22.-)
M8780/3 Голубой невус злокачественный (C43.-)
M8790/0 Клеточный голубой невус (D22.-)
M880 Опухоли и саркомы мягких тканей БДУ
M8800/0 Опухоль мягких тканей доброкачественная
M8800/3 Саркома БДУ
M8800/6 Саркоматоз БДУ
M8801/3 Веретеноклеточная саркома
M8802/3 Гигантоклеточная саркома (исключая кости M9250/3)
M8803/3 Мелкоклеточная саркома
M8804/3 Эпителиоидная саркома
M881-M883 Фиброматозные новообразования
M8810/0 Фиброма БДУ
M8810/3 Фибросаркома БДУ
M8811/0 Фибромиксома
M8811/3 Фибромиксосаркома
M8812/0 Периостальная фиброма (D16.-)
M8812/3 Периостальная фибросаркома (C40.-, C41.-)
M8813/0 Фасциальная фиброма
M8813/3 Фасциальная фибросаркома
M8814/3 Детская фибросаркома
M8820/0 Эластофиброма
M8821/1 Агрессивный фиброматоз
M8822/1 Абдоминальный фиброматоз
M8823/1 Десмопластическая фиброма
M8824/1 Миофиброматоз
M8830/0 Фиброзная гистиоцитома БДУ
M8830/1 Атипичная фиброзная гистиоцитома
M8830/3 Фиброзная гистиоцитома злокачественная
M8832/0 Дерматофиброма БДУ (D23. -)
M8832/3 Дерматофибросаркома БДУ (C44.-)
M8833/3 Пигментная дерматофибросаркома выбухающая
M884 Миксоматозные новообразования
M8840/0 Миксома БДУ
M8840/3 Миксосаркома
M8841/1 Ангиомиксома
M885-M888 Липоматозные новообразования
M8850/0 Липома БДУ (D17.-)
M8850/3 Липосаркома БДУ
M8851/0 Фибролипома (D17.-)
M8851/3 Липосаркома высокодифференцированная
M8852/0 Фибромиксолипома (D17.-)
M8852/3 Миксоидная липосаркома
M8853/3 Круглоклеточная липосаркома
M8854/0 Плеоморфная липома (D17.-)
M8854/3 Плеоморфная липосаркома
M8855/3 Смешанная липосаркома
M8856/0 Межмышечная липома (D17.-)
M8857/0 Веретеноклеточная липома (D17.-)
M8858/3 Липосаркома слабодифференцированная
M8860/0 Ангиомиолипома (D17.-)
M8861/0 Ангиолипома БДУ (D17.-)
M8870/0 Миелолипома (D17.-)
M8880/0 Гибернома (D17.-)
M8881/0 Липобластоматоз (D17.-)
M889-M892 Миоматозные новообразования
M8890/0 Лейомиома БДУ
M8890/1 Лейомиоматоз БДУ
M8890/3 Лейомиосаркома БДУ
M8891/0 Эпителиоидная лейомиома
M8891/3 Эпителиоидная лейомиосаркома
M8892/0 Клеточная лейомиома
M8893/0 Причудливая лейомиома
M8894/0 Ангиомиома
M8894/3 Ангиомиосаркома
M8895/0 Миома
M8895/3 Миосаркома
M8896/3 Слизистая лейомиосаркома
M8897/1 Гладкомышечная опухоль БДУ
M8900/0 Рабдомиома БДУ
M8900/3 Рабдомиосаркома БДУ
M8901/3 Плеоморфная рабдомиосаркома
M8902/3 Рабдомиосаркома смешанного типа
M8903/0 Фетальная рабдомиома
M8904/0 Зрелая рабдомиома
M8910/3 Эмбриональная рабдомиосаркома
M8920/3 Альвеолярная рабдомиосаркома
M893-M899 Сложные смешанные и стромальные новообразования
M8930/0 Эндометриальный стромальный узел (D26.
-)
M8832/3 Дерматофибросаркома БДУ (C44.-)
M8833/3 Пигментная дерматофибросаркома выбухающая
M884 Миксоматозные новообразования
M8840/0 Миксома БДУ
M8840/3 Миксосаркома
M8841/1 Ангиомиксома
M885-M888 Липоматозные новообразования
M8850/0 Липома БДУ (D17.-)
M8850/3 Липосаркома БДУ
M8851/0 Фибролипома (D17.-)
M8851/3 Липосаркома высокодифференцированная
M8852/0 Фибромиксолипома (D17.-)
M8852/3 Миксоидная липосаркома
M8853/3 Круглоклеточная липосаркома
M8854/0 Плеоморфная липома (D17.-)
M8854/3 Плеоморфная липосаркома
M8855/3 Смешанная липосаркома
M8856/0 Межмышечная липома (D17.-)
M8857/0 Веретеноклеточная липома (D17.-)
M8858/3 Липосаркома слабодифференцированная
M8860/0 Ангиомиолипома (D17.-)
M8861/0 Ангиолипома БДУ (D17.-)
M8870/0 Миелолипома (D17.-)
M8880/0 Гибернома (D17.-)
M8881/0 Липобластоматоз (D17.-)
M889-M892 Миоматозные новообразования
M8890/0 Лейомиома БДУ
M8890/1 Лейомиоматоз БДУ
M8890/3 Лейомиосаркома БДУ
M8891/0 Эпителиоидная лейомиома
M8891/3 Эпителиоидная лейомиосаркома
M8892/0 Клеточная лейомиома
M8893/0 Причудливая лейомиома
M8894/0 Ангиомиома
M8894/3 Ангиомиосаркома
M8895/0 Миома
M8895/3 Миосаркома
M8896/3 Слизистая лейомиосаркома
M8897/1 Гладкомышечная опухоль БДУ
M8900/0 Рабдомиома БДУ
M8900/3 Рабдомиосаркома БДУ
M8901/3 Плеоморфная рабдомиосаркома
M8902/3 Рабдомиосаркома смешанного типа
M8903/0 Фетальная рабдомиома
M8904/0 Зрелая рабдомиома
M8910/3 Эмбриональная рабдомиосаркома
M8920/3 Альвеолярная рабдомиосаркома
M893-M899 Сложные смешанные и стромальные новообразования
M8930/0 Эндометриальный стромальный узел (D26. 1)
M8930/3 Эндометриальная стромальная саркома (C54.-)
M8931/1 Эндолимфатический стромальный миоз (D39.0)
M8932/0 Аденомиома
M8933/3 Аденосаркома
M8940/0 Плеоморфная аденома
M8940/3 Злокачественная смешанная опухоль БДУ
M8941/3 Рак в плеоморфной аденоме (C07, C08.-)
M8950/3 Мюллеровская смешанная опухоль (C54.-)
M8951/3 Мезодермальная смешанная опухоль
M8960/1 Мезобластная нефрома
M8960/3 Нефробластома БДУ (C64)
M8963/3 Рабдоидная саркома
M8964/3 Светлоклеточная саркома почки (C64)
M8970/3 Гепатобластома (C22.0)
M8971/3 Панкреатобластома (C25.-)
M8972/3 Легочная бластома (C34.-)
M8980/3 Карциносаркома БДУ
M8981/3 Карциносаркома эмбриональная
M8982/0 Миоэпителиома
M8990/0 Мезенхимома доброкачественная
M8990/1 Мезенхимома БДУ
M8990/3 Мезенхимома злокачественная
M8991/3 Эмбриональная саркома
M900-M903 Фиброэпителиальные новообразования
M9000/0 Опухоль Бреннера БДУ (D27)
M9000/1 Опухоль Бреннера пограничной злокачественности (D39.
1)
M8930/3 Эндометриальная стромальная саркома (C54.-)
M8931/1 Эндолимфатический стромальный миоз (D39.0)
M8932/0 Аденомиома
M8933/3 Аденосаркома
M8940/0 Плеоморфная аденома
M8940/3 Злокачественная смешанная опухоль БДУ
M8941/3 Рак в плеоморфной аденоме (C07, C08.-)
M8950/3 Мюллеровская смешанная опухоль (C54.-)
M8951/3 Мезодермальная смешанная опухоль
M8960/1 Мезобластная нефрома
M8960/3 Нефробластома БДУ (C64)
M8963/3 Рабдоидная саркома
M8964/3 Светлоклеточная саркома почки (C64)
M8970/3 Гепатобластома (C22.0)
M8971/3 Панкреатобластома (C25.-)
M8972/3 Легочная бластома (C34.-)
M8980/3 Карциносаркома БДУ
M8981/3 Карциносаркома эмбриональная
M8982/0 Миоэпителиома
M8990/0 Мезенхимома доброкачественная
M8990/1 Мезенхимома БДУ
M8990/3 Мезенхимома злокачественная
M8991/3 Эмбриональная саркома
M900-M903 Фиброэпителиальные новообразования
M9000/0 Опухоль Бреннера БДУ (D27)
M9000/1 Опухоль Бреннера пограничной злокачественности (D39. 1)
M9000/3 Опухоль Бреннера злокачественная (C56)
M9010/0 Фиброаденома БДУ (D24)
M9011/0 Интраканаликулярная фиброаденома (D24)
M9012/0 Периканаликулярная фиброаденома (D24)
M9013/0 Аденофиброма БДУ (D27)
M9014/0 Серозная аденофиброма (D27)
M9015/0 Муцинозная аденофиброма (D27)
M9016/0 Гигантская фиброаденома (D24)
M9020/0 Филлоидная [листовидная] опухоль доброкачественная (D24)
M9020/1 Филлоидная [листовидная] опухоль БДУ (D48.6)
M9020/3 Филлоидная [листовидная] опухоль злокачественная (C50.-)
M9030/0 Ювенильная фиброаденома (D24)
M904 Синовиальноподобные новообразования
M9040/0 Синовиома доброкачественная
M9040/3 Синовиальная саркома БДУ
M9041/3 Синовиальная саркома веретеноклеточная
M9042/3 Синовиальная саркома эпителиоидно-клеточная
M9043/3 Синовиальная саркома двухфазная
M9044/3 Светлоклеточная саркома (за исключением почечной M8964/3)
M905 Мезотелиальные новообразования
M9050/0 Мезотелиома доброкачественная (D19.
1)
M9000/3 Опухоль Бреннера злокачественная (C56)
M9010/0 Фиброаденома БДУ (D24)
M9011/0 Интраканаликулярная фиброаденома (D24)
M9012/0 Периканаликулярная фиброаденома (D24)
M9013/0 Аденофиброма БДУ (D27)
M9014/0 Серозная аденофиброма (D27)
M9015/0 Муцинозная аденофиброма (D27)
M9016/0 Гигантская фиброаденома (D24)
M9020/0 Филлоидная [листовидная] опухоль доброкачественная (D24)
M9020/1 Филлоидная [листовидная] опухоль БДУ (D48.6)
M9020/3 Филлоидная [листовидная] опухоль злокачественная (C50.-)
M9030/0 Ювенильная фиброаденома (D24)
M904 Синовиальноподобные новообразования
M9040/0 Синовиома доброкачественная
M9040/3 Синовиальная саркома БДУ
M9041/3 Синовиальная саркома веретеноклеточная
M9042/3 Синовиальная саркома эпителиоидно-клеточная
M9043/3 Синовиальная саркома двухфазная
M9044/3 Светлоклеточная саркома (за исключением почечной M8964/3)
M905 Мезотелиальные новообразования
M9050/0 Мезотелиома доброкачественная (D19. -)
M9050/3 Мезотелиома злокачественная (C45.-)
M9051/0 Фиброзная мезотелиома доброкачественная (D19.-)
M9051/3 Фиброзная мезотелиома злокачественная (C45.-)
M9052/0 Эпителиоидная мезотелиома доброкачественная (D19.-)
M9052/3 Эпителиоидная мезотелиома злокачественная (C45.-)
M9053/0 Мезотелиома двухфазная доброкачественная (D19.-)
M9053/3 Мезотелиома двухфазная злокачественная (C45.-)
M9054/0 Аденоматоидная опухоль БДУ (D19.-)
M9055/1 Кистозная мезотелиома
M906-M909 Герминогенные [зародышевоклеточные] новообразования
M9060/3 Дисгерминома
M9061/3 Семинома БДУ (C62.-)
M9062/3 Семинома анапластическая (C62.-)
M9063/3 Сперматоцитарная семинома (C62.-)
M9064/3 Герминома
M9070/3 Эмбриональный рак БДУ
M9071/3 Опухоль эндодермального синуса
M9072/3 Полиэмбриома
M9073/1 Гонадобластома
M9080/0 Тератома доброкачественная
M9080/1 Тератома БДУ
M9080/3 Тератома злокачественная БДУ
M9081/3 Тератокарцинома
M9082/3 Злокачественная тератома недифференцированная
M9083/3 Злокачественная тератома промежуточная
M9084/0 Дермоидная киста БДУ
M9084/3 Тератома со злокачественной трансформацией
M9085/3 Смешанная герминогенная [зародышевоклеточная] опухоль
M9090/0 Струма яичника БДУ (D27)
M9090/3 Струма яичника злокачественная (C56)
M9091/1 Струмальный карциноид (D39.
-)
M9050/3 Мезотелиома злокачественная (C45.-)
M9051/0 Фиброзная мезотелиома доброкачественная (D19.-)
M9051/3 Фиброзная мезотелиома злокачественная (C45.-)
M9052/0 Эпителиоидная мезотелиома доброкачественная (D19.-)
M9052/3 Эпителиоидная мезотелиома злокачественная (C45.-)
M9053/0 Мезотелиома двухфазная доброкачественная (D19.-)
M9053/3 Мезотелиома двухфазная злокачественная (C45.-)
M9054/0 Аденоматоидная опухоль БДУ (D19.-)
M9055/1 Кистозная мезотелиома
M906-M909 Герминогенные [зародышевоклеточные] новообразования
M9060/3 Дисгерминома
M9061/3 Семинома БДУ (C62.-)
M9062/3 Семинома анапластическая (C62.-)
M9063/3 Сперматоцитарная семинома (C62.-)
M9064/3 Герминома
M9070/3 Эмбриональный рак БДУ
M9071/3 Опухоль эндодермального синуса
M9072/3 Полиэмбриома
M9073/1 Гонадобластома
M9080/0 Тератома доброкачественная
M9080/1 Тератома БДУ
M9080/3 Тератома злокачественная БДУ
M9081/3 Тератокарцинома
M9082/3 Злокачественная тератома недифференцированная
M9083/3 Злокачественная тератома промежуточная
M9084/0 Дермоидная киста БДУ
M9084/3 Тератома со злокачественной трансформацией
M9085/3 Смешанная герминогенная [зародышевоклеточная] опухоль
M9090/0 Струма яичника БДУ (D27)
M9090/3 Струма яичника злокачественная (C56)
M9091/1 Струмальный карциноид (D39. 1)
M910 Трофобластические новообразования
M9100/0 Пузырный занос БДУ (O01.9)
M9100/1 Инвазивный пузырный занос (D39.2)
M9100/3 Хориокарцинома БДУ
M9101/3 Хориокарцинома в сочетании с другими зародышевоклеточными
элементами
M9102/3 Злокачественная тератома трофобластическая (C62.-)
M9103/0 Частичный пузырный занос (O01.1)
M9104/1 Плацентарная трофобластная опухоль (D39.2)
M911 Мезонефромы
M9110/0 Мезонефрома доброкачественная
M9110/1 Мезонефральная опухоль
M9110/3 Мезонефрома злокачественная
M912-M916 Опухоли кровеносных сосудов
M9120/0 Гемангиома БДУ (D18.0)
M9120/3 Гемангиосаркома
M9121/0 Кавернозная гемангиома (D18.0)
M9122/0 Венозная гемангиома (D18.0)
M9123/0 Гроздевидная [рацемозная] гемангиома (D18.0)
M9124/3 Саркома из купферовых клеток (C22.3)
M9125/0 Эпителиоидная гемангиома (D18.0)
M9126/0 Гистиоцитоидная гемангиома (D18.0)
M9130/0 Гемангиоэндотелиома доброкачественная (D18.0)
M9130/1 Гемангиоэндотелиома БДУ
M9130/3 Гемангиоэндотелиома злокачественная
M9131/0 Капиллярная гемангиома (D18.
1)
M910 Трофобластические новообразования
M9100/0 Пузырный занос БДУ (O01.9)
M9100/1 Инвазивный пузырный занос (D39.2)
M9100/3 Хориокарцинома БДУ
M9101/3 Хориокарцинома в сочетании с другими зародышевоклеточными
элементами
M9102/3 Злокачественная тератома трофобластическая (C62.-)
M9103/0 Частичный пузырный занос (O01.1)
M9104/1 Плацентарная трофобластная опухоль (D39.2)
M911 Мезонефромы
M9110/0 Мезонефрома доброкачественная
M9110/1 Мезонефральная опухоль
M9110/3 Мезонефрома злокачественная
M912-M916 Опухоли кровеносных сосудов
M9120/0 Гемангиома БДУ (D18.0)
M9120/3 Гемангиосаркома
M9121/0 Кавернозная гемангиома (D18.0)
M9122/0 Венозная гемангиома (D18.0)
M9123/0 Гроздевидная [рацемозная] гемангиома (D18.0)
M9124/3 Саркома из купферовых клеток (C22.3)
M9125/0 Эпителиоидная гемангиома (D18.0)
M9126/0 Гистиоцитоидная гемангиома (D18.0)
M9130/0 Гемангиоэндотелиома доброкачественная (D18.0)
M9130/1 Гемангиоэндотелиома БДУ
M9130/3 Гемангиоэндотелиома злокачественная
M9131/0 Капиллярная гемангиома (D18. 0)
M9132/0 Внутримышечная гемангиома (D18.0)
M9133/1 Эпителиоидная гемангиоэндотелиома БДУ
M9133/3 Эпителиоидная гемангиоэндотелиома злокачественная
M9134/1 Внутрисосудистая бронхиально-альвеолярная опухоль (D38.1)
M9140/3 Саркома Капоши (C46.-)
M9141/0 Ангиокератома
M9142/0 Веррукозная гемангиома с ороговением (D18.0)
M9150/0 Гемангиоперицитома доброкачественная
M9150/1 Гемангиоперицитома БДУ
M9150/3 Гемангиоперицитома злокачественная
M9160/0 Ангиофиброма БДУ
M9161/1 Гемангиобластома
M917 Опухоли лимфатических сосудов
M9170/0 Лимфангиома БДУ (D18.1)
M9170/3 Лимфангиосаркома
M9171/0 Капилярная лимфангиома (D18.1)
M9172/0 Кавернозная лимфангиома (D18.1)
M9173/0 Кистозная лимфангиома (D18.1)
M9174/0 Лимфангиомиома (D18.1)
M9174/1 Лимфангиомиоматоз
M9175/0 Гемолимфангиома (D18.1)
M918-M924 Костные и хондроматозные новообразования
M9180/0 Остеома БДУ (D16.-)
M9180/3 Остеосаркома БДУ (C40.-, C41.-)
M9181/3 Хондробластическая остеосаркома (C40.
0)
M9132/0 Внутримышечная гемангиома (D18.0)
M9133/1 Эпителиоидная гемангиоэндотелиома БДУ
M9133/3 Эпителиоидная гемангиоэндотелиома злокачественная
M9134/1 Внутрисосудистая бронхиально-альвеолярная опухоль (D38.1)
M9140/3 Саркома Капоши (C46.-)
M9141/0 Ангиокератома
M9142/0 Веррукозная гемангиома с ороговением (D18.0)
M9150/0 Гемангиоперицитома доброкачественная
M9150/1 Гемангиоперицитома БДУ
M9150/3 Гемангиоперицитома злокачественная
M9160/0 Ангиофиброма БДУ
M9161/1 Гемангиобластома
M917 Опухоли лимфатических сосудов
M9170/0 Лимфангиома БДУ (D18.1)
M9170/3 Лимфангиосаркома
M9171/0 Капилярная лимфангиома (D18.1)
M9172/0 Кавернозная лимфангиома (D18.1)
M9173/0 Кистозная лимфангиома (D18.1)
M9174/0 Лимфангиомиома (D18.1)
M9174/1 Лимфангиомиоматоз
M9175/0 Гемолимфангиома (D18.1)
M918-M924 Костные и хондроматозные новообразования
M9180/0 Остеома БДУ (D16.-)
M9180/3 Остеосаркома БДУ (C40.-, C41.-)
M9181/3 Хондробластическая остеосаркома (C40. -, C41.-)
M9182/3 Фибробластическая остеосаркома (C40.-, C41.-)
M9183/3 Телеангиэктатическая остеосаркома (C40.-, C41.-)
M9184/3 Остеосаркома при болезни Педжета костей (C40.-, C41.-)
M9185/3 Мелкоклеточная остеосаркома (C40.-, C41.-)
M9190/3 Юкстакортикальная остеосаркома (C40.-, C41.-)
M9191/0 Остеоидная остеома БДУ (D16.-)
M9200/0 Остеобластома БДУ (D16.-)
M9200/1 Агрессивная остеобластома (D48.0)
M9210/0 Остеохондрома (D16.-)
M9210/1 Остеохондроматоз БДУ (D48.0)
M9220/0 Хондрома БДУ (D16.-)
M9220/1 Хондроматоз БДУ
M9220/3 Хондросаркома БДУ (C40.-, C41.-)
M9221/0 Юкстакортикальная хондрома (D16.-)
M9221/3 Юкстакортикальная хондросаркома (C40.-, C41.-)
M9230/0 Хондробластома БДУ (D16.-)
M9230/3 Хондробластома злокачественная (C40.-, C41.-)
M9231/3 Слизистая хондросаркома
M9240/3 Мезенхимальная хондросаркома
M9241/0 Хондромиксоидная фиброма (D16.-)
M925 Гигантоклеточные опухоли
M9250/1 Гигантоклеточная опухоль кости БДУ (D48.
-, C41.-)
M9182/3 Фибробластическая остеосаркома (C40.-, C41.-)
M9183/3 Телеангиэктатическая остеосаркома (C40.-, C41.-)
M9184/3 Остеосаркома при болезни Педжета костей (C40.-, C41.-)
M9185/3 Мелкоклеточная остеосаркома (C40.-, C41.-)
M9190/3 Юкстакортикальная остеосаркома (C40.-, C41.-)
M9191/0 Остеоидная остеома БДУ (D16.-)
M9200/0 Остеобластома БДУ (D16.-)
M9200/1 Агрессивная остеобластома (D48.0)
M9210/0 Остеохондрома (D16.-)
M9210/1 Остеохондроматоз БДУ (D48.0)
M9220/0 Хондрома БДУ (D16.-)
M9220/1 Хондроматоз БДУ
M9220/3 Хондросаркома БДУ (C40.-, C41.-)
M9221/0 Юкстакортикальная хондрома (D16.-)
M9221/3 Юкстакортикальная хондросаркома (C40.-, C41.-)
M9230/0 Хондробластома БДУ (D16.-)
M9230/3 Хондробластома злокачественная (C40.-, C41.-)
M9231/3 Слизистая хондросаркома
M9240/3 Мезенхимальная хондросаркома
M9241/0 Хондромиксоидная фиброма (D16.-)
M925 Гигантоклеточные опухоли
M9250/1 Гигантоклеточная опухоль кости БДУ (D48. 0)
M9250/3 Гигантоклеточная опухоль кости злокачественная (C40.-,
C41.-)
M9251/1 Гигантоклеточная опухоль мягких тканей БДУ
M9251/3 Злокачественная гигантоклеточная опухоль мягких тканей
M926 Разные костные опухоли
M9260/3 Саркома Юинга (C40.-, C41.-)
M9261/3 Адамантинома длинных костей (C40.-)
M9262/0 Оссифицирующая фиброма (D16.-)
M927-M934 Одонтогенные опухоли
M9270/0 Одонтогенная опухоль доброкачественная (D16.4, D16.5)
M9270/1 Одонтогенная опухоль БДУ (D48.0)
M9270/3 Одонтогенная опухоль злокачественная (C41.0, C41.1)
M9271/0 Дентинома (D16.4, D16.5)
M9272/0 Цементома БДУ (D16.4, D16.5)
M9273/0 Цементобластома доброкачественная (D16.4, D16.5)
M9274/0 Цементирующаяся фиброма (D16.4, D16.5)
M9275/0 Гигантоформная цементома (D16.4, D16.5)
M9280/0 Одонтома БДУ (D16.4, D16.5)
M9281/0 Смешанная одонтома (D16.4, D16.5)
M9282/0 Сложная одонтома (D16.4, D16.5)
M9290/0 Амелобластическая фиброодонтома (D16.4, D16.
0)
M9250/3 Гигантоклеточная опухоль кости злокачественная (C40.-,
C41.-)
M9251/1 Гигантоклеточная опухоль мягких тканей БДУ
M9251/3 Злокачественная гигантоклеточная опухоль мягких тканей
M926 Разные костные опухоли
M9260/3 Саркома Юинга (C40.-, C41.-)
M9261/3 Адамантинома длинных костей (C40.-)
M9262/0 Оссифицирующая фиброма (D16.-)
M927-M934 Одонтогенные опухоли
M9270/0 Одонтогенная опухоль доброкачественная (D16.4, D16.5)
M9270/1 Одонтогенная опухоль БДУ (D48.0)
M9270/3 Одонтогенная опухоль злокачественная (C41.0, C41.1)
M9271/0 Дентинома (D16.4, D16.5)
M9272/0 Цементома БДУ (D16.4, D16.5)
M9273/0 Цементобластома доброкачественная (D16.4, D16.5)
M9274/0 Цементирующаяся фиброма (D16.4, D16.5)
M9275/0 Гигантоформная цементома (D16.4, D16.5)
M9280/0 Одонтома БДУ (D16.4, D16.5)
M9281/0 Смешанная одонтома (D16.4, D16.5)
M9282/0 Сложная одонтома (D16.4, D16.5)
M9290/0 Амелобластическая фиброодонтома (D16.4, D16. 5)
M9290/3 Амелобластическая одонтосаркома (C41.0, C41.1)
M9300/0 Аденоматоидная одонтогенная опухоль (D16.4, D16.5)
M9301/0 Обызвествляющаяся одонтогенная киста (D16.4, D16.5)
M9302/0 Одонтогенная бесцветноклеточная опухоль (D16.4, D16.5)
M9310/0 Амелобластома БДУ (D16.4, D16.5)
M9310/3 Амелобластома злокачественная (C41.0, C41.1)
M9311/0 Одонтоамелобластома (D16.4, D16.5)
M9312/0 Плоскоклеточная одонтогенная опухоль (D16.4, D16.5)
M9320/0 Одонтогенная миксома (D16.4, D16.5)
M9321/0 Центральная одонтогенная фиброма (D16.4, D16.5)
M9322/0 Периферическая одонтогенная фиброма (D16.4, D16.5)
M9330/0 Амелобластическая фиброма (D16.4, D16.5)
M9330/3 Амелобластическая фибросаркома (C41.0, C41.1)
M9340/0 Обызвествленная эпителиальная одонтогенная опухоль (D16.4,
D16.5)
M935-M937 Разные опухоли
M9350/1 Краниофарингиома (D44.3, D44.4)
M9360/1 Пинеалома (D44.5)
M9361/1 Пинеоцитома (D44.5)
M9362/3 Пинеобластома (C75.3)
M9363/0 Меланотическая нейроэктодермальная опухоль
M9364/3 Периферическая нейроэктодермальная опухоль
M9370/3 Хордома
M938-M948 Глиомы
M9380/3 Глиома злокачественная (C71.
5)
M9290/3 Амелобластическая одонтосаркома (C41.0, C41.1)
M9300/0 Аденоматоидная одонтогенная опухоль (D16.4, D16.5)
M9301/0 Обызвествляющаяся одонтогенная киста (D16.4, D16.5)
M9302/0 Одонтогенная бесцветноклеточная опухоль (D16.4, D16.5)
M9310/0 Амелобластома БДУ (D16.4, D16.5)
M9310/3 Амелобластома злокачественная (C41.0, C41.1)
M9311/0 Одонтоамелобластома (D16.4, D16.5)
M9312/0 Плоскоклеточная одонтогенная опухоль (D16.4, D16.5)
M9320/0 Одонтогенная миксома (D16.4, D16.5)
M9321/0 Центральная одонтогенная фиброма (D16.4, D16.5)
M9322/0 Периферическая одонтогенная фиброма (D16.4, D16.5)
M9330/0 Амелобластическая фиброма (D16.4, D16.5)
M9330/3 Амелобластическая фибросаркома (C41.0, C41.1)
M9340/0 Обызвествленная эпителиальная одонтогенная опухоль (D16.4,
D16.5)
M935-M937 Разные опухоли
M9350/1 Краниофарингиома (D44.3, D44.4)
M9360/1 Пинеалома (D44.5)
M9361/1 Пинеоцитома (D44.5)
M9362/3 Пинеобластома (C75.3)
M9363/0 Меланотическая нейроэктодермальная опухоль
M9364/3 Периферическая нейроэктодермальная опухоль
M9370/3 Хордома
M938-M948 Глиомы
M9380/3 Глиома злокачественная (C71. -)
M9381/3 Глиоматоз мозга (C71.-)
M9382/3 Смешанная глиома (C71.-)
M9383/1 Субэпендимальная глиома (D43.-)
M9384/1 Субэпендимальная гигантоклеточная астроцитома (D43.-)
M9390/0 Папиллома хориоидального сплетения БДУ (D33.0)
M9390/3 Папиллома хориоидального сплетения злокачественная (C71.5)
M9391/3 Эпендимома БДУ (C71.-)
M9392/3 Эпендимома анапластическая (C71.-)
M9393/1 Папиллярная эпендимома (D43.-)
M9394/1 Миксоиднопапиллярная эпендимома (D43.-)
M9400/3 Астроцитома БДУ (C71.-)
M9401/3 Астроцитома анапластическая (C71.-)
M9410/3 Протоплазматическая астроцитома (C71.-)
M9411/3 Гемистоцитарная астроцитома (C71.-)
M9420/3 Фибриллярная астроцитома (C71.-)
M9421/3 Пилоцитарная астроцитома (C71.-)
M9422/3 Спонгиобластома БДУ (C71.-)
M9423/3 Спонгиобластома полярная (C71.-)
M9424/3 Плеоморфная ксантоастроцитома (C71.-)
M9430/3 Астробластома (C71.-)
M9440/3 Глиобластома БДУ (C71.-)
M9441/3 Гигантоклеточная глиобластома (C71.-)
M9442/3 Глиосаркома (C71.
-)
M9381/3 Глиоматоз мозга (C71.-)
M9382/3 Смешанная глиома (C71.-)
M9383/1 Субэпендимальная глиома (D43.-)
M9384/1 Субэпендимальная гигантоклеточная астроцитома (D43.-)
M9390/0 Папиллома хориоидального сплетения БДУ (D33.0)
M9390/3 Папиллома хориоидального сплетения злокачественная (C71.5)
M9391/3 Эпендимома БДУ (C71.-)
M9392/3 Эпендимома анапластическая (C71.-)
M9393/1 Папиллярная эпендимома (D43.-)
M9394/1 Миксоиднопапиллярная эпендимома (D43.-)
M9400/3 Астроцитома БДУ (C71.-)
M9401/3 Астроцитома анапластическая (C71.-)
M9410/3 Протоплазматическая астроцитома (C71.-)
M9411/3 Гемистоцитарная астроцитома (C71.-)
M9420/3 Фибриллярная астроцитома (C71.-)
M9421/3 Пилоцитарная астроцитома (C71.-)
M9422/3 Спонгиобластома БДУ (C71.-)
M9423/3 Спонгиобластома полярная (C71.-)
M9424/3 Плеоморфная ксантоастроцитома (C71.-)
M9430/3 Астробластома (C71.-)
M9440/3 Глиобластома БДУ (C71.-)
M9441/3 Гигантоклеточная глиобластома (C71.-)
M9442/3 Глиосаркома (C71. -)
M9443/3 Примитивная полярная спонгиобластома (C71.-)
M9450/3 Олигодендроглиома БДУ (C71.-)
M9451/3 Олигодендроглиома анапластическая (C71.-)
M9460/3 Олигодендробластома (C71.-)
M9470/3 Медуллобластома БДУ (C71.6)
M9471/3 Десмопластическая медуллобластома (C71.6)
M9472/3 Медулломиобластома (C71.6)
M9473/3 Примитивная нейроэктодермальная опухоль (C71.-)
M9480/3 Мозжечковая саркома БДУ (C71.6)
M9481/3 Монстроклеточная саркома (C71.-)
M949-M952 Нейроэпителиоматозные новообразования
M9490/0 Ганглионеврома
M9490/3 Ганглионейробластома
M9491/0 Ганглионейроматоз
M9500/3 Нейробластома БДУ
M9501/3 Медуллоэпителиома БДУ
M9502/3 Тератоидная медуллоэпителиома
M9503/3 Нейроэпителиома БДУ
M9504/3 Спонгионейробластома
M9505/1 Ганглиоглиома
M9506/0 Нейроцитома
M9507/0 Пачиниева опухоль
M9510/3 Ретинобластома БДУ (C69.2)
M9511/3 Ретинобластома дифференцированная (C69.2)
M9512/3 Ретинобластома недифференцированная (C69.2)
M9520/3 Ольфакторная нейрогенная опухоль
M9521/3 Эстезионейроцитома (C30.
-)
M9443/3 Примитивная полярная спонгиобластома (C71.-)
M9450/3 Олигодендроглиома БДУ (C71.-)
M9451/3 Олигодендроглиома анапластическая (C71.-)
M9460/3 Олигодендробластома (C71.-)
M9470/3 Медуллобластома БДУ (C71.6)
M9471/3 Десмопластическая медуллобластома (C71.6)
M9472/3 Медулломиобластома (C71.6)
M9473/3 Примитивная нейроэктодермальная опухоль (C71.-)
M9480/3 Мозжечковая саркома БДУ (C71.6)
M9481/3 Монстроклеточная саркома (C71.-)
M949-M952 Нейроэпителиоматозные новообразования
M9490/0 Ганглионеврома
M9490/3 Ганглионейробластома
M9491/0 Ганглионейроматоз
M9500/3 Нейробластома БДУ
M9501/3 Медуллоэпителиома БДУ
M9502/3 Тератоидная медуллоэпителиома
M9503/3 Нейроэпителиома БДУ
M9504/3 Спонгионейробластома
M9505/1 Ганглиоглиома
M9506/0 Нейроцитома
M9507/0 Пачиниева опухоль
M9510/3 Ретинобластома БДУ (C69.2)
M9511/3 Ретинобластома дифференцированная (C69.2)
M9512/3 Ретинобластома недифференцированная (C69.2)
M9520/3 Ольфакторная нейрогенная опухоль
M9521/3 Эстезионейроцитома (C30. 0)
M9522/3 Эстезионейробластома (C30.0)
M9523/3 Эстезионейроэпителиома (C30.0)
M953 Менингиомы
M9530/0 Менингиома БДУ (D32.-)
M9530/1 Менингиоматоз БДУ (D42.-)
M9530/3 Менингиома злокачественная (C70.-)
M9531/0 Менинготелиоматозная менингиома (D32.-)
M9532/0 Фиброзная менингиома (D32.-)
M9533/0 Псаммоматозная менингиома (D32.-)
M9534/0 Ангиоматозная менингиома (D32.-)
M9535/0 Гемангиобластическая менингиома (D32.-)
M9536/0 Гемангиоперицитарная менингиома (D32.-)
M9537/0 Переходная менингиома (D32.-)
M9538/1 Папиллярная менингиома (D42.-)
M9539/3 Менингеальный саркоматоз (C70.-)
M954-M957 Опухоли нервных оболочек
M9540/0 Нейрофиброма БДУ
M9540/1 Нейрофиброматоз БДУ (Q85.0)
M9540/3 Нейрофибросаркома
M9541/0 Меланотическая нейрофиброма
M9550/0 Плексиформная нейрофиброма
M9560/0 Неврилеммома БДУ
M9560/1 Невриноматоз
M9560/3 Неврилеммома злокачественная
M9561/3 Тритонная опухоль злокачественная
M9562/0 Нейротекома
M9570/0 Неврома БДУ
M958 Зернистоклеточные опухоли и альвеолярная мягкотканная саркома
M9580/0 Зернистоклеточная опухоль БДУ
M9580/3 Зернистоклеточная опухоль злокачественная
M9581/3 Альвеолярная мягкотканная саркома
M959-M971 Лимфома Ходжкина и неходжкинская лимфома
M959 Злокачественные лимфомы БДУ или диффузные
M9590/3 Злокачественная лимфома БДУ (C84.
0)
M9522/3 Эстезионейробластома (C30.0)
M9523/3 Эстезионейроэпителиома (C30.0)
M953 Менингиомы
M9530/0 Менингиома БДУ (D32.-)
M9530/1 Менингиоматоз БДУ (D42.-)
M9530/3 Менингиома злокачественная (C70.-)
M9531/0 Менинготелиоматозная менингиома (D32.-)
M9532/0 Фиброзная менингиома (D32.-)
M9533/0 Псаммоматозная менингиома (D32.-)
M9534/0 Ангиоматозная менингиома (D32.-)
M9535/0 Гемангиобластическая менингиома (D32.-)
M9536/0 Гемангиоперицитарная менингиома (D32.-)
M9537/0 Переходная менингиома (D32.-)
M9538/1 Папиллярная менингиома (D42.-)
M9539/3 Менингеальный саркоматоз (C70.-)
M954-M957 Опухоли нервных оболочек
M9540/0 Нейрофиброма БДУ
M9540/1 Нейрофиброматоз БДУ (Q85.0)
M9540/3 Нейрофибросаркома
M9541/0 Меланотическая нейрофиброма
M9550/0 Плексиформная нейрофиброма
M9560/0 Неврилеммома БДУ
M9560/1 Невриноматоз
M9560/3 Неврилеммома злокачественная
M9561/3 Тритонная опухоль злокачественная
M9562/0 Нейротекома
M9570/0 Неврома БДУ
M958 Зернистоклеточные опухоли и альвеолярная мягкотканная саркома
M9580/0 Зернистоклеточная опухоль БДУ
M9580/3 Зернистоклеточная опухоль злокачественная
M9581/3 Альвеолярная мягкотканная саркома
M959-M971 Лимфома Ходжкина и неходжкинская лимфома
M959 Злокачественные лимфомы БДУ или диффузные
M9590/3 Злокачественная лимфома БДУ (C84.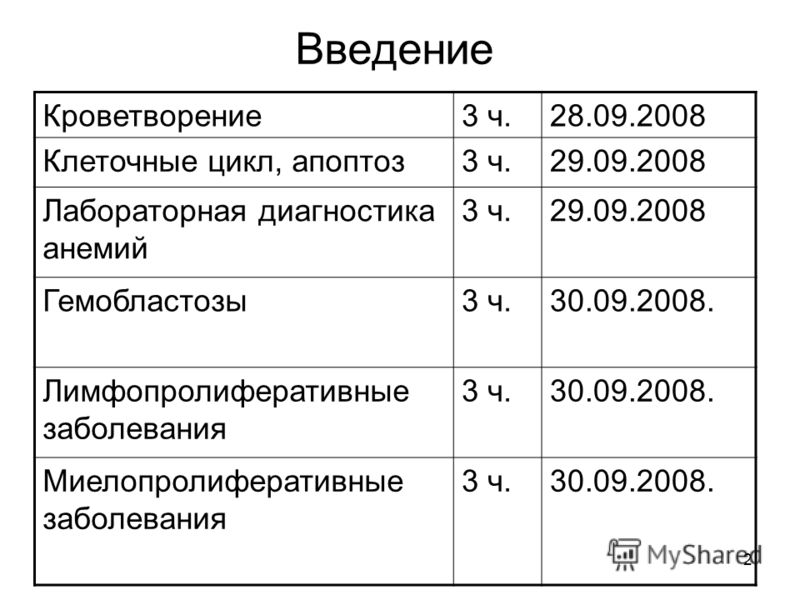 5, C85.9)
M9591/3 Злокачественная лимфома неходжкинская БДУ (C85.9)
M9592/3 Лимфосаркома БДУ (C85.0)
M9593/3 Ретикулосаркома БДУ (C83.3, C83.9)
M9594/3 Микроглиома (C85.7)
M9595/3 Злокачественная лимфома диффузная БДУ (C83.9)
M965-M966 Болезнь Ходжкина
M9650/3 Болезнь Ходжкина БДУ (C81.9)
M9652/3 Болезнь Ходжкина смешанно-клеточная БДУ (C81.2)
M9653/3 Болезнь Ходжкина с лимфоцитарным истощением БДУ (C81.3)
M9654/3 Болезнь Ходжкина с лимфоцитарным истощением и диффузным фиб-
розом (C81.3)
M9655/3 Болезнь Ходжкина с лимфоцитарным истощением, ретикулярная
(C81.3)
M9657/3 Болезнь Ходжкина с лимфоцитарным преобладанием БДУ (C81.0)
M9658/3 Болезнь Ходжкина с лимфоцитарным преобладанием диффузная
(C81.0)
M9659/3 Болезнь Ходжкина с лимфоцитарным преобладанием, нодулярная
(C81.0)
M9660/3 Парагранулема Ходжкина БДУ (C81.7)
M9661/3 Гранулема Ходжкина (C81.7)
M9662/3 Саркома Ходжкина (C81.
5, C85.9)
M9591/3 Злокачественная лимфома неходжкинская БДУ (C85.9)
M9592/3 Лимфосаркома БДУ (C85.0)
M9593/3 Ретикулосаркома БДУ (C83.3, C83.9)
M9594/3 Микроглиома (C85.7)
M9595/3 Злокачественная лимфома диффузная БДУ (C83.9)
M965-M966 Болезнь Ходжкина
M9650/3 Болезнь Ходжкина БДУ (C81.9)
M9652/3 Болезнь Ходжкина смешанно-клеточная БДУ (C81.2)
M9653/3 Болезнь Ходжкина с лимфоцитарным истощением БДУ (C81.3)
M9654/3 Болезнь Ходжкина с лимфоцитарным истощением и диффузным фиб-
розом (C81.3)
M9655/3 Болезнь Ходжкина с лимфоцитарным истощением, ретикулярная
(C81.3)
M9657/3 Болезнь Ходжкина с лимфоцитарным преобладанием БДУ (C81.0)
M9658/3 Болезнь Ходжкина с лимфоцитарным преобладанием диффузная
(C81.0)
M9659/3 Болезнь Ходжкина с лимфоцитарным преобладанием, нодулярная
(C81.0)
M9660/3 Парагранулема Ходжкина БДУ (C81.7)
M9661/3 Гранулема Ходжкина (C81.7)
M9662/3 Саркома Ходжкина (C81. 7)
M9663/3 Болезнь Ходжкина с нодулярным склерозом БДУ (C81.1)
M9664/3 Болезнь Ходжкина с нодулярным склерозом, клеточная фаза
(C81.1)
M9665/3 Болезнь Ходжкина с нодулярным склерозом, лимфоцитарное пре-
обладание (C81.1)
M9666/3 Болезнь Ходжкина с нодулярным склерозом, смешанноклеточная
(C81.1)
M9667/3 Болезнь Ходжкина с нодулярным склерозом, лимфоцитарное исто-
щение (C81.1)
M967-M968 Злокачественная лимфома диффузная или БДУ уточненного типа
M9670/3 Злокачественная лимфома мелкоклеточная лимфоцитарная БДУ
(C83.0)
M9671/3 Злокачественная лимфома лимфоплазмоцитарная (C83.8)
M9672/3 Злокачественная лимфома из мелких клеток с расщепленными яд-
рами диффузная (C83.1)
M9673/3 Злокачественная лимфома лимфоцитарная умеренно дифференциро-
ванная диффузная (C83.8)
M9674/3 Злокачественная лимфома центроцитарная (C83.8)
M9675/3 Злокачественная лимфома смешанная мелко- и крупноклеточная
диффузная (C83.
7)
M9663/3 Болезнь Ходжкина с нодулярным склерозом БДУ (C81.1)
M9664/3 Болезнь Ходжкина с нодулярным склерозом, клеточная фаза
(C81.1)
M9665/3 Болезнь Ходжкина с нодулярным склерозом, лимфоцитарное пре-
обладание (C81.1)
M9666/3 Болезнь Ходжкина с нодулярным склерозом, смешанноклеточная
(C81.1)
M9667/3 Болезнь Ходжкина с нодулярным склерозом, лимфоцитарное исто-
щение (C81.1)
M967-M968 Злокачественная лимфома диффузная или БДУ уточненного типа
M9670/3 Злокачественная лимфома мелкоклеточная лимфоцитарная БДУ
(C83.0)
M9671/3 Злокачественная лимфома лимфоплазмоцитарная (C83.8)
M9672/3 Злокачественная лимфома из мелких клеток с расщепленными яд-
рами диффузная (C83.1)
M9673/3 Злокачественная лимфома лимфоцитарная умеренно дифференциро-
ванная диффузная (C83.8)
M9674/3 Злокачественная лимфома центроцитарная (C83.8)
M9675/3 Злокачественная лимфома смешанная мелко- и крупноклеточная
диффузная (C83. 2)
M9676/3 Злокачественная лимфома центробластно-центроцитарная диффуз-
ная (C83.8)
M9677/3 Злокачественный лимфоматозный полипоз (C83.8)
M9680/3 Злокачественная лимфома крупноклеточная диффузная БДУ
(C83.3)
M9681/3 Злокачественная лимфома из крупных клеток с расщепленными
ядрами диффузная (C83.3)
M9682/3 Злокачественная лимфома из крупных клеток с нерасщепленными
ядрами диффузная (C83.3)
M9683/3 Злокачественная лимфома центробластная диффузная (C83.8)
M9684/3 Злокачественная лимфома иммунобластная БДУ (C83.4)
M9685/3 Злокачественная лимфома лимфобластная (C83.5)
M9686/3 Злокачественная лимфома из мелких клеток с нерасщепленными
ядрами диффузная (C83.0, C83.6)
M9687/3 Лимфома Беркитта БДУ (C83.7)
M969 Злокачественная лимфома фолликулярная или нодулярная с диффуз-
ными участками или без них
M9690/3 Злокачественная лимфома фолликулярная БДУ (C82.9)
M9691/3 Злокачественная лимфома смешанная из мелких клеток с расщеп-
ленными ядрами и крупных клеток фолликулярная (C82.
2)
M9676/3 Злокачественная лимфома центробластно-центроцитарная диффуз-
ная (C83.8)
M9677/3 Злокачественный лимфоматозный полипоз (C83.8)
M9680/3 Злокачественная лимфома крупноклеточная диффузная БДУ
(C83.3)
M9681/3 Злокачественная лимфома из крупных клеток с расщепленными
ядрами диффузная (C83.3)
M9682/3 Злокачественная лимфома из крупных клеток с нерасщепленными
ядрами диффузная (C83.3)
M9683/3 Злокачественная лимфома центробластная диффузная (C83.8)
M9684/3 Злокачественная лимфома иммунобластная БДУ (C83.4)
M9685/3 Злокачественная лимфома лимфобластная (C83.5)
M9686/3 Злокачественная лимфома из мелких клеток с нерасщепленными
ядрами диффузная (C83.0, C83.6)
M9687/3 Лимфома Беркитта БДУ (C83.7)
M969 Злокачественная лимфома фолликулярная или нодулярная с диффуз-
ными участками или без них
M9690/3 Злокачественная лимфома фолликулярная БДУ (C82.9)
M9691/3 Злокачественная лимфома смешанная из мелких клеток с расщеп-
ленными ядрами и крупных клеток фолликулярная (C82. 1)
M9692/3 Злокачественная лимфома центробластно-центроцитарная фолли-
кулярная (C82.7)
M9693/3 Злокачественная лимфома лимфоцитарная высокодифференцирован-
ная нодулярная (C82.7)
M9694/3 Злокачественная лимфома лимфоцитарная умеренно дифференциро-
ванная нодулярная (C82.7)
M9695/3 Злокачественная лимфома из мелких клеток с расщепленными яд-
рами фолликулярная (C82.0)
M9696/3 Злокачественная лимфома лимфоцитарная слабодифференцирован-
ная нодулярная (C82.7)
M9697/3 Злокачественная лимфома центробластная фолликулярная (C82.7)
M9698/3 Злокачественная лимфома крупноклеточная фолликулярная БДУ
(C82.2)
M970 Уточненные кожные и периферические Т-клеточные лимфомы
M9700/3 Грибовидный микоз (C84.0)
M9701/3 Болезнь Сезари (C84.1)
M9702/3 Периферическая Т-клеточная лимфома БДУ (C84.4)
M9703/3 Лимфома Т-зоны (C84.2)
M9704/3 Лимфоэпителиоидная лимфома (C84.3)
M9705/3 Периферическая Т-клеточная лимфома АИЛД (ангиоиммунобластная
лимфоаденопатия с диспротеинемией) (C84.
1)
M9692/3 Злокачественная лимфома центробластно-центроцитарная фолли-
кулярная (C82.7)
M9693/3 Злокачественная лимфома лимфоцитарная высокодифференцирован-
ная нодулярная (C82.7)
M9694/3 Злокачественная лимфома лимфоцитарная умеренно дифференциро-
ванная нодулярная (C82.7)
M9695/3 Злокачественная лимфома из мелких клеток с расщепленными яд-
рами фолликулярная (C82.0)
M9696/3 Злокачественная лимфома лимфоцитарная слабодифференцирован-
ная нодулярная (C82.7)
M9697/3 Злокачественная лимфома центробластная фолликулярная (C82.7)
M9698/3 Злокачественная лимфома крупноклеточная фолликулярная БДУ
(C82.2)
M970 Уточненные кожные и периферические Т-клеточные лимфомы
M9700/3 Грибовидный микоз (C84.0)
M9701/3 Болезнь Сезари (C84.1)
M9702/3 Периферическая Т-клеточная лимфома БДУ (C84.4)
M9703/3 Лимфома Т-зоны (C84.2)
M9704/3 Лимфоэпителиоидная лимфома (C84.3)
M9705/3 Периферическая Т-клеточная лимфома АИЛД (ангиоиммунобластная
лимфоаденопатия с диспротеинемией) (C84. 4)
M9706/3 Периферическая Т-клеточная лимфома плеоморфномелкоклеточная
(C84.4)
M9707/3 Периферическая Т-клеточная лимфома плеоморфносредне- и круп-
ноклеточная (C84.4)
M9709/3 Кожная лимфома (C84.5)
M971 Другие уточненные неходжкинские лимфомы
M9711/3 Моноцитоидная В-клеточная лимфома (C85.7)
M9712/3 Ангиоэндотелиоматоз (C85.7)
M9713/3 Ангиоцентрическая Т-клеточная лимфома (C84.5)
M9714/3 Крупноклеточная (Ki-l+) лимфома (C85.7)
M972 Другие лимфоретикулярные новообразования
M9720/3 Злокачественный гистиоцитоз (C96.1)
M9722/3 Болезнь Леттерера-Сиве (C96.0)
M9723/3 Истинная гистиоцитарная лимфома (C96.3)
M973 Плазмоклеточные опухоли
M9731/3 Плазмоцитома БДУ (C90.2)
M9732/3 Множественная миелома (C90.0)
M974 Тучноклеточные опухоли
M9740/1 Мастоцитома БДУ (D47.0)
M9740/3 Тучноклеточная саркома (C96.2)
M9741/3 Злокачественный мастоцитоз (C96.2)
M976 Иммунопролиферативные заболевания
M9760/3 Иммунопролиферативная болезнь БДУ (C88.
4)
M9706/3 Периферическая Т-клеточная лимфома плеоморфномелкоклеточная
(C84.4)
M9707/3 Периферическая Т-клеточная лимфома плеоморфносредне- и круп-
ноклеточная (C84.4)
M9709/3 Кожная лимфома (C84.5)
M971 Другие уточненные неходжкинские лимфомы
M9711/3 Моноцитоидная В-клеточная лимфома (C85.7)
M9712/3 Ангиоэндотелиоматоз (C85.7)
M9713/3 Ангиоцентрическая Т-клеточная лимфома (C84.5)
M9714/3 Крупноклеточная (Ki-l+) лимфома (C85.7)
M972 Другие лимфоретикулярные новообразования
M9720/3 Злокачественный гистиоцитоз (C96.1)
M9722/3 Болезнь Леттерера-Сиве (C96.0)
M9723/3 Истинная гистиоцитарная лимфома (C96.3)
M973 Плазмоклеточные опухоли
M9731/3 Плазмоцитома БДУ (C90.2)
M9732/3 Множественная миелома (C90.0)
M974 Тучноклеточные опухоли
M9740/1 Мастоцитома БДУ (D47.0)
M9740/3 Тучноклеточная саркома (C96.2)
M9741/3 Злокачественный мастоцитоз (C96.2)
M976 Иммунопролиферативные заболевания
M9760/3 Иммунопролиферативная болезнь БДУ (C88. 9)
M9761/3 Макроглобулинемия Вальденстрема (C88.0)
M9762/3 Болезнь альфа-тяжелых цепей (C88.1)
M9763/3 Болезнь гамма-тяжелых цепей (C88.2)
M9764/3 Иммунопролиферативная болезнь тонкого кишечника (C88.3)
M9765/1 Моноклональная гаммапатия (D47.2)
M9766/1 Ангиоцентрическое иммунопролиферативное поражение (D47.7)
M9767/1 Ангиоиммунобластная лимфаденопатия (D47.7)
M9768/1 Т-гамма лимфопролиферативная болезнь (D47.7)
M980-M994 Лейкозы
M980 Лейкозы БДУ
M9800/3 Лейкозы БДУ (C95.9)
M9801/3 Острый лейкоз БДУ (C95.0)
M9802/3 Подострый лейкоз БДУ (C95.2)
M9803/3 Хронический лейкоз БДУ (C95.1)
M9804/3 Алейкемический лейкоз БДУ (C95.7)
M982 Лимфоидные лейкозы
M9820/3 Лимфоидный лейкоз БДУ (C91.9)
M9821/3 Острый лимфобластный лейкоз БДУ (C91.0)
M9822/3 Подострый лимфолейкоз (C91.2)
M9823/3 Хронический лимфоцитарный лейкоз (C91.1)
M9824/3 Алейкемический лимфолейкоз (C91.7)
M9825/3 Пролимфоцитарный лейкоз (C91.3)
M9826/3 Лейкоз из клеток Беркитта (C91.
9)
M9761/3 Макроглобулинемия Вальденстрема (C88.0)
M9762/3 Болезнь альфа-тяжелых цепей (C88.1)
M9763/3 Болезнь гамма-тяжелых цепей (C88.2)
M9764/3 Иммунопролиферативная болезнь тонкого кишечника (C88.3)
M9765/1 Моноклональная гаммапатия (D47.2)
M9766/1 Ангиоцентрическое иммунопролиферативное поражение (D47.7)
M9767/1 Ангиоиммунобластная лимфаденопатия (D47.7)
M9768/1 Т-гамма лимфопролиферативная болезнь (D47.7)
M980-M994 Лейкозы
M980 Лейкозы БДУ
M9800/3 Лейкозы БДУ (C95.9)
M9801/3 Острый лейкоз БДУ (C95.0)
M9802/3 Подострый лейкоз БДУ (C95.2)
M9803/3 Хронический лейкоз БДУ (C95.1)
M9804/3 Алейкемический лейкоз БДУ (C95.7)
M982 Лимфоидные лейкозы
M9820/3 Лимфоидный лейкоз БДУ (C91.9)
M9821/3 Острый лимфобластный лейкоз БДУ (C91.0)
M9822/3 Подострый лимфолейкоз (C91.2)
M9823/3 Хронический лимфоцитарный лейкоз (C91.1)
M9824/3 Алейкемический лимфолейкоз (C91.7)
M9825/3 Пролимфоцитарный лейкоз (C91.3)
M9826/3 Лейкоз из клеток Беркитта (C91. 7)
M9827/3 Т-клеточный лейкоз/лимфома у взрослых (C91.5)
M983 Плазмоклеточный лейкоз
M9830/3 Плазмоклеточный лейкоз (C90.1)
M984 Эритролейкоз
M9840/3 Эритролейкоз (C94.0)
M9841/3 Острая эритремия (C94.0)
M9842/3 Хроническая эритремия (C94.1)
M985 Лимфосаркомоклеточный лейкоз
M9850/3 Лимфосаркомоклеточный лейкоз (C94.7)
M986 Миелоидные (гранулоцитарные) лейкозы
M9860/3 Миелоидный лейкоз БДУ (C92.9)
M9861/3 Острый миелоидный лейкоз (C92.0)
M9862/3 Подострый миелоидный лейкоз (C92.2)
M9863/3 Хронический миелоидный лейкоз (C92.1)
M9864/3 Алейкемический миелоидный лейкоз (C92.7)
M9866/3 Острый промиелоцитарный лейкоз (C92.4)
M9867/3 Острый миеломоноцитарный лейкоз (C92.5)
M9868/3 Хронический миеломоноцитарный лейкоз (C92.7)
M987 Базофильный лейкоз
M9870/3 Базофильный лейкоз (C92.-)
M988 Эозинофильный лейкоз
M9880/3 Эозинофильный лейкоз (C92.-)
M989 Моноцитарные лейкозы
M9890/3 Моноцитарный лейкоз БДУ (C93.
7)
M9827/3 Т-клеточный лейкоз/лимфома у взрослых (C91.5)
M983 Плазмоклеточный лейкоз
M9830/3 Плазмоклеточный лейкоз (C90.1)
M984 Эритролейкоз
M9840/3 Эритролейкоз (C94.0)
M9841/3 Острая эритремия (C94.0)
M9842/3 Хроническая эритремия (C94.1)
M985 Лимфосаркомоклеточный лейкоз
M9850/3 Лимфосаркомоклеточный лейкоз (C94.7)
M986 Миелоидные (гранулоцитарные) лейкозы
M9860/3 Миелоидный лейкоз БДУ (C92.9)
M9861/3 Острый миелоидный лейкоз (C92.0)
M9862/3 Подострый миелоидный лейкоз (C92.2)
M9863/3 Хронический миелоидный лейкоз (C92.1)
M9864/3 Алейкемический миелоидный лейкоз (C92.7)
M9866/3 Острый промиелоцитарный лейкоз (C92.4)
M9867/3 Острый миеломоноцитарный лейкоз (C92.5)
M9868/3 Хронический миеломоноцитарный лейкоз (C92.7)
M987 Базофильный лейкоз
M9870/3 Базофильный лейкоз (C92.-)
M988 Эозинофильный лейкоз
M9880/3 Эозинофильный лейкоз (C92.-)
M989 Моноцитарные лейкозы
M9890/3 Моноцитарный лейкоз БДУ (C93. 9)
M9891/3 Острый моноцитарный лейкоз (C93.0)
M9892/3 Подострый моноцитарный лейкоз (C93.2)
M9893/3 Хронический моноцитарный лейкоз (C93.1)
M9894/3 Алейкемический моноцитарный лейкоз (C93.7)
M990-M994 Другие лейкозы
M9900/3 Тучноклеточный лейкоз (C94.3)
M9910/3 Острый мегакариобластный лейкоз (C94.2)
M9930/3 Миелоидная саркома (C92.3)
M9931/3 Острый панмиелоз (C94.4)
M9932/3 Острый миелофиброз (C94.5)
M9940/3 Волосатоклеточный лейкоз (C91.4)
M9941/3 Лейкемический ретикулоэндотелиоз (C91.4)
M995-M997 Разные миелопролиферативные и лимфопролиферативные болезни
M9950/1 Истинная полицитемия (D45)
M9960/1 Хроническое миелопролиферативная болезнь (D47.1)
M9961/1 Миелосклероз с миелоидной метаплазией (D47.1)
M9962/1 Идиопатическая тромбоцитемия (D47.3)
M9970/1 Лимфопролиферативная болезнь БДУ (D47.9)
M998 Миелодиспластический синдром
M9980/1 Рефрактерная анемия БДУ (D46.4)
M9981/1 Рефрактерная анемия без сидеробластов (D46.
9)
M9891/3 Острый моноцитарный лейкоз (C93.0)
M9892/3 Подострый моноцитарный лейкоз (C93.2)
M9893/3 Хронический моноцитарный лейкоз (C93.1)
M9894/3 Алейкемический моноцитарный лейкоз (C93.7)
M990-M994 Другие лейкозы
M9900/3 Тучноклеточный лейкоз (C94.3)
M9910/3 Острый мегакариобластный лейкоз (C94.2)
M9930/3 Миелоидная саркома (C92.3)
M9931/3 Острый панмиелоз (C94.4)
M9932/3 Острый миелофиброз (C94.5)
M9940/3 Волосатоклеточный лейкоз (C91.4)
M9941/3 Лейкемический ретикулоэндотелиоз (C91.4)
M995-M997 Разные миелопролиферативные и лимфопролиферативные болезни
M9950/1 Истинная полицитемия (D45)
M9960/1 Хроническое миелопролиферативная болезнь (D47.1)
M9961/1 Миелосклероз с миелоидной метаплазией (D47.1)
M9962/1 Идиопатическая тромбоцитемия (D47.3)
M9970/1 Лимфопролиферативная болезнь БДУ (D47.9)
M998 Миелодиспластический синдром
M9980/1 Рефрактерная анемия БДУ (D46.4)
M9981/1 Рефрактерная анемия без сидеробластов (D46. 0)
M9982/1 Рефрактерная анемия с сидеробластами (D46.1)
M9983/1 Рефрактерная анемия с избытком бластов (D46.2)
M9984/1 Рефрактерная анемия с избытком бластов с трансформацией
(D46.3)
M9989/1 Миелодиспластический синдром БДУ (D46.9)
0)
M9982/1 Рефрактерная анемия с сидеробластами (D46.1)
M9983/1 Рефрактерная анемия с избытком бластов (D46.2)
M9984/1 Рефрактерная анемия с избытком бластов с трансформацией
(D46.3)
M9989/1 Миелодиспластический синдром БДУ (D46.9)