Воспалительный инфильтрат — симптомы болезни, профилактика и лечение Воспалительного инфильтрата, причины заболевания и его диагностика на EUROLAB
Что такое Воспалительный инфильтрат —
Для обозначения подобных форм воспалительных заболеваний многие авторы пользуются противоречивыми по значению терминами «начинающаяся флегмона», «флегмона в стадии инфильтрации» или вообще опускают описание указанных форм заболевания. В то же время отмечается, что формы одонтогеннои инфекции с признаками серозного воспаления околочелюстных мягких тканей встречаются часто и в большинстве случаев хорошо поддаются лечению.
При своевременно начатой рациональной терапии удается предупредить развитие флегмон и абсцессов. И это обосновано с биологических позиций. Подавляющее большинство воспалительных процессов должно заканчиваться и подвергаться инволюции на стадии припухлости или воспалительного инфильтрата. Вариант с дальнейшим их развитием и образованием абсцессов, флегмон — это катастрофа, гибель тканей, т. е. части организма, а при распространении гнойного процесса на несколько областей, сепсисе — нередко и смерть. Поэтому, на наш взгляд, воспалительный инфильтрат является самой частой, самой «целесообразной» и биологически обоснованной формой воспаления. По сути, мы часто видим воспалительные инфильтраты в околочелюстных тканях, особенно у детей, при пульпитах, периодонтитах, расценивая их как реактивные проявления этих процессов. Вариантом воспалительного инфильтрата являются периаденит, серозный периостит. Самым существенным для врача в оценке и классификации этих процессов (постановке диагноза) являются распознавание негнойной стадии воспаления и соответствующая тактика лечения.
е. части организма, а при распространении гнойного процесса на несколько областей, сепсисе — нередко и смерть. Поэтому, на наш взгляд, воспалительный инфильтрат является самой частой, самой «целесообразной» и биологически обоснованной формой воспаления. По сути, мы часто видим воспалительные инфильтраты в околочелюстных тканях, особенно у детей, при пульпитах, периодонтитах, расценивая их как реактивные проявления этих процессов. Вариантом воспалительного инфильтрата являются периаденит, серозный периостит. Самым существенным для врача в оценке и классификации этих процессов (постановке диагноза) являются распознавание негнойной стадии воспаления и соответствующая тактика лечения.
Что провоцирует / Причины Воспалительного инфильтрата:
Воспалительные инфильтраты
 Эта форма воспаления отмечается с одинаковой частотой во всех возрастных группах.
Эта форма воспаления отмечается с одинаковой частотой во всех возрастных группах.Симптомы Воспалительного инфильтрата:
Воспалительные инфильтраты возникают как за счет контактного распространения инфекции (per continuitatum), так и лимфогенного пути при поражении лимфатического узла с дальнейшей инфильтрацией тканей. Инфильтрат обычно развивается в течение нескольких дней. Температура у больных бывает нормальной и субфебрильной. В области поражения возникают припухлость и уплотнение тканей с относительно четкими контурами и распространением на одну или несколько анатомических областей. Пальпация безболезненная или слабо болезненная. Флюктуация не определяется. Кожные покровы в области очага поражения обычной окраски или слегка гиперемированы, несколько напряжены. Имеет место поражение всех мягких тканей данной области — кожи, слизистой оболочки, подкожно-жировой и мышечной ткани, нередко нескольких фасций с включением в инфильтрат лимфатических узлов. Именно поэтому мы отдаем предпочтение термину «воспалительный инфильтрат» перед термином «целлюлит», которым также обозначают подобные поражения.
Воспалительные инфильтраты могут иметь травматический генез. Локализуются они практически во всех анатомических отделах челюстно-лицевой области, несколько чаще в щечной и области дна полости рта. Воспалительные инфильтраты постинфекционной этиологии локализуются в поднижнечелюстной, щечной, околоушно-жевательной, подподбородочной областях. Четко прослеживается сезонность возникновения заболевания (осенне-зимний период). Дети с воспалительным инфильтратом чаще поступают в клинику после 5-х суток заболевания.
Диагностика Воспалительного инфильтрата:
Дифференциальную диагностику воспалительного инфильтрата проводят с учетом выявленного этиологического фактора и давности заболевания. Диагноз подтверждают нормальная или субфебрильная температура тела, относительно четкие контуры инфильтрата, отсутствие признаков гнойного расплавления тканей и резкой болезненности при пальпации. Другими, менее выраженными, отличительными признаками служат: отсутствие значительной интоксикации, умеренная гиперемия кожного покрова без выявления напряженной и лоснящейся кожи. Таким образом, воспалительный инфильтрат может характеризоваться преобладанием пролиферативной фазы воспаления мягких тканей челюстно-лицевой области. Это, с одной стороны, свидетельствует об изменени реактивности организма ребенка, с другой — служит проявлением естественного и терапевтического патоморфоза.
Другими, менее выраженными, отличительными признаками служат: отсутствие значительной интоксикации, умеренная гиперемия кожного покрова без выявления напряженной и лоснящейся кожи. Таким образом, воспалительный инфильтрат может характеризоваться преобладанием пролиферативной фазы воспаления мягких тканей челюстно-лицевой области. Это, с одной стороны, свидетельствует об изменени реактивности организма ребенка, с другой — служит проявлением естественного и терапевтического патоморфоза.
Наибольшие трудности для дифференциальной диагностики представляют гнойные очаги, локализующиеся в пространствах, отграниченных снаружи группами мышц, например в подвисочной области, под m. masseter и др. В этих случаях нарастание симптомов острого воспаления определяет прогноз процесса. В сомнительных вариантах помогает обычная диагностическая пункция очага поражения.
При морфологическом исследовании биоптата из воспалительного инфильтрата обнаруживают типичные для пролиферативной фазы воспаления клетки при отсутствии или небольшом количестве сегментоядерных нейтрофильных лейкоцитов, обилие которых характеризует гнойное воспаление.
В инфильтратах почти всегда обнаруживают скопления дрожжевых и мицелиальных грибов рода Candida, Aspergillus, Mucor, Nocardia. Вокруг них формируются эпителиоидно-клеточные гранулемы. Мицелий грибов характеризуется дистрофическими изменениями. Можно предположить, что длительная фаза продуктивной тканевой реакции поддерживается грибковыми ассоциациями, отражающими возможные явления дисбактериоза.
Лечение Воспалительного инфильтрата:
Лечение больных с воспалительными инфильтратами — консервативное. Проводят противовоспалительную терапию с использованием физиотерапевтических средств. Выраженный эффект дают лазерное облучение, повязки с мазью Вишневского и спиртом. В случаях нагнаивания воспалительного инфильтрата возникает флегмона. Тогда проводят хирургическое лечение.
К каким докторам следует обращаться если у Вас Воспалительный инфильтрат:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Воспалительного инфильтрата, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете  Вы также можете вызвать врача на дом. Клиника Eurolab открыта для Вас круглосуточно.
Вы также можете вызвать врача на дом. Клиника Eurolab открыта для Вас круглосуточно.
Телефон нашей клиники в Киеве: (+38 044) 206-20-00 (многоканальный). Секретарь клиники подберет Вам удобный день и час визита к врачу. Наши координаты и схема проезда указаны здесь. Посмотрите детальнее о всех услугах клиники на ее персональной странице.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу. Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
У Вас ? Необходимо очень тщательно подходить к состоянию Вашего здоровья в целом. Люди уделяют недостаточно внимания симптомам заболеваний
 Каждое заболевание имеет свои определенные признаки, характерные внешние проявления – так называемые симптомы болезни. Определение симптомов – первый шаг в диагностике заболеваний в целом. Для этого просто необходимо по несколько раз в год проходить обследование у врача, чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.
Каждое заболевание имеет свои определенные признаки, характерные внешние проявления – так называемые симптомы болезни. Определение симптомов – первый шаг в диагностике заболеваний в целом. Для этого просто необходимо по несколько раз в год проходить обследование у врача, чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации, возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию в разделе Вся медицина. Также зарегистрируйтесь на медицинском портале Eurolab, чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте, которые будут автоматически высылаться Вам на почту.
Другие заболевания из группы Болезни зубов и полости рта:
Если Вас интересуют еще какие-нибудь виды болезней и группы заболеваний человека или у Вас есть какие-либо другие вопросы и предложения – напишите нам, мы обязательно постараемся Вам помочь.
Воспалительный инфильтрат — описание болезни
Для обозначения подобных форм воспалительных заболеваний многие авторы пользуются противоречивыми по значению терминами «начинающаяся флегмона», «флегмона в стадии инфильтрации» или вообще опускают описание указанных форм заболевания. В то же время отмечается, что формы одонтогеннои инфекции с признаками серозного воспаления околочелюстных мягких тканей встречаются часто и в большинстве случаев хорошо поддаются лечению.
При своевременно начатой рациональной терапии удается предупредить развитие флегмон и абсцессов. И это обосновано с биологических позиций. Подавляющее большинство воспалительных процессов должно заканчиваться и подвергаться инволюции на стадии припухлости или воспалительного инфильтрата. Вариант с дальнейшим их развитием и образованием абсцессов, флегмон — это катастрофа, гибель тканей, т.е. части организма, а при распространении гнойного процесса на несколько областей, сепсисе — нередко и смерть. Поэтому, на наш взгляд, воспалительный инфильтрат является самой частой, самой «целесообразной» и биологически обоснованной формой воспаления. По сути, мы часто видим воспалительные инфильтраты в околочелюстных тканях, особенно у детей, при пульпитах, периодонтитах, расценивая их как реактивные проявления этих процессов. Вариантом воспалительного инфильтрата являются периаденит, серозный периостит. Самым существенным для врача в оценке и классификации этих процессов (постановке диагноза) являются распознавание негнойной стадии воспаления и соответствующая тактика лечения.
Поэтому, на наш взгляд, воспалительный инфильтрат является самой частой, самой «целесообразной» и биологически обоснованной формой воспаления. По сути, мы часто видим воспалительные инфильтраты в околочелюстных тканях, особенно у детей, при пульпитах, периодонтитах, расценивая их как реактивные проявления этих процессов. Вариантом воспалительного инфильтрата являются периаденит, серозный периостит. Самым существенным для врача в оценке и классификации этих процессов (постановке диагноза) являются распознавание негнойной стадии воспаления и соответствующая тактика лечения.
Возникновение болезни Воспалительный инфильтрат
Воспалительные инфильтраты составляют многообразную по этиологическому фактору группу. Проведенные исследования показали, что у 37 % больных был травматический генез заболевания, у 23 % причиной служила одонтогенная инфекция; в остальных случаях инфильтраты возникали после различных инфекционных процессов. Эта форма воспаления отмечается с одинаковой частотой во всех возрастных группах.
Симптомы болезни Воспалительный инфильтрат
Воспалительные инфильтраты возникают как за счет контактного распространения инфекции (per continuitatum), так и лимфогенного пути при поражении лимфатического узла с дальнейшей инфильтрацией тканей. Инфильтрат обычно развивается в течение нескольких дней. Температура у больных бывает нормальной и субфебрильной. В области поражения возникают припухлость и уплотнение тканей с относительно четкими контурами и распространением на одну или несколько анатомических областей. Пальпация безболезненная или слабо болезненная. Флюктуация не определяется. Кожные покровы в области очага поражения обычной окраски или слегка гиперемированы, несколько напряжены. Имеет место поражение всех мягких тканей данной области — кожи, слизистой оболочки, подкожно-жировой и мышечной ткани, нередко нескольких фасций с включением в инфильтрат лимфатических узлов. Именно поэтому мы отдаем предпочтение термину «воспалительный инфильтрат» перед термином «целлюлит», которым также обозначают подобные поражения.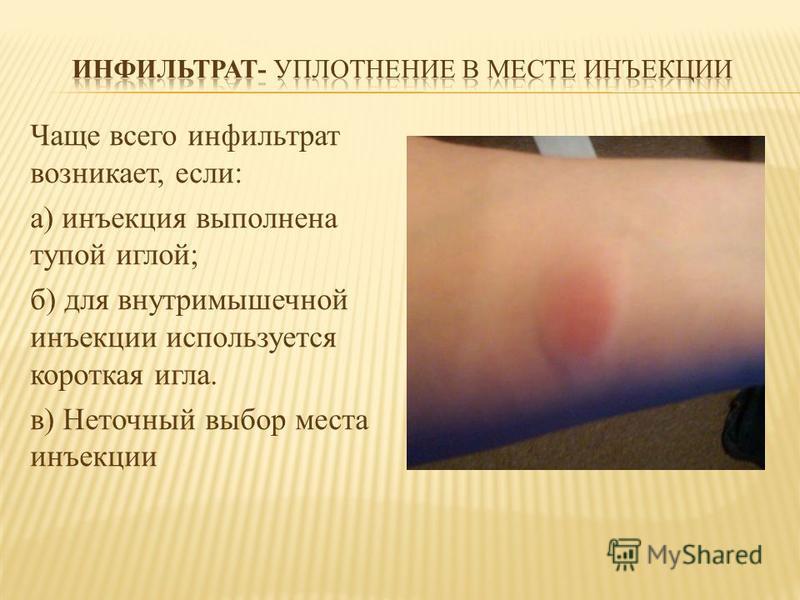 Инфильтрат может разрешаться в гнойные формы воспаления — абсцессы и флегмоны и в этих случаях его следует рассматривать как предстадию гнойного воспаления, которую не удалось купировать.
Инфильтрат может разрешаться в гнойные формы воспаления — абсцессы и флегмоны и в этих случаях его следует рассматривать как предстадию гнойного воспаления, которую не удалось купировать.
Воспалительные инфильтраты могут иметь травматический генез. Локализуются они практически во всех анатомических отделах челюстно-лицевой области, несколько чаще в щечной и области дна полости рта. Воспалительные инфильтраты постинфекционной этиологии локализуются в поднижнечелюстной, щечной, околоушно-жевательной, подподбородочной областях. Четко прослеживается сезонность возникновения заболевания (осенне-зимний период). Дети с воспалительным инфильтратом чаще поступают в клинику после 5-х суток заболевания.
Диагностика болезни Воспалительный инфильтрат
Дифференциальную диагностику воспалительного инфильтрата проводят с учетом выявленного этиологического фактора и давности заболевания. Диагноз подтверждают нормальная или субфебрильная температура тела, относительно четкие контуры инфильтрата, отсутствие признаков гнойного расплавления тканей и резкой болезненности при пальпации. Другими, менее выраженными, отличительными признаками служат: отсутствие значительной интоксикации, умеренная гиперемия кожного покрова без выявления напряженной и лоснящейся кожи. Таким образом, воспалительный инфильтрат может характеризоваться преобладанием пролиферативной фазы воспаления мягких тканей челюстно-лицевой области. Это, с одной стороны, свидетельствует об изменени реактивности организма ребенка, с другой — служит проявлением естественного и терапевтического патоморфоза.
Другими, менее выраженными, отличительными признаками служат: отсутствие значительной интоксикации, умеренная гиперемия кожного покрова без выявления напряженной и лоснящейся кожи. Таким образом, воспалительный инфильтрат может характеризоваться преобладанием пролиферативной фазы воспаления мягких тканей челюстно-лицевой области. Это, с одной стороны, свидетельствует об изменени реактивности организма ребенка, с другой — служит проявлением естественного и терапевтического патоморфоза.
Наибольшие трудности для дифференциальной диагностики представляют гнойные очаги, локализующиеся в пространствах, отграниченных снаружи группами мышц, например в подвисочной области, под m. masseter и др. В этих случаях нарастание симптомов острого воспаления определяет прогноз процесса. В сомнительных вариантах помогает обычная диагностическая пункция очага поражения.
При морфологическом исследовании биоптата из воспалительного инфильтрата обнаруживают типичные для пролиферативной фазы воспаления клетки при отсутствии или небольшом количестве сегментоядерных нейтрофильных лейкоцитов, обилие которых характеризует гнойное воспаление.
В инфильтратах почти всегда обнаруживают скопления дрожжевых и мицелиальных грибов рода Candida, Aspergillus, Mucor, Nocardia. Вокруг них формируются эпителиоидно-клеточные гранулемы. Мицелий грибов характеризуется дистрофическими изменениями. Можно предположить, что длительная фаза продуктивной тканевой реакции поддерживается грибковыми ассоциациями, отражающими возможные явления дисбактериоза.
Лечение болезни Воспалительный инфильтрат
Лечение больных с воспалительными инфильтратами — консервативное. Проводят противовоспалительную терапию с использованием физиотерапевтических средств. Выраженный эффект дают лазерное облучение, повязки с мазью Вишневского и спиртом. В случаях нагнаивания воспалительного инфильтрата возникает флегмона. Тогда проводят хирургическое лечение.
К каким докторам следует обращаться при болезни Воспалительный инфильтрат
Инфекционист
что это такое? Виды инфильтратов
Инфильтрат – что это такое? Медики выделяют несколько его видов – воспалительный, лимфоидный, постинъекционный и другие.
Постинъекционный инфильтрат
Этот вид патологических изменений появляется после инъекций в результате проникновения лекарственного средства в ткани. Причин, по которым возникает постинъекционный инфильтрат, существует несколько:
1. Не были соблюдены правила антисептической обработки.
2. Короткая или тупая игла шприца.
3. Быстрое введение лекарственного средства.
4. Место инъекции выбрано неверно.
5. Многократное введение препарата в одно и то же место.
Появление постинъекционного инфильтрата зависит и от индивидуальных особенностей организма человека. У одних людей он возникает крайне редко, а у других пациентов — практически после каждой инъекции.
Лечение постинъекционного инфильтрата
В инфильтрированной ткани инфекции нет, но опасностью этой патологии после укола является то, что возможен риск возникновения абсцесса. В этом случае лечение может проходить только под наблюдением хирурга.
В этом случае лечение может проходить только под наблюдением хирурга.
Если же не возникает осложнений, то инфильтрат после инъекций лечат физиотерапевтическими методами. Рекомендуется также на место уплотнения ткани наносить йодную сетку несколько раз в день, использовать мазь Вишневского.
Народная медицина тоже предлагает несколько эффективных методов избавления от «шишек», появившихся после инъекций. Мед, лист лопуха или капусты, алоэ, клюква, творог, рис могут оказать лечебное действие при возникновении подобной проблемы. Например, листья лопуха или капусты нужно брать для лечения в свежем виде, прикладывая их на продолжительное время к больному месту. Предварительно «шишку» можно смазать медом. Компресс из творога также хорошо помогает избавиться от застарелых «шишек».
Как бы хорош ни был тот или иной метод лечения указанной проблемы, решающее слово должно принадлежать врачу, так как именно он определит, чем лечить, и нужно ли это делать.
Воспалительный инфильтрат
Эта группа патологий разделяется на несколько видов. Воспалительный инфильтрат – что это такое? Все объясняет медицинская энциклопедия, где говорится о путях возникновения очага воспаления и указываются причины появления патологических реакций тканей.
Воспалительный инфильтрат – что это такое? Все объясняет медицинская энциклопедия, где говорится о путях возникновения очага воспаления и указываются причины появления патологических реакций тканей.
Медицина выделяет большое количество разновидностей инфильтратов рассматриваемой подгруппы. Их наличие может указывать на проблемы с иммунной системой, заболевания врожденного характера, наличие острого воспаления, хронического инфекционного заболевания, аллергических реакций в организме.
Наиболее часто встречающийся вид этого патологического процесса – воспалительный инфильтрат. Что это такое, помогает понять описание характерных признаков данного явления. Итак, на что стоит обратить внимание? Уплотнение тканей в зоне воспаления. При надавливании возникают болезненные ощущения. При более сильном нажатии на теле остается ямка, которая выравнивается медленно, так как вытесненные клетки инфильтрата возвращаются на прежнее место лишь через определенный промежуток времени.
Лимфоидный инфильтрат
Одной из разновидностей патологии тканей является лимфоидный инфильтрат. Что это такое, позволяет понять Большой медицинский словарь. В нем говорится, что такая патология встречается при некоторых хронических инфекционных заболеваниях. Инфильтрат содержит лимфоциты. Они могут скапливаться в разных тканях организма.
Что это такое, позволяет понять Большой медицинский словарь. В нем говорится, что такая патология встречается при некоторых хронических инфекционных заболеваниях. Инфильтрат содержит лимфоциты. Они могут скапливаться в разных тканях организма.
Наличие лимфоидной инфильтрации свидетельствует о сбое в работе иммунной системы.
Постоперационный инфильтрат
По какой причине может образоваться послеоперационный инфильтрат? Что это такое? Нужно ли его лечить? Как это делать? Указанные вопросы волнуют людей, которым пришлось столкнуться с указанной проблемой.
Развитие послеоперационного инфильтрата происходит постепенно. Обычно его обнаружение происходит на 4-6 или даже 10-15 день после хирургического вмешательства. У больного повышается температура тела, появляются ноющие боли в области брюшной полости, задержка стула. Определяется наличие болезненного уплотнения.
В отдельных случаях бывает трудно определить, где находится инфильтрат – в брюшной полости или в ее толще. Для этого врач использует специальные методы диагностики.
Для этого врач использует специальные методы диагностики.
Причины возникновения инфильтрата после операций не всегда удается точно определить, но его терапия в большинстве случаев заканчивается благополучно. Антибиотики и различные виды физиолечения дают положительные результаты.
Очень часто возникает инфильтрат послеоперационного рубца. Иногда он может появиться через несколько лет после проведения хирургической процедуры. Одной из причин его возникновения является используемый шовный материал. Возможно, инфильтрат рассосется самостоятельно. Хотя такое случается редко. Чаще всего явление осложняется абсцессом, который необходимо вскрывать хирургу.
Инфильтрат в легких
Это опасная патология, требующая незамедлительного лечения. С помощью данных рентгенологических исследований и биопсии врачи могут обнаружить у пациента инфильтрат легкого. Что это такое? Легочную инфильтрацию нужно отличать от отека легкого. При такой патологии у больного происходит проникновение и скопление жидкостей, химических веществ, клеточных элементов в тканях внутреннего органа.
Инфильтрация легкого чаще всего имеет воспалительное происхождение. Она может осложняться процессами нагноения, что приводит к потере функции органа.
Умеренное увеличение легкого, уплотнение его ткани – характерные признаки инфильтрации. Распознать их помогает рентгенологическое обследование, при котором видны затемнения тканей внутреннего органа. Что это дает? По характеру затемнения врач может определить вид рассматриваемой патологии и степень заболевания.
Опухолевый инфильтрат
К наиболее часто встречающимся патологиям относится и опухолевый инфильтрат. Что это такое? Его чаще всего составляют атипичные клетки опухоли разной природы (рака, саркомы). Пораженные ткани меняют цвет, становятся плотными, иногда болезненными. Проявляется в опухолевом росте.
Причины появления
Вероятность возникновения инфильтрата в равной степени присутствует у людей любого возраста.
Результаты исследования показали, что причиной заболевания могут стать различного рода травмы, недуги инфекционного характера. Они могут передаваться контактным путем, иметь лимфогенный тип распространения.
Они могут передаваться контактным путем, иметь лимфогенный тип распространения.
В тканях околочелюстной области очень часто развивается инфильтрат. Что это такое? Как его отличить от других заболеваний? Оценить состояние больного и дать точный ответ на поставленные вопросы может только опытный врач. Возбудителями воспаления являются стафилококки, стрептококки и другие представители микрофлоры ротовой полости.
Осложненное состояние острого аппендицита тоже может вызвать развитие инфильтрата. Он возникает при несвоевременном хирургическом вмешательстве.
Симптомы инфильтрата
При развитии заболевания у пациента может наблюдаться незначительно повышенная температура. Она держится на определенной отметке несколько дней. Иногда этот показатель остается нормальным. Распространение инфильтрата происходит на одну или несколько частей тела. Это выражается в припухлости и уплотнении тканей с ясно выделенным контуром. Поражению подвержены все ткани одновременно – слизистая, кожа, подкожно-жировая и мышечная оболочки.
Инфильтрат, который развивается на фоне осложнения аппендицита, характеризуется устойчивой болью в нижней части живота, повышением температуры до 39 градусов, ознобом. В этом случае выздоровление пациента возможно лишь при своевременном хирургическом вмешательстве. Наличие данного вида инфильтрата устанавливается при осмотре врачом (не требует специальных диагностических методов).
В других же случаях только дифференциальный подход позволяет точно установить диагноз и назначить нужное лечение. Иногда для установления диагноза во внимание принимаются данные результатов пункции из места воспаления.
Специалистами проводится исследование материалов, взятых из воспаленной области. Установлена разная природа клеток, составляющих инфильтрат. Именно это обстоятельство позволяет медикам классифицировать заболевание. Как правило, в составе инфильтрата обнаруживается большое скопление дрожжевых и мицелиальных грибов. Это говорит о наличии такого состояния, как дисбактериоз.
Основной целью лечения инфильтрата является ликвидация воспалительных очагов. Это достигается консервативными методами лечения, к которым относится физиотерапия. Пациент не должен заниматься самолечением и затягивать с визитом к специалисту.
Это достигается консервативными методами лечения, к которым относится физиотерапия. Пациент не должен заниматься самолечением и затягивать с визитом к специалисту.
Благодаря физиотерапевтическому лечению добиваются рассасывания инфильтрата путем увеличения кровотока. В это время происходит ликвидация явлений застоя. Также происходит уменьшение отека, снятие болевых ощущений. Чаще всего назначается электрофорез антибиотиков, кальция.
Физиолечение противопоказано, если присутствуют гнойные формы заболевания. Интенсивное воздействие на пораженный участок лишь спровоцирует быстрое развитие инфильтрата и дальнейшее распространение очага.
9.3. ВОСПАЛИТЕЛЬНЫЙ ИНФИЛЬТРАТ
9.3. ВОСПАЛИТЕЛЬНЫЙ ИНФИЛЬТРАТ
К
негнойным формам воспаления мягких
тканей одонтогенной и неодонтогенной
этиологии следует отнести воспалительный
инфильтрат, который возникает в начальном
периоде воспалительных изменений
околочелюстных тканей. Г.А. Васильев(1961)
предложил начальные формы воспалительных
процессов мягких тканей именовать
воспалительным инфильтратом. В. В.
Рогинский и соавт. (1976) рекомендуют
введение понятия «воспалительного
инфильтрата» в клиническую практику.
Некоторые исследователи отмечают
значительный процент воспалительных
инфильтратов в общем числе гнойно-
воспалительных заболеваний лица и шеи
(Биберман Я.М. и др.,1981; Рогинский В.В. и
др.,1984; Тимофеев А.А.,1988).
Г.А. Васильев(1961)
предложил начальные формы воспалительных
процессов мягких тканей именовать
воспалительным инфильтратом. В. В.
Рогинский и соавт. (1976) рекомендуют
введение понятия «воспалительного
инфильтрата» в клиническую практику.
Некоторые исследователи отмечают
значительный процент воспалительных
инфильтратов в общем числе гнойно-
воспалительных заболеваний лица и шеи
(Биберман Я.М. и др.,1981; Рогинский В.В. и
др.,1984; Тимофеев А.А.,1988).
Согласно рубрике 682 в «Статистической классификации болезней, травм и причин смерти», принятой на 29-й Всемирной ассамблее здравоохранения (1965), такой патологический процесс, как воспалительный инфильтрат (целлюлит) выделяется в самостоятельное заболевание.
М.М.
Соловьев и И. Худояров (1979) называют
данную форму воспалительных заболеваний
мягких тканей целлюлитом. Но этот термин
не получил широкого распространения,
т.к. не полностью отражает характер и
объем поражения мягких тканей. Ю.И.
Вернадский и соавт.(1983) начальные формы
воспалительных процессов именуют
«серозными флегмонами». Этот термин
неправильный, т.к. флегмона — это
острое, четко не ограниченное гнойное воспаление клетчатки (Энциклопедический
словарь медицинских терминов, 1984).
Согласно определению, флегмона
серозной не бывает. Воспалительный
инфильтрат некоторые авторы рассматривают
только как одну из стадий развития
воспалительного процесса (Евдокимов
А.И., Васильев ГА., 1964;Вернадский Ю.И.,
1970,1984;Васильев Г.А., Робустова Т.Г., 1981).
Ю.И.
Вернадский и соавт.(1983) начальные формы
воспалительных процессов именуют
«серозными флегмонами». Этот термин
неправильный, т.к. флегмона — это
острое, четко не ограниченное гнойное воспаление клетчатки (Энциклопедический
словарь медицинских терминов, 1984).
Согласно определению, флегмона
серозной не бывает. Воспалительный
инфильтрат некоторые авторы рассматривают
только как одну из стадий развития
воспалительного процесса (Евдокимов
А.И., Васильев ГА., 1964;Вернадский Ю.И.,
1970,1984;Васильев Г.А., Робустова Т.Г., 1981).
На
основании клинико-морфологических
исследований В. В. Рогинский и соавт.
(1984), А.А. Тимофеев (1988) утверждают, что
воспалительные инфильтраты могут быть
не только стадией развития гнойного
процесса, при которой преобладает
пролиферативная фаза воспаления, но
и являться самостоятельным заболеванием.
При инфильтрате имеет место поражение
всех слоев мягких тканей — кожи, слизистой
оболочки, подкожной клетчатки, мышц,
фасций, а иногда с вовлечением и
лимфатических узлов.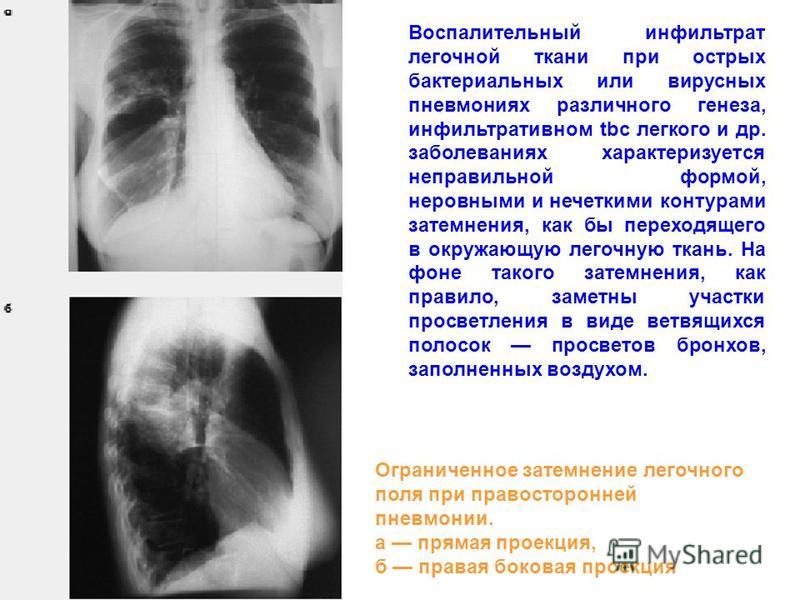 Гистологические
исследования пункционных биоптатов
показали стереотипную морфологическую
картину продуктивного воспаления.
Однако клинико-морфологические
исследования воспалительного инфильтрата
касаются, главным образом, детей. У
больных старшего возраста данный вопрос
ранее не изучался.
Гистологические
исследования пункционных биоптатов
показали стереотипную морфологическую
картину продуктивного воспаления.
Однако клинико-морфологические
исследования воспалительного инфильтрата
касаются, главным образом, детей. У
больных старшего возраста данный вопрос
ранее не изучался.
Выявлено, что одонтогенные воспалительные инфильтраты у взрослых чаще встречались в возрасте от 16 до 34 лет — в 51,7%, реже от 35 до 59 лет в 41,4% и крайне редко у пожилых лиц (от 60 до 74 лет) в 6,9% (Тимофеев А.А.,1988).
За медицинской помощью в 79,3% случаев больные обращаются на 5-10 сутки от начала развития заболевания. Лишь 20,7% обследуемых госпитализированы на 2-4 сутки от начала возникновения воспалительного процесса в мягких тканях.
При
госпитализации больных воспалительным
инфильтратом в стационар, жалобы как
правило, сводились к наличию болезненной
припухлости мягких тканей. У 86,2%
обследуемых боли иррадиировали в ухо,
глазницу, височную область и усиливались
при открывании рта. Все имели жалобы на
слабость, недомогание, головные боли,
нарушение аппетита и сна. Озноб отмечался
у 38,0% лиц.
Все имели жалобы на
слабость, недомогание, головные боли,
нарушение аппетита и сна. Озноб отмечался
у 38,0% лиц.
В анамнезе у обследуемых встречались следующие перенесенные и сопутствующие заболевания: частые острые респираторные заболевания (более 3-х раз в год) у 17,2% обследуемых; хронический тонзиллит и ринит у 10,4%, патология пародонта (пародонтит, гингивит) — у 10,4%; наличие кариозных зубов (более трех) — у 55,2%; обильные зубные отложения у 62,0%.
Аллергические заболевания и аллергические реакции у больных ни в прошлом, ни в настоящем не наблюдались. Развитию острого воспалительного процесса предшествовали парааллергические реакции (физическое перенапряжение, переохлаждение, перегревание, и т.п.) у 51,7% обследуемых.
Заболевания,
которые явились причиной возникновения
одонтогенного воспалительного инфильтрата
распределились следующим образом:
обострившийся хронический периодонтит
— в 51,7%, острый одонтогенный периостит
— в 37,9% (серозный — 17,2%, гнойный 20,7%),
затрудненное прорезывание зуба
мудрости — в 3,5%, альвеолит -6,9%.
Причинными зубами чаще были зубы нижней челюсти (72,4%),реже — зубы верхней челюсти (27,6,%). На нижней челюсти причинными зубами чаще являлись моляры (65,5,%), реже премоляры, а на верхней челюсти — чаще моляры (20,7%), реже премоляры.
В 79,3% случаев патологический процесс локализовался в одной анатомической области, воспалительные инфильтраты располагались в поднижнечелюстной (27,6%), щечной (27,6%) и височной (13,8%) областях, реже — в околоушно-жевательной и подподбородочной областях.
При
клиническом обследовании установлено,
что у всех больных имелась асимметрия
лица за счет припухлости мягких тканей
соответствующей анатомической области.
Кожа над припухлостью была гиперемирована
в 58,6% случаев; а в 41,4% — в цвете не изменена.
В складку обычно не собиралась. Пальпаторно
определялся болезненный или малоболезненный
инфильтрат округлой формы, плотно-
эластической консистенции, малоподвижный.
Контуры относительно четкие. Флюктуации
в начальной стадии заболевания не было.
Воспалительная контрактура челюстей
наблюдалась у 34,5% больных (расстояние
между режущими поверхностями
фронтальных зубов колебалось от 5 до 25
мм).
Флюктуации
в начальной стадии заболевания не было.
Воспалительная контрактура челюстей
наблюдалась у 34,5% больных (расстояние
между режущими поверхностями
фронтальных зубов колебалось от 5 до 25
мм).
Во время осмотра полости рта выявлено, что у 44,8% лиц причинные зубы были удалены еще до госпитализации. Имелась отечность слизистой оболочки альвеолярного отростка, а у 20,7% — сглаженность переходной складки.
Рис. 9.3.1. В дерме, вдоль и вокруг кровеносных сосудов, имеется круглоклеточный воспалитель-ный инфильтрат. Микрофото. Окраска гематок-силин- эозин. Ув. 10×10.
При рентгенологическом исследовании челюстей были выявлены: фиброзный периодонтит (20,7%), гранулематозный периодонтит (27,6%), гранулирующий периодонтит (48,2%), полуретенированные зубы (3,5%).
Рис.
9.3.2. В рыхлой фиброзной ткани, вблизи
кровеносных сосудов, имеются очаговые
скопле-ния воспалительного инфильтрата,
преимущест-венно состоящего из
плазмоцитов, лимфоцитов и небольшого
количества гистиоцитов и молодых
фибробластов, формирующих начало
грануляци-он-ной ткани. Микрофото.
Окраска гематокси-лин- эозин. Ув. 40×10.
Микрофото.
Окраска гематокси-лин- эозин. Ув. 40×10.
Показатели сенсибилизации организма на аллерген гемолитического стафилококка и гемолитического стрептококка были достоверно повышенными. Активность щелочной фосфатазы нейтрофильных лейкоцитов периферической крови достоверно повышалась (в три раза выше нормы) во время обращения больных в стационар. При изучении содержания катионных белков отмечено, что имеется достоверное увеличение их как в нейтрофильных лейкоцитах периферической крови, так и в нейтрофилах. которые эмигрировали в полость рта через слизистую оболочку щеки.
Определяя количество секреторного иммуноглобулина А в смешанной слюне больных одонтогенными воспалительными инфильтратами выявлено, что имеется повышение его. Уровень лизоцима значительно снижался, что указывало на угнетение местной неспецифической резистентности организма у этих больных.
Процент диагностических ошибок у больных данной патологией составил 75,9% (по направлениям врачей поликлиник) и 55,2% (в нашей клинике).
Рис. 9.3.3. Среди фиброзной и жировой ткани Рис. 9.3.4. На большом увеличении этот
диффузно расположен круглоклеточный воспалительный инфильтрат представлен
воспалительный инфильтрат. Окраска преимущественно лимфоидными и
гематоксилин- эозин. Микрофото. плазматическими клетками. Окраска
Ув. 10×10. гематоксилин- эозин. Микрофото. Ув. 40×10.
Морфологические исследования пункционных биоптатов больных воспалительными инфильтратами выявили следующую гистологическую картину — в тканях наблюдались явления пролиферативной фазы воспаления. Субэпидермально определялись микроскопической величины дефекты дермы, замещенные скоплениями макрофагов, фибробластов, эндотелиоцитов с формированием капилляров (рис. 9.3.1). Разрасталась молодая грануляционная ткань, которая замещала дефекты дермы. Формировались гранулемы, состоящие из фибробластов и микрофагов (рис. 9.3.2). В пролифератах можно было обнаружить лимфоциты, макрофаги, плазматические клетки, гистиоциты, фибробласты (рис. 9.3.3 и 9.3.4). Мышечная ткань находилась в состоянии некробиоза. Имеются васкулиты, перифлебиты, невриты и периневриты (рис. 9.3.5).
Рис. 9.3.5 Два нервных ствола среди, преимуще-ственно, фиброзной ткани, инфильтрированной небольшим количеством клеток лимфоидно- плазмоцитарного типа. В правой части рисунка видны венозные сосуды и в верхне- правом углу — значительное скопление воспалительного инфи-льтрата. Окраска гематоксилин- эозин. Микрофото. Ув. 20×10.
Изредка встречались небольшие скопления сегментоядерных нейтрофильных лейкоцитов (рис. 9.3.6). В патоморфологических препаратах нами не было обнаружено больших скоплений лейкоцитов (признаков «нагноения»). Наличие грибковых тел наблюдали у детей.
Рис. 9.3.6. Среди мышечных волокон, находящи-хся в состоянии дистрофии и некробиоза, имеют-ся очаговые лейкоцитарные инфильтраты и в правой части рисунка — рост молодых соедините-льнотканных клеток (фибробластов). Окраска ге-матоксилин- эозин. Микрофото. Ув. 40×10.
Таким образом, морфологическое исследование биоптатов, взятых у обследуемых воспалительными инфильтратами, установило наличие в очаге поражения клеток, которые были типичны для пролиферативной фазы воспаления, при отсутствии или небольшом количестве сегментоядерных нейтрофилов. У части больных морфологически имелось обильное скопление нейтрофильных лейкоцитов, что указывало на возможность нагноения в дальнейшем воспалительного инфильтрата. Переход одонтогенного воспалительного инфильтрата в гнойную форму отмечен у 27,6% больных. У 72,4% заболевание ликвидировалось под воздействием консервативной терапии.
Для ранней диагностики острого неспецифического серозного лимфаденита и воспалительного инфильтрата нами предложен способ, который основан на определении морфологического состава крови, полученной из патологического очага в сравнении с пробой крови из пальца того же больного (авт. свид. 1420531 от 1988 года).
Способ осуществляется следующим образом: больному при помощи иглы для внутривенных инъекций брали пробу капиллярной крови из центра воспалительного очага. Параллельно — пробу капиллярной крови из пальца. На предварительно обезжиренных и высушенных предметных стеклах делали мазки крови, высушивали и окрашивали их по способу Романовского-Гимза. Дальнейшее изучение клеток проводили под иммерсионным увеличением микроскопа (10×90). Подсчитывали в мазках по 100 лейкоцитарных клеток и определяли количество в них лимфоцитов и нейтрофилов. Высчитывали соотношение числа лимфоцитов, обнаруженных в мазке крови, взятой’ из воспалительного очага, к числу лимфоцитов, которые выявлены в пальцевой пробе. Затем определяли соотношение нейтрофилов в мазках из очага воспаления и в пробе из пальца. При увеличении числа лимфоцитов в патологическом очаге более чем в 1,25 раза по сравнению с пробой из невоспаленного участка ткани диагностировали острый неспецифический лимфаденит, а при таком же увеличении числа нейтрофилов — воспалительный инфильтративный процесс в мягких тканях. Изучили изменение морфологического состава капли крови из патологического очага у больных одонтогенным воспалительным инфильтратом. Параллельно с предлагаемым тестом проводилась пункционная биопсия. На основании исследований установлено достоверное увеличение в тканях воспалительного очага нейтрофильных лейкоцитов при воспалительных инфильтратах. Диагностическая ценность предложенного нами метода не уступает общеизвестной методике — пункционной биопсии. Однако наш метод имеет следующие преимущества: менее травматичен, не требует специального аппарата для его выполнения, нет необходимости в изготовлении патологоанатомических препаратов, выполним в обычной клинической лаборатории, быстрота получения ответа (через 1-2 часа).
В зависимости от проводимого нами лечения больных воспалительным инфильтратом разделили на 2 подгруппы. Всем больным удаляли причинные зубы (если они не были удалены ранее). В I подгруппу включены лица, которым применяли внутримышечное введение антибиотиков в общепринятых дозировках, неспецифическую гипосенсибилизирующую терапию, симптоматическое и физиотерапевтическое (УВЧ.СВЧ) лечение. Во II подгруппу — обследуемые, которых лечили ежедневными новокаиновыми блокадами симпатических ганглиев шеи на стороне поражения.
На основании проведенного обследования установлена малая эффективность традиционных методов терапии воспалительного инфильтрата. Для практического здравоохранения предлагается метод лечения (авт. свид. №1438791 от 1987), который заключается в проведении ежедневных новокаиновых блокад верхнего шейного и звездчатого симпатических узлов на стороне поражения. Техника блокад изложена ранее (раздел 9.2 данного руководства). Использование данного способа позволило нормализовать уровень лизоцима смешанной слюны еще до выписки обследуемых из стационара и сократить сроки лечения больных.
Нашими исследованиями установлено, что воспалительный инфильтрат может протекать в двух формах: первая — как самостоятельное заболевание, вторая — как ранняя фаза гнойно- воспалительного процесса.
Воспалительный инфильтрат может протекать в виде самостоятельного заболевания. В этих случаях он клинически характеризуется длительностью течения (не менее 5 дней), отсутствием или умеренной интоксикацией организма, субфебрильной температурой тела, отсутствием очагов гнойного расплавления, относительной четкостью контуров, малой болезненностью, постепенным снижением температуры по периферии инфильтрата, а морфологически — гистиоцитарно-плазмоклеточной инфильтрацией тканей.
Воспалительный инфильтрат может являться ранней стадией гнойно- воспалительного процесса. В этих случаях, в отличие от самостоятельной нозологической категории, ему характерен короткий срок течения (2-4 дня), выраженная интоксикация организма, умеренно повышенная и высокая температура тела, раннее абсцедирование, нечеткость контуров, резкая болезненность, гиперемия кожных покровов, а морфологически- инфильтрация тканей нейтрофильными лейкоцитами.
Воспалительный инфильтрат развивается у больных со сниженной местной неспецифической резистентностью организма, при наличии у них несанированных зубов (55,2%) и обильных зубных обложений (62,0%). Причиной заболевания чаще всего служит гранулирующий периодонтит (в 48,2% случаев), показатели местной неспецифической резистентности организма у этих лиц были значительно ниже, чем у больных лимфаденитами.
Деление воспалительного инфильтрата на две формы имеет принципиальное значение, т.к. это определяет тактику проводимого лечения.
Типы, симптомы, причины и лечение
Мы включаем продукты, которые, по нашему мнению, будут полезны нашим читателям. Если вы покупаете по ссылкам на этой странице, мы можем получить небольшую комиссию. Вот наш процесс.
Воспаление является частью защитного механизма организма и играет роль в процессе заживления.
Когда тело обнаруживает злоумышленника, оно запускает биологический ответ, чтобы попытаться удалить его.
Злоумышленником может быть инородное тело, например шип, раздражитель или патоген.Патогены включают бактерии, вирусы и другие организмы, вызывающие инфекции.
Иногда организм ошибочно воспринимает собственные клетки или ткани как вредные. Эта реакция может привести к аутоиммунным заболеваниям, таким как диабет 1 типа.
Эксперты считают, что воспаление может вызывать широкий спектр хронических заболеваний. Примерами этого являются метаболический синдром, который включает диабет 2 типа, сердечные заболевания и ожирение.
Люди с этими состояниями часто имеют более высокий уровень воспалительных маркеров в организме.
Из этой статьи вы узнаете больше о том, почему возникает воспаление, его симптомах и способах решения.
Поделиться на PinterestЧеловек с острым воспалением может испытывать боль в пораженной области.Есть два основных типа воспаления: острое и хроническое.
Острое воспаление
Травма или заболевание могут включать острое или краткосрочное воспаление.
Существует пять основных признаков острого воспаления:
- Боль : Это может происходить постоянно или только тогда, когда человек касается пораженного участка.
- Покраснение : Это происходит из-за увеличения притока крови к капиллярам в этой области.
- Потеря функции : Могут быть трудности с движением сустава, дыханием, ощущением запаха и т. Д.
- Отек : при скоплении жидкости может развиться отек.
- Тепло : усиление кровотока может сделать пораженный участок теплым на ощупь.
Эти признаки присутствуют не всегда. Иногда воспаление протекает «тихо», бессимптомно.Человек может также чувствовать усталость, общее недомогание и повышенную температуру.
Симптомы острого воспаления длятся несколько дней. Подострое воспаление длится 2–6 недель.
Хроническое воспаление может продолжаться месяцами или годами. Он либо имеет, либо может быть связан с различными заболеваниями, например:
Симптомы зависят от заболевания, но могут включать боль и усталость.
Измерение воспаления
Когда в организме присутствует воспаление, уровень веществ, известных как биомаркеры, повышается.
Примером биомаркера является C-реактивный белок (CRP). Если врач хочет проверить на воспаление, он может оценить уровень СРБ.
Уровни CRP обычно выше у пожилых людей и людей с такими заболеваниями, как рак и ожирение. Даже диета и упражнения могут иметь значение.
Воспаление возникает, когда физический фактор вызывает иммунную реакцию. Воспаление не обязательно означает наличие инфекции, но инфекция может вызвать воспаление.
Острое воспаление
Острое воспаление может возникнуть в результате:
- воздействия вещества, например укуса пчелы или пыли
- травмы
- инфекции
Когда организм обнаруживает повреждения или патогены, срабатывает иммунная система ряд реакций:
- В тканях накапливаются белки плазмы, что приводит к накоплению жидкости, что приводит к отеку.
- Организм выделяет нейтрофилы, один из видов лейкоцитов или лейкоцитов, которые движутся к пораженному участку. Лейкоциты содержат молекулы, которые помогают бороться с патогенами.
- Мелкие кровеносные сосуды увеличиваются, чтобы лейкоциты и белки плазмы легче достигали места повреждения.
Признаки острого воспаления могут появиться в течение нескольких часов или дней, в зависимости от причины. В некоторых случаях они могут быстро стать тяжелыми. Как они развиваются и как долго они продолжаются, будет зависеть от причины, на какую часть тела они влияют, и индивидуальных факторов.
Некоторые факторы и инфекции, которые могут привести к острому воспалению, включают:
Хроническое воспаление
Хроническое воспаление может развиться, если у человека есть:
Чувствительность : Воспаление возникает, когда организм ощущает то, чего не должно быть. Повышенная чувствительность к внешнему триггеру может привести к аллергии.
Воздействие : Иногда длительное незначительное воздействие раздражителя, например промышленного химического вещества, может привести к хроническому воспалению.
Аутоиммунные расстройства: Иммунная система по ошибке атакует нормальные здоровые ткани, как при псориазе.
Аутовоспалительные заболевания : генетический фактор влияет на работу иммунной системы, как при болезни Бехчета.
Стойкое острое воспаление : В некоторых случаях человек может не полностью вылечиться от острого воспаления. Иногда это может привести к хроническому воспалению.
Факторы, которые могут увеличить риск хронического воспаления, включают:
Долговременные заболевания, которые врачи связывают с воспалением, включают:
Воспаление играет жизненно важную роль в выздоровлении, но хроническое воспаление может увеличить риск различных заболеваний, включая некоторые виды рака. , ревматоидный артрит, атеросклероз, пародонтит и сенная лихорадка.
В следующей таблице приведены некоторые ключевые различия между острым и хроническим воспалением.
Важно выявлять и лечить воспаление и связанные с ним заболевания, чтобы предотвратить дальнейшие осложнения.
Острое воспаление может вызывать боль разного типа и степени тяжести. Боль может быть постоянной и устойчивой, пульсирующей, колющей или щипающей.
Боль возникает, когда скопление жидкости приводит к отеку, и опухшие ткани давят на чувствительные нервные окончания.
Во время воспаления происходят и другие биохимические процессы. Они влияют на поведение нервов, и это может способствовать возникновению боли.
Лечение воспаления зависит от причины и степени тяжести. Часто в лечении нет необходимости.
Однако иногда, если не лечить воспаление, могут появиться симптомы, угрожающие жизни.
Во время аллергической реакции, например, воспаление может вызвать сильную опухоль, которая может закрыть дыхательные пути, что сделает невозможным дыхание.При возникновении этой реакции необходимо пройти курс лечения.
Без лечения некоторые инфекции могут попасть в кровь, что приведет к сепсису. Это еще одно опасное для жизни состояние, требующее срочной медицинской помощи.
Острое воспаление
Врач может назначить лечение для устранения причины воспаления, устранения симптомов или того и другого.
Например, при бактериальной или грибковой инфекции они могут прописать антибиотики или противогрибковые препараты.
Вот несколько методов лечения, специально предназначенных для лечения воспаления:
Нестероидные противовоспалительные препараты
Нестероидные противовоспалительные препараты (НПВП) не устраняют причину воспаления, но они могут помочь облегчить боль, отек, лихорадку и т. другие симптомы.Они делают это, противодействуя ферменту, который способствует воспалению.
Примеры НПВП включают напроксен, ибупрофен и аспирин. Их можно приобрести онлайн или без рецепта. Люди должны сначала проконсультироваться с врачом или фармацевтом, чтобы убедиться, что они сделали правильный выбор.
Люди должны использовать НПВП в течение длительного времени только по рекомендации врача, поскольку они могут иметь побочные эффекты. Аспирин не подходит для детей.
Обезболивание : Ацетаминофен, включая парацетамол или тайленол, может облегчить боль, но не уменьшает воспаление.Эти препараты позволяют воспалению продолжать свою роль в заживлении.
Кортикостероиды
Кортикостероиды, такие как кортизол, являются разновидностью стероидных гормонов. Они влияют на различные механизмы, участвующие в воспалении.
Кортикостероиды могут помочь справиться с рядом состояний, в том числе:
Они доступны в виде таблеток, инъекций, ингаляторов, кремов или мазей.
Длительное употребление кортикостероидов может быть вредным. Врач может посоветовать их риски и преимущества.
Лечение заболеваний, сопровождающихся длительным воспалением, зависит от состояния.
Некоторые лекарства подавляют иммунные реакции организма. Они могут помочь облегчить симптомы ревматоидного артрита, псориаза и других подобных аутоиммунных реакций. Однако они также могут сделать организм человека менее способным бороться с инфекцией, если она возникнет.
Людям, перенесшим операцию по трансплантации, также необходимо принимать иммунодепрессанты, чтобы их организм не отторгал новый орган.Им тоже нужно проявлять особую осторожность, чтобы не заразиться инфекциями.
Различные травяные добавки могут помочь справиться с воспалением.
Harpagophytum procumbens: Это растение, также известное как дьявольский коготь, древесный паук или растение для захвата, происходит из Южной Африки и связано с кунжутом. Некоторые более ранние исследования 2011 года показали, что он может обладать противовоспалительными свойствами. Различные бренды доступны для покупки в Интернете.
Иссоп: Люди могут смешивать это растение с другими травами, такими как солодка, для лечения некоторых заболеваний легких, включая воспаление дыхательных путей.Однако эфирное масло иссопа вызывает у лабораторных животных опасные для жизни судороги, поэтому необходимо соблюдать осторожность.
Имбирь: Люди давно используют имбирь для лечения диспепсии, запоров, колик и других желудочно-кишечных заболеваний, а также боли при ревматоидном артрите. Имбирь доступен в свежем виде в магазинах или онлайн в виде добавок.
Куркума: Куркумин, основной ингредиент куркумы, может быть полезен при артрите, болезни Альцгеймера и некоторых других воспалительных состояниях.Добавки с куркумой и куркумином доступны в Интернете.
Каннабис: Каннабиноид под названием каннабихромен может обладать противовоспалительными свойствами. Люди должны сначала проверить, являются ли продукты, связанные с каннабисом, законными там, где они живут.
Узнайте больше о противовоспалительных добавках.
Эти травы не одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) для использования в медицинских целях. Всегда консультируйтесь с врачом перед тем, как принимать какие-либо травы или другие добавки.
Некоторые продукты содержат питательные вещества, которые могут помочь уменьшить воспаление.
Они включают:
- оливковое масло
- продукты с высоким содержанием клетчатки
- помидоры
- орехи, такие как грецкие орехи и миндаль
- листовая зелень, включая шпинат и капусту
- жирную рыбу, такую как лосось и скумбрия
- фрукты, включая чернику и апельсины
Исследования показали, что люди с высоким уровнем СРБ с меньшей вероятностью будут придерживаться диеты, богатой свежими продуктами и полезными маслами, такой как средиземноморская диета.
Следующие продукты могут усугубить воспаление:
- жареные продукты
- продукты высокой степени обработки
- продукты и напитки с добавлением сахара
- красное мясо
- нездоровые жиры, такие как насыщенные и трансжиры
Диета сама по себе не контролирует воспаление , но правильный выбор может помочь предотвратить ухудшение состояния.
Узнайте больше о противовоспалительной диете.
Воспаление — это часть процесса, с помощью которого иммунная система защищает организм от вредных агентов, таких как бактерии и вирусы.В краткосрочной перспективе он может оказать полезную услугу, хотя может также вызвать дискомфорт.
Однако длительное или хроническое воспаление может как привести к некоторым тяжелым и, возможно, опасным для жизни состояниям, так и быть их результатом.
Люди с опухолями, ревматоидным артритом, воспалительным заболеванием кишечника, реакциями на лекарства и другими проблемами со здоровьем могут иметь высокий уровень CRP, что является признаком воспалительного иммунного ответа.
По мере того как ученые узнают больше о роли воспаления в развитии болезни, их открытия могут привести к более эффективным методам лечения различных болезней, от которых еще нет лечения, таких как диабет 1 типа.
Противовоспалительные добавки: 8 натуральных ингредиентов
Мы включаем продукты, которые, по нашему мнению, полезны для наших читателей. Если вы покупаете по ссылкам на этой странице, мы можем получить небольшую комиссию. Вот наш процесс.
Воспаление — это реакция организма на раздражение, инфекцию и травму. Кратковременное воспаление защищает организм, в то время как хроническое воспаление может привести к длительной боли и повреждению, например, при артрите.
Противовоспалительные препараты помогают бороться с болью и хроническим воспалением.
Однако эти препараты безопасны не для всех, и длительное применение может привести к осложнениям и побочным эффектам.
Некоторые натуральные добавки могут помочь бороться с воспалением, хотя не все добавки подходят для всех типов воспалений.
В этой статье мы описываем некоторые из наиболее эффективных противовоспалительных добавок, которые люди могут захотеть попробовать, в зависимости от причины их воспаления.
Омега-3 жирные кислоты, которых много в жирной рыбе, такой как треска, являются одними из самых мощных противовоспалительных добавок.
Эти добавки могут помочь бороться с несколькими типами воспалений, включая воспаление сосудов. Воспаление сосудов является значительным фактором риска сердечных заболеваний и сердечного приступа.
В одном исследовании с участием 250 человек, страдающих от остеохондроза, 59% участников смогли заменить нестероидные противовоспалительные препараты (НПВП) рыбьим жиром.
Правильная дозировка зависит от эффективности добавки. Некоторые продукты выпускаются в форме таблеток, тогда как другие производители продают омега-3 в виде масла.При использовании этих продуктов люди всегда должны следовать инструкциям на упаковке.
Как и многие противовоспалительные препараты, отпускаемые по рецепту, омега-3 жирные кислоты и рыбий жир могут повышать риск кровотечения. Людям с нарушениями свертываемости крови и тем, кто принимает антикоагулянты, не следует принимать эту добавку.
Омега-3 жирные кислоты можно приобрести в Интернете.
Куркумин, который является активным ингредиентом куркумы, является растением из семейства имбирных. Исследования на животных показали, что это может помочь уменьшить воспаление, ускорить заживление ран и даже снизить риск рака.
Исследование 2011 года также показало, что куркумин может помочь уменьшить воспаление, вызванное метаболическими нарушениями, связанными с ожирением. Куркумин изменил несколько воспалительных процессов, снизив инсулинорезистентность, гипергликемию и гиперлипидемию.
Типичная дозировка куркумина составляет 400–600 миллиграммов (мг) три раза в день.
Хотя куркумин безопасно принимать с низкими дозами НПВП, более высокие дозы могут увеличить риск кровотечения. Куркумин также увеличивает риск кровотечения у людей, принимающих антикоагулянты, и у людей с нарушениями свертываемости крови.
Куркумин можно приобрести в Интернете.
S-аденозилметионин (SAM-e) — это вещество, которое организм вырабатывает естественным образом. Он играет важную роль в эпигенетической регуляции генов.
Эпигенетические факторы влияют на экспрессию и поведение генов, включая или выключая одни гены и изменяя действие других.
Врачи иногда рекомендуют SAM-e для лечения симптомов депрессии, остеоартрита и некоторых заболеваний печени, поскольку воспаление может играть роль в каждом из них.
Несколько клинических испытаний показали, что SAM-e может помочь облегчить боль и воспаление, связанные с различными типами артрита — иногда так же, как НПВП.
Правильная дозировка зависит от состояния человека. Например:
- При фибромиалгии человек может принимать 200–800 мг два раза в день.
- При депрессии человек может принимать 800–1600 мг два раза в день.
- При остеоартрите человек может принимать 600–1200 мг три раза в день.
SAM-e может взаимодействовать с широким спектром лекарств, поэтому люди не должны принимать его без предварительной консультации с врачом.
В высоких дозах SAM-e может вызвать рвоту, диарею, газы и тошноту, поэтому людям не следует превышать рекомендованную дозу.
Добавки SAM-e можно приобрести в Интернете. Исследования показывают, что цинк снижает окислительный стресс у пожилых людей.
Некоторые исследования показывают, что цинк является мощным противовоспалительным средством, которое может поддерживать иммунную систему и снижать некоторые маркеры воспаления.
Согласно статье 2014 года, цинк снижает воспаление и окислительный стресс у пожилых людей. Окислительный стресс вызывает воспаление и может увеличить риск множества состояний, включая рак.
Цинк также снизил уровень инфекций на 66%.
Люди с дефицитом цинка чаще болеют артритом, что предполагает связь между дефицитом цинка, воспалением и болью.
Обычная суточная доза добавок цинка составляет 11 мг для мужчин и 8 мг для женщин.Прием более 40 мг в день может быть опасным.
Цинк может взаимодействовать с кальцием, диуретиками и некоторыми антибиотиками, поэтому перед тем, как попробовать эту добавку, людям следует поговорить с врачом.
Добавки цинка можно приобрести в Интернете.
Врачи давно подозревали, что зеленый чай может бороться с воспалениями, потому что у людей, живущих в регионах, которые потребляют больше зеленого чая, ниже уровень заболеваний, связанных с воспалениями.
Исследования показывают, что зеленый чай может подавлять выработку определенных воспалительных химических веществ.Это также может помочь замедлить потерю хряща, уменьшая симптомы артрита.
Большинство врачей рекомендует выпивать три или четыре чашки зеленого чая в день или принимать 300–400 мг экстракта зеленого чая в день.
Зеленый чай содержит кофеин, поэтому он небезопасен для тех, кто чувствителен к кофеину. Кофеин может вызвать проблемы с желудком, такие как диарея.
Некоторые компании производят зеленый чай без кофеина, но исследователи еще не знают, эффективен ли этот вид зеленого чая для уменьшения воспаления.
Экстракт зеленого чая можно приобрести в Интернете.
Смола Boswellia serrata , или ладан, может облегчить воспаление и боль.
Он также может помочь уменьшить потерю хряща и обратить вспять аутоиммунные симптомы. Это быстродействующая добавка, которая может помочь от боли при остеоартрите всего за 5 дней.
Обычная дозировка — это экстракт, содержащий 30–40% босвеллиевых кислот, который человек принимает по 300–500 мг два-три раза в день.
Комбинация ладана с куркумином может повысить его эффективность, и некоторые исследования показали, что люди переносят эту комбинацию лучше, чем диклофенак НПВП.
Ладан обычно безопасен и не вызывает побочных эффектов. Однако некоторые люди сообщают о боли в животе и желудочно-кишечных проблемах, таких как диарея.
Добавки ладана можно приобрести в Интернете.
Капсаицин — это ингредиент, который дает острым перцам их тепло. Вещество P, ключевой компонент капсаицина, может снизить способность организма чувствовать и передавать боль.
Некоторые исследования показывают, что капсаицин может помочь при нервной и мышечной боли.
Некоторые производители предлагают кремы с капсаицином, которые можно наносить непосредственно на болезненные участки.Также могут помочь добавки капсаицина. Опять же, люди, принимающие их, должны следовать указаниям на упаковке.
Капсаицин может раздражать кожу и глаза, поэтому после использования необходимо тщательно мыть руки.
Добавки капсаицина можно приобрести в Интернете.
Кошачий коготь получают из различных растений ункарии, включая Uncaria tomentosa и Uncaria guianensis .
Исследования показывают, что кошачий коготь может уменьшить различные формы воспаления.Он особенно эффективен при подавлении TNF-альфа, воспалительного химического вещества в организме.
Если вы употребляете чай из кошачьих когтей, человек может выпить 1000 мг коры корня на 8 унций воды. Также безопасно употреблять в виде порошка в форме капсул в суточных дозах 20–60 мг.
Хотя кошачий коготь в целом безопасен, в двух отчетах о случаях заболевания предполагается, что он может вызывать почечную недостаточность у людей с волчанкой. Он также может вызывать тошноту, хотя некоторые исследования показывают, что НПВП индометацин также может уменьшить боль в желудке.
Добавки «Кошачий коготь» можно приобрести в Интернете.
Поделиться на PinterestСуществует широкий выбор противовоспалительных препаратов, отпускаемых по рецепту.Противовоспалительные добавки подходят не всем. Почти во всех случаях этим добавкам требуется время, чтобы снять воспаление.
Итак, люди, которым требуется немедленное обезболивание, могут попробовать другие варианты, в дополнение к противовоспалительным добавкам или вместо них. Некоторые варианты включают:
- Безрецептурные противовоспалительные препараты: Лекарства, такие как ибупрофен, ацетаминофен и аспирин, могут помочь при боли, связанной с воспалением.Они также могут уменьшить отек после недавней травмы.
- Противовоспалительные препараты, отпускаемые по рецепту: Широкий спектр лекарств, отпускаемых по рецепту, может помочь при воспалении и боли.
- Противовоспалительная диета: Некоторые люди сосредотачиваются на еде, уменьшающей воспаление, в то время как другие избегают продуктов, которые могут вызвать воспаление. Жареные продукты, газированные напитки, рафинированные углеводы и красное мясо могут вызвать воспаление, а орехи, черника, клубника, оливковое масло, помидоры и листовые зеленые овощи могут помочь в борьбе с ним.
Натуральные противовоспалительные добавки могут помочь организму бороться с болью и воспалением. Они могут даже предотвратить некоторые долгосрочные осложнения хронического воспаления, такие как рак.
Перед тем, как попробовать новое противовоспалительное средство, даже естественное, важно проконсультироваться с врачом. Природные средства правовой защиты часто являются сильнодействующими лекарствами, которые могут вызывать побочные эффекты и взаимодействовать с другими лекарствами.
Однако, работая, они могут уменьшить потребность в приеме рецептурных или безрецептурных лекарств.
Воспалительное заболевание кишечника: причины, симптомы и лечение
Воспалительное заболевание кишечника (ВЗК) относится к нескольким долгосрочным состояниям, которые включают воспаление пищеварительного тракта или кишечника.
По данным Центров по контролю и профилактике заболеваний (CDC), до 3 миллионов человек в Соединенных Штатах сейчас страдают ВЗК. Большинство людей с ВЗК получают диагноз до достижения 30-летнего возраста.
В этой статье исследуются различные типы ВЗК и их сравнение с синдромом раздраженного кишечника (СРК).Он также охватывает симптомы, причины и варианты лечения ВЗК.
Поделиться на Pinterest У человека с ВЗК может наблюдаться кровь в стуле, слабость и потеря веса.Двумя основными типами ВЗК являются язвенный колит и болезнь Крона. В следующих разделах они рассматриваются более подробно.
Язвенный колит
Это состояние вызывает воспаление толстой или толстой кишки. В зависимости от локализации и степени тяжести язвенный колит подразделяется на несколько различных классов.Это:
- Язвенный проктит: Этот тип возникает, когда воспаление остается в прямой кишке. Как правило, это самая легкая форма язвенного колита.
- Универсальный колит или панколит: Этот тип возникает, когда воспаление распространяется по всей толстой кишке.
- Проктосигмоидит: Тип возникает, когда прямая кишка и нижний конец толстой кишки испытывают воспаление.
- Дистальный колит: Этот тип возникает, когда воспаление распространяется от прямой кишки вверх по левой ободочной кишке.
- Острый тяжелый язвенный колит: Это редкий тип, вызывающий воспаление всей толстой кишки, приводящее к тяжелым симптомам и боли.
Узнайте все о язвенном колите здесь.
Болезнь Крона
Болезнь Крона может поражать любую часть пищеварительного тракта между ртом и анусом. Однако чаще всего он развивается в последнем отделе тонкой кишки и толстой кишки.
Этот тип ВЗК со временем стал более распространенным.На самом деле, по данным Национального института диабета, болезней органов пищеварения и почек (NIDDK), около 500000 человек в США сейчас страдают им.
Они также предполагают, что болезнь Крона наиболее вероятно разовьется в возрасте 20–29 лет.
Подробнее о болезни Крона здесь.
Другое
Если врач не может различить два основных типа ВЗК, он классифицирует состояние человека как «неопределенный колит».
Некоторые другие типы ВЗК включают лимфоцитарный колит и коллагенозный колит.
Между IBS и IBD есть некоторые сходства. Например, они оба могут привести к изменению привычек кишечника и боли в животе. Симптомы обоих также имеют тенденцию к обострению на короткие периоды времени, а затем переходят в ремиссию.
Ни у одного из них нет лекарства, которое могло бы полностью вылечить это состояние.
По этим причинам люди часто путают ВЗК с СРК. Однако эти два состояния различаются следующим образом:
- ВЗК — более тяжелое состояние, которое может привести к ряду осложнений, включая недостаточность питания и повреждение кишечника.
- ВЗК возникает из-за сверхактивной иммунной системы, которая приводит к воспалению во всем кишечнике и желудочно-кишечном тракте. СРК обычно развивается из-за проблем с пищеварением или чрезмерной чувствительности кишечника.
- Для лечения ВЗК используются препараты, уменьшающие воспаление. Люди с СРК могут уменьшить свои симптомы, изменив свой рацион или образ жизни.
Узнайте больше о IBS здесь.
Несколько факторов могут способствовать развитию ВЗК. Например, это может произойти из-за нерегулярной реакции иммунной системы на бактерии, вирусы или частицы пищи.Это может вызвать воспалительную реакцию в кишечнике.
Исследования также связали Escherichia coli с болезнью Крона.
Хотя в настоящее время не существует единой подтвержденной причины ВЗК, существует несколько потенциальных факторов, которые могут увеличить риск развития каждого из состояний в рамках ВЗК.
В следующих разделах они рассматриваются более подробно.
Факторы риска язвенного колита
- Возраст: Большинство людей получают диагноз примерно в 15–30 лет или после 60 лет.
- Этническая принадлежность: Люди еврейского происхождения имеют более высокий риск развития язвенного колита, чем другие этнические группы.
- Генетика: Люди, чьи близкие родственники болеют язвенным колитом, имеют более высокий риск его развития.
Факторы риска болезни Крона
Медицинские работники не до конца понимают, что вызывает болезнь Крона. Тем не менее, они определили несколько факторов, которые могут увеличить риск ее развития, в том числе:
- Генетика: Люди, у которых есть родители или братья или сестры с болезнью Крона, с большей вероятностью разовьются сами.
- Лекарства: Использование определенных лекарств, в том числе нестероидных противовоспалительных препаратов (НПВП), противозачаточных средств и антибиотиков, может увеличить риск болезни Крона.
- Курение: Эта привычка может вдвое увеличить риск болезни Крона.
- Диета: Диета с высоким содержанием жиров также может увеличить риск болезни Крона.
Симптомы ВЗК могут различаться в зависимости от типа, местоположения и степени тяжести.
У людей могут быть периоды обострения симптомов (обострения) и периоды с незначительными симптомами или их отсутствие (ремиссия). Вспышки могут различаться по количеству, интенсивности и продолжительности.
Согласно CDC, следующие симптомы являются общими для обоих основных типов ВЗК:
Управление по женскому здоровью (OWH) предполагает, что ВЗК может также вызывать симптомы вне пищеварительной системы, в том числе:
- лихорадка
- боль в суставах
- кожные заболевания
OWH также предполагает, что ВЗК может усугублять последствия менструации, и что симптомы ВЗК могут также ухудшаться во время менструации.ВЗК также увеличивает риск развития железодефицитной анемии у женщин.
Медицинские работники связывают с ВЗК ряд осложнений. Некоторые из них могут быть опасными для жизни.
Согласно NIDDK, некоторые возможные осложнения болезни Крона включают:
- непроходимость кишечника
- рак толстой кишки
- свищи, которые представляют собой аномальные туннели в кишечнике
- небольшие разрывы в анусе или анальные трещины
- язвы в рот, кишечник, задний проход или промежность, которая является областью между гениталиями и анусом
- недоедание
Они также предполагают, что язвенный колит может вызвать следующие осложнения:
- ректальное кровотечение, которое может привести к железодефицитной анемии
- обезвоживание
- плохое усвоение питательных веществ
- снижение плотности костей, что может привести к остеопении или остеопорозу
Обзор 2018 года также связал ВЗК с развитием камней в почках.
Чтобы диагностировать ВЗК, медицинский работник должен изучить полную историю болезни, прежде чем запрашивать один или несколько диагностических тестов. Некоторые тесты, которые они могут использовать, включают:
- образцов кала
- анализы крови для проверки на анемию или инфекцию
- Рентген, если они подозревают серьезное осложнение
- КТ или МРТ сканирование для обнаружения свищей в тонкой кишке или анальная область
Медицинский работник также может запросить эндоскопические процедуры. Во время этого они вставят гибкий зонд с камерой, прикрепленной через задний проход.
Эти процедуры помогают выявить любые повреждения кишечника и позволяют медицинскому работнику взять небольшой образец ткани для исследования.
Некоторые типы эндоскопических процедур, которые медицинский работник может использовать для диагностики ВЗК, включают:
- Колоноскопия: Они используют ее для исследования всей толстой кишки.
- Гибкая ректороманоскопия: Это обследование помогает им проверить последний отдел толстой кишки.
- Верхняя эндоскопия: Эта процедура позволяет исследовать пищевод, желудок и первую часть тонкой кишки.
Капсульная эндоскопия — еще один вариант. Эта процедура требует, чтобы человек проглотил капсулу с камерой, что позволяет медицинскому работнику исследовать тонкий кишечник.
В настоящее время лекарства от ВЗК нет. Целью лечения будет уменьшение симптомов, достижение и поддержание ремиссии и предотвращение осложнений.
Наиболее распространенными методами лечения ВЗК являются медикаменты и хирургическое вмешательство, о которых в следующих разделах будет рассказано более подробно.
Лекарство
Врачи могут прописать определенные препараты для лечения ВЗК, начиная с более легких и заканчивая более агрессивными методами лечения. Эти лекарства могут включать:
- Противовоспалительные препараты: Лекарства с 5-АСК обычно являются первой линией защиты от симптомов ВЗК. Они уменьшают воспаление в кишечнике и могут помочь человеку достичь и поддерживать ремиссию.
- Кортикостероиды: Врач может назначить быстродействующие противовоспалительные стероиды, если более мягкий класс противовоспалительных средств не эффективен.Люди должны использовать эти препараты только в краткосрочной перспективе для лечения обострений. Длительный прием НПВП может ухудшить симптомы ВЗК.
- Иммуносупрессоры: Они работают, предотвращая атаку иммунной системой клеток кишечника, что приводит к уменьшению воспаления. Однако они могут вступить в силу примерно через 3 месяца и могут вызвать ряд побочных эффектов, таких как повышенный риск заражения.
- Биологические методы лечения: Это антитела, нацеленные на определенные вещества, вызывающие воспаление в организме.
Некоторые другие лекарства, которые могут уменьшить симптомы ВЗК, включают:
- антибиотики
- противодиарейные препараты
- слабительные
- витаминные и минеральные добавки для случаев недостаточности питания из-за ВЗК
Хирургия
В некоторых случаях операция может потребоваться для лечения ВЗК или его осложнений. Например, врач может порекомендовать операцию по расширению узкой кишки или удалению свищей.
Людям с язвенным колитом может потребоваться операция по удалению толстой и прямой кишки.Людям с болезнью Крона может потребоваться процедура по удалению определенных частей кишечника.
Некоторые факторы питания и образа жизни могут усугубить симптомы ВЗК. Однако внесение положительных изменений в эти привычки может помочь человеку справиться с симптомами, уменьшить обострения и даже сохранить ремиссию.
Диета
Некоторые диетические меры, которые могут принести пользу людям с ВЗК, включают:
- ведение дневника питания, чтобы отслеживать, появляются ли определенные симптомы после употребления определенных продуктов
- ограничение потребления молочных продуктов
- ограничение потребления высоких жирная пища
- избегание или ограничение потребления острой пищи, кофеина и алкоголя
- ограничение потребления продуктов с высоким содержанием клетчатки, особенно если кишечник сужен
- есть частые небольшие приемы пищи, а не несколько больших
- пить много вода
- принимать витаминные и минеральные добавки для предотвращения дефицита.
Стресс
Многие люди с ВЗК говорят, что они испытывают более серьезные симптомы в периоды стресса.Таким образом, умение справляться со стрессом может помочь снизить частоту и тяжесть этих типов обострений.
Некоторые методы управления стрессом включают:
- упражнения
- медитацию
- дыхательные упражнения
- прогрессивное расслабление мышц
- занятие хобби и другими приятными занятиями
Узнайте больше об управлении стрессом здесь.
Курение
Недавние исследования показали связь между курением и болезнью Крона.Курение является фактором риска развития заболевания и может усугубить симптомы.
Другое исследование показало, что курение может принести пользу людям с язвенным колитом. Однако те же исследователи также обнаружили, что риски для здоровья, связанные с курением, намного перевешивают любые преимущества.
Прочтите о пяти способах бросить курить.
Эмоциональная поддержка
ВЗК может оказывать значительное эмоциональное воздействие, особенно на людей с тяжелыми симптомами. По этой причине важно иметь сильную сеть поддержки среди семьи и друзей.
Люди с ВЗК могут также подумать о том, чтобы присоединиться к группе поддержки или посетить консультации, которые они могут найти полезными.
Healthline предоставляет приложение, которое связывает людей с IBD и помогает им получить поддержку, когда они в ней нуждаются. Узнайте больше здесь.
Профилактика
Точная причина ВЗК еще не ясна. По этой причине трудно понять, как лучше всего предотвратить это.
Генетические факторы, связанные с ВЗК, не зависят от человека. Однако человек может снизить свой риск, соблюдая здоровую диету, бросив курить и регулярно занимаясь спортом.
Хотя в настоящее время не существует лекарства от ВЗК, можно управлять этим состоянием с помощью медицинского вмешательства и изменения образа жизни.
По данным Crohn’s & Colitis Foundation, при эффективном лечении около 50% людей с болезнью Крона будут в стадии ремиссии или будут иметь лишь легкие симптомы в течение следующих 5 лет.
Кроме того, около 45% людей в ремиссии не испытают рецидива в следующем году.
В любой конкретный год 48% людей с язвенным колитом находятся в стадии ремиссии, а у 30% наблюдаются легкие симптомы.Чем дольше кто-то остается в ремиссии, тем меньше вероятность, что у него случится обострение в течение следующего года.
Смерть от ВЗК или его осложнений бывает редко. У людей с болезнью Крона общий уровень смертности лишь немного выше, чем у людей без нее. У пациентов с язвенным колитом легкой или средней степени смертности не выше, чем у пациентов без ВЗК.
Если человек испытывает стойкие изменения в привычке кишечника или имеет какие-либо другие симптомы ВЗК, ему следует проконсультироваться со своим врачом.
SIU SOM Гистология INTRO
SIU SOM Гистология INTROОБЗОР
Воспалительная реакция хорошо знакома. ПОПРОБУЙТЕ СЕБЯ — A мягкий пример может быть произведен по вашему усмотрению. Тщательно очистите кожа на предплечье, а затем наблюдайте покраснение (возможно, небольшой отек) и тепло) развивается в течение следующих нескольких минут.
Воспаление характеризуется несколькими знакомыми признаками, покраснение , припухлость , жар и боль .Чтобы понять воспаление это понять, как и почему развиваются эти признаки.
Эти знаки представляют собой реакцию, запрограммированную в вашей ткани. Этот реакция — одна из основных защитных реакций вашего тела, предназначенная для того, чтобы предвидеть, перехватить и уничтожить вторгшиеся микроорганизмы. Воспаление лучше всего ценится пониманием функционирования вашего тела на уровне клеток и ткани. Последующие процессы восстановления (заживления) тканей включают: рост и деление клеток, перемещение и дифференциация клеток, а также производство внеклеточного материала.
Мы идем по жизни, отделенные от окружающей нас клеточная граница. Эта граница — включая эпидермис нашей кожи и эпителия различных слизистых оболочек — покрывает все поверхности нашего тела, даже внутренние поверхности легких, кишечника и протоков желез. Ничего не входит или покидает тело, кроме как проходя через клетки, которые образуют эту эпителиальную границу.
Когда эта эпителиальная граница сломан, как это часто бывает из-за царапин, порезов и укусов насекомых, два неудачных все может случиться. Могут вытекать такие хорошие вещи, как кровь. И плохо могут проникнуть такие вещества, как микробы (микроорганизмы). Устранение утечки может быть довольно простым, с быстрым пластырем (тромбом), предотвращающим значительная потеря телесной субстанции. Но быстрого патча недостаточно чтобы предотвратить серьезное заражение.Поскольку микробы живы, они могут расти и размножаться. Так что даже несколько микробов вторгаются в ваше тело в момент травмы, если его не беспокоить, может быстро преобразоваться ваша теплая, влажная, хорошо насыщенные кислородом ткани в процветающую бактериальную культуру. Воспаление помогает избежать этого результата.
К сожалению, воспаление доставляет дискомфорт. И воспаление может иногда могут быть вызваны ненадлежащим образом (например, из-за аллергии или аутоиммунных заболеваний).Многие распространенные медицинские методы лечения (например, аспирин и другие противовоспалительные агентов «) предназначены для облегчения дискомфорта и / или уменьшения количества обслуживающего персонала. нарушение тканей, которое может вызвать воспаление.
Любая ткань или орган могут воспалиться. Воспаление определенного часть тела названа в соответствии с сайтом, с добавлением суффикса «- itis » (например, тонзиллит, аппендицит, дерматит, артрит, синусит и т. д.). Таким образом, названия болезней на самом деле просто слова, определяющие сайты. воспаления. (Примеры)
Ремонт тканей . Следующий воспаление, поврежденная ткань обычно замещается новыми клетками и внеклеточными материалы, с неповрежденными окружающими клетками, размножающимися и мигрирующими чтобы заполнить пустоту. Хотя некоторые ткани, особенно поверхностный эпителий, может расти достаточно эффективно, сложная организация редко подбирается на обновленном сайте.Пробелы быстро заполняются коллагеном волокна, продуцируемые пролиферирующими фибробластами. Масса коллагена, заменяющая ткань который был разрушен, известен как шрам . Шрамы на коже кажутся белыми, потому что коллаген бесцветен, и заживление часто вызывает более компактное расположение коллагена с меньшим количеством капилляров, чем окружающие ткань. Рубцы в других органах также существуют в виде плотных масс коллагена. в которых нормальная функция органа невозможна.Например, цирроз печени представляет собой обширную замену коллагеном поврежденного клетки печени.
TOP СТРАНИЦЫ
КАРДИНАЛЬНЫЕ ПРИЗНАКИ ВОСПАЛЕНИЯ
Четыре основных признака воспаления — четыре «ОР» — являются:
НАЧАЛО СТРАНИЦЫОткуда эти знаки? Что происходит с вашим телом во время воспаление? Как вы понимаете воспаление, вы должны уметь ответьте на следующие конкретные вопросы.
- Почему ткани вокруг места травмы становятся красными и теплыми?
- Почему опухает воспаленная ткань?
- Что такое гной и как он образуется?
- Как происходит исцеление?
НАЧАЛО СТРАНИЦЫФИЗИОЛОГИЯ ВОСПАЛЕНИЯ
Четыре основных признака воспаления легко обнаруживаются. объясняется поведением нижележащих клеток и тканей.Воспалительный реакция состоит из нескольких физиологических процессов (иллюстрация из WebPath), все они вызваны высвобождением фармакологически активных веществ такие как гистамин и гепарин . Эти триггеры острого воспаление выделяют тучных клеток , чувствительные клетки, которые разбросаны по обычным соединительным тканям и которые реагируют на повреждение ткани или другое нарушение.
Хроническое воспаление поддерживается более сложными взаимодействия между несколькими типами клеток; диаграмма из WebPath.
Основные компоненты воспалительной реакции:
См. Иллюстрацию из WebPath.
Расширение сосудов ( усиление перфузии сосудов ).
- Расслабление гладкой мускулатуры который окружает терминальные артериолы приводит к усилению кровотока в капиллярном ложе соединительной ткани.
- Повышенная перфузия тканей, в свою очередь, вызывает покраснение ( руб. ), по мере прохождения через ткани большего количества эритроцитов и тепла ( кал, ), поскольку кровь переносит тепло тела от ядра тела к более холодным периферическим тканям.
Повышенная проницаемость сосудов .
- Эндотелиальная выстилка капилляров ( эндо = внутри; эндотелий слой тонких плоских клеток, выстилающих кровь сосуды) становится более проницаемым, позволяя выделять больше жидкости (плазмы крови) в соединительнотканные пространства.
- Обычно существует баланс между жидкостью, покидающей сосудистые пространства, и жидкость снова попадает в систему. Воспаление сдвигает этот баланс, вызывая скопление межклеточной жидкости.
- Накопление жидкости, которое следует за этим изменением проницаемости, называется отек и видна как отечность или припухлость ( опухоль ).
Обратите внимание, что отек может принимать самые разные формы.Следующие ссылки приведут вас к валовой изображения в WebPath.
Эмиграция лейкоцитов .
- Расширение сосудов и увеличение сосудов перфузия предназначена для подготовки пути воспалительного инфильтрат проникнет в воспаленные ткани.
- Сочетание расширения сосудов с утолщением крови (из-за жидкости утечка из сосудов) вызывает замедление скорости потока, что способствует лейкоциты (лейкоциты; лейко = белый, цит = ячейка), чтобы приклеить к стенкам сосудов.Это называется «маргинальность». или «тротуар» (лейкоциты собираются вдоль эндотелия, как кирпичи мостят дорогу). (Пример из WebPath.)
- Отсюда лейкоциты расползаются между эндотелиальными клетки и попадают в воспаленную соединительную ткань. Повышенный метаболизм активность, связанная с активностью лейкоцитов, также выделяет тепло ( кал, ), способствуя местному теплу.
Боль и / или зуд ( dolor ) вызвано прямым действием на нервные окончания химических агентов, выделяемых во время воспаление.
ВОСПАЛИТЕЛЬНЫЙ ИНФИЛЬТРАТ (Введение к воспалению)
воспалительный или лейкоцитарный инфильтрат состоит из лейкоцитов, которые выходят из крови и проникают (инфильтрируют) в воспаленную соединительную ткань ткань
Клетки воспалительного инфильтрата включают нейтрофилы, лимфоциты и моноциты. Иммиграция этих клеток в периферические ткани является одной из основных целей воспаление, приносящее к месту травмы клетки иммунной системы, которые могут бороться с инфекцией и очищать поврежденные ткани.
нейтрофилов (нейтрофильные лейкоциты) — первые лейкоциты, попадающие в ткань во время острого воспаления. Нейтрофилы — это антибактериальные клетки, которые лизировать (разрушать) бактериальные клетки, высвобождая лизосомальные ферменты. Нейтрофилов распознают бактерии как чужеродные по молекулам антител, которые прикрепились к бактериальной поверхности. Молекулы антител (молекулы, которые связываются с один специфический антиген или инородное вещество, с которым организм ранее сталкивался) обнаруживаются в плазме крови и межклеточной жидкости.
Нейтрофилы — самые многочисленные лейкоциты, около 60% лейкоцитов. Их диаметр около 12 м. в препаратах мазков крови (примерно в два раза больше красных кровяных телец), и являются полиморфно-ядерными (это означает, что их ядра имеют переменную форму с несколькими долями; нейтрофилы также называют PMNs или polys , сокращенно от полиморфноядерных нейтрофильных лейкоцитов).Цитоплазма содержит много лизосомальных гранул (везикулы, содержащие накопленные лизосомальные ферменты) чьи специфические свойства окрашивания дали этим клеткам свое название. В гранулы нейтрофильны, что означает, что они не проявляют особого сродства к либо кислотные, либо щелочные пятна, но они слабо окрашиваются обоими. Этот в отличие от специфических гранул эозинофилов, которые окрашивают в красный цвет с эозином и базофилами, окрашивающими основные пятна.Сильное воспаление может увеличить количество нейтрофилов в крови, что приведет к нейтрофилии (кровь размазывать изображение из WebPath). Для просмотра электронной микрофотографии см. WebPath.
Нейтрофилы лишь изредка обнаруживаются в срезах тканей вне крови (кроме, конечно, воспаленной ткани). Здесь они могут легче всего распознать по их лопастным ядрам. Одно ядро нейтрофила может быть ошибочно принят за скопление очень маленьких ядер, но каждая из долей намного меньше любого целого ядра — всего два-три метра в поперечнике, намного меньше, чем ядра лимфоцитов, которые являются одними из самых маленьких клеток.
[Подробнее о клетках крови.]
Лимфоциты накапливаются несколько позже во время воспалительный процесс. Их наличие в большом количестве указывает на продолжающееся присутствие антигена и, таким образом, может указывать на установленную инфекцию. Лимфоциты производят множество различных молекул антител (одна специфический тип антител на лимфоцит), которые обеспечивают механизм химическое распознавание посторонних материалов (различение между собой и несамостоятельное), а также для опосредования и регулирования иммунных реакций.
Лимфоциты перемещаются в крови, но обычно уходят капилляры и блуждают по соединительной ткани. Следовательно, лимфоциты обычно можно встретить в любое время в любом месте. Они даже проникают в эпителиальную ткань, ползая между эпителиальными клетками. Oни повторно входят в кровообращение через каналы лимфатической системы (отсюда и их название). Лимфа каналы стекают в лимфатические узлы, где плотные скопления лимфоцитов образуют лимфатических узлов .Каждый лимфатический узелок имеет зародышевый центр », где пролиферируют активированные лимфоциты. Лимфатические узелки с пролиферирующими лимфоцитами также характерны миндалины и аппендикс и может встречаться и на других сайтах.
[Последние исследования показывают, что некоторые типы лимфоцитов разделены на части. к определенным тканям или участкам тела.]
Лимфоциты — это маленькие клетки, в крови диаметром 7-9 м. мазки и являются вторым по распространенности типом лейкоцитов (около 30% лейкоцитов).Имеют круглую гетерохроматичную (глубоко окрашивающуюся) ядро окружено относительно тонким ободком цитоплазмы. Лимфоциты легче всего распознаются на гистологических срезах как маленькие «голые» ядра (цитоплазма обычно незаметна), которые встречаются кое-где в большинстве ткани и особенно часто возле слизистых оболочек. Лимфоциты обнаруживаются плотно упакованными в лимфоидной ткани — селезенке и лимфатических узлах. Чтобы просмотреть электронную микрофотографию, см. WebPath.
Клетки плазмы — лимфоциты которые специализируются на массовом производстве и секреции циркулирующих антител. Плазматические клетки имеют более обширную цитоплазму, заполненную шероховатой эндоплазматической ретикулум (для синтеза белка, в частности молекул антител). Этот цитоплазма явно базофильная, что является следствием большого количества рибосомы, связанные с rER, и обычно образуют однобокую выпуклость на одной стороне ядра.Гетерохроматин плазматических клеток — это обычно образуют характерную «спицевидную» систему, которая также способствует распознаванию плазматических клеток. Для просмотра электронной микрофотографии см. WebPath.
[Подробнее о клетках крови.]
Моноциты — это циркулирующие фагоциты. в крови. Эквивалентный тип клеток, называемый макрофагом , резидентная клетка в соединительной ткани.
Моноциты / макрофаги поглощают и переваривают чужеродные микроорганизмы, мертвые или изношенные клетки и другие тканевые остатки. Они тесно взаимодействуют с лимфоциты для распознавания и уничтожения посторонних веществ.
Резидентные макрофаги обычно остаются в покое (а не циркулирует в тканях и из них, например лимфоцитах). Но нормальный количество фиксированных макрофагов дополняется при воспалении притоком из многих моноцитов из крови.Когда сталкиваешься с слишком большой целью для одной клетки, например, осколка, несколько макрофагов могут сливаться вместе для одной огромной многоядерной массы, называемой «гигантской клеткой инородного тела».
Моноциты являются самыми крупными из лейкоцитов и составляют около 5% популяции лейкоцитов. Их ядра обычно в мазках крови с выемками, бобовидной формы. Тканевые макрофаги разнообразны по внешнему виду и их нелегко отличить от более распространенных фибробласты.Макрофаги, как правило, крупнее и могут содержать коричневый цвет. гранулы пигмента, которые представляют собой неперевариваемый остаток в третичных лизосомах. На электронных микрофотографиях макрофаги обычно распознаются по наличие множества лизосом разного размера, включая крупные гетерофаги везикулы.
[Подробнее о клетках крови.]
Подробнее об иммунной системе, включая внешних ссылок , см. CRR Лимфатическая система.
НАЧАЛО СТРАНИЦЫ
ПРИМЕРЫ воспаления
Микроскопически воспаление проявляется в увеличении количества лейкоцитов (то есть воспалительного инфильтрата, который результат эмиграции лейкоцитов).
Изображений воспалительного инфильтрата в коже.
WebPath сайт предлагает ряд наглядных примеров воспаления, в том числе:
Также см. Образцы по адресу Virtual Слайд-бокс гистопатологии , отделение патологии Университета Айовы.
Обратите внимание, что изучение образцов воспаленных тканей, таких как перечисленные выше, требует некоторого предварительного знакомства с нормальными гистологическими внешний вид.
Подробнее об иммунной системе см. снаружи. ссылки и CRR Лимфатическая система.
НАЧАЛО СТРАНИЦЫ
Комментарии и вопросы: [email protected]
SIUC / Школа of Medicine / Anatomy / David Король
http: // www.siumed.edu/~dking2/intro/inflam.htm
Последнее обновление: 1 января 2013 г. / dgk
Оценка противовоспалительного эффекта местного введения витамина С при лечении стойкого воспаления десен: клиническое и гистопатологическое исследование
Цель . Целью этого исследования является изучение роли и эффективности местного введения витамина С в лечении стойкого воспаления десен. Проект . В это исследование были включены двадцать взрослых пациентов со стойким хроническим воспалением десен.Такая же доза стерильного витамина С была введена в ткани десны после завершения терапии фазы I. Биопсия десны была взята после полного исчезновения воспаления. Образцы исследовали гистологически с использованием окрашивания H&E. Результат . Клиническая оценка показала значительное улучшение мест инъекций при повторных посещениях. Гистопатологические результаты показали заметное уменьшение воспалительных клеток и толщины эпителия, а также большее количество новообразованных суббазальных капилляров. Выводы . Витамин С является эффективным дополнительным средством для уменьшения хронического воспаления десен различной степени.
1. Введение
Гингивит, вызванный зубным налетом, является наиболее распространенным заболеванием полости рта, поражающим ткани десен [1]. Зараженная биопленка зубного налета и нарушение реакции организма хозяина остаются основными причинами широкого спектра заболеваний десен. Способность пациента придерживаться правильного плана ухода за полостью рта также является критическим фактором, контролирующим реакцию тканей и прогрессирование заболевания [2].
Клинические проявления воспаления десен различаются в зависимости от степени тяжести, распределения и реакции на лечение, варьируясь от локализации до высокой степени реагирования на лечение по отношению к давно существующим поражениям со стойким покраснением и массивным кровотечением при зондировании с различной степенью отека [3] . Эффективность лечения и последующий тканевой ответ зависят от этиологии и идиопатической, местной или системной причины [2].
В здоровых условиях нейтрофилы проходят из соединительной ткани десны через соединительный эпителий в десневую борозду, обеспечивая динамический баланс между непрерывным вторжением микроорганизмов и иммунным ответом [4].
Антиоксиданты, ферментативные или неферментативные, играют решающую роль в тканевом равновесии, нейтрализуя такие вредные агенты (АФК) [5, 6].
При определенных воспалительных состояниях общее количество антиоксидантов снижается до минимального уровня, что требует их дополнения из внешнего источника [7, 8].
Одним из важнейших антиоксидантов является витамин C (vit-C), который играет важную роль в различных функциях организма [7, 8]. Несмотря на умеренную кислотность (pH 4.2), ему необходима щелочная среда для выполнения своей функции восстановителя [9]. Чтобы активироваться, многие изменения в его структуре происходят в трех последовательных циклах окисления (рис. 1).
Витамин С, являясь сильным восстанавливающим агентом, может регулировать разрешение воспалительного процесса и стимулировать восстановление тканей. Он модулирует высвобождение катаболических воспалительных цитокинов [10–12], хемотаксис иммунных клеток и активацию фагоцитоза [4]. Нейтрофилы и лимфоциты, содержащие витамин С, демонстрируют более низкий потенциал апоптоза и более высокую скорость пролиферации.Это также увеличивает выработку антител [4].
Более того, он усиливает синтез коллагена I типа, сниженный воспалительным процессом, поддерживает баланс между коллагеном I и коллагеном III и изменяет скорость пролиферации фибробластов. Он также снижает вероятность образования рубцов за счет ингибирования сшивания коллагеновых волокон и фиброза. Витамин С также необходим для образования новых кровеносных сосудов (ангиогенеза). Он действует как кофактор в синтезе гидроксипролина для выработки коллагена IV типа и улучшает жизнеспособность и функцию эндотелиальных клеток [10–13].
Целью настоящего исследования является изучение точной роли и эффективности местного введения витамина С в лечении стойкого воспаления десен после однократного или многократного приема на основе клинических и гистопатологических исследований.
2. Методология
2.1. Этические аспекты
Перед участием каждый пациент подписал подробное информированное согласие с объяснением преимуществ, этапов и побочных эффектов протокола лечения.
2.2. Дизайн исследования
Исследование было спланировано как одностороннее, неслепое и нерандомизированное, поскольку оно не зависело от отбора пациентов, а скорее основывалось на обнаружении хронического стойкого явления. Были включены только пациенты со стойким воспалением.
2.3. Процедуры скрининга
Пациенты были набраны среди тех, у кого был диагностирован гингивит, вызванный бляшками, в пародонтологической клинике последипломного образования Каирского университета в период с 2013 по 2016 год.Первоначальная оценка, включая медицинский и стоматологический анамнез, клиническое обследование и рентгенологическое обследование, была проведена NMY и ARA для определения права пациента на участие в исследовании. Были обследованы пятьдесят пациентов, которые соответствовали следующим критериям включения: (1) в возрасте от 20 до 50 лет, (2) не имели медицинского статуса и (3) гингивит, вызванный генерализованным бляшками. Были исключены все причины, которые могли спровоцировать воспалительную реакцию: (1) системные заболевания, (2) беременные и кормящие матери, (3) лечение антибиотиками в течение 1 месяца до исследования и (4) местные причины (курение, ротовая полость). дыхание, местная травма и пародонтит) (рис. 2).
2.4. Подготовка пациента
Каждому пациенту был проведен сеанс наддесневой обработки всего рта с использованием ультразвуковых и ручных инструментов, а также предоставлены индивидуальные инструкции по гигиене полости рта. Кроме того, дважды в день рекомендовалось полоскание рта хлоргексидином 0,12%. Все пациенты были назначены на 2-недельные приемы для повторного обслуживания. Около двадцати пациентов достигли минимального остаточного воспаления (> 15% баллов бляшек и кровотечений по системе оценок О’Лири) и оптимального состояния мягких тканей в течение двух недель.Комбинированная терапия антибиотиками (амоксициллин 500 мг и метронидазол 500 мг / 3 раза в день в течение 7 дней) была назначена для того, чтобы контролировать степень заболевания. Через 7 дней после курса антибиотиков была проведена переоценка остальных 30 пациентов. По окончании поддерживающего периода (4 недели) в исследование были включены только рефрактерные пациенты. В исследование были включены 20 пациентов, страдающих стойким воспалением десен в эстетической передней области (рис. 2).
2,5. Процедура
Все процедуры инъекции выполнял один и тот же исследователь (NMY). Интересующий участок анестезировали лидокаином-адреналином 1: 100 000. Внутриэпидермальная инъекция (подход мезотерапии) 1–1,5 мл (концентрация 200–300 мг) L-аскорбиновой кислоты была местно введена по отношению к ороговевшим тканям десны с преимущественным распространением на всю целевую область, соответственно, с помощью инсулиновых шприцев. Рекомендуемая дозировка эквивалентна области между двумя клыками.Текущая доза эквивалентна обработанной области (расстояние простирается между шестью передними частями верхней челюсти) [14]. При первом посещении инъекции рекомендуется использовать только половину допустимой дозы. Та же доза повторялась один раз в неделю до исчезновения воспаления.
2.6. Послеоперационные инструкции
В конце каждого сеанса пациентам прописывали спасательный анальгетик (ибупрофен 200 мг), который использовался по мере необходимости. Пациентов просили воздерживаться от механических процедур гигиены полости рта по отношению к целевой области только на день процедуры.
2.7. Клинические параметры
Непосредственно перед процедурой инъекции теми же исследователями (NMY и ARA) были выполнены следующие клинические измерения: оценка налета и кровотечения с использованием системы оценки О’Лири [15] и оценка местного кровотечения с использованием индекса кровотечения Sulcus (SBI) [ 16] как более конкретный показатель: Оценка 0: здоровый вид и отсутствие кровотечения при зондировании Оценка 1: здоровый вид и кровотечение при зондировании Оценка 2: кровотечение при зондировании, изменение цвета и отсутствие отека Оценка 3: кровотечение при зондировании, изменение цвет и небольшой отек Оценка 4: кровотечение при зондировании, изменение цвета и явный отек Оценка 5: спонтанное кровотечение, изменение цвета и выраженный отек Последний показатель оценивал цвет, припухлость и склонность к кровотечениям.По завершении визитов для инъекций те же показатели использовались для выявления изменений. Цифровые фотографии были сделаны до операции и через 2 недели после операции. Удовлетворенность пациентов оценивалась с помощью 5-ступенчатого анализа самооценки: отлично (4), улучшилось более чем на 75%; хорошо (3), улучшилось на 50–75%; умеренный (2), улучшение на 25–50%; удовлетворительно (1), улучшилось менее чем на 25%; без изменений или хуже (0), без улучшения и затемнения [17].
2,8. Гистопатологическое исследование
Предоперационная и послеоперационная (через 1 неделю после последней инъекции) биопсию десны вырезали, немедленно фиксировали в 10% нейтральном забуференном формалине и затем обрабатывали обычным способом для получения парафинового блока.Срезы тканей были вырезаны и окрашены гематоксилином и эозином (H&E) для гистопатологического исследования. Наконец, эпидермальные и дермальные изменения до и после нанесения аскорбиновой кислоты оценивали с помощью программного обеспечения компьютерного анализатора изображений Leica QWin 515 system (Англия).
3. Результаты
3.1. Популяция исследования
В исследование были включены 20 пациентов. Экспериментальный период длился с сентября 2013 г. по апрель 2016 г. (последнее контрольное посещение). Было включено 20 участков локализованного хронического воспаления десен без какой-либо определенной причины в диапазоне от маргинального гингивита до диффузного гингивита.Ни один из пациентов не был исключен из исследования.
3.2. Клинические показатели
Возраст включенных пациентов колебался от 20 до 50 лет. Большинство вовлеченных пациентов составляли женщины (90%). Об улучшении сообщалось во всех случаях после максимум 2 инъекций, за исключением 2 случаев, когда потребовалась еще одна инъекция. Измерение SBI проводилось после терапии фазы I и после завершения лечения. Все пролеченные пациенты положительно отзываются о применяемом лечении. До операции было отмечено, что 12 (60%) из 20 пациентов набрали 3 балла, а 8 пациентов (40%) получили 4 балла по индексу SBI.После операции диапазон изменился до 20 пациентов (100%) с нулевой оценкой с различной степенью ответа на примененное лечение. Семь пациентов (35%) из двадцати леченных пациентов были полностью свободны от воспаления с нулевым баллом SBI после 1 посещения инъекции. Одиннадцать (55%) пациентов показали такие же результаты после 2 посещений инъекций. Только 2 пациентам (10%) из двадцати потребовались дополнительные инъекции для достижения нулевой оценки. Все включенные пациенты выразили большое удовлетворение результатами лечения, даже пациенты, которые не прошли полное лечение.Все пациенты (100%) показали большое удовлетворение результатами (4 балла) (рисунки 3 и 4).
3.3. Микроскопическое исследование участков, окрашенных H&E
3.3.1. Предоперационное микроскопическое исследование
На всем срезе ткани выявлен тяжелый хронический воспалительный процесс. Поверхностный эпителий паракератинизированного многослойного плоскоклеточного типа был гиперпластическим с широкими и удлиненными ретенштифтами, образующими многочисленные эпителиальные аркады. Наблюдались явный внутриклеточный отек и внеклеточный отек эпителиальных клеток, нарушающий межклеточные десмосомные соединения.В некоторых местах базальные клетки были переполнены. Наблюдался интенсивный инфильтрат острых и хронических воспалительных клеток, рассредоточенный по всей толщине соединительной ткани вместе с крупными кровеносными капиллярами (Таблица 1). Базальная мембрана в некоторых местах была замаскирована воспалительными клетками (рис. 5).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
.3.2. Послеоперационное микроскопическое исследование
После 1 недели однократной инъекции . При микроскопическом исследовании выявлено более слабое воспаление. В отличие от предоперационных срезов, был обнаружен менее гиперпластичный поверхностный эпителий с более короткими и более узкими ретиншетами. Внутриклеточный отек и внеклеточный отек уменьшились с почти неповрежденными десмосомными соединениями. Также было обнаружено несколько эпителиальных аркад. Базальные клетки стали более регулярными и хорошо выровненными. На некоторых участках были обнаружены легкие признаки воспаления.Соединительная ткань состояла из пролиферирующих фибробластов, образования коллагеновых волокон и нескольких агрегатов хронических воспалительных клеток. Характерными явлениями были наличие вакуолизированных эпителиальных клеток, особенно в базальном клеточном слое (в месте инъекции), и появление мелких капилляров в субэпителиальных областях КТ (рис. 5).
После 1 недели двойных инъекций . Осмотр послеоперационных срезов показал значительное улучшение. Обнаружен выраженный хорошо выраженный паракератинизированный слой.Гиперплазия эпителия исчезла при сохранении межклеточных десмосомных соединений. Явное уменьшение толщины эпителия было обнаружено с минимальными эпителиальными сетчатыми штифтами и эпителиальными аркадами. Была обнаружена более высокая частота вакуолизированных клеток, чем в двух инъекционных секциях. Отчетливо видна базальная мембрана. В соединительной ткани были обнаружены хорошо сформированные пучки коллагеновых волокон с многочисленными и широко расположенными кровеносными сосудами. Ясно был обнаружен тот же феномен субэпителиальных мелких капилляров.Было обнаружено меньше хронических воспалительных клеток, но они ограничены глубокими соединительными тканями (рис. 5).
4. Обсуждение
Из-за разнообразия заболеваний десен, план лечения должен варьироваться в зависимости от связанных причинных факторов. Однако одной из неприятных проблем является наличие хронических или резистентных воспалительных состояний без определенного этиопатогенеза. Такие условия сохраняются даже после устранения всех очевидных причин и соблюдения правил гигиены полости рта.Обычно они характеризуются стойким покраснением и кровотечением при зондировании с различной степенью отека тканей, который может быть локализованным или диффузным [2].
В этих случаях общепринятыми и обычно используемыми протоколами были массивный курс антибиотиков или схемы кортикостероидов с последующим хирургическим вмешательством, если необходимо. Несмотря на невероятные результаты, сопровождающие кортикостероиды, их обычно избегают из-за их побочных эффектов.
Следовательно, существует потребность в других безопасных нехирургических терапевтических средствах для контроля таких состояний или, по крайней мере, для улучшения заживления тканей и уменьшения воспалительных проявлений до хирургического удаления оставшихся псевдокарманов.Кожные мезотерапевтические методы с использованием антиоксидантов, таких как витамин С, показали многообещающие результаты в лечении подобных локализованных воспалительных состояний [18].
Целью настоящего исследования является регулирование чрезмерной реакции воспалительного процесса, ускорение заживления, увеличение содержания коллагена в пораженных тканях и улучшение кровообращения в деснах.
В текущем исследовании были включены двадцать пациентов, которые оценивались на исходном уровне (через 4 недели после терапии фазы I) и после операции во время повторного посещения (через 1 неделю после последней внутриэпидермальной инъекции витамина С).Длительный период наблюдения, предшествующий терапии, был важен для обеспечения устойчивости воспаления десен к традиционной терапии.
Во время воспаления было обнаружено, что уровень тканевых антиоксидантов (витамин С, витамин Е и т. Д.) Быстро снижается, что указывает на необходимость его приема. С другой стороны, в очаге воспаления увеличивается продукция свободных радикалов [19, 20]. Необходимы дополнительные дозы антиоксидантов, особенно витамина С. При локализованных воспалительных заболеваниях введение необходимых более высоких доз (более 500 мг) не может всасываться в желудочно-кишечном тракте и легко выводится с мочой.Более того, чтобы достичь этой дозы в очаге воспаления, необходимо введение очень высоких системных доз, которые могут быть вредными для пациента. Местная инъекция эффективно обеспечивает необходимую дозу [21].
Среди египтян заболеваемость дефицитом витамина С почти игнорируется из-за того, что он присутствует во многих фруктах и овощах. Из-за ухудшения финансового положения наших пациентов и отсутствия дефицитных условий, используемый метод намного дешевле, чем предоставление долгосрочного специального протокола питания или пероральных добавок для улучшения их состояния здоровья.
Местная инъекция vit-C была предпочтительнее, чем использование местного геля витамина C или средства для ухода за зубами, которые ранее использовали Daniels and Jefferies [22] и Shimabukuro et al. [23]. Витамин С — водорастворимый агент, обладающий поверхностным проникающим действием. Во многих исследованиях использовались различные формы жирорастворимого витамина С для местного применения, чтобы преодолеть его ограниченное всасывание. Эти исследования встретили несколько ограничений, таких как очень длительное время улучшения (12 недель), легкое удаление из тканей полости рта, ограниченное всасывание, нестабильность при воздействии растворов, воздуха, тепла или света и локальные эрозии эмали [9, 24, 25 ].
Витамин С вводили на субэпителиальном уровне. Была произведена общая численная оценка воспаления десен (с использованием SBI), в результате чего было получено среднее значение для каждого пациента. Этот анализ показывает 100% снижение воспаления десен по сравнению со средним исходным значением в течение 7–21 дней. Сообщенный процент указывает на значительное уменьшение воспаления десен. Внутриэпидермальная инъекция витамина С может быть однократной, двукратной или тройной с интервалом в одну неделю в зависимости от тяжести состояния.Очень важно более осторожно обращаться с воспаленными тканями во время первого посещения, чтобы избежать разрывов или некроза, особенно в тонких тканях биотипа. Улучшение цвета и формы тканей отчетливо наблюдалось при повторных посещениях через 2 месяца.
После того, как воспаление стихло, репрезентативные биопсии тканей были получены через 7 дней после последней инъекции у пациентов, которым была назначена гингивопластика или гингивэктомия. Клинически значимое уменьшение псевдодесневого увеличения было связано с возвращением базальных кератиноцитов к их нормальному пролиферативному паттерну, что является основной ролью витамина С [26, 27].Противовоспалительное действие vit-C также было очевидным и было обнаружено в наших образцах как уменьшение интраэпителиального отека и воспалительных клеток.
Другие характерные изменения, которые произошли после введения vit-C, были в соответствии с Nusgens et al. [28]. Было четко обнаружено повышенное количество фибробластов, образующих больше коллагеновых волокон, которые показали большее созревание и образование пучков после второй инъекции. Также были обнаружены многочисленные новообразованные мелкие кровеносные капилляры.Эти особенности согласуются с его известной важной ролью в образовании новой соединительной ткани в заживающей ране. Это связано с тем, что он действует как кофактор для ферментов, критически важных для образования коллагена, основного компонента соединительной ткани, которая формирует каркас, вокруг которого восстанавливается новая ткань. Коллаген также является важным компонентом стенки кровеносных сосудов. Поэтому, несмотря на увеличение количества кровеносных сосудов, покраснение и склонность к кровотечениям клинически заметно уменьшились.Эти сосуды обеспечивают больше питательных веществ и кислорода для хронически раздраженных и постоянно поврежденных участков слизистой оболочки, улучшая их заживление.
Наши результаты соответствуют Boyce et al. Они обнаружили, что витамин С способствует развитию структуры базальной мембраны, а также восстанавливает эпидермальный барьер в течение 2-3 недель. Кроме того, он способствует закрытию раны и снижает ее сокращение, что снижает вероятность образования паники [27].
Гистологически во всех группах наблюдалась характерная клеточная вакуолизация.В предоперационных препаратах вакуолизированные клетки выглядели как светлые клетки с маленьким пикнотическим темным ядром, представляющим признаки дегенерации. Они были обнаружены в кластерах, широко распределенных по всем слоям эпителия. Напротив, вакуолизированные клетки, связанные с vit-C, были индивидуально распределены вдоль эпителиальных слоев с наибольшей агрегацией в базальных клетках. Ядра были округлой или почковидной формы с почти нормальными пятнами. Подобная вакуолизация была обнаружена в немедленной и 15-минутной биопсии, удаленной после внутрикожной инъекции местной анестезии, описанной Kimura et al.[29]. Они объяснили это явление самой процедурой инъекции, а не использованным раствором, пространственно с наличием вакуолизации в биоптатах. Однако присутствие этих клеток в биопсиях через неделю может быть связано со способностью витамина С повышать устойчивость клеток к гибели. Кроме того, базальная локализация вакуолизированных клеток рядом с инъекцией может указывать на правильную инфузию vit-C.
Все эти положительные клинические изменения были встречены дальнейшим сотрудничеством пациентов и привели к их удовлетворению в конце лечения.
Эти данные свидетельствуют о значительном улучшении здоровья десен при использовании антиоксидантного подхода. Наконец, мы рекомендуем использовать внутриэпидермальную инъекцию витамина С в качестве дополнительного подхода к традиционному нехирургическому лечению. Рекомендуются дальнейшие исследования с долгосрочным наблюдением.
Раскрытие информации
Авторы несут полную ответственность за содержание данной статьи.
Конкурирующие интересы
Ни у одного из авторов нет конкурирующих интересов в отношении этой статьи.
Выражение признательности
Выражаем особую благодарность сотрудникам отделения пародонтологии Каирского университета за полезную помощь.
Роль воспалительных и противовоспалительных цитокинов в патогенезе остеоартрита
Остеоартрит (ОА) является наиболее распространенным хроническим заболеванием суставов человека. В основе патологических изменений лежат все ткани, образующие сустав; уже на ранней стадии имеет характер воспаления разной степени тяжести.Анализ сложных взаимоотношений показывает, что процессы, происходящие внутри сустава, — это не просто набор, который (по-видимому) включает только катаболические эффекты. Кроме них постоянно происходят противовоспалительные анаболические процессы. Эти явления вызываются различными медиаторами, ключевую роль в которых играют взаимодействия внутри сети цитокинов. Наиболее важной группой, контролирующей заболевание, являются воспалительные цитокины, включая IL-1 β , TNF α , IL-6, IL-15, IL-17 и IL-18.Вторую группу с антагонистическим действием составляют цитокины, известные как противовоспалительные цитокины, такие как IL-4, IL-10 и IL-13. Роль воспалительных и противовоспалительных цитокинов в патогенезе ОА в отношении меж- и внутриклеточных сигнальных путей все еще изучается. Эта статья резюмирует текущее состояние знаний. Сеть цитокинов при ОА рассматривается в контексте клеток, вовлеченных в это дегенеративное заболевание суставов. Также указаны возможности для дальнейшей реализации новых терапевтических стратегий при ОА.
1. Введение
Наиболее частым хроническим и в настоящее время рассматриваемым как потенциально необратимым заболеванием, поражающим суставы, является остеоартрит (ОА) [1, 2]. Постоянно растущее число причин развития болезни включает, например, генетическую предрасположенность, старение, ожирение, травмы и другие системные заболевания (рис. 1). Хотя мы имеем дело с разнообразной этиологией, которая чаще всего является результатом ряда перекрывающихся факторов, процессы происходят во время развития патомеханизмов заболевания на тканевом, клеточном и ультраструктурном уровнях, которые постепенно принимают схожую природу, в результате чего фенотипический образ ОА.Согласно последним медицинским знаниям, участие иммунной системы в развитии и прогрессировании ОА является одним из ключевых элементов патогенеза заболевания [3]. В настоящее время многие независимые авторы сосредоточены на выявлении и описании факторов, ответственных за развитие воспалительных процессов при ОА [4]. Анализ постоянно увеличивающегося количества сообщений обращает внимание на особую роль цитокиновой сети в патогенезе ОА. Во время прогрессирования ОА продукция и действие различных цитокинов могут варьироваться в зависимости от продолжительности и тяжести заболевания [5].Наиболее важный эффект цитокинов заключается в нарушении процессов катаболизма и анаболизма, что особенно важно в тканях, которые часто подвергаются высокой механической нагрузке, таких как суставы человека [6]. В результате нарушения указанного баланса происходит прогрессирующая дегенерация суставного хряща, играющего ключевую роль в биомеханике каждого сустава и других компонентов сустава, что приводит к развитию трудно прерываемого болезненного процесса, который включает: воспалительные, деградационные и производственные процессы, которые вместе приводят к постепенной потере функции суставов и боли.В связи с действием цитокинов в контексте воспалительного заболевания, такого как ОА, их можно разделить на воспалительные и противовоспалительные [7]. Следует отметить, что патофизиологические процессы, происходящие в суставе, пораженном ОА, в значительной степени опосредуются воспалительными цитокинами и другими медиаторами, усиливающими катаболические эффекты. В то же время не следует недооценивать роль противовоспалительных цитокинов, которые могут модулировать воспалительную реакцию и защищать ткани суставов.
Хотя мы не можем предотвратить некоторые причины ОА (генетические факторы, старение и травмы), мы можем попытаться изменить течение болезни на уровне клеточной коммуникации за счет лучшего понимания чувствительных зависимостей. в сети цитокинов. Это открывает возможность использования подходящего целевого лечения с использованием антител и других рекомбинантных биологических факторов, которые прерывают самовоспроизводящиеся процессы закрытого процесса болезни [8].Этот обзор направлен на предоставление точных и актуальных знаний о роли воспалительных и противовоспалительных цитокинов в патогенезе ОА. Стоит отметить, что роль противовоспалительных цитокинов в контексте ОА до сих пор полностью не изучена.
2. Воспалительные цитокины
Группа воспалительных цитокинов является наиболее важной группой соединений, участвующих в патогенезе ОА. Их участие, безусловно, наиболее широко и точно задокументировано в литературе.Они в наибольшей степени ответственны за нарушение метаболического гомеостаза тканей, образующих суставы, за счет стимуляции катаболических и деструктивных процессов. Ключевая роль, которую они играют в патогенезе ОА, является результатом действия этих соединений на большинство клеток, находящихся в суставе, и влияния внутриклеточных путей передачи сигнала на продукцию цитокинов, а также других воспалительных соединений и ферменты. Среди множества представителей этой группы наибольшее значение имеют ИЛ-1, ФНО, ИЛ-6, ИЛ-15, ИЛ-17 и ИЛ-18.
2.1. Интерлейкин-1 бета (IL-1 β )
Интерлейкин-1 бета (IL-1 β ) считается одним из ключевых цитокинов, вовлеченных в патогенез ОА; он вызывает воспалительные реакции и катаболический эффект независимо, а также в сочетании с другими медиаторами в отношении суставного хряща и других элементов суставов. Это один из 11 представителей семейства IL-1 (IL-1F) [9] (рисунок 2). Первоначально он образуется как цитозольный белок-предшественник (про-ИЛ-1 β ), состоящий из 269 аминокислотных остатков [9, 10].Получение активной формы IL-1 β со 153 аминокислотными остатками является результатом внутриклеточного протеолиза, осуществляемого ферментом Каспазой 1 (фермент, превращающий IL-1 β , ICE), с последующим высвобождением в внеклеточное пространство [11]. Его синтез в суставе регулируется хондроцитами, остеобластами, клетками, образующими синовиальную мембрану, и мононуклеарными клетками, которые ранее присутствовали в суставе или проникли в его структуру во время воспалительной реакции [4, 12–16].У пациентов с ОА повышенный уровень IL-1 β как в синовиальной жидкости, так и в синовиальной мембране, хрящах и субхондральном слое кости [12, 13, 15, 17]. Биологическая активация клеток IL-1 β опосредуется взаимодействием с мембранным рецептором, а именно, IL-1R1 (IL-1RI, CD121a), который также может связывать IL-1 α и IL-1Ra [ 18]. Другим рецептором, способным связывать IL-1 β , является IL-1R2 (IL-1RII, CD121b), который после связывания лиганда, такого как IL-1 α , IL-1 β или IL-1Ra , образует неактивный лиганд-рецепторный комплекс, не проявляя способности передавать и активировать внутриклеточный сигнал [19].Здесь стоит упомянуть о присутствии антагониста рецептора IL-1Ra, продуцируемого некоторыми клетками сустава, который (как отмечалось выше) может связываться с IL-1R1 и IL-1R2, тем самым блокируя их связь с IL-1 . β , что может в определенной степени влиять на снижение активности IL-1 β [20, 21]. Экспрессия рецептора IL-1R1 повышена у пациентов с ОА на поверхности хондроцитов и фибробластоподобных синовиоцитов (FLS) по сравнению с группами лечения [22, 23].Связывание IL-1 β с рецептором семейства TLR, таким как IL-1R1, сопровождается привлечением дополнительной цепи IL-1R3 (IL-1RAcP), в результате чего образуется комплекс, который через его внутриклеточный домен Toll- IL-1R (TIR) рекрутирует адаптерный белок MyD88 [24]. Весь ранее описанный комплекс связывает серин-треониновые киназы группы IRAK, которые влияют на белок TRAF6, который индуцирует дальнейшее связывание TAK1, TAB1 и TAB2 [25]. TAK1 влияет на фосфорилирование киназного комплекса I κ B (IKK), тем самым активируя фактор транскрипции NF- κ B [25].Кроме того, также активируются p38MAPK и c-Jun N-терминальная киназа (JNK) [24, 25]. Активация этих факторов транскрипции очень быстро приводит к экспрессии сотен генов, продукты которых включают другие цитокины, хемокины, молекулы адгезии, медиаторы воспаления и ферменты [26]. Действие IL-1 β проявляется в его значительном влиянии на метаболизм клеток и внеклеточный матрикс (ECM) [27]. В ходе болезни первостепенное значение имеет постепенная потеря суставного хряща.Многие исследования подтверждают, что действие IL-1 β блокирует хондроциты в контексте синтеза компонентов внеклеточного матрикса, препятствуя синтезу ключевых структурных белков, таких как коллаген типа II и аггрекан [28, 29]. Помимо снижения синтеза строительных блоков, IL-1 β влияет на работу хондроцитов по синтезу ферментов из группы металлопротеиназ (MMP), в основном интерстициальной коллагеназы (MMP-1), стромелизина- 1 (MMP-3) и коллагеназа 3 (MMP-13), которые разрушительно действуют на компоненты хряща [30–32].Помимо индукции ферментов семейства MMP, IL-1 β влияет на продукцию хондроцитами металлопротеиназ ADAMTS, которые ответственны за протеолиз молекул аггрекана [33]. Основная роль принадлежит ADAMTS-4, продукция которого стимулируется как IL-1 β , так и TNF α , в то время как ADAMTS-5 не коррелирует с влиянием цитокинов и продуцируется конститутивно [33, 34]. Хондроциты, подвергшиеся действию IL-1 β и TNF α , также имеют тенденцию к более быстрому старению и индукции апоптоза [35–37].Анализируя приведенную информацию, можно наблюдать разностороннее действие IL-1 β на хрящ, подавляя возможность его восстановления, усиливая его разрушение ферментами и оказывая прямое неблагоприятное воздействие на хондроциты. В клетках сустава IL-1 β способен индуцировать собственную секрецию аутокринным способом, чтобы стимулировать синтез других цитокинов, таких как, например, TNF α , IL-6, IL-8, и хемокин CCL5 [38–42]. Было показано, что IL-1 β ингибирует сигнальный путь регулируемых рецептором SMAD (R-SMAD), критически важных для активации факторов транскрипции, связанных с TGF- β [43].Это достигается за счет увеличения экспрессии белка-ингибитора SMAD7 и ингибирования синтеза рецептора TGF- β типа II в хондроцитах. Кроме того, наблюдаются эффекты на секрецию ряда других ферментов и медиаторов, вовлеченных в патофизиологию ОА. Эти соединения могут включать iNOS, генерирующую NO, фосфолипазу A2 (PLA2), циклооксигеназу-2 (COX-2), простагландин E-синтазу 2 (PGE2-синтазу), продуцирующую простагландин E2 (PGE2) [44–46]. Во время заболевания IL-1 β стимулирует выработку активных форм кислорода (ROS), которые вызывают образование, например, пероксидов и гидроксилированных радикалов, которые непосредственно повреждают суставной хрящ; усиление этого процесса связано также со снижением экспрессии окислительных ферментов, что наблюдается в пораженном заболеванием суставе [47].
2.2. Фактор некроза опухоли альфа (TNF α )
Фактор некроза опухоли альфа (TNF α ) вместе с IL-1 β считается ключевым воспалительным цитокином, участвующим в патофизиологических процессах, протекающих при ОА ( Рисунок 3). Это один из 19 лигандов в суперсемействе факторов некроза опухолей (суперсемейство TNF) [48]. Первоначально он образуется как гомотримерный трансмембранный белок типа II (mTNF α ), который может секретироваться в окружающую среду на следующей стадии с участием металлопротеиназы TACE / ADAM17, создавая свободную форму TNF α (sTNF α ). ) [49–51].TNF α секретируется теми же клетками в суставе, которые синтезируют IL-1 β , и его повышенная концентрация также наблюдается в тех же элементах, таких как синовиальная жидкость, синовиальная мембрана, хрящ и субхондральный слой кости, где Также обнаруживается повышенный уровень IL-1 β [12, 13, 15, 17]. Цитокин обладает способностью связываться с двумя изотипами мембранных рецепторов, расположенными на поверхности почти каждой ядерной клетки TNF-R1 (p55, CD120a и TNFRSF1a) и TNF-R2 (p75, CD120b и TNFRSF1b) [52, 53 ].Рецептор TNF-R1 может эффективно активироваться растворимой и мембранной формами, в то время как TNF-R2 в основном связывает мембранную форму [53]. Пока участие TNF-R1, по-видимому, оказывает большее влияние на локальную потерю суставного хряща, чем TNF-R2; это, однако, не меняет того факта, что оба рецептора участвуют в передаче сигнала после активации TNF α в процессах, происходящих при ОА [54, 55]. Экспрессия TNF-R1 также увеличивается в клетках FLS [56, 57].Как упоминалось выше, оба рецептора различаются по своему сродству к TNF α , а также по их аминокислотному составу, степени гликозилирования и структуре, в первую очередь в их внутриклеточной части, которая в TNF-R1 включает так называемый домен смерти. (DD), которого нет в рецепторе TNF-R2 [51, 58]. Ввиду значительного отсутствия гомологии во внутриклеточной части оба рецептора обладают способностью передавать разные сигналы. TNF-R1 способен привлекать два разных сигнальных комплекса TNF-R1 (TNF-RSC) [59, 60].Комплекс I в основном участвует в активации путей, конечные продукты которых стимулируют воспалительный ответ, особенно продукцию и секрецию цитокинов и продукцию белков, предотвращающих апоптоз, тогда как основная функция комплекса II включает передачу сигналов, ведущую к распаду клеток [60 , 61]. Ассоциация TNF α с TNF-R1 вызывает взаимодействие между адаптерным белком TRADD с доменом DD и постепенное связывание других адаптерных белков, таких как TRAF2, c-IAP1, c-IAP2 и RIP1 [62–64].За созданием комплекса следует убиквитинирование белка RIP1, который также связывает TAK1, TAB1 и TAB2, что приводит к фосфорилированию комплекса IKK и, в конечном итоге, к активации одного из наиболее важных путей транскрипции в ходе ОА. —NF- κ B [65, 66]. Более того, во время образования и действия комплекса I другой важный сигнальный путь также активируется с помощью киназы JNK, а также другие, такие как путь внеклеточной регулируемой киназы (ERK) и p38MAPK [60, 67, 68].Образование комплекса II сопровождается эндоцитозом активированного рецептора, изменением его конформации и привлечением FADD и про-каспазы 8, что заканчивается гибелью клеток [59, 69]. В свою очередь, связывание mTNF α с рецептором TNF-R2 приведет к связыванию и взаимному взаимодействию белков, включая TRAF2, который имеет решающее значение для передачи сигнала, и другие, такие как TRAF3, c-IAP1 и c-IAP2. . Эффект взаимодействия комплекса заключается в активации киназы JNK и фактора транскрипции NF- κ B [70–73].Доказано, что полиморфизм в гене (M196R), кодирующем рецепторный белок TNF-R2, может предопределять развитие ОА за счет увеличения количества рецепторных белков на поверхности хондроцитов, что приводит к нарушению их функций из-за чрезмерной активации mTNF α [74]. Более того, не только полиморфизм рецептора, но и лиганда TNF α может способствовать возникновению ОА по отношению к конкретным изученным популяциям [75, 76]. Стоит упомянуть наличие дополнительного лиганда, способного включать как TNF-R1, так и TNF-R2, значение которого в патогенезе ОА все еще возрастает, — это програнулин (PGRN), также известный как предшественник гранулин-эпителина (GEP), PC- фактор роста клеток (PCDGF), проэпителин (PEPI) или акрогранин [77–80].ПГРН — фактор роста, обладающий противовоспалительными и иммуномодулирующими свойствами [81]. Было показано, что уровень PGRN значительно повышен у пациентов, страдающих хрящевыми артропатиями, включая ОА [82]. Способность PGRN связываться со специальными рецепторами TNF α , а также его повышенные уровни во время болезни, делают его естественным антагонистом TNF, который мешает сигнальному пути TNF α / TNF-R1 и TNF α / TNF-R2 [83]. Это означает, что дисбаланс TNF α / PGRN может как ускорять, так и подавлять развитие ОА.Кроме того, наличие аутоантител к PGRN наблюдалось при некоторых заболеваниях суставов с аутоиммунным компонентом [84–86]. Эффект TNF α в большинстве случаев совпадает с действием IL-1 β , а в случае многих явлений, происходящих в ходе ОА, наблюдается заметный синергизм между двумя цитокинами [87]. Этот эффект является результатом активации той же группы внутриклеточных сигнальных путей, что, в свою очередь, запускает аналогичные эффекты, которые усиливают воспаление и катаболизм в тканях суставов [26, 27].TNF α влияет на блокировку хондроцитами синтеза протеогликановых компонентов, белков, связывающих протеогликаны, и коллагена типа II [88, 89]. Активированные хондроциты также продуцируют MMP-1, MMP-3, MMP-13 и ADAMTS-4 [33, 90, 91]. Как описано ранее, существует индукция гибели хондроцитов и нарушение миграции хондрогенных клеток-предшественников (ХПК), что лишает хрящ любой возможности регенерации [35–37, 92]. Также наблюдалось явное влияние TNF α и IL-1 β на снижение эффективности дыхательной цепи и, следовательно, снижение уровня АТФ, продуцируемого в митохондриях, расположенных в хондроцитах; кроме того, снижается потенциал митохондриальной мембраны [93].TNF α отвечает за усиленный синтез, например, IL-6, IL-8, RANTES и VEGF [39–41, 94]. Более того, как описано выше, IL-1 β и TNF α индуцируют продукцию iNOS, COX-2 и PGE2-синтазы, тем самым увеличивая количество их продуктов [44, 46, 95, 96].
2.3. Интерлейкин-6 (IL-6)
Интерлейкин-6 (IL-6) представляет собой соединение, характеризующееся всенаправленным взаимодействием в процессах, происходящих в организме человека.Он считается цитокином, который сильно активирует иммунную систему и усиливает воспалительный ответ, хотя, учитывая некоторые его эффекты, его можно классифицировать как противовоспалительное взаимодействие. IL-6 представляет собой гликопротеин, состоящий из 184 аминокислотных остатков, который в процессе посттрансляционного процессинга в конечном итоге становится взаимосвязанной структурой из четырех α -спиралей [97]. Продукция IL-6 в тканях пораженного сустава обычно происходит в ответ на IL-1 β и TNF α и в основном осуществляется хондроцитами, остеобластами, FLS, макрофагами и адипоцитами [39, 98–102]. ].Повышенная концентрация ИЛ-6 присутствует как в синовиальной жидкости, так и в сыворотке крови и положительно коррелирует с интенсивностью поражений на рентгеновских снимках [103-107]. Эффект IL-6 можно наблюдать через уникальную рецепторную систему. Существует два подтипа рецептора IL-6R (gp80, CD126), а именно мембранная форма mIL-6R и растворимый sIL-6R, который может быть образован путем разрезания или с помощью ADAM17 / TACE с помощью металлопротеиназы или посредством альтернативный сращивание [108]. Передача сигнала в клетку требует ассоциации дополнительного белка gp130 (CD130) [109, 110].Белок gp130 также присутствует в мембранной форме mgp130 и в растворимой форме sgp130 [111, 112]. Ассоциация IL-6 и IL-6R с sgp130 связана с ингибированием сигнального пути IL-6 [111, 112]. Привлечение комплекса лиганд-рецептор к mgp130 вызывает гомодимеризацию и, как следствие, образование гексамера, который обеспечивает эффективную передачу сигнала в клетку [113]. Киназа JAK опосредует фосфорилирование остатков тирозина, которые являются неотъемлемой частью gp130, что на следующих стадиях приводит к активации STAT3, фосфорилированию MAPK и активации пути PI3 K / AKT [114, 115].Анализируя роль ИЛ-6 в ОА, следует прежде всего отметить, что полиморфизм гена (-174G / C), кодирующего ИЛ-6, может предопределять развитие ОА [116, 117]. Воздействие ИЛ-6 на суставной хрящ не отличается от других цитокинов и, в синергии с ними, вызывает снижение продукции коллагена типа II и увеличивает продукцию ферментов из группы ММП [118–120]. Также было обнаружено, что эти эффекты могут усиливаться под влиянием травмы [121]. ИЛ-6 считается ключевым цитокином, вызывающим изменения в субхондральном костном слое [122, 123].Его действие в значительной степени основано на стимулировании образования остеокластов и, следовательно, на резорбции кости, при одновременном проявлении синергизма с IL-1 β и TNF α [122, 124]. Остеобласты, стимулированные IL-1 β , TNF α и IL-6, становятся их источником и могут также продуцировать ММП, отрицательно воздействуя на хрящ, расположенный рядом с ними [124]. В дополнение к продемонстрированной роли других цитокинов в индукции продукции IL-6, на его секрецию остеобластами, хондроцитами также влияет простагландин E2 [125, 126].В свою очередь, анализируя тесты на животных моделях, можно заметить, что IL-6 может иметь различный эффект в некоторых ситуациях. Эксперимент, проведенный на мышах, лишенных гена IL-6, показал, что они проявляли тенденцию к развитию гораздо более выраженных дегенеративных изменений, чем здоровые мыши [127]. Во время другого эксперимента на мышах, лишенных гена IL-6, также было продемонстрировано, что внутрисуставная инъекция IL-6 снижает потерю протеогликанов в острой фазе хронического воспаления суставов и вызывает образование остеофитов [128].
2.4. Интерлейкин-15 (ИЛ-15)
Интерлейкин-15 (ИЛ-15) представляет собой гликопротеин, который представляет собой четыре взаимосвязанных α -спирали с массой 14-15 кДа [129, 130]. Его действие в основном основано на стимуляции дифференцировки и пролиферации Т-клеток и NK-клеток [131]. Это один из наиболее документированных цитокинов, участвующих в патогенезе ревматоидного артрита (РА) [132, 133]. При анализе участия ИЛ-15 в патогенезе ОА его повышенная концентрация была обнаружена в синовиальной жидкости на ранних стадиях заболевания [134].Также было показано, что повышенный уровень IL-15 в сыворотке коррелирует как с ощущением боли, так и с тяжестью поражений на рентгеновском изображении [135]. Также было отмечено, что его присутствие может стимулировать секрецию некоторых типов металлопротеиназ из группы ММП [134].
2,5. Интерлейкин-17 (IL-17)
Семейство интерлейкинов-17 (IL-17) — это группа цитокинов с воспалительным действием, которая привлекает все больше внимания исследователей своим участием в патогенезе ОА.Он состоит из шести членов (IL-17A-F), которые могут взаимодействовать через пять типов рецепторов (IL-17RA-E) [136, 137]. Источником ИЛ-17 в основном являются стимулированные CD4 + Т-клетки и тучные клетки, которые проникают через синовиальную мембрану и весь сустав через кровеносные сосуды [138–141]. Основными клетками сустава, на которые воздействует IL-17, являются хондроциты и FLS, проявляющие экспрессию IL-17R на своей поверхности [142]. Кроме того, исследования продемонстрировали прямой клеточный иммунный ответ этих Т-клеток против мембранных антигенов хондроцитов и фибробластов во время ОА [143].Уровень IL-17, измеренный в сыворотке и синовиальной жидкости пациентов, повышен и показывает положительную корреляцию с рентгенографическим изображением поражений при ОА [144]. Было показано, что IL-17 ингибирует синтез протеогликанов хондроцитами и способствует продукции ферментов группы MMP [145–147]. Кроме того, IL-17 влияет на секрецию других цитокинов и соединений, отрицательно влияющих на хрящ, таких как IL-1 β , TNF α , IL-6, NO и PGE2 [148–150].Также характерно влияние IL-17 на секрецию VEGF как хондроцитами, так и FLS; он способствует чрезмерному развитию сети кровеносных сосудов внутри синовиальной мембраны, что приводит к ее гипертрофии [94, 142]. Также недавно было подтверждено, что полиморфизм гена IL-17A G-197A в определенных популяциях может коррелировать с предрасположенностью к развитию ОА [151].
2.6. Интерлейкин-18 (IL-18)
Интерлейкин-18 (IL-18) — еще один представитель семейства IL-1F [9].Он образуется в виде предшественника про-ИЛ-18, состоящего из 192 аминокислотных остатков, который после активации каспазы 1 или протеиназы 3 превращается в биологически активную форму, содержащую 157 аминокислотных остатков [152, 153] . Было отмечено, что уровень каспазы 1 повышен как в суставном хряще, так и в синовиальной оболочке у пациентов с ОА, что в значительной степени способствует образованию IL-1 β и IL-18 [154]. Продукция IL-18 в суставе определяется хондроцитами, остеобластами, FLS и макрофагами [155–157].Его повышенная концентрация очевидна в синовиальной жидкости, синовиальной оболочке, хряще и сыворотке крови и показывает положительную корреляцию со степенью тяжести заболевания, наблюдаемой на рентгенографических изображениях [158–160]. Действие IL-18 опосредуется рецептором IL-18R α , который имеет структурное и функциональное сходство с IL-1R. Как и в случае с IL-1 β , для эффективной передачи сигнала с помощью IL-18 требуется не только присутствие IL-18R α , но также дополнительное привлечение цепи IL-18R β (IL-18RAcP). [161, 162].Внутрижелудочковая передача сигнала через гетеродимерный рецепторный комплекс IL-18 не обнаруживает существенных отличий от механизма передачи сигнала рецепторным комплексом IL-1 β [163]. Исследования показали, что полиморфизм генов, кодирующих как IL-18R, так и интерлейкин IL-18, в некоторых вариантах может предопределять как развитие ОА, так и дегенерацию поясничного диска (LDD) [164, 165]. IL-18 влияет на хондроциты, вызывая повышенную регуляцию IL-18R α на их поверхности и стимулируя избыточный синтез металлопротеиназ MMP-1, MMP-3 и MMP-13 [166].Помимо увеличения концентрации ферментов, разрушающих хрящ, происходит ингибирование продукции протеогликанов, аггрекана и коллагена типа II; кроме того, в хондроцитах наблюдаются морфологические изменения, характерные для клеток, вступающих в апоптоз [167–169]. IL-18 влияет на хондроциты и синовиальные клетки, увеличивая выработку ряда соединений и ферментов, таких как аутокринный IL-18, IL-6, iNOS, PGE2, COX-2 и VEGF [155, 170– 173].
3. Противовоспалительные цитокины
Основными представителями группы противовоспалительных цитокинов, участвующих в патогенезе ОА, являются ИЛ-4, ИЛ-10 и ИЛ-13.В этой главе авторы сосредотачиваются на представлении эффекта только тех из вышеперечисленных цитокинов, биологическая активность которых является наиболее важной в свете соответствующих проблем (рис. 4). Однако следует отметить, что IL-4, IL-10 и IL-13 относятся к более широкой группе противовоспалительных цитокинов и не являются единственными представителями.
3.1. Интерлейкин-4 (IL-4)
Интерлейкин-4 (IL-4) представляет собой белок, состоящий из 129 аминокислот, который имеет форму четырех соединенных между собой α -спиралей, дополнительно стабилизированных тремя дисульфидными связями [174–176] .IL-4 — это лиганд, биологическая активность которого опосредована рецепторной системой, предназначенной как для IL-4, так и для IL-13 [177]. Существует два типа рецепторов, образующих гетеродимеры, которые структурно представляют собой комбинацию двух или трех рецепторных цепей, таких как IL-4R α , IL-13R α 1 и IL-2R γ c [178]. Димеризация IL-4R α и IL-2R γ c (комплекс типа 1) обеспечивает присоединение IL-4, в то время как взаимодействие между IL-4R α и IL-13R α 1 (тип 2) обеспечивает эффективное присоединение как IL-4, так и IL-13 [177–179].
После образования рецепторного комплекса типа 1 происходит внутриклеточная передача сигнала путем постепенного фосфорилирования каскада IL-4R α / JAK1 / STAT3 / STAT6, что приводит к экспрессии нескольких провоспалительных генов [180, 181] . Наблюдаемый полиморфизм генов, кодирующих как IL-4, так и IL-4R α , может предопределять развитие остеоартрита в суставах кисти, коленного и тазобедренного суставов, что дает основание утверждать, что взаимодействие между IL-4 и его специализированным рецептором комплекс — один из элементов патогенеза заболевания [182–184].Продукция IL-4 в первую очередь определяется Т-клетками (Th3), инфильтрирующими синовиальную оболочку сустава кровеносными сосудами [185, 186]. Далее было обнаружено, что уровень растворимого IL-4R α (sIL-4R) повышен в сыворотке пациентов, страдающих ОА, по сравнению со здоровой контрольной группой [187]. Повышенная концентрация ИЛ-4 наблюдается также в синовиальной жидкости и синовиальных клетках [185, 188, 189]. ИЛ-4 обладает сильным хондопротекторным действием. В ряде исследований было обнаружено, что IL-4 оказывает ингибирующее действие на деградацию протеогликанов в суставном хряще, ингибируя секрецию металлопротеиназ ММП, а также уменьшая вариабельность продукции протеогликанов, которая видна в курс ОА [190–193].Интересно, что во время ОА хондроциты показали пониженную чувствительность к эффектам IL-4, который может быть ответственным за быструю дегенерацию суставного хряща [194–196]. Кроме того, IL-4 сам по себе или в сочетании с IL-10 проявляет свойства, ингибирующие апоптоз как хондроцитов, так и FLS [191, 197, 198]. Принимая во внимание влияние IL-4 на культуры клеток хондроцитов и обработанных им FLS, наблюдается снижение синтеза воспалительных цитокинов, таких как IL-1 β , TNF α и IL-6 [191, 197, 199].Одновременно IL-4 может индуцировать повышающую регуляцию экспрессии рецепторов TNF α , таких как TNF-R1 и TNF-R2 [200]. Помимо прямого снижения секреции воспалительных цитокинов, также наблюдается снижение секреции других медиаторов воспаления, таких как PGE2, COX-2, PLA2 и iNOS [191, 197, 200, 201]. Представляется разумным сослаться на исследование, в котором анализировалось влияние rmIL-4 (рекомбинантный мышиный IL-4) в сочетании с rmGM-CSF на дендритные клетки CD11b + F4 / 80 + iDC на мышиной модели, где воспалительное заболевание суставов индуцировали искусственно [202].Наблюдаемые результаты, по-видимому, подтверждают положительный эффект IL-4 и GM-CSF на восстановление баланса между секрецией провоспалительных и противовоспалительных факторов в иммунных клетках мышей с CIA (коллаген-индуцированный артрит). CD11b + F4 / 80 + Воздействие на клетки iDC указанным эффектом показало повышенную способность синтезировать противовоспалительный IL-10 и TGF- β , а также ингибирующий или возбуждающий эффект по сравнению с другими клетками иммунной системы. система. Было отмечено, что пролиферация лимфоцитов Th27 снижена и что они показали способность синтезировать и секретировать провоспалительный IL-17.Макрофаги показали сниженную способность продуцировать и секретировать IL-1 и TNF α . В свою очередь, регуляторные Т-клетки стимулировались для увеличения продукции IL-10 и TGF- β . Подопытные мыши показали снижение морфологических маркеров воспаления синовиальной оболочки и суставного хряща и снижение иммунологической активности тимуса по сравнению с контрольной группой (не подвергавшейся воздействию rmIL-4 rmGM-CSF). Хотя модель мыши с CIA соответствует в основном RA в мировой литературе, зависимости между эффектом IL-4 и GM-CSF, наблюдаемые для клеток иммунной системы, могут указывать на некоторые процессы, происходящие при OA.В контексте других исследований это дает нам приблизительное представление о противовоспалительном эффекте ИЛ-4 при ОА, хотя, безусловно, требует дальнейшего изучения.
3.2. Интерлейкин-10 (ИЛ-10)
Интерлейкин-10 (ИЛ-10) представляет собой цитокин, структурно связанный с интерферонами, который находится в форме гомодимера, где каждый мономер представляет собой полипептидную цепь, состоящую из 160 аминокислотных остатков, принимая во внимание структура из 6 взаимосвязанных α -спиралей [203–205]. Инициирование IL-10 становится возможным благодаря связыванию его с рецептором IL-10R, который представляет собой гетеродимер, состоящий из субъединиц IL-10R1 и IL-10R2 [206, 207].Первая стадия активации рецептора включает связывание IL-10 с субъединицей IL-10R1, которая затем изменяет свою конформацию таким образом, чтобы позволить связывать комплекс IL-10 и IL-10R1 с субъединицей IL-10R2 [206 , 207]. В этот момент запускается каскад передачи внутриклеточного сигнала. Это приводит к активации тирозинкиназы JAK1 (связанной с субъединицей IL-10R1) и TYK2 (связанной с IL-10R2) [208]. Это, в свою очередь, подразумевает отправку клеточного сигнала дальше активаторами транскрипции STAT3, которые при связывании с SBE (STAT-связывающие элементы) ядра клетки стимулируют синтез продуктов генов, зависимых от IL-10 [209].ИЛ-10 — еще один цитокин, который проявляет хондопротекторный эффект при ОА. Хондроциты экспрессируют как цитокин IL-10, так и рецептор IL-10R [210]. Доказано, что IL-10 участвует в стимуляции синтеза коллагена II типа и аггрекана. После введения ИЛ-10 в условиях in vitro как здоровый суставной хрящ, так и хрящ в ходе ОА продемонстрировали увеличение синтеза протеогликана и его процентную долю во внеклеточном матриксе. Кроме того, синовиальная оболочка пациентов с остеоартрозом в контексте гемофилии, которая показала тенденцию к избыточной продукции TNF α и IL-1 β после введения in vitro IL-10, значительно снизила среднюю секрецию указанных провоспалительных цитокинов на 60% и 83% соответственно [211].Было показано, что IL-10 отвечает за ингибирование продукции металлопротеиназ семейства ММП [212]. Было подтверждено, что ИЛ-10 (аналогичный ИЛ-4) подавляет апоптоз хондроцитов [213]. Эти свойства IL-10, вероятно, являются результатом стимуляции синтеза антагониста IL-1 β , которым является IL-1Ra и тканевый ингибитор металлопротеиназы-1 (TIMP-1), а также факторов роста [214, 215]. Изучение влияния IL-10 на стимуляцию пролиферации хондроцитов на модели мышей показывает дополнительные пути передачи сигналов IL-10 [216].Доказано, что IL-10 активирует киназный путь SMAD1 / SMAD5 / SMAD8 и ERK1 / 2 MAP и индуцирует экспрессию костных морфогенетических белков 2 и 6 (BMP-2, BMP-6). Белки BMP принадлежат к семейству TGF- β и играют решающую роль в хондрогенезе [217]. Они являются частью сигнального пути, который влияет на многие гены и белки, ответственные за регуляцию трансформации мезенхимальных клеток в хондроцитах, такие как NKX-3.2 / SOX9, SOX5 и SOX6 [218, 219]. Помимо определения трансформации мультипотентных клеток в хондроциты, белки BMP стимулируют их пролиферацию как напрямую, так и посредством IHH / PTHrP-зависимого пути [220, 221].Таким образом было подтверждено участие IL-10 в индукции дифференцировки и пролиферации хондроцитов через сигнальный путь BMP. Авторы исследования пришли к выводу, что наблюдаемые механизмы могут частично отвечать за хондопротекторные эффекты IL-10 при ОА. В другом исследовании клетки кроветворной системы наблюдались после стимуляции LPS. Цель состояла в том, чтобы выяснить, как стимуляция LPS влияет на синтез и повышение уровня IL-10 в образцах крови пациентов с ОА и здоровых людей.На основе результатов определения уровня IL-10 и информации о состоянии здоровья субъектов была разработана конкретная модель прогнозирования ОА. Лица, образцы крови которых не показали значительного увеличения уровня IL-10 относительно начальной точки (нижний квартиль результатов), подвергались даже трехкратному риску развития ОА по сравнению с теми, у которых уровни IL-10 после стимуляции были ниже. в высшем квартиле [222]. ИЛ-10 снижает эффект TNF α на синовиальные фибробласты, взятые у пациентов с ОА [200].Это проявляется в значительном снижении секреции ими PGE2, COX-2 и PLA2. Интересно, что IL-10 не обладает такими свойствами по отношению к фибробластам, не обработанным TNF α . Было подтверждено, что IL-10 снижает экспрессию рецепторов TNF α и, таким образом, их способность связываться с поверхностью фибробластов. Противовоспалительная и хондропротективная природа IL-10 складывается из результатов интересных исследований влияния физических упражнений на секрецию цитокинов в суставной жидкости и околосуставных тканях у пациентов с ОА коленных суставов [223, 224].В этих исследованиях пациенты были разделены на исследуемую группу, которая тренировала коленные суставы, пораженные ОА, в течение 3 часов, и контрольную группу, которая должна была воздерживаться от упражнений в течение того же времени. Стоит отметить, что в контрольной группе были пациенты с такой же степенью тяжести ОА коленных суставов. Коленные суставы, пораженные ОА, были подключены к катетерам как в основной, так и в контрольной группах. Катетеры, помещенные в суставы и околосуставные суставы, использовались для исследования уровней IL-10 и других цитокинов перед тренировкой, во время тренировки и после тренировки относительно контрольной группы.Значительное повышение уровня ИЛ-10 в синовиальной жидкости и околосуставных тканях наблюдалось у пациентов в исследуемой группе по сравнению с контрольной группой, в которой уровни ИЛ-10, наблюдаемые до и после нагрузки, не имели значимой разницы. На основании этих наблюдений кажется разумным отстаивать лечебный эффект физических упражнений на суставы, пораженные ОА. По правде говоря, неясно, какой механизм приводит к повышенной секреции IL-10. Некоторые авторы утверждают, что это связано с индуктивным действием повышенного внутрисуставного давления на секрецию клеток [225, 226].
3.3. Интерлейкин-13 (IL-13)
Интерлейкин-13 (IL-13) представляет собой соединение, которое имеет структуру четырех взаимосвязанных α -спиралей, что очень похоже по своему действию на IL-4 [227, 228] . Подобно IL-4, действие IL-13 как лиганда опосредуется рецепторной системой, которая объединяет оба цитокина [177]. В этом случае требуется рекрутирование лиганда, а именно IL-13, и дополнительно цепей IL-4R α и IL-13R α 1 для создания комплекса типа 2 [177, 178].С этой комбинацией IL-13 обладает способностью передавать внутриклеточный сигнал как посредством каскада IL-4R α / JAK2 / STAT3, так и IL-13R α 1 / TYK2 / STAT1 / STAT6 [180]. Противовоспалительное и хондопротекторное действие IL-13 на клетки иммунного ответа, суставной хрящ и синовиальную оболочку при ОА достаточно хорошо задокументировано [229, 230]. Противовоспалительный эффект IL-13 в контексте ОА кажется наиболее важным в отношении фибробластов, включенных в синовиальную оболочку.Однако обратите внимание, что противовоспалительные свойства, основанные на ингибировании секреции воспалительных цитокинов, относятся к целому ряду клеток, таких как макрофаги, моноциты, B-клетки, NK-клетки и эндотелиальные клетки [231]. В одном из наиболее важных исследований влияния IL-13 на ОА образцы синовиальной оболочки были взяты у 16 пациентов с ОА во время процедуры имплантации эндопротеза коленного сустава (TKR) [232]. Пациентам был поставлен диагноз на основании критериев диагностического подкомитета ACR для ОА, выявляющих III или IV стадию заболевания по данным рентгенологического исследования [233].В взятые синовиальные образцы вводили провоспалительный LPS (контрольные образцы), а затем IL-13 (тестовые образцы). После 72 ч инкубации были выполнены лабораторные тесты, включая тесты связывания, нозерн-блоттинг и ELISA. Было показано, что, по сравнению с контрольными образцами, IL-13 проявлял ингибирующее действие на синтез провоспалительных IL-1 β , TNF α и MMP-3 с одновременным повышением уровня IL-1Ra. . В исследованиях клеток синовиальной оболочки количество мРНК для IL-1 β было снижено, в то время как уровень мРНК для IL-1Ra был увеличен по сравнению с контрольными образцами.Более того, синовиальные фибробласты показали снижение связывания между IL-1 β и его рецептором, что было вызвано повышенной продукцией и действием IL-1Ra. Было продемонстрировано, что IL-13 обладает способностью подавлять провоспалительный эффект TNF α по сравнению с фибробластами пациентов с ОА [190]. Наблюдалось значительное снижение синтеза PGE2 за счет блокирования синтеза COX-2. Интересно, что по сравнению с IL-4 и IL-10, IL-13 не влияет на уровень продукции PLA2.Это может указывать на избирательный эффект IL-13, который включает только COX-2 и, более конкретно, экспрессию его гена. Исследование доказало, что IL-13 обладает способностью снижать ядерную концентрацию факторов транскрипции C / EBP, что может влиять на ингибирование синтеза ЦОГ-2. В этом контексте фибробласты могут проявлять свойства, подобные остеобластам [234]. Анализ этих результатов указывает на потенциальную полезность IL-13 при лечении ОА в качестве соединения, которое ингибирует воспалительные процессы, защищает хондроциты, снижает секрецию воспалительных цитокинов и металлопротеиназ, одновременно стимулируя синтез IL-1Ra.
4. Резюме
ОА представляет собой комплекс сложных и трудно идентифицируемых процессов, ведущих к прогрессирующей дегенерации суставов. Но, вопреки тому, что может показаться, это не только набор катаболических эффектов. Кроме них, постоянно происходят анаболические противовоспалительные процессы. Очевидный дисбаланс метаболизма, наблюдаемый при ОА, является последним проявлением дисрегуляции в так называемой сети цитокинов между противовоспалительными и воспалительными цитокинами. В этой статье представлены современные знания о влиянии наиболее важных цитокинов на патогенез ОА, основанные на обзоре мировой литературы.По биологическому действию цитокины были разделены на воспалительные и противовоспалительные. Однако в конкретных условиях этот критерий не так очевиден. Соответствующие цитокины следует анализировать вместе с природой и структурой конкретных рецепторов и внутриклеточными сигнальными путями, запускаемыми их активацией в конкретной ткани. Таким образом, особое внимание было уделено потенциальному влиянию цитокинов на суставной хрящ, синовиальную оболочку и клетки иммунной системы.В контексте разработки оптимальной тактики лечения ОА авторы данной статьи попытались обобщить и прокомментировать наиболее важную информацию, полученную из собранных выше (опубликованных) данных.
Из-за своего воздействия на сустав воспалительные цитокины оказывают прежде всего деструктивное воздействие на суставной хрящ. Это многоуровневое воздействие, которое включает не только индукцию старения и апоптоза хондроцитов, но и снижение синтеза ключевых компонентов внеклеточного матрикса, таких как протеогликаны, аггрекан и коллаген II типа.Кроме того, воспалительные цитокины способствуют усиленному синтезу и высвобождению многих протеолитических ферментов, разлагающих суставной хрящ, в том числе металлопротеиназ семейства MMP и ADAMTS. Помимо своего действия на хондроциты, синовиальные клетки и другие суставные и околосуставные ткани, воспалительные цитокины влияют на клетки иммунной системы, мигрирующие к месту воспаления. Из-за действия воспалительных цитокинов все эти клетки имеют тенденцию продуцировать чрезмерное количество воспалительного PGE2, COX-2, фосфолипазы A2, NO и свободных радикалов.Следует отметить, что воспалительные цитокины стимулируют клетки к синтезу других воспалительных цитокинов, а именно IL-1 β , TNF α , IL-6, IL-8 и хемокинов CCL5 (RANTES). Таким образом, они могут стимулировать собственное производство, демонстрируя аутокринный, паракринный и самодвижущийся эффект на воспалительный процесс.
Действие противовоспалительных цитокинов в основном включает ингибирование синтеза воспалительных цитокинов, особенно IL-1 β и TNF α .Наблюдаемые эффекты противовоспалительных цитокинов включают усиление синтеза протеогликанов, ингибирование апоптоза хондроцитов, снижение синтеза и секреции металлопротеиназ и снижение уровня PGE2. Однако эти свойства следует рассматривать как ингибирующее действие на воспалительные цитокины, а не как прямые хондопротекторные возможности. Следует добавить, что было доказано, что действие противовоспалительных цитокинов в основном осуществляется в отношении клеток, стимулируемых воспалительными цитокинами, в то время как никаких существенных различий в метаболизме клеток, не подвергающихся такой стимуляции, не отмечено.Такая взаимосвязь наблюдалась, например, в отношении синовиальных фибробластов, полученных от пациентов с ОА [200]. Однако некоторые свойства противовоспалительных цитокинов выходят за рамки простейшего представления об антагонизме по отношению к воспалительным цитокинам. Например, IL-10 стимулирует синтез факторов роста семейства BMP (BMP-2, BMP-6) и влияет на регуляторные белки, такие как NKX-3.2 / SOX9, SOX5 и SOX6, которые индуцируют и регулируют процесс хондрогенеза. . В свою очередь, rmIL-4 на мышиной модели стимулирует регуляторные Т-клетки к синтезу IL-10 и фактора роста TGF- β , что, по крайней мере, соответствует свойствам воспалительных цитокинов в контексте стимуляции их собственного синтеза [202] .Основное наблюдение, касающееся эффектов воспалительных и противовоспалительных цитокинов в ходе ОА, заключается в том, что воспалительная реакция в пораженных суставах никогда не контролируется полностью. Многие авторы подтвердили, что действие противовоспалительных цитокинов и лечения на их основе не может положительно остановить прогрессирование заболевания, блокируя продвижение катаболических путей [200]. Пока нет исчерпывающих ответов на этот вопрос. По мнению авторов исследования, недостаточное действие противовоспалительных цитокинов в суставе может определяться особенностями их действия.По сравнению со здоровой суставной тканью противовоспалительные цитокины не проявляют значительного анаболического эффекта, который мог бы создать достаточное биохимическое преимущество против эффектов воспалительных цитокинов. Роль противовоспалительных цитокинов становится заметной только в суставе, пораженном болезнью при наличии медиаторов воспаления. Таким образом, действие противовоспалительных цитокинов не проявляет первичной профилактической способности; тем не менее, он обладает свойствами вторичной реакции, направленной на борьбу с симптомами болезни.Такой блокирующий эффект активности воспалительных цитокинов по принципу «действие-реакция» уже на ранних стадиях заболевания делает антикатаболические процессы вторичными по отношению к катаболическому эффекту и, следовательно, является поздним или отсроченным.
В поисках лучшего понимания патомеханизма ОА следует обратить внимание на количественные изменения, которые происходят в так называемой сети цитокинов. Изобилие или недостаток любого элемента может вызвать нарушение всей конструкции и, в конечном итоге, ее разрушение.При остеоартрите отсутствует много «строительных блоков», которые способствуют сохранению метаболического баланса в суставе. Основная фигура в этой группе — это прежде всего TGF- β , цитокин и фактор роста, ответственный за стимуляцию выработки протеогликана, коллагена типа II и хондрогенез [235, 236]. Его присутствие в суставах наблюдается у здоровых людей, в отличие от пациентов с ОА, у которых количество TGF- β низкое или даже не обнаруживается [237]. Некоторые авторы считают, что снижение уровня этого цитокина отвечает за сенсибилизацию хряща к действию медиаторов воспаления и за прогрессирование заболевания [235].Объяснение пониженного количества TGF- β в ходе ОА и, следовательно, его биологической активности может включать перехват клеточных сигнальных путей воспалительными цитокинами, хотя это, безусловно, требует дальнейшего изучения [238, 239]. Другой фактор, который может способствовать безудержному прогрессированию ОА, — это тип клеток, ответственных за продукцию определенных цитокинов. А именно, в модели ОА выработка противовоспалительных цитокинов определяется в первую очередь клетками иммунной системы, которые в значительной степени являются инфильтрирующими клетками.В свою очередь, воспалительные цитокины, такие как IL-1 β или TNF α , синтезируются и секретируются клетками иммунной системы, а также локально клетками суставного хряща [240]. Эта двойная модель выпуска, кажется, создает благоприятные условия для развития ОА. Добавьте немного видимое влияние противовоспалительных цитокинов на стимуляцию их собственной секреции и, следовательно, отсутствие механизма «самоподачи» (в отличие от воспалительных цитокинов), и мы увидим картину болезни, в которой его нет. можно вызвать преимущества воспалительных процессов.Такая схема прогрессирования заболевания достаточно точно соответствует картине прогрессирования ОА. В настоящее время мы пытаемся найти соответствующее лечение, которое могло бы остановить прогрессирование ОА или, по крайней мере, замедлить его до удовлетворительной степени. Тактика, используемая исследователями, состоит в том, чтобы влиять на пути клеточной трансдукции, которые имеют решающее значение для индукции воспалительного процесса. Поэтому ведутся исследования, направленные на получение более точных знаний о действии воспалительных и противовоспалительных цитокинов.Складывающаяся картина показывает множественность, сложность и многоуровневость процессов, протекающих с участием цитокинов в ходе ОА.
