Наследственная тромбофилия
Склонность к патологическому свертыванию крови, или тромбофилия может обнаруживаться у пациентов, столкнувшихся с опасным состоянием — тромбозом 1. И у многих из них склонность к повышенному тромбообразованию передалась по наследству. Почему развивается наследственная тромбофилия. Какие симптомы появляются при данном состоянии, как ее диагностировать и лечить?
Генетические факторы
Тромбофилия, которая передается по наследству, — генетически обусловленная склонность к формированию тромбов. При сочетании двух и более нарушений в системе свертывания выраженные тромботические расстройства могут развиваться уже в раннем детстве. Однако чаще наследственное повышение свертываемости крови вызвано одним нарушением, которое выявляется случайно при лабораторном исследовании крови 2.
Выделяют два основных типа тромбофилий: гематогенные, связанные с изменениями свертывающей системы крови, и негематогенные. На сегодня известны как минимум 20 генетических факторов, связанных с развитием заболевания.
Установленные:
- фактор V Лейден — мутация, при которой из-за замены аминокислот в белковой цепи V фактора свертывания он становится устойчивым к действию одного из основных противосвертывающих агентов, активированного протеина С.
- Мутация G20210А протромбина II, при которой изменяется уровень фактора свертывания крови II протромбина.
- Дефицит протеина С, инактивирующего факторы свертывания крови Va и VIIIa. Встречается реже, чем две предыдущие мутации, обычно приводит к развитию семейного венозного тромбоза.
- Дефицит протеина S — кофактора протеина С, который усиливает его противосвертывающую и фибринолитическую активность.
- • Дефицит антитромбина, основного белкового фактора, который угнетает свертывание крови. Передается по аутосомно-доминантному типу, то есть проявляется только при наличии хотя бы одного дефектного гена.
Неопределённые:
- Дисфибриногенемия — состояние, при котором содержание фибриногена соответствует норме, однако сама молекула фибриногена изменена.
 Чаще передается по аутосомному типу наследования, то есть для проявления заболевания дефектный ген должен передаться от обоих родителей. Обычно проявляется умеренными кровотечениями на фоне травмы или хирургического вмешательства.
Чаще передается по аутосомному типу наследования, то есть для проявления заболевания дефектный ген должен передаться от обоих родителей. Обычно проявляется умеренными кровотечениями на фоне травмы или хирургического вмешательства. - Гипергомоцистеинемия. Может быть одновременно и наследственным, и приобретенным нарушением 2. Связана с редкими генетическими поломками, которые приводят к повышению концентрации гомоцистеина в моче, плазме крови. Гомоцистеин проявляет выраженный токсический эффект, повреждая внутреннюю поверхность сосудов, значительно увеличивая риск тромбозов.
- Дисфибриногенемия — состояние, при котором содержание фибриногена соответствует норме, однако сама молекула фибриногена изменена.
Редкие.
К редким факторам тромбофилии относятся повышение концентрации факторов свертывания крови VIII, IX, XI, VII, XII, дефицит плазминогена, активация тканевого плазминогена, повышение липопротеина А, полиморфизм гликопротеина тромбоцитов, дефект гена тромбомодулина, другие факторы.
Как проявляется тромбофилия?
Наличие тромбофилии можно заподозрить при следующих состояниях 2:
- Повторная венозная тромбоэмболия
- Венозный тромбоз в возрасте младше 40 лет
- Венозная тромбоэмболия у родственников
- Тромбоз необычной локализации, например, брыжеечной вены, почечной вены, печени, церебральный тромбоз.

Необходимо отметить, что чаще всего тромбофилия приводит к тромбозу вен, однако недостаточность протеинов С, S и антитромбина могут проявляться также тромбозами в артериях. Последние становятся причиной инфаркта миокарда и острого нарушения мозгового кровообращения — инсульта.
Диагностика тромбофилии
Своевременная диагностика генетической (наследственной) тромбофилии играет важную роль в прогнозе заболевания. Раннее выявление заболевания позволяет внести необходимые коррективы в образ жизни и таким образом предупредить патологическое тромбообразование.
Поскольку передающаяся по наследству тромбофилия может быть связана с различными генетическими факторами, диагностика ее носит комплексный характер. Задача врача — подтвердить или опровергнуть наличие мутаций, связанных с нарушением свертывающей активности крови.
К числу анализов, которые придется сдать при подозрениях на наследственную тромбофилию, относятся3:
Развернутая коагулограмма с определением уровня факторов свертывания крови, физиологических антикоагулянтов.
Коагулограмма позволяет выявить отклонения в системе гемостаза и определить тип тромбофилии, недостаточность каких именно факторов свертываемости наблюдается.
- Определение уровня гомоцистеина, позволяющее диагностировать гипергомоцистеинемию.
- Определение содержания тромбомодулина, активности фактора Виллебранда, а также концентрации эндотелина-1, необходимые для получения информации о возможном поражении сосудов вследствие тромбофилии.
- Генетическое исследование полиморфизма генов тех факторов, которые участвуют в гемостазе.
Наследственная тромбофилия и беременность
Связь между передаваемыми по наследству тромбофилиями и осложнениями беременности, например, преэклампсией, эклампсией, самопроизвольным прерыванием беременности, задержкой развития плода, отслойкой плаценты до сих пор остается противоречивой4. И тем не менее, некоторые акушерские осложнения все же вызваны тромбофилиями.
Так, ряд исследований свидетельствует о возможной связи между потерей плода во втором и третьем триместрах беременности с наличием наследственной тромбофилии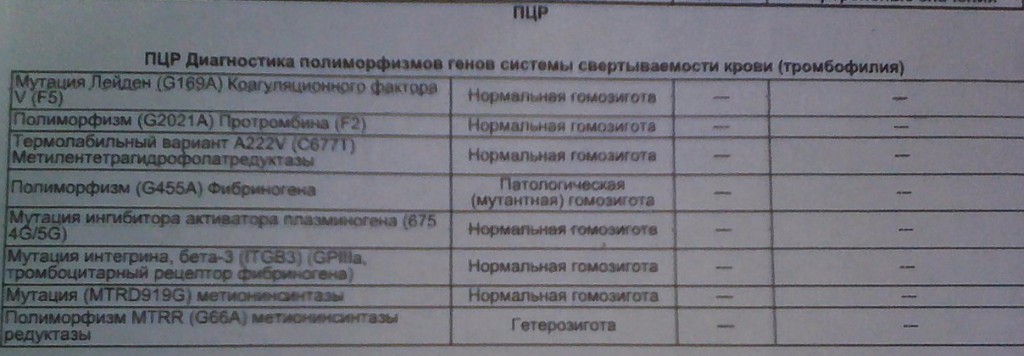 Это объясняется нарушением кровообращения в сосудах плаценты вследствие формирования в ней тромбов. Однако важно подчеркнуть, что самопроизвольные потери плода на ранних сроках беременности (в первом триместре) чаще не имеют отношения к тромбофилии.
Это объясняется нарушением кровообращения в сосудах плаценты вследствие формирования в ней тромбов. Однако важно подчеркнуть, что самопроизвольные потери плода на ранних сроках беременности (в первом триместре) чаще не имеют отношения к тромбофилии.
Тем не менее, наличие тромбофилии, которая заложена генетически, у беременных женщин может повышать риск венозных тромбоэмболических осложнений5. Даже в норме, у здоровых женщин во время беременности свертывающая система крови активируется: наблюдается физиологическая гиперкоагуляция (повышение свертываемости крови), также имеется венозный застой. Однако, у беременных женщин, страдающих тромбофилией, коагуляция еще более увеличивается, что и может приводить к повышению риска тромбообразования, прежде всего в венозных сосудах
Формированию венозного застоя у будущих мам может способствовать и снижение физической активности, например, при некоторых осложнениях беременности, а также после кесарева сечения 7.
Диагностика тромбофилии при беременности затруднена, поскольку ряд показателей повышается как при патологии, так и у здоровых женщин, причем чем больше срок беременности, тем выше риск тромбоза. Чтобы поставить диагноз, прибегают к генетическому исследованию, которое обычно проводится по рекомендации лечащего врача при наличии определенных показаний, например, при наличии перенесенного венозного тромбоза нижних конечностей или наличии венозных тромбозов у близких родственников.
Профилактика тромбозов
Профилактика тромбозов при тромбофилии в большинстве случаев основана на изменении образа жизни. Пациентам рекомендуют избегать тяжелых физических нагрузок и травм, при этом сохраняя прежний объем физической активности. Важная мера профилактики — ношение компрессионного трикотажа. Врачи всегда принимают решение о профилактических мерах строго индивидуально после оценки тромботического риска.
Список литературы
- Kyrle P.A., Rosendaal F.R., Eichinger S.
 Risk assessment for recurrent venous thrombosis //Elsevier.2010;376(9757):2032–2039.
Risk assessment for recurrent venous thrombosis //Elsevier.2010;376(9757):2032–2039. - Khan S., Dickerman J.D. Hereditary thrombophilia. // Thromb. J. BioMed Central. 2006;4:15.
- Васильев С.А., Виноградов В.Л., и соавт. Тромбозы и тромбофилии: классификация, диагностика, лечение, профилактика // РМЖ — 2013.- № 17. — С.896.
- Robertson L. et al. Thrombophilia in pregnancy: a systematic review // Br. J. Haematol. Blackwell Science Ltd.2006;132(2):171–196.
- Sibai B.M., How H.Y., Stella C.L. Thrombophilia in pregnancy: Whom to screen, when to treat. 2007;19(1):50–64.
- Battinelli E.M., Marshall A., Connors J.M. The role of thrombophilia in pregnancy. // Thrombosis. Hindawi.2013; 2013:516420.
- Андрияшкин А.В. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений // Флебология — 2015. –Т. 9. – № 2. –С.1–52.
SARU.ENO.19.03.0436
Анализы в KDL. Генетический риск нарушений системы свертывания
Данное исследование представляет собой выявление полиморфизмов в генах, связанных с наследственной тромбофилией и другими нарушениями системы свертывания крови.
В каких случаях обычно назначают исследование?
Анализ рекомендован следующим категориям пациентов:
- пациенты с семейной историей тромбофилии и других венозных осложнений
- пациенты с наличием в семейной истории сердечно- сосудистых событий (инфарктов и инсультов) у близких родственников в возрасте до 50 лет
- женщины, планирующие прием комбинированных
- пациенты с тромбозами любой локализации в возрасте до 50 лет, даже при наличии предрасполагающих факторов
- пациенты с тромбозами необычных мест (тромбоз мозговых синусов, мезентериальные, печеночные вены)
- пациенты с хроническими заболеваниями вен, в частности с тромбофлебитами
- женщины, планирующие прием комбинированных оральных контрацептивов
- женщины, планирующие гормональную заместительную терапию
- женщины с привычным невынашиванием беременности.

Что именно определяется в процессе анализа?
В данном исследовании выявляются полиморфизмы следующих генов:
- F2 — ген протромбина.
- F5 – ген фактора V свертывания крови.
- F7 – ген проконвертина.
- F13A1 – ген, кодирующий A-субъединицу XIII фактора свертывания.
- FGB – ген, кодирующий бета- субъединицу фибриногена.
- ITGA2 – ген, кодирующий тромбоцитарный гликопротеин Iа.
- ITGB3 – ген, кодирующий белок интегрин бета- 3, являющийся компонентом тромбоцитарного гликопротеина IIb/IIIа.
- SERPINE1 (PAI-I)– ген ингибитора активатора плазминогена 1 типа.
Что означают результаты теста?
В качестве заключения выдается генетическая карта здоровья, составленная профессиональным врачом-генетиком нашей лаборатории. В ней представлены результаты анализа с расшифровкой, дано подробное описание исследуемых полиморфизмов и их влияния на риски развития нарушений системы свертывания крови, сердечно-сосудистых заболеваний и патологий беременности, советы по проведению дополнительных исследований и подробные клинические рекомендации для лечащего врача.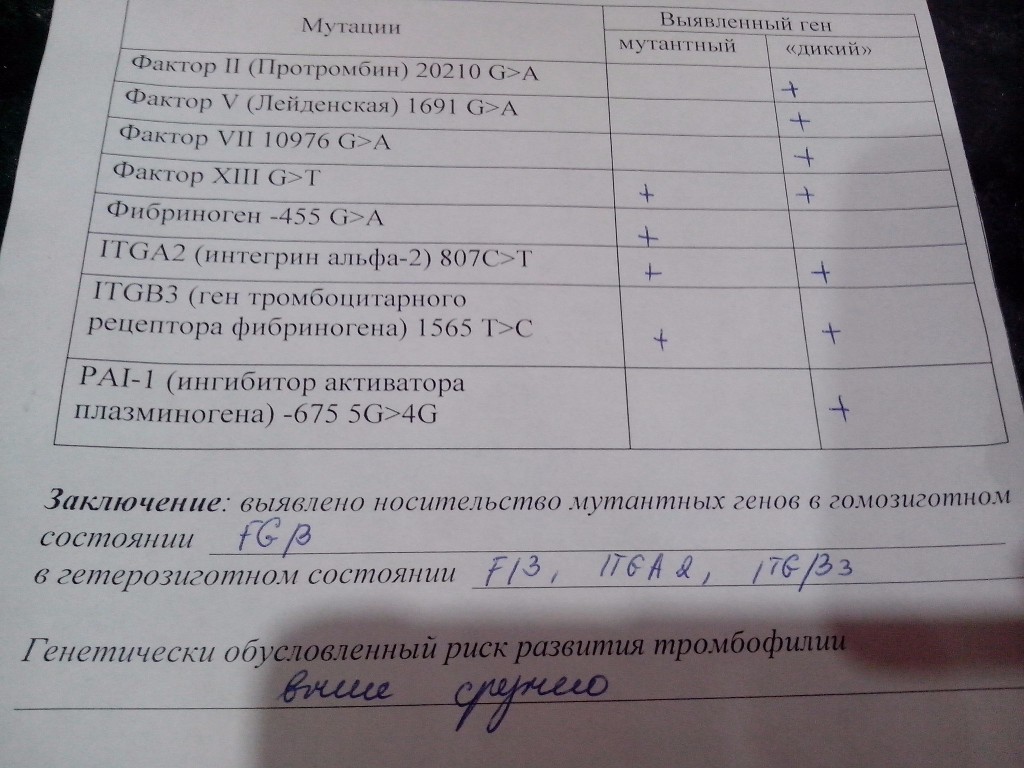
Результаты анализа интерпретируются лечащим врачом. Опираясь на них, врач может скорректировать питание и образ жизни пациента, назначить лекарственные препараты и дополнительные исследования.
Сроки выполнения теста.
Результат генетического исследования можно получить спустя 10-11 дней после взятия крови.
Как подготовиться к анализу?
Следует придерживаться общих правил подготовки к взятию крови из вены. Кровь можно сдавать не ранее, чем через 3 часа после приема пищи в течение дня, или утром натощак. Чистую воду можно пить в обычном режиме.
Инвитро. Генетические предрасположенности, узнать цены на анализы и сдать в Москве
Врожденная гиперплазия надпочечников, ген CYP21A2, ч.м.Генетическое исследование на наличие частых мутаций в гене CYP21OHB направлено на диагностику адреногенитального синдрома – заболевания, обусловленного генетическим дефектом ферментативных систем, которые участвуют в синтезе кортикостероидов, и сопровождаемое аномалиями полового и соматического развития, гиперандрогенией.
Выявление индивидуальных особенностей в основных генах ферментов фолатного цикла для оценки вероятности формирования дефицита фолиевой кислоты при беременности (рекомендовано оценивать в комплексе с иммунохимическим тестом на определение уровня гомоцистеина).
Типирование генов системы HLA II классаВыявление индивидуальных особенностей по трем локусам генов HLA II класса для оценки предрасположенности к развитию некоторых аутоиммунных заболеваний, в том числе во время беременности.
Определение генотипа резус-фактораТест включает в себя исследование гена RHD – гена резус-фактора с определением гетерозиготного или гомозиготного носительства по резус-фактору. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
Определение резус-фактораТест выполняют при плановой подготовке к беременности, для профилактики резус-конфликта и гемолитической болезни новорожденных.
Выявление индивидуальных особенностей в 6 генах системы гемостаза для оценки наличия факторов риска развития тромбоза и повышения уровня гомоцистеина (гены протромбина, фактора Лейдена и ферментов реакций фолатного цикла).
Фибриноген — генАнализ направлен на исследование полиморфизмов в гене β-полипептида фибриногена FGB, которые могут обуславливать увеличение риска развития тромбофилических состояний. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
ГипергомоцистеинемияВыявление изменений в основных генах ферментов фолатного цикла для оценки наличия склонности к гипергомоцистеинемии (рекомендовано оценивать в комплексе с иммунохимическим тестом на определение уровня гомоцистеина).
Гиперагрегация тромбоцитовИсследование полиморфизмов в генах интегрина альфа-2 и тромбоцитарного гликопротеина 1b проводят для выявления генетической предрасположенности к раннему развитию инфаркта миокарда, ишемического инсульта, тромбоэмболии, а также для оценки риска развития тромбозов. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
Исследование полиморфизмов в генах интегрина альфа-2 и тромбоцитарного гликопротеина 1b проводят для выявления генетической предрасположенности к раннему развитию инфаркта миокарда, ишемического инсульта, тромбоэмболии, а также для оценки риска развития тромбозов. Описание результатов врачом-генетиком не выдается.
Тромбоцитарный рецептор фибриногенаОпределение полиморфизмов в гене тромбоцитарного рецептора фибриногена (β3-интегрина) выполняют для выявления наследственной предрасположенности к тромбофилическим состояниям. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
Сердечно-сосудистые заболеванияВ процессе исследования выявляют генетические факторы риска развития артериальной гипертензии, атеросклероза, ишемической болезни сердца, инфаркта миокарда, ишемического инсульта.
Анализ полиморфизмов в генах ACE, AGT, NOS3 дает возможность обнаружить наследственные факторы риска развития артериальной гипертензии. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
Артериальная гипертензия, связанная с нарушениями в ренин-ангиотензиновой системеТест позволяет определить наличие генетических факторов риска развития артериальной гипертензии в результате сужения просвета сосудов и нарушения водно-солевого баланса, возникающих при наличии полиморфизмов в генах ACE, AGT. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
ИБС, инфаркт миокардаИсследование дает возможность выявить наследственные факторы риска развития тромбозов, артериальной гипертензии и атеросклероза путем анализа полиморфизмов в генах ACE, AGT, ApoE, NOS3, ITGB3, ITGA2. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
Тест используют при диагностике болезни Крона, для определения прогноза тяжести течения заболевания и риска развития осложнений. Также исследование применяют для дифференциальной диагностики болезни Крона с язвенным колитом и в качестве прогностического теста у родственников пациентов с болезнью Крона.
Поражения печени, гены ATP7B, PNPLA3, SERPINA1, ч.м.Исследование используется для дифференциальной диагностики генетических причин патологии печени — дефицита альфа-1-антитрипсина, болезни Вильсона-Коновалова, классического гемохроматоза и злокачественной формы неалкогольной жировой болезни печени
Анализ перестроек 1 хромосомы (FISH, колич.)Исследование показано для диагностики, определения прогноза течения заболевания, подбора адекватной терапии и мониторинга минимальной остаточной болезни пациентов с множественной миеломой.
Синдром множественной эндокринной неоплазии 2В типа относится к группе семейных опухолевых синдромов, ассоциированных со специфическими мутациями протоонкогена RET, которые выявляют в процессе исследования.
Синдром Жильбера, UGT1A1Генетическая диагностика синдрома Жильбера – неконъюгированной доброкачественной гипербилирубинемии – основана на исследовании возможных мутаций в промоторной области гена UGT1A1.
Остеопороз: полная панельИсследование проводят при наличии нарушений минерального обмена, а также при отягощенном семейном анамнезе по заболеваниям костной системы.
Остеопороз: сокращённая панельИсследование проводят при наличии нарушений минерального обмена, а также при отягощенном семейном анамнезе по заболеваниям костной системы.
Остеопороз: рецептор витамина DИсследование генетических факторов риска развития остеопороза проводят при отягощенном семейном анамнезе по заболеваниям костного аппарата, а также при наличии нарушений минерального обмена. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
Выявление индивидуальных особенностей в основных генах ферментов фолатного цикла для оценки наличия склонности к гипергомоцистеинемии (рекомендовано оценивать в комплексе с иммунохимическим тестом на определение уровня гомоцистеина).
Наследственный гемохроматоз, I тип. HFEВыявление 2 наиболее часто встречаемых мутаций в гене HFE для оценки риска развития гемохроматоза 1-го типа. Рекомендовано при выявлении повышения концентрации ферритина и % насыщения трансферрина железом в сыворотке крови.
Описание результатов генетического теста 2 категории сложности (№№ 118ГП/БЗ, 121ГП/БЗ, 123ГП/БЗ, 131ГП/БЗ, 141ГП/БЗ, 149ГП/БЗ, 150ГП/БЗ, 115ГП/БЗ, 152ГП/БЗ, 124ГП/БЗ, 154ГП/БЗ)Исследование включает описание врачом-генетиком результатов генетических анализов, которые относятся ко второй категории сложности.
Исследование включает описание врачом-генетиком результатов генетических анализов, которые относятся к третьей категории сложности.
Гидралазин и прокаинамидТест включает проведение анализа полиморфизмов в гене NAT-2, который указывает на наличие наследственных факторов повышенного риска развития волчаночноподобного синдрома и гепатотоксичности при приеме кардиотропных препаратов.
ИзониазидТест включает проведение анализа полиморфизмов в гене NAT-2, который указывает на наличие наследственных факторов повышенного риска развития полиневритов при приеме изониазида, связанных с нарушением его метаболизма.
Ингибиторы АПФ, флувастатин, блокаторы рецепторов АТIIАнализ полиморфизмов в гене ACE необходим для прогнозирования нефропротективного эффекта ингибиторов ангиотензин-превращающего фермента (АПФ) – физиологического регулятора артериального давления и водно-солевого обмена при недиабетических заболеваниях.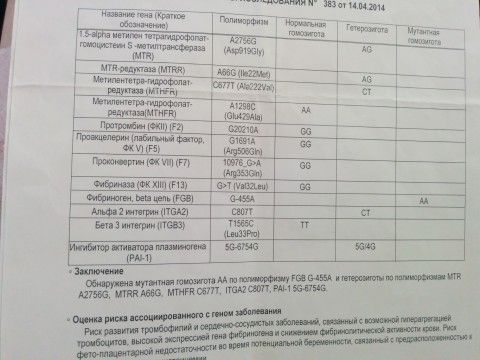 Посредством исследования можно определить генетические маркеры эффективности атенолола при артериальной гипертензии с гипертрофией левого желудочка или флувастатина при ишемической болезни сердца.
Посредством исследования можно определить генетические маркеры эффективности атенолола при артериальной гипертензии с гипертрофией левого желудочка или флувастатина при ишемической болезни сердца.
В процессе исследования проводится анализ полиморфизмов в гене CYP2C9, который выступает генетическим маркером риска нарушений метаболизма блокаторов рецепторов ангиотензина II.
МетотрексатВыявление изменений в основных генах ферментов фолатного цикла для оценки вероятности развития побочных реакций при приеме метотрексата.
Нестероидные противовоспалительные препаратыАнализ полиморфизмов в гене CYP2C9 выполняют с целью выявления наследственных факторов развития побочных реакций по типу желудочных кровотечений при приеме нестероидных противовоспалительных препаратов (НПВП).
ПеницилламинПеницилламин представляет собой лекарственный препарат из группы детоксицирующих средств. Некоторые варианты полиморфизмов в генах системы детоксикации ксенобиотиков и канцерогенов ассоциированы с усилением клинической эффективности этого препарата.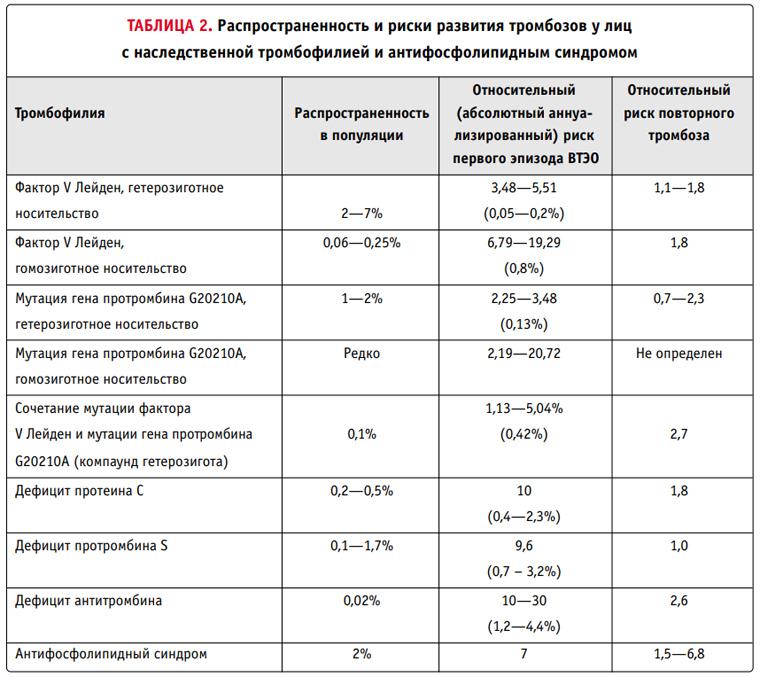 Исследование направлено на выявление генетических маркеров, потенцирующих клиническую эффективность при применении пеницилламина.
Исследование направлено на выявление генетических маркеров, потенцирующих клиническую эффективность при применении пеницилламина.
Тест включает проведение анализа полиморфизмов в гене NAT-2, который указывает на наличие наследственных факторов повышенного риска развития побочных реакций в форме диспепсий и желудочных кровотечений при приеме сульфасалазина, связанных с нарушением его метаболизма.
Бета-адреноблокаторы. Ген CYP2D6. Фармакогенетика.Цитохром CYP2D6 участвует в метаболизме лекарственных препаратов (β-адреноблокаторов, антиаритмиков, аналептиков, антидепрессантов и наркотических анальгетиков), применяемых при лечении ряда сердечно-сосудистых заболеваний и психических расстройств. Исследование полиморфизмов в гене CYP2D6 позволяет выявить людей со сниженной активностью CYP2D6, поскольку таким пациентам необходимо индивидуально подбирать более низкие дозы препаратов.
ГлутатионтрансферазыВыявление генетических факторов нарушения системы детоксикации (2-я фаза биотрансформации).
Анализ полиморфизмов в гене NAT-2 позволяет обнаружить наследственные факторы нарушения системы детоксикации. От активности фермента N-ацетилтрансферазы зависит эффективность выведения из организма токсинов, лекарственных препаратов и канцерогенов, что определяет больший или меньший риск различных заболеваний.
Цитохром СYP2D6: ген СYP2D6Тест целесообразно проводить перед плановым назначением антигипертензивных, антиаритмических, психотропных препаратов, а также при длительном их приеме.
Цитохром CYP2C9Анализ наличия полиморфизмов в гене цитохрома Р450 проводят для выявления наследственных факторов нарушения детоксикации. CYP2C9 участвует в метаболизме лекарственных средств. При снижении активности цитохрома CYP2C9 метаболизм препаратов замедляется, в результате чего происходит увеличение их концентрации в крови, что может быть причиной развития нежелательных реакций.
Сдать анализ крови на тромбофилию в Москве: доступные цены.

Тромбофилия – это патологическое состояние, при котором кровь имеет склонность к повышенной свертываемости и образованию тромбов. Это, в свою очередь, грозит серьезными последствиями для здоровья, а в некоторых случаях – для жизни человека.
Поэтому очень важно вовремя обнаружить это состояние и принять меры.
Методы выявления тромбофилии
Диагностика достаточно проста. Для этого Вам необходимо прийти в лабораторию Международного медицинского центра ОН КЛИНИК и сдать кровь из вены.
Самый простой способ выявления патологии – пройти инновационный тест «тромбодинамика». Исследование не только дает информацию об уже имеющемся заболевании, но и прогнозирует риски развития болезни в Вашем случае.
Кроме того, для выявления приобретенного недуга в лаборатории проведут следующие исследования:
- Общеклинический анализ крови
Для определения уровня эритроцитов и тромбоцитов, чей уровень может быть повышен.
- Биохимический анализ крови
Гемостазиограмма или куалограмма – тесты на определение состояния свертываемости крови.
Д-димер – это вещество-показатель активности тромбообразования и разрушения тромбов.
Определение уровня гомоцистеина – увеличение концентрации этого вещества может говорить об усилении тромбообразования.
- Генетический анализ крови
Международный медицинский центр ОН КЛИНИК предлагает пациентам пройти «Тромбоген» – расширенный генетический анализ и диагностику связанных сердечно-сосудистых заболеваний. Он необходим, если болезнь наследственная, а не приобретенная.
В каком случае необходимо сдать анализ?
- Есть нарушения в свертывающей системе по результатам гемостазиограммы и биохимического исследования крови;
- Наблюдаются клинические проявления сердечно-сосудистых заболеваний (при отсутствии жалоб): сосудистые звездочки на коже, варикозные расширения вен;
- Есть жалобы на боли в ногах, отеки нижних конечностей, боли в области сердца, частые головные боли, при нарушении зрения, при заболеваниях почек;
- Есть беременность, особенно при тяжело протекавших предыдущих разах, сопровождавшихся угрозой выкидыша;
- Если у родственников пациента в анамнезе отмечались инсульты и инфаркты.

Специалисты нашего центра обязательно объяснят Вам, что означает каждый из полученных показателей, есть ли риски развития заболеваний и как их избежать.
Лабораторные исследования в ОН КЛИНИК – это всегда оперативное получение точных результатов.
Доверяйте здоровье профессионалам! ОН КЛИНИК
сдать анализ в лаборатории KDLmed
Тромбофилия – это наследственно обусловленная или приобретенная предрасположенность к формированию тромбов (кровяных сгустков) в просвете кровеносных сосудов. Тромбофилия не является заболеванием как таковым, а представляет собой состояние, которое в сочетании с факторами риска увеличивает вероятность возникновения тромбов в несколько раз.
Проявления тромбофилии связаны с образованием тромбов в венах и/или артериях, которые нарушают работу внутренних органов и представляют серьезную опасность для здоровья и жизни пациента. Однако многие люди с тромбофилией не испытывают в течение жизни никаких негативных последствий этого состояния.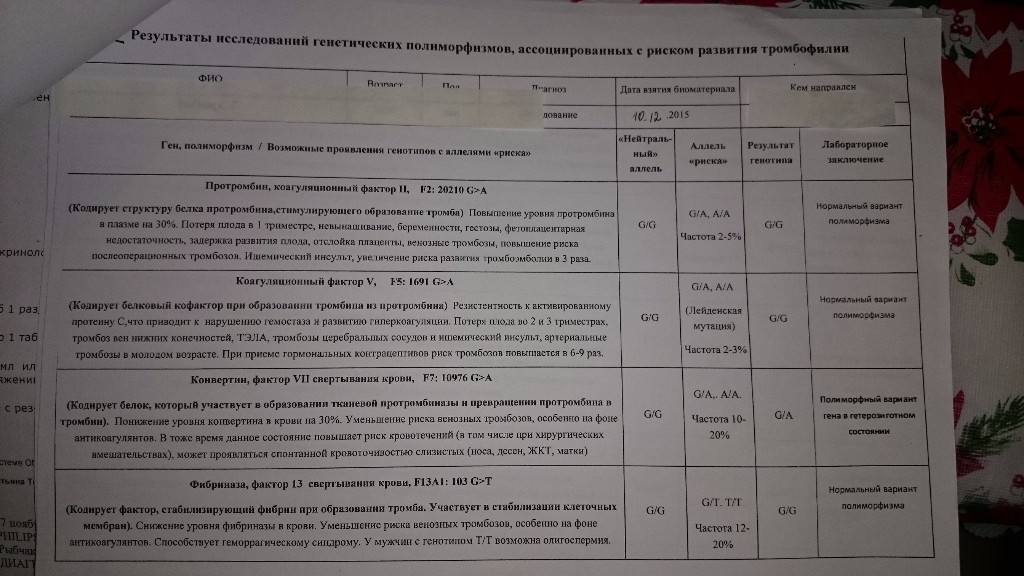
Специфическое лечение тромбофилии отсутствует. Вопрос необходимости использования профилактической терапии, направленной на предотвращение формирования тромбов, решается индивидуально для каждого пациента. При высоком риске тромбоза профилактическое лечение позволяет предотвратить ряд тяжелых осложнений.
Прогноз тромбофилии зависит от ее типа, наличия и тяжести предшествующих случаев тромбоза, сопутствующих заболеваний.
Синонимы русские
Первичная тромбофилия, наследственная тромбофилия, врожденная тромбофилия, вторичная тромбофилия, приобретенная тромбофилия.
Синонимы английские
Hypercoagulability, coagulability, hypercoagulable state, hereditary thrombophilia, familial thrombophilia, primary thrombophilia, acquired thrombophilia, secondary thrombophilia.
Тромбофилия – это наследственно обусловленная или приобретенная предрасположенность к формированию тромбов (кровяных сгустков) в просвете кровеносных сосудов. Тромбофилия не является заболеванием как таковым, а представляет собой состояние, которое в сочетании с факторами риска увеличивает вероятность возникновения тромбов в несколько раз.
Тромбофилия не является заболеванием как таковым, а представляет собой состояние, которое в сочетании с факторами риска увеличивает вероятность возникновения тромбов в несколько раз.
Проявления тромбофилии связаны с образованием тромбов в венах и/или артериях, которые нарушают работу внутренних органов и представляют серьезную опасность для здоровья и жизни пациента. Однако многие люди с тромбофилией не испытывают в течение жизни никаких негативных последствий этого состояния.
Специфическое лечение тромбофилии отсутствует. Вопрос необходимости использования профилактической терапии, направленной на предотвращение формирования тромбов, решается индивидуально для каждого пациента. При высоком риске тромбоза профилактическое лечение позволяет предотвратить ряд тяжелых осложнений.
Прогноз тромбофилии зависит от ее типа, наличия и тяжести предшествующих случаев тромбоза, сопутствующих заболеваний.
Симптомы
Большинство пациентов не знают о наличии у них тромбофилии до тех пор, пока не возникнет тромбоз или другие нарушения свертывания крови. Чаще всего при появлении тромба появляются следующие симптомы:
Чаще всего при появлении тромба появляются следующие симптомы:
- Отек, покраснение, болезненность, онемение голеней и стоп
- Одышка
- Затруднение дыхания
- Кашель с кровью
- Боль в груди при глубоком вдохе
- Учащенное сердцебиение
- Повторяющиеся выкидыши и другие нарушения течения беременности
Общая информация о заболевании
Тромбофилия представляет собой состояние, при котором сгустки в крови образуются легче, чем в норме. Это происходит за счет изменения соотношения свертывающих и противосвертывающих факторов.
Нормальный процесс свертывания крови необходим для предотвращения кровотечений и заключается в формировании сгустков, которые закупоривают поврежденный сосуд. Процесс формирования сгустка происходит за счет взаимодействия ряда активных веществ – так называемых факторов свертывания. Существуют и противосвертывающие факторы, необходимые для предотвращения избыточного свертывания крови.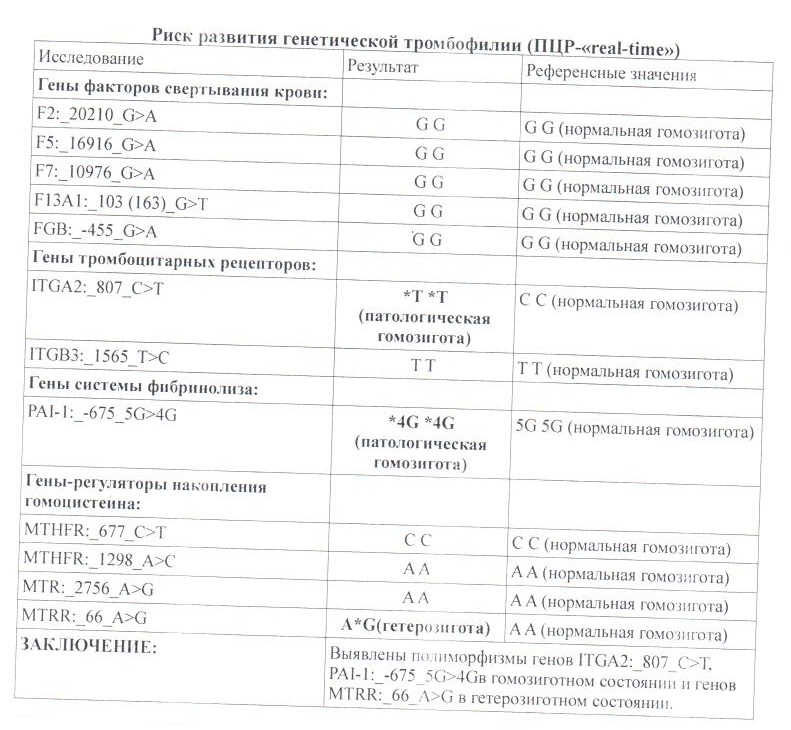 При тромбофилии баланс этих веществ нарушен – либо повышается количество факторов свертывания, либо снижается количество противосвертывающих веществ. Это может привести к формированию тромбов – сгустков в просвете сосудов (вен или артерий), которые могут закупоривать просвет сосуда, нарушая таким образом кровоснабжение органов и тканей.
При тромбофилии баланс этих веществ нарушен – либо повышается количество факторов свертывания, либо снижается количество противосвертывающих веществ. Это может привести к формированию тромбов – сгустков в просвете сосудов (вен или артерий), которые могут закупоривать просвет сосуда, нарушая таким образом кровоснабжение органов и тканей.
Тромбофилии делят на:
- Врожденные (наследственные, первичные). Это тромбофилии, которые обусловлены наличием аномалий в генах, содержащих информацию о белках, участвующих в свертывании крови. Чаще всего встречается дефицит антитротромбина III, протеинов C и S, аномалия фактора V (мутация Лейден), аномалия протромбина G 202110А.
- Дефицит антитромбина III. При этом заболевании нарушен синтез антитромбина III. Является одним из самых распространенных заболеваний среди всех наследственных нарушений свертывания крови. Имеет аутосомно-доминантный тип наследования. Это значит, что передача дефектного гена от родителей к детям происходит независимо от пола, и при наличии хотя бы одного дефектного гена из двух у человека возникнет тромбофилия.
 Однако ген имеет частичную пенетрантность (проявление), то есть даже при наличии у человека дефектного гена вероятность возникновения тромбоза может быть разной. Антитромбин III – важнейший компонент противосвертывающей системы. Он образует соединения с тромбином, что приводит к их взаимной инактивации. Тромбин – это белок, который участвует в образовании тромба, стимулирует тромбоциты и клетки сосудистой стенки.
Однако ген имеет частичную пенетрантность (проявление), то есть даже при наличии у человека дефектного гена вероятность возникновения тромбоза может быть разной. Антитромбин III – важнейший компонент противосвертывающей системы. Он образует соединения с тромбином, что приводит к их взаимной инактивации. Тромбин – это белок, который участвует в образовании тромба, стимулирует тромбоциты и клетки сосудистой стенки. - Дефицит протеинов С и S. Протеин С – это белок, который синтезируется в печени. Он активируется тромбином и при взаимодействии с другим важным компонентом крови – протеином S – ограничивает процесс тромбообразования за счет разрушения факторов свертывания V и VIII и прекращения образования фибрина. Таким образом, протеины С и S регулируют интенсивность свертывающей системы крови. Их дефицит приводит к избыточному тромбообразованию.
- Аномалия фактора V (мутация Лейден). При этом заболевании появляется дефект в гене, несущем информацию о пятом факторе свертывания крови.
 В результате фактор V становится устойчивым к разрушающему действию протеина C. Фактор V является фактором свертывания и участвует в образовании тромбина. При увеличении его количества риск возникновения тромбов повышается.
В результате фактор V становится устойчивым к разрушающему действию протеина C. Фактор V является фактором свертывания и участвует в образовании тромбина. При увеличении его количества риск возникновения тромбов повышается. - Аномалия протромбина. При этом заболевании увеличивается синтез протромбина – предшественника тромбина. В результате активность свертывающей системы крови увеличивается. При подобном нарушении синтеза протромбина часто встречаются не только венозные тромбозы, но и тромбы в артериях сердца и головного мозга, что может привести к инфарктам и инсультам у людей моложе 50 лет.
- Приобретенные. К ним относятся тромбофилии, которые возникли в результате других заболеваний или приема лекарственных препаратов.
- Антифосфолипидный синдром. Это состояние, при котором в организме образуется избыточное количество белков (антител), которые разрушают фосфолипиды – важные компоненты мембраны нервных клеток, тромбоцитов и клеток стенки сосудов.
 В результате разрушения этих клеток выделяются активные вещества, которые нарушают нормальное взаимодействие свертывающей и противосвертывающей систем крови. В результате возникает повышенная свертываемость и склонность к образованию тромбов. Большое количество антител к фосфолипидам о
В результате разрушения этих клеток выделяются активные вещества, которые нарушают нормальное взаимодействие свертывающей и противосвертывающей систем крови. В результате возникает повышенная свертываемость и склонность к образованию тромбов. Большое количество антител к фосфолипидам о
Генетика тромбофилии
Комплексный генетический анализ, который позволяет определить риск тромбофилии. Он представляет собой молекулярно-генетическое исследование генов факторов свертываемости крови, тромбоцитарных рецепторов, фибринолиза изменение активности которых напрямую или опосредованно обуславливает склонность к повышенному тромбообразованию.
Какой биоматериал можно использовать для исследования?
Буккальный (щечный) эпителий, венозную кровь.
Как правильно подготовиться к исследованию?
Подготовки не требуется.
Подробнее об исследовании
В результате различных патологических процессов в сосудах могут образоваться тромбы, которые блокируют кровоток.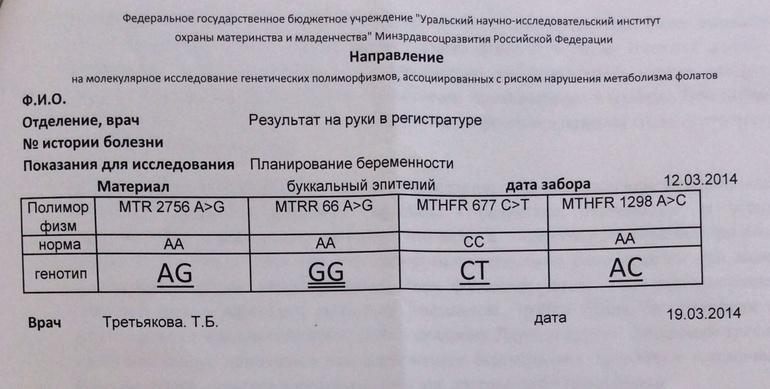 Это самое частое и неблагоприятное проявление наследственной тромбофилии – повышенной склонности к тромбообразованию, связанной с определенными генетическими дефектами. Она может приводить к развитию артериальных и венозных тромбозов, которые в свою очередь зачастую являются причиной инфаркта миокарда, ишемической болезни сердца, инсульта, тромбоэмболии легочной артерии и др.
Это самое частое и неблагоприятное проявление наследственной тромбофилии – повышенной склонности к тромбообразованию, связанной с определенными генетическими дефектами. Она может приводить к развитию артериальных и венозных тромбозов, которые в свою очередь зачастую являются причиной инфаркта миокарда, ишемической болезни сердца, инсульта, тромбоэмболии легочной артерии и др.
Генетический анализ позволяет выявить полиморфизмы генов факторов и компонентов системы гемостаза, которые приводят к их аномальному синтезу или нарушению функциональной активности. Это позволяет оценить риски развития сердечно-сосудистой патологии и акушерско-гинекологических осложнений, тромбоэмболии, венозных и артериальных тромбозов. Скрининг генетических особенностей тромбофилий помогает на раннем этапе выявить группу риска и внести соответствующие коррективы в тактику ведения пациентов.
Данный тест даёт возможность выявить риск развития заболеваний, обусловленных полиморфизмом генов следующих факторов и компонентов системы гемостаза:
F2-протромбин (фактор II свертывания крови).
Ген протромбина кодирует белок (протромбин), который является одним из главных факторов системы свертывания. Повышение уровня протромбина в плазме на 30%. Потеря плода в I триместре, невынашивание беременности, фетоплацентарная недостаточность, гестозы, задержка развития плода, отслойка плаценты. Венозные тромбозы, повышение риска послеоперационной смерти. Ишемический инсульт, увеличение риска развития тромбоэмболии в 3 раза.
F5 (фактор V свертывания крови).
Резистентность к активированному протеину C. Потеря плода во II и III триместрах, тромбоз вен нижних конечностей, ТЭЛА, тромбозы церебральных сосудов и ишемический инсульт, артериальные тромбозы в молодом возрасте. При приеме гормональных контрацептивов риск тромбозов повышается в 6-9 раз.
F7 (фактор VII свертывания крови).
Понижение уровня фактора VII в. крови на 30%. Двухкратное снижение риска инфаркта миокарда. У новорожденных — геморрагический диатез, кровотечение из пупочной ранки, слизистой оболочки носа, желудочно-кишечного тракта.
F13A1 (фактор XIII свертывания крови).
Снижение уровня фактора XIII в. крови. Уменьшение риска венозного тромбоза. Повышенный риск на фоне антикоагулянтной терапии. Геморрагический синдром, олигоспермия у гомозиготных мужчин, гемартрозы.
FGB — фибриноген (фактор I свертывания крови).
Повышение уровня фибриногена в крови на 10-30%. Повышенный в 2,6 раза риск инсульта с многоочаговостью поражений. Привычное невынашивание беременности, фетоплацентарная недостаточность, гипоксия плода.
Серпин 1 (PAI-1) — антагонист тканевого активатора плазминогена. Повышение уровня PAI-1 в крови, снижение фибринолитической активности крови. Привычное невынашивание беременности, увеличение риска развития тяжелого гестоза в 2–4 раза. Гипоксия, задержка развития и внутриутробная смерть плода. Повышение риска коронарных нарушений в 1,3 раза.
ITGA2-α2 интегрин (тромбоцитарный рецептор к коллагену). Ген ITGA2 кодирует аминокислотную последовательность α2-субъединицы интегринов — специализированных рецепторов тромбоцитов, за счет которых происходит взаимодействие тромбоцитов с тканевыми белками, обнажаемыми при повреждении стенки сосудов. Благодаря интегринам, тромбоциты образуют монослой в области поврежденных тканей, что является необходимым условием включения последующих звеньев свертывающей системы крови, предохраняющей организм от кровопотери.
Благодаря интегринам, тромбоциты образуют монослой в области поврежденных тканей, что является необходимым условием включения последующих звеньев свертывающей системы крови, предохраняющей организм от кровопотери.
Полиморфизм гена ITGA2 связан с заменой нуклеотида цитозина С на тимин (Т), что приводит к замене аминокислоты в пептидной цепи молекулы α2-субъединицы интегринов. Изменение первичной структуры субъединицы вызывает изменение свойств рецепторов. В случае варианта Т полиморфизма C > T отмечается увеличение скорости адгезии тромбоцитов, что может приводить к повышенному риску тромбофилии. Имеющиеся данные позволяют рассматривать вариант Т как маркер повышенного риска инфаркта миокарда (в 2,8 раза), ишемического инсульта, повышенного риска послеоперационных тромбозов. Развитие тромбоэмболических заболеваний, постангиопластические тромбозы.
ITGB3-b интегрин (тромбоцитарный рецептор фибриногена). Ген ITGB3 кодирует аминокислотную последовательность белковой молекулы тромбоцитарного рецептора фибриногена. Данный рецептор обеспечивает взаимодействие тромбоцитов с фибриногеном плазмы крови, в результате чего происходит агрегация тромбоцитов и образование тромба.
Данный рецептор обеспечивает взаимодействие тромбоцитов с фибриногеном плазмы крови, в результате чего происходит агрегация тромбоцитов и образование тромба.
Полиморфизм c.176T > C связан с заменой нуклеотида тимина (Т) на цитозин С в участке ДНК, кодирующем аминокислотную последовательность белковой молекулы тромбоцитарного рецептора фибриногена. Вследствие нуклеотидной замены происходит замена аминокислоты в белковой цепи рецептора, что приводит к изменению его свойств. В случае варианта С полиморфизма тромбоциты приобретают повышенную склонность к агрегации, поэтому носители этого варианта имеют повышенный риск тромбообразования с такими последствиями, как инфаркт миокарда, развитие острого коронарного синдрома, тромбоэмболия.
Посттрансфузионная тромбоцитопения. Повышенный риск потери плода на ранних сроках. В то же время, у пациентов с этим вариантом полиморфизма отмечается низкая эффективность применения в качестве антиагрегантов таких препаратов, как аспирин (ацетилсалициловая кислота) и плавикс.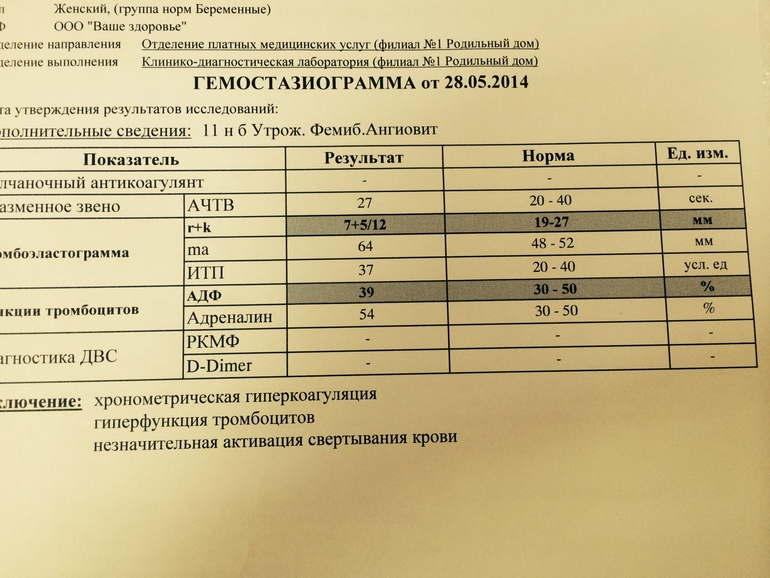
Что означают результаты?
По результатам комплексного исследования выдается заключение врача-генетика, которое позволит оценить риск тромбофилии, спрогнозировать развитие таких заболеваний как тромбоз, тромбоэмболия, инфаркт, или вероятность осложнений, связанных с нарушением гемостаза, при беременности, выбрать направления оптимальной профилактики, а при уже имеющихся клинических проявлениях детально разобраться в их причинах.
Проведение генетического анализа на тромбофилию
Миклухо-Маклая Россия,Москва +7 495 735 88 99 +7 495 134 25 26
Ленинский проспект Россия,Москва +7 495 735 88 77 +7 495 134 25 26
Тромбофилия — склонность к образованию венозных тромбов — очень опасная патология сердечно-сосудистой системы. Заболевание часто протекает бессимптомно, а среди его опасных последствий — привычное невынашивание беременности, инфаркт, тромбоэмболия легочных артерий, инсульт.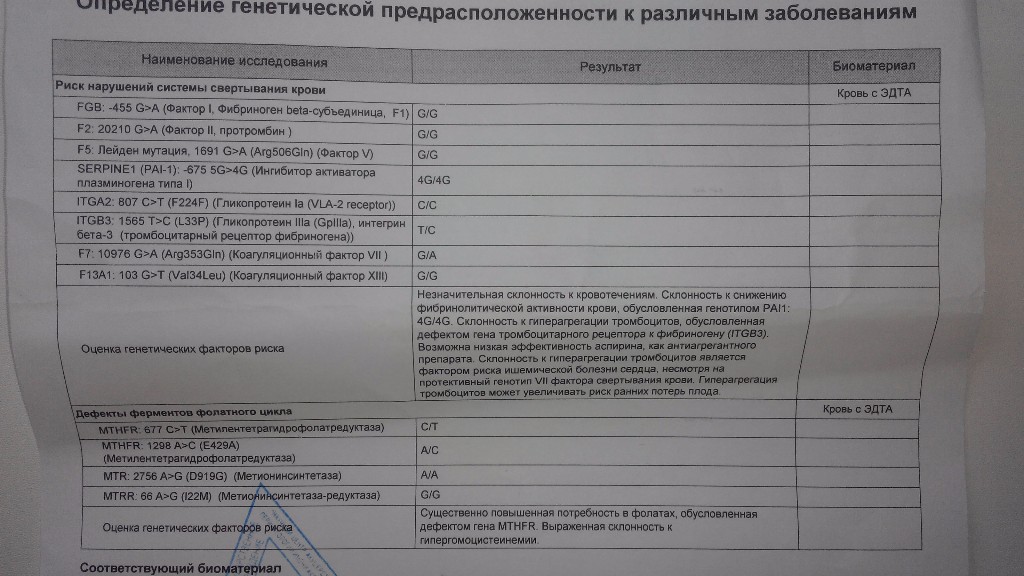
Нарушения свертываемости крови, из-за которых образуются тромбы, могут быть врожденными или приобретенными. У большинства пациентов они связаны с наследственными мутациями. Если у Вас есть родственники с патологиями сердечно-сосудистой системы, рекомендуем сдать генетический анализ на тромбофилию. Тест достаточно пройти один раз в жизни, так как наследственная информация не изменяется с рождения. По его результатам врач-генетик оценит риск образования тромбов, разработает индивидуальную программу профилактики. При соблюдении рекомендаций врача Вы сможете избежать развития опасного заболевания.
Чтобы пройти генетическое исследование на тромбофилию, необходимо сдать кровь из вены. Через несколько дней Вы получите на руки расшифровку генетического профиля, в которой будут указаны выявленные полиморфизмы генов. Для интерпретации результатов обратитесь к специалисту.
В нашей лаборатории можно сдать генетический анализ на тромбофилию, включающий основные полиморфизмы генов, или пройти исследование на определенные показатели — лейденскую мутацию, ген тромбоцитарного рецептора и др.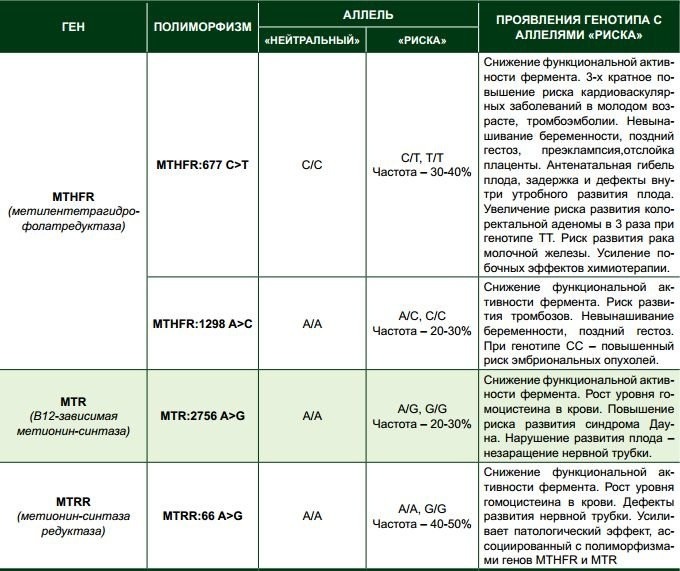 Программу лабораторной диагностики составят гематолог или генетик на предварительной консультации.
Программу лабораторной диагностики составят гематолог или генетик на предварительной консультации.
Чтобы сдать анализы на Ленинском проспекте, нужно предварительно записаться на прием. Выбрать время визита и уточнить порядок подготовки к исследованию можно у наших администраторов по телефону.
Что такое тромбофилия?
Если вы порежете палец или ушибете ногу, ваше тело остановит кровотечение. Клетки крови, называемые тромбоцитами, и белки крови, называемые факторами свертывания, работают вместе, образуя сгусток. Как только кровотечение прекращается, сгусток растворяется.
Но у некоторых людей может быть состояние, называемое тромбофилией, которое делает их склонными к образованию тромбов даже без травм. Это также называется гиперкоагуляцией. Это может произойти, если ваше тело вырабатывает слишком много белка свертывания.Это также может произойти, если вы не вырабатываете достаточно белков, задача которых — остановить процесс свертывания крови. В некоторых случаях белки в сгустке могут не растворяться даже после того, как они больше не нужны. В других случаях ваше тело вырабатывает белки, которые повреждают стенки кровеносных сосудов.
В некоторых случаях белки в сгустке могут не растворяться даже после того, как они больше не нужны. В других случаях ваше тело вырабатывает белки, которые повреждают стенки кровеносных сосудов.
Тромбофилия может блокировать кровеносные сосуды и перекрывать доступ кислорода к тканям или органам. Это может привести к таким состояниям, как тромбоз глубоких вен (ТГВ), тромб в ноге и тромбоэмболия легочной артерии (тромб в легких). Это также может вызвать сердечный приступ или инсульт.
Причины
Существует два основных типа тромбофилии:
Унаследованная тромбофилия. Это означает, что вы родились с этим заболеванием. Один или оба ваших родителя передали дефектный ген или гены.
Унаследованная тромбофилия бывает нескольких форм. Наиболее распространенными являются лейденская мутация фактора V, которую имеет 1 из 20 человек европейского происхождения, и мутация гена протромбина G20210A или мутация фактора II, которая встречается у 2% населения.
Приобретенная тромбофилия. Это когда ваша печень, почка или другой орган не вырабатывает или не удаляет свертывающиеся белки должным образом. Это часто случается после постельного режима после операции или из-за серьезного заболевания, например рака. Синдром антифосфолипидных антител — наиболее частая приобретенная тромбофилия. Это аутоиммунное заболевание, которое может повысить ваши шансы на осложнения беременности и выкидыш.
Симптомы
Вы можете не знать, что у вас тромбофилия, пока не получите аномальный тромб.Но это может случиться не очень часто. Признаки этого заболевания включают неожиданное ТГВ или проблемы со сгустками крови в необычной части тела, особенно если вы молоды и у вас нет явных проблем со здоровьем.
Факторы риска
Если у вас аутоиммунное заболевание, такое как волчанка, оно может повысить вероятность заражения тромбофилией.
Тромбофилия — не единственная причина образования тромбов. Другие включают:
Диагноз
Ваш врач может проверить наличие тромбофилии с помощью анализов крови.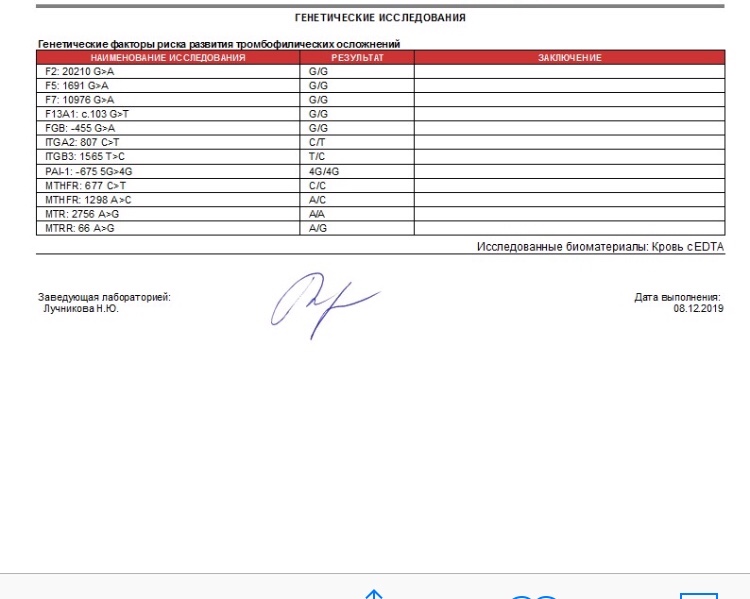 Они ищут аномальные гены и специфические антитела. Они измеряют уровень белков свертывания в крови.
Они ищут аномальные гены и специфические антитела. Они измеряют уровень белков свертывания в крови.
Ваш врач может порекомендовать пройти тестирование, чтобы принять решение о выборе лечения, например о том, какой тип разжижителя крови и как долго вам следует его принимать. Тест также может помочь выяснить, насколько вероятно, что у вас будет больше тромбов, и есть ли у членов вашей семьи тромбофилия.
Консультант-генетик может помочь вам понять, что результаты теста значат для вас и ваших близких.
Лечение
Лечение тромбофилии невозможно до тех пор, пока у вас не появится тромб. Что происходит дальше, зависит от того, где находится сгусток, его размера и других факторов.
Продолжение
Если у вас синдром тромбофилии в виде синдрома антифосфолипидных антител, вам может потребоваться длительное лечение препаратами для разжижения крови.
Если вы женщина, возможно, вам придется избегать некоторых форм гормональных противозачаточных средств, содержащих эстроген. Вместо этого вы можете принимать таблетки, содержащие только прогестин.Ваш врач также может порекомендовать воздержаться от заместительной гормональной терапии при симптомах менопаузы.
Вместо этого вы можете принимать таблетки, содержащие только прогестин.Ваш врач также может порекомендовать воздержаться от заместительной гормональной терапии при симптомах менопаузы.
Если у вас тромбофилия, вы можете снизить свои шансы на образование нежелательных тромбов, изменив образ жизни, в том числе:
Тромбофилия | Причины и лечение
Что такое тромбофилия?
Тромбофилия относится к группе состояний, при которых кровь свертывается легче, чем обычно. Это может привести к образованию нежелательных тромбов (так называемых тромбозов) внутри кровеносных сосудов.Эти сгустки крови могут вызывать такие проблемы, как тромбоз глубоких вен (ТГВ) или тромбоэмболия легочной артерии. Дополнительные сведения см. В отдельных брошюрах «Тромбоз глубоких вен и эмболия легочной артерии».
Что вызывает тромбофилию?
В организме происходит естественный процесс свертывания крови, который изменяется при тромбофилии.
Нормальный процесс свертывания крови называется гемостазом. Это помогает остановить кровотечение, если у вас есть травма, например порез. При травме кровеносного сосуда запускается процесс свертывания крови.Это называется каскадом свертывания. Это цепная реакция различных химических веществ в крови, которые называются факторами свертывания крови. Каскад свертывания крови заставляет кровь превращаться в сгусток, который прилипает к поврежденной части кровеносного сосуда. Маленькие частицы в крови, называемые тромбоцитами, также способствуют образованию сгустка.
Это помогает остановить кровотечение, если у вас есть травма, например порез. При травме кровеносного сосуда запускается процесс свертывания крови.Это называется каскадом свертывания. Это цепная реакция различных химических веществ в крови, которые называются факторами свертывания крови. Каскад свертывания крови заставляет кровь превращаться в сгусток, который прилипает к поврежденной части кровеносного сосуда. Маленькие частицы в крови, называемые тромбоцитами, также способствуют образованию сгустка.
В крови также содержатся природные химические вещества, которые действуют против системы свертывания, препятствуя слишком сильному свертыванию крови.
Тромбофилия возникает, если нарушен нормальный баланс системы свертывания крови.Может быть слишком много фактора свертывания или слишком мало вещества, препятствующего свертыванию.
Тромбофилия может вызвать нежелательные тромбы (тромбозы). Это не означает, что у каждого человека с тромбофилией образуется тромб. Но это означает, что у вас более высокий риск образования тромбов, чем обычно.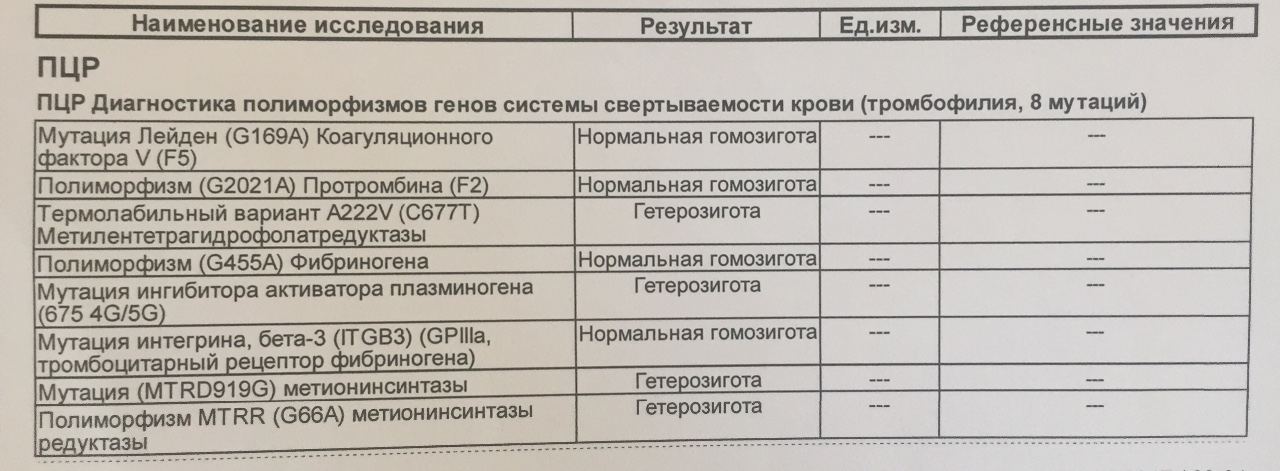 Дополнительный риск будет зависеть от типа вашей тромбофилии.
Дополнительный риск будет зависеть от типа вашей тромбофилии.
Что такое тромбоз?
Сгусток крови, образующийся внутри кровеносного сосуда, в медицине известен как тромб .Тромбоз — это процесс, при котором образуется тромб. Тромб может заблокировать кровеносный сосуд — эта закупорка теперь также известна как тромбоз . Слово тромбозы — это множественная версия тромбоза (то есть более одного).
Какие бывают типы тромбофилии?
Тромбофилии можно разделить на наследственные и приобретенные. Унаследованные являются генетическими и могут передаваться от родителей к ребенку.
Приобретенные тромбофилии не передаются по наследству, то есть не имеют ничего общего с вашими генами.Обычно приобретенные тромбофилии проявляются в зрелом возрасте. Они могут возникнуть в результате других появившихся медицинских проблем или могут быть связаны с проблемами с иммунной системой.
Возможна смешанная тромбофилия, частично обусловленная генетическими, а частично негенетическими факторами.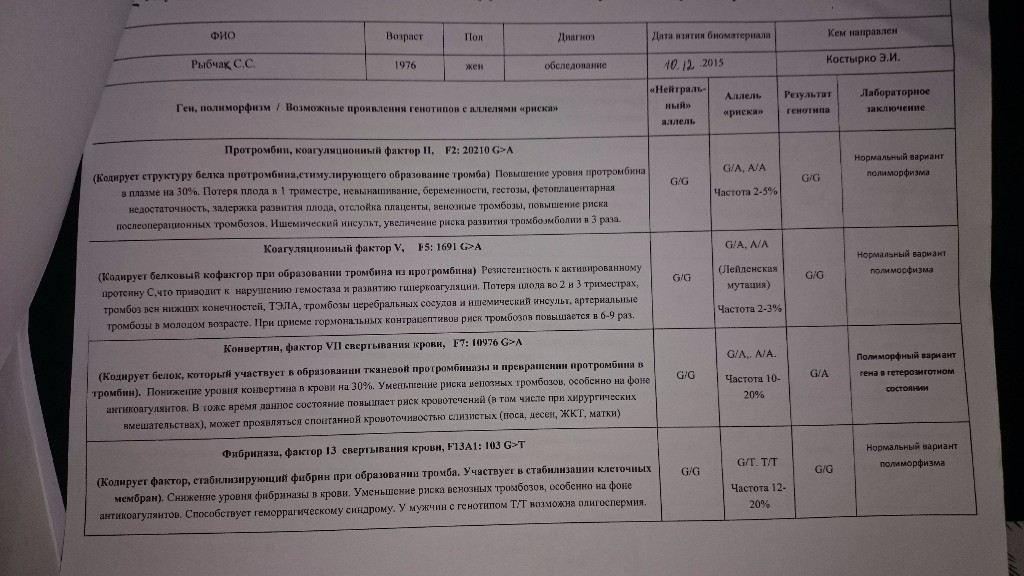
Более подробно различные типы тромбофилии описаны ниже в этой брошюре.
Каковы симптомы тромбофилии?
Нет никаких симптомов, если тромбофилия не приводит к образованию тромба (тромбозу) .
Многие люди с тромбофилией не образуют тромб и не имеют никаких симптомов.
Какие симптомы тромбов?
Тромбы могут образовываться в артериях и венах. Артерии — это кровеносные сосуды, которые отводят кровь от сердца к органам и тканям тела. Вены — это кровеносные сосуды, по которым кровь возвращается к сердцу от остального тела.
Сгусток крови в вене является наиболее частой проблемой при тромбофилии — это называется венозным тромбозом .Возможные симптомы:
- Боль и припухлость в ноге. Это происходит, если у вас есть тромб в большой вене на ноге. Это обычно известно как тромбоз глубоких вен (ТГВ). ТГВ может возникнуть в любой вене вашего тела, но чаще всего поражает вену ног.
- Тромб может попасть в сердце и в легкое, вызывая тромбоэмболию легочной артерии.
 Возможные симптомы: боль в груди, боль при глубоком дыхании, одышка или, в редких случаях, коллапс.
Возможные симптомы: боль в груди, боль при глубоком дыхании, одышка или, в редких случаях, коллапс. - Некоторые типы тромбофилии могут вызвать образование тромба в необычных местах, например в головном мозге, кишечнике или печени.Это может вызвать симптомы в голове или животе (животе). Сгусток крови в венах печени называется синдромом Бадда-Киари.
Сгусток крови в артерии может образоваться при некоторых типах тромбофилии. Это называется артериальным тромбозом . В зависимости от того, какая артерия поражена, сгусток крови в артерии может вызвать инсульт, сердечный приступ или проблемы с плацентой во время беременности. Итак, возможные симптомы артериального тромбоза, вызванного тромбофилией:
. Важно помнить, что все эти состояния могут быть вызваны не тромбофилией, а другими причинами.Например, курение, высокое кровяное давление, диабет и высокий уровень холестерина являются основными факторами риска развития таких проблем, как сердечный приступ и инсульт.
По этой причине не все пациенты с инсультом или сердечным приступом проходят тестирование на тромбофилию, поскольку это не частая причина.
Как диагностируется тромбофилия?
Тромбофилию можно заподозрить, если у кровного родственника был тромб в молодом возрасте (до 40 лет). Это также можно заподозрить, если у вас образуется тромб, чего нельзя было ожидать, учитывая ваш возраст и общее состояние здоровья.
Одним из наиболее важных моментов является то, что тестирование на тромбофилию не проводится регулярно всем, у кого есть тромб. Только определенные люди должны проходить эти тесты — результат изменит то, как к вам относятся. Тесты дорогие, и иногда неизвестно, как результат повлияет на ваши шансы в будущем получить тромб. Это может быть довольно сложно понять, но часто, если у вас только что образовался тромб, вам в любом случае будет назначено разжижающее кровь (антикоагулянтное) лечение.Это произойдет независимо от того, есть у вас тромбофилия или нет. Если у вас однажды был неспровоцированный тромб (то есть это произошло без очевидной причины), вы в любом случае будете классифицированы как имеющие более высокий риск образования тромба в будущем. Это произойдет независимо от того, положительный у вас тест на тромбофилию.
Если у вас однажды был неспровоцированный тромб (то есть это произошло без очевидной причины), вы в любом случае будете классифицированы как имеющие более высокий риск образования тромба в будущем. Это произойдет независимо от того, положительный у вас тест на тромбофилию.
Какие тесты на тромбофилию?
Тромбофилия диагностируется на основании анализа крови.
Анализы проводятся через несколько недель или месяцев после тромбоэмболии легочной артерии или тромбоэмболии легочной артерии, так как наличие этих состояний может повлиять на результаты.Обычно вам приходится ждать, пока вы не прекратите принимать разжижающие кровь лекарства (антикоагулянты), такие как варфарин, в течение 4-6 недель. Если вы недавно были беременны, анализы, возможно, придется отложить на восемь недель. Это связано с тем, что результаты беременности гораздо труднее понять.
Берется образец крови, и на нем будет проведен ряд различных анализов для проверки различных частей процесса свертывания. Обычно тесты проходят в два этапа. Первый тест — это скрининг на тромбофилию, который представляет собой несколько основных тестов на свертывание крови.Если результаты показывают, что возможна тромбофилия, будет взят еще один образец крови для более подробных анализов.
Обычно тесты проходят в два этапа. Первый тест — это скрининг на тромбофилию, который представляет собой несколько основных тестов на свертывание крови.Если результаты показывают, что возможна тромбофилия, будет взят еще один образец крови для более подробных анализов.
Вас могут направить к врачу, специализирующемуся на заболеваниях крови (гематологу). Врач обычно спрашивает о вашем анамнезе и семейном анамнезе. Это поможет интерпретировать результаты теста.
Все ли тромбофилии можно диагностировать с помощью анализов?
Вероятно, существуют некоторые виды тромбофилии, которые мы еще не можем идентифицировать или тестировать.Это связано с тем, что есть люди или семьи, у которых тромбов больше, чем обычно ожидается, но результаты тестов на тромбофилию отрицательны. В этой ситуации вам могут посоветовать лечение как от тромбофилии, даже если у вас нет точного диагноза.
Таким образом, отрицательные результаты анализов не исключают возможности наличия у вас унаследованного повышенного риска образования тромбов.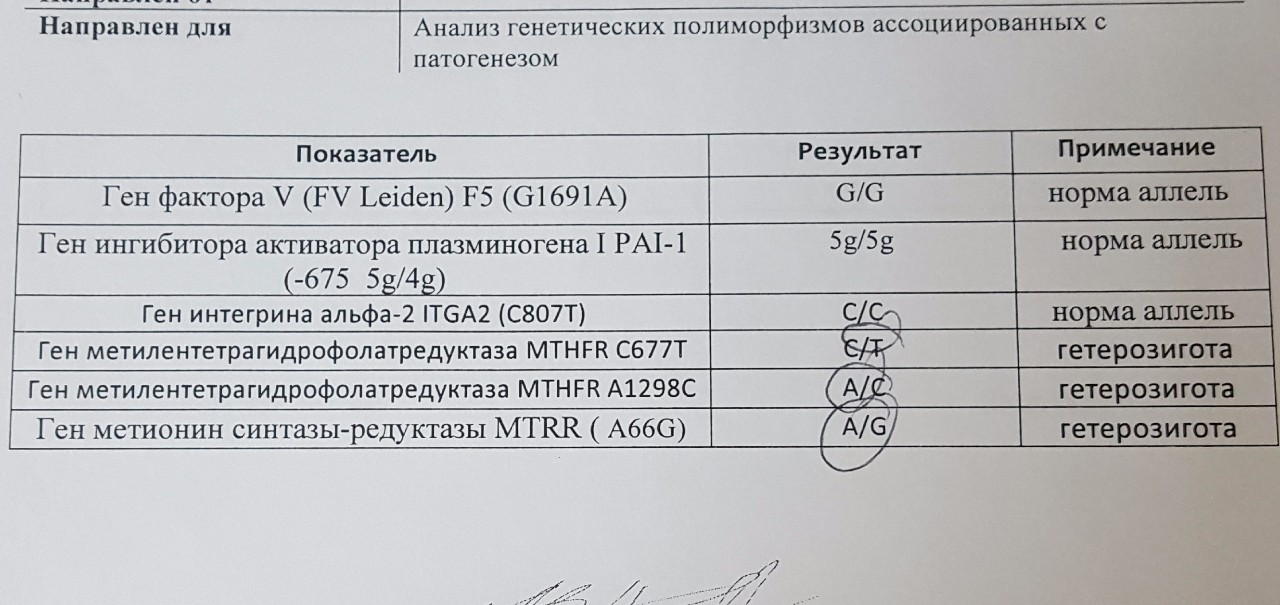
Кого следует обследовать на тромбофилию?
Текущие рекомендации предполагают, что тестирование на тромбофилию следует рассматривать в следующих ситуациях:
- Если у вас венозный тромбоз или тромбоэмболия легочной артерии в возрасте до 40 лет.
- Если у вас повторялись эпизоды венозного тромбоза, тромбоэмболии легочной артерии или воспаленных вен (тромбофлебит).
- Если у вас венозный тромбоз в необычном месте — например, в животе (животе) или головном мозге — при некоторых обстоятельствах, так как они могут быть вызваны другими состояниями.
- Необъяснимые тромбозы у новорожденных.
- Младенцы или дети с редким заболеванием, называемым молниеносной пурпурой.
- Если у вас развивается некроз кожи, при котором участки кожи теряются из-за образования тромбов внутри или под кожей, из-за таких лекарств, как варфарин.
- Если у вас артериальный тромбоз в возрасте до 40 лет.
- Если вы являетесь кровным родственником человека с определенными типами тромбофилии высокого риска, такими как дефицит протеина C и протеина S в некоторых случаях.

- Некоторые беременные, у которых в прошлом был тромбоз из-за легкого провоцирующего фактора. (Тем не менее, беременная женщина с неспровоцированным тромбозом в анамнезе не нуждается в тестировании, так как ей все равно нужны разжижающие кровь препараты (антикоагулянты) во время беременности.)
- Если у вас есть семейная история венозных тромбозов как минимум у двух родственников.
- Если у вас есть определенные результаты анализа крови: необъяснимое пролонгированное активированное частичное тромбопластиновое время (АЧТВ) — ненормальный результат определенного типа теста на свертывание крови. Некоторые люди с другими заболеваниями (потому что они иногда могут быть связаны с тромбофилией):
- Повторяющийся выкидыш.
- Смерть плода.
- Идиопатическая тромбоцитопеническая пурпура (ИТП) — заболевание, поражающее тромбоциты крови.
- Системная красная волчанка (СКВ), также называемая волчанкой.
Даже если в семье есть известная тромбофилия, вы не можете пройти тест на нее, если она легкая и у вас не было тромба. Это потому, что у вас нет симптомов (у вас нет симптомов). Если вы знаете, есть ли у вас этот унаследованный дефект, это не изменит вашего отношения; вам, вероятно, не понадобятся антикоагулянты, потому что неизвестно, насколько увеличивается ваш риск аномального свертывания крови.Лечение антикоагулянтами должно быть тщательно оценено, так как их использование также сопряжено с определенными рисками, такими как кровотечение.
Это потому, что у вас нет симптомов (у вас нет симптомов). Если вы знаете, есть ли у вас этот унаследованный дефект, это не изменит вашего отношения; вам, вероятно, не понадобятся антикоагулянты, потому что неизвестно, насколько увеличивается ваш риск аномального свертывания крови.Лечение антикоагулянтами должно быть тщательно оценено, так как их использование также сопряжено с определенными рисками, такими как кровотечение.
Как лечить тромбофилию?
На первом этапе вы и ваш врач должны определить, насколько велик риск образования тромба. Этот риск зависит от сочетания факторов, например:
- Какой у вас тип тромбофилии (у некоторых риск образования тромбов выше, чем у других).
- Ваш возраст, вес, образ жизни и другие заболевания.
- Беременны ли вы или недавно родили.
- Был ли у вас тромб.
- Ваш семейный анамнез — были ли у близких родственников тромбы.
Эта информация поможет вашему врачу оценить, насколько у вас есть риск образования тромба и какой тип тромба может образоваться. Затем вы и ваш врач можете обсудить плюсы и минусы лечения и, при необходимости, какой тип лечения вам следует принять.
Затем вы и ваш врач можете обсудить плюсы и минусы лечения и, при необходимости, какой тип лечения вам следует принять.
Возможные методы лечения тромбофилии:
Аспирин в низких дозах
Аспирин в низких дозах подавляет действие тромбоцитов, поэтому может помочь предотвратить образование тромбов.Это также может помочь предотвратить выкидыш или проблемы с беременностью при некоторых типах тромбофилии.
Лечение антикоагулянтами
Антикоагулянты часто называют «разжижением» крови. Однако на самом деле он не разжижает кровь. Он изменяет определенные химические вещества в крови, чтобы предотвратить легкое образование тромбов — по сути, он замедляет процесс свертывания. Он также не растворяет тромб (как некоторые ошибочно думают). Затем собственные механизмы исцеления организма могут работать, чтобы разрушить любой существующий тромб.
Антикоагулянты могут значительно снизить вероятность образования тромба. Антикоагулянтные препараты обычно используются для лечения венозного тромбоза (например, ТГВ) или тромбоэмболии легочной артерии.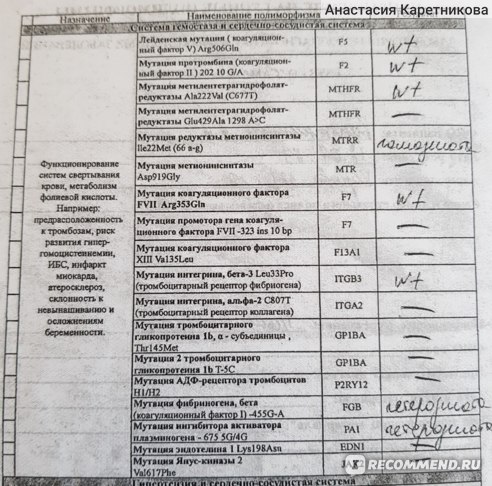
При тромбофилии можно порекомендовать прием антикоагулянтов, если:
- У вас образовался тромб, чтобы предотвратить образование нового.
- У вас не было тромба, но у вас высокий риск его развития.
- У вас временная ситуация, которая подвергает вас высокому риску образования тромба.Это может произойти, если вы беременны, в течение шести недель после родов или в течение длительного периода времени неподвижны.
Антикоагулянтные лекарства вводятся либо путем инъекции (например, гепарина), либо в виде таблеток. Варфарин — это наиболее часто используемый таблетированный антикоагулянт. Другие антикоагулянты, принимаемые в форме таблеток, включают апиксабан, эдоксабан, дабигатран и ривароксабан.
Варфарин — обычный антикоагулянт. Однако для полного действия таблеток варфарина требуется несколько дней.Поэтому инъекции гепарина (часто вводимые непосредственно под кожу) используются вместе с варфарином в первые несколько дней (обычно пять дней) для немедленного эффекта, если у вас в настоящее время есть тромб.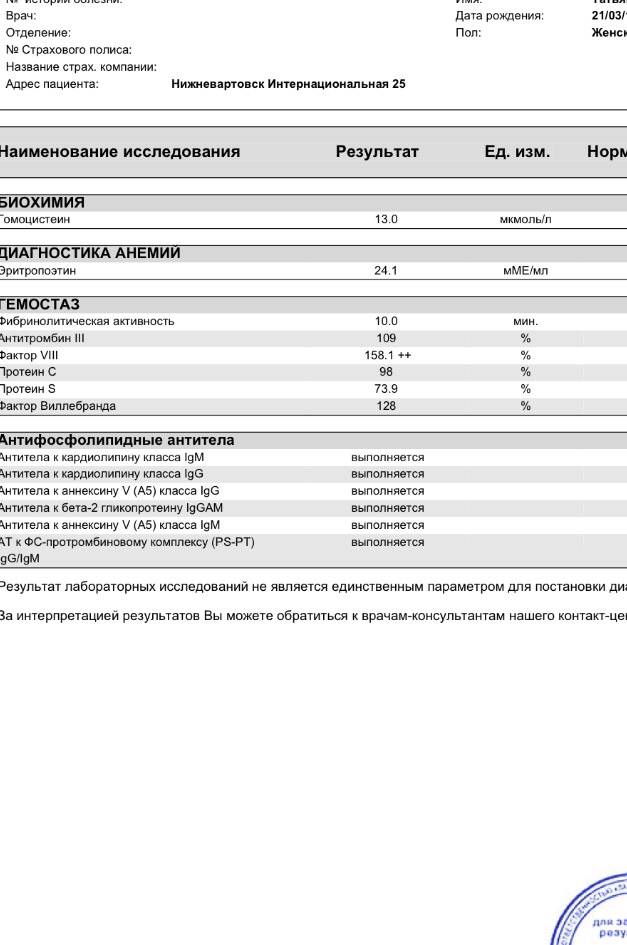 Если вы начинаете прием варфарина и у вас нет сгустка крови (то есть это просто для его предотвращения), вам не понадобятся инъекции гепарина в первую очередь.
Если вы начинаете прием варфарина и у вас нет сгустка крови (то есть это просто для его предотвращения), вам не понадобятся инъекции гепарина в первую очередь.
Цель состоит в том, чтобы получить нужную дозу варфарина, чтобы кровь не свертывалась легко. Слишком большое количество варфарина может вызвать кровотечение. Чтобы подобрать правильную дозу, вам понадобится регулярный анализ крови, называемый международным нормализованным соотношением (INR), пока вы принимаете варфарин.Доза подбирается индивидуально по результатам этого анализа крови. INR — это анализ крови, который измеряет вашу способность к свертыванию крови. Сначала вам нужны анализы довольно часто, но затем, когда будет подобрана правильная доза, они будут реже.
Обычно целью является МНО 2,5, если вы принимаете варфарин для предотвращения образования тромбов при тромбофилии или для лечения ТГВ или тромбоэмболии легочной артерии. Тем не менее, любое значение в диапазоне 2-3 обычно нормально. Если у вас были рецидивирующие ТГВ или легочная эмболия во время приема варфарина, вам может потребоваться более высокий INR (даже более «жидкая» кровь). Анализы крови на МНО обычно можно сделать в амбулаторной клинике или иногда у вашего терапевта. Вам могут посоветовать принимать варфарин на протяжении всей жизни, чтобы предотвратить образование тромбов, если у вас тромбофилия. Или вы можете пройти краткосрочное лечение вашего текущего ТГВ или тромбоэмболии легочной артерии (обычно 3-6 месяцев).
Анализы крови на МНО обычно можно сделать в амбулаторной клинике или иногда у вашего терапевта. Вам могут посоветовать принимать варфарин на протяжении всей жизни, чтобы предотвратить образование тромбов, если у вас тромбофилия. Или вы можете пройти краткосрочное лечение вашего текущего ТГВ или тромбоэмболии легочной артерии (обычно 3-6 месяцев).
Гепарин — инъекционный антикоагулянт. Стандартный гепарин вводится внутривенно (IV), то есть непосредственно в вену — обычно в руку. Этот тип гепарина вводится в больнице и контролируется анализами крови.
Низкомолекулярный гепарин (НМГ) вводится под кожу в нижней части живота (брюшной полости). Его можно вводить дома, участковой медсестрой, или вас могут научить делать инъекции самостоятельно (или лицо, осуществляющее уход, может сделать это за вас). Для его наблюдения не нужны анализы крови. Для профилактики (профилактики) и лечения имеющегося тромба используются разные дозы. Существуют разные марки инъекций гепарина; наиболее распространенными из них являются Clexane® и Fragmin®.
Лечение во время беременности
Если вы беременны или планируете беременность, обсудите это со своим врачом и сообщите своей акушерке и врачу, специализирующемуся на беременности и родах (акушеру), о тромбофилии.Лечение тромбофилии во время беременности может быть различным, потому что:
- Некоторым женщинам с определенными типами тромбофилии рекомендуется принимать низкие дозы аспирина во время беременности, чтобы предотвратить выкидыш или проблемы с беременностью.
- Сама беременность увеличивает риск венозного тромбоза — это касается всей беременности и особенно шести недель после родов. Поэтому вам могут посоветовать начать лечение антикоагулянтами во время беременности или после родов. Это будет зависеть от типа тромбофилии и вашей истории болезни.
- Если вы принимали варфарин, вам обычно рекомендуется перейти на гепарин. Это связано с тем, что гепарин более безопасен для будущего ребенка (существует значительная вероятность того, что варфарин может вызвать аномалии плода).
 И гепарин, и варфарин безопасны для кормления грудью.
И гепарин, и варфарин безопасны для кормления грудью.
Профилактика ТГВ
Определенные ситуации могут временно подвергнуть вас высокому риску образования тромба, и в этих ситуациях вам могут посоветовать на некоторое время дополнительное лечение. Примеры: беременность и послеродовой период, тяжелая болезнь, серьезная операция или все, что вас обездвиживает, например, путешествие или операция.Также можно порекомендовать специальные чулки, такие как летные носки или компрессионные чулки, чтобы предотвратить ТГВ.
Общие рекомендации для людей с тромбофилией
- Если вам предстоит лечение или операция, сообщите своему врачу / медсестре / фармацевту о тромбофилии.
- Помните о предупреждающих симптомах тромба — немедленно обратитесь за медицинской помощью, если вы подозреваете его (симптомы см. Выше).
- Избегайте недостатка жидкости в организме (обезвоживания), выпивая достаточное количество жидкости.Обезвоживание может способствовать образованию тромбов.

- Сохраняйте физическую активность и избегайте длительного пребывания в неподвижности — неподвижность способствует образованию тромбов в ногах (ТГВ).
- С осторожностью при приеме лекарств: некоторые лекарства повышают риск образования тромба. Например, комбинированные оральные контрацептивы (КОК), таблетки или пластыри и заместительная гормональная терапия (ЗГТ). Вам могут посоветовать избегать приема некоторых лекарств или перейти на те, которые не влияют на свертываемость крови.
- Поддерживайте здоровый вес — избыточный вес или ожирение увеличивает риск образования тромбов в ногах.
- Не курите, чтобы поддерживать здоровье кровеносных сосудов (в частности, артерий). Это важно, если у вас есть тромбофилия, которая может вызывать образование тромбов в артериях, поскольку курение также способствует образованию тромбов в артериальной крови.
Какие осложнения тромбофилии — и каковы перспективы?
Часто осложнений не бывает. Многие формы тромбофилии являются легкими, поэтому прогноз (прогноз) для многих людей с тромбофилией означает, что у них нет проблем с их состоянием.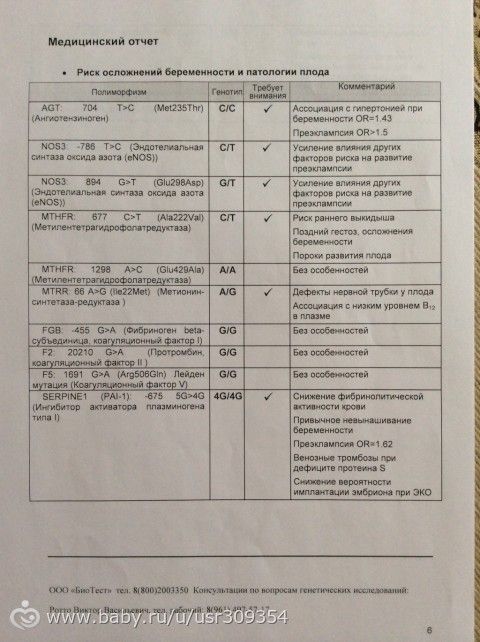 Кроме того, во многих случаях лечение может успешно предотвратить осложнения.
Кроме того, во многих случаях лечение может успешно предотвратить осложнения.
Тромбоэмболия легочной артерии, инсульт, сердечный приступ или сгусток крови в головном мозге или животе (брюшной полости) могут быть опасными для жизни состояниями. Раннее лечение может спасти жизнь и уменьшить количество осложнений. Поэтому важно знать симптомы и немедленно обратиться за лечением, если вы подозреваете какой-либо тромб.
Как упоминалось выше, некоторые типы (не все) тромбофилии могут увеличить вероятность проблем во время беременности.Ваш врач может посоветовать — это будет зависеть от типа тромбофилии, а также у разных людей. Однако у многих женщин с тромбофилией беременность действительно протекает успешно.
Также могут возникнуть осложнения из-за разжижающей кровь (антикоагулянтной) терапии. Аспирин, гепарин и варфарин могут иметь побочные эффекты, в основном нежелательные кровотечения, такие как внутреннее кровотечение из слизистой оболочки желудка. По этой причине для вас и вашего врача важно взвесить все за и против лечения. Необходимо учитывать вашу индивидуальную ситуацию и предпочтения.
Необходимо учитывать вашу индивидуальную ситуацию и предпочтения.
Тестирование родственников
Если у вас или у вашей семьи есть наследственная (генетическая) форма тромбофилии, вас могут попросить пройти тесты для себя или ваших близких родственников. Это нужно для того, чтобы увидеть, есть ли у вас или других членов семьи такое же состояние. Однако преимущества поиска людей с тромбофилией, у которых не было тромба, еще не доказаны. Вот почему существуют четкие инструкции о том, кого следует тестировать.
Какие бывают типы тромбофилии?
В этом разделе описаны наиболее распространенные типы тромбофилии, но не все состояния.
Унаследованные тромбофилии
Фактор V Лейден
Это произносится как «фактор 5 lyden». Это довольно распространено среди людей европейского происхождения — примерно у 1 из 20 европейцев есть лейденский ген фактора V. Этот ген влияет на фактор V каскада свертывания, заставляя процесс свертывания длиться дольше. Это увеличивает риск образования тромба в вене примерно в восемь раз. Это все еще относительно низкий риск, поэтому у большинства людей с фактором V Лейден не возникает проблем. Некоторые люди наследуют два гена фактора V Лейдена — по одному гену от каждого родителя (известный как «гомозиготный фактор V Лейдена»). Это менее распространено, но повышает риск — примерно в восемьдесят раз выше обычного.
Это увеличивает риск образования тромба в вене примерно в восемь раз. Это все еще относительно низкий риск, поэтому у большинства людей с фактором V Лейден не возникает проблем. Некоторые люди наследуют два гена фактора V Лейдена — по одному гену от каждого родителя (известный как «гомозиготный фактор V Лейдена»). Это менее распространено, но повышает риск — примерно в восемьдесят раз выше обычного.
Протромбин 20210
Протромбин является фактором свертывания крови, и у людей с геном 20210 наблюдается изменение протромбина, что облегчает образование сгустка.Примерно 1 из 50 человек европейского происхождения имеет этот ген; это чаще встречается у людей южноевропейского происхождения. Это увеличивает риск образования тромба в вене в два раза выше обычного. Это относительно низкий риск, поэтому у большинства людей с протромбином 20210 тромб не образуется.
Дефицит протеина C
Протеин C — это естественный антикоагулянт, содержащийся в крови. Дефицит может быть генетическим или вызван другими заболеваниями, такими как заболевание почек. При наследственном дефиците протеина C риск образования тромба варьируется в зависимости от семьи.Это потому, что в каждой семье есть разные изменения в гене протеина C. Лучшим ориентиром для вашего уровня риска является наличие тромба у вас или ваших родственников. Если ребенок унаследует два гена с дефицитом протеина C (по одному от каждого родителя — это очень редко), у него будет более серьезная проблема. Вскоре после рождения у них на коже образуются тромбы (состояние, называемое молниеносной пурпурой). Это лечится концентратами протеина С и препаратами, разжижающими кровь (антикоагулянтами).
Дефицит может быть генетическим или вызван другими заболеваниями, такими как заболевание почек. При наследственном дефиците протеина C риск образования тромба варьируется в зависимости от семьи.Это потому, что в каждой семье есть разные изменения в гене протеина C. Лучшим ориентиром для вашего уровня риска является наличие тромба у вас или ваших родственников. Если ребенок унаследует два гена с дефицитом протеина C (по одному от каждого родителя — это очень редко), у него будет более серьезная проблема. Вскоре после рождения у них на коже образуются тромбы (состояние, называемое молниеносной пурпурой). Это лечится концентратами протеина С и препаратами, разжижающими кровь (антикоагулянтами).
Дефицит белка S
Белок S также является естественным антикоагулянтом в крови.Дефицит протеина S встречается редко. Риск образования тромба варьируется в зависимости от семьи. Лучшим индикатором вашего риска является проверка наличия тромба у других родственников.
Дефицит антитромбина
Антитромбин — еще один природный антикоагулянт, содержащийся в крови.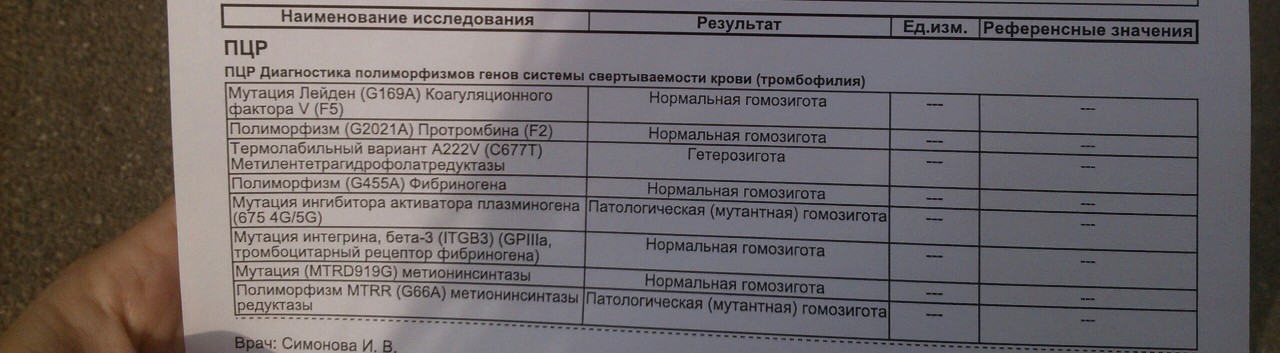 Существуют разные типы дефицита антитромбина, как генетические, так и вызванные другими заболеваниями. Наследственная форма встречается редко, поражая примерно 1 из 2000 человек.
Существуют разные типы дефицита антитромбина, как генетические, так и вызванные другими заболеваниями. Наследственная форма встречается редко, поражая примерно 1 из 2000 человек.
Дефицит антитромбина — довольно тяжелая форма тромбофилии.Риск образования тромба варьируется в зависимости от семьи, но может быть увеличен в 25-50 раз по сравнению с нормальным риском. При этом состоянии сгусток крови может образоваться не только в ногах или легких, но и в венах рук, кишечника, головного мозга или печени. Примерно у 1 из 2 человек с дефицитом антитромбина тромб образуется в возрасте до 30 лет. Другие же без проблем доживают до пожилого возраста.
При этом заболевании, если у вас действительно образуется тромб, вам могут посоветовать длительный прием варфарина.Однако это нужно решать в индивидуальном порядке. Кроме того, лечение концентратами антитромбина может быть назначено, когда существует более высокий риск образования тромба — например, если вам предстоит серьезная операция.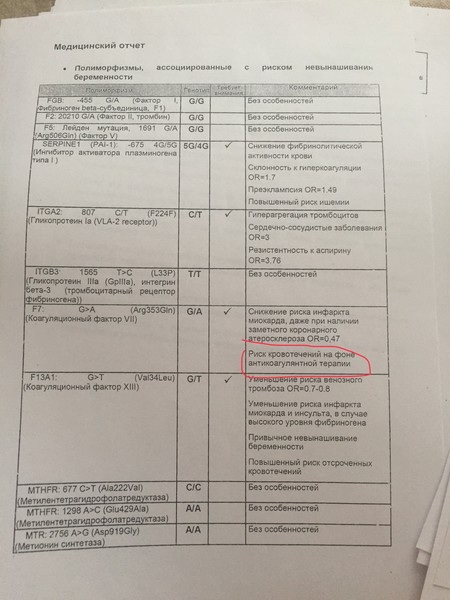
При беременности обычно требуется антикоагулянтное лечение гепарином. Также можно использовать лечение концентратами антитромбина.
Примечание : у детей может быть дефицит антитромбина; родители должны знать, чтобы они могли обнаружить признаки сгустка крови.Хотя у большинства детей тромб не образуется, они подвергаются риску в таких ситуациях, как хирургия. У некоторых новорожденных также появляются тромбы. Может потребоваться лечение антикоагулянтами или концентрат антитромбина. Родители, которые сами имеют дефицит антитромбина и ждут ребенка, должны обсудить это со своим врачом.
Дисфибриногенемия
Это редкий генетический дефект, при котором растворяющее сгустки химическое вещество, называемое фибриногеном, не работает нормально. Может быть повышенное свертывание крови, усиление кровотечения или и то, и другое.
Комбинированные унаследованные тромбофилии
Некоторые люди наследуют более одного гена тромбофилии — например, фактор V Лейден плюс протромбин 20210.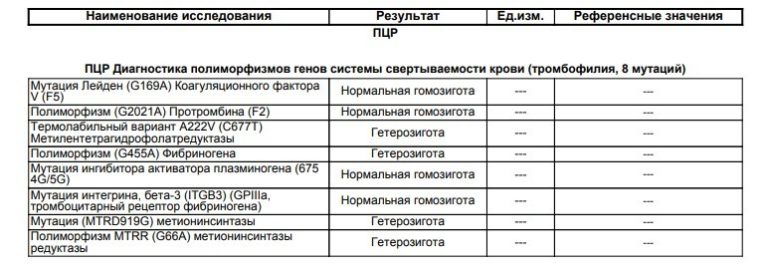 При комбинированных тромбофилиях риск образования тромба увеличивается в разы, и существует гораздо больший риск, чем при любом другом. только состояние.
При комбинированных тромбофилиях риск образования тромба увеличивается в разы, и существует гораздо больший риск, чем при любом другом. только состояние.
Приобретенные тромбофилии
Приобретенные тромбофилии не передаются по наследству и обычно возникают в зрелом возрасте.
Антифосфолипидный синдром (APS) .Это также известно как синдром Хьюза. Это вызвано определенными химическими веществами иммунной системы (антителами) в крови, которые называются антифосфолипидными антителами. APS может вызвать образование тромба в артериях и мелких кровеносных сосудах, а также в венах. В некоторых случаях APS может повлиять на беременность. Многие женщины с АФС не имеют проблем с беременностью. Однако АФС может вызвать выкидыш или другие проблемы — ограничение роста плода, преэклампсию или, в редких случаях, смерть плода. Эти проблемы можно уменьшить путем лечения.
APS можно лечить низкими дозами аспирина, которые помогают при беременности. Если у вас был сгусток крови, то вместо него обычно рекомендуется варфарин (или гепарин, если вы беременны).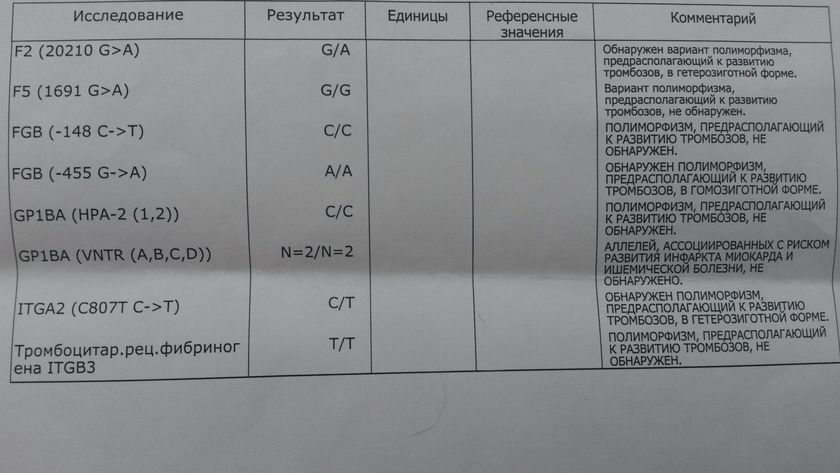 Узнайте больше об антифосфолипидном синдроме.
Узнайте больше об антифосфолипидном синдроме.
Другие приобретенные состояния
Другие состояния могут увеличить риск образования тромба. Некоторые врачи классифицируют их как тромбофилии. Примерами являются определенные нарушения, влияющие на тромбоциты, некоторые заболевания костного мозга, некоторые проблемы с почками, воспалительные заболевания кишечника и запущенный рак.
Смешанные наследственные / приобретенные тромбофилии
Они возникают как по генетическим, так и негенетическим причинам.
Гипергомоцистеинемия
Это повышенный уровень химического вещества, называемого гомоцистеином, в крови, который, как считается, увеличивает риск образования артериальных и венозных тромбов. Повреждает кровеносные сосуды. Это относительно легкое заболевание, но оно может добавить к факторам риска образования тромба. Могут помочь витамин B12 и фолиевая кислота.
Пароксизмальная ночная гемоглобинурия
Это редкое заболевание, поражающее костный мозг. Это может привести к образованию венозных тромбов, часто в необычных местах, таких как вены кишечника, печени или мозга. Может потребоваться антикоагулянтная терапия, и есть другие методы лечения этого состояния.
Это может привести к образованию венозных тромбов, часто в необычных местах, таких как вены кишечника, печени или мозга. Может потребоваться антикоагулянтная терапия, и есть другие методы лечения этого состояния.
Повышенный фактор VIII
Это произносится как «фактор 8». Это происходит из-за аномально высокого уровня фактора VIII, который является одним из химических веществ крови, способствующих свертыванию. В зависимости от фактического уровня фактора VIII, он может увеличить риск свертывания крови примерно в шесть раз — это относительно низкий риск образования тромба.
Что такое тромбофилия? | Сгустки крови
Тромбофилия (также известная как гиперкоагуляция) — это предрасположенность к развитию тромбов. Тромбофилия может передаваться по наследству или приобретаться в течение жизни. Состояния, ведущие к тромбофилии, которые могут быть приобретены или развиваться в течение жизни, включают аномалии крови, такие как слишком много красных кровяных телец (полицитемия) или слишком много тромбоцитов (тромбоцитоз или тромбоцитемия), установка механического сердечного клапана или развитие аномальных белки или антитела.
Унаследованная тромбофилия была впервые описана в 1960-х годах, когда исследователи обнаружили дефицит антитромбина. Антитромбин — это природный антикоагулянт, который блокирует как превращение протромбина в тромбин, так и преобразование фактора X в его активную форму, фактор Xa. (См. Вопрос 18.) Дефицит протеина C и протеина S был описан в 1980-х годах. Протеин C и протеин S являются природными антикоагулянтами, которые в сочетании друг с другом расщепляют или разрушают фактор V. В 1990-х годах фактор V Лейдена и
Мутация
Изменение гена от его естественного состояния.Мутации могут вызвать заболевание или привести к нормальному варианту, не вызывающему проблем у пациента.
Джин
Чертежи для создания отдельных белков, находящихся в ДНК. Геном человека кодирует примерно от 20 000 до 25 000 отдельных генов.
Также описана мутацияв гене протромбина.
История Дены:
После того, как мне сделали экстренную операцию по поводу мертвой кишки, вызванной тромбом, который образовался в моей верхней брыжеечной вене (вена в кишечнике), а также были обнаружены небольшие сгустки, образовавшиеся в обеих общих бедренных венах (вены в моей пах), вызвали гематолога.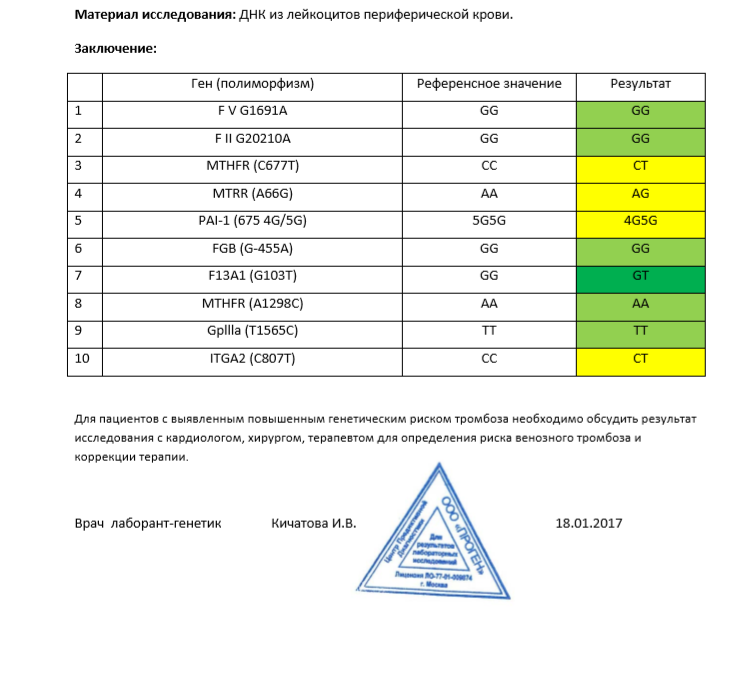 Проведя несколько тестов, он обнаружил, что у меня редкое наследственное заболевание крови, называемое дефицитом протеина S.
Проведя несколько тестов, он обнаружил, что у меня редкое наследственное заболевание крови, называемое дефицитом протеина S.
Я принимал кумадин® на всю жизнь. Мне ежемесячно проверяют PT и INR в местной лаборатории, и после 15 лет приема кумадина я достигла терапевтического уровня и живу вполне нормальной жизнью. Я исследовал это заболевание крови и с тех пор обнаружил, что несколько членов семьи со стороны моей матери также страдают им. Некоторым были назначены различные антикоагулянты, а другим назначают аспирин.Я так благодарен, что мое состояние было обнаружено вовремя, и что я хорошо осведомлен и подготовлен на случай, если эта болезнь передается моей дочери.
Тромбофилия | Сгустки крови
Важность свертывания крови
Свертывание крови необходимо для выживания. Без него организм не может остановить кровотечение после травмы, болезни или операции. Даже незначительная травма или рана могут перерасти в неотложную медицинскую помощь при недостаточном свертывании.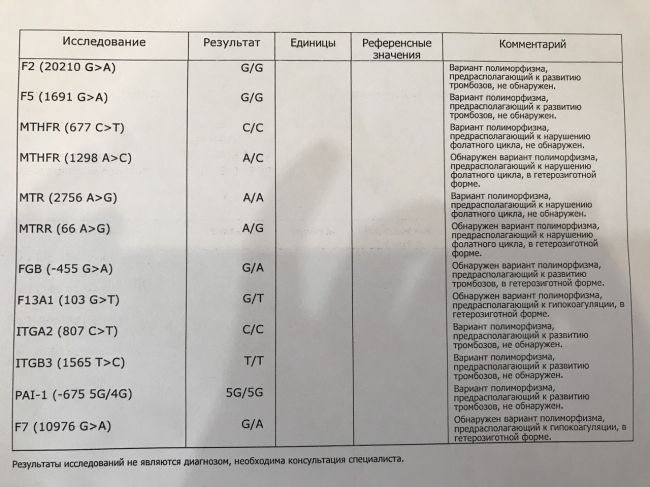 Нормальное свертывание происходит в результате ряда реакций, которые работают вместе, чтобы сдержать утечку крови из поврежденных вен и артерий.Когда происходит травма, организм выделяет химические вещества, которые сужают разорванные кровеносные сосуды, ограничивая приток крови к пораженной области и уменьшая размер разрывов на стенках сосудов. Кровь, которая уже разлилась в окружающие ткани, образует лужу, называемую гематомой, которая давит на сосуды, чтобы остановить кровотечение. Эти механические воздействия дополняют процесс, с помощью которого организм вырабатывает собственный сгусток для уплотнения и начинает заживлять место повреждения.
Нормальное свертывание происходит в результате ряда реакций, которые работают вместе, чтобы сдержать утечку крови из поврежденных вен и артерий.Когда происходит травма, организм выделяет химические вещества, которые сужают разорванные кровеносные сосуды, ограничивая приток крови к пораженной области и уменьшая размер разрывов на стенках сосудов. Кровь, которая уже разлилась в окружающие ткани, образует лужу, называемую гематомой, которая давит на сосуды, чтобы остановить кровотечение. Эти механические воздействия дополняют процесс, с помощью которого организм вырабатывает собственный сгусток для уплотнения и начинает заживлять место повреждения.
Когда происходит травма, организм мобилизует клетки, называемые тромбоцитами, которые устремляются к месту травмы и выполняют свою важную функцию свертывания крови.Тромбоциты прилипают к стенкам сосудов и друг к другу, образуя пробку, которая закрывает место кровотечения и помогает начать процесс заживления. В этом сложном процессе задействованы десятки факторов, белков и ферментов.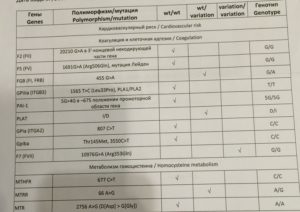 Дефекты производства или производительности любого из этих веществ могут привести к проблемам со свертыванием крови, которые будут обсуждаться в следующих разделах.
Дефекты производства или производительности любого из этих веществ могут привести к проблемам со свертыванием крови, которые будут обсуждаться в следующих разделах.
Венозная тромбоэмболия (ВТЭ): общая проблема со свертыванием крови
Хотя свертывание крови играет важную роль для выживания и общего состояния здоровья, нарушение свертываемости может привести к серьезным проблемам со здоровьем.Одним из наиболее распространенных нарушений свертывания крови является образование вредного сгустка, который блокирует кровоток в кровеносном сосуде, чаще всего в крупной вене на руке или ноге, известном как тромбоз глубоких вен (ТГВ). Если ТГВ отрывается от своего первичного очага и перемещается в легкое, это называется тромбоэмболией легочной артерии (ТЭЛА). Это опасно для жизни и приводит к 100000 смертей ежегодно в Соединенных Штатах. Если вы испытываете признаки и симптомы тромба в ноге или руке, вам следует как можно скорее обратиться к врачу.Если у вас есть признаки ПЭ, которые могут быть опасными для жизни, вам следует немедленно обратиться за медицинской помощью.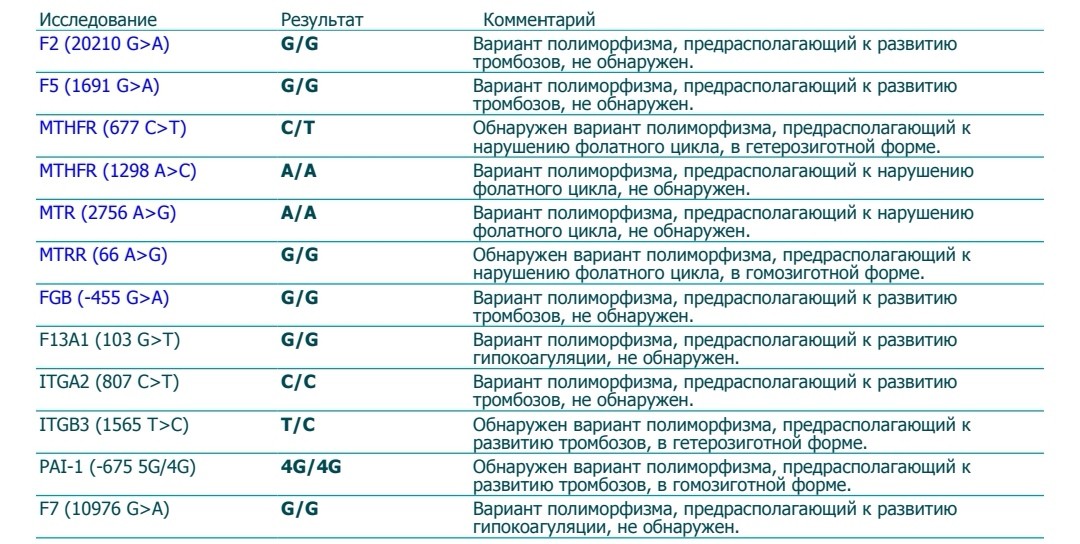
Признаки и симптомы сгустка крови
DVT и PE имеют разные симптомы, которые иногда можно спутать с другими менее серьезными проблемами со здоровьем. Например, спазмы, часто характерные для ТГВ в бедре, можно интерпретировать как «лошадь Чарли». Одышку от ПЭ можно принять за аллергию или беспокойство. Только ваш врач может точно оценить наличие или отсутствие сгустка крови, поэтому немедленно обратитесь за медицинской помощью, если у вас возникнут какие-либо из следующих признаков или симптомов:
- Отек ног или рук
- Боль или болезненность, не вызванные травмой
- Теплая на ощупь кожа
- Покраснение или изменение цвета кожи
- Затрудненное дыхание
- Боль в груди или спине, усиливающаяся при глубоком вдохе
- Кашель или кашель с кровью
- Более быстрое сердцебиение или нерегулярное сердцебиение
Риски образования тромбов
Несмотря на успехи в лечении и профилактике тромбов, тромбы остаются серьезной проблемой для общественного здравоохранения и продолжают возникать с относительно высокой частотой — сравнимой с частотой инсульта, 3 No. 4 убийцы в США. 4 По данным Центров США по контролю и профилактике заболеваний, до 900 000 человек в США ежегодно сталкиваются с тромбами и около 100 000 умирают, многие в течение месяца после постановки диагноза. У 30% выживших рецидив будет повторяться в течение 10 лет. 5 Сгустки крови — основная причина предотвратимой смерти, особенно у людей, которые госпитализированы. Примерно 50 процентов всех тромбов происходит во время или в течение 3 месяцев после госпитализации или операции.Однако почти половина всех госпитализированных пациентов не получают надлежащей профилактики. 6
4 убийцы в США. 4 По данным Центров США по контролю и профилактике заболеваний, до 900 000 человек в США ежегодно сталкиваются с тромбами и около 100 000 умирают, многие в течение месяца после постановки диагноза. У 30% выживших рецидив будет повторяться в течение 10 лет. 5 Сгустки крови — основная причина предотвратимой смерти, особенно у людей, которые госпитализированы. Примерно 50 процентов всех тромбов происходит во время или в течение 3 месяцев после госпитализации или операции.Однако почти половина всех госпитализированных пациентов не получают надлежащей профилактики. 6
Хотя сгустки крови могут образоваться в любом возрасте, риски возрастают с возрастом. Исследователи знают, что у мужчин риск образования тромбов выше, чем у женщин. 7 Однако беременность, роды и использование противозачаточных средств на основе эстрогенов увеличивают вероятность образования тромбов у женщин детородного возраста по сравнению с небеременными женщинами или женщинами, которые не используют эти типы контрацептивов. Фактически, у беременных женщин риск ВТЭ в 5 раз выше, чем у небеременных женщин детородного возраста.Эти риски возрастают еще больше — в 20 раз больше, чем риск небеременных детей — в первые недели после родов. 8
Фактически, у беременных женщин риск ВТЭ в 5 раз выше, чем у небеременных женщин детородного возраста.Эти риски возрастают еще больше — в 20 раз больше, чем риск небеременных детей — в первые недели после родов. 8
Чтобы получить полный список факторов риска ВТЭ, щелкните эту ссылку на веб-сайте Национального альянса по сгусткам крови: https://www.stoptheclot.org/know-your-risk.
Иногда у людей появляются тромбы без видимой причины. У этих людей может быть скрытый риск образования тромбов, называемый тромбофилией. Тромбофилия также может быть фактором риска, который присутствует в дополнение к перечисленным выше.
Этот веб-ресурс был создан специально для того, чтобы помочь людям с тромбофилией понять свое состояние, оценить свои риски в сотрудничестве со своим врачом и принять меры для защиты, когда это необходимо. В следующих разделах будет представлен обзор тромбофилии, различных подтипов состояния, а также варианты правильной диагностики и профилактического лечения.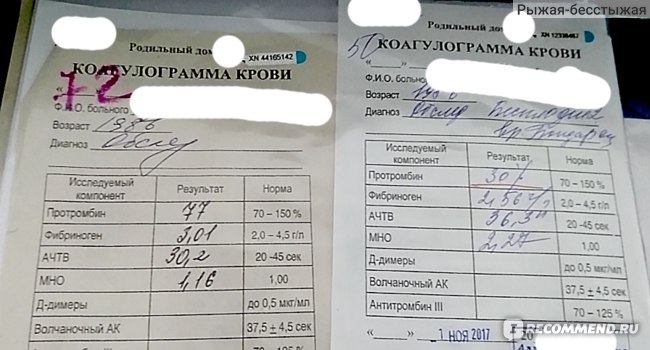
Тромбофилия: скрытый риск образования тромбов
У некоторых людей есть основная уязвимость к тромбам, известная как тромбофилия.Медицинские работники часто подозревают наличие тромбофилии всякий раз, когда тромбы возникают по необъяснимым причинам или когда отсутствуют другие факторы риска. Около 30 процентов всех людей, у которых наблюдается образование тромба, не имеют известных факторов риска, и примерно в половине этих случаев неспровоцированного образования тромбов выявляется тромбофилия. 9 Врачи также будут рассматривать тромбофилию, когда тромб образуется у молодого человека или в необычной области тела, такой как мозг или живот. История невынашивания многоплодной беременности также может указывать на скрытую тромбофилию, в частности на аутоиммунное состояние, называемое синдромом антифосфолипидных антител (APAS).Термин «тромбофилия» охватывает группу состояний, характеризующихся аномалиями в различных белках, которые способствуют процессу свертывания крови. Эти отклонения могут включать любую из следующих функций:
Эти отклонения могут включать любую из следующих функций:
- Производство слишком большого количества белка свертывания
- Производство слишком малого количества белков, которые останавливают свертывание
- Дефектные белки, которые могут сопротивляться расщеплению после того, как потребность в свертывании прошла
- Образование аминокислот, которые повреждают стенки кровеносных сосудов и вызывают свертывание крови
(Для более полного обсуждения основ ДНК, в том числе того, как происходят мутации, щелкните по этой ссылке: https://www.stoptheclot.org/news/the-genetics-of-thrombophilia/) Унаследованная тромбофилия чаще всего встречается у жителей северных регионов.
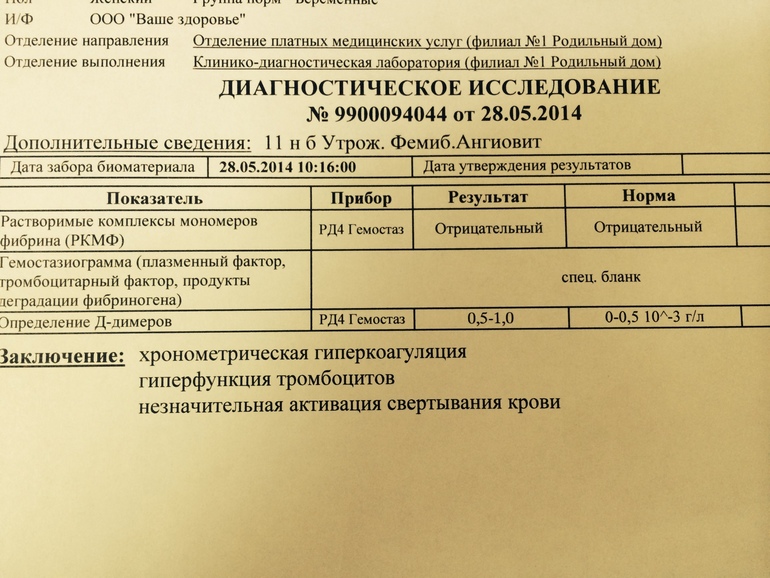 Европейское происхождение и у некоторых народов Ближнего Востока.Редко среди азиатов, африканцев и коренных американцев. 10 Хотя тромбофилия увеличивает риск образования тромба, это никоим образом не гарантирует его. Пожизненный риск развития ТГВ составляет 10 процентов или меньше для определенных тромбофилий, 11 , но степень риска колеблется в зависимости от ряда факторов, включая:
Европейское происхождение и у некоторых народов Ближнего Востока.Редко среди азиатов, африканцев и коренных американцев. 10 Хотя тромбофилия увеличивает риск образования тромба, это никоим образом не гарантирует его. Пожизненный риск развития ТГВ составляет 10 процентов или меньше для определенных тромбофилий, 11 , но степень риска колеблется в зависимости от ряда факторов, включая:Тромбофилии, признанные в настоящее время
Для большинства тромбофилий характерно отсутствие достаточного количества правильно функционирующих белков свертывания крови.Эти состояния либо наследуются генетически от одного или обоих родителей, либо приобретены в результате травмы, болезни или операции.
Наследственная тромбофилия
Часто тромбофилии передаются по наследству от одного или обоих родителей. Определенные генетические мутации соответствуют конкретным тромбофилиям. Некоторые мутации, такие как лежащие в основе фактора V Лейдена и протромбина G20210A, относительно распространены и затрагивают 1-5 процентов населения в целом.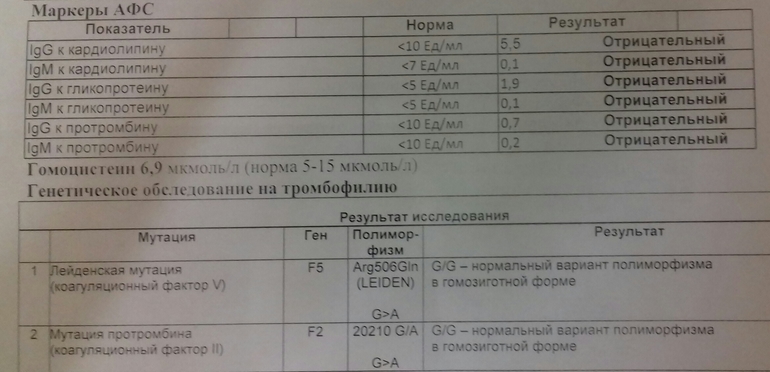 Другие, например, ответственные за дефицит протеина C и протеина S, встречаются реже и затрагивают менее одного процента людей.Некоторые тромбофилии наблюдаются в основном в определенных подгруппах населения или очень редки, представляя небольшой риск для населения.
Другие, например, ответственные за дефицит протеина C и протеина S, встречаются реже и затрагивают менее одного процента людей.Некоторые тромбофилии наблюдаются в основном в определенных подгруппах населения или очень редки, представляя небольшой риск для населения.
Ниже приводится краткое описание некоторых наиболее известных наследственных тромбофилий:
Фактор V Лейден: Названный в честь города в Нидерландах, в котором впервые была выявлена генетическая мутация, Фактор V Лейден является наиболее распространенной тромбофилией, встречающейся гетерозиготно (то есть с одной дефектной копией гена) примерно у 5 процентов европейского населения. и гомозиготные (т.е. две дефектные копии гена) менее чем в 1%. Латиноамериканцы и афроамериканцы страдают реже (распространенность 2% и 1% соответственно). Как и большинство тромбофилий, это редко встречается у людей азиатского, африканского или индейского происхождения. 16
Фактор V Лейден вызывает генетическую мутацию, которая генерирует ненормальную версию фактора V.
 Как инструментальный белок свертывания, фактор V помогает генерировать фибрин, волокнистый материал, который создает «сеть», удерживающую сгусток крови вместе.После формирования функционального сгустка крови фактор V инактивируется другим веществом, называемым активированным протеином C, также известным как APC. Измененная версия фактора V устойчива к APC, поэтому ее активность продолжается и после периода ее полезности. В результате фактор V Лейдена может вызвать повышенную реакцию свертывания крови.
Как инструментальный белок свертывания, фактор V помогает генерировать фибрин, волокнистый материал, который создает «сеть», удерживающую сгусток крови вместе.После формирования функционального сгустка крови фактор V инактивируется другим веществом, называемым активированным протеином C, также известным как APC. Измененная версия фактора V устойчива к APC, поэтому ее активность продолжается и после периода ее полезности. В результате фактор V Лейдена может вызвать повышенную реакцию свертывания крови.Гетерозиготная форма фактора V Лейдена увеличивает риск первого ТГВ в 5-7 раз (т. Е. Дополнительно на 5-7 человек на тысячу ежегодно по сравнению с риском 1 из 1000 для населения в целом).Однако гомозиготная форма увеличивает риск образования тромбов в 50 раз. 17
Наследственный дефицит антитромбина (HAD): Антитромбин, обнаруженный в 1950-х годах, представляет собой белок, необходимый для предотвращения образования тромбов.
 Люди, чей организм не вырабатывает достаточного количества антитромбина, гораздо чаще имеют тромб.
Люди, чей организм не вырабатывает достаточного количества антитромбина, гораздо чаще имеют тромб.HAD менее распространен, чем фактор V Лейдена, поражая от 1 из 500 до 5000 человек. 18 Этот диапазон предполагает, что от примерно 63 000 до 630 000 человек в США могут пострадать.Однако это тромбофилия самого высокого риска с точки зрения образования тромбов у пораженного населения. Более чем у восьми из десяти пациентов с HAD будет хотя бы один тромб к 50 годам. Примерно у шести из десяти людей с HAD будут повторяться тромбы. Наличие HAD можно установить с помощью анализа крови. Вы можете подвергаться риску HAD, если у вас уже был сгусток, особенно если сгусток не имел очевидной причины или если он был каким-то образом необычным, или если у вас есть член семьи, у которого в анамнезе были сгустки.Подобно дефициту протеина C и протеина S, HAD может быть вызван генетическими мутациями, которые приводят либо к неадекватной выработке антитромбина, либо к выработке дисфункционального антитромбина.
 Оба типа приводят к недостаточной активности антитромбина и повышенному риску образования тромбов.
Оба типа приводят к недостаточной активности антитромбина и повышенному риску образования тромбов.Сгустки крови с недостаточностью антитромбина возникают в среднем в возрасте 30 лет и могут появляться в необычных местах, например в венах головного мозга или желудочно-кишечного тракта, или в нескольких венах одновременно.Приблизительно 50 процентов людей с HAD будут испытывать тромб в своей жизни 19 , а 40 процентов будут испытывать конкретно тромбоэмболию легочной артерии. HAD увеличивает риск образования тромбов на 20 процентов по сравнению с населением в целом. 20
Людей с HAD часто лечат, получая дополнительный антитромбин, чтобы восполнить недостаток антитромбина в организме. Лечение чаще применяется в определенных ситуациях повышенного риска, таких как хирургическое вмешательство, беременность и роды, или когда у человека уже есть тромб.
- Протромбин G20210A: Протромбин G20210A, обнаруженный в 1996 году, является второй по распространенности тромбофилией, встречающейся в гетерозиготной форме у 2 процентов европейского населения.
 21 Менее 1 из 10 000 имеют гомозиготную форму. Как и фактор V Лейдена, протромбин G20210A редко встречается у людей неевропейского или ближневосточного происхождения. Его название включает в себя код, обозначающий точное местоположение мутации в молекуле ДНК. Протромбин G20210A содержит мутацию в гене, ответственном за производство протромбина, также известного как фактор II, — подобного белку фактора V, который играет решающую роль в генерации фибрина — опять же, материала, составляющего структурную сеть в сгустке крови.У лиц с гетерозиготным расстройством слишком много циркулирующего фактора II, что увеличивает вероятность ВТЭ в 2 или 3 раза по сравнению с нормальным риском образования тромбов. 22 Ученым еще предстоит количественно оценить риск гомозиготной формы.
21 Менее 1 из 10 000 имеют гомозиготную форму. Как и фактор V Лейдена, протромбин G20210A редко встречается у людей неевропейского или ближневосточного происхождения. Его название включает в себя код, обозначающий точное местоположение мутации в молекуле ДНК. Протромбин G20210A содержит мутацию в гене, ответственном за производство протромбина, также известного как фактор II, — подобного белку фактора V, который играет решающую роль в генерации фибрина — опять же, материала, составляющего структурную сеть в сгустке крови.У лиц с гетерозиготным расстройством слишком много циркулирующего фактора II, что увеличивает вероятность ВТЭ в 2 или 3 раза по сравнению с нормальным риском образования тромбов. 22 Ученым еще предстоит количественно оценить риск гомозиготной формы. - Дефицит протеина C: Впервые описанный в медицинской литературе почти 40 лет назад, дефицит протеина C является относительно редкой тромбофилией, встречающейся менее чем у 1% населения или у 1 из 200-300 человек в гетерозиготной форме.
 23 Однако, когда он действительно появляется, гомозиготный дефицит протеина C считается опасным для жизни заболеванием. 24 В отличие от тромбофилий на основе фактора V и протромбина, дефицит протеина C коррелирует с повышенным риском повторного образования тромбов. В результате это может потребовать большего внимания у тех, кто уже испытал начальное событие ВТЭ. Белок С играет важную роль в прекращении процесса свертывания крови после завершения восстановления поврежденного кровеносного сосуда. Люди с мутацией, связанной с протеином C, производят либо слишком мало протеина, либо его неактивную версию.
23 Однако, когда он действительно появляется, гомозиготный дефицит протеина C считается опасным для жизни заболеванием. 24 В отличие от тромбофилий на основе фактора V и протромбина, дефицит протеина C коррелирует с повышенным риском повторного образования тромбов. В результате это может потребовать большего внимания у тех, кто уже испытал начальное событие ВТЭ. Белок С играет важную роль в прекращении процесса свертывания крови после завершения восстановления поврежденного кровеносного сосуда. Люди с мутацией, связанной с протеином C, производят либо слишком мало протеина, либо его неактивную версию. - Дефицит протеина S: Протеин S, названный в честь первой буквы в Сиэтле, городе, в котором он был обнаружен, известен как кофактор свертывания крови. Сам по себе он не может производить химические реакции, необходимые для регулирования свертывания крови. Вместо этого он увеличивает активность других белков и ферментов, которые напрямую влияют на процесс.
 У людей с этим заболеванием не хватает функционального белка S. Как и при других тромбофилиях, мутации могут возникать в одной или обеих копиях гена.Более легкий гетерозиготный дефицит поражает менее четверти 1 процента населения (1 из 500). 25 Опасная для жизни гомозиготная форма встречается крайне редко, но обычно является причиной молниеносной пурпуры, часто летального и системного нарушения свертывания крови у младенцев.
У людей с этим заболеванием не хватает функционального белка S. Как и при других тромбофилиях, мутации могут возникать в одной или обеих копиях гена.Более легкий гетерозиготный дефицит поражает менее четверти 1 процента населения (1 из 500). 25 Опасная для жизни гомозиготная форма встречается крайне редко, но обычно является причиной молниеносной пурпуры, часто летального и системного нарушения свертывания крови у младенцев. - Гомоцистинурия: Гомоцистинурия — наследственное заболевание, которое характеризуется неспособностью организма усваивать определенные аминокислоты, особенно гомоцистеин, которые являются строительными блоками белков.Этот дефект приводит к хроническому повышению уровня гомоцистеина, который может повредить внутренние стенки кровеносных сосудов и вызвать образование тромбов. Примерно каждый пятый человек, родившийся с наследственной гомоцистинурией, умрет от осложнения, связанного с тромбообразованием, в возрасте до 30 лет. 26 Это очень редкое состояние, включающее передачу аномальных копий гена, известного как CBS, от обоих родителей.

Приобретенная тромбофилия
При приобретенных тромбофилиях орган, ответственный за производство или удаление этих белков, например печень или почка, мог быть поврежден или изменен в результате серьезного заболевания.В результате орган либо не производит достаточного количества функционирующего белка, либо слишком быстро выводит его из крови, прежде чем сможет завершить свою работу. В других случаях болезнь, травма или токсическое воздействие могут активировать чрезмерное производство химических веществ, вызывающих дисбаланс в процессе свертывания. Ярким примером приобретенной тромбофилии является антифосфолипидный синдром (APS), состояние, которое представляет особый риск для беременных. женщины, потому что сгустки крови, связанные с АФС, чаще всего возникают до или в следующие недели после родов.Это может привести к выкидышу. В отличие от большинства тромбофилий, APS связан с более высокой частотой повторных сгустков венозной крови, а также сгустков артериальной крови. 27
27
APS считается аутоиммунным заболеванием, при котором организм атакует собственные клетки, принимая их за чужеродных захватчиков. Последовавший за этим натиск повреждает стенки кровеносных сосудов, что приводит к усилению реакции свертывания крови.
Люди с другими основными аутоиммунными заболеваниями, такими как волчанка, или те или иные инфекции в анамнезе, подвергаются более высокому риску развития АФС.
Тестирование и диагностика тромбофилии
Значение тестирования на тромбофилию — предмет постоянных дискуссий в медицинском сообществе и среди семей. На сегодняшний день не опубликовано ни одного утвержденного руководства по тестированию. Данные, показывающие клиническую ценность тестирования на тромбофилию, ограничены, как и преимущества профилактического лечения тромбов, основанного только на диагностике тромбофилии. 28 Лицам с подтвержденной тромбофилией, возможно, потребуется принять особые меры предосторожности перед операцией, планированием беременности, ожиданием длительного периода иммобилизации или выбора метода контрацепции или лечения менопаузы. Эти и другие факторы риска ВТЭ могут вызывать особую озабоченность в сочетании с известной тромбофилией. Иногда ваш врач может назначить краткосрочную профилактическую терапию, пока эти риски не будут устранены.
Эти и другие факторы риска ВТЭ могут вызывать особую озабоченность в сочетании с известной тромбофилией. Иногда ваш врач может назначить краткосрочную профилактическую терапию, пока эти риски не будут устранены.
Тестирование может быть полезным для людей, у которых подозрение на тромбофилию реально велико, в том числе у тех, у кого есть:
- Сгусток крови в молодом возрасте (т.е. до 50 лет), который не был спровоцирован.
- Сильный семейный анамнез ВТЭ, включая нескольких близких родственников, у которых был тромб в возрасте до 50 лет.
- Рецидивирующие тромбы, особенно в молодом возрасте.
- Тяжелая или обширная ВТЭ или сгустки крови в необычных местах.
Некоторые проблемы тестирования
Как и в случае любого медицинского решения, существуют опасения по поводу тестирования, поэтому скрининг на тромбофилию — это вариант, который вам и вашему врачу следует тщательно продумать вместе. Если вы решите продолжить тестирование, вам следует поработать вместе со своим врачом и генетическим консультантом. Вместе они могут помочь вам понять ваши результаты и их значение.
Вместе они могут помочь вам понять ваши результаты и их значение.
Некоторые рекомендации и предостережения при тестировании включают:
- Тестирование может быть неточным.
С помощью этих тестов возможны ложные срабатывания и отрицательные результаты, хотя это бывает редко, если тестирование проводится в нужное время. Чтобы свести к минимуму неточности, ваш врач будет избегать тестирования вас, если у вас есть активный тромб или вы принимаете разжижающие кровь лекарства, беременны или принимаете гормональную терапию эстрогенами, поскольку известно, что эти условия влияют на результаты теста.Аналогичным образом, некоторые заболевания, такие как заболевания почек и печени, также могут повлиять на результаты анализов. - Результаты обычно не влияют на решение о лечении. Если вы уже лечитесь от тромба, ни положительный, ни отрицательный результат теста на тромбофилию, скорее всего, не повлияет на ваш план лечения. Однако в случае HAD доступна стратегия предотвращения, так как уровни AT могут быть увеличены путем добавления фактора AT.
 В случае подтвержденного диагноза тромбофилия ваш врач продолжит лечение препаратами, известными как антикоагулянты.(Информацию об этих лекарствах см. В Разделе 7.) Конечно, отрицательный результат теста на тромбофилию будет облегчением. Однако очень важно, чтобы вы не полагались на ложное чувство защищенности от хороших новостей. Вы по-прежнему находитесь в группе риска на основании истории сгустков крови. Итак, продолжайте принимать прописанные лекарства и следуйте всем остальным медицинским инструкциям, например, снижение веса, поскольку ожирение является важным изменяемым фактором риска. Если у вас диагностирована тромбофилия и у вас не было сгустка крови, маловероятно, что вам дадут профилактическое лечение, если у вас нет других значительных факторов риска.Хотя все тромбофилии увеличивают риск образования тромбов, общий риск остается низким. Например, общая вероятность образования тромба составляет примерно 1-2 на 1000 человек. Если ваша тромбофилия увеличивает этот шанс в 5 раз, ваш риск по-прежнему составляет всего 1 процент или меньше.
В случае подтвержденного диагноза тромбофилия ваш врач продолжит лечение препаратами, известными как антикоагулянты.(Информацию об этих лекарствах см. В Разделе 7.) Конечно, отрицательный результат теста на тромбофилию будет облегчением. Однако очень важно, чтобы вы не полагались на ложное чувство защищенности от хороших новостей. Вы по-прежнему находитесь в группе риска на основании истории сгустков крови. Итак, продолжайте принимать прописанные лекарства и следуйте всем остальным медицинским инструкциям, например, снижение веса, поскольку ожирение является важным изменяемым фактором риска. Если у вас диагностирована тромбофилия и у вас не было сгустка крови, маловероятно, что вам дадут профилактическое лечение, если у вас нет других значительных факторов риска.Хотя все тромбофилии увеличивают риск образования тромбов, общий риск остается низким. Например, общая вероятность образования тромба составляет примерно 1-2 на 1000 человек. Если ваша тромбофилия увеличивает этот шанс в 5 раз, ваш риск по-прежнему составляет всего 1 процент или меньше. Таким образом, ваш врач может не захотеть подвергать вас потенциальным побочным эффектам антикоагулянтов, в том числе опасному для жизни кровотечению, если у вас низкий шанс образования тромба.
Таким образом, ваш врач может не захотеть подвергать вас потенциальным побочным эффектам антикоагулянтов, в том числе опасному для жизни кровотечению, если у вас низкий шанс образования тромба. - Отрицательные результаты анализов не означают, что вы не в группе риска.
Иногда люди с обширным семейным анамнезом дают отрицательный результат на тромбофилию.Однако они по-прежнему подвергаются повышенному риску образования тромбов, поскольку ВТЭ у близких членов семьи является фактором риска образования тромба в будущем. Тем не менее, пациенты и / или их врачи могут ошибочно полагать, что отрицательные результаты тестов минимизируют риск, и могут отказаться от разумных профилактических мер. - Диагноз может вызвать серьезное беспокойство Если пациенты получают диагноз тромбофилии при отсутствии других факторов риска, это может вызвать у них ненужное беспокойство, даже если результаты могут не изменить их общий профиль риска.К сожалению, многие пациенты могут чрезмерно беспокоиться, терять сон и испытывать трудности с концентрацией внимания на работе или семье.
 В худшем случае некоторые люди прибегают к ненужному лечению, которое подвергает их альтернативным рискам. В большинстве случаев положительный диагноз считается вторичным по отношению к семейному анамнезу или личному опыту с ВТЭ. Для большинства пациентов, у которых никогда не было сгустков крови, статус тромбофилии считается значимым для стратегий профилактики только тогда, когда они сталкиваются с определенными событиями со здоровьем, такими как операция или беременность, которые являются установленными сопутствующими факторами риска.
В худшем случае некоторые люди прибегают к ненужному лечению, которое подвергает их альтернативным рискам. В большинстве случаев положительный диагноз считается вторичным по отношению к семейному анамнезу или личному опыту с ВТЭ. Для большинства пациентов, у которых никогда не было сгустков крови, статус тромбофилии считается значимым для стратегий профилактики только тогда, когда они сталкиваются с определенными событиями со здоровьем, такими как операция или беременность, которые являются установленными сопутствующими факторами риска. - Тестирование может быть дорогостоящим Некоторые планы страхования не покрывают тестирование, за исключением четко определенных обстоятельств, которые демонстрируют медицинскую необходимость. Страховщики с большей вероятностью будут платить за анализы, если у вас в анамнезе аномальная свертываемость крови, но не все. Без страхового покрытия тестирование, особенно генетический скрининг, может быть довольно дорогостоящим. Любому, кто рассматривает возможность скрининга на тромбофилию, следует обратиться в свою страховую компанию, чтобы узнать критерии страхового покрытия.
 Точно так же пациенты должны заранее знать свои финансовые обязательства, включая доплаты, франшизы и выплаты наличными.Хотя офис вашего врача и лаборатория могут обрабатывать большую часть документации, убедитесь, что вы осведомлены о требованиях.
Точно так же пациенты должны заранее знать свои финансовые обязательства, включая доплаты, франшизы и выплаты наличными.Хотя офис вашего врача и лаборатория могут обрабатывать большую часть документации, убедитесь, что вы осведомлены о требованиях.
Генетическое консультирование
Также важно обратиться за советом к консультанту по генетике при тестировании на тромбофилию. Службы генетического консультирования или генетические консультанты могут помочь семьям, подверженным риску наследственных заболеваний, исследовать проблему, присутствующую в семье, интерпретировать информацию о заболевании, анализировать модели наследования, интерпретировать риски для членов семьи, анализировать доступные варианты лечения и помогать в вопросах страхования .Для получения дополнительной информации о генетическом консультировании перейдите по следующей ссылке: Национальное общество консультантов по генетическим вопросам.
Подходы к тестированию
Для многих тромбофилий первые тесты, проводимые для измерения количества и уровня активности различных белков свертывания крови. Для белков, которые играют активную роль в образовании сгустков, необычно высокие уровни предполагают, что организм вырабатывает либо слишком много, либо ненормальную версию молекулы. Для белков, которые ингибируют процесс свертывания или растворяют сгустки после завершения восстановления кровеносных сосудов, недостаточный уровень может указывать на то, что организм испытывает проблемы с производством адекватных количеств или должным образом функционирующих форм молекулы.Эти типы анализов доступны специально для антитромбина и белков C и S. Если результаты усиливают подозрение на лежащую в основе тромбофилию, может потребоваться скрининг на генетические мутации.
Для белков, которые играют активную роль в образовании сгустков, необычно высокие уровни предполагают, что организм вырабатывает либо слишком много, либо ненормальную версию молекулы. Для белков, которые ингибируют процесс свертывания или растворяют сгустки после завершения восстановления кровеносных сосудов, недостаточный уровень может указывать на то, что организм испытывает проблемы с производством адекватных количеств или должным образом функционирующих форм молекулы.Эти типы анализов доступны специально для антитромбина и белков C и S. Если результаты усиливают подозрение на лежащую в основе тромбофилию, может потребоваться скрининг на генетические мутации.
Для наиболее распространенных тромбофилий, фактора V Лейдена и протромбина G20210A доступны только генетические тесты для определения наличия характерных мутаций. Наиболее распространенные тесты используют технологии, которые умножают ДНК в образце крови на миллионы копий, чтобы можно было легко идентифицировать мутации.
Антифосфолипидные антитела — это строго приобретенная тромбофилия, поэтому генетический скрининг не требуется. Вместо этого используются несколько анализов для обнаружения высоких уровней молекул, связанных с антифосфолипидными нарушениями, включая маркеры аутоиммунного заболевания волчанки и антитела к кардиолипину жирной кислоты.
Конфиденциальность и дискриминация
Было бы нормально беспокоиться о влиянии генетического тестирования — особенно подтвержденного диагноза тромбофилии — на вашу способность застраховаться от болезней и других страховок.Благодаря агрессивным законодательным усилиям федерального правительства и многих штатов вы защищены от дискриминации со стороны работодателей, страховых компаний и других лиц на основании вашей генетической информации. Аналогичным образом, обмен этой информацией строго регулируется. Для получения дополнительной информации по этой теме щелкните ссылку Национального института исследования генома человека (NHGRI): https://www. genome.gov/10002077/
genome.gov/10002077/
Лечение и профилактика тромбов
Сгустки крови обрабатываются антикоагулянтами, также известными как антикоагулянты.Хотя эти лекарства на самом деле не разжижают кровь, они замедляют процесс свертывания, связываясь с различными белками свертывания и нейтрализуя их или снижая выработку белков свертывания в печени. 29 Это не дает существующим сгусткам увеличиваться в размерах и предотвращает образование новых сгустков, в то время как организм работает над растворением существующего сгустка.Если у вас возникнет сгусток крови, вы и ваш врач будете работать вместе, чтобы выбрать подходящий разбавитель крови и разработать план лечения, основанный на локализации, степени и серьезности сгустка, вашем риске кровотечения и других аспектах вашего общего профиля риска. 30 Цель будет заключаться в максимизации пользы от лечения при минимизации побочных эффектов. Важно, чтобы вы принимали лекарства в соответствии с указаниями, соблюдали все требования к мониторингу и немедленно сообщали о любых возможных осложнениях своему врачу.
Иногда препараты для разжижения крови назначают строго для первичной профилактики образования тромбов у людей с множественными факторами риска, включая известную тромбофилию, семейный анамнез ВТЭ и текущие проблемы со здоровьем, такие как беременность, госпитализация, предстоящая операция или длительная иммобилизация. коррелируют с более высокой частотой свертывания крови.Лица с HAD также могут получать дополнительный антитромбин в ситуациях высокого риска.
Разжижители крови очень эффективны, но могут вызывать побочные эффекты, включая умеренное или сильное кровотечение. Некоторые из этих методов лечения требуют периодического контроля, чтобы убедиться, что они работают стабильно.
Ниже приведены краткие сведения о наиболее часто назначаемых антикоагулянтах:
Нефракционированный гепарин (UFH)
Нефракционированный гепарин (НФГ) — это быстродействующий антикоагулянт, подавляющий образование тромбов в течение нескольких минут после приема.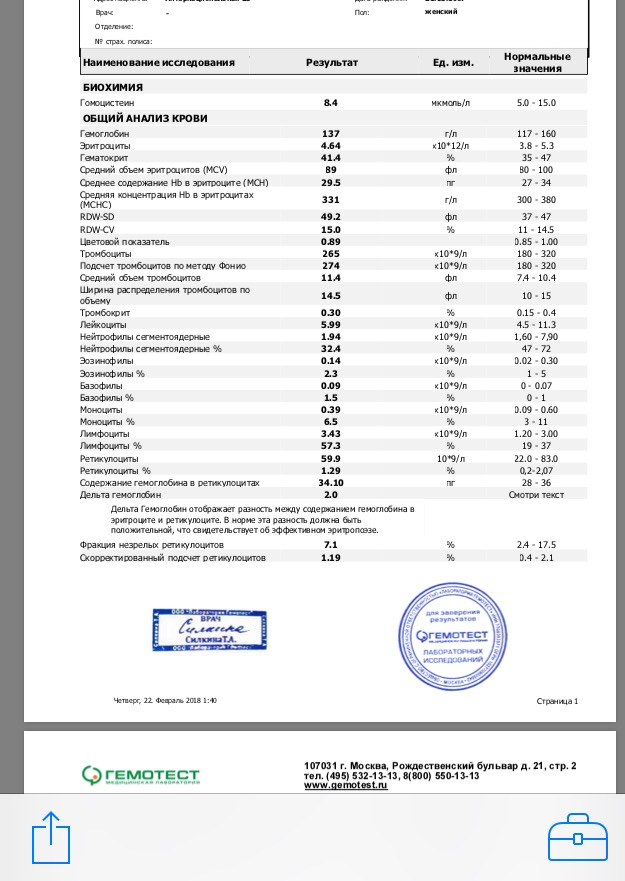
Из-за быстрого начала действия НФГ обычно является средством экстренной помощи при тромбозах. Он редко используется за пределами больницы, потому что он вводится через иглу для внутривенного (IV) введения, которую должен установить квалифицированный медицинский работник. НФГ-терапия также требует частого — обычно, по крайней мере, ежедневного — мониторинга для обеспечения адекватного уровня в крови. Первоначальная дозировка зависит от веса пациента. УВЧ нуждается в антитромбине, чтобы быть эффективным, поэтому людям с HAD может потребоваться дополнительное лечение антитромбином, чтобы добиться успеха при УВЧ-терапии.
Гепарины не проникают через плаценту, поэтому они считаются безопасными для использования беременными женщинами, хотя низкомолекулярный гепарин (см. Ниже) считается оптимальным препаратом по разным причинам.
Перед началом лечения НФГ вы должны предупредить врача, если вы принимаете обезболивающие, такие как аспирин, ибупрофен, напроксен или любой другой нестероидный противовоспалительный препарат (НПВП), поскольку они увеличивают риск кровотечения.
Низкомолекулярный гепарин (НМГ)
Альтернативный препарат гепарина, низкомолекулярный гепарин (НМГ) предлагает преимущества, аналогичные НФГ, но с некоторыми существенными отличиями.НМГ фракционируется — процесс, который разделяет и собирает мельчайшие молекулярные цепочки гепарина. Эти крошечные нити действуют более предсказуемо и служат дольше, чем молекулы НФГ. В результате, НМГ не требует частых анализов крови, необходимых для НФГ. НМГ обычно вводят через кожу, что делает его более подходящим, чем НФГ, для домашнего использования.
Однако, учитывая более длительную активность, LMWH может быть труднее, чем UFH, в случае кровотечения. Кроме того, некоторым пациентам трудно самостоятельно вводить домашние инъекции.С точки зрения затрат, LMWH дороже, чем UFH, и может быть дополнительным бременем для пациентов без адекватного страхового покрытия.
Для беременных женщин, которым требуется терапия гепарином, предпочтительны препараты гепарина НМГ. Он также часто используется у онкологических больных, у которых варфарин менее эффективен.
НМГ часто используется в качестве промежуточной терапии между НФГ и пероральным антикоагулянтом, таким как варфарин (см. Ниже).
LMWH нуждается в антитромбине, чтобы быть эффективным, поэтому людям с HAD может потребоваться дополнительное лечение антитромбином для успешной терапии LMWH.
Перед началом лечения НМГ вы должны предупредить врача, если вы принимаете обезболивающие, такие как аспирин, ибупрофен, напроксен или любой другой нестероидный противовоспалительный препарат (НПВП), поскольку они увеличивают риск кровотечения.
Варфарин
Людям, которым требуется промежуточная или длительная терапия антикоагулянтами, часто назначают варфарин (кумадин®), антикоагулянт, успешно применяемый с 1950-х годов.
Варфарин принимают внутрь, поэтому он очень подходит для домашнего применения и исключает необходимость болезненных и неудобных инъекций или инфузий.Его формула для приема один раз в день улучшает комплаентность пациента, что является критической проблемой для управления тромбами в амбулаторных условиях. Хотя варфарин может вызывать кровотечение, характерное для всех разжижающих кровь препаратов, его эффекты легко обращаются в случае осложнений.
Хотя варфарин может вызывать кровотечение, характерное для всех разжижающих кровь препаратов, его эффекты легко обращаются в случае осложнений.
Дозировка варфарина индивидуальна и не зависит от веса. Следовательно, требуется частый контроль с помощью теста, называемого протромбиновым временем или ПВ. PT измеряет время, необходимое для свертывания крови. PT-тест используется, чтобы убедиться, что пациент принимает правильную дозу варфарина.Лаборатория сообщает о ПВ как о международном нормализованном соотношении или INR. Для большинства пациентов идеальный диапазон МНО составляет от 2,0 до 3,0. Показания ниже 2,0 увеличивают вероятность образования сгустка, а результаты выше 3,0 повышают риск кровотечения.
Варфарин проникает через плаценту и разжижает кровь плода, поэтому его не следует принимать беременным женщинам, за исключением очень ограниченных случаев. Варфарин — лучший разжижитель крови для пациентов с механическими сердечными клапанами, поэтому женщинам с сердечными клапанами следует обсудить лечение со своим кардиологом и акушером, прежде чем забеременеть. Варфарин обычно не содержится в грудном молоке, поэтому подходит для кормящих мам.
Варфарин обычно не содержится в грудном молоке, поэтому подходит для кормящих мам.
Многие продукты взаимодействуют с варфарином, особенно продукты с высоким содержанием витамина К, такие как многие зеленые листовые овощи. Алкоголь также может влиять на уровень варфарина, поэтому пациенты, которые пьют, должны потреблять не более 1-2 порций в день.
Как и при любой антикоагулянтной терапии, при приеме варфарина следует избегать таких НПВП, как аспирин и ибупрофен. Сообщите своему врачу, если вы в настоящее время принимаете какие-либо из этих препаратов, прежде чем начинать режим варфарина.
Пероральные антикоагулянты прямого действия (DOAC)
Новейшая категория разжижителей крови, пероральные антикоагулянты прямого действия (DOAC), предлагает смесь агентов короткого и длительного действия с хорошими профилями безопасности и относительно низким риском кровотечения. Эти лекарства были тщательно изучены и считаются не менее безопасными, чем традиционные методы лечения. 31 Члены этого класса соединений включают апиксабан (Eliquis®), бетриксабан (BevyxXa®), дабигатран (Pradaxa®), эдоксабан (Savaysa®) и ривароксабан (Xarelto®).
31 Члены этого класса соединений включают апиксабан (Eliquis®), бетриксабан (BevyxXa®), дабигатран (Pradaxa®), эдоксабан (Savaysa®) и ривароксабан (Xarelto®).
DOAC блокируют различные белки, которые играют важную роль в производстве фибрина, важного компонента сгустков крови. Они предсказуемо работают при фиксированных дозах, поэтому не требуют регулярного контроля. 32 DOAC также имеют меньше лекарств и взаимодействий с пищей, чем стандартные методы лечения. Для должным образом отобранных пациентов DOAC могут в конечном итоге заменить обычные антикоагулянты в качестве предпочтительного лечения. 33
Существует ограниченная информация о DOAC во время беременности, но исследования на животных показывают, что они могут вызывать побочные эффекты, поэтому их следует избегать у беременных женщин. 34 Точно так же их следует использовать с осторожностью у людей с почечной или печеночной недостаточностью. Кроме того, только один DOAC, дабигатран, имеет противоядие, которое быстро отменяет его антикоагулянтный эффект в случае серьезного кровотечения или неотложной операции. В результате большинство этих препаратов не подходят для людей с высоким риском кровотечений.
В результате большинство этих препаратов не подходят для людей с высоким риском кровотечений.
Опять же, любой, кому прописали DOAC, должен уведомить своего врача, если он принимает аспирин или другие НПВП для облегчения боли, поскольку они увеличивают риск кровотечения.
Изменения образа жизни для снижения риска образования тромбов
Для людей, у которых образовался тромб или которым медицинский работник сказал, что они подвержены повышенному риску ТГВ или ПЭ, различные изменения образа жизни могут обеспечить дополнительную защиту. В целом, важно оставаться здоровым и активным. Пейте много жидкости, желательно воды, чтобы избежать обезвоживания. Соблюдайте сбалансированную диету, включающую разнообразные питательные продукты, которые не влияют на эффективность любых принимаемых вами разжижителей крови.Выбирайте упражнения, виды спорта и другие занятия, которые вам нравятся и соответствуют вашему состоянию здоровья. Физические упражнения поддерживают движение крови и хорошее кровообращение. Это также помогает вам сбросить или поддерживать вес тела и улучшить функцию легких.
Это также помогает вам сбросить или поддерживать вес тела и улучшить функцию легких.
Известно, что периоды длительной неподвижности, такие как очень длительные перелеты на самолете или продолжительные периоды малоподвижного поведения (например, сидение за рабочим столом или на диване перед телевизором), повышают вероятность образования тромба. Во время путешествий, особенно заграничных, старайтесь не сидеть на месте все это время.Когда горит знак «без ремня безопасности», периодически выходите в проход, чтобы пройтись или потянуться. Если вам необходимо оставаться в сидячем положении, не скрещивайте ноги, потому что это ослабляет кровообращение. Точно так же вы можете выполнять упражнения для стопы и голеностопного сустава с минимальным движением, например вращать лодыжками или качать стопы. Во втором случае поставьте ступни на пол и поочередно поднимайте пальцы ног и пятки.
Эти упражнения также могут быть полезны, если вы каждый день много часов сидите за своим рабочим столом. Аналогичным образом, рекомендуется установить будильник на мобильном телефоне в качестве напоминания о необходимости вставать и ходить по холлу каждые час или два.Если ваш график позволяет, выйдите на обед на улицу вместо того, чтобы заказывать еду.
Аналогичным образом, рекомендуется установить будильник на мобильном телефоне в качестве напоминания о необходимости вставать и ходить по холлу каждые час или два.Если ваш график позволяет, выйдите на обед на улицу вместо того, чтобы заказывать еду.
Если у вас сложная работа за столом или вам приходится много путешествовать, посоветуйтесь со своим врачом о компрессионных чулках, которые предназначены для легкого давления на ваши ноги и ступни для улучшения кровотока.
Отказ от курения — одно из лучших изменений, которые вы можете сделать для общего здоровья и, в частности, для снижения риска образования тромбов. Курение сужает кровеносные сосуды и в сочетании с жирной диетой увеличивает образование бляшек на стенках сосудов.Все эти физические воздействия повышают вероятность образования тромба. Если вы используете разбавители крови, внесите изменения, которые снизят вероятность порезов и других травм, которые могут вызвать чрезмерное кровотечение. Во-первых, избегайте занятий, которые увеличивают эти опасности, например контактных видов спорта. Если вы катаетесь на велосипеде, лыжах или коньках, убедитесь, что вы носите обычное защитное снаряжение для защиты от травм.
Если вы катаетесь на велосипеде, лыжах или коньках, убедитесь, что вы носите обычное защитное снаряжение для защиты от травм.
Дома при бритье используйте электробритвы. Будьте особенно осторожны при стрижке ногтей и волос машинкой для стрижки или ножницами.Изучите и применяйте более безопасные методы измельчения и нарезки продуктов во время приготовления. Подумайте о кухонных инструментах, предназначенных для уменьшения потребности в столовых приборах, таких как кухонные комбайны и ручные инструменты для нарезки мяса с экранированными лезвиями. Для ухода за полостью рта используйте мягкую или очень мягкую зубную щетку и вощеную нить, чтобы свести к минимуму кровотечение десен. Поговорите со своим врачом о других разумных шагах, которые вы можете предпринять, чтобы снизить риск образования тромбов.
Когда показано обследование на тромбофилию?
Случай
Здоровая женщина 42 лет поступила в больницу с острой плевритной болью в груди и одышкой.Она не делала в последнее время операций, не принимает лекарств, ведет активный образ жизни. Сканирование вентиляции-перфузии легких показывает высокую вероятность легочной эмболии (ЛЭ). В анамнезе пациентки отмечены две потери беременности во втором триместре. Пациенту назначен низкомолекулярный гепарин и варфарин (LMHW).
Сканирование вентиляции-перфузии легких показывает высокую вероятность легочной эмболии (ЛЭ). В анамнезе пациентки отмечены две потери беременности во втором триместре. Пациенту назначен низкомолекулярный гепарин и варфарин (LMHW).
Следует ли этому пациенту пройти обследование на тромбофилию?
Предпосылки
В настоящее время тромбофилию можно идентифицировать более чем у половины всех пациентов с ВТЭ, а тестирование на основные причины тромбофилии стало широко распространенным. 1 Врачи считают, что тестирование на тромбофилию часто меняет лечение пациентов с ВТЭ. 2
Тромбофилии можно разделить на три основные категории: дефицит естественных ингибиторов коагуляции, аномальная функция или повышенный уровень факторов свертывания крови и приобретенные тромбофилии (см. Таблицу 1).
Распространенность конкретных тромбофилий широко варьирует. Например, распространенность резистентности к активированному протеину С (лейденская мутация фактора V) составляет от 3% до 7%.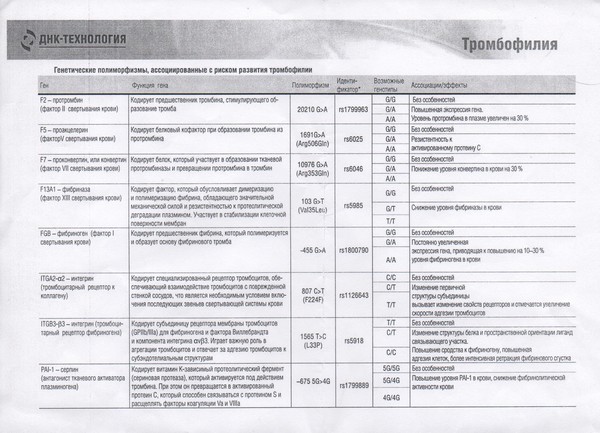 Для сравнения, распространенность дефицита антитромбина оценивается в 0,02%. Каждая тромбофилия связана с повышенным риском ВТЭ, но уровень риска, связанный с данной тромбофилией, сильно варьируется. 1
Для сравнения, распространенность дефицита антитромбина оценивается в 0,02%. Каждая тромбофилия связана с повышенным риском ВТЭ, но уровень риска, связанный с данной тромбофилией, сильно варьируется. 1
Перед тестированием на тромбофилию при острой ВТЭ оцените риск рецидива ВТЭ, определив, был ли тромбоз спровоцирован или нет. Событие ВТЭ считается спровоцированным, если оно произошло во время беременности в течение предыдущих трех месяцев; эстрогеновая терапия; неподвижность от острого заболевания более одной недели; путешествие продолжительностью более шести часов; травма ноги, перелом или операция в течение предыдущих трех месяцев; или активная злокачественная опухоль (см. таблицу 2,). 3 Частота рецидивов неспровоцированной ВТЭ составляет 7,4% на пациента в год по сравнению с 3,3% на пациента в год для спровоцированных ВТЭ; риск еще ниже (0,7% на пациента в год), если фактор риска спровоцированной ВТЭ был хирургическим. 4
Тестирование на тромбофилию показано, если результаты добавят значительную прогностическую информацию за пределы истории болезни, или если это изменит лечение пациента, в частности, интенсивность или продолжительность антикоагуляции.
Обзор данных
Влияет ли наличие тромбофилии на интенсивность антикоагуляции при ВТЭ?
Если тромбофилия увеличивает риск рецидива ВТЭ на фоне антикоагулянтной терапии, то более интенсивный уровень антикоагуляции может предотвратить будущую ВТЭ.Нет исследований, посвященных более высокой интенсивности антикоагуляции, но если стандартная антикоагуляция была недостаточна для пациентов с идентифицируемой тромбофилией, можно было бы ожидать увеличения частоты рецидивов среди пациентов с тромбофилией, получавших стандартную терапию варфарином.
В дополнительном исследовании расширенной антикоагулянтной терапии низкой интенсивности при неспровоцированной венозной тромбоэмболии (ELATE) риск рецидива ВТЭ среди лечившихся субъектов был в целом очень низким, а наличие тромбофильных аномалий не было связано со значительно более высоким риском. 5 Обсервационные исследования показали, что частота рецидивов ВТЭ низкая у пациентов, получавших варфарин, с тромбофилией или без нее.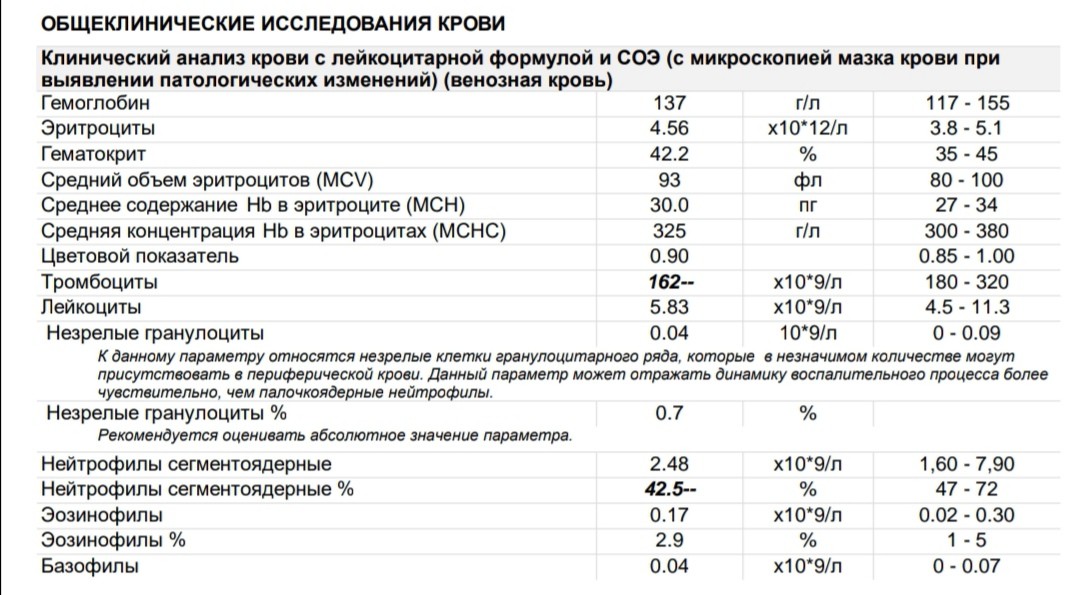 6-8
6-8
Было оценено влияние начального уровня антикоагуляции на рецидив после завершения периода лечения. Хотя одно исследование показало, что пациенты с низкими уровнями антикоагуляции подвергались повышенному риску последующей ВТЭ, это не было подтверждено в Лейденском исследовании тромбофилии (LETS). 9,10
В целом, большинство данных не предполагают значительного увеличения риска рецидива ВТЭ у пациентов с тромбофилией, получавших стандартные антикоагулянты.Следовательно, лечения варфарином до целевого МНО от 2 до 3 достаточно.
Влияет ли наличие тромбофилии на продолжительность лечения ВТЭ?
Основное решение, с которым сталкиваются клиницисты при уходе за пациентами с ВТЭ, — это продолжительность лечения антикоагулянтами. Текущая рекомендация ACCP для лечения спровоцированной ВТЭ составляет три месяца, а лечение неспровоцированной ВТЭ — три месяца или пожизненно. 11 Если наличие тромбофилии увеличивает риск рецидива после прекращения лечения антикоагулянтами, может быть показана более длительная продолжительность лечения. Одной из целей тестирования на тромбофилию должно быть выявление таких пациентов.
Одной из целей тестирования на тромбофилию должно быть выявление таких пациентов.
В целом, частота рецидивов после первой ВТЭ высока: кумулятивная частота составляет 25% через пять лет, 30% через восемь лет и 56% через 20 лет. 12,13
Дефицит естественных ингибиторов коагуляции.
Согласно некоторым исследованиям, дефицит естественного ингибитора коагуляции был связан с риском рецидива ВТЭ до 10% в год. 6,14 Однако оценки основаны на исследованиях, в которых участвовали люди из семей, склонных к тромбозу, и систематическая ошибка отбора могла способствовать высокой частоте рецидивов. 1 В неотобранной популяции, представленной в исследовании LETS, оценочный риск рецидива у пациентов с недостаточностью ингибиторов наблюдался лишь незначительно. 15
Тестирование на дефицит ингибиторов дает мало прогностической информации, кроме той, которая была получена при определении того, является ли событие ВТЭ спровоцированным или неспровоцированным.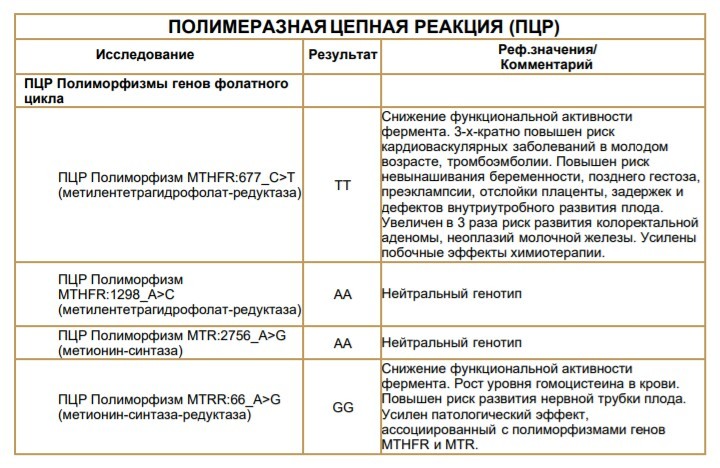 В исследованиях, в которых отдельно изучались субъекты с спровоцированной и неспровоцированной ВТЭ, дефицит ингибитора не связан с повышенным риском рецидива. 15,16
В исследованиях, в которых отдельно изучались субъекты с спровоцированной и неспровоцированной ВТЭ, дефицит ингибитора не связан с повышенным риском рецидива. 15,16
Нарушение функции или уровня факторов антикоагуляции.
Фактор V Лейдена (FVL) является наиболее частой причиной наследственной тромбофилии и связан с шестикратным увеличением риска ВТЭ, в то время как мутация гена протромбина связана с двукратным увеличением. 17,18
Напротив, доказательства, связывающие эти мутации с риском рецидивов ВТЭ, не столь последовательны. Хотя исследование, проведенное в специализированном центре в Италии, выявило повышенный риск рецидива при использовании Лейденского фактора V или мутации гена протромбина, большой метаанализ 23 исследований выявил повышенный риск только при использовании фактора V Лейдена. 19,20 Другой метаанализ продемонстрировал лишь умеренное повышение риска рецидива у субъектов с лейденским фактором V или мутацией гена протромбина, а проспективное исследование, проведенное в Австрии, не обнаружило повышенного риска рецидива с фактором V Leiden через два года после прекращения антикоагуляции. . 18,21 Кроме того, при использовании пациентов с неспровоцированной ВТЭ в качестве эталона не было повышенного риска рецидива среди пациентов, гомозиготных по фактору V Лейдена или мутации гена протромбина. 22
. 18,21 Кроме того, при использовании пациентов с неспровоцированной ВТЭ в качестве эталона не было повышенного риска рецидива среди пациентов, гомозиготных по фактору V Лейдена или мутации гена протромбина. 22
Таким образом, несмотря на то, что дефекты лейденского фактора V и гена протромбина связаны с повышенным риском рецидива ВТЭ, величина увеличения риска умеренная и, следовательно, не должна влиять на продолжительность терапии.
Приобретенная тромбофилия.
Похоже, что единственное тромбофильное состояние, которое может иметь значительное влияние на риск рецидива, — это антифосфолипидный синдром. Прекращение терапии варфарином у пациентов с тромбозом, связанным с антифосфолипидными антителами, несет 69% риск повторного тромбоза в течение года. 23 Некоторые исследования показали, что наличие специфических антител (т. Е. Антикардиолипиновых антител) связано с повышенным риском у пациентов с антифосфолипидным синдромом.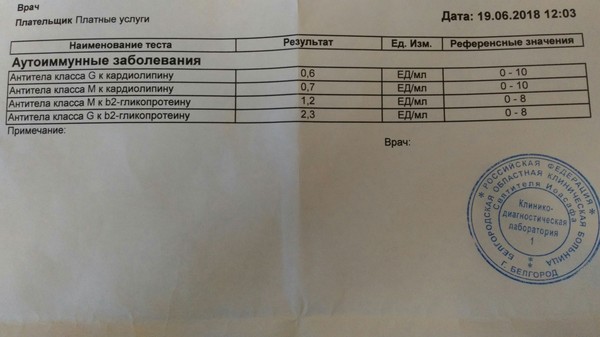 24
24
Однако в настоящее время все пациенты с ВТЭ и антифосфолипидным синдромом должны быть кандидатами на пожизненную антикоагулянтную терапию. Тестирование на антифосфолипидные антитела следует проводить у пациентов с подозрительным анамнезом, в том числе с рецидивирующей потерей плода или однократной потерей плода через 10 недель, или с известным заболеванием коллагеновых сосудов. 25
Роль спровоцированных и неспровоцированных ВТЭ.
Было показано, что определение того, является ли ВТЭ спровоцированной или неспровоцированной, является важным предиктором рецидива.Например, одно проспективное когортное исследование показало, что частота рецидивов за два года равна нулю у пациентов с хирургическим вмешательством или связанной с беременностью ВТЭ, 9% с другими спровоцированными ВТЭ и 19% с неспровоцированными ВТЭ. 26 В том же исследовании тест на тромбофилию не смог надежно предсказать риск рецидива.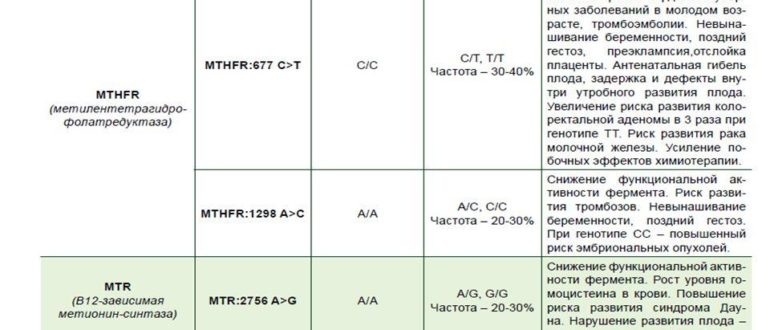 Пациенты с неспровоцированной ВТЭ, у которых было обнаружено отсутствие дефекта, имели такой же высокий риск рецидива ВТЭ, как и пациенты с тромбофилией. 27
Пациенты с неспровоцированной ВТЭ, у которых было обнаружено отсутствие дефекта, имели такой же высокий риск рецидива ВТЭ, как и пациенты с тромбофилией. 27
Наиболее важным предиктором рецидива ВТЭ является то, было ли спровоцировано первое событие, а тестирование на тромбофилию дает мало дополнительной прогностической информации. 28
ВТЭ как многофакторное заболевание.
Становится все более очевидным, что ВТЭ является многофакторным заболеванием, вызванным взаимодействием генотипических, фенотипических факторов и факторов окружающей среды. В случае неспровоцированной ВТЭ у пациента уже имеется значительно повышенный риск рецидива, и дальнейшие исследования известных причин тромбофилии, по-видимому, добавляют очень мало дополнительной информации. Оптимальная продолжительность антикоагулянтной терапии при неспровоцированной ВТЭ неясна, но текущие рекомендации предлагают не менее трех месяцев, и врачи должны рассмотреть возможность лечения на протяжении всей жизни.
В подавляющем большинстве случаев тестирование на тромбофилию не влияет на лечение ВТЭ и не является оправданным. Пациентам с синдромом антифосфолипидных антител, учитывая высокий риск рецидива, может быть показана длительная антикоагулянтная терапия после первой ВТЭ. У некоторых пациентов с клинической картиной, указывающей на синдром антифосфолипидных антител, или с сильным семейным анамнезом, следует рассмотреть возможность тестирования.
Обратно к делу
Похоже, что у нашего пациента неспровоцированная ВТЭ.Она должна регулярно получать антикоагулянтную терапию варфарином с целевым МНО от 2 до 3 в течение как минимум трех месяцев. Следует рассмотреть возможность пожизненной антикоагулянтной терапии. Тестирование на наследственную тромбофилию не повлияет на текущее лечение или продолжительность лечения и, следовательно, не показано. Однако анамнез пациента наводит на мысль о синдроме антифосфолипидных антител, поэтому ее следует обследовать. Если установлен диагноз антифосфолипидного синдрома, следует рассмотреть возможность пожизненной антикоагуляции./8/8.jpg)
Bottom Line
Неспровоцированное VTE обеспечивает самый надежный предсказатель повторения. Тесты на тромбофилию мало помогают в прогнозировании рецидива и редко показаны.
Д-р Стехликова — клинический госпиталист в отделении больничной медицины, медицинском отделении Медицинского колледжа Альберта Эйнштейна и Медицинского центра Монтефиоре в Бронксе, штат Нью-Йорк. Доктор Мартин является директором Службы госпиталистов Эйнштейна. Д-р Джанакирам — научный сотрудник отделения гематологии Эйнштейна, а д-р.Корчак — инструктор Эйнштейна в отделе медицины и директор Медицинской службы Вейлера. Д-р Галхотра — заместитель директора по качеству стационарных пациентов в отделении медицины Эйнштейна; Доктор Авербух — академический госпиталист; и Д-р Южный — начальник отдела больничной медицины Эйнштейна.
Каталожные номера
- Middeldorp S, van Hylckama Vlieg A.Помогает ли тестирование на тромбофилию в клиническом ведении пациентов? Br J Haematol . 2008; 143: 321-335.
- Coppens M, van Mourik JA, Eckmann CM, Büller HR, Middeldorp S. Текущая практика тестирования на наследственную тромбофилию. J Thromb Haemost . 2007; 5: 1979-1981.
- Прандони П., Новента Ф., Гирардуцци А. и др. Риск рецидива венозной тромбоэмболии после прекращения антикоагулянтной терапии у пациентов с острым проксимальным тромбозом глубоких вен или тромбоэмболией легочной артерии.Проспективное когортное исследование с участием 1626 пациентов. Haematologica . 2007; 92: 199-205.
- Иорио А., Кеарон С., Филиппуччи Э. и др. Риск рецидива после первого эпизода симптоматической венозной тромбоэмболии, спровоцированной временным фактором риска: систематический обзор. Arch Intern Med . 2010; 170: 1710-1716.
- Кеарон С., Джулиан Дж. А.
 , Ковач М. Дж. И др. Влияние тромбофилии на риск рецидива венозной тромбоэмболии при приеме варфарина: результаты рандомизированного исследования. Кровь . 2008; 112: 4432-4436.
, Ковач М. Дж. И др. Влияние тромбофилии на риск рецидива венозной тромбоэмболии при приеме варфарина: результаты рандомизированного исследования. Кровь . 2008; 112: 4432-4436. - Vossen CY, Walker ID, Svensson P, et al. Частота рецидивов после первого венозного тромбоза у пациентов с семейной тромбофилией. Артериосклер тромб Vasc Biol . 2005; 25: 1992–1997.
- Браун К., Ладдингтон Р., Уильямсон Д., Бейкер П., Баглин Т. Риск венозной тромбоэмболии, связанной с переходом из G в A в положении 20210 в 3′-нетранслируемой области гена протромбина. Br J Haematol . 1997; 98: 907-909.
- Schulman S, Tengborn L. Лечение венозной тромбоэмболии у пациентов с врожденной недостаточностью антитромбина III. Тромб Гемост . 1992; 68: 634-636.
- Palareti G, Legnani C, Cosmi B, Guazzaloca G, Cini M, Mattarozzi S. Низкое качество антикоагуляции в первые 3 месяца после неспровоцированной венозной тромбоэмболии является фактором риска долгосрочного рецидива.
 J Thromb Haemost. 2005; 3: 955-961.
J Thromb Haemost. 2005; 3: 955-961. - Gadisseur AP, Christiansen SC, van der Meer FJ, Rosendaal FR.Качество пероральной антикоагулянтной терапии и повторяющиеся венозные тромботические явления в исследовании Leiden Thrombophilia Study. J Thromb Haemost. 2007; 5: 931-936.
- Кеарон С., Кан С.Р., Аньелли Дж., Голдхабер С., Раскоб Г.Е., Комерота А.Дж. Антитромботическая терапия венозной тромбоэмболической болезни: Научно обоснованные клинические практические рекомендации Американского колледжа грудных врачей (8-е издание). Сундук . 2008; 133: 454С-545С.
- Prandoni P, Lensing AW, Cogo A, et al. Отдаленное клиническое течение острого тромбоза глубоких вен. Энн Интерн Мед. . 1996; 125: 1-7.
- Laczkovics C, Grafenhofer H, Kaider A, et al. Риск рецидива после первого венозного тромбоэмболического события у молодых женщин. Haematologica . 2007; 92: 1201-1207.
- Brouwer JL, Lijfering WM, Ten Kate MK, Kluin-Nelemans HC, Veeger NJ, van der Meer J.
 Высокий долгосрочный абсолютный риск рецидива венозной тромбоэмболии у пациентов с наследственной недостаточностью протеина S, протеина C или антитромбина. Тромб Гемост .2009; 101: 93-99.
Высокий долгосрочный абсолютный риск рецидива венозной тромбоэмболии у пациентов с наследственной недостаточностью протеина S, протеина C или антитромбина. Тромб Гемост .2009; 101: 93-99. - Christiansen SC, Cannegieter SC, Koster T, Vandenbroucke JP, Rosendaal FR. Тромбофилия, клинические факторы и повторяющиеся венозные тромботические события. ЯМА . 2005; 293: 2352-2361.
- Де Стефано В., Симиони П., Росси Е. и др. Риск рецидива венозной тромбоэмболии у пациентов с наследственной недостаточностью природных антикоагулянтов, антитромбина, протеина С и протеина S. Haematologica . 2006; 91: 695-698.
- Цена ДТ, Ридкер П.М. Фактор V лейденской мутации и риски тромбоэмболической болезни: клиническая перспектива. Энн Интерн Мед. . 1997; 127: 895-903.
- Хо В.К., Хэнки Дж. Дж., Куинлан Д. Д., Эйкельбум Дж. В.. Риск рецидива венозной тромбоэмболии у пациентов с общей тромбофилией: систематический обзор. Arch Intern Med .
 2006; 166: 729-736.
2006; 166: 729-736. - Simioni P, Prandoni P, Lensing AW, et al. Риск последующих венозных тромбоэмболических осложнений у носителей протромбина или мутации гена фактора V с первым эпизодом тромбоза глубоких вен. Кровь . 2000; 96: 3329-3333.
- Segal JB, Brotman DJ, Necochea AJ, et al. Прогностическая ценность фактора V Лейдена и протромбина G20210A у взрослых с венозной тромбоэмболией и у членов семей с мутацией: систематический обзор. ЯМА . 2009; 301: 2472-2485.
- Eichinger S, Pabinger I., Stumpflen A, et al. Риск рецидива венозной тромбоэмболии у пациентов с фактором V и без него. Лейден. Тромб Гемост . 1997; 77: 624-628.
- Lijfering WM, Middeldorp S, Veeger NJ, et al.Риск рецидива венозного тромбоза у гомозиготных носителей и двойных гетерозиготных носителей фактора V Лейдена и протромбина G20210A. Тираж . 2010; 121 (15): 1706-1712.
- Khamashta MA, Cuadrado MJ, Mujic F, Taub NA, Hunt BJ, Hughes GR. Лечение тромбоза при синдроме антифосфолипид-антитела.
 N Engl J Med . 1995; 332: 993-997.
N Engl J Med . 1995; 332: 993-997. - Schulman S, Svenungsson E, Granqvist S. Антикардиолипиновые антитела предсказывают ранний рецидив тромбоэмболии и смерть среди пациентов с венозной тромбоэмболией после антикоагулянтной терапии.Продолжительность группы исследования антикоагуляции. Am J Med . 1998; 104: 332-338.
- Pengo V, Tripodi A, Reber G и др. Обновление рекомендаций по выявлению антикоагулянтов при волчанке. Подкомитет по волчаночным антикоагулянтам / антифосфолипидным антителам Комитета по науке и стандартизации Международного общества по тромбозам и гемостазу. J Thromb Haemost. 2009; 7: 1737-1740.
- Баглин Т., Ладдингтон Р., Браун К., Баглин С. Частота рецидивов венозной тромбоэмболии в связи с клиническими и тромбофильными факторами риска: проспективное когортное исследование.Ланцет. 2003; 362: 523-526.
- Rosendaal FR. Один раз и только один раз. Тираж . 2010; 121: 1688-1690.
- Dalen JE. Следует ли обследовать пациентов с венозной тромбоэмболией на тромбофилию? Am J Med .
 2008; 121: 458-463.
2008; 121: 458-463.
Связь между врожденной тромбофилией и исходами у пациентов с тромбоэмболией легочной артерии | Кровавые достижения
Легочная эмболия (ТЭЛА), один из основных типов венозной тромбоэмболии (ВТЭ), представляет собой опасное для жизни заболевание.Это также важная проблема общественного здравоохранения, которая стала третьим по распространенности сердечно-сосудистым заболеванием со смертельным исходом в мире. 1 Хотя связь между врожденной тромбофилией и тромбозом глубоких вен (ТГВ) и их этническими различиями была выяснена, 2-4 роль врожденной тромбофилии у пациентов с ТЭЛА еще предстоит определить, независимо от этнической принадлежности.
Наиболее распространенные типы врожденной тромбофилии включают лейденскую мутацию фактора V, мутацию протромбина G20210A, дефицит протеина C (PCD), дефицит протеина S (PSD) и дефицит антитромбина III (ATIII).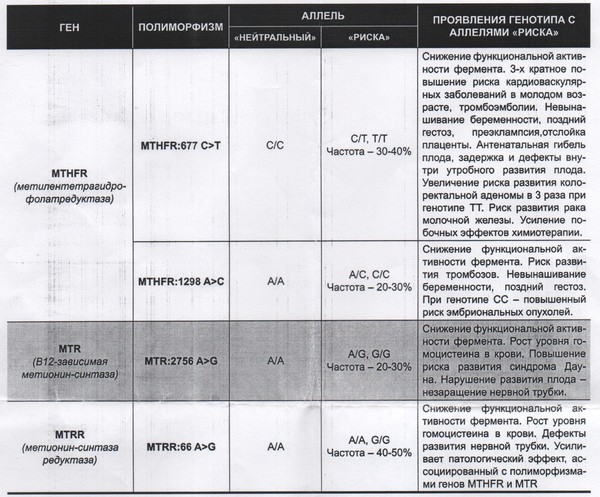 Распространенность врожденной тромбофилии разнообразна и зависит от этнической принадлежности. 5 Лейденские мутации фактора V и протромбина G20210A составляют> 60% случаев врожденной тромбофилии у белых пациентов, 3,6,7 , в то время как дефицит антикоагулянтов, таких как протеин C, протеин S и ATIII, является основными подтипами врожденной тромбофилии у белых пациентов. Азиатские пациенты. 8-11
Распространенность врожденной тромбофилии разнообразна и зависит от этнической принадлежности. 5 Лейденские мутации фактора V и протромбина G20210A составляют> 60% случаев врожденной тромбофилии у белых пациентов, 3,6,7 , в то время как дефицит антикоагулянтов, таких как протеин C, протеин S и ATIII, является основными подтипами врожденной тромбофилии у белых пациентов. Азиатские пациенты. 8-11
Однако большинство предыдущих исследований врожденной тромбофилии в основном были сосредоточены на пациентах с ТГВ.Только в одном небольшом исследовании из Южной Кореи изучалась распространенность и генетический фон тромбофилии у пациентов с ТЭЛА. 12 Влияние врожденной тромбофилии на пациентов с ТЭЛА с факторами риска или без них, а также на исходы пациентов с ТЭЛА не определялось. Настоящее исследование направлено на изучение распространенности и распределения 5 известных подтипов врожденной тромбофилии в большой группе пациентов с ТЭЛА и оценки влияния врожденной тромбофилии на заболеваемость и исходы ТЭЛА.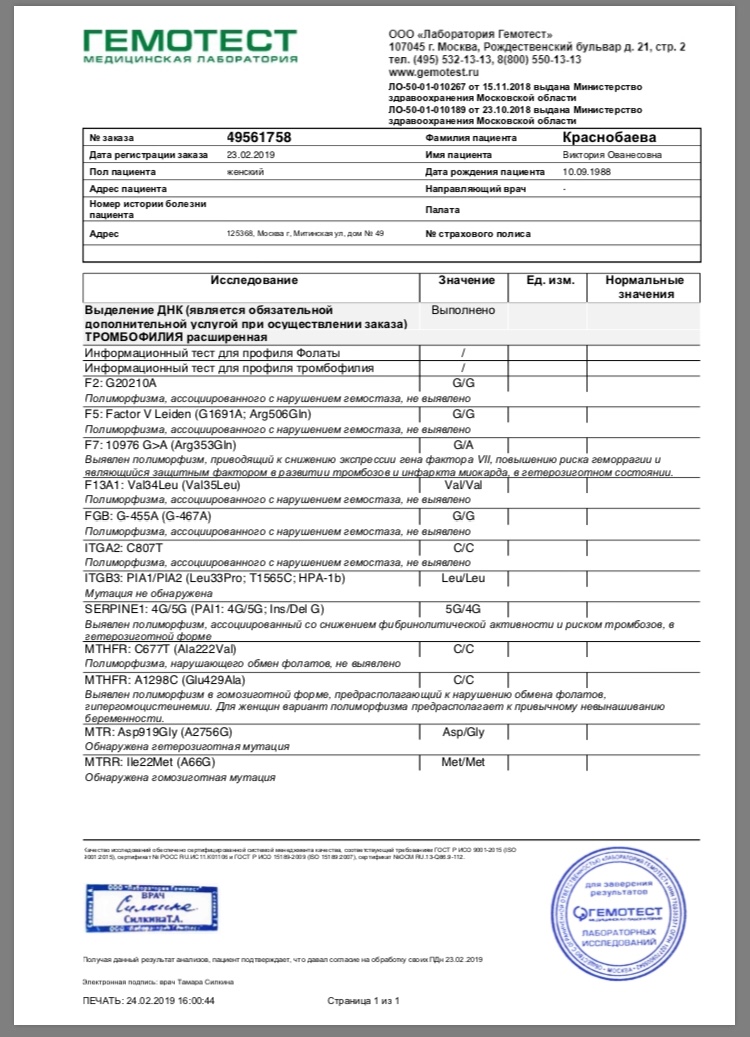
Это исследование было проведено в Центре тромбозов и сосудистой медицины больницы FuWai при Китайской академии медицинских наук (Пекин, Китай), национальном справочном центре по ПЭ. Исследование проводилось в период с мая 2013 года по июнь 2018 года. Пациенты с ПЭ последовательно включались в исследование, когда была диагностирована ПЭ. Диагноз ТЭЛА был основан на стандартизированной диагностической работе с ТЭЛА следующим образом: пациенты оценивались с помощью компьютерной томографии, ангиографии легких (КТПА) или вентиляции / перфузионного сканирования на предмет ТЭЛА и компрессионного УЗИ на предмет ТГВ.Пациенты, которые отказались участвовать в генетическом тестировании, или те, кто не соответствовал критериям тестирования на врожденные антикоагулянты, были исключены. Это исследование было одобрено наблюдательным советом больницы FuWai.
Выборка состояла из пациентов с ТЭЛА с факторами риска и пациентов с ТЭЛА без факторов риска. Факторы риска были основаны на рекомендациях Европейского общества кардиологов от 2019 г., 13 , включая активный рак, застойную сердечную недостаточность, инфаркт миокарда, паралитический инсульт, постельный режим> 3 дней, беременность, послеродовой период, использование оральных контрацептивов, серьезные травмы, хирургические операции, использование гипсовой повязки в течение 3 месяцев до события, антифосфолипидный синдром (APS) и другие аутоиммунные заболевания.
Факторы риска были основаны на рекомендациях Европейского общества кардиологов от 2019 г., 13 , включая активный рак, застойную сердечную недостаточность, инфаркт миокарда, паралитический инсульт, постельный режим> 3 дней, беременность, послеродовой период, использование оральных контрацептивов, серьезные травмы, хирургические операции, использование гипсовой повязки в течение 3 месяцев до события, антифосфолипидный синдром (APS) и другие аутоиммунные заболевания.
Были собраны данные, касающиеся истории болезни пациента с ВТЭ, места тромбоэмболии (с или без ТГВ) и начального лечения. Всем пациентам был оперативно поставлен диагноз, и они наблюдались в течение ≥3 месяцев. Пациенты с диагнозом тромбофилия должны были получать длительную антикоагулянтную терапию, в то время как пациенты без тромбофилии должны были пройти 6 месяцев антикоагулянтной терапии. Общий дизайн исследования представлен на Рисунке 1.
Рисунок 1.
Рисунок 1.
Врожденный дефицит антикоагулянтов определялся снижением антикоагулянтной активности <2 стандартного отклонения (SD) после исключения возможных приобретенных факторов, таких как применение дикумарола и гепарина, аутоиммунных заболеваний, злокачественных новообразований и беременности. Тесты включали скрининг активности протеина C (HemosIL Protein C, Instrumentation Laboratory Company), активности протеина S (ProS, Instrumentation Laboratory Company) и активности антитромбина III (HemosIL Liquid Antithrombin, Instrumentation Laboratory Company).Белок C и ATIII анализировали с помощью анализов хромогенного субстрата, тогда как белок S определяли с помощью анализа свертывания с использованием ACL TOP 700 (Instrumentation Laboratory Company). Референсные диапазоны были определены в соответствии с нашими лабораторными данными, и тесты были повторены дважды, с интервалом не менее 1 недели. Как минимум, 1 тест был проведен через 1 месяц после нового события VTE. 4,15 Первый тест на тромбофилию был проведен на следующий день после постановки диагноза ПЭ. В случае положительного результата теста на тромбофилию тест повторяли через 7 дней.Пациенты с постоянным снижением антикоагулянтной активности были повторно проверены через 3 месяца наблюдения.
Как минимум, 1 тест был проведен через 1 месяц после нового события VTE. 4,15 Первый тест на тромбофилию был проведен на следующий день после постановки диагноза ПЭ. В случае положительного результата теста на тромбофилию тест повторяли через 7 дней.Пациенты с постоянным снижением антикоагулянтной активности были повторно проверены через 3 месяца наблюдения.
Пациенты находились под наблюдением после возникновения эпизода индексной ТЭЛА в амбулаторном режиме антикоагуляции в больнице FuWai. Клиницисты из Центра тромбозов и сосудистой медицины организовали группу WeChat для конкретных пациентов для быстрой связи. Пациент был впервые опрошен через 3 месяца после постановки диагноза ТЭЛА, а второе наблюдение было запланировано через 1 год после постановки диагноза ТЭЛА.В дальнейшем пациентка наблюдалась один раз в год. В течение этого периода, если у пациента не было события исхода, последующее наблюдение продолжалось.
Основным исходом была комбинация смерти или рецидива симптоматической ТЭЛА и ТГВ. Было зарегистрировано сильное кровотечение для оценки риска кровотечения при антикоагулянтной терапии. Рецидивирующая симптоматическая ТЭЛА определялась как развитие нового дефекта внутрипросветного наполнения в ≥1 сегментарной или проксимальной ветвях посредством тестирования CTPA или развитие нового дефекта перфузии ≥75% от 1 сегмента по сравнению с нормальным исходным уровнем.Рецидив DVT был определен аномальным дефектом внутрипросветного наполнения при венографии с помощью компрессионного ультразвука. Обильное кровотечение было определено как опасное для жизни кровотечение, требующее переливания ≥2 Ед эритроцитов или приводящее к абсолютному снижению гематокрита> 10% или смерти или геморрагической / субдуральной гематоме.
В общей сложности 513 пациентов с ПЭ, госпитализированных в Центр тромбозной и сосудистой медицины больницы FuWai в период с мая 2013 года по июнь 2018 года, были проверены на право участия в исследовании. В исследование были включены 436 пациентов, 77 из которых были исключены из-за неполного тестирования на тромбофилию (рис. 1). Из 436 включенных пациентов средний возраст (SD) составил 57,9 (15,8) лет. Большинство пациентов составляли женщины (46,1% мужчин, 53,9% женщин). В общей сложности 277 пациентов (63,5%) имели как ТГВ, так и ТЭЛА на момент постановки диагноза, а 87 пациентов (20%) имели в анамнезе рецидивы ТЭЛА. Новые пероральные антикоагулянты (НОАК), не зависящие от витамина К, в качестве начальной терапии использовали 80,7% пациентов нашего центра.Из 436 включенных пациентов у 117 (26,8%) была диагностирована ПЭ с фактором риска, а у остальных 319 (73,2%) — ПЭ без фактора риска (Таблица 1). Наиболее частым предрасполагающим фактором была недавняя операция или травма, за которыми следовали иммобилизация, рак, APS и другие заболевания соединительной ткани, терапия эстрогенами, послеродовой период, инсульт и застойная сердечная недостаточность (дополнительная таблица 1).
В исследование были включены 436 пациентов, 77 из которых были исключены из-за неполного тестирования на тромбофилию (рис. 1). Из 436 включенных пациентов средний возраст (SD) составил 57,9 (15,8) лет. Большинство пациентов составляли женщины (46,1% мужчин, 53,9% женщин). В общей сложности 277 пациентов (63,5%) имели как ТГВ, так и ТЭЛА на момент постановки диагноза, а 87 пациентов (20%) имели в анамнезе рецидивы ТЭЛА. Новые пероральные антикоагулянты (НОАК), не зависящие от витамина К, в качестве начальной терапии использовали 80,7% пациентов нашего центра.Из 436 включенных пациентов у 117 (26,8%) была диагностирована ПЭ с фактором риска, а у остальных 319 (73,2%) — ПЭ без фактора риска (Таблица 1). Наиболее частым предрасполагающим фактором была недавняя операция или травма, за которыми следовали иммобилизация, рак, APS и другие заболевания соединительной ткани, терапия эстрогенами, послеродовой период, инсульт и застойная сердечная недостаточность (дополнительная таблица 1).

Клинические характеристики пациентов с ПЭ в исследовании
| Характеристики . | пациента с ТЭЛА (N = 436) . | |
|---|---|---|
| Возраст, среднее ± стандартное отклонение , лет | 57,9 ± 15,8 | |
| Возраст на момент первого эпизода , лет | ||
| > 75 | 40 (9,2) | |
| Мужской | 201 (46,1) | |
| BMI , кг / м 2 1054 * | ||
| ≤18.5 | 13 (3,0) | |
| > 18,5-28 | 273 (62,6) | |
| > 28 | 93 (21,3) | |
| С DVT | 277 (63,547) | VTE«> 87 (20,0) |
| Первичное лечение † | ||
| NOAC | 352 (80,7) | |
| Стандартный режим VKA | 9104 9104 9104 9104 9104 | тромболитическая терапия25 (5.7) |
| Характеристики . | пациента с ТЭЛА (N = 436) . |
|---|---|
| Возраст, среднее ± стандартное отклонение , лет | 57,9 ± 15,8 |
| Возраст на момент первого эпизода , лет | |
| > 75 | 40 (9,2) |
| Наружный | 201 (46.1) |
| BMI , кг / м 2 * | |
| ≤ 18,5 | «> 13 (3,0) |
| > 28 | 93 (21,3) |
| С DVT | 277 (63,5) |
| Предыдущий VTE | 87 (20,0) |
| NOAC | 352 (80.7) |
| Стандартная схема АВК | 81 (18,6) |
| Пациенты, получавшие тромболитическую терапию | 25 (5,7) |
Из 436 пациентов с ТЭЛА 31 (7,1%) соответствовали диагностическим критериям врожденной тромбофилии (рис. 2). Наиболее частыми типами врожденной тромбофилии были дефициты протеина S (13/436 [3,0%]; 13/31 [42%]) и протеина C (12/436 [2.8%]; 12/31 [39%]). На эти два подтипа приходилось> 80% пациентов с врожденной тромбофилией, за которыми следовала недостаточность ATIII (5/436 [1,1%]; 5/31 [16%]). Только 1 пациент (1/436 [0,2%]; 1/31 [3%]) имел лейденские мутации фактора V, и ни один (0/436 [0%]; 0/31 [0%]) не имел мутаций протромбина G20102A ( Фигура 2).
Только 1 пациент (1/436 [0,2%]; 1/31 [3%]) имел лейденские мутации фактора V, и ни один (0/436 [0%]; 0/31 [0%]) не имел мутаций протромбина G20102A ( Фигура 2).
Рисунок 2.
Распространенность 5 известных подтипов врожденной тромбофилии у китайских пациентов с ПЭ. (A) Распространенность врожденной тромбофилии у пациентов с симптоматической ТЭЛА. (B) Распределение 5 известных подтипов врожденной тромбофилии. FVL, фактор V Лейден; ПТ, протромбин.
Рисунок 2.
Распространенность 5 известных подтипов врожденной тромбофилии у китайских пациентов с ПЭ. (A) Распространенность врожденной тромбофилии у пациентов с симптоматической ТЭЛА. (B) Распределение 5 известных подтипов врожденной тромбофилии. FVL, фактор V Лейден; ПТ, протромбин.
При сравнении распространенности тромбофилии между пациентами с ТЭЛА с факторами риска и без них не наблюдалось статистически значимой разницы между двумя группами (7. 5% против 6,0%, P = 0,68). В многомерном логистическом регрессионном анализе переменными, независимо связанными с прогнозированием возникновения врожденной тромбофилии, были возраст первого эпизода ТЭЛА ≤50 лет (отношение шансов [OR], 5,43, 95% доверительный интервал [CI], 2,35-13,52; P <0,001) и мужской пол (OR 2,67; 95% ДИ 1,15-6,78; P = 0,03) (таблица 2).
5% против 6,0%, P = 0,68). В многомерном логистическом регрессионном анализе переменными, независимо связанными с прогнозированием возникновения врожденной тромбофилии, были возраст первого эпизода ТЭЛА ≤50 лет (отношение шансов [OR], 5,43, 95% доверительный интервал [CI], 2,35-13,52; P <0,001) и мужской пол (OR 2,67; 95% ДИ 1,15-6,78; P = 0,03) (таблица 2).
Характеристика пациентов с ПЭ с врожденной тромбофилией и факторами риска врожденной тромбофилии при ПЭ
| Характеристики . | Пациенты с тромбофилией (n = 31), n (%) . | п. . | Однопараметрический анализ . | Многопараметрический анализ * . | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
OR (95% ДИ)
. | п . | OR (95% ДИ) . | п . | ||||||||||||||
| PE без фактора риска | .68 | ||||||||||||||||
| Есть | 24/319 (7,5) | 1,28 (0,56–3,29) | ,58 | 3,70 (0,14-611054 | 3,70 (0,14-6110540) | ||||||||||||
| № | 7/117 (6,0) | 1 (справка) | 1 (справка) | ||||||||||||||
| Возраст ≤ 50 лет в первом эпизоде | <. | ||||||||||||||||
| Есть | 22/134 (16.4) | 6,39 (2,95-15,04) | <0,001 | 5,43 (2,35-13,52) | <0,001 | ||||||||||||
| № | 9/302 (3,0) | 1 ) | 1 (ссылка) | ||||||||||||||
| Пол | «> <0,01 | ||||||||||||||||
| ,002 | 2,67 (1,15-6,78) | ,03 | |||||||||||||||
| Внутренняя часть | 8/235 (3,4) | 1 (ссылка) | 1 ) | ||||||||||||||
| С DVT | .08 | ||||||||||||||||
| Да | 25/277 ( | ) | .05 | 1.73 (0,66-5,13) | ,29 | ||||||||||||
| № | 6/159 (3,8) | 1 (ссылка) | 1 (ссылка) | ||||||||||||||
| Причина † | |||||||||||||||||
| Недавняя операция или травма | «> 1.00 | .64 | .3) | 0,71 (0,11-2,48) | 2,32 (0,08-38,70) | ,55 | |||||||||||
| № | 29/398 (7,3) | 1 (исх.) | 1 (справ.) | ||||||||||||||
| Иммобилизация | 1,00 | ,57 | |||||||||||||||
| Да | 1/31047 | ||||||||||||||||
| Да | 1/31051 | 0,054 0,0541/241051 | 0,0577)2,62 (0,09-26,63) | .46 | |||||||||||||
| Нет | 30/412 (7,3) | 1 (ссылка) | 1 (ссылка) | ||||||||||||||
| Активный рак | 1,00 | NE | .99 | ||||||||||||||
| Да | 0/12 (0,0) | NE | 31/424 (7.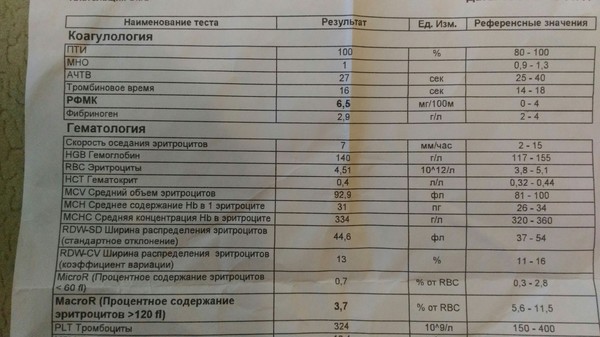 3) 3) | ||||||||||||||
| APS и другие заболевания соединительной ткани | 1,00 | ,57 | 0,55 (0,03-2,77) | 0,86 (0,02-15,15) | ,92 | ||||||||||||
| Нет | 30/412 (7,3) | 1 (справка) | (ref) | ||||||||||||||
| Эстрогеновая терапия и послеродовой период | 1.00 | NE | .99 | ||||||||||||||
| Да | 0/2 (0,0) | NE | .99 | ||||||||||||||
| Ход | 1,00 | NE | «> .99 | ||||||||||||||
| NE | .99 | ||||||||||||||||
| Нет | 31/432 (7.2) | 17 | .15 | ||||||||||||||
| Да | 3/19 (15,8) | 2,60 (0,58-8,42) | 6.96 (0,24-120,40) | ,18 | |||||||||||||
| Нет | 28/417 (6,7) | 1 (ссылка) | 1 (ссылка) | ||||||||||||||
| Острый коронарный синдром | 1,00 | ,95 | |||||||||||||||
| Да | 1/15 (6,7) | 0,93 (0,05-4,88) | -31073,284 (0,07) 0,0747 | ||||||||||||||
| № | 30/421 (7. 1) 1) | 1 (ссылка) | 1 (ссылка) | ||||||||||||||
| Предыдущий VTE | |||||||||||||||||
| Да | 11/87 (12,6) | 2,38 (1,06-5,10) | ,03 | 1,64 (0,65-3,98) | ,28 | 20/349 (5.7) | 1 (ссылка) | ||||||||||
| Тромболитическая терапия | .70 | 8,0 ) | 2,71 (0,75-7,75) | 0,09 | 2,31 (0,57-7,73) | ,20 | |||||||||||
| № | 29/411 (7,1) | 910 (ссылка) | 1 (ссылка) | ||||||||||||||
Характеристики
. | Пациенты с тромбофилией (n = 31), n (%) . | п. . | Однопараметрический анализ . | Многопараметрический анализ * . | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| OR (95% ДИ) . | п . | OR (95% ДИ) . | п . | ||||||||||||||
| PE без фактора риска | .68 | ||||||||||||||||
| Есть | 24/319 (7,5) | 1,28 (0,56–3,29) | ,58 | 3,70 (0,14-611054 | 3,70 (0,14-6110540) | ||||||||||||
| № | 7/117 (6,0) | 1 (справка) | 1 (справка) | ||||||||||||||
| Возраст ≤ 50 лет в первом эпизоде | <. | ||||||||||||||||
| Есть | 22/134 (16.4) | 6,39 (2,95-15,04) | <0,001 | 5,43 (2,35-13,52) | <0,001 | ||||||||||||
| № | 9/302 (3,0) | 1 ) | 1 (ссылка) | ||||||||||||||
| Пол | <0,01 | ||||||||||||||||
| ,002 | 2,67 (1,15-6,78) | ,03 | |||||||||||||||
| Внутренняя часть | 8/235 (3,4) | 1 (ссылка) | 1 ) | ||||||||||||||
| С DVT | .08 | ||||||||||||||||
| Да | 25/277 ( | ) | . | 1.73 (0,66-5,13) | ,29 | ||||||||||||
| № | 6/159 (3,8) | 1 (ссылка) | 1 (ссылка) | ||||||||||||||
| Причина † | |||||||||||||||||
| Недавняя операция или травма | 1.00 | .64 | .3) | 0,71 (0,11-2,48) | 2,32 (0,08-38,70) | ,55 | |||||||||||
| № | 29/398 (7,3) | 1 (исх.) | 1 (справ.) | ||||||||||||||
| Иммобилизация | 1,00 | ,57 | |||||||||||||||
| Да | 1/31047 | ||||||||||||||||
| Да | 1/31051 | 0,054 0,0541/241051 | 0,0577)2,62 (0,09-26,63) | «> .46 | |||||||||||||
| Нет | 30/412 (7,3) | 1 (ссылка) | 1 (ссылка) | ||||||||||||||
| Активный рак | 1,00 | NE | .99 | ||||||||||||||
| Да | 0/12 (0,0) | NE | 31/424 (7.3) | ||||||||||||||
| APS и другие заболевания соединительной ткани | 1,00 | ,57 | 0,55 (0,03-2,77) | 0,86 (0,02-15,15) | ,92 | ||||||||||||
| Нет | 30/412 (7,3) | 1 (справка) | (ref) | ||||||||||||||
| Эстрогеновая терапия и послеродовой период | «> 1.00 | NE | .99 | ||||||||||||||
| Да | 0/2 (0,0) | NE | .99 | ||||||||||||||
| Ход | 1,00 | NE | .99 | ||||||||||||||
| NE | .99 | ||||||||||||||||
| Нет | 31/432 (7.2) | 17 | .15 | ||||||||||||||
| Да | 3/19 (15,8) | 2,60 (0,58-8,42) | 6.96 (0,24-120,40) | ,18 | |||||||||||||
| Нет | 28/417 (6,7) | 1 (ссылка) | 1 (ссылка) | ||||||||||||||
| Острый коронарный синдром | «> 1,00 | ,95 | |||||||||||||||
| Да | 1/15 (6,7) | 0,93 (0,05-4,88) | -31073,284 (0,07) 0,0747 | ||||||||||||||
| № | 30/421 (7.1) | 1 (ссылка) | 1 (ссылка) | ||||||||||||||
| Предыдущий VTE | |||||||||||||||||
| Да | 11/87 (12,6) | 2,38 (1,06-5,10) | ,03 | 1,64 (0,65-3,98) | ,28 | 20/349 (5.7) | 1 (ссылка) | ||||||||||
| Тромболитическая терапия | .70 | 8,0 ) | 2,71 (0,75-7,75) | ,09 | 2,31 (0,57-7,73) | «>,20 | |||||||||||
| № | 29/411 (7,1) | 910 (ссылка) | 1 (ссылка) | ||||||||||||||
Группа тромбофилии была моложе по сравнению с пациентами без тромбофилии (45.4 против 58,9, P <0,01). Более половины пациентов с тромбофилией имели первый приступ ТЭЛА в возрасте <50 лет (71,0% против 27,7%, P <0,01). Кроме того,> 30% пациентов в группе тромбофилии имели в анамнезе ВТЭ в анамнезе, что было значительно выше по сравнению с группой, не получавшей тромбофилию (35,5% против 18,8%, P = 0,04). Большинство пациентов с тромбофилией были мужчинами (74,2% против 44,0%, P <0,01) (дополнительная таблица 2).
Не было статистически значимой разницы в клинических характеристиках среди пациентов с различными подтипами тромбофилии, за исключением того, что у пациентов с ТЭЛА, возникших в результате дефицита ATIII, редко обнаруживался ТГВ ( P <. 01) (дополнительная таблица 3).
01) (дополнительная таблица 3).
В течение периода наблюдения 7 пациентов умерли в течение 3 месяцев после постановки диагноза и 16 пациентов были потеряны для последующего наблюдения; Остальные пациенты наблюдались в течение ≥3 месяцев. Среднее время наблюдения составило ~ 800 дней (от 11 до 1872 дней). В общей сложности 31 пациент (7,1%) умер, а у 30 пациентов (6,8%) возникли рецидивы тромботических событий. Из 30 пациентов с рецидивом 10 произошли во время антикоагулянтной терапии и 20 — после прекращения лечения.У четырех пациентов произошло сильное кровотечение, требующее госпитализации и изменения антикоагулянтной терапии (рис. 1).
После сравнения пациентов с ТЭЛА с тромбофилией и без нее мы не обнаружили статистически значимых различий в смертности от всех причин (7,7% против 0,0%, P = 0,15) или частоте рецидивов (7,2% против 3,2%, P =.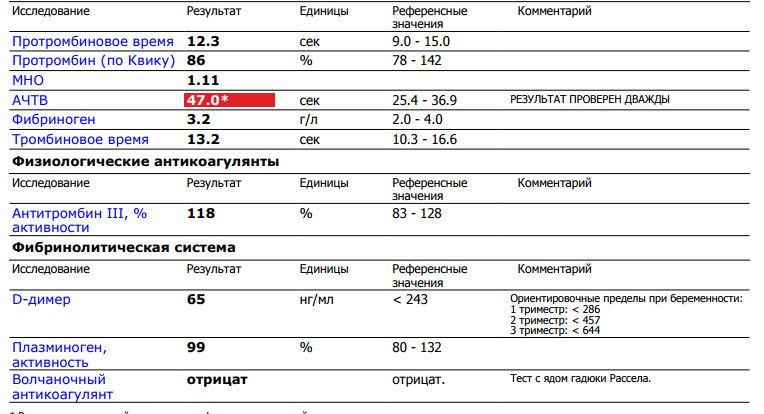 71). Что касается пациентов с тромбофилией, только у 1 пациентки с PCD был рецидив ТЭЛА, подтвержденный CTPA, и ни один пациент не умер во время последующего наблюдения (дополнительная таблица 2).Хотя статистически значимой разницы не было, риск комбинированного исхода смерти и рецидива ВТЭ был ниже среди пациентов с врожденной тромбофилией, чем среди пациентов без врожденной тромбофилии (отношение рисков 0,18; 95% ДИ 0,02-5,69; P = 0,08) (Рисунок 3). Между тем, риск кровотечения также был одинаковым между двумя группами (1,0% против 0,0%, P = 1,00). У пациентов с врожденной тромбофилией не наблюдалось серьезных кровотечений, несмотря на то, что они получали длительную антикоагулянтную терапию (дополнительная таблица 2).
71). Что касается пациентов с тромбофилией, только у 1 пациентки с PCD был рецидив ТЭЛА, подтвержденный CTPA, и ни один пациент не умер во время последующего наблюдения (дополнительная таблица 2).Хотя статистически значимой разницы не было, риск комбинированного исхода смерти и рецидива ВТЭ был ниже среди пациентов с врожденной тромбофилией, чем среди пациентов без врожденной тромбофилии (отношение рисков 0,18; 95% ДИ 0,02-5,69; P = 0,08) (Рисунок 3). Между тем, риск кровотечения также был одинаковым между двумя группами (1,0% против 0,0%, P = 1,00). У пациентов с врожденной тромбофилией не наблюдалось серьезных кровотечений, несмотря на то, что они получали длительную антикоагулянтную терапию (дополнительная таблица 2).
Рисунок 3.
Выживаемость без рецидивов у пациентов с ТЭЛА с врожденной тромбофилией и без нее.
Рисунок 3.
Выживаемость без рецидивов у пациентов с ТЭЛА с врожденной тромбофилией и без нее.
Тромбофилия — это состояние с нарушением свертываемости крови, которое увеличивает риск тромбоза.Врожденная тромбофилия — это состояние гиперкоагуляции, вызванное различными генетическими факторами риска и триггерами окружающей среды. Распространенность врожденной тромбофилии широко варьируется среди разных этнических групп. 5 У белых пациентов наиболее распространено нарушение регуляции прокоагулянта в результате лейденских мутаций фактора V и мутаций протромбина G20210A. 7,16 У азиатов дефицит естественных антикоагулянтов плазмы, включая протеин C, протеин S и ATIII, чаще встречается у пациентов с ВТЭ.Сообщаемая распространенность PSD, PCD и дефицита ATIII у японских пациентов с DVT составляет 17,7%, 8,0% и 5,6% соответственно. 11,17 У китайских ханьских пациентов с ВТЭ распространенность PCD, PSD и дефицита ATIII составляет 10,3%, 13,9% и 1,9% соответственно.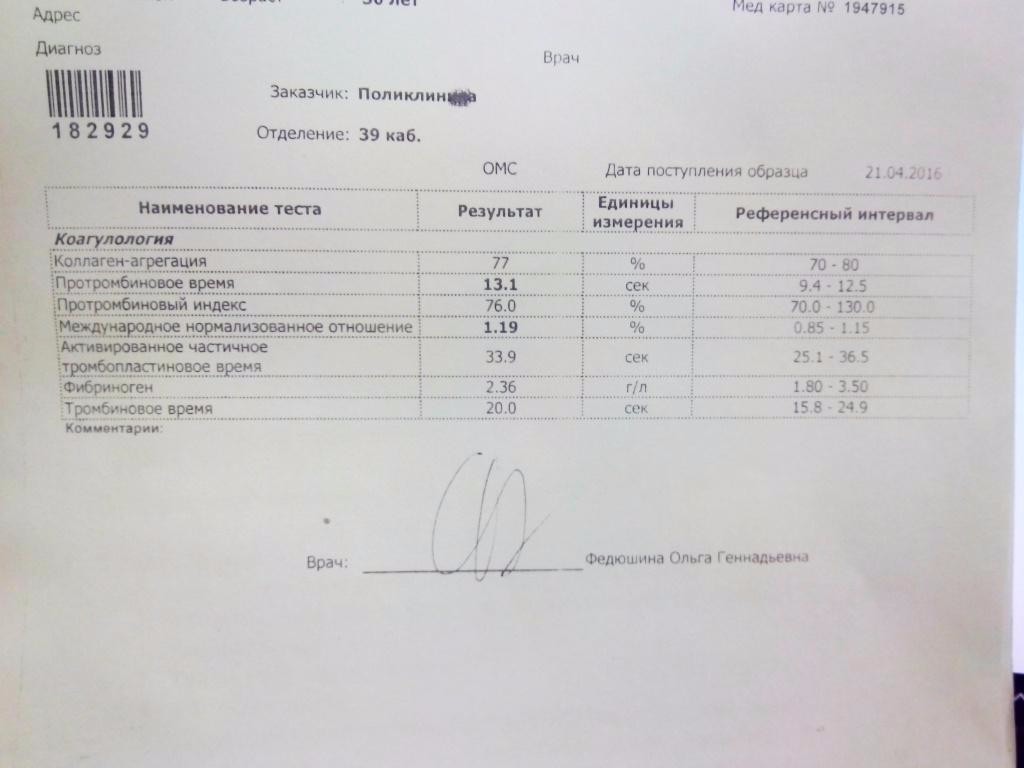 18
18
В настоящем исследовании у 7,1% пациентов с ТЭЛА была диагностирована врожденная тромбофилия, включая дефицит PCD, PSD и ATIII, а также лейденского фактора V.Интересно, что PSD (3,0%) является наиболее частым подтипом врожденной тромбофилии, за которым следуют PCD (2,8%) и дефицит ATIII (1,1%). Только у 1 пациента (0,2%) была диагностирована гетерозиготная мутация фактора V по Лейдену. Таким образом, распространенность врожденной тромбофилии в нашем центре намного ниже, чем ранее сообщалось для азиатской когорты ВТЭ, в то время как распределение тромбофилии схоже в 2 группах. Снижение распространенности может быть связано с разными характеристиками пациентов с ТЭЛА и ТГВ.В нашем исследовании пациенты с ТЭЛА с врожденной тромбофилией показали тенденцию к коморбидному ТГВ (80,6% против 62,2%, P = 0,06), особенно при наиболее распространенных подтипах тромбофилии, PCD (83,3%) и PSD (100%) ( дополнительные таблицы 2 и 3).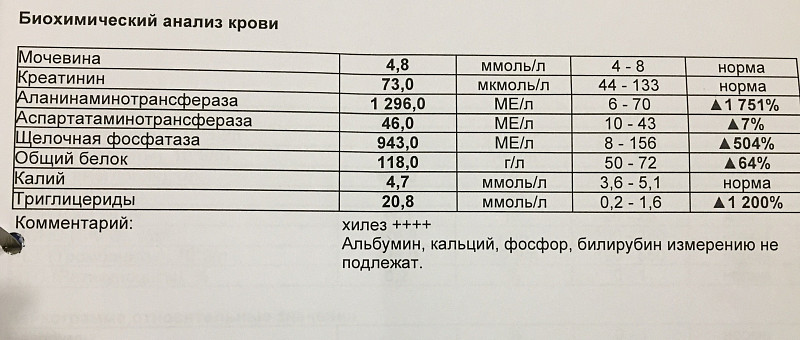 Это предполагало возможное объяснение того, что пациенты с PCD и PSD были склонны к DVT. Другие потенциальные доказательства включали, что распространенность PCD и PSD более чем в 3 раза выше у пациентов с VTE, чем у пациентов с PE, в то время как распространенность дефицита ATIII была аналогичной в 2 когортах.Более того, согласно Лейденскому парадоксу фактора V 19-22 врожденный тромбоз, такой как лейденская мутация фактора V, является фактором риска ТГВ, но не ТЭЛА. Наше исследование, являющееся крупнейшим скринингом пациентов с ТЭЛА с тромбозом, подтвердило этот вывод, обнаружив низкую частоту лейденских мутаций фактора V и протромбина G20210A у пациентов с ТЭЛА. Этот результат указывает на то, что генетический фон изолированной ПЭ не соответствует ТГВ. Незаменимая клиническая ценность генетических исследований изолированной ПЭ.
Это предполагало возможное объяснение того, что пациенты с PCD и PSD были склонны к DVT. Другие потенциальные доказательства включали, что распространенность PCD и PSD более чем в 3 раза выше у пациентов с VTE, чем у пациентов с PE, в то время как распространенность дефицита ATIII была аналогичной в 2 когортах.Более того, согласно Лейденскому парадоксу фактора V 19-22 врожденный тромбоз, такой как лейденская мутация фактора V, является фактором риска ТГВ, но не ТЭЛА. Наше исследование, являющееся крупнейшим скринингом пациентов с ТЭЛА с тромбозом, подтвердило этот вывод, обнаружив низкую частоту лейденских мутаций фактора V и протромбина G20210A у пациентов с ТЭЛА. Этот результат указывает на то, что генетический фон изолированной ПЭ не соответствует ТГВ. Незаменимая клиническая ценность генетических исследований изолированной ПЭ.
Многие предыдущие исследования были сосредоточены на пациентах с ВТЭ, сообщая о более молодом возрасте на момент обращения и о более высоком проценте мужчин среди пациентов с врожденной тромбофилией. 4,23 Наши данные согласуются с этими выводами. В нашей когорте мы обнаружили пациентов с преждевременной ПЭ (возраст <50 лет) и преобладанием мужчин (74,2%), и эти 2 фактора могли независимо влиять на тромбофилию. Распространенность врожденной тромбофилии между пациентами с ПЭ с факторами риска и без них существенно не различалась в нашем исследовании (6.0% против 7,5%, P > 0,05). Это отличается от того, что сообщали Weingarz et al. 4 , в которых тромбофилия чаще встречается среди пациентов с ВТЭ без факторов риска (47,7% против 57,7%, P = 0,001). Такое несоответствие может заключаться в различиях в спектре тромбофилии между двумя исследованиями. Большинство тромбофилий в исследовании Weingarz et al было вызвано лейденскими мутациями фактора V и повышенным уровнем фактора VIII, тогда как дефицит антикоагулянтов в плазме был основной причиной врожденной тромбофилии.Наши результаты показывают, что пациенты с врожденной тромбофилией предрасположены к спонтанному развитию ТЭЛА или ТЭЛА, объясняемой наличием фактора риска, что подчеркивает важность скрининга на тромбофилию.
4,23 Наши данные согласуются с этими выводами. В нашей когорте мы обнаружили пациентов с преждевременной ПЭ (возраст <50 лет) и преобладанием мужчин (74,2%), и эти 2 фактора могли независимо влиять на тромбофилию. Распространенность врожденной тромбофилии между пациентами с ПЭ с факторами риска и без них существенно не различалась в нашем исследовании (6.0% против 7,5%, P > 0,05). Это отличается от того, что сообщали Weingarz et al. 4 , в которых тромбофилия чаще встречается среди пациентов с ВТЭ без факторов риска (47,7% против 57,7%, P = 0,001). Такое несоответствие может заключаться в различиях в спектре тромбофилии между двумя исследованиями. Большинство тромбофилий в исследовании Weingarz et al было вызвано лейденскими мутациями фактора V и повышенным уровнем фактора VIII, тогда как дефицит антикоагулянтов в плазме был основной причиной врожденной тромбофилии.Наши результаты показывают, что пациенты с врожденной тромбофилией предрасположены к спонтанному развитию ТЭЛА или ТЭЛА, объясняемой наличием фактора риска, что подчеркивает важность скрининга на тромбофилию.
Хотя врожденная тромбофилия, по-видимому, не увеличивает риск рецидива, 24,25 текущие рекомендации рекомендуют антикоагулянтное лечение независимо от наличия или отсутствия врожденной тромбофилии. 26 Роль дефицита природных антикоагулянтов в рецидиве до сих пор неясна. В исследовании Baglin et al., 24 частота рецидивов у пациентов с естественным дефицитом антикоагулянтов составила 17,5%, что выше, чем общая частота рецидивов, составляющая 11%, но не достигла статистической значимости. Исходы пациентов с врожденной тромбофилией в настоящем исследовании не уступали результатам пациентов без тромбофилии, включая смертность от всех причин (0,0% против 7.7%, P = 0,15) и частота рецидивов (3,2% против 7,2%, P = 0,71). Очевидно, что пациенты с врожденной тромбофилией обычно имели первый приступ ТЭЛА в более молодом возрасте и без сопутствующих заболеваний, что снижало риск смерти. Что касается частоты рецидивов, снижение числа пациентов с тромбофилией может быть связано с нашей антикоагулянтной терапией (использование NOAC и расширенное лечение более 3 месяцев без повышенного риска кровотечения). Кроме того, все 16 пациентов, которые были потеряны для последующего наблюдения, не были пациентами с тромбофилией, что могло недооценить частоту исходов у пациентов с нетромбофилией.
Что касается частоты рецидивов, снижение числа пациентов с тромбофилией может быть связано с нашей антикоагулянтной терапией (использование NOAC и расширенное лечение более 3 месяцев без повышенного риска кровотечения). Кроме того, все 16 пациентов, которые были потеряны для последующего наблюдения, не были пациентами с тромбофилией, что могло недооценить частоту исходов у пациентов с нетромбофилией.
У нашего исследования есть некоторые ограничения. Во-первых, это одноцентровое исследование с более отобранной группой пациентов в больнице FuWai, национальном центре диагностики и лечения сердечно-сосудистых заболеваний в Китае. Результаты одноцентрового исследования обычно подвержены систематической ошибке отбора. Однако пациенты в нашем исследовании были со всего Китая и были включены в исследование последовательно, что должно обеспечить хорошее представительство пациентов с ПЭ в Китае.Поскольку больница специализируется на сердечно-сосудистых заболеваниях, пациенты с ПЭ с факторами риска после общей операции или травмы могут быть менее представлены в больнице FuWai Hospital, что может привести к некоторой избирательной систематической ошибке в результатах этого исследования. Во-вторых, настоящее исследование представляет собой предварительное наблюдательное исследование, в котором было выполнено множество статистических тестов. В результате могут быть ложноположительные результаты. В качестве открытого исследования врачи, участвовавшие в исследовании, знали о диагнозе тромбофилии.Следовательно, пациенты с тромбофилией могут получать больше внимания и быть более склонными сообщать о событиях исхода. Тем не менее, результат этого исследования — клиническая точная конечная точка, и при его измерении может быть меньше такой ошибки в отчетности. Кроме того, за диагностику и последующее наблюдение отвечали разные врачи, и последующие врачи могут не знать о статусе тромбофилии пациента, что могло снизить потенциальную систематическую ошибку в отчетности. В-третьих, мы взяли> 10 потенциальных предикторов в многомерный анализ, но нельзя игнорировать возможные ненаблюдаемые смешивающие факторы.Тем не менее, наши результаты действительно предоставляют новое понимание распространенности и основных механизмов врожденной тромбофилии у китайских пациентов и их последующих исходов.
Во-вторых, настоящее исследование представляет собой предварительное наблюдательное исследование, в котором было выполнено множество статистических тестов. В результате могут быть ложноположительные результаты. В качестве открытого исследования врачи, участвовавшие в исследовании, знали о диагнозе тромбофилии.Следовательно, пациенты с тромбофилией могут получать больше внимания и быть более склонными сообщать о событиях исхода. Тем не менее, результат этого исследования — клиническая точная конечная точка, и при его измерении может быть меньше такой ошибки в отчетности. Кроме того, за диагностику и последующее наблюдение отвечали разные врачи, и последующие врачи могут не знать о статусе тромбофилии пациента, что могло снизить потенциальную систематическую ошибку в отчетности. В-третьих, мы взяли> 10 потенциальных предикторов в многомерный анализ, но нельзя игнорировать возможные ненаблюдаемые смешивающие факторы.Тем не менее, наши результаты действительно предоставляют новое понимание распространенности и основных механизмов врожденной тромбофилии у китайских пациентов и их последующих исходов. Это поможет в разработке терапевтической стратегии, адаптированной к самой большой в мире популяции пациентов.
Это поможет в разработке терапевтической стратегии, адаптированной к самой большой в мире популяции пациентов.
Авторы благодарят пациентов и их семьи за участие в этом исследовании.
Эта работа была поддержана грантами Национальной программы ключевых исследований и разработок Китая (2016YFC02), Инновационного фонда медицинских наук CAMS (2016-I2M-1-002, 2017-12M-3-003, 2017-I2M-B & R -02, 2017-F16-SYS, 2017-I2M-1-004, 2017-I2M-2-001), Проект муниципальной столичной клиники Пекина (Z171100001017195 и Z181100001718203), а также фонды фундаментальных исследований для центральных университетов Пекина. Молодежный фонд Union Medical College (PUMC) (2017310006).
Вклад: Z.-C.J. имеет полный доступ ко всем данным в исследовании и берет на себя ответственность за целостность данных и точность анализа данных, включая любые побочные эффекты; T. -Y.L., D.L., X.-X.Y. и Z.-C.J. способствовал дизайну исследования; D.L., T.W., Y.-J.Z., Y.-P.W., J.-S.T., F.-H.P. и X.J. отвечали за набор пациентов и сбор данных; T.-Y.L. проведенные эксперименты; Т.-Y.L. и К.С. провел анализ данных и написал первый черновик отчета; Z.-C.J. и Л.Х. помогли написать и отредактировать рукопись; и все авторы внесли свой вклад в окончательный отчет и одобрили его.
-Y.L., D.L., X.-X.Y. и Z.-C.J. способствовал дизайну исследования; D.L., T.W., Y.-J.Z., Y.-P.W., J.-S.T., F.-H.P. и X.J. отвечали за набор пациентов и сбор данных; T.-Y.L. проведенные эксперименты; Т.-Y.L. и К.С. провел анализ данных и написал первый черновик отчета; Z.-C.J. и Л.Х. помогли написать и отредактировать рукопись; и все авторы внесли свой вклад в окончательный отчет и одобрили его.
Раскрытие информации о конфликте интересов: Z.-C.J. получил спонсорскую поддержку от GlaxoSmithKline для Конгресса ISTH 2019. T.-Y.L. получила спонсорскую поддержку от компании Bayer для плаката Конгресса ISTH 2019. Остальные авторы заявляют об отсутствии конкурирующих финансовых интересов.
Для корреспонденции: Чжи-Чэн Цзин, отделение кардиологии — ключевая лаборатория легочно-сосудистой медицины, больница Пекинского медицинского колледжа, Китайская академия медицинских наук — Пекинский союзный медицинский колледж, № 1, Шуай-Фу-Юань, округ Донг-Ченг , Пекин 100730, Китай; электронная почта: jingzhicheng@vip. 163.com.
163.com.
Унаследованная тромбофилия: палка о двух концах | Гематология
В 1995 году мои коллеги-младшие исследователи в отделении отметили большое количество выкидышей и мертворождений у женщин, которые участвовали в семейном исследовании, которое было организовано для оценки абсолютного риска ВТЭ в семьях с дефицитом антитромбина, протеина С или протеина S. .Действительно, они обнаружили, что риск у дефицитных женщин увеличивается в 2 раза по сравнению с недефицитными родственниками 38 В нашем семейном исследовании фактора V в Лейдене 39 , но не в нашем исследовании протромбина 20210A, 34 мы наблюдали подобное явление. . С тех пор в многочисленных исследованиях изучалась связь между наследственной тромбофилией и различными осложнениями беременности, от единичного выкидыша до внутриутробной гибели плода, преэклампсии, HELLP (гемолиз, повышение ферментов печени и низкий уровень тромбоцитов) и отслойки плаценты. 27,40 Обследование женщин с осложнениями беременности вскоре стало обычной клинической практикой, но основанного на доказательствах ответа о последующих терапевтических последствиях не было. Этот частый клинический вопрос вызвал у меня интерес не только к ассоциациям и абсолютным рискам, но и к проверке часто обсуждаемой гипотезы о том, что антикоагуляция низкомолекулярным гепарином (НМГ) может улучшить исход беременности у женщин с наследственной тромбофилией и без нее и с другими необъяснимыми рецидивами выкидыш.Это был мой первый личный опыт успешного создания и ведения многоцентрового рандомизированного клинического исследования по инициативе исследователя, которое называлось ALIFE. 41 Несмотря на то, что набор и проведение исследования были сложными, а результат был отрицательным, я считаю его завершение, публикацию и влияние на клиническую практику важным моментом в моей карьере. После 15 лет различных клинических испытаний, проведенных коллегами по всему миру, мы теперь знаем, что LMWH не улучшает вероятность живорождения у женщин с невынашиваемым невынашиванием беременности без объяснения причин.
27,40 Обследование женщин с осложнениями беременности вскоре стало обычной клинической практикой, но основанного на доказательствах ответа о последующих терапевтических последствиях не было. Этот частый клинический вопрос вызвал у меня интерес не только к ассоциациям и абсолютным рискам, но и к проверке часто обсуждаемой гипотезы о том, что антикоагуляция низкомолекулярным гепарином (НМГ) может улучшить исход беременности у женщин с наследственной тромбофилией и без нее и с другими необъяснимыми рецидивами выкидыш.Это был мой первый личный опыт успешного создания и ведения многоцентрового рандомизированного клинического исследования по инициативе исследователя, которое называлось ALIFE. 41 Несмотря на то, что набор и проведение исследования были сложными, а результат был отрицательным, я считаю его завершение, публикацию и влияние на клиническую практику важным моментом в моей карьере. После 15 лет различных клинических испытаний, проведенных коллегами по всему миру, мы теперь знаем, что LMWH не улучшает вероятность живорождения у женщин с невынашиваемым невынашиванием беременности без объяснения причин. 42-45 Тем не менее, мы все еще не уверены, так ли это у женщин с наследственной тромбофилией. 46,47 В исследовании ALIFE подгруппа женщин с наследственной тромбофилией (n = 47) показала тенденцию к положительному эффекту от НМГ и аспирина (относительный риск живорождения, 1,31 [95% ДИ, 0,74–2,33] для НМГ и аспирин по сравнению с плацебо: относительный риск живорождения 1,22 [95% ДИ 0,69–2,16] для аспирина с соответствующей абсолютной разницей в коэффициентах живорождения 16.3% [95% ДИ, от –18,2% до 50,8%] и 11,8% [95% ДИ, от –21,1% до 44,6%], соответственно). 41 На основе этих результатов мы инициировали исследование ALIFE2, в которое с 2013 года набирают пациентов в Нидерландах, Великобритании и Бельгии и, надеюсь, вскоре в США и Словении. 48
42-45 Тем не менее, мы все еще не уверены, так ли это у женщин с наследственной тромбофилией. 46,47 В исследовании ALIFE подгруппа женщин с наследственной тромбофилией (n = 47) показала тенденцию к положительному эффекту от НМГ и аспирина (относительный риск живорождения, 1,31 [95% ДИ, 0,74–2,33] для НМГ и аспирин по сравнению с плацебо: относительный риск живорождения 1,22 [95% ДИ 0,69–2,16] для аспирина с соответствующей абсолютной разницей в коэффициентах живорождения 16.3% [95% ДИ, от –18,2% до 50,8%] и 11,8% [95% ДИ, от –21,1% до 44,6%], соответственно). 41 На основе этих результатов мы инициировали исследование ALIFE2, в которое с 2013 года набирают пациентов в Нидерландах, Великобритании и Бельгии и, надеюсь, вскоре в США и Словении. 48
Что касается других осложнений беременности, опосредованных плацентой, результаты метаанализа индивидуальных данных пациентов AFFIRM включили 963 женщины, которые участвовали в 8 рандомизированных контролируемых исследованиях, включая исследование TIPPS, которое было полностью посвящено женщинам с тромбофилией. 49-51 НМГ не значительно снижали риск повторных осложнений беременности, опосредованных плацентой (14% против 22%; относительный риск 0,64; 95% ДИ 0,36–1,11). Между одноцентровыми и многоцентровыми исследованиями наблюдалась значительная неоднородность. В анализе подгрупп, НМГ значительно снижал первичный исход у женщин с предыдущей отслойкой, но не в любой из других подгрупп с предыдущими осложнениями. Следует отметить, что со временем ассоциации наследственной тромбофилии и осложнений беременности стали менее сильными или даже отсутствовали, когда были оценены более качественные проспективные исследования. 52
49-51 НМГ не значительно снижали риск повторных осложнений беременности, опосредованных плацентой (14% против 22%; относительный риск 0,64; 95% ДИ 0,36–1,11). Между одноцентровыми и многоцентровыми исследованиями наблюдалась значительная неоднородность. В анализе подгрупп, НМГ значительно снижал первичный исход у женщин с предыдущей отслойкой, но не в любой из других подгрупп с предыдущими осложнениями. Следует отметить, что со временем ассоциации наследственной тромбофилии и осложнений беременности стали менее сильными или даже отсутствовали, когда были оценены более качественные проспективные исследования. 52


 Чаще передается по аутосомному типу наследования, то есть для проявления заболевания дефектный ген должен передаться от обоих родителей. Обычно проявляется умеренными кровотечениями на фоне травмы или хирургического вмешательства.
Чаще передается по аутосомному типу наследования, то есть для проявления заболевания дефектный ген должен передаться от обоих родителей. Обычно проявляется умеренными кровотечениями на фоне травмы или хирургического вмешательства.
 Risk assessment for recurrent venous thrombosis //Elsevier.2010;376(9757):2032–2039.
Risk assessment for recurrent venous thrombosis //Elsevier.2010;376(9757):2032–2039.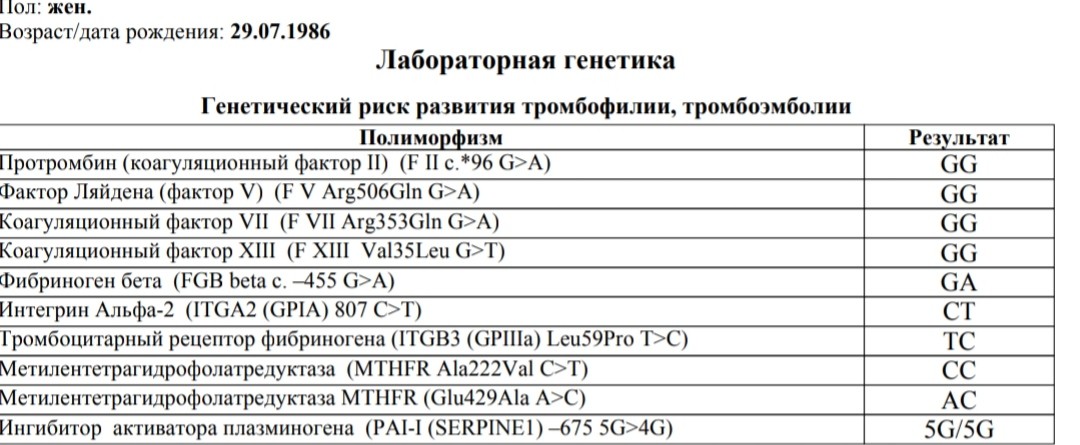

 Однако ген имеет частичную пенетрантность (проявление), то есть даже при наличии у человека дефектного гена вероятность возникновения тромбоза может быть разной. Антитромбин III – важнейший компонент противосвертывающей системы. Он образует соединения с тромбином, что приводит к их взаимной инактивации. Тромбин – это белок, который участвует в образовании тромба, стимулирует тромбоциты и клетки сосудистой стенки.
Однако ген имеет частичную пенетрантность (проявление), то есть даже при наличии у человека дефектного гена вероятность возникновения тромбоза может быть разной. Антитромбин III – важнейший компонент противосвертывающей системы. Он образует соединения с тромбином, что приводит к их взаимной инактивации. Тромбин – это белок, который участвует в образовании тромба, стимулирует тромбоциты и клетки сосудистой стенки. В результате фактор V становится устойчивым к разрушающему действию протеина C. Фактор V является фактором свертывания и участвует в образовании тромбина. При увеличении его количества риск возникновения тромбов повышается.
В результате фактор V становится устойчивым к разрушающему действию протеина C. Фактор V является фактором свертывания и участвует в образовании тромбина. При увеличении его количества риск возникновения тромбов повышается. В результате разрушения этих клеток выделяются активные вещества, которые нарушают нормальное взаимодействие свертывающей и противосвертывающей систем крови. В результате возникает повышенная свертываемость и склонность к образованию тромбов. Большое количество антител к фосфолипидам о
В результате разрушения этих клеток выделяются активные вещества, которые нарушают нормальное взаимодействие свертывающей и противосвертывающей систем крови. В результате возникает повышенная свертываемость и склонность к образованию тромбов. Большое количество антител к фосфолипидам о Возможные симптомы: боль в груди, боль при глубоком дыхании, одышка или, в редких случаях, коллапс.
Возможные симптомы: боль в груди, боль при глубоком дыхании, одышка или, в редких случаях, коллапс.
 И гепарин, и варфарин безопасны для кормления грудью.
И гепарин, и варфарин безопасны для кормления грудью.
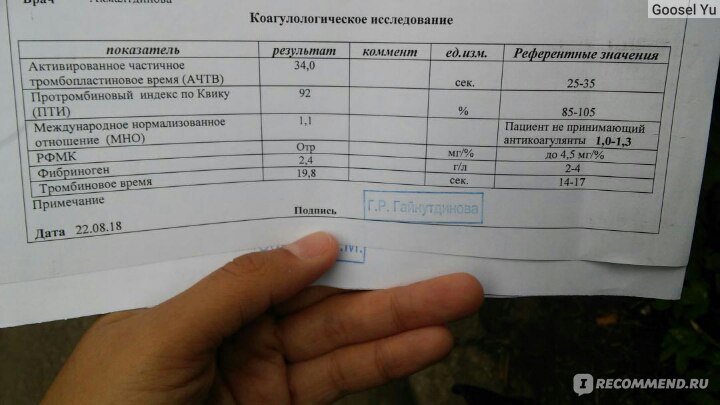 Как инструментальный белок свертывания, фактор V помогает генерировать фибрин, волокнистый материал, который создает «сеть», удерживающую сгусток крови вместе.После формирования функционального сгустка крови фактор V инактивируется другим веществом, называемым активированным протеином C, также известным как APC. Измененная версия фактора V устойчива к APC, поэтому ее активность продолжается и после периода ее полезности. В результате фактор V Лейдена может вызвать повышенную реакцию свертывания крови.
Как инструментальный белок свертывания, фактор V помогает генерировать фибрин, волокнистый материал, который создает «сеть», удерживающую сгусток крови вместе.После формирования функционального сгустка крови фактор V инактивируется другим веществом, называемым активированным протеином C, также известным как APC. Измененная версия фактора V устойчива к APC, поэтому ее активность продолжается и после периода ее полезности. В результате фактор V Лейдена может вызвать повышенную реакцию свертывания крови.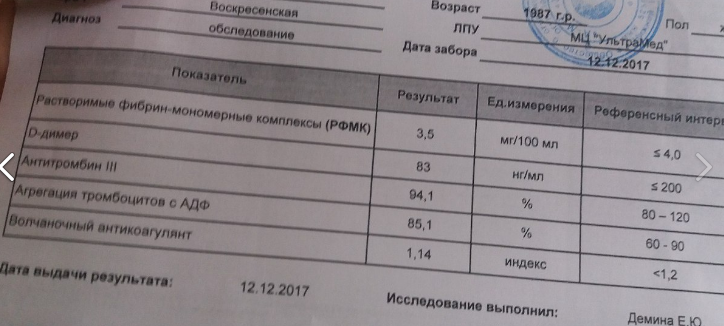 Люди, чей организм не вырабатывает достаточного количества антитромбина, гораздо чаще имеют тромб.
Люди, чей организм не вырабатывает достаточного количества антитромбина, гораздо чаще имеют тромб.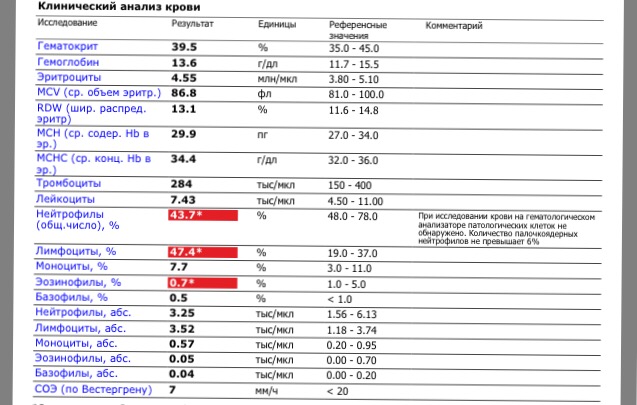 Оба типа приводят к недостаточной активности антитромбина и повышенному риску образования тромбов.
Оба типа приводят к недостаточной активности антитромбина и повышенному риску образования тромбов. 21 Менее 1 из 10 000 имеют гомозиготную форму. Как и фактор V Лейдена, протромбин G20210A редко встречается у людей неевропейского или ближневосточного происхождения. Его название включает в себя код, обозначающий точное местоположение мутации в молекуле ДНК. Протромбин G20210A содержит мутацию в гене, ответственном за производство протромбина, также известного как фактор II, — подобного белку фактора V, который играет решающую роль в генерации фибрина — опять же, материала, составляющего структурную сеть в сгустке крови.У лиц с гетерозиготным расстройством слишком много циркулирующего фактора II, что увеличивает вероятность ВТЭ в 2 или 3 раза по сравнению с нормальным риском образования тромбов. 22 Ученым еще предстоит количественно оценить риск гомозиготной формы.
21 Менее 1 из 10 000 имеют гомозиготную форму. Как и фактор V Лейдена, протромбин G20210A редко встречается у людей неевропейского или ближневосточного происхождения. Его название включает в себя код, обозначающий точное местоположение мутации в молекуле ДНК. Протромбин G20210A содержит мутацию в гене, ответственном за производство протромбина, также известного как фактор II, — подобного белку фактора V, который играет решающую роль в генерации фибрина — опять же, материала, составляющего структурную сеть в сгустке крови.У лиц с гетерозиготным расстройством слишком много циркулирующего фактора II, что увеличивает вероятность ВТЭ в 2 или 3 раза по сравнению с нормальным риском образования тромбов. 22 Ученым еще предстоит количественно оценить риск гомозиготной формы. 23 Однако, когда он действительно появляется, гомозиготный дефицит протеина C считается опасным для жизни заболеванием. 24 В отличие от тромбофилий на основе фактора V и протромбина, дефицит протеина C коррелирует с повышенным риском повторного образования тромбов. В результате это может потребовать большего внимания у тех, кто уже испытал начальное событие ВТЭ. Белок С играет важную роль в прекращении процесса свертывания крови после завершения восстановления поврежденного кровеносного сосуда. Люди с мутацией, связанной с протеином C, производят либо слишком мало протеина, либо его неактивную версию.
23 Однако, когда он действительно появляется, гомозиготный дефицит протеина C считается опасным для жизни заболеванием. 24 В отличие от тромбофилий на основе фактора V и протромбина, дефицит протеина C коррелирует с повышенным риском повторного образования тромбов. В результате это может потребовать большего внимания у тех, кто уже испытал начальное событие ВТЭ. Белок С играет важную роль в прекращении процесса свертывания крови после завершения восстановления поврежденного кровеносного сосуда. Люди с мутацией, связанной с протеином C, производят либо слишком мало протеина, либо его неактивную версию. У людей с этим заболеванием не хватает функционального белка S. Как и при других тромбофилиях, мутации могут возникать в одной или обеих копиях гена.Более легкий гетерозиготный дефицит поражает менее четверти 1 процента населения (1 из 500). 25 Опасная для жизни гомозиготная форма встречается крайне редко, но обычно является причиной молниеносной пурпуры, часто летального и системного нарушения свертывания крови у младенцев.
У людей с этим заболеванием не хватает функционального белка S. Как и при других тромбофилиях, мутации могут возникать в одной или обеих копиях гена.Более легкий гетерозиготный дефицит поражает менее четверти 1 процента населения (1 из 500). 25 Опасная для жизни гомозиготная форма встречается крайне редко, но обычно является причиной молниеносной пурпуры, часто летального и системного нарушения свертывания крови у младенцев.
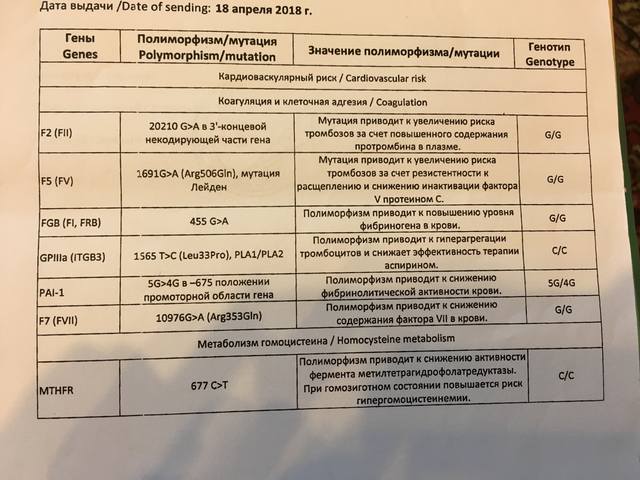 В случае подтвержденного диагноза тромбофилия ваш врач продолжит лечение препаратами, известными как антикоагулянты.(Информацию об этих лекарствах см. В Разделе 7.) Конечно, отрицательный результат теста на тромбофилию будет облегчением. Однако очень важно, чтобы вы не полагались на ложное чувство защищенности от хороших новостей. Вы по-прежнему находитесь в группе риска на основании истории сгустков крови. Итак, продолжайте принимать прописанные лекарства и следуйте всем остальным медицинским инструкциям, например, снижение веса, поскольку ожирение является важным изменяемым фактором риска. Если у вас диагностирована тромбофилия и у вас не было сгустка крови, маловероятно, что вам дадут профилактическое лечение, если у вас нет других значительных факторов риска.Хотя все тромбофилии увеличивают риск образования тромбов, общий риск остается низким. Например, общая вероятность образования тромба составляет примерно 1-2 на 1000 человек. Если ваша тромбофилия увеличивает этот шанс в 5 раз, ваш риск по-прежнему составляет всего 1 процент или меньше.
В случае подтвержденного диагноза тромбофилия ваш врач продолжит лечение препаратами, известными как антикоагулянты.(Информацию об этих лекарствах см. В Разделе 7.) Конечно, отрицательный результат теста на тромбофилию будет облегчением. Однако очень важно, чтобы вы не полагались на ложное чувство защищенности от хороших новостей. Вы по-прежнему находитесь в группе риска на основании истории сгустков крови. Итак, продолжайте принимать прописанные лекарства и следуйте всем остальным медицинским инструкциям, например, снижение веса, поскольку ожирение является важным изменяемым фактором риска. Если у вас диагностирована тромбофилия и у вас не было сгустка крови, маловероятно, что вам дадут профилактическое лечение, если у вас нет других значительных факторов риска.Хотя все тромбофилии увеличивают риск образования тромбов, общий риск остается низким. Например, общая вероятность образования тромба составляет примерно 1-2 на 1000 человек. Если ваша тромбофилия увеличивает этот шанс в 5 раз, ваш риск по-прежнему составляет всего 1 процент или меньше. Таким образом, ваш врач может не захотеть подвергать вас потенциальным побочным эффектам антикоагулянтов, в том числе опасному для жизни кровотечению, если у вас низкий шанс образования тромба.
Таким образом, ваш врач может не захотеть подвергать вас потенциальным побочным эффектам антикоагулянтов, в том числе опасному для жизни кровотечению, если у вас низкий шанс образования тромба.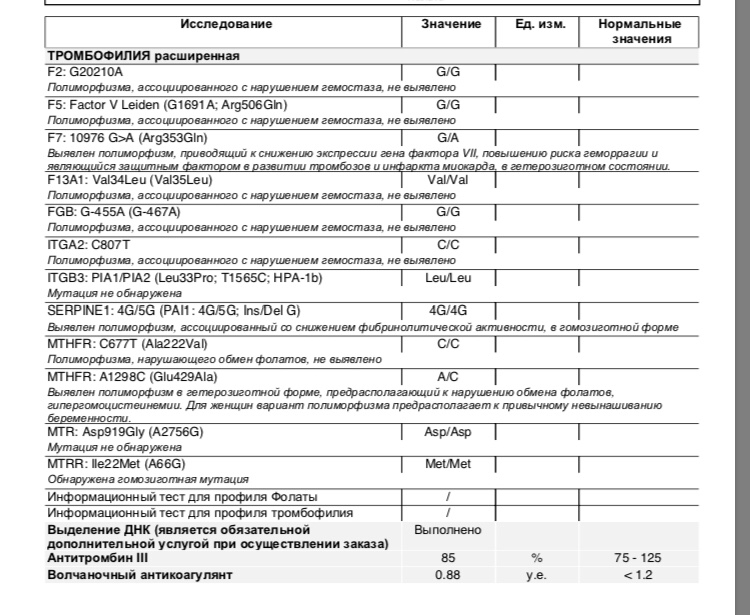 В худшем случае некоторые люди прибегают к ненужному лечению, которое подвергает их альтернативным рискам. В большинстве случаев положительный диагноз считается вторичным по отношению к семейному анамнезу или личному опыту с ВТЭ. Для большинства пациентов, у которых никогда не было сгустков крови, статус тромбофилии считается значимым для стратегий профилактики только тогда, когда они сталкиваются с определенными событиями со здоровьем, такими как операция или беременность, которые являются установленными сопутствующими факторами риска.
В худшем случае некоторые люди прибегают к ненужному лечению, которое подвергает их альтернативным рискам. В большинстве случаев положительный диагноз считается вторичным по отношению к семейному анамнезу или личному опыту с ВТЭ. Для большинства пациентов, у которых никогда не было сгустков крови, статус тромбофилии считается значимым для стратегий профилактики только тогда, когда они сталкиваются с определенными событиями со здоровьем, такими как операция или беременность, которые являются установленными сопутствующими факторами риска. Точно так же пациенты должны заранее знать свои финансовые обязательства, включая доплаты, франшизы и выплаты наличными.Хотя офис вашего врача и лаборатория могут обрабатывать большую часть документации, убедитесь, что вы осведомлены о требованиях.
Точно так же пациенты должны заранее знать свои финансовые обязательства, включая доплаты, франшизы и выплаты наличными.Хотя офис вашего врача и лаборатория могут обрабатывать большую часть документации, убедитесь, что вы осведомлены о требованиях. , Ковач М. Дж. И др. Влияние тромбофилии на риск рецидива венозной тромбоэмболии при приеме варфарина: результаты рандомизированного исследования. Кровь . 2008; 112: 4432-4436.
, Ковач М. Дж. И др. Влияние тромбофилии на риск рецидива венозной тромбоэмболии при приеме варфарина: результаты рандомизированного исследования. Кровь . 2008; 112: 4432-4436. J Thromb Haemost. 2005; 3: 955-961.
J Thromb Haemost. 2005; 3: 955-961. Высокий долгосрочный абсолютный риск рецидива венозной тромбоэмболии у пациентов с наследственной недостаточностью протеина S, протеина C или антитромбина. Тромб Гемост .2009; 101: 93-99.
Высокий долгосрочный абсолютный риск рецидива венозной тромбоэмболии у пациентов с наследственной недостаточностью протеина S, протеина C или антитромбина. Тромб Гемост .2009; 101: 93-99. 2006; 166: 729-736.
2006; 166: 729-736. N Engl J Med . 1995; 332: 993-997.
N Engl J Med . 1995; 332: 993-997. 2008; 121: 458-463.
2008; 121: 458-463.