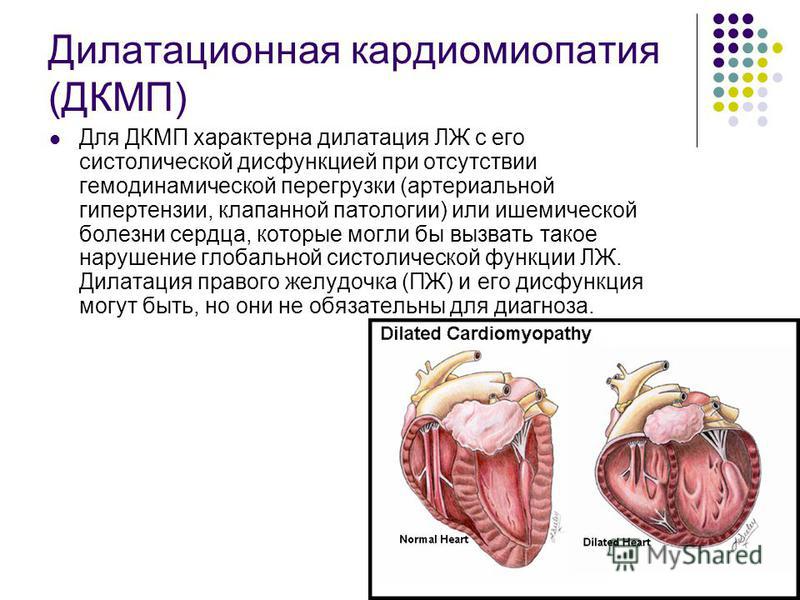
О ПОНЯТИЯХ «СИСТЕМНОЕ ВОВЛЕЧЕНИЕ СОЕДИНИТЕЛЬНОЙ ТКАНИ» И «ВОВЛЕЧЕНИЕ СЕРДЦА» В СВЕТЕ ПЕРЕСМОТРА ГЕНТСКОЙ НОЗОЛОГИИ ДЛЯ ДИАГНОСТИКИ СИНДРОМА МАРФАНА | Земцовский
1. Kadurina T. I., Gorbunova V. N. Connective tissue dysplasia. Guide for physicians. SPb.: ELBI SPb; 2009. Russian (Кадурина Т. И., Горбунова В. Н. Дисплазия cоединительной ткани. Руководство для врачей. СПб.: ЭЛБИ СПб, 2009).
2. Neptune E. R., Frischmeyer P. A., Arking D. E. et al. Dysregulation of TGF-b activation contributes to pathogenesis in Marfan syndrome. Nat Genet 2003; 33:407–11.
3. Dietz H. C., Loeys B., Carta L. et al. Recent progress towards a molecular understanding of Marfan syndrome. Am J Med Genet C Semin Med Genet 2005; 139:4–9.
4.
5. Beighton P., De Paepe A., Danks D. еt al. International Nosology of Heritable Disorders of Connective Tissue, Вerlin,1986. Am. J. of Medical Gen.1988; 29:581–94.
6. Loeys B. L., Dietz H. C., Braverman A. C. et al. The revised Ghent nosology for the Marfan syndrome. J. Med. Genet. 2010; 47:476–85.
7. De Paepe A., Devereux R. B., Deitz H. C., et al. Revised diagnostic criteria for the Marfan syndrome. American Journal of Medical Genetics 1996; 62:417–26.
8. Heritable connective tissue disorders/Russian Guideline/Cardiovascular therapy and prophylaxis 2009; 8 (6), Supрl. 5. Russian (Наследственные нарушения соединительной ткани. Российские рекомендации. Всероссийское научное общество кардиологов – секция дисплазии соединительной ткани. Кардиоваскулярная терапия и профилактика 2009; 8 (6), Приложение 5).
5. Russian (Наследственные нарушения соединительной ткани. Российские рекомендации. Всероссийское научное общество кардиологов – секция дисплазии соединительной ткани. Кардиоваскулярная терапия и профилактика 2009; 8 (6), Приложение 5).
10. Tymofeev E. V. Frequency of the dysplastic phenotypes and it relation with heart rhythm in young persons/Essay ph. d. SPb. 2011. Russian (Тимофеев Е. В. Распространенность диспластических синдромов и фенотипов и их взаимосвязь с особенностями сердечного ритма у лиц молодого возраста//авт. канд. дис. СПб. 2011.С. 24).
 Kapelko V. I. Extracellular matrix of myocardium and heart disease. Cardiology 2000; 9:78–90. Russian (Капелько В. И. Внеклеточный матрикс миокарда и его изменения при заболеваниях сердца. Кардиология 2000; 9:78–90).
Kapelko V. I. Extracellular matrix of myocardium and heart disease. Cardiology 2000; 9:78–90. Russian (Капелько В. И. Внеклеточный матрикс миокарда и его изменения при заболеваниях сердца. Кардиология 2000; 9:78–90).12. Kozlov P. S., Malev E. G., Prokudina M. N. et al. Strain and strain rate – novel technique for quantification of regional myocardial function. Arterial hypertension 2010; 16 (2):215–7. Russian (Козлов П. С., Малев Э. Г., Прокудина М. Н. и соавт. Деформация и скорость деформации – новые возможности количественной оценки регионарной функции
13. миокарда. Артериальная гипертензия 2010; 16 (2):215–7).
14. Leung D. Y., Ng AC. Emerging clinical role of strain imaging in echocardiography. Heart Lung Circ. 2010 Mar; 19 (3):161–74.
15. Mor-Avi V., Lang R. M., Badano L. P., et al. Current and evolving echocardiographic techniques for the quantitative evaluation of cardiac mechanics: ASE/EAE consensus statement on methodology and indications endorsed by the Japanese Society of Echocardiography. Eur. J. Echocardiogr. 2011 Mar; 12 (3):167–205.
Mor-Avi V., Lang R. M., Badano L. P., et al. Current and evolving echocardiographic techniques for the quantitative evaluation of cardiac mechanics: ASE/EAE consensus statement on methodology and indications endorsed by the Japanese Society of Echocardiography. Eur. J. Echocardiogr. 2011 Mar; 12 (3):167–205.
16. Malev E. G., Reeva S. V., Timofeev E. V., et al. Systolic and diastolic function of the left ventricle in mitral valve prolapsed. Heart failure 2012; 13 (1):25. Russian (Малев Э. Г., Реева С. В., Тимофеев Е. В., Пшепий А. Р., Коршунова А. Л., Панкова И. А., Земцовский Э. В. Систолическая и диастолическая функция левого желудочка при пролапсе митрального клапана. Сердечная недостаточность 2012; 13 (1) (69):25–30).
 Russian (Земцовский Э. В., Малев Э. Г. Малые аномалии cердца и диспластические фенотипы. СПб.: Изд-во «ИВЭСЭП», 2012). 160 с.
Russian (Земцовский Э. В., Малев Э. Г. Малые аномалии cердца и диспластические фенотипы. СПб.: Изд-во «ИВЭСЭП», 2012). 160 с.18. Bonow R. O., Carabello B. A., Kanu C. et al. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology.American Heart Association Task Force on Practice Guidelines. Circulation 2006; 114 (5): e84–231.
19. Zemtsovsky E. V., Malev E. G., Korshunova A. L. Left ventricular function in young person with marfanoid habitus and minor anomalies of the heart. Cardiostim 2012. Suppl. A 402. Russian (Земцовский Э. В., Малев Э. В., Коршунова А. Л. Функция левого желудочка у лиц молодого возраста с марфаноидной внешностью и малыми аномалиями сердца. Материалы конгресса «Кардиостим 2012». Вестник аритмологии. Приложение А. 402).
20. Malfait F., Hakim A. J., De Paepe A. et al. The genetic basis of the joint hypermobility syndromes. Rheumatology 2006; 45:502–7.
Malfait F., Hakim A. J., De Paepe A. et al. The genetic basis of the joint hypermobility syndromes. Rheumatology 2006; 45:502–7.
21. Davtyan K. R. Atrial fibrillation in patient with IHD and connective tissue disorders. Essay ph. d. SPb. 2009. Russian (Давтян К. Р. Фибрилляция предсердии у больных с ИБС, ассоциированной с недифференцированной соединительно-тканной дисплазией.
22. авт. канд. дис. СПб. 2009. с. 24).
23. Hasanova S. I. The role of connective tissue dysplasia in the formation of sclerodegenerative lesions of the aortic valve: avtoref. dis. … kand. med. nauk. SPb.; 2010. Russian (Хасанова С. И. Роль соединительно – тканной дисплазии в формировании склеродегенеративных поражений аортального клапана: автореф. дис. … канд. мед. наук.
24. СПб.; 2010).
СПб.; 2010).
Дисплазия соединительной ткани
В последнее время врачи нередко ставят детям диагноз «диспластический синдром» или «дисплазия соединительной ткани». Что это такое?
Соединительная ткань в человеческом организме является самой «разноплановой». Она включает такие несхожие субстанции, как кость, хрящ, подкожно-жировую клетчатку, кожные покровы, связки и др. В отличие от других тканей, соединительная ткань имеет структурные особенности: клеточные элементы находящиеся в межуточном веществе, которое представлено волокнистыми элементами и аморфным веществом.
От содержания аморфного компонента зависит консистенция соединительной ткани. Коллагеновые волокна придают всей ткани прочность и позволяют растягиваться.
Клинические проявления дисплазии соединительной ткани (ДСТ) обусловлены аномалией коллагеновых структур, которые выполняют опорную функцию, активно участвуют в формировании тканей, регенерации и старении клеток соединительной ткани.
Дисплазия соединительной ткани имеет наследственную предрасположенность. И если как следует поискать, то в вашей родословной обязательно найдутся родственники, страдающие варикозной болезнью нижних конечностей, близорукостью, плоскостопием, сколиозом, склонностью к кровоточивости. У кого-то в детстве болели суставы, у кого-то постоянно выслушивали шумы в сердце, кто-то был очень «гибким»… В основе этих проявлений лежат мутации генов, отвечающих за синтез коллагена – основного белка соединительной ткани. Волокна коллагена формируются неправильно и не выдерживают должной механической нагрузки.
Практически все дети до 5-летнего возраста имеют признаки дисплазии – у них нежная, легко растяжимая кожа, «слабые связки» и т.д. Поэтому диагностировать ДСТ в этом возрасте можно только косвенно, а также по наличию внешних признаков дисплазии у детей.

Сегодня выделено множество признаков ДСТ, которые условно можно разделить на выявляемые при внешнем осмотре, и внутренние, то есть признаки со стороны внутренних органов и центральной нервной системы.
Из внешних признаков наиболее часто встречаются следующие: выраженная гипермобильность или разболтанность суставов, повышенная растяжимость кожи, деформация позвоночника в виде сколиоза или кифоза, плоскостопие, плосковальгусная деформация стоп, выраженная венозная сеть на коже (тонкая, нежная кожа), патология зрения, деформация грудной клетки (килевидная, воронкообразная или небольшое вдавление на грудине), асимметрия лопаток, «вялая» осанка, склонность к появлению синяков или носовые кровотечения, слабость мышц живота, мышечная гипотония, искривление или асимметрия носовой перегородки, нежность или бархотность кожи, «полая» стопа, грыжи, неправильный рост зубов или сверхкомплектные зубы.
Как правило, уже в возрасте 5-7 лет дети предъявляют множество жалоб на слабость, недомогание, плохую переносимость физических нагрузок, снижение аппетита, боли в сердце, в ногах, голове, животе.

Изменения со стороны внутренних органов формируются с возрастом. Характерны опущение внутренних органов (почек, желудка), со стороны сердца — пролапс митрального клапана, шумы в сердце, со стороны желудочно-кишечноготракта — дискинезия желчевыводящих путей, рефлюксная болезнь, склонность к запорам, варикозному расширению вен нижних конечностей и т.д. Геморрагический синдром проявляется носовыми кровотечениями, склонностью к появлению синяков при малейшей травме.
Со стороны нервной системы отмечаются синдром вегетативной дистонии, склонность к обморокам, вертебробазиллярная недостаточность на фоне нестабильности шейного отдела позвоночника, синдром гипервозбудимости с дефицитом внимани. Со стороны опорно-двигательного аппатата: юношеский остеохондроз позвоночника или грыжи Шморля, юношеский остеопороз, артралгии или микротравматический «преходящий» артрит, дисплазия тазобедренных суставов.
Как помочь ребенку?
Режим дня. Ночной сон должен составлять не менее 8-9 часов, некоторым детям показан и дневной сон.
 Необходимо ежедневно делать утреннюю гимнастику. Если нет каких-то ограничений к занятиям спортом, то им заниматься необходимо всю жизнь, но ни в коем случае не профессиональным спортом! У детей с гипермобильностью суставов, занимающихся профессиональным спортом, очень рано развиваются дегенеративно-дистрофические изменения в хрящах, в связочном аппарате. Это связано с постоянной травматизацией, микроизлияниями, которые приводят к хроническому асептическому воспалению и дистрофическим процессам.
Необходимо ежедневно делать утреннюю гимнастику. Если нет каких-то ограничений к занятиям спортом, то им заниматься необходимо всю жизнь, но ни в коем случае не профессиональным спортом! У детей с гипермобильностью суставов, занимающихся профессиональным спортом, очень рано развиваются дегенеративно-дистрофические изменения в хрящах, в связочном аппарате. Это связано с постоянной травматизацией, микроизлияниями, которые приводят к хроническому асептическому воспалению и дистрофическим процессам.Хороший эффект дают лечебное плавание, ходьба на лыжах, езда на велосипеде, ходьба вверх по горкам и по лестницам, бадминтон, гимнастика ушу.
Лечебный массаж является важной составляющей реабилитации детей с ДСТ. Проводится массаж спины и шейно-воротниковой зоны, а также конечностей (курс 15-20 сеансов).
При наличии плосковальгусной установки стоп показано ношение супинаторов. Если ребенок жалуется на боли в суставах, обратите внимание на подбор рациональной обуви.
 У маленьких детей правильная обувь должна плотно фиксировать стопу и голеностопный сустав с помощью «липучек», должна иметь минимальное количество внутренних швов, изготавливаться из натуральных материалов. Задник должен быть высокий, жесткий, каблучок — 1-1,5 см.
У маленьких детей правильная обувь должна плотно фиксировать стопу и голеностопный сустав с помощью «липучек», должна иметь минимальное количество внутренних швов, изготавливаться из натуральных материалов. Задник должен быть высокий, жесткий, каблучок — 1-1,5 см.Желательно ежедневно проводить гимнастику для стоп, делать ножные ванны с морской солью 10-15 минут, делать массаж стоп и голеней.
Основной принцип лечения дисплазии соединительной ткани — это диетотерапия. Питание должно быть полноценным по белкам, жирам, углеводам. Рекомендуется пища, богатая белком (мясо, рыба, фасоль, орехи). Также в рационе необходим творог и сыр. Также продукты должны содержать большое количество микроэлементов и витаминов.
Лечение пациентов с ДСТ — сложная,но благодарная задача, если достигнуто взаимопонимание между родителями и врачом. Рациональный режим дня, правильное питание, разумные физические нагрузки и ваш постоянный контроль могут достаточно быстро избавить от проблем, связанных с ДСТ. Дисплазия имеет наследственный характер, и здоровый образ жизни полезен всем членам семьи!
Дисплазия имеет наследственный характер, и здоровый образ жизни полезен всем членам семьи!
Пролапс митрального клапана, лечение в Нижнем Новгороде
Однако эхокардиографические признаки пролабирования могут быть выявлены при УЗИ сердца. При этом признаков пролапса нет при аускультации (прослушивании) сердца и пациент не предъявляет никаких жалоб. В этом случае пролапс является УЗИ – находкой и речь идет о так называемом безобидном эхокардиографическом феномене. В таком случае диагноз может быть поставлен по заключению УЗИ.
Причины и формы пролапса митрального клапана
Пролабирование (пролапс) митрального клапана может быть первичным и вторичным.
Первичные формы связаны с генетической предрасположенностью к слабости и дезорганизации соединительной ткани, из которой состоят створки клапана, или с наследственными заболеваниями, при которых также страдает соединительная ткань (синдром Марфана, Элеса – Данлоса и другие). При первичном пролапсе створки клапана удлиняются, растягиваются и провисают. Замыкательная функция клапана нарушается, но только отчасти в отличие от недостаточности клапана – более тяжелой патологии. Часто этот вариант сочетается с пролапсом других клапанов сердца.
Замыкательная функция клапана нарушается, но только отчасти в отличие от недостаточности клапана – более тяжелой патологии. Часто этот вариант сочетается с пролапсом других клапанов сердца.
Вторичный пролапс митрального клапана выявляется на фоне уже имеющейся аномалии сердца или заболевания: диспропорция размеров желудочка и клапана, кардиомиопатия, нарушение работы миокарда, его сокращения и расслабления и другие.
Также можно определить пролапс митрального клапана, как результат комбинации генетических особенностей и приобретенных нарушений, что в совокупности приводит к удлинению и деформации створок, хорд и т.д.
Небольшое заключение: есть симптомы у пролапса и когда они себя проявляют
- Если пролапс был обнаружен при УЗИ сердца, при этом в сердце не выслушиваются шумы в сердце и человека не беспокоят жалобы на сердце, утомляемость, обмороки, то пролапс имеет значение только УЗИ-феномена, случайной находки.
- Если признаки пролабирования выявлены на УЗИ и есть еще диспластические процессы (изменения в соединительной ткани), то речь идет о малой аномалии сердца.
 Хотя и малый порок сердца может никак не влиять на жизнедеятельность. Что касается шумов, выслушиваемых в сердце, порок может давать характерную «звуковую» картину в виде шумов, которые слышит врач при аускультации сердца стетофонендоскопом.
Хотя и малый порок сердца может никак не влиять на жизнедеятельность. Что касается шумов, выслушиваемых в сердце, порок может давать характерную «звуковую» картину в виде шумов, которые слышит врач при аускультации сердца стетофонендоскопом. - Если помимо УЗИ признаков пролапса и шумов в сердце имеются симптомы, то речь идет о самостоятельном синдроме в виде пролапса. Чаще всего пациентов беспокоят повышенная утомляемость, особенно при физических нагрузках, сердцебиение, ортостатическая гипотензия, ощущение сердцебиения и дискомфорта в грудной клетке, предобморочные и обморочные состояния.
Диагностика пролапса митрального клапана
Диагностика основывается на клинической картине и данных аускультации (выслушивания) сердца. Для подтверждения диагноза применяют ЭхоКГ (эхокардиографию, УЗИ сердца). В то же время изменения, выявленные при УЗИ сердца, также могут навести на мысль о пролапсе митрального клапана.
Диагностика пролапса митрального клапана в Нижнем Новгороде
Диагностику пролапса митрального клапана в Нижнем Новгороде проводят в МЦ ТОНУС ЛАЙФ.
Особенности формирования рубца на матке после кесарева сечения при недифференцированной дисплазии соединительной ткани
Цель исследования. Изучить экспрессию магниевых каналов в рубце на матке после операции кесарева сечения у пациенток с недифференцированной дисплазией соединительной ткани (нДСТ).ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, 117 997 Россия,Москва, ул. Опарина, 4
Материал и методы. В исследование были включены 80 пациенток с рубцом на матке после операции кесарева сечения, которые были разделены на 2 группы: I (основная группа) – 40 пациенток с нДСТ и II (группа сравнения) – 40 беременных без признаков нДСТ. Использовались клинические, лабораторные, ультразвуковые, морфологические, иммуногистохимические методы исследования.
Результаты исследования. Полноценные рубцы на матке были представлены молодой соединительной тканью, богатой разнообразными фибробластическими элементами, располагающимися среди полнокровных капилляров и сосудов мелкого калибра.
 Неполноценные рубцы на матке характеризовались наличием атрофии и истончения с формированием тонкой фиброзной пленки, прикрывающей дефект стенки матки. В основной группе в рубцах на матке выявлено снижение экспрессии магниевых каналов, приводящее к повышению активности матриксных металлопротеиназ (ММР), что на фоне снижения активности их тканевых ингибиторов (ТIМP) приводит к усилению процессов деградации экстрацеллюлярного матрикса (ЭЦМ). В группе сравнения на фоне нормальной экспрессии магниевых каналов имеет место сбалансированное и однонаправленное увеличение ММP-9 и ТIМP-1, приводящее к более полноценному течению процессов репарации.
Неполноценные рубцы на матке характеризовались наличием атрофии и истончения с формированием тонкой фиброзной пленки, прикрывающей дефект стенки матки. В основной группе в рубцах на матке выявлено снижение экспрессии магниевых каналов, приводящее к повышению активности матриксных металлопротеиназ (ММР), что на фоне снижения активности их тканевых ингибиторов (ТIМP) приводит к усилению процессов деградации экстрацеллюлярного матрикса (ЭЦМ). В группе сравнения на фоне нормальной экспрессии магниевых каналов имеет место сбалансированное и однонаправленное увеличение ММP-9 и ТIМP-1, приводящее к более полноценному течению процессов репарации.Заключение. Снижение содержания магниевых каналов в гладкомышечных клетках и фибробластах сопровождается повышением активности ММP, усиливающих деградацию коллагеновых волокон, что приводит к дезорганизации соединительной ткани и, как следствие, к формированию неполноценного рубца на матке при нДСТ.
недифференцированная дисплазия соединительной ткани
неполноценный рубец на матке
кесарево сечение
магниевые каналы
матриксные металлопротеиназы
тканевые ингибиторы матриксных металлопротеиназ
1. Кадурина Т.И., Горбунова В.Н. Дисплазия соединительной ткани. СПб.: ЭЛБИ-СПб; 2009. 701 c
Кадурина Т.И., Горбунова В.Н. Дисплазия соединительной ткани. СПб.: ЭЛБИ-СПб; 2009. 701 c
2. Земцовский Э.В. Диспластические фенотипы. Диспластическое сердце. СПб.: Ольга; 2007. 80 c
3. Клеменов А.В. Недифференцированные дисплазии соединительной ткани. М.: Информтех; 2005. 136 c
4. Филипенко П.С., Малоокая Ю.С. Роль дисплазии соединительной ткани в формировании пролапса митрального клапана. Клиническая медицина. 2006; 84(12): 13-9
5. Клеменов А.В. Особенности течения беременности у женщин с недифференцированной дисплазией соединительной ткани. Проблемы репродукции. 2005; 3: 85-8
6. Спасов А.А. Магний в медицинской практике. Волгоград; 2000. 272 с
7. Senni K., Foucault-Bertaud A., Godeau G. Magnesium and connective tissue. Magnes. Res. 2003; 16(1): 70-4.
8. Нечаева Г.И., Яковлев В.М., Конев В.П., Друк И.В., Морозов С.Л. Дисплазия соединительной ткани: основные клинические синдромы, формулировка диагноза, лечение. Лечащий врач. 2008; 2: 22-8
9. Громова О.А. , Торшин И.Ю. Возможные молекулярные механизмы влияния дефицита магния и оротовой кислоты на дисплазию соединительной ткани. Эстетическая медицина. 2009; 8(1): 75-83
, Торшин И.Ю. Возможные молекулярные механизмы влияния дефицита магния и оротовой кислоты на дисплазию соединительной ткани. Эстетическая медицина. 2009; 8(1): 75-83
10. Chubanov V., Waldegger S., Mederos y Schnitzler M., Vitzthum H., Sassen M.C., Seyberth H.W. et al. Disruption of TRPM6/TRPM7 complex formation by a mutation in the TRPM6 gene causes hypomagnesemia with secondary hypocalcemia. Proc. Natl. Acad. Sci. USA. 2004; 101(9): 2894-9.
11. Schlingmann K.P., Weber S., Peters M., Niemann Nejsum L., Vitzthum H., Klingel K. et al. Hypomagnesemia with secondary hypocalcemia is caused by mutations in TRPM6, a new member of the TRPM gene family. Nat. Genet. 2002; 31(2): 166-70.
12. Кадурина Т.И. Наследственные коллагенопатии (клиника, диагностика, лечение и диспансеризация). СПб.: Невский диалект; 2000. 297 c
13. Abramson J.H. WINPEPI (PEPI-for-Windows): computer programs for epidemiologists. Epidemiol. Perspect. Innov. 2004; 1(1): 6.
14. Козинова О.В., Ищенко А.И., Липман А. Д., Паршикова О.В. Беременность, роды и перинатальные исходы у женщин с соединительнотканными дисплазиями сердца. Вопросы гинекологии, акушерства и перинатологии. 2008; 7(1): 21-5.
Д., Паршикова О.В. Беременность, роды и перинатальные исходы у женщин с соединительнотканными дисплазиями сердца. Вопросы гинекологии, акушерства и перинатологии. 2008; 7(1): 21-5.
15. Рочева С.Л. Выбор метода родоразрешения у женщин с миопией различной степени. Вестник офтальмологии. 2006; 3: 47-51.[Rocheva S.L. The choice of mode of delivery in women with varying degrees of myopia. Vestnik oftalmologii. 2006; 3: 47-51. (in Russian)]
16. Нечаева Г.И., Викторова И.А., Друк И.В. Дисплазия соединительной ткани: распространенность, фенотипические признаки, ассоциации с другими заболеваниями. Врач. 2006; 1: 19-23.
Тютюнник Виктор Леонидович, д.м.н., зав. акушерским обсервационным отделением ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул.
 Академика Опарина, д. 4. Телефон: 8 (495) 438-09-88. E-mail: [email protected]
Академика Опарина, д. 4. Телефон: 8 (495) 438-09-88. E-mail: [email protected]Демура Татьяна Александровна, к.м.н., с.н.с. 1-го патологоанатомического отделения ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. E-mail: [email protected]
Кесова Марина Исааковна, д.м.н., с.н.с. акушерского обсервационного отделения ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-09-88. E-mail: [email protected]
ЭФФЕКТИВНОСТЬ ЭЛЬКАРА ПРИ ДИСПЛАЗИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ СЕРДЦА У ДЕТЕЙ
1 52 ПРАКТИКА В ПОМОЩЬ ВРАЧУ ЭФФЕКТИВНОСТЬ ЭЛЬКАРА ПРИ ДИСПЛАЗИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ СЕРДЦА У ДЕТЕЙ Л. А. Воропай, Н.И. Пирожкова, ГБОУ ВПО Новосибирский государственный медицинский университет Минздрава России, Новосибирск Н.Г. Воропай, Городской неврологический центр «Сибнейромед», Новосибирск Ключевые слова: диспластическое сердце, левокарнитин, диспластическое сердце, энерготропная терапия Keywords: dysplastic heart, L-carnitine, dysplastic heart, energotropic therapy Клиника недифференцированной дисплазии соединительной ткани у детей многообразна, но диспластическое сердце является одним из самых распространенных ее проявлений в педиатрии и детской кардиологии. Соединительная ткань является структурной основой практически всех тканей человека, она составляет 50% всей массы тела и образует не только кожные покровы и опорный каркас, но и формирует внутреннюю среду организма, через которую органы получают питательные вещества. Соединительная ткань это особая ткань, в ней мало клеток и много внеклеточной матрицы. Внеклеточная матрица состоит из гелеобразной среды, коллагеновых и эластических волокон и клеток: фибробластов, остеокластов, хондробластов [4, 7, 8].
А. Воропай, Н.И. Пирожкова, ГБОУ ВПО Новосибирский государственный медицинский университет Минздрава России, Новосибирск Н.Г. Воропай, Городской неврологический центр «Сибнейромед», Новосибирск Ключевые слова: диспластическое сердце, левокарнитин, диспластическое сердце, энерготропная терапия Keywords: dysplastic heart, L-carnitine, dysplastic heart, energotropic therapy Клиника недифференцированной дисплазии соединительной ткани у детей многообразна, но диспластическое сердце является одним из самых распространенных ее проявлений в педиатрии и детской кардиологии. Соединительная ткань является структурной основой практически всех тканей человека, она составляет 50% всей массы тела и образует не только кожные покровы и опорный каркас, но и формирует внутреннюю среду организма, через которую органы получают питательные вещества. Соединительная ткань это особая ткань, в ней мало клеток и много внеклеточной матрицы. Внеклеточная матрица состоит из гелеобразной среды, коллагеновых и эластических волокон и клеток: фибробластов, остеокластов, хондробластов [4, 7, 8]. Гелеобразная среда самый важный компонент внеклеточной матрицы. Гель обеспечивает быструю диффузию питательных веществ, строительных материалов и гормонов между кровью и клетками соединительной ткани, которая происходит при участии большого количества ферментов, а так же ионов кальция, цинка, магния. Дисплазия соединительной ткани (ДСТ) это генетически детерминированное заболевание. Различают дифференцированные дисплазии соединительной ткани (ДДСТ) и недифференцированные (НДСТ) [5, 8]. ДДСТ это болезни с мутациями одного гена белка коллагена (они встречаются нечасто и мало зависят от внешних факторов). Чаще мы встречаемся НДСТ, которые характеризуются мутацией не одного гена, а нуклеотидным полиморфизмом. Нуклеотидный полиморфизм зависит от нутрициальных факторов (витаминов, макро и микронутриентов) [7].
Гелеобразная среда самый важный компонент внеклеточной матрицы. Гель обеспечивает быструю диффузию питательных веществ, строительных материалов и гормонов между кровью и клетками соединительной ткани, которая происходит при участии большого количества ферментов, а так же ионов кальция, цинка, магния. Дисплазия соединительной ткани (ДСТ) это генетически детерминированное заболевание. Различают дифференцированные дисплазии соединительной ткани (ДДСТ) и недифференцированные (НДСТ) [5, 8]. ДДСТ это болезни с мутациями одного гена белка коллагена (они встречаются нечасто и мало зависят от внешних факторов). Чаще мы встречаемся НДСТ, которые характеризуются мутацией не одного гена, а нуклеотидным полиморфизмом. Нуклеотидный полиморфизм зависит от нутрициальных факторов (витаминов, макро и микронутриентов) [7].
2 ПРАКТИКА В ПОМОЩЬ ВРАЧУ 53 Проявления ДСТ многообразны и касаются нарушений структуры и функции всех висцеральных органов и сопровождаются различными синдромами: астеническим, клапанным, торако-диафрагмальным, сосудистым, аритмическим, бронхолегочным, вертеброгенным, косметическим, вегетативной дисфункцией и гипермобильностью суставов. Частое сочетание вегетативной дистонии и ДСТ рассматривается как обязательный компонент диспластического фенотипа и обусловлен генетическими факторами, лежащими в основе нарушений биохимизма обменных процессов в соединительной ткани и формированием морфологических субстратов, приводящих к изменению функций гипоталамуса, гипофиза, половых желез, симпатоадреналовой системы [5]. Частота встречаемости ДСТ зависит от возраста детей. В период новорожденности выявление признаков НДСТ минимально, в 4 5 лет начинают формироваться пролапсы клапанов сердца, в лет торако диафрагмальный синдром, плоскостопие, миопия, а в подростковом возрасте сосудистый синдром. Объясняется это тем, что по мере роста ребенка увеличивается общая масса соединительной ткани [7]. При дисплазии соединительной ткани доказано наличие митохондриальной недостаточности, снижение окислительно-восстановительных процессов в митохондриях, недостаточность L-карнитина. Карнитин относится к незаменимым витаминоподобным веществам. Основные метаболические функции карнитина связаны с процессами преобразования биологической энергии, поэтому в особенно больших количествах он содержится в тканях, нуждающихся в высоком энергетическом обеспечении, скелетных мышцах, миокарде сердца, головном мозге, печени и почках.
Частое сочетание вегетативной дистонии и ДСТ рассматривается как обязательный компонент диспластического фенотипа и обусловлен генетическими факторами, лежащими в основе нарушений биохимизма обменных процессов в соединительной ткани и формированием морфологических субстратов, приводящих к изменению функций гипоталамуса, гипофиза, половых желез, симпатоадреналовой системы [5]. Частота встречаемости ДСТ зависит от возраста детей. В период новорожденности выявление признаков НДСТ минимально, в 4 5 лет начинают формироваться пролапсы клапанов сердца, в лет торако диафрагмальный синдром, плоскостопие, миопия, а в подростковом возрасте сосудистый синдром. Объясняется это тем, что по мере роста ребенка увеличивается общая масса соединительной ткани [7]. При дисплазии соединительной ткани доказано наличие митохондриальной недостаточности, снижение окислительно-восстановительных процессов в митохондриях, недостаточность L-карнитина. Карнитин относится к незаменимым витаминоподобным веществам. Основные метаболические функции карнитина связаны с процессами преобразования биологической энергии, поэтому в особенно больших количествах он содержится в тканях, нуждающихся в высоком энергетическом обеспечении, скелетных мышцах, миокарде сердца, головном мозге, печени и почках. Карнитин обеспечивает перенос жирных кислот в митохондрии, где происходит их окисление и высвобождение ацетил-коа субстрата для цикла Кребса. Карнитин осуществляет модуляцию внутриклеточного гомеостаза кофермента А в матриксе митохондрий, таким образом регулируя интенсивность биоэнергетического метаболизма. Цель исследования: выявить эффективность применения лекарственного препарата левокарнитина (препарат Элькар, ПИК-ФАРМА, Россия) при дисплазии соединительной ткани сердца у детей. МАТЕРИАЛЫ И МЕТОДЫ Из многочисленных висцеральных проявлений дисплазии соединительной ткани, выделяют дисплазию сердца, так как нарушения ритма сердца и проводимости, митральная регургитация, миксоматоз митрального клапана, аневризмы межпредсердной и межжелудочковой перегородки часто встречаются в практике [1, 10]. Нами обследовано 100 детей лет (50 мальчиков и 50 девочек) с дисплазией соединительной ткани сердца. Обследование проводилось по специально составленной анкете, которая заполнялась кардиологами детских поликлиник г.
Карнитин обеспечивает перенос жирных кислот в митохондрии, где происходит их окисление и высвобождение ацетил-коа субстрата для цикла Кребса. Карнитин осуществляет модуляцию внутриклеточного гомеостаза кофермента А в матриксе митохондрий, таким образом регулируя интенсивность биоэнергетического метаболизма. Цель исследования: выявить эффективность применения лекарственного препарата левокарнитина (препарат Элькар, ПИК-ФАРМА, Россия) при дисплазии соединительной ткани сердца у детей. МАТЕРИАЛЫ И МЕТОДЫ Из многочисленных висцеральных проявлений дисплазии соединительной ткани, выделяют дисплазию сердца, так как нарушения ритма сердца и проводимости, митральная регургитация, миксоматоз митрального клапана, аневризмы межпредсердной и межжелудочковой перегородки часто встречаются в практике [1, 10]. Нами обследовано 100 детей лет (50 мальчиков и 50 девочек) с дисплазией соединительной ткани сердца. Обследование проводилось по специально составленной анкете, которая заполнялась кардиологами детских поликлиник г. Новосибирска. Всем проводилась эхокардиография (ЭхоКГ), электрокардиография (ЭКГ), реоэнцефалография (РЭГ), холтеровское мониторирование, электроэнцефалография (ЭЭГ), кардиоинтервалография (КИГ), клиноортостатическая проба (КОП). РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ У 80% был выявлен пролапс митрального клапана (ПМК), пролапс трикуспидального клапана у 5% и пролапс аортального клапана у 15% детей. У всех пациентов пролапсы клапанов были первичными. У 30% обследованных ПМК сочетался с миксоматозным утолщением митрального клапана, которое сопровождалось митральной гемодинамически значимой регургитацией, что потребовало исключения острой ревматической лихорадки. У трети детей выявлен двустворчатый аортальный клапан. У 85% были аномально расположенные хорды в полости левого желудочка (поперечные, продоль-
Новосибирска. Всем проводилась эхокардиография (ЭхоКГ), электрокардиография (ЭКГ), реоэнцефалография (РЭГ), холтеровское мониторирование, электроэнцефалография (ЭЭГ), кардиоинтервалография (КИГ), клиноортостатическая проба (КОП). РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ У 80% был выявлен пролапс митрального клапана (ПМК), пролапс трикуспидального клапана у 5% и пролапс аортального клапана у 15% детей. У всех пациентов пролапсы клапанов были первичными. У 30% обследованных ПМК сочетался с миксоматозным утолщением митрального клапана, которое сопровождалось митральной гемодинамически значимой регургитацией, что потребовало исключения острой ревматической лихорадки. У трети детей выявлен двустворчатый аортальный клапан. У 85% были аномально расположенные хорды в полости левого желудочка (поперечные, продоль-
3 54 ПРАКТИКА В ПОМОЩЬ ВРАЧУ Динамика частоты жалоб пациентов на фоне лечения Таблица 1 Жалобы До лечения, абс., (%) После лечения, абс., (%) Перебои в работе сердца 49 (49) 9 (9)* Кардиалгии 100 (100) 2 (2)* Сердцебиения 80 (80) 1 (1)* Головная боль 99 (99) 1 (1)* Головокружние 56 (56) 5 (5)* Снижение аппетита 43 (43) 1 (1)* Утомляемость 100 (100%) 10 (10)* Апатия 89 (89) 7 (7)* *p < 0,05 ные, диагональные). У 3 человек констатирована аневризма межпредсердной перегородки, у 7 астенический вариант торакодиафрагмального сердца. Вегетативная дисфункция проявлялась артериальной гипотонией у 71% ребенка, а у 29% артериальная гипертония. В неврологическом статусе отмечались признаки церебральной недостаточности (82%), гипертензионного синдрома (30%), а по ЭЭГ данным ирритация подкорковых структур (65%). Кроме того, в результате обследования были выявлены проявления дисплазии соединительной ткани: астенический тип конституции в 60% случаев, арахнодактилия в 55%, нарушения осанки в 72% (сколиоз, прямая спина, сутулость, крыловидные лопатки). Гипермобильность суставов диагностирована у 10%, кожные проявления (келоидные рубцы, стрии, ломкие, тусклые волосы, лейконихии) у 48% обследованных. У 25% детей определялась миопия. Висцеральные нарушения в виде аномалии строения желчного пузыря, нефроптоз, задержка полового развития были у 61%, 20% и 21% пациентов соответственно. Учитывая нарушения метаболических процессов при дисплазии соединительной ткани, развитие энергодефицитного состояния, недостаток карнитина и микроэлементов, всем детям на 2 месяца была назначена энерготропная терапия левокарнитином (Элькар, ПИК-Фарма, Россия) в дозе 50 мг/кг в сутки [6].
У 3 человек констатирована аневризма межпредсердной перегородки, у 7 астенический вариант торакодиафрагмального сердца. Вегетативная дисфункция проявлялась артериальной гипотонией у 71% ребенка, а у 29% артериальная гипертония. В неврологическом статусе отмечались признаки церебральной недостаточности (82%), гипертензионного синдрома (30%), а по ЭЭГ данным ирритация подкорковых структур (65%). Кроме того, в результате обследования были выявлены проявления дисплазии соединительной ткани: астенический тип конституции в 60% случаев, арахнодактилия в 55%, нарушения осанки в 72% (сколиоз, прямая спина, сутулость, крыловидные лопатки). Гипермобильность суставов диагностирована у 10%, кожные проявления (келоидные рубцы, стрии, ломкие, тусклые волосы, лейконихии) у 48% обследованных. У 25% детей определялась миопия. Висцеральные нарушения в виде аномалии строения желчного пузыря, нефроптоз, задержка полового развития были у 61%, 20% и 21% пациентов соответственно. Учитывая нарушения метаболических процессов при дисплазии соединительной ткани, развитие энергодефицитного состояния, недостаток карнитина и микроэлементов, всем детям на 2 месяца была назначена энерготропная терапия левокарнитином (Элькар, ПИК-Фарма, Россия) в дозе 50 мг/кг в сутки [6]. Основная метаболическая функция левокарнитина транспорт длинноцепочечных жирных кислот через митохондриальную мембрану, в митохондриях они подвергаются Я-окислению и дальнейшему метаболизму с образованием АТФ. Левокарнитин усиливает дезинтоксикационную и белковосинтетическую функцию печени, которая начинает более активно расщеплять молочную и пировиноградную кислоту [2, 7]. Обследованные предъявляли большое количество жалоб. Динамика жалоб до и после лечения представлена в таблице 1. Четкая положительная динамика отмечалась в отношении всего перечня жалоб. Наиболее статистически значимые изменения были зарегистрированы со стороны вегетативной нервной системы: практически во всех случаях исчезли боли в сердце, ощущения сердцебиения, головная боль. У большинства пациентов улучшился эмоциональный тонус, повысилась активность, нормализовался аппетит. Результаты лечения представлены в таблице 2. Действие Элькара на вегетативную регуляцию у больных с ДСТ проявилось улучшением показателей электрокардиограммы.
Основная метаболическая функция левокарнитина транспорт длинноцепочечных жирных кислот через митохондриальную мембрану, в митохондриях они подвергаются Я-окислению и дальнейшему метаболизму с образованием АТФ. Левокарнитин усиливает дезинтоксикационную и белковосинтетическую функцию печени, которая начинает более активно расщеплять молочную и пировиноградную кислоту [2, 7]. Обследованные предъявляли большое количество жалоб. Динамика жалоб до и после лечения представлена в таблице 1. Четкая положительная динамика отмечалась в отношении всего перечня жалоб. Наиболее статистически значимые изменения были зарегистрированы со стороны вегетативной нервной системы: практически во всех случаях исчезли боли в сердце, ощущения сердцебиения, головная боль. У большинства пациентов улучшился эмоциональный тонус, повысилась активность, нормализовался аппетит. Результаты лечения представлены в таблице 2. Действие Элькара на вегетативную регуляцию у больных с ДСТ проявилось улучшением показателей электрокардиограммы. Так, по ЭКГ-данным, на фоне приема Элькара в течение 2 месяцев зарегистрировано достоверное улучшение процессов репо-
Так, по ЭКГ-данным, на фоне приема Элькара в течение 2 месяцев зарегистрировано достоверное улучшение процессов репо-
4 ПРАКТИКА ГАСТРОЭНТЕРОЛОГИЯ 55
5 56 ПРАКТИКА В ПОМОЩЬ ВРАЧУ Динамика метаболических изменений миокарда, различных нарушений ритма и проводимости до и после лечения по данным ЭКГ Таблица 2 Признак До лечения, абс., (%) После лечения, абс., (%) Нарушение процессов реполяризации (сглаженность и отрицательный зубец Т и/или депрессия сегмента ST) 96 (96) 16 (16)* синусовая тахикардия 80 (80) 5 (5)* синусовая аритмия 20 (20)
|
|
титул
%PDF-1.6 % 1 0 obj > endobj 5 0 obj >/Font>>>/Fields[]>> endobj 2 0 obj >stream 2014-09-16T15:51:57+04:002014-09-16T15:51:57+04:002014-09-16T15:51:57+04:00Adobe PageMaker 6.5application/pdf
Синдром дисплазии митрального клапана: уникальная форма левостороннего порока сердца
Задний план: Синдром дисплазии митрального клапана — уникальная форма левостороннего порока сердца, характеризующаяся гипоплазией оттока аорты, расширением левого желудочка, диспластическим / несостоятельным митральным клапаном и рестриктивной / неповрежденной перегородкой предсердий. Пациенты с этой совокупностью патологий лечились различными способами с плохими результатами в целом.
Методы: Мы провели ретроспективный обзор всех пациентов с синдромом дисплазии митрального клапана, чтобы определить эхокардиографические маркеры плода, позволяющие прогнозировать исходы.
Полученные результаты: Синдром дисплазии митрального клапана выявлен у 10 плодов.Расширение левых отделов сердца плода и аномальный кровоток в легочных венах были связаны с повышенной смертностью. У семи плодов была аномальная допплеровская картина легочных вен; 3 имел уникальную схему течения с «двойным обращением». Тяжелая дилатация левых отделов сердца плода (соотношение площадей левого и правого отделов сердца> 1,5) имела место у 5. Пренатальное вмешательство было выполнено на 3 плодах: баллонная вальвулопластика аорты (n = 2) и баллонная септостомия предсердий (n = 1). Из трех один умер в утробе матери, и ни одному из выживших не было выполнено восстановление 2 желудочков.Пяти пациентам потребовалось немедленное послеродовое вмешательство для открытия межпредсердной перегородки. Общая летальность составила 50%.
Выводы: Синдром дисплазии митрального клапана — уникальная форма врожденного порока сердца с тяжелым стенозом аорты, но нормальным или увеличенным левым желудочком, вторичным по отношению к первичному поражению митрального клапана. Увеличение размера левого сердца и допплерография легочных вен являются предиктором послеродового исхода.Несмотря на наличие расширенного левого желудочка, постнатальное лечение с помощью поэтапной паллиативной терапии одного желудочка может быть наиболее эффективной стратегией.
Х-сцепленная дисплазия сердечного клапана: MedlinePlus Genetics
Х-сцепленная дисплазия сердечного клапана — это состояние, характеризующееся аномальным развитием (дисплазией) сердечных (сердечных) клапанов. Нормальное сердце имеет четыре клапана, два на левой стороне сердца и два на правой стороне, которые позволяют крови проходить через сердце и предотвращают обратный ток крови.При Х-сцепленной дисплазии сердечных клапанов один или несколько из четырех сердечных клапанов утолщены и не могут полностью открываться и закрываться, когда сердце бьется и перекачивает кровь. Эти деформированные клапаны могут вызвать ненормальный кровоток и нерегулярный звук сердца во время сердцебиения (шум в сердце).
Признаки и симптомы Х-сцепленной дисплазии сердечного клапана сильно различаются у разных людей. У одних нет проблем со здоровьем, у других кровь может просачиваться через утолщенные и частично закрытые клапаны.Эта утечка клапана (регургитация) обычно влияет на митральный клапан, который соединяет две левые камеры сердца, или аортальный клапан, который регулирует кровоток из сердца в большую артерию, называемую аортой. Клапанная регургитация заставляет сердце работать сильнее, чтобы кровь проходила через сердце. В результате у пораженных людей могут развиться боли в груди, одышка или головокружение.
При Х-сцепленной дисплазии сердечного клапана митральный или аортальный клапан также может быть пролапсирован, что означает, что клапан слабый или гибкий.Выпадение клапана также препятствует правильному закрытию утолщенного клапана и может привести к регургитации клапана. Другие редкие осложнения Х-сцепленной дисплазии сердечного клапана включают воспаление внутренней оболочки сердца (эндокардит), аномальные тромбы или внезапную смерть.
Х-сцепленная дисплазия сердечного клапана может быть диагностирована в любое время от рождения (в некоторых случаях пренатально) до позднего взросления, но обычно диагностируется в раннем и среднем зрелом возрасте, поскольку порок развития клапана часто является медленным процессом.Это заболевание поражает мужчин чаще и тяжелее, чем женщин.
Аритмогенная дисплазия правого желудочка (АРВД)
Обзор
Что такое аритмогенная дисплазия правого желудочка (АРВД)?
(Также называется аритмогенной кардиомиопатией правого желудочка)
ARVD — это редкая форма кардиомиопатии, при которой сердечная мышца правого желудочка (ПЖ) замещается жировой и / или фиброзной тканью.Правый желудочек расширен и плохо сокращается. В результате способность сердца перекачивать кровь обычно ослабляется. У пациентов с АРВЗ часто наблюдаются аритмии (нарушения сердечного ритма), которые могут увеличить риск внезапной остановки сердца или смерти.
Симптомы и причины
Каковы симптомы аритмогенной дисплазии правого желудочка?
ARVD обычно диагностируется в молодом возрасте (обычно менее 40 лет) и может вызвать внезапную сердечную смерть у спортсменов.Симптомы могут включать:
- Желудочковые аритмии: нерегулярные сердечные ритмы, возникающие в желудочках или нижних камерах сердца. Наиболее распространенной является желудочковая тахикардия.
- Сердцебиение: трепетание в груди из-за нарушения сердечного ритма
- Головокружение, дурноту или обморок, вызванные нерегулярным сердечным ритмом
- Внезапная сердечная смерть — может быть первым признаком ОРВИ
- Сердечная недостаточность — одышка при физической активности, неспособность выполнять нормальную деятельность без утомления, отеки в ногах, лодыжках и стопах (отеки)
Что вызывает аритмогенную дисплазию правого желудочка?
Причина АРВД неизвестна.Встречается примерно у 1 из 5000 человек. АРВЗ может протекать без семейного анамнеза, хотя часто передается в семье. Семейный анамнез АРВЗ присутствует как минимум в 30–50 процентах случаев. Поэтому рекомендуется, чтобы все члены семьи первой и второй степени родства (родители, братья и сестры, дети, внуки, дядя, тетя, племянник, племянница) были тщательно обследованы на предмет этой формы кардиомиопатии, даже при отсутствии симптомов.
Исследователи обнаружили две модели наследования АРВД:
- Аутосомно-доминантный — Когда один из родителей болен АРВД.Исследования показывают, что в этих семьях члены семьи имеют 50-процентную вероятность унаследовать заболевание, хотя симптомы и возраст начала могут быть разными у разных членов семьи. АРВД более распространено в некоторых географических регионах, например в Италии.
- Аутосомно-рецессивный (одна форма называется болезнью Наксоса) — характеризуется симптомами АРВД, перечисленными выше. Болезнь Наксоса связана с утолщением внешнего слоя кожи на ладонях рук и подошвах ног (гиперкератоз) и густыми «шерстяными» волосами.
Не все специфические гены были идентифицированы как причина ARVD. Исследователи пытаются идентифицировать специфические генные мутации и расположение хромосом, связанных с ARVD.
ARVD также может быть связана с негенетическими причинами, такими как врожденные аномалии (поражающие правый желудочек), вирусный или воспалительный миокардит.
Диагностика и тесты
Как диагностируется аритмогенная дисплазия правого желудочка?
ARVD диагностируется на основании вашего анамнеза, физического осмотра и тестов (эхокардиограмма, холтеровский монитор, электрофизиологическое исследование, МРТ сердца и / или компьютерная томография сердца.
Магнитно-резонансная томография сердца (МРТ) рекомендуется для диагностики АРВЗ, поскольку она позволяет визуализировать фиброзно-жировую инфильтрацию миокарда правого желудочка (ПЖ). Он также может показать увеличенные размеры правого желудочка, а также аномалии движения стенок. К сожалению, качество изображения часто ухудшается из-за артефакта от нерегулярного сердечного ритма. По этой причине пациент может также пройти компьютерную томографию сердца, чтобы подтвердить или исключить диагноз АРВД. Этот визуализирующий тест может выявить характерные аномалии миокарда правого желудочка или полости правого желудочка.В отличие от МРТ, компьютерная томография может выполняться, если пациенту имплантировано устройство (например, кардиостимулятор, дефибриллятор).
Диагноз АРВД подтверждается при наличии у пациента следующих характеристик:
- Нарушение функции правого желудочка (ПЖ)
- Жировые или фиброзно-жировые инфильтраты правого желудочка сердечной мышцы (миокарда)
- Аномальная ЭКГ
- Аритмии (наджелудочковая тахикардия, желудочковая тахикардия или фибрилляция желудочков, особенно при физической нагрузке)
- Семейная история АРВД
Ведение и лечение
Как лечится аритмогенная дисплазия правого желудочка?
Нет никаких известных лечебных методов лечения АРВД.Лечение обычно направлено на контроль желудочковых аритмий пациента и лечение сердечной недостаточности. Основная цель лечения — предотвращение устойчивых желудочковых аритмий и / или внезапной смерти. Таким образом, антиаритмическая медикаментозная терапия является наиболее часто применяемой терапией. Частые желудочковые аритмии, которые не удалось вылечить медикаментозным лечением, можно лечить с помощью радиочастотной абляции. Пациенты, которые, как считается, подвержены риску внезапной смерти, обычно получают лечение с помощью имплантируемого дефибриллятора (ИКД).
Пациентам с АРВД необходимо спросить своего врача о физических упражнениях или занятиях спортом.
Ресурсы
Лечащие врачи
Доктора различаются по качеству из-за разной подготовки и опыта; больницы различаются по количеству доступных услуг.Чем сложнее ваша медицинская проблема, тем значительнее становятся эти различия в качестве и тем большее значение они имеют.
Очевидно, что врач и больница, которые вы выберете для комплексного специализированного медицинского обслуживания, будут иметь прямое влияние на то, насколько хорошо вы себя чувствуете. Чтобы помочь вам сделать этот выбор, ознакомьтесь с результатами нашего Института сердца, сосудов и торакальной системы семьи Миллер.
Кливлендская клиника сердца и сосудов Института кардиологов и хирургов
Выбор врача для лечения нарушения сердечного ритма зависит от того, на каком этапе диагностики и лечения вы находитесь.Следующие секции и отделения Института сердца и сосудов лечат пациентов с аритмией:
Институт сердца и сосудов также имеет специализированные центры для лечения определенных групп пациентов:
Для молодых пациентов с нарушениями сердечного ритма:
См. Раздел «О нас», чтобы узнать больше о Семейном кардиологическом, сосудистом и торакальном институте Сиделла и Арнольда Миллеров.
Контакт
Если вам нужна дополнительная информация, нажмите здесь, чтобы связаться с нами, поговорите в чате с медсестрой или позвоните медсестре по ресурсам и информации Института сердечно-сосудистых заболеваний семьи Миллер по номеру 216.445.9288 или по бесплатному телефону 866.289.6911. Будем рады вам помочь.
Стать пациентом
Варианты лечения
Руководства по лечению
Диагностические тесты
Диагностические тесты используются для диагностики аномального сердцебиения и определения наиболее эффективного метода лечения.
Анатомия
Веб-чаты
Наши веб-чаты и видеочаты дают пациентам и посетителям еще одну возможность задать вопросы и пообщаться с нашими врачами.
Видео
Интерактивные инструменты
Ссылки на ресурсы
Включение ссылок на другие веб-сайты не означает одобрения материалов на этих веб-сайтах или какой-либо связи с их операторами.
Почему стоит выбрать клинику Кливленда для лечения?
Наши результаты говорят сами за себя. Ознакомьтесь с нашими цифрами и фактами, и если у вас возникнут вопросы, не стесняйтесь их задавать.
Аритмогенная дисплазия / кардиомиопатия правого желудочка (ARVD / C)
Что такое аритмогенная дисплазия / кардиомиопатия правого желудочка?
Аритмогенная дисплазия / кардиомиопатия правого желудочка (ARVD / C) — редкое семейное заболевание, которое может вызывать желудочковую тахикардию и внезапную сердечную смерть у молодых, практически здоровых людей.Клиническим признаком заболевания являются желудочковые аритмии, возникающие преимущественно из правого желудочка. Патологический признак заболевания — фибро-жировое замещение миокарда правого желудочка.
Что вызывает АРВД / К?
ARVD / C вызывается мутациями в генах, кодирующих десмосомные белки. Эти белки участвуют в межклеточной адгезии. Это важное наблюдение помогает объяснить, почему АРВД / К чаще встречается у спортсменов, и отсроченное начало заболевания.
Каковы симптомы АРВД / К?
Симптомы ARVD / C включают:
- Аритмии — Нарушение ритма или характера сердцебиения, которое проявляется в виде учащенного сердцебиения, пропуска сердцебиения, сердцебиения или трепетания
- Преждевременные сокращения желудочков — дополнительные или нерегулярные сердцебиения, возникающие, когда электрический сигнал начинается в нижней камере сердца (желудочке)
- Желудочковая тахикардия (ЖТ) — серия учащенных сердечных сокращений, берущих начало в желудочке.Это может длиться всего несколько ударов или продолжаться и приводить к опасным для жизни аритмиям. ЖТ может вызывать слабость, тошноту, рвоту и головокружение, а также ощущение учащенного или учащенного сердцебиения.
- Обморок — Также называется обмороком или внезапной потерей сознания
- Сердечная недостаточность — Редко первые симптомы пациента связаны с правожелудочковой недостаточностью, включая слабость, отек стопы и лодыжки (периферический отек), скопление жидкости в брюшной полости (асцит), а также симптомы аритмии.
- Внезапная остановка сердца — У некоторых пациентов первым признаком АРВЗ / К является внезапная остановка сердца, когда сердце перестает биться и перекачивает кровь к остальным органам тела. Если не принять меры в течение нескольких минут, это может привести к смерти.
Как диагностируется АРВД / Х?
Диагноз АРВД / К основывается на выполнении ряда определенных критериев, которые учитывают отклонения ЭКГ, аритмии, структурные отклонения и характеристики тканей, а также семейный анамнез и генетику.В 1994 г. международная рабочая группа предложила критерии клинического диагноза АРВД / ХС, основанные на этих различных категориях. Эти критерии были очень специфичными для АРВД / К, однако им не хватало чувствительности для диагностики более легких или атипичных проявлений. Эти диагностические критерии были пересмотрены в 2010 году и теперь включают достижения в области технологий и генетики. При применении диагностических критериев важна информация из электрокардиограмм (ЭКГ), ЭКГ с усредненным сигналом, тестов с физической нагрузкой, мониторов Холтера, эхокардиограмм, МРТ, семейного анамнеза и генетического тестирования.См. Сравнительную таблицу диагностических критериев АРВЗ / К за 1994 и 2010 годы.
Диагностические критерии ARVD / C
A Определенный диагноз АРВД / К состоит из следующих критериев различных категорий:
- Два основных критерия, или
- Один основной и два второстепенных критерия, или
- Четыре второстепенных критерия
Пограничный диагноз состоит из следующих вариантов критериев из разных категорий:
- Один основной и один второстепенный критерии, или
- Три второстепенных критерия
A Возможный диагноз состоит из следующих критериев вариантов из разных категорий:
- Один из основных критериев, или
- Два второстепенных критерия
Тестирование
Не существует единого теста, который мог бы установить или исключить ARVD / C.Критерии, которые используются для определения ARVD / C, — это медицинский осмотр, семейный анамнез, различные кардиологические тесты и генетическая информация. Тесты могут включать:
Как лечится АРВД / Х?
Варианты лечения различаются в зависимости от пациента и основаны на результатах сердечного теста пациента, истории болезни и наличии или отсутствии генетических мутаций. Три наиболее распространенных метода лечения аритмий — это медикаменты, имплантируемые кардиовертер-дефибрилляторы (ИКД) и катетерная абляция.
Лекарства
Лекарства можно использовать для уменьшения количества эпизодов и тяжести аритмии.Лекарства изменяют электрические свойства сердца одним из двух способов:
- Непосредственно: лекарства влияют на электрические токи в сердце
- Косвенно: такие лекарства, как бета-блокаторы, блокируют действие адреналина или улучшают приток крови к сердцу.
Бета-адреноблокаторы снижают частоту сердечных сокращений, артериальное давление и действие адреналина. Это безопасный и широко используемый вид лекарств.
Если пациенты испытывают желудочковую тахикардию, несмотря на лечение бета-блокаторами, могут быть рекомендованы антиаритмические препараты, такие как сотолол или амиодарон.Ингибиторы АПФ также могут помочь снизить нагрузку на сердце и предотвратить развитие сердечной недостаточности. Помните, что все лекарства могут вызывать побочные эффекты, и что каждый год разрабатываются новые лекарства.
Имплантируемый кардиовертер-дефибриллятор (ICD)
Имплантируемые кардиовертеры-дефибрилляторы обычно используются для лечения пациентов с ARVD / C. Эти устройства постоянно контролируют сердцебиение и автоматически наносят небольшой электрический разряд в сердце, если происходит нерегулярное сердцебиение или быстрый устойчивый сердечный ритм.Это может вызвать кратковременный дискомфорт, который некоторые пациенты описывают как «удар ногой в грудь».
ИКД также могут работать как кардиостимуляторы и могут лечить как медленные, так и быстрые ритмы. Их следует проверять каждые три-шесть месяцев и, возможно, менять каждые четыре-шесть лет.
Катетерная абляция
Для лечения ARVD / C с помощью катетерной абляции области сердца, вызывающие аритмию, локализуются и прижигаются (сжигаются) для разрушения ткани. Эта инвазивная процедура проводится в электрофизиологической лаборатории и может снизить частоту эпизодов аритмии.
Традиционная катетерная абляция, называемая эндокардиальной аблацией, обрабатывает мышцу на внутренней поверхности сердца. Катетеры вводятся по венам в ногах и направляются в сердце, где располагается аритмическая область и разрушается. Недавно была разработана многообещающая техника абляции, называемая эпикардиальной аблацией. В этой технике обрабатывается внешняя часть сердца. Многие аритмии ARVD / C возникают вне сердца. При эпикардиальной абляции катетер проходит под грудиной в мешок вокруг сердца.Хотя эпикардиальная абляция может быть очень эффективной при лечении аритмий у пациентов с ARVD / C, это сложная процедура. Мы рекомендуем проводить процедуру в центре, имеющем опыт лечения пациентов с АРВД / К с использованием этого эпикардиального подхода.
Катетерная абляция не является окончательным средством лечения АРВД / К, потому что это прогрессирующее заболевание. Катетерная абляция может помочь снизить потребность в терапии ИКД. Перед выполнением этой процедуры пациенты должны тщательно обсудить со своими врачами риски и преимущества катетерной аблации.
Каков прогноз при АРВД / К?
У некоторых пациентов сердце будет стабильно функционировать в течение десятилетий, в то время как у других могут быть приступы аритмии, требующие смены лекарств или абляций. Исследования показали, что долгосрочные перспективы для большинства людей с АРВД / Х относительно хороши. У некоторых пациентов развивается такая серьезная дисфункция или частые эпизоды желудочковой тахикардии, что может потребоваться трансплантация сердца.
Дифференциальная диагностика
Основным заболеванием, которое необходимо дифференцировать от АРВД / К, является идиопатическая желудочковая тахикардия, возникающая из тракта оттока.Желудочковая тахикардия может быть точно такой же, но структурной аномалии сердца нет, в отличие от ситуации при АРВЗ / Х, когда обычно наблюдается расширение желудочка, аномальное сокращение или снижение функции. Тахикардия из тракта оттока правого желудочка встречается чаще, чем АРВД / К, и встречается у молодых, в остальном здоровых людей. Лечение проводится либо с помощью лекарств, либо с помощью катетерной абляции.
Ремонт врожденной дисплазии митрального клапана у младенцев и детей: всегда ли это возможно? ✩ | Европейский журнал кардио-торакальной хирургии
Абстрактные
Цели : Хирургическое лечение врожденной аномалии митрального клапана (МК) в детской возрастной группе остается терапевтической проблемой в связи с широким спектром морфологических аномалий и высокой частотой ассоциированных сердечных аномалий.Мы проанализировали наш опыт, чтобы оценить, всегда ли целесообразна консервативная операция МК и ее результаты превосходят замену МК. Методы : Тридцать четыре последовательных ребенка (20 мальчиков и 14 девочек) со средним возрастом 5,9 лет (диапазон от 45 дней до 18 лет) подверглись хирургическому лечению от врожденного порока МК в период с января 1987 года по июнь 1999 года. Четыре пациента (11,7%) были моложе 12 месяцев, а 21 пациент (62%) — моложе 5 лет. У двадцати двух пациентов была недостаточность МК (или преобладающая недостаточность), а у 12 — стеноз (или преобладающий стеноз).Сопутствующие поражения сердца присутствовали у 22 пациентов (62,8%). Результаты : Реконструкция митрального клапана возможна в целом. Оперативных смертей не было. Трем пациентам потребовалась повторная операция по поводу рестеноза МК (повторное восстановление у одного и замена МК механическим протезом через два) через 4 месяца, 27 месяцев и 5,6 года после восстановления, без операционных смертей. Был только один поздний случай смерти от тромбоза протезного клапана. Данные последующего наблюдения показывают, что у 33 выживших пациентов симптомы отсутствуют и находятся в периоде от 4 месяцев до 12 лет (в среднем 72 месяца) после операции.К 12 годам актуарная выживаемость и отсутствие повторной операции составили 96,8 и 85,9% соответственно. Эхокардиография, выполненная во всех из них, выявила отсутствие или умеренную несостоятельность или стеноз у 26 (78%), в то время как остаточная умеренная несостоятельность МК сохраняется у шести. Выводы : Наш опыт показывает, что реконструктивные процедуры МК у младенцев и детей с врожденной дисплазией МК могут быть эффективными и надежными при низкой смертности и низкой частоте повторных операций. Всегда следует пытаться восстановить митральный клапан, особенно у младенцев, несмотря на частую серьезность дисплазии МК, чтобы избежать недостатков имеющихся в настоящее время протезов.
1 Введение
Врожденная дисплазия митрального клапана (МВ) — это редкая аномалия, характеризующаяся широким спектром морфологических аномалий и высокой частотой ассоциированных сердечных аномалий [1–4]. Несмотря на недавние достижения в лечении сложных врожденных пороков сердца, хирургическое лечение врожденной дисфункции МК по-прежнему сопряжено со значительной смертностью [5,6]. Консервативное хирургическое вмешательство рекомендовано и считается возможным у большинства пациентов [6–9], даже у пациентов с чрезвычайно тяжелым заболеванием МК [10].Замена митрального клапана все еще связана со значительной летальностью при операции и постоянным риском необратимой заболеваемости [11,12], в то время как замена митрального клапана в более молодом возрасте определяет более высокую частоту повторных операций [12].
Целью данной статьи является обзор нашего опыта консервативного хирургического лечения врожденных пороков развития МК в детской возрастной группе в течение 12-летнего периода, чтобы оценить, всегда ли целесообразно консервативное хирургическое вмешательство МК и является ли результат этого лечения целесообразным. превосходит замену MV.
2 Материалы и методы
В период с января 1987 г. по июнь 1999 г. 34 ребенка подряд (20 мальчиков и 14 девочек), средний возраст которых составлял 5,9 лет (диапазон от 45 дней до 18 лет), подверглись хирургическому лечению по поводу врожденной дисплазии МК. Четверо детей (11,7%) были младше 12 месяцев, а 21 (61,7%) — младше 5 лет. Средний вес при операции составил 20,6 кг (диапазон: 3,7–62,5 кг). Из этого исследования были исключены пациенты с дефектами атриовентрикулярного канала, гипоплазией левого желудочка, атриовентрикулярным и вентрикуло-артериальным дисбалансом, а также функциональным единичным желудочком.
Предоперационные симптомы включали одышку при физической нагрузке, задержку роста и повторные инфекции грудной клетки у 14 пациентов. Четверо детей поступили с застойной сердечной недостаточностью, двоим из них потребовалась интубация трахеи, искусственная вентиляция легких и инфузия инотропных препаратов перед операцией. Остальные 16 пациентов протекали бессимптомно. Электрокардиограмма у всех ритм синусовый. Среднее кардио-грудное соотношение составило 0,56 в диапазоне от 0,41 до 0,71.
Все дети были обследованы до операции с помощью двумерной эхокардиографии и цветного допплера.Несостоятельность митрального клапана (или преобладающая недостаточность) была основной дисфункцией у 22 пациентов (64,7%). Несостоятельность митрального клапана оценивалась количественно путем измерения объема регургитации ниже отверстия на цветном допплеровском изображении (область конвергенции потока), согласно Bargiggia et al. [13]. Мы определили регургитацию как легкую, когда максимальный объем потока срыгивания (MRFV) составляет менее 100 мл / мин на м 2 (четыре случая), от легкой до умеренной, когда MRFV колеблется от 100 до 200 мл / мин на м 2 ( пять случаев), средней степени, когда MRFV составляет от 200 до 300 мл / мин на м 2 (11 случаев), и тяжелой, когда MRFV превышает 300 мл / мин на м 2 (два случая).У десяти из этих MV фиброзное кольцо было расширено в среднем на 5,7 мм (диапазон от 2 до 9,6 мм) по сравнению с нормальным контролем для площади поверхности тела [14]. Стеноз митрального клапана (или превалирующий стеноз) был основной клапанной дисфункцией у 12 пациентов (35,3%) со средним градиентом пикового диастолического давления левого предсердия и левого желудочка 24,1 мм рт.
Предоперационная катетеризация сердца была проведена у 16 пациентов (47%) в качестве рутинного исследования, в начале нашего опыта. Легочная гипертензия была тяжелой (давление в легких выше 50% системного систолического давления) у трех пациентов и легкой (среднее давление в легких ниже 35 мм рт. Ст.) У трех.У остальных 28 пациентов он был в пределах нормы [15].
Врожденные пороки развития МК классифицировались по Карпентье [1]. Несостоятельность митрального клапана разделили на: тип I (нормальное движение створки) — 17 случаев; тип II (выпадение створки) — три случая; тип III (ограниченное движение створки), два случая. Стеноз митрального клапана был разделен на следующие категории: тип А (нормальная папиллярная мышца), три случая; тип B (аномальная папиллярная мышца), девять случаев (Таблица 1) . Сопутствующие поражения сердца, требующие хирургического вмешательства, перечислены в таблице 2.Коарктация перешейка аорты у 11 пациентов и тетралгия Фалло у одного были хирургически исправлены перед лечением МК. В 12 случаях (35%) порок развития МК проявился в виде изолированной аномалии.
Таблица 1
Классификация по Carpentier
Таблица 1
Классификация по Carpentier
Таблица 2
Сопутствующие пороки развития сердца, требующие хирургического лечения, у 22 пациентов (64.7%)
Таблица 2
Сопутствующие пороки развития сердца, требующие хирургического лечения, у 22 пациентов (64,7%)
2,1 Хирургическая техника
Хирургическое лечение включало оценку МК с помощью интраоперационной чреспищеводной эхокардиографии (ЧЭ) или эпикардиальной эхокардиографии [16] у пациентов с массой тела менее 6 кг. Особое внимание было уделено пониманию механизма дисфункции МК. Во всех случаях установлен аортобикавальный искусственный кровообращение с системной гипотермией; гипотермия была умеренной (25 ° C) в 30 случаях, в то время как у пациентов с массой тела менее 4 кг (четыре случая) была достигнута глубокая гипотермия (ректальная температура 18 ° C) для остановки кровообращения; Кардиоплегия холодным калием использовалась у первых 25 пациентов, в то время как совсем недавно холодная кардиоплегия крови, обогащенная калием, применялась у остальных девяти пациентов.МК был открыт либо через левую атриотомию кзади от межпредсердной борозды (28 случаев), либо через межпредсердную перегородку (шесть случаев), в зависимости от размеров левого предсердия и необходимости лечения связанных сердечных аномалий. Весь аппарат митрального клапана был тщательно осмотрен с помощью четырех выворачивающихся швов, наложенных на фиброзное кольцо (рис.1). . Функцию клапана гидродинамически оценивали до и после реконструкции с помощью быстрой инфузии холодного физиологического раствора в левый желудочек через МК.Наличие остаточной важной утечки на месте закрытия створки было сочтено плохим результатом, и была предпринята попытка дальнейшего лечения. Кольцевидная дилатация, приводящая к недостаточности центрального клапана, лечилась с помощью редуктивной аннулопластики на листке настенной росписи, начиная с каждой спайки, аналогично описанной Kay et al. [17]. Раздельные U-образные швы использовались для лечения срыгивания в области спаек. Протезное кольцо Карпентье было использовано у одного 16-летнего мальчика, у которого была чистая кольцевидная дилатация.Подробная информация о хирургических методах, применяемых для каждого пациента, представлена в таблице 3. Девятнадцати пациентам было выполнено одновременное восстановление ассоциированных внутрисердечных поражений, в то время как у 11 пациентов лечение коарктации перешейка аорты проводилось до восстановления МК (таблица 3).
Рис. 1
Четыре выворачивающихся шва используются для улучшения обнажения всего аппарата митрального клапана.
Рис. 1
Четыре выкидных шва используются для улучшения обнажения всего аппарата митрального клапана.
Таблица 3
Хирургические данные и оперативные методы у пациентов, перенесших хирургическое лечение дисплазии митрального клапана a
Таблица 3
Хирургические данные и операционные методы у пациентов, подвергшихся хирургическому лечению дисплазии митрального клапана a
3 Результаты
Реконструкция митрального клапана возможна у всех детей. Смертей в больницах не было. Не было серьезных послеоперационных хирургических осложнений, за исключением полной атриовентрикулярной блокады, потребовавшей имплантации постоянного кардиостимулятора, в одном случае (пациент 14), перенесший резекцию субаортального стеноза и закрытие патча дефекта межжелудочковой перегородки в сочетании с восстановлением МК.
Трем детям потребовалась повторная операция через 4, 27 и 66 месяцев после восстановления МК соответственно (Таблица 3). У всех МВ при первой операции оказался крайне деформированным (гамак-клапан в двух случаях, комплекс Шона в одном). Повторная консервативная операция была возможна только у одного ребенка (пациент 3, таблица 3) после комиссуротомии МК, у которого для лечения остаточного функционального стеноза была выполнена дополнительная комиссуротомия в дополнение к хордальной фенестрации, связанной с субаортальной резекцией.Двое детей (случаи 16 и 23, таблица 3) успешно перенесли протезирование МК механическим протезом (размер 16 Carbomedics).
Одному пациенту (случай 11, таблица 3), у которого первоначально была произведена коррекция на тетралогию Фалло в возрасте 7 месяцев, потребовалась модифицированная процедура Конно по поводу рецидивирующего туннелеподобного субаортального стеноза через 73 месяца после восстановления МК и резекции дискретного субаортальный стеноз.
3.1 Дальнейшие действия
Один пациент (случай 16, таблица 3) умер поздно (10 месяцев после восстановления МК, 6 месяцев после замены МК) из-за тромбоза клапана из-за недостаточного соблюдения нашей программы антикоагуляции.
Всем выжившим было проведено полное клиническое и эхокардиографическое наблюдение. Среднее время наблюдения составило 72 месяца, от 4 месяцев до 12 лет. Все пациенты остаются бессимптомными и имеют синусовый ритм. Ни один из них не проходит пероральную противозастойную терапию. Актуарная выживаемость составляет 96,8%, частота отсутствия повторных операций составляет 85,9%, а отсутствие протеза МК составляет 93% (рис. 2–4). .
Рис. 2
Актуарная выживаемость после операции на митральном клапане.
Рис. 2
Актуарная выживаемость после операции на митральном клапане.
Рис. 3
Актуарная свобода от повторных операций.
Рис. 3
Актуарная свобода от повторных операций.
Рис. 4
Актуарная свобода от протеза митрального клапана.
Рис. 4
Актуарная свобода от протеза митрального клапана.
Двумерная эхокардиография и цветная допплерография были выполнены 32 пациентам, получавшим консервативное лечение.Семнадцать из них не имеют признаков митральной регургитации или стеноза или имеют легкие признаки, в то время как умеренная степень недостаточности присутствует у шести. У девяти пациентов имеется остаточный мягкий митральный стеноз со средним пиковым градиентом 12,6 мм рт. Ст. По МК.
Один выживший пациент с протезом клапана без симптомов, принимающий антикоагулянтную терапию варфарином натрия. Об эпизодах эмболии или геморрагии не сообщалось.
4 Выводы
Восстановление митрального клапана при приобретенном заболевании у взрослых в настоящее время является хорошо зарекомендовавшим себя лечением, и долгосрочное наблюдение подтверждает его надежность [18–19].Сообщается, что хирургические результаты у детей с врожденными пороками МК не столь хороши из-за сложного широкого спектра морфологических аномалий, частой ассоциации с другими сердечными аномалиями, более низкого уровня заболеваемости [1,2,5,6] и как следствие, меньший опыт хирургического вмешательства в такой группе пациентов [20].
Когда мальформация МК диагностируется в раннем младенчестве, хирургическое лечение обычно откладывают до появления симптомов. Технические проблемы во время операции, такие как трудности с получением надлежащего обнажения клапанных и подклапанных структур в сердце небольшого размера, и опасения по поводу имплантации протеза МК, который обычно слишком большой, в кольцевое пространство МК пациента, по-видимому, являются серьезной проблемой.По нашему опыту, мы применили глубокую гипотермическую остановку кровообращения у младенцев с массой тела менее 4 кг и четыре вывертывающих шва в области митрального кольца, чтобы улучшить обнажение всего клапанного аппарата (рис. перед планированием правильной хирургической стратегии.
Нас также вдохновили Соуза Ува и др. [20], которые за свой 13-летний опыт восстановления МК на первом году жизни сообщили об отличных результатах в такой сложной отобранной популяции с низкой операционной смертностью, актуарной выживаемостью и актуарной долей отсутствия повторной операции 94 и 58 человек. % соответственно на 7 лет.
Мы считаем, что врожденно деформированный МК является активным анатомическим объектом, и тяжесть его функционального поражения не может быть строго связана с его морфологией. По нашему опыту, целью хирургического восстановления было достижение «идеальной» функции МК, а не «идеальной» анатомической хирургической реконструкции. Хорошие функциональные результаты могут быть достигнуты при минимальном хирургическом вмешательстве. Действительно, у некоторых из наших пациентов с тяжелой диспластической МК после операции была остаточная степень стеноза или регургитации.Однако улучшение функции МК может сохранить работоспособность миокарда, облегчить клинические симптомы и отсрочить возможное замещение МК.
Chavaud et al. [6,21] считают кольцевую аннулопластику при несостоятельности МК обязательной у детей старше 2 лет. Это утверждение подтверждается их опытом 25% случаев остаточной значительной митральной регургитации после восстановления без вставки кольца [6]. Другие недавние сообщения [5,9,20] подтверждают наше первоначальное утверждение о том, что протезные кольца, полные или частичные, не являются необходимыми для достижения благоприятных результатов у младенцев [8].В нашей группе пациентов кольцевая аннулопластика применялась только у 16-летнего пациента с массой тела 52 кг, в начале нашего опыта. Наши текущие и предыдущие результаты [8] продемонстрировали высокую эффективность аннулопластики с помощью настенной створки для лечения митральной недостаточности, отдавая предпочтение любой консервативной процедуре, не требующей протезного материала.
Операция по поводу стеноза МК обычно дает худшие результаты по сравнению с регургитацией МК [22]. По нашему опыту, стеноз МК был связан со значительно более высокой частотой повторных операций (3/12 vs.0/22, P — значение ≪0,05). Целью эффективного восстановления является восстановление беспрепятственного пути между притоком и оттоком левого желудочка, максимально ограничивая потенциальный риск создания некомпетентного МК. Хирургическое лечение должно быть индивидуальным для каждого случая, поскольку морфология стенозированного МК «сама по себе» является переменной [1,3]. Тщательной комиссуротомии с щедрым деликатным разделением папиллярных мышц глубоко в стенку миокарда левого желудочка или без него часто бывает достаточно для облегчения стеноза большинства деформированных клапанов.При парашютном МВ единственная сосочковая мышца обычно делилась на две половины, как описано Carpentier [1], увеличивая таким образом ход створок МК во время диастолической фазы. Тот же принцип был применен к гамаку MV и митральной аркаде. Согласно Thiene et al. [23], мы определяем гамаковый клапан как очень диспластический МК, сухожильные связки отсутствуют, а вершина двух сосочковых мышц сливается с тканью створки в ожидаемых областях спаек.Со стороны предсердий он выглядит как гамак, имеющий только одну большую створку с центральным ограничивающим отверстием из-за отсутствия комиссур. Под термином митральная аркада мы подразумеваем состояние, при котором вместо двух четко определенных сосочковых мышц есть одна «мышечная аркада», к которой прикрепляются небольшие сухожильные связки. В соответствии с другими сообщениями [1,22], МВ в гамаке действительно является наиболее трудной аномалией для исправления из-за количества мышц, находящихся под створками, которые препятствуют притоку в левый желудочек; в этом случае было выполнено большое расщепление двух огромных сосочковых мышц, чтобы увеличить движение створок, которое ограничено короткой и маленькой сухожильными хордами.По нашему опыту, двум пациентам из шести с гамаковым клапаном потребовалась возможная замена МК через 4 и 27 месяцев после операции МК (Таблица 3). Точно так же мы обработали митральную аркаду, выполнив обширный продольный разрез мышечной структуры, начиная с каждой стороны хордовых вставок и разделив аркаду на две половины.
Восстановление митрального клапана дает то преимущество, что у детей не требуется пожизненная антикоагулянтная терапия. Кроме того, замена МК у детей, и особенно у младенцев, связана с высокой смертностью и высокой частотой повторных операций [11,12], а поддержание адекватного режима антикоагуляции часто бывает обременительным [24].Хорошо известно, что использование заменителей клапана биопротеза у детей связано с уменьшением долговечности и ранней недостаточностью клапана [25]. Недавно Plunkett et al. [26] сообщили о четырех случаях замены МК у детей митральным гомотрансплантатом. Длительное наблюдение недоступно, чтобы оценить долговечность такого гомотрансплантата в митральном положении по сравнению с другими биологическими заменителями.
Важность интраоперационной эхокардиографии для функциональной оценки хирургического результата вскоре после восстановления МК была признана в других исследованиях [5,6,9,10].Кроме того, мы считаем, что дальнейший функциональный анализ деформированного клапана непосредственно перед восстановлением может предоставить хирургу важную информацию о соответствующих анатомических деталях, что приведет к лучшему пониманию дисфункции клапана и, следовательно, к идеальной хирургической реконструкции.
В заключение, по нашему опыту, восстановление МК превратилось в надежную и предпочтительную альтернативу протезному протезированию МК. Восстановление митрального клапана у детей часто является паллиативной процедурой; однако следует предпринять все усилия, чтобы сохранить естественный клапан, даже если он очень диспластичен, с помощью консервативных методов восстановления.Даже при неоптимальном восстановлении МК обеспечит хорошее качество жизни детям без лечения антикоагулянтами. Возможная замена МК может быть отложена до взрослого возраста.
Доктор М. Соуза Ува ( Лиссабон, Португалия ): Доктор Стеллин, я хочу поздравить вас с этими превосходными результатами, особенно отметить отсутствие летальности и очень низкую частоту повторных операций. Мне интересно, не могли бы вы прокомментировать методы, потому что мы рассмотрели опыт Мари Ланнелонг у детей в возрасте до 1 года, и у нас был более высокий, гораздо более высокий процент повторных операций, поэтому мне интересно, могли бы вы прокомментировать методы, которые вы используется для лечения пациентов с гамаком или аркадным стенозом митрального клапана.Действительно, это особенно сложная группа пациентов. У нас была одна ранняя замена клапана, которую нам пришлось сделать у одного из этих пациентов, и большинство повторных операций было у этих особенно трудных пациентов.
Д-р Стеллин : Мне известно о вашей недавней публикации о 20 случаях в возрасте до 1 года с очень хорошим результатом. В наших руках нет магических приемов. Я думаю, что наши результаты значительно улучшились, так как мы регулярно использовали интраоперационную эхокардиографию.Кроме того, я думаю, что для того, чтобы полностью понять внутреннюю анатомию митрального клапана, вам потребуется очень хорошая экспозиция в операционном поле. У маленьких детей мы должны без колебаний применять глубокую гипотермическую остановку кровообращения, чтобы облегчить обзор аппарата митрального клапана. Важно понимать анатомию и, следовательно, механизм дисфункции, чтобы спланировать правильную хирургическую стратегию.
Во-вторых, при реконструкции деформированного клапана важно соблюдать его основную анатомию.Наша цель не в том, чтобы по окончании реконструкции получить красивый клапан, а все, что мы хотим, — это улучшить его функциональное состояние. Очевидно, что это паллативная процедура для большинства диспластических клапанов.
Д-р А. Урбан ( Санкт-Августин, Германия, ): Вы включали митральные клапаны, где клапанное кольцо было гипопластичным, или клапаны нормального размера с патологией на уровне створок и подклапанного аппарата?
Доктор Стеллин : Насколько мне известно, ни в одном из наших случаев мы не обнаружили гипопластического кольца.Очевидно, нам пришлось исключить тех пациентов, у которых была гипоплазия левого желудочка. Все случаи с функциональным единичным желудочком не включены в наш опыт.
Д-р Ф. Рамирес ( Гвадалахара, Мексика ): Насколько вы увеличили клапанную область парашюта или аркадных стенозирующих клапанов?
Доктор Стеллин : На этот вопрос сложно ответить. В парашютных митральных клапанах кольцо обычно нормального размера.Очевидно, непроходимость вызвана деформированным подклапанным аппаратом. На этом уровне следует измерить площадь клапана. У наших пациентов он не измерялся. В парашютных клапанах мы пытались добиться, чтобы створки открывались немного больше, поскольку они прикреплены к одной сосочковой мышце. Во всех из них произведено обширное рассечение сосочковой мышцы до стенки желудочка.
Д-р Д. Метрас ( Марсель, Франция ): Одна вещь, которая показалась мне не очень ясной, по крайней мере, мне: как вы сделали разницу между аркадой и гамаком? На днях в аспирантуре об этом много говорили.Я не понял, чем вы их отличаете.
Dr Stellin : Что касается определения клапана-гамака, мы следуем классификации Padova Dr Thiene. В качестве клапана-гамака мы подразумеваем митральный клапан с очень дисплазией с двумя огромными сосочковыми мышцами и очень маленькими кордами, прикрепленными к ним. Если посмотреть на клапан сверху, он выглядит как воронка. Определенных комиссур нет, и клапан может выглядеть как одностворчатый.
Как вы помните, вчера во время аспирантуры я спрашивал доктора Андерсона, что он имеет в виду для митральной аркады, и его ответ был именно тем, что я сказал во время своей презентации. В митральной аркаде вместо двух четко определенных сосочковых мышц есть одна «мышечная аркада», к которой прикрепляются маленькие хорды.
Список литературы
[1]. ,.Врожденные аномалии митрального клапана
,Хирургия врожденных пороков сердца
,1994
Philadelphia, PA
W.Б. Сондерс
(стр.599
—614
) [2],. ,Кардиохирургия
,1993
Нью-Йорк
Черчилль-Ливингстон
(стр.1343
—1360
) [3],.Анатомические типы врожденного митрального стеноза: отчет о 49 аутопсиях с учетом диагноза и хирургических последствий
,Am J Cardiol
,1978
, vol.42
(стр.592
—601
) [4],,,,,.Комплекс развития «парашютный митральный клапан», надклапанное кольцо левого предсердия, субаортальный стеноз и коарктация аорты
,Am J Cardiol
,1963
, vol.11
(стр.714
—725
) [5],,.Десятилетний опыт агрессивного репаративного подхода к врожденным аномалиям митрального клапана
,Eur J Cardio-thorac Surg
,1996
, vol.10
(стр.534
—539
) [6],,,,,.Реконструктивная хирургия при врожденной недостаточности митрального клапана (методы Карпентье): отдаленные результаты
,J Thorac Cardiovasc Surg
,1998
, vol.115
(стр.84
—93
) [7],,,,,,,,,,.Врожденные аномалии митрального клапана у детей. Патологическое и хирургическое лечение
,J Thorac Cardiovasc Surg
,1976
, vol.6
(стр.854
—866
) [8],,,,,,,.Ремонт врожденного порока митрального клапана у детей
,J Thorac Cardiovasc Surg
,1988
, vol.95
(стр.480
—485
) [9],,,,,.Хирургическое лечение врожденного порока митрального клапана у младенцев и детей
,Ann Thorac Surg
,1998
, vol.66
(стр.1551
—1559
) [10],,,,,,,,.Ранние и поздние результаты пластики митрального клапана у детей
,J Thorac Cardiovasc Surg
,1994
, vol.107
(стр.1262
—1271
) [11],,,,.Опыт замены аортального и митрального клапанов у детей
,J Thorac Cardiovasc Surg
,1981
, vol.81
(стр.326
—333
) [12],,,.Замена митрального клапана в первый год жизни
,J Thorac Cardiovasc Surg
,1990
, vol.100
(стр.762
—768
) [13],,,,,,,.Новый метод количественной оценки митральной регургитации, основанный на цветном доплеровском изображении конвергенции потока проксимальнее отверстия регургитации
,Circulation
,1991
, vol.84
(стр.1481
—1489
) [14],.Кардиохирургия
,Черчилль-Ливингстон, Нью-Йорк
,1993
стр.31
[15]. ,1992
Филадельфия, Пенсильвания
Hanley & Belfus Inc
(стр.190
—194
) [16],,,,,,.Регулярное использование интраоперационной эпикардиальной эхокардиографии и цветной допплеровской визуализации для определения и оценки восстановления врожденных пороков сердца. Проспективное исследование
,J Thorac Cardiovasc Surg
,1990
, vol.100
(стр.297
—309
) [17],,,,.Восстановление митрального клапана при значительной митральной недостаточности
,Am Heart J
,1978
, vol.96
2
(стр.253
—262
) [18],,,,,,,.Операции на митральном клапане. Серия из 130 последовательных случаев
,J Thorac Cardiovasc Surg
,1983
, vol.86
(стр.553
—561
) [19],,,.Опыт применения метода Карпентье реконструкции митрального клапана у 103 пациентов (1980–1985)
,J Thorac Cardiovasc Surg
,1985
, vol.90
(стр.341
—350
) [20],,,,,,,,,.Операция по поводу врожденного порока митрального клапана на первом году жизни
,J Thorac Cardiovasc Surg
,1995
, vol.109
1
(стр.164
—176
) [21],,,.Хирургическое лечение недостаточности митрального клапана: опыт «The Hopital Broussais»
,Cardiol Young
,1997
, vol.7
(стр.5
—14
) [22],,,.Хирургическое лечение стеноза митрального клапана: опыт «The Hopital Broussais»
,Cardiol Young
,1997
, vol.7
(стр.15
—21
) [23],,.,,,,,.Патология врожденного порока митрального клапана
,Детская кардиология
,1986
Нью-Йорк
Черчилль-Ливингстон
(стр.225
—239
) [24],,,,.Антикоагулянтная терапия у детей с механическим протезом сердечного клапана
,Am J Cardiol
,1985
, vol.56
(стр.533
—555
) [25],,,,,.Изолированное протезирование митрального клапана биопротезом Хэнкока: оценка 13 лет
,Ann Thorac Surg
,1984
, vol.38
(стр.571
—578
) [26],,,,,.Замена митрального клапана гомотрансплантатом у детей
,Ann Thorac Surg;
,1998
, т.66
(стр.649
—652
)© 2000 Издано Elsevier Science B.V.
Elsevier Science B.V.
Врожденные пороки сердца — факты о гипопластическом синдроме левых отделов сердца
Гипопластический (произносится как hi-puh-PLAS-tik) синдром левых отделов сердца или HLHS — это врожденный дефект, который влияет на нормальный кровоток через сердце.
Что такое синдром гипоплазии левых отделов сердца?
Синдром гипоплазии левых отделов сердца (HLHS) — это врожденный дефект, который влияет на нормальный кровоток через сердце. Поскольку ребенок развивается во время беременности, левая часть сердца формируется неправильно. Синдром гипоплазии левых отделов сердца — это один из видов врожденного порока сердца. Врожденный означает наличие при рождении. Поскольку ребенку с этим дефектом требуется хирургическое вмешательство или другие процедуры вскоре после рождения, HLHS считается критическим врожденным пороком сердца (CCHD).
Синдром гипоплазии левых отделов сердца поражает ряд структур в левой части сердца, которые не полностью развиваются, например:
- Левый желудочек недоразвит и слишком мал.
- Митральный клапан не сформирован или очень мал.
- Аортальный клапан не сформирован или очень маленький.
- Восходящая часть аорты недоразвита или слишком мала.
- Часто у детей с синдромом гипоплазии левых отделов сердца также имеется дефект межпредсердной перегородки, который представляет собой отверстие между левой и правой верхними камерами (предсердиями) сердца.
У ребенка без врожденного порока сердца правая сторона сердца перекачивает бедную кислородом кровь из сердца в легкие. Левая часть сердца перекачивает богатую кислородом кровь к остальному телу. Когда ребенок растет в утробе матери во время беременности, между левой и правой сторонами сердца есть два маленьких отверстия: открытый артериальный проток и открытый овальный проток . Обычно эти отверстия закрываются через несколько дней после рождения.
У детей с синдромом гипоплазии левых отделов сердца левая сторона сердца не может перекачивать богатую кислородом кровь в организм должным образом. В течение первых нескольких дней жизни ребенка с синдромом гипоплазии левых отделов сердца богатая кислородом кровь обходит плохо функционирующую левую часть сердца через открытый артериальный проток и открытое овальное отверстие. Затем правая сторона сердца перекачивает кровь как в легкие, так и в остальные части тела. Однако у детей с синдромом гипоплазии левых отделов сердца, когда эти отверстия закрываются, богатой кислородом крови становится трудно добраться до остального тела.
Узнайте больше о том, как работает сердце »
появление
По оценкам Центров по контролю и профилактике заболеваний (CDC), каждый год в Соединенных Штатах рождается около 1025 детей с синдромом гипоплазии левых отделов сердца.1 Другими словами, примерно 1 из каждых 3841 ребенка, рожденных в Соединенных Штатах каждый год, рождается родился с синдромом гипоплазии левых отделов сердца.
Женщины могут принимать меры до и во время беременности, чтобы снизить риск рождения ребенка с врожденными дефектами.Такие меры включают ежедневный прием поливитаминов с фолиевой кислотой (400 мкг), отказ от курения и употребления алкоголя во время беременности.
Узнайте больше о том, как предотвратить врожденные дефекты »
Причины и факторы риска
Причины пороков сердца, таких как синдром гипоплазии левых отделов сердца у большинства младенцев, неизвестны. У некоторых младенцев пороки сердца возникают из-за изменений в их генах или хромосомах. Считается, что эти типы пороков сердца вызваны комбинацией генов и других факторов риска, таких как факторы, с которыми мать контактирует в окружающей среде, или то, что мать ест или пьет, или лекарства, которые она использует.
Подробнее о работе CDC над причинами и факторами риска »
Диагностика
Синдром гипоплазии левых отделов сердца может быть диагностирован во время беременности или вскоре после рождения ребенка.
Во время беременности
Во время беременности проводятся скрининговые тесты (также называемые пренатальными тестами) для выявления врожденных дефектов и других состояний. Синдром гипоплазии левых отделов сердца может быть диагностирован во время беременности с помощью УЗИ (которое создает изображения тела). Некоторые результаты ультразвукового исследования могут заставить врача подозревать, что у ребенка синдром гипоплазии левых отделов сердца.Если это так, врач может запросить эхокардиограмму плода , ультразвуковое исследование сердца ребенка, чтобы подтвердить диагноз. Этот тест может показать проблемы со структурой сердца и то, как сердце работает с этим дефектом.
После рождения ребенка
Младенцы с синдромом гипоплазии левых отделов сердца могут не иметь проблем в течение первых нескольких дней жизни, пока открытый артериальный проток и открытое овальное отверстие (нормальные отверстия в сердце) открыты, но после закрытия этих отверстий быстро появляются признаки, в том числе :
- Проблемы с дыханием,
- Бьющееся сердце,
- Слабый пульс, или
- Пепельный или голубоватый цвет кожи.
Во время медицинского осмотра врач может увидеть эти признаки или услышать шум в сердце (ненормальный свистящий звук, вызванный неправильным кровотоком). Если слышен шум или присутствуют другие признаки, врач может запросить один или несколько тестов для постановки диагноза, наиболее частым из которых является эхокардиограмма. Эхокардиография также помогает врачу следить за состоянием здоровья ребенка с течением времени.
HLHS — это дефект, который также может быть обнаружен при скрининге пульсоксиметрии новорожденных.Пульсоксиметрия — это простой прикроватный тест для определения количества кислорода в крови ребенка. Низкий уровень кислорода в крови может быть признаком ХБС. Скрининг новорожденных с использованием пульсоксиметрии может выявить некоторых младенцев с ХБП, например, HLHS, до того, как у них появятся какие-либо симптомы.
Процедуры
Лечение некоторых проблем со здоровьем, связанных с синдромом гипоплазии левых отделов сердца, может включать:
Лекарства
Некоторым младенцам и детям потребуются лекарства, которые помогут укрепить сердечную мышцу, снизить кровяное давление и помочь организму избавиться от лишней жидкости.
Питание
Некоторые дети с синдромом гипоплазии левых отделов сердца устают во время кормления и не едят достаточно, чтобы набрать вес. Чтобы обеспечить здоровую прибавку в весе младенцев, может быть прописана специальная высококалорийная смесь. Некоторые дети сильно устают во время кормления, и им может потребоваться кормление через зонд для кормления .
Хирургия
Вскоре после рождения ребенка с синдромом гипоплазии левых отделов сердца необходимо провести несколько операций в определенном порядке, чтобы увеличить приток крови к телу и обойти плохо функционирующую левую часть сердца.Правый желудочек становится главной насосной камерой тела. Эти операции не излечивают синдром гипоплазии левых отделов сердца, но помогают восстановить работу сердца. Иногда до или после операции назначают лекарства для лечения симптомов дефекта. Операция по поводу синдрома гипоплазии левых отделов сердца обычно проводится в три отдельных этапа:
- Norwood Процедура
Эта операция обычно проводится в течение первых 2 недель жизни ребенка. Хирурги создают «новую» аорту и соединяют ее с правым желудочком.Они также помещают трубку от аорты или правого желудочка к сосудам, снабжающим легкие (легочные артерии). Таким образом, правый желудочек может перекачивать кровь как к легким, так и к остальному телу. Это может быть очень сложная операция. После этой процедуры кожа младенца все еще может выглядеть синеватой, потому что богатая кислородом и бедная кислородом кровь все еще смешиваются в сердце. - Процедура двунаправленного шунта по Гленну
Обычно это делается, когда младенцу от 4 до 6 месяцев.Эта процедура создает прямую связь между легочной артерией и сосудом (верхней полой веной), возвращающим бедную кислородом кровь из верхней части тела в сердце. Это уменьшает работу, которую должен выполнять правый желудочек, позволяя крови, возвращающейся из тела, течь непосредственно в легкие. - Процедура Фонтана
Эта процедура обычно выполняется в период, когда младенцу от 18 месяцев до 3 лет. Врачи соединяют легочную артерию и сосуд (нижнюю полую вену), возвращая бедную кислородом кровь из нижней части тела в сердце, позволяя остальной крови, возвращающейся из тела, идти в легкие.По завершении этой процедуры кровь, богатая и бедная кислородом, больше не смешивается в сердце, и кожа младенца перестает выглядеть синеватой.
Младенцы, перенесшие эти операции, неизлечимы
У младенцев с синдромом гипоплазии левых отделов сердца могут быть пожизненные осложнения. Им потребуются регулярные контрольные посещения кардиолога (кардиолога), чтобы следить за их прогрессом. Если синдром гипоплазии левых отделов сердца очень сложен или сердце становится слабым после операций, может потребоваться пересадка сердца.Младенцы, которым сделают пересадку сердца, должны будут принимать лекарства всю оставшуюся жизнь, чтобы их организм не отвергал новое сердце.
Список литературы
- Mai CT, Isenburg JL, Canfield MA, et al. для Национальной сети профилактики врожденных дефектов. Национальные популяционные оценки основных врожденных дефектов, 2010-2014 гг. Врожденные дефекты Res 2019; 1–16. Https://doi.org/10.1002/bdr2.1589.
Изображения находятся в общественном достоянии и, следовательно, свободны от каких-либо ограничений авторских прав.В качестве вежливости мы просим поставщика контента (Центры по контролю и профилактике заболеваний, Национальный центр по врожденным порокам и нарушениям развития) указывать и уведомлять о любом публичном или частном использовании этого изображения.
Изображения находятся в общественном достоянии и, следовательно, свободны от каких-либо ограничений авторских прав. В порядке любезности мы просим, чтобы поставщик контента (Центры по контролю и профилактике заболеваний, Национальный центр по врожденным дефектам и порокам развития) был указан и уведомлен о любом публичном или частном использовании этого изображения.
Фибромышечная дисплазия и болезнь сердца | Гора Синай
Фибромускулярная дисплазия (ящур) — это заболевание, поражающее артерии. Многие врачи не очень хорошо с ним знакомы, и часто между первым симптомом или признаком и диагнозом ящура проходит много времени. Он отличается от широко известных заболеваний, таких как атеросклероз (закупорка артерий из-за налета), васкулит (воспаление артерий) или тромбоз (образование тромбов).Врачи и ученые Mount Sinai Heart известны во всем мире в области обнаружения и лечения ящура. Хотя многие считают ящур редким заболеванием, есть убедительные научные доказательства того, что он может поражать до 5 процентов женского населения (подавляющее большинство пациентов — женщины).
«Мы часто называем ящур наиболее распространенным заболеванием, о котором вы никогда не слышали», — говорит Джеффри В. Олин, доктор медицинских наук, директор лаборатории сосудистой медицины и сосудистой диагностической лаборатории Института сердечно-сосудистой системы Зена и Майкла А. Винера и Мари-Жозе. и Генри Р.Кравис Центр сердечно-сосудистой системы больницы горы Синай.
Что такое фибромускулярная дисплазия?
Фибромышечная дисплазия — это заболевание, которое преимущественно встречается у женщин. Согласно Регистру США по ящуру, 95 процентов всех пациентов составляют женщины. При наиболее распространенном типе ящура, известном как мультифокальный ящур, возникают аномальные изменения в стенках кровеносных сосудов, в результате чего артерия выглядит как «нитка бус» с участками сужения, за которыми следуют области увеличения.
При менее распространенном типе ящура, очаговом ящуре, имеется единственная очаговая область сужения в артерии. В то время как средний возраст для постановки диагноза мультифокального ящура составляет 52 года, очаговый ящур часто встречается в возрасте от 25 до 30 лет.
У пациентов с ящуром может быть несколько обнаружений:
- Рассечение кровеносного сосуда. Рассечение — это разрыв и разделение слоев артериальной стенки или образование скопления крови между слоями артериальной стенки, что приводит к сильному сужению сосуда и образованию тромба.Когда это происходит в артериях шеи, это может привести к инсульту. Расслоение артерий шеи называется расслоением шейной артерии (CvAD). Когда это происходит в артериях, ведущих к сердцу, это может вызвать сердечный приступ или даже внезапную сердечную смерть. Расслоение сердечных артерий называется спонтанным расслоением коронарных артерий (SCAD). И CvAD, и SCAD могут быть проявлением ящура.
- Аневризма кровеносного сосуда. При аневризме стенки артерии становятся слабыми и раздуваются, вызывая расширение сосуда.Это может произойти в любой артерии тела и, если его не распознать, может привести к разрыву, который может вызвать инсульт или смерть. Примерно у 26 процентов пациентов с ящуром имеется расслоение по крайней мере в одном месте, а у 22 процентов — аневризма.
- Извилистость артерий встречается примерно у трети всех пациентов с ящуром. Нормальные артерии — это прямые «трубы» кровотока, но при ящуре (и некоторых других состояниях) они становятся очень извилистыми.
Признаки и симптомы
Признаки и симптомы ящура различаются в зависимости от пораженных артерий, что усложняет диагностику.Часто ящур обнаруживается в артериях, ведущих к мозгу или почкам, но он может возникнуть в любой артерии. Некоторые общие симптомы включают:
- Высокое кровяное давление: очень часто встречается при ящуре в артериях, кровоснабжающих почки
- Мигрень
- Свист или свист в ушах, называемый пульсирующим тиннитусом
- Головокружение
- Сердечный приступ или инсульт, если происходит расслоение или разрыв аневризмы
Ящур следует рассматривать в следующих случаях:
Любой пациент с инсультом или сердечным приступом в возрасте до 60 лет, аневризмой, расслоением, извилистостью артерий, пульсирующим шумом в ушах или высоким кровяным давлением, которое невозможно контролировать должным образом.
Кроме того, пациенты с шейными (шея) или абдоминальными ушибами (аномальный свист, обнаруживаемый стетоскопом, указывающий на турбулентность кровотока в артериях) должны быть дополнительно обследованы с помощью визуализации. Однако отсутствие шума не исключает диагноза ящура.
Диагностика и лечение
Если по какой-либо причине вы подозреваете, что у вас ящур, попросите врача проверить, нет ли у вас синяков, при этом прислушиваясь к вашей шее и животу с помощью стетоскопа. Неинвазивные методы визуализации, такие как компьютерная томография (КТ) или магнитно-резонансная томография (МРТ), могут измерить степень сужения артерий и обнаружить аневризмы и расслоения.
Иногда лечение сводится к наблюдению за вами с помощью ежегодного ультразвукового обследования. Могут быть прописаны лекарства для лечения высокого кровяного давления или мигрени. Часто пациентов просят принять аспирин для предотвращения инсульта.
Если имеется серьезная закупорка артерии, разрыв или аневризма, может потребоваться катетерное вмешательство. Некоторые процедуры с использованием катетера могут включать:
- Ангиопластика: минимально инвазивная процедура, при которой для открытия суженных артерий используется баллон
- Стент: крошечная трубка, которая вводится для увеличения кровотока в закупоренной артерии
- Лечение аневризмы может включать сосудистые спирали или покрытые стенты: они вводятся через катетер, чтобы заблокировать кровоток к аневризме.В некоторых случаях для лечения аневризмы требуется хирургическая процедура.
Почему выбирают Mount Sinai
Гора Синай Кардиологи-ученые находятся в авангарде изучения и лечения фиброзно-мышечной дисплазии. Д-р Олин — всемирно признанный специалист в области сосудистой медицины и ящура, он является пионером в национальном реестре пациентов с ящуром. Даниэлла Кадиан-Додов, доктор медицины, опубликовала знаменательную статью, показывающую, что у пациентов с ящуром высока вероятность возникновения аневризмы и / или расслоения.Джейсон Ковачич, доктор медицинских наук, провел несколько важных исследований, которые способствовали нашему пониманию этого заболевания, а также других сердечно-сосудистых заболеваний. Вместе с другими докторами и исследователями Mount Sinai они произвели революцию в понимании и лечении болезни за последнее десятилетие. В дополнение к нашим врачам в нашей программе есть опытные медсестры, которые помогают планировать посещения новых пациентов, обследования, биопсии и т. Д.
- Аннет Кинг
- Кимберли Капустин
Врачи из центра Mount Sinai Heart ежегодно принимают большое количество пациентов с фиброзно-мышечной дисплазией и имеют большой опыт в диагностике и лечении этого заболевания.А поскольку ящур часто появляется в другом месте тела, у вас есть доступ к специалистам в системе здравоохранения Mount Sinai, которые могут согласовать ваш план лечения.
.
 Хотя и малый порок сердца может никак не влиять на жизнедеятельность. Что касается шумов, выслушиваемых в сердце, порок может давать характерную «звуковую» картину в виде шумов, которые слышит врач при аускультации сердца стетофонендоскопом.
Хотя и малый порок сердца может никак не влиять на жизнедеятельность. Что касается шумов, выслушиваемых в сердце, порок может давать характерную «звуковую» картину в виде шумов, которые слышит врач при аускультации сердца стетофонендоскопом.