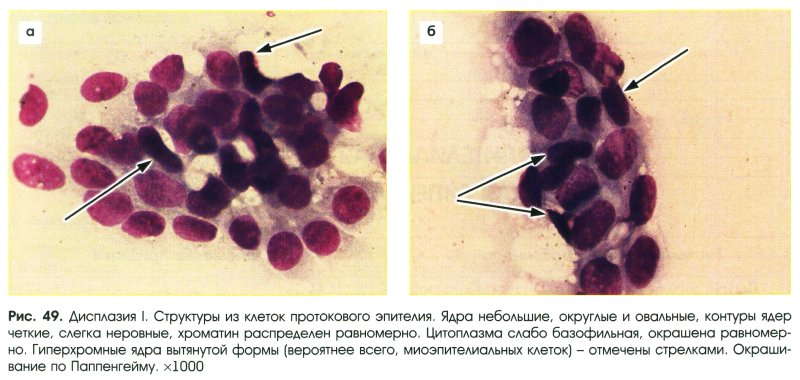
Ведение легкой атипии клеток шейки матки, обнаруженной при цервикальном скрининге
Вопрос
Цервикальный скрининг позволяет снизить риск рака шейки матки за счет цитологического исследования шейки матки (анализ мазка), применяемого для обнаружения и дальнейшего лечения различных предраковых изменений, которые могут повышать риск возникновения инвазивных заболеваний (инвазивный рак шейки матки) в будущем. Как правило, лечения требуют только серьезные предраковые изменения, однако существуют различия в том, какое лечение необходимо женщинами с незначительными цитологическими изменениями (атипические клетки плоского эпителия неопределенного происхождения (ASCUS/пограничные изменения) или поражением эпителия легкой степени (LSIL/дискариоз легкой степени) при невозможности рутинного анализа на ВПЧ (вирус папилломы человека).
Цель обзора
Мы хотели выяснить, какой из методов – немедленная кольпоскопия или «наблюдательное выжидание» с повторным онкоцитологическим анализом –является наилучшим для женщин с легкой атипией клеток шейки матки.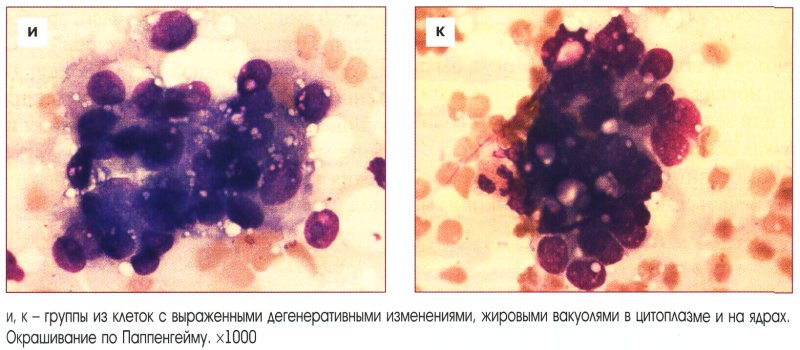
Каковы основные результаты?
Мы включили 5 рандомизированных контролируемых исследований, в которых приняли участие 11 466 пациенток с легкой атипией клеток шейки матки, которым проводили немедленную кольпоскопию или же повторное цитологическое исследование. Во включенных в обзор исследованиях оценивали различия в частоте развития предраковых изменений шейки матки между этими двумя процедурами.
Согласно результатам, можно предположить, что у женщин, направленных на немедленную кольпоскопию после обнаружения легкой атипии клеток шейки матки во время одного цитологического исследования, клинически незначимые результаты будут получены с большей вероятностью, чем при «наблюдательном выжидании».
Было 18 случаев инвазивного рака шейки матки, семь – в группе немедленной кольпоскопии, и 11 – в группах цитологического наблюдения (повторные цитологические исследования). Частота обнаружения клинически незначимых поражений легкой степени была выше в группе немедленной кольпоскопии, равно как и частота обнаружения клинически значимых предраковых поражений высокой степени (CIN2 или CIN2 или хуже) на сроке 18 месяцев, но не 24 месяца.
Риск нарушения приверженности был значительно большим в группе повторной цитологии и повышался по мере наблюдения.
Качество доказательств
Мы оценили качество доказательств как низкое и умеренное.
Каковы выводы?
Анализ на ДНК ВПЧ зарекомендовал себя как эффективный метод скрининга легких атипий клеток шейки матки. Однако, в настоящее время рутинное применение этого теста во всем мире невозможно. В связи с недоступностью анализа на ДНК ВПЧ, немедленная кольпоскопия, вероятно, поможет диагностировать больше предраковых поражений в ранние сроки, чем цитологическое наблюдение, однако по прошествии двух лет различия между этими подходами могут отсутствовать. Женщины могут быть направлены на немедленную кольпоскопию после однократного обнаружения легкой атипии или пограничных результатов цитологического исследования, если ожидается, что приверженность к цитологическому наблюдению будет низкой. Если же ожидается высокая приверженность, могут быть предложены повторные цитологическое исследования, так как они могут снизить риск гипердиагностики и избыточности вмешательств.
Атипичные клетки это рак или нет? Что делать если у вас их обнаружили | записки врача-эндоскописта
Атипичные клетки — это такие клетки, которые под воздействием различных неблагоприятных факторов из обычной нормальной клетки человеческого организма изменились, приобрели нехарактерную, неправильную структуру, изменили свой размер и форму. Организм, в свою очередь, теряет контроль над такими клетками, поэтому существует риск перерождения атипических клеток, что может привести к образованию рака.
Что может повлиять на образование атипичных клеток:
1. Канцерогены.
2. Длительное воздействие ультрафиолетовых лучей.
3. Слабая радиация.
4. Электромагнитное излучение.
5. Агрессивные химические вещества.
6. Сбой в организме.
7. Воспаление и инфекция
8. Естественное старение.
Это некоторые факторы, которые могут привести к образованию атипичных клеток. К сожалению, точной причины их возникновения сказать никто не может. Даже какой-то незначительный сбой в организме может привести к возникновению не одной и даже не двух таких клеток, а тысяч.
Даже какой-то незначительный сбой в организме может привести к возникновению не одной и даже не двух таких клеток, а тысяч.
К Как происходит перерождение атипичных клеток в рак
Давно известно, что образование клеток с измененной днк появляются постоянно. Но появление атипичных клеток не всегда приводят к раку. В нашем организме есть защитный механизм, процесс старение и уничтожение клеток, так называемый апоптоз. Такая защита отвечает за то, чтобы аномальные клетки исчезали из организма. Но любая система может дать сбой, и в результате атипичные клетки затаятся в организме. При таком раскладе есть вероятность их перерождения в раковые клетки.
Ч Что же делать, если обнаружили атипичные клетки во время биопсии, рак или нет?
— Во-первых, не паниковать, вы уже знаете, что аномальные клетки не всегда являются раковыми.
— Во-вторых, ваш организм сам может справиться с этой проблемой, особенно если причина их возникновения ликвидирована. Некоторым людям может быть назначено особенное лечение.
— В-третьих, нужно немедленно проверить ваши атипичные клетки, рак это или нет. Более подробно изучить очаг скопления на присутствие структуры рака и убедиться, что он не начинает развиваться.
— В-четвертых, после того, как все сделанные тесты подтвердили, что атипичные клетки не являются злокачественными, необходимо пристальное наблюдение врача за ними. Чтобы не пропустить изменений в них в худшую сторону. Различные дополнительные тесты и обследования только пойдут на пользу.
В такой ситуации лучше перестраховаться, чем что-то пропустить. Ведь ранняя диагностика рака может спасти вам жизнь.
Иногда врач назначает какое-то конкретное лечение, чтобы постараться остановить образование атипичных клеток. Либо может понадобиться еще один образец ткани – дополнительная биопсия, чтобы быть уверенным в отсутствии рака или какого-то другого заболевания.
Читайте записки врача-эндоскописта
Подписывайтесь на канал, ставьте лайки, и делитесь полезной информацией с друзьями!
Моя почта: dr-endoskopy@yandex. ru
ru
ВНИМАНИЕ! Имеются противопоказания, проконсультируйтесь со специалистом.
Цитологический метод в диагностике опухолей и опухолеподобных процессов
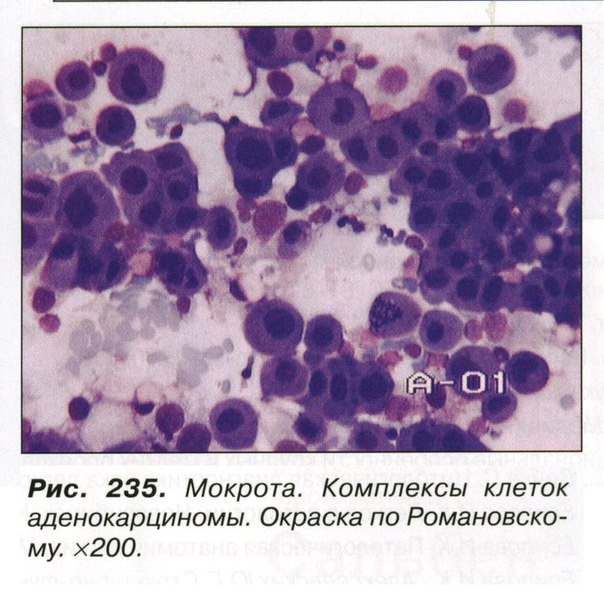
Цитологический метод технически прост, быстр, сравнительно дешев, малотравматичен. Однако «легкость» цитологического метода обманчива, так как цитологическое исследование должно заканчиваться формулировкой заключения, основываясь на котором разрабатывается тактика лечения.
По способу получения материала цитологию можно подразделить на дооперационную (эксфолиативную, абразивную, аспирационную) и интраоперационную. Эксфолиативная цитология включает в себя исследование вагинальных мазков, мокроты, мочи, плевральной, перитонеальной, перикардиальной, цереброспинальной, синовиальной жидкости и т.д. Этот раздел цитологии отличается простотой техники получения большого количества различного типа клеток, в том числе воспалительного ряда. Клеточный материал может быть не очень хорошо сохранен. Для получения информативного материала с поверхности патологического очага удаляют гноевидные массы, корочки, некротический налет. Если полученный материал представляет жидкость, то в нее добавляется цитрат натрия, чтобы жидкость не свернулась.
Абразивная цитология получает материал из определенного участка внутренних органов, в том числе исследуются субэпителиальные поражения с помощью фиброоптических инструментов. При таком взятии материала клетки хорошо сохраняются, и препараты легко интерпретировать. Материал получают из шейки матки, вагины, эндометрия, респираторного, желудочно-кишечного, мочеполового тракта.
Тонкоигольная биопсия в настоящее время позволяет получить материал практически из любого органа. Метод постоянно совершенствуется и дает оптимальные результаты, что делает его в плане диагностики высокоэффективным и экономичным.
Взятый для цитологического исследования материал помещают на край предметного стекла и другим предметным или покровным стеклом равномерно, сильно не надавливая, тонким слоем распределяют по всей поверхности препарата.
В последние годы помимо рутинных цитологических мазков для получения качественных монослойных цитологических препаратов используется жидкостная система: пунктаты вносятся в специальную среду накопления, после чего центрифугируются в режиме 1000 оборотов в течение 5 минут при среднем ускорении на центрифуге (Суtospin-3, Суtospin-4).
ния. Для создания архива и возможности последующего исследования материала используется методика Cell-block, при которой получаются препараты, занимающие промежуточное положение между цитологическими и гистологическими.
Влажная фиксация препарата в спирте сразу после взятия мазков применяется при окраске по Папаниколау. В остальных случаях мазки высушивают на воздухе, а затем фиксируют уже в лаборатории. Наиболее распространенный способ фиксации – в равных объемах спирта и эфира (смесь Никифорова). Для иммуноцитохимического исследования применяют фиксацию ацетоном. При окраске мазков используют панхромную окраску азур-эозином по методу Романовского – Гимза в различных модификациях (Лейшмана, Паппенгейма), а также окраска гематоксилином и эозином, особенно при исследовании гинекологического материала используется окраска по Папаниколау.
Цитологическая диагностика основана на следующих принципах:
- Разница клеточного состава в норме и патологии.
- Оценка не одной отдельно взятой клетки, а совокупности клеток, большое значение придается фону препарата.
- Цитолог должен иметь патологоанатомический базис.
- Каждое исследование завершается формулировкой заключения.
Критерии цитологической диагностики злокачественных новообразований составляются из оценки клетки, ядра и ядрышка.
Клетка:
– увеличена в размере, иногда гигантская, редко размер близок к норме, что затрудняет цитологическую диагностику, например, при коллоидном, тубулярном раке, маститоподобном варианте долькового рака молочной железы, фолликулярном раке щитовидной железы, карциноиде, почечноклеточном светлоклеточном раке, высокодифференцированных веретеноклеточных саркомах;
– изменение формы и полиморфизм клеточных элементов;
– нарушение соотношения ядра и цитоплазмы в сторону увеличения доли ядра;
– диссоциация степени зрелости ядра и цитоплазмы, например, молодое ядро в ороговевшей цитоплазме при высокодифференцированном плоскоклеточном раке.
Ядро:
– увеличение размера, полиморфизм, бугристость, неравномерный рисунок хроматина, наиболее постоянный признак – неровность контуров, гиперхромия, фигуры клеточного деления в цитологических препаратах сравнительно редки.
Ядрышко:
– число ядрышек больше, чем в нормальной клетке, ядрышки увеличены в размере, неправильной формы.
Несмотря на присутствие критериев злокачественности у подавляющего большинства клеток, в некоторых клетках рака эти критерии могут отсутствовать или быть выражены в неполном объеме. Необходимо обращать внимание на особенности взаимного расположения клеток, характер межклеточных связей. Заключение формулируют по совокупности признаков при достаточном количестве клеточного материала. Попытка оценить мазок по неадекватно взятому материалу – наиболее частая причина ошибочных заключений.
Основные задачи цитологической диагностики состоят в следующем:
- Формулировка заключения до лечения.

- Интраоперационная срочная диагностика.
- Контроль эффективности лечения.
- Оценка важнейших факторов прогноза течения заболевания.
Цитологическое заключение до лечения включает:
- определение гистогенеза новообразований;
- установление степени дифференцировки опухолевого процесса;
- уточнение степени распространенности опухоли;
- изучение фоновых изменений;
- определение некоторых факторов прогноза;
- возможность исследования бактериальной флоры.
Современное цитологическое заключение не только констатирует наличие рака, но и указывает гистологический тип опухоли и степень дифференцировки согласно общепринятым международным классификациям (МКБ-О и ВОЗ).
Критериями достоверности цитологического метода являются результаты сопоставления с плановым гистологическим исследованием. Наибольший процент совпадений цитологического заключения с окончательным гистологическим заключением наблюдается при исследовании образований кожи, молочной, щитовидной железы, при метастатическом поражении лимфатических узлов. Результаты исследования гиперпластических процессов в эндометрии неудовлетворительны (достоверность 30–50%) и заставляют искать пути совершенствования диагностики. Достоверность цитологической диагностики патологии шейки матки составляет 75–90%. 3–24% исследований, в зависимости от локализации и способа получения материала, оказываются неудачными из-за неадекватно полученного, неинформативного материала.
Результаты исследования гиперпластических процессов в эндометрии неудовлетворительны (достоверность 30–50%) и заставляют искать пути совершенствования диагностики. Достоверность цитологической диагностики патологии шейки матки составляет 75–90%. 3–24% исследований, в зависимости от локализации и способа получения материала, оказываются неудачными из-за неадекватно полученного, неинформативного материала.
Таблица 1. Достоверность цитологических исследований
опухолей различных локализаций.
| Локализация | % совпадения цитологического и гистологического диагноза | % совпадения по данным литературы | % неудавшихся пункций |
|---|---|---|---|
| Легкое | 95,5-97 | 79-98 | 2,9-3,0 |
| Молочная железа | 95,8-97,4 | 90-96 | 2,6-8,3 |
| Лимфатические узлы | 98,4-98,7 | 90 | 1,6-10,7 |
| Кожа | 91,2-92,7 | 90-98 | 2,4-12,5 |
| Мягкие ткани (без указания гистологического типа опухоли) |
90,2-93,8 | 65-93,4 | 5-12,3 |
| Желудочно-кишечный тракт | 92,3-97,5 | 73-93,6 | 2,5-4,4 |
| Щитовидная железа | 85,5-93,2 | 57-94 | 1,6-4,2 |
| Шейка матки | 89,5-93,2 | 65-90 | 3,5-4,5 |
| Эндометрий | 78,9-84,8 | 30-90 | 3,8-15,4 |
| Почка | 86,2-89,3 | 76,4-91,3 | 7,1-11,5 |
| Экссудаты | 95,7-100 | – | 1,2-2,7 |
Уверенное цитологическое заключение о наличии злокачественного новообразования, совпадающее с клиническими симптомами и данными других диагностических исследований, расценивается как морфологическое подтверждение диагноза злокачественной опухоли. Это предъявляет к цитологическому методу высокие требования и заставляет искать пути предупреждения возможных ошибок. По характеру ошибки цитологов можно разделить на две большие группы: ложноотрицательные и ложноположительные. Ложноотрицательные заключения преобладают и приводят к гиподиагностике опухолевого процесса, чаще всего из-за небольшого количества информативного материала в пунктате. Имеются и объективные трудности в оценке изменений, связанные чаще с высокой дифференцировкой опухоли, например, практически невозможно диагностировать фолликулярный рак щитовидной железы с минимальной инвазией, трудно диагностируется тубулярный, маститоподобная форма долькового рака молочной железы.
Это предъявляет к цитологическому методу высокие требования и заставляет искать пути предупреждения возможных ошибок. По характеру ошибки цитологов можно разделить на две большие группы: ложноотрицательные и ложноположительные. Ложноотрицательные заключения преобладают и приводят к гиподиагностике опухолевого процесса, чаще всего из-за небольшого количества информативного материала в пунктате. Имеются и объективные трудности в оценке изменений, связанные чаще с высокой дифференцировкой опухоли, например, практически невозможно диагностировать фолликулярный рак щитовидной железы с минимальной инвазией, трудно диагностируется тубулярный, маститоподобная форма долькового рака молочной железы.
Гипердиагностика опухолей на нашем материале многие годы не превышает 1%, однако может служить причиной ненужного, а иногда и калечащего лечения. Истинная гипердиагностика, то есть ложное цитологическое заключение о наличии опухоли, объясняется несколькими наиболее типичными причинами.
Выраженная пролиферация клеточных элементов является наиболее частой причиной гипердиагностики рака. Например, пролиферация эпителия протоков и долек молочной железы при фиброаденоме и пролиферирующем аденозе, особенно при укрупнении ядер, наиболее часто приводит к гипердиагностике рака молочной железы. Правильной диагностике помогает анализ ядерных характеристик клеток опухоли: наличие ровных контуров ядра и равномерное распределение хроматина.
Реактивные изменения эпителия служат также нередкой причиной неадекватной цитологической диагностики. Наиболее тяжелые ошибки встречаются при ангиомиолипоме почки, при которой реактивные изменения почечного эпителия с укрупнением и полиморфизмом ядер приводят к ошибочному диагнозу высокодифференцированного почечноклеточного светлоклеточного рака. Диагностике ангиомиолипомы помогает обнаружение сосудистых структур и веретенообразных клеток, экспрессирующих виментин, десмин, НМВ-45.
Хронический аутоиммунный тиреоидит типа Хашимото сопровождается образованием сосочковоподобных структур, к оценке которых необходимо подходить осторожно и помнить, что при этом процессе реактивные изменения эпителия можно ошибочно принять за папиллярный рак щитовидной железы. Для хронических дерматитов, язв характерны атипические реактивные разрастания многослойного плоского эпителия, нередко представляющие непреодолимые трудности в дифференциальной диагностике с высокодифференцированным плоскоклеточным раком.
Выраженные дистрофические изменения клеток являются также одной из причин ошибочной цитологической диагностики. Например, выраженная жировая дистрофия гепатоцитов может привести к гипердиагностике метастаза почечноклеточного светлоклеточного рака, особенно при уже состоявшемся диагнозе рака почки.
Для хронических дерматитов, язв характерны атипические реактивные разрастания многослойного плоского эпителия, нередко представляющие непреодолимые трудности в дифференциальной диагностике с высокодифференцированным плоскоклеточным раком.
Выраженные дистрофические изменения клеток являются также одной из причин ошибочной цитологической диагностики. Например, выраженная жировая дистрофия гепатоцитов может привести к гипердиагностике метастаза почечноклеточного светлоклеточного рака, особенно при уже состоявшемся диагнозе рака почки.
Большую проблему цитологии представляет дифференциальная диагностика различных степеней диспластических изменений эпителия и внутриэпителиального рака. Присутствие при тяжелой дисплазии полиморфных крупных клеток с большими неправильно округлыми ядрами, иногда с увеличенными ядрышками, двуядерных клеток с тяжистым рисунком хроматина может быть неверно расценено как рак. При диспластических изменениях плоского эпителия необходимо учесть, что большинство клеток сходны с клетками глубоких слоев, крупные атипические клетки находятся в тесной связи с клетками без признаков атипии, имеются клетки стромы.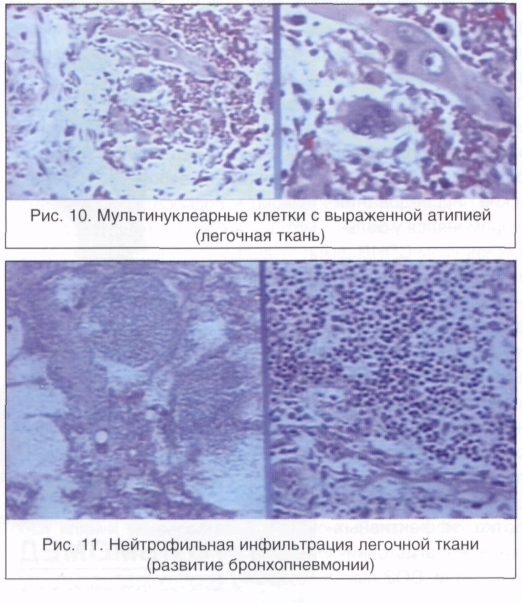 Для объективизации дифференциальной диагностики различных степеней дисплазии и внутриэпителиального рака желательно проведение морфометрии клеток и ядер, что позволяет значительно снизить процент ошибочных заключений.
Для объективизации дифференциальной диагностики различных степеней дисплазии и внутриэпителиального рака желательно проведение морфометрии клеток и ядер, что позволяет значительно снизить процент ошибочных заключений.
Нередко причиной гипердиагностики метастатического поражения в лимфатических узлах являются комплексы клеток укрупненного эндотелия и гистиоцитов, образующих эпителиоподобные структуры, а также наличие макрофагов с содержанием бурого пигмента. При затруднениях диагностики помогает иммуноцитохимическое исследование с небольшим набором антител (VIII фактор, цитокератины, ЭМА, НМВ-45), позволяющее подтвердить или отвергнуть наличие метастазов рака или меланомы.
Во избежание ошибок морфологической диагностики большое значение имеет четкое указание на характер проведенного лечения. Например, прием довольно распространенного антибиотика тетрациклина приводит к накоплению в клетках щитовидной железы бурого пигмента и ошибочному диагнозу метастаза меланомы. Прием мерказолила при зобе сопровождается резким полиморфизмом фолликулярного эпителия, что служит причиной цитологической и даже гистологической гипердиагностики фолликулярного рака. Проведение лучевой терапии вызывает выраженные изменения не только опухолевых клеток, но и нормального эпителия: укрупнение, полиморфизм клеток, патологическое ороговение, что является причиной гипердиагностики рака.
Прием мерказолила при зобе сопровождается резким полиморфизмом фолликулярного эпителия, что служит причиной цитологической и даже гистологической гипердиагностики фолликулярного рака. Проведение лучевой терапии вызывает выраженные изменения не только опухолевых клеток, но и нормального эпителия: укрупнение, полиморфизм клеток, патологическое ороговение, что является причиной гипердиагностики рака.
Имеются и объективные диагностические проблемы, например, в дифференциальной диагностике между эндометриоидной высокодифференцированной аденокарциномой и атипической гиперплазией эндометрия, себоррейной (базальноклеточной) кератомой и базально-клеточным раком, инфекционным мононуклеозом и болезнью Ходжкина, где достаточно высокий процент ошибочных заключений и требуется дальнейшая разработка цитологических критериев диагностики.
Знание клинической картины, характера проведенного лечения, применение современных методик морфологической диагностики с использованием иммуноцитохимии и морфометрии способствует сведению случаев гипердиагностики к нулю.
Вместе с истинной цитологической гипердиагностикой существует ложная гипердиагностика, когда цитолог дает уверенное заключение о злокачественном процессе, а при гистологическом исследовании опухоли не обнаруживается, то есть фактически имеет место гистологическая гиподиагностика. Пересмотр цитологических препаратов несколькими высококвалифицированными специалистами, повторное взятие биопсии, клиническое течение заболевания в дальнейшем подтверждают результаты цитологического исследования. Больше всего ложной цитологической гипердиагностики относится к исследованию биопсийного материала из бронхов и гортани, а также при исследовании лимфатическиих узлов, когда при цитологическом исследовании выявлялись единичные комплексы анаплазированных клеток, несомненно принадлежащих раку. При приготовлении гистологических препаратов эти комплексы теряются в готовых гистологических препаратах. Реальная потеря немногочисленных опухолевых клеток при приготовлении гистологических препаратов не допускает игнорирования клиницистом данных цитологического исследования и приводит к «золотому» стандарту – совместному цитологическому и гистологическому исследованию биоптата.
Интраоперационная цитологическая диагностика – одно из основных направлений цитологического метода исследования. Во время операции, используя цитологический метод, уточняется характер патологического процесса, степень распространенности с выявлением метастазов в лимфатические узлы, печень и другие органы, производится контроль радикальности выполненной операции с исследованием краев резекции. Роль цитологии возрастает при разработке показаний к расширенным лимфоаденэктомиям и при определении так называемых «сторожевых», или «сигнальных», лимфатических узлов, которых может быть шесть, и применение гистологического метода невозможно из-за длительности исследования. По данным ведущих клиник, ошибка срочного гистологического исследования «сторожевых» лимфатических узлов составляет 25%, поэтому они рекомендуют использовать интраоперационное цитологическое исследование отпечатков с поверхности разрезанного лимфатического узла. По нашим данным, достоверность срочного цитологического исследования по выявлению метастатического поражения лимфатических узлов составляет 97-99%.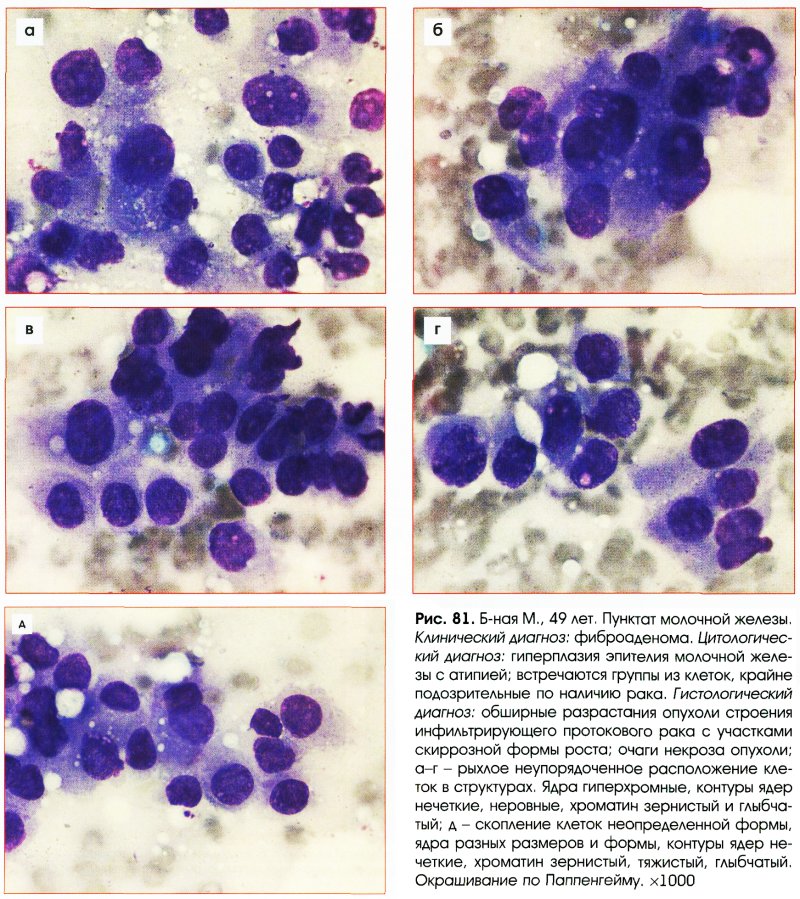
Надо отметить, что к срочному морфологическому исследованию могут быть противопоказания. Срочное интраоперационное морфологическое исследование не рекомендуется выполнять при подозрении на внутриэпителиальный рак с ограниченным очагом поражения из-за того, что не останется материала для планового гистологического исследования. Цитологические критерии внутриэпителиального рака только разрабатываются, и цитолог может дать заключение о раке, не указывая, что это Carcinoma in situ. При внутрипротоковых папилломах небольшого размера срочное гистологическое исследование лучше не выполнять, а цитологическое исследование достоверно поможет установить характер процесса.
При срочной морфологической диагностике существенно помогает макроскопическое исследование операционного материала. Опытный морфолог при визуальном исследовании уже может поставить диагноз, но для подтверждения диагноза необходимо микроскопическое исследование. Например, опухолевый узел классической звездчатой формы может быть при трех совершенно разных процессах: при раке, склерозирующем аденозе с центром Семба и липогранулеме.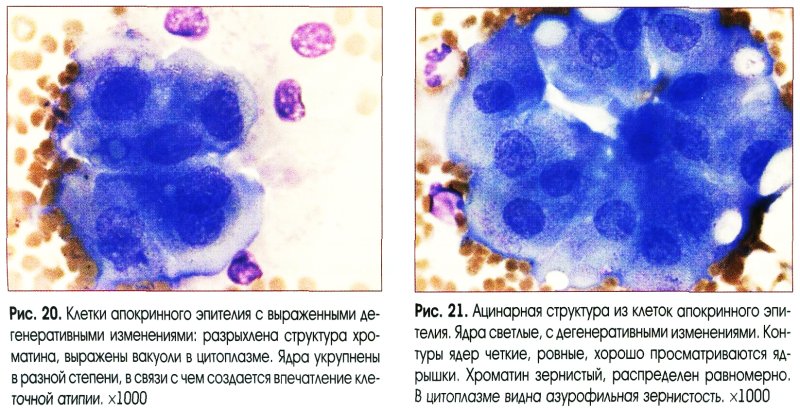 И только микроскопическое исследование позволяет правильно поставить диагноз.
И только микроскопическое исследование позволяет правильно поставить диагноз.
Цитологический метод позволяет в динамике, не травмируя пациента, изучать лечебный патоморфоз при химиолучевой и фотодинамической терапии.
XX столетие названо в медицинских кругах веком цитопатологии. Оценивая возможности цитологического метода, можно сказать, что есть еще возможности его развития в комбинации с другими дисциплинами и методами.
Иммуноцитохимическое исследование нередко является решающим в дифференциальной диагностике новообразований, когда при рутинном исследовании возникают непреодолимые трудности для установления гистогенеза отдельных опухолей, определения источника метастазирования, трактовки первично-множественных поражений.
За последние годы достигнут огромный прогресс в клиническом использовании различных биологических маркеров. В отличие от сывороточных маркеров, клеточные маркеры определяются непосредственно в опухолевых клетках ИЦХ исследованием, в основе которого лежит реакция антиген-антитело. В их числе онкогены, рецепторы эстрогенов и прогестерона, молекулы, опосредующие апоптоз, рецепторы факторов роста и т. д. Все эти показатели позволяют более детально изучить молекулярно-биологические особенности опухолевых клеток, ассоциированные со степенью дифференцировки, способностью к инвазии и метастазированию, чувствительностью к химиотерапии, и, следовательно, с особенностями течения и прогнозом заболевания в каждом конкретном случае.
В их числе онкогены, рецепторы эстрогенов и прогестерона, молекулы, опосредующие апоптоз, рецепторы факторов роста и т. д. Все эти показатели позволяют более детально изучить молекулярно-биологические особенности опухолевых клеток, ассоциированные со степенью дифференцировки, способностью к инвазии и метастазированию, чувствительностью к химиотерапии, и, следовательно, с особенностями течения и прогнозом заболевания в каждом конкретном случае.
Специфических маркеров дифференциальной диагностики злокачественных и доброкачественных опухолевых процессов не существует, но на сегодняшний день активно ведутся научные изыскания в решении этой проблемы. Так, равномерное окрашивание герминативных центров лимфоидных фолликулов с использованием антител bcl-2 указывает на фолликулярную лимфосаркому, в то время как негативная реакция свидетельствует о доброкачественном гиперпластическом процессе; реакция с антителами HBME-1 при ИЦХ исследовании опухолей щитовидной железы часто положительная в злокачественных новообразованиях и практически отсутствует при доброкачественных, в дифференциальной диагностике широко применяют галектин-3, экспрессирующийся карциномами щитовидной железы из А-клеток (папиллярный, фолликулярный) с отсутствием экспрессии в фолликулярных аденомах, зобах и нормальной ткани щитовидной железы.
Для установления гистогенеза и дифференциальной диагностики опухолей разработаны и постоянно совершенствуются, схемы C.R.Taylor и R.J. Cote (1994 г.). Разнообразие моноклональных антител, используемых в иммуноцитохимических исследованиях тонкоигольных пунктатов, в каждом конкретном случае позволяет ответить на вопрос, имеет ли данная опухоль эпителиальное происхождение или является саркомой, меланомой, лимфомой. Иммуноцитохимия широко применяется для иммунофенотипирования злокачественных лимфом, без чего, по современным канонам, невозможно начать лечение.
Иммуноцитохимическое исследование помогает в определении источника метастазирования при невыявленном первичном очаге. К сожалению, органоспецифических маркеров не так уж и много. К их числу могут быть отнесены специфический антиген предстательной железы (ПСA), позволяющий идентифицировать метастазы рака простаты более чем в 95% случаев; тиреоглобулин, экспрессирующийся в 92–98% фолликулярного и папиллярного рака щитовидной железы, и кальцитонин, экпрессирующийся в 80% медуллярных раков щитовидной железы В некоторых случаях рак щитовидной железы может экспрессировать и кальцитонин, и тиреоглобулин, что только с помощью иммуноферментной диагностики позволяет диагностировать диморфные А-С-клеточные раки.
Одним из первых показателей, вошедших в практику лечения больных раком молочной железы (РМЖ), и относящихся к категории клеточных маркеров, были рецепторы стероидных гормонов. Рецепторы стероидных гормонов – это белки, специфически и избирательно связывающие соответствующие стероиды после их проникновения в клетку.
По данным ВОЗ (2003 г.), экспрессия рецепторов эстрогенов (РЭ+) и прогестерона (РП+) в инвазивных протоковых раках составляет 70-80%; инвазивный дольковый рак в 70-95% экспрессирует РЭ, в 60-70% -РП, 100% экспрессия РЭ отмечена в инвазивном криброзном, муцинозных опухолях молочной железы. Эдокринная терапия наиболее эффективна у больных с первичными опухолями с высоким уровнем рецепторов стероидов. При метастатических поражениях степень реакции на эндокринную терапию также зависит от наличия РЭ и РП в опухоли: её эффективность составляет около 10–15% при гормонотрицательных опухолях, 27% при опухоли с РЭ+ и РП-, 46% при статусе РЭ- и РП+ и 75% при опухолях, содержащих РЭ+ и РП+. Рецепторположительные опухоли молочной железы имеют более высокую дифференцировку и более благоприятный прогноз.
Рецепторположительные опухоли молочной железы имеют более высокую дифференцировку и более благоприятный прогноз.
Необходимо отметить, что рецепторы гормонов в доброкачественных образованиях молочной железы еще мало изучены. Отмечено повышение числа РЭ+ клеток в нормальной ткани молочной железы с увеличением возраста, а также при склерозирующем аденозе, папилломах, фиброаденомах и листовидных опухолях. Коэкспрессия РЭ+/Ki-67+ с разной степенью выраженности и соотношения большей частью выявлялась в патологии, связанной с риском развития РМЖ.
Рецепторы эстрогенов экспрессируются в клетках рака эндометрия, яичников, шейки матки, щитовидной железы, кишечника, нейроэндокринных опухолей, в том числе карциноидов.
Иммуноцитохимическое исследование позволяет на дооперационном этапе установить важнейшие факторы прогноза опухолевого процесса и скоррегировать схемы лечения. Пролиферативная активность многих новообразований оценивается с помощью антител Ki-67 в злокачественных лимфомах, опухолях молочной, предстательной, поджелудочной железы, легких, гипофиза, толстой кишки.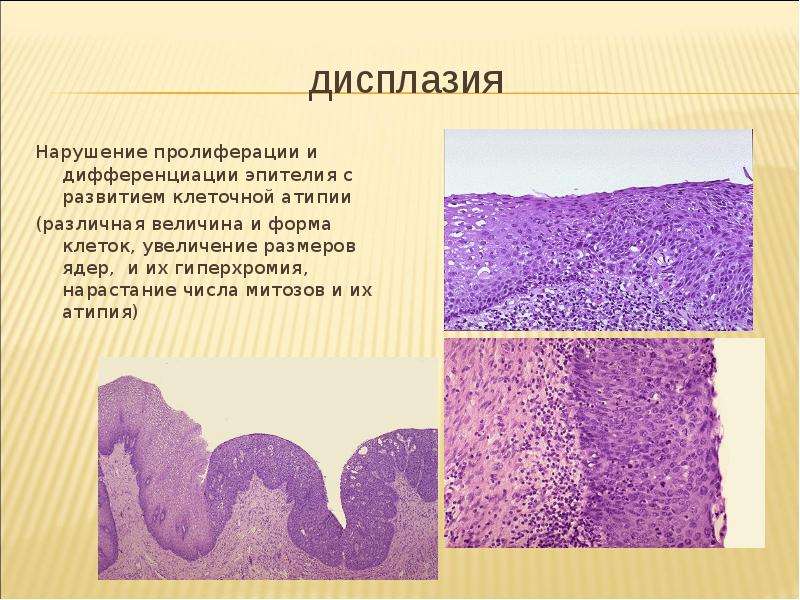 Обнаружена связь между значениями индекса пролиферации и степенью гистологической дифференцировки опухоли и клиническим прогнозом при раке эндометрия, яичников, легкого, молочной железы, мочевого пузыря, лимфомах, опухолях нервной системы.
Обнаружена связь между значениями индекса пролиферации и степенью гистологической дифференцировки опухоли и клиническим прогнозом при раке эндометрия, яичников, легкого, молочной железы, мочевого пузыря, лимфомах, опухолях нервной системы.
Гиперэкспрессия онкопротеина C-erbB-2(HER2/neu), являющегося рецептором эпидермального фактора роста 2-го типа, придающего клеткам свойство неограниченного деления, служит фактором риска рецидива заболевания для ряда опухолей: рака молочной железы, толстой кишки, лёгкого и др. Экспрессия онкобелка C-erbB-2 при ИГХ исследовании обнаруживается в 15–40% РМЖ. Выявление онкопротеина C-erbB-2, по мнению некоторых авторов, ассоциируется с высокой степенью злокачественности опухоли, отсутствием РЭ и РП, высокой митотической активностью, устойчивостью к химиотерапии и требует назначение герцептина.
Наличие метастазов в лимфатических узлах при опухолевом поражении является главным дискриминирующим прогностическим признаком.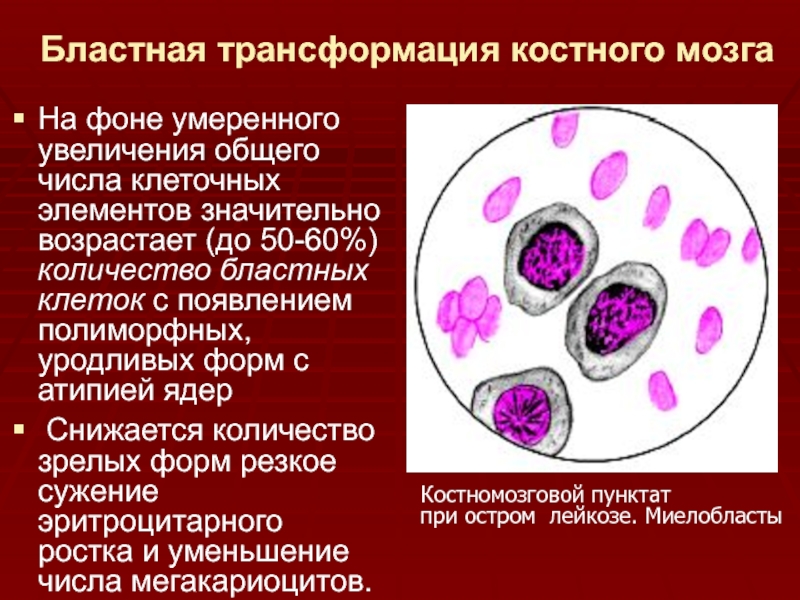 С помощью иммуноцитохимического исследования можно выявить единичные циркулирующие кератин-положительные клетки РМЖ в костном мозге и периферической крови. Применение ИЦХ исследования повышает выявляемость микрометастазов в лимфатических узлах на 3,2–24%.
С помощью иммуноцитохимического исследования можно выявить единичные циркулирующие кератин-положительные клетки РМЖ в костном мозге и периферической крови. Применение ИЦХ исследования повышает выявляемость микрометастазов в лимфатических узлах на 3,2–24%.
Иммуноцитохимические реакции оцениваются как качественно при уточнении гистогенеза опухоли, наличии метастаза в лимфатическом узле или другом органе, иммунофенотипировании лимфом, так и количественно – при оценке пролиферативной активности, экспрессии рецепторов гормонов в опухоли, онкопротеина С-erbB-2 и т.д. Иммуноцитохимическая реакция может быть ядерной, цитоплазменной и мембранной. Ядерная реакция проявляется интенсивным окрашиванием ядра и бывает при определении РЭ и РП, Ki–67, PCNA, p53 и т.д. Цитоплазменная реакция характеризуется диффузным окрашиванием цитоплазмы или отложением гранул в виде грубых пятен и зерен. Цитоплазменное окрашивание дают хромогранин, синаптофизин, белок S-100, виментин, десмин, тиреоглобулин, кальцитонин, цитокератины, bcl-2 и т. д. Оценка этой реакции требует большой осторожности и контроля, так как фоновое окрашивание цитоплазмы клеток может быть принято за истинную реакцию. Мембранное окрашивание наблюдается при проведении реакции с онкопротеином C-erbB-2 и ЭМА (эпителиальным мембранным антигеном). Окрашивание в таких случаях только цитоплазмы не должно учитываться как экспрессия антигена. Маркер крупноклеточной анаплазированной лимфомы CD-30 может экспрессироваться как в цитоплазме, так и на мембране клетки.
д. Оценка этой реакции требует большой осторожности и контроля, так как фоновое окрашивание цитоплазмы клеток может быть принято за истинную реакцию. Мембранное окрашивание наблюдается при проведении реакции с онкопротеином C-erbB-2 и ЭМА (эпителиальным мембранным антигеном). Окрашивание в таких случаях только цитоплазмы не должно учитываться как экспрессия антигена. Маркер крупноклеточной анаплазированной лимфомы CD-30 может экспрессироваться как в цитоплазме, так и на мембране клетки.
Для количественной оценки экспрессии маркера Мс. Carthy и соавторы разработали систему подсчета Histo score (H.S.). Система подсчета включает интенсивность иммуноцитохимической окраски, оцениваемую по 4-балльной шкале, и долю окрашенных клеток и представляет собой сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски на балл, соответствующий интенсивности реакции. Интенсивность окраски в баллах: 0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное, 4 – очень сильное окрашивание. Формула подсчета:
Формула подсчета:
Histochemical score = ∑ P(i)×i (гистосчет),
где i – интенсивность окрашивания, выраженная в баллах от 0 – 4,
Р(i) – процент клеток, окрашенных с разной интенсивностью.
Максимальное количество Histo score соответственно должно быть 400. Подсчет проводится в трех когортах по 100 опухолевых клеток в различных полях зрения (объектив х 40).
В практической работе допустимо использование полуколичественной оценки. Реакция считается отрицательной при полном отсутствии или экспрессии антигена менее 5%–10% опухолевых клеток, слабоположительной – от 5%–10% до 24% клеток, умеренно положительной – в 25%–75%, выраженной – более чем в 75% клеток. При оценке иммуноферментной реакции принимают во внимание интенсивность и полноту окрашивания цитолеммы клеток в центре опухолевого очага. Так, яркая, мембранная, беспрерывная по контуру клетки реакция обозначает выраженную экспрессию белка С-erbB-2 (+++), что в 95% случаев подтверждается амплификацией гена С-erbB-2, выявляемой с помощью FISH (флуоресцентной гибридизацией in situ).
Сопоставляя данные иммуноцитохимических исследований различных опухолей с целью уточнения гистогенетической принадлежности и результатов послеоперационных морфологических заключений, получены следующие результаты: 89% совпадений при анализе опухолей щитовидной железы, 83% при уточнении гистогенеза первичной опухоли и метастазах в лимфатических узлах, 89% – при опухолях мягких тканей и кожи и 100% – при исследовании биологических жидкостей. При определении гормонального статуса РМЖ процент совпадения ИЦХ и ИГХ исследований составляет 88,3%, при исследовании пролиферативной активности – 83%, при определении онкопротеина C-erbB-2 – 93,2%.
При сравнении возможностей ИЦХ исследования при выполнении пункционной биопсии и ИГХ исследования при трепанобиопсии преимущества ИЦХ, на наш взгляд, несомненны. Пункционная биопсия – более простая процедура, не сопровождается такими осложнениями, как воспаление, кровотечение, и позволяет получить полноценный клеточный материал. При неудачной пункции и попадании в некроз, строму опухоли, окружающие ткани можно практически безболезненно повторить процедуру. Кроме того, отсутствует потеря и маскировка антигенов при проводке и депарафинизации материала с использованием агрессивных химических реагентов.
При неудачной пункции и попадании в некроз, строму опухоли, окружающие ткани можно практически безболезненно повторить процедуру. Кроме того, отсутствует потеря и маскировка антигенов при проводке и депарафинизации материала с использованием агрессивных химических реагентов.
Использование иммуноцитохимического исследования позволяет расширить возможности морфологических методов и на дооперационном этапе уточнить гистогенез, диагностировать первично-множественные поражения, степень распространения и оценить некоторые показатели прогноза и чувствительность опухоли к химиогормонотерапии.
На современном этапе развития в цитологии используются методы молекулярной и генной диагностики: гибридизация in situ, Southern Blotting, Nothern Blooting, Western Blotting, DNK Microarray и т.д) В научной и практической работе цитологи применяют проточную цитофотометрию.
Одним из путей совершенствования цитологического метода исследования является применение морфометрии, что позволяет получать объективные количественные параметры. Например, при обработке на компьютере выделены наиболее информативные морфометрические признаки, относящиеся к параметрам ядра с использованием основных диагностических морфометрических признаков: площадь, периметр, оптической плотности, коэффициент поляризации ядер, числа ядрышек, их площади и периметра. Разработаны объективные морфометрические признаки различных степеней дисплазии при дисгормонально-гиперпластических процессах молочной железы, шейки матки, что уменьшило долю субъективизма в определении различных степеней дисплазии.
Например, при обработке на компьютере выделены наиболее информативные морфометрические признаки, относящиеся к параметрам ядра с использованием основных диагностических морфометрических признаков: площадь, периметр, оптической плотности, коэффициент поляризации ядер, числа ядрышек, их площади и периметра. Разработаны объективные морфометрические признаки различных степеней дисплазии при дисгормонально-гиперпластических процессах молочной железы, шейки матки, что уменьшило долю субъективизма в определении различных степеней дисплазии.
Развиваются новые методы микроскопии: фазово-контрастная, флюоресцентная, конфокальная и т.д. Создание компьютерных систем обучения, развитие метода телеконсультации также предъявляют новые требования и, несомненно, будут способствовать развитию и совершенствованию цитологического метода диагностики.
Волченко Надежда Николаевна
д.м.н., профессор, руководитель отделения
онкоцитологии МНИОИ им.П.А.Герцена
Атипия — Atypia — qaz.
 wiki
wikiАтипии (от греческого , через + опечаток , без типа; условие является нерегулярным или нестандартным) представляет собой гистопатологическая термин для структурных аномалий в клетке, т.е. он используется для описания атипичный клеток.
Атипия может быть вызвана инфекцией или раздражением, если, например, диагностирована по мазку Папаниколау . В матке это более вероятно предраковое состояние.
Родственная концепция дисплазии относится к аномалиям развития и включает аномалии в более крупных гистопатологических масштабах.
Примеры функций
Признаки, составляющие атипию, имеют разные определения для разных заболеваний, но часто включают следующие аномалии ядра :
Примеры для пищевода Барретта
В пищеводе Барретта признаки, которые классифицируются как атипия, но не как дисплазия , в основном:
- Ядерная стратификация , при которой ядра клеток , которые обычно расположены почти на одном уровне между соседними клетками, вместо этого расположены на разных уровнях.

- Теснота
- Гиперхроматизм
- Выступающие ядрышки
Прогноз
Это может быть или не быть предраковым признаком, связанным с более поздним злокачественным новообразованием , но уровень соответствующего беспокойства сильно зависит от контекста, в котором оно диагностировано.
Например, уже дифференцированные специализированные клетки, такие как эпителий, демонстрирующий «клеточную атипию», с гораздо меньшей вероятностью станут проблемными [раковыми / злокачественными], чем миелоидные клетки-предшественники иммунной системы. Чем дальше назад в уже специализированном, дифференцированном клоне клеток, тем более проблематичной может быть клеточная атипия. Это происходит из-за передачи такой атипии клеткам-потомкам, находящимся ниже по клону этого типа клеток.
Смотрите также
| Поищите атипию в Викисловаре, бесплатном словаре. |
Ссылки
<img src=»https://en. wikipedia.org//en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
wikipedia.org//en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>Цитологическое исследование соскобов шейки матки и цервикального канала с описанием по терминологической системе Бетесда (The Bethesda System – TBS)
Метод определения Цитологическое исследование осуществляется согласно «Номенклатуре клинических лабораторных исследований, применяемых в целях диагностики и слежения за состоянием пациентов в учреждениях Российской Федерации», утвержденной приказом Минздрава России от 21.02.2000 г. №64 и «Примерному перечню лабораторных исследований для клинико-диагностической лаборатории лечебно-профилактических учреждений» от 25.12.1997 г. №380.
Исследуемый материал Смотрите в описании
Доступен выезд на дом
Международный метод своевременного распознавания вероятной онкологической патологии матки.
Онкологические заболевания шейки матки являются серьезной проблемой здравоохранения, широко распространены, имеют надежно распознаваемую преклиническую фазу и длительный период развития. Для достоверной верификации диагноза и выбора методов эффективного лечения применяется надежный скрининг-тест – цитологическое исследование мазков, взятых из шейки матки и цервикального канала.
Цитологический метод исследования является весьма чувствительным в диагностике предрака (дисплазий) и начального преклинического рака шейки матки (карциномы in situ, микроинвазивного и скрытого инвазивного рака). Цитологический скрининг позволяет выявить пациенток в преклинической фазе заболевания, использовать щадящие методы лечения, сокращать его сроки, снижать частоту инвалидизации и смертности. Скрининговое цитологическое исследование шейки матки рекомендуется проводить ежегодно всем женщинам от 21 года (или через год от начала половой жизни), независимо от клинических показаний. При наличии клинических изменений частота цитологического исследования определяется врачом-гинекологом.
Для возникновения и развития многих патологических процессов существенное значение имеет особенность анатомического строения шейки матки и, в частности, состояние и взаимоотношение эпителиальных слоев влагалищной части шейки цервикального канала. Как правило, предраковые изменения, а затем и малигнизация, возникают в месте перехода многослойного плоского эпителия влагалищной порции шейки матки в цилиндрический эпителий цервикального канала (зоне трансформации), расположенного (в фертильном возрасте) в области наружного зева. Под влиянием гормональных факторов, травм, воспалительных процессов, диатермокоагуляции зона трансформации (зона стыка) может значительно варьировать. В период увядания овариально-менструальной функции в связи с процессами атрофии уровень стыка поднимается высоко в цервикальный канал.
В 95-97% случаев злокачественная трансформация происходит в клетках плоского эпителия, в остальных – в клетках цилиндрического эпителия цервикального канала.
Основоположником диагностической цитопатологии является Г. Папаниколау (G.N. Papanicolaou), который в 1928 г. описал раковые клетки в мазках из влагалища. Им была разработана широко используемая классификация изменения клеток влагалища и цервикального канала шейки матки. Но в этой классификации не учитываются цитологические изменения, обусловленные вирусом папилломы человека (ВПЧ). Поэтому в настоящее время Всемирная организация здравоохранения рекомендует систему, разработанную в клинике Бетесда (США).
Терминологическая система Бетесда (ТБС, 2001 г.)
разработана для унификации описаний результатов цитологического исследования эпителия шейки матки (с целью представления их в удобной клиницистам форме), с выделением в отдельные группы находок разной клинической значимости и оценкой адекватности исследуемого материала.
Система Бетесда включает 3 категории мазков: норма, мазки неопределенного значения (ASCUS) и внутриэпителиальные (предраковые) поражения низкой (LSIL) и высокой (HSIL) степеней.
Согласно ТБС, начальным компонентом интерпретации цервикальных мазков является оценка адекватности образца, так как его качество влияет на чувствительность цитологического метода. ТБС 2001 г. предполагает две категории образцов: «удовлетворительный» и «неудовлетворительный».
Терминология системы Бетесда (пересмотр 2004 г.).
NILM – интраэпителиальные изменения и злокачественные процессы отсутствуют. В эту группу включены цитологические заключения о нормальном состоянии эпителия, а также о наличии различных не неопластических состояний (заболеваний). Уточняют их характер и, по возможности, причину:
- атрофические изменения;
- наличие клеток железистого эпителия после гистерэктомии;
- реактивные изменения, ассоциированные с воспалением, включая типичную регенерацию, лучевую терапию, применение внутриматочных контрацептивов;
- кроме того, указывают наличие микроорганизмов:
- Trichomonas vaginalis;
- грибов, по морфологическому строению соответствующих Candida spp.
 ;
; - бактерий, по морфологическому строению соответствующих Actinomyces spp.;
- коккобациллярную микрофлору, характерную для бактериального вагиноза;
- клеточные изменения, соответствующие поражению Herpes simplex virus.
У женщин 40 лет и старше при отсутствии плоскоклеточных интраэпителиальных изменений указывается также наличие эндометриальных клеток.
ASCUS – клетки плоского эпителия с атипией неясного значения.
ASC-Н – клетки плоского эпителия с атипией неясного значения, не исключающие наличия высокой степени интраэпителиальных изменений.
LSIL – интраэпителиальные изменения плоского эпителия низкой степени, включают поражения, ассоциированные с HPV и CIN I.
НSIL – интраэпителиальные изменения плоского эпителия высокой степени, включают CIN II, CIN III, карциному in situ и случаи, подозрительные на наличие инвазии.
Плоскоклеточная карцинома.
AGC – клетки цервикального (железистого) эпителия с атипией неясного значения.
AGC, favor neoplastic – клетки цервикального (железистого) эпителия, возможно неоплазия.
Эндоцервикальная аденокарцинома in situ.
Эндоцервикальная аденокарцинома.
Эндометриальная аденокарцинома.
Вторичная аденокарцинома.
Неклассифицируемая карцинома.
Другие злокачественные опухоли.
Материал для исследования:
мазок эпителия шейки матки (см. инструкцию по взятию биоматериала).
Инструкция по взятию материала:
Мазки берутся до бимануального исследования и кольпоскопии. Используемые инструменты должны быть стерильными и сухими, поскольку вода и дезинфицирующие растворы разрушают клеточные элементы.
При профилактическом осмотре женщин (цитологический скрининг) клеточный материал целесообразно получать с поверхности влагалищной части шейки матки (эктоцервикса) и стенок цервикального канала (эндоцервикса), при наличии патологических изменений шейки матки – прицельно.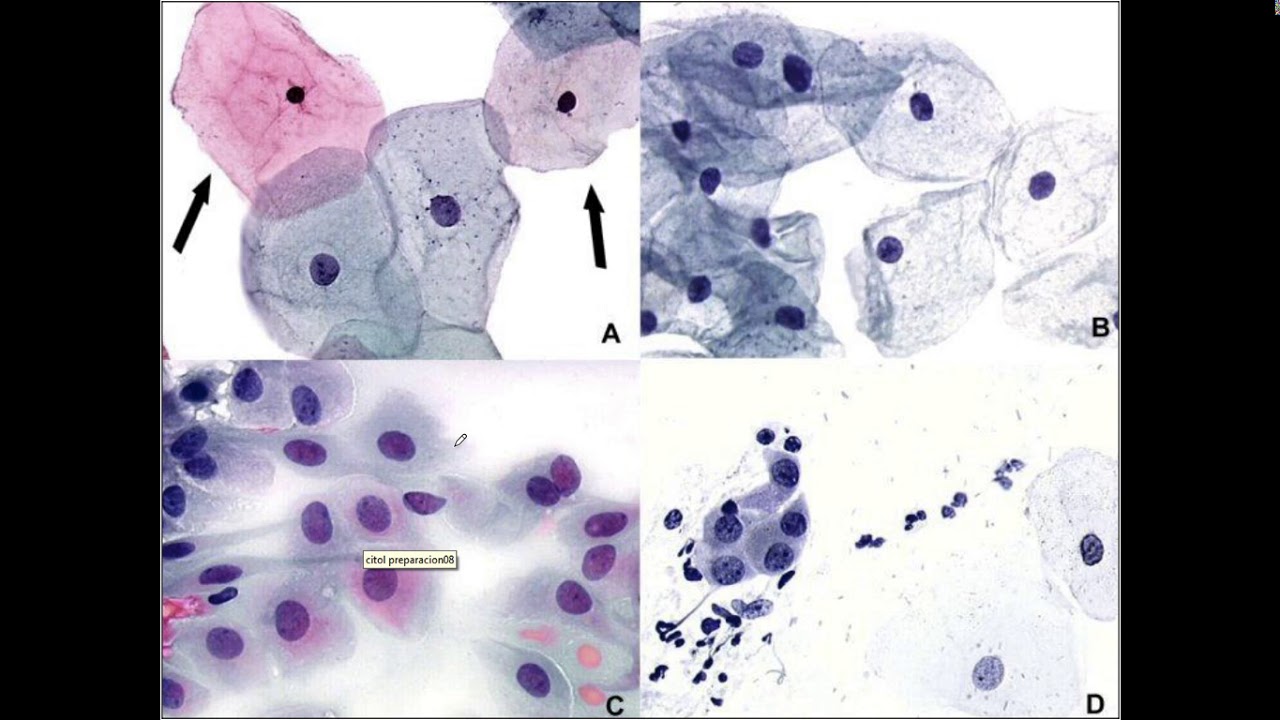
В качестве инструмента для взятия материала из шейки матки при профилактическом осмотре используются модифицированные шпатели типа Эйра или щетки Cervix-Brash, Papette. С диагностической целью материал получают раздельно: шпателями из эктоцервикса, щетками типа Cytobrash из эндоцервикса.
Полученный биологический материал наносится тонким слоем на предметное стекло и подсушивается на воздухе. Стекло обязательно маркируется с указанием фамилии/кода и места взятия клеточного материала (шейка матки, цервикальный канал). Маркировка на предметном стекле и в направлении на цитологическое исследование должны соответствовать друг другу.
Обращаем внимание, что у девочек до 16 лет гинекологические анализы берутся только в присутствии родителей. В медицинских офисах не делают соскоб и мазок из цервикального канала беременным женщинам со сроком 22 недели и более, так как эта процедура может вызвать осложнения. В случае необходимости для взятия материала вы можете обратиться к своему лечащему врачу.
В направлении на цитологическое исследование биологического материала обязательно указывают клинические данные, диагноз, особенности и место получения материала, данные о менструальном цикле.
Мазок должен быть нанесен тонким слоем на стекло и полностью высушен.
Литература
- American Cancer Society (ACS), American Society for Colposcopy and Cervical Pathology (ASCCP), and American Society for Clinical Pathology (ASCP). Cervical Cancer Screening Guidelines for Average-Risk Women. – Atlanta, GA 30329-4027 USA. — 2012. — http://www.cdc.gov/cancer/cervical/pdf/guidelines.pdf.
- Arbyn M., Anttila A. et al. European guidelines for quality assurance in cervical cancer screening (second edition) // Luxembourg: Office for Official Publications of the European Communities. — 2008. — p.25.
- Casper G.R., Ostor A.G., Quinn M.A. A clinicopathologic study of glandular dysplasia of the cervix // Gynec.
 Oncol. — 1997. — №64(1). — р.166-70.
Oncol. — 1997. — №64(1). — р.166-70. - Cirizano F.D. Management of pre-invasive diseade of the cervix // Semin. Surg. Oncol. — 1999. — №16 (3). — р.222-7.
- Ferenczy A., Coutlee F., Franco E., Hankins C. Human papillomavirus and HIV coinfection and the risk of neoplasias of the lower genital tract: a review of recent developments // CMAJ. — 2003. — №169(5). — р.431-4.
- Franco E.L., Duarte-Franco E., Ferenczy. Cervical cancer: epidemiology, prevention and the role of human papillomavirus infection // CMAJ. — 2001. — №164(7). — р.1017-25.
- Kenneth R. Shroyer, Mamatha Chivukula et al. CINtec® p16 Cervical Histology Compendium & Staining Atlas // Roche Diagnostics International Ltd. CH-6343 Rotkreuz.– Switzerland, 2012. — http://www.roche.com/index.htm.
- Ostor A.G. Natural history of cervical intraepithelial neoplasia: a critical review // Int. J. Gynecol. Pathol. — 1993. — №12(2).
 — р.186-
— р.186- - Schwartz S.M., Daling J.R., Shera K.A. et al. Human Papillomavirus and prognosis of invasive cervical cancer: a population-based study // J. Clin. Oncol. — 2001. — №19(7). — р.1906-15.
- Shlay J.C., Dunn T., Byers T et al. Prediction of cervical intraepithelial Neoplasia grade 2-3 using risk assessment and human papillomavirus testing in women with atypia on Papanicolaou smears // Obstet. Gynecol. — 2000. — №96. — р.410-16.
- Solomon D., Davey D., Kurman R. et al. The 2001 Bethesda System. Terminaligy for reporting results of cervical cytology // JAMA. — 2002. — vol.16. — р.2114-2118.
- World Health Organization (WHO). Comprehensive Cervical Cancer Control. A guide to essential practice. – WHO, Geneva. — 2006. — http://www.who.int/reproductive-health/publications/cervical_cancer_gep/text.pdf.
- Wright T.C. Jr., Cox J.T., Massad L.S. et al. 2001 Consensus Guidelines for the Management of Women with Cervical Cytological Abnormalities // JAMA.
 — 2002. — №287(16). — р.2120-9.
— 2002. — №287(16). — р.2120-9. - Воробьев С.Л., Иванова Т.М. и др. Цитологический скрининг рака шейки матки. – М., 2013.
Атипичная гиперплазия | Memorial Sloan Kettering Cancer Center
Эта информация поможет вам понять, что такое атипичная гиперплазия и как она может повлиять на риск развития рака молочной железы. Она также разъясняет, что вы можете сделать, чтобы предотвратить рак молочной железы.
Вернуться к началуОб атипичной гиперплазии
Молочная железа состоит из протоков и долек. Дольки — это маленькие полости, которые вырабатывают грудное молоко. Протоки — это небольшие трубки, по которым грудное молоко поступает к соскам. Гиперплазия — это состояние, при котором в протоках или дольках молочной железы находится больше клеток, чем обычно.
При обычной гиперплазии лишние клетки выглядят как нормальные клетки молочной железы. При атипичной гиперплазии лишние клетки отличаются от нормальных клеток молочной железы.
Виды атипичной гиперплазии
Существует два основных вида атипичной гиперплазии: атипичная протоковая гиперплазия (atypical ductal hyperplasia (ADH)) и атипичная дольковая гиперплазия (atypical lobular hyperplasia (ALH)).
Атипичная протоковая гиперплазия
При ADH вновь вырастающие клетки выглядят как клетки протоков молочной железы. И хотя ADH не является раком, она может увеличивать риск развития рака молочной железы в будущем.
Если ADH была обнаружена после пункционной биопсии (взятия небольшого образца ткани), возможно, вам потребуется операция, которая позволит убедиться в том, что у вас нет рака молочной железы. Если рака у вас нет, врач даст вам рекомендации о скрининговых исследованиях, которых вам следует проходить, а также расскажет о том, как можно снизить риск развития рака молочной железы в дальнейшем.
Атипичная дольковая гиперплазия
При ALH вновь вырастающие клетки выглядят как клетки долек молочной железы.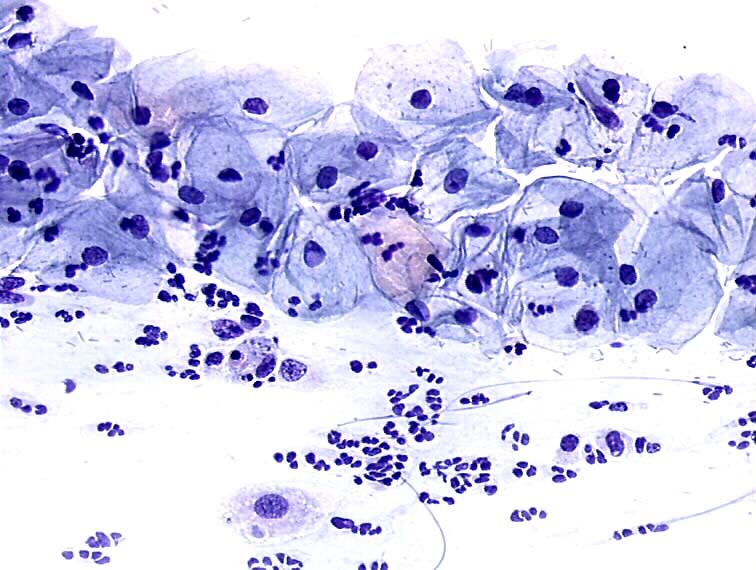 ALH связана с увеличенным риском развития рака молочной железы.
ALH связана с увеличенным риском развития рака молочной железы.
При обнаружении ALH после пункционной биопсии операция нужна не всегда. Вы и ваш врач решите, стоит ли вам делать операцию.
Вернуться к началуСкрининговые исследования на наличие рака молочной железы
Из-за увеличенного риска развития рака молочной железы люди с любым видом атипичной гиперплазии должны регулярно проходить исследования и процедуры медицинской визуализации молочных желез. Вы и ваш врач решите, какой тип визуализации молочных желез больше подойдет вам с учетом вашей истории болезни. Рекомендуется проходить врачебный осмотр у специалиста по молочным железам каждые 6–12 месяцев и процедуру визуализации молочных желез каждый год.
Вернуться к началуСнижение риска развития рака молочной железы
Лекарства
Прием определенных лекарств может помочь в снижении риска развития рака молочной железы. Исследования показывают, что следующие лекарства могут снизить риск развития рака молочной железы больше чем наполовину. Обсудите с медицинским сотрудником прием лекарств, чтобы решить, какое лекарство больше подойдет вам.
Обсудите с медицинским сотрудником прием лекарств, чтобы решить, какое лекарство больше подойдет вам.
Tamoxifen и raloxifene
Tamoxifen (Nolvadex®, Soltamox®) и raloxifene (Evista®) — это лекарства, снижающие риск развития рака молочной железы за счет блокировки действия эстрогена. Эстроген — это естественный гормон, который вырабатывается организмом и может провоцировать рост некоторых опухолей молочной железы. Эти лекарства могут снизить риск развития рака молочной железы лишь определенного типа, называемого эстроген-рецептор-положительным раком, который является наиболее распространенным типом. Они не снижают риск развития эстроген-рецептор-отрицательного рака.
Вы можете принимать raloxifene только после наступления менопаузы (окончательного прекращения менструальных циклов). Вы можете принимать tamoxifen до и после наступления менопаузы.
Ингибиторы ароматазы
Ингибиторы ароматазы — это лекарства, которые не дают ферменту, называемому ароматазой, превращать другие гормоны в эстроген. Один из таких препаратов, exemestane (Aromasin®), как было доказано, снижает риск развития рака молочной железы у людей с атипичной гиперплазией. Вам следует принимать эти лекарства только после наступления менопаузы.
Один из таких препаратов, exemestane (Aromasin®), как было доказано, снижает риск развития рака молочной железы у людей с атипичной гиперплазией. Вам следует принимать эти лекарства только после наступления менопаузы.
Профилактическая мастэктомия
Для предотвращения рака молочной железы некоторые люди могут предпочесть удаление молочных желез. Это называется двусторонней профилактической мастэктомией. Эта операция иногда применяется, чтобы снизить риск развития рака молочной железы у людей с ADH или ALH.
Изменение образа жизни
Если у вас неинвазивная дольковая карцинома, то для снижения риска развития рака молочной железы вы также можете изменить образ жизни. Вы можете обсудить эти изменения с вашим врачом.
Вернуться к началуЦитологическое исследование соскобов шейки матки и цервикального канала с описанием по терминологической системе Бетесда (The Bethesda System – TBS)
Исследуемый материал Смотрите в описании
Метод определения
Цитологическое исследование осуществляется согласно «Номенклатуре клинических лабораторных исследований, применяемых в целях диагностики и слежения за состоянием пациентов в учреждениях Российской Федерации», утвержденной приказом Минздрава России от 21.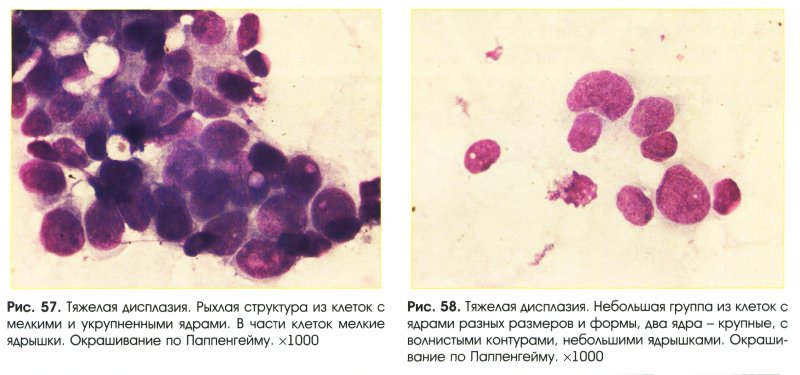 02.2000 г. №64 и «Примерному перечню лабораторных исследований для клинико-диагностической лаборатории лечебно-профилактических учреждений» от 25.12.1997 г. №380.
02.2000 г. №64 и «Примерному перечню лабораторных исследований для клинико-диагностической лаборатории лечебно-профилактических учреждений» от 25.12.1997 г. №380.
Международный метод своевременного распознавания вероятной онкологической патологии матки.
Онкологические заболевания шейки матки являются серьезной проблемой здравоохранения, широко распространены, имеют надежно распознаваемую преклиническую фазу и длительный период развития. Для достоверной верификации диагноза и выбора методов эффективного лечения применяется надежный скрининг-тест – цитологическое исследование мазков, взятых из шейки матки и цервикального канала.
Цитологический метод исследования является весьма чувствительным в диагностике предрака (дисплазий) и начального преклинического рака шейки матки (карциномы in situ, микроинвазивного и скрытого инвазивного рака). Цитологический скрининг позволяет выявить пациенток в преклинической фазе заболевания, использовать щадящие методы лечения, сокращать его сроки, снижать частоту инвалидизации и смертности. Скрининговое цитологическое исследование шейки матки рекомендуется проводить ежегодно всем женщинам от 21 года (или через год от начала половой жизни), независимо от клинических показаний. При наличии клинических изменений частота цитологического исследования определяется врачом-гинекологом.
Скрининговое цитологическое исследование шейки матки рекомендуется проводить ежегодно всем женщинам от 21 года (или через год от начала половой жизни), независимо от клинических показаний. При наличии клинических изменений частота цитологического исследования определяется врачом-гинекологом.
Для возникновения и развития многих патологических процессов существенное значение имеет особенность анатомического строения шейки матки и, в частности, состояние и взаимоотношение эпителиальных слоев влагалищной части шейки цервикального канала. Как правило, предраковые изменения, а затем и малигнизация, возникают в месте перехода многослойного плоского эпителия влагалищной порции шейки матки в цилиндрический эпителий цервикального канала (зоне трансформации), расположенного (в фертильном возрасте) в области наружного зева. Под влиянием гормональных факторов, травм, воспалительных процессов, диатермокоагуляции зона трансформации (зона стыка) может значительно варьировать. В период увядания овариально-менструальной функции в связи с процессами атрофии уровень стыка поднимается высоко в цервикальный канал.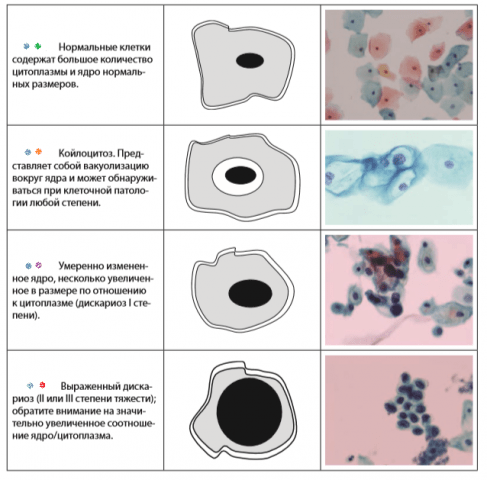
В 95-97% случаев злокачественная трансформация происходит в клетках плоского эпителия, в остальных – в клетках цилиндрического эпителия цервикального канала.
Основоположником диагностической цитопатологии является Г. Папаниколау (G.N. Papanicolaou), который в 1928 г. описал раковые клетки в мазках из влагалища. Им была разработана широко используемая классификация изменения клеток влагалища и цервикального канала шейки матки. Но в этой классификации не учитываются цитологические изменения, обусловленные вирусом папилломы человека (ВПЧ). Поэтому в настоящее время Всемирная организация здравоохранения рекомендует систему, разработанную в клинике Бетесда (США).
Терминологическая система Бетесда (ТБС, 2001 г.)
разработана для унификации описаний результатов цитологического исследования эпителия шейки матки (с целью представления их в удобной клиницистам форме), с выделением в отдельные группы находок разной клинической значимости и оценкой адекватности исследуемого материала.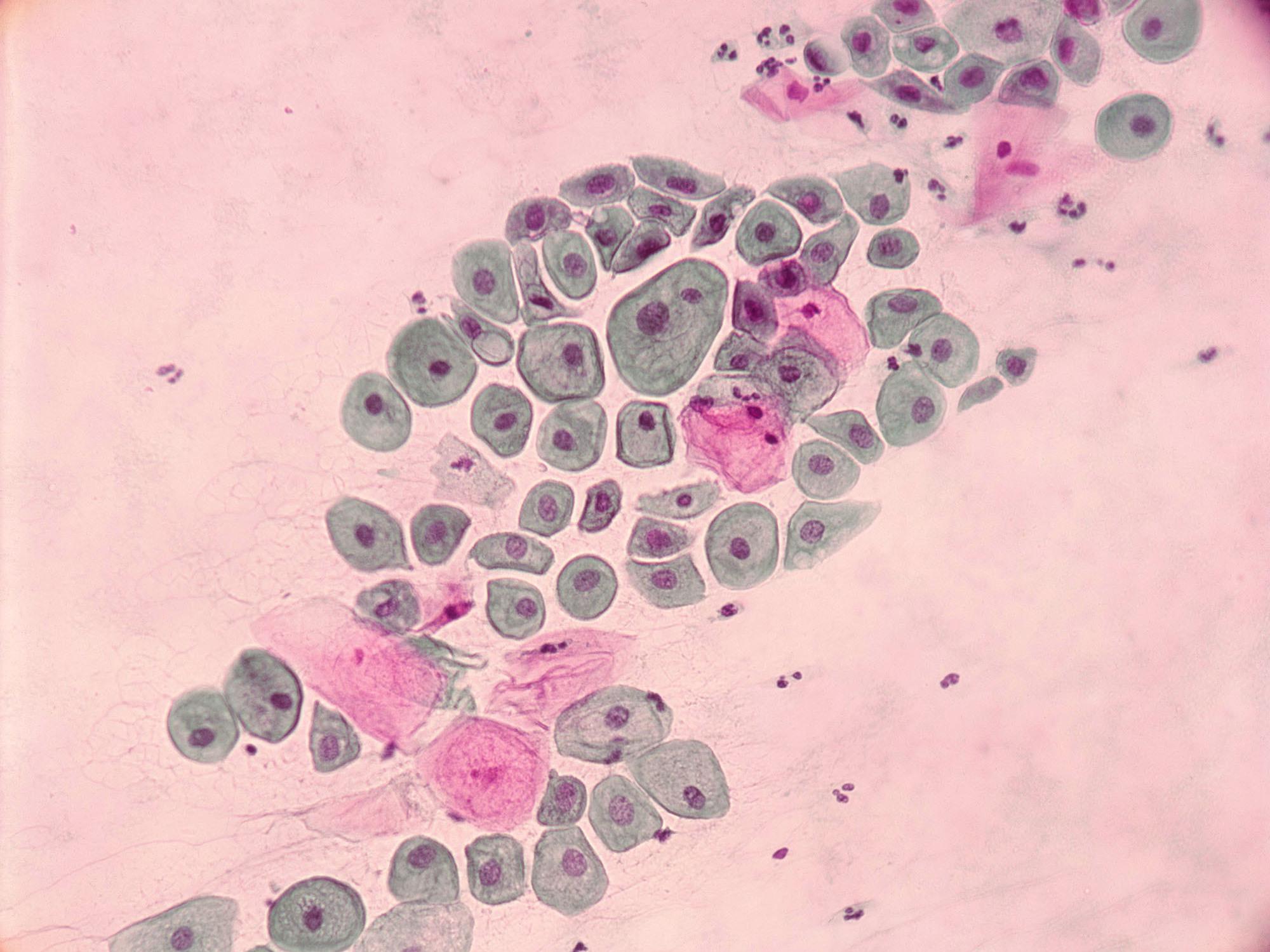
Система Бетесда включает 3 категории мазков: норма, мазки неопределенного значения (ASCUS) и внутриэпителиальные (предраковые) поражения низкой (LSIL) и высокой (HSIL) степеней.
Согласно ТБС, начальным компонентом интерпретации цервикальных мазков является оценка адекватности образца, так как его качество влияет на чувствительность цитологического метода. ТБС 2001 г. предполагает две категории образцов: «удовлетворительный» и «неудовлетворительный».
Терминология системы Бетесда (пересмотр 2004 г.).
NILM – интраэпителиальные изменения и злокачественные процессы отсутствуют. В эту группу включены цитологические заключения о нормальном состоянии эпителия, а также о наличии различных не неопластических состояний (заболеваний). Уточняют их характер и, по возможности, причину:
- атрофические изменения;
- наличие клеток железистого эпителия после гистерэктомии;
- реактивные изменения, ассоциированные с воспалением, включая типичную регенерацию, лучевую терапию, применение внутриматочных контрацептивов;
- кроме того, указывают наличие микроорганизмов:
- Trichomonas vaginalis;
- грибов, по морфологическому строению соответствующих Candida spp.
 ;
; - бактерий, по морфологическому строению соответствующих Actinomyces spp.;
- коккобациллярную микрофлору, характерную для бактериального вагиноза;
- клеточные изменения, соответствующие поражению Herpes simplex virus.
У женщин 40 лет и старше при отсутствии плоскоклеточных интраэпителиальных изменений указывается также наличие эндометриальных клеток.
ASCUS – клетки плоского эпителия с атипией неясного значения.
ASC-Н – клетки плоского эпителия с атипией неясного значения, не исключающие наличия высокой степени интраэпителиальных изменений.
LSIL – интраэпителиальные изменения плоского эпителия низкой степени, включают поражения, ассоциированные с HPV и CIN I.
НSIL – интраэпителиальные изменения плоского эпителия высокой степени, включают CIN II, CIN III, карциному in situ и случаи, подозрительные на наличие инвазии.
Плоскоклеточная карцинома.
AGC – клетки цервикального (железистого) эпителия с атипией неясного значения.
AGC, favor neoplastic – клетки цервикального (железистого) эпителия, возможно неоплазия.
Эндоцервикальная аденокарцинома in situ.
Эндоцервикальная аденокарцинома.
Эндометриальная аденокарцинома.
Вторичная аденокарцинома.
Неклассифицируемая карцинома.
Другие злокачественные опухоли.
Материал для исследования:
мазок эпителия шейки матки (см. инструкцию по взятию биоматериала).
Инструкция по взятию материала:
Мазки берутся до бимануального исследования и кольпоскопии. Используемые инструменты должны быть стерильными и сухими, поскольку вода и дезинфицирующие растворы разрушают клеточные элементы.
При профилактическом осмотре женщин (цитологический скрининг) клеточный материал целесообразно получать с поверхности влагалищной части шейки матки (эктоцервикса) и стенок цервикального канала (эндоцервикса), при наличии патологических изменений шейки матки – прицельно.
В качестве инструмента для взятия материала из шейки матки при профилактическом осмотре используются модифицированные шпатели типа Эйра или щетки Cervix-Brash, Papette.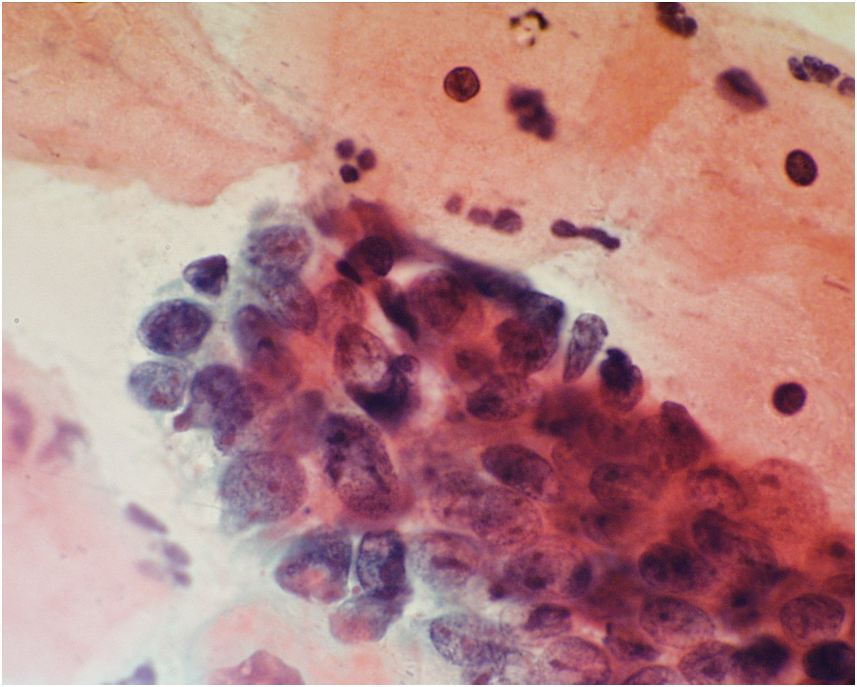 С диагностической целью материал получают раздельно: шпателями из эктоцервикса, щетками типа Cytobrash из эндоцервикса.
С диагностической целью материал получают раздельно: шпателями из эктоцервикса, щетками типа Cytobrash из эндоцервикса.
Полученный биологический материал наносится тонким слоем на предметное стекло и подсушивается на воздухе. Стекло обязательно маркируется с указанием фамилии/кода и места взятия клеточного материала (шейка матки, цервикальный канал). Маркировка на предметном стекле и в направлении на цитологическое исследование должны соответствовать друг другу.
Обращаем внимание, что у девочек до 16 лет гинекологические анализы берутся только в присутствии родителей. В медицинских офисах не делают соскоб и мазок из цервикального канала беременным женщинам со сроком 22 недели и более, так как эта процедура может вызвать осложнения. В случае необходимости для взятия материала вы можете обратиться к своему лечащему врачу.
В направлении на цитологическое исследование биологического материала обязательно указывают клинические данные, диагноз, особенности и место получения материала, данные о менструальном цикле.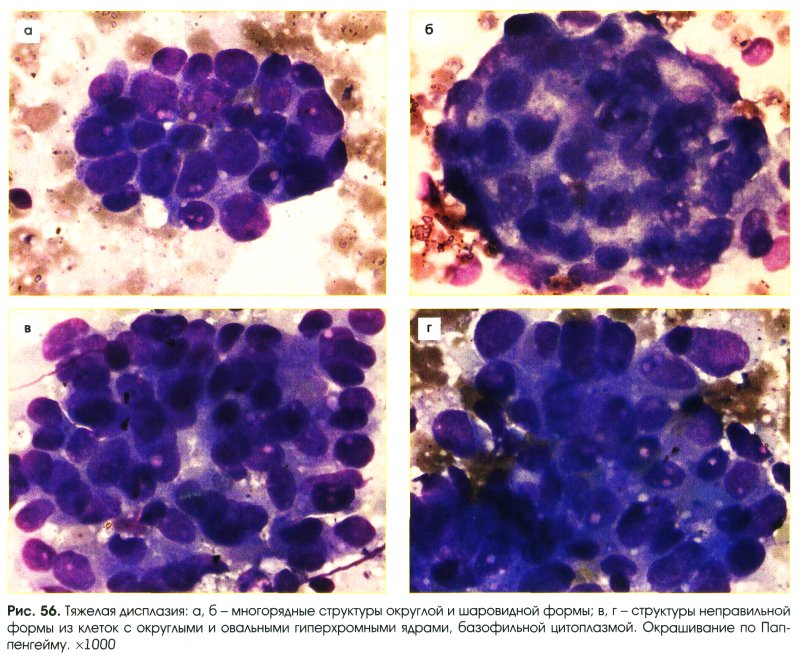
Мазок должен быть нанесен тонким слоем на стекло и полностью высушен.
Литература
- American Cancer Society (ACS), American Society for Colposcopy and Cervical Pathology (ASCCP), and American Society for Clinical Pathology (ASCP). Cervical Cancer Screening Guidelines for Average-Risk Women. – Atlanta, GA 30329-4027 USA. — 2012. — http://www.cdc.gov/cancer/cervical/pdf/guidelines.pdf.
- Arbyn M., Anttila A. et al. European guidelines for quality assurance in cervical cancer screening (second edition) // Luxembourg: Office for Official Publications of the European Communities. — 2008. — p.25.
- Casper G.R., Ostor A.G., Quinn M.A. A clinicopathologic study of glandular dysplasia of the cervix // Gynec. Oncol. — 1997. — №64(1). — р.166-70.
- Cirizano F.D. Management of pre-invasive diseade of the cervix // Semin. Surg. Oncol. — 1999. — №16 (3). — р.222-7.
- Ferenczy A.
 , Coutlee F., Franco E., Hankins C. Human papillomavirus and HIV coinfection and the risk of neoplasias of the lower genital tract: a review of recent developments // CMAJ. — 2003. — №169(5). — р.431-4.
, Coutlee F., Franco E., Hankins C. Human papillomavirus and HIV coinfection and the risk of neoplasias of the lower genital tract: a review of recent developments // CMAJ. — 2003. — №169(5). — р.431-4. - Franco E.L., Duarte-Franco E., Ferenczy. Cervical cancer: epidemiology, prevention and the role of human papillomavirus infection // CMAJ. — 2001. — №164(7). — р.1017-25.
- Kenneth R. Shroyer, Mamatha Chivukula et al. CINtec® p16 Cervical Histology Compendium & Staining Atlas // Roche Diagnostics International Ltd. CH-6343 Rotkreuz.– Switzerland, 2012. — http://www.roche.com/index.htm.
- Ostor A.G. Natural history of cervical intraepithelial neoplasia: a critical review // Int. J. Gynecol. Pathol. — 1993. — №12(2). — р.186-
- Schwartz S.M., Daling J.R., Shera K.A. et al. Human Papillomavirus and prognosis of invasive cervical cancer: a population-based study // J. Clin. Oncol. — 2001. — №19(7). — р.
 1906-15.
1906-15. - Shlay J.C., Dunn T., Byers T et al. Prediction of cervical intraepithelial Neoplasia grade 2-3 using risk assessment and human papillomavirus testing in women with atypia on Papanicolaou smears // Obstet. Gynecol. — 2000. — №96. — р.410-16.
- Solomon D., Davey D., Kurman R. et al. The 2001 Bethesda System. Terminaligy for reporting results of cervical cytology // JAMA. — 2002. — vol.16. — р.2114-2118.
- World Health Organization (WHO). Comprehensive Cervical Cancer Control. A guide to essential practice. – WHO, Geneva. — 2006. — http://www.who.int/reproductive-health/publications/cervical_cancer_gep/text.pdf.
- Wright T.C. Jr., Cox J.T., Massad L.S. et al. 2001 Consensus Guidelines for the Management of Women with Cervical Cytological Abnormalities // JAMA. — 2002. — №287(16). — р.2120-9.
- Воробьев С.Л., Иванова Т.М. и др. Цитологический скрининг рака шейки матки. – М., 2013.

Атипия | Словарь патологии | MyPathologyReport.ca
Что означает атипия?
Атипия — это слово, которое патологи используют для описания клеток, которые выглядят ненормальными по форме, цвету или размеру по сравнению с нормальными здоровыми клетками в том же месте. Патологи могут также описать эти изменения как цитологическую атипию или атипичные клетки.
Что вызывает атипию?
Есть много причин, по которым это изменение может развиваться в клетке или группе клеток. К наиболее частым причинам относятся:
- Воспаление. Воспаление — это естественная защита организма от травм или болезней.Организм также использует воспаление для восстановления тканей после травмы. Особые клетки, которые участвуют в воспалении, называются воспалительными клетками, и они являются частью иммунной системы организма. Нормальные, здоровые клетки могут начать выглядеть нетипично, когда они находятся рядом с воспалительными клетками.
 В этой ситуации атипия уходит, когда прекращается воспаление.
В этой ситуации атипия уходит, когда прекращается воспаление. - Инфекция — Клетки, инфицированные вирусом, могут выглядеть очень нетипично. Патологи иногда называют это изменение вирусными цитопатическими эффектами.Этот тип атипии пройдет, как только инфекция будет выведена из организма.
- Радиация — Радиация является распространенным методом лечения рака. Нормальные, здоровые клетки, подвергшиеся облучению, обычно выглядят очень нетипично при исследовании под микроскопом. Ваш врач всегда должен сообщать своему патологу, получаете ли вы сейчас или в прошлом.
- Предраковые заболевания — Аномальные клетки при большинстве предраковых заболеваний выглядят нетипично при исследовании под микроскопом.Предраковые заболевания, при которых обнаруживаются атипичные клетки, включают дисплазию и карциному in situ.
- Рак — Почти все раковые образования состоят из клеток, которые выглядят нетипично по сравнению с нормальными здоровыми клетками вокруг них. В этом случае очень важна атипия, потому что она помогает вашему патологу поставить диагноз и определить степень опухоли.

Важно помнить, что атипия — это описание внешнего вида некоторых клеток, а не полноценный диагноз. Во многих случаях ваш патолог попытается определить причину появления атипичных клеток.Если причина известна, она будет описана в вашем отчете о патологии. Однако ваши врачи могут определить причину атипии только позже с помощью дополнительной информации о вас и вашей истории болезни.
Реактивная атипия
Патологоанатомы используют термин реактивная атипия для описания клеток, которые показывают это изменение в ответ на воспаление, инфекцию или облучение. Реактивная атипия — это не рак.
атипия при биопсии груди: что это значит? — Грудь360.org
Грудь состоит из долек, из которых вырабатывается молоко, и протоков, по которым молоко поступает к соску. И дольки, и протоки выстланы двумя слоями клеток. Когда клетки, выстилающие дольки или протоки, растут, скопление клеток называется гиперплазией. Обычная гиперплазия не представляет риска, но когда клетки растут нерегулярно, они могут стать проблематичными. Этот нерегулярный образец известен как атипия. Атипичные клетки не являются злокачественными, но повышают риск развития рака у пациента в течение жизни.
Этот нерегулярный образец известен как атипия. Атипичные клетки не являются злокачественными, но повышают риск развития рака у пациента в течение жизни.
Атипичная гиперплазия протоков, также известная как ADH, затрагивает протоки ткани груди, а атипичная дольчатая гиперплазия, также известная как ALH, затрагивает дольки ткани груди. Когда патолог обнаруживает АДГ или АЛГ при биопсии стержневой иглой, выполненной для аномальной маммографии или УЗИ, может быть рекомендована открытая хирургическая биопсия. Причина этой рекомендации заключается в том, что образцы биопсии стержневой иглы могут потенциально не обнаруживать рак груди в 10-20% случаев. Атипия, обнаруженная при открытой хирургической биопсии, не требует дополнительной операции, но будет полезна при оценке рака и при расчете риска развития рака груди у пациента в будущем.
Другие формы аномальных клеток включают лобулярную неоплазию, также называемую LIN, и лобулярную карциному in-situ, называемую LCIS. ADH и ALH увеличивают риск развития рака груди у пациента в 4 раза, а LIN и LCIS увеличивают риск развития рака груди в 10 раз.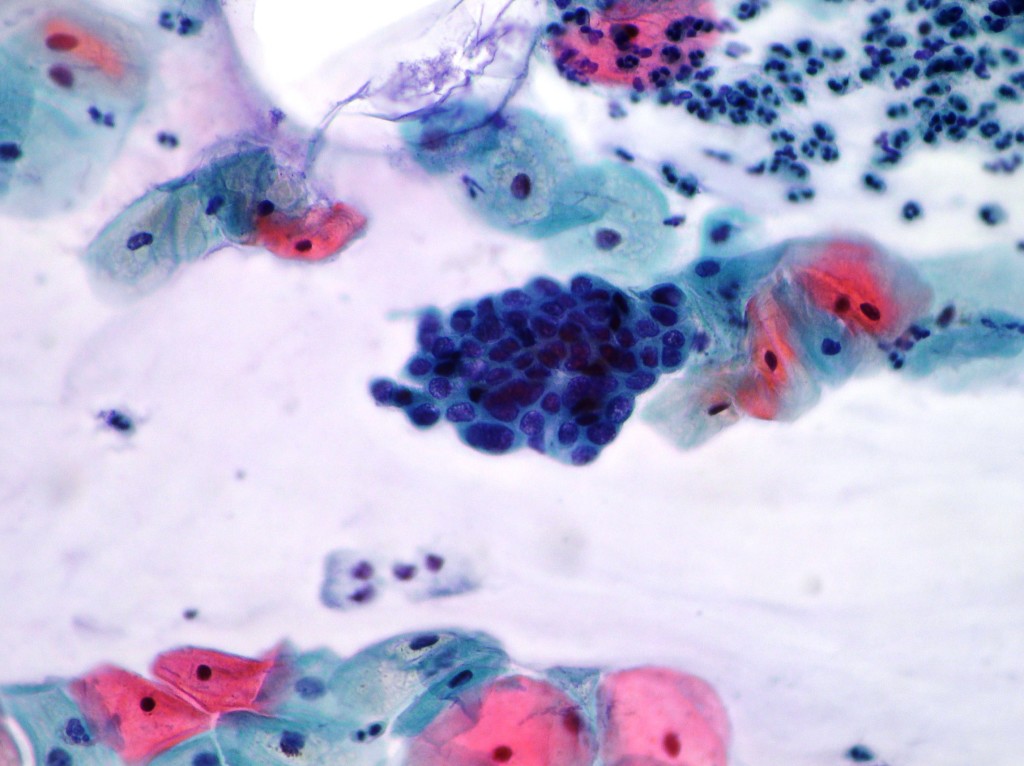 Для тех людей, у которых есть повышенный риск развития рака груди, может быть рассмотрен вопрос о дополнительном усиленном скрининге с помощью МРТ груди и таких лекарств, как Тамоксифен, Анастрозол (Аримидекс) или Эвиста (Ралоксифен), чтобы снизить риск рака груди.
Для тех людей, у которых есть повышенный риск развития рака груди, может быть рассмотрен вопрос о дополнительном усиленном скрининге с помощью МРТ груди и таких лекарств, как Тамоксифен, Анастрозол (Аримидекс) или Эвиста (Ралоксифен), чтобы снизить риск рака груди.
Зная результаты своей патологии по результатам биопсии груди, вы можете понять свой риск развития рака груди и участвовать в создании плана последующего наблюдения, который лучше всего подходит для вас.
Атипичные клетки в опухоли груди | Прочие условия
Атипичная гиперплазия — доброкачественное заболевание. Это когда количество клеток груди увеличивается, и они также приобретают необычную форму.
Грудь состоит из:
- жир
- железистая ткань, разделенная на доли (каждая содержит множество долек)
- сеть протоков или молочных протоков
- соединительная ткань
Протоки распространяются от долей к соску.
Атипичная гиперплазия может возникать в протоках (атипическая гиперплазия протоков или АДГ) или долях (атипичная дольчатая гиперплазия или АЛГ).
Атипичные клетки означают, что клетки не совсем нормальные. Нормальные клетки претерпевают довольно много изменений, прежде чем стать злокачественными.
Клетки не обязательно могут стать раковыми. Ячейки могут не измениться дальше. Или они могут умереть или вернуться в нормальное состояние.
Влияет ли атипичная гиперплазия на риск рака груди?
Атипичная гиперплазия может увеличить риск развития рака груди в будущем.
У кого возникает атипичная гиперплазия?
Атипичная гиперплазия иногда может развиваться по мере изменения груди с возрастом. Он может поражать женщин любого возраста, но чаще встречается у женщин старше 35 лет.
Диагностика атипичной гиперплазии
Атипичная гиперплазия обычно обнаруживается случайно после обычной маммограммы или когда ткань из биопсии или операции на груди исследуется под микроскопом в лаборатории.
Лечение атипичной гиперплазии
Ваш специалист может порекомендовать небольшую операцию для удаления всей гиперплазии.Затем это будет исследовано в лаборатории под микроскопом.
Нет опасности распространения каких-либо клеток, если удаленные клетки не являются раковыми. Но если опухоль осталась, и в будущем она действительно станет злокачественной, существует риск того, что некоторые клетки могут оторваться от опухоли и распространиться в других частях тела.
Продолжение
Ваш специалист может попросить вас записаться на прием к врачу. Они могут включать посещение клиники и маммографию каждые один-два года.Как часто и как долго вы будете ходить на контрольные приемы, будет зависеть от вашей ситуации.
Обратитесь к врачу, если вы заметили какие-либо новые изменения груди. Вам не нужно ждать посещения клиники.
Факторы защиты рака молочной железы
Некоторые факторы могут помочь снизить риск рака груди в целом. К ним относятся:
К ним относятся:
- быть физически активным
- иметь здоровую диету и ограничивать количество употребляемого алкоголя
Что это такое, Профилактика, Лечение
Обзор
Что такое атипичная гиперплазия?
Атипичная гиперплазия (или атипия) означает наличие аномальных клеток в ткани груди, взятых во время биопсии.(Биопсия означает, что ткань была удалена из тела для исследования в лаборатории.) Эти аномальные скопления клеток являются доброкачественными (не злокачественными), но имеют высокий риск рака.
На данные об атипичной гиперплазии приходится 10% доброкачественных биопсий молочной железы. Существует два типа атипической гиперплазии — атипическая гиперплазия протоков (АДГ) и атипическая лобулярная гиперплазия (АЛГ).
Атипичная гиперплазия протоков означает, что аномальные клетки расположены в протоке молочной железы. Атипичная лобулярная гиперплазия означает, что аномальные клетки находятся в доле груди (части груди, вырабатывающей молоко).Еще одно поражение с высоким риском — это лобулярная карцинома in situ (LCIS), которая представляет собой более обширное поражение атипичных клеток в долях груди.
Что означает атипичная гиперплазия?
Если биопсия груди показывает атипичную гиперплазию, это не означает, что у вас рак. Клетки являются маркером повышенного риска рака груди. Исследования показали, что у женщин с атипичной гиперплазией риск рака груди повышается до четырех раз. Это особенно верно в отношении рака груди с положительным рецептором эстрогена.
Долгосрочные данные показали, что чем моложе женщина на момент постановки диагноза атипичной гиперплазии, тем выше вероятность того, что в более позднем возрасте у нее разовьется рак груди. В частности, через пять лет после диагностики атипичной гиперплазии у 7% женщин разовьется рак груди. Через десять лет после постановки диагноза у 13% этих женщин разовьется рак. Через двадцать пять лет после постановки диагноза у 30% этих женщин разовьется рак груди.
Через десять лет после постановки диагноза у 13% этих женщин разовьется рак. Через двадцать пять лет после постановки диагноза у 30% этих женщин разовьется рак груди.
Что такое рак груди, положительный по рецепторам эстрогена?
Большинство клеток рака груди реагируют на гормоны, особенно на эстроген или прогестерон.Эти гормоны циркулируют в крови. Рак называется положительным по рецепторам эстрогена, если он реагирует на эстроген. Это означает, что эстроген вызывает рост рака. Рак молочной железы с положительным рецептором прогестерона означает, что прогестерон вызывает рост рака.
Знание того, какой гормон вызывает рост рака, помогает определить лучший способ лечения или профилактики рака груди. Одно исследование показало, что среди женщин, у которых действительно развился рак груди, 88% случаев рака груди были положительными по рецепторам эстрогена.
Ведение и лечение
Какое последующее наблюдение необходимо после диагностики атипичной гиперплазии?
Операция обычно проводится для удаления всей области ткани, где были обнаружены атипичные клетки. Примерно в 20% случаев рак может быть обнаружен после заключительного осмотра удаленной ткани груди.После операции рекомендуется усиленный скрининг. Клинические обследования груди будут проводиться каждые шесть месяцев, а маммография будет проходить ежегодно. В качестве дополнения некоторым пациентам также могут проходить ежегодные скрининговые МРТ высокого риска, чередующиеся с маммографией; Это означает, что вы будете проходить визуализацию груди каждые шесть месяцев. Ваш врач-маммолог поможет определить, имеете ли вы право на ежегодную МРТ молочной железы, исходя из ваших факторов риска. МРТ особенно полезна, если у вас плотная ткань груди.
Примерно в 20% случаев рак может быть обнаружен после заключительного осмотра удаленной ткани груди.После операции рекомендуется усиленный скрининг. Клинические обследования груди будут проводиться каждые шесть месяцев, а маммография будет проходить ежегодно. В качестве дополнения некоторым пациентам также могут проходить ежегодные скрининговые МРТ высокого риска, чередующиеся с маммографией; Это означает, что вы будете проходить визуализацию груди каждые шесть месяцев. Ваш врач-маммолог поможет определить, имеете ли вы право на ежегодную МРТ молочной железы, исходя из ваших факторов риска. МРТ особенно полезна, если у вас плотная ткань груди.
Профилактика
Что я могу сделать, чтобы снизить риск рака груди?
Женщинам с атипичной гиперплазией может значительно помочь пятилетний курс определенных лекарств. Эти лекарства блокируют эстроген и помогают снизить риск инвазивного рака груди, положительного по рецепторам эстрогена.Эффект может сохраняться до 15 лет после их приема.
Эти лекарства блокируют эстроген и помогают снизить риск инвазивного рака груди, положительного по рецепторам эстрогена.Эффект может сохраняться до 15 лет после их приема.
Тамоксифен (Нолвадекс®) рекомендуется женщинам, которые еще не достигли менопаузы. Другие препараты рекомендуются женщинам в период менопаузы. Менопауза определяется как отсутствие менструального цикла в течение 12 месяцев. Лекарства для женщин в период менопаузы:
- Ралоксифен (Evista®).
- Экземестан (Аромазин®).
- Анастрозол (Аримидекс®).
Все эти лекарства имеют побочные эффекты.Однако количество серьезных побочных эффектов очень невелико.
Вам необходимо подробно обсудить со своим врачом, подходят ли вам эти лекарства или другие методы лечения. В некоторых крайних случаях рассматривается возможность уменьшения риска мастэктомии (удаления груди). Однако это не обычная рекомендация.
Полезно ознакомиться с тканями собственной груди, чтобы определить изменения, о которых следует сообщать врачу. Поэтому сделайте все возможное, чтобы выполнять самопроверку груди, также называемую самосознанием груди.
Поэтому сделайте все возможное, чтобы выполнять самопроверку груди, также называемую самосознанием груди.
Ожирение — известный фактор риска рака груди. Поддержание здорового веса и активного образа жизни поможет снизить риск. Употребление алкоголя является недостаточно признанным фактором риска рака груди. Регулярное употребление трех-шести алкогольных напитков в неделю может увеличить риск рака груди еще на 15%. Поэтому избегайте употребления алкоголя или сводите его к минимуму до менее одного стакана в день. Курение является известным фактором риска не только рака груди, но и других видов рака и болезней (болезни сердца и легких; ускоряет процесс старения).Старайтесь избегать курения, в том числе пассивного курения.
Что такое атипия и дисплазия?
Urol Clin North Am. Авторская рукопись; доступно в PMC 2017 10 января.
Опубликован в окончательной редакции как:
PMCID: PMC5224879
NIHMSID: NIHMS602110
, MD, 1 , MD, 2 and, MD PhD 16 1, 2, 3, 4Joseph Sanfrancesco
1 Институт патологии и лабораторной медицины, Клиника Кливленда, Кливленд, Огайо
J.
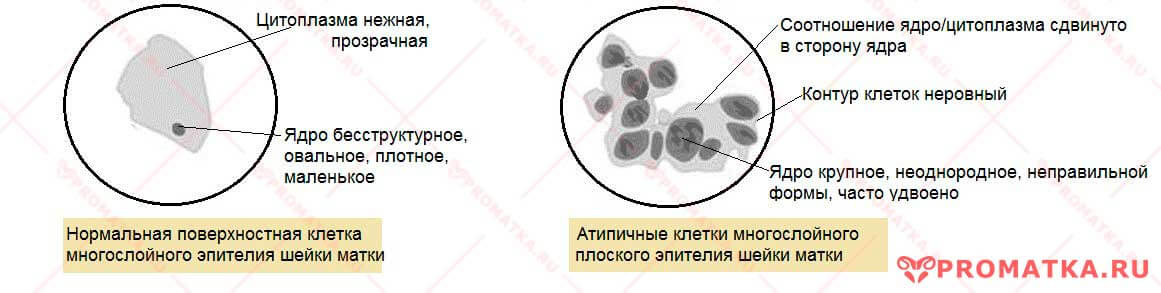 Стивен Джонс
Стивен Джонс2 Институт урологии и почек Гликмана, Клиника Кливленда, Кливленд, Огайо
Донна Э. Хансель
1 Институт патологии и лабораторной медицины, Клиника Кливленда, Кливленд, Огайо
2 Glick Институт урологии и почек, Клиника Кливленда, Кливленд, Огайо
3 Институт рака Тауссига, Клиника Кливленда, Кливленд, Огайо
4 Институт геномной медицины, Клиника Кливленда, Кливленд, Огайо
1 Патология и Институт лабораторной медицины, Клиника Кливленда, Кливленд, Огайо
2 Институт урологии и почек Гликмана, Клиника Кливленда, Кливленд, Огайо
3 Институт рака Тауссига, Клиника Кливленда, Кливленд, Огайо
4 Институт геномной медицины, Клиника Кливленда, Кливленд, Огайо
Автор, ответственный за переписку: Донна Э.Hansel, MD PhD, 9500 Euclid Avenue, Desk L25, Cleveland, OH 44195, телефон: (216) 444-5893, факс: (216) 445-3707, gro. fcc@dlesnah См. Другие статьи в PMC, в которых цитируется опубликованная статья.
fcc@dlesnah См. Другие статьи в PMC, в которых цитируется опубликованная статья.Сводка
В этой статье рассматривается спектр атипии и дисплазии в эпителии мочевого пузыря, а также диагностические категории, разработанные для дальнейшей классификации сложных поражений. Кроме того, авторы обсуждают влияние воспаления, специфических методов лечения и инструментов на микроскопический вид слизистой оболочки мочевого пузыря и связанные с этим трудности в достижении соответствующего диагноза из-за общих результатов, наблюдаемых в каждой из этих клинических ситуаций.
Ключевые слова: Мочевой пузырь, уротелиальная карцинома, атипия, дисплазия, патология
Введение
Уротелиальная выстилка мочевого пузыря представляет диагностические проблемы даже при нормальных обстоятельствах. Множество сопутствующих факторов, таких как воспаление, репаративные изменения, состояние растяжения и эффекты лечения, могут помешать диагностике ранней неоплазии.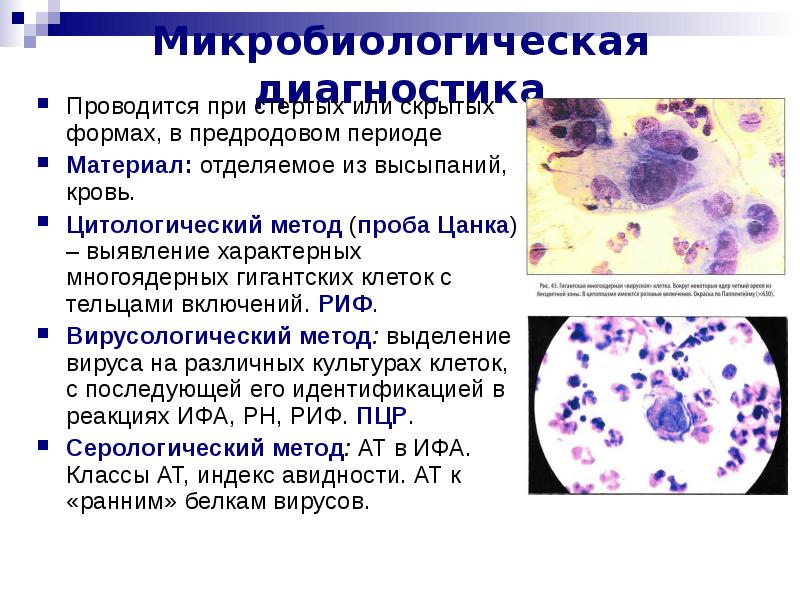 Таким образом, оценка образцов биопсии и / или трансуретральной резекции (ТУР) требует от патологоанатома детального понимания спектра гистологических изменений, которые могут возникнуть в мочевом пузыре.К диагностической проблеме добавляется тот факт, что доступные дополнительные исследования, такие как иммуногистохимические (ИГХ) окрашивания, не являются оптимальными для диагностики неоплазии мочевого пузыря. В свете этих трудностей патологи разработали ряд диагностических категорий для устранения гистологических «серых зон» при патологии мочевого пузыря. Несмотря на достигнутый прогресс, эти категории относительно субъективны и часто не коррелируют с результатами.
Таким образом, оценка образцов биопсии и / или трансуретральной резекции (ТУР) требует от патологоанатома детального понимания спектра гистологических изменений, которые могут возникнуть в мочевом пузыре.К диагностической проблеме добавляется тот факт, что доступные дополнительные исследования, такие как иммуногистохимические (ИГХ) окрашивания, не являются оптимальными для диагностики неоплазии мочевого пузыря. В свете этих трудностей патологи разработали ряд диагностических категорий для устранения гистологических «серых зон» при патологии мочевого пузыря. Несмотря на достигнутый прогресс, эти категории относительно субъективны и часто не коррелируют с результатами.
II. Что такое атипия и дисплазия?
Определение «атипия» был спорный вопрос в области патологии, не ограничивается исключительно мочеполовой узкой специализации.Отсутствие консенсуса по одному из наиболее часто используемых терминов в патологии может быть объяснено множеством причин, таких как субъективный характер гистологической оценки, институциональная предвзятость, предыдущий диагноз и предпочтение оценивающего патолога 1 . Кроме того, некоторые патологи использовали термины «атипия» и «дисплазия» как синонимы, что может создавать проблемы в клиническом ведении. Подразумевается, что атипия представляет собой доброкачественный процесс во многих случаях, в то время как дисплазия описывает предопухолевый / неопластический процесс 1 , хотя различия в определении этих категорий на микроскопическом уровне часто приводят к путанице.
Кроме того, некоторые патологи использовали термины «атипия» и «дисплазия» как синонимы, что может создавать проблемы в клиническом ведении. Подразумевается, что атипия представляет собой доброкачественный процесс во многих случаях, в то время как дисплазия описывает предопухолевый / неопластический процесс 1 , хотя различия в определении этих категорий на микроскопическом уровне часто приводят к путанице.
С гистологической точки зрения «атипия» относится к наличию одной или нескольких клеточных или архитектурных особенностей, которые отклоняются от таковых у нормально выглядящей клетки или группы клеток. В нормальных условиях уротелиальные клетки содержат овальные ядра, мелко пунктирный хроматин и ядрышки от мелких до отсутствующих, а также обильную цитоплазму и отчетливые клеточные мембраны () 2 . Даже в пределах спектра «нормальных» уротелиальные клетки могут иметь определенные различия в размере клеток и цитоплазме, особенно в самом поверхностном слое уротелия (слой зонтичных клеток), который находится в постоянном контакте с содержимым мочевого пространства. .Эти зонтичные клетки, как правило, больше, чем клетки в промежуточном и базальном слоях, со случайным бинуклеарным образованием и обильной эозинофильной цитоплазмой. Чтобы еще больше усложнить ситуацию для патологоанатома, растяжение мочевого пузыря может привести к уплощению поверхностных (или зонтичных) клеток до такой степени, что слой может быть трудно идентифицировать микроскопически 3 .
.Эти зонтичные клетки, как правило, больше, чем клетки в промежуточном и базальном слоях, со случайным бинуклеарным образованием и обильной эозинофильной цитоплазмой. Чтобы еще больше усложнить ситуацию для патологоанатома, растяжение мочевого пузыря может привести к уплощению поверхностных (или зонтичных) клеток до такой степени, что слой может быть трудно идентифицировать микроскопически 3 .
Несмотря на разнообразие внешнего вида нормальной уротелиальной клетки, при определении наличия атипии оцениваются некоторые специфические клеточные особенности.Аномальные особенности ядра, включая увеличенный размер (нуклеомегалия), отклонение от типичной овоидной формы, грубый хроматин и нерегулярный контур ядерной мембраны, — все это факторы, способствующие классификации клетки как атипичной () 4 . Кроме того, идентификация увеличенного, выступающего ядрышка или множественных ядрышек должна вызывать беспокойство 1 . В то время как эозинофильные (розовые) цитоплазматические признаки приемлемы для поверхностного уротелия, эти цитоплазматические изменения в других слоях, а также потеря цитоплазматического просвета также считаются атипичными признаками 4 .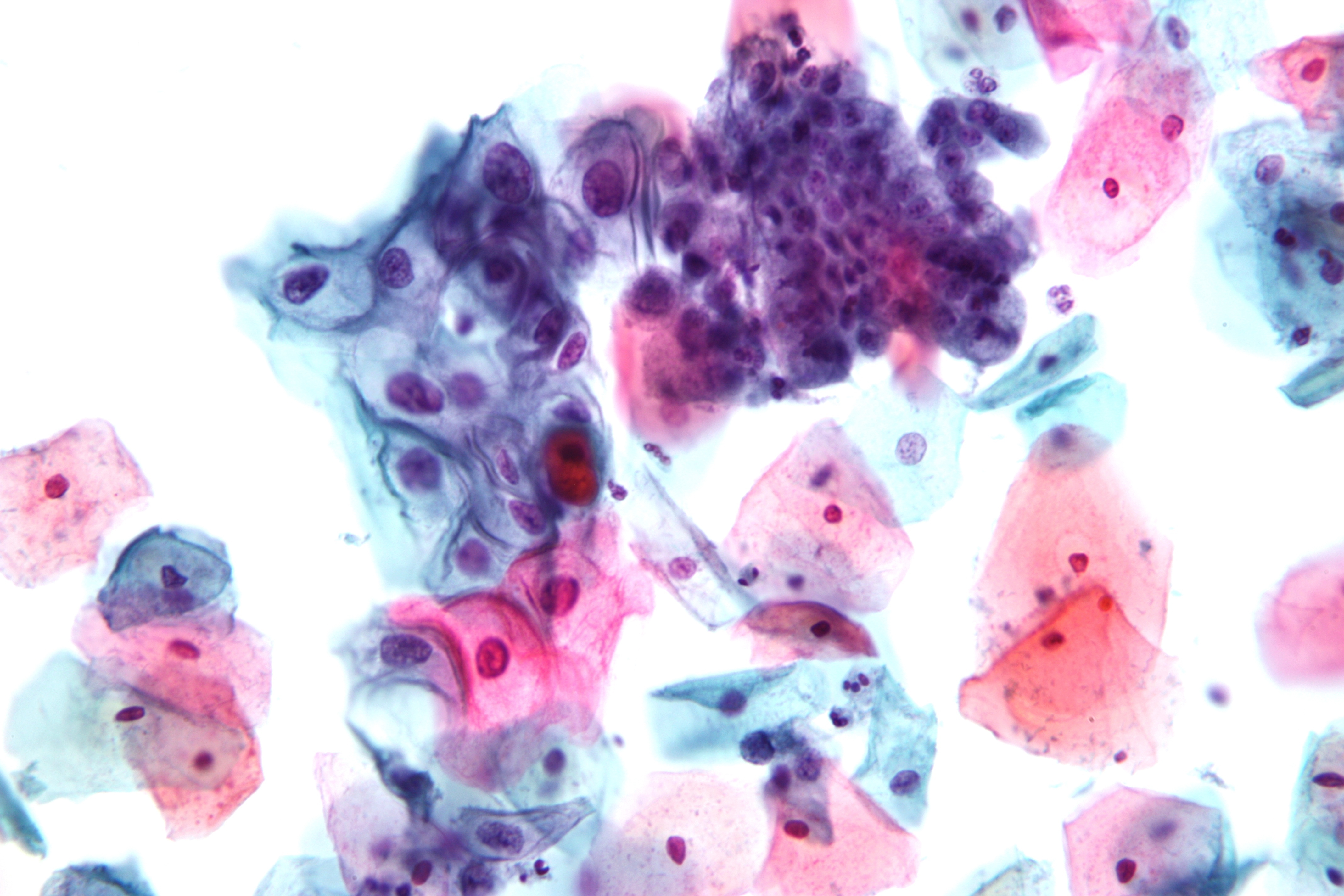
Атипия демонстрирует незначительные отклонения от нормы, которые могут включать случайную гиперхромазию, дезорганизацию или повышенную ядерную / клеточную изменчивость.
Хотя атипия часто относится конкретно к цитологическим (клеточным) аномалиям, архитектурные изменения также могут помочь патологу поставить правильный диагноз. Денудация уротелия может быть связана с предыдущими инструментами, воспалением или неопластическим процессом () 5 . И наоборот, утолщение (гиперплазия) эпителия может быть результатом множества причин, от доброкачественной пролиферации до реактивного процесса, вторичного по отношению к воспалению, а также быть просто артефактом тангенциального разреза 6 .Наличие атипичных клеток на фоне различной толщины эпителия может представлять собой сложную диагностическую проблему. Оценка гистологических изменений во всем образце, подробная история болезни и результаты цистоскопии необходимы для постановки правильного диагноза. Таким образом, тесное общение с лечащим урологом имеет решающее значение для правильного диагноза и ведения пациента 7 .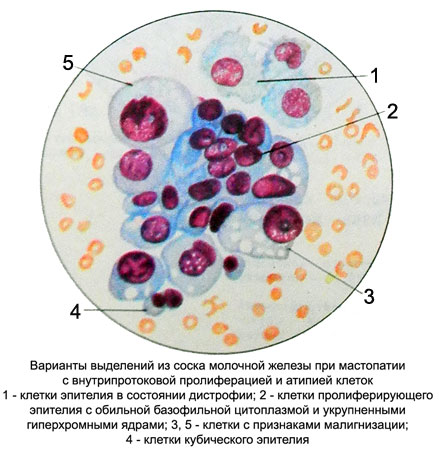
Денудация может привести к диагностике атипии.
III. Диагностические категории плоских уротелиальных поражений
Реактивная уротелиальная атипия
Реактивная уротелиальная атипия остается одной из самых широких категорий, используемых для описания аномального уротелия, но обычно считается при диагностике доброкачественным процессом 5 . Реактивная атипия чаще всего диагностируется на фоне острого и / или хронического воспалительного процесса, который может возникнуть в связи с предыдущими инструментами, инфекцией, предшествующим лечением и другими клиническими сценариями, провоцирующими воспаление.Цитологические и архитектурные аномалии, возникающие в этих условиях, обычно мягкие и однородные 4 . Увеличенный размер ядра, везикулярный хроматин и точечные ядрышки являются наиболее частыми признаками, идентифицируемыми под микроскопом с реактивными изменениями, которые часто возникают при наличии воспалительного инфильтрата внутри уротелия () 1 .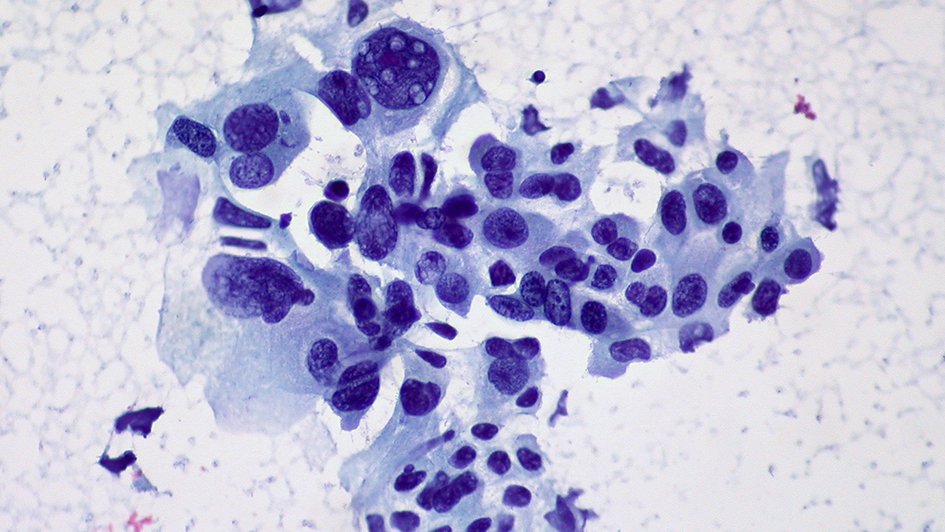 Ключевым отличием реактивной атипии является единообразие результатов по всему образцу. Плеоморфизм (изменение размера ядра), гиперхромазия и скученность ядер — это особенности, которые должны вызывать беспокойство по поводу вероятного предопухолевого или явного неопластического процесса 8 .
Ключевым отличием реактивной атипии является единообразие результатов по всему образцу. Плеоморфизм (изменение размера ядра), гиперхромазия и скученность ядер — это особенности, которые должны вызывать беспокойство по поводу вероятного предопухолевого или явного неопластического процесса 8 .
Воспаление может затруднить диагностику, часто приводя к диагнозу атипии.
Атипия неизвестной значимости
«Атипия неизвестной значимости» — это термин, введенный консенсусной группой Международного общества урологической патологии в 1998 году для классификации гистологических результатов, которые соответствуют различным критериям как реактивных изменений, так и дисплазии 1 . Как правило, этот диагноз используется в связи с реактивными ядерными и цитоплазматическими изменениями с легкой степенью плеоморфизма и / или гиперхромазии, которые имеют отношение к дисплазии.Кроме того, этот термин использовался для описания гистологических находок, когда уровень атипии непропорционально выше, чем ожидалось для количества воспаления.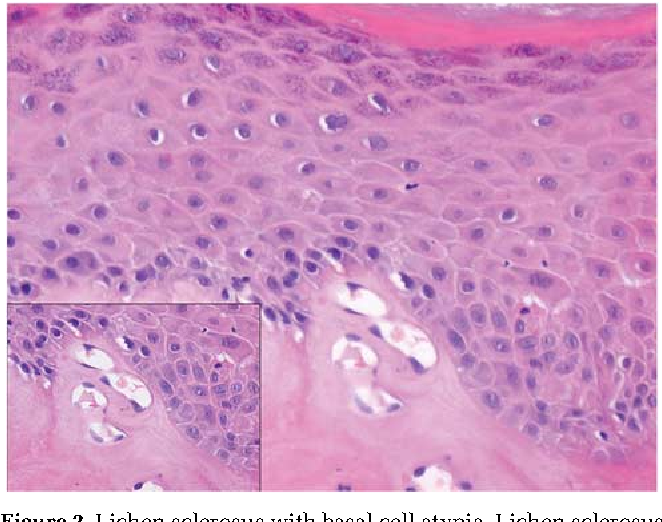 Продолжаются дискуссии о том, является ли этот термин подходящим диагнозом 4 . Классификация гистологических результатов как «атипия неизвестного значения» требует клинического наблюдения, в идеале в условиях исчезнувшего воспаления. Несмотря на склонность к проспективному мониторингу этих пациентов, в литературе нет доказательств того, что эта категория пациентов предрасположена к неопластическому прогрессированию, хотя необходимы дальнейшие исследования, чтобы лучше прояснить этот вопрос 8 .
Продолжаются дискуссии о том, является ли этот термин подходящим диагнозом 4 . Классификация гистологических результатов как «атипия неизвестного значения» требует клинического наблюдения, в идеале в условиях исчезнувшего воспаления. Несмотря на склонность к проспективному мониторингу этих пациентов, в литературе нет доказательств того, что эта категория пациентов предрасположена к неопластическому прогрессированию, хотя необходимы дальнейшие исследования, чтобы лучше прояснить этот вопрос 8 .
Уротелиальная дисплазия
Считается, что уротелиальная дисплазия представляет собой раннее пренеопластическое / неопластическое изменение, с гистологическими особенностями, выходящими за рамки спектра доброкачественного или реактивного уротелия 9 . При дисплазии толщина уротелия может быть разной, но обычно присутствуют зонтичные клетки. В этой диагностической категории часто встречаются признаки скопления клеток, множественных ядрышек и легкой гиперхромазии () 10 . Диагноз «дисплазия» используется при соблюдении некоторых, но не всех критериев, необходимых для уротелиальной карциномы in situ (CIS).В настоящее время дальнейшая подклассификация дисплазии на «легкую» или «умеренную» больше не является обычным явлением, тогда как «тяжелая дисплазия» обычно считается CIS.
Диагноз «дисплазия» используется при соблюдении некоторых, но не всех критериев, необходимых для уротелиальной карциномы in situ (CIS).В настоящее время дальнейшая подклассификация дисплазии на «легкую» или «умеренную» больше не является обычным явлением, тогда как «тяжелая дисплазия» обычно считается CIS.
Дисплазия — это субъективный диагноз. В этом случае вариабельный размер ядра, легкая клеточная дезорганизация и случайные аномальные контуры ядер (стрелка) подтверждают диагноз.
Уротелиальная дисплазия подразделяется на первичную (de novo) и вторичную дисплазию. Первичная дисплазия определяется как дисплазия, возникающая при отсутствии других гистологических признаков CIS и без предшествующей истории уротелиальной неоплазии 8 .Так как пациенты обычно протекают бессимптомно и / или при цистоскопии грубые поражения не видны, истинная первичная дисплазия редко выявляется патологом. Вторичная дисплазия классифицируется как дисплазия, выявляемая на фоне известной неоплазии мочевого пузыря, текущей или предшествующей. В любом случае пациент в настоящее время проходит скрининг для оценки текущих симптомов или наблюдения за предшествующим поражением высокой степени. В то время как первичная и вторичная дисплазия классифицируются как истинные предраковые поражения, вторичная дисплазия с большей вероятностью прогрессирует до карциномы 8 .
В любом случае пациент в настоящее время проходит скрининг для оценки текущих симптомов или наблюдения за предшествующим поражением высокой степени. В то время как первичная и вторичная дисплазия классифицируются как истинные предраковые поражения, вторичная дисплазия с большей вероятностью прогрессирует до карциномы 8 .
Карцинома in situ
Уротелиальная карцинома in situ (CIS) — это неопластический диагноз, при котором злокачественные клетки ограничиваются уротелиальной оболочкой мочевого пузыря (неинвазивное заболевание). Помимо признаков дисплазии, эти клетки демонстрируют выраженный ядерный и клеточный плеоморфизм и гиперхромазию () 9 . CIS обычно не диагностируется при отсутствии цитологической атипии на всю толщину или при идентификации зонтичных клеток. Недостаточная диагностика CIS может также происходить в условиях «цепляющегося» CIS (единичные клетки карциномы присутствуют на фоне обнаженного в противном случае уротелия) и незначительного вовлечения гнезд фон Брунна клетками CIS 9 .
CIS обычно демонстрирует явные неопластические особенности.
IV. Воспаление как фактор, способствующий диагностике атипии / дисплазии
Существует множество воспалительных и инфекционных процессов, которые вызывают реактивные изменения в мочевом пузыре. В частности, острое и хроническое воспаление, вторичное по отношению к инфекционным, механическим или идиопатическим причинам, может вызывать цитологические и архитектурные изменения, которые патолог может интерпретировать в пределах спектра атипии. Следующие категории представляют собой выборку некоторых из наиболее распространенных воспалительных процессов, которые часто приводят к диагнозу атипии и / или дисплазии при биопсии мочевого пузыря.
Острый и хронический цистит
Наиболее частой причиной острого цистита является инфекция, в первую очередь, но не ограничиваясь ими, грамотрицательные бактерии 11 . Дополнительные причины острого цистита включают предшествующее вмешательство, травму и катетеризацию.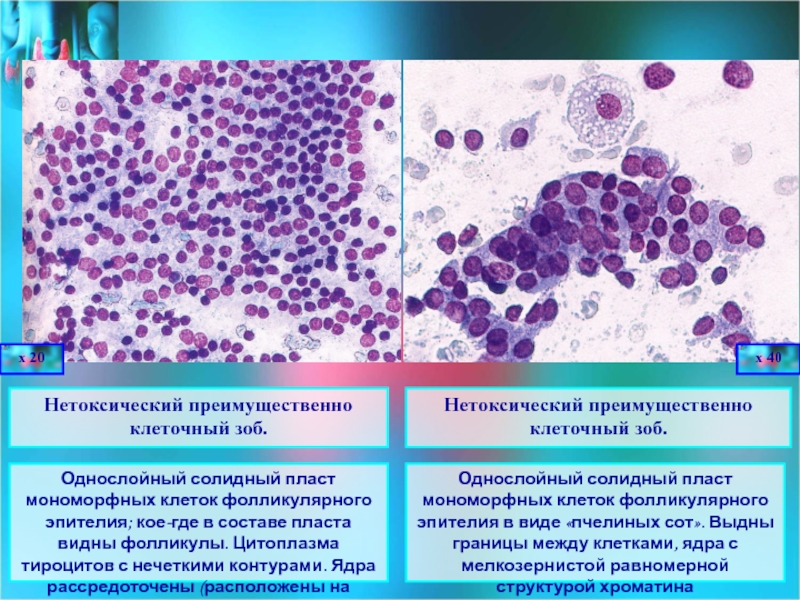 В острой стадии клеточные реакции, опосредованные воспалением, приводят к притоку нейтрофилов, лимфоцитов и макрофагов в уротелий и собственную пластинку мочевого пузыря. Также распространены отеки и заложенность сосудов 12 .Хотя реактивные изменения уротелия могут не произойти до подострой или хронической воспалительной фазы, выраженное воспаление может скрыть лежащие в основе патологические процессы и чрезвычайно затруднить оценку патологоанатома, что приведет к диагностике атипии. В условиях хронического цистита в уротелии могут происходить различные изменения, включая денудацию, изъязвление или гиперплазию. Помимо трудностей с адекватной визуализацией образца под микроскопом, вторичных по отношению к обильному количеству грануляционной ткани и / или фиброзу, реактивная атипия из-за стойкого воспалительного процесса может вызвать подозрение на дисплазию мочевого пузыря 8 .
В острой стадии клеточные реакции, опосредованные воспалением, приводят к притоку нейтрофилов, лимфоцитов и макрофагов в уротелий и собственную пластинку мочевого пузыря. Также распространены отеки и заложенность сосудов 12 .Хотя реактивные изменения уротелия могут не произойти до подострой или хронической воспалительной фазы, выраженное воспаление может скрыть лежащие в основе патологические процессы и чрезвычайно затруднить оценку патологоанатома, что приведет к диагностике атипии. В условиях хронического цистита в уротелии могут происходить различные изменения, включая денудацию, изъязвление или гиперплазию. Помимо трудностей с адекватной визуализацией образца под микроскопом, вторичных по отношению к обильному количеству грануляционной ткани и / или фиброзу, реактивная атипия из-за стойкого воспалительного процесса может вызвать подозрение на дисплазию мочевого пузыря 8 .
Полиповидный цистит
Полиповидный цистит, распространенный вариант цистита мочевого пузыря, остается серьезным воспалительным поражением как для патологов, так и для урологов 13 (). При цистоскопии картина часто экзофитного роста полиповидного цистита может клинически напоминать папиллярное новообразование. Эти поражения, как правило, появляются у пациентов с постоянными катетерами, свищами, хронической обструкцией или камнями в анамнезе. Микроскопически поражение состоит из больших выпуклых выступов слизистой оболочки уротелия, при этом собственная пластинка часто бывает довольно отечной () 13 .Со временем продолжающееся воспаление может вызвать рубцевание собственной пластинки, что приведет к появлению более папиллярного вида, а также вызвать плоскоклеточную метаплазию и реактивную атипию 14 . В исследовании 2008 г. был повторно рассмотрен 41 случай полиповидного цистита, ранее ошибочно диагностированного как папиллярная уротелиальная неоплазия 13 . Несмотря на некоторую легкую атипию и митотические фигуры во многих случаях, цитологические особенности включали равномерное увеличение клеток, сходные паттерны везикулярного хроматина и единственное выступающее ядрышко.
При цистоскопии картина часто экзофитного роста полиповидного цистита может клинически напоминать папиллярное новообразование. Эти поражения, как правило, появляются у пациентов с постоянными катетерами, свищами, хронической обструкцией или камнями в анамнезе. Микроскопически поражение состоит из больших выпуклых выступов слизистой оболочки уротелия, при этом собственная пластинка часто бывает довольно отечной () 13 .Со временем продолжающееся воспаление может вызвать рубцевание собственной пластинки, что приведет к появлению более папиллярного вида, а также вызвать плоскоклеточную метаплазию и реактивную атипию 14 . В исследовании 2008 г. был повторно рассмотрен 41 случай полиповидного цистита, ранее ошибочно диагностированного как папиллярная уротелиальная неоплазия 13 . Несмотря на некоторую легкую атипию и митотические фигуры во многих случаях, цитологические особенности включали равномерное увеличение клеток, сходные паттерны везикулярного хроматина и единственное выступающее ядрышко.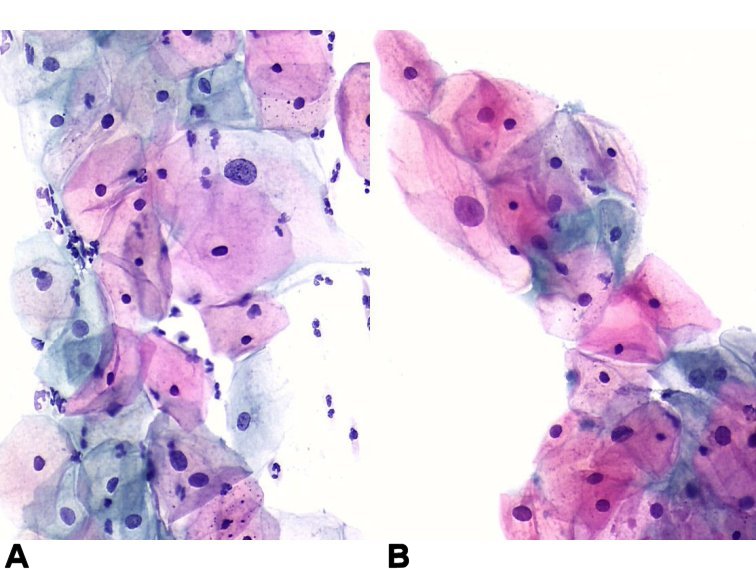 В каждом из 41 случая отсутствовали окончательная гиперхромазия и ядерный плеоморфизм, которые являются ключевыми критериями дифференциации доброкачественных реактивных поражений от неоплазии.
В каждом из 41 случая отсутствовали окончательная гиперхромазия и ядерный плеоморфизм, которые являются ключевыми критериями дифференциации доброкачественных реактивных поражений от неоплазии.
Плоская гиперплазия уротелия, распознаваемая как утолщенный уротелий без атипии.
Полиомавирус
BK и JC представляют собой двухцепочечные ДНК-вирусы из семейства паповавирусов, которые могут вызывать цитологические изменения, касающиеся дисплазии 15 . Эти вирусы латентно живут в эпителии мочевыводящих путей и протекают бессимптомно.Использование системных химиотерапевтических агентов, в первую очередь циклофосфамида, а также другие клинические сценарии иммунодефицита могут привести к реактивации этих латентных вирусов полиомы человека 16 . Атипичные клеточные признаки обычно сначала выявляются при цитологическом исследовании мочи, где отмечаются ядерные включения и / или нарушения хроматина. Клеточные изменения полиомавируса часто не обнаруживаются при гистологическом исследовании образцов биопсии из-за предпочтения вируса инфицировать поверхностный слой клеток, который может быть утерян при обработке 15 . Попытки использовать анализ содержания ДНК для дифференциации инфицированных вирусом клеток от истинных неопластических клеток исторически были безуспешными из-за анеуплоидии 17 . Корреляция с историей болезни, знание иммунного статуса пациента и знакомство с общими ядерными изменениями, связанными с повторно активированными вирусными инфекциями, имеют решающее значение для предотвращения гипердиагностики злокачественных новообразований в этой популяции пациентов 16 .
Попытки использовать анализ содержания ДНК для дифференциации инфицированных вирусом клеток от истинных неопластических клеток исторически были безуспешными из-за анеуплоидии 17 . Корреляция с историей болезни, знание иммунного статуса пациента и знакомство с общими ядерными изменениями, связанными с повторно активированными вирусными инфекциями, имеют решающее значение для предотвращения гипердиагностики злокачественных новообразований в этой популяции пациентов 16 .
V. Гиперплазия как фактор, способствующий диагностике атипии / дисплазии
Два наиболее распространенных типа гиперплазии мочевого пузыря — это простой (плоский) и папиллярный.Плоская гиперплазия определяется как утолщенный, но цитологически нормальный уротелий, обычно более 7 слоев клеток по толщине () 1 . Плоская гиперплазия иногда была связана с наличием легкой атипии, но оценивающий патолог должен иметь низкий порог для решения этой проблемы в своем диагнозе. Трудность окончательного определения наличия плоской гиперплазии может быть вторичной по отношению к тангенциальному сечению ткани во время обработки 6 . Плоская гиперплазия уротелия обычно возникает в клинических условиях воспаления или литиаза (камни в мочевом пузыре), но также выявляется рядом с новообразованиями папиллярного типа 9 .
Плоская гиперплазия уротелия обычно возникает в клинических условиях воспаления или литиаза (камни в мочевом пузыре), но также выявляется рядом с новообразованиями папиллярного типа 9 .
Папиллярная уротелиальная гиперплазия гистологически проявляется как волнообразное утолщение эпителия, лишенное значительной клеточной атипии (). Эти сосочковые валики могут содержать небольшие расширенные сосуды, которые выглядят как рудиментарные сосудистые ядра, но не имеют разветвления или более сложной архитектуры, которые поместили бы их в категорию папиллярных неопластов 18 . Как и при плоской гиперплазии, допустимы умеренные цитологические изменения на фоне воспаления и инструментария. Любое указание на то, что атипичные признаки непропорциональны с учетом клинической ситуации, должно побудить патолога рассмотреть предопухолевый процесс и, таким образом, поставить диагноз «папиллярная гиперплазия с дисплазией» 19 .Тейлор и др. изучили 16 случаев папиллярной гиперплазии и не смогли окончательно определить, будет ли папиллярная гиперплазия без признаков атипии прогрессировать до неоплазии без вмешательства.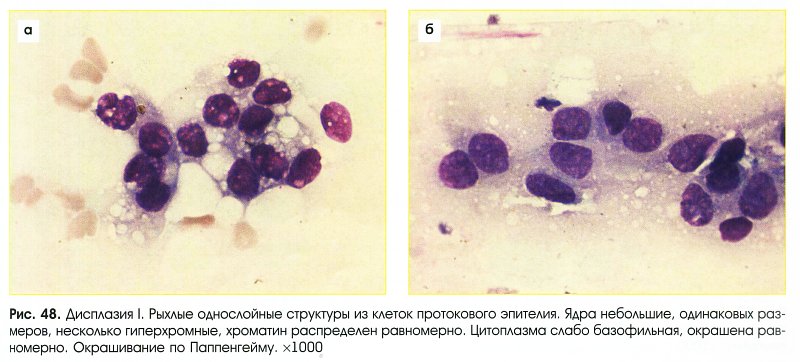 Более того, авторы постулировали, что диагностика папиллярной гиперплазии у пациента с уротелиальной неоплазией в анамнезе, вероятно, представляет рецидив 18 . И наоборот, папиллярная гиперплазия с атипичными признаками, дисплазия или очаговая CIS могут предрасполагать пациента к повышенному риску прогрессирования заболевания 19 .
Более того, авторы постулировали, что диагностика папиллярной гиперплазии у пациента с уротелиальной неоплазией в анамнезе, вероятно, представляет рецидив 18 . И наоборот, папиллярная гиперплазия с атипичными признаками, дисплазия или очаговая CIS могут предрасполагать пациента к повышенному риску прогрессирования заболевания 19 .
Папиллярная гиперплазия показывает восходящее шатание сосудов, что в некоторых случаях указывает на возможное раннее папиллярное поражение.
VI. Метапластические процессы и их связь с атипией и неоплазией мочевого пузыря
Метаплазия определяется как изменение (часто обратимое) от одного дифференцированного типа клеток к другому 20 . В случае уротелия метаплазия часто возникает на фоне воспалительного процесса или после обработки. Хотя метаплазия по определению не является неопластическим процессом, атипия в этих метапластических клетках может вызывать беспокойство по поводу менее распространенных злокачественных новообразований мочевого пузыря, таких как аденокарцинома или плоскоклеточный рак.
Плоская метаплазия
Плоская метаплазия мочевого пузыря включает замену уротелия плоским эпителием и может быть как некератинизирующим, так и ороговевшим. В некоторых случаях плоскоклеточная метаплазия без ороговения является нормальным явлением, например, в тригоне мочевого пузыря у женщин 21 . Хронические воспалительные процессы, часто наблюдаемые у пациентов с травмой спинного мозга или постоянными катетерами в помещении, могут увеличить вероятность развития плоскоклеточной метаплазии, которая может проявляться как лейкоплакия при цистоскопии.Хотя ороговевшая плоскоклеточная метаплазия традиционно ассоциируется с циститом, камнями мочевого пузыря и шистосомозом, она также может быть связана с сопутствующим или последующим злокачественным новообразованием и, таким образом, должна рассматриваться с большим подозрением и дополнительным клиническим наблюдением () 22 .
Кератинизирующая плоская метаплазия.
Cystitis cystica et glandularis
Cystitis cystica et glandularis (CCEG) — доброкачественный процесс, определяемый как кистозные изменения в гнездах фон Брунна (cystitis cystica), которые вызывают метапластические изменения клеточной выстилки в столбчатый или кубовидный эпителий .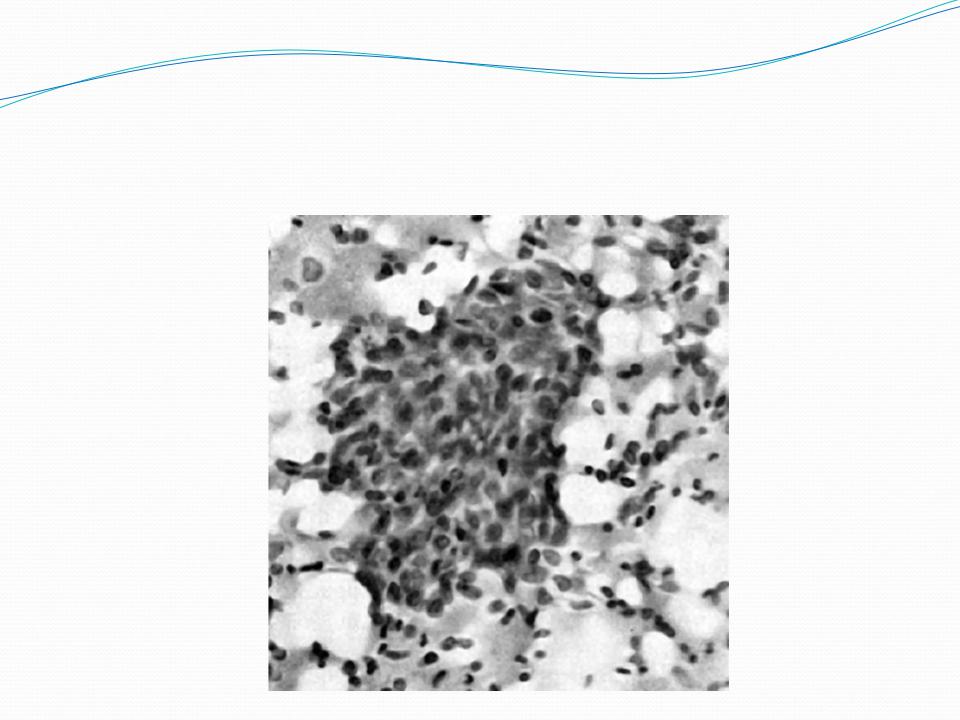 Подобно другим метапластическим процессам, CCEG связывают с хроническим воспалением / раздражением и благоприятствуют, но не ограничиваются им, тригону мочевого пузыря. CCEG далее подразделяется на обычные и кишечные типы, хотя на практике эта подкатегория часто не используется.
Подобно другим метапластическим процессам, CCEG связывают с хроническим воспалением / раздражением и благоприятствуют, но не ограничиваются им, тригону мочевого пузыря. CCEG далее подразделяется на обычные и кишечные типы, хотя на практике эта подкатегория часто не используется.
Cystitis cystica et glandularis.
Кишечная метаплазия
Кишечная метаплазия (IM) — это пролиферация эпителия в мочевом пузыре, характеризующаяся железоподобными структурами, выстланными муцин-секретирующими клетками () 24 .Эти секретирующие муцин клетки напоминают бокаловидные клетки, которые обнаруживаются в слизистой оболочке толстой кишки нижних отделов желудочно-кишечного тракта 23 . В исследовании Corica et al., 53 случая ИМ в мочевом пузыре были оценены при долгосрочном наблюдении (среднее значение> 12 лет среди двух групп случаев 24 ). Авторы определили, что наличие IM не было сильным фактором риска развития явной злокачественной опухоли 24 . Smith et al. оценили 19 случаев IM и не обнаружили признаков карциномы при последующем наблюдении (в среднем 4.4 года 23 ). Кроме того, хотя в 37% случаев ИМ была сосуществующая карцинома, авторы считают, что связь между двумя процессами не подразумевает, что ИМ был предшественником поражения 23 . Одно исследование показало, что чистые аденокарциномы мочевого пузыря (в отличие от уротелиальной карциномы с железистой дифференцировкой) происходят от ИМ, но попытки окончательно связать ИМ как предзлокачественные еще не доказаны 25 . Было высказано предположение, что обширная ИМ предрасполагает пациентов к большему риску развития аденокарциномы, но эта часто цитируемая ассоциация основана на единственном исследовании 26 , и в текущей литературе не было выявлено дополнительных доказательств.
Smith et al. оценили 19 случаев IM и не обнаружили признаков карциномы при последующем наблюдении (в среднем 4.4 года 23 ). Кроме того, хотя в 37% случаев ИМ была сосуществующая карцинома, авторы считают, что связь между двумя процессами не подразумевает, что ИМ был предшественником поражения 23 . Одно исследование показало, что чистые аденокарциномы мочевого пузыря (в отличие от уротелиальной карциномы с железистой дифференцировкой) происходят от ИМ, но попытки окончательно связать ИМ как предзлокачественные еще не доказаны 25 . Было высказано предположение, что обширная ИМ предрасполагает пациентов к большему риску развития аденокарциномы, но эта часто цитируемая ассоциация основана на единственном исследовании 26 , и в текущей литературе не было выявлено дополнительных доказательств.
Кишечная метаплазия, показывающая муцин-содержащие бокаловидные клетки.
Железистая метаплазия с дисплазией
Железистая метаплазия (иногда используется взаимозаменяемо с кишечной метаплазией 24 ) в редких случаях ассоциируется с цитологической атипией и может быть далее разделена на железистую метаплазию с дисплазией низкой / высокой степени .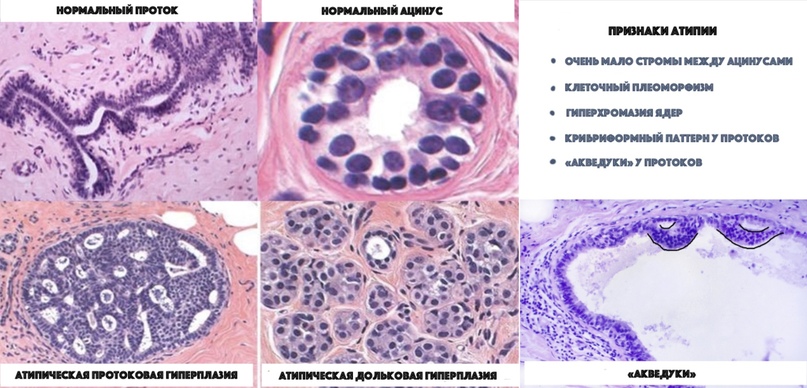 Дисплазия низкой степени имеет общие морфологические особенности с канальцевыми аденомами толстой кишки, включая столбчатые ядра, которые сохраняют полярность и однородность.Напротив, аденокарцинома in situ (железистая метаплазия с дисплазией высокой степени) демонстрирует явную атипию, включая стратификацию ядер, атипичные митозы и ядерный плеоморфизм () 28 .
Дисплазия низкой степени имеет общие морфологические особенности с канальцевыми аденомами толстой кишки, включая столбчатые ядра, которые сохраняют полярность и однородность.Напротив, аденокарцинома in situ (железистая метаплазия с дисплазией высокой степени) демонстрирует явную атипию, включая стратификацию ядер, атипичные митозы и ядерный плеоморфизм () 28 .
Аденокарцинома in situ (железистая метаплазия с дисплазией высокой степени) демонстрирует явные неопластические изменения.
Ворсинчатые аденомы мочевыводящих путей (также называемые железистой метаплазией с экзофитной структурой роста 8 ) гистологически выглядят идентичными ворсинчатым аденомам толстой кишки и состоят из псевдостратифицированной столбчатой слизистой оболочки с секретирующими муцин клетками и эпителиальными выступами различного размера. .Ворсинчатые аденомы в мочевом пузыре были связаны с инвазивной аденокарциномой, плоскоклеточной карциномой и уротелиальной карциномой in situ 29 . Эти поражения чрезвычайно редки, но при выявлении без сопутствующей карциномы прогноз для пациента отличный 30 . Как и в случае ворсинчатых аденом толстой кишки, обширный отбор образцов является обязательным для окончательного исключения стромальной инвазии или фокальной аденокарциномы in situ 8 .
Эти поражения чрезвычайно редки, но при выявлении без сопутствующей карциномы прогноз для пациента отличный 30 . Как и в случае ворсинчатых аденом толстой кишки, обширный отбор образцов является обязательным для окончательного исключения стромальной инвазии или фокальной аденокарциномы in situ 8 .
VII. Эффект лечения как причина атипии и дисплазии
Безоперационное вмешательство при неоплазии мочевого пузыря и / или предстательной железы включает в себя различные методы лечения, включая системную химиотерапию, внутрипузырную терапию и лучевую терапию.Каждый метод лечения ставит перед патологом свои собственные проблемы из-за воспаления и атипии, связанных с каждым вмешательством. Для точного определения цитологических и морфологических изменений, вторичных по отношению к лечебному эффекту, необходимо детальное понимание того, каких эффектов следует ожидать от индивидуальной терапии. Хотя многие методы лечения могут вызывать многочисленные реактивные изменения, которые можно интерпретировать как атипию, некоторые из них, например лучевой цистит, также могут быть фактором риска развития неоплазии мочевого пузыря.
Лучевая терапия
Примерно четверть всех пациентов с мышечно-инвазивной карциномой мочевого пузыря будут подвергаться той или иной форме лучевой терапии 31 . Кроме того, многие пациенты, у которых диагностирован рак простаты, также будут проходить различные формы лучевой терапии, которая в конечном итоге может повлиять на слизистую оболочку мочевого пузыря из-за ее близости. При цистоскопии часто наблюдаются отек, изъязвление и эритема, помимо кровоизлияний в слизистую. Гистологически уротелий показывает «радиационную атипию», которая включает увеличение клеток, многоядерность, вакуолизацию и очистку хроматина () 31 .Помимо воспаления и цитологической атипии, выявленных в эпителии, сосудистые изменения, вторичные по отношению к облучению, включают отек, пролиферацию сосудов, гиалинизацию сосудистой стенки и тромбоз. Ишемические изменения, вызванные воздействием радиации, могут привести к долгосрочным последствиям, таким как обнажение слизистой оболочки, контрактуры и образование свищей 32 .
Лучевая атипия на фоне воспаления, ядерной атипии и отека.
Химиотерапия
Химиотерапевтические режимы при лечении рака мочевого пузыря состоят из внутрипузырных и / или системных агентов, многие из которых могут вызвать атипию уротелия.Двумя наиболее распространенными внутрипузырными агентами являются триэтилентиофосфорамид (тиотепа) и митомицин С. Тиотепа (подщелачивающее средство) и митомицин С (антибиотик с противоопухолевыми свойствами) вызывают аналогичные цитологические и архитектурные изменения уротелия, включая денудацию и атипию зонтика. клетки с особенностями увеличенного размера, многоядерности и вакуолизации 31 . Дополнительные формы клеточной атипии, которые возникают после лечения этими двумя агентами, включают дегенеративные изменения и изменения мембран, которые могут вызвать диагноз атипии.Другие внутрипузырные местные агенты, такие как доксорубицин и эпирубицин, могут вызывать цистит и аналогичные цитологические изменения, но детали этих изменений не были тщательно изучены 31 .
В дополнение к внутрипузырной химиотерапии оксазофошпорином класса алкилирующих агентов, системная химиотерапия циклофосфамидом была идентифицирована как причина уротелиальной атипии мочевого пузыря 33,34 . Часто используемый в терапии аутоиммунных состояний, таких как системная красная волчанка и ревматоидный артрит, а также лимфопролиферативные заболевания, этот алкилирующий агент подвергается метаболизму с образованием акролеина и фосфорамидного иприта, которые выделяются с мочой и попадают на поверхностную слизистую оболочку мочевого пузыря 35 .Клинически пациенты могут иметь симптомы мочеиспускания и гематурию, что может побудить врача провести цистоскопическую оценку и биопсию. В целом поверхность слизистой оболочки может выглядеть эритематозной, отечной и, возможно, геморрагической. Микроскопически видны большие многоядерные клетки, вызванные остановкой деления клеток, вторичным по отношению к действию активных метаболитов циклофосфамида. Ядра в разной степени увеличены с неправильными мембранами, грубым хроматином и ядрышками неправильной формы и формы 31 .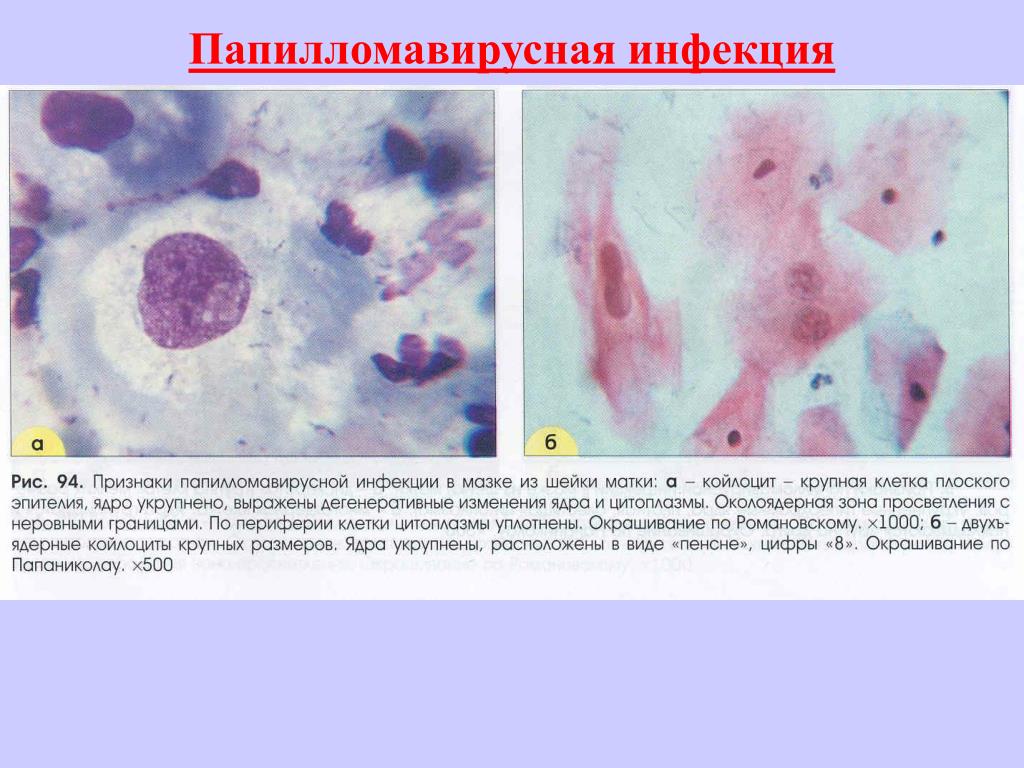 Эти эффекты аналогичны изменениям, вызванным лучевой терапией. Циклофосфамид также был связан с геморрагическим циститом 36 .
Эти эффекты аналогичны изменениям, вызванным лучевой терапией. Циклофосфамид также был связан с геморрагическим циститом 36 .
С точки зрения патологоанатома, одна из самых больших трудностей при назначении химиотерапевтического лечения состоит в том, чтобы определить, является ли атипия результатом терапии или атипия представляет собой ранние неопластические изменения, вторичные по отношению к новому или повторному заболеванию. В нескольких исследованиях было установлено, что терапия циклофосфамидом связана с девятикратным увеличением развития карциномы мочевого пузыря 37 .Кроме того, химиотерапевтические агенты связаны с доброкачественными разрастаниями эпителия, которые могут имитировать инвазивную карциному из-за инфильтративного характера роста в собственную пластинку слизистой оболочки мочевого пузыря 38 . Эти «псевдокарциноматозные» пролиферации создают несколько проблем для патологов из-за повышенного риска развития рака у пациентов, получающих химиотерапию, и ограниченного отбора проб при биопсии 38 .
Бациллы Кальметта-Герена (БЦЖ)
Бациллы Кальметта-Герена (БЦЖ) являются наиболее распространенным внутрипузырным иммунотерапевтическим средством, используемым во всем мире для лечения поверхностных и неинвазивных новообразований мочевого пузыря высокой степени злокачественности 39 .БЦЖ представляет собой плейотропный иммуностимулятор, который может ограничивать прогрессирование опухоли за счет привлечения противоопухолевого иммунного ответа 28 . Микроскопически БЦЖ-терапия наиболее заметно вызывает острое и хроническое воспаление, связанное с неказеозными гранулемами, но может также вызывать изъязвление слизистой оболочки, денудацию и реактивную уротелиальную атипию 40 .
Фотодинамическая терапия
Фотодинамическая терапия — это новый, менее распространенный метод лечения неоплазии мочевого пузыря 41 .Фотодинамическое лечение проводится либо системно, либо внутрипузырно, что впоследствии вызывает некроз опухолевых клеток при воздействии источника света 42 . Помимо индукции коагуляционного некроза и кровотечения, лечение может повлиять на прилегающую доброкачественную слизистую оболочку. Цитологическая атипия традиционно не связана с этой терапией и должна вызывать подозрение, если обнаружена при микроскопическом исследовании 28 .
Помимо индукции коагуляционного некроза и кровотечения, лечение может повлиять на прилегающую доброкачественную слизистую оболочку. Цитологическая атипия традиционно не связана с этой терапией и должна вызывать подозрение, если обнаружена при микроскопическом исследовании 28 .
Кетаминовый цистит
Чрезвычайно редким, но заметным аналогом CIS является кетаминовый цистит, который может возникать при хроническом воздействии этого препарата.Эти пациенты обычно сообщают о клинических симптомах дизурии, неотложных позывов, гематурии и недержания мочи. При цистоскопии виден эритематозный мочевой пузырь небольшой емкости. Микроскопически язвы и острое воспаление являются наиболее частыми находками. Исследование, проведенное в 2009 году Oxley et al. изучили 17 пациентов с кетаминовым циститом, 10 из которых были описаны как имеющие значительную уротелиальную атипию при гистологическом исследовании, касающемся CIS. Авторы сообщили, что, несмотря на увеличение ядер и дезорганизацию клеток, наблюдаемых при биопсии, выявленные изменения, вероятно, были реактивными и не представляли пренеопластический процесс 43 .
VIII. Иммуногистохимия как вспомогательный инструмент
Несмотря на обширные исследования, использование иммуногистохимии (ИГХ) в диагностике уротелиальной неоплазии остается довольно сложной задачей. Как обсуждалось ранее, различение реактивной атипии от дисплазии и CIS остается одной из самых серьезных тем для разногласий в урологической патологии. В нескольких исследованиях изучали полезность ИГХ при неинвазивных поражениях уротелия, особенно атипии и CIS, чтобы определить, какую роль, если таковая имеется, они могут сыграть в постановке соответствующего диагноза.
Цитокератин 20, CD44 и p53
Было проведено несколько исследований, чтобы определить, какие иммуногистохимические маркеры могут быть полезны патологу для дифференциации реактивной атипии от дисплазии. В 2001 году в одном исследовании оценивали 25 случаев неопухолевого уротелия (15 случаев реактивной атипии и 10 случаев нормального уротелия) с использованием трех распространенных красителей ИГХ: цитокератина 20 (CK20), CD44 и p53 44 . СК20 окрашивает промежуточные филаменты цитоскелета, обнаруженные в слизистой оболочке желудочно-кишечного тракта, уротелии и клетках Меркеля, и обычно ограничивается слоем зонтичных клеток в нормальном уротелии.p53 представляет собой ген-супрессор опухоли, участвующий во многих злокачественных новообразованиях, включая карциному мочевого пузыря 45 ; в нормальных условиях р53 демонстрирует слабый цитоплазматический сигнал в уротелии. Наконец, CD44 является иммуномаркером, ранее изучавшимся как возможный прогностический фактор при папиллярных уротелиальных новообразованиях, и было обнаружено, что при нормальных условиях он располагается в базальных слоях уротелия 45 . Комбинаторный подход был использован с этими тремя маркерами IHC, чтобы помочь в различении нормального уротелия с атипией и CIS.В частности, интенсивная ядерная экспрессия p53 (которая коррелирует с мутацией p53) в сочетании с полной экспрессией CK20 и потерей CD44 благоприятствует CIS 44, 46 .
СК20 окрашивает промежуточные филаменты цитоскелета, обнаруженные в слизистой оболочке желудочно-кишечного тракта, уротелии и клетках Меркеля, и обычно ограничивается слоем зонтичных клеток в нормальном уротелии.p53 представляет собой ген-супрессор опухоли, участвующий во многих злокачественных новообразованиях, включая карциному мочевого пузыря 45 ; в нормальных условиях р53 демонстрирует слабый цитоплазматический сигнал в уротелии. Наконец, CD44 является иммуномаркером, ранее изучавшимся как возможный прогностический фактор при папиллярных уротелиальных новообразованиях, и было обнаружено, что при нормальных условиях он располагается в базальных слоях уротелия 45 . Комбинаторный подход был использован с этими тремя маркерами IHC, чтобы помочь в различении нормального уротелия с атипией и CIS.В частности, интенсивная ядерная экспрессия p53 (которая коррелирует с мутацией p53) в сочетании с полной экспрессией CK20 и потерей CD44 благоприятствует CIS 44, 46 . Хотя этот общий вывод в более крупных исследованиях кажется многообещающим, рутинное использование этих маркеров в отдельных случаях часто может быть проблематичным, поскольку часто встречаются вариабельность интенсивности и распределения маркеров.
Хотя этот общий вывод в более крупных исследованиях кажется многообещающим, рутинное использование этих маркеров в отдельных случаях часто может быть проблематичным, поскольку часто встречаются вариабельность интенсивности и распределения маркеров.
IX. Заключение
Оценка уротелия мочевого пузыря — это сложный с диагностической точки зрения процесс, который включает не только тонкости морфологической оценки, но и понимание истории болезни пациента для выяснения источников атипии, не связанных с неопластической трансформацией.Общие проблемы при различении категорий реактивной атипии от атипии неопределенного значения и дисплазии включают наличие воспаления, терапию и предшествующие инструменты. Несмотря на улучшенные исследования полезности маркеров ИГХ, микроскопическая оценка остается окончательным подходом к достижению наиболее точного возможного диагноза уротелия.
Ключевые точки
Атипия и дисплазия — это термины, используемые для описания клеточных аномалий в спектре реактивных изменений неоплазии.

Острое и хроническое воспаление, вторичное по отношению к инфекционным, механическим или идиопатическим причинам, может вызывать цитологические и архитектурные изменения, которые патолог может интерпретировать в пределах спектра атипии.
Лечение, включая системную химиотерапию, внутрипузырную терапию и лучевую терапию, вызывает специфические, часто общие, клеточные изменения, которые с микроскопической точки зрения могут быть связаны с неопластическим процессом.
Несмотря на улучшенные исследования, полезность иммуногистохимии в качестве вспомогательного инструмента для отличия доброкачественных процессов от уротелиальной неоплазии остается неясной
Footnotes
Заявление издателя: Это PDF-файл неотредактированной рукописи. для публикации.В качестве услуги для наших клиентов мы предоставляем эту раннюю версию рукописи. Рукопись будет подвергнута копированию, верстке и проверке полученного доказательства, прежде чем она будет опубликована в окончательной форме для цитирования.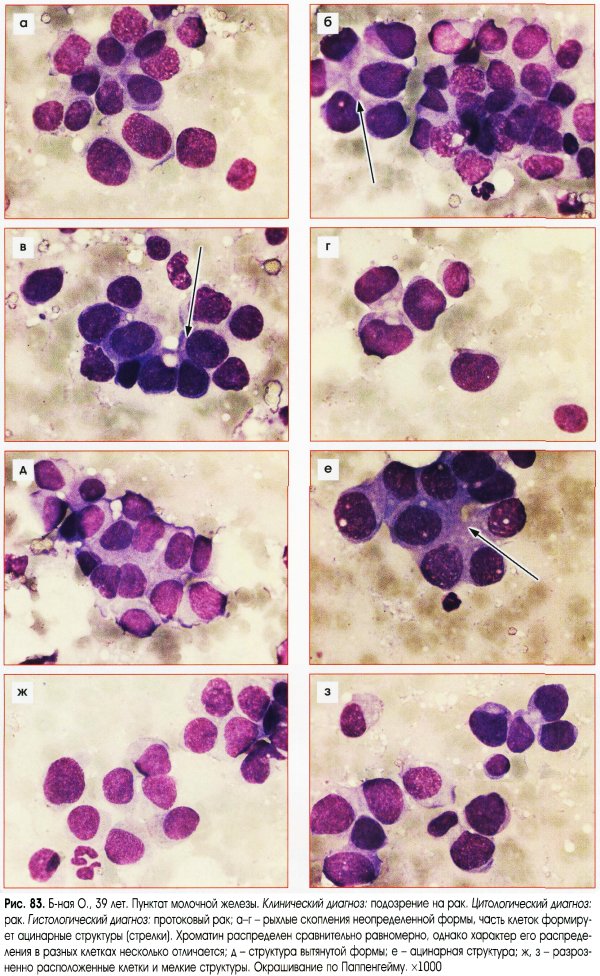 Обратите внимание, что во время производственного процесса могут быть обнаружены ошибки, которые могут повлиять на содержание, и все юридические оговорки, относящиеся к журналу, имеют отношение.
Обратите внимание, что во время производственного процесса могут быть обнаружены ошибки, которые могут повлиять на содержание, и все юридические оговорки, относящиеся к журналу, имеют отношение.
Ссылки
1. Эпштейн Дж. И., Амин М.Б., Рейтер В.Р., Мостофи Ф.К. Всемирная организация здравоохранения / Международное общество урологической патологии согласовали классификацию уротелиальных (переходно-клеточных) новообразований мочевого пузыря.Комитет конференции по консенсусу по мочевому пузырю. Am J Surg Pathol. 1998 декабрь; 22 (12): 1435–1448. [PubMed] [Google Scholar] 2. Эпштейн Д.И., Амин МБ, Рейтер В.Е. Интерпретация биопсии мочевого пузыря. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2010. Нормальная анатомия мочевого пузыря и варианты нормальной гистологии; С. 1–13. [Google Scholar] 3. Reuter VE. Гистология для патологов 3ед. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2010. Мочевой пузырь, мочеточник и почечная лоханка; С. 910–922. [Google Scholar] 4. Банерджи Суман К., доктор медицины, доктор философии, Лопес-Бельтран Антонио.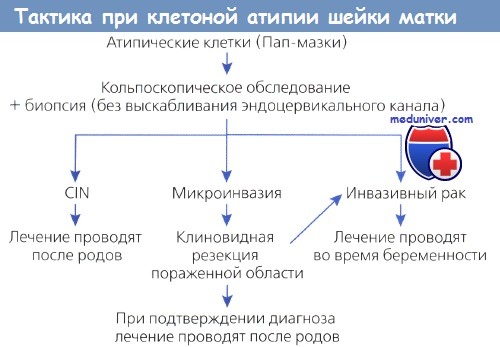 , MD Уротелиальная дисплазия и ее мимики. Обзоры случаев патологии. Июль-август 2008 г .; 13 (4): 149–153. [Google Scholar] 5. Амин МБ, Маккенни Дж. К., Панер Г. П., Гензель Д. Е., Гриньон Д. Д., Монтирони Р., Лин О, Джорда М., Дженкинс Л. К., Солоуэй М., Эпштейн Д. И., Рейтер В. Е.. Международная консультация ICUD-EAU по раку мочевого пузыря 2012: Патология. Eur Urol. 2012 Oct 5; [PubMed] [Google Scholar] 6. Koss LG. Опухоли мочевого пузыря, Fasicle 11. Вашингтон, округ Колумбия: Институт патологии вооруженных сил; 1975. [Google Scholar] 7. Горин М.А., Айятурай Р., Солоуэй М.С.Диагностика и лечение рака мочевого пузыря: как мы можем улучшить? Postgrad Med. 2012 Май; 124 (3): 28–36. [PubMed] [Google Scholar] 8. Сестерхенн I, ван дет Кваст К.Т., Мазероллес С. Пренепластические непапиллярные поражения и состояния мочевого пузыря: обновленная информация на основе международной консультации в Анконе. Арка Вирхова. 2002 Янв; 440 (1): 3–11. [PubMed] [Google Scholar] 9. Заутер Г., Альгаба Ф., Амин М.
, MD Уротелиальная дисплазия и ее мимики. Обзоры случаев патологии. Июль-август 2008 г .; 13 (4): 149–153. [Google Scholar] 5. Амин МБ, Маккенни Дж. К., Панер Г. П., Гензель Д. Е., Гриньон Д. Д., Монтирони Р., Лин О, Джорда М., Дженкинс Л. К., Солоуэй М., Эпштейн Д. И., Рейтер В. Е.. Международная консультация ICUD-EAU по раку мочевого пузыря 2012: Патология. Eur Urol. 2012 Oct 5; [PubMed] [Google Scholar] 6. Koss LG. Опухоли мочевого пузыря, Fasicle 11. Вашингтон, округ Колумбия: Институт патологии вооруженных сил; 1975. [Google Scholar] 7. Горин М.А., Айятурай Р., Солоуэй М.С.Диагностика и лечение рака мочевого пузыря: как мы можем улучшить? Postgrad Med. 2012 Май; 124 (3): 28–36. [PubMed] [Google Scholar] 8. Сестерхенн I, ван дет Кваст К.Т., Мазероллес С. Пренепластические непапиллярные поражения и состояния мочевого пузыря: обновленная информация на основе международной консультации в Анконе. Арка Вирхова. 2002 Янв; 440 (1): 3–11. [PubMed] [Google Scholar] 9. Заутер Г., Альгаба Ф., Амин М. Б., Буш К. Классификация опухолей, патология и генетика Всемирной организации здравоохранения: опухоли мочевыделительной системы и мужских половых органов.В: Эпштейн JI, Eble JN, Sesterhenn I, Sauter G, редакторы. Опухоли мочевыводящей системы. Лион: IARC Press; 2004. С. 89–157. [Google Scholar] 10. Cheng L, Cheville JC, Neumann RM, Bostwick DG. Естественное течение уротелиальной дисплазии мочевого пузыря. Am J Surg Pathol. 1999 апр; 23 (4): 443–447. [PubMed] [Google Scholar] 11. Филиатро Л., Маккей Р.М., Патрик Д.М., Роско Д.Л., Куан Дж., Брубахер Дж., Коллинз К.М. Устойчивость к антибиотикам в изолятах, полученных от женщин с внебольничными инфекциями мочевыводящих путей, обращающихся в отделение неотложной помощи.CJEM. 2012 Сен; 14 (5): 295–305. [PubMed] [Google Scholar] 12. Эпштейн Д.И., Амин МБ, Рейтер В.Е. Интерпретация биопсии мочевого пузыря. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2010. Цистит; С. 226–259. [Google Scholar] 13. Lane Z, Epstein JI. Полиповидный / папиллярный цистит: серия из 41 случая, ошибочно диагностированная как папиллярная уротелиальная неоплазия.
Б., Буш К. Классификация опухолей, патология и генетика Всемирной организации здравоохранения: опухоли мочевыделительной системы и мужских половых органов.В: Эпштейн JI, Eble JN, Sesterhenn I, Sauter G, редакторы. Опухоли мочевыводящей системы. Лион: IARC Press; 2004. С. 89–157. [Google Scholar] 10. Cheng L, Cheville JC, Neumann RM, Bostwick DG. Естественное течение уротелиальной дисплазии мочевого пузыря. Am J Surg Pathol. 1999 апр; 23 (4): 443–447. [PubMed] [Google Scholar] 11. Филиатро Л., Маккей Р.М., Патрик Д.М., Роско Д.Л., Куан Дж., Брубахер Дж., Коллинз К.М. Устойчивость к антибиотикам в изолятах, полученных от женщин с внебольничными инфекциями мочевыводящих путей, обращающихся в отделение неотложной помощи.CJEM. 2012 Сен; 14 (5): 295–305. [PubMed] [Google Scholar] 12. Эпштейн Д.И., Амин МБ, Рейтер В.Е. Интерпретация биопсии мочевого пузыря. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2010. Цистит; С. 226–259. [Google Scholar] 13. Lane Z, Epstein JI. Полиповидный / папиллярный цистит: серия из 41 случая, ошибочно диагностированная как папиллярная уротелиальная неоплазия. Am J Surg Pathol. 2008 Май; 32 (5): 758–764. [PubMed] [Google Scholar] 14. Молодой Р.Х. Папиллярный и полиповидный цистит. Отчет о восьми случаях. Am J Surg Pathol.Июль 1988 г., 12 (7): 542–546. [PubMed] [Google Scholar] 15. Херави М., Парвани А.В., Чан Т., Али С.З., Эпштейн Д.И. Связанные с вирусом полиомы клеточные изменения в образцах биопсии мочи и мочевого пузыря: цито-гистологическая корреляция. Am J Surg Pathol. 2006 Март; 30 (3): 345–350. [PubMed] [Google Scholar] 16. Войчик Е.М., Миллер М.К., Райт BC, Велтри Р.В., О’Дауд Г.Дж. Сравнительный анализ содержания ДНК в уротелиальных клетках, инфицированных полиомавирусом, уротелиальной дисплазии и переходно-клеточной карциноме высокой степени. Анальный Квант Цитол Гистол.1997 Октябрь; 19 (5): 430–436. [PubMed] [Google Scholar] 17. Косс Л.Г., Шерман А.Б., Эппич Э. Анализ изображений и содержание ДНК уротелиальных клеток, инфицированных полиомавирусом человека. Anal Quant Cytol. 1984 июн; 6 (2): 89–94. [PubMed] [Google Scholar] 18. Тейлор Д.
Am J Surg Pathol. 2008 Май; 32 (5): 758–764. [PubMed] [Google Scholar] 14. Молодой Р.Х. Папиллярный и полиповидный цистит. Отчет о восьми случаях. Am J Surg Pathol.Июль 1988 г., 12 (7): 542–546. [PubMed] [Google Scholar] 15. Херави М., Парвани А.В., Чан Т., Али С.З., Эпштейн Д.И. Связанные с вирусом полиомы клеточные изменения в образцах биопсии мочи и мочевого пузыря: цито-гистологическая корреляция. Am J Surg Pathol. 2006 Март; 30 (3): 345–350. [PubMed] [Google Scholar] 16. Войчик Е.М., Миллер М.К., Райт BC, Велтри Р.В., О’Дауд Г.Дж. Сравнительный анализ содержания ДНК в уротелиальных клетках, инфицированных полиомавирусом, уротелиальной дисплазии и переходно-клеточной карциноме высокой степени. Анальный Квант Цитол Гистол.1997 Октябрь; 19 (5): 430–436. [PubMed] [Google Scholar] 17. Косс Л.Г., Шерман А.Б., Эппич Э. Анализ изображений и содержание ДНК уротелиальных клеток, инфицированных полиомавирусом человека. Anal Quant Cytol. 1984 июн; 6 (2): 89–94. [PubMed] [Google Scholar] 18. Тейлор Д. К., Багаван Б.С., Ларсен М.П., Кокс Дж. А., Эпштейн Д. И.. Папиллярная уротелиальная гиперплазия. Предшественник папиллярных новообразований. Am J Surg Pathol. 1996 декабрь; 20 (12): 1481–1488. [PubMed] [Google Scholar] 19. Swierczynski SL, Epstein JI. Прогностическое значение атипичной папиллярной гиперплазии уротелия.Hum Pathol. 2002 Май; 33 (5): 512–517. [PubMed] [Google Scholar] 20. Аббас А.К., Астер JC, Фаусто Н., Кумар В. Кумар: Патологическая основа болезни Роббинса и Котрана, Профессиональное издание. 8-е изд. Филадельфия: Сондерс; 2009. Клеточные реакции на стресс и токсические оскорбления: адаптация, травмы и смерть. [Google Scholar] 21. Эпштейн Д.И., Амин МБ, Рейтер В.Е. Интерпретация биопсии мочевого пузыря. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2010. Плоские уротелиальные поражения; С. 14–42. [Google Scholar] 22.Lagwinski N, Thomas A, Stephenson AJ, Campbell S, Hoschar AP, El-Gabry E, Dreicer R, Hansel DE. Плоскоклеточный рак мочевого пузыря: клинико-патологический анализ 45 случаев.
К., Багаван Б.С., Ларсен М.П., Кокс Дж. А., Эпштейн Д. И.. Папиллярная уротелиальная гиперплазия. Предшественник папиллярных новообразований. Am J Surg Pathol. 1996 декабрь; 20 (12): 1481–1488. [PubMed] [Google Scholar] 19. Swierczynski SL, Epstein JI. Прогностическое значение атипичной папиллярной гиперплазии уротелия.Hum Pathol. 2002 Май; 33 (5): 512–517. [PubMed] [Google Scholar] 20. Аббас А.К., Астер JC, Фаусто Н., Кумар В. Кумар: Патологическая основа болезни Роббинса и Котрана, Профессиональное издание. 8-е изд. Филадельфия: Сондерс; 2009. Клеточные реакции на стресс и токсические оскорбления: адаптация, травмы и смерть. [Google Scholar] 21. Эпштейн Д.И., Амин МБ, Рейтер В.Е. Интерпретация биопсии мочевого пузыря. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2010. Плоские уротелиальные поражения; С. 14–42. [Google Scholar] 22.Lagwinski N, Thomas A, Stephenson AJ, Campbell S, Hoschar AP, El-Gabry E, Dreicer R, Hansel DE. Плоскоклеточный рак мочевого пузыря: клинико-патологический анализ 45 случаев.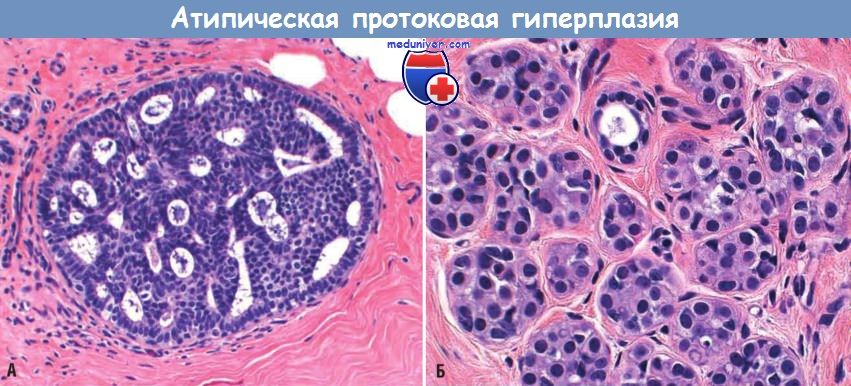 Am J Surg Pathol. 2007 декабрь; 31 (12): 1777–1787. [PubMed] [Google Scholar] 23. Смит А.К., Гензель Д.Е., Джонс Дж. С.. Роль cystitis cystica et glandularis и кишечной метаплазии в развитии рака мочевого пузыря. Урология. 2008 Май; 71 (5): 915–918. [PubMed] [Google Scholar] 24. Корика Ф.А., Хусманн Д.А., Черчилль Б.М., Янг Р.Х., Пачелли А., Лопес-Бельтран А., Боствик Д.Г.Кишечная метаплазия не является сильным фактором риска рака мочевого пузыря: исследование 53 случаев с долгосрочным наблюдением. Урология. 1997 сентябрь; 50 (3): 427–431. [PubMed] [Google Scholar] 25. Бехзатоглу К. Злокачественные поражения желез и дифференцировка желез при инвазивной / неинвазивной уротелиальной карциноме мочевого пузыря. Энн Диаг Патол. 2011 декабрь; 15 (6): 422–426. [PubMed] [Google Scholar] 26. Elem B, Alam SZ. Тотальная кишечная метаплазия с очаговой аденокарциномой в нарушенном мочевом пузыре, инфицированном шистосомой.Br J Urol. 1984 июн; 56 (3): 331–333. [PubMed] [Google Scholar] 27. Чан Т.Ю., Эпштейн Д.
Am J Surg Pathol. 2007 декабрь; 31 (12): 1777–1787. [PubMed] [Google Scholar] 23. Смит А.К., Гензель Д.Е., Джонс Дж. С.. Роль cystitis cystica et glandularis и кишечной метаплазии в развитии рака мочевого пузыря. Урология. 2008 Май; 71 (5): 915–918. [PubMed] [Google Scholar] 24. Корика Ф.А., Хусманн Д.А., Черчилль Б.М., Янг Р.Х., Пачелли А., Лопес-Бельтран А., Боствик Д.Г.Кишечная метаплазия не является сильным фактором риска рака мочевого пузыря: исследование 53 случаев с долгосрочным наблюдением. Урология. 1997 сентябрь; 50 (3): 427–431. [PubMed] [Google Scholar] 25. Бехзатоглу К. Злокачественные поражения желез и дифференцировка желез при инвазивной / неинвазивной уротелиальной карциноме мочевого пузыря. Энн Диаг Патол. 2011 декабрь; 15 (6): 422–426. [PubMed] [Google Scholar] 26. Elem B, Alam SZ. Тотальная кишечная метаплазия с очаговой аденокарциномой в нарушенном мочевом пузыре, инфицированном шистосомой.Br J Urol. 1984 июн; 56 (3): 331–333. [PubMed] [Google Scholar] 27. Чан Т.Ю., Эпштейн Д. И. Аденокарцинома мочевого пузыря in situ. Am J Surg Pathol. Июль 2001 г .; 25 (7): 892–899. [PubMed] [Google Scholar] 28. Монтирони Р., Лопес-Бельтран А., Скарпелли М., Маццуккелли Р., Ченг Л. Морфологическая классификация и определение доброкачественных, пренеопластических и неинвазивных неопластических поражений мочевого пузыря. Гистопатология. 2008 декабрь; 53 (6): 621–633. [PubMed] [Google Scholar] 29. Сейбель Дж. Л., Прасад С., Вайс Р. Э., Бансила Е., Эпштейн Дж.Ворсинчатая аденома мочевыводящих путей: поражение, часто связанное со злокачественными новообразованиями. Hum Pathol. 2002 Февраль; 33 (2): 236–241. [PubMed] [Google Scholar] 30. Ченг Л., Монтирони Р., Боствик Д.Г. Ворсинчатая аденома мочевыводящих путей: сообщение о 23 случаях, в том числе 8 с сопутствующей аденокарциномой. Am J Surg Pathol. Июль 1999 г .; 23 (7): 764–771. [PubMed] [Google Scholar] 31. Лопес-Бельтран А., Луке Р.Дж., Маццучелли Р., Скарпелли М., Монтирони Р. Изменения, происходящие в уротелии с помощью традиционных и новейших терапевтических процедур при раке мочевого пузыря.
И. Аденокарцинома мочевого пузыря in situ. Am J Surg Pathol. Июль 2001 г .; 25 (7): 892–899. [PubMed] [Google Scholar] 28. Монтирони Р., Лопес-Бельтран А., Скарпелли М., Маццуккелли Р., Ченг Л. Морфологическая классификация и определение доброкачественных, пренеопластических и неинвазивных неопластических поражений мочевого пузыря. Гистопатология. 2008 декабрь; 53 (6): 621–633. [PubMed] [Google Scholar] 29. Сейбель Дж. Л., Прасад С., Вайс Р. Э., Бансила Е., Эпштейн Дж.Ворсинчатая аденома мочевыводящих путей: поражение, часто связанное со злокачественными новообразованиями. Hum Pathol. 2002 Февраль; 33 (2): 236–241. [PubMed] [Google Scholar] 30. Ченг Л., Монтирони Р., Боствик Д.Г. Ворсинчатая аденома мочевыводящих путей: сообщение о 23 случаях, в том числе 8 с сопутствующей аденокарциномой. Am J Surg Pathol. Июль 1999 г .; 23 (7): 764–771. [PubMed] [Google Scholar] 31. Лопес-Бельтран А., Луке Р.Дж., Маццучелли Р., Скарпелли М., Монтирони Р. Изменения, происходящие в уротелии с помощью традиционных и новейших терапевтических процедур при раке мочевого пузыря. J Clin Pathol. 2002 сентябрь; 55 (9): 641–647. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Павлидаки П.Г., МакЛеннан Г.Т. Лучевой цистит. J Urol. 2009 сентябрь; 182 (3): 1172–1173. [PubMed] [Google Scholar] 33. Сиддики А., Меламед М.Р., Абби Р. и др. Муцинозная (коллоидная) карцинома мочевого пузыря после длительного применения циклофосфамида при макроглобулинемии Вальденстрема. Am J Surg Pathol. 1996. 20: 500–504. [PubMed] [Google Scholar] 34. Wall RL, Clausen KP. Карцинома мочевого пузыря у пациентов, получающих циклофосфамид.N Engl J Med. 1975. 293: 271–273. [PubMed] [Google Scholar] 35. Plotz PH, Klippel JH, Decker JL, Grauman D, Wolff B, Brown BC, Rutt G. Осложнения со стороны мочевого пузыря у пациентов, получающих циклофосфамид при системной красной волчанке или ревматоидном артрите. Ann Intern Med. 1979, август; 91 (2): 221–223. [PubMed] [Google Scholar] 36. Лоуренс HJ, Simone J, Aur RJA. Геморрагический цистит, вызванный циклофосфамидом, у детей с лейкемией. Рак. 1975; 36: 1572–1576.
J Clin Pathol. 2002 сентябрь; 55 (9): 641–647. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Павлидаки П.Г., МакЛеннан Г.Т. Лучевой цистит. J Urol. 2009 сентябрь; 182 (3): 1172–1173. [PubMed] [Google Scholar] 33. Сиддики А., Меламед М.Р., Абби Р. и др. Муцинозная (коллоидная) карцинома мочевого пузыря после длительного применения циклофосфамида при макроглобулинемии Вальденстрема. Am J Surg Pathol. 1996. 20: 500–504. [PubMed] [Google Scholar] 34. Wall RL, Clausen KP. Карцинома мочевого пузыря у пациентов, получающих циклофосфамид.N Engl J Med. 1975. 293: 271–273. [PubMed] [Google Scholar] 35. Plotz PH, Klippel JH, Decker JL, Grauman D, Wolff B, Brown BC, Rutt G. Осложнения со стороны мочевого пузыря у пациентов, получающих циклофосфамид при системной красной волчанке или ревматоидном артрите. Ann Intern Med. 1979, август; 91 (2): 221–223. [PubMed] [Google Scholar] 36. Лоуренс HJ, Simone J, Aur RJA. Геморрагический цистит, вызванный циклофосфамидом, у детей с лейкемией. Рак. 1975; 36: 1572–1576. [PubMed] [Google Scholar] 37. Fairchild WV, Спенс CR, Solomon HD, Gangai MP.Заболеваемость раком мочевого пузыря после терапии циклофосфамидом. J Urol. 1979, август; 122 (2): 163–164. [PubMed] [Google Scholar] 38. Lane Z, Epstein JI. Псевдокарциноматозная эпителиальная гиперплазия мочевого пузыря, не связанная с предшествующим облучением или химиотерапией. Am J Surg Pathol. 2008 Янв; 32 (1): 92–97. [PubMed] [Google Scholar] 39. Пинке Л.А., Ламм Д.Л. Внутрипузырная иммунотерапия: БЦЖ. В: Лернер, Шенберг, Штернберг, редакторы. Учебник рака мочевого пузыря. 1-й. Оксон: Тейлор и Фрэнсис; 2006. С. 353–358.[Google Scholar] 40. Басси П., Милани С., Менегини А. и др. Клиническое значение патологических изменений после внутрипузырной БЦЖ терапии поверхностного рака мочевого пузыря. Урология. 1992; 40: 175–179. [PubMed] [Google Scholar] 41. Пинтус Дж. Х., Богардс А., Версинк Р., Уилсон BC, Трахтенберг Дж. Фотодинамическая терапия урологических злокачественных новообразований: прошлые и современные подходы.
[PubMed] [Google Scholar] 37. Fairchild WV, Спенс CR, Solomon HD, Gangai MP.Заболеваемость раком мочевого пузыря после терапии циклофосфамидом. J Urol. 1979, август; 122 (2): 163–164. [PubMed] [Google Scholar] 38. Lane Z, Epstein JI. Псевдокарциноматозная эпителиальная гиперплазия мочевого пузыря, не связанная с предшествующим облучением или химиотерапией. Am J Surg Pathol. 2008 Янв; 32 (1): 92–97. [PubMed] [Google Scholar] 39. Пинке Л.А., Ламм Д.Л. Внутрипузырная иммунотерапия: БЦЖ. В: Лернер, Шенберг, Штернберг, редакторы. Учебник рака мочевого пузыря. 1-й. Оксон: Тейлор и Фрэнсис; 2006. С. 353–358.[Google Scholar] 40. Басси П., Милани С., Менегини А. и др. Клиническое значение патологических изменений после внутрипузырной БЦЖ терапии поверхностного рака мочевого пузыря. Урология. 1992; 40: 175–179. [PubMed] [Google Scholar] 41. Пинтус Дж. Х., Богардс А., Версинк Р., Уилсон BC, Трахтенберг Дж. Фотодинамическая терапия урологических злокачественных новообразований: прошлые и современные подходы. J Urol. 2006 апр; 175 (4): 1201–1207. [PubMed] [Google Scholar] 42. Jichlinski P, Leisinger HJ. Фотодинамическая терапия при поверхностном раке мочевого пузыря: прошлое, настоящее и будущее.Urol Res. 2001; 29: 396–405. [PubMed] [Google Scholar] 43. Оксли Дж. Д., Коттрелл А. М., Адамс С., Гиллатт Д. Кетаминовый цистит как имитация карциномы in situ. Гистопатология. 2009 декабрь; 55 (6): 705–708. [PubMed] [Google Scholar] 44. Маккенни Дж. К., Десаи С., Коэн С., Амин МБ. Дискриминационное иммуногистохимическое окрашивание уротелиальной карциномы in situ и неопухолевого уротелия: анализ антигенов цитокератина 20, p53 и CD44. Am J Surg Pathol. 2001 августа; 25 (8): 1074–1078. [PubMed] [Google Scholar] 45. Нетто GJ, Эпштейн JI.Даббс: Диагностическая иммуногистохимия. 3-е изд. Филадельфия: Сондерс; 2010. Иммуногистология простаты, мочевого пузыря, почек и яичек в; С. 593–661. [Google Scholar] 46. Ходжес К. Б., Лопес-Бельтран А., Эмерсон Р. Е., Монтирони Р., Ченг Л. Клиническая полезность иммуногистохимии в диагностике неоплазии мочевого пузыря.
J Urol. 2006 апр; 175 (4): 1201–1207. [PubMed] [Google Scholar] 42. Jichlinski P, Leisinger HJ. Фотодинамическая терапия при поверхностном раке мочевого пузыря: прошлое, настоящее и будущее.Urol Res. 2001; 29: 396–405. [PubMed] [Google Scholar] 43. Оксли Дж. Д., Коттрелл А. М., Адамс С., Гиллатт Д. Кетаминовый цистит как имитация карциномы in situ. Гистопатология. 2009 декабрь; 55 (6): 705–708. [PubMed] [Google Scholar] 44. Маккенни Дж. К., Десаи С., Коэн С., Амин МБ. Дискриминационное иммуногистохимическое окрашивание уротелиальной карциномы in situ и неопухолевого уротелия: анализ антигенов цитокератина 20, p53 и CD44. Am J Surg Pathol. 2001 августа; 25 (8): 1074–1078. [PubMed] [Google Scholar] 45. Нетто GJ, Эпштейн JI.Даббс: Диагностическая иммуногистохимия. 3-е изд. Филадельфия: Сондерс; 2010. Иммуногистология простаты, мочевого пузыря, почек и яичек в; С. 593–661. [Google Scholar] 46. Ходжес К. Б., Лопес-Бельтран А., Эмерсон Р. Е., Монтирони Р., Ченг Л. Клиническая полезность иммуногистохимии в диагностике неоплазии мочевого пузыря. Appl Immunohistochem Mol Morphol. Октябрь 2010; 18 (5): 401–410. [PubMed] [Google Scholar]
Appl Immunohistochem Mol Morphol. Октябрь 2010; 18 (5): 401–410. [PubMed] [Google Scholar]Отчет о вашей патологии: атипичная гиперплазия (груди)
При проведении биопсии груди взятые образцы были изучены под микроскопом врачом-специалистом, имеющим многолетнюю подготовку, под названием патолог .Патологоанатом отправляет вашему врачу отчет с диагнозом для каждого взятого образца. Информация в этом отчете будет использоваться для управления вашим лечением. Следующие вопросы и ответы призваны помочь вам понять медицинский язык, который вы можете найти в отчете о патологии при биопсии молочной железы, такой как игольная биопсия или эксцизионная биопсия.
При пункционной биопсии игла используется для взятия образца из аномальной области. При эксцизионной биопсии удаляется вся аномальная область, часто вместе с некоторыми окружающими нормальными тканями.Иссеченная биопсия очень похожа на операцию по сохранению груди, называемую лампэктомией.
Что означает гиперплазия?
Нормальная грудь состоит из протоков (крошечных трубок), которые заканчиваются группой мешочков, называемых дольками.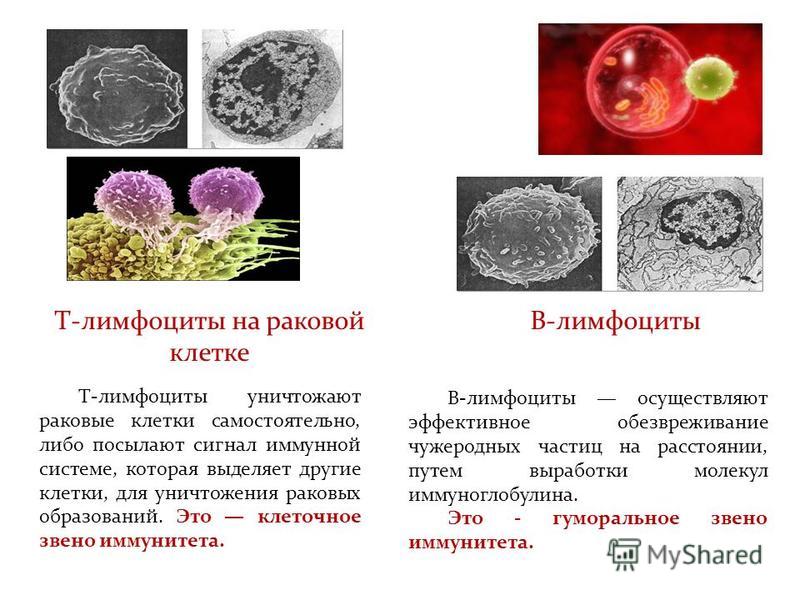 Гиперплазия — это термин, используемый, когда в протоках и / или долях груди наблюдается рост клеток, не являющихся злокачественными. Обычно протоки и дольки выстланы 2 слоями клеток. Гиперплазия означает, что клеток больше, чем обычно, и они больше не выстраиваются только в 2 слоя.Если под микроскопом рост выглядит как нормальный образец, гиперплазию можно назвать обычным . Некоторые новообразования выглядят более ненормально, и их можно назвать атипичной гиперплазией (см. Ниже).
Гиперплазия — это термин, используемый, когда в протоках и / или долях груди наблюдается рост клеток, не являющихся злокачественными. Обычно протоки и дольки выстланы 2 слоями клеток. Гиперплазия означает, что клеток больше, чем обычно, и они больше не выстраиваются только в 2 слоя.Если под микроскопом рост выглядит как нормальный образец, гиперплазию можно назвать обычным . Некоторые новообразования выглядят более ненормально, и их можно назвать атипичной гиперплазией (см. Ниже).
Двумя основными типами гиперплазии груди являются протоковая гиперплазия и дольковая гиперплазия . То, что делает гиперплазию протоковой или дольчатой, больше зависит от того, как клетки выглядят под микроскопом, а не от того, возникает ли гиперплазия внутри протоков или долек.
Что означает, если в моем отчете упоминается Е-кадгерин?
Е-кадгерин — это тест, который патолог может использовать, чтобы определить, является ли гиперплазия протоковой или дольчатой. (Клетки атипичной дольчатой гиперплазии (АЛГ) обычно отрицательны на Е-кадгерин.) Если в вашем отчете не упоминается Е-кадгерин, это означает, что этот тест не нужен для определения того, какой у вас тип гиперплазии.
(Клетки атипичной дольчатой гиперплазии (АЛГ) обычно отрицательны на Е-кадгерин.) Если в вашем отчете не упоминается Е-кадгерин, это означает, что этот тест не нужен для определения того, какой у вас тип гиперплазии.
Что означает, если в моем отчете говорится об атипичной гиперплазии протоков (АДГ)?
При ADH характер роста клеток ненормален и имеет некоторые (но не все) признаки протоковой карциномы in-situ (которая является предраком).Это означает, что ADH еще не является предраком, хотя он связан с повышенным риском развития рака груди в будущем.
Если АДГ обнаруживается при игольчатой биопсии, обычно необходимо удалить больше ткани в этой области, чтобы убедиться, что в груди также нет ничего более серьезного. Удаленная ткань исследуется под микроскопом, и если ничего более серьезного не обнаружено, никакого другого лечения не требуется. Затем пациентка проходит обследование груди и визуализацию груди, например, маммографию.
Если при эксцизионной биопсии обнаружен АДГ, дополнительное хирургическое лечение не требуется, но врач может порекомендовать принимать лекарства, которые помогут снизить риск рака груди.
Какое значение имеет атипичная лобулярная гиперплазия (АЛГ)?
ALH — это также аномальный рост клеток в долях груди, связанный с повышенным риском рака груди. Если ALH обнаружен при игольчатой биопсии, неясно, что лучше всего делать — некоторые врачи считают, что нужно сделать больше операций, чтобы убедиться, что поблизости нет ничего более серьезного, в то время как другие врачи думают, что это так. достаточно, чтобы следить за пациентом с помощью физических осмотров и визуализационных тестов (например, маммографии).Если при иссечении (лампэктомии) обнаруживается АЛГ, пациенты чаще всего наблюдаются без дальнейшего лечения, но ваш врач может порекомендовать принимать лекарства, чтобы снизить риск рака груди.
Что означает, если в моем отчете упоминаются специальные тесты, такие как высокомолекулярный цитокератин (HMWCK), CK903, CK5 / 6, p63, мышечный специфический актин, тяжелая цепь гладкомышечного миозина, кальпонин или кератин?
Это специальные тесты, которые иногда использует патологоанатом для постановки правильного диагноза различных поражений груди. Независимо от того, упоминаются ли в вашем отчете эти тесты или нет, это не влияет на точность вашего диагноза.
Независимо от того, упоминаются ли в вашем отчете эти тесты или нет, это не влияет на точность вашего диагноза.
Что это означает, если в моем отчете также используется любой из следующих терминов: обычная гиперплазия протоков, аденоз, склерозирующий аденоз, лучевой рубец, сложное склерозирующее поражение, папилломатоз, папиллома, апокринная метаплазия, кисты, изменение столбчатых клеток, коллагенозный сферулез, эктазия протока , фиброзно-кистозные изменения, атипия плоского эпителия или столбчатые изменения с выступающими апикальными мордами и выделениями (CAPSS)?
Все это термины для обозначения доброкачественных (незлокачественных) изменений, которые патолог может увидеть под микроскопом.Они не важны при просмотре биоптата, содержащего АДГ или АЛГ.
Что означает, если в моем отчете упоминаются микрокальцификации или кальцификации?
Микрокальцификаты или кальцификаты — это отложения кальция, которые могут быть обнаружены как в незлокачественных, так и в раковых поражениях груди. Их можно увидеть как на маммограммах, так и под микроскопом. Поскольку определенные кальцификаты обнаруживаются в областях, содержащих рак, их присутствие на маммограмме может привести к биопсии этой области.Затем, когда биопсия сделана, патолог осматривает удаленную ткань, чтобы убедиться, что она содержит кальцификаты. Если кальцификаты есть, лечащий врач знает, что при биопсии был взят образец правильного участка (аномальный участок с кальцификациями, который был замечен на маммограмме).
Их можно увидеть как на маммограммах, так и под микроскопом. Поскольку определенные кальцификаты обнаруживаются в областях, содержащих рак, их присутствие на маммограмме может привести к биопсии этой области.Затем, когда биопсия сделана, патолог осматривает удаленную ткань, чтобы убедиться, что она содержит кальцификаты. Если кальцификаты есть, лечащий врач знает, что при биопсии был взят образец правильного участка (аномальный участок с кальцификациями, который был замечен на маммограмме).
Атипичная гиперплазия — Фонд доктора Сьюзан Лав по исследованию рака груди
Чтобы исследовать клетки, удаленные во время биопсии, их необходимо поместить на предметное стекло, окрасить и затем изучить под микроскопом.Клетки оцениваются на основе ряда критериев, включая размер и цвет ядра (центр клетки, содержащей ДНК), внешний вид других структур в цитоплазме (область между ядром и внешней стенкой ячейка), а также общий размер самой ячейки.
Биопсия исследует клетки под микроскопом
На протяжении веков патологи (врачи, которые выявляют заболевания путем изучения клеток и тканей под микроскопом) пытались предсказать, как клетки будут вести себя, основываясь на том, как они выглядят. Мы знаем, что рак возникает при повреждении клетки. Но это повреждение не происходит за один шаг. Вместо этого требуется ряд «ошибок», чтобы клетка трансформировалась из нормальной клетки в раковую, которая обладает способностью бесконтрольно расти и жить вне органа, в котором она зародилась.
Мы знаем, что рак возникает при повреждении клетки. Но это повреждение не происходит за один шаг. Вместо этого требуется ряд «ошибок», чтобы клетка трансформировалась из нормальной клетки в раковую, которая обладает способностью бесконтрольно расти и жить вне органа, в котором она зародилась.
Поскольку наши тела производят сотни миллионов новых клеток каждую секунду, каждый день существуют миллиарды возможностей для ошибок, которые происходят в генетическом коде внутри ДНК клетки. В большинстве случаев наш организм способен найти и исправить или устранить эти ошибки, но не всегда.Некоторые ошибки ускользают. И когда клетки, несущие генетическую ошибку, воспроизводятся, они склонны совершать больше генетических ошибок. Эти ошибки в генетическом коде внутри ДНК могут отражаться на внешнем виде клетки, делая ее ненормальной.
Требуется ряд генетических «ошибок», чтобы клетка трансформировалась из нормальной клетки в раковую.
Но в чем именно заключается проблема, сказать невозможно. Иногда клетки, которые выглядят причудливо, ведут себя странно.Но в других случаях клетки, которые выглядят очень странно, по-прежнему ведут себя довольно нормально. Все зависит от того, какие гены повреждаются, когда клетка воспроизводится, и от микросреды, в которой живут клетки. Кроме того, глядя на клетку на слайде, патолог не имеет возможности узнать, собиралась ли эта клетка восстанавливаться или собиралась. остаться незамеченным. Патологоанатом также не может определить, сколько ошибок произошло в генах и, следовательно, насколько близка клетка к тому, чтобы стать злокачественной. Все, что патологоанатом может сказать наверняка, — это то, что клетка выглядит ненормально и что ей нанесены некоторые повреждения.
Иногда клетки, которые выглядят причудливо, ведут себя странно.Но в других случаях клетки, которые выглядят очень странно, по-прежнему ведут себя довольно нормально. Все зависит от того, какие гены повреждаются, когда клетка воспроизводится, и от микросреды, в которой живут клетки. Кроме того, глядя на клетку на слайде, патолог не имеет возможности узнать, собиралась ли эта клетка восстанавливаться или собиралась. остаться незамеченным. Патологоанатом также не может определить, сколько ошибок произошло в генах и, следовательно, насколько близка клетка к тому, чтобы стать злокачественной. Все, что патологоанатом может сказать наверняка, — это то, что клетка выглядит ненормально и что ей нанесены некоторые повреждения.
Проблема с нынешним методом, который патологи используют для исследования клеток, заключается в том, что он очень субъективен. Патолог должен определить, насколько далеко от нормы выглядит клетка, но есть большие различия в том, что считается нормальным. Вот почему важен опыт патологоанатома, читающего слайды, и почему может быть полезно получить второе мнение от другого патолога. Есть надежда, что в ближайшем будущем патологи смогут анализировать генетический состав ядра напрямую, чтобы определить, насколько повреждена клетка.Это предоставит более точную информацию, чем полученная путем оценки повреждения клетки по ее внешнему виду.
Есть надежда, что в ближайшем будущем патологи смогут анализировать генетический состав ядра напрямую, чтобы определить, насколько повреждена клетка.Это предоставит более точную информацию, чем полученная путем оценки повреждения клетки по ее внешнему виду.
По мере того как патологи узнавали больше о клетках и о том, как они изменяются, стало ясно, что важнее всего то, насколько далеко от нормального выглядит клетка, потому что чем менее нормальна внешность клетки, тем больше вероятность того, что произошло генетическое повреждение. А когда произошло генетическое повреждение, клетка может стать раковой. Это не означает, что поврежденная клетка превратится в раковую; значит, может.Этот рисунок иллюстрирует возможное прогрессирование гиперплазии и / или атипии до инвазивного рака.
Гиперплазия — это первый тип аномалии внешнего вида клетки. Это означает, что в стенках протоков или долек больше клеток, чем можно было бы ожидать, но все эти клетки кажутся нормальными. Диагноз гиперплазии не подвергает вас повышенному риску развития рака груди.
Диагноз гиперплазии не подвергает вас повышенному риску развития рака груди.
Atypia означает, что клетки выглядят иначе, чем нормальные клетки.У вас может быть атипия с гиперплазией, что означает, что клетки выглядят не так, как обычно, и что клеток больше, чем вы ожидаете увидеть. У вас также может быть атипия без гиперплазии. Диагноз атипии не означает, что у вас рак или даже предраковое заболевание. Это означает, что у вас может быть предраковое заболевание. Фактически, большинство женщин с атипией никогда не болеют раком груди. Скорее, диагноз атипии означает, что у вас есть «маркер» повышенного риска развития рака. Повышенный риск для группы женщин с атипией на один процент выше, чем для группы женщин, у которых нет атипии.Если у женщины не разовьется рак груди через 10 лет после того, как ей поставили диагноз атипия, то ее риск значительно снизится. На самом деле, нередко повторная биопсия в той же области груди показывает совершенно нормальные клетки.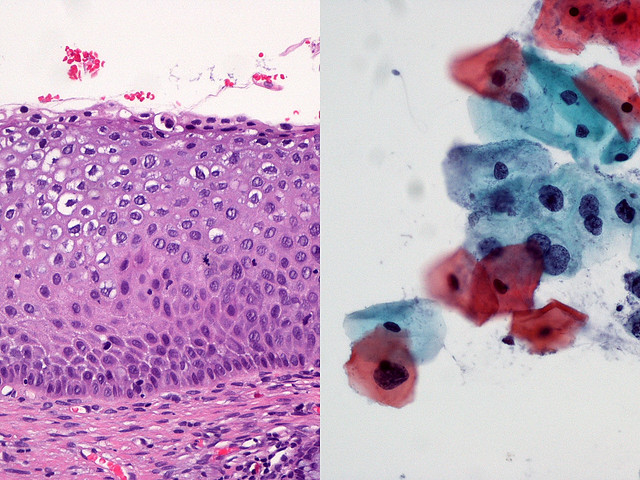
Термины протоковый и дольчатый указывают на происхождение клеток. Протоковый означает, что необычные клетки находятся в протоках, проходах, через которые молоко проходит, чтобы добраться до соска. Дольчатый означает, что необычные клетки находятся в дольках, частях груди, способных производить молоко.Считается, что атипия и гиперплазия обратимы, хотя неясно, что может вернуть их к норме. Атипичная гиперплазия протоков (АДГ) увеличивает риск рака груди, возникающего в той груди, где был обнаружен АДГ. Атипичная лобулярная гиперплазия (АЛГ) увеличивает риск развития рака груди в обеих молочных железах. Однако имейте в виду, что у подавляющего большинства женщин с диагнозом АДГ или АЛГ никогда не развивается рак груди.
Как лечится атипичная гиперплазия?
Если атипичная гиперплазия диагностирована на основе основной биопсии, лучше всего будет провести эксцизионную биопсию, чтобы посмотреть на окружающие ткани и убедиться, что это не только верхушка айсберга.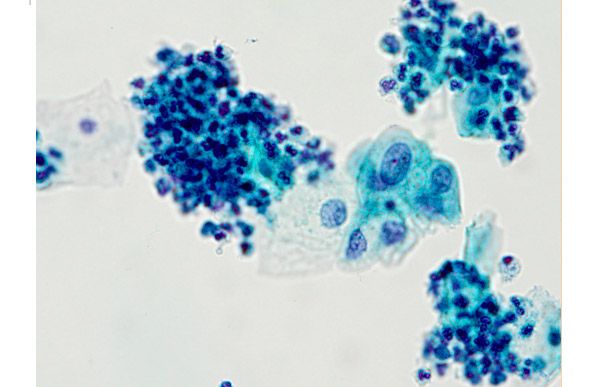 Если диагноз был поставлен на основании эксцизионной биопсии, вы должны получить более подробную информацию о размере и тяжести увиденного.
Если диагноз был поставлен на основании эксцизионной биопсии, вы должны получить более подробную информацию о размере и тяжести увиденного.
Стандартным методом лечения атипичной гиперплазии является тщательное наблюдение. Мониторинг особенно важен, если у вас есть сильная семейная история рака груди. Если вы это сделаете, вы можете попросить своего врача порекомендовать программу для женщин из группы высокого риска. Эти программы предусматривают тщательное наблюдение, что означает клинические осмотры груди каждые шесть месяцев и ежегодную маммографию.
Если вам поставили диагноз атипичная гиперплазия — протоковая или дольчатая — ваш врач может посоветовать вам рассмотреть возможность приема тамоксифена. Если вы в постменопаузе, вам также может подойти ралоксифен (Эвиста). Оба препарата выпускаются в форме таблеток и принимаются ежедневно в течение пяти лет. Тамоксифен — это тип гормональной терапии, который обычно используется для лечения женщин с раком груди, опухоли которых чувствительны к гормонам..jpg)
Тамоксифен используется для профилактики рака груди с 1998 года, когда испытание по профилактике рака груди показало, что он снижает частоту рака груди у женщин с атипией на 86%.Что это обозначает?
В испытании по профилактике рака груди приняли участие 13 388 женщин из группы высокого риска. Половине женщин давали тамоксифен в течение трех-пяти лет, а другой половине — плацебо. После наблюдения за женщинами исследователи обнаружили 23 случая инвазивного рака груди, развившегося у женщин с атипией, которым давали плацебо, в то время как только три случая инвазивного рака груди развились у женщин с атипией, которым давали тамоксифен. Таким образом, несмотря на то, что снижение риска на 86% кажется большим, на самом деле оно представляет собой сравнение трех случаев с 23 случаями.
Кроме того, снижение риска определяется исходя из вашего первоначального риска. Что это обозначает? Допустим, ваш риск развития рака груди в течение следующих пяти лет составлял 20%. Сокращение на 86% составит 86% от 20%, или около четырех процентов.
Ралоксифен был первоначально одобрен для лечения остеопороза. Он был рекомендован женщинам в постменопаузе для снижения риска рака груди с 2006 года, когда исследование STAR (Исследование тамоксифена и ралоксифена) показало, что эти два препарата обладают аналогичными преимуществами для снижения риска.Принимать тамоксифен или ралоксифен небезопасно, если вы беременны или пытаетесь забеременеть. Поскольку и тамоксифен, и ралоксифен имеют побочные эффекты, вам необходимо обсудить риски и преимущества с вашим врачом, поскольку риски могут перевешивать получаемую вами пользу.
Химиопрофилактика тамоксифеном или ралоксифеном не является обязательным лечением. Это выбор. Чтобы решить, подходит ли это вам, нужно взвесить риски и преимущества. И тамоксифен, и ралоксифен не обходятся без побочных эффектов.Исследование по профилактике рака груди показало, что женщины, принимавшие тамоксифен, имели в три раза больше шансов на развитие рака эндометрия (рака слизистой оболочки матки или матки) по сравнению с женщинами, принимавшими плацебо. В частности, исследование показало, что у 53 женщин, принимавших тамоксифен, и у 17 женщин, принимавших плацебо, развился рак эндометрия. Из этих 70 случаев 67 относились к стадии I (что означает, что они были выявлены раньше). Таким образом, хотя это звучит как значительный рост заболеваемости раком матки, на самом деле цифры невелики.Тем не менее, это реальный риск, который необходимо учитывать. Исследование также показало, что женщины, принимавшие тамоксифен, имели в два раза больше шансов на развитие тромбоэмболии легочной артерии (сгусток крови в легких), чем женщины, принимавшие плацебо (28 женщин, принимавших тамоксифен, по сравнению с 13 женщинами, принимавшими плацебо). У них также была более высокая вероятность развития тромбоза глубоких вен (сгусток крови в основной вене), чем у женщин, получавших плацебо (49 женщин принимали тамоксифен по сравнению с 34 женщинами, принимавшими плацебо). Кроме того, у них был немного повышен шанс инсульта (71 женщина принимала тамоксифен по сравнению с 50 женщинами, принимавшими плацебо).Опять же, цифры небольшие. Но это риски, которые необходимо учитывать.
Если у вас есть семейный анамнез рака груди в дополнение к ADH или ALH, и вы хотите больше узнать о том, может ли ваш семейный анамнез повлиять на риск рака груди, вам следует записаться на прием к генетическому консультанту, чтобы обсудить тестирование на наследственность. мутации гена рака молочной железы, называемые BRCA1 и BRCA2, которые повышают риск рака груди и яичников у женщин. Национальный институт рака и Национальное общество консультантов по генетическим вопросам могут помочь вам найти ближайшего к вам генетического консультанта.Согласно Закону о доступном медицинском обслуживании, генетическое консультирование и тестирование покрываются женщинами из групп высокого риска.
Если вы решите пройти генетическое тестирование и окажется, что у вас есть одна из мутаций гена BRCA, повышающая риск рака груди и яичников у женщин, ваш врач может посоветовать вам рассмотреть возможность двусторонней профилактической мастэктомии (удаление обеих молочных желез).

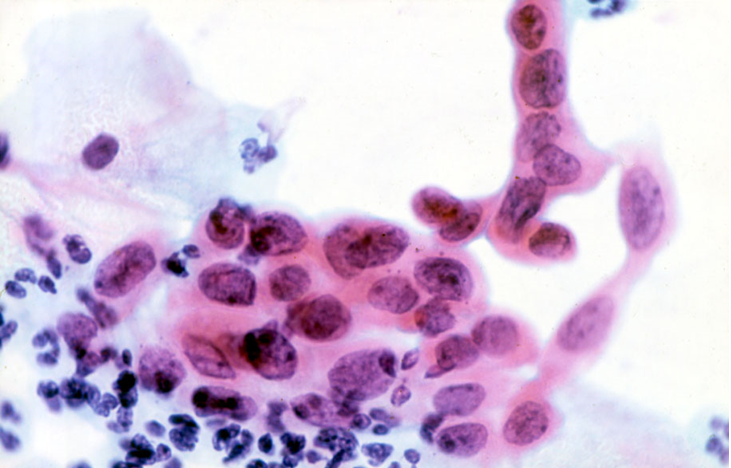

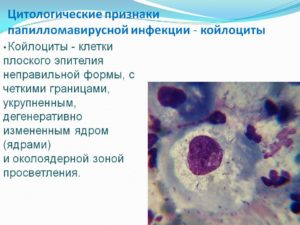 ;
; Oncol. — 1997. — №64(1). — р.166-70.
Oncol. — 1997. — №64(1). — р.166-70.  — р.186-
— р.186-  — 2002. — №287(16). — р.2120-9.
— 2002. — №287(16). — р.2120-9.  ;
; , Coutlee F., Franco E., Hankins C. Human papillomavirus and HIV coinfection and the risk of neoplasias of the lower genital tract: a review of recent developments // CMAJ. — 2003. — №169(5). — р.431-4.
, Coutlee F., Franco E., Hankins C. Human papillomavirus and HIV coinfection and the risk of neoplasias of the lower genital tract: a review of recent developments // CMAJ. — 2003. — №169(5). — р.431-4.  1906-15.
1906-15.
 В этой ситуации атипия уходит, когда прекращается воспаление.
В этой ситуации атипия уходит, когда прекращается воспаление.