Разработка состава, технологии получения, биологические исследования лекарственного сиропа с этилметилгидроксипиридина сукцинатом для профилактики и лечения гипоксических состояний
Введение. Успехи биофармации, как науки, дают возможность для любой лекарственной формы при конструировании, основываться на ее базовых положениях. Одними из факторов фармацевтических, напрямую связанными с конечным фармакологическим эффектом, являются лекарственная форма и комплекс вспомогательных веществ. Не исключение из правила, такая лекарственная форма жидкая – как сиропы. Технологические исследования разработки лекарственной формы предусматривают решение вопросов и биодоступности, и стабильности, создания комфортных условий приема и в т.ч. приемлемых органолептических признаков. В конечном результате, все выше перечисленное обеспечивает необходимые потребительские свойства: внешний вид лекарственной формы, её органолептические показатели, которые имеют определённое психологическое воздействие, способствующее повышению эффективности лекарственной терапии для групп больных всех возрастных категорий. Поэтому, немаловажным, является тщательный подбор разных групп веществ вспомогательных при конструировании лекарственных препаратов, обеспечивающих в совокупности удобство, комфортность лечения [1, 2, 3].
Поэтому, немаловажным, является тщательный подбор разных групп веществ вспомогательных при конструировании лекарственных препаратов, обеспечивающих в совокупности удобство, комфортность лечения [1, 2, 3].
Основные исследования технологии получения сиропов призваны оптимизировать уже имеющиеся составы и расширить номенклатуру сиропов за счет использующихся уже лекарственных веществ [4].
По данным Синевой Т.Д. 30,3% среди сиропов, присутствующих в Государственном реестре, на долю секретолитиков приходится, Н1-антигистаминных – 13,8%, противокашлевых – 6,2%, витаминных и витаминоподобных средств – 5,5%, слабительных, стимуляторов гемопоэза – по 4,1%, общетонизирующих и адаптогенов – 3,4%, макро- и микроэлементов – 2,7%. Зарегистрированы также сиропы гомеопатические [5].
Анализируя выше изложенное, пришли к выводу, что отдельной группы сиропов, содержащих антиоксиданты и антигипоксанты нет [6].
На сегодняшний день, имеются только работы по разработке состава сиропа с гипоксеном (натрия поли(дигидроксифенилен)тиосульфонатом. Гипоксен не столь широко применяется в медицинской практике, возможно, это связано с тем, что капсулируемая форма – это его единственная зарегистрированная форма выпуска (Максименкова К.И., 2017 г.).
Гипоксен не столь широко применяется в медицинской практике, возможно, это связано с тем, что капсулируемая форма – это его единственная зарегистрированная форма выпуска (Максименкова К.И., 2017 г.).
Достаточно разнообразны вспомогательные вещества, входящие в состав выпускаемых сиропов с синтетическими лекарственными веществами, в соответствии с данными РЛС и «Видаль» [7, 8, 9].
Наиболее часто, из подсластителей, применяют сахарозу, декстрозу, глицерол, сорбит, сироп мальтитный, сахарный, сироп инвертный, солода экстракт, аспартам, натрия сахаринат, натрия цикламат и некоторые другие.
Как ароматизаторы широко используются – масла эфирные: апельсина, корицы, аниса; ароматизаторы грейпфрутовый, абрикосовый, апельсиновый, карамельно-ванильный, вишневый, малиновый, персиковый, сливочный, кремовый, ананасовый, ромовый; апельсиновая, мандариновая, вишневая эссенции, фруктовая смешанная, ментол, ванилин натуральный. Стабилизаторы (химические) – это прежде всего кислоты: лимонная, аскорбиновая, молочная, винная и хлористоводородная, натрия ЭДТА, цитрат и метабисульфит.
Как консерванты зарекомендовали себя – бензоат натрия, бензойная кислота, калия сорбат, нипагин, спирт этиловый.
Известно, что использование вспомогательных веществ, может сказаться на качестве лекарственной формы как положительно, так и отрицательно. Поэтому, корректируя цвет, вкус и запах, предпочтительно использовать натуральные осветленные соки фруктов и ягод.
Среди обширного перечня антиоксидантов и антигипоксантов препаратом выбора зачастую выступает этилметилгидроксипиридина сукцинат, который блокирует свободно-радикальное окисление, защищает мембраны клеток от повреждения и, вместе с тем, обладает ноотропным и выраженным антигипоксическим действием.
Кроме того, если рассматривать с этиопатогенетической точки зрения панкреатит как заболевание, основой которого является агрессия ферментативной природы [10], то применение сиропа с мексидолом может быть оправданным и при таких заболеваниях как сахарный диабет и метаболический синдром. Внутриацинарная активация панкреатических ферментов и развитие феномена «уклонения ферментов в кровь» сопровождается снижением энергетической эффективности окислительных процессов, повышением скорости перекисного окисления липидов и недостаточностью антиоксидантной защиты (АОЗ) [11, 12].
Целью исследования явились технологические исследования по разработке состава и технологии сиропа с этилметилгидроксипиридина сукцинатом, на основе сорбита и фруктозы, что позволит существенно расширить возможности применения данного препарата в детской практике и в такой обширной, к сожалению, нозологической группе – как больные сахарным диабетом, так как последний, существенно снижает гипоксические эффекты в паренхиме поджелудочной железы, а также оценке биологической активности предлагаемой лекарственной формы.
Материалы и методы исследования.
Технологическая схема получения сиропов следующая:
- Получение осветленных соков.
- Приготовление сиропов.
- Добавление мексидола, консерванта.
Для маскировки вкуса, цвета и запаха мы использовали натуральные продукты – малину и вишню.
Сорбитный, фруктозный сиропы получали в соответствии со стандартной методикой получения сиропа (ГФ-XII), оценку качества полученных сиропов проводили согласно ОФС 1. 4.1.0012.15 (ГФ-XIII).
4.1.0012.15 (ГФ-XIII).
Получали вишневый сироп (Sirupus Cerasi) и малиновый сироп (Sirupus Rubi idaei). Вишневый и малиновый сиропы готовили путем растворения 67 частей сахара в 32,5 частях перебродившего прозрачного ягодного сока, 0,5 частей натрия бензоата. Далее использовали 12,5% мексидола и 87,5% полученного сиропа.
При получении осветленных соков использовали следующую методику.
Малины и вишни свежие ягоды содержат воды до 82% и в числе веществ растворенных сахара до 10% (сахароза и инвертный сахар), органические кислоты (1,3-2,7% в пересчете на кислоту яблочную), пектины, дубильные вещества, красящие вещества и аскорбиновую кислоту (примерно 25 мг). Процесс приготовления сиропов ягодных начинали с сортировки сырья, для чего отбирали неповрежденные и зрелые плоды, удаляли попавшие в качестве примеси веточки и листья, плодоножки. Отсортированные ягоды далее превращали в кашицеобразную массу, с помощью дробилки.
Для получения стабильных сиропов из ягодных соков удаляли пектиновые вещества. В противном случае при кипячении с сахаром они могут вызвать желеобразование.
В противном случае при кипячении с сахаром они могут вызвать желеобразование.
Измельченную ягодную массу помещали в широкогорлые стеклянные баллоны, наполняя их примерно на 2/3 емкости, сверху посыпали небольшим количеством фруктозы (сорбита), закрывали баллоны пробками с двумя отверстиями и оставляли бродить при температуре 20-25 °С в течении нескольких дней. В одно отверстие пробки вставляли стеклянную трубку, нижний конец которой опускали до дна сосуда. В другое отверстие вставляли изогнутую стеклянную трубку, нижний конец которой под пробкой, а верхний опускали в сосуд с водой (чтобы можно было следить за выделением СО2). Смесь время от времени перемешивали покачиванием. Брожение считается законченным тогда, когда прекратилось выделение СО2. От прибавления спирта в пробе профильтрованного сока не появляется осадок.
Перебродившую ягодную массу процеживали, а остаток отжимали и присоединяли к первой порции сока.
Собранный сок ягодный отстаивали в течение 2-3 дней, после чего его осторожно сливали с осадка, фильтруя и немедленно готовя сироп [11].
Для этого сок в сироповарочном котле , нагревали до 70 °С, растворяли фруктозу (сорбит) в соответствующей пропорции и давали сиропу вскипеть (снимая пену), после чего сливали его в стеклянную посуду, при необходимости фильтруя через тройной слой марли. Далее добавляли мексидол и натрия бензоат [4].
У готовой лекарственной формы pH определяли потенциометрически при помощи HI 2210 – настольного рН-метр компании Hanna Instruments с автоматической калибровкой.
Плотность разработанных сиропов определяли при помощи стеклянного пикнометра.
Антиоксидантную и мембраностабилизирующую активность разработанных сиропов изучали используя методику на парамециях.
Биологическая характеристика продукта проводилась наParametium caudatum, образцы которых были отобранны из естественных мест обитания отдельных клонов (от одной особи бесполым путем). Культура инфузорий находилась в среде Л.К. Лозина-Лозинского [13, 14].
Пищей для парамеций являлись Rhadotorula gracilis – живые дрожжи с пшеничной мукой.
С помощью пероксида водорода (1%) и спирта этилового (14%) воспроизводили патологическую модель повреждения мембраны клетки, в последствии проводили на этой модели изучение протективной активности по отношению к клеточным ядам. При добавлении спирта этилового происходит повреждении белковой части биомембраны, а при добавлении пероксида водорода – перекисное окисление липидов (ПОЛ) мембраны. Соответственно, удлинение жизни парамеций, при добавлении разработанных лекарственных препаратов, может характеризовать наличие мембраностабилизирующего и антиоксидантного эффектов. [14, 15]
Результаты и их обсуждение.
Нами были получены четыре фруктовых сиропа с мексидолом:
- Сироп малиновыйна фруктозе с мексидолом;
- Сироп малиновыйна сорбите с мекисдолом;
- Сироп вишневыйна фруктозе с мексидолом;
- Сироп вишневый на сорбите с мекисдолом.
По органолептическим свойствам сиропы представляет собой:
- Сироп вишневый, темно-вишневого цвета, с приятным характерным запахом (от присутствия бензальдегида, образовавшегося в результате расщепления амигдалина, находившегося в косточках) и кисловато-сладким вкусом, прозрачный.

- Сироп малиновый ярко-малинового цвета, с приятным запахом и кисловато-сладким вкусом, пррозрачный.
Определение pH сиропа с мексидолом (этилметилгидроксипиридина сукцинатом). Показатель pH всех четырех лекарственных сиропов с мексидолом находится в диапазоне от 4,9 до 5,1.
Определение плотности сиропа с мексидолом (этилметилгидроксипиридина сукцинатом). Плотности в диапазоне от 1,23 до 1,25.
Следующим этапом наших исследований было определение антиоксидантной и мембраностабилизирующей акстивности разработанных сиропов на парамециях.
Разработанные сиропы существенно увеличивали время остановки парамеций под воздействием клеточных ядов – пероксида водорода и спирта этилового.
Мембраностабилизирующую активность разработанных сиропов характеризует увеличение времени движения парамеций до полной остановки, под воздействием спирта этилового, компоненты которого препятствуют повреждению белковой части биомембраны.
Повышение времени движения парамеций при добавлении 1% раствора пероксида водорода свидетельствует о наличии антиоксидантной активности. Это связано со способностью мексидола тормозить перекисное окисление липидов мембраны.
Это связано со способностью мексидола тормозить перекисное окисление липидов мембраны.
Таблица 1
Влияние клеточных ядов спирта этилового 14% и пероксида водорода 1% на срок жизни парамеций
Тable 1
Effect of cellular poisons of 14% ethyl alcohol and 1% hydrogen peroxide on the lifetime of Paramecia
Парамеции | Время жизни, мин | |
спирт этиловый 14% | перекись водорода 1% | |
Интактные | живут бесконечно | |
Контроль | 2,43±0,02 | 1,50±0,02 |
Сироп малиновый на фруктозе с мексидолом | 3,45±0,02 | 2,52±0,02 |
Сироп малиновый на сорбите с мекисдолом | 3,21±0,02 | 2,15±0,02 |
Сироп вишневый на фруктозе с мексидолом | 3,55±0,02 | 2,62±0,02 |
Сироп вишневый на сорбите с мекисдолом | 3,17±0,02 | 2,07±0,02 |
Полученный экстракт продлевает срок жизни парамеций под действием ядов клеточных, спирта этилового и перекиси водорода на 1. 0 и 1.03 минуты, соответственно, в среднем. Данный тест подтверждает наличие мембрано-стабилизирующего и антиоксидантного эффекта у разработанных сиропов.
0 и 1.03 минуты, соответственно, в среднем. Данный тест подтверждает наличие мембрано-стабилизирующего и антиоксидантного эффекта у разработанных сиропов.
Выводы:
- Разработан состав лекарственного сиропа с мексидолом, который представляет собой однородную вязкую жидкость малинового и вишневого цвета с кислосладким вкусом, pH 4,9-5,1, плотностью 1,23-25. Количество этилметилгидроксипиридина сукцината в сиропе должно быть от 12,0 до 13,0 г в 100 г.
- Разработаны технологическая схема производства сиропов с использованием осветленных соков малины и вишни, на фруктозе и сорбите.
- Проведены биологические исследования на парамециях, которые подтвердили наличие антиоксидантной и мембраностабилизирующей активности разработанной жидкой лекарственной формы – сиропов, что может быть залогом антигипоксантной и нейротропной активности.
В отношении данной статьи не было зарегистрировано конфликта интересов.
Исследование острой токсичности и антигипоксической активности новых металлоком-плексов железа
Резюме:Цель: определить острую токсичность новых металлокомплексов железа производных винилимидазола и исследовать их антигипоксическое действие в сравнении с Ацизолом и известными антигипоксантами: это-мерзолом и гипоксеном. ЛД50 ЛД84) вычисляли графически по методу Миллера и Тейнтера. Изменения окислительного обмена у мышеи’под влиянием наиболее активного соединения оценивали по величинам потребления кислорода и ректальной температуры. Результаты. Исследованные металлокомплексы железа относятся к мало- и умеренно токсичным. Соединение под шифром Тетравим по степени выраженности антигипоксического действия (увеличение продолжительности жизни подопытных мышей по сравнению с контрольными группами на 20-127%) в диапазоне исследуемых доз (5-250 мг/кг, в/б) превосходит другие производные винилимидазола и известные антигипоксанты: этомерзол (25-100 мг/кг, в/б) и гипоксен (50-150 мг/кг, в/б). Заключение. Полученные данные по фармакологической активности Тетравима требуют дальнейшего выяснения механизма антигипоксического действия и проведения клинических исследований с целью внедрения его на фармакологический рынок в качестве перспективного антигипоксанта.
ЛД50 ЛД84) вычисляли графически по методу Миллера и Тейнтера. Изменения окислительного обмена у мышеи’под влиянием наиболее активного соединения оценивали по величинам потребления кислорода и ректальной температуры. Результаты. Исследованные металлокомплексы железа относятся к мало- и умеренно токсичным. Соединение под шифром Тетравим по степени выраженности антигипоксического действия (увеличение продолжительности жизни подопытных мышей по сравнению с контрольными группами на 20-127%) в диапазоне исследуемых доз (5-250 мг/кг, в/б) превосходит другие производные винилимидазола и известные антигипоксанты: этомерзол (25-100 мг/кг, в/б) и гипоксен (50-150 мг/кг, в/б). Заключение. Полученные данные по фармакологической активности Тетравима требуют дальнейшего выяснения механизма антигипоксического действия и проведения клинических исследований с целью внедрения его на фармакологический рынок в качестве перспективного антигипоксанта.
Литература:
1. Баринов А. В., Нечипоренко С.П. Разработан антидот угарного газа. UNIFOR RASHA 2006: 116-117
В., Нечипоренко С.П. Разработан антидот угарного газа. UNIFOR RASHA 2006: 116-117
2. Патент РФ №2331417,20.08.2008)
3. Бабаниязов X.X., Трофимов Б.A., Нечипоренко С.П. и др. Опыт изучения фармакологических свойств ацизола в эксперименте и клинике. Вестник восстановительной медицины 2008; (5): 7-11
5. Арзамасцев E.B., Гуськова ТА., Березовская И.В., Любимов Б. И. и др. Методические указания по изучению общетоксического действия фармакологических веществ: руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М., 2005. С. 41-54
6. Березовская И. В. Классификация химических веществ по параметрам острой токсичности при парентеральных способах введения. Химико-фармацевтический журнал 2003; 37 (3): 32-34
7. Методические рекомендации по экспериментальному изучению препаратов, предлагаемых для клинического изучения в качестве антигипоксических средств / под ред. Л.Д. Лукьяновой. М., 1990.

8. (Катунина Н.П., Катунин М.П. Изучение влияния фенилэтилзамещенных производных 3-оксипиридина на продолжительность жизни мышей при острой гипоксии с гиперкапнией и острой гипобарической гипоксии. Саратовский научно-медицинский журнал 2007; 3 (1): 100-103
9. (Курбанов A.M., Самойлов H.H., Стратиенко E.H. и др. Антигипоксическая активность новых производных 3-оксипиридина. Психофармакол. и биол. наркол. 2006; 6 (1): 1149-1153
10. Стратиенко E.H., Богус С. К., Катунина Н.П. и др. Изучение антигипоксической активности новых металлокомплексных соединений производных алкенилимидазола. Кубанский научный медицинский вестник 2009; (8): 76-78.
Косметические серии :: «Космическое здоровье» :: Зубная паста «Профилактическая»
Защищает десны от повреждений, обеспечивает
профилактику пародонтоза и предотвращает возникновения кариеса. Быстро
устраняет проблемы с зубами и деснами. Восстанавливает дыхательные функции
тканей. Повышает местный иммунитет полости рта.
Фитоальянс «Профилактический» снимает раздражение с десен и языка, устраняет кровоточивость, предотвращает возникновение гингивита: экстракты медвежьего корня, желтой лилии, багульника, тимьяна даурского.
Дента-оксидантный комплекс «Космодент 17» содержит витамин Е и дигидрокверцитин, а также ферменты (лизоцим, пероксидазу), которые расщепляют патогенные микроорганизмы и препятствуют возникновению кариеса.
Базовый комплекс «Кедродент 9» (вода родниковая, кедровое масло, кокамидопропилбетаин, целлюлоза пихтовая, глицерин кедровый) эффективно растворяет и удаляет зубной налет, смягчает слизистую оболочку полости рта.
Глицерофосфат кальция и микрочастицы диоксида кремния, титана и магния оберегают зубную эмаль от повреждений.
Антигипоксант олифен укрепляет десны, уменьшает кровоточивость, обладает бактерицидным и восстанавливающим действием.
Эфирное
масло цитронеллы
и экстракт зеленого кофе создают эффект свежезаваренного кофе, оказывают
бодрящее действие.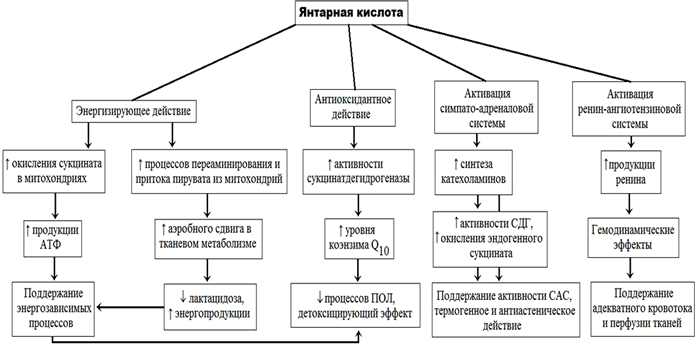
Для достижения видимого эффекта чистить зубы и десны не менее двух раз в день в течение месяца. Использовать зубную щетку невысокой жесткости. Рекомендуемая длительность процедуры — не менее 2-х минут.
(Для получения эффекта обязательно подержать пасту в полости рта не менее двух минут!)
Базовый комплекс «Кедродент 9», глицерофосфат кальция, микрочастицы диоксида кремния, дента-оксидантный комплекс «Космодент 17», розмарин, пассифлора, водяной перец, эфирное масла цитронеллы, экстракт зеленого кофе, фитоальянс «Профилактический», антигипоксант олифен, ароматическая композиция.
Механизм повреждения энергетического обмена при гипоксии и возможные пути его коррекции фумаратсодержащими растворами
Л.В. Слепнева, Г.А. Хмылова
ФГБУ «Российский НИИ гематологи трансфузиологии ФМБА», г. Санкт-Петербург
Трансфузиология №2, 2013
Резюме
Статья посвящена вопросам механизма действия препаратов, влияющих на процессы энергообразования в организме. Показаны пути коррекции нарушений энергетического обмена и преимущества фумаратсодержащих инфузионных растворов.
Показаны пути коррекции нарушений энергетического обмена и преимущества фумаратсодержащих инфузионных растворов.
В настоящее время нарушения энергетического обмена рассматриваются как один из ведущих патологических процессов, приводящих к необратимым последствиям и гибели организма, что обусловливает исключительную важность рассматриваемой проблемы. Коррекция или устранение энергодефицита является обязательным компонентом в лечении большинства патологических состояний, и в связи с этим, понимание механизма действия препаратов, способных влиять на различные звенья энергообмена, для практикующих врачей приобретают особую ценность.
Жизнедеятельность организма с многообразием всех физиологических функций и биохимических процессов возможна лишь при условии его постоянного энергообеспечения. В настоящее время имеется значительный экспериментальный и клинический материал, свидетельствующий о том, что различные экстремальные воздействия на организм (тяжелая кровопотеря, ожог, травма, сердечная недостаточность, острое отравление и др. ) вызывают однотипные повреждения в клеточной системе энергообразования. Это явление обусловлено тем, что результирующим эффектом различных по своей природе экстремальных факторов является развитие острого кислородного голодания тканей. Дефицит кислорода — акцептора электронов в митохондриальной дыхательной цепи, приводит к глубокому подавлению биоэнергетической функции митохондрий. Выходит из строя основная энергетическая система клетки, энергопродукция клетками резко снижается, и, как следствие, нарушается течение многочисленных энергозависимых процессов в организме [2, 6, 11, 13, 24, 34, 36, 37, 43].
) вызывают однотипные повреждения в клеточной системе энергообразования. Это явление обусловлено тем, что результирующим эффектом различных по своей природе экстремальных факторов является развитие острого кислородного голодания тканей. Дефицит кислорода — акцептора электронов в митохондриальной дыхательной цепи, приводит к глубокому подавлению биоэнергетической функции митохондрий. Выходит из строя основная энергетическая система клетки, энергопродукция клетками резко снижается, и, как следствие, нарушается течение многочисленных энергозависимых процессов в организме [2, 6, 11, 13, 24, 34, 36, 37, 43].
Недостаточность систем энергообразования в клетке составляет существенный элемент патогенеза многих заболеваний. По мнению ряда авторов, поддержание жизни в экстремальных условиях возможно до тех пор, пока дефицит энергии не достигнет критических величин. Истощение клеточных энергетических резервов ниже допустимого уровня сопровождается развитием в клетке необратимых процессов и гибелью организма.
Прежде чем перейти к рассмотрению вопросов, связанных с нарушением энергетического обмена в клетке при патологических состояниях и его коррекции применением различных лекарственных средств, кратко остановимся на описании процессов энергообразования в нормально функционирующей клетке [16, 41].
На рис. 1 схематически представлен сложный процесс распада питательных веществ, который обеспечивает ступенчатое постепенное освобождение энергии и аккумуляцию ее в виде макроэргической фосфатной связи аденозинтрифосфата (АТФ).
На первой стадии крупные молекулы под влиянием сложных ферментативных систем расщепляются на более простые. В результате действия этих ферментативных систем углеводы расщепляются до гексоз и пентоз, липиды – до глицерина и жирных кислот, из белков образуется около 20-ти аминокислот.
На второй стадии происходит дальнейшее расщепление образовавшихся соединений. Из 20-ти различных аминокислот образуется лишь несколько конечных продуктов, а именно, ацетил-коэнзим А, α-кетоглютаровая и щавелевоуксусная кислоты.
Жирные кислоты в процессе β-окисления превращаются в ацетил-КоА. Гексозы под действием ферментативных систем гликолиза расцепляются до пировиноградной кислоты, которая затем в процессе окислительного декарбоксилирования превращается также в ацетил-КоА.
Гликолиз является тем механизмом, посредством которого многие организмы получают химическую энергию из глюкозы и других субстратов в отсутствие молекулярного кислорода. У большинства аэробных организмов процесс гликолиза является предварительной ступенью для дальнейшего окисления продуктов брожения кислородом в процессе дыхания.
Метаболиты, образовавшиеся на второй стадии распада питательных веществ (ацетил-КоА, α-кето-глютаровая, щавелевоуксусная кислоты) вступают в третью стадию, которая для них является общей и на которой они в конечном итоге окисляются до СО2 и Н2О.
Третья стадия – стадия терминального окисления питательных веществ, во время которой освобождается основная масса энергии, осуществляется в митохондриях через цикл трикарбоновых кислот (ЦТК) и митохондриальную дыхательную цепь. ЦТК – общий конечный путь окислительного катаболизма всех видов клеточного топлива в аэробных условиях. В этом цикле под действием специфических дегидрогеназ протекают процессы дегидрирования субстратов, восстановительные эквиваленты от которых (протоны и электроны) поступают на митохондриальную дыхательную цепь. Дегидрирование – отщепление молекул Н2 от интермедиатов цикла Кребса происходит, в основном, при помощи дегидрогеназ, простетической группой которых является никотинамидаденин-динуклеотид (НАД), и лишь дегидрирование янтарной кислоты осуществляется ФАД-зависимой дегидрогеназой (сукцинатдегидрогеназой).
Дыхательная цепь, состоящая из серии переносчиков электронов, передает восстановительные эквиваленты конечному акцептору электронов – молекулярному кислороду. Дыхательная цепь – это полиферментная система, локализованная во внутренней мембране митохондрий, основными компонентами которой являются НАД-зависимые дегидрогеназы, флавопротеиды и цитохромы (рис. 1).
Дыхательная цепь – это полиферментная система, локализованная во внутренней мембране митохондрий, основными компонентами которой являются НАД-зависимые дегидрогеназы, флавопротеиды и цитохромы (рис. 1).
Сопряженно с транспортом электронов протекает процесс окислительного фосфорилирования, в котором значительная часть свободной энергии электронов, передаваемых редокс-цепью на кислород, аккумулируется и трансформируется в специфическую макроэргическую связь АТФ. Таким образом, необходимая для нужд организма энергия образуется благодаря функционированию взаимосвязанных процессов гликолиза и дыхания. В процессе гликолиза высвобождается лишь незначительная часть той химической энергии, которая потенциально может быть извлечена из молекулы глюкозы. Полное окисление глюкозы до СО2 и Н 2О, осуществляемое в процессе дыхания, приводит к синтезу значительно большего количества макроэргов. При окислении одной молекулы глюкозы в гликолитическом цикле образуется 2 молекулы АТФ, тогда как дальнейшее расщепление продуктов гликолиза в цикле Кребса сопровождается синтезом 38 молекул АТФ. Таким образом, митохондриальная дыхательная цепь является основным местом приложения и утилизации кислорода в клетке.
Таким образом, митохондриальная дыхательная цепь является основным местом приложения и утилизации кислорода в клетке.
При дефиците кислорода – конечного акцептора электронов в редокс-цепи митохондрий – отмечается выраженная гиперредукция всех компонентов терминального звена окисления. Прекращаются транспорт электронов по дыхательной цепи и сопряженный с ним процесс образования макроэнергических фосфатов. Известно, что в условиях нормоксии НАД-звено дыхательной цепи митохондрий принимает восстановительные эквиваленты из различных источников:
1. от субстратов цикла Кребса при участии специфических дегидрогеназ;
2. оксиацил-КоА-дегидрогеназы поставляютионы водорода на НАД- звено при окислении жирных кислот;
3. сложная система пируват-дегидрогеназы, отщепляя ионы водорода в реакциях окислительного декарбоксилирования, передает их на НАД-звено редокс-цепи;
4. внемитохондриальный НАД-Н, образованный в центральной реакции гликолитической оксидоредукции, также отдает свои протоны на митохондриальную дыхательную цепь (рис. 1).
1).
Мощный поток восстановительных эквивалентов в условиях кислородной недостаточности не может реализоваться из-за гипервосстановленности НАД-зависимого участка дыхательной цепи. Выключается из функционирования основная энергетическая система клетки, резко снижается продукция АТФ.
В анаэробных условиях клетка стремится восполнить энергетический дефицит за счёт активации гликолиза. Несмотря на то, что при анаэробном гликолизе продуцируется почти в 20 раз меньше АТФ, чем при полном сгорании глюкозы в цикле Кребса, потенциальная скорость процесса в основном может обеспечить энергозатраты организма. Однако для осуществления гликолитических реакций необходим постоянный приток окисленной формы НАД, который при нормоксии обеспечивается работой специфических челночных механизмов. Гликолитический НАД-Н проникает через митохондриальные мембраны посредством функционирования α-глицерофосфатного, β-оксибутиратного и других механизмов переноса восстановительных эквивалентов.
Оксибутиратный и глицерофосфатные шунты являются основными конкурентами лактатдегидрогеназного механизма окисления гликолитического НАД-Н, деятельность которого при нормальной концентрации кислорода в клетке подавлена более активными вышеназванными механизмами.
При нарушении электронтранспортной функции редокс-цепи и гиперредукции ее НАД-звена клетка вынуждена изыскивать другие пути реокисления цитоплазматического НАД-Н. В условиях острой гипоксии конечный продукт гликолиза – пируват – не подвергается декарбоксилированию и не вовлекается в цикл Кребса, а, принимая восстановительные эквиваленты от цитоплазматического НАД-Н, превращается в лактат с освобождением новых порций окисленной формы НАД (рис. 2).
Активация лактатдегидрогеназного механизма поставки НАД для гликолиза в конечном итоге приводит к истощению запасов гликогена и тканевому ацидозу вследствие накопления кислых продуктов метаболизма (лактата, пирувата, оксибутирата, глицерофосфата и др.). Избыточные концентрации конечного субстрата анаэробного гликолиза – лактата – тормозят последнюю реакцию гликолитического цикла.
Регенерация НАД прекращается, и, именно, дефицит пиридиннуклеотида останавливает гликолиз и анаэробную продукцию АТФ. Клеточный ацидоз способствует нарушению проницаемости мембран, вплоть до разрушения лизосом. В цитоплазму поступают аутолитические ферменты. Развивается процесс аутолиза клеток, сопровождающийся повреждением тканей и органов. В организме формируются необратимые изменения.
В цитоплазму поступают аутолитические ферменты. Развивается процесс аутолиза клеток, сопровождающийся повреждением тканей и органов. В организме формируются необратимые изменения.
Таким образом, степень повреждения митохондриального метаболизма в условиях тяжелой кислородной недостаточности определяет тяжесть многих патологических состояний. Накопленный опыт лечения шока и кровопотери показывает, что существующие инфузионнотрансфузионные среды, проявляя лечебное действие в стадиях легкой и средней тяжести, оказываются недостаточными на поздних стадиях процесса. Особенности течения поздних стадий геморрагического шока связывают главным образом с генерализованными нарушениями метаболизма и возникающими в результате этого расстройствами энергообмена.
В связи с этим применение совместно с кровезаменителями препаратов, способных повысить энергетический потенциал клетки в условиях гипоксии, рассматривается как один из путей повышения эффективности инфузионной терапии гиповолемических состояний.
В ликвидации энергетического дефицита большое значение придается антигипоксантам. К настоящему времени не выработано единого общепринятого определения антигипоксантов и их классификации, так как в ответ на гипоксическое воздействие вовлекаются самые разные системы организма. Препараты биоэнергетического действия можно разделить на несколько групп.
К первой группе следует отнести препараты, являющиеся источником энергетического сырья (глюкоза, сорбит, АТФ, фосфорилированные гексозы и др.). Использование их показано при патологических состояниях, сопровождающихся истощением энергетических ресурсов в клетке. Включение в состав противошоковых кровезаменителей 5-10% глюкозы или фосфорилированных гексоз [1, 42] для поддержания гликолиза в клетках не позволяет существенно повысить эффективность инфузионной терапии из-за неизбежно возникающего накопления кислых продуктов метаболизма и дефицита окисленной формы пиридиннуклеотида (НАД). Отсюда понятно, что введение таких субстратов окисления, как глюкоза или гексозы, при гипоксии целесообразно лишь с препаратами, ускоряющими утилизацию лактата. Таким свойством обладают соединения группы гутимина. В эксперименте показан антигипоксический эффект гутимина и амтизола при геморрагическом шоке [8].
Таким свойством обладают соединения группы гутимина. В эксперименте показан антигипоксический эффект гутимина и амтизола при геморрагическом шоке [8].
Ко второй группе препаратов можно отнести средства, которые, не являясь энергетически богатыми соединениями, способны активно воздействовать на энергетический обмен посредством коррекции отдельных звеньев многоступенчатого процесса аккумуляции энергии в клетке. Данные о нарушении транспорта электронов в дыхательной цепи митохондрий при шоке и кровопотери [28] являются теоретической предпосылкой для применения антигипоксантов с электрон-акцепторными свойствами. В литературе имеются довольно обширные сведения о применении естественных и искусственных антигипоксантов – переносчиков электронов. К числу первых относится цитохром С, который, как известно, является одним из компонентов дыхательной цепи митохондрий и служит мобильным переносчиком электронов. Играя важную роль в энергетическом метаболизме клетки, цитохром С показал высокую лечебную эффективность в клинической практике при терапии шока, кровопотери и постишемической гипоксии [12, 32].
Разработке и исследованию искусственных переносчиков электронов посвящено значительное количество работ. Эти соединения способны модифицировать дыхательную цепь митохондрий так, чтобы осуществлять «сброс» восстановительных эквивалентов непосредственно на кислород, минуя заблокированные участки дыхательной цепи. К числу таких веществ относится ряд соединений из класса хинонов (ортопарабензохиноны, нафтохиноны, гексогидрохиноны). Высокий редокс-потенциал этих препаратов определяет их способность к транспорту электронов [30]. При проведении экспериментов на животных многие из этих соединений оказались токсичными, что не позволило рекомендовать их в качестве лечебных средств. Из всех средств, формирующих искус- ственные редокс-системы, в медицинскую практику внедрен препарат «Гипоксен», представляющий собой синтетический полихинон [9].
Известно, что антигипоксанты группы хинонов осуществляют перенос электронов с НАД-Н звена на кислород, минуя все 3 пункта фосфорилирования в дыхательной цепи и, следовательно, устранение дефицита энергии при введении этих препаратов может происходить лишь за счет активации гликолитической выработки АТФ. Однако для полноценного проявления антигипоксических свойств этих соединений необходим акцептор электронов – кислород. Наибольший интерес для включения в состав новых комплексных кровезаменителей представляют, так называемые, истинные антигипоксанты или антигипоксанты прямого действия, непосредственно влияющие на митохондриальный метаболизм при гипоксии.
Однако для полноценного проявления антигипоксических свойств этих соединений необходим акцептор электронов – кислород. Наибольший интерес для включения в состав новых комплексных кровезаменителей представляют, так называемые, истинные антигипоксанты или антигипоксанты прямого действия, непосредственно влияющие на митохондриальный метаболизм при гипоксии.
Согласно теоретическим предпосылкам, одна из возможностей поддержания биоэнергетики клетки может быть реализована посредством стимуляции адаптационных механизмов к гипоксии, работающих на последних этапах цикла Кребса. Из всех субстратов цикла Кребса только влияние сукцината на энергетический обмен подробно изучено в эксперименте на животных.
Исследование механизма действия сукцината при гипоксических состояниях проведено в работах М.Н. Кондрашовой с соавторами [5, 6]. Исследователи считают, что в условиях гипоксии сукцинат, не являясь НАД-зависимым субстратом, «монополизирует» дыхательную цепь и активно в ней окисляется. Высокая скорость реакции окисления сукцината, поставляющей 2 молекулы АТФ, позволяет компенсировать выработку 3-х молекул АТФ, образующихся при окислении НАД-зависимых субстратов. Однако в условиях прогрессирующей гипоксии дефицит кислорода, лимитирующий скорость окисления всех субстратов, снижает ценность сукцината и ставит его в один ряд с другими субстратами окисления. Поэтому применение сукцината в качестве антигипоксанта должно быть особенно эффективно в комплексе с препаратами, улучшающими кислородообеспечение организма. Преимущественное использование сукцината – естественная защита клетки против гипоксии. При этом пополнение фонда субстрата может происходить за счет реакций цикла Кребса, идущих как в прямом, так и в обратном направлениях (рис. 3).
Высокая скорость реакции окисления сукцината, поставляющей 2 молекулы АТФ, позволяет компенсировать выработку 3-х молекул АТФ, образующихся при окислении НАД-зависимых субстратов. Однако в условиях прогрессирующей гипоксии дефицит кислорода, лимитирующий скорость окисления всех субстратов, снижает ценность сукцината и ставит его в один ряд с другими субстратами окисления. Поэтому применение сукцината в качестве антигипоксанта должно быть особенно эффективно в комплексе с препаратами, улучшающими кислородообеспечение организма. Преимущественное использование сукцината – естественная защита клетки против гипоксии. При этом пополнение фонда субстрата может происходить за счет реакций цикла Кребса, идущих как в прямом, так и в обратном направлениях (рис. 3).
При обратном течении реакций имеющийся запас малата по мере необходимости превращается в фумарат, который восстанавливается в сукцинат. Восстановление фумарата сопровождается выработкой АТФ, и поэтому реакции обращения в системе «малат-фумарат-сукцинат» способны поддерживать окислительное фосфорилирование даже при аноксии.
В условиях же гипоксии инверсивные превращения фумарата выполняют роль триггера, который, в зависимости от концентрации кислорода регулирует течение конечных реакций цикла Кребса в прямом либо в обратном направлениях, и эти реакции сопровождаются синтезом АТФ. Механизм инверсивных превращений фумарата в цикле Кребса объясняет эффективность применения фумаратсодержащих инфузионных сред, таких как кристаллоидный раствор – мафусол, коллоидный кровезаменитель – полиоксифумарин и концентрированный раствор фумарата натрия – конфумин. Эти препараты разработаны и основательно изучены в Российском НИИ гематологии и трансфузиологии. Лечебная эффективность была изучена на моделях геморрагического и ожогового шока, а также при экспериментальном перитоните [17–20, 23, 25,45]. Оценку эффективности инфузионных растворов определяли по совокупности показателей системной гемодинамики, кислородного режима, кислотно-основного состояния (КОС), перекисного окисления липидов и митохондриального метаболизма в печени и сердце животных. Полярографическое исследование митохондрий, выделенных из печени и сердца животных, леченных фумаратсодержащими растворами, свидетельствовало о полном восстановлении энергопродуцирующих функций этих органелл. Следует отметить, что летальность животных в контрольной группе (тяжелый шок) составляло 100%, при лечении мафусолом или полиоксифумарином – 17–20%.
Полярографическое исследование митохондрий, выделенных из печени и сердца животных, леченных фумаратсодержащими растворами, свидетельствовало о полном восстановлении энергопродуцирующих функций этих органелл. Следует отметить, что летальность животных в контрольной группе (тяжелый шок) составляло 100%, при лечении мафусолом или полиоксифумарином – 17–20%.
Результаты исследования митохондриального метаболизма позволяют предположить, что парентеральное введение фумарата индуцирует суперкомпенсацию адаптационного механизма к гипоксии, функционирующих на последних этапах цикла Кребса. Фумарат в системе «малат-фумарат-сукцинат» способен поддерживать синтез АТФ как в аэробных, так и в анаэробных условиях. При дефиците кислорода фумарат, восстанавливаясь ФАД∙Н2-группой сукцинатдегидрогеазой, превращается в сукцинат и освобождает новые порции окисленной формы ФАД. Принимая восстановительные эквиваленты от НАД-Н, ФАД способствует снятию гипервосстановленности НАД звена дыхательной цепи и синтезу АТФ в бескислородной среде. При поступлении кислорода в клетку сукцинат, синтезируемый из фумарата, монополизирует дыхательную цепь и, активно окисляясь в ней, продуцирует АТФ (рис. 3). К тому же, образование в этих реакциях окисленной формы НАД запускает также и механизм гликолитической продукции АТФ. Поддержание энергетического потенциала клетки при инфузия фумарата способствует удлинению периода обратимых изменений в организме и предотвращает развитие «необратимости» при патологических состояниях, отягощенных глубокой гипоксией.
При поступлении кислорода в клетку сукцинат, синтезируемый из фумарата, монополизирует дыхательную цепь и, активно окисляясь в ней, продуцирует АТФ (рис. 3). К тому же, образование в этих реакциях окисленной формы НАД запускает также и механизм гликолитической продукции АТФ. Поддержание энергетического потенциала клетки при инфузия фумарата способствует удлинению периода обратимых изменений в организме и предотвращает развитие «необратимости» при патологических состояниях, отягощенных глубокой гипоксией.
Парентеральное введение фумаратсодержащих растворов наряду с восстановлением биоэнергетики клетки, сопровождается «мягким» ощелачивающим действием препаратов на кислотно-основное состояние крови при ацидозе. Это действие обусловлено тем, что такие органические соли, как фумарат-, ацетат-, лактат-, сукцинат- и малат натрия являются соединениями, образованными сильным основанием (NaOH) и слабой кислотой. При гидролизе подобных солей в кровеносном русле освобождается соответствующая кислота и NaOH, который расходуется на нейтрализацию кислых продуктов метаболизма. Реакция гидролиза смещена вправо, так как постоянно происходит потребление продукта гидролитической реакции – NaOH (рис. 4).
Реакция гидролиза смещена вправо, так как постоянно происходит потребление продукта гидролитической реакции – NaOH (рис. 4).
Следует отметить, что вышеназванные соли оказывают мягкое ощелачивающие действие по сравнению с бикарбонатом натрия, широко используемым в клинической практике для ликвидации ацидоза. Реакция гидролиза NaHСО3 протекает значительно быстрее, так как в ходе реакции удаляются оба ее продукта: NaOH расходуется на нейтрализацию метаболитов, а второй продукт реакции – угольная кислота, нестоек и разлагается на Н2О и СО2. Образованная в избыточном количестве щелочь может способствовать развитию алкалоза, что имеет место в клинических условиях при передозировке бикарбоната натрия.
Все вышеперечисленные соли входят в состав различных инфузионных растворов (мафусол, полиоксифумарин, конфумин, лактасол, Рингер-лактат, ацесоль, реамберин, стерофундин и др.). Однако оказывая ощелачивающее действие при ацидозе, далеко не все эти препараты способны поддержать энергетический обмен при гипоксии. Восстановление показателей КОС «химическим путем» является недостаточным для успешной терапии шока.
Восстановление показателей КОС «химическим путем» является недостаточным для успешной терапии шока.
Следует к тому же учитывать, что при гидролизе лактата натрия выделяется молочная кислота, которая в сумме с эндогенной молочной кислотой, возникающей в больших концентрациях при гипоксии, могут способствовать подавлению реакций гликолиза, что, в свою очередь, вызывает снижение продукции гликолитической АТФ. Существуют также исследования, указывающие, что лактат может вызвать интерстициальный отек головного мозга и повышать агрегацию тромбоцитов и эритроцитов [14, 39, 44]. Лактатсодержащие инфузионные растворы нельзя использовать при печеночной недостаточности [35, 38, 40], а также в случаях шока, сопровождающегося гиперлактатемией или лактатным ацидозом [33].
Ацетат натрия, в отличие от лактата, не проявляет токсического действия при тяжелом шоке. Однако утилизация уксусной кислоты, образованной при гидролизе ацетата натрия, в условиях кислородной недостаточности затруднена вследствие постгипоксического дефекта в функционировании митохондриальной дыхательной цепи. Лечебное действие фумарата натрия в сравнении с лактатом и ацетатом представляется более физиологичным, так как при его введении наряду с ощелачивающим эффектом проявляется и его влияние на восстановление процессов генерации энергии в митохондриях, а, следовательно, устраняется причина возникновения метаболического ацидоза.
Лечебное действие фумарата натрия в сравнении с лактатом и ацетатом представляется более физиологичным, так как при его введении наряду с ощелачивающим эффектом проявляется и его влияние на восстановление процессов генерации энергии в митохондриях, а, следовательно, устраняется причина возникновения метаболического ацидоза.
Сукцинатсодержащие растворы, в частности «Реамберин», способствуют поддержанию энергетического обмена, однако, в условиях острого дефицита кислорода подавляется окисление сукцината и существенно снижается его энергопродуцирующая функция. Окисление малата в цикле Кребса осуществляется НАД-зависимой малатдегидрогеназой, и эта реакция тормозится из-за гипервосстановленности НАД-звена редокс-цепи митохондрий при гипоксии. Следовательно, в этих условиях субстрат не способен повысить энергетический потенциал клетки. К тому же, в инфузионном малатсодержащем растворе «Стерофундин» концентрация малата очень низкая, чтобы обеспечить достаточную продукцию АТФ. В условиях гипоксии повышение концентрации малата могло бы создать условия для обращения реакций в цикле Кребса с увеличением фонда фумарата, способного принимать восстановительные эквиваленты (Н2) и синтезировать АТФ. Однако концентрация малата в стерофундине (5 ммоль/л) незначительна для запуска реакций в цикле Кребса в обратном направлении.
Однако концентрация малата в стерофундине (5 ммоль/л) незначительна для запуска реакций в цикле Кребса в обратном направлении.
Фумаратсодержащие растворы (мафусол, полиоксифумарин) содержат высокие концентрации фумарата (86 ммоль/л), обеспечивающие как выработку АТФ, так и накопление сукцината, который активно окисляется при поступлении кислорода. Введение субстратов в организм при гипоксии показано еще и вследствие того, что кислородная недостаточность сопровождается значительным субстратным голодом клетки. Препараты «Мафусол» и «Полиоксифумарин» с высокой концентрацией фумарата и возможностью инфузий больших объемов этих растворов без побочных эффектов являются высокоэффективными средствами терапии шока различного генеза. Это подтверждено клинически. Так, кристаллоидный кровезаменитель «Мафусол» разрешен к медицинскому применению уже более 20 лет и широко используется в разных областях медицины (хирургия, неврология, кардиология, реаниматология, педиатрия, акушерство и гинекология, комбустиология, токсикология и др.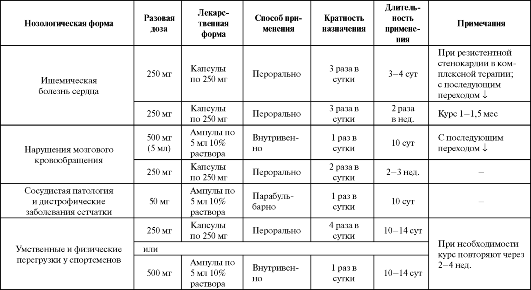 ) [3, 15, 22, 27, 29, 31]. Отличительной особенностью этого препарата является то, что его можно переливать в больших количествах, не только внутривенно, но и внутриартериально, а также в смеси для заполнения контура АИК при открытых операциях на сердце. Ни один из существующих сейчас на фармацевтическом рынке инфузионных антигипоксических препаратов не обладает этими свойствами. Полифункциональный коллоидный плазмозаменитель «Полиоксифумарин» с 1999 года успешно применяется у взрослых и детей в клинической практике гиповолемических состояний различной степени тяжести [10, 21, 22]. Аналогов ему нет ни в России, ни зарубежом.
) [3, 15, 22, 27, 29, 31]. Отличительной особенностью этого препарата является то, что его можно переливать в больших количествах, не только внутривенно, но и внутриартериально, а также в смеси для заполнения контура АИК при открытых операциях на сердце. Ни один из существующих сейчас на фармацевтическом рынке инфузионных антигипоксических препаратов не обладает этими свойствами. Полифункциональный коллоидный плазмозаменитель «Полиоксифумарин» с 1999 года успешно применяется у взрослых и детей в клинической практике гиповолемических состояний различной степени тяжести [10, 21, 22]. Аналогов ему нет ни в России, ни зарубежом.
Применение концентрированного раствора фумарата натрия (препарата «Конфумин») в качестве антигипоксического компонента в схемах инфузионно-трансфузионной терапии существенно увеличивает уровень субстратов окисления в кровеносном русле и позволяет повысить лечебную эффективность общепринятых в клинической практике плазмозаменителей [3, 4, 22, 25-27]. Конфумин разрешен к широкому медицинскому применению у взрослых, промышленный выпуск препарата освоен в ОАО «Фирма Медполимер».
Антигипоксант и способ его получения
Изобретение относится к области фармацевтики и медицины и касается антигипоксанта, представляющего собой аминокислоту глицин, иммобилизованную на частицах детонационного наноалмаза размером 2-10 нм, и способа его получения. Продукт обладает низкой токсичностью и высокой эффективностью. 2 н. и 2 з.п. ф-лы, 5 ил., 8 табл., 3 пр.
Изобретение относится к медицине, в частности к фармакологии, и касается антигипоксанта — лекарственного средства для коррекции гипоксии, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза.
Проблема гипоксии на протяжении многих десятилетий является чрезвычайно актуальной в медицине, в том числе в военной и спортивной, и привлекает постоянное внимание клиницистов и фармакологов с точки зрения профилактики, лечения и изучения механизмов развития различных патологических состояний, включая острые и хронические нарушения мозгового кровообращения и внезапную смерть [1]. Гипоксию рассматривают как несоответствие энергопотребности клетки энергопродукции в системе митохондриального окислительного фосфорилирования [2]. Гипоксия является механизмом, запускающим каскад биохимических «поломок», приводящих сначала к функциональным, а затем и структурным нарушениям деятельности различных органов и систем. Причины генерализованной гипоксии разделяют на экзогенные («горная» и кессонная болезни, нахождение в замкнутом пространстве, неисправность аппарата искусственной вентиляции легких и др.) и эндогенные (пневмония, пневмоторакс, бронхоспазм, сердечно-сосудистая недостаточность, анемия, отравление тяжелыми металлами, цианидами и др.). К локальной гипоксии (ишемия мозга, миокарда, конечностей) приводят местный спазм сосудов, атеросклероз, нарушения кровоснабжения, вызванные тромбом и др. [3]. При любой гипоксии первично развивается угнетение энергетического обмена, которое проявляется уменьшением содержания креатинфосфата (особенно в головном мозге) и АТФ при одновременном увеличении концентрации аденозинди- и аденозинмонофосфорных кислот, а также неорганического фосфата.
Гипоксию рассматривают как несоответствие энергопотребности клетки энергопродукции в системе митохондриального окислительного фосфорилирования [2]. Гипоксия является механизмом, запускающим каскад биохимических «поломок», приводящих сначала к функциональным, а затем и структурным нарушениям деятельности различных органов и систем. Причины генерализованной гипоксии разделяют на экзогенные («горная» и кессонная болезни, нахождение в замкнутом пространстве, неисправность аппарата искусственной вентиляции легких и др.) и эндогенные (пневмония, пневмоторакс, бронхоспазм, сердечно-сосудистая недостаточность, анемия, отравление тяжелыми металлами, цианидами и др.). К локальной гипоксии (ишемия мозга, миокарда, конечностей) приводят местный спазм сосудов, атеросклероз, нарушения кровоснабжения, вызванные тромбом и др. [3]. При любой гипоксии первично развивается угнетение энергетического обмена, которое проявляется уменьшением содержания креатинфосфата (особенно в головном мозге) и АТФ при одновременном увеличении концентрации аденозинди- и аденозинмонофосфорных кислот, а также неорганического фосфата. Это приводит к нарушениям мембранного транспорта, процессов биосинтеза и других функций клеток, а также к внутриклеточному лактоацидозу, увеличению внутриклеточной концентрации свободного кальция и активации перекисного окисления липидов [3].
Это приводит к нарушениям мембранного транспорта, процессов биосинтеза и других функций клеток, а также к внутриклеточному лактоацидозу, увеличению внутриклеточной концентрации свободного кальция и активации перекисного окисления липидов [3].
Известно, что процесс окислительного фосфорилирования происходит в митохондриях [4]. Гипоксия прежде всего нарушает процессы окисления субстратов цикла Кребса и пентозного цикла НАД-зависимыми дегидрогеназами. При этом начинает усиленно образовываться ацетальдегид, который, в свою очередь, взаимодействует со спиртами, тиолами и аминами с образованием полуацеталей, полукеталей и карбиноламинов. В результате нарушаются структура и функции клеточных и субклеточных, в частности, митохондриальных, мембран, хроматина и медиаторных систем.
Для связывания ацетальдегида и его дальнейшего окисления с целью восстановления жизнедеятельности клеток и работоспособности организма в целом известно применение заменимой аминокислоты глицина [3]. Выявлено, что в условиях гипоксии под влиянием глицина увеличивалась продолжительность жизни нейронов коры головного мозга [5]. На модели гипоксии синусоидальных эндотелиальных клеток печени было показано, что глицин предотвращает снижение уровня АТФ и защищает клетки от некротической гибели [6]. В работе [7] установлено, что глицин предотвращает перекисные процессы и тем самым блокирует разобщение митохондрий. В работе [8] выявлено, что глицин значительно улучшает механометаболические показатели перфузируемого сердца; на фоне действия аминокислоты наблюдалось повышенное по сравнению с контролем потребление кислорода сердцем в условиях гипоксического воздействия. Это может свидетельствовать о восстановлении окислительной и фосфорилирующей способности дыхательной цепи и повышении уровня АТФ в кардиомиоцитах. В этих процессах глицин является индуктором, что приводит к образованию эндогенного глицина, который может использоваться клеткой в качестве протектора при гипоксическом воздействии. Механизм антигипоксического действия глицина связывают с его способностью связывать ацетальдегид, образуя с ним L-треонин, благодаря чему повышенный при гипоксии уровень свободного ацетальдегида в клетке снижается, что существенно ослабляет его инактивирующее действие на убихинон, который тем самым остается в активном состоянии и продолжает выполнять свою функцию переносчика восстановительных эквивалентов от НАДН к цитохромам [8].
На модели гипоксии синусоидальных эндотелиальных клеток печени было показано, что глицин предотвращает снижение уровня АТФ и защищает клетки от некротической гибели [6]. В работе [7] установлено, что глицин предотвращает перекисные процессы и тем самым блокирует разобщение митохондрий. В работе [8] выявлено, что глицин значительно улучшает механометаболические показатели перфузируемого сердца; на фоне действия аминокислоты наблюдалось повышенное по сравнению с контролем потребление кислорода сердцем в условиях гипоксического воздействия. Это может свидетельствовать о восстановлении окислительной и фосфорилирующей способности дыхательной цепи и повышении уровня АТФ в кардиомиоцитах. В этих процессах глицин является индуктором, что приводит к образованию эндогенного глицина, который может использоваться клеткой в качестве протектора при гипоксическом воздействии. Механизм антигипоксического действия глицина связывают с его способностью связывать ацетальдегид, образуя с ним L-треонин, благодаря чему повышенный при гипоксии уровень свободного ацетальдегида в клетке снижается, что существенно ослабляет его инактивирующее действие на убихинон, который тем самым остается в активном состоянии и продолжает выполнять свою функцию переносчика восстановительных эквивалентов от НАДН к цитохромам [8].
В современной терапевтической практике глицин применяют также как средство, ослабляющее влечение к алкоголю, уменьшающее явления абстиненции, депрессивные нарушения, повышенную раздражительность, нормализующее сон, а также в комплексном лечении нарушений мозгового кровообращения [9].
Применяемый фармакопейный глицин назначают в виде таблеток (по 0,1 г) под язык 3-4 раза в день.
Актуальность и практическая значимость нахождения методов эффективной коррекции гипоксии требуют разработки и поиска новых антигипоксантов, повышающих выживаемость человека в условиях острой гипоксии. Арсенал имеющихся лекарственных средств с антигипоксическим действием ограничен, широта и эффективность лечебных доз сравнительно невелики. Специфическая антигипоксантная активность препаратов, имеющихся в настоящее время в распоряжении врачей-клиницистов, проявляется не при всех видах гипоксии, а некоторые антигипоксанты оказывают нежелательные побочные действия. В связи с этим чрезвычайно важным и необходимым для нужд медицины является нахождение, изучение и внедрение в практику безопасных, высокоактивных препаратов антигипоксантного действия с большой широтой эффективных доз.
Известен глицин, иммобилизованный на частицах детонационного наноалмаза с размером 2-10 нм, применяемый в качестве связующего компонента в полимерных композитах [10, 11]. Способ его получения заключается в следующем [11]. Навеску наноалмаза помещают в реактор в постоянном токе гелия и отжигают при температуре 150-470°C в течение 3-4 ч. Далее проводят фторирование образцов наноалмаза при температуре 50-500°C в течение 1-24 ч контактированием со смесью газообразных фтора и водорода. Для получения глицина, иммобилизованного на частицах наноалмаза, фторированный наноалмаз обрабатывают ультразвуком в о-дихлорбензоле в течение 20-30 мин, добавляют гидрохлорид этилового эфира глицина (NH2CH2COOCH2CH3HCl) и несколько капель пиридина. Полученную смесь перемешивают при температуре 130-140°C в течение 8-12 ч. Образовавшийся продукт фильтруют, промывают этанолом и сушат под вакуумом при 70°C.
Дополнительной характеристикой этого вещества является размер его частиц в суспензии, равный, по данным динамического рассеяния света (ДРС), 310 нм[11].
Особенностью данного вещества является наличие на поверхности частиц наноалмаза помимо молекул глицина также атомов фтора. Хотя их количество авторами декларируется менее 1% ат., в действительности экспериментально установлено, что концентрация фтора на поверхности наноалмаза может достигать 14% ат. и более. Это обусловлено тем, что связь C-F (Есв.=115 ккал/г-атом) является прочной и фторпроизводные углерода инертны по отношению ко многим веществам. Поэтому при химической иммобилизации глицина на поверхность наноалмаза, содержащего атомы фтора, молекулы глицина замещаются на атомы фтора лишь частично. При этом известно, что присутствие в органическом веществе фтора и его производных повышает его токсичность и может изменять показатели микросомальной системы биотрансформации ксенобиотиков в печени [12]. Так, наличие атомов фтора в ближайшем наноструктурном аналоге наноалмаза — фуллерене (C60) — повышает его общую токсичность в 2,4-5 раз [13]. Кроме того, фтор и его соединения способны накапливаться в различных объектах окружающей среды и присутствовать в них в различных количествах [14]. Поэтому глицин, иммобилизованный на частицах наноалмаза, которые содержат атомы фтора, нежелательно использовать в медицинской практике в качестве лекарственного средства.
Поэтому глицин, иммобилизованный на частицах наноалмаза, которые содержат атомы фтора, нежелательно использовать в медицинской практике в качестве лекарственного средства.
Использование глицина, иммобилизованного на частицах детонационного наноалмаза, как антигипоксанта в научной и патентной литературе не описано.
Поэтому получение антигипоксанта, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза, не содержащих атомов фтора, с повышенной дисперсностью в суспензии, применяемого в качестве лекарственного средства, а также снижение уровня экологической и эндоэкологической опасности, упрощение и удешевление способа его получения, представляют собой актуальную и практически значимую задачу.
Целью и задачей изобретения является повышение эффективности антигипоксического действия глицина без проявления каких-либо побочных и токсических воздействий, снижение дозировки препарата и расширение номенклатуры антигипоксических лекарственных средств.
Поставленная задача решается с помощью описываемого в соответствии с изобретением антигипоксанта, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза размером 2-10 нм, не содержащих атомов фтора и имеющих оболочку толщиной до 1 нм, с содержанием глицина до 21±3% масс., и способа его получения.
Описываемый антигипоксант в виде глицина, иммобилизованного на частицах детонационного наноалмаза, не содержащих на своей поверхности атомов фтора, представляет собой ультрадисперсный порошок (Фиг.1) темно-серого цвета или темно-серого цвета с зеленоватым или темно-синим оттенками с размером частиц от 2 до 10 нм, имеющих оболочку толщиной до 1 нм (Фиг.2), размером агрегатов в водной суспензии до 100 нм (Фиг.3) и содержанием глицина до 21±3% масс, входящего в состав поверхностной оболочки.
На Фиг.1 отчетливо видно наличие у описываемого антигипоксанта ультрадисперсной структуры из частиц с размером, меньшим разрешающей способности использованного прибора (от 20 нм).
Микрофотография частиц описываемого антигипоксанта получена на автоэмиссионном сканирующем электронном микроскопе сверхвысокого разрешения Zeiss Ultra Plus (Carl Zeiss, Германия).
На Фиг.2 видно, что размер частиц описываемого антигипоксанта, покрытых оболочкой толщиной до 1 нм, равен 2-10 нм.
Микрофотография частиц описываемого антигипоксанта получена на просвечивающем электронном микроскопе Jeol 1011 (JEOL, Япония).
На Фиг.3. приведена кривая распределения размеров частиц в суспензии описываемого антигипоксанта, из которой следует, что размеры частиц в суспензии не превышают 100 нм.
Измерение распределения размера частиц описываемого антигипоксанта в суспензии проводили методом ДРС на приборе ZetaSizer (Malvern Instruments, США). По оси абсцисс отложена логарифмическая шкала размера частиц в нм. По оси ординат — процентное содержание частиц с определенными размерами.
Элементный состав поверхности частиц описываемого антигипоксанта по данным рентгенофотоэлектронной спектроскопии (РФЭС) приведен в табл. 1.
1.
| Таблица 1 | |||
| Элементный состав и энергии связи поверхностных атомов описываемого антигипоксанта | |||
| Наименование характеристики | Химические элементы | ||
| C | O | N | |
| Атомные, % | 77,5-94,5 | 4-14 | 1,5-8,5 |
| Энергии связи, эВ | 285,2±0,5 | 530,7±0,5 | 399,8±0,5 |
Исследование поверхности описываемого антигипоксанта проводили на приборе LAS-3000 (Riber, Франция), оснащенном полусферическим анализатором ОРХ-150. Для возбуждения фотоэлектронов использовали немонохроматизированное рентгеновское излучение алюминиевого анода (AlKα=1486,6 эВ) при напряжении на трубке 12 кВ и токе эмиссии 20 мА. Калибровку фотоэлектронных пиков проводили по линии углерода С 1s с энергией связи 285 эВ. Вакуум в рабочей камере составлял 6,7·10-8 Па. Для получения высокого вакуума был использован ионный насос.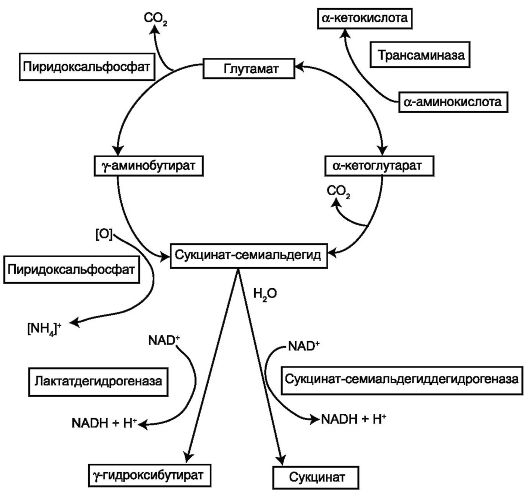
Количество глицина в описываемом антигипоксанте определяют следующим образом. Готовят смеси наноалмаза с разным содержанием глицина. Берут навески каждой смеси равной массы. Регистрируют их ИК-спектры, выбирают на них наиболее интенсивные характеристические сигналы, которые соотносят с полосами ИК-спектра исходного глицина. Затем строят калибровочные кривые зависимости интенсивности сигнала в ИК-спектре от содержания глицина в навеске. Далее, по интенсивности выбранных характеристических полос исследуемого антигипоксанта по калибровочным кривым определяют количественное содержание в нем глицина. По полученным данным определяют среднее значение величины содержания глицина в описываемом антигипоксанте.
Описываемый способ получения антигипоксанта заключается в следующем. Детонационный наноалмаз отжигают в токе газообразного водорода при температуре 500-1200°C в течение 1-8 ч, затем подвергают жидкофазному хлорированию молекулярным хлором при фотохимическом воздействии видимым светом при температуре 50-70°C в течение 36-60 ч с последующей промывкой четыреххлористым углеродом,
центрифугированием и сушкой под вакуумом. Модифицированный хлором наноалмаз растворяют в полярном растворителе с образованием суспензии. Добавляют третичный амин и глицин и обрабатывают полученную смесь ультразвуком в течение 5-60 мин с последующим выдерживанием при 50-80°C в течение 12-48 ч, центрифугированием, промывкой растворителем и сушкой. Обработку ультразвуком ведут в течение 5-60 мин, в качестве третичного амина используют триэтиламин и в качестве полярного растворителя применяют пиридин, низший алифатический спирт, водно-спиртовую смесь или воду.
Модифицированный хлором наноалмаз растворяют в полярном растворителе с образованием суспензии. Добавляют третичный амин и глицин и обрабатывают полученную смесь ультразвуком в течение 5-60 мин с последующим выдерживанием при 50-80°C в течение 12-48 ч, центрифугированием, промывкой растворителем и сушкой. Обработку ультразвуком ведут в течение 5-60 мин, в качестве третичного амина используют триэтиламин и в качестве полярного растворителя применяют пиридин, низший алифатический спирт, водно-спиртовую смесь или воду.
Описываемый антигипоксант не содержит атомов фтора (табл.1), а также атомов других галогенов, в количестве, превышающем ошибку прибора (0,1% ат.), так как в процессе получения антигипоксанта все атомы хлора заменяются на молекулы глицина и уходят с поверхности наноалмаза в виде молекул НС1.
Исследование специфической противогипоксической активности заявляемого антиоксиданта в сравнении с фармакопейным глицином и широко применяемым в медицинской практике препаратом мексидолом было проведено согласно [15, 16]. Оно осуществлялось при использовании двух методик с различным генезом гипоксических состояний: нормобарической гипоксии с гиперкапнией в гермообъеме и гемической гипоксии [17, 18]. Эти методики являются базисными моделями при поиске и изучении веществ с противогипоксической активностью.
Оно осуществлялось при использовании двух методик с различным генезом гипоксических состояний: нормобарической гипоксии с гиперкапнией в гермообъеме и гемической гипоксии [17, 18]. Эти методики являются базисными моделями при поиске и изучении веществ с противогипоксической активностью.
Исследование выполнено на белых беспородных половозрелых мышах самцах массой 23-28 г по 10 голов в каждой группе. Всего использовано 140 животных.
В результате исследований показано, что описываемый антигипоксант обладает выраженной противогипоксической активностью в условиях моделей нормобарической гипоксии с гиперкапнией в гермообъеме и гемической гипоксии, что характеризуется статистически достоверным увеличением времени выживания животных в условиях гипоксии. Противогипоксический эффект описываемого антигипоксанта имеет дозозависимый характер и усиливается с увеличением дозы от 10 до 20 мг/кг и выявляется как при однократном, так и при повторном введении. По противогипоксической активности в тесте нормобарической гипоксии заявляемый антигипоксант не уступает фармакопейному глицину и препарату сравнения мексидолу, а в тесте гемической гипоксии существенно превосходит фармакопейный глицин и мексидол.
Исследование острой токсичности описываемого антигипоксанта было проведено согласно Методическим указаниям по изучению острой токсичности, изложенных в [19].
При проведении эксперимента регистрировались следующие показатели: характер шерстяного покрова, изменение состояния слизистых оболочек, птоз верхнего века, повышенная уринация, повышенная дефекация, повышенная саливация, пилоэрекция, вокализация, боковое положение, ритм и глубина дыхательных движений, агрессивность, пугливость, тремор, судороги, изменение порогов болевой реакции, изменение позы, каталепсия, нарушение координации движений в тесте вращающегося стержня, удерживание в течение 5 секунд на перевернутой сетчатой платформе, перелезание с перевернутой сетчатой платформы наверх, наличие пинеального, роговичного рефлексов, седации, стереотипии и груминга, гибель животного.
Статистическая обработка результатов была осуществлена с помощью статистических пакетов «BioStat» для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей.
Полученные результаты убедительно показывают, что описываемый антигипоксант при внутрибрюшинном введении мышам в дозах 75, 150 и 225 мг/кг, также как и фармакопейный глицин, не вызывает признаков интоксикации и гибели животных на протяжении 14 сут. наблюдения.
Описываемый антигипоксант не только позволяет повысить терапевтическую эффективность фармакопейного препарата глицина, но и расширить ассортимент эффективных и безопасных антигипоксических средств.
Краткое описание графических материалов.
Фиг.1. Электронная микрофотография описываемого антигипоксанта, полученная на сканирующем электронном микроскопе.
Фиг.2. Электронная микрофотография описываемого антигипоксанта, полученная на просвечивающем электронном микроскопе.
Фиг.3. Распределение размеров частиц описываемого антигипоксанта в водной суспензии по данным метода ДРС.
Фиг.4. ИК-спектры смесей наноалмаза с глицином, используемых для построения калибровочных кривых. I, II, III — спектры смесей с содержанием глицина 1:1,75:2,5, соответственно. В рамках выделены характеристические пики.
В рамках выделены характеристические пики.
Фиг.5. Калибровочные кривые для каждой характеристической полосы ИК-спектра смеси наноалмаза с глицином, а, б, в — калибровочные кривые для полос 1407, 1332 и 504 см-1, соответственно.
Изобретение иллюстрируется следующими примерами.
Пример 1.
300 мг исходного детонационного наноалмаза отжигают в токе газообразного водорода со скоростью 3,0 л/ч при температуре 1000°C в течение 6 ч. Затем отожженный наноалмаз подвергают жидкофазному хлорированию молекулярным хлором, растворенным в 40 мл CCl4 до 6% масс. Cl2. Реакцию хлорирования проводят при фотохимическом воздействии видимым светом в течение 60 ч при температуре 60°C. Затем образец промывают CCl4 с центрифугированием суспензии при 6000 об/мин и высушивают под давлением 0,1 мм. рт.ст. до постоянного веса. Затем из хлорированного наноалмаза получают суспензию, используя 40 мл водно-спиртовой смеси (вода:метанол=1:1), в которую вносят 300 мг глицина в виде свободной аминокислоты (NH2CH2COOH) с добавлением 1 мл триэтиламина. Полученную смесь обрабатывают ультразвуком (50 Вт) в течение 60 мин и выдерживают при постоянном перемешивании при температуре 65°C в течение 30 ч. Полученный продукт промывают большим количеством этанола, центрифугируют и высушивают под вакуумом при 70°C в течение всей ночи. Остаточная влажность продукта составляет 2,2%. Выход целевого продукта составляет 279 мг (93%). Продукт представляет собой темно-серый с синеватым оттенком ультрадисперсный порошок (Фиг.1) с размерами первичных частиц 2-10 нм (Фиг.2), имеющих оболочку поверхностного слоя до 1 нм. В суспензии размер частиц порошка не превышает 100 нм (Фиг.3). Элементный состав поверхности частиц полученного продукта приведен в табл.2.
Полученную смесь обрабатывают ультразвуком (50 Вт) в течение 60 мин и выдерживают при постоянном перемешивании при температуре 65°C в течение 30 ч. Полученный продукт промывают большим количеством этанола, центрифугируют и высушивают под вакуумом при 70°C в течение всей ночи. Остаточная влажность продукта составляет 2,2%. Выход целевого продукта составляет 279 мг (93%). Продукт представляет собой темно-серый с синеватым оттенком ультрадисперсный порошок (Фиг.1) с размерами первичных частиц 2-10 нм (Фиг.2), имеющих оболочку поверхностного слоя до 1 нм. В суспензии размер частиц порошка не превышает 100 нм (Фиг.3). Элементный состав поверхности частиц полученного продукта приведен в табл.2.
| Таблица 2 | |||
| Данные РФЭС полученного продукта | |||
| Наименование характеристики | Химические элементы | ||
| C | O | N | |
| Атомные, % | 80,1±0,1 | 11,5±0,1 | 8,4±0,1 |
| Энергии связи, эВ | 285,2±0,5 | 530,7±0,5 | 399,6±0,5 |
Для определения массовой доли глицина в полученном продукте готовят 3 смеси наноалмаза с глицином с содержанием последнего 1:1,75:3,5, соответственно._575.gif) Для каждой смеси берут навеску массой 0,0035 г и тщательно перетирают в ступке с 0,090 г KBr. 0,070 г полученной смеси прессуют в таблетку и снимают ее ИК-спектр (Фиг.4). Характеристические полосы выбирают при 1407, 1332 и 504 см-1, соответственно, и строят для них калибровочные графики (Фиг.5). Интенсивность соответствующих характеристических на ИК-спектре полученного образца массой 0,0035 г составила 0,23, 0,22 и 0,10 о.е., соответственно. Из калибровочных кривых а, 6, в на Фиг.5 определяют величину содержания глицина в полученном образце, которая составляет 0,00057±8·10-5 г. Следовательно, массовая доля глицина в навеске образца составляет 21±3% масс.
Для каждой смеси берут навеску массой 0,0035 г и тщательно перетирают в ступке с 0,090 г KBr. 0,070 г полученной смеси прессуют в таблетку и снимают ее ИК-спектр (Фиг.4). Характеристические полосы выбирают при 1407, 1332 и 504 см-1, соответственно, и строят для них калибровочные графики (Фиг.5). Интенсивность соответствующих характеристических на ИК-спектре полученного образца массой 0,0035 г составила 0,23, 0,22 и 0,10 о.е., соответственно. Из калибровочных кривых а, 6, в на Фиг.5 определяют величину содержания глицина в полученном образце, которая составляет 0,00057±8·10-5 г. Следовательно, массовая доля глицина в навеске образца составляет 21±3% масс.
Пример 2.
Изучение противогипоксической активности описываемого средства в условиях нормобарической гипоксии с гиперкапнией в гермообъеме.
Исследование выполнено на белых беспородных половозрелых мышах-самцах массой 23-28 г по 10 животных в группе, всего 100 голов.
Животных получали из Центрального питомника лабораторных животных «Столбовая», Московская область.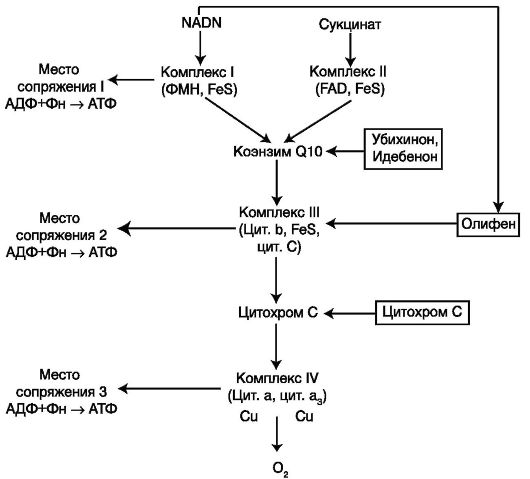 Содержание животных соответствовало правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 3 51000.3-96 и 51000.4-96), нормативному документу «Санитарные правила по устройству, оборудованию и содержанию вивариев», утвержденных Главным Государственным санитарным врачом 06.04.1973 г. №1045-73, и Приказу МЗ РФ №267 от 19.06.2003 г. «Об утверждении правил лабораторной практики» (GLP) с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997 г.). Животные содержались в виварии при температурном режиме 20-22°C, при световом цикле — 12 часов светлый и 12 часов темный периоды, в пластмассовых клетках T/4A размером 580×375×200 мм с верхней крышкой из нержавеющей стали и подстилкой обеспыленной из деревянной стружки. Животные содержались при постоянном доступе к корму и воде с использованием полного рациона экструдированного брикетированного корма (ГОСТ на корм P 50258-92) и питьевой воды.
Содержание животных соответствовало правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 3 51000.3-96 и 51000.4-96), нормативному документу «Санитарные правила по устройству, оборудованию и содержанию вивариев», утвержденных Главным Государственным санитарным врачом 06.04.1973 г. №1045-73, и Приказу МЗ РФ №267 от 19.06.2003 г. «Об утверждении правил лабораторной практики» (GLP) с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997 г.). Животные содержались в виварии при температурном режиме 20-22°C, при световом цикле — 12 часов светлый и 12 часов темный периоды, в пластмассовых клетках T/4A размером 580×375×200 мм с верхней крышкой из нержавеющей стали и подстилкой обеспыленной из деревянной стружки. Животные содержались при постоянном доступе к корму и воде с использованием полного рациона экструдированного брикетированного корма (ГОСТ на корм P 50258-92) и питьевой воды. При проведении экспериментов учитывались требования Комиссии по проблеме этики отношения к животным Российского национального Комитета по биоэтике при Российской академии наук и этические нормы, изложенные в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1985 г.). Опыты проводили в первую половину дня.
При проведении экспериментов учитывались требования Комиссии по проблеме этики отношения к животным Российского национального Комитета по биоэтике при Российской академии наук и этические нормы, изложенные в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1985 г.). Опыты проводили в первую половину дня.
В тесте нормобарической гипоксии с гиперкапнией («баночной» гипоксии) мышей одинакового веса (разброс не более 2-х г) помещали по одному животному в герметически закрываемые банки объемом 200 см3 или 250 см3, которые плотно закрывали крышкой и смазывали герметиком. Животное при дыхании в замкнутом пространстве поглощает кислород и выдыхает углекислый газ (ререспирация), вследствие чего возникает дефицит кислорода во вдыхаемом воздухе и развивается гипоксия. Регистрировали время выживания (резервное время) животных в условиях гипоксии. Вещества вводили внутрибрюшинно в объеме 0,1 мл на 10 г веса мыши однократно за 40 минут до помещения животного в гермообъем (банки объемом 200 см3). При изучении антигипоксической активности описываемого антигипоксанта при повторном внутрибрюшинном введении описываемый антигипоксант вводили 2 раза (за 4 часа и 40 мин) до помещения животного в гермообъем (банки объемом 250 см3). Животным контрольной группы вводили дистиллированную воду.
При изучении антигипоксической активности описываемого антигипоксанта при повторном внутрибрюшинном введении описываемый антигипоксант вводили 2 раза (за 4 часа и 40 мин) до помещения животного в гермообъем (банки объемом 250 см3). Животным контрольной группы вводили дистиллированную воду.
Специфическую фармакологичекую активность заявляемого средства исследовали в сравнении с фармакопейным глицином и препаратом сравнения мексидолом.
Статистическая обработка результатов была осуществлена с помощью статистических пакетов «BioStat» для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей.
Установлено, что контрольные животные, помещенные в условия нормобарической гипоксии с гиперкапнией, погибают в среднем в течение 15-ти мин (табл.3). Из табл.3 видно, что заявляемый антигипоксант в дозе 0,5 мг/кг не оказывал антигипоксического действия, в дозе 1 мг/кг наблюдалась тенденция к увеличению времени выживания, в дозе 5 мг/кг он достоверно увеличивал (на 14,85%) время выживания мышей, в дозе 10 мг/кг время выживания мышей в условиях нормобарической гипоксии с гиперкапнией достоверно увеличивалось на 21,49% (табл. 3). Фармакопейный глицин в дозе 1 мг/кг не оказывал противогипоксического действия, а в дозе 10 мг/кг достоверно увеличивал (на 13,67%) время выживания мышей в условиях нормобарической гипоксии (табл.3). Препарат мексидол в десятикратно превышающей дозе (100 мг/кг) также достоверно увеличивал продолжительность жизни в условиях нормобарической гипоксии и имел схожий терапевтический эффект по сравнению с описываемым антигипоксантом в дозе 10 мг/кг.
3). Фармакопейный глицин в дозе 1 мг/кг не оказывал противогипоксического действия, а в дозе 10 мг/кг достоверно увеличивал (на 13,67%) время выживания мышей в условиях нормобарической гипоксии (табл.3). Препарат мексидол в десятикратно превышающей дозе (100 мг/кг) также достоверно увеличивал продолжительность жизни в условиях нормобарической гипоксии и имел схожий терапевтический эффект по сравнению с описываемым антигипоксантом в дозе 10 мг/кг.
| Таблица 3 | ||
| Противогипоксическая активность описываемого антигипоксанта, фармакопейного глицина и мексидола при однократном введении в тесте нормобарической гипоксии с гиперкапнией у мышей | ||
| Вещества | Доза, мг/кг | Продолжительность жизни, мин |
| Контроль | — | 15,08±0,45 |
| Антигипоксант | 0,5 | 14,54±0,19 |
| Антигипоксант | 1 | 16,09±0,21 |
| Антигипоксант | 5 | 17,32±0,6* |
| Антигипоксант | 10 | 18,32±0,43* |
| Фармакопейный глицин | 1 | 15,32±0,42 |
| Фармакопейный глицин | 10 | 17,14±0,41* |
| Мексидол | 100 | 18,01±0,12* |
| * — p<0,05 достоверность различий по критерию Манна-Уитни по сравнению с группой контроля |
Описываемый антигипоксант в дозе 20 мг/кг (внутрибрюшинно, 2 раза: за 4 часа и 40 мин до посадки в гермообъем) достоверно увеличивал на 35,63% по сравнению с контрольной группой продолжительность жизни животных в условиях гипоксии с гиперкапнией. (Табл. 4).
(Табл. 4).
| Таблица 4 | ||
| Противогипоксическая активность описываемого антигипоксанта в тесте нормобарической гипоксии с гиперкапнией при повторном введении | ||
| Группа, доза, число животных | Доза, мг/кг | Продолжительность жизни, мин |
| Контроль | — | 25,56±1,28 |
| Антигипоксант | 20 | 34,26±2,03* |
| *- p<0,05 достоверность различий по критерию Манна-Уитни по сравнению с группой контроля. |
Изучение противогипоксической активности описываемого средства в условиях гемической гипоксии.
Исследование выполнено на белых беспородных половозрелых мышах самцах массой 23-26 г по 10 животных в группе, всего 40 голов. Для получения гипоксии мышам вводили подкожно нитрит натрия в дозе 300 мг/кг и регистрировали время выживания (резервное время) животных в условиях возникающей гипоксии. Описываемый антигипоксант и фармакопейный глицин вводили однократно в объеме 0,1 мл на 10 г веса мыши внутрибрюшинно за 40 мин до введения нитрита натрия. Животным контрольной группы вводили дистиллированную воду. Статистическая обработка результатов была осуществлена с помощью статистических пакетов «BioStat» для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей.
Животным контрольной группы вводили дистиллированную воду. Статистическая обработка результатов была осуществлена с помощью статистических пакетов «BioStat» для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей.
Установлено, контрольные животные в условиях гемической гипоксии, погибают в среднем в течение 18 мин после введения нитрита натрия (табл.5). Описываемый антигипоксант в дозе 10 мг/кг статистически достоверно и существенно (в 1,73 раза) увеличивал по сравнению с контролем время выживания мышей. Противогипоксическое действие описываемого антиоксиданта имеет дозозависимый характер и усиливается с увеличением дозы. Фармакопейный глицин в дозе 10 мг/кг статистически достоверно увеличивал (в 1,45 раза по сравнению с контролем) время выживания мышей в условиях гемической гипоксии (табл.5). В этих условиях мексидол в дозе 100 мг/кг не увеличивал продолжительность выживания животных по сравнению с контролем.
| Таблица 5 | ||
| Противогипоксическая активность описываемого антигипоксанта, фармакопейного глицина и мексидола в тесте гемической гипоксии | ||
| Вещества | Доза, мг/кг | Продолжительность жизни, мин |
Контроль, диет. Вода Вода | 17,58±0,75 | |
| Антигипоксант | 10 | 30,49±2,4* |
| Фармакопейный глицин | 10 | 25,50±3,57* |
| Мексидол | 100 | 20,5±3,45 |
| * — p<0,05 достоверность различий по критерию Манна-Уитни по сравнению с группой контроля. |
Таким образом, полученные данные свидетельствуют о наличии выраженной притивогипоксической активности описываемого средства в условиях моделей нормобарической гипоксии с гиперкапнией в гермообъеме и гемической гипоксии, что характеризуется статистически достоверным увеличением времени выживания животных в условиях гипоксии. Противогипоксический эффект описываемого антигипоксанта имеет дозозависимый характер и усиливается с увеличением дозы от 10 до 20 мг/кг и выявляется как при однократном, так и при повторном введении. По противогипоксической активности в тесте нормобарической гипоксии заявляемый антигипоксант не уступает фармакопейному глицину и препарату сравнения мексидолу, а в тесте гемической гипоксии существенно превосходит фармакопейный глицин и мексидол.
Пример 3.
Изучение побочных эффектов и токсического действия описываемого антигипоксанта.
Исследование проводили на белых беспородных половозрелых мышах-самцах массой 20-24 г возрастом 2-3 месяца. Экспериментальные животные содержались аналогично примеру 2. Всего использовалось 42 животных — 7 групп по 6 мышей.
Регистрацию возможных побочных эффектов, признаков интоксикации и гибели животных проводили через 1 ч — 14 сут. после внутрибрюшинного введения описываемого антигипоксанта в сравнении с фармакопейным глицином в тех же дозах.
В результате исследования было установлено, что описываемый антигипоксант при внутрибрюшинном введении мышам в дозах 75, 150 и 225 мг/кг не вызывал признаков интоксикации и гибели животных на протяжении 14 сут. (табл.6-8). При этом описываемый антигипоксант также не вызывал у мышей изменения шерстяного покрова, состояния слизистых оболочек. Также отсутствовали птоз верхнего века, повышенная уринация, дефекация, саливация, пилоэрекция, вокализация, боковое положение. В пределах нормы были ритм и глубина дыхательных движений, отсутствовали агрессивность, пугливость, тремор, судороги, каталепсия, стереотипия и груминг. Не наблюдалось изменения позы. У животных были сохранены пинеальный, роговичный и болевой рефлексы. На протяжении всех 14 сут. наблюдения животные удерживались на перевернутой сетчатой платформе в течение 5 с (табл.6-8).
В пределах нормы были ритм и глубина дыхательных движений, отсутствовали агрессивность, пугливость, тремор, судороги, каталепсия, стереотипия и груминг. Не наблюдалось изменения позы. У животных были сохранены пинеальный, роговичный и болевой рефлексы. На протяжении всех 14 сут. наблюдения животные удерживались на перевернутой сетчатой платформе в течение 5 с (табл.6-8).
| Таблица 6 | |||||||
| Изучение возможных побочных эффектов и гибели мышей через 1 час после введения фармакопейного глицина и описываемого антигипоксанта (показатель изменения в группе в %) | |||||||
| Показатели | Группы | ||||||
| Контроль | Антигипоксант/доза, мг/кг | Фармакопейный глицин/доза, мг/кг | |||||
| 75 | 150 | 225 | 75 | 150 | 225 | ||
| Изменение характера шерстяного покрова | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение состояния слизистых оболочек | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Птоз верхнего века | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная уринация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная дефекация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная саливация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие пилоэрекция | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие вокализации | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие бокового положения | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение ритма и глубины дыхательных движений | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие агрессивности | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение реакции на постукивание по клетке | 0 | 0 | 0 | 33,3* | 0 | 0 | 33,3* |
| Повышенная пугливость | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие тремора | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие судорог | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение порогов болевой реакции | 0 | 66,7* | 100* | 100* | 0 | 100* | 100* |
| Изменение позы, каталепсия | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение координации движений в тесте вращающегося стержня | 0 | 16,7 | 50* | 50* | 33,3* | 33,3* | 50* |
| Удерживание 5 с на перевернутой сетчатой платформе | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Перелезание с перевернутой сетчатой платформы наверх | 100 | 66,7* | 66,7* | 50* | 66,7* | 66,7* | 66,7* |
| Наличие пинеального рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие роговичного рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие седации | 0 | 66,7* | 100* | 100* | 0 | 100* | 100* |
| Наличие стереотипии | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие груминга | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Гибель животного | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| +- P<0,05 — относительно контроля по критерию χ2 |
| Таблица 7 | |||||||
| Изучение возможных побочных эффектов и гибели мышей через 24 часа после введения фармакопейного глицина и описываемого антигипоксанта (показатель изменения в группе в %) | |||||||
| Показатели | Группы | ||||||
| Контроль | Антигипоксант/доза, мг/кг | Фармакопейный глицин/доза, мг/кг | |||||
| 75 | 150 | 225 | 75 | 150 | 225 | ||
| Изменение характера шерстяного покрова | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение состояния слизистых оболочек | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Птоз верхнего века | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная уринация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная дефекация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная саливация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие пилоэрекция | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие вокализации | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие бокового положения | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение ритма и глубины дыхательных движений | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие агрессивности | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение реакции на постукивание по клетке | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная пугливость | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие тремора | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие судорог | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение порогов болевой реакции | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение позы, каталепсия | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение координации движений в тесте вращающегося стержня | 0 | 0 | 0 | 0 | 33,3* | 16,7 | 33,3* |
| Удерживание 5 с на перевернутой сетчатой платформе | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Перелезание с перевернутой сетчатой платформы наверх | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие пинеального рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 66,6* |
| Наличие роговичного рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие седации | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие стереотипии | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие груминга | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Гибель животного | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| * — P<0,05 — относительно контроля по критерию χ2 |
| Таблица 8 | |||||||
Изучение возможных побочных эффектов и гибели мышей через 14 сут. после введения фармакопейного глицина и описываемый антигипоксант (показатель изменения в группе в %) после введения фармакопейного глицина и описываемый антигипоксант (показатель изменения в группе в %) | |||||||
| Показатели | Группы | ||||||
| Контроль | Антигипоксант/доза, мг/кг | Фармакопейный глицин/доза, мг/кг | |||||
| 75 | 150 | 225 | 75 | 150 | 225 | ||
| Изменение характера шерстяного покрова | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение состояния слизистых оболочек | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Птоз верхнего века | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная уринация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная дефекация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная саливация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие пилоэрекция | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие вокализации | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие бокового положения | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение ритма и глубины дыхательных движений | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие агрессивности | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение реакции на постукивание по клетке | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная пугливость | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие тремора | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие судорог | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение порогов болевой реакции | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение позы, каталепсия | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение координации движений в тесте вращающегося стержня | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Удерживание 5 с на перевернутой сетчатой платформе | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Перелезание с перевернутой сетчатой платформы наверх | 100 | 100 | 100 | 100 | 100 | 100 | 66,7* |
| Наличие пинеального рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие роговичного рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие седации | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие стереотипии | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие груминга | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Гибель животного | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| * — P<0,05 — относительно контроля по критерию χ2 |
Список литературы
1. Л.А. Кравцова, М.А. Школьникова, Л.А. Калинин. Антигипоксанты в практике детского кардиолога-аритмолога. Метод, рекомендации. — М.: 2008. 24 с.
Л.А. Кравцова, М.А. Школьникова, Л.А. Калинин. Антигипоксанты в практике детского кардиолога-аритмолога. Метод, рекомендации. — М.: 2008. 24 с.
2. Р. Марри, Д. Греннер, П. Нейес, В. Родуэлл. Бихимия человека. В 2 т. Т.1. — М.: Мир, 1993. 381 с.
3. С.А. Олейник, Н.А. Горчакова, Л.М. Гунина. Антигипоксанты в спортивной медицине и практике спортивной подготовки // Спортивная медицина. 2008. №1. С.66-73.
4. Ю.А. Владимиров. Физико-химические основы патологии клетки. Лекция 3 / Нарушение функций митохондрий при тканевой гипоксии. — М.: МГУ, РГМУ, 1998.6 с.
5. P. Zhao, Н. Qian, Y. Xia. GAB A and glycine are protective to mature but toxic to immature rat cortical neurons under hypoxia // Eur. J. Neurosci. 2005. V.22. №2. P.289-300.
6. Y. Nishimura, J.J. Lemasters. Glycine blocks opening of a death channel in cultured hepatic sinusoidal endothelial cells during chemical hypoxia // Cell Death&Differ. 2001. V.8. №8. P.850-858.
7. A.A. Селин, H.B. Лобышева, O. H.Воронцова и др. Механизм действия глицина как протектора нарушения энергетики тканей мозга в условиях гипоксии // Бюлл. эксперим. биол. мед. 2012. Т.153. №1. С.52-55.
H.Воронцова и др. Механизм действия глицина как протектора нарушения энергетики тканей мозга в условиях гипоксии // Бюлл. эксперим. биол. мед. 2012. Т.153. №1. С.52-55.
8. А.А. Корнеев, И.А. Комиссарова. О механизме повреждающего действия гипоксии на дыхательную цепь и способах ее фармакологической коррекции. // Эксперим. и клин, фармакол. 1994. Т.57. С.44-47.
9. М.Д. Машковский. Лекарственные средства. В 2 т. Т.2. — 14-е изд., перераб., исправ. и доп. — М.: ООО «Издательство Новая волна», 2000. С.124.
10. US Pat 7820130 B2, 24.11.2004.
11. Y. Liu, Zh. Gu, J.L. Margrave, V.N. Khabashesku. Functionalization of Nanoscale Diamond Powder: Fluoro-, Alkyl-, Amino-, and Amino Acid-Nanodiamond Derivatives // Chem. Mater. 2004. V.16. P.3924-3930.
12. Российская энциклопедия по охране труда. В 3 т. 2-е изд., перераб. и доп. Т.3. — М.: Изд-во. НЦ ЭНАС.2007. С.181.
13. Н.Н. Каркищенко. Биомедицина, 2009. №2. С.5-26.
14. Т.И. Шалина, Л.С. Васильева. Общие вопросы токсического действия фтора // Сибирский медицинский журнал. 2009. №5. С.5-9.
15. Л.Д. Лукьянова, В.В. Гацура, Л.В. Пастушенков, О.Ю. Урюпов, Е.В. Лесновская. Метод, рекомендации по экспериментальному изучению препаратов, предлагаемых для клинического изучения в качестве антигипоксических средств. Государственный фармакологический комитет МЗ СССР. — М., 1990. 18 с.
16. Т.А. Воронина, Р.У. Островская, Т.Л. Гарибова. Метод, рекомендации по доклиническому изучению лекарственных средств с ноотропным типом действия / Руководство по проведению доклинических исследований лекарственных средств 4.1. ФГБУ «НЦЭМСП». — М., Изд-во Гриф и К, 2012. С.276-296.
17. Т.А. Воронина. Гипоксия и память. Особенности эффектов и применения ноотропных препаратов // Вестник РАМН. 2000. Т.9. С.27-34.
18. И.В. Зарубина, П.Д. Шабанов. Молекулярная фармакология антигипоксантов. Серия «Обзоры по клинической фармакологии и лекарственной терапии», СПб.: ООО Издательство Н-Л, 2004. С.308-320.
19. Е.В. Арзамасцев, И.В. Березовская, О.Л. Верстакова и др. Метод, рекомендации по изучению общетоксического действия лекарственных средств / Руководство по проведению доклинических исследований лекарственных средств ФГБУ «НЦЭМСП». — М., Изд-во Гриф и К, 2012. С.13-24.
1. Антигипоксант, представляющий собой глицин, иммобилизованный на частицах детонационного наноалмаза размером 2-10 нм, имеющих оболочку толщиной до 1 нм, с содержанием глицина до (21±3) мас.%.
2. Способ получения антиоксиданта по п.1, характеризующийся тем, что детонационный наноалмаз отжигают в токе газообразного водорода при температуре 500-1200°С в течение 1-8 ч, подвергают жидкофазному хлорированию молекулярным хлором при фотохимическом воздействии видимым светом при температуре 50-70°С в течение 36-60 ч с последующей промывкой четыреххлористым углеродом, центрифугированием и сушкой, полученный модифицированный хлором наноалмаз растворяют в полярном растворителе с образованием суспензии, добавляют третичный амин и глицин, полученную смесь обрабатывают ультразвуком с последующим выдерживанием при 50-80°С, центрифугированием, промывкой растворителем и сушкой.
3. Способ по п.2, где обработку ультразвуком ведут в течение 5-60 мин и выдерживание при 50-80°С осуществляют в течение от 12 до 48 ч.
4. Способ по п.2 или 3, где в качестве третичного амина используют триэтиламин и в качестве полярного растворителя используют пиридин, низший алифатический спирт, водно-спиртовую смесь или воду.
Обогащенная ванна — ICF Clinic — Клиника восстановления здоровья
Задача — ускорить циркуляцию крови, насытить клетки организма кислородом, оказать седативное, противовоспалительное, анальгезирующее, иммуномоделирующие действие.
Результат — ускорится обмен веществ в организме, клетки организма насыщены кислородом и полезными веществами, в зависимости от компонентов обогащения. Обладает тонизирующим, седативным и спазмолитическим эффектом, положительно влияет на сердечно-сосудистую систему.
Компоненты к лечебной ванне (по назначению врача):
Биолонг 1 — это пенная композиция для курсового принятия ванн. Действующее вещество Митофен (антигипоксант-антиоксидант) — нейтрализует окислители, которые образуются при острой кислородной недостаточности, обеспечивает повышение энергообеспечения живых клеток и тем самым предотвращает повышенное образование свободных радикалов в условиях гипоксии при неблагоприятных внешних факторах, способствует нормальному накоплению энергии. Теплая вода ванны обеспечит равномерную трансдермальную доставку активных веществ, создаст ощущение чистоты и комфортную термостатическую релаксацию. Отсутствие отдушек минимизирует риски аллергических проявлений.
Показания:
- при синдроме хронической усталости
- вертеброгенной дорсопатии (остеохондроз) с рефлекторными синдромами поясничного уровня: люмбаго, люмбоишиалгия с выраженными вегетативно-сосудистыми и трофическими нарушениями
- вертеброгенной дорсопатии с корешковыми проявлениями поясничного уровня в стадии неполной ремиссии и подострой стадии с умеренно выраженными статико-динамическими нарушениями
- торакалгии
- когцигодинии
- цервикалгии
- плече-лопаточном периартрозе
Противопоказания:
- Перед первой процедурой врач уточнит ваше состояние здоровья (кожные заболевания, инфекционные, измерит температуру и давление) и выдаст дополнительные рекомендации
Биолонг 3 — это пенная композиция для курсового принятия ванн. Действующее вещество Митофен (антигипоксант-антиоксидант) — выполняет функцию эффективного антиоксиданта, повышает эффективность аэробного окисления субстратов, т. е. выполняет функцию универсального антигипоксанта, защищая ткани от повреждающего воздействия на них активных форм кислорода, концентрация которых резко возрастает при гипоксии.
Показания:
- при нейродермите
- псориазе
- псориатическом артрите
- последствиях термических ожогов
- нарушениях мозговой гемодинамики
- дисциркуляциях в конечностях
- с целью профилактики инфаркта миокарда и инсульта
Противопоказания:
- Перед первой процедурой врач уточнит ваше состояние здоровья (кожные заболевания, инфекционные, измерит температуру и давление) и выдаст дополнительные рекомендации
Кристаллы ЛЕГРАН (с пихтой, с лавром, с мускатным орехом) — это природные соли древнего моря с уникальной формулой, добываемые из недр земли. На кристаллическую решетку кристаллов специальным методом нанесены экстракты и натуральные эфирные масла лекарственных растений и морских водорослей. Оказывает седативное, противовоспалительное, анальгезирующее, иммуномоделирующие действие.
Показания:
- бессонница
- стрессы
- заболевания центральной нервной системы
- заболевания сердечно-сосудистой системы
- гипертоническая болезнь
- заболевания суставов
- заболевания почек
- заболевание верхних дыхательных путей (спектр применения средства довольно обширный)
Противопоказания:
- Перед первой процедурой врач уточнит ваше состояние здоровья (кожные заболевания, инфекционные, измерит температуру и давление) и выдаст дополнительные рекомендации
Соль «Йодобромная». Ионы брома и йода представляют собой активные с биологической точки зрения вещества, которые оказывают большое воздействие на жизнедеятельность человеческого организма. Они находятся в составе многих тканей и органов. Йод оказывает положительное воздействие на обмен веществ, в результате чего происходит усиление функций работы желез внутренней секреции: половых желез и надпочечников. Щитовидная железа также требует небольшого количества йода, а гипофиз не способен обойтись без брома.
Показания:
- гинекологические и кожные заболевания
- болезни костно-мышечной системы
- сердечнососудистой системы
- системы пищеварения
- эндокринной системы
Противопоказания:
- Перед первой процедурой врач уточнит ваше состояние здоровья (кожные заболевания, инфекционные, измерит температуру и давление) и выдаст дополнительные рекомендации
Скипидарная эмульсия «Скипофит». Применение скипидарных ванн заключается в чередовании белой эмульсии и желтого раствора, то есть происходит поочередное раскрытие спавшихся капилляров (белые ванны) и очищение их от шлаков (желтые ванны). По показаниям (повышенное или пониженное давление) назначают Смешанные ванны — это смешение двух жидкостей в одной ванне. Смешанные скипидарные ванны не повышают и не снижают давление, поэтому могут быть использованы для пациентов, как с повышенным, так и с пониженным давлением.
Скипидарные ванны Скипофит действуют комплексно на весь организм, а не на какое-то отдельно взятое заболевание.
Показания:
- бессонница, стрессы, заболевания центральной нервной системы
- заболевания сердечно-сосудистой системы
- гипертоническая болезнь
- заболевания суставов, заболевания почек
- заболевание верхних дыхательных путей
Противопоказания:
- Перед первой процедурой врач уточнит ваше состояние здоровья (кожные заболевания, инфекционные, измерит температуру и давление) и выдаст дополнительные рекомендации
Остались вопросы, звоните! +7 383 363-01-80, +7-913-761-22-61 Мы все объясним, расскажем =)
Прием ведут:
Баблюк Галина ПетровнаВрач-физиотерапевт, реабилитолог, фитотерапевт Мирзаян Елена НиколаевнаМедсестра физио и бальнео Тырина Татьяна АлексеевнаМассажист, медсестра физио и бальнео Кротова Ирина МихайловнаМедсестра процедурного кабинета, медсестра физио и бальнеоПродолжительность сеанса30 минут
800.–
Запись на приёмПротивопоказанием являются
острые воспалительные процессы.
Нервные клетки и окислительный стресс
С.Н. Иллариошкин
доктор медицинских наук, профессор, заместитель директора по научной работе
НЦ неврологии РАМН
Окислительный стресс — один из наиболее значимых механизмов повреждения нервной ткани, который запускает патологические реакции, необратимо повреждающие клетку и приводящие к запуску генетически запрограммированной гибели нейронов — апоптозу.
Нейроны являются самыми высокоспециализированными клетками в нашем организме и выполняют сложнейшие функции, обеспечивающие сознание, движение, чувствительность и адаптацию к постоянно меняющимся условиям внешней и внутренней среды. Такая напряженная деятельность требует исключительно больших затрат энергии. Не случайно мозг, составляя не более 2% от массы тела, потребляет около 20% поступающего в организм кислорода — основного источника энергии в живых клетках.
На практике, однако, далеко не всегда потребление нейронами кислорода происходит оптимальным образом. Так, например, при нарушениях мозгового кровообращения неполное восстановление кровотока после его временной остановки приводит к резкому нарастанию числа недоокисленных, промежуточных форм кислорода — свободных радикалов, отличающихся особой агрессивностью и токсичностью по отношению к клеточным структурам. Активация свободнорадикальных реакций отмечается и при целом ряде других заболеваний нервной системы — как острых, так и хронических, что является следствием нарушений функционирования ряда ключевых ферментов, систем клеточной защиты и т.д. Возникающее при этом состояние носит название окислительный стресс.
Центральным звеном окислительного стресса является так называемое перекисное окисление липидов (ПОЛ). Липиды представляют собой жировые компоненты всех клеточных мембран, они обеспечивают постоянство внутренней среды клетки, передачу клеточных сигналов, функционирование рецепторов и др. Избыточные реакции ПОЛ в условиях патологии повреждают, в первую очередь, мембраны нейронов и их внутриклеточных органелл (митохондрий, ядер, лизосом, эндоплазматической сети). С учетом значимости биологических мембран для жизнедеятельности любых клеточных структур становится понятным, почему окислительный стресс сопровождается катастрофическими последствиями для клетки, вплоть до ее гибели. Особенно это касается возбудимых клеток (нейронов, мышечных фибрилл скелетной мускулатуры и мышцы сердца), в осуществлении функций которых важным моментом является генерация потенциала действия — изменение заряда клеточной мембраны в ответ на определенные стимулы.
Таким образом, на сегодняшний день есть все основания считать окислительный стресс одним из наиболее значимых механизмов повреждения нервной ткани, борьба с которым представляет собой актуальнейшую проблему неврологии.
Окислительный стресс запускает определенный «метаболический каскад», т.е. совокупность взаимосвязанных патологических реакций, необратимо повреждающих клетку. Убедительно показано, что на фоне разворачивающегося окислительного стресса в механизмах гибели нейронов при различных заболеваниях начинают играть дополнительную роль нарушения митохондрий («энергетических станций» клетки), избыточный поток ионов кальция внутрь клетки в результате гиперстимуляции рецепторов возбуждающим нейромедиатором глутаматом, а также недостаточность факторов роста нервных клеток — особых пептидов с модулирующими свойствами. Все эти нарушения приводят к запуску генетически запрограммированной гибели нейронов — апоптозу.
Методы лечения и профилактики окислительного стресса разнообразны. Достаточно давно применяются препараты, связывающие свободные радикалы и предотвращающие реакции ПОЛ — антиоксиданты (витамин Е, аскорбиновая кислота и др.). Однако, несмотря на хороший результат применения антиоксидантов в экспериментальных условиях, результаты их использования в клинике пока остаются далекими от идеала. Другая группа нейропротекторов имеет целью нормализацию функций митохондрий и улучшение обеспечения клетки энергией (коэнзим Q1O, янтарная кислота, рибофлавин и др.). Обычно на практике применяют комбинацию нескольких препаратов из данной группы, что не всегда удобно. Еще одна возможность нейропротекции связана с предотвращением либо уменьшением токсического действия глутамата, выделяемого в межклеточное пространство: для этой цели осуществляют фармакологическую блокаду рецепторов глутамата на поверхности нейронов.
С учетом нерешенности основных проблем защиты нервных клеток при разнообразных заболеваниях мозга в последние годы особое внимание привлекают препараты пептидной природы — универсальные регуляторы клеточных функций в тканях организма. Пептидные регуляторы как лекарственные средства обладают рядом преимуществ перед традиционной «химией»: они характеризуются физиологичностью оказываемых эффектов, широтой спектра действия, возможностью стимулирования механизмов саморегуляции в пораженных клетках. Медицине известен ряд тканеспецифичных пептидов, реализующих свое защитное и лечебное действие преимущественно на уровне мозга, печени либо, например, кроветворной системы, но наибольшей ценностью обладают трофические пептиды с поливалентным, комплексным потенциалом. Одним из таких пептидов, широко применяющимся в клинической практике, является препарат Актовегин.
Актовегин представляет собой дериват из крови молодых телят, по своему действию это высокоактивный антигипоксант, повышающий содержание циклических нуклеотидов в клетке и, следовательно, улучшающий состояние мозгового метаболизма, утилизацию кислорода и глюкозы. Помимо неорганических электролитов и других микроэлементов (натрия, кальция, фосфора, магния), он содержит пептиды, аминокислоты, липиды, олигосахариды и другие органические вещества, а также холин и лейцин (важнейшие строительные материалы для клеточных мембран). Показано, что под влиянием Актовегина различные ткани увеличивают потребление кислорода и глюкозы, что сопровождается повышением энергетического потенциала клеток (в первую очередь, нейронов) с одновременным уменьшением выраженности реакций ПОЛ и маркеров окислительного стресса. В механизмах действия Актовегина как корректора энергетического гомеостаза ведущее значение придается поддержанию оптимального соотношения вазоконстрикции (реакции сужения сосудов) и вазодилатации (их расширения), что способствует нормализации кровотока и стабилизации метаболического фона пораженных тканей. Можно добавить, что входящий в состав Актовегина магний, важнейшей роли которого в метаболизме нервной ткани был посвящен ряд статей в нашем журнале, является компонентом биологически активных нейропептидов и каталитическим центром различных ферментов. Таким образом, сложный поликомпонентный состав Актовегина обеспечивает возможность его действия в качестве уникального модулятора состояния кровотока и метаболизма, структурно-функциональной целостности клеточных мембран, энергокорректора с нейропротективными (защитными) свойствами.
Во всем мире, в том числе и в нашей стране, к настоящему времени накоплен огромный опыт применения Актовегина в составе комплексной терапии при целом ряде заболеваний и поражений нервной системы — остром инсульте, синдроме полиорганной недостаточности на фоне критических неврологических состояний, хронической ишемии мозга, сопровождающейся расстройствами памяти и внимания, миастении и др. Препарат может применяться в виде таблеток и в виде инъекций — внутривенных и внутримышечных, что обеспечивает достаточную «гибкость» применяемых лечебных схем при острой и хронической патологии. Актовегин, как правило, хорошо переносится и обладает весьма незначительным числом побочных эффектов.
Подводя итог, отметим, что включение в протоколы лечения неврологических пациентов различного профиля современных препаратов, обладающих свойствами антиоксидантов и стабилизаторов энергетического метаболизма, является патогенетически оправданным и перспективным.
Антигипоксантное и антиоксидантное действие лекарственных растений как основа их использования при деструктивных заболеваниях головного мозга
Пастушенков Л.В. и Лесиовская Е.И., Растения-антигипоксанты (Растения-антигипоксанты), Санкт-Петербург, 1991.
Yu T.F., Wang J., et al. , Влияние общих алкалоидов Каралиаузи ( Sophora alopecuroides L.) на толерантность к аноксии у мышей. Китай Дж. Чин. Матер. Med. , 1993, т.500 шт. 18 (8), с. 511.
Google Scholar
Панасенко О.М., Сдвигов А.Г., Сергеенко В.И. Коррекция ПОЛ при экспериментальном атеросклерозе антиоксидантами кукурузного масла // Биоантиоксидант . 2, стр. 14.
Яковлева Л.В., Салманов Е.О., Шапови О.И. Исследование антиоксидантной активности нового растительного препарата Альтан в составе Биоантиоксидант (Биоантиоксидант).2, стр. 91.
Amr, A.M. и Айед А.С., Антиоксидантная роль некоторых ароматических трав, Dirasat Univ. J. , 1995, т. 22 Б, нет. 6, стр. 1475.
Google Scholar
Бобырева Л.Е. Биоантиоксиданты в профилактике ишемии головного мозга // Биоантиоксиданты и свободнорадикальная патология , Полтава: 1987.
PubMed Статья CAS Google Scholar
Курода М., Асака С., Тофуку Л., et al. , Антиоксидантная активность сыворотки у пациентов с уремией, Nephron , 1985, т. 41, стр. 293.
PubMed CAS Google Scholar
Александрова Л.А., Поспелова М.Л., Сорокоумов В.А., и др. , Сравнительная оценка антиоксидантных свойств препаратов из растений, Ученые записки СПб ГМУ им. акад. И. Павлова (Научные труды СПбГУ им.И.П.Павлова), 1998, т. 5, вып. 1, стр. 46.
Google Scholar
Комаров П.Г., Биленко М.В., Швецова А.А., и др. , Оценка влияния химических соединений на ферментативное перекисное окисление липидов, Вопр.Med. Хим. , 1985, т. 31, нет. 2, стр. 40.
PubMed CAS Google Scholar
Барнаулов О.Д., Куликов А.В., Халикова Н.А., и др. , Химический состав и первичная оценка фармакологических свойств из Filipendula ulmaria (L) maxim, Растительные ресурсы, , 1977, т. 23, нет. 4, стр. 661.
Google Scholar
Поспелова, М.Л. и Олин В.В. Перекисное окисление липидов и активность супероксиддисмутазы в ткани мозга гипертонических крыс с ишемией или без нее // Актуальные вопросы патофизиологии , Материалы Межвузовской научной конф., Санкт-Петербург. , 1995, с. 34.
,, Рохо-Ортега, К., Дженести, Дж., Способ получения экспериментальной гипертонии у крыс, Can. J. Physiol. Pharmacol. , 1968, т.6, вып. 6, стр. 883.
Google Scholar
Конюхова С.Г., Дубикайтис А.Ю., Шебуневич Л.В., и др. , Роль активации перекисного окисления липидов в патогенезе экспериментального перитонита, Бюлл. Эксп. Биол. Med. , 1989, т. 107, нет. 5, стр. 557.
CAS Статья Google Scholar
Гаврилов В.Б. и Микрорудная М.Н., Спектрофотометрическое определение гидроперекисей липидов в плазме крови, Lab. Дело .1983. 3, стр. 33.
Google Scholar
Костюк В.А., Потапович А.И., Ковалёва Н.В. Простой и чувствительный метод определения супероксиддисмутазы на основе окисления кверцетина // Вопр. Med. Хим. , т. 36, нет. 2, стр. 88.
Тимирбулатов Р.А. , Селезнев Е.И. Способ увеличения свободнорадикального окисления липидсодержащих компонентов крови и его диагностическое значение, Lab.Дело .1981. 4, стр. 209.
PubMed Google Scholar
Маринов Б.С., Филатов Г.Л., Никонов С.С., и др. , Регуляция мембранной проводимости в наружных сегментах стержня сетчатки с помощью редокс-агентов, Biol. Membr. , 1992, т. 9, вып. 2, стр. 66.
Google Scholar
Мисра, Х., Придович И., Роль супероксид-аниона в антиоксидировании адреналина и простой анализ супероксиддисмутазы, J.Биол. Chem. , 1972, т. 247, нет. 10, стр. 3170.
PubMed CAS Google Scholar
Костюк В.А., Потапович А.И., Сорока Н.Ф. Антиоксидантная активность противоартритных препаратов. Med. Хим. , 1990, т. 36, нет. 3, стр. 37.
CAS Google Scholar
Антигипоксантное и антиоксидантное действие лекарственных растений как основа их использования при деструктивных заболеваниях головного мозга
Пастушенков, Л.В. и Лесиовская Е.И., Растения-антигипоксанты (Растения-антигипоксанты), Санкт-Петербург, 1991.
Yu T.F., Wang J., et al. , Влияние общих алкалоидов Каралиаузи ( Sophora alopecuroides L.) на толерантность к аноксии у мышей. Китай Дж. Чин. Матер. Med. , 1993, т. 500 шт. 18 (8), с. 511.
Google Scholar
Панасенко, О.М., Сдвигов А.Г., Сергеенко В.И. Коррекция ПОЛ при экспериментальном атеросклерозе антиоксидантами кукурузного масла // Биоантиоксидант . 2, стр. 14.
Яковлева Л.В., Салманов Е.О., Шапови О.И. Исследование антиоксидантной активности нового растительного препарата Альтан в составе Биоантиоксидант (Биоантиоксидант). 2, стр. 91.
Amr, A.M. и Айед А.С., Антиоксидантная роль некоторых ароматических трав, Dirasat Univ.J. , 1995, т. 22 Б, нет. 6, стр. 1475.
Google Scholar
Бобырева Л.Е. Биоантиоксиданты в профилактике ишемии головного мозга // Биоантиоксиданты и свободнорадикальная патология , Полтава: 1987.
PubMed Статья CAS Google Scholar
Курода М., Асака С., Тофуку Л., et al. , Антиоксидантная активность сыворотки у пациентов с уремией, Nephron , 1985, т. 41, стр. 293.
PubMed CAS Google Scholar
Александрова Л.А., Поспелова М.Л., Сорокоумов В.А., и др., Сравнительная оценка антиоксидантных свойств препаратов из растений, Ученые записки СПб ГМУ им. акад. И. Павлова (Научные труды СПбГУ им.И.П.Павлова), 1998, т. 5, вып. 1, стр. 46.
Google Scholar
Комаров П.Г., Биленко М.В., Швецова А.А., и др. , Оценка влияния химических соединений на ферментативное перекисное окисление липидов, Вопр. Med.Хим. , 1985, т. 31, нет. 2, стр. 40.
PubMed CAS Google Scholar
Барнаулов О.Д., Куликов А.В., Халикова Н.А., и др. , Химический состав и первичная оценка фармакологических свойств из Filipendula ulmaria (L) maxim, Растительные ресурсы, , 1977, т. 23, нет. 4, стр. 661.
Google Scholar
Поспелова, М.Л., Олин В.В. Перекисное окисление липидов и активность супероксиддисмутазы в ткани головного мозга крыс с гипертонией с ишемией или без нее // Актуальные вопросы патофизиологии , Материалы Межвузовской научной конф., СПб. . СПб, 1995, с. 34.
,, Рохо-Ортега, К., Дженести, Дж., Способ получения экспериментальной гипертонии у крыс, Can. J. Physiol. Pharmacol. , 1968, т. 6, вып. 6, стр.883.
Google Scholar
Конюхова С.Г., Дубикайтис А.Ю., Шебуневич Л.В., и др. , Роль активации перекисного окисления липидов в патогенезе экспериментального перитонита, Бюлл. Эксп. Биол. Med. , 1989, т. 107, нет. 5, стр. 557.
CAS Статья Google Scholar
Гаврилов В.Б. А., Микрорудная М.Н. Спектрофотометрическое определение гидроперекисей липидов в плазме крови.Дело .1983. 3, стр. 33.
Google Scholar
Костюк В.А., Потапович А.И., Ковалёва Н.В. Простой и чувствительный метод определения супероксиддисмутазы на основе окисления кверцетина // Вопр. Med. Хим. , т. 36, нет. 2, стр. 88.
Тимирбулатов Р.А. , Селезнев Е.И. Способ увеличения свободнорадикального окисления липидсодержащих компонентов крови и его диагностическое значение, Lab.Дело .1981. 4, стр. 209.
PubMed Google Scholar
Маринов Б.С., Филатов Г.Л., Никонов С.С., и др. , Регуляция мембранной проводимости в наружных сегментах стержня сетчатки с помощью редокс-агентов, Biol. Membr. , 1992, т. 9, вып. 2, стр. 66.
Google Scholar
Мисра, Х., Придович И., Роль супероксид-аниона в антиоксидировании адреналина и простой анализ супероксиддисмутазы, J.Биол. Chem. , 1972, т. 247, нет. 10, стр. 3170.
PubMed CAS Google Scholar
Костюк В.А., Потапович А.И., Сорока Н.Ф. Антиоксидантная активность противоартритных препаратов. Med. Хим. , 1990, т. 36, нет. 3, стр. 37.
CAS Google Scholar
Гипоксия и антигипоксанты, основное внимание уделяется травмам головного мозга | Шабанов
ВВЕДЕНИЕ
Практическая медицина нуждается в защите организма от кислородной недостаточности.В этом случае достаточно эффективно применение антигипоксантов. Концепция антигипоксантов и поиск новых препаратов из этой группы разрабатываются на кафедре фармакологии Военно-медицинской академии, Санкт-Петербург, Россия. Антигипоксанты — это соединения различной химической структуры (алифатические и циклические аминотиолы, бензимидазолы) с общими эффектами (не передающие, не тканеспецифические и системные), обладающие как энергостабилизирующим, так и антиоксидантным действием и повышающие устойчивость организма дырки к дефициту кислорода.Кроме того, эти препараты поддерживают физическую выносливость в экстремальных условиях окружающей среды (кислородный голод, перегрев, интоксикации, истощение) и ускоряют восстановление физического и психического статуса после экстремальных нагрузок, отравлений фосфорограновыми соединениями, при стрессах и т. Д. [1]. Такая актопротекторная активность антигипоксантов обусловлена их способностью ускорять репаративный и адаптивный синтез РНК, ферментов, структурных белков после действия различных агрессивных агентов [10].Защитные свойства антигипоксантов различаются, это позволяет профилировать каждый препарат в разных клинических ситуациях и у здоровых людей [3]. Например, бемитил (рис. 1), производное бензимидазола, использовался для поддержки физической активности военнослужащих в Афганистане (1979–1989), у ликвидаторов последствий стихийных бедствий на Чернобыльской атомной станции (1986, Украина), землетрясения в Армении. (1988), железнодорожная катастрофа в Уфе (Россия) и другие экстремальные ситуации. Бемитил использовался полярными исследователями в антарктических экспедициях, новобранцами в тяжелых ситуациях и т. Д.В клинической практике бемитил применяется как анантиастеническое средство, когда наблюдается слабость, быстрая утомляемость и снижение доступности. Аминотиоловые антигипоксанты могут быть назначены в качестве дополнительных препаратов в отделениях интенсивной терапии и в неотложной медицине [12]. Амтизол назначается при распространенной гипоксии вследствие недостаточности крови, критических нарушениях гемодинамики, асфиксии, резекции легкого. В кардиологической практике амтизол повышал эффективность традиционной терапии сердечных аритмий, аритмогенного и кардиогенного коллапса.Таким образом, антигипоксанты являются новыми оригинальными базовыми и высокоэффективными фармакологическими препаратами, перспективными для использования как в фармакологии здорового человека, так и в общей практике.
Рис. 1. Структура некоторых антигипоксантов
АНТИГИПОКСАНТЫ, НООТРОПЫ И ТРАВМА МОЗГА
К патогенетическим факторам острой черепно-мозговой травмы относится кислородное голодание головного мозга. Особое значение в посттравматическом периоде имеет индивидуальная устойчивость организма к острой гипоксии, а ее взаимосвязь с типологическими особенностями высшей нервной деятельности и метаболизма мозга определяет направление фармакологической коррекции последствий черепно-мозговой травмы.Выбор оптимального пути восстановления функции центральной нервной системы и метаболизма мозга с учетом рисков принудительной нормализации и задержки различных этапов реабилитации после травм остается актуальной проблемой.
Эффективное устранение поведенческих аномалий у животных и устранение метаболических нарушений в посттравматический период можно решить с помощью антигипоксических средств, которые повышают устойчивость организма к действию острой или хронической гипоксии.К эффективным антиоксидантам относятся этомерол (5-этокси-2-этилтиобензимидазол), синтезированный на кафедре фармакологии Военно-медицинской академии; Биохимические и физиологические эффекты этого агента опосредуются активацией синтеза белка и ферментов, участвующих в энергетическом обмене и антиоксидантных системах [14]. Метаболический тип действия этомерсола обуславливает его значительные защитные свойства при цереброваскулярных нарушениях гипоксического происхождения [4]. Тот факт, что этомерсол обладает актопротекторными свойствами неистощительного характера, заставляет ожидать, что его использование приведет к эффективному восстановлению функциональных и метаболических поражений головного мозга в посттравматическом периоде.Целью настоящей работы было изучение роли устойчивости крыс к острой гипоксии в реализации защитных эффектов этомерсола после черепно-мозговой травмы.
Опыты выполнены на белых крысах-самцах линии Вистар массой 160–180 г (группы по 8–10 животных). Перед травмой всех животных классифицировали по их устойчивости к острой гипоксии, поднимая их в барокамере на высоту 12000 м со скоростью 50 м / сек и удерживая на этой высоте до начала агонального дыхания.Животные, переносящие гипоксию в течение 5–10 минут, считались низкорезистентными (LR) животными, а животные, переносящие более 10 минут, считались животными с высокой устойчивостью (HR). Закрытая черепно-мозговая травма средней степени тяжести была нанесена через 24 ч при свободном падении грузом 64 г в полой трубке высотой 80 см и диаметром 1,3 см с приземлением на теменную область головы [7]. Во избежание перелома челюсти головы животных фиксировали на мягкой опоре. Когда происходили вдавленные переломы теменной кости, животных подвергали эвтаназии в течение минуты после черепно-мозговой травмы, и их мозг не исследовался.
Этомерсол (25 мг / кг) вводили внутрибрюшинно (в / б) трижды один раз в день в течение трех дней. Препарат сравнения представлял собой 20% раствор пирацетама из ампул (ИЦН-Октябрь, Россия), вводимый в дозе 60 мг / кг по той же схеме, что и для этомерола. Положительное влияние лечения на течение черепно-мозговой травмы оценивали с точки зрения выживаемости животных, измерения температуры тела, частоты дыхания, измерения отека мозга, поведения животных и биохимических исследований.
Оценку наличия и степени тяжести отека головного мозга проводили после обезглавливания животных через три дня после черепно-мозговой травмы; мозг извлекали вместе с обонятельными долями и измеряли вес во влажном состоянии и после высушивания до постоянного веса. Расчеты производились с использованием калибровочных графиков. Общие измерения физиологических реакций на черепно-мозговую травму были получены от крыс с разным уровнем устойчивости к острой гипоксии с использованием теста открытого поля и теста приподнятого крестообразного лабиринта для изучения ориентировочно-исследовательских, эмоциональных, стереотипных и моторных компонентов в соответствии с поведенческим атласом. для грызунов.Крыс помещали в открытое поле на 5 минут и измеряли активность спонтанных горизонтальных и вертикальных движений (квадратные переходы, вставания на корточки), исследовательское поведение (количество взглядов в отверстия и экскурсии в центр) и эмоциональность (количество дефекаций). болюсы и груминговые акты). Тест приподнятого крестообразного лабиринта включал измерения времени, проведенного в закрытых и открытых рукавах лабиринта, количества переходов в закрытые рукава, числа экскурсий в открытые рукава, количества завешиваний из открытых рукавов и количество взглядов из-под закрытых рук.Уровень тревожности оценивался по процентному соотношению экскурсий в открытые объятия к общему количеству экскурсий [6].
Состояние энергетического обмена головного мозга оценивали по содержанию креатинфосфата, АТФ, молочной и пировиноградной кислот [14, 15] в замороженной в жидком азоте ткани. Процессы перекисного окисления липидов изучали по содержанию в продуктах перекисного окисления диеновых конъюгатов и малонового диальдегида. Состояние антиоксидантной системы оценивали по уровню восстановленного глутатиона и активности супероксиддисмутазы [13].Активность фермента была связана с содержанием белка в образцах, как оценивали методом Лоури. Данные были проанализированы статистически с использованием теста Стьюдента t- .
Сразу после нанесения черепно-мозговой травмы у лиц с высоким и низким сопротивлением наблюдались преходящие тонические и клонические судороги (2–4 секунды), потеря реакции на окружающую среду, оцепенение, лежа на боку, эти проявления продолжались 10–20 секунд. сек. У крыс отмечалось учащение дыхания, снижение температуры и веса тела, непроизвольное мочеиспускание и дефекация.Изменения этих показателей сохранялись на протяжении всего периода наблюдения и были более выражены у лиц с низкой устойчивостью к гипоксии (таблица 1).
Таблица 1. Влияние пирацетама и этомерсола на изменение физиологических показателей у крыс после черепно-мозговой травмы ( n = 8)
До измерения | 73 Группа | Сразу после CCT | Через день после CCT | Три дня после CCT | Три дня после CCT + + пирацетам | Три дня после CCT + + Масса тела, г | HR | 185.1 ± 3,3 | 161,2 ± 2,2 * | 176,2 ± 4,4 * | 152,2 ± 2,5 * | 167,3 ± 3,4 ** | 178,1 ± 2,2 * |
183,5 ± 2,2 | 163,1 ± 2,3 * | 177,4 ± 4,1 * | 155,1 ± 2,3 * | 171,2 ± 3,2 ** | **|||||||||
Частота дыхания, об / мин | HR | 124 ± 3 | 146 ± 3 * | 163 ± 3 * | 137 ± 3 ** | 131 ± 3 ** | |||||||
LR | 128 ± 2 | 137 ± 3.3 * | 153 ± 2 * | 129 ± 4 * | 132 ± 1 ** | 130 ± 3 ** | |||||||
Температура тела, ° C56 | 38,55 ± 0,12 | 38,12 ± 0,11 * | 37,53 ± 0,11 * | 37,76 ± 0,11 * | 38,17 ± 0,11 * | ||||||||
LR | 38.48 ± 0,13 | 38,10 ± 0,11 * | 37,13 ± 0,11 * | 37,58 ± 0,14 * | 38,46 ± 0,12 ** | 38,5602 ± 0,13 Примечание. * p <0,05 по сравнению с крысами без черепно-мозговой травмы; ** p <0,05 по сравнению с крысами с черепно-мозговой травмой. ЧМТ - черепно-мозговая травма; HR = крысы с высокой устойчивостью к гипоксии и LR = крысы с низкой устойчивостью к гипоксии. |
Пирацетам и этомерсол, введенные в течение трех дней в посттравматический период, поддерживали частоту дыхания и температуру тела на уровнях, наблюдаемых у интактных животных. Через день после черепно-мозговой травмы в мозге крысы обнаружилась резкая закупорка сосудов головного мозга с точечными или микрофокальными кровоизлияниями в мягкие и твердые мозговые оболочки, а также гематомы в коре головного мозга и мозжечке, которые были наиболее выражены у лиц с низким сопротивлением.Эти изменения наблюдались в 40% случаев через три дня после черепно-мозговой травмы. У крыс, получавших пирацетам и этомерол, патоморфологические изменения в головном мозге были более умеренными. Пирацетам и этомерол увеличивали время выживания крыс после черепно-мозговой травмы (таблица 2).
Таблица 2. Влияние этомерсола на выживаемость крыс через три дня после черепно-мозговой травмы
CCT | CCT + + пирацетам | CCT + + всего | % | Выжившие / всего | % | Выжившие / всего | % | |||
HR 17/23 72/237 | 16/20 | 80 | 15/18 | 83,3 | ||||||
LR 14/24 | 16/19 | 84,2 | ||||||||
Примечание. * p <0,05 по сравнению с крысами без черепно-мозговой травмы; ** p <0.05 по сравнению с крысами с черепно-мозговой травмой. ЧЧСТКТ - черепно-мозговая травма; HR = крысы с высокой устойчивостью к гипоксии и LR = крысы с низкой устойчивостью к гипоксии. | ||||||||||
Самым распространенным и тяжелым последствием черепно-мозговой травмы был отек головного мозга, развитие которого во многом определяет появление неврологических осложнений черепно-мозговой травмы. Прием этомерсола в течение трех дней уменьшал выраженность признаков отека, предотвращая увеличение массы мозга из-за повышенного содержания воды (рис.2).
Рис. 2. Влияние этомерсола на отек мозга у крыс через 3 дня после черепно-мозговой травмы (ЧМТ). По горизонтальной оси показаны группы животных; по вертикальной оси отложен отек мозга (%), p <0,05. Белые столбцы - это крысы с высоким сопротивлением, а заштрихованные столбцы - с крысами с низким сопротивлением, * p <0,05
Уменьшение отека мозга после лечения этомерсолом может быть результатом его сосудорасширяющего действия в результате блокады потенциально зависимых и особенно контролируемых рецепторами Ca 2+ канала [11].Черепно-мозговая травма, наряду с локальным поражением головного мозга, вызвала универсальную генерализованную реакцию организма с признаками стресса, с классическими признаками состояния напряжения, нейроэндокринных и нейрогуморальных нарушений. Интегральной мерой функционально-метаболических изменений, возникающих после черепно-мозговой травмы, служили изменения в поведении животных. Сразу после черепно-мозговой травмы у крыс обеих групп наблюдалось снижение спонтанной двигательной активности. В последующие часы (до суток) наблюдались эпизоды повышенной возбудимости и агрессии, чередующиеся с состоянием торможения, которые сохранялись до трех дней у контрольных животных, не получавших фармакологические препараты.Умеренно тяжелая черепно-мозговая травма подавляла двигательную и ориентировочно-исследовательскую активность в течение трех суток у крыс с высокой и низкой устойчивостью к гипоксии. После травмы животные обеих групп демонстрировали разные модели поведения. У крыс с низким сопротивлением основным проявлением было психомоторное торможение с уменьшением объема двигательных паттернов, уменьшением вегетативных проявлений эмоциональности и повышением тревожности (табл. 3).
Таблица 3. Влияние этомерсола на показатели поведения крыс в тесте «Открытое поле» через три дня после черепно-мозговой травмы ( n = 10)
Группа | Типы двигательной активности | |||||
Горизонтально | Вертикально | Поиск | Уход | Эмоциональный | ||
2 ± 6,2 | 8,2 ± 2,2 | 5,0 ± 0,9 | 2,6 ± 0,7 | 1,5 ± 0,6 | ||
LR | ± 3,2 | 7,0 ± 0,5 | 3,6 ± 0,2 | 2,5 ± 0,3 | ||
CCT | HR | 35,4 4 ± 3,4 * | 2,0 ± 0,3 * | 1,1 ± 0,2 * | 0,5 ± 0,2 * | |
LR | 25,2 ± 4,2 *5 6 | 2,4 *2,0 ± 0,6 * | 0,6 ± 0,2 * | 0,7 ± 0,6 * | ||
CCT + пирацетам | HR | 4,2 7.2 ± 3,2 ** | 3,0 ± 0,9 ** | 1,6 ± 0,7 | 0,7 ± 0,1 ** | |
LR | 29,7 ± 4,2 | 4,2 2,2 ** | 3,2 ± 0,6 ** | 0,8 ± 0,4 ** | 0,7 ± 0,3 | |
CCT + этомерол | HR | 8.9 ± 3,2 ** | 4,0 ± 0,2 ** | 2,2 ± 0,7 ** | 1,2 ± 0,2 ** | |
LR | 56,5 ± 4,2 ** | 9,2 ± 4,2 ** | 6,0 ± 0,9 ** | 2,9 ± 0,6 ** | 1,9 ± 0,8 ** | |
Примечание. Данные сравниваются с 3 днями после черепно-мозговой травмы (ЧМТ). * p <0.05 по сравнению с крысами без черепно-мозговой травмы; ** p <0,05 по сравнению с крысами с черепно-мозговой травмой. HR = крысы с высокой устойчивостью к гипоксии и LR = крысы с низкой устойчивостью к гипоксии. | ||||||
Введение этомерсола оказало психоактивирующее действие, выраженное в уменьшении психопатологической симптоматики и восстановлении структуры индивидуального поведения. Менее выраженные эффекты пирацетама, вероятно, были связаны с коротким курсом лечения, поскольку для пирацетама характерно более постепенное начало терапевтических изменений.После лечения этомеролом у крыс с высокой и особенно низкой резистентностью наблюдалось восстановление ориентировочно-исследовательского поведения в течение одного дня после черепно-мозговой травмы с увеличением взаимосвязи движения и исследовательской активности. Время восстановления после черепно-мозговой травмы у высокорезистентных особей было меньше, чем у животных с низкой устойчивостью к гипоксии. Анализ поведенческих реакций крыс в приподнятом крестообразном лабиринте после введения этомерсола показал увеличение времени, проведенного животными в открытых рукавах, частоты подвешивания за края лабиринта и количества вертикальных вставок.Увеличилось процентное соотношение количества экскурсий в открытые объятия к общему количеству экскурсий. В целом, эти показатели, чувствительные к анксиотропным факторам и использованные для оценки тревожности [6], продемонстрировали, что этомерол снимает тревожное состояние у животных, перенесших черепно-мозговую травму (рис. 3). Наиболее положительные изменения наблюдались у животных с низкой устойчивостью к гипоксии.
Рис. 3. Влияние этомерсола на показатели тревожности в тесте «приподнятый лабиринт» у крыс.Вертикальная ось показывает количество экскурсий в открытые объятия как долю от всех экскурсий. ЧМТ — черепно-мозговая травма, * p <0,05 для группы ЧМТ
Таким образом, введение этомерола крысам в течение трех дней после травмы черепа средней степени тяжести предотвратило распад отдельных компонентов общих поведенческих реакций и способствовало быстрому восстановлению структуры. индивидуального поведения животных как с высокой, так и с низкой устойчивостью к гипоксии.Степень изменений рефлекторно-поведенческого статуса крыс в посттравматический период наиболее выражена у животных с низкой устойчивостью к гипоксии; защитные эффекты этомерсола также были наиболее выражены в этой группе животных.
Метаболические изменения в мозге животных с высокой и низкой резистентностью после черепно-мозговой травмы также различались. Животные с низкой резистентностью, которые представляют «группу риска» по травмам, показали более выраженный дефицит энергии, больший лактоацидоз, более обширную активацию перекисного окисления липидов и большее подавление антиоксидантных систем (см. Таблицу 4).Свойства этомерсола предотвращали ограничение скорости НАД-зависимого дыхания, продемонстрированного на модели церебральной циркуляторной гипоксии [10], предполагая, что он должен стабилизировать энергетический обмен в головном мозге после черепно-мозговой травмы. Фактически, в посттравматический период этомерсол и пирацетам способствовали нормализации пула макроэргических веществ в мозге крыс с высокой и низкой устойчивостью к гипоксии, устраняя метаболический ацидоз. Эти два агента вызывали аналогичное снижение лактоацидоза, хотя этомерзол приводил к увеличению пула креатинфосфата и АТФ в мозге из-за его способности предотвращать разобщение фосфорилирования от окисления.
Таблица 4. Влияние этомерсола на показатели энергетического метаболизма, перекисного окисления липидов и антиоксидантных систем в головном мозге крыс после черепно-мозговой травмы ( n = 8)
| 9000 Группа | Интактная | ЧМТ, 1 день | ЧМТ, 3 дня | ЧКТ, 3 дня + пирацетам | CCT, 3 дня + конъюгаты этимерсола | |||||||||||||
HR | 21.69 ± 0,28 | 45,05 ± 1,36 a | 47,73 ± 0,51 a | 35,59 ± 0,46 b | 28,21 ± 0,31 9037 9037 28,21 ± 0,31 9037 | 24,09 ± 0,32 | 61,19 ± 0,78 a | 51,14 ± 0,24 a | 43,33 ± 0,23 b 56 | 11 ± 0,22 b |||||||||
Малоновый диальдегид, ммоль / г | HR | 6,56 ± 0,17 | 19,17 ± 0,64 a
| 8,48 ± 0,15 b | 7,24 ± 0,37 b | |||||||||||||
LR | 7,66 ± 0,16 | 7,66 ± 0,16 | 16 ± 0,13 a | 9,74 ± 0,12 b | 8,52 ± 0,17 b | |||||||||||||
Восстановленный глутатион, ммоль / г | 0,6918,62 ± 0,40 a | 21,79 ± 0,40 a | 33,53 ± 0,41 b | 35,91 ± 0,77 03 907 31.12 ± 0,19 | 12,23 ± 0,62 a | 18,09 ± 0,53 a | 22,32 ± 0,34 b | 28,49 ± 0,24 90oxide дисмутаза, Акт / мг белка | HR | 3,11 ± 0,09 | 0,95 ± 0,04 a | 1,07 ± 0,05 a | 34 ± 0,08 b | 2,59 ± 0,08 b | ||||
LR | 2,09 ± 0,05 | 0,71 ± 0,03 | 6 1 | 1,86 ± 0,03 b | 2,18 ± 0,04 b | |||||||||||||
Креатинфосфат, ммоль / г | HR56 | 12 ± 0,051,89 ± 0,03 a | 2,92 ± 0,12 a | 3,18 ± 0,08 b | 3,89 003 9037 9407 907 907 | 3,72 ± 0,04 | 1,12 ± 0,05 a | 1,87 ± 0,03 a | 2,92 ± 0,05 b 5 | |||||||||
АТФ, ммоль / г | HR | 3,53 ± 0,12 | 2,12 ± 0,13 а 0,06 | 3,78 ± 0,32 b | 3,27 ± 0,07 b | |||||||||||||
LR | 2,78 ± 0,15 | 1,32 ± 0,08 975 | ± 0,11 a | 2,12 ± 0,07 b | 2,98 ± 0,05 b | |||||||||||||
Лактат, ммоль / г | 0,09 | 0,09 | 0,09 | 7,46 ± 0,13 a | 6,26 ± 0,18 a | 3,78 ± 0,32 b | 3,27 ± 0,07 b | 44 940759,63 ± 0,07 a | 5,52 ± 0,06 a | 4,31 ± 0,09 b | 3.52 ± 0.07 , ммоль / г | HR | 0,36 ± 0,01 | 0,15 ± 0,03 а | 0,08 ± 0,01 а | 0,01 | 0,07
| 0,07 0.32 ± 0,01 b |
LR | 0,27 ± 0,02 | 0,16 ± 0,01 a | 0,06 ± 0,01 | 6 0,07 0,06 | 0,26 ± 0,01 b | |||||||||||||
Примечание. a p <0,05 по сравнению с крысами без черепно-мозговой травмы; b p <0.05 по сравнению с крысами с черепно-мозговой травмой через 3 дня. ЧМТ - черепно-мозговая травма; HR = крысы с высокой устойчивостью к гипоксии и LR = крысы с низкой устойчивостью к гипоксии. | ||||||||||||||||||
Лечение посттравматических крыс пирацетамом и этомерсолом помогает предотвратить чрезмерное перекисное окисление липидов и стабилизирует активность антиоксидантных систем головного мозга. Этомерсол более эффективен, чем пирацетам, в предотвращении накопления первичных и вторичных продуктов перекисного окисления липидов, снижая уровень пониженного глутатиона и активность супероксиддисмутазы в головном мозге.По сравнению с пирацетамом, положительные метаболические изменения, наблюдаемые у крыс, получавших этомерол, были более выражены в группе с низкой устойчивостью к острой гипоксии. Сходство структуры этомерсола и большинства его защитных эффектов при гипоксическом повреждении с таковыми беметила, другого представителя класса фармакологических антиоксидантов, предполагает, что антиоксидантные эффекты этомерсола могут быть результатом его энергостабилизирующего действия и его отдельных антирадикальных и антиоксидантных свойств. мероприятия [14]. Таким образом, индивидуальная сопротивляемость организма острой гипоксии имеет решающее значение в раннем периоде восстановления после черепно-мозговой травмы, а лечение этомерзолом предотвращает поведенческие и метаболические нарушения, возникающие после травмы головного мозга.
АНТИГИПОКСАНТЫ, АНТИДЕПРЕССАНТЫ И ПОВРЕЖДЕНИЯ МОЗГА
Посткоммоционный период черепно-мозговой травмы (ЧМТ) характеризуется длительной реабилитацией пациентов. Патогенез ЧМТ включает нейродинамические и метаболические нарушения центральной нервной системы, которые в первую очередь связаны с гипоксическим повреждением нервной ткани и приводят к развитию постгипоксической энцефалопатии. Психопатологический синдром — частое отсроченное последствие ЧМТ, проявляющееся при астенических, невротических и неврозоподобных расстройствах [5].Выраженность психовегетативного синдрома и эмоционально-интеллектуальных нарушений прогрессивно увеличивается после ЧМТ. Патологические изменения в головном мозге развиваются в отсроченном периоде после ЧМТ и аналогичны тем, которые наблюдаются у депрессивных пациентов [2].
Общий принцип фармакотерапии ЧМТ — комбинированное лечение с учетом патогенетических особенностей заболевания. Стандартная терапия посттравматических расстройств должна включать фармакологические препараты, обладающие ноотропным и антигипоксическим действием.Чтобы избежать чрезмерного использования препаратов для комбинированного лечения пациентов с ЧМТ, необходимо синтезировать новые препараты со специфической фармакологической активностью. Антигипоксант бемитил (гидробромид 2-этилтиобензимидазола) обладает ноотропным и умеренным психостимулирующим действием и полностью соответствует этим требованиям [4, 8, 9]. Изучали церебропротекторный эффект индивидуального и комбинированного лечения антигипоксантом бемитилом и антидепрессантом пиразидолом у животных с ЧМТ, отличающихся различной устойчивостью к гипоксии.
Эксперименты выполнены на самцах крыс-альбиносов линии Вистар массой 160–180 г. В каждой группе было по 8–10 животных. Животные были разделены на группы по устойчивости к острой гипоксии. Гипоксия производилась в барокамере. Крыс поднимали на высоту 12000 м (50 м / сек) и содержали в этих условиях до появления агонального дыхания. Животные, выжившие в течение 5–10 и более 10 мин, считались низкоустойчивыми (LR) и высокорезистентными (HR) соответственно.Умеренная закрытая ЧМТ производилась через 24 ч после гипоксии. Вес 64 г свободно упал из полой трубки (высота 80 см, диаметр 1,3 см) в теменную область головы [7]. Голова фиксировалась на мягкой подушке для предотвращения перелома челюсти. Животные с вдавленным переломом теменной доли погибали в первые минуты после ЧМТ (не более 5% крыс). Мозг умерших животных не исследовали. Крысы были разделены на группы. Животным 1-й группы внутрибрюшинно вводили бемитил в дозе 25 мг / кг (ИЦН-Октябрь, Россия) в течение 20 дней.Пиразидол в дозе 1 мг / кг (Фармакон, Россия) вводили внутрибрюшинно крысам 2-й группы. Комбинированное лечение пиразидолом 1 мг / кг и бемитилом 25 мг / кг применяли к животным 3 группы. Контрольные крысы получали эквивалентный объем физиологического раствора. Заключение о положительном влиянии препаратов на животных с ЧМТ было основано на выживаемости, поведенческих реакциях и биохимических анализах. Изучена физиологическая реакция крыс на ЧМТ в тестах «открытое поле» и «приподнятый крестообразный лабиринт».Регистрировали ориентировочно-исследовательскую, эмоциональную, стереотипную и двигательную активность животных. Состояние энергетического обмена в головном мозге определялось содержанием креатинфосфата, АТФ, молочной и пировиноградной кислот [14] в тканях мозга, предварительно замороженных в жидком азоте. Интенсивность перекисного окисления липидов (ПОЛ) оценивали по концентрациям конъюгированных диенов и малонового диальдегида (МДА) [15]. Состояние антиоксидантной системы оценивали по количеству восстановленного глутатиона и активности супероксиддисмутазы (СОД) [13].Активность фермента рассчитывали на содержание белка в образцах, измеренное методом Лоури. Результаты были проанализированы с помощью t-критерия Стьюдента.
Крысы, фенотипически различающиеся по устойчивости к гипоксии до ЧМТ, проявляли различные поведенческие реакции. Животные HR характеризовались «плавным» поведением в открытом поле и приподнятом крестообразном лабиринте. Крысы LR обладали выраженной двигательной и исследовательской активностью и высоким уровнем тревожности. После ЧКТ последовала инверсия индивидуальных поведенческих характеристик.Крысы LR были вялыми и не проявляли исследовательской активности. Эти изменения отражают распад отдельных компонентов в общей поведенческой реакции. Крысы HR сохранили такие поведенческие реакции, как фырканье и движение. Исследовательская активность снизилась у животных обеих групп. Однако у животных с ЧР наблюдались поведенческие и вегетативные признаки повышенной эмоциональной реактивности. Количество и продолжительность реакций груминга и дефекации увеличились. Эти изменения отражали психомоторное возбуждение животных.У контрольных крыс наблюдаемые поведенческие реакции сохранялись в течение 20 дней после травмы.
Индивидуальное или комбинированное введение пиразидола и бемитила увеличивало выживаемость крыс с ЧМТ (таблица 5). Количество крыс HR и LR, получавших пиразидол и выживших через 3 дня после ЧМТ, было на 10% больше по сравнению с необработанными животными. Бемитил увеличивал количество выживших крыс HR и LR на 44 и 52% соответственно. После комбинированного лечения пиразидолом и бемитилом выживаемость крыс HR и LR превышала контроль на 50 и 66% соответственно.Поведенческие реакции крыс с ЧМТ претерпели изменения после 20-дневной терапии (таблица 6). Двигательная и исследовательская активность животных LR, получавших пиразидол, увеличивалась, что проявлялось в сокращении латентности первого движения и увеличении количества пересеченных квадратов, вертикальных позы вставания, заходов в центр открытого поля и исследуемых нор. Пиразидол оказывает умеренное каталептическое действие на крыс линии HR. Этот препарат снижал вертикальную и горизонтальную активность животных с ЧСС. После лечения пиразидолом сокращение латентности первого движения у крыс HR было более выраженным, чем у животных LR.Изменения в поведении крыс HR отражают седативный эффект пиразидола. Бемитил значительно увеличивал двигательную и исследовательскую активность крыс линии HR и LR. Наблюдаемые изменения были наиболее выражены у животных LR. Однако у обработанных крыс эти показатели не достигли контрольного уровня. Совместное введение пиразидола и бемитила практически не влияло на двигательную и исследовательскую активность крыс LR и HR.
Таблица 5. Выживаемость животных через 3 дня после CCT
Группа | CCT ( n = 30) | CCT и пиразидол ( n ) CCT и бемитил ( n = 19) | CCT и пиразидол + бемитил ( n = 30) | |||||
абс. | % | абс. | % | абс. | % | абс. | % | |
HR | 14 | 40 | 15 | 50 | 90 | |||
LR | 8 | 27 | 11 | 37 | 15 | |||
Примечание. ЧМТ — черепно-мозговая травма; HR = крысы с высокой устойчивостью к гипоксии, LR = крысы с низкой устойчивостью к гипоксии. | ||||||||
Таблица 6. Влияние индивидуального или комбинированного лечения пиразидолом и бемитилом на двигательную активность, эмоциональную реактивность и уровень беспокойства у крыс с ЧМТ ( M ± m n = 10)
Индекс | Неповрежденный | CCT | CCT и пиразидол | CCT и berazidol | CCT6 и bebe | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Двигательная активность | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Количество скрещенных квадратов | HR | 55.2 ± 6,2 | 38,2 ± 4,2 * | 25,2 ± 2,1 # | 48,3 ± 2,6 # | 58,2 ± 4,7 # | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
LR5 | 21,2 ± 2,2 * | 26,5 ± 3,3 # | 59,5 ± 3,4 # | 64,9 ± 3,3 # | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Задержка первого движения, с56 903 | 25.2 ± 4,1 | 30,1 ± 4,2 * | 10,3 ± 3,2 # | 19,3 ± 5,4 # | 26,1 ± 2,4 # | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ± 4,2 | 40,1 ± 2,3 * | 29,2 ± 2,5 # | 12,3 ± 1,4 # | 14,2 ± 3,4 # | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Число входов в центр | 10.0 ± 1,3 | 5,2 ± 2,2 * | 4,1 ± 1,1 # | 8,2 ± 2,3 # | 11,2 ± 4,3 # | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
LR | 1,2 | 3,1 ± 1,2 * | 4,3 ± 2,1 # | 5,6 ± 1,9 # | 8,4 ± 2,6 # | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Количество стоек для выращивания | 20.0 ± 2,2 | 14,2 ± 3,4 * | 12,1 ± 1,4 # | 15,2 ± 2,7 # | 19,2 ± 5,1 # | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4220003 LR | 2,2 ± 1,2 * | 3,5 ± 2,3 # | 35,4 ± 2,3 # | 45,2 ± 2,7 # | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Количество разведанных скважин | 5.0 ± 0,9 | 1,0 ± 0,3 * | 0,6 ± 1,3 # | 4,1 ± 1,3 # | 5,5 ± 1,3 # | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
LR | 0,5 ± 0,2 * | 1,2 ± 1,4 # | 7,4 ± 2,3 # | 7,9 ± 4,2 # | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Эмоциональная реактивность HR 2.0 ± 0,1 3,2 ± 0,3 * 0,8 ± 0,2 1,6 ± 0,3 # 1,8 ± 0,2 LR 0,9 ± 0,2 * 1,4 ± 0,4 # 2,0 ± 0,2 # 2,6 ± 0,3 # Продолжительность реакций груминга, сек HR HR 25.3 ± 4,2 29,2 ± 2,3 * 8,1 ± 3,3 18,3 ± 4,1 # 20,2 ± 2,4 # LR5 5,2 ± 2,4 * 8,3 ± 4,5 # 19,2 ± 2,5 # 28,3 ± 4,3 # Скорость дефекации HR0 ± 0,3 3,1 ± 0,3 * 1,3 ± 0,4 1,6 ± 0,2 # 1,8 ± 0,2 # LR 0,8 ± 0,2 * 1,2 ± 0,2 # 2,2 ± 0,2 # 2,6 ± 0,4 # Беспокойство HR 53 ± 3 22 ± 5 * 29 ± 4 45 ± 6 # 56 ± 40006 LR 78 ± 4 17 ± 5 * 42 ± 6 # 48 ± 3 # 73 ± 3 # HR 222 ± 6 278 ± 5 * 271 ± 3 255 ± 3 # LR 247 ± 7 283 ± 4 * 258 ± 2 # 252 ± 4 # Вид из закрытого рычага HR 7.4 ± 0,3 2,2 ± 0,4 * 2,7 ± 0,4 4,8 ± 0,3 # 6,9 ± 0,4 # 1,2 ± 0,2 * 2,6 ± 0,6 # 4,5 ± 0,2 # 5,6 ± 0,2 # Количество входов в центр HR HR 4.4 ± 0,2 1,2 ± 0,3 * 1,4 ± 0,3 2,2 ± 0,4 # 4,6 ± 0,4 # LR 0,4 ± 0,2 * 0,8 ± 0,1 # 1,6 ± 0,2 # 2,5 ± 0,1 # Количество выступов HR .2 ± 0,2 1,4 ± 0,3 * 1,7 ± 0,2 3,4 ± 0,3 # 5,9 ± 0,2 # LR 0,9 ± 0,5 * 2,4 ± 0,4 # 3,2 ± 0,2 # 4,4 ± 0,3 # Примечание. * p <0,05 по сравнению с интактными животными; # p <0.05 по сравнению с черепно-мозговой травмой. ЧМТ - черепно-мозговая травма; HR = крысы с высокой устойчивостью к гипоксии и LR = крысы с низкой устойчивостью к гипоксии. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Таблица 6. (продолжение)
Эмоциональная реактивность крыс, пролеченных в посттравматическом периоде, претерпела значительные изменения. Пиразидол оказывал седативное действие на крыс HR, что проявлялось в снижении скорости и продолжительности реакций груминга (см. Таблицу 6). Напротив, пиразидол оказывал стимулирующее действие и увеличивал эмоциональную реактивность животных LR.Бемитил действовал как психостимулятор при ЧСС и, особенно, у крыс линии LR. Комбинированное лечение пиразидолом и бемитилом более значительно улучшало эмоциональную реактивность животных, которая не отличалась от нормы. У животных, получавших исследуемые препараты, показатели тревожности соответствовали эмоциональному состоянию. Пиразидол увеличивал время пребывания в открытых рукавах приподнятого крестообразного лабиринта, количество заходов в центр лабиринта и количество нависающих поз. Мы наблюдали увеличение соотношения между количеством входов в открытые рукава и общим количеством переходов.Эти индексы иллюстрируют влияние анксиотропных факторов и используются для оценки тревожности [6]. Наблюдаемые изменения указывают на то, что пиразидол снимает симптомы тревоги у животных с ЧМТ. Следует подчеркнуть, что у крыс с ЧСС эти показатели изменились незначительно. Однако изменения степени тревожности были значительными у животных LR и отражали мощный антидепрессивный эффект препарата.
Беметил-терапия облегчила симптомы тревоги у крыс LR и HR с ЧМТ.Уровень тревожности после монотерапии бемитилом не достиг нормы. Психостимулирующее действие бемитила наиболее выражено у крыс линии LR. Совместное введение бемитила и пиразидола снижало степень беспокойства у животных обеих групп.
Наши результаты показывают, что индивидуальное или комбинированное лечение исследуемыми препаратами оказывает различное влияние на поведенческие реакции крыс с ЧМТ. Пиразидол имел типичный «сбалансированный» эффект, увеличивал двигательную активность и снижал тревожность и эмоциональную реактивность у крыс LR.Однако препарат оказывал седативное и умеренное каталептическое действие на животных с сердечной недостаточностью. В отличие от пиразидола, бемитил не снижал двигательную и эмоциональную активность крыс HR. Кроме того, бемитил обладал психостимулирующим действием и увеличивал двигательную и эмоциональную активность у животных LR. При комбинированном лечении пиразидол и бемитил аддитивно влияли на поведенческие реакции животных, фенотипически различающихся по устойчивости к гипоксии. Эти крысы не отличались от интактных животных по двигательной и ориентировочно-исследовательской активности, эмоциональной реактивности и уровню тревожности.Поведенческие реакции служат общим критерием функциональных и метаболических изменений. Можно предположить, что бемитил, обладающий метаболической активностью, оказывает сильное терапевтическое действие при лечении последствий КТТ. Бемитил обладает энергостимулирующими и антиоксидантными свойствами. Защитный эффект этого препарата при ЧМТ требует дальнейших исследований. Мы изучали метаболический эффект индивидуального или комбинированного лечения пиразидолом и бемитилом у крыс с ЧМТ. Испытуемые препараты оказывали различное церебропротекторное действие (табл. 7).
Таблица 7. Влияние пиразидола, бемитила и их комбинации на параметры энергетического обмена, липопротеинов и антиоксидантных систем в головном мозге крыс после ЧМТ ( M ± m , n = 10)
Индекс | Неповрежденный | CCT | CCT и пиразидол | CCT и bemithyl 3 9378 CCT3 и bemithyl 90 | HR | 21.58 ± 0,26 | 45,12 ± 0,32 * | 37,25 ± 0,21 | 27,89 ± 0,16 | 20,56 ± 0,21 | |
| 0003 | |||||||||||
LR 0,25 56,14 ± 0,82 * | 41,35 ± 0,22 # | 29,35 ± 0,13 | 23,22 ± 0,23 | ||||||||
MDA, мкмоль / г | 18 ± 0,15 | 15,14 ± 0,12 * | 10,27 ± 0,12 # | 7,72 ± 0,11 | 7,01 ± 0,17 | ||||||
12,12 ± 0,11 # | 8,13 ± 0,12 | 8,14 ± 0,14 | |||||||||
Восстановленный глутатион, мкмоль / г | 22,62 ± 0,40 * | 29,79 ± 0,21 | 37,15 ± 0,21 | 39,85 ± 0,27 | |||||||
| 9750003 | |||||||||||
| 15,23 ± 0,62 * | 21,02 ± 0,23 # | 24,12 ± 0,14 | 28,87 ± 0,24 | ||||||||
SOD, ед. / Мг белка 30006 | HR | 21 ± 0,07 | 1,25 ± 0,06 * | 1,57 ± 0,04 | 2,04 ± 0,07 | 2,89 ± 0,06 | |||||
0,06 0,88 ± 0,03 * | 1,22 ± 0,03 # | 1,97 ± 0,04 | 2,18 ± 0,04 | ||||||||
Креатинфосфат, мкмоль / г | 25 ± 0,04 | 1,12 ± 0,04 * | 2,28 ± 0,12 | 3,18 ± 0,04 | 3,69 ± 0,04 | ||||||
0 0,87 ± 0,05 * | 1,98 ± 0,03 # | 2,87 ± 0,05 | 2,98 ± 0,03 | ||||||||
АТФ, мкмоль / г | 68 ± 0,14 | 2,12 ± 0,9 * | 2,45 ± 0,12 | 3,18 ± 0,12 | 3,78 ± 0,05 | ||||||
5 0,19 1,29 ± 0,05 * | 1,81 ± 0,11 # | 2,11 ± 0,07 | 2,12 ± 0,02 | ||||||||
Лактат, мкмоль / г | 11 ± 0,04 | 6,24 ± 0,03 * | 5,12 ± 0,12 # | 2,88 ± 0,22 | 3,12 ± 0,05 | ||||||
LR 8,43 ± 0,06 * | 6,52 ± 0,09 # | 4,54 ± 0,05 | 4,12 ± 0,06 | ||||||||
Пируват, мкмоль / г56 73 07 78 | 38 ± 0,010,14 ± 0,02 * | 0,19 ± 0,01 # | 0,25 ± 0,01 | 0,32 ± 0,01 | |||||||
0,25 0,05 0,09 ± 0,01 * 0,14 ± 0,01 # 0,19 ± 0,01 0,22 ± 0,01 | |||||||||||
Примечание. * p <0,05 по сравнению с интактными животными; # p <0.05 по сравнению с ЧМТ - черепно-мозговая травма. | |||||||||||
Пиразидол более эффективно предотвращал развитие метаболических нарушений в головном мозге крыс LR. Препарат снизил содержание конъюгированных диенов и МДА на 26 и 42% соответственно. Более того, пиразидол увеличивал содержание восстановленного глутатиона и активность СОД на 38 и 39% соответственно. Стабилизация энергетического потенциала головного мозга крыс LR, получавших пиразидол, проявлялась в повышении содержания креатинфосфата и АТФ (на 128 и 40% соответственно).Препарат предотвращал накопление избытка лактата, но увеличивал содержание пирувата на 56%. Состояние метаболизма в головном мозге крыс HR, получавших пиразидол, имело тенденцию к норме. Следует подчеркнуть, что бемитил оказался более сильнодействующим, чем пиразидол, при лечении животных с ЧМТ. У животных обеих групп бемитил предотвращал накопление продуктов ПОЛ в головном мозге, подавление антиоксидантной системы, развитие метаболического ацидоза и дефицита энергии. Терапевтический эффект бемитила был более выражен у крыс линии LR.Однако метаболические показатели у крыс, получавших бемитил, не достигли нормы. После совместного введения пиразидола и бемитила метаболическое состояние головного мозга обработанных крыс не отличалось от такового у интактных животных. Комбинированное лечение исследуемыми препаратами наиболее достоверно нормализовало содержание продуктов ПОЛ, активность СОД и количество макроэргических соединений у крыс LR.
Эти данные указывают на то, что фенотипическая устойчивость к гипоксии играет роль в формировании поведенческих реакций и метаболических изменениях в головном мозге после ЧМТ.Поэтому лицам, различающимся по устойчивости к гипоксии, необходима индивидуальная фармакологическая коррекция. Монотерапия пиразидолом по поводу последствий ЧМТ вызвала «сбалансированный» эффект у крыс HR. Препарат обладал анксиолитическим действием и снижал психомоторное возбуждение крыс линии HR в посттравматическом периоде. Однако пиразидол оказывал активирующее действие на животных LR. Бемитил имел одинаковые эффекты у крыс HR и LR с CCT. Препарат нормализовал индивидуальные особенности поведения и обмен веществ в головном мозге.Однако бемитиловая терапия была предпочтительнее для животных LR. Мягкий психостимулирующий эффект бемитила у крыс LR был более выражен, чем у животных HR. При комбинированном лечении пиразидол и бемитил оказывали аддитивный корректирующий эффект у крыс HR и LR с последствиями CCT. Это лечение нормализовало поведенческие реакции и предотвратило развитие метаболических нарушений в головном мозге. Учитывая аддитивный эффект препаратов, нельзя исключить, что антидепрессант пиразидол может применяться в меньшей дозе при комбинированном лечении с бемитилом.Иногда невозможно оценить фенотипические характеристики организма по устойчивости к гипоксии. Затем для коррекции нарушений высшей нервной деятельности и метаболических изменений в головном мозге во время ЧМТ необходимо комбинированное лечение антидепрессантом пиразидолом и антигипоксантом бемитилом.
Основные подходы и принципы контролируемой инфузионной терапии у больных с неотложной хирургической патологией органов брюшной полости
Королевский колледж хирургов Англии, Министерство здравоохранения.RCS / DH; Лондон: 2010. Хирургический пациент с повышенным риском: на пути к улучшенному уходу за забытой группой.
Неотложная хирургия, Стандарты внеплановой хирургической помощи, Руководство для поставщиков медицинских услуг, уполномоченных и специалистов по планированию услуг. — Лондон: RCS, 2011.
.Знание риска; Обзор периоперационного ухода за хирургическими пациентами // NCEPOD. — 2011.
Хорвуд Дж., Ратнам С., Мо А. Решения к оперативным действиям: дилемма 5-го уровня ASA // Ann.R. Coll. Surg. Англ. — 2011. — 93 (5). — 365-369. [Паб. Мед.]
Сондерс Д.И., Мюррей Д., Пичел А.С., Варли С., Педен С.Дж. Сеть экстренной лапаротомии Великобритании. Вариации смертности после экстренной лапаротомии: первый отчет Британской сети экстренной лапаротомии // Br. J. Anaesth. — 2012. — 109 (3). — 368-75. DOI: 10,1093 / bja / aes165. [Паб. Мед.] [Крест. Ссылка]
Стюарт П.А. Современная количественная кислотно-основная химия // Кан. J. Physiol. Pharmacol.- 1983. — 61. — 1444-61.
Kellum J.A., Elbers P.W.G. Учебник Кислотно-Основного Стюарта. — 2-е изд. — Баркинг, Великобритания: Lulu Enterprises UK Ltd., 2009.
.Lloyd P., Freebairn R. Использование количественного кислотно-основного анализа в отделении интенсивной терапии // Крит. Уход Resusc. — 2006 г. — 8. — 19-30. [Паб. Мед.]
Gilfix B.M., Bique M., Magder S. Физико-химический подход к анализу кислотно-щелочного баланса в клинических условиях // J. Crit. Забота. — 1993.- 8. — 187-97. [Паб. Мед.]
Беренд К., де Врис А.П., Ганс Р.О. Физиологический подход к оценке кислотно-щелочных нарушений // N. Engl. J. Med. — 2014. — 371. — 1434-45. DOI: 10,1093 / bja / aes165. [Паб. Мед.] [Крест. Ссылка]
Seifter J.L. Интеграция кислотно-основных и электролитных нарушений // N. Engl. J. Med. — 2014. — 371. — 1821-31.
Фигге Дж. Дж. Интеграция кислотно-основных и электролитных нарушений // N. Engl. J. Med.- 2015. — 372. — 390. [Pub. Мед.]
Rocktaeschel J., Morimatsu H., Uchino S., Goldsmith D., Poustie S., Story D., Gutteridge G., Story DA, Vaja R., Poustie SJ, McNicol L. Анализ кислотно-основного состава Фенкла-Стюарта изменения сразу после трансплантации печени // Крит. Уход Resusc. — 2008. — 10. — 23. [Pub. Мед.]
История Д.А. Заполнение (сильного ионного) промежутка // Крит. Care Med. — 2008. — 36. — 998-9. [Паб. Мед.]
Юнос Н.М., Ким И.Б., Белломо Р., Бейли М., Хо Л., Стори Д., Гаттеридж Г.А., Харт Г.К. Биохимические эффекты ограничения хлорсодержащих жидкостей в реанимации // Крит. Care Med. — 2011. — 39. — 2419-24. [Паб. Мед.]
Guidet B., Soni N., Della R.G. и другие. Сбалансированный взгляд на сбалансированные решения // Крит. Забота. — 2010. — 14. — 325. [Pub. Мед.]
Каплан Л.Дж., Келлум Дж. А. Жидкости, pH, ионы и электролиты // Curr. Opin. Крит. Забота. — 2010. — 16. — 323-31.[Паб. Мед.]
Deng L.Q. Влияние переливания лактатного раствора Рингера на концентрацию лактата в артериальной крови и кислотно-щелочной баланс при ортотопической трансплантации печени // Подбородок. J. Mod. Nurs. — 2008. — 14. — 1754. DOI: 10.1093 / bja / aes165. [Паб. Мед.] [Крест. Ссылка]
Теллан Г., Антонуччи А., Марандола М. и др. Послеоперационный метаболический ацидоз: использование трех различных моделей инфузионной терапии // Чир. Ital. — 2008. — 60. — 33-40. [Паб. Med.] [Крест. Ссылка]
Nuraei N., Khajenouri R., Soleimani M., Dabbagh A. Эффекты интраоперационного физиологического раствора по сравнению с раствором Рингера с лактатом на клинические исходы и лабораторные данные у пациентов с трансплантацией почки // Тегеран. Univ. Med. J. — 2010. — 68. — 872-7. [Паб. Мед.]
Раманатан С., Масих А.К., Ашок У., Арисменди Дж., Турндорф Х. Концентрации лактата и пирувата в крови матери и новорожденного при различных внутривенных жидкостях, используемых для предварительной гидратации перед эпидуральной анестезией // Anesth.Анальг. — 1984. — 63. — 69-74. [Паб. Мед.]
О’Мэлли К.М., Фрументо Р.Дж., Харди М.А. и др. Рандомизированное двойное слепое сравнение раствора Рингера с лактатом и 0,9% NaCl при трансплантации почек // Anesth. Анальг. — 2005. — 100. — 1518-24. [Паб. Мед.]
Хаджави М.Р., Этезади Ф., Мохарари Р.С. и другие. Эффекты физиологического раствора по сравнению с лактатом Рингера при трансплантации почки // Рен. Неудача. — 2008. — 30. — 535-9. DOI: 10.4103 / 0019-5049.123332.[Паб. Мед.] [Крест. Ссылка]
Хадимиоглу Н., Саадави И., Саглам Т., Эртуг З., Динкан А. Влияние различных растворов кристаллоидов на кислотно-щелочной баланс и раннюю функцию почек после трансплантации почки // Anesth. Анальг. — 2008. — 107. — 264-9. DOI: 10,1093 / bja / aes165. [Паб. Мед.] [Крест. Ссылка]
Aoki K., Yoshino A., Yoh K., Sekine K., Yamazaki M., Aikawa N. Сравнение лактатных и ацетатных растворов Рингера и реанимационные эффекты на височную дисоксию у пациентов с обширными ожогами // Burns.- 2010. — 36. — 1080-5. DOI: 10,1093 / bja / aet487. [Бесплатная статья PMC] [Pub. Мед.] [Крест. Ссылка]
Shin W.J., Kim Y.K., Bang J.Y., Cho S.K., Han S.M., Hwang G.S. Тесты функции лактата и печени после правой гепатэктомии живого донора: сравнение растворов с лактатом и без него // Acta Anaesthesiol. Сканд. — 2011. — 55. — 558-64. DOI: 10,1093 / bja / aet487. [Паб. Мед.] [Крест. Ссылка]
Mahler S.A., Conrad S.A., Wang H., Arnold T.C. Реанимация сбалансированным раствором электролитов предотвращает гиперхлоремический метаболический ацидоз у пациентов с диабетическим кетоацидозом // Am.J. Emerg. Med. — 2011. — 29. — 670-4. [Паб. Мед.]
Wu B.U., Hwang J.Q., Gardner T.H. и другие. Лактатный раствор Рингера снижает системное воспаление по сравнению с физиологическим раствором у пациентов с острым панкреатитом // Клин. Гастроэнтерол. Гепатол. — 2011. — 9. — 710-7. DOI: 10.4103 / 0019-5049.123332. [Бесплатная статья PMC] [Pub. Мед.] [Крест. Ссылка]
Heidari S.M., Saryazdi H., Shafa A., Arefpour R. Сравнение эффекта предоперационного введения раствора Рингера, нормального и гипертонического 5% раствора на послеоперационную тошноту и рвоту: рандомизированное двойное слепое клиническое исследование // Пак.J. Med. Sci. — 2011. — 27. — 771-4. DOI: 10,1093 / bja / aet487. [Паб. Мед.] [Крест. Ссылка]
Hasman H., Cinar O., Uzun A., Cevik E., Jay L., Comert B. Рандомизированное клиническое испытание, сравнивающее влияние быстро вводимых кристаллоидов на кислотно-щелочной статус у обезвоженных пациентов в отделении неотложной помощи // Int. J. Med. Sci. — 2012. — 9. — 59-64. [Паб. Мед.]
Моди М.П., Вора К.С., Парих Г.П., Шах В.Р. Сравнительное исследование влияния инфузии раствора лактата Рингера по сравнению с физиологическим раствором на кислотно-щелочной баланс и электролиты сыворотки во время трансплантации родственных почек живыми // Saudi J.Почек Dis. Транспл. — 2012. — 23. — 135-7. [Паб. Мед.]
Рид Ф., Лобо Д.Н., Уильямс Р.Н., Роулендс Б.Дж., Эллисон С.П. (Ab) нормальный физиологический раствор Хартмана: рандомизированное двойное слепое перекрестное исследование // Clin. Sci (Лондон). — 2003. — 104. — 17-24. [Паб. Мед.]
Ганнерсон К.Дж., Сол М., Хе С., Келлум Дж. А. Лактат против метаболического ацидоза, не связанного с лактатом: ретроспективная оценка исходов тяжелобольных пациентов // Крит. Забота. — 2006.- 10. — R22. [Паб. Мед.]
Браммель-Зиединс К., Велихан М.Ф., Зиединс Э.Г., Манн К.Г. Выбранная вами реанимационная жидкость может усилить кровотечение // J. Trauma. — 2006. — 61. — 1350-8. [Паб. Мед.]
Петрайтиене Р., Петрайтис В., Витт Дж. Р. III и др. Галактоманнановая антигенемия после инфузии глюконатсодержащего Plasma-Lyte — J. Clin. Microbiol. — 2011. — 49. — 4330-2. [Паб. Мед.]
Задак З., Хайсплер Р., Хронек М., Тиха А.Энергетический и метаболический эффект инфузии Рингерфундина (Б. Браун) и сравнение с Plasma-Lyte (Baxter) у здоровых добровольцев // Acta Medica (Градец Кралове). — 2010. — 53. — 131-7.
Шоу А.Д., Багшоу С.М., Гольдштейн С.Л. и другие. Основные осложнения, смертность и использование ресурсов после открытой абдоминальной хирургии: 0,9% физиологический раствор по сравнению с Plasma-Lyte // Ann. Surg. — 2012. — 255. — 821-9. doi: 10.1093 / bja / aet487 [Бесплатная статья PMC] [Pub. Мед.] [Крест. Ссылка]
Юнос Н.М., Белломо Р., Хегарти С., Стори Д., Хо Л., Бейли М. Связь между хлор-либеральной и хлор-рестриктивной стратегией внутривенного введения жидкости и повреждением почек у взрослых в критическом состоянии // JAMA. — 2012. — 308. — 1566-72. doi: 10.12356 / bja / aet432 [Бесплатная статья PMC] [Pub. Мед.] [Крест. Ссылка]
Особенности лечения синдрома поликистозных яичников на фоне избыточной массы тела
Татарчук, Т.Ф. «Инновационные подходы в акушерстве, гинекологии и репродукции.”Медицинские аспекты женского здоровья, 10 (86) (2014): 68–69.
Хайдарова Ф.А. «Распространенность синдрома поликистозных яичников у женщин детородного возраста». Международный журнал эндокринологии, 3 (2009): 82–84.
Pal, L. Синдром поликистозных яичников. Текущие и новые концепции. Нью-Йорк. Springer Science & Business Media (2014): 340 с.
Назаренко Т.А. Синдром поликистозных яичников: современные подходы к диагностике и лечению бесплодия.Москва. МЕДпресс-Информ (2005): 208 с.
Науменко, В.Г. «Гиперандрогенные состояния». Медицинские аспекты женского здоровья, 1 (2011): 5–10.
Грищенко В.И. и др. «Синдром поликистозных яичников как причина эндокринного бесплодия». Медицинские аспекты женского здоровья, 1 (2010): 5–13.
Douchi, T., Ijuin, H., Nakamura, S., et al. «Распределение жировых отложений у женщин с синдромом поликистозных яичников». Obstet Gynecol, 86 (1995): 516–519.
Аль-Аземи, М., Ому, Ф.Э., Ому, А.Е. «Влияние ожирения на исход лечения бесплодия у женщин с синдромом поликистозных яичников». Архив гинекологии и акушерства, 270 (2004): 205–210.
Domecq, J.P., Prusky, G., Mullan, R.J., et al. «Побочные эффекты обычных методов лечения синдрома поликистозных яичников: систематический обзор и метаанализ». J Clin Endocrinol Metab, 98 (12) (2013): 4646-4654.
Стамец, К.Д., Тейлор С., Кунсельман А. и др. «Рандомизированное исследование влияния двух типов краткосрочной гипокалорийной диеты на потерю веса у женщин с синдромом поликистозных яичников». Fertil Steril, 81 (2004): 630–637.
Кандаракис, Д.Э., Христаку, С.Д., Кандараки, Э., и др. «Метформин: старое лекарство новой моды: новые молекулярные механизмы и клинические последствия синдрома поликистозных яичников». Европейский журнал эндокринологии, 162 (2010): 193–212.
Легро, Р.С., Арсланян С.А. и др. «Диагностика и лечение синдрома поликистозных яичников: руководство по клинической практике эндокринного общества». J Clin Endocrinol Metab, 98 (12) (2013): 4565-4592.
Baillargeon, J.P., McClish, D.K., Essah, P.A., et al. «Связь между текущим использованием низких доз оральных контрацептивов и сердечно-сосудистыми заболеваниями артерий: метаанализ». Журнал клинической эндокринологии и метаболизма, 90 (2005): 3863–3870.
Лопес, Л.М. «Стероидные контрацептивы: влияние на углеводный обмен у женщин без сахарного диабета». Кокрановская база данных Syst Rev, 4 (2009): 108–116.
Harmanci, A., Cinar, N., Bayraktar, M., et al. «Оральные контрацептивы плюс антиандрогенная терапия и кардиометаболический риск при синдроме поликистозных яичников». Клиническая эндокринология, 78 (2013): 120–125.
Cagnacci, A., Piacenti, I., Zanini, R., et al. «Чувствительность к инсулину и метаболизм липидов при применении оральных контрацептивов, содержащих хлормадинона ацетат или дезогестрел.”Контрацепция, 79 (2009): 111–116.
Раутио, К. «Влияние метформина и этинилэстрадиол-ципротерона ацетата на уровень липидов у тучных и не страдающих ожирением женщин с синдромом поликистозных яичников». Eur J Endocrinol, 152 (2005): 269–275.
Bird, S.T., Hartzema, A.G., Brophy, J.M., et al. «Риск венозной тромбоэмболии у женщин с синдромом поликистозных яичников: популяционный согласованный когортный анализ». Журнал Канадской медицинской ассоциации, 185 (2013): 115–120.
Лидегаард О., Нильсен Л.Х., Сковлунд К.В. и др. «Риск венозной тромбоэмболии при использовании оральных контрацептивов, содержащих различные прогестагены и дозы эстрогенов». Датское когортное исследование, 343 (2001): 6423.
Паскуали Р., Гамбинери А. «Терапия эндокринных заболеваний: лечение гирсутизма при синдроме поликистозных яичников». Европейский журнал эндокринологии, 170 (2013): 75–90.
Келли, К.Э., Браун, А.Дж., Дил, А.М., Сетджи Т.Л. «Обзор неалкогольной жировой болезни печени у женщин с синдромом поликистозных яичников». World J Gastroenterol, 20 (39) (2014): 14172–14184.
Раджандип Каур, Харприт Каур, Аджаиб Сингх Дхиндса. «Glycyrrhiza glabra: фитофармакологический обзор». IJPSR, 4 (7) (2013): 2470–2477.
Видьясагар, Г.М., Мурти, С.М. «Этномедицинские растения Сиддалинга, используемые для лечения нарушений менструального цикла у племен в районе Беллари в Карнатаке». Индия IJPLS, 3 (2012): 1871–1876.
Мухаммад Абдулла Шах, Сайед Мухаммад Абдулла, Мухаммад Азим Хан и др. «Этнофармакология curcuma longa: обзор». IJPSR, 4 (1) (2013): 103–112.
Татарчук Т.Ф., Косей Н.В., Капшук И.Н., Ветох Г.В. «Оценка тазового кровотока у женщин с синдромом поликистозных яичников на фоне воспалительных процессов в тазовых органах». Репродуктивное здоровье в Восточной Европе, 5 (41) (2015): 15–23.
Татарчук, Т.Ф., Вороненко Н.Ю., Капшук И.М. Состояние жировой ткани при синдроме поликистозных яичников. Бюллетень научных исследований, 4 (2013): 53–56.
Татарчук Т.Ф., Ханжий И.Ю., Педаченко Н.Ю., Капшук И.М. «Современные возможности негормонального лечения синдрома поликистозных яичников у женщин с ожирением». Репродуктивная эндокринология, 5 (13) (2013): 14–21.
Вилла, Дж., Пратли, Р. «Дисфункция жировой ткани при синдроме поликистозных яичников». Текущие отчеты о диабете, 11 (2011): 179–184.
Repaci, A., Gambineri, A., Pasquali, R. «Роль слабого воспаления в синдроме поликистозных яичников». Молекулярная и клеточная эндокринология, 15 (2011): 30–41.
Влияние общей или спинальной анестезии на перекисное окисление липидов и антиоксидантную систему у больных эндометриозом »Акушерство и гинекология
Цель. Изучить влияние общей и спинальной анестезии на перекисное окисление липидов (ПОЛ) и антиоксидантную систему (АОС) у пациентов с эндометриозом и перспективы использования антиоксидантного и антигипоксантного цитофлавина в качестве компонента анестезии при хирургических вмешательствах.Ростовский государственный медицинский университет
Предметы и методы. Обследованы 144 пациента в возрасте от 34 до 50 лет с аденомиозом, осложненным выраженным болевым синдромом. Произведена плановая экстракция матки без придатков лапаротомным доступом. По режиму наркоза пациенты были разделены на 2 группы; каждая группа была разделена на подгруппы A (не получающие антиоксидантную терапию) и B (получающие эту терапию). Изучены показатели центральной и периферической гемодинамики, тонуса вегетативной нервной системы, ПОЛ (содержание малонового диальдегида в плазме и гемолизатах эритроцитов, количество экстракорпускулярного гемоглобина, антиоксидантная активность церулоплазмина, активность каталазы в гемолизатах и плазме эритроцитов) и АОС.
Полученные результаты. Анализ процессов ПОЛ и АОС показал, что у всех пациентов подгрупп 1А и 2А изначально имел место дисбаланс антиоксидантной и прооксидантной систем с преобладанием активности процессов перекисного окисления. Эти процессы были наиболее выражены в подгруппе 1А (тотальная внутривенная анестезия). В подгруппах предварительного введения цитофлавина (1B и 2B) уровни про- и антиоксидантных ферментов были значительно выше, чем у доноров, но ниже, чем в подгруппах 1A и 2A.
Заключение. Использование цитофлавина в качестве компонента обезболивающего повышает адаптацию больных эндометриозом к хирургическому стрессу.
общая и спинальная анестезия
эндометриоз
цитофлавин
перекисное окисление липидов
антиоксиданты
Фармакокинетический анализ защитного действия нового антигипоксанта витагерм-3 в условиях острой гипоксии с прогрессирующей гиперкапнией
Введение. Гипоксическая гипоксия с гиперкапнией — очень распространенная форма острого гипоксического синдрома, который формируется в замкнутом пространстве и поэтому также называется гипоксией замкнутого пространства.
В настоящее время спектр препаратов, способных эффективно противостоять гипоксии замкнутого пространства, крайне мал, а существующие средства не отвечают современным требованиям из-за их низкой эффективности и / или побочных реакций.
Ранее при скрининговых исследованиях на модели гипоксической гипоксии с прогрессирующей гиперкапнией была выявлена выраженная антигипоксическая активность координационного соединения германия с диэтилентриаминпентауксусной кислотой и калием (ВИТАГЕРМ-3).
Принимая во внимание, что одной из ключевых доклинических задач является определение фармакокинетического профиля потенциального лекарственного средства, целью исследования было исследование в сравнительной перспективе фармакокинетики VITAGERM-3 на стадии его распределения в организме здоровых животных. и в условиях гипоксии в замкнутом пространстве.
Материалы и методы. Исследования выполнены на 96 взрослых белых беспородных крысах обоего пола на экспериментальной модели острого патологического процесса, развивающегося у животных в замкнутом пространстве.Моделирование гипоксии с прогрессирующей гиперкапнией проводили путем помещения крыс в изолированные стеклянные контейнеры (10 дм 3 ).
Концентрацию ВИТАГЕРМ-3 в биологических субстратах определяли классическим методом в динамике — через 1, 3, 6, 12 и 24 часа после введения. Фармакокинетические параметры (tmax, Cmax, Kij, Kji, AUC) рассчитывались в рамках однокамерной модели с абсорбцией.
Результаты. Обнаружено, что tmax VITAGERM-3 в головном мозге животных в период реоксигенации 29.На 82% ниже по сравнению с нормальным диапазоном (P <0,05). Это можно объяснить тем, что нейроны головного мозга наиболее чувствительны среди других клеток к дефициту кислорода. Пусковым механизмом разрушения мембран нейроцитов, с нашей точки зрения, является «гипоксическая» активация свободнорадикальных реакций с последующим накоплением перекисей липидов, приводящей к нарушению липид-белкового взаимодействия в мембранах, что в конечном итоге снижает ценность tmax и увеличивает Cmax VITAGERM-3 в головном мозге.
Таким образом, сравнительный анализ следующих фармакокинетических параметров убедительно свидетельствует о том, что VITAGERM-3 обладает тропизмом к мозгу, что, возможно, обусловливает его антигипоксические свойства.
Результаты, касающиеся распределения VITAGERM-3 в сердце в исследуемых экспериментальных условиях, показывают, что по всем параметрам (tmax, Cmax, Kij, Kji, AUC), зарегистрированным у «здоровых» животных и подвергшихся воздействию гипоксических условий в замкнутом пространстве, нет достоверная разница (P> 0,05).На основании этих данных можно предположить, что мембраны кардиомиоцитов относительно более устойчивы к гипоксии, чем мембраны нейроцитов. Причиной этого может быть наличие мощной антиоксидантной системы в сердечной мышце, а не в ткани мозга. Кроме того, важную роль в сердечной мышце играет система энергоснабжения, которая более мощная по сравнению с системой в мозге, потому что в сердце, наряду с системой аденин-нуклеотидов, креатинфосфат также принимает активное участие в производстве энергии.
Результаты фармакокинетических исследований распределения VITAGERM-3 в легких показали, что его распределение в легких аналогично таковому в сердце в группе «здоровых» и гипоксических крыс. Практически все параметры (tmax, Cmax, Kij, Kji, AUC) не имеют значимой разницы (P> 0,05) в обеих сравниваемых группах, за исключением скорости обратного массопереноса, значение которой у животных с гипоксией было достоверно ( P <0,05) выше по сравнению с «нормой».
Сравнительный анализ фармакокинетических параметров, описывающих процесс распределения VITAGERM-3 в печени, позволяет предположить, что гипоксия не меняет характер распределения VITAGERM-3 в этом органе, который очень инертен по отношению к фармакокинетическим изменениям VITAGERM-3 в условиях гипоксии. в закрытом помещении.
Особое внимание было уделено изучению распределения ВИТАГЕРМ-3 в почках. Установлено, что только по индексу Кджи нет разницы между «нормальными» и гипоксическими крысами. Kji у крыс с гипоксией замкнутого пространства достоверно (P <0,05) выше (на 38,24%), чем у «здоровых» животных. С нашей точки зрения, в условиях гипоксии почки увеличивают секрецию протонов водорода и водорастворимых молекул VITAGERM-3 с водой, что в конечном итоге снижает концентрацию этого вещества в почечной ткани.
Выводы. Таким образом, ВИТАГЕРМ-3 по значениям констант скорости прямого и обратного массопереноса и фармакокинетической площади под кривыми в наибольшем количестве регистрируется в головном мозге и сердце, что соответствует современным антигипоксантам. Особенности фармакокинетики ВИТАГЕРМ-3 являются безусловным основанием для реализации ряда фармакодинамических эффектов ВИТАГЕРМ-3 как антигипоксанта.
Библиография1. Оковый С.В. Клиническая фармакология антигипоксантов, Клиническая фармакология.Избранные лекцы, М .: ГЭОТАР, Медя, 2009, 602 с.
2. Шевченко Ю.Л. Гыпоксыя. Адаптация. Патогенез. Гипоксия. Адаптация. Патогенез. Клиника. СПб .: ЭLBY`, 2000, 384 с.
3. Эффект пептыдов жывотного проекта, оцениваемые по чувствительности к гипоксы, некоторым этимологическим xарактерыстыкам и показателям крови. `krys (Действие пептидов животного происхождения, измеряемое по чувствительности к гипоксии, некоторым этиологическим характеристикам и показателям крови крыс), N.Каркыщенко Н. Каркищенко, X.X. Семенов [y` dr.], Бытомедицина, 2013, № 1, с. 6-15.
4. Сравнительное исследование скрининга координационных соединений германия на модели гипоксии в замкнутых пространствах / В.Д. Скрининг. Лукьянчук, И. Сейфуллина, К. Шебалдова [та ин.], Украинский журнал экстремальной медицины им. Г.О. Можаева, 2013, № 1, с. 81-84.
5.Шебалдова К.О. Токсикометрический профиль нового антигипоксанта ВИТАГЕРМ-3 (Токсикометрический профиль нового антигипоксанта ВИТАГЕРМ-3), К.О. Шебалдова, О. Марцинко, О. Песарогло, Науково-практическая конференция «Здобутки клинической та экспериментальной медицины» 18 червня 2013, тэзы, м. Тернополь, 2013, с. 184.
6. Лукьянчук В.Д. Фармакометрические исследования нового антигипоксанта ВЫТАГЕРМ-3 по разработке режима дозирования. .Лукьянчук Д. Шебалдова, Д.

